Efectos de la castración y la esterilización en los niveles basales y de respuesta de cortisol en cobayas
Efectos de la castración y la esterilización en los niveles basales y de respuesta de cortisol: un estudio de caso en cobayas machos
 Sylvia Kaiser1*
Sylvia Kaiser1*  Annika Korte1
Annika Korte1  Joachim Wistuba2
Joachim Wistuba2  Maximiliano Calvo1
Maximiliano Calvo1  Andreas Wissmann3
Andreas Wissmann3  Marko Dubičanac3
Marko Dubičanac3  S. Helene Richter1
S. Helene Richter1  Norbert Sachser1
Norbert Sachser1- 1Departamento de Biología del Comportamiento, Universidad de Münster, Münster, Alemania
- 2Instituto de Biología Reproductiva y Regenerativa, Centro de Medicina Reproductiva y Andrología, Universidad de Münster, Münster, Alemania
- 3Animalario Central, Clínica Universitaria, Universidad de Duisburg-Essen, Essen, Alemania
Debe evitarse la reproducción incontrolada de animales en manos humanas. Para cumplir con este objetivo, los animales se castran ampliamente, es decir, se eliminan por completo las gónadas. Dado que las gónadas son la fuente más importante de hormonas sexuales, esta es una intervención seria en todo el sistema endocrino de un organismo. La esterilización es un procedimiento mucho menos invasivo. Por lo tanto, podría tener ventajas sobre la castración. Por lo tanto, el objetivo general de este estudio fue analizar el efecto de la castración frente a la esterilización sobre la liberación de glucocorticoides, es decir, un indicador importante para el bienestar. Tomando como sistema modelo cobayas domésticas, estudiamos los valores basales y de respuesta de cortisol (el cortisol es el principal glucocorticoide en cobayas) en machos castrados, esterilizados, operados simuladamente e intactos y los valores basales en sus hembras alojadas. Mientras que los valores basales de los machos no difirieron entre los grupos, los machos castrados mostraron niveles de respuesta de cortisol significativamente más altos que los machos intactos, operados simuladamente y esterilizados. Las hembras alojadas con machos castrados, esterilizados, operados simuladamente o intactos no difirieron en sus concentraciones de cortisol, ni poco después de ser colocadas con el macho respectivo ni después de haber sido alojadas durante varias semanas. En general, los resultados apoyan la hipótesis de que los machos castrados exhibieron una mayor respuesta al cortisol durante el desafío agudo, lo que podría apuntar a un deterioro generalizado del bienestar de los machos castrados en comparación con los machos intactos, operados simuladamente y esterilizados. Nuestros resultados proporcionan la primera evidencia de un posible impacto negativo de la castración en el bienestar de los animales, mientras que al mismo tiempo apuntan a que la esterilización representa una alternativa menos invasiva y prometedora. Por lo tanto, los resultados pueden estimular futuras investigaciones sobre este tema para detectar aún más los posibles efectos secundarios de la castración relacionados con el bienestar.
1. Introducción
La castración y la esterilización son dos procedimientos que se pueden utilizar para controlar la reproducción de los animales en manos humanas (1). Durante la castración, se extirpan las gónadas (machos: testículos; hembras: ovarios, a veces además el útero) [p. ej., (2, 3)]. Dado que las gónadas son la fuente más importante de hormonas sexuales como andrógenos, estrógenos y progestinas [por ejemplo, (3, 4)], esta es una intervención seria en todo el sistema endocrino de un organismo. Después de la castración, solo concentraciones muy bajas de estas hormonas sexuales pueden ser secretadas por otras células endocrinas-activas situadas, por ejemplo, en la corteza suprarrenal (3). La esterilización, por otro lado, es una intervención menos invasiva en el organismo: aquí se cierran, cortan o extirpan los conductos deferentes o las trompas de Falopio [p. ej., (2)]. Los espermatozoides y los óvulos ya no pueden ser transportados y, por lo tanto, los óvulos ya no pueden ser fertilizados después de esta intervención y se impide la reproducción. Sin embargo, las gónadas no se extirpan y pueden seguir funcionando como glándulas endocrinas [p. ej., (5)]. Por lo tanto, esta intervención no tiene ninguna influencia en la producción de hormonas sexuales. Dado que los caracteres sexuales secundarios están mediados por las hormonas sexuales, pueden desarrollarse o permanecer intactos en los machos esterilizados.
El objetivo principal de ambos métodos quirúrgicos es controlar la reproducción de los animales en manos humanas. Sin embargo, en la cría de animales domésticos, de granja y de zoológico, la mayoría de los animales son castrados, no esterilizados [p. ej., (1, 6–9)]. Aquí, se suele argumentar que, además de impedir la reproducción, la castración también puede prevenir el comportamiento sexual no deseado o excesivo y la agresión inducida por las hormonas sexuales (10). Dado que estos comportamientos están controlados por hormonas sexuales como la testosterona y los estrógenos (3), la esterilización a menudo se considera insuficiente. Sin embargo, este argumento no siempre es cierto, porque la interacción de las hormonas y el comportamiento es muy compleja. Por ejemplo, se sabe que los animales que ya están sexualmente maduros en el momento del procedimiento continúan realizando conductas de cortejo y sexuales, o se necesita mucho tiempo para que estas conductas desaparezcan (11, 12). Además, la presencia o ausencia de experiencia sexual antes de la castración suele ser fundamental para el declive del cortejo y las conductas sexuales. En cuanto a los efectos de la castración sobre la agresión, se encuentran resultados controvertidos: algunos estudios muestran que los animales castrados son menos agresivos que los animales intactos (13, 14). Otros estudios, sin embargo, no muestran diferencias en el comportamiento agresivo entre animales castrados e intactos (15).
Otro argumento a favor de la castración en lugar de la esterilización es que el riesgo de desarrollar enfermedades reproductivas (p. ej., cáncer de glándula mamaria, hiperplasia/infección de próstata) se reduce en los animales castrados (1, 16-19). Sin embargo, el riesgo de formación de tumores fuera del sistema reproductivo, de diversos trastornos articulares (p. ej., rotura del ligamento cruzado craneal), incontinencia urinaria, obesidad y disfunciones cognitivas puede aumentar en animales castrados (18, 20-23).
En resumen, los argumentos por los que se debe preferir la castración a la esterilización para evitar la reproducción descontrolada no son del todo convincentes. Como la esterilización es menos invasiva porque el sistema endocrino no se ve alterado, se debe considerar cuidadosamente si se debe realizar este procedimiento en lugar de la castración. En principio, la legislación también apunta en esta dirección. Por ejemplo, según la Ley de Protección Animal alemana, está prohibido realizar amputaciones a animales sin causa razonable: «Está prohibida la amputación total o parcial de partes del cuerpo o la extirpación o destrucción total o parcial de órganos o tejidos de un animal vertebrado». [§6 (1) Tierschutzgesetz 1972, modificado por última vez en 2021]. Por lo tanto, de acuerdo con el artículo 6 de la Ley de Protección Animal, la castración de animales está comprendida en la prohibición de amputación y solo puede realizarse si existe una razón razonable. En la actualidad, las indicaciones médicas y la prevención de la reproducción no controlada cuentan como justificación razonable en Alemania. En muchos otros países occidentales se aplican normas similares (24). Sin embargo, también hay algunos países en los que la prevención de la reproducción no controlada no se considera una razón razonable suficiente para castrar a los animales. Por ejemplo, en Noruega está prohibido castrar a los animales de compañía si el único objetivo es evitar la descendencia (24). Además, en Suecia existe una larga tradición de no castrar a los perros: Salander et al. (25) describieron que el 99% de los perros se dejaban intactos en Suecia.
A menudo, también debe evitarse la reproducción descontrolada desde el punto de vista del animal. Por ejemplo, los perros y gatos callejeros, que a menudo son abandonados a su suerte, viven en condiciones difíciles, especialmente en las zonas urbanas. Esto puede conducir a una reducción del bienestar de los animales y, por lo tanto, debe evitarse la reproducción de estos animales. Sin embargo, este objetivo también se puede lograr mediante la esterilización, es decir, no es necesario realizar una ambutación. Por lo tanto, es necesario examinar comparativamente la influencia de estas dos intervenciones, castración vs. esterilización, en el bienestar de los animales. Para evaluar el bienestar animal, se dispone de varios indicadores que están bien validados. Dichos indicadores incluyen parámetros conductuales, emocionales, cognitivos y fisiológicos [p. ej., (26)]. Los indicadores fisiológicos fiables para el bienestar animal pueden ser, por ejemplo, la frecuencia cardíaca, la temperatura corporal, los parámetros inmunitarios y la cantidad de liberación de glucocorticoides [p. ej., (26, 27)], siendo este último un indicador fisiológico de bienestar de uso frecuente y bien validado. Una de las principales funciones de los glucocorticoides es el mantenimiento de la homeostasis, que está garantizada por la liberación de glucocorticoides a un nivel basal bajo y continuo (28). Los niveles basales de glucocorticoides dependen de varios factores, como el estado nutricional o el nivel de actividad (29-31). Sin embargo, durante situaciones difíciles, se producen mayores cantidades de glucocorticoides y se secretan en el torrente sanguíneo a través de la activación del sistema hipotálamo-hipófisis-adrenocortical (HPA), uno de los principales sistemas de estrés en los vertebrados (32). Los glucocorticoides activan varias vías que conducen a la activación de la gluconeogénesis y la redistribución del sistema inmunitario antes de que los niveles vuelvan a la línea de base a través de bucles de retroalimentación negativa (28, 33-35). Por lo tanto, la activación del sistema HPA proporciona energía al organismo durante situaciones desafiantes y lo cambia a un estado de mayor reactividad que es un requisito previo para responder a los cambios ambientales de manera adecuada. Dado que la capacidad de respuesta a los glucocorticoides se correlaciona con la liberación máxima de glucocorticoides después de la estimulación de las glándulas suprarrenales con la hormona adrenocorticotrópica [ACTH; (32, 36)], esto puede servir como un buen indicador de la actividad de la corteza suprarrenal y de la capacidad secretora de un individuo (32). Por lo tanto, ambos parámetros, valores basales y de respuesta, son medidas válidas en situaciones de estrés para evaluar el bienestar animal.
Aunque la mayoría de los estudios que investigan los efectos de la castración se han llevado a cabo en perros y en parte en gatos, en nuestro estudio utilizamos la cobaya doméstica. Estos animales son un sistema modelo adecuado para este propósito por dos razones: (1) Los conejillos de indias son mascotas populares. En el Reino Unido, por ejemplo, se tienen 0,7 millones de animales como mascotas y en los Estados Unidos 1,36 millones de animales (37). (2) Los efectos de los factores estresantes sobre las concentraciones de glucocorticoides se conocen en varias especies [p. ej., (38, 39)]. Sin embargo, los conejillos de indias son una de las especies mejor estudiadas en cuanto a los efectos de los estresores sobre los glucocorticoides basales [en el conejillo de indias doméstico principalmente el cortisol; (40, 41)] y valores de respuesta [p. ej., (29, 36, 42–48)].
El objetivo general de este estudio fue analizar los niveles basales y de respuesta de cortisol en cobayas machos castrados, esterilizados, operados simuladamente e intactos. Aunque para una evaluación más amplia del bienestar animal es deseable una amplia gama de indicadores, los niveles basales y de respuesta de cortisol son indicadores bien establecidos del bienestar animal y, por lo tanto, nuestro enfoque puede proporcionar una primera evidencia de las diferentes cirugías que afectan el bienestar del animal de diferentes maneras. Los machos operados simuladamente e intactos sirvieron como controles. Dado que a los machos castrados se les extirparon las glándulas endocrinas y, por lo tanto, el sistema endocrino se vio fuertemente afectado, predijimos que los machos castrados tendrían diferentes concentraciones basales de cortisol, así como una respuesta de cortisol diferente a la de los machos esterilizados, operados simuladamente e intactos. Además, la concentración de testosterona en los machos castrados debe ser menor que en los otros machos. Además de la investigación de las hormonas en los machos, también se investigaron los valores de cortisol de las hembras que conviven con estos machos. Dado que se ha demostrado que la castración cambia el olor de un macho debido a los bajos niveles de testosterona (49), es muy probable que la presencia de machos intactos y simulados y muy probablemente esterilizados (que se comportan y huelen como machos intactos en contraste con los machos castrados) conduzca a una reducción del comportamiento agresivo entre las hembras (50). Por lo tanto, planteamos la hipótesis de que las hembras que conviven con los machos castrados tienen valores más altos de cortisol.
2. Métodos
2.1. Animales y condiciones de alojamiento
Los animales utilizados en este experimento fueron criados en el Departamento de Biología del Comportamiento de la Universidad de Münster a partir de un programa de cría de conejillos de indias de pelo corto multicolor (Cavia aperea f. porcellus) que fueron adquiridos originalmente de un criador en 1975. Todos los animales nacieron en pequeños grupos de un macho, dos o tres hembras y sus crías pre-destetadas.
Los animales utilizados fueron destetados alrededor de los 21 días de edad y transferidos a grupos del mismo sexo (hembras; 2-12 individuos) o parejas del mismo sexo (machos) hasta el inicio del experimento. Durante el experimento, cada macho fue alojado junto con dos hembras. Estaban alojados en recintos de 1 m × 1 m, con paredes construidas en madera con una sección de plástico rojo en la parte inferior, en total 0,5 m de altura. El suelo estaba cubierto con virutas de madera (Tierwohl Super), y alimentos (Höveler Meerschweinchenfutter 10700) y agua con ácido ascórbico estaba disponible ad libitum. El heno se reponía diariamente. Cada recinto contenía dos refugios; un refugio grande de plástico rojo y un pequeño refugio de plástico rojo o madera negra. Las luces estaban encendidas todos los días de 7:00 a 19:00 y las condiciones de la habitación eran de ~22 ° C con aproximadamente un 50% de humedad. Al final del experimento, las hembras permanecieron en el Departamento de Biología del Comportamiento. Por lo tanto, se pudo verificar si las hembras quedaron embarazadas o no durante el experimento. Todas las hembras de los grupos con machos intactos y operados simuladamente quedaron embarazadas. Todas las hembras alojadas junto con machos castrados no quedaron embarazadas; Sin embargo, las hembras de 10 de los 14 grupos con machos esterilizados quedaron embarazadas (un macho esterilizado se apareó primero 1 año después con las hembras). Probablemente, se produjo una recanalización en estos animales. Esto también se sabe por otros estudios; sin embargo, en una medida mucho menor [p. ej., (51, 52)]. Un factor para una esterilización exitosa es el procedimiento quirúrgico. El fracaso de la esterilización se observa con mayor frecuencia cuando la esterilización se realiza sin cauterización. En nuestro estudio, solo se utilizó ligadura, pero no cauterización (ver más adelante, sección 2.4). Por esta razón, tuvimos que excluir a estos 10 machos de nuestro análisis, ya que no pudimos saber en qué momento se produjo la recanalización. Por lo tanto, pudimos analizar los datos de solo 4 machos esterilizados. En el futuro, se recomienda encarecidamente realizar la esterilización con cauterización y ligadura.
2.2. Procedimiento experimental
Los machos habían sido castrados (n = 14), esterilizados (14, solo 4 permanecieron esterilizados) u operados simuladamente (n = 8) entre 30 y 45 días después del nacimiento, es decir, varias semanas antes de la madurez sexual, que se alcanza en los cobayos machos alrededor de los 70 días de edad. Además, también se incluyeron machos intactos (n = 10). El procedimiento de castración consistía en la castración a través del escroto con ligadura inmediata de los vasos sanguíneos y sutura del escroto después de la extirpación de los testículos. El procedimiento de esterilización que se utilizó consistió en extirpar una pieza de 8-10 mm de cada uno de los dos conductos deferentes después de realizar ligaduras en ambos extremos para mantener el conducto cerrado (para más detalles, véase la sección 2.4 a continuación). Durante el experimento, cada macho (edad aproximada de 85 días de edad; rango: 78-92 días de edad) fue introducido en un nuevo recinto junto con dos hembras (edad de las hembras alrededor de 75 días de edad; rango: 55-107 días de edad; diferencias de edad entre dos hembras de un grupo: 0-40 días). Dado que cada dos hembras se alojaban junto con un macho, el tamaño de la muestra de hembras fue el siguiente: hembras que convivían con un macho castrado: n = 28, con un macho operado simuladamente: n = 16, con un macho esterilizado: n = 8, con un macho intacto: n = 20.
2.3. Cronología
Alrededor de los 34 días de edad (rango: 27-41 días de edad) se realizó una prueba de respuesta de cortisol (CRT; ver más abajo) en cada hombre antes de la cirugía para garantizar que no hubiera diferencias entre los hombres que luego fueron tratados de manera diferente en este momento. Con una edad de aproximadamente 85 ± 7 días (alrededor de la madurez sexual), cada macho fue introducido junto con dos hembras en un nuevo recinto. 5 ± 1 día antes de esta introducción se realizó una nueva TRC para evaluar los valores iniciales. Se realizaron otras dos TRC 8 ± 2 días y 21 días ± 2 días después de la introducción en los grupos para evaluar la capacidad de afrontar esta nueva situación a largo plazo. Además, se tomó una muestra de sangre de cada varón justo antes y 2 h después de la introducción.
También se tomaron muestras de sangre de las hembras (ver más abajo el procedimiento): 1 día antes de que las hembras se administraran al macho para determinar los valores basales, 3 h y 1 día después de ser colocadas junto con el macho para determinar la respuesta aguda de cortisol, y aproximadamente 1 semana después y el último día para determinar la respuesta de cortisol a largo plazo.
2.4. Cirugía
Las cirugías se realizaron bajo anestesia mixta con ketamina y medetomidina i.m. (Ketamin, Ceva Tiergesundheit GmbH, Düsseldorf, Alemania, 60 mg/kg de peso corporal; Domitor, Pfizer, Berlín, Alemania, 0,25 mg/kg de peso corporal). Además, se aplicó anestesia local utilizando una solución de lidocaína al 0,5% (Xilocaína al 1%, AstraZeneca, Wedel, Alemania, en solución salina fisiológica, 0,05-0,1 ml s.c. a cada lado del escroto). Los efectos de la medetomidina se revirtieron con atipamezol (Antisedan, Pfizer, Berlín, Alemania, 0,75–2 mg/kg de peso corporal s.c.) después de la finalización de la cirugía (al menos 45 min después de la inducción de la anestesia). La analgesia postoperatoria fue proporcionada por carprofeno (Rimadyl, Pfizer, Berlín, Alemania, 4 mg/kg de peso corporal s.c., después de la inducción de la anestesia).®®®®®
Castración: Se abrió el escroto por ambos lados con una pequeña incisión, se colocaron los testículos y el epidídimo por delante del escroto, se ligaron con material de sutura reabsorbible y se retiraron. El escroto se suturó en dos capas (peritoneo con capas musculares y piel).
Esterilización: La cavidad abdominal se abrió por ambos lados de la ingle con una pequeña incisión a través de la piel y la pared abdominal, se colocaron los conductos deferentes delante de la cavidad abdominal y se deslizó un par de fórceps por debajo para estirar los conductos deferentes abiertos. Se colocaron dos nudos quirúrgicos entre las patas de las pinzas. Además, se cortó el área entre los nudos (~5-10 mm). A continuación, el acceso quirúrgico también se suturó en dos capas (peritoneo con músculo y piel).
Operaciones simuladas: El escroto o la cavidad abdominal se abrieron en el mismo lugar y luego se cerraron de nuevo como se describe.
2.5. Toma de muestras de sangre
En cobayos machos y hembras se tomaron muestras de sangre para determinar las concentraciones de cortisol. En los varones, además, se determinaron las concentraciones de testosterona.
En resumen, las cobayas no fueron molestadas durante 1 h antes del inicio del procedimiento de muestreo, que siempre comenzó a las 9:00 a.m. A continuación, se retiró al conejillo de indias de su recinto y se perforó una vena marginal del oído para recoger unos 50 μl de sangre en 3 minutos (cortisol) y otros 100 μl en 6 minutos (testosterona). Los conejillos de indias muestran poco comportamiento de defensa durante el procedimiento de recolección, y no se produce una elevación del cortisol plasmático durante aproximadamente 5 minutos (36). En consecuencia, todas las muestras para la determinación de los niveles de cortisol se recogieron dentro de los 3 minutos posteriores a la entrada en la habitación para asegurarse de que aún no se había producido ninguna elevación de cortisol. Después de eso, se pesó el conejillo de indias.
2.6. Ensayo de respuesta al cortisol
Con cobayas machos se realizaron varias pruebas de reacción al cortisol. Durante esta prueba se tomaron 3 muestras de sangre. La primera muestra se tomó como se ha descrito anteriormente a las 9.00 horas. En lugar de devolver al animal a su recinto de origen, se colocó individualmente en un2 Un nuevo recinto sin refugio, que es un factor estresante para las cobayas y desencadena un aumento del cortisol circulante (42) hasta exactamente 1 h después de la recogida de la primera muestra de sangre (a las 10.00 horas). Posteriormente, se repitió este proceso hasta que se tomaron tres muestras de sangre durante 2 h a las 11.00 h (basal, después de 1 h, después de 2 h) y luego se devolvió la cobaya al recinto domiciliario. Las concentraciones de cortisol se determinaron a partir de cada muestra de sangre; También se determinaron las concentraciones de testosterona a partir de todas las muestras recogidas antes del inicio de la prueba.
2.7. Determinación de las concentraciones hormonales
El plasma sanguíneo se extrajo directamente después de la recolección de muestras mediante centrifugación y luego se congeló a -20 °C. Una vez recogidas todas las muestras al final del experimento, se determinaron las concentraciones de cortisol y testosterona por duplicado mediante ensayos de inmunoabsorción enzimática (Cortisol ELISA, RE52061, IBL International GmbH, Hamburgo, Alemania; CV intra e interensayo: 3,0 y 3,5%; reactividad cruzada de anticuerpos: cortisol 100%, prednisolona 30%, 11-desoxicortisol 7%, cortisona 4,2%, prednisona 2,5% y corticosterona 1,4%; ELISA de testosterona, RE52151, IBL Internacional; CV intra e interensayo: 4,6 y 5,7%; reactividad cruzada de anticuerpos: testosterona 100%, 11β-OH-testosterona 8,7%, 11α-OH-testosterona 3,2% y dihidrotestosterona 1,9%). El asistente técnico que realizó los ensayos no conocía el diseño experimental. Además, todas las muestras de un macho fueron analizadas en el mismo ensayo. Además, se garantizó que las muestras de al menos tres machos tratados de manera diferente se analizaran en el mismo ensayo.
2.8. Estadísticas
Todos los estadísticos se calcularon con el programa SPSS para Windows (SPSS, Chicago, IL, USA versión 28). Para crear gráficos se utilizaron R 4.0.0 (53) y RStudio (Posit, Boston, MA, EE. UU., versión 2022.07.1+554). Se realizó un cálculo a priori del tamaño de la muestra utilizando el software GPower (estadística: ANOVA de un factor para efectos fijos). Basamos nuestros cálculos en los valores basales y de respuesta de cortisol. Los datos anteriores mostraron que los efectos del entorno social sobre las concentraciones de cortisol son grandes, por ejemplo, los tamaños del efecto para efectos grandes entre f = 0,69 y 1,6 [p. ej., (42, 54)]. Para detectar efectos con f = 0,69 con una potencia de >80%, se necesitaría un tamaño total de muestra de al menos 28 animales, es decir, 7 por grupo. Para detectar efectos grandes, ya a partir de f = 0,4-0,5 con una potencia del >80%, decidimos utilizar 14 animales por grupo, lo que resultó en un tamaño total de muestra de 56 animales, es decir, 14 animales por grupo. El tamaño de la muestra calculado a veces se desvía considerablemente del tamaño de la muestra alcanzado. En el caso de los animales esterilizados, esto se debe a la cirugía (ver sección 2.1). Además, en algunos momentos nacieron muy pocos varones para los cuatro grupos de tratamiento. Por lo tanto, el tamaño de la muestra fue el siguiente: machos esterilizados: n = 4 (ver sección 2.1 para la razón del pequeño tamaño de la muestra), machos castrados: n = 14; varones operados simuladamente: n = 8; Machos intactos: n = 10. Debido a que el tamaño de la muestra era muy pequeño y las medidas violaban los supuestos de las pruebas paramétricas y las transformaciones no lograron corregir esto, se utilizaron estadísticos no paramétricos. Se utilizaron pruebas de Kruskal-Wallis para determinar si había algún efecto del tratamiento en los valores basales y de respuesta de testosterona y de cortisol entre los animales de los cuatro grupos. En caso de significación, posteriormente se realizaron comparaciones por pares entre machos castrados, esterilizados, intactos y operados simuladamente mediante pruebas U de Mann-Whitney (corregidas por Holm-Bonferroni). En general, se utilizaron pruebas de dos colas y la significación se fijó en p < 0,05. La tendencia central y la variabilidad de las medidas endocrinas se expresaron como medianas y valores máximos y mínimos.*
3. Resultados
3.1. Concentraciones de testosterona en los varones
Las concentraciones de testosterona no difirieron entre los hombres antes de las cirugías a la edad de aproximadamente 34 días. Sin embargo, hubo una diferencia significativa en las concentraciones plasmáticas de testosterona entre los varones intactos (n = 10), operados simuladamente (n = 8), castrados (n = 14) y esterilizados (n = 4) después de la cirugía en cada punto de muestra (ver Figura 1; para detalles estadísticos, ver Tabla 1). Las pruebas post-hoc revelaron que los machos castrados mostraron concentraciones de testosterona más bajas que los machos intactos, operados simuladamente y esterilizados (Figura 1; para detalles estadísticos, véase la Tabla 1).
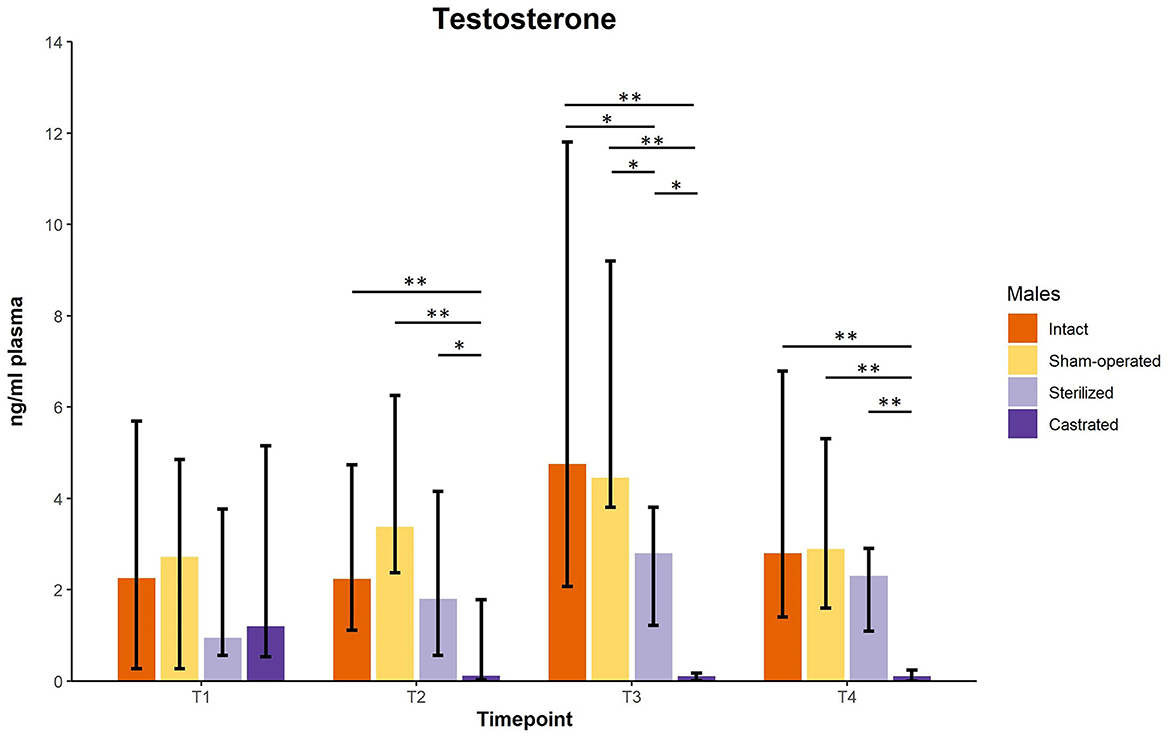 Figura 1. Concentraciones de testosterona en ng/ml plasmáticas de varones intactos, simulados, esterilizados y castrados. Los datos se presentan como medianas, valores mínimos y máximos. T1: concentraciones de testosterona antes de la cirugía; T2, concentraciones de testosterona unos 5 días antes del inicio del experimento (1 macho y 2 hembras se juntaron en un nuevo recinto); T3, concentraciones de testosterona 1 semana después de la introducción en el nuevo recinto; T4, concentraciones de testosterona 2 semanas después de la introducción en el nuevo recinto. Estadísticas: Pruebas de Kruskal-Wallis, pruebas U de Holm-Bonferroni corregidas post-hoc de Mann-Whitney. Nintacto = 10, nOperado por simulacro = 8, ncastrado = 14, nesterilizado = 4. *p < 0,05, **p < 0,01 (después de la corrección de Holm-Bonferroni).
Figura 1. Concentraciones de testosterona en ng/ml plasmáticas de varones intactos, simulados, esterilizados y castrados. Los datos se presentan como medianas, valores mínimos y máximos. T1: concentraciones de testosterona antes de la cirugía; T2, concentraciones de testosterona unos 5 días antes del inicio del experimento (1 macho y 2 hembras se juntaron en un nuevo recinto); T3, concentraciones de testosterona 1 semana después de la introducción en el nuevo recinto; T4, concentraciones de testosterona 2 semanas después de la introducción en el nuevo recinto. Estadísticas: Pruebas de Kruskal-Wallis, pruebas U de Holm-Bonferroni corregidas post-hoc de Mann-Whitney. Nintacto = 10, nOperado por simulacro = 8, ncastrado = 14, nesterilizado = 4. *p < 0,05, **p < 0,01 (después de la corrección de Holm-Bonferroni).
 Tabla 1. Parámetros estadísticos de las concentraciones de testosterona de machos intactos (n = 10), operados simuladamente (n = 8), castrados (n = 14) y esterilizados (n = 4).
Tabla 1. Parámetros estadísticos de las concentraciones de testosterona de machos intactos (n = 10), operados simuladamente (n = 8), castrados (n = 14) y esterilizados (n = 4).
3.2. Valor basal del cortisol y capacidad de respuesta de los machos
Las concentraciones de cortisol fueron significativamente diferentes inmediatamente antes de que los machos fueran transferidos a las hembras en un nuevo recinto y 2 h después (machos intactos: n = 10; machos operados simuladamente: n = 8, machos castrados: n = 14, machos esterilizados: n = 4). Las pruebas post-hoc mostraron que los valores poco antes de la introducción en los grupos eran más altos en los machos castrados que en los machos operados y castrados (Figura 2; para detalles estadísticos, véase la Tabla 2). Dos horas después de la introducción, las concentraciones de cortisol fueron significativamente más altas en los machos castrados que en los machos intactos, operados simuladamente y esterilizados (Figura 2; para detalles estadísticos, véase la Tabla 2).
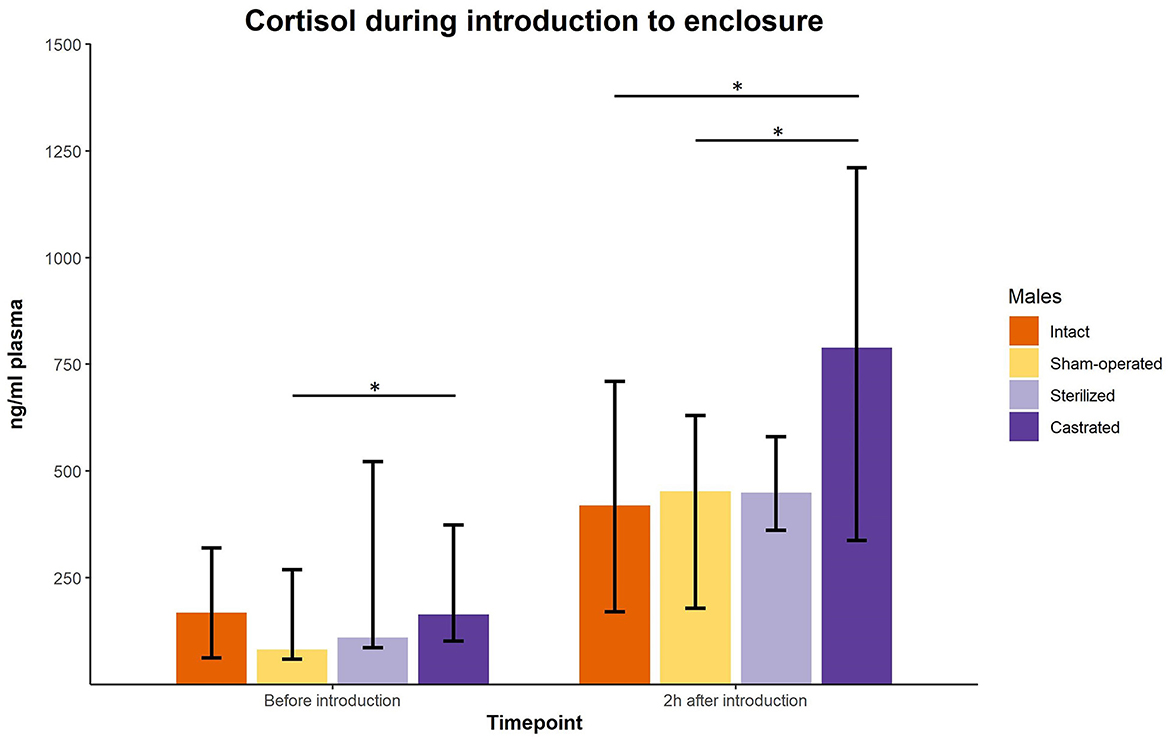 Figura 2. Concentraciones de cortisol en ng/ml plasmáticas de machos intactos, simulados, esterilizados y castrados antes y poco después de la introducción (1 macho y 2 hembras se juntaron en un nuevo recinto). Los datos se presentan como medianas, valores mínimos y máximos. Antes de la introducción: muestra de sangre tomada justo antes del inicio del experimento; 2 h después de la introducción: muestra de sangre tomada 2 h después de la introducción en el nuevo recinto. Estadísticas: Pruebas de Kruskal-Wallis, pruebas U de Holm-Bonferroni corregidas post-hoc de Mann-Whitney. Nintacto = 10, nOperado por simulacro = 8, ncastrado = 14, nesterilizado = 4. *p < 0,05 (después de la corrección de Holm-Bonferroni).
Figura 2. Concentraciones de cortisol en ng/ml plasmáticas de machos intactos, simulados, esterilizados y castrados antes y poco después de la introducción (1 macho y 2 hembras se juntaron en un nuevo recinto). Los datos se presentan como medianas, valores mínimos y máximos. Antes de la introducción: muestra de sangre tomada justo antes del inicio del experimento; 2 h después de la introducción: muestra de sangre tomada 2 h después de la introducción en el nuevo recinto. Estadísticas: Pruebas de Kruskal-Wallis, pruebas U de Holm-Bonferroni corregidas post-hoc de Mann-Whitney. Nintacto = 10, nOperado por simulacro = 8, ncastrado = 14, nesterilizado = 4. *p < 0,05 (después de la corrección de Holm-Bonferroni).
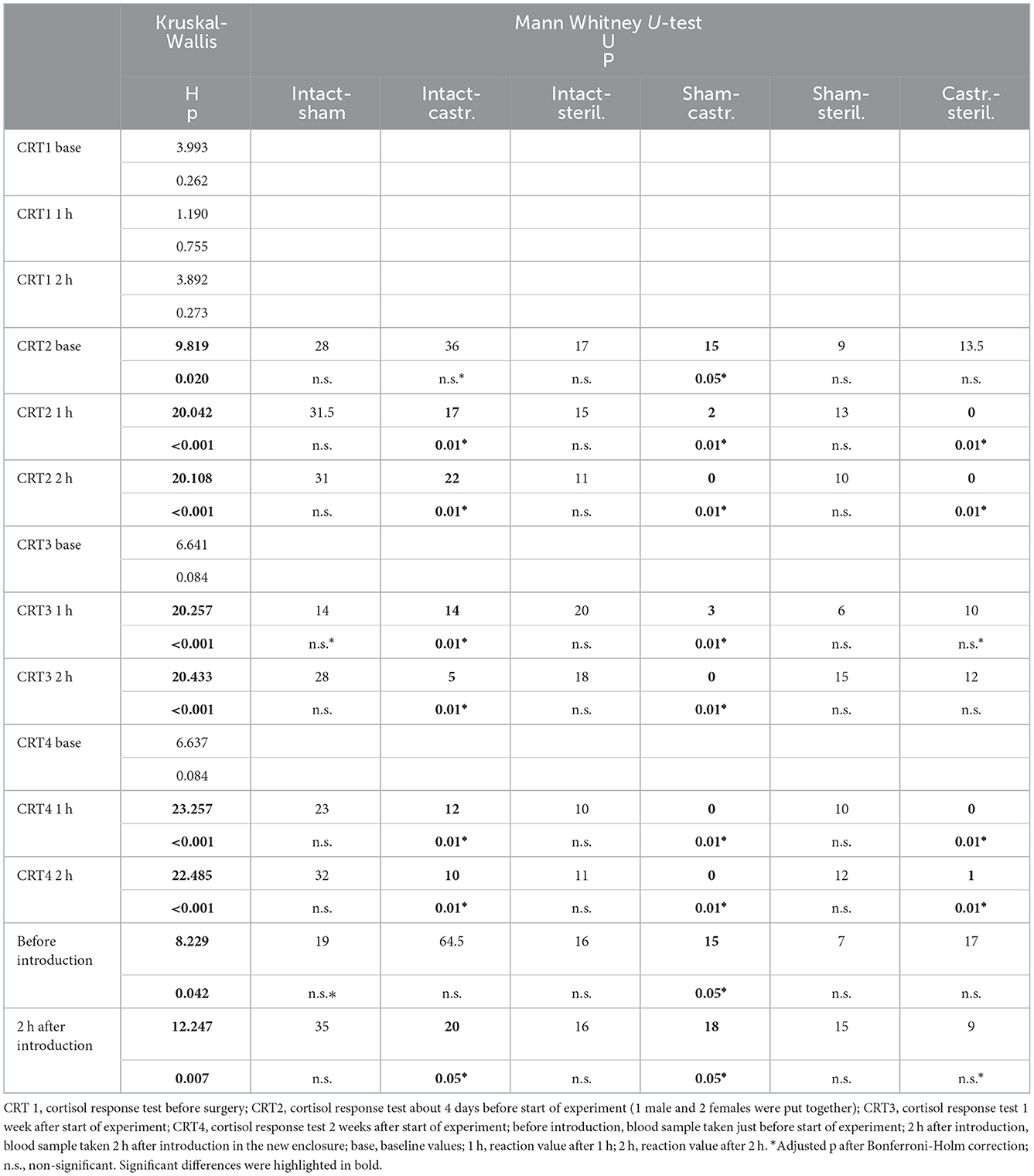 Tabla 2. Parámetros estadísticos de las concentraciones de cortisol de machos intactos (n = 10), operados simuladamente (n = 8), castrados (n = 14) y esterilizados (n = 4).
Tabla 2. Parámetros estadísticos de las concentraciones de cortisol de machos intactos (n = 10), operados simuladamente (n = 8), castrados (n = 14) y esterilizados (n = 4).
En la prueba de respuesta al cortisol se determinaron los valores basales y de respuesta del cortisol. Antes de las cirugías, no se encontraron diferencias en los valores basales y de respuesta del cortisol (Figuras 3 y 4; para detalles estadísticos, ver Tabla 2). Una semana antes del inicio del experimento (es decir, se realizaron cirugías, pero los machos aún no fueron presentados a las hembras), se encontraron diferencias en los valores basales: las pruebas post-hoc revelaron valores más altos en los machos castrados que en los operados simuladamente (Figura 3; para detalles estadísticos, ver Tabla 2). Los niveles basales después de la cirugía no difirieron (Figura 3; para detalles estadísticos, ver Tabla 2). En cuanto a los valores de respuesta, tanto 1 semana antes como 2 y 3 semanas después del inicio del experimento se pudieron determinar diferencias significativas. Las pruebas post-hoc demostraron que los machos castrados mostraron valores de respuesta C significativamente más altos que los machos intactos, operados simuladamente y en dos puntos de tiempo también que los machos esterilizados (Figura 4; para detalles estadísticos, ver Tabla 2).
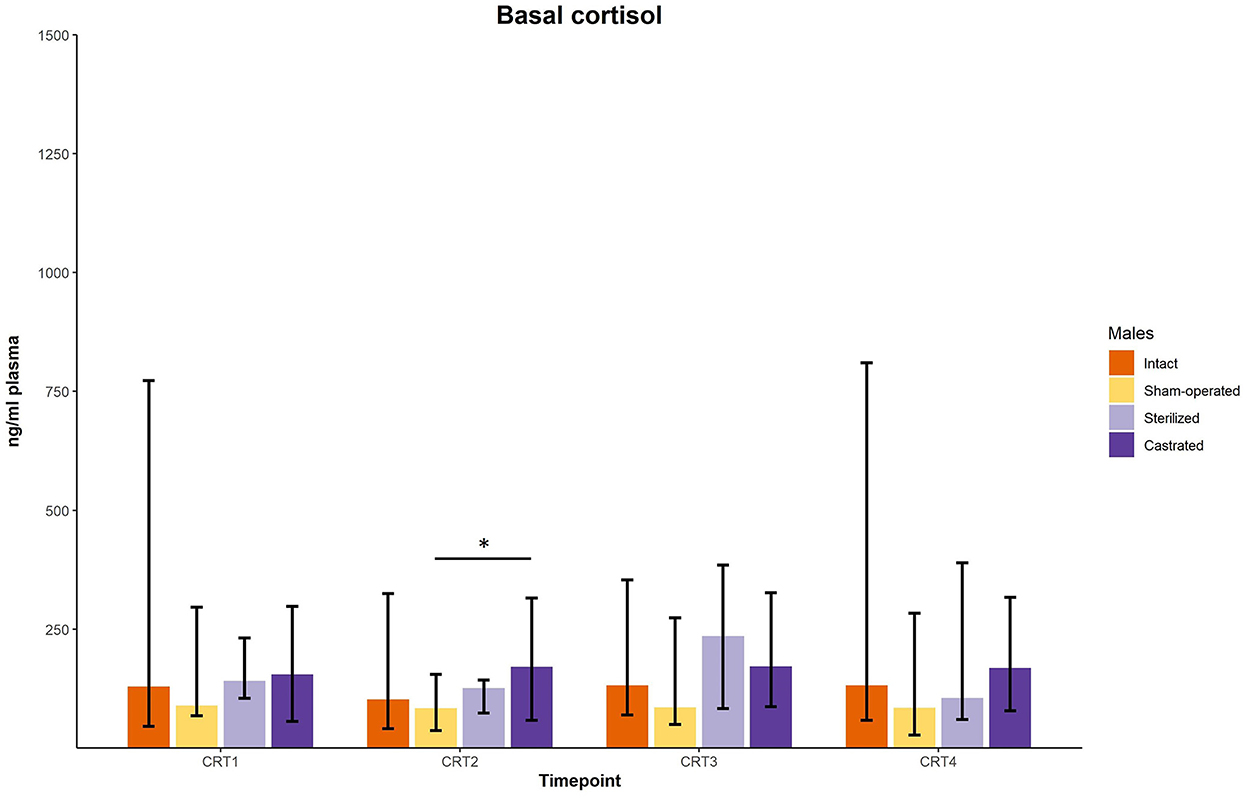 Figura 3. Concentraciones basales de cortisol en ng/ml plasmáticas de varones intactos, simulados, esterilizados y castrados durante las pruebas de respuesta al cortisol. Los datos se presentan como medianas, valores mínimos y máximos. CRT1: prueba de respuesta al cortisol antes de la cirugía; CRT2, prueba de respuesta al cortisol unos 4 días antes del inicio del experimento (se juntaron 1 macho y 2 hembras); CRT3: prueba de respuesta al cortisol 1 semana después del inicio del experimento; CRT4, prueba de respuesta de cortisol 2 semanas después del inicio del experimento. Estadísticas: Pruebas de Kruskal-Wallis, pruebas U de Holm-Bonferroni corregidas post-hoc de Mann-Whitney. Nintacto = 10, nOperado por simulacro = 8, ncastrado = 14, nesterilizado = 4. *p < 0,05 (después de la corrección de Holm-Bonferroni).
Figura 3. Concentraciones basales de cortisol en ng/ml plasmáticas de varones intactos, simulados, esterilizados y castrados durante las pruebas de respuesta al cortisol. Los datos se presentan como medianas, valores mínimos y máximos. CRT1: prueba de respuesta al cortisol antes de la cirugía; CRT2, prueba de respuesta al cortisol unos 4 días antes del inicio del experimento (se juntaron 1 macho y 2 hembras); CRT3: prueba de respuesta al cortisol 1 semana después del inicio del experimento; CRT4, prueba de respuesta de cortisol 2 semanas después del inicio del experimento. Estadísticas: Pruebas de Kruskal-Wallis, pruebas U de Holm-Bonferroni corregidas post-hoc de Mann-Whitney. Nintacto = 10, nOperado por simulacro = 8, ncastrado = 14, nesterilizado = 4. *p < 0,05 (después de la corrección de Holm-Bonferroni).
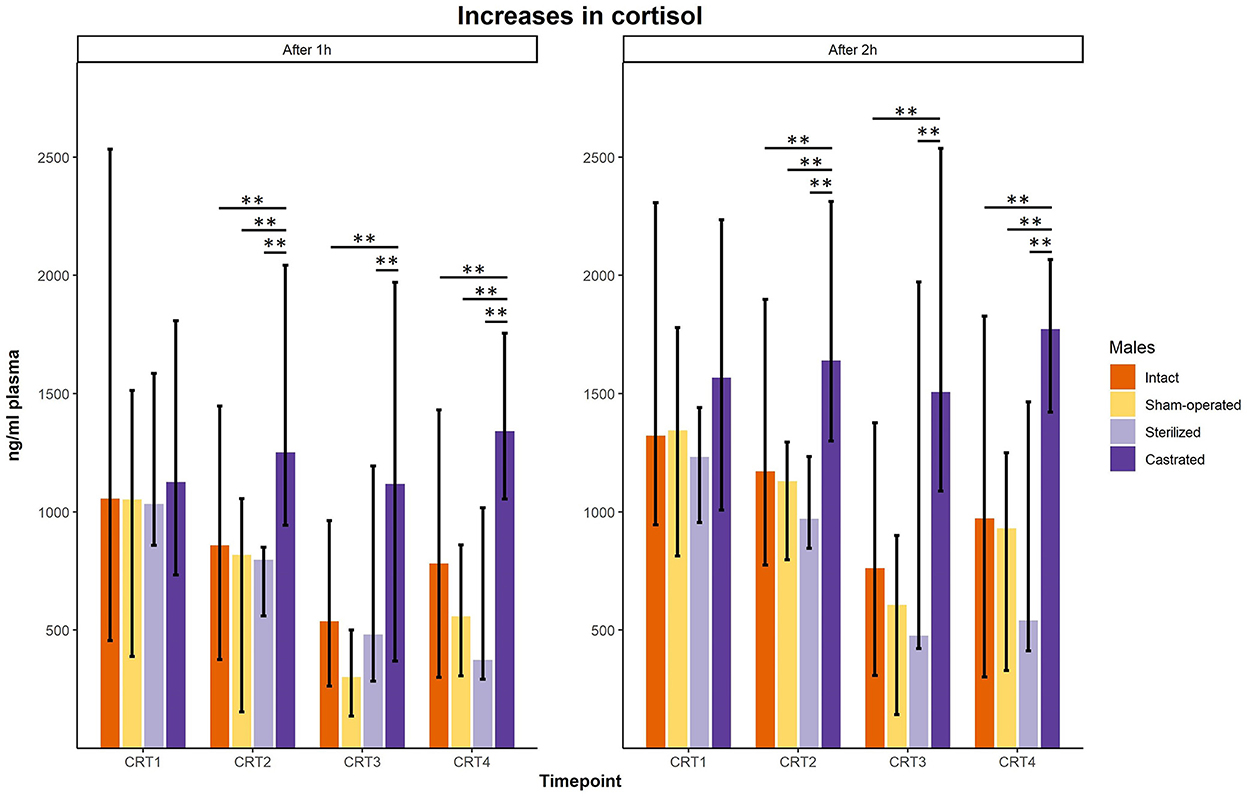 Figura 4. Valores de respuesta de cortisol en ng/ml plasma de machos intactos, operados simuladamente, esterilizados y castrados después de 1 h (panel izquierdo) y después de 2 h (panel derecho) durante las pruebas de respuesta de cortisol. Los datos se presentan como medianas, valores mínimos y máximos. CRT1: prueba de respuesta al cortisol antes de la cirugía; CRT2, prueba de respuesta al cortisol unos 4 días antes del inicio del experimento (se juntaron 1 macho y 2 hembras); CRT3: prueba de respuesta al cortisol 1 semana después del inicio del experimento; CRT4, prueba de respuesta de cortisol 2 semanas después del inicio del experimento. Estadísticas: Pruebas de Kruskal-Wallis, pruebas U de Holm-Bonferroni corregidas post-hoc de Mann-Whitney. Nintacto = 10, nOperado por simulacro = 8, ncastrado = 14, nesterilizado = 4. **p < 0,01 (después de la corrección de Holm-Bonferroni).
Figura 4. Valores de respuesta de cortisol en ng/ml plasma de machos intactos, operados simuladamente, esterilizados y castrados después de 1 h (panel izquierdo) y después de 2 h (panel derecho) durante las pruebas de respuesta de cortisol. Los datos se presentan como medianas, valores mínimos y máximos. CRT1: prueba de respuesta al cortisol antes de la cirugía; CRT2, prueba de respuesta al cortisol unos 4 días antes del inicio del experimento (se juntaron 1 macho y 2 hembras); CRT3: prueba de respuesta al cortisol 1 semana después del inicio del experimento; CRT4, prueba de respuesta de cortisol 2 semanas después del inicio del experimento. Estadísticas: Pruebas de Kruskal-Wallis, pruebas U de Holm-Bonferroni corregidas post-hoc de Mann-Whitney. Nintacto = 10, nOperado por simulacro = 8, ncastrado = 14, nesterilizado = 4. **p < 0,01 (después de la corrección de Holm-Bonferroni).
3.3. Concentraciones de cortisol en las hembras
En las hembras solo se determinaron los valores basales de cortisol, es decir, se tomaron muestras de sangre 1 día antes y poco después, 1 y 3 semanas después de alojarlas junto con un macho castrado (n = 28), operado de forma simulada (n = 16), esterilizado (n = 8) o intacto (n = 20). Solo se pudo encontrar una pequeña diferencia. Las concentraciones de cortisol fueron significativamente diferentes antes del inicio del experimento (Tabla 3). Las pruebas post-hoc mostraron que las hembras que más tarde fueron alojadas con un macho intacto tenían concentraciones de cortisol significativamente más altas que las hembras que más tarde fueron alojadas con un macho operado simuladamente (Mann-Whitney U-Test , dos colas, U = 66.5, p < 0.05. No se observaron diferencias en todos los puntos temporales después de las hembras. Independientemente de si estaban alojados con un macho intacto, simulado, esterilizado o castrado.
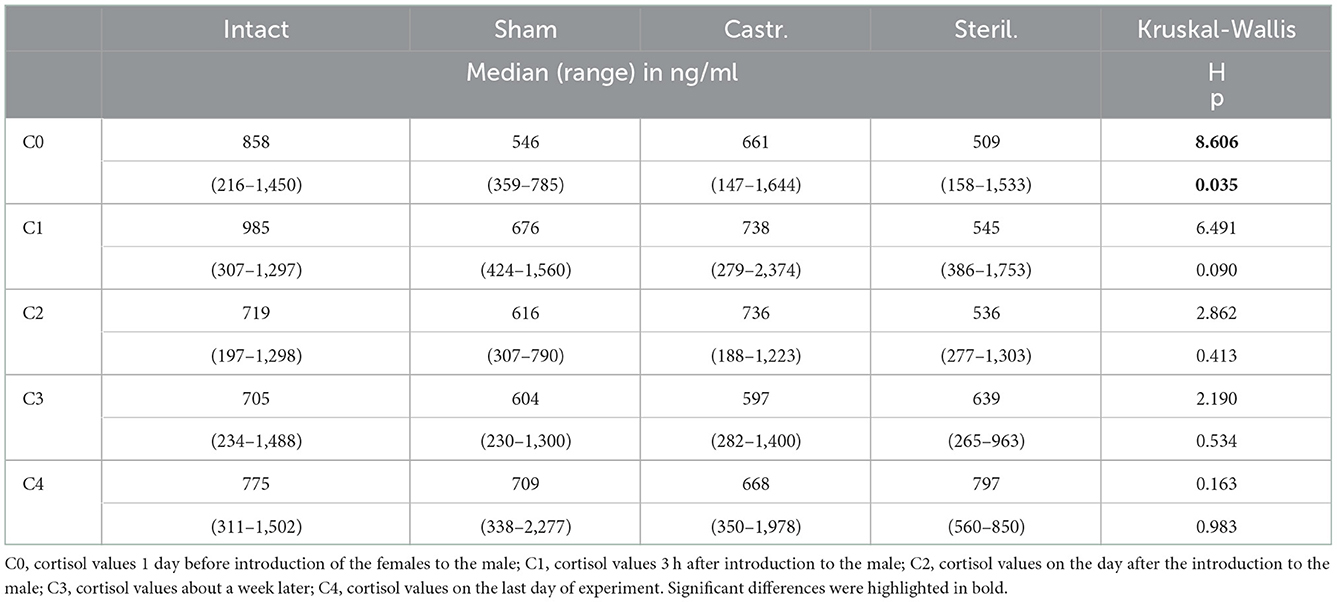 Tabla 3. Mediana, rango y parámetros estadísticos de las concentraciones de cortisol de las hembras que viven juntas con hembras intactas (n = 20), operadas simuladamente (n = 16), castradas (n = 28) y esterilizadas (n = 8).
Tabla 3. Mediana, rango y parámetros estadísticos de las concentraciones de cortisol de las hembras que viven juntas con hembras intactas (n = 20), operadas simuladamente (n = 16), castradas (n = 28) y esterilizadas (n = 8).
4. Discusión
En este estudio, investigamos si la castración y la esterilización tienen diferentes efectos sobre las concentraciones basales de cortisol, así como sobre los valores de respuesta al cortisol de los cobayos machos y sus hembras alojadas. Mientras que los valores basales de los machos no difirieron, los machos castrados mostraron niveles de reacción de cortisol significativamente más altos que los machos intactos, operados simuladamente y esterilizados. En general, los resultados apoyan la hipótesis de que los machos castrados muestran una mayor capacidad de respuesta al estrés en situaciones de estrés agudo. Además, las concentraciones de cortisol de las hembras no difirieron, independientemente del tipo de cirugía a la que se haya sometido su compañera de jaula.
4.1. Línea de base y capacidad de respuesta del cortisol como indicador de bienestar
Como se describe en la introducción, los valores basales y de respuesta de los glucocorticoides son medidas válidas en situaciones de estrés para evaluar el bienestar animal. En nuestro estudio, los valores basales de cortisol no difirieron entre los machos castrados y los machos intactos, operados simuladamente y esterilizados (con una excepción: antes del inicio del experimento, los machos castrados mostraron valores basales más altos que los machos operados simuladamente). Por lo tanto, en situaciones no desafiantes, todos los varones no muestran ningún signo endocrinológico de deterioro del bienestar. Curiosamente, sin embargo, los machos castrados mostraron valores más altos de respuesta de cortisol después de la exposición a un factor estresante agudo (nuevo entorno, separación de su grupo), es decir, los machos castrados fueron más reactivos en situaciones desafiantes agudas que los machos intactos, operados simuladamente y esterilizados. Esto apunta a una forma menos efectiva de hacer frente a las situaciones de estrés en los cobayos machos castrados que en los no castrados. Esto podría ser un indicio de un deterioro generalizado del bienestar en los machos castrados, al menos en situaciones impredecibles y desafiantes. Un hallazgo similar podría mostrarse en conejillos de indias alojados de manera diferente: los machos alojados individualmente mostraron una mayor activación del sistema HPA después de un factor estresante agudo que los machos alojados junto con una hembra. Esto indica una capacidad de afrontamiento menos efectiva con situaciones estresantes en los conejillos de indias mantenidos solos en comparación con los conejillos de indias que viven en grupos sociales (36).
Curiosamente, no se encontraron diferencias en las concentraciones de cortisol en las hembras que vivían junto con machos castrados, esterilizados, operados simuladamente o intactos. Esto es contrario a nuestra predicción y también a otras especies como por ejemplo los ratones. Garratt et al. (55) pudieron demostrar que los ratones hembra emparejados con machos castrados tenían concentraciones más altas de corticosterona (el principal glucocorticoide en ratones) que las hembras alojadas con machos esterilizados, lo que indica una mayor respuesta al estrés. Estos diferentes resultados pueden explicarse posiblemente por diferentes formas de organización social, una diferente importancia de los machos para las hembras, así como una diferente importancia de los olores para la comunicación.
4.2. Efectos mediadores de la testosterona
Dado que los varones fueron castrados antes de la madurez sexual en nuestro estudio, los niveles de testosterona fueron muy bajos durante la adolescencia. Curiosamente, algunos estudios podrían demostrar que la testosterona puede estar involucrada en la organización del eje HPA. En conejillos de indias domésticos, se informó que el nivel de testosterona experimentado durante la adolescencia puede moldear la capacidad de respuesta al cortisol: si las concentraciones altas de testosterona están presentes durante la adolescencia, las concentraciones bajas de cortisol se liberan más adelante en la vida durante una situación de estrés agudo. Si las concentraciones bajas de testosterona están presentes durante la adolescencia, las concentraciones altas de cortisol se liberan más adelante en la vida (56, 57). Por lo tanto, durante la adolescencia se produce un efecto inhibidor de la testosterona sobre la respuesta al cortisol. Es muy probable que este mecanismo exista de manera similar no solo para los conejillos de indias domésticos, sino también para otros animales que viven en grupo (44, 58). Por lo tanto, en nuestro estudio, los machos castrados podrían mostrar una mayor capacidad de respuesta al cortisol durante la prueba de respuesta al cortisol en comparación con los machos intactos, operados simuladamente y esterilizados debido a los efectos mediadores de la testosterona en el eje HPA. Por lo tanto, la alteración artificial de la concentración de testosterona a través de la castración tiene consecuencias de gran alcance para la reactividad al estrés de los animales. Dado que esto podría ser un indicio de una menor capacidad de afrontamiento en situaciones de estrés agudo, esto podría tener implicaciones para el bienestar animal.
En general, nuestros resultados apuntan a un posible deterioro del bienestar de los animales castrados. Sin embargo, en nuestro estudio decidimos centrarnos en los niveles basales y de respuesta de cortisol, que son indicadores bien establecidos del bienestar animal. Para una evaluación más amplia y profunda del bienestar animal, también deben investigarse otros parámetros en estudios futuros. Además del cortisol, estos podrían ser otros parámetros fisiológicos (p. ej., frecuencia cardíaca o mediciones inmunológicas), pero también indicadores etológicos (p. ej., el grado de comportamiento agresivo o estereotipado) y la evaluación de los estados afectivos [p. ej., miedo o placer; (59)]. Nuestro estudio es limitado debido al pequeño tamaño de la muestra y al enfoque en los valores basales y de respuesta del cortisol. Sin embargo, los resultados animan a seguir investigando si la esterilización no suele ser una alternativa a la castración en términos de bienestar animal a la hora de elegir un método para prevenir la reproducción descontrolada.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue revisado y aprobado por el Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen LANUV NRW, número de referencia: 84-02.04.2017.A199.
Contribuciones de los autores
SHR, NS y SK concibieron el estudio. AK, NS, SHR y SK diseñaron los experimentos. AK, JW, AW y MD llevaron a cabo las cirugías. AK y MB realizaron los experimentos, mientras que SK supervisó el proyecto. SK analizó los datos y escribió el borrador inicial del manuscrito. MB creó las figuras. Todos los autores lo revisaron críticamente en busca de contenido intelectual importante. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
Este trabajo fue apoyado por una beca de la Fundación Alemana de Investigación (DFG) a SK (KA 1546/10-1).
Reconocimientos
Los autores agradecen a Vanessa von Kortzfleisch por contribuir con su experiencia estadística, así como a S. Kruse por realizar el análisis endocrino. También nos gustaría agradecer a las cuidadoras de animales Hanna Sicking y Kimberley Kubski por su ayuda con la toma de muestras de sangre.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Financiación
Este trabajo fue apoyado por una beca de la Fundación Alemana de Investigación (DFG) a SK (KA 1546/10-1).
Referencias
1. Urfer SR, Kaeberlein M. Desexing dogs: una revisión de la literatura actual. Animales. (2019) 9:1086. doi: 10.3390/ani9121086
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Dyck E. Un experimento eugenésico: esterilización, hiperactividad y degeneración. En:Dyck E, Stewart L, , editores. Los usos de los humanos en la experimentación. Leiden: Brill (2016). págs. 260-80. doi: 10.1163/9789004286719_012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Nelson RJ, Kriegsfeld J. Una introducción a la endocrinología conductual. Sunderland, MA: Sinauer Associates (2017).
4. Lauretta R, Sansone M, Sansone A, Romanelli F, Appetecchia M. Género en enfermedades endocrinas: papel de las hormonas gonadales sexuales. Int J Endocrinol. (2018) 2018:11. doi: 10.1155/2018/4847376
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Gentile GP, Helbig DW, Zacur H, Park T, Lee YJ, Westhoff CL. Niveles hormonales antes y después de la esterilización tubárica. Contracepción. (2006) 73:507–11. doi: 10.1016/j.anticonception.2005.12.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Ansari AS, Badar A, Lohiya NK. Modalidades de control de la fertilidad en animales: una visión general. BAOJ Vet Sci. (2017) 1:004.
7. Rowland M. Cuidado veterinario de conejillos de indias. Prácticas. (2020) 42:91–104. doi: 10.1136/inp.m405
8. Spoolder HAM, Schöne M, Bracke MBM. Iniciativas para reducir las mutilaciones en la producción ganadera. Wageningen: Wageningen UR (Universidad y Centro de Investigación) Investigación Ganadera (2016), p. 84.
9. Yadav SK, Hossain MA, Dey T, Bostami B, Sutradhar BC. Evaluación quirúrgica y anestésica de la castración en casos de cobaya-2. J Cuidado de la crítica de Anesth. (2017) 8:00325. doi: 10.15406/jaccoa.2017.08.00325
10. Knol BW, Egberink-Alink ST. Tratamiento del comportamiento problemático en perros y gatos mediante la castración y la administración de progestágenos: una revisión. Veterinario Q. (1989) 11:102–7. doi: 10.1080/01652176.1989.9694206
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Manning A, Thompson ML. Retención postcastración del comportamiento sexual en el ratón macho BDF1: el papel de la experiencia. Anim Behave. (1976) 24:523–33. doi: 10.1016/S0003-3472(76)80065-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Wallace PY, Asa CS, Agnew M, Cheyne SM. Una revisión de los métodos de control de la población en primates alojados en cautiverio. Anim Welf. (2016) 25:7–20. doi: 10.7120/09627286.25.1.007
13. Jacobs JA, Coe JB, Pearl DL, Widowski TM, Niel L. Factores asociados con el comportamiento de protección de recursos caninos en presencia de perros: una encuesta transversal de propietarios de perros. Prev Vet Med. (2018) 161:134–42. doi: 10.1016/j.prevetmed.2017.02.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Jacobs JA, Coe JB, Pearl DL, Widowski TM, Niel L. Factores asociados con el comportamiento de protección de recursos caninos en presencia de personas: una encuesta transversal de propietarios de perros. Prev Vet Med. (2018) 161:143–53. doi: 10.1016/j.prevetmed.2017.02.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Farhoody P, Mallawaarachchi I, Tarwater PM, Serpell JA, Duffy DL, Zink C. Agresión hacia personas conocidas, extraños y congéneres en perros gonadectomizados e intactos. Front Vet Sci. (2018) 5:18. doi: 10.3389/fvets.2018.00018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Bryan JN, Keeler MR, Henry CJ, Bryan ME, Hahn AW, Caldwell CW, et al. Estudio poblacional del estado de la castración como factor de riesgo para el cáncer de próstata canino. Próstata. (2007) 67:1174–81. doi: 10.1002/pros.20590
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Kutzler MA. Posible relación entre los efectos adversos para la salud a largo plazo de la esterilización quirúrgica con extracción de gónadas y la hormona luteinizante en perros. Animales. (2020) 10:599. doi: 10.3390/ani10040599
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. McKenzie B. Evaluación de los beneficios y riesgos de la castración de perros y gatos. CAB Rev Perspect Agric Vet Sci Nutr Nat Resour. (2010) 5:1–18. doi: 10.1079/PAVSNNR20105045
19. Overly B, Shofer FS, Goldschmidt MH, Sherer D, Sorenmo KU. Asociación entre la ovariohisterectomía y el carcinoma mamario felino. J Veterinario Pasante Med. (2005) 19:560–3. doi: 10.1111/j.1939-1676.2005.tb02727.x
20. Colliard L, Paragon B-M, Lemuet B, Bénet J-J, Blanchard G. Prevalencia y factores de riesgo de la obesidad en una población urbana de gatos sanos. J Feline Med Surg. (2009) 11:135–40. doi: 10.1016/j.jfms.2008.07.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Neilson JC, Hart BL, Cliff KD, Ruehl WW. Prevalencia de cambios de comportamiento asociados al deterioro cognitivo relacionado con la edad en perros. J Am Vet Med Assoc. (2001) 218:1787–91. doi: 10.2460/javma.2001.218.1787
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Stöcklin-Gautschi NM, Hässig M, Reichler IM, Hubler M, Arnold S. La relación de la incontinencia urinaria con la esterilización precoz en perras. J Reprod Fertil Suppl. (2001) 57:233–6.
23. Taylor-Brown FE, Meeson RL, Brodbelt DC, Church DB, Mcgreevy PD, Thomson PC, et al. Epidemiología del diagnóstico de la enfermedad del ligamento cruzado craneal en perros que acuden a consultas veterinarias de atención primaria en Inglaterra. Cirugía veterinaria. (2015) 44:777–83. doi: 10.1111/vsu.12349
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Andersen SS, Meyer I, Forkman B, Nielsen SS, Sandøe P. Regulación del bienestar de los perros de compañía: un estudio comparativo de los marcos legales en los países occidentales. Animales. (2021) 11:1660. doi: 10.3390/ani11061660
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Sallander M, Hedhammar Å, Rundgren M, Lindberg JE. Datos demográficos de una población de perros suecos asegurados medidos en un estudio de cuestionario. Acta Vet Scand. (2001) 42:71–80. doi: 10.1186/1751-0147-42-71
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Escoba DM, Johnson KG. Estrés y Bienestar Animal. Dordrecht: Kluwer Academics Publishers (1993).
27. Mormède P, Andanson S, Aupérin B, Beerda B, Guémené D, Malmkvist J, et al. Exploración de la función hipotálama-hipófisis-suprarrenal como herramienta para evaluar el bienestar animal. Physiol Behave. (2007) 92:317–39. doi: 10.1016/j.physbeh.2006.12.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Sapolsky RM. Endocrinología de la respuesta al estrés. En:Becker JB, Breedlove SM, Crews D, McCarthy M, , editores. Endocrinología Conductual. Cambridge, MA: MIT Press (2002), p. 409-450.
29. Sachser N, Dürschlag M, Hirzel D. Las relaciones sociales y la gestión del estrés. Psiconeuroendocrinología. (1998) 23:891–904. doi: 10.1016/S0306-4530(98)00059-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Koolhaas J, Bartolomucci A, Buwalda B, de Boer SF, Flügge G, Korte S, et al. Stress revisited: una evaluación crítica del concepto de estrés. Neurosci Biobehav Rev. (2011) 35:1291–301. doi: 10.1016/j.neubiorev.2011.02.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Sapolsky RM, Romero LM, Munck AU. ¿Cómo influyen los glucocorticoides en las respuestas al estrés? Integrar acciones permisivas, supresivas, estimulantes y preparativas. Endocr Rev. (2000) 21:55–89. doi: 10.1210/edrv.21.1.0389
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. von Holst D. El concepto de estrés y su relevancia para el comportamiento animal. En:Møller AP, Milinski M, Slater PJB, , editores. Avances en el estudio de la conducta. Nueva York, NY: Academic Press (1998). págs. 1-131.
33. Hau M, Casagrande S, Ouyang JQ, Baugh AT. Fenotipos mediados por glucocorticoides en vertebrados: variación multinivel y evolución. En:Naguib M, Mitani JC, Simmons LW, Barrett L, Healy S, Zuk M, , editores. Avances en el estudio de la conducta. Nueva York, NY: Academic Press (2016), p. 41–115. doi: 10.1016/bs.asb.2016.01.002
34. McEwen BS, Wingfield JC. El concepto de alostasia en biología y biomedicina. Horm Compórtate. (2003) 43:2–15. doi: 10.1016/S0018-506X(02)00024-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Vera F, Zenuto R, Antenucci CD. Ampliar las acciones del cortisol y la corticosterona en vertebrados silvestres: un paso necesario para superar los desafíos emergentes. Gen Comp Endocrinol. (2017) 246:337–53. doi: 10.1016/j.ygcen.2017.01.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Sachser N. Sozialphysiologische Untersuchungen an Hausmeerschweinchen. Gruppenstrukturen, soziale Situation und Endokrinium, Wohlergehen Schriftenreihe Versuchstierkunde, Heft 16. Berlín: Paul Parey Verlag (1994).
37. Grant RA, Montrose VT, Wills AP. ExNOTic: ¿deberíamos tener mascotas exóticas? Animales. (2017) 7:47. doi: 10.3390/ani7060047
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Cockrem JF. Variación individual en las respuestas al estrés glucocorticoides en animales. Gen Comp Endocrinol. (2013) 181:45–58. doi: 10.1016/j.ygcen.2012.11.025
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Hennessy MB, Kaiser S, Tiedtke T, Sachser N. Estabilidad y cambio: respuestas al estrés y la conformación de fenotipos conductuales a lo largo de la vida. Zoológico frontal. (2015) 12:S18. doi: 10.1186/1742-9994-12-S1-S18
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Jones CT. Concentraciones de corticosteroides en el plasma de cobayas fetales y maternas durante la gestación. Endocrinología. (1974) 95:1129–33. doi: 10.1210/endo-95-4-1129
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Fujieda K, Goff AK, Pugeat M, Strott CA. Regulación de la hipófisis: eje suprarrenal e interacción corticosteroide-globulina fijadora-cortisol en el conejillo de indias. Endocrinología. (1982) 111:1944–9. doi: 10.1210/endo-111-6-1944
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Hennessy MB, Hornschuh G, Kaiser S, Sachser N. Respuestas de cortisol y amortiguación social: un estudio a lo largo de la vida. Horm Compórtate. (2006) 49:383–90. doi: 10.1016/j.yhbeh.2005.08.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Kaiser S, Krüger C, Sachser N. El conejillo de indias. En:Hubrecht R, Kirkwood J, , editores. El cuidado y manejo de animales de laboratorio y otros animales de investigación. 8ª edición. Chichester: Wiley-Blackwell (2010), p. 380-98. doi: 10.1002/9781444318777.ch27
44. Sachser N, Kaiser S, Hennessy MB. Los perfiles conductuales están determinados por la experiencia social: cuándo, cómo y por qué. Philos Trans R Soc Lond B Biol Sci. (2013) 368:20120344. doi: 10.1098/rstb.2012.0344
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Sachser N, Hennessy MB, Kaiser S. Modulación adaptativa de los perfiles conductuales por estrés social durante las primeras fases de la vida y la adolescencia. Neurosci Biobehav Rev. (2011) 35:1518–33. doi: 10.1016/j.neubiorev.2010.09.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Bauer B, Palme R, Machatschke IH, Dittami J, Huber S. Medición no invasiva de la actividad adrenocortical y gonadal en cobayas machos y hembras (Cavia aperea f. porcellus). Gen Comp Endocrinol. (2008) 156:482–9. doi: 10.1016/j.ygcen.2008.03.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Nemeth M, Pschernig E, Wallner B, Millesi E. Mediciones no invasivas de cortisol como indicadores de respuestas fisiológicas al estrés en cobayas. PeerJ. (2016) 4:E1590. doi: 10.7717/peerj.1590
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Powell DM, Kozlowski CP, Clark J, Seyfried A, Baskir E, Franklin AD. Indicadores físicos y fisiológicos de bienestar en cobayas (Cavia porcellus) que sirven como animales embajadores. Animales. (2020) 10:815. doi: 10.3390/ani10050815
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Ferkin MH, Sorokin ES, Renfroe MW, Johnston RE. El atractivo de los olores masculinos para las hembras varía directamente con la concentración plasmática de testosterona en los ratones de campo. Physiol Behave. (1994) 55:347–53. doi: 10.1016/0031-9384(94)90145-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Thyen Y, Hendrichs H. Diferencias en el comportamiento y la organización social de las cobayas hembras en función de la presencia de un macho. Etología. (1990) 85:25–34. doi: 10.1111/j.1439-0310.1990.tb00382.x
51. Aradhya KW, Mejor K, Sokal DC. Revisión clínica: evolución reciente de la vasectomía. BMJ. (2005) 330:296–9. doi: 10.1136/bmj.330.7486.296
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Labrecque M, Hays M, Chen-Mok M, Barone MA, Sokal D. Frecuencia y patrones de recanalización temprana después de la vasectomía. BMC Urol. (2006) 6:25. doi: 10.1186/1471-2490-6-25
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Equipo central de R. R: Un entorno lingüístico para la computación estadística 4.0.0. Viena: R Foundation Stat Comput (2020). Disponible en línea en: https://www.R-project.org/ (consultado el 20 de octubre de 2022).
54. Mutwill AM, Zimmermann TD, Hennicke A, Richter SH, Kaiser S, Sachser N. Remodelación adaptativa del fenotipo hormonal después de la transición del nicho social en la edad adulta. Proc Biol Sci. (2020) 287:20200667. doi: 10.1098/rspb.2020.0667
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Garratt M, Kee AJ, Palme R, Brooks RC. La presencia de machos puede aumentar la masa corporal e inducir una respuesta al estrés en ratones hembra independientemente de los costos de producción de la descendencia. Sci Rep. (2016) 6:23538. doi: 10.1038/srep23538
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Lürzel S, Kaiser S, Krüger C, Sachser N. Influencia inhibidora de la testosterona en la respuesta al estrés durante la adolescencia. Horm Compórtate. (2011) 60:691–8. doi: 10.1016/j.yhbeh.2011.09.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Lürzel S, Kaiser S. La interacción social disminuye la capacidad de respuesta al estrés durante la adolescencia. Psiconeuroendocrinología. (2011) 36:1370–7. doi: 10.1016/j.psyneuen.2011.03.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Diablos AL, Handa RJ. Diferencias sexuales en la respuesta del eje hipotálamo-hipófisis-suprarrenal al estrés: un papel importante de las hormonas gonadales. Neuropsicofarmaco. (2019) 44:45–58. doi: 10.1038/s41386-018-0167-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Fraser D. Entendiendo el bienestar animal. Oxford: Wiley-Blackwell (2008). doi: 10.1186/1751-0147-50-S1-S1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Ley de Protección Animal, hormonas, mascotas, eje hipotálamo-hipófisis-adrenocortical, reproducción, estrés, testosterona, bienestar
Cita: Kaiser S, Korte A, Wistuba J, Baldy M, Wissmann A, Dubičanac M, Richter SH y Sachser N (2023) Efectos de la castración y la esterilización en los niveles basales y de respuesta del cortisol: un estudio de caso en cobayas machos. Frente. Vet. Sci. 9:1093157. doi: 10.3389/fvets.2022.1093157
Recibido: 08 de noviembre de 2022; Aceptado: 14 de diciembre de 2022;
Publicado: 06 Enero 2023.
Editado por:
Daniel Mota-Rojas, Universidad Autónoma Metropolitana, México
Revisado por:
Miriam Marcet Rius, Institut de Recherche en Sémiochimie et Ethologie Appliquée (IRSEA), Francia
Adriana Olmos-Hernández, Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra, México
Derechos de autor © 2023 Kaiser, Korte, Wistuba, Baldy, Wissmann, Dubičanac, Richter y Sachser. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Sylvia Kaiser,  kaisesy@uni-muenster.de
kaisesy@uni-muenster.de
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


