Efectos de la suplementación dietética de L-citrulina en cerdos
 Efectos de la suplementación dietética de L-citrulina en el rendimiento del crecimiento, la calidad de la carne y la composición microbiana fecal en cerdos de engorde
Efectos de la suplementación dietética de L-citrulina en el rendimiento del crecimiento, la calidad de la carne y la composición microbiana fecal en cerdos de engorde
 Junhua Du1,2†
Junhua Du1,2† Mailin Gan1,2†
Mailin Gan1,2† Zhongwei Xie1,2
Zhongwei Xie1,2 Chengpeng Zhou1,2
Chengpeng Zhou1,2 Yunhong Jing1,2
Yunhong Jing1,2 Menglin Li1,2
Menglin Li1,2 Chengming Liu1,2
Chengming Liu1,2 Meng Wang1,2
Meng Wang1,2 Haodong Dai1,2
Haodong Dai1,2 Zhiyang Huang1,2
Zhiyang Huang1,2 Lei Chen1,2
Lei Chen1,2 Ye Zhao1,2
Ye Zhao1,2 Lili Niu1,2
Lili Niu1,2 Yan Wang1,2
Yan Wang1,2 Shunhua Zhang1,2
Shunhua Zhang1,2 Zongyi Guo3
Zongyi Guo3 Linyuan Shen1,2*
Linyuan Shen1,2* Li Zhu1,2*
Li Zhu1,2*- 1Key Laboratory of Livestock and Poultry Multi-omics, Ministerio de Agricultura y Asuntos Rurales, Facultad de Animales y Tecnología, Universidad Agrícola de Sichuan, Chengdu, China
- 2Laboratorio clave de exploración e innovación de recursos genéticos de animales de granja de la provincia de Sichuan, Universidad Agrícola de Sichuan, Chengdu, China
- 3Academia de Ciencia Animal de Chongqing, Chongqing, China
La microbiota intestinal juega un papel importante en la ecología intestinal y el desarrollo de los cerdos, que siempre está regulada por nutrientes. Este estudio investigó el efecto de la L-citrulina en el rendimiento del crecimiento, las características de la canal, y su posible mecanismo regulador. Los resultados mostraron que la suplementación dietética con L-citrulina al 1% durante 52 días aumentó significativamente el peso final, el aumento de peso vivo, el peso en canal y la grasa dorsal promedio y disminuyó notablemente la pérdida por goteo (p < 0.05) de cerdos de engorde en comparación con el grupo de control. El análisis microbiano de muestras fecales reveló un marcado aumento en la diversidad α y una composición significativamente alterada de la microbiota intestinal en cerdos de engorde en respuesta a la L-citrulina. En particular, esta microbiota intestinal alterada a nivel de filo y género puede estar involucrada principalmente en el proceso metabólico de carbohidratos, energía y aminoácidos, y exhibió una asociación significativa con el peso final, el peso de la canal y el grosor de la grasa dorsal. Tomados en conjunto, nuestros datos revelaron el papel potencial de la L-citrulina en la modulación del rendimiento de crecimiento, las características de la canal y la calidad de la carne de los cerdos de engorde, que probablemente esté asociada con la microbiota intestinal.
1. Introducción
La microbiota intestinal es un ecosistema complejo y diverso formado por numerosos microorganismos, que desempeñan un papel crucial en el apoyo a las funciones nutricionales, fisiológicas e inmunes de los cerdos (Brestoff y Artis, 2013; Fouhse et al., 2016). Los cerdos poseen la capacidad de albergar intrincadas comunidades microbianas. La relación entre el huésped y la microbiota simbiótica se caracteriza por la interdependencia y la influencia mutua. Además, la modulación de la microbiota puede emplearse para mejorar la salud y la productividad de los cerdos (Yang et al., 2017). La composición de la microbiota intestinal suele estar influenciada por diversos factores, como el genotipo del huésped, la edad, el sexo, el medio ambiente, la dieta y el uso de antibióticos. Rothschild et al. (2018) creían que la heredabilidad promedio de la microbiota intestinal se estima en solo el 1,9%. Además, más del 20% de la variación en la composición microbiana se puede atribuir a factores ambientales como la dieta, los medicamentos y las opciones de estilo de vida. Sin embargo, la alimentación es el factor más importante entre muchos factores que afectan la composición de la microbiota intestinal del cerdo, lo que puede explicar el 35% de la variación de la composición de la microbiota intestinal del cerdo (Wang et al., 2019). Se informó que los cambios en la dieta pueden causar cambios en la microbiota cecal dentro de las 24 h (David et al., 2014). El impacto beneficioso de los cambios en la comunidad microbiana en el huésped se basa principalmente en la abundancia y el carácter distintivo de los microorganismos alterados, así como en los metabolitos que producen. Actualmente, numerosos nutrientes dietéticos y aditivos funcionales, incluidos probióticos, prebióticos y enzimas, se han identificado como reguladores efectivos de la composición de microorganismos intestinales en cerdos, promoviendo así la salud intestinal.
La citrulina, también conocida como ornitina carbamilornitina, existe en la conformación de tipo L, por lo que se conoce comúnmente como L-citrulina. Dentro del cuerpo, la citrulina (Cit) se metaboliza principalmente por la arginina y el óxido nítrico (NO), lo que lleva a la producción de NO y poliaminas como sus productos finales, respectivamente (Tsuboi et al., 2018). En numerosos estudios en humanos, la L-citrulina se ha utilizado como un suplemento dietético con el propósito de proporcionar un sustrato para la síntesis de arginina (ARG) o como precursor del óxido nítrico (NO) (Papadia et al., 2018). Se informó que la L-citrulina sirve como precursor de arginina de manera más productiva que la arginina en sí (Schwedhelm et al., 2008). En la actualidad, aunque la L-citrulina ha mostrado muchos efectos beneficiosos, que pueden promover el aumento de peso (Meesters et al., 2020), mejorar la inmunidad (Cai et al., 2020) y disminuir la proporción de células senescentes (Tsuboi et al., 2018), glucosa en sangre y lípidos en sangre (Danboyi et al., 2021), desgaste muscular y aumento del ejercicio (Eshreif et al., 2020). Sin embargo, el impacto potencial de la suplementación dietética de L-citrulina en el crecimiento y la calidad de la carne de cerdo de engorde aún no está claro. Anteriormente, los estudios sugirieron que la síntesis, la descomposición y el metabolismo de la L-citrulina ocurren principalmente en el intestino, mientras que se desconoce si el mecanismo de acción de la citrulina está asociado con la microbiota del huésped. En este estudio, investigamos los efectos de la suplementación dietética con L-citrulina sobre el rendimiento de crecimiento, las características de la canal y la calidad de la carne, así como la microbiota intestinal, e identificamos su corrección entre fenotipos y microbiota intestinal en cerdos de engorde. Los resultados proporcionan nuevos conocimientos sobre el potencial biológico de la L-citrulina en la mejora de cerdos con valores nutricionales significativos.
2. Materiales y métodos
2.1. Animales y diseño experimental
Un total de 12 cerdos blancos grandes con 72,25 ± 4,30 kg proporcionados por una empresa de cría de cerdos en la provincia de Sichuan, China, fueron asignados aleatoriamente a dos grupos de dieta diferentes (n = 6 por grupo) incluyendo (1) una dieta basal o (2) una dieta basal y 1% de L-citrulina (10 g de L-citrulina por 1 kg de alimento líquido), respectivamente. Utilizamos un alimento comercial de Cargill Feed (Chongqing) Co., Ltd. como alimento basal para todos los cerdos de engorde. La composición y los niveles de nutrientes de la dieta basal se dan en la Tabla Suplementaria S1. Todos los cerdos tuvieron acceso gratuito a alimento y agua, y se alojaron en condiciones ambientales similares con temperaturas ambiente de alrededor de 25-35 ° C. Utilizando el dispositivo de pesaje individual de cerdos D600 (Jiangsu Kono Animal Husbandry Equipment Technology Co., Ltd.), los pesos corporales iniciales y finales de los cerdos de engorde se midieron individualmente antes y después de los experimentos de alimentación. L-citrulina con una pureza mínima del 98% fue comprado de Shanghai Yuanye Biological Co., Ltd. Todos los procedimientos experimentales fueron aprobados por el Comité de Ética y Bienestar Animal de la Universidad Agrícola de Sichuan, Chengdu, China (número de aprobación DKY-B20131403).
2.2. Análisis en animales y recogida de muestras
Recolectamos heces frescas de cerdos de engorde, e inmediatamente las congelamos y almacenamos a -80 ° C para la extracción de ADN, en el día 52 después del tratamiento. Posteriormente, se evaluaron más a fondo las características de la canal. Brevemente, todos los cerdos fueron trasladados a una sala de sacrificio comercial y aturdidos eléctricamente, y luego sacrificados de acuerdo con los procedimientos comerciales estándar. El peso corporal vivo y el peso de la canal caliente se registraron inmediatamente para el cálculo del porcentaje de apósito. Mientras tanto, también se registró la longitud de la canal. El grosor de la grasa dorsal (mm) se calculó promediando las puntuaciones de tres regiones en la primera costilla, la última costilla y la última vértebra lumbar de los lados derechos de la canal. El área muscular del ojo se midió en la última costilla usando calibradores vernier. El pH45 minutos, el color de la carne, la pérdida por goteo, la pérdida por purga y las mediciones de pérdida de cocción se realizaron utilizando el músculo longissimus dorsi (LD) obtenido del lado izquierdo de cada canal.
2.3. Medición de la calidad de la carne
Los parámetros de pH y color de la carne (ligereza L*, enrojecimiento a* y amarillez b*) se evaluaron 45 min después del sacrificio utilizando un medidor de pH (pH-STAR, MATTHAUS, Alemania) y un cromómetro portátil (CR-400, KONICA MINOLTA, Japón) respectivamente. Se tomaron tres mediciones en diferentes áreas de cada chuleta, y se calculó el valor promedio. La pérdida por goteo se evaluó pesando aproximadamente 25 g de músculo después de un período postmortem de 45 minutos (W1). Luego, el músculo se colocó en una bolsa de almacenamiento unida a un anzuelo y se mantuvo a 4 ° C durante 24 h. Después, el músculo se retiraba del anzuelo, se secaba cuidadosamente y se volvía a pesar (W2). El valor de pérdida por goteo se calculó utilizando la siguiente fórmula: pérdida por goteo (%) = (W1 − W2)/W1 * 100. Para determinar la pérdida de cocción, se pesaron aproximadamente 100 g de músculo (W3) y se cocinaron en una vaporera durante 30 min. Después del proceso de cocción, la muestra de músculo se retiró rápidamente del vaporizador, se dejó enfriar durante 20 minutos a temperatura ambiente y se volvió a pesar (W4). La pérdida de cocción se calculó utilizando la fórmula: pérdida de cocción (%) = (W3 − W4)/W3 * 100. La pérdida de purga se midió y calculó de acuerdo con el método descrito por Setyabrata y Kim (2019).
2.4. Secuenciación del gen 16S rRNA
Se utilizó el método CTAB/SDS para extraer el ADN total del genoma en muestras (Sambrook et al., 1989). La concentración y pureza del ADN se monitorizaron con gel de agarosa al 1%. De acuerdo con la concentración, el ADN se diluyó a 1 ng / μL con agua estéril. Luego, el ADN genómico diluido se utilizó como plantilla para la amplificación por PCR. La región hipervariable V3-V4 del gen 16S rRNA se amplificó utilizando un par de cebadores específicos: 341F (CCTAYGGGRBGCASCAG) y 806R (GGACTACNNGGGTATCTAAT). La amplificación por PCR se realizó utilizando Phusion High-Fidelity PCR Master Mix (New England Biolabs, Ipswich, MA, Estados Unidos) siguiendo las instrucciones del fabricante. Finalmente, los productos de PCR se detectaron mediante electroforesis en gel de agarosa al 2%.®
2.5. Análisis bioinformático de los datos de secuenciación
De acuerdo con la secuencia de código de barras y la secuencia de cebador de amplificación de PCR, los datos de la muestra se separaron de los datos fuera de línea. Después de truncar las secuencias de código de barras y cebador, las lecturas de las muestras se empalmaron utilizando FLASH (V1.2.11)1 (Magoc y Salzberg, 2011) software para obtener Raw Tags. Posteriormente, se utilizó el software fastp para realizar el control de calidad de las etiquetas RAW obtenidas para obtener etiquetas limpias de alta calidad. Finalmente, el software Vsearch se utiliza para comparar Clean Tags con la base de datos para detectar quimeras y eliminarlas, a fin de obtener los datos válidos finales, Effective Tags (Haas et al., 2011).
Para las etiquetas efectivas obtenidas anteriormente, el módulo DADA2 en el software QIIME2 se utiliza para la reducción de ruido, y las secuencias con una abundancia de menos de 5 se filtran para obtener los ASV finales (variantes de secuencia de amplicones) y la tabla de características.
Se utilizó el software QIIME2 para calcular los índices observed_ASVs y chao1 para analizar la diversidad de la composición microbiana fecal y dibujar una curva de rarefacción. El análisis de componentes principales se utilizó para analizar la diversidad β entre diferentes grupos (paquetes «veganos») para comparar las diferencias en la composición microbiana fecal bajo diferentes tratamientos. Para obtener las diferentes especies entre diferentes grupos, se utilizó el software LEfSe para analizar la diferencia significativa de especies entre diferentes grupos bajo diferentes tratamientos, y LDA discriminante lineal (LDA Score) para cuantificar el efecto de diferentes especies sobre la diferencia entre grupos. Además, las funciones de ASV se anotaron contra la base de datos Greengenes utilizando PICRUST (Haas et al., 2011). Finalmente, se utilizó el análisis de correlación de Pearson para determinar las correlaciones de los 40 filos y géneros principales con diferencias significativas en la abundancia relativa del peso final, el peso en canal y la grasa dorsal promedio.
2.6. Análisis estadísticos
El rendimiento de crecimiento, las características de la canal y la abundancia relativa de microbios fecales de cerdos de engorde fueron analizados por el software SPSS 22.0. Las diferencias entre los valores medios se evaluaron mediante una muestra T independiente. La significancia se estableció en un valor p de 0,05.
3. Resultados
3.1. Efecto de la L-citrulina dietética sobre el rendimiento del crecimiento y las características de la canal
Para investigar el efecto de la L-citrulina en el rendimiento de crecimiento y el peso en canal de los cerdos de engorde, los cerdos blancos grandes sin diferencia tanto en el peso inicial como en la edad se suplementaron con L-Cit al 1% durante 52 días. Como se muestra en la Tabla 1, detectamos un marcado aumento en el peso final de los cerdos alimentados con L-citrulina (L-Cit) en comparación con el grupo control (NC), que puede deberse a un aumento significativo de la ganancia diaria promedio (ADG) tras la suplementación con L-citrulina. Además, la suplementación con L-citrulina resultó en un notable aumento del peso de la canal en un 7,9% sin afectar la longitud de la canal en cerdos de engorde. No se determinaron diferencias en el área del músculo ocular entre los dos grupos, mientras que los cerdos alimentados con L-citrulina exhibieron un grosor de grasa dorsal significativamente mayor en comparación con los cerdos alimentados con dieta basal.
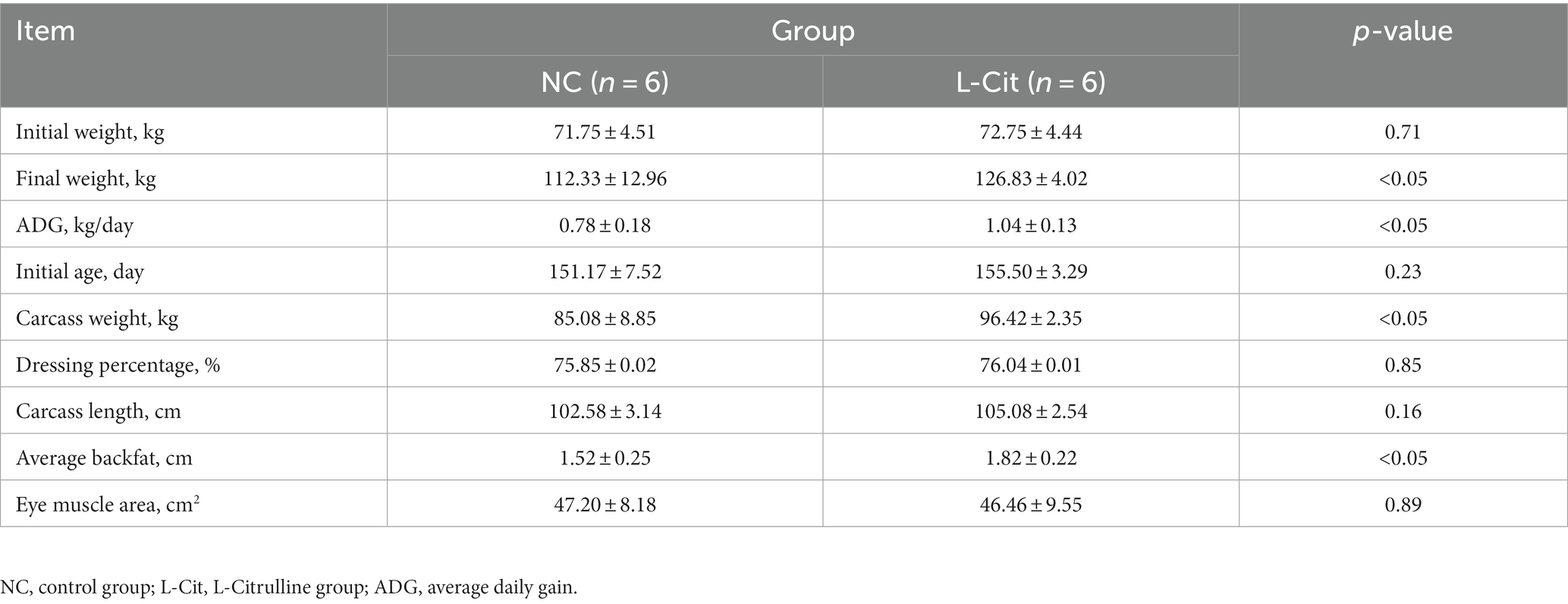 Tabla 1. Efecto de la suplementación dietética de L-citrulina sobre el rendimiento de crecimiento y las características de la canal de cerdos de engorde.
Tabla 1. Efecto de la suplementación dietética de L-citrulina sobre el rendimiento de crecimiento y las características de la canal de cerdos de engorde.
3.2. Efecto de la L-citrulina dietética sobre la calidad de la carne de cerdos de engorde
A continuación, accedimos al efecto de la L-citrulina dietética en la calidad de la carne de los cerdos de engorde. Como se muestra en la Tabla 2, la pérdida por goteo disminuyó significativamente de 4.33 a 2.32% después de la suplementación dietética con L-citrulina. Sin embargo, no se observaron diferencias significativas en el pH45 minutos, el color de la carne, la pérdida de purga y la pérdida de cocción entre los dos grupos.
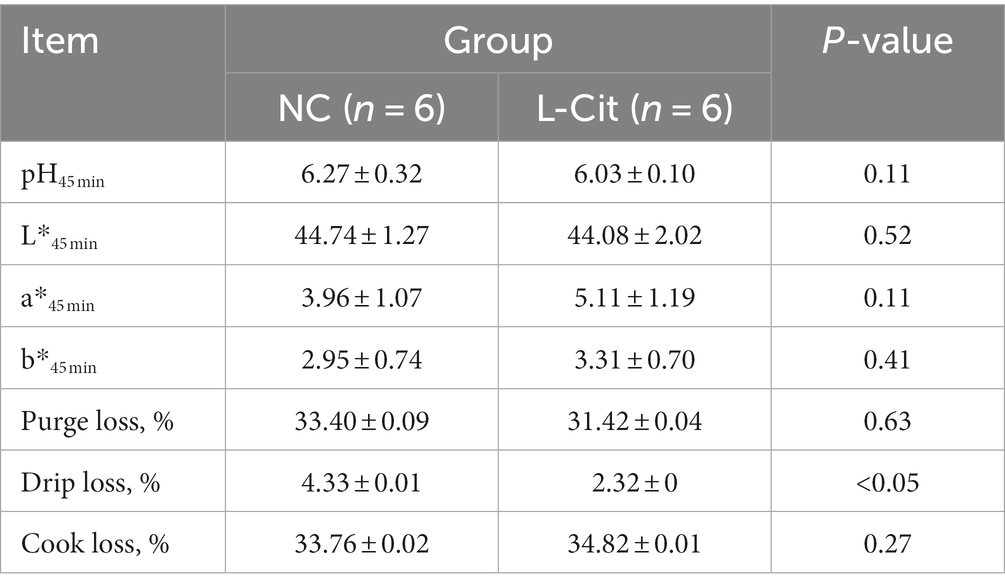 Tabla 2. Efecto de la suplementación dietética de L-citrulina en la calidad de la carne de cerdos de engorde.
Tabla 2. Efecto de la suplementación dietética de L-citrulina en la calidad de la carne de cerdos de engorde.
3.3. Microbios fecales alterados en cerdos de engorde
La evidencia emergente revela un papel potencial de la microbiota intestinal en las alteraciones mediadas por nutrientes del rendimiento del crecimiento y las características de la canal, y la L-citrulina puede contribuir a mejorar la salud intestinal. Para caracterizar el mecanismo regulador por el cual la L-citrulina afectó el rendimiento del crecimiento y las características de la canal de los cerdos de engorde, analizamos la microbiota intestinal mediante la secuenciación del gen 16S rRNA en muestras fecales recolectadas de los grupos L-Cit y NC, respectivamente. Después del control de calidad, se generaron 4.066 ASV válidos para cada muestra a realizar para su posterior análisis, que se agrupó al 100% de similitud. Como se muestra en la Figura Suplementaria S1, el análisis de la curva de dilución sugirió que la profundidad de secuenciación cubría nuevos filotipos raros y la mayor parte de la diversidad. El análisis ponderado de coordenadas principales basado en UniFrac (PCoA) reveló una agrupación distinta de la composición de la microbiota en cada grupo de tratamiento (Figura 1A). Para obtener más información sobre las alteraciones de la microbiota intestinal en cerdos de engorde con L-Cit, se realizó un análisis de diversidad α adicional. Como se muestra en las Figuras 1B,C, el grupo L-Cit exhibió una mayor diversidad de microbiota como lo demuestra el aumento de los índices de Chao1 y Observado cuando se compara con el grupo control, así como determinado por el análisis del índice Ace (Figura Suplementaria S2).
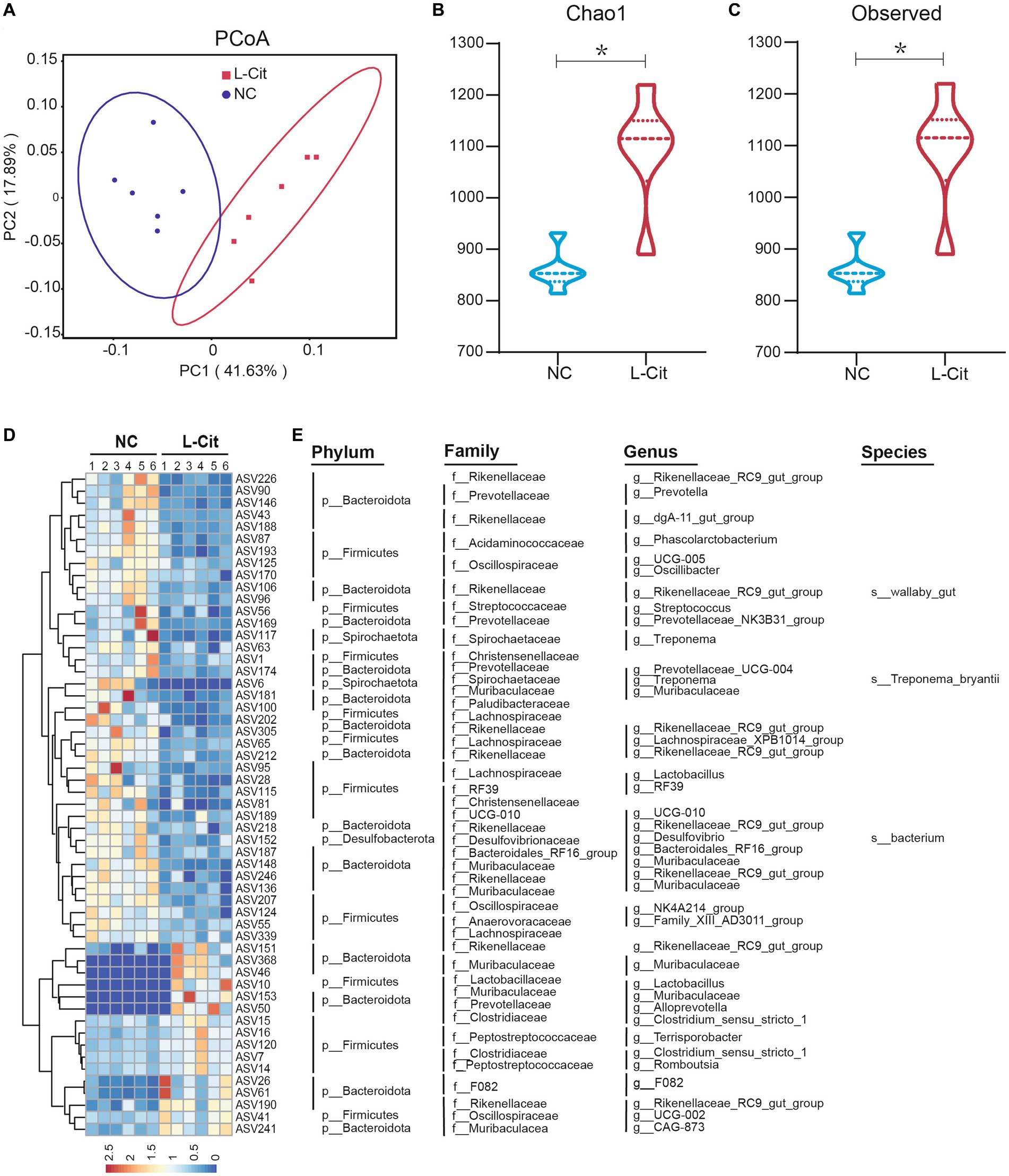 Figura 1. Número de variantes de secuencia de amplicones (ASVs) y riqueza y diversidad de la microbiota fecal en cerdos de engorde. (A) Análisis de coordenadas principales. (B) Índice Chao1. (C) Índice observado. (D) Mapa de calor que muestra la abundancia relativa de ASV bacterianos en los 55 primeros. (E) Se muestra información representada de taxones bacterianos (filo, familia, género y especie) de 55 ASVs de (D). *p < 0,05.
Figura 1. Número de variantes de secuencia de amplicones (ASVs) y riqueza y diversidad de la microbiota fecal en cerdos de engorde. (A) Análisis de coordenadas principales. (B) Índice Chao1. (C) Índice observado. (D) Mapa de calor que muestra la abundancia relativa de ASV bacterianos en los 55 primeros. (E) Se muestra información representada de taxones bacterianos (filo, familia, género y especie) de 55 ASVs de (D). *p < 0,05.
Para comprender mejor el efecto de la L-citrulina en la microbiota intestinal en cerdos de engorde, identificamos los filotipos bacterianos específicos que responden a la L-citrulina después de eliminar los datos con una abundancia extremadamente baja entre las muestras fecales. L-citrulina alteró dramáticamente 199 variantes de secuencia de amplicón (ASV), entre las cuales 124 disminuyeron y 75 aumentaron en cerdos de engorde después de la suplementación con L-citrulina (Tabla Suplementaria S2). Aquí, nos centramos principalmente en la abundancia de 55 ASV alterados principales de la microbiota intestinal en respuesta a la L-citrulina, entre los cuales 39 disminuyeron y 16 aumentaron en cerdos de engorde después de la suplementación con L-citrulina (Figura 1D). En particular, la mayoría de estos ASV se clasificaron principalmente en las familias Rikenellaceae y Lachnospiraceae (Figura 1E), que son dos familias importantes involucradas en el metabolismo de la glucosa, el metabolismo de los lípidos y el músculo esquelético (Wu et al., 2021; Du et al., 2022). Tomados en conjunto, estos resultados sugirieron que la L-citrulina puede alterar significativamente la microbiota intestinal de los cerdos de engorde.
3.4. Alteraciones de los microbios fecales a nivel de filo y género
Luego analizamos la composición de la microbiota fecal tanto a nivel de filo como de género de cerdos de engorde bajo diferentes condiciones de dieta. El análisis de las parcelas volcánicas mostró que 7 filos aumentaron significativamente y 2 disminuyeron significativamente en cerdos de engorde tras la suplementación con L-citrulina (Figura 2A). Del mismo modo, los cerdos L-Cit exhibieron 17 géneros significativamente aumentados y 23 géneros significativamente disminuidos (Figura 2B). Basándonos en los resultados del mapa del volcán, empleamos el análisis del algoritmo LEfSe (umbral de puntuación logarítmica LDA ≥4) para identificar biomarcadores de alta dimensión entre dos grupos de dieta. Se observaron un total de 9 biomarcadores potenciales en los dos grupos, en los que f_F082, g_F082, g_Muribaculaceae, f_Muribaculaceae y p_Firmicutes mostraron en el grupo L-Cit, mientras que f_Prevotellaceae, s_Treponema_bryantii, f_Rikenellaceae y g_Rikenellaceae_RC9_gut_group encontraron en el grupo NC (Figura 2C). Cabe destacar que, a nivel de filo, Firmicutes es el taxón más diferencialmente abundante en el grupo L-Cit (Figura 2D). Por lo tanto, estos filotipos clave pueden contribuir a las diferencias en la composición de la microbiota en los grupos.
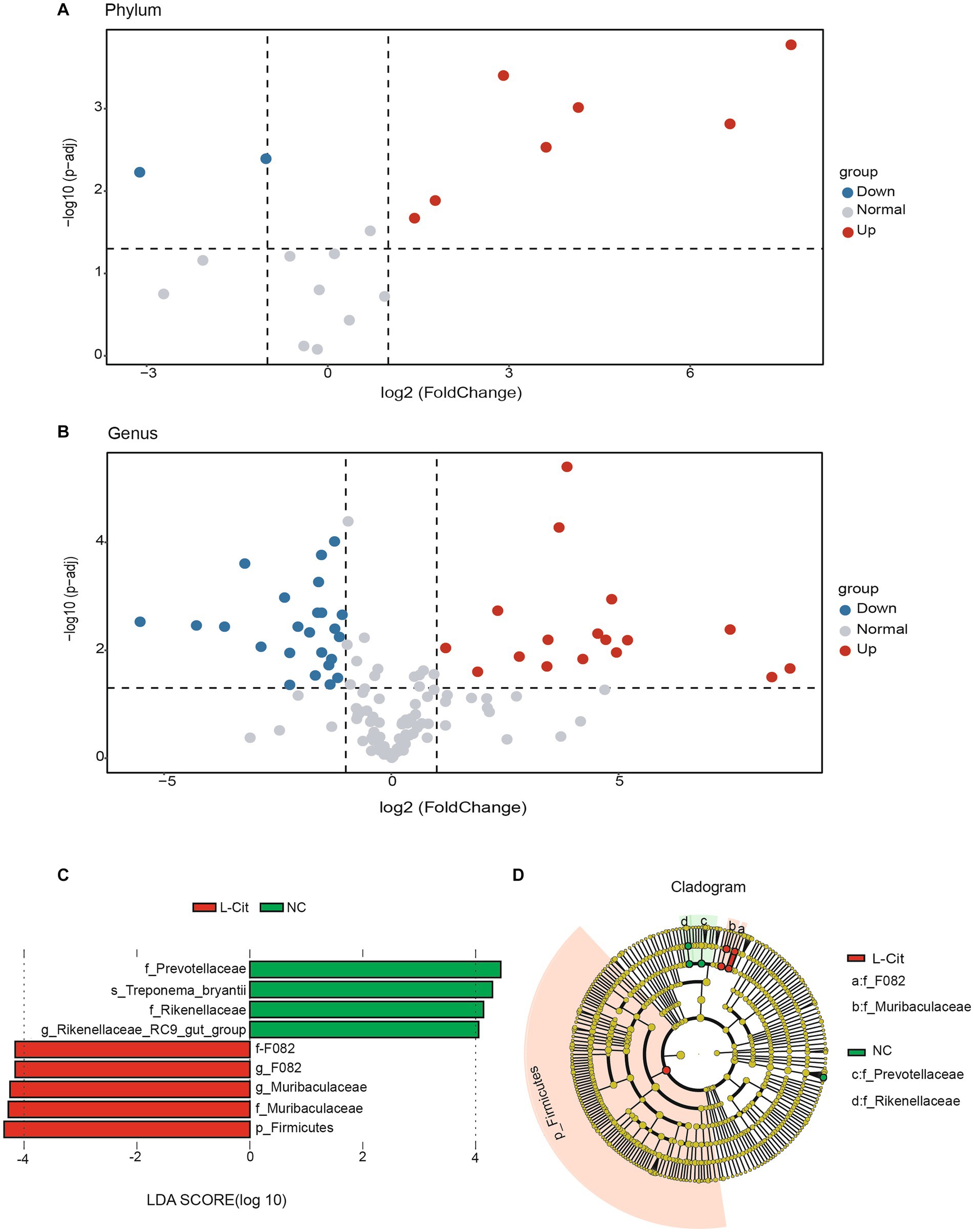 Figura 2. Cribado de biomarcadores microbianos fecales en los grupos. (A,B) Mapa diferencial del volcán [coordenadas del eje x, cambio de pliegue log2 (FC); coordenadas del eje y, valor p ajustado]. Cada punto en el gráfico representa un filo o género y las dos líneas paralelas al eje y representan FC = 1 y FC = −1. La línea punteada paralela al eje x representa 2log10 (0.05), y los puntos arriba, izquierda y derecha la línea punteada representa filos o géneros con significado en P, 0.05. (C) Histograma de los resultados de LEfSe entre el grupo L-Cit y el grupo control y sus respectivos tamaños de efecto. (D) Cladograma que muestra la representación taxonómica de las diferencias entre el grupo L-Cit y el grupo control.
Figura 2. Cribado de biomarcadores microbianos fecales en los grupos. (A,B) Mapa diferencial del volcán [coordenadas del eje x, cambio de pliegue log2 (FC); coordenadas del eje y, valor p ajustado]. Cada punto en el gráfico representa un filo o género y las dos líneas paralelas al eje y representan FC = 1 y FC = −1. La línea punteada paralela al eje x representa 2log10 (0.05), y los puntos arriba, izquierda y derecha la línea punteada representa filos o géneros con significado en P, 0.05. (C) Histograma de los resultados de LEfSe entre el grupo L-Cit y el grupo control y sus respectivos tamaños de efecto. (D) Cladograma que muestra la representación taxonómica de las diferencias entre el grupo L-Cit y el grupo control.
3.5. Análisis de los 10 principales filos y géneros abundantes
Dada la importancia de la microbiota intestinal relativamente abundante en la regulación de la ecología intestinal y la salud del huésped, nos centramos aún más en los 10 principales filos y géneros abundantes. A nivel de filo, Firmicutes y Bacteroidetes fueron el filo más abundante en los dos grupos, representando alrededor del 85-90% (Figura 3A), lo que es consistente con hallazgos previos de microbiota intestinal en cerdos y humanos. En relación con Actinobacteriota, Desulfobacterota, Proteobacteria y Acidobacteriota significativamente alterados se encuentran entre las 10 principales abundancias microbianas de las microbiotas intestinales a nivel de filo (Figura 3C). Sin embargo, los tres filos más abundantes de bacterias, incluidos Firmicutes, Bacteroidota y Spirochaetota, no difirieron en los cerdos alimentados con L-citrulina de los cerdos control (Figura 3C). Dados los estudios previos que muestran una asociación obvia entre el metabolismo animal y la proporción de Firmicutes: Bacteroidetes (F: B), también examinamos la relación F: B entre los dos grupos. Como se muestra en la Figura Suplementaria S3, el análisis de correlación mostró que la relación F:B no tuvo correlación con el rendimiento de crecimiento y las características de la canal, como el peso final, el peso de la canal y la grasa dorsal promedio, aunque la relación F:B aumentó ligeramente de 1,92 en el grupo NC a 2,24 en el grupo L-CIT.
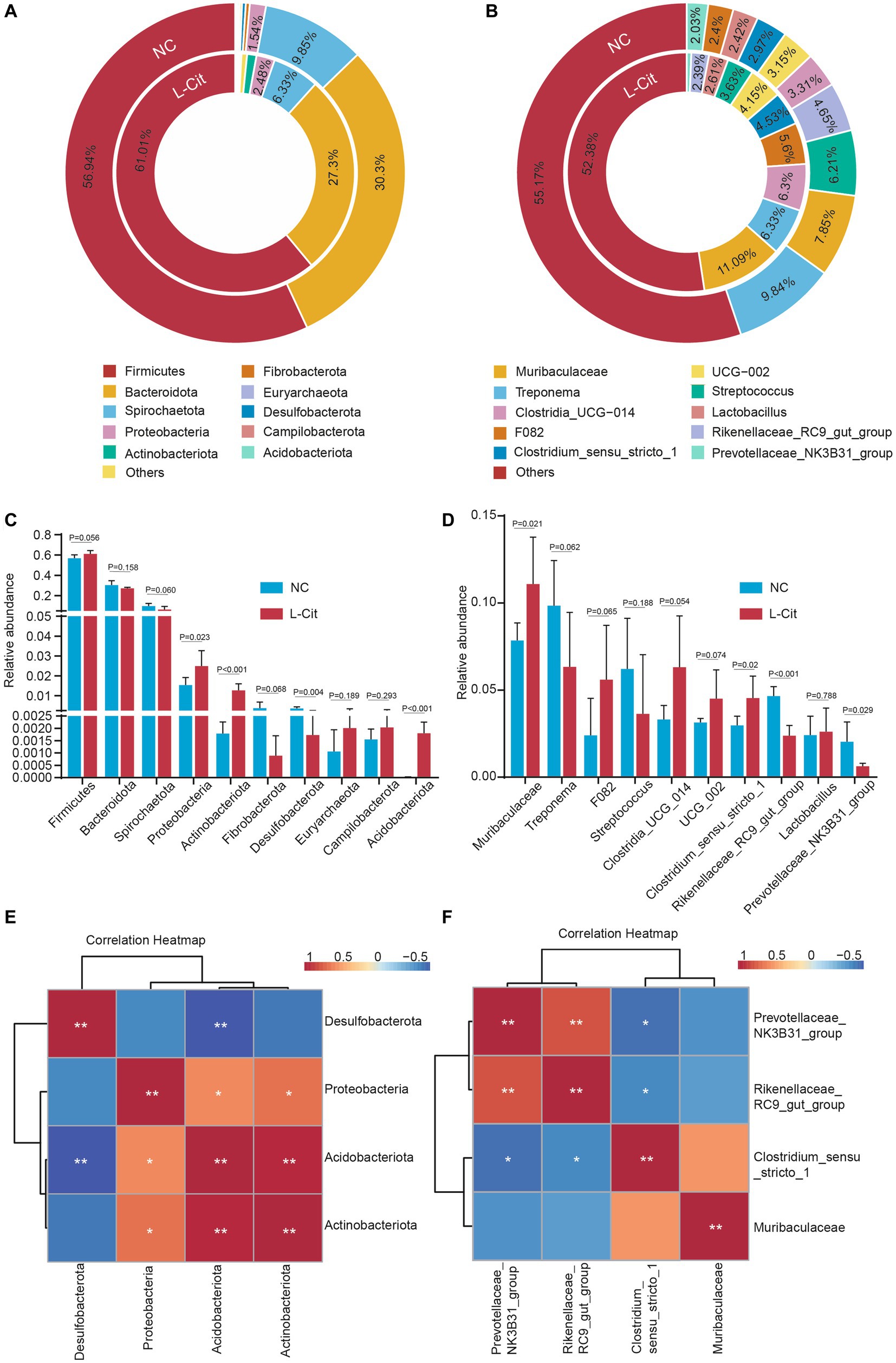 Figura 3. Composición y diferencias de la microbiota fecal a nivel de filo y género. (A) Composición microbiana de las heces a nivel del filo. (B) Composición microbiana de las heces a nivel de género. El círculo interno es la distribución de la microbiota fecal en el grupo L-Cit, y el círculo exterior es la distribución de la microbiota fecal en el grupo control. (C) Abundancia relativa de filos diferenciales comparados entre grupos. (D) Abundancia de géneros diferenciales comparados entre grupos. (E) Análisis de correlación de Spearman de cuatro filos significativos. (F) Análisis de correlación de Spearman de cuatro géneros significativos. *p < 0,05, **p < 0,01.
Figura 3. Composición y diferencias de la microbiota fecal a nivel de filo y género. (A) Composición microbiana de las heces a nivel del filo. (B) Composición microbiana de las heces a nivel de género. El círculo interno es la distribución de la microbiota fecal en el grupo L-Cit, y el círculo exterior es la distribución de la microbiota fecal en el grupo control. (C) Abundancia relativa de filos diferenciales comparados entre grupos. (D) Abundancia de géneros diferenciales comparados entre grupos. (E) Análisis de correlación de Spearman de cuatro filos significativos. (F) Análisis de correlación de Spearman de cuatro géneros significativos. *p < 0,05, **p < 0,01.
En las tres principales abundancias microbianas de la microbiota intestinal a nivel de género, Muribaculaceae y Treponema fueron los dos géneros más abundantes entre los dos grupos de dieta, mientras que Streptococcus y Clostridia_UCG-014 se mostraron especialmente en el grupo NC y el grupo L-Cit, respectivamente (Figura 3B). Para revelar la diferencia a nivel de género en cerdos de engorde con L-citrulina, analizamos las principales abundancias microbianas de la microbiota intestinal. Como se muestra en la Figura 3D, la suplementación con L-citrulina aumentó significativamente la abundancia relativa de Muribaculaceae y Clostridium_sensu_stricto_1, pero redujo notablemente la abundancia relativa de Rikenellaceae_RC9_gut_group y Prevotellaceae_NK3B31_group en cerdos de engorde. Además, para comprender mejor las alteraciones de la microbiota intestinal que responden a la L-citrulina, se realizó un análisis de correlación de Spearman para determinar las correlaciones de filos y géneros significativos. Basado en la abundancia a nivel de filo, Actinobacteriota se asoció positivamente con Acidobacteriota y Proteobacteriota, y Acidobacteriota, respectivamente, mostró una corrección significativamente negativa o positiva con Desulfobacterota, o Proteobacteriota (Figura 3E). A nivel de género, hubo una asociación significativamente negativa entre Prevotellaceae_NK3B31_group, Rikenellaceae_RC9_gut_group y Clostridium_sensu_stricto_1 (Figura 3F). El aumento de Prevotellaceae_NK3B31_group puede contribuir a Rikenellaceae_RC9_gut_group pero no a Clostridium_sensu_stricto_1 (Figura 3F).
3.6. Alteración de la función de la microbiota intestinal en cerdos de engorde con L-citrulina
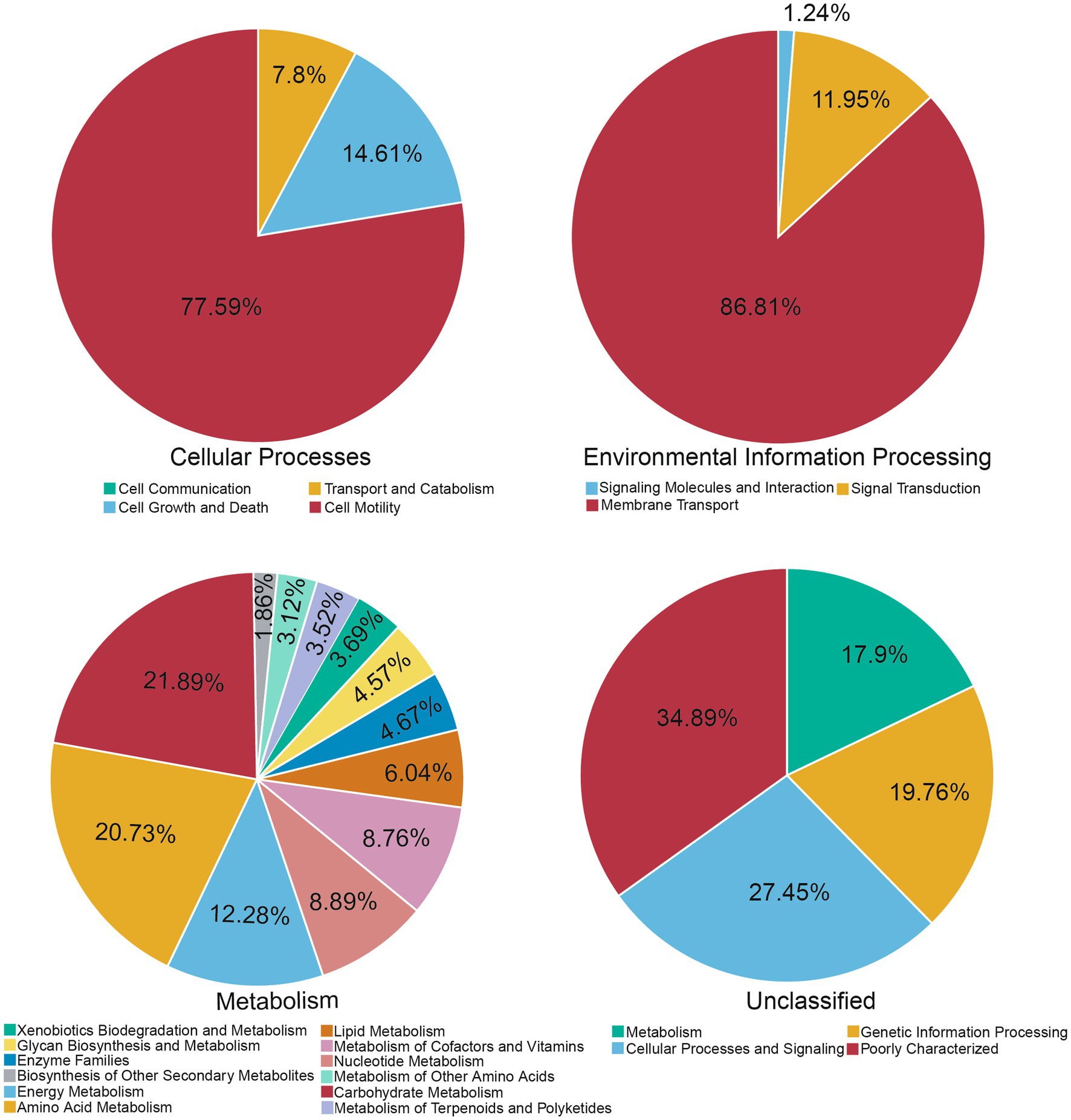
Para obtener más información sobre el efecto de la L-citrulina en la microbiota intestinal, investigamos la función potencial de la microbiota intestinal que responde a la L-citrulina en cerdos de engorde mediante la voladura de Unigenes a las bases de datos KEGG. En primer lugar, analizamos el número de genes no redundantes asignados a las vías KEGG (Figura suplementaria S4). Debido a que el número de genes no redundantes asignados a enfermedades humanas y sistemas de organismos era relativamente menor en comparación con otras vías, nos centramos principalmente en otras vías KEGG. Como se muestra en la Figura 4, la mayoría de los genes se asignaron a la motilidad celular, el transporte de membranas, el metabolismo de carbohidratos, el metabolismo de la energía, el metabolismo de los carbohidratos y el metabolismo de los aminoácidos y se caracterizaron de manera deficiente.
Posteriormente, se utilizó la riqueza de la función predictiva para generar una gráfica de análisis de componentes principales (PCA). Las muestras en el grupo L-Cit y el grupo control se agruparon por separado (Figura 5A). Luego, se llevó a cabo un análisis de prueba T sobre la abundancia de niveles anotados de KEGG (nivel 2) de composición de microbiota fecal de cerdos de engorde en los grupos. En total, 5 vías metabólicas aumentaron significativamente en el grupo L-Cit en comparación con el grupo control, incluyendo el metabolismo amino, el metabolismo de los lípidos, la biodegradación y el metabolismo de los xenobióticos, el metabolismo de los terpenoides y policétidos, y la enfermedad neurodegenerativa, y 9 vías metabólicas disminuyeron significativamente en el grupo L-Cit en comparación con el grupo control, incluidas las del metabolismo de nucleótidos, la biodegradación de glicanos y el metabolismo y la enfermedad metabólica (Figura 5B).
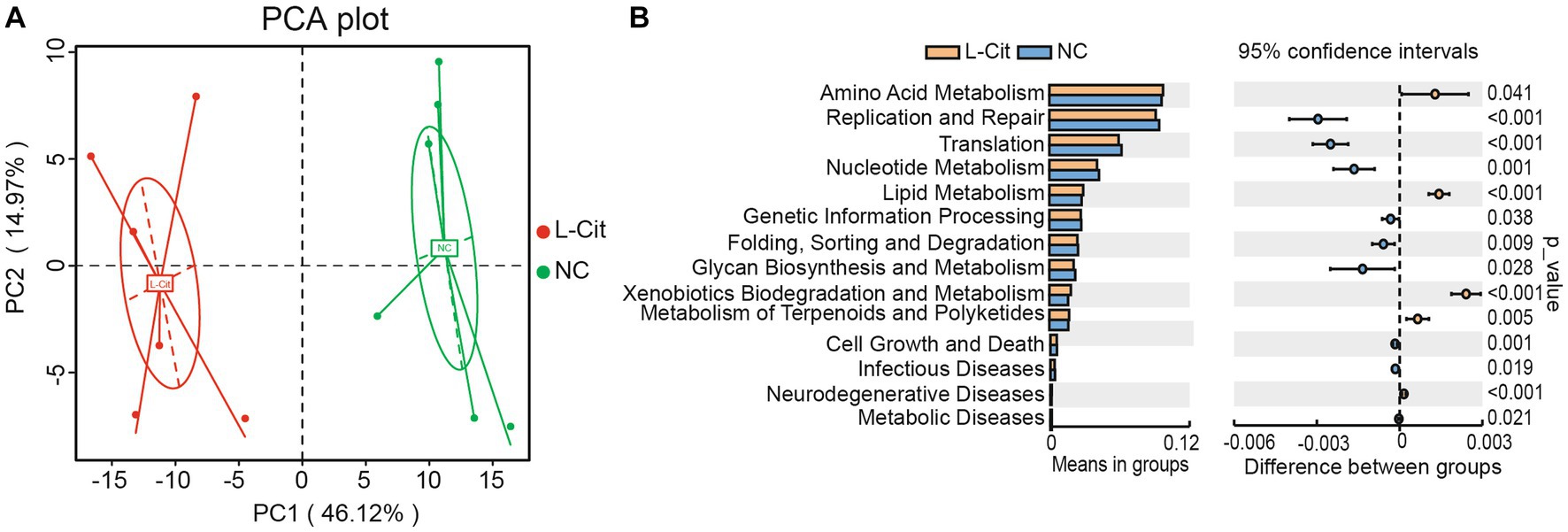 Figura 5. Predicción de vías metabólicas reguladas por microbios fecales. (A) Análisis de componentes principales. (B) Análisis de la prueba T.
Figura 5. Predicción de vías metabólicas reguladas por microbios fecales. (A) Análisis de componentes principales. (B) Análisis de la prueba T.
3.7. Análisis de correlación entre la microbiota fecal y el peso final, el peso en canal, la grasa dorsal media y la pérdida por goteo
Para obtener más información sobre el efecto de la L-citrulina en cerdos de engorde, examinamos las correlaciones de los 40 filos y géneros más significativamente abundantes en la microbiota fecal con el rendimiento de crecimiento, los rasgos de la canal y la calidad de la carne. El análisis de correlación de Pearson indicó las correlaciones significativas entre el microbio fecal y el peso final, el peso de la canal, la grasa dorsal promedio y la pérdida por goteo. Como se muestra en la Figura 6A, la grasa dorsal promedio, el peso en canal y el peso final se asociaron positivamente con los filos más significativos, incluidos Actinobacteriota, Acidobacteriota, Chloroflexi, Myxococcota, Verrucomicrobiota y Gemmatimonadota, y se correlacionaron negativamente con Desulfobacterota. El resultado de la pérdida por goteo fue todo lo contrario. A nivel de género, el peso final, el peso de la canal y la grasa dorsal promedio se correlacionaron positivamente con Alistipes, Bacillus y Romboutsia, mientras que se correlacionaron negativamente con Family_XIII_AD3011_group (Figura 6B). Además, la grasa dorsal promedio también se correlacionó positivamente con Terrisporobacter y Muribaculaceae (Figura 6B). La pérdida por goteo se correlacionó significativamente positivamente con Rikenellaceae_RC9_gut_group, Prevotellaceae_NK3B31_group, Prevotella, Prevotellaceae_UCG-003, Bacteroides, Bacteroidales_RF16_group y Prevotellaceae_UCG-004, mientras que fueron significativamente negativas relacionadas con Turicibacter y Bacillus (Figura 6B). Estos resultados indicaron la interacción de los microbios con el peso final, el peso de la canal, la grasa dorsal promedio y la pérdida por goteo.
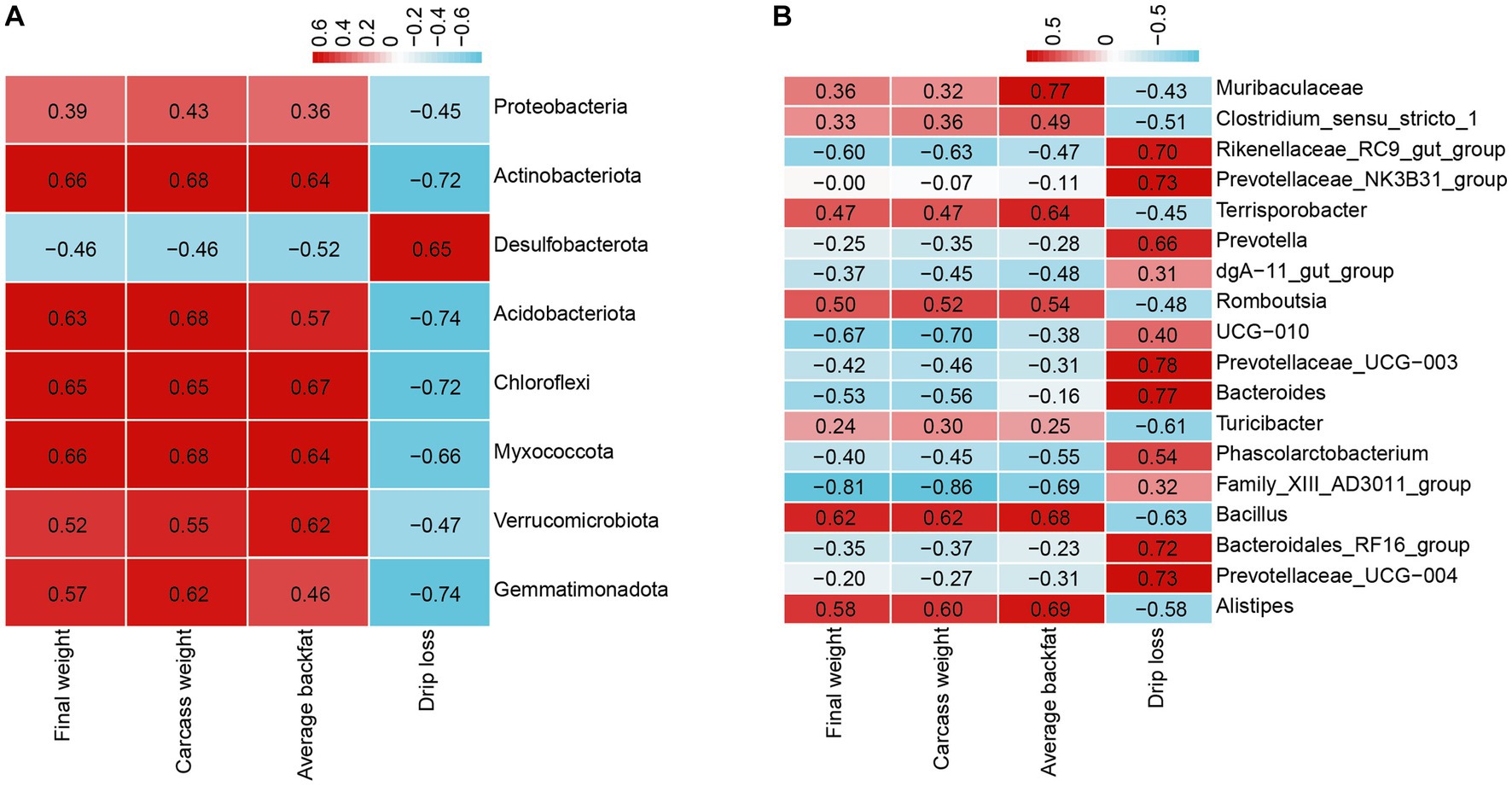 Figura 6. Análisis de correlación de Pearson entre la microbiota fecal y el peso final, el peso en canal, la grasa dorsal promedio y la pérdida por goteo. (A) Análisis de correlación entre la abundancia relativa significativa de los 40 filos principales y el peso final, el peso de la canal, la grasa dorsal promedio y la pérdida por goteo. (B) Análisis de correlación entre la abundancia relativa significativa de los 40 géneros principales y el peso final, el peso en canal, la grasa dorsal promedio y la pérdida por goteo.
Figura 6. Análisis de correlación de Pearson entre la microbiota fecal y el peso final, el peso en canal, la grasa dorsal promedio y la pérdida por goteo. (A) Análisis de correlación entre la abundancia relativa significativa de los 40 filos principales y el peso final, el peso de la canal, la grasa dorsal promedio y la pérdida por goteo. (B) Análisis de correlación entre la abundancia relativa significativa de los 40 géneros principales y el peso final, el peso en canal, la grasa dorsal promedio y la pérdida por goteo.
4. Discusión
L-citrulina sirve como un precursor altamente eficaz para la síntesis de arginina, un aminoácido esencial crucial para el crecimiento y desarrollo normal en las aves de corral. Tanto en condiciones normales como durante el estrés por calor, la arginina desempeña un papel fundamental en la promoción del peso corporal, el peso en canal y el desarrollo muscular de las aves de corral (Kalvandi et al., 2022). Además, se ha encontrado que la suplementación de L-citrulina tiene efectos protectores sobre el rendimiento de crecimiento de pollos de engorde en condiciones de estrés por calor. Ayuda a reducir el catabolismo proteico, preservando así la masa muscular y promoviendo mejores resultados de crecimiento (Uyanga et al., 2022). En este estudio, la suplementación dietética con L-citrulina aumentó significativamente el peso final y el peso de la canal de los cerdos de engorde. El peso final, el aumento de peso total y el peso en canal de los cerdos de engorde en el grupo L-Cit fueron 7.90, 16.50 y 7.91% más altos que los del grupo control, respectivamente. Los resultados indicaron que la suplementación dietética con L-citrulina promovió el aumento de peso y la rentabilidad en cerdos de engorde. Sin embargo, el mecanismo preciso por el cual la L-citrulina regula el aumento de peso en este contexto sigue siendo incierto. Se ha sugerido que este efecto puede atribuirse a la conversión de L-citrulina en L-arginina, que desempeña un papel en la protección intestinal (Kobata et al., 2007). Vale la pena señalar que la salud del tracto gastrointestinal afecta significativamente la digestión de nutrientes, la absorción y, posteriormente, el crecimiento y desarrollo de los animales. Además, se sabe que el óxido nítrico desempeña un papel crucial en el mantenimiento del metabolismo de los nutrientes, particularmente en el metabolismo del azúcar, las grasas, las proteínas y los aminoácidos (Jobgen et al., 2006). Por lo tanto, es plausible que la citrulina puede mejorar el metabolismo del óxido nítrico y el transporte de nutrientes dentro del cuerpo, promoviendo así el aumento de peso en los cerdos de engorde. Se necesita investigación adicional para dilucidar completamente los mecanismos involucrados en los efectos observados.
Es bien sabido que el pH, el color de la carne y la capacidad de retención de agua son indicadores clave que reflejan el sabor y el atractivo visual de la carne, que también son factores cruciales que influyen en la calidad de la carne y las preferencias de los consumidores (Popp et al., 2015; Ramanathan et al., 2020). En este estudio, aunque no hubo diferencias estadísticamente significativas en el valor de pH entre los dos grupos dietéticos, todos los valores observados cayeron dentro del rango normal descrito por el estándar objetivo nacional actual para la calidad del consumo de carne de cerdo (NY/T2793-2015), lo que sugiere que una inclusión a corto plazo de citrulina en la dieta puede no tener un efecto significativo sobre el valor de pH de los cerdos de engorde. En particular, el grupo L-Cit exhibió una reducción significativa en la pérdida de goteo de carne en comparación con el grupo de control, lo que implica que la adición de citrulina en la dieta puede ayudar a mitigar la pérdida de agua y mejorar la calidad de la carne.
La microbiota intestinal sirve como un vínculo vital entre la dieta y la salud del huésped, desempeñando un papel crucial en la configuración de la estructura de la comunidad microbiana dentro del intestino. La composición de la microbiota intestinal está significativamente influenciada por factores dietéticos. A través de sus intrincadas interacciones con el huésped, la microbiota intestinal ejerce una profunda influencia en varios aspectos de la fisiología del huésped, incluido el mantenimiento de la homeostasis, el desarrollo de órganos, los procesos metabólicos y la respuesta inmune (Fouhse et al., 2016; Shang et al., 2022). Según el resultado de PCoA, los dos grupos estaban claramente separados, lo que sugiere influencias significativas en la composición bacteriana entre el grupo L-Cit. Se informó que la diversidad microbiana sirve como un indicador confiable de la salud intestinal, con una mayor diversidad de α que indica una composición más intrincada y resistente de la microbiota intestinal (Sommer et al., 2017). El aumento de la diversidad microbiana significa una mayor resistencia a las interrupciones externas, una mayor adaptabilidad y una mejor capacidad de autorestauración, todo lo cual es beneficioso para el huésped. En consecuencia, una comunidad microbiana intestinal diversa se considera ventajosa para mantener una función intestinal óptima y un bienestar general (Sommer et al., 2017; Lang et al., 2018). Las mediciones de diversidad α en cerdos de engorde que recibieron suplementos dietéticos de L-citrulina sugirieron que la presencia de una mayor variedad de especies dentro de su microbiota intestinal podría mejorar su resistencia a los factores ambientales. Esto puede atribuirse al efecto compensatorio exhibido por microorganismos funcionalmente relacionados dentro de un ecosistema bien equilibrado, donde la ausencia de ciertas especies puede ser compensada por las funciones realizadas por otras especies microbianas.
Los filos Firmicutes y Bacteroidetes, que se encuentran comúnmente en el microbioma intestinal de los mamíferos, incluidos los cerdos, se han asociado fuertemente con el metabolismo energético y la eficiencia alimentaria (Bergamaschi et al., 2020). Se ha encontrado que el filo Bacteroidetes exhibe una mayor abundancia en cerdos caracterizados por una alta eficiencia alimenticia o composición corporal magra, en contraste con los cerdos con menor eficiencia alimenticia u obesidad (Jami et al., 2014). En este estudio, no se observó diferencia significativa en la abundancia de estos 2 taxones entre los grupos L-Cit y NC, Firmicutes y Bacteroidetes predominaron en el microbioma fecal de todas las muestras, y la abundancia relativa de Bacteroidetes en el microbioma fecal del grupo control fue ligeramente mayor que en el grupo L-Cit. A nivel de filo, Firmicutes era una bacteria central y diferencial del grupo L-Cit y, por lo tanto, puede tener funciones importantes. Se ha identificado que el grupo Prevotellaceae NK3B31, un subgrupo dentro del género Prevotella, posee propiedades promotoras del crecimiento en cerdos (Yang et al., 2017). Sin embargo, nuestro estudio indicó que la abundancia relativa del grupo control fue mayor en comparación con el grupo L-CIT. Se ha establecido que Muribaculaceae posee la capacidad de inhibir el desarrollo de enfermedades inflamatorias y metabólicas (Tavella et al., 2021). A nivel de género, la abundancia de Muribaculaceae en el grupo L-Cit aumentó significativamente en comparación con el grupo control, lo que indicó que el consumo a largo plazo de L-citrulina puede contribuir a la forma de la caracterización resistente a enfermedades de las bacterias intestinales en cerdos de engorde. Además, se sabe que el Rikenellaceae_RC9_gut_group posee la capacidad de degradar carbohidratos complejos como oligosacáridos no digeribles, celulosa, hemicelulosa y almidón resistente. Como resultado de este metabolismo de carbohidratos, producen ácidos grasos beneficiosos de cadena corta como acetato, butirato y ácido láctico. Se puede inferir que la presencia de Rikenellaceae_RC9_gut_group en la microbiota intestinal de cerdos de engorde alimentados con L-citrulina puede mejorar la digestión y absorción de nutrientes en el huésped. Al descomponer eficientemente los carbohidratos complejos y producir metabolitos beneficiosos, estas bacterias pueden contribuir a mejorar la utilización de nutrientes del huésped y la eficiencia metabólica general.
Finalmente, el análisis funcional microbiano (PICRUSt) mostró que se encontró una mayor abundancia de funciones predichas relacionadas con el metabolismo de aminoácidos, el metabolismo de los lípidos, la biodegradación de los xenobióticos y el metabolismo y metabolismo de los terpenoides y policétidos en el grupo L-Cit, lo que puede indicar que los cerdos de acabado de la suplementación dietética con L-citrulina intestinal contienen más bacterias con mayor capacidad metabólica, y estas bacterias pueden producir más energía para los huéspedes. Es notable que el grupo L-Cit solo enriquecido en enfermedades neurodegenerativas, mientras que el grupo de control enriquecido en enfermedades infecciosas y enfermedades metabólicas, que además indicó cerdos de engorde de suplementos dietéticos de L-citrulina puede contribuir a la forma de caracterización resistente a enfermedades de las bacterias intestinales en cerdos de engorde. El análisis de correlación de Pearson en nuestro estudio mostró que Rikenellaceae_RC9_gut_group se correlacionó negativamente con el peso de la canal y el peso final, lo que sugiere que el bajo peso de la canal y el peso final en el grupo control pueden atribuirse a la mayor abundancia de Rikenellaceae_RC9_gut_group.
5. Conclusión
En conclusión, la suplementación dietética con L-citrulina tuvo un efecto significativo en el rendimiento del crecimiento y la pérdida por goteo, así como en la modulación de la microbiota fecal de los cerdos de engorde. Por lo tanto, estos resultados indicaron que la L-citrulina podría ser un ingrediente potencial de aminoácidos para los cerdos de engorde, y si la proporción de adición recomendada en el acabado es del 1% aún no ha sido confirmada por investigaciones adicionales.
Declaración de disponibilidad de datos
Los datos presentados en el estudio están depositados en el repositorio del NCBI, número de acceso CRA011705.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Ética de la Universidad Agrícola de Sichuan.
Contribuciones del autor
JD y MG: conceptualización y redacción: preparación del borrador original. JD, LN y ZH: metodología. ZX, CL y HD: software. CZ, MW y ML: validación. JD: análisis formal. YW: investigación. LC y SZ: recursos. JD y ZX: curación de datos. LZ y LS: escritura: revisión, edición y adquisición de fondos. YZ y YJ: visualización. ZG, LZ y LS: supervisión. LZ: administración de proyectos. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por el Programa Nacional de Investigación y Desarrollo Clave de China (2021YFD1200801); Programa de Ciencia y Tecnología de Sichuan (2021ZDZX0008, 2021YFYZ0030, scsztd-2023-08-09); el Fondo Destinado a CARS (CARS-pig-35); Centro Nacional de Innovación Tecnológica para Porcinos.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fmicb.2023.1209389/full#supplementary-material
Notas
1. ^http://ccb.jhu.edu/software/FLASH/
Referencias
Bergamaschi, M., Tiezzi, F., Howard, J., Huang, Y. J., Gray, K. A., Schillebeeckx, C., et al. (2020). Las diferencias en la composición del microbioma intestinal entre las razas afectan la eficiencia alimenticia en los cerdos. Microbioma 8:110. DOI: 10.1186/S40168-020-00888-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Brestoff, J. R. y Artis, D. (2013). Bacterias comensales en la interfaz del metabolismo del huésped y el sistema inmunológico. Nat. Immunol. 14, 676–684. DOI: 10.1038/NI.2640
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cai, B., Zhou, M. H., Huang, H. L., Zhou, A. C., Chu, Z. D., Huang, X. D., et al. (2020). Efectos protectores de la suplementación con citrulina en ratas con colitis ulcerosa. PLoS One 15:e240883:e0240883. doi: 10.1371/journal.pone.0240883
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Danboyi, T., Alhassan, A. W., Jimoh, A. y Hassan-Danboyi, E. (2021). Efecto de la suplementación con l-citrulina sobre el nivel de glucosa en sangre y el perfil lipídico en la dieta alta en grasas y la diabetes tipo 2 inducida por dexametasona en ratas wistar macho. Níger. Biosci. 8, 100–107. doi: 10.4103/njecp.njecp_23_20
David, L. A., Maurice, C. F., Carmody, R. N., Gootenberg, D. B., Button, J. E., Wolfe, B. E., et al. (2014). La dieta altera rápida y reproduciblemente el microbioma intestinal humano. Nature 505, 559–563. doi: 10.1038/nature12820
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Du, L., Wang, Q., Ji, S., Sun, Y., Huang, W., Zhang, Y., et al. (2022). La remodelación metabolómica y microbiana por la cápsula Shanmei mejora la hiperlipidemia en ratones inducidos por alimentos ricos en grasa. Frente. Celda. Infecta. Microbiol. 12:729940. doi: 10.3389/fcimb.2022.729940
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Eshreif, A., al Batran, R., Jamieson, K. L., Darwesh, A. M., Gopal, K., Greenwell, A. A., et al. (2020). La suplementación con L-citrulina mejora la tolerancia a la glucosa y al ejercicio en ratones machos obesos. Exp. Physiol. 105, 270–281. doi: 10.1113/EP088109
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Fouhse, J. M., Zijlstra, R. T. y Willing, B. P. (2016). El papel de la microbiota intestinal en la salud y la enfermedad de los cerdos. Anim. Frente. 6, 30–36. DOI: 10.2527/AF.2016-0031
Haas, B. J., Gevers, D., Earl, A. M., Feldgarden, M., Ward, D. V., Giannoukos, G., et al. (2011). Formación y detección de secuencias quiméricas de ARNr 16S en amplicones de PCR de Sanger y 454 pirosecuenciados. Genoma Res. 21, 494–504. doi: 10.1101/gr.112730.110
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Jami, E., White, B. A. y Mizrahi, I. (2014). Papel potencial del microbioma ruminal bovino en la modulación de la composición de la leche y la eficiencia alimenticia. PLoS One 9:e85423. doi: 10.1371/journal.pone.0085423
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Jobgen, W. S., Fried, S. K., Fu, W. J., Meininger, C. J. y Wu, G. (2006). Papel regulador de la vía arginina-óxido nítrico en el metabolismo de sustratos energéticos. J. Nutr. Bioquímica. 17, 571–588. doi: 10.1016/j.jnutbio.2005.12.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kalvandi, O., Sadeghi, A. y Karimi, A. (2022). La suplementación con arginina mejora el rendimiento reproductivo, el estado antioxidante, la inmunidad y la transmisión materna de anticuerpos en codornices japonesas reproductoras en condiciones de estrés por calor. Ital. J. Anim. Sci. 21, 8–17. doi: 10.1080/1828051X.2021.2013136
Kobata, A., Kotani, T., Komatsu, Y., Amagase, K., Kato, S. y Takeuchi, K. (2007). Acción dual del óxido nítrico en la patogénesis de la lesión mucosa inducida por isquemia/reperfusión en el estómago del ratón. Digestión 75, 188–197. DOI: 10.1159/000108590
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Lang, J. M., Pan, C., Cantor, R. M., Tang, W., Garcia-Garcia, J. C., Kurtz, I., et al. (2018). Impacto de los rasgos individuales, las grasas saturadas y la fuente de proteínas en el microbioma intestinal. MBio 9. doi: 10.1128/mBio.01604-18
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Meesters, D. M., Hannemann, P. F. W., van Eijk, H., Schriebl, V. T. J., Brink, P. R. G., Poeze, M., et al. (2020). Mejora de la curación de fracturas después de la suplementación con citrulina en ratones. Eur. Células Mater. J. 39, 183–192. doi: 10.22203/eCM.v039a12
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Magoc, T., y Salzberg, S. L. (2011). Flash: ajuste rápido de la longitud de lecturas cortas para mejorar los ensamblajes del genoma. Bioinformática 27, 2957–2963. DOI: 10.1093/bioinformatics/btr507
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Papadia, C., Osowska, S., Cynober, L. y Forbes, A. (2018). La citrulina en la salud y la enfermedad. Revisión sobre estudios en humanos. Clin. Nutr. 37, 1823–1828. doi: 10.1016/j.clnu.2017.10.009
Popp, J., Wicke, M., Klein, G. y Krischek, C. (2015). La relación del pH del músculo longissimus de cerdo con las actividades respiratorias mitocondriales, la calidad de la carne y la estructura muscular. Animal 9, 356–361. doi: 10.1017/S1751731114002365
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ramanathan, R., Suman, S. P. y Faustman, C. (2020). Interacciones biomoleculares que rigen el color de la carne fresca en el músculo esquelético post-mortem: una revisión. J. Agric. Food Chem. 68, 12779–12787. doi: 10.1021/acs.jafc.9b08098
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rothschild, D., Weissbrod, O., Barkan, E., Kurilshikov, A., Korem, T., Zeevi, D., et al. (2018). El medio ambiente domina sobre la genética del huésped en la configuración de la microbiota intestinal humana. Nature 555, 210–215. doi: 10.1038/nature25973
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sambrook, J. E., Maniatis, T. E. y Fritsch, E. F. (1989). Clonación molecular: manual de laboratorio. Cold Spring Harbor, NY: Cold Spring Harbor Laboratories.
Schwedhelm, E., Maas, R., Freese, R., Jung, D., Lukacs, Z., Jambrecina, A., et al. (2008). Propiedades farmacocinéticas y farmacodinámicas de l-citrulina y l-arginina orales: impacto en el metabolismo del óxido nítrico. Fr. J. Clin. Pharmacol. 65, 51–59. doi: 10.1111/j.1365-2125.2007.02990.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Setyabrata, D., y Kim, Y. (2019). Impactos de la secuencia de envejecimiento / congelación en la microestructura, la degradación de proteínas y las propiedades físico-químicas de los músculos de la carne. Carne Sci. 151, 64–74. doi: 10.1016/j.meatsci.2019.01.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Shang, P., Wei, M., Duan, M., Yan, F. y Chamba, Y. (2022). La composición saludable del microbioma intestinal mejora la resistencia a las enfermedades y la deposición de grasa en los cerdos tibetanos. Frente. Microbiol. 13:965292. doi: 10.3389/fmicb.2022.965292
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sommer, F., Rühlemann, M. C., Bang, C., Höppner, M., Rehman, A., Kaleta, C., et al. (2017). Microbiomarcadores en enfermedades inflamatorias intestinales: las advertencias vienen con el caviar. Gut 66, 1734–1738. DOI: 10.1136/GuTJNL-2016-313678
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Tavella, T., Rampelli, S., Guidarelli, G., Bazzocchi, A., Gasperini, C., Pujos-Guillot, E., et al. (2021). La elevada abundancia de microbiomas intestinales de christensenellaceae, porphyromonadaceae y rikenellaceae se asocia con una reducción del tejido adiposo visceral y un perfil metabólico más saludable en ancianos italianos. Microbios intestinales 13, 1–19. doi: 10.1080/19490976.2021.1880221
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Tsuboi, T., Maeda, M. y Hayashi, T. (2018). La administración de l-arginina más l-citrulina o l-citrulina sola retrasó con éxito la senescencia endotelial. PLoS One 13:e192252. doi: 10.1371/journal.pone.0192252
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Uyanga, V. A., Zhao, J., Wang, X., Jiao, H., Onagbesan, O. M. y Lin, H. (2022). La l-citrulina dietética modula el rendimiento de crecimiento, el perfil de aminoácidos y el eje de la hormona del crecimiento / factor de crecimiento similar a la insulina en pollos de engorde expuestos a altas temperaturas. Frente. Physiol. 13:937443. DOI: 10.3389/FPHYS.2022.937443
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wang, X., Cheng, T. T., Maxwell, C. V. y Zhao, J. (2019). 83 Dinámica de por vida del microbioma intestinal porcino: desde el nacimiento hasta el mercado. J. Anim. 97:48. doi: 10.1093/jas/skz122.087
Wu, C., Lyu, W., Hong, Q., Zhang, X., Yang, H. y Xiao, Y. (2021). La microbiota intestinal influye en el metabolismo lipídico del músculo esquelético en cerdos. Frente. Nutr. 8:675445. doi: 10.3389/fnut.2021.675445
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Yang, H., Huang, X., Fang, S., He, M., Zhao, Y., Wu, Z., et al. (2017). Desentrañar la microbiota fecal y la capacidad funcional metagenómica asociada a la eficiencia alimenticia en cerdos. Frente. Microbiol. 8:1555. doi: 10.3389/fmicb.2017.01555
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: L-citrulina, rendimiento de crecimiento, características de la canal, microbios fecales, cerdos de engorde
Cita: Du J, Gan M, Xie Z, Zhou C, Jing Y, Li M, Liu C, Wang M, Dai H, Huang Z, Chen L, Zhao Y, Niu L, Wang Y, Zhang S, Guo Z, Shen L y Zhu L (2023) Efectos de la suplementación dietética con L-citrulina en el rendimiento de crecimiento, calidad de la carne y composición microbiana fecal en cerdos de engorde. Frente. Microbiol. 14:1209389. doi: 10.3389/fmicb.2023.1209389
Recibido: 01 Junio 2023; Aprobado: 17 de julio de 2023;
Publicado: 03 agosto 2023.
Editado por:
Xiangfeng Kong, Academia China de Ciencias (CAS), China
Revisado por:
Yu Pi, Academia China de Ciencias Agrícolas, China
Tarique Hussain, Instituto Nuclear de Agricultura y Biología, Pakistán
Derechos de autor © 2023 Du, Gan, Xie, Zhou, Jing, Li, Liu, Wang, Dai, Huang, Chen, Zhao, Niu, Wang, Zhang, Guo, Shen y Zhu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Linyuan Shen, shenlinyuan@sicau.edu.cn; Li Zhu, zhuli@sicau.edu.cn
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía