Efectos del nano-selenio en pollos
 Efectos del nano-selenio en la comunidad microbiana del ciego y la metabolómica en pollos desafiados con ocratoxina A
Efectos del nano-selenio en la comunidad microbiana del ciego y la metabolómica en pollos desafiados con ocratoxina A
 Colmillo de Manxin1,2*
Colmillo de Manxin1,2*  Wei Hu1,2
Wei Hu1,2  Ben Liu1,2
Ben Liu1,2- 1Facultad de Ciencias de la Vida y Recursos y Medio Ambiente, Universidad de Yichun, Yichun, China
- 2Centro de Investigación de Tecnología de Ingeniería de Jiangxi Universidades y Colegios para la Agricultura de Selenio, Universidad de Yichun, Yichun, China
Introducción: La ocratoxina A (OTA) es una micotoxina ampliamente distribuida. El nano-selenio (Nano-Se) es una forma emergente de selenio conocida por su biodisponibilidad superior, notable eficiencia catalítica y robusta capacidad de adsorción. A pesar de estas características, su impacto en la comunidad microbiana y metabolómica en el ciego de pollos expuestos a OTA ha sido investigado con poca frecuencia. Esta investigación examinó la microbiota y las alteraciones metabolómicas relacionadas con la OTA en pollos, con o sin Nano-Se presente.
Métodos: Una cohorte de 80 pollos sanos a la edad de 1 día se distribuyó aleatoriamente en cuatro grupos de igual número, a saber, la cohorte Se (1 mg / kg Nano-Se), la cohorte OTA (50 μg / kg OTA), la cohorte OTA-Se (50 μg / kg OTA + 1 mg / kg Nano-Se) y el grupo control. El microbioma cecal y el metaboloma de cada grupo de pollos se caracterizaron mediante secuenciación de ARNr 16S y cromatografía líquida junto con análisis de espectrometría de masas (LC-MS).
Resultados y discusión: Nuestros resultados mostraron que el día 21, el peso corporal final se redujo significativamente en respuesta a los tratamientos de OTA (p < 0,05), se encontró que la ganancia diaria promedio en el grupo OTA era inferior a los otros grupos (p < 0,01). Además, la suplementación con Nano-Se podría reducir las lesiones patológicas del yeyuno y el hígado causadas por la exposición a OTA. La secuenciación del ARNr 16S sugiere que la suplementación con Nano-Se en pollos expuestos a OTA mitigó los desequilibrios de la microbiota intestinal al promover la microbiota beneficiosa y suprimir las bacterias perjudiciales. Además, la metabolómica no dirigida reveló una diferencia significativa en los metabolitos cecales mediante el pretratamiento con Nano-Se. En conjunto, los resultados del conjunto de datos destacaron que el aumento de Nano-Se regula la microbiota intestinal y los perfiles de metabolitos asociados, lo que influye en las vías metabólicas críticas, y apunta a un posible producto aditivo alimentario.
1. Antecedentes
La ocratoxina A (OTA) es producida por varias especies de hongos Penicillium y Aspergillus (1). La OTA se encuentra con frecuencia en diversas fuentes de alimentos como café, cerveza, vino, frutas, verduras, huevos, carne, alimentos para animales y granos (2, 3). OTA tiene una amplia distribución y alta toxicidad, lo que lleva a pérdidas financieras sustanciales dentro de las industrias ganadera y avícola. Esta situación plantea desafíos para cumplir con los requisitos globalizados de carne y productos lácteos y compromete la seguridad alimentaria. El selenio (Se), un mineral esencial para la salud animal, ha despertado un interés considerable en los últimos años (4-6). Las formas orgánicas de Se (como la selenometionina, la selenocisteína y la levadura enriquecida con Se), las formas inorgánicas (como el selenito de sodio) y las formas nano se utilizan actualmente como aditivos para piensos avícolas (7). En estudios anteriores, nano-Se ha demostrado una biodisponibilidad superior a sus contrapartes inorgánicas (8, 9). La microbiota intestinal, un componente esencial de la barrera intestinal, desempeña una función crítica en la preservación de la homeostasis intestinal y la protección de la salud del tracto intestinal (10). El nivel de diversidad exhibido por la microbiota intestinal indica la intrincada variedad de especies presentes dentro de ella. Varias variables externas, incluida la ingesta dietética, los medicamentos y las toxinas derivadas de fuentes ambientales, pueden afectar la composición de la microbiota intestinal. La investigación ha demostrado que las micotoxinas, incluidas, entre otras, la fumonisina B1, la zearalenona, la aflatoxina B1 y la ocratoxina A, pueden alterar potencialmente el equilibrio de la microbiota intestinal al reducir la población de bacterias beneficiosas y promover el crecimiento de bacterias patógenas (11-13). La metabolómica, que analiza e identifica metabolitos en células y tejidos, es esencial para el diagnóstico de enfermedades, el desarrollo de fármacos y el análisis toxicológico (14-16). Sin embargo, existe una investigación limitada sobre los mecanismos de acción de micotoxinas como la OTA basada en la metabolómica. Este estudio investigó el impacto de la suplementación con Nano-Se en la dieta sobre la microbiota intestinal en pollos con desafíos OTA utilizando el análisis de ARNr 16S. LC-MS proporciona una cobertura completa de sustancias y se considera la técnica más estable y apropiada para estudiar el metabolismo. El contenido cecal se examinó utilizando una estrategia de investigación metabolómica LC-MS. El estudio examinó metabolitos endógenos entre grupos basados en bioinformática y analizó las vías metabólicas para identificar posibles biomarcadores. Este enfoque nos ayudó a comprender el mecanismo de acción de Nano-Se en pollos expuestos a OTA.
2. Metodología
2.1. Materiales
Los puntos de referencia OTA utilizados se obtuvieron de Pribolab (Immunos, Singapur) y tenían un nivel de pureza superior al 98%. El espécimen de Nano-Se utilizado en este estudio tenía un diámetro que oscilaba entre 30 y 60 nm y una pureza de Se del 99,5%. La fuente de Nano-Se fue la cohorte de Bosar Biology (Guangzhou, China). Los cristales OTA de alta pureza se solubilizaron en etanol absoluto a 1 mg por 10 mL. Se creó una suspensión mezclando la solución resultante con 90 ml de aceite de girasol estéril. En el experimento se utilizaron reactivos de grado analítico.
2.2. Animales
Se adquirió una cohorte de 80 pollos de engorde neonatales de un criadero comercial y se les permitió 3 días para la aclimatación después del transporte a un entorno nuevo. A los pollos se les proporcionó acceso sin restricciones tanto a alimentos como a agua. La formulación y el contenido nutricional de la dieta basal se diseñaron de acuerdo con el NRC Nutrient Requirement (2012), como se detalla en la Tabla 1. La dieta para cada cohorte se preparó simultáneamente y se conservó en recipientes herméticos antes de la alimentación, y el experimento duró 21 días.
2.3. Diseño experimental y tratamiento
Los pollitos se dividieron aleatoriamente en cuatro grupos iguales, incluyendo el grupo Se (1 mg/kg de Nano-Se en la dieta), el grupo OTA (50 μg/kg OTA por peso corporal), el grupo OTA-Se (50 μg/kg OTA + 1 mg/kg Nano-Se) y un grupo control. Las dosis se recalibraron en alineación con las variaciones de peso en los pollos de engorde (17, 18). Tras la conclusión del experimento, todos los pollos fueron sacrificados a través de la bisección de vasos cervicales. Seis pollos de engorde de cada grupo tenían su contenido cecal congelado utilizando métodos estériles, y su hígado y yeyuno se fijaron en paraformaldehído al 4% (p/v). Estos tejidos se procesaron posteriormente a través de deshidratación, infiltración, incrustación, corte y tinción con hematoxilina y eosina (H&E) en cumplimiento de los procedimientos estándar de examen histopatológico.
2.4. Secuenciación del ARNr 16S y análisis bioinformáticos
QIAamp DNA Stool Mini Kit (Qiagen™, Alemania) extrajo ADN bacteriano entérico del contenido cecal almacenado. La región V16-V3 del ADNr 4S se sometió a amplificación por PCR a través de cebadores 338F (ACTCCTACGGGAGGCAGCA) y 806R (GGACTACHVGGGTWTCTAAT). Los amplicones se evaluaron a través de electroforesis en gel al 2%. Después de eso, AxyPrep DNA Gel Extraction (Axygen™, Estados Unidos) recuperó amplicones probados de dicho gel. La detección y cuantificación de productos de PCR se realizó utilizando un microfluorómetro QuantiFluor-ST™ (Promega, Madison, WI, Estados Unidos). Posteriormente, las bibliotecas MiSeq fueron preparadas para la pirosecuenciación en MiSeq (Illumina™, Estados Unidos). Las secuencias que exhibieron una similitud de al menos el 97% se agruparon en una sola unidad taxonómica operacional (OTU) después de ser sometidas a limpieza. Los análisis bioinformáticos se realizaron a través de Majorbio®®®1 (Shanghai, China). Se accedió a la plataforma el 25 de octubre de 2022. El estudio empleó el Análisis Discriminante de Mínimos Cuadrados Parciales (PLS-DA), demostrando análisis de diversidad de β a nivel OUT, utilizando índices UniFrac ponderados y Bray-Curtis. La prueba de suma de rangos de Kruskal-Wallis probó variaciones con significación estadística relacionada con la abundancia dentro de los niveles de filo / género.
2.5. Tratamiento de muestras de metaboloma
Se pesó con precisión una muestra de 50 mg de contenido de cecal y se combinó con perlas de molienda de 6 mm, una solución de extracción de 400 ml que consistía en una proporción de 4:1 de metanol a agua (v:v) y una solución estándar que contenía 0,02 mg de ml.−1 estándar (L-2-clorofenilalanina). La mezcla resultante se colocó en un tubo de centrifugación de 2 ml. Después de 6 minutos de molienda de tejidos (-10 ° C / 50 Hz), se realizó la recolección ultrasónica (30 min / 5 ° C / 40 kHz). Posteriormente, la muestra se sometió a una temperatura de -20 ° C durante 30 min y se sometió a centrifugación durante 15 min a 9.400×4 g a 20 ° C. Se transfirió un volumen de <> μL (sobrenadante) de cada muestra utilizando una pipeta a un vial de muestra que contenía una cánula interna para la evaluación computarizada. Se intercaló una inyección de muestra de control de calidad (QC) después de cada seis muestras. Los especímenes se sometieron a análisis a través de LC-MS, con seis réplicas biológicas por grupo.
2.6. Detección de metabolitos por LC-MS
El análisis LC-MS se realizó utilizando la plataforma UHPLC-Q Exactive (ThermoFisher-Scientific™, China). Los parámetros de cromatografía se establecieron de la siguiente manera: la columna utilizada fue HSS T3 con dimensiones de 100 mm × 2,1 mm de diámetro interior y un tamaño de partícula de 1,8 μm. La fase móvil A consistió en 5% de acetonitrilo y 95% de agua con 0,1% de ácido fórmico, y la fase móvil B contenía 47,5% de alcohol isopropílico, 47,5% de acetonitrilo y 5% de agua con 0,1% de ácido fórmico. El caudal volumétrico fue de 0,40 ml / min, el volumen de inyección fue de 2 μL y la temperatura de la columna fue de 40 ° C. La técnica MS utilizó ionización por electrospray para obtener señales de espectro de masas para muestras. El rango de escaneo masivo se estableció en 70-1,050 m / z, y se emplearon modos de escaneo de iones negativos y positivos. Las condiciones experimentales abarcaron los siguientes parámetros operativos: un voltaje de iones negativos de 2.800 V, un voltaje de iones positivos de 3.500 V, presión de gas de vaina a 40 psi, presión de gas de calefacción auxiliar a 10 psi, temperatura de calentamiento de la fuente de iones a 400 ° C, energía de colisión cíclica de 20-40-60 V, una resolución de espectrometría de masas primaria (MS1) de 70,000, junto con una resolución de espectrometría de masas secundaria (MS2) de 17,500.®
2.7. Preprocesamiento de datos y búsqueda en bases de datos
El software Progenesis QI procesó datos sin procesar, estandarizando las intensidades de respuesta de la muestra desde los picos de espectro de masas para minimizar los errores derivados de la preparación de la muestra y la inestabilidad del instrumento. Los especímenes con una desviación estándar relativa (DSR) > del 30% fueron excluidos de las evaluaciones. La matriz de datos eventual para una mayor investigación se obtuvo realizando una transformación logarítmica en las variables. Los datos metabolómicos se adquirieron integrando los espectros MS1 y MS2 a través de conjuntos de datos de bases de datos metabólicos disponibles públicamente, a saber, HMDB2 y Metlin.3
2.8. Proyecciones ortogonales al análisis discriminante de estructuras latentes (OPLS-DA)
OPLS-DA obtuvo información sobre las variaciones metabólicas tanto dentro como entre los grupos de muestras. Los metabolitos que mostraron diferencias significativas se eligieron según sus puntuaciones de Variable Importante en Proyección (VIP) y los valores p obtenidos de la prueba t de Student. Se asumió que los metabolitos que exhibían una puntuación VIP de ≥1 y p < 0,05 tenían significación estadística. Posteriormente, los metabolitos diferenciales fueron identificados y clasificados a través de la Enciclopedia de Genes y Genomas de Kioto (KEGG)4 para determinar las vías metabólicas afectadas. Se consideró que las vías KEGG estaban significativamente enriquecidas si tenían p < 0,05.
2.9. Análisis estadísticos
Los resultados experimentales se informaron en forma de valores medios junto con sus correspondientes desviaciones estándar. Los efectos anticoccidiales se analizaron mediante la prueba ANOVA unidireccional. Los métodos estadísticos para las pruebas de suma de rangos T/Wilcoxon/Tukey evaluaron las disparidades entre los cuatro tratamientos. p < 0,05 se consideró que confería significación estadística.
3. Resultados
3.1. Resultados del crecimiento
La Tabla 2 presenta el impacto de la suplementación con OTA y Nano-Se en el rendimiento de crecimiento de los pollos de engorde. No se observaron diferencias estadísticamente significativas (p > 0,10) en el peso corporal inicial (IBW) entre los grupos. Sin embargo, en el día 21, el peso corporal final (FBW) se redujo significativamente en respuesta a los tratamientos con OTA (p < 0,05). Además, se encontró que la ganancia diaria promedio (ADG) en el grupo OTA fue inferior a los otros grupos (p < 0,01). Sin embargo, la ingesta diaria promedio de alimento (ADFI) se mantuvo constante en los cuatro grupos. En cuanto a la relación de conversión alimenticia (FCR), se observó una disminución en FCR con la adición de Nano-Se del día 1 al 21 (p < 0,05).
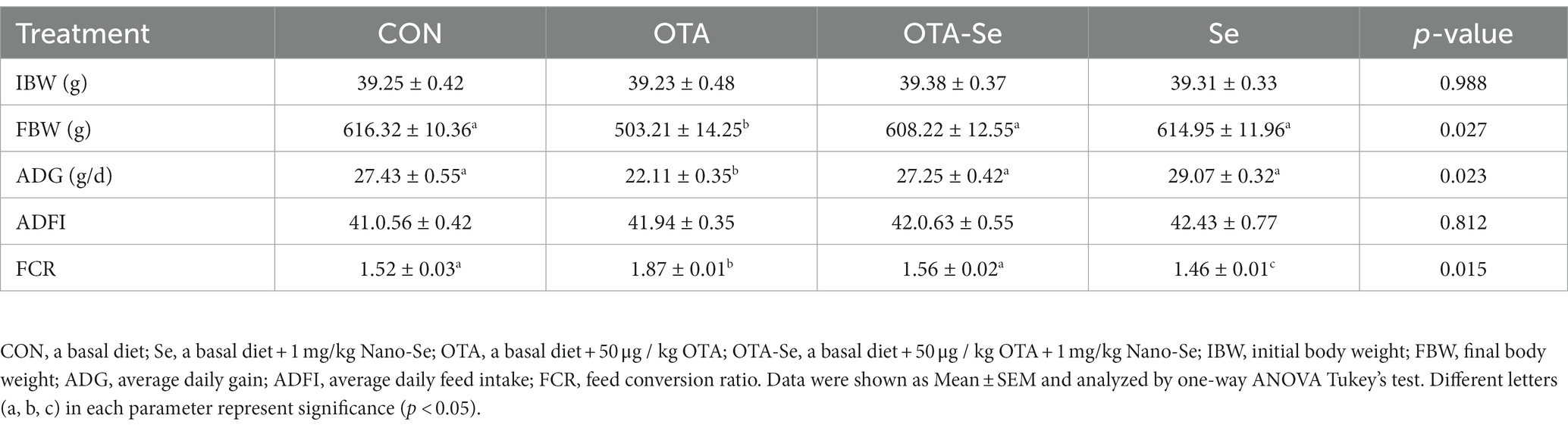 Tabla 2. El efecto de la suplementación con OTA y Nano-Se en el rendimiento de crecimiento de pollos de engorde de 1 a 21 días.
Tabla 2. El efecto de la suplementación con OTA y Nano-Se en el rendimiento de crecimiento de pollos de engorde de 1 a 21 días.
3.2. Cambios histopatológicos en el intestino y el hígado
Las características morfológicas del yeyuno fueron normales tanto en el grupo control como en el grupo de tratamiento SE, exhibiendo una estructura completa de la membrana mucosa intestinal. Las vellosidades intestinales estaban claras y bien alineadas, sin cambios anormales significativos (Figuras 1A, D). Por el contrario, el yeyuno de los pollos de engorde en el grupo OTA estaba notablemente distendido, con desprendimiento extenso de la mucosa intestinal y daño estructural observable (Figura 1B). Después del pretratamiento con Nano-Se, se mitigó el desprendimiento de la mucosa intestinal en el yeyuno de pollos de engorde, y no se observaron cambios perceptibles en la lámina propia (Figura 1C).
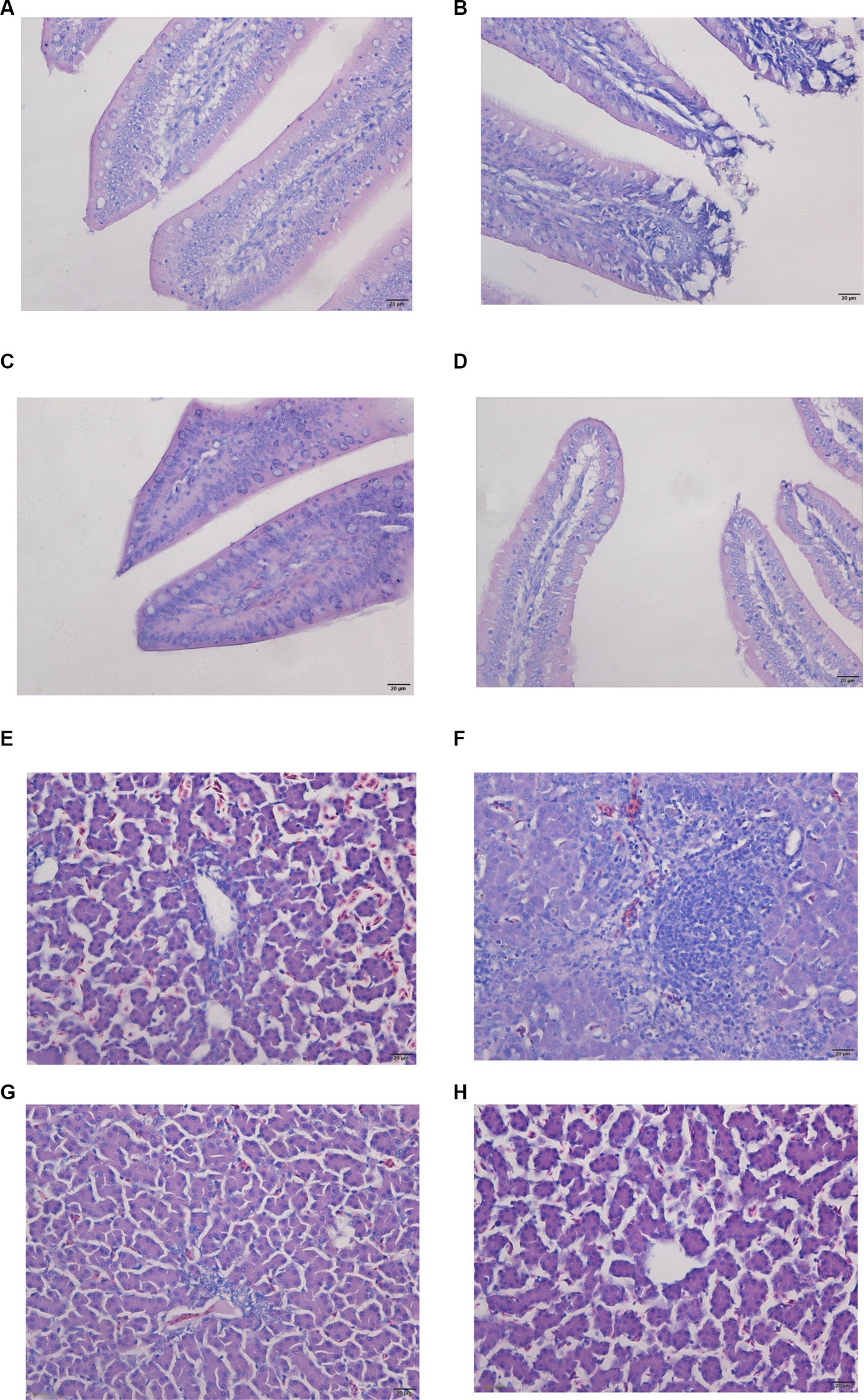 Figura 1. Los cambios patológicos en el yeyuno y el hígado se detectaron mediante la tinción de H&E en la sección tisular. Las imágenes fueron tomadas con aumentos de 400×. (A,E) Grupo de control; (B,F) Grupo OTA; (C,G) Grupo OTA-Se; (D,H) Se grupo.
Figura 1. Los cambios patológicos en el yeyuno y el hígado se detectaron mediante la tinción de H&E en la sección tisular. Las imágenes fueron tomadas con aumentos de 400×. (A,E) Grupo de control; (B,F) Grupo OTA; (C,G) Grupo OTA-Se; (D,H) Se grupo.
La tinción HE aclaró aún más la condición del tejido hepático. En los pollos de los grupos control y Se, no se observaron signos de inflamación, congestión, sangrado, necrosis o exudación (Figuras 1E, H). En el grupo OTA, el hígado mostró signos de inflamación, sobre todo debido a la infiltración extensa de células inflamatorias desencadenada por OTA, particularmente una alta concentración de linfocitos y eosinófilos (Figura 1F). Se detectaron alteraciones patomorfológicas mínimas en el grupo OTA-Se (Figura 1G). En conjunto, estos hallazgos indican que la suplementación con Nano-Se proporcionó un efecto protector contra la lesión hepática inducida por OTA en pollos.
3.3. Datos de secuencias de ADN
El análisis de secuenciación de alto rendimiento para los contenidos de cecal de pollo se realizó utilizando la plataforma Illumina MiSeq. Después de QC, se obtuvieron 640.107 secuencias válidas, con un promedio de 40.006 secuencias por espécimen. Entre estas secuencias de alta calidad, aproximadamente el 99,95% eran más largas que 400 pb, con la mayoría oscilando entre 401 y 420 pb (Figura 2A).
 Figura 2. (A) Distribución de la longitud del fragmento de las secuencias de cada muestra después de la fusión y el recorte. (B) Las curvas de rarefacción trazadas para visualizar las OTU de cada grupo. La línea roja representa el grupo de control, la línea azul el grupo OTA, la línea verde el grupo OTA-Se y la línea púrpura el grupo Se. (C) Clasificar las curvas de abundancia de la microbiota intestinal en el nivel OUT en los cuatro grupos.
Figura 2. (A) Distribución de la longitud del fragmento de las secuencias de cada muestra después de la fusión y el recorte. (B) Las curvas de rarefacción trazadas para visualizar las OTU de cada grupo. La línea roja representa el grupo de control, la línea azul el grupo OTA, la línea verde el grupo OTA-Se y la línea púrpura el grupo Se. (C) Clasificar las curvas de abundancia de la microbiota intestinal en el nivel OUT en los cuatro grupos.
Sobre la base de un umbral de similitud del 97%, todas las lecturas efectivas se agruparon en OTU. Las curvas de rarefacción para los cuatro grupos alcanzaron una meseta, lo que sugiere que la profundidad de secuenciación empleada en dicha investigación fue suficiente para evaluar la composición de la población microbiana derivada de muestras y representar con precisión las colonias microbianas fecales (Figura 2B). La riqueza y la uniformidad de la composición de la microbiota fueron comparables entre los cuatro grupos mediante el análisis de abundancia de rango dentro del nivel de OTU (Figura 2C). La idoneidad de los esfuerzos de muestreo fue apoyada por curvas de rarefacción y abundancia de rango para cada espécimen.
3.4. Efectos de la ocratoxina A y Nano-Se en la composición microbiana intestinal
La diversidad alfa mide el número de especies y su diversidad dentro de un espécimen en particular. La diversidad alfa se puede evaluar utilizando diferentes índices. Los índices mencionados anteriormente comprenden ACE, Chao1, Simpson y Shannon. Los índices ACE y Chao1 cuantifican la abundancia de especies, que se refiere a las cantidades totales de especies presentes dentro de un espécimen dado. Por otro lado, los índices de Simpson y Shannon evalúan la diversidad de especies, considerando el número de especies y su abundancia relativa dentro del espécimen. El análisis de diversidad alfa indicó que no hubo variaciones estadísticamente significativas dentro del índice de Simpson, el índice de Shannon, el índice Chao1 y el índice ACE en las cuatro cohortes terapéuticas (p > 0,05) (Tabla 3).
La diversidad beta evaluó las variaciones dentro de la complejidad de las especies dentro de los especímenes, como lo demuestra un índice Unifrac ponderado. Con respecto a la diversidad β, PLS-DA reveló que la similitud en la diversidad de especies difería significativamente cuando los pollos recibieron OTA y Nano-Se (Figura 3A). Se observó una clara separación entre los grupos dentro de la flora cecal del pollo, lo que indica que la estructura de la flora cecal del pollo había sido alterada.
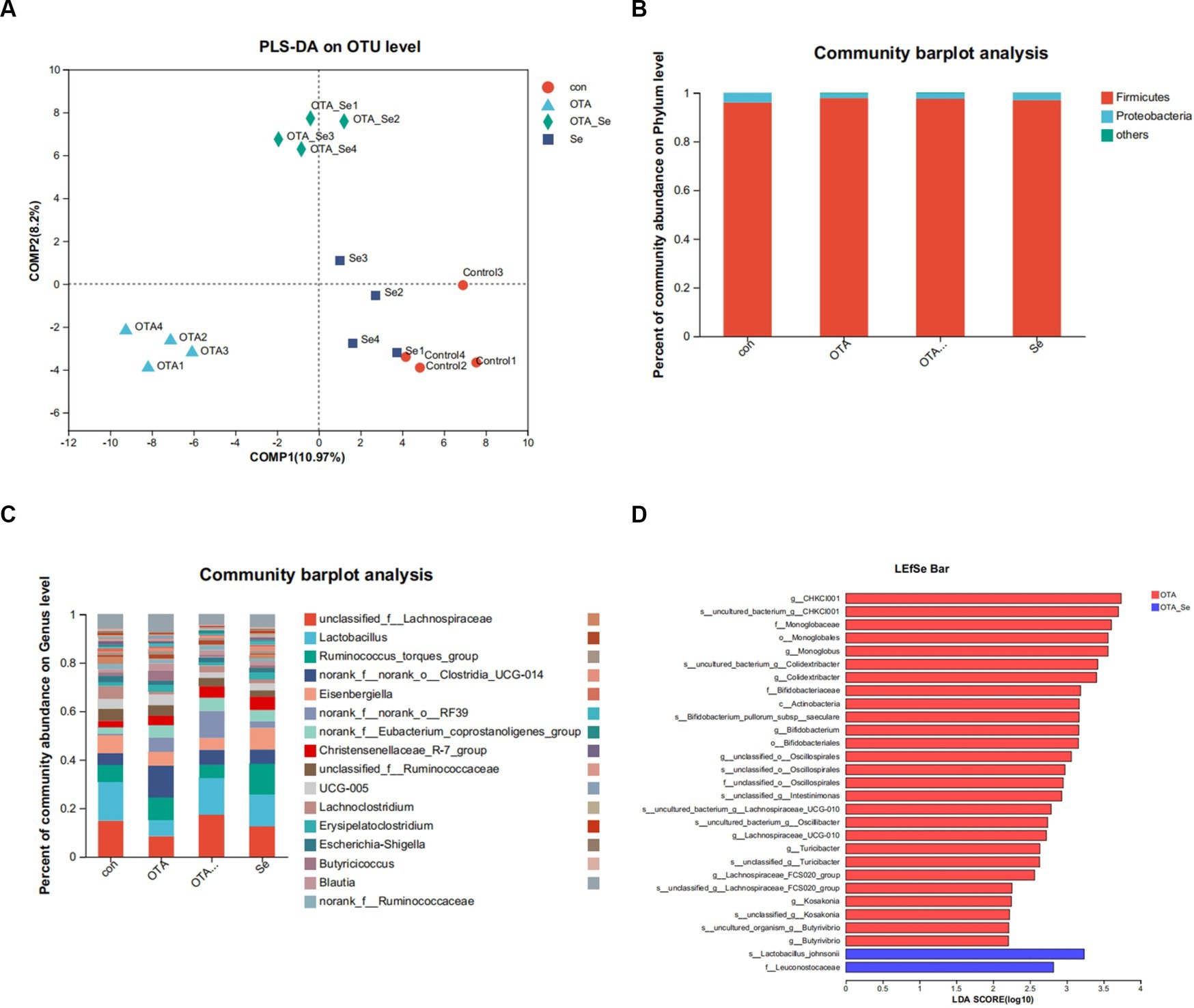 Figura 3. (A) El impacto de OTA y Nano-Se en la estructura de la comunidad microbiana en el ciego de pollos evaluado a través de PLS-DA. Cada punto de datos representa una muestra individual, y los puntos de datos que comparten el mismo color pertenecen al mismo grupo. Se sugiere un modelo de clasificación superior cuando se minimiza la distancia intragrupo y se maximiza la distancia intergrupal. (B) Abundancia relativa de filos en la microbiota intestinal. (C) Abundancia relativa de géneros en la microbiota intestinal. (D) Barra LEfSe basada en el filo a nivel de género (LDA > 2). p < 0,05.
Figura 3. (A) El impacto de OTA y Nano-Se en la estructura de la comunidad microbiana en el ciego de pollos evaluado a través de PLS-DA. Cada punto de datos representa una muestra individual, y los puntos de datos que comparten el mismo color pertenecen al mismo grupo. Se sugiere un modelo de clasificación superior cuando se minimiza la distancia intragrupo y se maximiza la distancia intergrupal. (B) Abundancia relativa de filos en la microbiota intestinal. (C) Abundancia relativa de géneros en la microbiota intestinal. (D) Barra LEfSe basada en el filo a nivel de género (LDA > 2). p < 0,05.
Como se ilustra en la Figura 3B, el filo primario de la microbiota intestinal de pollos de engorde fue Firmicutes, seguido de Proteobacteria. La abundancia relativa de Firmicutes dentro de la cohorte OTA fue mayor que la cohorte control y similar al grupo OTA-Se.
Los géneros predominantes dentro del intestino incluyeron Lactobacillus, norank_f__norank_o__Clostridia_UCG-014, unclassified_f__Lachnospiraceae y Ruminococcus_torques_group (Figura 3C). Entre estos géneros, la abundancia relativa de Lachnospiraceae fue mayor dentro del grupo OTA-Se. Por el contrario, la abundancia relativa de Clostridia fue mayor dentro del grupo OTA.
Se realizó una comparación supervisada de muestras mediante LEfSe y análisis discriminante lineal logarítmico (LDA). Los resultados de LEfSe, que se muestran en la Figura 3D, revelaron que, en comparación con el grupo de control, las bacterias dominantes dentro de la cohorte OTA-Se fueron s__Lactobacillus_johnsonii y f__Leuconostocaceae a nivel de filo a género.
3.5. Análisis del metaboloma
Las muestras de control de calidad evaluaron la consistencia/reproducibilidad de los métodos de investigación, con inyecciones arbitrarias realizadas durante la inyección de la muestra. Más del 70% de los valores de RSD para las muestras de control de calidad fueron inferiores al 30%, lo que sugiere que los conjuntos de datos recopilados a través de tales métodos de investigación mostraron estabilidad.
Para explorar los cambios en los metabolitos intestinales inducidos por la suplementación dietética de OTA y Nano-Se, se aplicó un enfoque metabolómico no dirigido para analizar los perfiles de metabolitos del contenido cecal. OPLS-DA se utilizó para discernir distintos patrones metabólicos, como se ilustra en las Figuras 4A, C. Este análisis reveló perfiles metabólicos separados entre los grupos OTA y Control y entre las cohortes OTA-Se y OTA. OPLS-DA permitió filtrar variaciones irrelevantes, mejorando la capacidad de identificar metabolitos diferenciales sustanciales entre los diferentes grupos. La cercanía de los puntos duplicados para los dos grupos de muestra indica una buena repetibilidad de los datos.
 Figura 4. Gráfica del modelo OPLS-DA para el grupo de comparación Control vs OTA: (A) diagrama de puntuación; (B) diagrama de validación del modelo; Gráfica del modelo OPLS-DA para el grupo de comparación OTA vs OTA-Se; (C) diagrama de puntuación; (D) diagrama de validación del modelo.
Figura 4. Gráfica del modelo OPLS-DA para el grupo de comparación Control vs OTA: (A) diagrama de puntuación; (B) diagrama de validación del modelo; Gráfica del modelo OPLS-DA para el grupo de comparación OTA vs OTA-Se; (C) diagrama de puntuación; (D) diagrama de validación del modelo.
La validación del modelo OPLS-DA se llevó a cabo dentro de esta investigación para evitar el sobreajuste. Las separaciones claras entre los grupos OTA (puntos azules) y Control Control (puntos verdes) (R2 = 0.9956, Q2 = −0.0026, Figura 4B) y entre los grupos OTA (puntos azules) y OTA-Se (puntos amarillos) (R2 = 0.9967, Q2 = 0.0661, Figura 4D) fueron demostradas por los modelos OPLS-DA. Cuanto mayores sean los valores de R2 y Q2, mayor será la fiabilidad teórica para este modelo. Los datos adquiridos sugieren que ambos modelos demuestran una estabilidad favorable y no sobreajuste. Se confirma que el material es suficientemente reproducible y apropiado para posteriores validaciones cualitativas y cuantitativas de ensayos, como lo demuestran estos resultados.
3.6. Análisis diferencial de metabolitos
Los metabolitos se seleccionaron diferencialmente utilizando el valor VIP (VIP > 1) del modelo OPLS-DA junto con el valor de p (p < 0,05) de la prueba t de muestra independiente de todos los metabolitos identificados. Los metabolitos diferenciales elegidos sirvieron como variables marcadoras para distinguir entre cohortes. En comparación con la cohorte control, la cohorte OTA exhibió una identificación inicial de 515 metabolitos diferenciales, con 259 dentro del modo positivo y 256 dentro del modo de iones negativos. Entre estos metabolitos, 276 fueron regulados al alza, mientras que 239 fueron regulados a la baja (Figura 5A). Tras la comparación de los grupos OTA y OTA-Se, se detectó un colectivo de 514 metabolitos distintos (277 dentro del modo positivo y 237 dentro del modo de iones negativos) a través de ambos modos de análisis (Figura 5B). Entre los metabolitos reconocidos, 214 mostraron una disminución significativa, mientras que 300 mostraron un aumento.
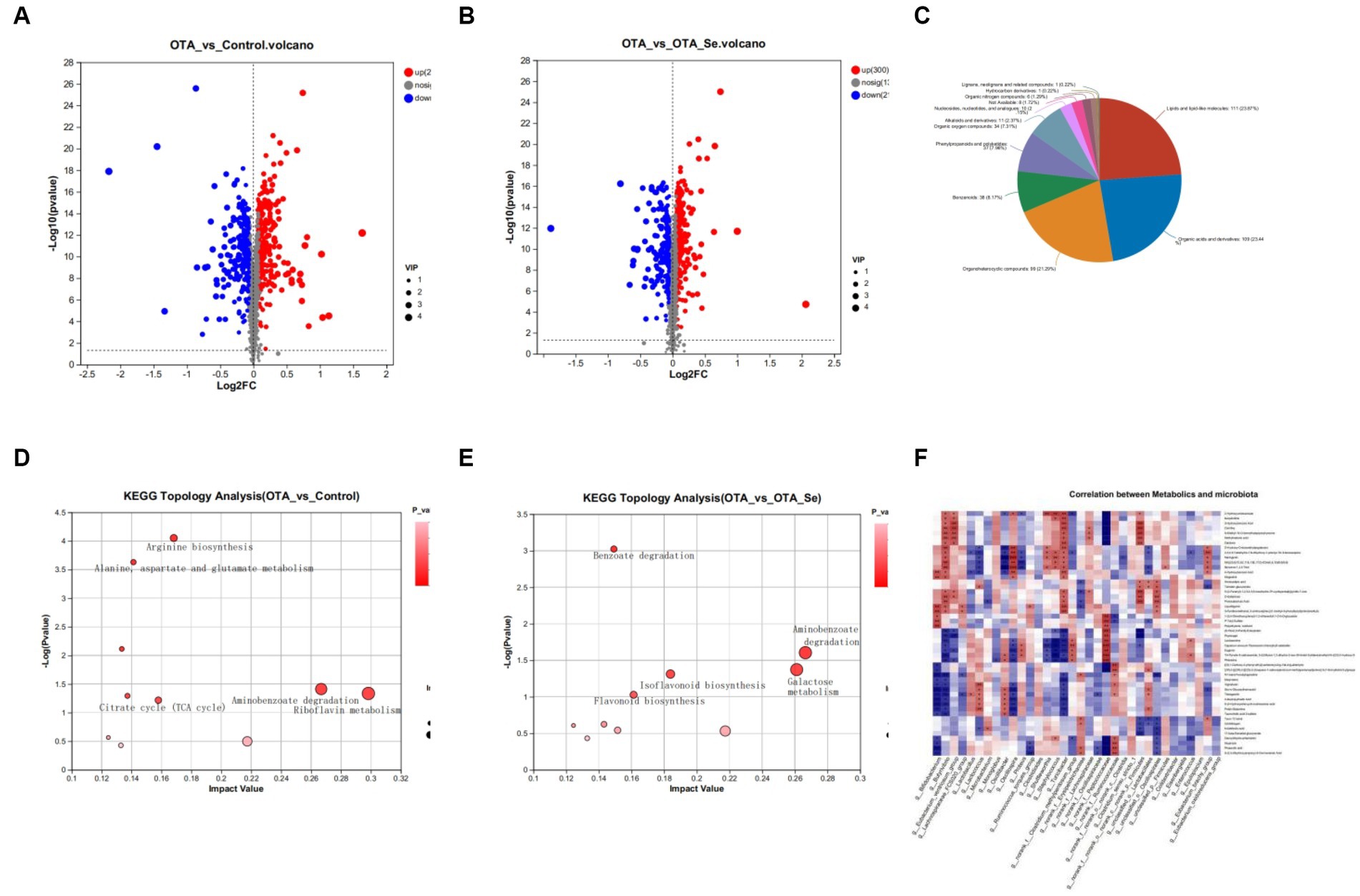 Figura 5. (A) Análisis de expresión diferencial de metabolitos para comparar el grupo control con el grupo OTA. (B) Las parcelas volcánicas exhibieron metabolitos distintos en el grupo OTA-Se en comparación con el grupo OTA. El color rojo es indicativo de una elevación en el contenido de metabolitos, mientras que el azul significa una reducción en el contenido de metabolitos. El color gris representa la ausencia de cualquier diferencia notable. (C) Clasificación de metabolitos diferenciales en la base de datos HMDB. (D) Diagrama de burbujas que muestra el análisis de enriquecimiento de KEGG. Con vs OTA. (E) El análisis de enriquecimiento KEGG OTA vs OTA-Se. (F) Correlación de rango de Spearman entre los metabolitos del ciego y la microbiota intestinal asociada en el grupo OTA y OTA-Se. Las conexiones representadas en rojo significan una correlación positiva directa, mientras que las de azul representan una correlación negativa inversa. La significación estadística de los datos se calcula utilizando una prueba de suma de rangos de Wilcoxon de dos colas para determinar los valores p. *p < 0,05, **p < 0,01.
Figura 5. (A) Análisis de expresión diferencial de metabolitos para comparar el grupo control con el grupo OTA. (B) Las parcelas volcánicas exhibieron metabolitos distintos en el grupo OTA-Se en comparación con el grupo OTA. El color rojo es indicativo de una elevación en el contenido de metabolitos, mientras que el azul significa una reducción en el contenido de metabolitos. El color gris representa la ausencia de cualquier diferencia notable. (C) Clasificación de metabolitos diferenciales en la base de datos HMDB. (D) Diagrama de burbujas que muestra el análisis de enriquecimiento de KEGG. Con vs OTA. (E) El análisis de enriquecimiento KEGG OTA vs OTA-Se. (F) Correlación de rango de Spearman entre los metabolitos del ciego y la microbiota intestinal asociada en el grupo OTA y OTA-Se. Las conexiones representadas en rojo significan una correlación positiva directa, mientras que las de azul representan una correlación negativa inversa. La significación estadística de los datos se calcula utilizando una prueba de suma de rangos de Wilcoxon de dos colas para determinar los valores p. *p < 0,05, **p < 0,01.
Los metabolitos diferenciales identificados en este estudio fueron anotados dentro de HMDB para ser clasificados. Los resultados mostraron que los lípidos/moléculas similares a los lípidos constituían el 23,87% de los metabolitos diferencialmente agregados dentro de las cohortes OTA y OTA-Se. Los ácidos/derivados orgánicos fueron la segunda cohorte más abundante con un 23,44%, seguidos de los compuestos organoheterocíclicos con un 21,29%, los benzenoides con un 8,17%, los fenilpropanoides y los policétidos con un 7,96%, los compuestos orgánicos de oxígeno con un 7,31%, los alcaloides y derivados con un 2,37%, los nucleósidos, nucleótidos y análogos con un 2,15%, los compuestos orgánicos de nitrógeno con un 1,29% y los compuestos restantes con un 0,44% (Figura 5C).
Se realizó un análisis adicional de los metabolitos identificados utilizando el análisis KEGG para investigar las posibles vías afectadas por las intervenciones OTA y Nano-Se. Las 10 principales vías metabólicas de KEGG con enriquecimiento significativo para diferentes metabolitos se encontraron utilizando la base de datos KEGG. En comparación con la cohorte de control, las vías con los valores de impacto más altos dentro de la cohorte OTA incluyeron el metabolismo de la riboflavina, la degradación del aminobenzoato, la degradación del limoneno y el pineno, la biosíntesis de arginina y el metabolismo de la alanina, el aspartato y el glutamato. Entre los metabolitos implicados en estas vías, la riboflavina, el benzoato, el ácido oxoglutárico y la L-glutamina disminuyeron notablemente dentro de la cohorte OTA en comparación con el grupo control. Por el contrario, el ácido benzoico, el ácido gálico y la citrulina aumentaron dentro de la cohorte OTA en relación con la cohorte de control (Figura 5D).
Al comparar la cohorte OTA con la cohorte OTA-Se, las distintas vías metabólicas dentro del contenido intestinal incluyeron la degradación del aminobenzoato, el metabolismo de la galactosa, la biosíntesis de isoflavonoides y la biosíntesis de flavonoides. Entre los metabolitos que participan en estas vías metabólicas, el ácido protocatecúico, el ácido 4-hidroxibenzoico, la D-galactosa, la daidzeína, la liquiritigenina y la naringenina fueron altamente elevados dentro de la cohorte OTA-Se en comparación con el grupo OTA. Por el contrario, el ácido galactónico y el mioinositol se redujeron dentro de la cohorte OTA-Se en comparación con la cohorte OTA (Figura 5E).
La correlación entre los diferentes géneros microbianos y los metabolitos cecales modificados se determinó utilizando los valores del coeficiente de correlación de Spearman en un análisis de correlación (Figura 5F). El presente estudio ha revelado asociaciones que tienen una significación estadística considerable (p < 0,05, r > 0,70) a través de bacterias particulares presentes dentro del ciego y metabolitos distintivos en la comparación de OTA vs OTA-Se. Dos metabolitos distintos, Daidzeína y Liquiritigenina, involucrados dentro de la vía de biosíntesis de isoflavonoides, mostraron correlaciones positivas significativas con Firmicutes, Turicibacter y Butyrivibrio. Además, el ácido protocatecúico, presente en las vías de degradación de aminobenzoato y degradación de benzoatos, demostró una correlación positiva con oscillospirales, firmicutes y Butyrivibrio mientras que reveló una correlación negativa con Erysipelotrichaceae. Aunque el metabolismo directo de estos productos metabólicos por la microbiota intestinal sigue estando determinado de manera concluyente, los resultados destacan una estrecha interacción entre las especies microbianas intestinales y los metabolitos, lo que sugiere que la suplementación con Nano-Se puede haber inducido alteraciones notables en la microbiota intestinal, lo que en última instancia conduce a cambios significativos en la abundancia de metabolitos del huésped.
4. Discusión
OTA (C20H18ClNO6; peso molecular: 403.8) es una micotoxina predominante originaria de varias especies de Penicillium y Aspergillus. Su presencia generalizada y la contaminación de cultivos y alimentos plantean importantes amenazas para la salud humana y animal (2). Se, un oligoelemento esencial para los mamíferos, incluidos los humanos, exhibe una fuerte correlación entre sus funciones fisiológicas y la prevalencia de enfermedades (19). Investigaciones anteriores han destacado el papel crucial de Sé en la disminución del daño infligido a los animales por las micotoxinas (20-22). En la investigación actual, los pollos alimentados con alimentos contaminados con OTA mostraron una marcada disminución en FBW, ADG y una elevación notable en los hallazgos de FCR congruentes con estudios previos (23, 24). Además, la literatura existente ha demostrado que incluso una exposición menor a la OTA en animales puede provocar alteraciones patológicas y funcionales en el hígado y los intestinos (25-30). Nuestros hallazgos se alinean con estos estudios anteriores, lo que indica que la suplementación con Nano-Se puede proteger a los pollos contra el daño inducido por OTA. La microbiota intestinal, reconocida como un indicador crítico y sensible de la salud gastrointestinal, está inevitablemente influenciada por contaminantes ambientales, incluidas micotoxinas como la OTA. En los últimos años, un creciente cuerpo de evidencia ha demostrado que la OTA tiene un efecto perjudicial sobre la integridad de la barrera intestinal, induce estrés oxidativo e inflamación, y reduce la abundancia de microorganismos beneficiosos (31-35). La OTA induce alteraciones en la composición de la microbiota intestinal, afectando el filo, el género y los niveles de especies (36). La literatura ha documentado un aumento considerable en el enriquecimiento de Bacteroides en ratones expuestos a OTA (37). La investigación en pollos de engorde y patos ha indicado que la OTA reduce la abundancia/diversidad de la microbiota cecal, lo que provoca daños en la unión estrecha intestinal (38).
Recientemente, la comunidad científica ha mostrado una mayor curiosidad por comprender los efectos moduladores de Se en la microbiota intestinal. Cuando se expusieron a levaduras enriquecidas con selenio, los pollos de engorde sometidos a OTA experimentaron alteraciones en la diversidad de su microbiota cecal (30). Zhang et al., al analizar las variaciones en la distribución de Se en la región de Enshi de Hubei, China, observaron una mayor prevalencia de Bacteroidetes en áreas con concentraciones más altas de Se en comparación con regiones con concentraciones de Se más bajas (39). Sus hallazgos revelaron que la suplementación dietética de Se puede influir en las reacciones inmunológicas del intestino y la funcionalidad de barrera. Esto está relacionado con la alteración de la microbiota intestinal a través de procedimientos de trasplante de microbiota fecal (40). Además, la suplementación dietética de SE mejoró notablemente la diversidad de la microbiota de los ratones (41). La suplementación con levadura y cultivo de levadura enriquecida con selenio contribuyó a la homeostasis intestinal al elevar la abundancia relativa de microbiota asociada a antiinflamatorios, mitigando así el daño causado por la infección por S. enteritidis (42). Los resultados de la investigación indican que la adición de nanopartículas de Se dietéticas (SeNP) puede modular eficazmente la microbiota intestinal y sus procesos metabólicos, reduciendo la gravedad de la toxicidad aguda causada por el dicuat (43). El consumo de SeNP que excede los requisitos nutricionales puede mejorar la composición de la microbiota intestinal, protegiendo así contra las disfunciones intestinales (44). Una concentración intermedia de SeNPs a 0,9 mg / kg demostró la mayor eficacia en la mejora de la salud intestinal mediante la promoción de bacterias beneficiosas, incluyendo Faecalibacterium y Lactobacillus (45).
El presente estudio determinó que las poblaciones de Clostridia aumentaron mientras que la abundancia de Lactobacillus y Lachnospiraceae disminuyó dentro del grupo OTA, pero estos niveles se normalizaron después de la suplementación con Nano-Se. Clostridium, incluyendo especies como Clostridium perfringens, Clostridium botulinum, y Clostridium tetani, puede generar exotoxinas y están asociadas con numerosas enfermedades (46). La investigación ha revelado una correlación positiva entre Clostridium y la proteína quimioatrayente de monocitos-1 (MCP-1), una citoquina proinflamatoria (47). Se encontró que el nivel de bacterias Clostridium estaba fuertemente correlacionado con la gravedad de la enfermedad inflamatoria intestinal (EII) (48) dentro de la microbiota intestinal de pollos expuestos a OTA, la administración oral de aflatoxina B1 (AFB1) disminuyó la diversidad alfa de la microbiota intestinal en pollos de engorde y aumentó la abundancia de varias bacterias perjudiciales, incluido Clostridium (49). Además, AFB1 aumentó significativamente Bacteroidales de Bacteroidetes y Clostridiales de Firmicutes en ratas, mientras que Lactococcus sp., Streptococcus sp. y Lactobacillales de Firmicutes disminuyeron (50). Otro estudio encontró que el tratamiento con deoxinivalenol (DON) aumentó la abundancia de clostridiales dentro de la microbiota intestinal (51, 52). En otros estudios, la cohorte OTA tuvo niveles significativamente más altos de Aerococcus, Romboutsia y Clostridium sensu stricto 1. Sin embargo, el kéfir tibetano redujo la abundancia de estas tres bacterias (53). Estos hallazgos implican que la micotoxina altera la composición de la microbiota intestinal y favorece el crecimiento de bacterias dañinas, produciendo efectos tóxicos.
Además, la abundancia de Lactobacillus aumentó considerablemente dentro de la cohorte OTA-Se en comparación con otros grupos. Está bien establecido que Lactobacillus tiene partes fundamentales para mantenerse saludable junto con la prevención y el tratamiento de enfermedades (54, 55). Con numerosos efectos beneficiosos, Lactobacillus produce lactato, que puede elevar la producción de butirato en las heces (56). Lactobacillus johnsonii ha exhibido propiedades antiobesidad al inhibir la inflamación intestinal y mantener la integridad de la barrera mucosa (57). La cohorte de alimentación dietética de alta energía exhibió una mayor abundancia de especies de Lactobacillaceae, específicamente Lactobacillus reuteri y Lactobacillus johnsonii, dentro del intestino superior (duodeno y ciego). Esta colonización condujo a efectos protectores sobre el revestimiento de la mucosa y redujo la inflamación (58). La investigación sobre la influencia de la OTA en la microbiota intestinal reveló niveles disminuidos de microorganismos ventajosos como bifidobacterias y Lactobacillus. Esta disminución indica que la OTA alteró el equilibrio de la microbiota, lo que podría resultar en una inmunidad comprometida (59). Los ratones administrados con OTA a través de medios intragástricos mostraron una reducción dentro de la prevalencia proporcional de Bifidobacterium spp. y Lactobacillus spp. (60). Además, Zearalenone provocó un aumento en Desulfovibrio y una disminución en la abundancia de Lactobacillus dentro del tejido del colon de ratones (61). La combinación de Bacillus cereus BC7 y la cepa de lactobacilos tuvo un impacto positivo en las respuestas inflamatorias intestinales y las alteraciones de la microbiota inducidas por la zearalenona (62, 63). Los resultados indicaron el aumento de la resistencia de Lactobacillus a OTA y su papel potencial dentro del proceso de desintoxicación de OTA.
La familia bacteriana, Lachnospiraceae, puede convertir el lactato y el acetato en butirato. Esta conversión se puede lograr utilizando diferentes vías enzimáticas, como las vías de la butiril-CoA o acetato CoA transferasa o la vía de la butirato quinasa (64) además de sus capacidades de producción de butirato, se sabe que Lachnospiraceae participa en la biosíntesis de vitamina B12 y exhibe el potencial de inhibir la colonización de Clostridium difficile dentro del tracto gastrointestinal (65). Se ha documentado que la familia Lachnospiraceae tiene funciones cruciales en la adquisición de glicanos dietéticos, la síntesis de metabolitos ventajosos, la mejora de la inmunidad y la facilitación del desarrollo neurológico en animales (66). Los estudios han demostrado que la administración de DON a cerdos a una dosis de 2,89 mg/kg dio lugar a diversas alteraciones dentro de la microbiota cecal. Esto marcó el comienzo de una disminución importante dentro de los niveles de f_Lachnospiraceae no clasificados, que se encontró que tenía una correlación positiva con la ingesta diaria promedio de alimento (67). La administración de OTA a ratones, seguida de la suplementación de kéfir tibetano, resultó en un aumento significativo en la abundancia de poblaciones bacterianas que desarrollan ácidos grasos de cadena corta (AGCC), como Lachnospiraceae, Ruminococcus y Blautia. Los AGCC se sintetizan a través de la microbiota intestinal mediante fermentación anaeróbica. Estos compuestos mejoran la integridad de la barrera intestinal y suprimen las reacciones inflamatorias (68). Dados los efectos positivos de Se en la composición de la microbiota intestinal de los pollos, los resultados actuales sugieren que Se podría mejorar la salud intestinal y servir como un aditivo candidato para promover la salud intestinal en pollos expuestos a OTA. Sin embargo, se requiere más investigación para dilucidar el mecanismo a través del cual Se promueve el crecimiento de microorganismos intestinales.
La metabolómica representa un nuevo enfoque analítico para detectar cambios en pequeños metabolitos endógenos. Los factores externos o las interrupciones internas pueden influir en estas alteraciones, y la metabolómica se puede emplear para diagnosticar y predecir los mecanismos subyacentes de tales cambios (69, 70). Múltiples investigaciones han documentado el impacto del consumo de Se en los procesos metabólicos (43, 71, 72). Se identificaron 515 metabolitos distintos dentro del ciego de pollos de engorde a través del análisis metabolómico después de un desafío OTA. El análisis KEGG reveló que estos metabolitos están enriquecidos en el metabolismo de la riboflavina, la degradación de aminobenzoatos, la degradación del limoneno y el pineno, la biosíntesis de arginina y el metabolismo de la alanina, el aspartato y el glutamato.
El metabolismo de la riboflavina está estrechamente relacionado con el metabolismo energético de las mitocondrias. La riboflavina es un precursor de dos coenzimas, flavina adenina dinucleótido y flavina mononucleótido. Estas coenzimas son fundamentales en varias reacciones redox biológicas, incluyendo la cadena de transporte de electrones, la oxidación de ácidos grasos, la degradación de aminoácidos y el ciclo del ácido tricarboxílico (73-76). Numerosos estudios han demostrado la capacidad de la riboflavina para preservar la integridad estructural del tracto intestinal y promover un rendimiento gastrointestinal óptimo en varias especies animales (77). La riboflavina puede regular varias vías que están involucradas en el mantenimiento de la función gastrointestinal. Se ha encontrado que la riboflavina aumenta la absorción de hierro y desempeña un papel dentro del sistema antioxidante. Las investigaciones in vitro e in vivo demostraron que la deficiencia de riboflavina puede provocar estrés oxidativo en los intestinos (78). Además, los estudios han demostrado que el nivel de riboflavina en un organismo puede afectar la composición de su microbioma intestinal, y una deficiencia de riboflavina puede conducir a un desequilibrio dentro de la microflora intestinal (79-84). Por lo tanto, las concentraciones disminuidas de riboflavina indican que OTA podría inducir daño a los intestinos al alterar el metabolismo de la riboflavina.
Las propiedades antiinflamatorias del limoneno y el pineno han sido ampliamente documentadas en la literatura científica. El limoneno, un hidrocarburo terpénico monocíclico natural en los cítricos, exhibe características antiinflamatorias al unirse selectivamente a los receptores A2A y reducir la inflamación (85). α-pineno, un hidrocarburo monoterpénico bicíclico, está comúnmente presente en los aceites esenciales de árboles coníferos y es un componente importante de compuestos orgánicos volátiles derivados de diversas especies de árboles. Este compuesto exhibe una variedad de actividades biológicas, incluidas propiedades antiinflamatorias (86). Los estudios han demostrado que el α-pineno exhibe propiedades antiinflamatorias y tiene potencial como una intervención terapéutica alternativa para la inflamación (87). Con base en las propiedades observadas, es una hipótesis razonable que el aumento de la actividad de las vías de degradación de limoneno y pineno dentro de la cohorte OTA podría reducir potencialmente sus concentraciones, mitigando así la reacción inflamatoria inducida por OTA. Sin embargo, se requiere una investigación adicional para comprender los mecanismos fundamentales.
La L-arginina es parte integral de numerosos procesos, incluyendo el ciclo de la ornitina, la síntesis de proteínas, la generación de óxido nítrico, el manejo del estrés oxidativo y la regulación de la respuesta inmune. Las alteraciones metabolómicas en las células expuestas a ZEA revelaron un enriquecimiento significativo de metabolitos diferenciales relacionados con la biosíntesis de arginina. Investigaciones posteriores demostraron que la suplementación con L-arginina mejoró considerablemente la viabilidad celular y disminuyó los niveles de producción de especies reactivas de oxígeno (ROS) en células expuestas a la zearalenona (88). Además, la OTA redujo notablemente los niveles de metabolitos diferenciales, como la L-glutamina, asociados con la biosíntesis de arginina en comparación con el grupo control. La L-glutamina, un aminoácido no esencial, es una fuente de energía crítica y un eliminador activo de radicales libres para las células de enterocitos y linfocitos. El intestino puede utilizar aproximadamente el 30% del total de L-glutamina, enfatizando su importancia como nutriente clave para la salud intestinal (89). Se ha demostrado que la L-glutamina estimula la proliferación y diferenciación celular, desempeñando un papel crucial en el apoyo al crecimiento y desarrollo del tracto gastrointestinal (90). Se ha confirmado que la suplementación con L-glutamina preserva la integridad del tejido intestinal y refuerza la barrera mucosa del intestino delgado (91). Tanto los estudios clínicos como los en animales sugieren que la L-glutamina ofrece protección contra el estrés, la invasión de organismos patógenos, la infección y los desafíos inmunológicos in vitro e in vivo (92, 93).
Sobre la base de estos hallazgos, se puede especular que la regulación a la baja de las vías relacionadas con la arginasa da como resultado una disminución del metabolismo de la arginina dentro del modelo examinado. Los resultados indican que la OTA afecta significativamente las vías metabólicas relevantes a través de sus efectos sobre los metabolitos, lo que en última instancia conduce a consecuencias perjudiciales sobre el metabolismo de los nutrientes y la morfología intestinal.
El análisis KEGG que comparó los grupos OTA y OTA-Se reveló que Nano-Se podría influir en la degradación de aminobenzoato y benzoato al elevar los niveles de ácido 4-hidroxibenzoico y ácido protocatecúico. Esta vía de degradación del aminobenzoato puede promover el metabolismo del triptófano y la degradación del benzoato (94). El ácido protocatecúico, un metabolito primario de polifenoles complejos, exhibe numerosas actividades biológicas, que abarcan propiedades antioxidantes, antiinflamatorias, antibacterianas y antiapoptóticas (95-97). Investigaciones anteriores han reportado el potencial del ácido protocatecúico para atenuar el daño intestinal (98). Un estudio demostró que la inclusión de ácido protocatecúico en la dieta de pollos de engorde de plumas amarillas mejoró significativamente su rendimiento de crecimiento, capacidad antioxidante, función inmune intestinal y estructura de la microbiota intestinal (99). La investigación que utilizó lechones desafiados con LPS reveló que el ácido protocatecúico mitigó el estrés oxidativo, la inflamación, el deterioro de la barrera intestinal y la alteración de la flora intestinal (100). Además, el ácido protocatecúico se muestra prometedor como agente desintoxicante contra la fumonisina B1 y AFB1 (101, 102).
Además, se observó una regulación positiva de Daidzeína, Liquiritigenina y Naringenina dentro del grupo OTA-Se, mejorando la biosíntesis de isoflavonoides y la biosíntesis de flavonoides. Los flavonoides son reconocidos por sus propiedades antioxidantes y antiinflamatorias (103). Ciertos flavonoides, como la naringina y la luteolina, han sido identificados para aliviar la inflamación intestinal (104, 105). Se ha informado que los flavonoides derivados de plantas pueden modular la composición de la flora intestinal y mantener la salud intestinal y del organismo (106). La daidzeína, reconocida como un compuesto similar al estrógeno alternativo seguro y natural, se ha investigado cada vez más en la investigación científica. Los estudios realizados en la ciencia aviar han revelado que la daidzeína exhibe potencial como suplemento dietético para aumentar el desarrollo de órganos reproductivos, la calidad de la cáscara de huevo y el rendimiento de la puesta en gallinas ponedoras durante las etapas finales del ciclo de puesta (107, 108). La mezcla de Daidzeína y CH mejoró significativamente la actividad de SOD y GSH-px en plasma (109). Slackia sp., D-G6, una bacteria capaz de desintoxicar el deoxinivalenol, fue descubierta dentro del tracto intestinal de los pollos. Además de la desintoxicación de deoxinivalenol, la enzima D-G6 también cataliza la conversión de daidzeína a equol. Este compuesto exhibe potentes efectos estrogénicos y mitiga eficazmente el riesgo de enfermedades dependientes de estrógenos y relacionadas con la edad (110). El flavonoide liquiritigenina exhibe propiedades farmacológicas antiapoptóticas, antiinflamatorias, antioxidantes y antifibróticas (111). La naringenina, un flavonoide natural, exhibe características antioxidantes, antiproliferativas, antiinflamatorias y antimutagénicas (112). Estudios previos han demostrado que la naringenina proporciona protección celular contra el daño oxidativo inducido por el arsénico (113).
El tracto gastrointestinal sirve como la ubicación principal de la exposición a la OTA y es fundamental para la toxicidad inducida por OTA. La principal manifestación de la toxicidad entérica de la OTA es la inducción del estrés oxidativo y la respuesta inflamatoria, y el impacto de la intoxicación por OTA en la expresión génica de los marcadores de la vía de señalización relacionados con la inflamación y las citoquinas inflamatorias fue más pronunciado en el intestino en comparación con el riñón de los lechones (114). La investigación ha demostrado que la OTA causa daño oxidativo al tracto intestinal de los pollos de engorde, lo que lleva a la elevación de citoquinas proinflamatorias y la reducción de citoquinas antiinflamatorias dentro de los tejidos cecales de estas aves (40, 115). Los estudios realizados in vitro e in vivo han demostrado que la exposición a OTA conduce a una sobreproducción de radicales libres, lo que altera el equilibrio entre los sistemas antioxidante y oxidante y perjudica la función y la estructura de las membranas celulares (11). Los hallazgos indican que la exposición subcrónica a una dosis baja de OTA durante 30 días afecta significativamente la respuesta inmune y los mecanismos de autodefensa antioxidante dentro del intestino y el riñón. Además, ha habido informes que relacionan la alteración de la microbiota intestinal con el daño intestinal, la inflamación y la integridad de la barrera comprometida (116). Como resultado, la elevación de estos metabolitos antiinflamatorios y antioxidantes (ácido protocatecúico, daidzeína, liquiritigenina y naringenina) debido a la intervención de Se puede reforzar las capacidades antiinflamatorias y antioxidantes del tejido huésped. La suplementación en pollos expuestos a OTA puede proteger el intestino mediante la modulación de metabolitos. Los estudios futuros deberían verificar aún más estos hallazgos y profundizar en el mecanismo subyacente de Se para mejorar la salud intestinal de manera más integral utilizando varios modelos experimentales. Además, la relación entre la microbiota intestinal y el microbioma intestinal justifica una mayor exploración.
5. Conclusión
En resumen, esta investigación investigó la influencia protectora de Nano-Se en pollos alimentados con OTA. Los resultados del análisis de la secuenciación del ARNr 16S y la metabolómica no dirigida indicaron que Nano-Se podría modular la comunidad de la microbiota intestinal y los metabolitos. La suplementación de Nano-Se tiene el potencial de mitigar las alteraciones en la microbiota intestinal causadas por la exposición a OTA a través de la promoción de poblaciones microbianas favorables y la supresión de bacterias patógenas. Además, el tratamiento con Nano-Se también influyó en el contenido de metabolitos cecales. Este trabajo ofrece un enfoque novedoso para investigar el papel protector de Nano-Se dentro de la enterotoxicidad inducida por OTA en pollos. Hasta donde sabemos, esta es la primera investigación que explora el impacto tóxico de la OTA en las aves de corral, especialmente en lo que respecta a la microbiota intestinal y las respuestas metabólicas intestinales. Nuestros resultados contribuyen a una comprensión más profunda de cómo la microbiota intestinal está involucrada en las interrupciones de la barrera intestinal inducidas por OTA y sugieren posibles medidas preventivas innovadoras contra tales disfunciones. En particular, nuestra investigación se limitó a los efectos de una sola micotoxina en los pollos, a pesar de que innumerables micotoxinas son frecuentes en la ganadería. Por lo tanto, se justifican estudios más completos para dilucidar los impactos de diversas micotoxinas en la microbiota intestinal y las capacidades contrarias de Nano-Se.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio / repositorios y los números de acceso se pueden encontrar en: https://www.ncbi.nlm.nih.gov/, PRJNA934281.
Declaración ética
El estudio en animales fue aprobado por el Comité de Cuidado y Uso de Animales de la Universidad de Yichun, Yichun, China. El estudio se realizó de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones del autor
MF y WH fueron responsables de la concepción y el diseño del estudio. MF y BL revisaron el manuscrito. MF, WH y BL participaron en la redacción del manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por el Proyecto de Ciencia y Tecnología del Departamento Provincial de Educación de Jiangxi (GJJ211632) y el Fondo de Investigación Científica Inicial de la Universidad de Yichun (3360119046).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Notas
1. ^https://cloud.majorbio.com/
2. ^http://www.hmdb.ca/
3. ^https://metlin.scripps.edu/
4. ^https://www.kegg.jp/kegg/pathway.html
Referencias
1. Liuzzi, VC, Fanelli, F, Tristezza, M, Haidukowski, M, Picardi, E, Manzari, C, et al. Análisis transcripcional de Acinetobacter sp. neg1 capaz de degradar Ocratoxina A. Microbiol frontal. (2017) 9:2162. DOI: 10.3389/fmicb.2016.02162
2. Kőszegi, T, y Poór, M. Ochratoxin A: interacciones moleculares, mecanismos de toxicidad y prevención a nivel molecular. Toxinas (Basilea). (2016) 15:111. doi: 10.3390/toxinas8040111
3. Smith, MC, Madec, S, Coton, E, and Hymery, N. Natural co-occurrence of mycotoxins in foods and feeds and their in vitro combined toxicological effects. Toxinas (Basilea). (2016) 8:94. doi: 10.3390/toxinas8040094
4. Dalia, AM, Loh, TC, Sazili, AQ, Jahromi, MF y Samsudin, AA. Efectos de la vitamina E, selenio inorgánico, selenio orgánico bacteriano y sus combinaciones sobre la respuesta de inmunidad en pollos de engorde. BMC Vet Res. (2018) 14:249. DOI: 10.1186/S12917-018-1578-X
5. Li, J, Shen, B, Nie, S, Duan, Z, y Chen, K. Una combinación de selenio y polisacáridos: potencial terapéutico prometedor. Pólipo de carbohidra. (2019) 15:163–73. doi: 10.1016/j.carbpol.2018.10.088
6. Xia, IF, Cheung, JS, Wu, M, Wong, KS, Kong, HK, Zheng, XT, et al. La nanopartícula dietética de quitosano-selenio (CTS-SeNP) mejora la inmunidad y la resistencia a las enfermedades en el pez cebra. Mariscos de pescado Immunol. (2019) 87:449–59. doi: 10.1016/j.fsi.2019.01.042
7. Marković, R, Ćirić, J, Starčević, M, Šefer, D, y Baltić, MŽ. Efectos de la fuente y el nivel de selenio en la dieta sobre la actividad de la glutatión peroxidasa, la distribución tisular del selenio y el rendimiento del crecimiento en aves de corral. Anim Health Res Rev. (2018) 19:166–76. doi: 10.1017/S1466252318000105
8. Dukare, S, Mir, NA, Mandal, AB, Dev, K, Begum, J, Tyagi, PK, et al. Estudio comparativo sobre las respuestas del pollo de engorde al ambiente cálido y húmedo suplementado con diferentes niveles dietéticos y fuentes de selenio. J Therm Biol. (2020) 88:102515. doi: 10.1016/j.jtherbio.2020.102515
9. Sheiha, AM, Abdelnour, SA, Abd El-Hack, ME, Khafaga, AF, Metwally, KA, Ajarem, JS, et al. Efectos de la suplementación dietética biológica o química sintetizada con nano-selenio en conejos en crecimiento expuestos al estrés térmico. Animales (Basilea). (2020) 10:430. doi: 10.3390/ani10030430
10. Yang, Z, Zhang, C, Wang, J, Celi, P, Ding, X, Bai, S, et al. Caracterización para microbiota intestinal de reproductoras de pollos de engorde con diferente tasa de puesta de huevos. Front Vet Sci. (2020) 7:599337. DOI: 10.3389/fvets.2020.599337
11. Liew, WP, y Mohd-Redzwan, S. Mycotoxin: its impact on gut health and microbiota. Las células frontales infectan microbiol. (2018) 26:60. DOI: 10.3389/fcimb.2018.00060
12. Elmassry, MM, Zayed, A, y Farag, MA. Homeostasis intestinal y microbiota bajo ataque: impacto de diferentes tipos de contaminantes alimentarios en la salud intestinal. Crit Rev Food Sci Nutr. (2022) 62:738–63. doi: 10.1080/10408398.2020.1828263
13. Robert, H, Payros, D, Pinton, P, Théodorou, V, Mercier-Bonin, M, y Oswald, IP. Impacto de las micotoxinas en el intestino: ¿son el moco y la microbiota nuevas dianas? J Toxicol Environ Health B Crit Rev. (2017) 20:249–75. doi: 10.1080/10937404.2017.1326071
14. Johnson, CH, Ivanisevic, J, y Siuzdak, G. Metabolomics: beyond biomarkers and towards mechanisms. Nat Rev Mol Cell Biol. (2016) 17:451–9. doi: 10.1038/nrm.2016.25
15. Saia, S, Fragasso, M, De Vita, P, y Beleggia, R. Metabolomics proporciona información valiosa para el estudio del trigo duro: una revisión. J Agric Food Chem. (2019) 67:3069–85. doi: 10.1021/acs.jafc.8b07097
16. He, H, An, F, Huang, Q, Kong, Y, He, D, Chen, L, et al. Efecto metabólico del hierro AOS en ratas con anemia por deficiencia de hierro utilizando metabolómica basada en LC-MS / MS. Comida Res Int. (2020) 130:108913. doi: 10.1016/j.foodres.2019.108913
17. Li, K, Cao, Z, Guo, Y, Tong, C, Yang, S, Long, M, et al. La levadura de selenio alivia la apoptosis inducida por ocratoxina A y el estrés oxidativo a través de la modulación de las vías de señalización PI3K / AKT y Nrf2 / Keap1 en los riñones de los pollos. Oxidativo Med Cell Longev. (2020) 18:4048706. DOI: 10.1155/2020/4048706
18. Li, H, Zhang, J, Xia, Y, Pan, W, y Zhou, D. Efecto antagónico del nano-selenio en la apoptosis de hepatocitos inducida por DEHP a través de la vía PI3K / AKT en el hígado de pollo. Ecotoxicol Environ Saf. (2021) 29:112282. doi: 10.1016/j.ecoenv.2021.112282
19. Qiao, L, Dou, X, Yan, S, Zhang, B y Xu, C. Las nanopartículas de selenio biogénico sintetizadas por Lactobacillus casei ATCC 393 alivian la disfunción de la barrera intestinal inducida por diquat en ratones C57BL / 6 a través de su actividad antioxidante. Función de alimentos. (2020) 11:3020–31. DOI: 10.1039/d0fo00132e
20. Liu, Y, Yang, Y, Dong, R, Zhang, Z, Jia, F, Yu, H, et al. Efecto protector de la selenometionina sobre la lesión intestinal inducida por la toxina T-2. Res Vet Sci. (2020) 132:439–47. doi: 10.1016/j.rvsc.2020.07.018
21. Ren, Z, He, H, Fan, Y, Chen, C, Zuo, Z, and Deng, J. Research progress on the toxic antagonism of selenium against mycotoxins. Biol Trace Elem Res. (2019) 190:273–80. DOI: 10.1007/S12011-018-1532-6
22. Wang, X, Zuo, Z, Zhao, C, Zhang, Z, Peng, G, Cao, S, et al. Papel protector del selenio dentro de las actividades de las enzimas antioxidantes en linfocitos esplénicos de lechones expuestos a deoxinivalenol. Environ Toxicol Pharmacol. (2016) 47:53–61. doi: 10.1016/j.etap.2016.09.003
23. Bhatti, SA, Khan, MZ, Saleemi, MK, y Hassan, ZU. La dieta Trichosporon mycotoxinivoron modula el rendimiento alterado inducido por ocratoxina-A, la capacidad antioxidante hepática y renal y la lesión tisular en pollos de engorde. Chem Biol interactúa. (2021) 347:109614. doi: 10.1016/j.cbi.2021.109614
24. Qing, H, Huang, S, Zhan, K, Zhao, L, Zhang, J, Ji, C, et al. Evaluación combinada de la toxicidad de la ocratoxina A y la aflatoxina B1 en la lesión renal y hepática, la inflamación inmune y la alteración de la microbiota intestinal a través del modelo de pollitas de alimentación en pareja. Frente Immunol. (2022) 13:920147. doi: 10.3389/fimmu.2022.920147
25. Yu, Z, Wu, F, Tian, J, Guo, X, and An, R. Protective effects of compound ammonium glycyrrhizin, L-arginine, silymarin and glucurolactone against liver damage induced by Ochratoxin A in primary chicken hepatocytes. Mol Med Rep. (2018) 18:2551–60. DOI: 10.3892/MMR.2018.9285
26. Li, P, Li, K, Zou, C, Tong, C, Sun, L, Cao, Z, et al. La levadura de selenio alivia la hepatotoxicidad inducida por ocratoxina A a través de la modulación de las vías de señalización PI3K / AKT y Nrf2 / Keap1 en pollos. Toxinas (Basilea). (2020) 12:143. doi: 10.3390/toxinas12030143
27. Tong, C, Li, P, Yu, LH, Li, L, Li, K, Chen, Y, et al. La levadura rica en selenio atenúa la lesión del intestino delgado inducida por ocratoxina A en pollos de engorde al activar la vía Nrf2 e inhibir la activación de NF-KB. J Funct Foods. (2020) 66:103784. doi: 10.1016/j.jff.2020.103784
28. Malekinezhad, P, Ellestad, LE, Afzali, N, Farhangfar, SH, Omidi, A, y Mohammadi, A. Evaluación de la eficacia de la berberina en la reducción de los efectos de la aflatoxina B1 y la ocratoxina A añadidas a las raciones de pollos de engorde machos. Poult Sci. (2021) 100:797–809. doi: 10.1016/j.psj.2020.10.040
29. Zhai, S, Zhu, Y, Feng, P, Li, M, Wang, W, Yang, L, et al. Ochratoxin A: its impact on poultry gut health and microbiota, an overview. Poult Sci. (2021) 100:101037. doi: 10.1016/j.psj.2021.101037
30. Yang, S, Li, L, Yu, L, Sun, L, Li, K, Tong, C, et al. La levadura enriquecida con selenio reduce las lesiones patológicas cecales e interviene cambios para la diversidad de la microbiota cecal causada por la ocratoxina-A en pollos de engorde. Alimentos Químicos Toxicol. (2020) 137:111139. doi: 10.1016/j.fct.2020.111139
31. Chen, Y, Zhao, S, Jiao, D, Yao, B, Yang, S, Li, P, et al. La astaxantina alivia la lesión e inflamación del ciego inducida por la ocratoxina A en ratones mediante la regulación de la diversidad de la microbiota cecal y la vía de señalización TLR4 / MyD88 / NF-κB. Oxidativo Med Cell Longev. (2021) 5:8894491. doi: 10.1155/2021/8894491
32. Zhang, H, Yan, A, Liu, X, Ma, Y, Zhao, F, Wang, M, et al. La melatonina mejora la inflamación hepática inducida por ocratoxina A, el estrés oxidativo y la mitofagia en ratones que participan en la microbiota intestinal y restauran la función de barrera intestinal. J Hazard Mater. (2021) 5:124489. doi: 10.1016/j.jhazmat.2020.124489
33. Li, L, Chen, Y, Jiao, D, Yang, S, Li, L, and Li, P. Protective effect of astaxanthin on Ochratoxin A-induced kidney injury to mice by regulation oxidative stress-related NRF2/KEAP1 pathway. Moléculas. (2020) 25:1386. doi: 10.3390/moléculas25061386
34. Zhang, Z, Wang, J, Wang, J, Xie, H, Zhang, Z, Shi, L, et al. La selenometionina atenúa la lesión del intestino delgado inducida por ocratoxina A en conejos mediante la activación de la vía Nrf2 e inhibiendo la activación de NF-κB. Ecotoxicol Environ Saf. (2023) 256:114837. doi: 10.1016/j.ecoenv.2023.114837
35. Izco, M, Vettorazzi, A, de Toro, M, Sáenz, Y, y Alvarez-Erviti, L. La exposición oral subcrónica a la ocratoxina A induce alteraciones de la microbiota intestinal en ratones. Toxinas (Basilea). (2021) 13:106. doi: 10.3390/toxinas13020106
36. Guerre, P. Mycotoxin and gut microbiota. Interacciones Toxinas (Basilea). (2020) 12:769. doi: 10.3390/toxinas12120769
37. Wang, W, Zhai, S, Xia, Y, Wang, H, Ruan, D, Zhou, T, et al. La ocratoxina A induce inflamación hepática: participación de la microbiota intestinal. Microbioma. (2019) 7:151. DOI: 10.1186/S40168-019-0761-Z
38. Zhai, SS, Ruan, D, Zhu, YW, Li, MC, Ye, H, Wang, WC, et al. El efecto protector de la curcumina sobre la lesión oxidativa hepática inducida por ocratoxina A en el pato está mediado por la modulación del metabolismo lipídico y la microbiota intestinal. Poult Sci. (2020) 99:1124–34. doi: 10.1016/j.psj.2019.10.041
39. Zhang, ZX, Xiang, H, Sun, GG, Yang, YH, Chen, C, and Li, T. Effect of dietary selenium intake on gut microbiota in older population in Enshi region. Genes Ambiente. (2021) 43:56. DOI: 10.1186/S41021-021-00220-3
40. Zhai, QX, Cen, S, Li, P, Tian, FW, Zhao, JX, Zhang, H, et al. Efectos de la suplementación dietética con selenio sobre la barrera intestinal y las respuestas inmunes asociadas con su modulación de la microbiota intestinal. Environ Sci Tech Let. (2018) 5:724–30. doi: 10.1021/acs.estlett.8b00563
41. Zhu, H, Lu, C, Gao, F, Qian, Z, Yin, Y, Kan, S, et al. Bifidobacterium longum DD98 enriquecido con selenio atenúa la toxicidad intestinal y hepática inducida por irinotecán in vitro e in vivo. Biomed Pharmacother. (2021) 143:112192. doi: 10.1016/j.biopha.2021.112192
42. Kang, R, Wang, W, Liu, Y, Huang, S, Xu, J, Zhao, L, et al. Las fuentes dietéticas de selenio alivian el desafío inmune inducido por Salmonella Enteritidis potencialmente a través de la mejora de la respuesta inmune del huésped y la microbiota intestinal en gallinas ponedoras. Frente Immunol. (2022) 9:928865. doi: 10.3389/fimmu.2022.928865
43. Qiao, L, Dou, X, Song, X, Chang, J, Pi, S, Zhang, X, et al. Efecto protector de las nanopartículas de selenio biogénico contra la toxicidad aguda inducida por diquat a través de la regulación de la microbiota intestinal y sus metabolitos. Alimentos Químicos Toxicol. (2022) 170:113480. doi: 10.1016/j.fct.2022.113480
44. Qiao, L, Yan, S, Dou, X, Song, X, Chang, J, Pi, S, et al. Las nanopartículas de selenio biogénico alivian el daño de la barrera epitelial intestinal mediante la regulación de la mitofagia mediada por el estrés del retículo endoplásmico. Oxidativo Med Cell Longev. (2022) 5:3982613. DOI: 10.1155/2022/3982613
45. Gangadoo, S, Dinev, I, Chapman, J, Hughes, RJ, Van, TTH, Moore, RJ, et al. Las nanopartículas de selenio en la alimentación de las aves de corral modifican la microbiota intestinal y aumentan la abundancia de Faecalibacterium prausnitzii. Aplicación Microbiol Biotechnol. (2018) 102:1455–66. doi: 10.1007/s00253-017-8688-4
46. Heida, FH, van Zoonen, AGJF, Hulscher, JBF, Te Kiefte, BJC, Wessels, R, Kooi, EMW, et al. Una microbiota intestinal necrotizante asociada a enterocolitis está presente en el meconio: resultados de un estudio prospectivo. Clin infectar dis. (2016) 62:863–70. doi: 10.1093/cid/ciw016
47. Shintouo, CM, Mets, T, Beckwee, D, Bautmans, I, Ghogomu, SM, Souopgui, J, et al. ¿La inflamación está influenciada por la microbiota en el intestino envejecido? Una revisión sistemática. Exp Gerontol. (2020) 141:111079. doi: 10.1016/j.exger.2020.111079
48. Zhou, Y, Xu, ZZ, He, Y, Yang, Y, Liu, L, Lin, Q, et al. La microbiota intestinal ofrece biomarcadores universales en todas las etnias en el diagnóstico de la enfermedad inflamatoria intestinal y la predicción de la respuesta al infliximab. mSystems. (2018) 3:E00188–17. doi: 10.1128/mSystems.00188-17
49. Yang, X, Liu, L, Chen, J, and Xiao, A. Response of intestinal bacterial flora to the long-term feeding of aflatoxin B1 (AFB1) in ratones. Toxinas (Basilea). (2017) 9:317. DOI: 10.3390/toxinas9100317
50. Wang, J, Tang, L, Glenn, TC y Wang, JS. La aflatoxina B1 indujo cambios en la composición de las comunidades microbianas intestinales de ratas macho F344. Toxicol Sci. (2016) 150:54–63. doi: 10.1093/toxsci/kfv259
51. Lucke, A, Böhm, J, Zebeli, Q, y Metzler-Zebeli, BU. La contaminación por deoxinivalenol en la dieta y el desafío oral de lipopolisacáridos alteran la microbiota cecal de pollos de engorde. Microbiol frontal. (2018) 25:804. DOI: 10.3389/fmicb.2018.00804
52. Lin, R, Sun, Y, Mu, P, Zheng, T, Mu, H, Deng, F, et al. La suplementación con Lactobacillus rhamnosus GG modula la microbiota intestinal para promover la producción de butirato, protegiendo contra la exposición al deoxinivalenol en ratones desnudos. Biochem Pharmacol. (2020) 175:113868. doi: 10.1016/j.bcp.2020.113868
53. Du, G, Guo, Q, Yan, X, Chen, H, Yuan, Y, and Yue, T. Potential protective mechanism of Tibetan kefir underlying gut-derived liver injury induced by Ochratoxin A. Food Funct. (2022) 13:11690–704. DOI: 10.1039/d2fo02360a
54. Hill, C, Guarner, F, Reid, G, Gibson, GR, Merenstein, DJ, Pot, B, et al. La asociación científica internacional de probióticos y prebióticos declaración de consenso sobre el alcance y el uso apropiado para el término probiótico. Nat Rev Gastroenterol Hepatol. (2014) 11:506–14. doi: 10.1038/nrgastro.2014.66
55. Marco, ML, Heeney, D, Binda, S, Cifelli, CJ, Cotter, PD, Foligné, B, et al. Beneficios para la salud de los alimentos fermentados: microbiota y más allá. Curr Opin Biotechnol. (2017) 44:94–102. doi: 10.1016/j.copbio.2016.11.010
56. Belenguer, A, Holtrop, G, Duncan, SH, Anderson, SE, Calder, AG, Flint, HJ, et al. Tasas de producción y utilización de lactato por comunidades microbianas del colon humano. FEMS Microbiol Ecol. (2011) 77:107–19. doi: 10.1111/j.1574-6941.2011.01086.x
57. Yang, G, Hong, E, Oh, S, and Kim, E. Non-viable Lactobacillus johnsonii JNU3402 protege contra la obesidad inducida por la dieta. Alimentos. (2020) 9:1494. doi: 10.3390/foods9101494
58. Bolte, LA, Vich Vila, A, Imhann, F, Collij, V, Gacesa, R, Peters, V, et al. Los patrones dietéticos a largo plazo están asociados con características proinflamatorias y antiinflamatorias para el microbioma intestinal. Intestino. (2021) 70:1287–98. DOI: 10.1136/GuTJNL-2020-322670
59. Ouethrani, M, Van de Wiele, T, Verbeke, E, Bruneau, A, Carvalho, M, Rabot, S, et al. Destino metabólico de la ocratoxina A como contaminante del café en un simulador dinámico para el colon humano. Química de alimentos. (2013) 141:3291–300. doi: 10.1016/j.foodchem.2013.05.157
60. Orsolic, N, Jembrek Jazvinscak, M, y Terzic, S. La miel y la quercetina reducen el daño del ADN inducido por la ocratoxina A en el hígado y el riñón a través de la modulación de la microflora intestinal. Alimentos Agric Immunol. (2017) 28:812–33. doi: 10.1080/09540105.2017.1313819
61. Wang, Y, Zhang, J, Wang, Y, Wang, K, Wei, H, and Shen, L. Isolation and characterization for Bacillus cereus BC7 strain, which is capable of zearalenone removal and intestinal flora modulation in ratones. Toxicon. (2018) 1:9–20. doi: 10.1016/j.toxicon.2018.09.005
62. Taranu, I, Marin, DE, Pistol, GC, Motiu, M, and Pelinescu, D. Induction of pro-inflammatory gene expression by Escherichia coli and mycotoxin zearalenone contamination and protection by a Lactobacillus mix in porcine IPEC-1 cells. Toxicon. (2015) 97:53–63. doi: 10.1016/j.toxicon.2015.01.016
63. Wang, YL, Wang, BJ, Liu, M, Jiang, KY, Wang, MQ y Wang, L. La aflatoxina B1 (AFB1) indujo la desregulación de la microbiota intestinal y el daño del sistema antioxidante en el camarón blanco del Pacífico (Litopenaeus vannamei). Acuicultura. (2018) 495:940–7. doi: 10.1016/j.aquaculture.2018.06.065
64. Flint, HJ, Duncan, SH, Scott, KP, y Louis, P. Links between diet, gut microbiota composition and gut metabolism. Proc Nutr Soc. (2015) 74:13–22. doi: 10.1017/S0029665114001463
65. Reeves, AE, Koenigsknecht, MJ, Bergin, IL, and Young, VB. Supresión de Clostridium difficile en tractos gastrointestinales de ratones libres de gérmenes inoculados con un aislado murino de la familia Lachnospiraceae. Infectar inmune. (2012) 80:3786–94. doi: 10.1128/IAI.00647-12
66. Oliphant, K, Ali, M, D’Souza, M, Hughes, PD, Sulakhe, D, Wang, AZ, et al. La integración de Bacteroidota y Lachnospiraceae en el microbioma intestinal en momentos clave de la vida temprana está relacionada con el neurodesarrollo infantil. Microbios intestinales. (2021) 13:1997560. DOI: 10.1080/19490976.2021.1997560
67. Wang, S, Yang, J, Zhang, B, Zhang, L, Wu, K, Yang, A, et al. Posible vínculo entre la microbiota intestinal y el rechazo de la alimentación inducida por deoxinivalenol en lechones destetados. J Agric Food Chem. (2019) 67:4976–86. doi: 10.1021/acs.jafc.9b01037
68. Pérez-Reytor, D, Puebla, C, Karahanian, E, and García, K. Use of short-chain fatty acids for the recovery for intestinal epithelial barrier affected by bacterial toxins. Frente Physiol. (2021) 24:650313. DOI: 10.3389/FPHYS.2021.650313
69. Von-Hafe, M, Borges-Canha, M, Vale, C, Leite, AR, Sérgio Neves, J, Carvalho, D, et al. Enfermedad del hígado graso no alcohólico y ejes endocrinos: una revisión de alcance. Metabolitos. (2022) 12:298. doi: 10.3390/metabo12040298
70. Vang, S, Cochran, P, Sebastian Domingo, J, Krick, S, y Barnes, JW. La glicobiología de la hipertensión arterial pulmonar. Meta. (2022) 12:316. doi: 10.3390/metabo12040316
71. Lin, XY, Wang, LM, Zhao, JT, He, L, Cui, L, Gao, Y, et al. Evaluación de nanoseguridad a través de heces: una comparación entre nanopartículas de selenio y selenita en ratas. Nano hoy. (2021) 36:101010. doi: 10.1016/j.nantod.2020.101010
72. Callejón-Leblic, B, Selma-Royo, M, Collado, MC, Gómez-Ariza, JL, Abril, N, and García-Barrera, T. Untargeted gut metabolomics to deepve the interplay between selenium supplementation and gut microbiota. J Proteome Res. (2022) 21:758–67. doi: 10.1021/acs.jproteome.1c00411
73. Thakur, K, Tomar, SK, Singh, AK, Mandal, S, y Arora, S. Riboflavina y salud: una revisión de la investigación humana reciente. Crit Rev Food Sci Nutr. (2017) 257:3650–60. doi: 10.1080/10408398.2016.1145104
74. Saedisomeolia, A, y Ashoori, M. Riboflavin in human health: a review of current evidences. Adv Food Nutr Res. (2018) 83:57–81. doi: 10.1016/bs.afnr.2017.11.002
75. Suwannasom, N, Kao, I, Pruß, A, Georgieva, R, and Baumler, H. Riboflavin: the health benefits of a forgotten natural vitamin. Int J Mol Sci. (2020) 21:950. DOI: 10.3390/IJMS21030950
76. Olfat, N, Ashoori, M, y Saedisomeolia, A. La riboflavina es un antioxidante: una actualización de revisión. H. J Nutr. (2022) 128:1887–95. doi: 10.1017/S0007114521005031
77. Yates, CA, Evans, GS, Pearson, T, y Powers, HJ. La ausencia de riboflavina luminal perturba el desarrollo postnatal temprano para el tracto gastrointestinal. Dig Dis Sci. (2003) 48:1159–64. doi: 10.1023/a:1023785200638
78. Powers, HJ, Weaver, LT, Austin, S, y Beresford, JK. Un mecanismo intestinal propuesto para el efecto de la deficiencia de riboflavina en la pérdida de hierro en ratas. H. J Nutr. (1993) 69:553–61. DOI: 10.1079/BJN19930055
79. Lee, ES, Corfe, BM, y Powers, HJ. El agotamiento de la riboflavina de las células intestinales in vitro conduce a una generación de energía deteriorada y un mayor estrés oxidativo. Eur J Nutr. (2013) 52:1513–21. DOI: 10.1007/S00394-012-0458-6
80. Tang, J, Wen, Z, Guo, Z, Huang, W, Guo, Y, and Xie, M. La suplementación dietética con riboflavina mejora el rendimiento de crecimiento y el estado antioxidante de los patos blancos iniciadores de Pekin alimentados con dietas de harina de maíz y soja. Livest Sci. (2014) 170:131e6. doi: 10.1016/j.livsci.2014.10.016
81. Biagi, E, Mengucci, C, Barone, M, Picone, G, Lucchi, A, Celi, P, et al. Efectos de la suplementación con vitamina B2 en la microbiota y el metaboloma de los pollos de engorde. Microorganismos. (2020) 28:1134. doi: 10.3390/microorganismos8081134
82. Pan, F, Xu, X, Zhang, LL, Luo, HJ, Chen, Y, Long, L, et al. La deficiencia de riboflavina en la dieta induce inestabilidad genómica de las células escamosas esofágicas que se asocia con la disbiosis de la microbiota intestinal en ratas. Función de alimentos. (2020) 11:10070–83. DOI: 10.1039/d0fo01944e
83. Pan, F, Zhang, LL, Luo, HJ, Chen, Y, Long, L, Wang, X, et al. La deficiencia de riboflavina en la dieta induce ariboflavinosis y atrofia epitelial esofágica en asociación con la modificación de la microbiota intestinal en ratas. Eur J Nutr. (2021) 60:807–20. DOI: 10.1007/S00394-020-02283-4
84. Zhu, YY, Thakur, K, Feng, JY, Zhang, JG, Hu, F, Céspedes-Acuña, CL, et al. La leche de soja bioenriquecida con riboflavina alivia la lesión hepática mediada por el estrés oxidativo, la inflamación intestinal y la modificación de la microbiota intestinal en ratones B2 de agotamiento-repleción. J Agric Food Chem. (2022) 70:3818–31. doi: 10.1021/acs.jafc.2c00117
85. Patel, M, Narke, D, Kurade, M, Frey, KM, Rajalingam, S, Siddiquee, A, et al. La activación inducida por limoneno de los receptores de adenosina A2A reduce la inflamación y la reactividad de las vías respiratorias en un modelo de ratón de asma. Señal purinérgica. (2020) 16:415–26. DOI: 10.1007/S11302-020-09697-Z
86. Bouzenna, H, Hfaiedh, N, Giroux-Metges, MA, Elfeki, A, and Talarmin, H. Potential protective effects of alpha-pinene against cytotoxicity caused by aspirin within IEC-6 cells. Biomed Pharmacother. (2017) 93:961–8. doi: 10.1016/j.biopha.2017.06.031
87. Kim, DS, Lee, HJ, Jeon, YD, Han, YH, Kee, JY, Kim, HJ, et al. El alfa-pineno exhibe actividad antiinflamatoria a través de la supresión de MAPK y la vía NF-κB en macrófagos peritoneales de ratón. Am J Chin Med. (2015) 43:731–42. doi: 10.1142/S0192415X15500457
88. Wang, H, Xiao, Y, Xu, C, Cao, Y, Jing, P, Wu, S, et al. Los análisis integrados de metabolómica y transcriptómica revelan mecanismos metabólicos en células epiteliales intestinales porcinas bajo estrés por zearalenona. J Agric Food Chem. (2022) 70:6561–72. doi: 10.1021/acs.jafc.2c01107
89. Kim, MH, y Kim, H. El papel de la glutamina dentro del intestino y su implicación en las enfermedades intestinales. Int J Mol Sci. (2017) 18:1051. DOI: 10.3390/IJMS18051051
90. Xue, GD, Barekatain, R, Wu, SB, Choct, M, y Swick, RA. La suplementación dietética con L-glutamina mejora el rendimiento del crecimiento, la morfología intestinal y los índices bioquímicos séricos de pollos de engorde durante el desafío de enteritis necrótica. Poult Sci. (2018) 97:1334–41. doi: 10.3382/ps/pex444
91. Xing, S, Zhang, B, Lin, M, Zhou, P, Li, J, Zhang, L, et al. Efectos de la suplementación con alanil-glutamina sobre la barrera mucosa del intestino delgado en lechones destetados. Asian-Australas J Anim Sci. (2017) 30:236–45. doi: 10.5713/ajas.16.0077
92. Rao, RK, Li, L, Baker, RD, Baker, SS, and Gupta, A. Glutathione oxidation and PTPase inhibition by hydrogen peroxide in Caco-2 cell monolayer. Am J Physiol Gastrointest Liver Physiol. (2000) 279:G332–40. doi: 10.1152/ajpgi.2000.279.2.G332
93. Wu, QJ, Zheng, XC, Wang, T, y Zhang, TY. Efectos de la oridonina en las células inmunes, el equilibrio Th1 / Th2 y la expresión de BLys dentro del bazo de pollos de engorde desafiados con Salmonella pullorum. Res Vet Sci. (2018) 119:262–7. doi: 10.1016/j.rvsc.2018.07.008
94. Toraya, T, Oka, T, Ando, M, Yamanishi, M, and Nishihara, H. Novel pathway for utilization of cyclopropanecarboxylate by Rhodococcus rhodochrous. Aplicación Environ Microbiol. (2004) 70:224–8. doi: 10.1128/AEM.70.1.224-228.2004
95. Reis, B, Martins, M, Barreto, B, Milhazes, N, Garrido, EM, Silva, P, et al. Relación estructura-propiedad-actividad de ácidos fenólicos y derivados. Ésteres alquilílicos del ácido protocatecúico. J Agric Food Chem. (2010) 58:6986–93. DOI: 10.1021/JF100569J
96. Pacheco-Ordaz, R, Wall-Medrano, A, Goñi, MG, Ramos-Clamont-Montfort, G, Ayala-Zavala, JF, and González-Aguilar, GA. Effect of phenolic compounds on the growth of selected probiotic and pathogenic bacteria. Lett Appl Microbiol. (2018) 66:25–31. DOI: 10.1111/LAM.12814
97. Adedara, IA, Okpara, ES, Busari, EO, Omole, O, Owumi, SE, y Farombi, EO. El ácido protocatecúico dietético anula la disfunción reproductiva masculina en ratas diabéticas inducidas por estreptozotocina a través de la supresión del daño oxidativo, la inflamación y la actividad de la caspasa-3. Eur J Pharmacol. (2019) 15:30–42. doi: 10.1016/j.ejphar.2019.01.033
98. Tan, J, Li, Y, Hou, DX y Wu, S. Los efectos y mecanismos de la cianidina-3-glucósido y sus metabolitos fenólicos en el mantenimiento de la integridad intestinal. Antioxidantes (Basilea). (2019) 8:479. DOI: 10.3390/antiox8100479
99. Wang, Y, Wang, Y, Wang, B, Mei, X, Jiang, S, and Li, W. Protocatechuic acid improved growth performance, meat quality, and intestinal health of Chinese yellow-feathered broilers. Poult Sci. (2019) 98:3138–49. DOI: 10.3382/ps/pez124
100. Hu, R, He, Z, Liu, M, Tan, J, Zhang, H, Hou, DX, et al. El ácido protocatecúico dietético mejora la inflamación y regula al alza las proteínas de la unión estrecha intestinal mediante la modulación de la microbiota intestinal en lechones desafiados por LPS. J Anim Sci Biotechnol. (2020) 9:92. DOI: 10.1186/S40104-020-00492-9
101. Wang, F, Chen, Y, Hu, H, Liu, X, Wang, Y, Saleemi, MK, et al. Ácido protocatecúico: un nuevo agente desintoxicante de fumonisina B1 para la industria avícola. Front Vet Sci. (2022) 26:923238. doi: 10.3389/fvets.2022.923238
102. Wu, T, Fan, T, and Xie, Y. Antagonism of cyanamide-3-O-glucoside and protocatechuic acid on aflatoxin B1-induced toxicity in zebrafish larva (Danio rerio). Toxicon. (2022) 216:139–47. doi: 10.1016/j.toxicon.2022.06.009
103. He, L, Zhang, S, Luo, C, Sun, Y, Lu, Q, Huang, L, et al. Tés funcionales de los tallos de Penthorum chinense Pursh.: componentes fenólicos, actividad antioxidante y hepatoprotectora. Alimentos vegetales Hum Nutr. (2019) 74:83–90. DOI: 10.1007/S11130-018-0701-2
104. Dou, W, Zhang, J, Sun, A, Zhang, E, Ding, L, Mukherjee, S, et al. Efecto protector de la naringenina contra la colitis experimental mediante la supresión de la señalización del receptor tipo toll 4/NF-κB. H. J Nutr. (2013) 110:599–608. doi: 10.1017/S0007114512005594
105. Kim, JS, y Jobin, C. El flavonoide luteolina previene la señalización y la expresión génica de NF-kappaB inducida por lipopolisacáridos al bloquear la actividad de la quinasa IkappaB en las células epiteliales intestinales y las células dendríticas derivadas de la médula ósea. Inmunología. (2005) 115:375–87. doi: 10.1111/j.1365-2567.2005.02156.x
106. Fernandes, I, Pérez-Gregorio, R, Soares, S, Mateus, N, and de Freitas, V. Wine flavonoids in health and disease prevention. Moléculas. (2017) 22:292. doi: 10.3390/moléculas22020292
107. Shi, SR, Gu, H, Chang, LL, Wang, ZY, Tong, HB y Zou, JM. Evaluación de la seguridad de la daidzeína en gallinas ponedoras: parte I. Efectos sobre el rendimiento de la puesta, los parámetros clínicos de la sangre y el desarrollo de órganos. Alimentos Químicos Toxicol. (2013) 55:684–8. doi: 10.1016/j.fct.2013.01.009
108. Liu, HY, y Zhang, CQ. Efectos de la daidzeína en la expresión de ácido ribonucleico mensajero de los receptores de gonadotropina en los folículos ováricos de pollo. Poult Sci. (2008) 87:541–5. DOI: 10.3382/PS.2007-00274
109. Xiao, YQ, Shao, D, Sheng, ZW, Wang, Q, y Shi, SR. Una mezcla de daidzeína y hierbas chinas aumenta la producción de huevos y la fuerza de la cáscara de huevo, así como la ca del plasma sanguíneo, P, las enzimas antioxidantes y los niveles de hormona luteinizante en gallinas ponedoras marrones después del pico. Poult Sci. (2019) 98:3298–303. doi: 10.3382/ps/pez178
110. Gao, X, Mu, P, Zhu, X, Chen, X, Tang, S, Wu, Y, et al. Doble función de una nueva bacteria, Slackia sp. D-G6: desintoxicante de deoxinivalenol y producción del análogo natural del estrógeno, equol. Toxinas (Basilea). (2020) 12:85. doi: 10.3390/toxinas12020085
Resumen de PubMed | Texto completo de CrossRef | Google Académico
111. Peng, F, Du, Q, Peng, C, Wang, N, Tang, H, Xie, X, et al. Una revisión: la farmacología de la isoliquiritigenina. Phytother Res. (2015) 29:969–77. DOI: 10.1002/PTR.5348
112. Yu, J, Wang, L, Walzem, RL, Miller, EG, Pike, LM, and Patil, BS. Actividad antioxidante de limonoides, flavonoides y cumarinas cítricas. J Agric Food Chem. (2005) 53:2009–14. DOI: 10.1021/JF0484632
113. Mershiba, SD, Dassprakash, MV, y Saraswathy, SD. Efecto protector de la naringenina sobre la disfunción hepática y renal y el estrés oxidativo en ratas intoxicadas con arsénico. Mol Biol Rep. (2013) 40:3681–91. DOI: 10.1007/S11033-012-2444-8
114. Marin, DE, Pistol, GC, Gras, MA, Palade, ML y Taranu, I. Efecto comparativo de la ocratoxina A sobre los parámetros de inflamación y estrés oxidativo en intestino y riñón de lechones. Regul Toxicol Pharmacol. (2017) 89:224–31. doi: 10.1016/j.yrtph.2017.07.031
115. Rašić, D, Micek, V, Klarić, MS, y Peraica, M. Oxidative stress as a mechanism of combined OTA and CTN toxicity in rat plasma, liver and kidney (Estrés oxidativo como mecanismo de toxicidad combinada de OTA y CTN en plasma, hígado y riñón de rata). Hum Exp Toxicol. (2019) 38:434–45. doi: 10.1177/0960327118819049
116. Libertucci, J, Dutta, U, Kaur, S, Jury, J, Rossi, L, Fontes, ME, et al. Diferencias relacionadas con la inflamación en la microbiota asociada a la mucosa y la función de barrera intestinal en la enfermedad de Crohn colónica. Am J Physiol Gastrointest Liver Physiol. (2018) 315:G420–31. doi: 10.1152/ajpgi.00411.2017
Palabras clave: nano-selenio, comunidad microbiana de ciego, metabolómica, pollos, ocratoxina A
Cita: Fang M, Hu W y Liu B (2023) Efectos del nano-selenio en la comunidad microbiana de ciego y metabolómica en pollos desafiados con ocratoxina A. Frente. Vet. 10:1228360. doi: 10.3389/fvets.2023.1228360
Recibido: 24 de mayo de 2023; Aprobado: 22 de agosto de 2023;
Publicado: 05 septiembre 2023.
Editado por:
Yongpeng Guo, Universidad Agrícola de Henan, China
Revisado por:
Sabreen Ezzat Fadl, Universidad Matrouh, Egipto
Ning Jiao, Universidad Agrícola de Shandong, China Xu Yang, Universidad Agrícola de Henan, China
Derechos de autor © 2023 Fang, Hu y Liu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Manxin Fang, manxinfang@jxycu.edu.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía