Efectos diferenciales del aislamiento social en el desarrollo de oligodendrocitos en diferentes regiones del cerebro

Efectos diferenciales del aislamiento social en el desarrollo de oligodendrocitos en diferentes regiones del cerebro: conocimientos de un modelo canino
 Huilin Hong1,
Huilin Hong1,  Chao Guo2,3,
Chao Guo2,3,  Xueru Liu4,5,
Xueru Liu4,5,  Liguang Yang5,6,
Liguang Yang5,6,  Wei Ren1,5,
Wei Ren1,5,  Hui Zhao1,
Hui Zhao1,  Yuan Li7,
Yuan Li7,  Zhongyin Zhou3,
Zhongyin Zhou3,  Sin Man Lam1,
Sin Man Lam1,  Jidong Mi7,
Jidong Mi7,  Zhentao Zuo4,5,
Zhentao Zuo4,5,  Cirong Liu8,9,
Cirong Liu8,9,  Guo-Dong Wang3,
Guo-Dong Wang3,  Yan Zhuo4,5,
Yan Zhuo4,5,  Ya-Ping Zhang3,
Ya-Ping Zhang3,  Yixue Li6,
Yixue Li6,  Guanghou Shui1,5,
Guanghou Shui1,5,  Yong Q. Zhang1,5* y
Yong Q. Zhang1,5* y  Ying Xiong1*
Ying Xiong1*- 1Laboratorio Estatal Clave de Biología Molecular y del Desarrollo, Instituto de Genética y Biología del Desarrollo, Academia China de Ciencias, Beijing, China
- 2División de Ciencias de la Vida y Medicina, Facultad de Ciencias de la Vida, Universidad de Ciencia y Tecnología de China, Hefei, China
- 3Laboratorio Estatal Clave de Recursos Genéticos y Evolución, Instituto de Zoología de Kunming, Academia China de Ciencias, Kunming, China
- 4Laboratorio Estatal Clave de Ciencias Cerebrales y Cognitivas, Instituto de Biofísica, Academia China de Ciencias, Beijing, China
- 5Facultad de Ciencias de la Vida, Universidad de la Academia China de Ciencias, Beijing, China
- 6Bio-Med Big Data Center, Laboratorio clave de biología computacional, CAS-MPG Partner Institute for Computational Biology, Shanghai Institute of Nutrition and Health, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences, Shanghai, China
- 7Beijing Sinogene Biotechnology Co., Ltd., Beijing, China
- 8Instituto de Neurociencia, Centro de Excelencia en Ciencia del Cerebro y Tecnología de Inteligencia, Academia China de Ciencias, Shanghai, China
- 9Shanghai Center for Brain Science and Brain-Inspired Intelligence Technology, Shanghai, China
El aislamiento social (SI) ejerce diversos efectos adversos sobre la estructura y función cerebral en humanos. Para obtener una idea de los mecanismos subyacentes a estos efectos, realizamos un análisis sistemático de múltiples regiones cerebrales de perros socialmente aislados y alojados en grupos, cuyo cerebro y comportamiento son similares a los humanos. Nuestro análisis transcriptómico reveló una expresión reducida de genes relacionados con la mielina específicamente en la sustancia blanca de la corteza prefrontal (PFC) después del SI durante la etapa juvenil. A pesar de estos cambios en la expresión génica, la organización de la fibra de mielina en PFC se mantuvo sin cambios. Sorprendentemente, observamos oligodendrocitos más maduros y haces de mielina más gruesos en la corteza parietal somatosensorial en perros socialmente aislados, lo que puede estar relacionado con una mayor expresión de ADORA2A, un gen conocido por promover la maduración de oligodendrocitos. Además, encontramos una expresión reducida de los componentes estructurales de la barrera hematoencefálica (BBB) Aquaporin-4, Occludin, y Claudin1 tanto en PFC como en cortezas parietales, lo que indica una interrupción de BBB después de SI. De acuerdo con la interrupción de la BBB, los esfingolípidos relacionados con la mielina aumentaron en el líquido cefalorraquídeo en el grupo socialmente aislado. Estos hallazgos inesperados muestran que el SI induce alteraciones distintas en el desarrollo de oligodendrocitos y una interrupción compartida en la integridad de la BHE en diferentes cortezas, lo que demuestra el valor de los perros como un modelo animal complementario para descubrir los mecanismos moleculares subyacentes a la disfunción cerebral inducida por el SI.
Introducción
Las interacciones sociales son necesidades humanas básicas, análogas a otras necesidades básicas como la nutrición o el sueño (Baumeister y Leary, 1995; Cacioppo et al., 2011; Tomova et al., 2020), que ofrecen seguridad y protección, apoyan la supervivencia de la descendencia, reducen la necesidad de gasto de energía y proporcionan una forma de recompensa social (Eisenberger, 2012). La interacción social es importante para las personas de todas las edades; la falta o la reducción de la interacción social, como las medidas obligatorias durante la pandemia de COVID-19, conduce a déficits socioemocionales y cognitivos en la vida temprana (<5 años) y una mayor incidencia de trastornos psiquiátricos como la depresión y la ansiedad durante la adolescencia y las etapas adultas (Rutter et al., 2007; Cacioppo et al., 2011; Kennedy et al., 2016; Sonuga-Barke et al., 2017; Loades et al., 2020; Deoni y otros, 2021; Pancani et al., 2021; Taheri Zadeh y otros, 2021; Shuffrey et al., 2022). La resonancia magnética y el análisis de neuroimagen de tensor de difusión revelaron una disminución de la integridad de la sustancia blanca en regiones específicas del cerebro, incluida la corteza prefrontal (PFC), en niños que experimentaron privación social temprana (Eluvathingal et al., 2006; Govindan y otros, 2010; Bick et al., 2015).
Los mecanismos subyacentes a los cambios estructurales y conductuales cerebrales inducidos por el IS se han estudiado principalmente en PFC utilizando modelos de roedores (Liu et al., 2012; Makinodan et al., 2012; Yamamuro et al., 2018; Xiong et al., 2023). Por ejemplo, el SI conduce a una expresión reducida del ligando ErbB3 neuregulina-1. La vía de señalización NRG1-ErbB, que es importante para la maduración de OL, está relacionada con la reducción de la mielinización medial de PFC en respuesta al SI en ratones jóvenes (Makinodan et al., 2012). Dado que la progresión del desarrollo de varios procesos, incluida la mielinización de diferentes regiones del cerebro, es distinta (Hong et al., 2022), diferentes regiones cerebrales pueden reaccionar de manera diferente al SI. Descubrir esos cambios moleculares inducidos por IS en diferentes regiones del cerebro es fundamental para comprender la disfunción cerebral inducida por SI. Sin embargo, no está claro cómo la IS afecta a diferentes regiones del cerebro a nivel molecular y celular.
Los perros domésticos (Canis familiaris), con una estructura cerebral girocefálica similar a la de los humanos, han desarrollado habilidades complejas y eficientes de procesamiento emocional y social entre especies durante una larga historia de coevolución con humanos (Muller et al., 2015). Además, nuestro trabajo reciente ha revelado patrones de expresión de proteínas interregionales conservados, especialmente proteínas relacionadas con la mielinización, en el cerebro entre perro y humano (Hong et al., 2022). El perro doméstico se ha utilizado durante décadas como modelos experimentales en estudios de neurociencia, cognición, genética evolutiva y enfermedades como trastornos neurológicos y psiquiátricos (Adams et al., 2000; Wang y otros, 2013; Bunford et al., 2017; Liu et al., 2018; Cao et al., 2021). En particular, los perros se consideran modelos efectivos para estudiar los comportamientos sociales y los trastornos mentales causados por experiencias adversas de la vida temprana (Berns y Cook, 2016; Ogata, 2016; Bunford et al., 2017; Dietz et al., 2018).
Para investigar los mecanismos subyacentes a la disfunción cerebral inducida por SI, realizamos análisis transcriptómicos e inmunoquímicos de varias regiones cerebrales de perros socialmente aislados y alojados en grupos durante la etapa juvenil. Encontramos que el SI disminuyó la expresión génica relacionada con la mielina específicamente en la sustancia blanca PFC, pero la organización de la fibra de mielina permaneció sin cambios. Sin embargo, el SI aumentó el grosor de los haces de mielina que contienen más fibras en la corteza parietal somatosensorial (Par), posiblemente debido a oligodendrocitos más maduros. SI también interrumpió la integridad de la barrera hematoencefálica (BBB) tanto en PFC como en Par, como lo demuestra la expresión reducida de las proteínas componentes de BBB. Consistentemente, los lípidos relacionados con la mielina aumentaron significativamente en el líquido cefalorraquídeo (LCR). Estos hallazgos arrojan nueva luz sobre los mecanismos moleculares y celulares subyacentes a los efectos perjudiciales de la IS en el cerebro.
Materiales y métodos
Perros y condiciones de alojamiento
Se obtuvieron Beagles machos sanos de raza pura de Beijing Marshall Biotechnology Co., seis perros Beagle machos (peso 2.9 ± 0.3 kg) de tres camadas diferentes se mantuvieron en un ciclo natural de luz-oscuridad de 12 horas (2 perros en cada jaula). Después del destete en el día postnatal 51 (P51), 6 compañeros de camada fueron criados juntos en una jaula hasta P60. Luego, tres machos, uno por camada, fueron alojados juntos en una jaula. Los otros tres fueron alojados individualmente en un lugar tranquilo dentro de un edificio con actividad humana mínima durante 4 semanas.
Adquisición y análisis de datos de resonancia magnética
Cinco beagles (3 compañeros de camada socialmente aislados y 2 alojados en grupo de los perros socialmente aislados; uno de los 3 perros alojados en grupo tenía un chip implantado debajo de su piel, lo que lo hacía inadecuado para el análisis de resonancia magnética; edad 96.6 ± 0.49 días, peso 4.8 ± 1.59 kg) fueron escaneados en escáner de resonancia magnética 3T (MAGNETOM Prisma, Siemens Healthcare, Erlangen, Alemania) con una bobina de RF Tx / Rx de 4 canales hecha en casa para obtener resonancia magnética estructural (sMRI) y resonancia magnética de difusión (dMRI) de alta calidad. Para la resonancia magnética múltiple, las imágenes ponderadas en T2 se adquirieron en la misma posición y resolución espacial que las imágenes ponderadas en T1 utilizando la secuencia SPACE, que utilizó diferentes ángulos de giro para optimizar los contrastes para el muestreo T2. Los principales parámetros de escaneo: FOV = 128 × 128 mm2; TE = 3,68 ms; TR = 2.370 ms; TI = 1.030 ms; FA = 8°; Matriz de datos de adquisición Tamaño 256 × 256. DWI se adquirió utilizando una secuencia EPI con aceleración multibanda. Los principales parámetros de escaneo fueron: vóxel 1,2 mm isotrópico, campo de visión = 120 × 120 mm2; TE = 86 ms; TR = 7.000 ms; FA = 90°; Tamaño de matriz de datos de adquisición 80 × 80, 64 gradientes de difusión en diferentes direcciones y cuatro valores B de 0 s/mm2, 1.000 s/mm2, 2.000 s/mm2, y 3.000 s/mm2respectivamente. Cada escaneo duró entre 30 y 45 minutos. Para los conjuntos de datos de difusión, las imágenes de difusión originales se procesaron previamente utilizando FSL, incluyendo movimiento y corriente de Foucault corregidos. Los mapas FA, MD, RD y AD se obtuvieron utilizando algoritmos «dtifit». Los mapas de difusión FA, AD y RD de las regiones PFC y Par en materia gris cortical y sustancia blanca se compararon entre el grupo SI y Ctrl utilizando una prueba t no pareada de dos muestras.
Disección cerebral
Los cerebros fueron pesados y colocados con el lado ventral hacia arriba sobre una placa de vidrio enfriada sobre hielo. Al recibir el cerebro del perro, el tejido fresco se incrustó inmediatamente en una matriz de gelatina utilizando un molde de fabricación propia (patente No. ZL 2022 2 0238374.7). El cerebro se colocó para la sección coronal. Para verificar los artefactos técnicos, se utilizaron modelos cerebrales de impresión 3D como prefabricación. La primera sección rostral se obtuvo del bulbo olfatorio. La cuadrícula de referencia estereotáxica fue de intervalos de 2 mm. Las secciones se dividieron en hemisferios izquierdo y derecho cortando a lo largo de la línea media con un bisturí largo. El cerebro izquierdo se utilizó para lipidómica, RNAseq y análisis bioquímico. Todos los especímenes y cerebros residuales se almacenaron a -80 ° C después de congelarse en nitrógeno líquido. El cerebro derecho se utilizó para la tinción después de que las secciones se fijaron en PFA al 4% en PBS durante al menos 72 h. Para descripciones detalladas de diferentes regiones cerebrales, nos referimos al suplemento del libro llamado The Beagle Brain in Stereotaxic Coordinates (Palazzi, 2011). Para garantizar la consistencia, todas las disecciones fueron realizadas por el Dr. Huilin Hong y el Dr. Hui Zhao.
Inmunohistoquímica del tejido cerebral del perro e imágenes
El animal fue anestesiado con xilazina/ketamina o isoflurano y perfundido con PFA al 4% en PBS. El hemisferio derecho del cerebro se extirpó y se fijó en PFA al 4% en PBS durante la noche. Para las criosecciones, las muestras se transfirieron a una solución de sacarosa al 30%, incrustadas en un compuesto de temperatura de corte óptima (OCT) durante al menos 2 días y almacenadas a -80 ° C. Las secciones cerebrales coronales del perro (10 μm) fueron cortadas por criostato (Leica). Las secciones se almacenaron flotando libremente en solución crioprotectora (25% etilenglicol, 20% glicerol, en PBS). La tinción de mielina de alta resolución y contraste se logró utilizando el derivado de fosfato de oro, TrueGold Kit (BK-AC001, Oasis Biofarm Inc., Hangzhou, China), siguiendo los protocolos publicados (Schmued et al., 2008). Para la mayoría de las tinciones, las secciones se permeabilizan y bloquean durante 1 h con 0,2% de tritón-x-100, 10% de suero bovino fetal (FBS) y albúmina sérica bovina al 5% en PBS, y luego se incuban durante la noche a 4 ° C con los anticuerpos primarios. Los anticuerpos primarios se diluyeron en PBST al 0,2% y se aplicaron durante la noche a 4 °C. Los anticuerpos primarios que utilizamos incluyeron anti-MBP de conejo (ab7349, 1:1,000), anti-CC1 de ratón (OP80, 1:500), anti-NeuN de ratón (ab104224, 1:500), anti-MYRF de conejo (OB-PRB007-02, 1:300) y anti-Sox10 de conejillo de indias (OB-PGB001, 1:300), anti-AQP4 de cobaya (OB-PGP0016, 1:500), anti-GFAP de cabra (ab53554, 1:1000), antilaminina de conejo (L9393, 1:200), anti-ocludina de conejo (71-1500, 1:500), anti-claudina de conejo1 (ab15098, 1:500). Las secciones se lavaron con PBST al 0,2% y posteriormente se incubaron con anticuerpos secundarios marcados con Alexa Fluor (1:1.000) durante 2 h en RT.
Las imágenes confocales convencionales de haces MBP se recolectaron a 488 nm con un microscopio confocal Leica TCS SP8 utilizando un objetivo de aceite de 40×. Las pilas confocales (tamaño de paso z = 1 μm) se procesaron con el software ImageJ (Institutos Nacionales de Salud). Para las imágenes de tinción MBP, se recolectaron diapositivas completas de tejido con PerkinElmer Vectra Polaris utilizando un objetivo de 20× o 40×; La representación y visualización 3D se procesaron con el software Imaris 6.5.1
Análisis cuantitativo de oligodendrocitos y haces de mielina
La densidad y morfología de los oligodendrocitos en el cerebro del perro se cuantificaron como se describió anteriormente (Makinodan et al., 2012; Tanti et al., 2018). Las proporciones de los subgrupos de OL y los cambios morfológicos de los OL en la sustancia blanca del PFC y Par se cuantificaron a partir de 3 animales en cada grupo. Para cuantificar el número de protuberancias celulares de CC1 OL, se caracterizaron más de 90 CC1 OL de 3 animales de cada grupo (el número de CC1 OL cuantificadas en cada animal del grupo: Controles, 41/33/30; SI, 41/39/39). El número de protuberancias OL entre los grupos se analizó mediante ANOVA unidireccional y la prueba de Bonferroni. El número de OL CC1, Sox10 se cuantificó en un área rectangular de 461 × 263 μm utilizando ImageJ.+++++
Para cuantificar las intensidades de fluorescencia de haces de mielina marcados con MBP compuestos de fibras de mielina, tres regiones de interés de 0,06 mm2 se seleccionaron en las capas 2/3 de la materia gris por muestra para su análisis por ImageJ. La significación estadística se calculó con la prueba t de Student de dos colas. Los datos se presentan como medios ± SEM.
Extracción de ARN
Se tomaron cortes de tejido del PFC medial, la amígdala, el hipocampo, el lóbulo parietal, el lóbulo occipital y se congelaron rápidamente para su posterior procesamiento. Se utilizó un homogeneizador de molino de perlas (Bullet Blender, Gingko Biotech) y perlas de acero inoxidable refrigeradas (SSB14B, Next Advance) para lisar el tejido cerebral pulverizado. El ARN total se extrajo mediante un procedimiento no fenólico (RNeasy Plus Mini Kit, Qiagen), seguido de un tratamiento con DNasa (TURBO DNase, Ambion) según las instrucciones del producto. El ARN se transcribió inversamente con el sistema de síntesis de primera cadena SuperScript™ III para RT-PCR (Invitrogen, 18080-051) y la PCR cuantitativa en tiempo real (qPCR) se realizó utilizando KAPA SYBR FAST qPCR (KAPA, KK4601) en las tecnologías Stratagene Mx3000P Agilent.®
Análisis transcriptómico
Después de construir la biblioteca, usamos Qubit 2.0 para la cuantificación preliminar, diluimos la biblioteca y luego usamos Agilent 2100 para detectar el tamaño del inserto en la biblioteca. RNA-seq fue realizado por Novogene utilizando una plataforma Illumina NovaSeq 6000 mediante la estrategia de secuenciación PE150. Después de usar fastp para recortar lecturas para obtener lecturas de alta calidad, generamos al menos 12 G de datos limpios. Las lecturas de extremo pareado se mapearon al genoma de referencia de Canis lupus familiaris (ROS_Cfam_1.0) utilizando Hisat2. El comando sort en Samtools se usó para convertir archivos sam a archivos bam. Para mejorar el análisis a nivel genético, se utilizó StringTie para ensamblar y cuantificar las transcripciones en cada muestra utilizando el archivo de anotación gtf (ROS_Cfam_1.0.105) para el genoma de referencia de Canis lupus familiaris. Luego, se utilizó el paquete R IsoformSwitchAnalyzeR para asignar nombres de genes a transcripciones ensambladas por StringTie y estimar los recuentos de lecturas de resúmenes a nivel de genes, lo que puede ser particularmente útil en los casos en que StringTie no pudo realizar la asignación sin ambigüedades. Para garantizar resultados de alta confianza, solo los genes anotados como «codificación de proteínas» en Biomark y respaldados por más de 2 muestras se utilizaron para el análisis posterior de expresión diferencial. Se utilizó DESeq2 para normalizar la matriz de recuento y analizar la expresión diferencial (cambio de pliegue ≥1,5 y adj p ≤ 0,05).
qPCR
El ARN extraído se transcribió inversamente utilizando un kit de síntesis de ADNc iScript™ (BIO-RAD), seguido de qPCR utilizando el kit KAPA SYBR(R) FAST (Roche, KK4601) en un sistema QPCR en tiempo real (Agilent). Los niveles relativos de expresión de ARNm se analizaron según el método ΔΔ Ct (Livak y Schmittgen, 2001). Se utilizó GAPDH como gen de referencia. Los genes y cebadores utilizados para la qPCR se enumeran en la Tabla complementaria 2. Para la validación de los resultados de RNA-seq, comparamos los resultados de qPCR de genes representativos que incluyen Aqp4, Uqcrh, Ndufa12, Cox7a2l, Erbb3, Egfr, Mobp, Ecsit, Ptp4a2, Adora2a, Arnt, Myo5a, Dusp19, Lrrc3b, B3galt6 y Cntn2 con datos de RNA-seq utilizando la prueba de correlación de Pearson.
Análisis de enriquecimiento funcional
El análisis de enriquecimiento funcional se realizó utilizando el paquete R ClusterProfiler (4.4.1) (Wu et al., 2021) con parámetros predeterminados (corte del valor p = 0.05, corte del valor q = 0.2). Para garantizar la precisión de la prueba de enriquecimiento, solo se utilizaron como fondo los genes involucrados en el análisis de expresión diferencial en el paso anterior. Examinamos todos los términos de Gene Ontology de la última versión de «org. Cf.eg.db» y KEGG pathways desde la API oficial.
SEA
Los conjuntos de genes diana se derivaron de marcadores de linaje de oligodendrocitos de ratón validados experimentalmente (Marques et al., 2016). Se evaluó el enriquecimiento de estos marcadores en los datos del transcriptoma mediante pruebas de permutación con 100.000 iteraciones. La visualización de los resultados de enriquecimiento se basó en las funciones de trazado que vienen con ClusterProfiler (4.4.1) (Wu et al., 2021), excepto que los mapas de rutas KEGG específicos se basaron en la herramienta web Pathview.2
Análisis lipidómico
Los lípidos se extrajeron de acuerdo con una versión modificada del protocolo de Bligh y Dyer (Lam et al., 2021). El lipidoma del LCR se cuantificó utilizando un enfoque lipidómico dirigido de alta cobertura como se describió anteriormente (Lam et al., 2021). Todos los análisis lipidómicos se realizaron en un sistema que comprende un Exion-UPLC acoplado con un 6500 Plus QTRAP que ejecuta Analyst v.1.6.3 (Sciex). Todas las cuantificaciones se realizaron utilizando calibración estándar interna. Los niveles de TAGs y DAGs de cadena corta, media y larga se calcularon haciendo referencia a los estándares internos con picos de TAG(14:0)3-d5, TAG(16:0)3-d5, TAG(18:0)3-d5, d5-DAG17:0/17:0 y d5-DAG18:1/18:1 de Avanti Polar Lipids. Los colesteroles libres y los ésteres de colesterilo se analizaron como se describió previamente con d6-colesterol y d6-CE18:0 éster de colesterilo (CE) (isótopos CDN) como patrones internos.
Análisis estadísticos
La significación estadística entre los grupos se determinó mediante la prueba t de Student de dos colas, mientras que la comparación múltiple entre genotipos se determinó mediante ANOVA unidireccional con una prueba post-hoc de Tukey y un ANOVA bidireccional. Los asteriscos sobre una columna indican comparaciones entre un genotipo específico y el control, mientras que los asteriscos sobre una línea horizontal denotan comparaciones entre dos genotipos específicos. ns denota p > 0,05; *indica p < 0,05; denota p < 0,01; indica p < 0,001.*****
Resultados
El IS induce una expresión reducida de genes relacionados con la mielina en la sustancia blanca PFC
Para dilucidar el efecto de la IS en el desarrollo del cerebro, diseñamos un experimento de SI de perros beagle desde 2 meses después del destete hasta los 3 meses de edad. Específicamente, tres perros beagle de dos meses de edad (uno de una camada) fueron aislados socialmente durante 1 mes, mientras que los otros tres compañeros de camada correspondientes fueron criados juntos en la misma jaula (Figura Suplementaria 1). Para examinar qué regiones cerebrales se vieron afectadas por el SI, realizamos un análisis transcriptómico de la corteza prefrontal (PFC) y la corteza parietal, así como del hipocampo subcortical y la amígdala (Tabla complementaria 1). La materia gris y la sustancia blanca de diferentes cortezas se analizaron por separado.
Encontramos que la sustancia blanca de la PFC mostró muchos más genes expresados diferencialmente (DE) que las otras regiones después de SI. En concreto, detectamos 708 y 37 genes DE en la sustancia blanca y la sustancia gris del PFC, respectivamente, en comparación con los genes 7 y 20 DE en la sustancia blanca y la sustancia gris de la corteza parietal (Par) (Figura 1A). Los genes DE representativos de PFC y Par, incluida la proteína básica de oligodendrocitos asociada a mielina (MOBP), la acuaporina 4 (AQP4) y el receptor de adenosina a2a (ADORA2A), se verificaron de forma independiente mediante RT-PCR (Figura 1B; Tablas complementarias 2, 3), validando la calidad de los datos transcriptómicos. Los análisis de Gene Ontology (GO) / Kyoto Encyclopedia of Genes and Genomes (KEGG) mostraron que los genes significativamente aumentados en la sustancia blanca PFC de los perros SI están involucrados en los procesos metabólicos de ATP y las proyecciones neuronales, mientras que los genes disminuidos están involucrados en la interacción del receptor de la matriz extracelular (ECM) y la adhesión celular (Figura 1C). No se identificaron vías GO/KEGG en otras regiones debido a un número limitado de genes DE.
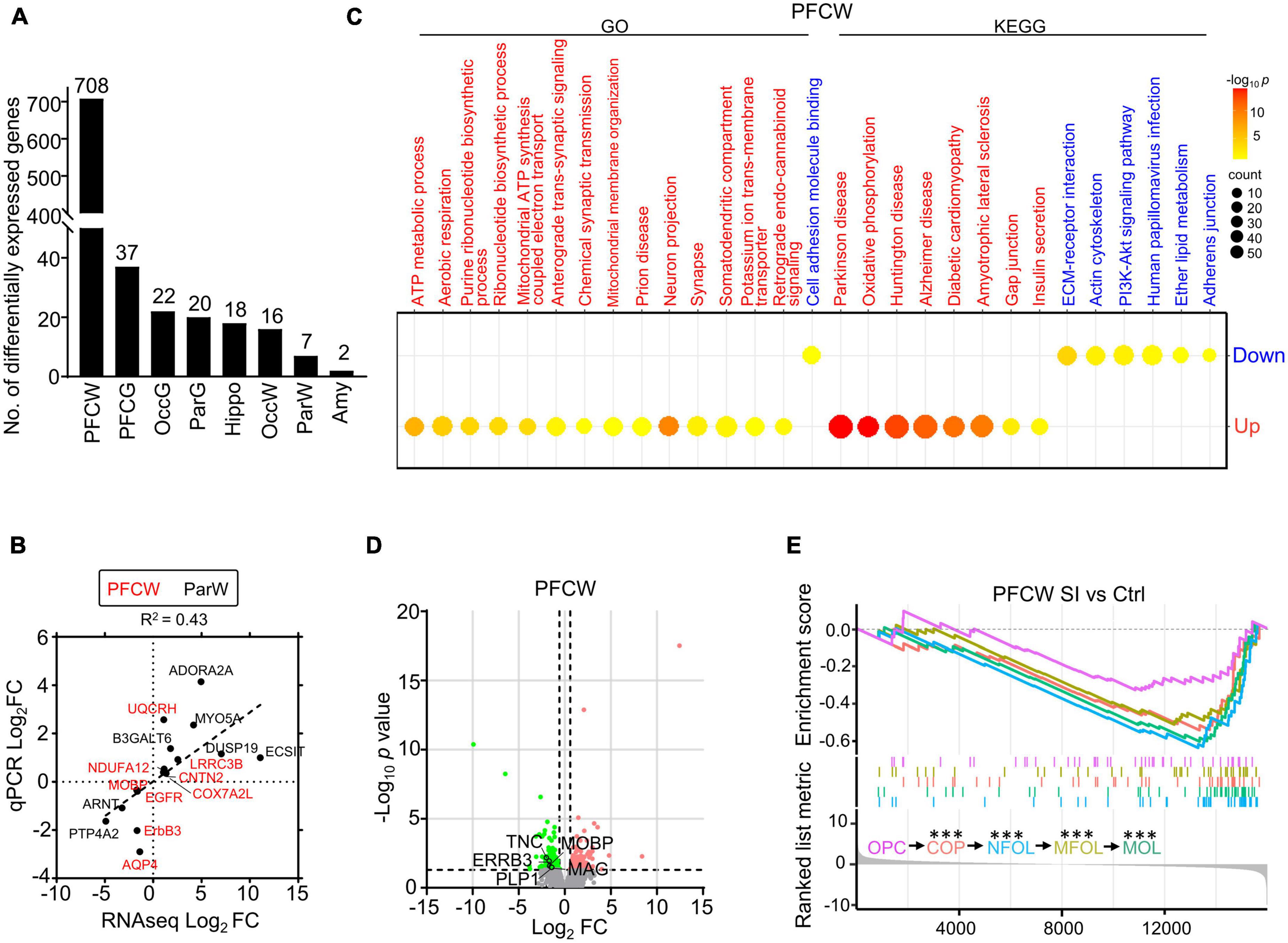 Figura 1. El aislamiento social (SI) conduce a una disminución de los niveles de expresión génica relacionada con la mielina y los lípidos en la sustancia blanca de la corteza prefrontal. (A) El número de genes expresados diferencialmente (DE) en cada región del cerebro de los perros SI en comparación con los controles alojados en grupo. (B) El diagrama de puntos muestra RNAseq y valores cuantitativos de PCR en tiempo real (qRT-PCR) de genes seleccionados con cambios significativos en diferentes regiones. (C) El mapa de calor de burbujas muestra vías GO y KEGG enriquecidas de genes regulados hacia arriba y hacia abajo inducidos por SI en la sustancia blanca de PFC (prueba exacta de Fisher, fc > 1.5, p ajustado < 0.05). El tamaño y el color de las burbujas indican el enriquecimiento del pliegue para esa vía y el valor p ajustado, respectivamente. Las vías reguladas al alza están en rojo, las vías reguladas a la baja están en azul. (D) Diagramas volcánicos de genes expresados diferencialmente en materia blanca de PFC después de SI. Los valores de corte se fijaron en fc > 1,5 o fc < 0,67 y p < 0,05. Los genes relacionados con la mielina significativamente regulados a la baja se resaltan en verde. (E) El diagrama GSEA muestra el enriquecimiento de diferentes marcadores específicos de la etapa, la mayoría de los cuales están significativamente regulados a la baja en PFC de perros socialmente aislados en comparación con el control. ***p < 0,001.
Figura 1. El aislamiento social (SI) conduce a una disminución de los niveles de expresión génica relacionada con la mielina y los lípidos en la sustancia blanca de la corteza prefrontal. (A) El número de genes expresados diferencialmente (DE) en cada región del cerebro de los perros SI en comparación con los controles alojados en grupo. (B) El diagrama de puntos muestra RNAseq y valores cuantitativos de PCR en tiempo real (qRT-PCR) de genes seleccionados con cambios significativos en diferentes regiones. (C) El mapa de calor de burbujas muestra vías GO y KEGG enriquecidas de genes regulados hacia arriba y hacia abajo inducidos por SI en la sustancia blanca de PFC (prueba exacta de Fisher, fc > 1.5, p ajustado < 0.05). El tamaño y el color de las burbujas indican el enriquecimiento del pliegue para esa vía y el valor p ajustado, respectivamente. Las vías reguladas al alza están en rojo, las vías reguladas a la baja están en azul. (D) Diagramas volcánicos de genes expresados diferencialmente en materia blanca de PFC después de SI. Los valores de corte se fijaron en fc > 1,5 o fc < 0,67 y p < 0,05. Los genes relacionados con la mielina significativamente regulados a la baja se resaltan en verde. (E) El diagrama GSEA muestra el enriquecimiento de diferentes marcadores específicos de la etapa, la mayoría de los cuales están significativamente regulados a la baja en PFC de perros socialmente aislados en comparación con el control. ***p < 0,001.
Aunque la vía relacionada con la mielina no se enriqueció con el análisis GO/KEGG, varios genes relacionados con la mielina, incluidos MOBP y la proteína proteolípida 1 (PLP1), se regularon significativamente a la baja en la sustancia blanca PFC de los perros SI en comparación con los perros de control (Figura 1D). Para determinar qué etapa del proceso de mielinización se vio afectada por el SI en PFC, realizamos un análisis de enriquecimiento de conjuntos de genes (GSEA) de los datos de RNAseq, que evaluaron la distribución de conjuntos de genes predefinidos. Utilizamos 50 genes marcadores publicados previamente para cada uno de los cinco tipos de células que representan diferentes etapas del proceso de mielinización (Marques et al., 2016). Todos los marcadores de oligodendrocitos (OL) en etapas posteriores de maduración, incluidos los precursores de oligodendrocitos (COP) comprometidos con la diferenciación, los oligodendrocitos recién formados (NFOL), los oligodendrocitos formadores de mielina (MFOL) y los oligodendrocitos maduros (MOL) se regularon negativamente (Figura 1E). Juntos, nuestros hallazgos demostraron que el SI conduce a una maduración reducida del OL en la sustancia blanca de la PFC.
El SI induce haces de mielina más gruesos con más fibras en el Par pero no en PFC
Para examinar los efectos de la reducción inducida por IS de la expresión génica relacionada con la mielina en la mielina, marcamos las fibras de mielina con un anticuerpo MBP y el colorante TrueGold, un derivado del fosfato de oro (Schmued, 1990). La organización de las fibras de mielina marcadas con MBP en la materia gris de PFC y Par fue diferente en que hubo una organización radial obvia de las fibras de mielina desde la sustancia blanca hasta la materia gris del Par, pero no el PFC (Figuras 2A-D). No se observaron cambios obvios en las fibras de mielina en el PFC después del SI. Sin embargo, los haces de mielina marcados con MBP por microscopía de campo amplio fueron marcadamente más gruesos con fibras paralelas en el Par después del SI (Figuras 2C-D). Las imágenes de gran aumento mostraron haces de mielina más gruesos que consisten en más fibras paralelas y menos cruces de fibras de mielina entre haces longitudinales de mielina en el Par después del SI (Figuras 2G, H), pero no hubo cambios en el PFC (Figuras 2E, F). Específicamente, la intensidad MBP de los haces de mielina y el número de fibras de mielina en los haces de mielina aumentaron significativamente (Figura 2M). Similar a la tinción MBP, la tinción TrueGold mostró haces de mielina más gruesos que contienen múltiples fibras de mielina paralelas en el Par después del SI (Figuras 2I-L; Figura complementaria 2). Los haces de mielina más gruesos se colocalizaron con la expresión de CC1 (un marcador de OL maduro), lo que sugiere un papel potencial de los LO más maduros en la regulación de la organización del haz de mielina (Figura 2N). Para identificar si el IS afectaba la distribución de las neuronas maduras que pueden conducir a los haces de mielina más gruesos, realizamos inmunotinción con anticuerpos contra NeuN (Figura complementaria 3). Los resultados mostraron una distribución lineal de los cuerpos celulares neuronales en Par después del SI (Figura Suplementaria 3C), lo que puede contribuir a más axones mielinizados paralelos. Se ha informado que la proteína de adhesión celular protocadherina (PCDH) regula el patrón de distribución de las neuronas en la corteza (Lv et al., 2022). Específicamente, la PCDH regulada a la baja da como resultado una distribución lineal similar de los cuerpos celulares neuronales (Lv et al., 2022). Consistentemente, el nivel de ARNm de PCDHB6 disminuyó después del SI, aunque no a un nivel estadísticamente significativo, probablemente debido a un tamaño de muestra pequeño (Cambio de pliegue = 0,42; p = 0,07; Figura complementaria 3D). Por lo tanto, una expresión reducida de PCDHB6 puede alterar el patrón de distribución de las neuronas, contribuyendo al patrón único de más fibras de mielina paralelas en el Par después del SI.
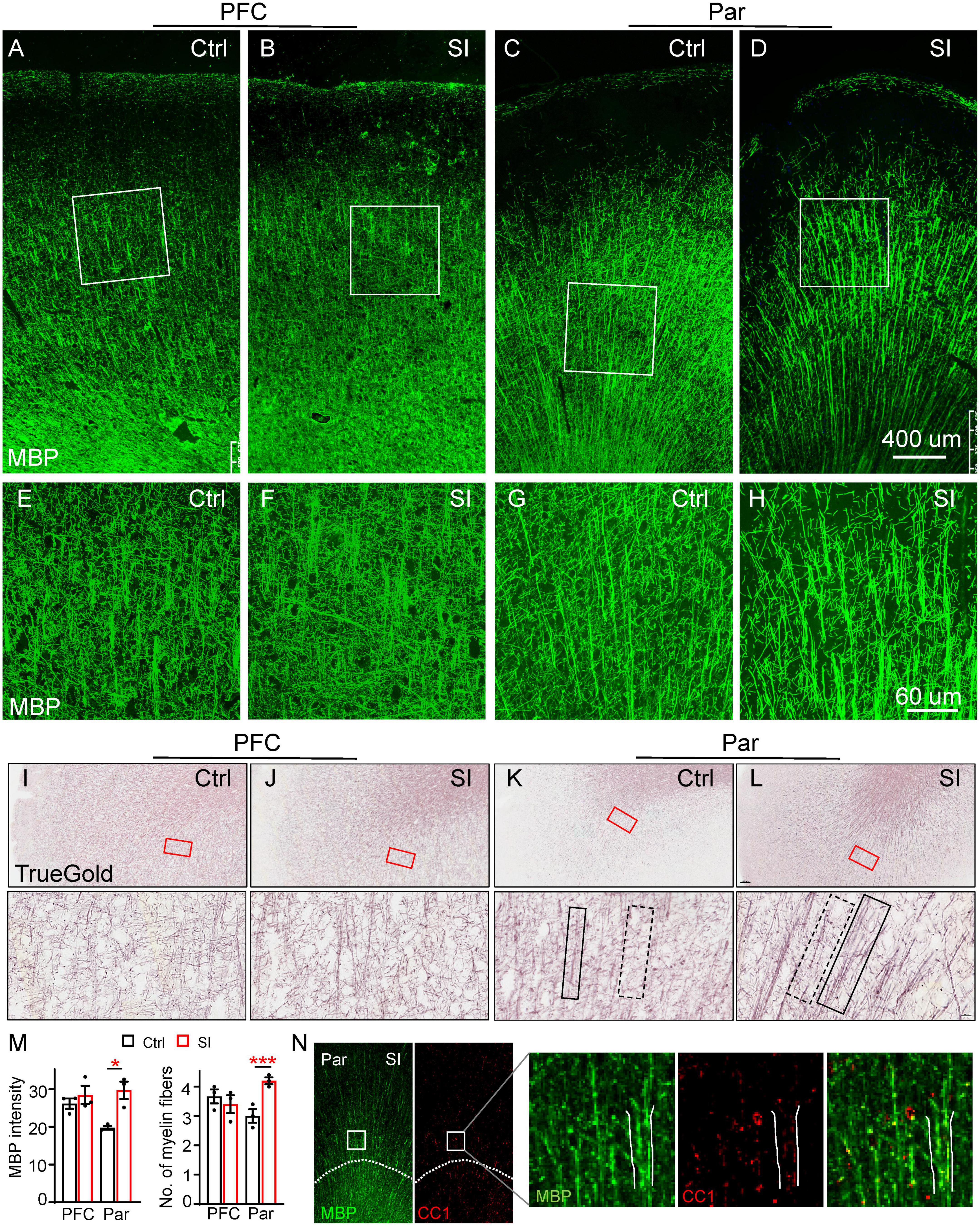 Figura 2. El aislamiento social (SI) de los perros juveniles resulta en la desorganización de las fibras mielinizadas en la materia gris de la corteza parietal. (A-D) Imágenes confocales de fibras mielinizadas marcadas por MBP (verde) en el PFC y Par de perros socialmente aislados y alojados en grupo. Barra de escala, 400 mm. (E–H) Imágenes de reconstrucción tridimensional de tinción MBP de regiones Par y PFC encajonadas en los paneles correspondientes (A-D). Barra de escala, 60 μm. (I-L) Imágenes de fibras mielinizadas etiquetadas por el kit TrueGold en PFC y Par de perros socialmente aislados y alojados en grupo. Barra de escala, 10 mmm. No se observaron cambios obvios de fibras mielinizadas en la materia gris de PFC, pero se observaron fibras de mielina desorganizadas en la materia gris Par después de SI. (M) Estadísticas de la intensidad de MBP en paneles (A-D) y el número de fibras de mielina para cada haz en paneles (E-H). *p < 0,05; ***p < 0,001. (N) Imágenes de co-tinción de MBP (verde) y CC1 (rojo) en Par de perros socialmente aislados y alojados en grupo.
Figura 2. El aislamiento social (SI) de los perros juveniles resulta en la desorganización de las fibras mielinizadas en la materia gris de la corteza parietal. (A-D) Imágenes confocales de fibras mielinizadas marcadas por MBP (verde) en el PFC y Par de perros socialmente aislados y alojados en grupo. Barra de escala, 400 mm. (E–H) Imágenes de reconstrucción tridimensional de tinción MBP de regiones Par y PFC encajonadas en los paneles correspondientes (A-D). Barra de escala, 60 μm. (I-L) Imágenes de fibras mielinizadas etiquetadas por el kit TrueGold en PFC y Par de perros socialmente aislados y alojados en grupo. Barra de escala, 10 mmm. No se observaron cambios obvios de fibras mielinizadas en la materia gris de PFC, pero se observaron fibras de mielina desorganizadas en la materia gris Par después de SI. (M) Estadísticas de la intensidad de MBP en paneles (A-D) y el número de fibras de mielina para cada haz en paneles (E-H). *p < 0,05; ***p < 0,001. (N) Imágenes de co-tinción de MBP (verde) y CC1 (rojo) en Par de perros socialmente aislados y alojados en grupo.
Para verificar aún más los cambios inducidos por el SI en la estructura de la mielina en el Par, realizamos imágenes de resonancia magnética de difusión (dMRI) de SI y perros de control. Cuantificamos los valores de anisotropía fraccional (AF), difusividad media (DM), difusividad axial (AD) y difusividad radial (RD), que son parámetros comúnmente utilizados para describir la microestructura de la sustancia blanca, en el PFC y Par de perros SI y perros control alojados en grupo. Los cambios de 2 meses a 3 meses de edad entre los grupos se compararon debido a la varianza individual. Nuestros resultados mostraron una tendencia de aumento de la Ataxia de Friedreich pero disminución de la EA en la sustancia blanca Par de los perros SI (Figura suplementaria 4), lo que indica fibras de mielina más organizadas, consistentes con haces de mielina más gruesos con más fibras paralelas observadas por inmunotinción (Figuras 2D, H, L). No se observaron cambios para DM y DR en el PFC y Par después del SI. Los resultados inmunohistoquímicos y de imagen juntos demuestran que el SI juvenil conduce a una organización alterada de la fibra de mielina en la materia gris de Par pero no PFC.
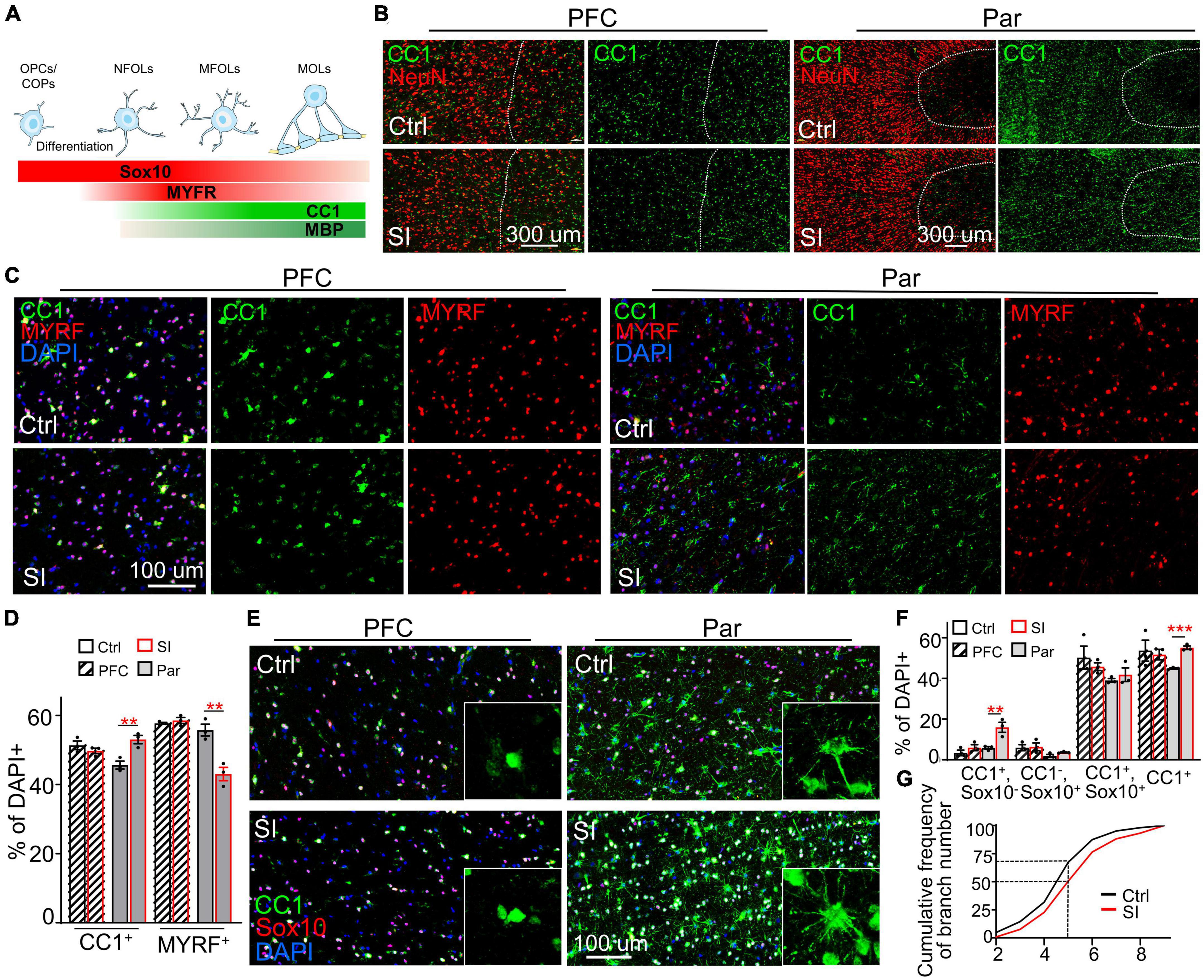
El SI aumenta el número de OL maduros en Par pero no en materia blanca PFC
Mientras que los genes relacionados con la mielina se regularon negativamente en la sustancia blanca PFC, ADORA2A, que inhibe la proliferación de OPC y promueve la maduración de OL (Coppi et al., 2021), se reguló al alza (FC = 31; adj p = 0.003) en la sustancia blanca Par después de SI (Figura 1B; Figura complementaria 5). Consistentemente, la tinción de inmunofluorescencia contra NeuN (un marcador para neuronas maduras), el factor de transcripción CC1 y MYRF [factor regulador de mielina, un marcador para OL premielinizante (Huang et al., 2022)] reveló un marcado aumento en la densidad y el número de células CC1 en la sustancia blanca Par de los perros SI en comparación con los perros control (Figuras 3A-D). En contraste, el número de células MYRF en la sustancia blanca Par disminuyó después del SI en comparación con el de los perros alojados en grupo (Figura 3C). Como control, no hubo diferencias obvias en el número de células CC1 y MYRF en la sustancia blanca PFC entre los perros SI y los perros control. Estos resultados indican que el SI en la etapa juvenil indujo OL CC1 más maduros junto con menos OL Myrf inmaduros en la sustancia blanca del Par pero no en el PFC.++++++
Figura 3. El aislamiento social (SI) aumenta el número de oligodendrocitos maduros en la sustancia blanca de la corteza parietal. (A) Representación esquemática de los marcadores específicos de la etapa durante la diferenciación de OPC y la maduración de oligodendrocitos. Los marcadores en negrita se analizan en el presente estudio. (B) Más células CC1 en la sustancia blanca Par de los perros SI. Imágenes de co-tinción de CC1 (verde) y NeuN (rojo) en la materia gris (a la izquierda de la línea blanca interrumpida) y la sustancia blanca (a la derecha de la línea blanca interrumpida) de Par y PFC de perros socialmente aislados y alojados en grupos. Barra de escala, 200 μm. (C) Co-tinción de imágenes confocales de CC1, MYRF y DAPI en la materia gris de Par y PFC de perros socialmente aislados y alojados en grupos. Barra de escala, 100 μm. (D) Menos OL inmaduros etiquetados como MYRF pero más OL maduros etiquetados con CC1 en la sustancia blanca de Par después de SI. **p < 0,01. (E) Triple tinción de imágenes de campo amplio de CC1, Sox10 y DAPI en PFC y Par sustancia blanca de perro socialmente aislado y alojado en grupo. Barra de escala, 100 μm. (F) Resultados estadísticos de los porcentajes de CC1Sox10, CC1Sox10++++++–, CC1–Sox10, y células CC1 en sustancia blanca de PFC y Par. **p < 0.01; ***p < 0,001. (G) Gráfico de probabilidad acumulativa del número de rama de oligodendrocitos CC1 en perros de control y SI de materia blanca Par.+++
Para cuantificar la proporción de OL inmaduros y maduros, realizamos una doble inmunotinción con anticuerpos que reconocen CC1 y el factor de transcripción Sox10 (Figuras 3E-G), que se expresa en todo el linaje incluyendo OPC, con niveles gradualmente decrecientes a medida que los OL maduran (Emery et al., 2009). Los anticuerpos reconocen específicamente que las OPC no estaban disponibles o no funcionaban en perros. Cuantificamos los porcentajes de tres poblaciones de células OL: (i) Sox10CC1+– células, que representan OPC/COPs/NFOLs; ii) células Sox10CC1, que representan MFOL inmaduras; y iii) Sox10++–Células CC1, que representan MOL maduros con más protuberancias celulares (Figura 3F). OL inmaduros (Sox10CC1++–) mostró una morfología característica de cuerpos celulares prominentes y pocas protuberancias similares a filopodios (Figura 3A). Las células Sox10 se distribuyeron ampliamente en toda la materia blanca PFC y Par. Los OL en la sustancia blanca PFC fueron relativamente más inmaduros que los de la sustancia blanca Par según el número de protrusión de CC1 OL. No se observaron cambios obvios en las tres poblaciones de células OL en el PFC después del SI (Figura 3E). Sin embargo, el número de OL CC1 aumentó significativamente en la sustancia blanca Par de los perros SI en comparación con los perros control (Figura 3F; el porcentaje de OL CC1 entre las células DAPI-positivas de 330∼420 en el área Par de 0,23 mm++++2: 44,8% para control versus 55,1% para SI, p = 0,0003). Consistentemente, el número de procesos celulares por CC1 OL fue mayor en perros SI que en los controles; la frecuencia acumulada de procesos celulares >5 por CC1 OL fue del 50% en el SI frente al 30% en el grupo control (Figura 3G). Estos resultados muestran que el SI da lugar a OLs más maduros específicamente en la sustancia blanca Par.++
SI resulta en la integridad de la barrera hematoencefálica alterada
Además de los cambios relacionados con la mielina, el análisis transcriptómico también reveló una disminución significativa en la expresión del gen que codifica AQP4 (FC = 0,38; adj p = 0,037, Figura 1B), un canal de agua localizado en los extremos astrocíticos (un componente estructural de la BBB), en la sustancia blanca PFC después de SI. Para verificar si la integridad de la BHE estaba comprometida por el SI, realizamos inmunotinción y verificamos una disminución significativa en los niveles de proteína AQP4 en el PFC y Par (Figuras 4A-H). AQP4 se colocalizó completamente con GFAP alrededor de los vasos sanguíneos en controles alojados en grupos, pero solo se colocalizó parcialmente con GFAP en los pies finales de astrocitos en PFC después de SI, lo que sugiere que AQP4 falta en ciertas áreas de señales GFAP positivas (Figuras 4A, B). También examinamos la expresión de otros componentes estructurales de la barrera hematoencefálica, incluyendo la proteína de la membrana basal laminina y las proteínas de unión estrecha Occludina y Claudina1 (Figuras 4A-H; Figura complementaria 6). Las tres proteínas se expresaron y colocalizaron con AQP4 en los vasos sanguíneos en el PFC y Par de los perros control. No se observaron cambios obvios en el nivel de expresión de Laminin después de la IS. Sin embargo, los niveles de expresión de Occludin y Claudin1 disminuyeron significativamente, similar a la de AQP4, lo que sugiere una interrupción de la integridad de BBB en el PFC después del SI (Figuras 4C, D; Cifras complementarias 6C, d). En el Par, notamos que la co-localización de AQP4 con GFAP se mantuvo normal (Figuras 4E, F); sin embargo, la intensidad de AQP4, Occludin y Claudin1 en BBB se redujo significativamente como en el PFC después del SI (Figuras 4G, H; Cifras suplementarias 6G, H). Estos resultados sugieren una alteración de la integridad de la BHE en diferentes regiones del cerebro después de la IS.
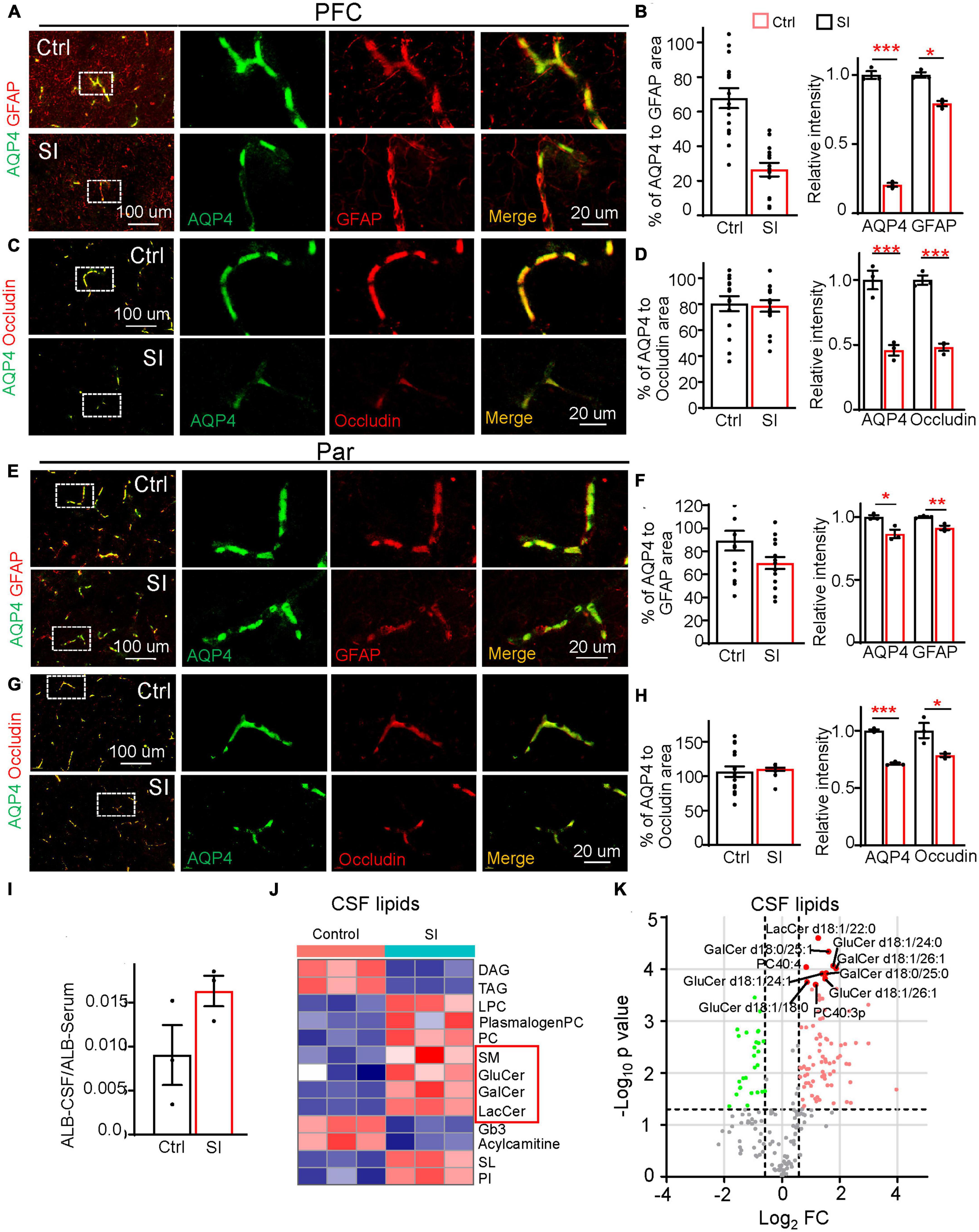 Figura 4. El aislamiento social de los perros conduce a una barrera hematoencefálica defectuosa y al aumento de los lípidos en el LCR. (A,C,E,G) Doble tinción de AQP4 (verde) y GFAP u Occludin en el PFC y Par de perros socialmente aislados y alojados en grupo. Barra de escala, 20 μm. (B, D, F, H) Cuantificaciones del área relativa de AQP4/GFAP, AQP4/Occludin, y la intensidad media de AQP4, GFAP y Occludin en los grupos control y SI (5 ramas GFAP-positivas por animal). *p < 0,05; **p < 0,01; ***p < 0,001. (I) Cuantificación de la relación del nivel de albúmina [líquido cefalorraquídeo (LCR)/Suero] en SI y grupos control. (J) El mapa de calor de diferentes clases de lípidos de LCR en perros alojados en grupo y aislados socialmente. El recuadro rojo indica los lípidos relacionados con la mielina que aumentaron significativamente después del SI. (K) Gráficos volcánicos de lípidos expresados diferencialmente en el LCR de cerebros de perros SI versus controles por análisis lipidómico.
Figura 4. El aislamiento social de los perros conduce a una barrera hematoencefálica defectuosa y al aumento de los lípidos en el LCR. (A,C,E,G) Doble tinción de AQP4 (verde) y GFAP u Occludin en el PFC y Par de perros socialmente aislados y alojados en grupo. Barra de escala, 20 μm. (B, D, F, H) Cuantificaciones del área relativa de AQP4/GFAP, AQP4/Occludin, y la intensidad media de AQP4, GFAP y Occludin en los grupos control y SI (5 ramas GFAP-positivas por animal). *p < 0,05; **p < 0,01; ***p < 0,001. (I) Cuantificación de la relación del nivel de albúmina [líquido cefalorraquídeo (LCR)/Suero] en SI y grupos control. (J) El mapa de calor de diferentes clases de lípidos de LCR en perros alojados en grupo y aislados socialmente. El recuadro rojo indica los lípidos relacionados con la mielina que aumentaron significativamente después del SI. (K) Gráficos volcánicos de lípidos expresados diferencialmente en el LCR de cerebros de perros SI versus controles por análisis lipidómico.
La integridad de la barrera hematoencefálica comprometida puede conducir a la fuga de componentes sanguíneos de los vasos sanguíneos al LCR. Un aumento del nivel de albúmina en el LCR se considera un sello distintivo de la fuga de BBB (Algotsson y Winblad, 2007). Consistentemente, observamos un mayor nivel de albúmina, aunque no alcanzando significación, en el LCR de los perros SI que en el de los perros control (Figura 4I), posiblemente debido a los niveles de albúmina muy variados en diferentes individuos y un tamaño de muestra pequeño. Para examinar más a fondo el efecto de la integridad interrumpida de la BHE después de la IS, realizamos un análisis lipidómico del LCR y encontramos aumentos significativos en los esfingolípidos polares de membrana, incluyendo lactosilceramida (LacCer), glucosilceramida (GluCer), galactosilceramida (GalCer) y esfingomielina (SM), componentes específicos de la mielina, en el LCR de perros SI en comparación con perros control (Figuras 4J, K). Estos resultados indican que el SI resulta en un aumento de los lípidos relacionados con la mielina en el LCR, que pueden filtrarse de las regiones cerebrales afectadas a través de la integridad de la BHE comprometida.
Discusión
En este estudio, realizamos un análisis sistemático de múltiples regiones cerebrales y LCR, de perros socialmente aislados y alojados en grupo en la etapa juvenil utilizando análisis multiómicos e inmunoquímicos. En general, el SI de los perros durante la etapa juvenil conduce a un pequeño número de genes expresados diferencialmente en múltiples regiones del cerebro, excepto el PFC. Esto podría explicarse por algunas posibilidades. En primer lugar, de 3 a 7 semanas de edad de los perros es un período crítico para la socialización con los seres humanos (Freedman et al., 1961; Scott, 1963). Los cachorros de perro separados de la madre a los 30 a 40 días durante el período crítico tenían más probabilidades de desarrollar una variedad de problemas de comportamiento, como miedo, sensibilidad al ruido y ladridos excesivos a edades posteriores (Sargisson, 2014; Dietz et al., 2018). Por lo tanto, cuando los perros experimentaron SI a partir de los 2 meses de edad, su desarrollo social se completó en su mayoría. En segundo lugar, los perros no estaban completamente aislados socialmente, ya que los cuidadores venían dos veces al día para alimentarse y limpiar.
La mielinización es esencial para garantizar una conectividad eficiente dentro y entre las diferentes regiones del cerebro; la mielinización anormal conduce a la disfunción cognitiva y comportamientos sociales anormales (Nave y Werner, 2014; Chen et al., 2020). El aislamiento social prolongado de ratones adultos disminuye el nivel de transcripciones del gen de la mielina en PFC (Liu et al., 2012). Aquí, demostramos un efecto diferencial del SI en los procesos relacionados con la mielina de diferentes cortezas por primera vez, es decir, el SI durante la etapa juvenil de perros indujo una disminución de la expresión de genes relacionados con la mielina en el PFC pero OL más maduros en el Par. Hay dos explicaciones posibles: por un lado, estudios previos han demostrado un papel importante de la actividad neuronal en la mielinización. La supresión de la actividad neuronal durante el desarrollo del SNC reduce la proliferación de OPC (Barres y Raff, 1993) e interrumpe la mielinización del nervio óptico (Demerens et al., 1996). Por el contrario, la inducción de la actividad neuronal a través de la estimulación eléctrica o la genética óptica promueve la supervivencia del OL, la maduración del OL y la mielinización del axón in vitro (Stevens et al., 2002; Ishibashi y otros, 2006; Gibson et al., 2014). El PFC es un centro integrador que recibe información de todas las demás regiones y funciones corticales para planificar y dirigir comportamientos motores, cognitivos, afectivos y sociales (Miller, 1999; Miller y Cohen, 2001; Forbes y Grafman, 2010; Euston et al., 2012). Sin embargo, durante la IS, los perros fueron confinados a una jaula con mucha menos locomoción, lo que puede conducir a una disminución de las actividades neuronales y, por lo tanto, a una reducción de la diferenciación de OPC y la maduración de OL en el PFC en comparación con los controles alojados en grupos. El área Par es vital para la percepción sensorial y la integración de la visión, el tacto, el oído y el olfato (Freedman e Ibos, 2018; Xu, 2018; Medendorp y Heed, 2019). Es posible que la percepción sensorial se mejore para compensar las actividades ampliamente inhibidas de los perros SI. De hecho, los perros mostraron un aumento gradual de las expectativas sociales (mayor atención y aumento de las actividades que preceden a la llegada de los cuidadores) desde la segunda semana de SI (datos no mostrados). Como resultado, la percepción sensorial mejorada de la audición y el olfato en el Par puede aumentar la actividad neuronal, lo que promueve la maduración del OL en el Par.
Por otro lado, los efectos del IS en el desarrollo de OL en el PFC y Par pueden diferir ya que las dos regiones cerebrales se desarrollan a ritmos diferentes, es decir, hay progresiones diferenciales de mielinización en diferentes regiones cerebrales de los perros durante el desarrollo postnatal (Hong et al., 2022). La doble inmunotinción con Sox10 y CC1 reveló que hay OL más maduros en el Par que en el PFC de los perros control de 3 meses de edad. Estudios previos han demostrado que las OPC en la sustancia blanca forman sinapsis con axones neuronales y establecen un microambiente a través de la entrada sináptica excitatoria e inhibitoria de los axones neuronales (Karadottir et al., 2008). A medida que las OPC se diferencian en OL premielinizantes, pierden la entrada sináptica, así como la expresión de los receptores de glutamato (De Biase et al., 2010). Dado que el PFC contiene OL más inmaduros y probablemente más OPC que el Par, puede haber más sinapsis formadas entre los axones neuronales y OPC en el PFC. Por lo tanto, la actividad neuronal reducida debido al SI puede ejercer un impacto más negativo en la diferenciación de OPC en el PFC que en el Par. Además, la transcripción y la traducción ocurren con diferentes ritmos en diferentes puntos de tiempo y se detectan con diferente sensibilidad, lo que puede explicar por qué la reducción de la expresión génica de mielina en el PFC después del SI no afectó el número de oligodendrocitos o fibras de mielina por inmunotinción.
Junto con OL más maduros, observamos haces de mielina más gruesos con más fibras de mielina paralelas en el Par después del SI. La razón de este patrón único de fibra de mielina que no se ha informado antes es actualmente desconocida. Los OL más maduros y la distribución lineal de las neuronas pueden contribuir a los haces de mielina más gruesos después de la IS. La distribución lineal de las neuronas puede ser causada por la expresión reducida de PCDHB6 en Par; la interacción homofílica de PCDH entre células vecinas de las mismas células progenitoras tiene un efecto repulsivo (Schreiner y Weiner, 2010; Brasch et al., 2019). Además, se ha informado que la endotelina vascular regula el número de vainas de mielina en ratones; El aumento de la señalización de endotelina rescata el defecto de mielinización inducido por SI en el PFC de ratones (Swire et al., 2019). Es posible que el SI pueda aumentar la expresión de endotelina que conduce a más vainas de mielina en el Par.
Aunque no hubo una interrupción obvia de la estructura de la mielina en PFC y Par por inmunotinción, los esfingolípidos relacionados con la mielina aumentaron en el LCR en el grupo socialmente aislado, lo que indica desmielinización, formación defectuosa de mielina o ambos. Se necesitaría microscopía electrónica para determinar si el proceso de mielinización en el PFC o Par se vio afectado por el SI en el futuro. Se ha demostrado que la clemastina, un compuesto antimuscarínico, mejora la diferenciación del progenitor OL y revierte con éxito el comportamiento de evitación social en ratones adultos socialmente aislados (Liu et al., 2012, 2016). Debido a los diferentes efectos de la IS sobre el desarrollo de OL en PFC y Par, los efectos de clemastine deben evaluarse en diferentes cortezas. Además, el efecto de los haces de mielina más gruesos sobre la actividad del circuito neural en el Par después del SI aún no se ha aclarado.
Además, revelamos por primera vez una integridad BBB interrumpida tanto en PFC como en Par después del SI mediante análisis transcriptómicos, inmunoquímicos y lipidómicos. ¿Cómo interrumpiría SI la integridad de BBB? La inflamación y el estrés oxidativo pueden conducir a la sobreproducción de metaloproteinasa-9 de matriz (MMP-9) por parte de OPC, interrumpiendo la integridad de la BBB (Seo et al., 2013). Un estudio reciente de SI en ratones jóvenes muestra un mayor nivel de citoquinas neuroinflamatorias IL-1β y daño BBB en la amígdala (Wu et al., 2022). Todavía no está claro si la interrupción de la barrera hematoencefálica se debe a la sobreproducción de MMP-9 por OPC, neuroinflamación u otros mecanismos desconocidos en las cortezas de los perros SI. Se necesita más investigación para comprender completamente el impacto de la IS en la integridad de la BHE.
En resumen, estos hallazgos de cambios compartidos y distintos en múltiples regiones del cerebro arrojan nueva luz sobre los mecanismos moleculares y celulares subyacentes a los efectos perjudiciales de la IS en el cerebro. Nuestro estudio demuestra el valor de los perros como modelo animal complementario para un estudio mecanicista de anomalías y trastornos del desarrollo cerebral inducidos por SI.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio están depositados en el repositorio Genome Sequence Archive (GSA), número de acceso CRA010898.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité Institucional de Cuidado de Animales del Instituto de Genética y Biología del Desarrollo de la Academia China de Ciencias.
Contribuciones del autor
YQZ concibió y supervisó el estudio. HH, WR y HZ realizaron la disección. HH realizó la inmunotinción. XL, ZZu e YZ realizaron y supervisaron la adquisición y el análisis de datos de resonancia magnética. SL y GS realizaron el análisis lipidómico. CG, LY, ZZh, G-DW, YZ y YiL realizaron y supervisaron el análisis de datos transcriptómicos. HH y YX realizaron la visualización de datos y escribieron el manuscrito. JM y YuL proporcionaron y mantuvieron a los animales. YX, CL y YQZ revisaron el manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por subvenciones del Programa Nacional de Investigación y Desarrollo Clave (2019YFA0707100 a YQZ) y STI2030-Major Projects (2021ZD0203900 a YQZ y CL), el Programa de Investigación Estratégica Prioritaria B de la Academia China de Ciencias (XDBS1020100 a YQZ) y la Fundación Nacional de Ciencias Naturales de China (31830036 y 31921002 a YQZ y 32171088 a CL).
Reconocimientos
Agradecemos al Dr. Q. Richard Lu, al Dr. Lingqiang Zhu, al Dr. Qingfeng Wu y a Zhiheng Xu por la discusión sobre el manuscrito. Agradecemos al Dr. Mikael Simons por sus consejos sobre la inmunotinción de la mielina, y al Dr. Yong Shen y al Dr. Bingyu Mao por sus consejos sobre la inmunotinción de los componentes de la barrera hematoencefálica.
Conflicto de intereses
YuL y JM fueron empleados por Beijing Sinogene Biotechnology Co., Ltd.
Los autores restantes declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fncel.2023.1201295/full#supplementary-material
Notas
Referencias
Adams, B., Chan, A., Callahan, H. y Milgram, N. W. (2000). El canino como modelo de envejecimiento cognitivo humano: Desarrollos recientes. Prog. Neuropsychopharmacol. Biol. Psychiatry 24, 675–692. doi: 10.1016/s0278-5846(00)00101-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Algotsson, A., y Winblad, B. (2007). La integridad de la barrera hematoencefálica en la enfermedad de Alzheimer. Acta Neurol. Scand. 115, 403–408.
Barres, B. A., y Raff, M. C. (1993). La proliferación de células precursoras de oligodendrocitos depende de la actividad eléctrica en los axones. Nature 361, 258–260.
Baumeister, R. F., y Leary, M. R. (1995). La necesidad de pertenecer: el deseo de apegos interpersonales como una motivación humana fundamental. Psychol. Bol. 117, 497–529.
Berns, G. S. y Cook, P. F. (2016). ¿Por qué el perro entró en la resonancia magnética? Curr. Directo. Psicol. Sci. 25, 363–369.
Bick, J., Zhu, T., Stamoulis, C., Fox, N. A., Zeanah, C. y Nelson, C. A. (2015). Efecto de la institucionalización temprana y el cuidado de crianza en el desarrollo de la materia blanca a largo plazo: un ensayo clínico aleatorizado. JAMA Pediatr. 169, 211–219. doi: 10.1001/jamapediatrics.2014.3212
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Brasch, J., Goodman, K. M., Noble, A. J., Rapp, M., Mannepalli, S., Bahna, F., et al. (2019). Visualización de complejos de autorreconocimiento neuronal de protocadherina agrupados. Nature 569, 280–283. DOI: 10.1038/S41586-019-1089-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bunford, N., Andics, A., Kis, A., Miklosi, A. y Gacsi, M. (2017). Canis familiaris como modelo para la neurociencia comparativa no invasiva. Tendencias Neurosci. 40, 438–452. doi: 10.1016/j.tins.2017.05.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cacioppo, J. T., Hawkley, L. C., Norman, G. J. y Berntson, G. G. (2011). Aislamiento social. Ann. N. Y. Acad. 1231, 17–22.
Cao, X., Liu, W., Cheng, L., Li, H., Wu, H., Liu, Y., et al. (2021). Los análisis del genoma completo revelan una convergencia significativa en el trastorno obsesivo-compulsivo entre humanos y perros. Sci. Bol. 66, 187–196. doi: 10.1016/j.scib.2020.09.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Chen, X., Wang, F., Gan, J., Zhang, Z., Liang, X., Li, T., et al. (2020). Los déficits de mielina causados por la deficiencia de olig2 conducen a la disfunción cognitiva y aumentan la vulnerabilidad al aislamiento social en ratones adultos. Neurosci. Toro. 36, 419–426. DOI: 10.1007/S12264-019-00449-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Coppi, E., Cencetti, F., Cherchi, F., Venturini, M., Donati, C., Bruni, P., et al. (2021). Diafonía de los receptores de adenosina A2 B y la señalización de la esfingosina 1-fosfato en la oligodendrogliogénesis. Frente. Neurosci. 15:677988. doi: 10.3389/fnins.2021.677988
Resumen de PubMed | Texto completo de CrossRef | Google Académico
De Biase, L. M., Nishiyama, A. y Bergles, D. E. (2010). Excitabilidad y comunicación sináptica dentro del linaje de oligodendrocitos. J. Neurosci. 30, 3600–3611. doi: 10.1523/JNEUROSCI.6000-09.2010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Demerens, C., Stankoff, B., Logak, M., Anglade, P., Allinquant, B., Couraud, F., et al. (1996). Inducción de la mielinización en el sistema nervioso central por actividad eléctrica. Proc. Natl. Acad. Sci. U. S. A. 93, 9887–9892.
Deoni, S. C., Beauchemin, J., Volpe, A., Da Sa, V. y Consortium, R. (2021). Impacto de la pandemia de COVID-19 en el desarrollo cognitivo de la primera infancia: hallazgos iniciales en un estudio observacional longitudinal de la salud infantil. Medrxiv [Preprint]. doi: 10.1101/2021.08.10.21261846
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Dietz, L., Arnold, A. M. K., Goerlich-Jansson, V. C. y Vinke, C. M. (2018). La importancia de las experiencias de vida temprana para el desarrollo de trastornos del comportamiento en perros domésticos. Comportamiento 155, 83–114.
Eisenberger, N. I. (2012). El dolor de la desconexión social: examinar los fundamentos neuronales compartidos del dolor físico y social. Neurosci. 13, 421–434. DOI: 10.1038/NRN3231
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Eluvathingal, T. J., Chugani, H. T., Behen, M. E., Juhasz, C., Muzik, O., Maqbool, M., et al. (2006). Conectividad cerebral anormal en niños después de privación socioemocional severa temprana: un estudio de imágenes de tensor de difusión. Pediatrics 117, 2093–2100. DOI: 10.1542/PEDS.2005-1727
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Emery, B., Agalliu, D., Cahoy, J. D., Watkins, T. A., Dugas, J. C., Mulinyawe, S. B., et al. (2009). El factor regulador del gen de la mielina es un regulador transcripcional crítico requerido para la mielinización del SNC. Celda 138, 172–185.
Euston, D. R., Gruber, A. J. y Mcnaughton, B. L. (2012). El papel de la corteza prefrontal medial en la memoria y la toma de decisiones. Neurona 76, 1057–1070.
Forbes, C. E. y Grafman, J. (2010). El papel de la corteza prefrontal humana en la cognición social y el juicio moral. Annu. Rev. Neurosci. 33, 299–324.
Freedman, D. G., King, J. A. y Elliot, O. (1961). Período crítico en el desarrollo social de los perros. Ciencia 133, 1016–1017.
Freedman, D. J. e Ibos, G. (2018). Un marco integrador para las funciones sensoriales, motoras y cognitivas de la corteza parietal posterior. Neurona 97, 1219–1234.
Gibson, E. M., Purger, D., Mount, C. W., Goldstein, A. K., Lin, G. L., Wood, L. S., et al. (2014). La actividad neuronal promueve la oligodendrogénesis y la mielinización adaptativa en el cerebro de los mamíferos. Ciencia 344:1252304.
Govindan, R. M., Behen, M. E., Helder, E., Makki, M. I. y Chugani, H. T. (2010). La difusividad del agua alterada en los tractos de asociación cortical en niños con privación temprana se identificó con Tract-Based Spatial Statistics (TBSS). Cereb. Corteza 20, 561–569. DOI: 10.1093/Cercor/BHP122
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hong, H., Zhao, Z., Huang, X., Guo, C., Zhao, H., Wang, G. D., et al. (2022). El análisis comparativo de proteoma y elementos reguladores cis revela vías moleculares específicas conservadas en cerebros de perros y humanos. Proteoma celular mol. 21:100261. doi: 10.1016/j.mcpro.2022.100261
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Huang, H., He, W., Tang, T. y Qiu, M. (2022). Marcadores inmunológicos para la glía del sistema nervioso central. Neurosci. Toro. 39, 379–392.
Ishibashi, T., Dakin, K. A., Stevens, B., Lee, P. R., Kozlov, S. V., Stewart, C. L., et al. (2006). Los astrocitos promueven la mielinización en respuesta a los impulsos eléctricos. Neurona 49, 823–832.
Karadottir, R., Hamilton, N. B., Bakiri, Y., y Attwell, D. (2008). Clases puntiagudas y no puntiagudas de la glía precursora de oligodendrocitos en la sustancia blanca del SNC. Nat. Neurosci. 11, 450–456. DOI: 10.1038/NN2060
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kennedy, M., Kreppner, J., Knights, N., Kumsta, R., Maughan, B., Golm, D., et al. (2016). La privación institucional severa temprana se asocia con una variante persistente del trastorno por déficit de atención / hiperactividad en adultos: presentación clínica, continuidades de desarrollo y circunstancias de vida en el estudio de adoptados ingleses y rumanos. J. Child Psychol. Psychiatry 57, 1113–1125. DOI: 10.1111/JCPP.12576
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Lam, S. M., Zhang, C., Wang, Z., Ni, Z., Zhang, S., Yang, S., et al. (2021). Una investigación multiómica de la composición y función de vesículas extracelulares a lo largo de la trayectoria temporal de COVID-19. Nat. Metab. 3, 909–922. DOI: 10.1038/S42255-021-00425-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Liu, C., Yang, D., Li, J., Li, D., Yang, M., Sun, W., et al. (2018). Imágenes de tensor de difusión dinámica de la contusión de la médula espinal: un modelo canino. J. Neurosci. 96, 1093–1103.
Liu, J., Dietz, K., Deloyht, J. M., Pedre, X., Kelkar, D., Kaur, J., et al. (2012). Impaired adult myelination in the prefrontal cortex of socially isolated mice. Nat. Neurosci. 15, 1621–1623.
Liu, J., Dupree, J. L., Gacias, M., Frawley, R., Sikder, T., Naik, P., et al. (2016). Clemastine enhances myelination in the prefrontal cortex and rescues behavioral changes in socially isolated mice. J. Neurosci. 36, 957–962. doi: 10.1523/JNEUROSCI.3608-15.2016
Livak, K. J., and Schmittgen, T. D. (2001). Analysis of relative gene expression data using real-time quantitative Pcr and the 2(-Delta Delta C(T)) Method. Methods 25, 402–408.
Loades, M. E., Chatburn, E., Higson-Sweeney, N., Reynolds, S., Shafran, R., Brigden, A., et al. (2020). Rapid systematic review: The impact of social isolation and loneliness on the mental health of children and adolescents in the context of COVID-19. J. Am. Acad. Child Adolesc. Psychiatry 59, 1218–1239.e3.
Lv, X., Li, S., Li, J., Yu, X. Y., Ge, X., Li, B., et al. (2022). Patterned cpcdh expression regulates the fine organization of the neocortex. Nature 612, 503–511. doi: 10.1038/s41586-022-05495-2
Makinodan, M., Rosen, K. M., Ito, S., and Corfas, G. (2012). A critical period for social experience-dependent oligodendrocyte maturation and myelination. Science 337, 1357–1360. doi: 10.1126/science.1220845
Marques, S., Zeisel, A., Codeluppi, S., Van Bruggen, D., Mendanha Falcao, A., Xiao, L., et al. (2016). Oligodendrocyte heterogeneity in the mouse juvenile and adult central nervous system. Science 352, 1326–1329.
Medendorp, W. P. y Heed, T. (2019). Estimación del estado en la corteza parietal posterior: Polos distintos de los estados ambientales y corporales. Prog. Neurobiol. 183:101691. doi: 10.1016/j.pneurobio.2019.101691
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Miller, E. K. (1999). La corteza prefrontal: propiedades neuronales complejas para el comportamiento complejo. Neurona 22, 15–17.
Miller, E. K., y Cohen, J. D. (2001). Una teoría integradora de la función de la corteza prefrontal. Annu. Rev. Neurosci. 24, 167–202.
Muller, C. A., Schmitt, K., Barber, A. L. y Huber, L. (2015). Los perros pueden discriminar las expresiones emocionales de los rostros humanos. Curr. Biol. 25, 601–605.
Nave, K. A., y Werner, H. B. (2014). Mielinización del sistema nervioso: Mecanismos y funciones. Annu. Rev. Cell Dev. Biol. 30, 503–533.
Ogata, N. (2016). Ansiedad por separación en perros: ¿Qué progreso se ha logrado en nuestra comprensión de los problemas de comportamiento más comunes en los perros? J. Vet. 16, 28–35.
Pancani, L., Marinucci, M., Aureli, N. y Riva, P. (2021). Aislamiento social forzado y salud mental: un estudio sobre 1.006 italianos bajo confinamiento por COVID-19. Frente. Psychol. 12:663799. DOI: 10.3389/fpsyg.2021.663799
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rutter, M., Colvert, E., Kreppner, J., Beckett, C., Castle, J., Groothues, C., et al. (2007). Resultados de la adolescencia temprana para adoptados privados y no privados institucionalmente. I: Apego desinhibido. J. Child Psychol. Psychiatry 48, 17–30.
Sargisson, R. J. (2014). Ansiedad por separación canina: estrategias para el tratamiento y el manejo. Veterinario Med. 5, 143–151. doi: 10.2147/VMRR. S60424
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Schmued, L. C. (1990). Una tinción histoquímica rápida y sensible para la mielina en secciones cerebrales congeladas. J. Histoquímica. Citoquímica. 38, 717–720. doi: 10.1177/38.5.1692056
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Schmued, L., Bowyer, J., Cozart, M., Heard, D., Binienda, Z. y Paule, M. (2008). Presentamos Black-Gold Ii, un complejo de fosfato de oro altamente soluble con varias ventajas únicas para la localización histoquímica de la mielina. Cerebro Res. 1229, 210–217. doi: 10.1016/j.brainres.2008.06.129
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Schreiner, D., y Weiner, J. A. (2010). La interacción homofílica combinatoria entre multímeros gamma-protocadherina amplía enormemente la diversidad molecular de la adhesión celular. Proc. Natl. Acad. Sci. U. S. A. 107, 14893–14898. doi: 10.1073/pnas.1004526107
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Scott, J. P. (1963). El proceso de socialización primaria en bebés caninos y humanos. Monogr. Soc. Res. Child Dev. 28, 1–47.
Seo, J. H., Miyamoto, N., Hayakawa, K., Pham, L. D., Maki, T., Ayata, C., et al. (2013). Los precursores de oligodendrocitos inducen la apertura temprana de la barrera hematoencefálica después de una lesión de la sustancia blanca. J. Clin. Invertir. 123, 782–786. doi: 10.1172/JCI65863
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Shuffrey, L. C., Firestein, M. R., Kyle, M. H., Fields, A., Alcantara, C., Amso, D., et al. (2022). Asociación del nacimiento durante la pandemia de COVID-19 con el estado del desarrollo neurológico a los 6 meses en lactantes con y sin exposición in utero a la infección materna por Sars-CoV-2. JAMA Pediatr. 176:E215563.
Sonuga-Barke, E. J. S., Kennedy, M., Kumsta, R., Knights, N., Golm, D., Rutter, M., et al. (2017). Trayectorias de desarrollo neurológico y salud mental de niño a adulto después de la privación temprana de la vida: el seguimiento de adultos jóvenes del estudio longitudinal de adoptados ingleses y rumanos. Lancet 389, 1539–1548. doi: 10.1016/S0140-6736(17)30045-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Stevens, B., Porta, S., Haak, L. L., Gallo, V. y Fields, R. D. (2002). Adenosina: Un transmisor neuronal-glial que promueve la mielinización en el SNC en respuesta a los potenciales de acción. Neurona 36, 855–868. DOI: 10.1016/S0896-6273(02)01067-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Swire, M., Kotelevtsev, Y., Webb, D. J., Lyons, D. A. y Ffrench-Constant, C. (2019). La señalización de endotelina media la mielinización dependiente de la experiencia en el SNC. Elife 8:e49493. doi: 10.7554/eLife.49493
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Taheri Zadeh, Z., Rahmani, S., Alidadi, F., Joushi, S. y Esmaeilpour, K. (2021). Depresión, ansiedad y otras consecuencias cognitivas del aislamiento social: tratamientos farmacológicos y no farmacológicos. Int. J. Clin. Práctica. 75:E14949. doi: 10.1111/ijcp.14949
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Tanti, A., Kim, J. J., Wakid, M., Davoli, M. A., Turecki, G. y Mechawar, N. (2018). El abuso infantil se asocia con un desequilibrio de las células de linaje de oligodendrocitos en la sustancia blanca prefrontal ventromedial. Mol. Psiquiatría 23, 2018–2028. doi: 10.1038/mp.2017.231
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Tomova, L., Wang, K. L., Thompson, T., Matthews, G. A., Takahashi, A., Tye, K. M., et al. (2020). El aislamiento social agudo evoca respuestas de antojo del cerebro medio similares al hambre. Nat. Neurosci. 23, 1597–1605.
Wang, G. D., Zhai, W., Yang, H. C., Fan, R. X., Cao, X., Zhong, L., et al. (2013). La genómica de la selección en perros y la evolución paralela entre perros y humanos. Nat. Commun. 4:1860.
Wu, T., Hu, E., Xu, S., Chen, M., Guo, P., Dai, Z., et al. (2021). clusterProfiler 4.0: Una herramienta de enriquecimiento universal para interpretar datos ómicos. Innovación 2:100141. doi: 10.1016/j.xinn.2021.100141
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wu, X., Ding, Z., Fan, T., Wang, K., Li, S., Zhao, J., et al. (2022). El aislamiento social infantil causa comportamientos similares a la ansiedad a través del daño de la barrera hematoencefálica en la amígdala en ratones hembra. Frente. Cell Dev. Biol. 10:943067. doi: 10.3389/fcell.2022.943067
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Xiong, Y., Hong, H., Liu, C. y Zhang, Y. Q. (2023). El aislamiento social y el cerebro: efectos y mecanismos. Mol. Psychiatry 28, 191–201.
Xu, Y. (2018). La corteza parietal posterior en el procesamiento visual adaptativo. Tendencias Neurosci. 41, 806–822.
Cita: Hong H, Guo C, Liu X, Yang L, Ren W, Zhao H, Li Y, Zhou Z, Lam SM, Mi J, Zuo Z, Liu C, Wang G-D, Zhuo Y, Zhang Y-P, Li Y, Shui G, Zhang YQ y Xiong Y (2023) Efectos diferenciales del aislamiento social en el desarrollo de oligodendrocitos en diferentes regiones del cerebro: ideas de un modelo canino. Frente. Celda. Neurosci. 17:1201295. doi: 10.3389/fncel.2023.1201295
Recibido: 06 Abril 2023; Aprobado: 07 Junio 2023;
Publicado: 18 julio 2023.
Editado por:
Shingo Miyata, Universidad de Kindiai, Japón
Reviewed by:
Jeffrey Dupree, Virginia Commonwealth University, Estados Unidos
Matthew Swire, University College London, Reino Unido
Derechos de autor © 2023 Hong, Guo, Liu, Yang, Ren, Zhao, Li, Zhou, Lam, Mi, Zuo, Liu, Wang, Zhuo, Zhang, Li, Shui, Zhang y Xiong. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Ying Xiong, ying.xiong@hubu.edu.cn; Yong Q. Zhang, yqzhang@genetics.ac.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía