El antimoniato de meglumine y la miltefosina combinados con alopurinol para mantener entornos inmunes proinflamatorios durante el tratamiento de la leishmaniosis canina
El antimoniato de meglumine y la miltefosina combinados con alopurinol para mantener entornos inmunes proinflamatorios durante el tratamiento de la leishmaniosis canina
- 1Faculdade de Medicina Veterinária, CIISA–Centro de Investigação Interdisciplinar em Sanidade Animal, Universidade de Lisboa, Lisboa, Portugal
- 2GHTM-Salud Global y Medicina Tropical, Instituto de Higiene y Medicina Tropical (IHMT), Universidade Nova de Lisbon (UNL), Lisboa, Portugal
La leishmaniosis canina (CanL) causada por Leishmania infantum es una enfermedad zoonótica de preocupación mundial. Las terapias farmacológicas antileishmaniales comúnmente utilizadas para tratar a los perros enfermos mejoran su condición clínica, aunque cuando se suspende pueden producirse recaídas. Por lo tanto, el estudio actual tiene como objetivo evaluar el efecto de los tratamientos con CanL en el perfil de citoquinas de sangre periférica, ganglios linfáticos y médula ósea asociados con la recuperación clínica. Dos grupos de seis perros diagnosticados con CanL fueron tratados con miltefosina combinada con alopurinol y antimoniato de meglumina combinado con alopurinol (MT+A y MG+A), respectivamente. En el momento del diagnóstico y después del tratamiento, durante un seguimiento de 3 meses, se registraron signos clínicos, parámetros hematológicos y bioquímicos, resultados de análisis de orina y títulos de anticuerpos antileishmanial. Además, se recogieron muestras de sangre periférica, ganglios linfáticos poplíteos y médula ósea para evaluar la expresión génica de IL-2, IL-4, IL-5, IL-10, IL-12, TNF-α, TGF-β e IFN-γ mediante qPCR. Paralelamente, también se evaluaron muestras obtenidas de cinco perros sanos. Ambos protocolos de tratamiento promovieron la remisión de los signos clínicos, así como la normalización de los parámetros hematológicos y bioquímicos y los valores de análisis de orina. Los anticuerpos antileishmanial volvieron a los títulos no significativos en todos los perros. Los perros enfermos mostraron una regulación ascendente generalizada de IFN-γ y una regulación a la baja de IL-2, IL-4 y TGF-β, mientras que la expresión génica de IL-12, TNF-α, IL-5 e IL-10 varió entre los grupos y de acuerdo con el tejido evaluado. Una tendencia a la normalización de la expresión del gen de citoquinas fue inducida por las terapias combinadas de militefosina y meglumina. Sin embargo, la expresión del gen IFN-γ todavía estaba regulada en los tres tejidos evaluados. Además, el efecto del tratamiento en la expresión génica de las citocinas que no fueron cambiadas significativamente por la infección, indica que la terapia combinada de antimoniato de mitefosina y meglumina afecta directamente a la generación de citoquinas. Ambas terapias combinadas son efectivas en el tratamiento de la CanL, lo que conduce a entornos inmunes proinflamatorios sostenidos que pueden comprometer la supervivencia de los parásitos y favorecer la cura clínica de los perros. En el estudio actual, las citocinas antiinflamatorias y reguladoras no parecen desempeñar un papel destacado en la CanL o durante la recuperación clínica.
Introducción
La leishmaniosis constituye un grupo de enfermedades parasitarias de interés mundial, que son consideradas por la Organización Mundial de la Salud como enfermedades tropicales desatendidas (1). La leishmaniosis canina (CanL) causada por el protozoo intracelular Leishmania infantum es una enfermedad zoonótica endémica de varios países del sur de Europa, incluido Portugal. En CanL, puede haber una amplia gama de signos clínicos no específicos (2), lo que plantea dificultades para un diagnóstico correcto. Estudios anteriores diferenciaron a los perros enfermos en sintomáticos, oligosintomáticos y polisintomáticos (3-6), aunque más recientemente se ha propuesto un sistema mejorado para la condición clínica del perro en escena (7, 8). Este sistema de clasificación tiene en cuenta el examen físico, las anomalías clínico-patológicas, el título de anticuerpos anti-Leishmania y la evaluación de la función renal de acuerdo con las directrices de la Sociedad Internacional de Interés Renal (9). Otras propuestas también consideran una primera etapa de perros expuestos como aquellos que viven o han vivido en regiones geográficas en las que se ha confirmado la presencia de vectores (10). Los tratamientos convencionales de CanL mejoran la condición clínica del perro, reduciendo la carga de parásitos en la piel y, en consecuencia, el riesgo de transmisión de Leishmania. Aunque no se ha demostrado definitivamente que el tratamiento elimine por completo al parásito (11), y las recaídas son comunes cuando se suspende la terapia (3, 11, 12), sigue siendo crucial para mejorar la eficiencia de los protocolos utilizados para el tratamiento con CanL. Los principales protocolos para el tratamiento de perros suelen incluir el antimoniato de meglumina (antimoniato de N-metilglucamina), la miltefosina (1-O-hexadecilfosfocolina) y el alopurinol. El antimoniato de meglumina es un fármaco pentavalente a base de antimonial cuyo mecanismo de acción preciso aún no se entiende bien, pero se considera un fármaco multifactorial con actividad probable en los procesos moleculares de los parásitos e influencia en la actividad del microbicida de los macrófagos (13, 14). La miltefosina es un compuesto de alquilfosfocolina capaz de inducir apoptosis por mecanismos aún no del todo claros (15-18). El alopurinol es un análogo purina del nucleótido de adenosina, que bloquea la síntesis de ARN, inhibiendo el crecimiento de Leishmania (19). Hasta la fecha, el antimoniato de meglumina en combinación con alopurinol se considera la primera línea de tratamiento en Europa (2), mientras que la miltefosina más el alopurinol ha sido la segunda línea de tratamiento. Sin embargo, la terapia con miltefosina ha estado ganando más atención (3-6), siendo recientemente autorizada en 2017 para el tratamiento con CanL en Brasil (20), un país altamente endémico para la leishmaniosis canina y humana. Sin embargo, con la adecución de más informes de resistencia a los medicamentos que conducen a un fracaso terapéutico, falta de respuesta o recaída, ya sea en humanos o perros, es imprescindible una comprensión más profunda de las terapias habituales (13, 15, 21, 22).
La respuesta inmunitaria de los perros que evidencian signos clínicos de la leishmaniosis generalmente se ha caracterizado por niveles más altos de anticuerpos específicos, junto con una respuesta de T-helper tipo-2 (Th2) asociada con la expresión de interleucina (IL)-4, IL-5 e IL-6 (23-25). Por el contrario, se cree que la inmunidad protectora depende de una fuerte respuesta de tipo 1 T-helper (Th1) caracterizada por la producción de IL-2, IL-12, factor de necrosis tumoral (TNF)-α e interferón (IFN)-γ (23, 25). Además, los parásitos pueden suprimir la inmunidad del huésped mediante la participación de las células T reguladoras (Treg), lo que permite la persistencia de la infección (26), con un estudio que muestra la eliminación de la infección por Leishmania después del agotamiento de las poblaciones de Treg en ratones (27). Además, una mayor expresión de citocinas reguladoras (IL-10, factor de crecimiento tumoral [TGF-β]) asociadas con una alta carga de parásitos observada en perros que presentan signos clínicos (28) sugiere un papel no insignificante de estas citocinas en la progresión de la enfermedad. A nuestro leal saber y entender, no hay un estudio que defina el enfoque ideal para el tratamiento de CanL basado en el conocimiento de la respuesta inmune provocada por los diferentes protocolos de tratamiento, y solo hay un estudio que analiza más de un órgano diana del parásito en CanL no tratada (29). Por lo tanto, otros estudios son esenciales para aclarar cómo los tratamientos afectan la capacidad de los perros para desarrollar una respuesta inmune protectora o, por el contrario, para provocar la supresión inmunitaria de las células efectoras. En el presente estudio, se evaluó la influencia de dos protocolos de tratamiento diferentes en la evolución de la enfermedad de los perros infectados naturalmente y en la respuesta inmune evaluando los cambios clinicopatológicos y la expresión génica de citocinas proinflamatorias (IL-2, IL-12, TNF-α, IFN-γ), antiinflamatorias (IL-4, IL-5)
Materiales y métodos
Selección de perros
Veintitrés perros de al menos 1,5 años de edad, que pesaban más de 5 kg, que no habían sido vacunados para CanL y diagnosticados con la etapa clínica I/II de CanL, de acuerdo con las Directrices de Consenso de LeishVet (7), y la etapa C de acuerdo con las Directrices del Grupo de Trabajo de Leishmaniosis Canina (CLWG Doce de esos 23 perros no se habían sometido a ningún tratamiento en los últimos 8 meses que pudiera interferir con la respuesta inmunitaria (como la terapia con antibióticos y corticosteroides o la administración de inmunomoduladores), y fueron negativos para patógenos circulantes potencialmente responsables de enfermedades transmitidas por vectores caninos (CVBD), fueron seleccionados para participar en el estudio actual. Cinco perros clínicos sanos que no fueron vacunados para CanL, negativos para la prueba de anticuerpos de Leishmania y CVBD también se incluyeron en el presente estudio como grupo de control (Figura 1).Todos los dueños de perros dieron su consentimiento por escrito después de ser informados sobre los objetivos del estudio y cada procedimiento, asegurando que los resultados clínicos estuvieran disponibles. Los perros seleccionados incluyen 13 machos y 4 hembras de varias razas con edades de entre 2 y 9 años y un peso de entre 7,6 y 32,1 kg. El equipo veterinario del Hospital Docente de la Facultad de Medicina Veterinaria de la Universidad de Lisboa (Lisboa, Portugal) realizaron procedimientos de manipulación de animales y recogida de muestras. El presente estudio siguió a la Directiva 86/609/CEE del Consejo de la Unión Europea y fue aprobado por el Comité de Ética y Bienestar Animal de la Facultad de Medicina Veterinaria de la Universidad de Lisboa.
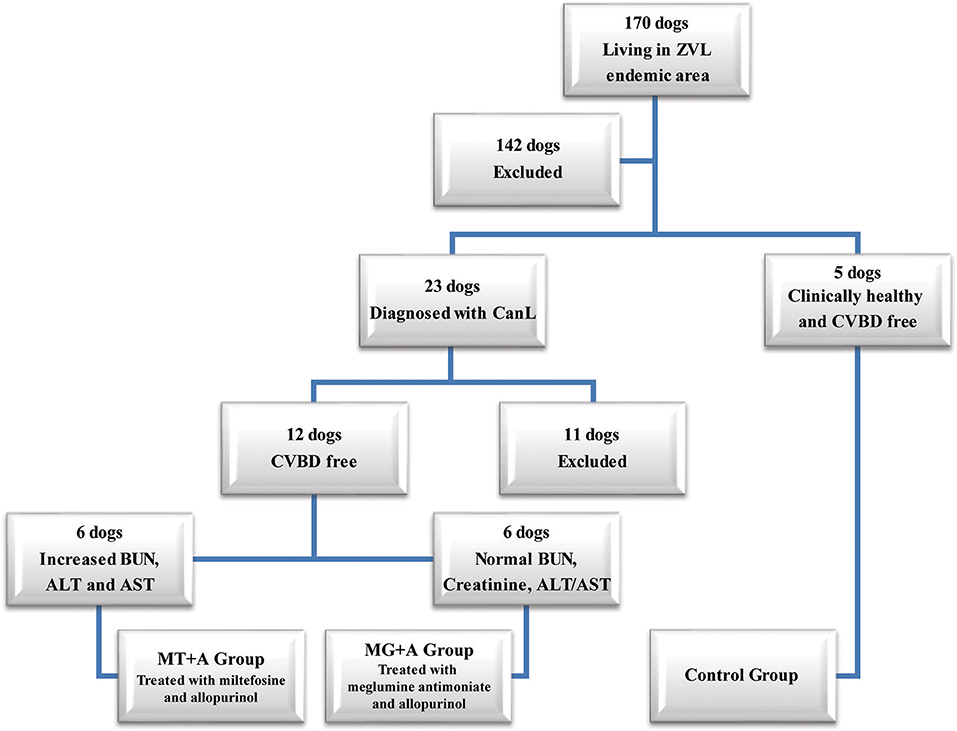 FIGURA 1. Diagrama de flujo que representa el proceso de selección del perro utilizado en el estudio actual. De un total de 170 perros, que viven en un área endémica de leishmaniosis visceral zoonótica, se constituyeron dos grupos de perros con leishmaniosis canina (CanL), y fueron tratados con miltefosina en combinación con alopurinol (MT+A) o con antimoniato de meglumina en asociación con alopurinol ( Estos perros fueron negativos para las enfermedades de los vectores caninos (CVBD). ALT, alanina aminotransferasa; AST, aspartato aminotransferasa; BUN, nitrógeno ureico en sangre.
FIGURA 1. Diagrama de flujo que representa el proceso de selección del perro utilizado en el estudio actual. De un total de 170 perros, que viven en un área endémica de leishmaniosis visceral zoonótica, se constituyeron dos grupos de perros con leishmaniosis canina (CanL), y fueron tratados con miltefosina en combinación con alopurinol (MT+A) o con antimoniato de meglumina en asociación con alopurinol ( Estos perros fueron negativos para las enfermedades de los vectores caninos (CVBD). ALT, alanina aminotransferasa; AST, aspartato aminotransferasa; BUN, nitrógeno ureico en sangre.
Diseño experimental
Para reducir la incomodidad y garantizar el bienestar del perro, la cantidad de recogidas de muestras y su periodicidad se redujeron al mínimo. Se recogieron muestras de sangre, ganglios linfáticos poplíteos y médula ósea de perros sanos (grupo de control) y enfermos antes del inicio del tratamiento (Tp0) y luego de perros enfermos, 1 (Tp1), 2 (Tp2) y 3 meses (Tp3) después del inicio del tratamiento. Las muestras recogidas de perros enfermos en Tp0 se utilizaron, no solo, para establecer los niveles basales de acumulación de ARNm de citoquinas, sino también, por razones éticas, para servir como controles de sí mismos, evitando la necesidad de un grupo adicional de animales enfermos sin ningún tratamiento. El éxito del tratamiento fue clínicamente y serológicamente reevaluado 6 meses después del diagnóstico inicial de cada animal tratado (Figura 2). Cada perro se inscribió en uno de los dos protocolos de tratamiento (Figura 1), de acuerdo con los siguientes criterios:
(i) Los perros que presentaban un aumento de nitrógeno urea en sangre (BUN), creatinina y/o alanina aminotransferasa (ALT), aspartato aminotransferasa (AST) y UCP entre 0,2 y 0,6, lo que apuntando a la posibilidad de desarrollar una lesión hepática y renal, fueron tratados con miltefosina (Milteforan®, Vir
(ii) Los perros que presentaron cambios en los parámetros bioquímicos y hematológicos, proteínas séricas y UCP entre 0,2 y 0,4 fueron tratados con antimoniato de meglumina (Glucantime®, Merial Portuguesa, Portugal; 100 mg/kg SID durante 4 semanas) en combinación con alopurinol 10 mg/kg, por os, BID durante
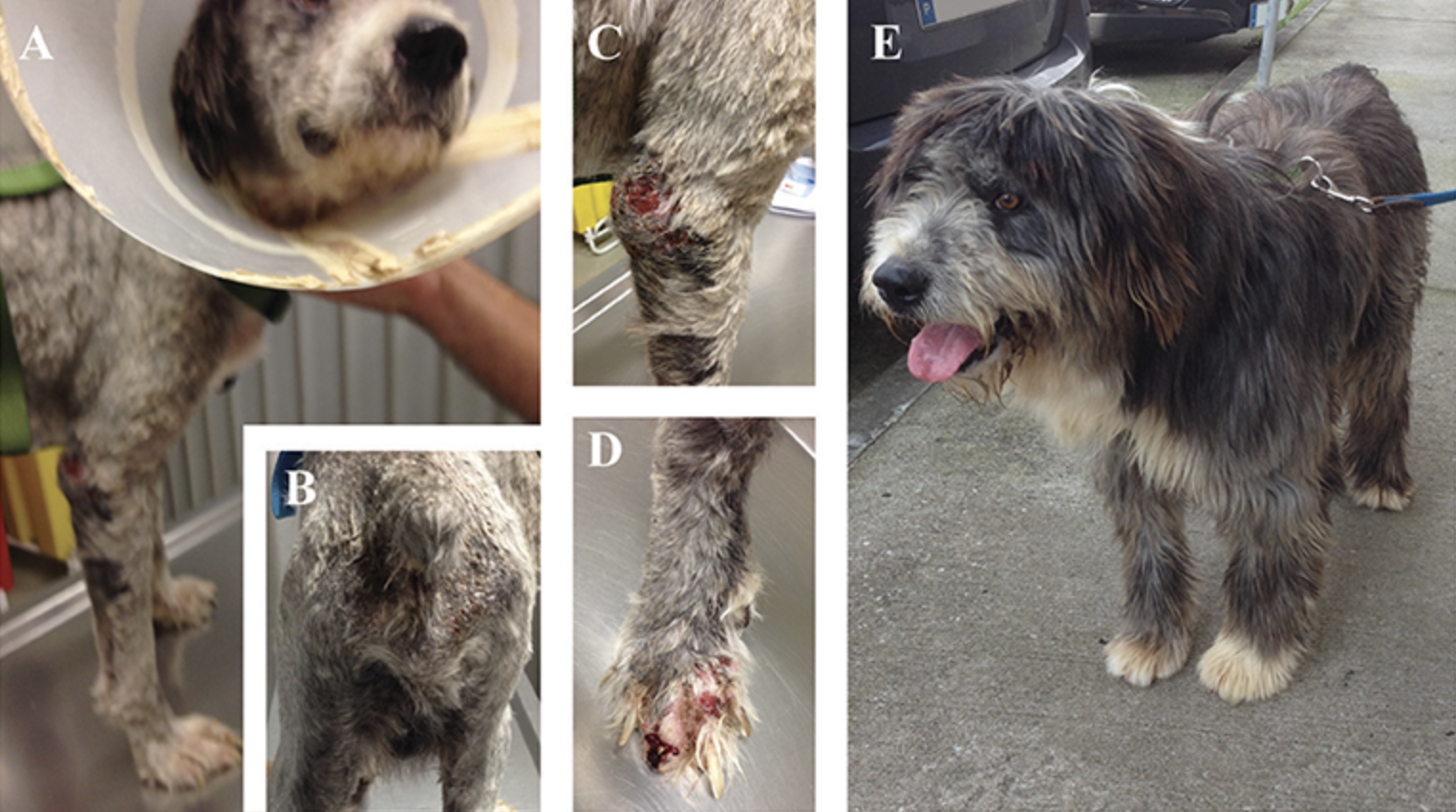
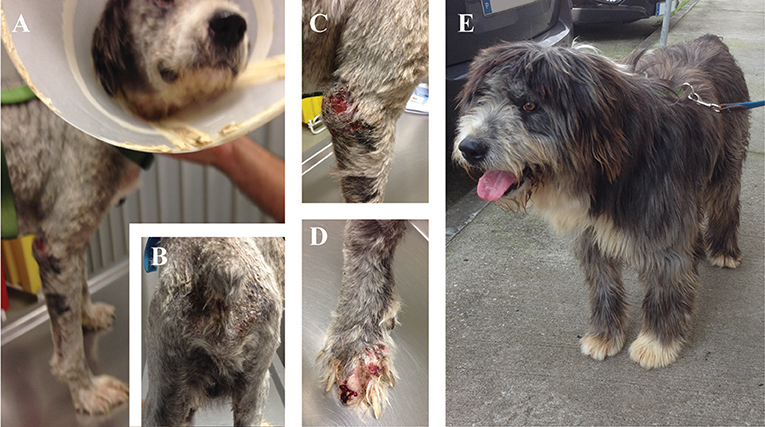 FIGURA 2. Manifestaciones clínicas de un perro infectado naturalmente con Leishmania infantum. (A, B) Perro que presenta una pérdida de peso evidente, letargo, alopecia cutánea y dermatitis exfoliante; (C) Lesiones ulcerosas e hiperqueratosis en el codo de la extremidad delantera; (D) Onicoglofisosis con sangrado severo; (E) Perro del grupo MT+A 6 meses después del diagnóstico con remisión completa de los signos Fotos de Marcos Santos.
FIGURA 2. Manifestaciones clínicas de un perro infectado naturalmente con Leishmania infantum. (A, B) Perro que presenta una pérdida de peso evidente, letargo, alopecia cutánea y dermatitis exfoliante; (C) Lesiones ulcerosas e hiperqueratosis en el codo de la extremidad delantera; (D) Onicoglofisosis con sangrado severo; (E) Perro del grupo MT+A 6 meses después del diagnóstico con remisión completa de los signos Fotos de Marcos Santos.
Se aplicaron collares impregnados de Deltametrarina a todos los perros para prevenir infecciones o reinfecciones durante el estudio actual y también para evitar la diseminación de Leishmania a las moscas de arena. Se utilizaron muestras de sangre para determinar los parámetros hematológicos y bioquímicos, así como para las pruebas serológicas y moleculares. El ganglio linfático poplíteo, la médula ósea y la sangre periférica se utilizaron para examinar la expresión génica de las citoquinas. Las muestras de orina se recogieron en recipientes esterilizados para el análisis de orina y la determinación de la relación proteína/creatinina (UPC).
Recogida de muestras, análisis hematológico y bioquímico y pruebas serológicas
La sangre periférica (20 ml) se recogió en jeringas que contenían citrato fosfato dextrosa adenina (CPDA-1, Medinfar Sorológico, Portugal). Los aspirados linfáticos poplíteos se recogieron en jeringas que contenían 0,8 ml de solución salina (0,9 % de NaCl) para evitar la interrupción celular y luego se transfirieron a tubos de ácido etilenodiaminetetraacético (EDTA) para evitar la coagulación. Después de la anestesia cutánea con un spray de bomba de xilocaína al 10% (AstraZeneca, Reino Unido), los aspirados de médula ósea se recogieron del área distal de las costillas, entre las novena y las 11, en jeringas que contenían 0,8 ml de solución salina. Se recogieron 4 ml adicionales de sangre en tubos EDTA y tubos secos para ser utilizados para análisis hematológico (conjunto sanguíneo completo), análisis bioquímico (medición sérico de alanina aminotransferasa (ALT), aspartato aminotransferasa (AST), fosfatasa alcalina, bilirrubina, nitrógeno de urea en sangre (BUN), creatinina, fósforo También se utilizaron muestras de sangre periféricas para el aislamiento de células mononucleares. El ganglio linfático poplíteo y la médula ósea se utilizaron para la detección de formas de amastigoto de Leishmania y el aislamiento de células mononucleares.
Detección de Leishmania
Se utilizaron muestras de suero para la detección de anticuerpos anti-Leishmania mediante el ensayo IFAT (Leishmania-Spot IF, BioMérieux, Francia) utilizando promastigotos L. infantum como antígeno y siguiendo las instrucciones del fabricante. Las muestras se detectaron utilizando un microscopio Olympus DP10 (modelo BX50F, longitud de onda de 425 nm) y se clasificaron como positivas si se observó fluorescencia en el citoplasma o membrana de promastigote a una dilución sérica de 1:80 o superior. De acuerdo con LeishVet (7) y las directrices del Grupo de Trabajo de Leishmaniosis Canina (CLWG) (10), IFAT es una prueba de oro para la leishmaniosis canina y para evaluar posibles recaídas.
Para probar la presencia de ADN de Leishmania, el ADN genómico total se extrajo de 200 μl de sangre periférica utilizando el kit de sangre y tejido DNeasy® (QIAGEN®, Alemania) de acuerdo con las instrucciones del fabricante. La amplificación de ADN por qPCR se realizó en un volumen total de 20 μl, que comprende 10 μl de TaqMan® Gene Expression Master Mix (Applied BiosystemsTM, EE. UU.), 2 μl de agua ultrapura (Merck MilliporeTM KGaA, Alemania), 300 nM de imprimaciones delanteras e Las reacciones se llevaron a cabo utilizando el ciclor térmico PCR en tiempo real 7300 (Applied BiosystemsTM), con las siguientes condiciones de ciclo: 10 min a 95°C para la activación de AmpliTaq® Gold, seguido de un total de 40 ciclos de 15 s a 95 °C y 1 min a 60 °C. El control positivo se construyó clonando fragmentos de PCR generados por las mismas imprimaciones en un vector fácil pGEM®-T (Promega, EE. UU.), de acuerdo con las instrucciones del fabricante. Los fragmentos ligados se transformaron en células competentes JM109 y el ADN plásmido se preparó utilizando el QIAprep® Spin Miniprep Kit (QIAGEN®). El inserto se secuenciaba utilizando imprimaciones pUC/M13 (Promega) para garantizar la estabilidad de la transformación. Para excluir la presencia de amastigotos de Leishmania, los linfáticos y las diapositivas de la médula ósea se mancharon con Giemsa y se observaron mediante microscopía óptica (microscopio Olympus CX31, utilizando una ampliación de 1000 ×).
Exclusión de CVBD
La detección de anticuerpos contra Babesia, Anaplasma, Ehrlichia y Rickettsia se realizó utilizando pruebas de diagnóstico comerciales (Megacor® MegaScreen, Austria, FLUOBABESIA canis-cortado 1:32; FLUOANAPLASMA phagocytophilum-cortado 1:50; FLUOEHRLICHIA canis-corta 1:50; FLUORICKETTSIA conorii La ausencia de ADN de Babesia, Anaplasma, Ehrlichia y Rickettsia también se evaluó mediante qPCR (Tabla 1) como se describió anteriormente. Para excluir la presencia de Dindofilaria immitis microfilaria, las muestras de sangre se evaluaron mediante la técnica Knott y los antígenos de parásitos se evaluaron mediante el kit Witness® Dirofilaria (Zoetis, Portugal) de acuerdo con las instrucciones del fabricante.
Aislamiento celular
La sangre periférica de perro se volvió a suspender en PBS (1:1 v/v), se superponó sobre una solución de Histopaque®-1077 1:2 (Sigma-Aldrich, Alemania) y se centrifugó a 400 g durante 30 minutos a 18 °C. Las células mononucleares se recogieron y lavaron en PBS frío (300 g, 10 min, 4°C), se volvieron a suspender en PBS, y el volumen total se ajustó a 2 × 107 células ml-1. Los aspirados de los ganglios linfáticos y la médula ósea se centrifugaron a 400 g (4°C) durante 5 y 15 minutos, respectivamente, y se volvieron a suspender en 100 μl, con el volumen total también ajustado para 2 × 107 células.ml−1. Luego, 200 μl de células mononucleares de sangre periférica (PBMC) y 100 μl de suspensiones de linfonoides y células de médula ósea se centrifugaron a 400 g (4°C) durante 5 minutos, se volvieron a suspender en 600 μl de RLT Buffer (QIAGEN®) suplementado con β
Extracción de ARNm y transcripción inversa
El ARN total extraído de PBMC, ganglios linfáticos y células de la médula ósea, utilizando RNeasy® Mini Kit (QIAGEN®) y columnas de espín QIAshredder® (QIAGEN®) se trató con DNasa I Amplification Grade (InvitrogenTM, EE. UU.) de acuerdo con las instrucciones del fabricante. Para la síntesis de ADNc, 1 μg de ARN purificado, que presentaba una relación de absorbancia de 260/280 que oscilaba entre 1,9 y 2,1, se desnaturalizó a 65 °C durante 5 minutos y se transcribió de forma inversa a 37 °C durante 60 minutos en una mezcla de reacción final de 30 μl que contiene 6 μ TM, EU) e inhibidor de la RNasa RiboLock de 40 U/μl (Thermo Fisher Scientific Inc. TM). Las muestras de ADNc se calentaron a 95 °C durante 10 minutos para la inactivación de enzimas y se almacenaron a -20 °C hasta su uso posterior.
Expresión del gen de citoquinas
Para evaluar el efecto del tratamiento en citocinas proinflamatorias, antiinflamatorias y reguladoras, la acumulación de ARNm que codifica para IL-2, IL-4, IL-5, IL-10, IL-12, TNF-α, TGF-β e IFN-γ se evaluó mediante qPCR en PBMC, ganglios linfático y células de Cada amplificación de muestra se realizó por triplicado, utilizando las siguientes condiciones: 10 minutos a 95 °C para la activación de AmpliTaq® Gold, seguido de un total de 40 ciclos (perfil térmico para cada ciclo: 15 s a 95 °C, 1 minuto a 60 °C). Se agregó un paso de disociación adicional para confirmar la especificidad de la amplificación mediante el análisis del punto de fusión y la ausencia de productos no específicos. Los estándares externos de ADNc para todas las citocinas diana y el control interno utilizados en cada reacción se construyeron como se describió anteriormente. La concentración de los estándares se determinó midiendo el OD a 260 nm seguido del cálculo del número de copia correspondiente, y se utilizaron diluciones en serie de los clones resultantes como curvas estándar, cada una conteniendo una cantidad conocida de número de copia de entrada (39,40). Los números de copia de los genes diana se normalizaron al gen de limpieza β-actina, por lo tanto, corrigiendo las variaciones menores en el aislamiento del ARNm y la transcripción inversa. Los resultados finales se expresaron como el número de copia de cada citocina por cada 1.000 copias del gen de limpieza. Las eficiencias de amplificación fueron >90 %.
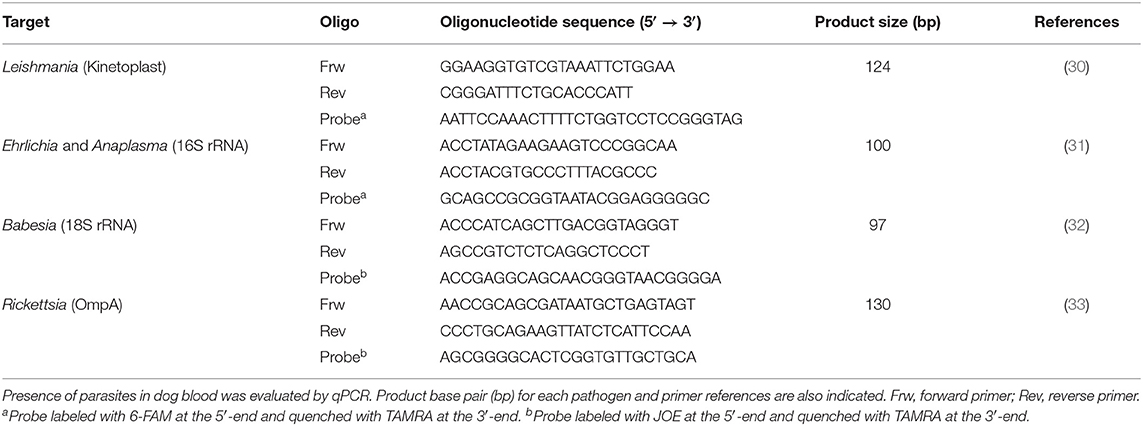
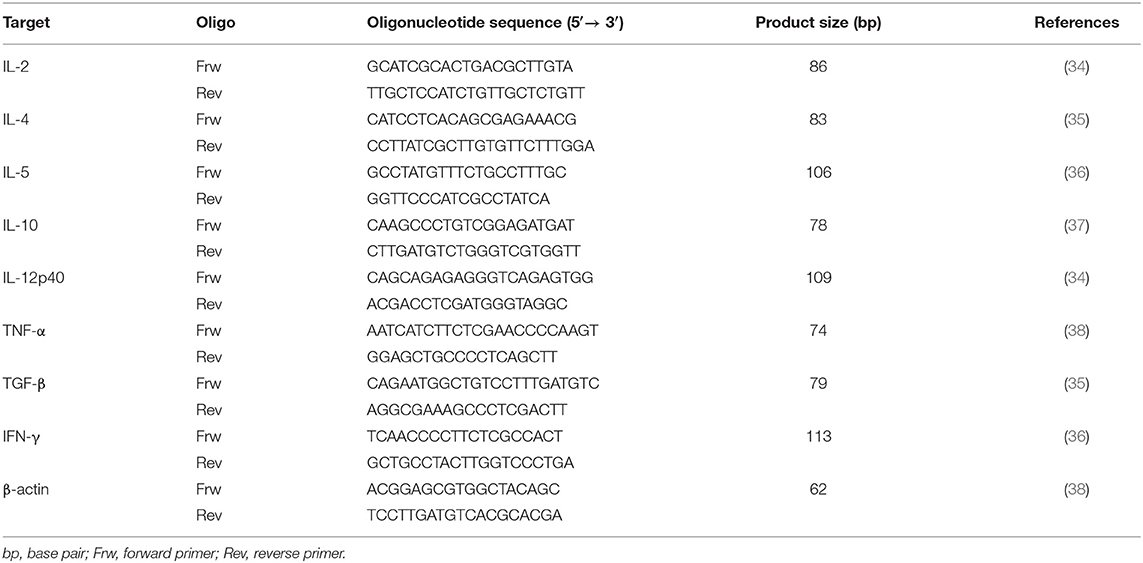 TABLA 2. Imprimaciones utilizadas para la cuantificación de la expresión de ARNm de citoquinas por qPCR.
TABLA 2. Imprimaciones utilizadas para la cuantificación de la expresión de ARNm de citoquinas por qPCR.
Análisis de datos
Se realizó un análisis estadístico exploratorio multivariado, específicamente el Análisis de Componentes Principales (PCA), por tejido, en todos los conjuntos de datos, con el fin de identificar los componentes principales que representan la mayoría de la variación y evaluar gráficamente la separación entre los perros de control sanos, enfermos (Tp0) y tratados (Tp1, Tp2 y Tp3). Este análisis estadístico se realizó utilizando la versión 14.3.0 de JMP (Instituto SAS). Del mismo modo, también se utilizó un análisis de K-Means Cluster para complementar el análisis anterior de PCA y confirmar la separación de la agrupación. Con el fin de reducir el número de variables irrelevantes o redundantes y presentar un modelo más robusto, se empleó un método de selección de características. Usando la herramienta Predictor Screening de JMP, se obtuvo la contribución individual de cada variable, y se consideraron las características seleccionadas en los modelos finales.
El análisis estadístico entre grupos de tratamiento se realizó utilizando el paquete de software GraphPad Prism versión 8.0.1. La normalidad de los datos se evaluó utilizando la prueba Kolmogorov-Smirnoff. La prueba de rango firmada por Wilcoxon se utilizó para comparar los resultados hematológicos y bioquímicos en cada grupo de tratamiento de perros entre Tp0 y Tp3, y las diferencias se consideraron significativas cuando p < 0,05. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en las filas) con la prueba post hoc de Dunn se utilizó para evaluar las diferencias en los niveles de ARNm entre los grupos de tratamiento y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparar perros en diferentes puntos de tiempo.
Resultados
Ambos protocolos de tratamiento conducen a la remisión clínica del perro
Las frotis de sangre de perros de MT+A, MG+A y Control Group fueron todas negativas para los agentes causantes de CVBD. Los perros presentaron una serología negativa para Babesia, Anaplasma, Ehrlichia y Rickettsia, y fueron negativos para la detección de ADN de estos parásitos. Los perros también fueron negativos en la migración inmune rápida para el antígeno D. immitis y la microfilaria estaban ausentes en la técnica de Knott.
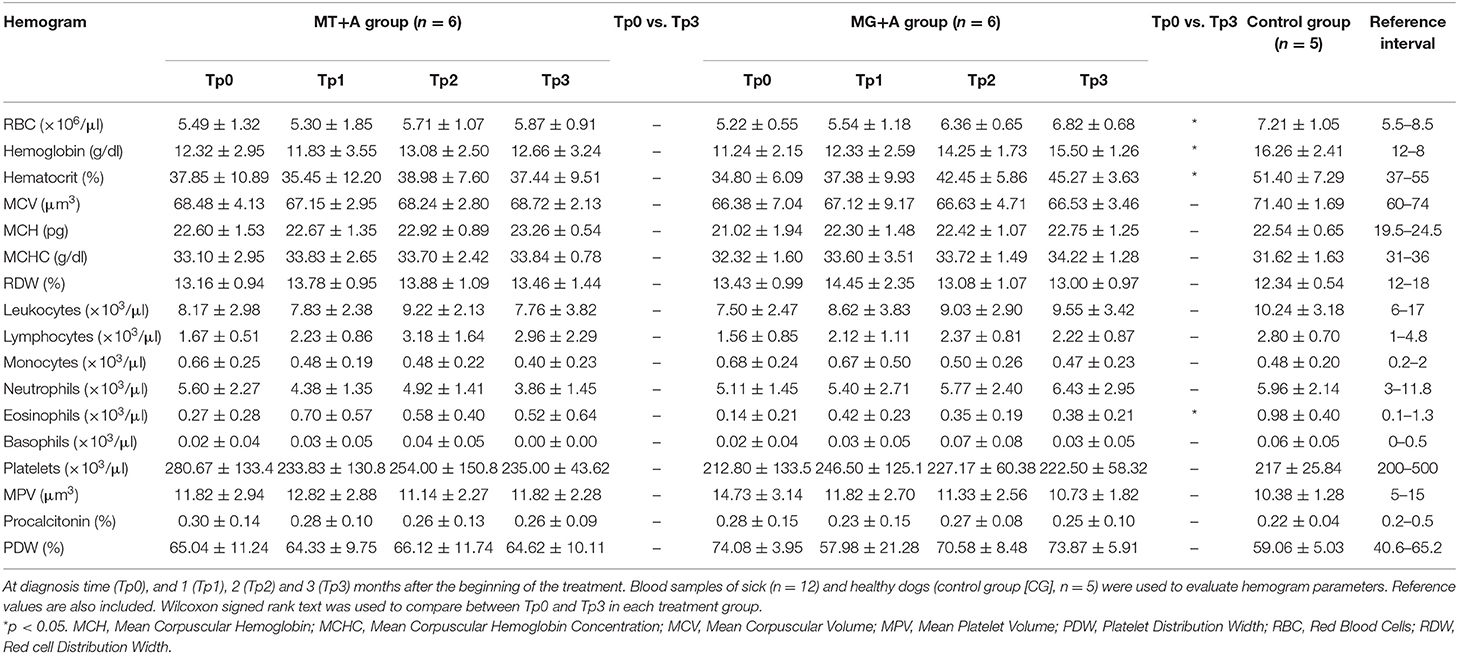
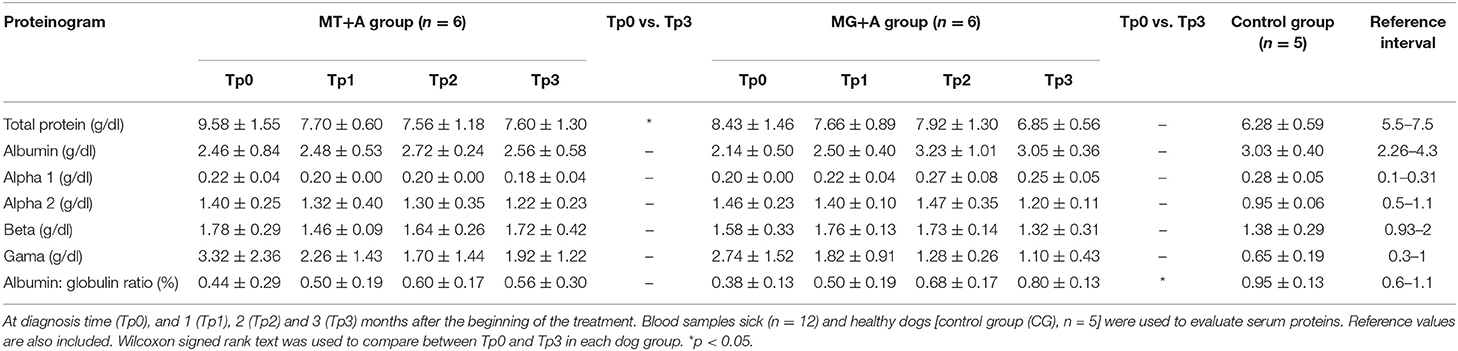
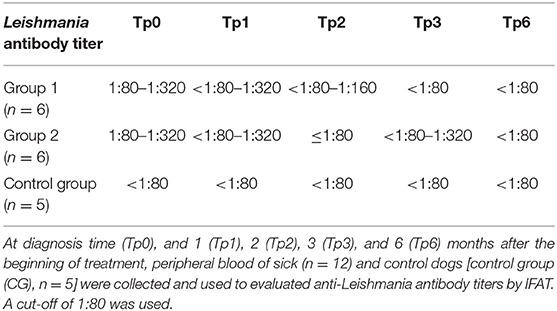
Los signos clínicos observados en perros enfermos al comienzo del estudio (Tp0) incluyeron pérdida de peso corporal (Figuras 2A,B), linfadenopatía local/generalizada, disminución/aumento del apetito, letargo, palidez de la membrana mucosa, poliuria/polidipsia, alopecia cutánea, onicoglofiosis (Figura 2D), hiperquerat También se observaron otros signos clínicos, como epistaxis, cojera y miositis muscular masticatoria. No se detectaron signos clínicos en perros del Grupo de Control. Los perros enfermos también mostraron cambios en los parámetros hematológicos y bioquímicos, incluyendo una ligera disminución de los valores de hemoglobina, eritropopenia leve, valores más bajos de hematocrito, trombocitopenia (Tabla 3), azotemia renal leve (Tabla 4), hiperglobulinemia con aumento de las fracciones de alfa 2 y gammaglobulina, y disminución de los Los perros del grupo MT+A presentaron valores de BUN más altos y un AST y ALT acentuados, mientras que los perros del grupo MG+A mostraron valores normales de BUN y un ligero aumento en los valores de ALT y AST (Tabla 4, Figura 3). Tres perros del grupo MT+A también mostraron valores de creatinina inferiores a 1,4 mg/dL y proteinuria leve, presentando una relación proteína-creatinina en la orina (UPC) de 0,6. Los perros del grupo de control mostraron parámetros hematológicos y bioquímicos normales, proteínas séricas y valores de análisis de orina. Los ganglios linfáticos y las frotis de médula ósea de perros de los grupos MT+A y MG+A presentaron formas de amastigotos dentro de los macrófagos asociados con la hiperplasia linfoide. Los perros de ambos grupos mostraron títulos de anticuerpos anti-Leishmania que oscilaban entre 1:80 y 1:320. No se detectaron anticuerpos antileishmaniales en perros del Grupo de Control (Tabla 6). Un mes después del tratamiento (Tp1), los perros de MG+A mostraron mayor vivacidad y energía que los perros de MT+A. Tres meses después del inicio del tratamiento (Tp3), ambos grupos mostraron una recuperación exitosa, mostrando la remisión de todos los signos clínicos. Los perros del grupo MT+A presentaron una recuperación significativa (p < 0,05) de los valores de BUN a niveles normales. AST y ALT se recuperaron rápidamente a los valores normales en perros del grupo MG+A (Tabla 4). Aunque presenta valores más altos de AST y ALT, el tratamiento combinado de miltefosina y alopurinol promovió la disminución de AST y ALT en perros del grupo MT+A, aunque más lento, con valores de análisis de orina volviendo a la normalidad. Los perros del grupo MG+A mostraron una normalización de la relación de globulina de albúmina 2 meses después del inicio del tratamiento (Tp2) y 1 mes después (Tp3) la proteína total y la gammaglobulina estaban dentro de los valores de referencia. Sin embargo, en los perros del grupo MT+A, la proteína total y la gammaglobulina se mantuvieron altas y la globulina alfa 2 se normalizó 3 meses después del inicio del tratamiento (Tp3) (Tabla 5, Figura 3). Tres meses después del inicio del tratamiento (Tp3), los perros MG+A fueron negativos para anticuerpos anti-Leishmania y, con la excepción de un perro que tenía un tinte de 1:320, los perros del grupo MT+A también fueron negativos. Cuando se reevaluó 6 meses después del diagnóstico inicial, este perro positivo fue negativo para los anticuerpos antileishmaniales (Tabla 6). Además, ya no se observaron formas de amastigota en los ganglios linfáticos y frotis de médula ósea de perros de ambos grupos.
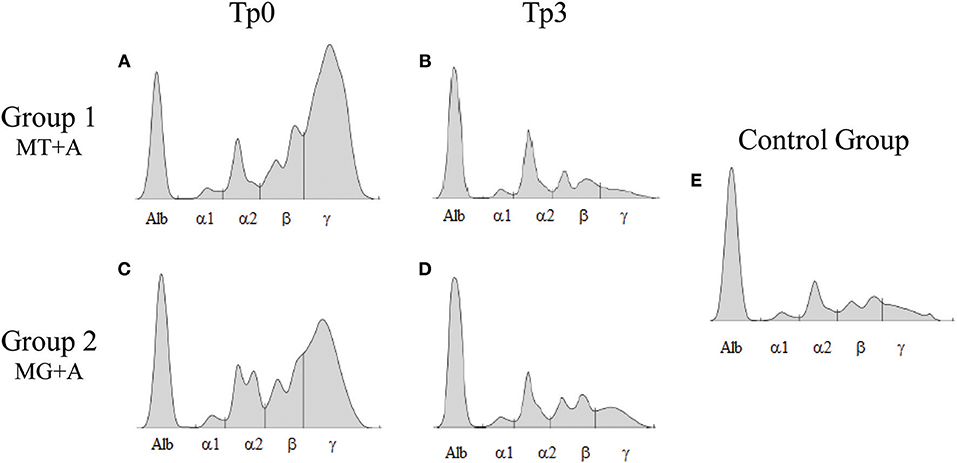 FIGURA 3. Electroforesis de proteínas séricas de perros enfermos y tratados. Se muestran proteinogramas representativos de enfermos [Tp0; (A) MT+A; (B) MG+A], [Tp3; (C) MT+A; (D) MG+A] y perros clínicamente sanos (E) tratados. Alb, Albumina; α1, α1-globulina; α2, α2-globulina; β, β-globulina; γ, γ-globulina.
FIGURA 3. Electroforesis de proteínas séricas de perros enfermos y tratados. Se muestran proteinogramas representativos de enfermos [Tp0; (A) MT+A; (B) MG+A], [Tp3; (C) MT+A; (D) MG+A] y perros clínicamente sanos (E) tratados. Alb, Albumina; α1, α1-globulina; α2, α2-globulina; β, β-globulina; γ, γ-globulina.
El componente principal y el análisis de racimo permiten la distinción entre perros sanos y enfermos
El análisis de componentes principales en PBMC confirmó que los perros sanos y enfermos podrían distinguirse en función de su expresión de IFN-γ, IL-2, IL-4, IL-5, IL-12 y TGF-β junto con los resultados de IFAT, con estas características explicando el 65,5% de la distribución (Figura 4A). En los ganglios linfáticos, el PCA también fue capaz de distinguir a los perros sanos y enfermos en función de la expresión de IFN-γ, IL-2 e IL-10 junto con los resultados de IFAT, con el 63,4% de la distribución explicada por estas variables (Figura 4C). Para la médula ósea, la expresión de IFN-γ, IL-4, IL-5 e IL-12, junto con los resultados de IFAT, permitió distinguir entre perros sanos y enfermos, con estas características explicando el 72,3 % de la distribución (Figura 4E). Estos resultados también están respaldados por el análisis de clústeres (Figuras 4B,D,F), con la formación de dos grupos separados. No se pudo distinguir a los perros de ambos grupos de tratamiento en función de las características seleccionadas, pero la transición del grupo de perros enfermos al grupo de perros sanos a lo largo de los puntos de tiempo se puede observar en PBMC, ganglio linfático y médula ósea.
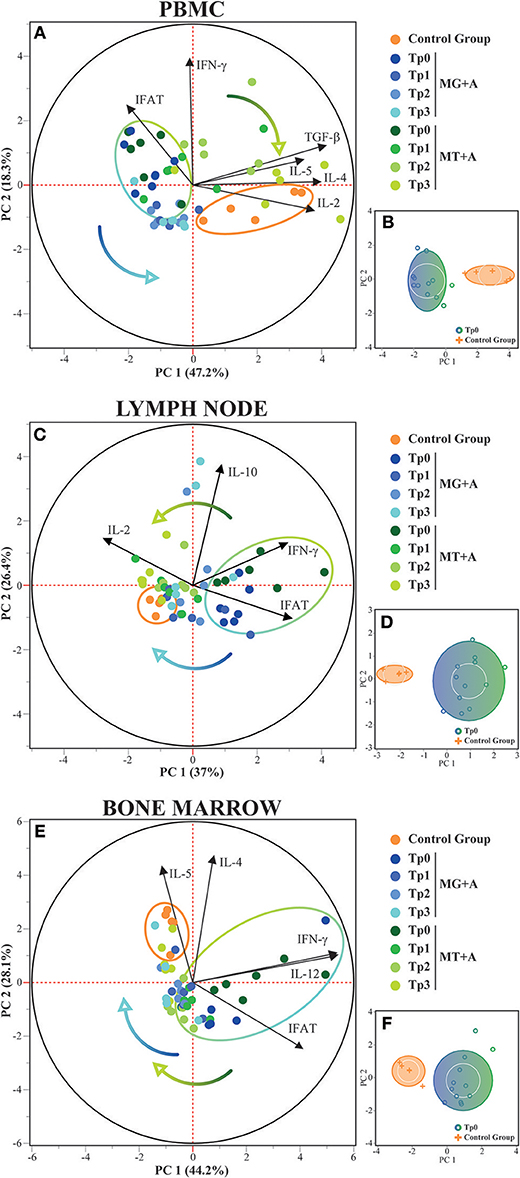 FIGURA 4. Análisis del componente principal y del clúster de la expresión de citoquinas en PBMC, ganglios linfáticos y médula ósea. El análisis de componentes principales se utilizó para identificar los dos primeros componentes principales que explican 65,5, 63,4 y 72,3% para cada tejido respectivo, de la variación en el conjunto de datos. (A,C, E) Biplot de la puntuación y los gráficos de carga que muestran las variables que se cargan en los respectivos componentes principales. Los grupos de control, MG+A y MT+A se presentan por diferentes puntos de color a lo largo de todos los puntos de tiempo, con el grupo de control y los perros enfermos (Tp0) delimitados por su respectivo halo. Las flechas de colores muestran la transición de los perros tratados a lo largo del tiempo. (B,D,F) Análisis de clúster que confirma la separación de perros sanos y enfermos (Tp0) utilizando las variables seleccionadas. PC, componente principal.
FIGURA 4. Análisis del componente principal y del clúster de la expresión de citoquinas en PBMC, ganglios linfáticos y médula ósea. El análisis de componentes principales se utilizó para identificar los dos primeros componentes principales que explican 65,5, 63,4 y 72,3% para cada tejido respectivo, de la variación en el conjunto de datos. (A,C, E) Biplot de la puntuación y los gráficos de carga que muestran las variables que se cargan en los respectivos componentes principales. Los grupos de control, MG+A y MT+A se presentan por diferentes puntos de color a lo largo de todos los puntos de tiempo, con el grupo de control y los perros enfermos (Tp0) delimitados por su respectivo halo. Las flechas de colores muestran la transición de los perros tratados a lo largo del tiempo. (B,D,F) Análisis de clúster que confirma la separación de perros sanos y enfermos (Tp0) utilizando las variables seleccionadas. PC, componente principal.
La infección por Leishmania forma el perfil de las citoquinas de los perros
Los perros enfermos (MT+A y MG+A) mostraron una acumulación significativa de ARNm IFN-γ en las células de PBMC (pMT+A = 0,0057; pMG+A = 0,0425; Figura 5J), ganglio linfático (pMT+A = 0,001; pMG+A = 0,0028; Figura 5K) y médula ósea Las células de la médula ósea de los perros de MT+A mostraron una regulación ascendente significativa de la IL-12 (p = 0,0059; Figura 5F) en comparación con los perros de control. Por otro lado, las células ganglios linfáticos de los perros enfermos evidenciaron una reducción significativa del ARNm de IL-2 (pMT+A = 0,0365; pMG+A = 0,0068; Figura 5B). Los perros del grupo MG+A también mostraron una regulación a la baja significativa de la expresión del gen IL-2 en PBMC (p = 0,0193; Figura 5A) y TNF-α en las células linfáticos (p = 0,0186; Figura 5H). Mientras que los perros del grupo MT+A mostraron una regulación ascendente significativa de la expresión génica TNF-α en las células de la médula ósea (p = 0,0413; Figura 5I). No se encontraron diferencias significativas en la expresión génica de IL-12 por PBMC y células linfáticos, IL-2 por células de médula ósea y TNF-α por PBMC en comparación con perros clínicamente sanos.
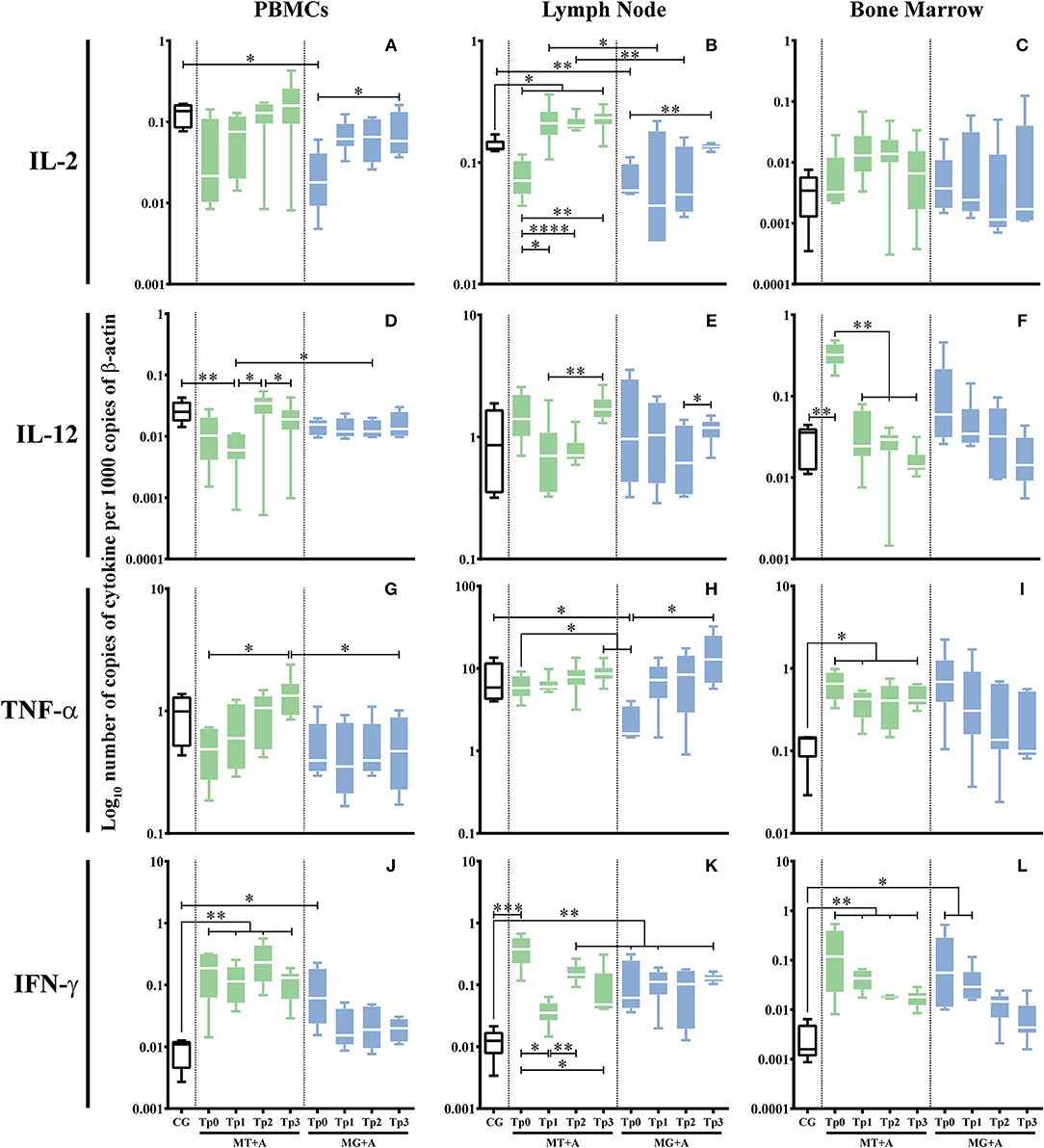 FIGURA 5. Expresión del gen de citoquinas proinflamatoria en perros tratados con el protocolo MT+A o MG+A a lo largo de todos los puntos de tiempo. El ARNm de IL-2 (A-C), IL-12 (D-F), TNF-α(G-I) y IFN-γ (J-L) en las células PBMC (A,D,G,J), ganglios linfáticos (B,E,H,K) y médula ósea (C,F,I,L) Los resultados de 17 perros y tres réplicas por muestra están representados por la parcela de caja y bigote, valores medianos, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en las filas) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamientos y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. *p < 0,05, **p < 0,01, ***p < 0,001 y ****p < 0,0001) indican significación estadística.
FIGURA 5. Expresión del gen de citoquinas proinflamatoria en perros tratados con el protocolo MT+A o MG+A a lo largo de todos los puntos de tiempo. El ARNm de IL-2 (A-C), IL-12 (D-F), TNF-α(G-I) y IFN-γ (J-L) en las células PBMC (A,D,G,J), ganglios linfáticos (B,E,H,K) y médula ósea (C,F,I,L) Los resultados de 17 perros y tres réplicas por muestra están representados por la parcela de caja y bigote, valores medianos, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en las filas) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamientos y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. *p < 0,05, **p < 0,01, ***p < 0,001 y ****p < 0,0001) indican significación estadística.
PBMC (pMT+A = 0,0662; pMG+A = 0,0032; Figura 6A) y la médula ósea (pMG+A = 0,0138; Figura 6C) de los perros enfermos evidenciaron una regulación significativa a la expresión del gen IL-4 en comparación con el CG. En las células linfáticas, no se observaron diferencias significativas en la expresión del gen IL-4. PBMC de perros enfermos del grupo MT+A (p = 0,0031; Figura 6D) y las células de la médula ósea de los perros del grupo MG+A (p = 0,0082; Figura 6F) mostraron una regulación a la baja estadísticamente significativa de la expresión del gen IL-5. Además, las células ganglios linfáticos de MT+A mostraron una acumulación significativa de ARNm de IL-5 (p = 0,0235; Figura 6E).
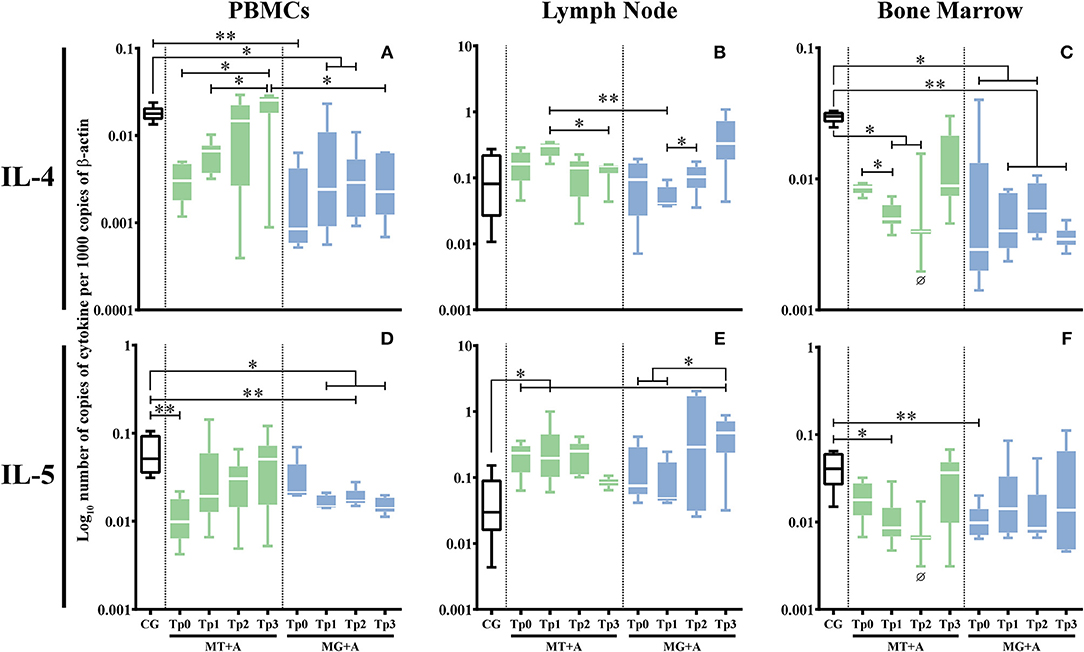 FIGURA 6. Expresión del gen de citoquinas antiinflamatorias en perros tratados con el protocolo MT+A o MG+A a lo largo de todos los puntos de tiempo. El ARNm de IL-4 (A-C) y IL-5 (D-F) en las células de PBMC (A,D), ganglios linfáticos (B,E) y médula ósea (C,F) de perros de MT+A, MG+A y Grupo de Control (CG) se evaluó mediante qPCR. Los resultados de 17 perros y tres réplicas por muestra están representados por la parcela de caja y bigote, valores medianos, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en las filas) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamientos y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. *p < 0,05, **p < 0,01 indican significación estadística. Ø muestra los valores de expresión de ARNm de solo tres perros.
FIGURA 6. Expresión del gen de citoquinas antiinflamatorias en perros tratados con el protocolo MT+A o MG+A a lo largo de todos los puntos de tiempo. El ARNm de IL-4 (A-C) y IL-5 (D-F) en las células de PBMC (A,D), ganglios linfáticos (B,E) y médula ósea (C,F) de perros de MT+A, MG+A y Grupo de Control (CG) se evaluó mediante qPCR. Los resultados de 17 perros y tres réplicas por muestra están representados por la parcela de caja y bigote, valores medianos, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en las filas) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamientos y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. *p < 0,05, **p < 0,01 indican significación estadística. Ø muestra los valores de expresión de ARNm de solo tres perros.
Una regulación inicial significativa de la IL-10 en PBMC de MG+A (p = 0,0153; Figura 7A) y una regulación ascendente en las células linfáticas de los perros enfermos (pMT+A = 0,0041, pMG+A = 0,0112; Figura 7B). No se observaron diferencias significativas en la expresión génica de IL-10 en las células de la médula ósea de los perros enfermos en comparación con los perros de control.
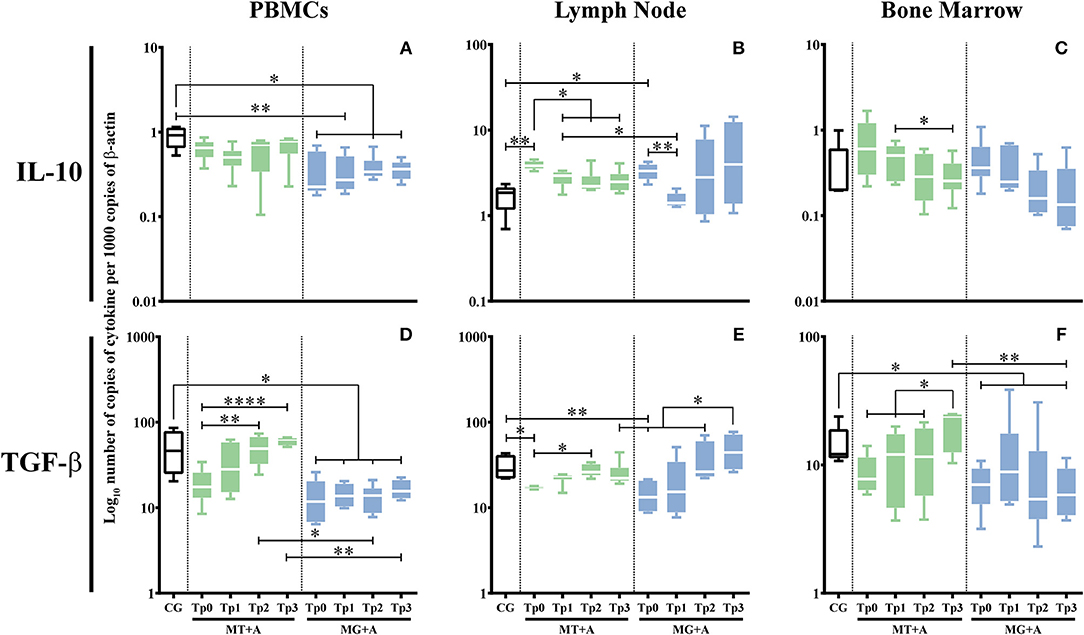 FIGURA 7. Expresión génica reguladora de citoquinas en perros tratados con el protocolo MT+A o MG+A a lo largo de todos los puntos de tiempo. El ARNm de IL-10 (A-C) y TGF-β (D-F) en las células de PBMC (A,D), ganglios linfáticos (B,E) y médula ósea (C,F) de perros de MT+A, MG+A y Grupo de Control (CG) fue evaluado por qPCR. Los resultados de 17 perros y tres réplicas por muestra están representados por la parcela de caja y bigote, valores medianos, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en las filas) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamientos y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. *p < 0,05, **p < 0,01 y ****p < 0,0001 indican significación estadística.
FIGURA 7. Expresión génica reguladora de citoquinas en perros tratados con el protocolo MT+A o MG+A a lo largo de todos los puntos de tiempo. El ARNm de IL-10 (A-C) y TGF-β (D-F) en las células de PBMC (A,D), ganglios linfáticos (B,E) y médula ósea (C,F) de perros de MT+A, MG+A y Grupo de Control (CG) fue evaluado por qPCR. Los resultados de 17 perros y tres réplicas por muestra están representados por la parcela de caja y bigote, valores medianos, mínimos y máximos. La prueba no paramétrica de Kruskal-Wallis (ANOVA unidireccional en las filas) con la prueba post hoc de Dunn se utilizó para comparaciones estadísticas entre los grupos de tratamientos y el CG. La prueba ANOVA de medidas repetidas con la prueba post hoc de Tukey se utilizó para comparaciones estadísticas dentro de cada grupo de tratamiento. *p < 0,05, **p < 0,01 y ****p < 0,0001 indican significación estadística.
Se observó una reducción significativa en la acumulación de ARNm de TGF-β en PBMC (pMG+A = 0,0112; Figura 7D) y las células de los ganglios linfáticos (pMT+A = 0,0425; pMG+A = 0,0057; Figura 7E) de los perros enfermos en relación con el CG. Las células de la médula ósea del grupo MG+A (Figura 7F) también mostraron una regulación a la baja significativa de TGF-β (p = 0,0186).
Aunque hubo diferencias entre los perros enfermos, estos resultados parecen indicar que la infección por Leishmania puede dar forma a la respuesta inmune de los perros al inducir la regulación superior del IFN-γ, mientras que otras citocinas proinflamatorias (IL-2), antiinflamatorias (IL-4) y reguladoras (TGF-β) se reducían. Además, la modulación del TNF-α, un actor clave en la activación de los macrófagos, IL-5, que está involucrado en la diferenciación de los linfocitos B activados en células plasmáticas secretas de Ig, y IL-10, una citocina asociada con la regulación inmune, parece ser específica del tejido.
El aumento de la expresión génica de las citocinas proinflamatorias persiste después del tratamiento con mixofinas en combinación con alopurinol
La expresión génica de las citocinas que fueron modificadas por la infección se evaluó a lo largo de todos los puntos de tiempo y se estudiaron los tejidos. En perros tratados con MT+A, las células de la médula ósea (Figura 5F) evidenciaron una expresión del gen IL-12 similar a CG 1 mes después del inicio del tratamiento y a lo largo del estudio, apuntando hacia la normalización. La expresión del gen IFN-γ todavía estaba regulada en las células PBMC (pTp1 = 0,0027, pTp2 = 0,0023, pTp3 = 0,0013; Figura 5J), ganglio linfático (pTp2 = 0,0061; Figura 5K) y médula ósea (pTp1 = 0,0057, pTp2En las células linfáticas, hubo un ligero aumento en la acumulación de ARNm IFN-γ en Tp2 en comparación con Tp1 (pTp1 = 0,0032). Sin embargo, se observó una tendencia a la normalización en la médula ósea.
Se encontró una gran cantidad significativa de ARNm de IL-2 en las células de los ganglios linfáticos en Tp3 (p = 0,0143) en comparación con el CG (Figura 5B). En las células de la médula ósea, la expresión del gen TNF-α persistió elevada (pTp1 = 0,0303, pTp3 = 0,0481) a lo largo de todos los puntos de tiempo (Figura 5I).
En PBMC, la expresión del gen IL-4 se recuperó por Tp2 en comparación con CG (Figura 6A), mientras que en la médula ósea se observó una baja acumulación de ARNm de IL-4 (Figura 6C) (pTp1 = 0,0365, pTp2 = 0,0420) a lo largo del estudio. Aun así, en TP3 hubo una ligera regulación ascendente de la expresión génica de IL-4, lo que reveló una tendencia a volver a los valores normales. Aunque se observó una fluctuación de la expresión del gen IL-5 (Figura 6D), en Tp3 vuelve a los valores en comparación con CG. En las células de los ganglios linfáticos, aunque la expresión del gen IL-5 se mantuvo aumentó en Tp1 (Figura 6E) en comparación con CG (p = 0,0124), en Tp3 una tendencia a la reducción de los puntos de acumulación de ARNm de IL-5 hacia la normalización.
La expresión génica de IL-10 y TGF-β reveló una tendencia a la recuperación a los valores normales. Es decir, la acumulación de ARNm de IL-10 en el ganglio linfático (Figura 7B) disminuyó significativamente en comparación con Tp0 (pP1 = 0,0338, pTp2 = 0,0144, pTp3 = 0,0409), junto con un aumento significativo de la acumulación de ARNm de TGF-β en PBMC (p
A pesar de la tendencia generalizada de los perros tratados a alcanzar niveles normales, la regulación ascendente de las citocinas proinflamatorias (IFN-γ e IL-2) junto con la tendencia a la normalización de las citocinas antiinflamatorias (IL-4 e IL-5) y reguladoras (IL-10 y TGF-β) apuntan a una respuesta inmune inflamatoria persistente
La regulación ascendente de la expresión del gen IFN-γ persiste después del tratamiento con terapia combinada con antimoniato de meglumina
Los perros tratados con MG+A evidenciaron una normalización de la expresión del gen IFN-γ en PBMC (Figura 5J). La expresión del gen IFN-γ se mantuvo significativamente más alta (pTp1 = 0,0029, pTp3 = 0,0018) en las células linfáticas en comparación con CG (Figura 5K). Por el contrario, las células de la médula ósea (Figura 5L) mostraron una disminución progresiva del ARNm IFN-γ. En Tp1 (p = 0,0425) los valores aumentaron significativamente en comparación con el CG. Sin embargo, por Tp2 y Tp3, la expresión del gen IFN-γ se redujo hacia niveles comparables al CG. Por otro lado, la expresión génica de IL-2 (Figura 5B) y TNF-α (Figura 5H) en las células linfáticas fue similar a la CG. IL-2 en Tp1 en PBMC (Figura 5A) presentó valores similares a los perros de control, y Tp3 tenía una diferencia significativa en Tp0 (p = 0,0425). Lo mismo se verificó en los ganglios linfáticos, con la IL-2 recuperándose a cantidades comparables a CG por Tp3 (p = 0,0098). TNF-α (Figura 5H) en el ganglio linfático recuperado a valores similares a CG que muestran una diferencia significativa en comparación con Tp0 (p = 0,0451).
Durante el seguimiento del tratamiento, la expresión del gen IL-4 se mantuvo regulada en PBMC (pTp1 = 0,0219, pTp2 = 0,0297) (Figura 6A) y en las células de la médula ósea (pTp1 = 0,0068, pTp2 = 0,0229, pTp3 = 0,0013; Figura 6C) cuando se compara En PBMC, la expresión del gen IL-5 también se redujo (pTp1 = 0,0199, pTp2 = 0,0071, pTp3 = 0,0343; Figura 6D). A pesar de una ligera reducción en la acumulación de ARNm de IL-5 en el hueso a la Tp2, se observó una tendencia a la normalización (Figura 6F).
Durante el tratamiento, la acumulación de ARNm de IL-10 (pTp1 = 0,0076, pTp2 = 0,0101, pTp3 = 0,0108; Figura 7A) y TGF-β (pTp1 = 0,0192, pTp2 = 0,0235, pTp3 = 0,0473; Figura 7D) se redujo en gran Sin embargo, en las células de los ganglios linfáticos, la expresión génica de la IL-10 (Figura 7B) y TGF-β (Figura 7E) fue similar a la de los perros de control. Sin embargo, en Tp3, se observó un ligero aumento del ARNm de TGF-β en los ganglios linfáticos en comparación con Tp2 (p = 0,0285). A pesar de que las células de la médula ósea mostraron una normalización de la expresión del gen TGF-β (Figura 7F), 2 meses después del tratamiento (Tp3) se observó una disminución significativa de la acumulación de ARNm de TGF-β (p = 0,0453) en comparación con perros sanos. Los perros infectados con Leishmania tratados con antimoniato de meglumina en combinación con alopurinol (MG+A) evidencian una tendencia generalizada a alcanzar niveles normales de citoquinas en los tejidos del huésped de Leishmania evaluados en el estudio actual. Sin embargo, la regulación ascendente persistente de la expresión génica IFN-γ asociada con la regulación a la baja de la expresión génica de IL-4, IL-5, IL-10 y TGF-β indica el posible predominio de una respuesta inmune inflamatoria. Por otro lado, el ligero aumento de TGF-β en Tp3 en el ganglio linfático puede apuntar hacia la activación local de una respuesta inmune reguladora.
La actividad de las terapias combinadas de antimoniato de mitefosina y meglumina puede influir en la expresión génica de las citoquinas
Para estimar la influencia de los medicamentos en la generación de citoquinas, las citocinas que no fueron alteradas significativamente por la infección por Leishmania se analizaron comparando la expresión génica de perros enfermos (Tp0) y tratados (Tp1-Tp3).
Después del primer mes de tratamiento (Tp1) con miltefosina en asociación con alopurinol (MT+A), PBMC evidenció una regulación a la baja de la IL-12 (p = 0,0025; Figura 5D) y la IL-10 (Figura 7A), y una ligera regulación ascendente de la IL-2 (Figura 5A) y el TNF- Durante el segundo y tercer mes, IL-2, TNF-α e IL-10 mostraron una regulación ascendente progresiva, con IL-12 teniendo un aumento acentuado en Tp2 (p = 0,0411) y una ligera disminución en Tp3 (p = 0,0233). En cuanto a las células de ganglios linfáticos, se observó una regulación ascendente considerable de la IL-12 (Figura 5E) después de Tp1 (p = 0,0062), junto con una ligera sobreexpresión de TNF-α (Figura 5H) en Tp2 y Tp3 (p = 0,0138) puntos de tiempo y una expresión génica considerable En la médula ósea, el tratamiento causó acumulación de ARNm de IL-2 (Figura 5C) que persistió hasta Tp2, junto con un aumento de TGF-β (Figura 7F) que alcanzó su punto máximo en Tp3 (p = 0,0106). Los niveles de ARNm de IL-5 (Figura 6F) mostraron una regulación a la baja en Tp1 (p = 0,0343) que persistió hasta Tp2. Una regulación progresiva de la IL-10 (Figura 7C) fue evidente de Tp1 a Tp3 (p = 0,024).
El PBMC de los perros tratados con MG+A mostró una regulación progresiva hacia abajo de la IL-12 (Figura 5D) de Tp0 a Tp2, seguida de un aumento en Tp3, y un aumento progresivo de TNF-α (Figura 5G) de Tp0 que alcanzó los valores máximos en Tp3. Las células ganglios linfáticos presentaron niveles de ARNm de IL-12 (Figura 5E) aumentados en Tp3 (p = 0,0484), exhibiendo una regulación a la baja leve y transitoria de los niveles de IL-4 (Figura 6B) en Tp1 (p = 0,0293) seguida de una regulación ascendente progresiva que alcanzó su punto máximo en Tp3. La IL-5 (Figura 6E) se redujo ligeramente a la baja en Tp1, pero mostró un aumento acentuado cuando se interrumpió el antimoniato de meglumina (Tp2), con una ligera disminución en Tp3 (p = 0,0344). En cuanto a las células de la médula ósea, se observó una disminución continua en la acumulación de ARNm de IL-12 y TNF-α de Tp1 a Tp3. Sin embargo, la expresión génica de IL-2 presentó un patrón irregular, sufriendo una regulación a la baja en Tp2. En comparación con Tp0, el IL-10 presentó una regulación progresiva hacia abajo hasta Tp3.
Estos hallazgos indican que la MG+A dirige la sobreexpresión de citocinas en la sangre y los ganglios linfáticos y es posible que el alopurinol desempeñe un papel clave en la mejora de la generación de citoquinas. En la médula ósea, los medicamentos parecen reducir la expresión génica de las citoquinas. MT+A también parece mejorar la expresión génica de las citoquinas. Sin embargo, cuando se interrumpió la miltefosina, la IL-4 en el ganglio linfático y la IL-10 en la médula ósea se redujo.
Discusión
La progresión de la infección L. infantum depende principalmente de la competencia del sistema inmunitario del perro, que está relacionada con características inherentes como el origen genético. Por lo tanto, el espectro de manifestaciones clínicas puede variar desde la infección subclínica hasta la enfermedad grave. Durante la enfermedad activa, la respuesta inmunitaria del perro se ha caracterizado principalmente por una marcada respuesta inmunitaria humoral e inmunosupresión específica de la proliferación de linfocitos T (41). A pesar de ser el principal reservorio doméstico de L. infantum, los perros también tienen un valor intrínseco, más importante un papel social y afectivo reconocido. Por lo tanto, es muy necesario el uso de terapias que puedan garantizar un tratamiento exitoso de la enfermedad de la enfermedad de la enfermedad de la enfermedad.
Varios estudios han señalado la eficacia y la tasa de recuperación más rápida de los perros tratados con antimoniato de meglumina en combinación con alopurinol (5, 19, 42, 43). Con respecto al progreso de los parámetros hematológicos, bioquímicos y urinarios, vale la pena enfatizar que ambas terapias combinadas utilizadas en el estudio actual fueron capaces de recuperar los valores normales de eritrocitos, hemoglobina, hematocrito y UCP, mientras que los leucocitos, los neutrófilos, la creatinina y la albúmina estaban dentro de los intervalos de Los perros que evidenciaron menos alteraciones clinicopatológicas, que fueron seleccionados para ser tratados con antimoniato de meglumina en combinación con alopurinol, presentaron una rápida recuperación de los parámetros hematológicos, bioquímicos y urinarios. Los perros que mostraron más alteraciones clínico-patológicas, y que fueron tratados con miltefosina en combinación con alopurinol, tardaron más en alcanzar la normalización de esos parámetros.
Tres meses después del diagnóstico de CanL (Tp3), ambas terapias combinadas tuvieron éxito en promover la remisión de los signos clínicos, la recuperación de los valores normales hematológicos y bioquímicos en todos los perros y en la restricción de la infección por parásitos, ya que no se encontraron amastigotas en las frotis de médula ósea y ganglios linfáticos. Los anticuerpos antiparasitarios también disminuyeron a títulos no significativos en la mayoría de los perros, y solo un perro tratado con MG+A tardó más tiempo en ser negativo (>3 meses).
Durante el CanL, los parásitos de L. infantum se alojan en varios órganos del sistema reticuloendotelial, teniendo una influencia generalizada en el sistema inmunitario del huésped. Como se informó anteriormente (28, 39, 44), en CanL, la expresión del gen IFN-γ aumenta en el tejido huésped parásito antes de cualquier tratamiento. También en el estudio actual PBMC, los ganglios linfáticos y las células de la médula ósea evidenciaron una generación pronunciada de IFN-γ. Aunque dicha respuesta inmunitaria se verifica ampliamente en muchos otros estudios, también planteó la cuestión de si esta respuesta inmunitaria Th1 está correlacionada positivamente con el control de los parásitos. Estudios anteriores en hámsters infectados experimentalmente y en humanos que sufren de leishmaniosis visceral han demostrado altas cargas de parásitos en entornos Th1, lo que indica una incapacidad de IFN-γ para conferir protección (45, 46). Por lo tanto, el principal consenso indica que los perros enfermos expresan altos niveles de IFN-γ en los tejidos objetivo de Leishmania, posiblemente dirigiendo una respuesta inmune a Th1 contra la infección persistente.
El tejido más estudiado con respecto a la expresión de citoquinas durante la CanL es la sangre periférica, que en animales que presentan signos clínicos se caracteriza por tener supresión de la inmunidad mediada por células T y producción de altos niveles de anticuerpos específicos (24), como consecuencia de una respuesta predominantemente Th2 con la producción de citocinas antiinflamatorias, como IL-4 e IL-5 (23) En el presente estudio, con la excepción de la alta expresión del gen IFN-γ, la sangre periférica IL-2, TGF-β, IL-4 e IL-5 de los perros no tratados disminuyeron, lo que sugiere que Leishmania causó una desactivación general de los linfocitos, lo que llevó al desequilibrio de los mediadores inmunes pro e antiinflama Aún así, teniendo en cuenta que la sangre periférica no es el tejido elegido para la replicación y persistencia de L. infantum (47, 48), junto con la posible variabilidad genética natural entre perros, puede ser la razón por la que hay tanta divergencia entre los estudios con respecto a la expresión de citoquinas en este tejido.
A pesar de que la mayoría de los estudios de CanL se centran en un solo tejido, generalmente en la sangre periférica, cada vez más estudios consideran que cada tejido afectado por este parásito presenta su propia respuesta inmune (28, 39, 49, 50). La IL-10 es una citocina reguladora clave que previene la patología excesiva. Esta citocina puede regular negativamente las respuestas inmunitarias innatas y adaptativas al perjudicar la producción de citocinas proinflamatorias (por ejemplo, IL-12, IL-2, IFN-γ y TNF-α) y antiinflamatorias (IL-4 e IL-5), restringiendo la actividad de las células T en los ganglios linfáticos En CanL, se informa que el ganglio linfático tiene una respuesta inmune predominantemente Th1 (39). Además de esto, no se ha establecido un verdadero consenso, con estudios que muestran una mayor expresión de citocinas Th1, como IFN-γ y TNF-α (51), en ganglios linfáticos precapulares de perros sin signos clínicos externos y menor carga de parásitos, apuntando hacia un posible papel de estas citocinas en el control Por el contrario, los perros que presentaban signos clínicos no mostraron expresión de IL-4 e IL-12, sino altos niveles de citocinas inmunosupresoras como IL-10 y TGF-β (51), lo que desempeñaba un papel en la progresión de la enfermedad. En el estudio actual, el ganglio linfático de perros con CanL parece evidenciar una respuesta inmune mixta de Th1/Treg con IL-2 baja, pero alta IL-12 e IFN-γ, junto con la expresión baja de TGF-β pero sobreexpresión de IL-10, apuntando hacia un equilibrio entre la diferenciación de la respuesta inflamatoria mediada por
Teniendo en cuenta la expresión de citoquinas en la médula ósea de perros con CanL, que sabemos mejor, solo hay unos pocos estudios documentados (28, 39, 44), que informan de este tejido como un entorno predominantemente Th1 que tiende a desarrollar altas cargas de parásitos, caracterizado por una mayor expresión de IFN-γ y TNF-α y una detección baja En el estudio actual, las células de la médula ósea de los perros enfermos también evidencian la sobreexpresión IFN-γ y la baja expresión de IL-4, IL-5 y TGF-β que apuntan a una respuesta inmune predominantemente proinflamatoria. Además, el PCA y el análisis de clúster refuerzan que cada tejido presenta un patrón de citoquinas distinto de respuesta a la infección, lo que confirma informes anteriores (39). Además, el nivel de infección también parece influir en la expresión génica local de las citoquinas, a saber, el TNF-α, que apunta hacia una generación disminuida de esta citocina en las células de los ganglios linfáticos de perros que presentan menos signos clínico-patológicos (MG+A) y sobreexpresión en las células de la médula ósea El TNF-α junto con el IFN-γ induce la regulación ascendente de la óxido nítrico sintasa inducible (iNOS) por los macrófagos, dirigiendo la oxidación de L-arginina y la producción de óxido nítrico (NO) (52). NO es una poderosa molécula oxidativa que media en la matanza de parásitos. Por lo tanto, la hipótesis de que el TNF-α puede ser un biomarcador de la gravedad de CanL debe investigarse más a fondo. Además, la IL-5, una citocina vinculada al crecimiento y la diferenciación de las células B, se ha sobreexpresado en las células ganglios linfáticos de perros que presentan signos más clínico-patológicos (MT+A). Estos hallazgos apuntan a una mayor activación de las células B en los ganglios linfáticos. La sobreexpresión de IL-12 en las células de la médula ósea de perros que exhiben signos más clínico-patológicos (MT+A), una citocina de vía de señalización queprime las células T ingenuas para diferenciarse en células Th1, apoya el posible establecimiento de una población de células Th1.
Al analizar la sangre periférica, el ganglio linfático poplíteo y la médula ósea a lo largo de dos de los tratamientos de protocolo CanL más utilizados, el estudio actual muestra evidencia de una mayor generación de IFN-γ durante los 3 meses de seguimiento de los perros tratados con MT+A. Además, las células ganglios linfáticos también mostraron una sobreexpresión de TNF-α, lo que sugiere que hay condiciones para la activación de macrófagos y la inactivación de parásitos, y un aumento de la generación de IL-2, lo que indica una posible proliferación de linfocitos. Estos hallazgos indican que la terapia asociada a la miltefosina no promueve la reducción de la respuesta inmune proinflamatoria, sino que induce la normalización de los antiinflamatorios IL-4 e IL-5 y del inmunossupror TGF-β en las células sanguíneas mononucleares, del inmunosorpresor IL-10 en el ganglio linfático
MG+A conduce a la normalización de la respuesta inmune proinflamatoria, restaurando los niveles de expresión de IFN-γ e IL-2 en las células sanguíneas, IL-2, IL-12 y TNF-α en el ganglio linfático e IFN-γ en la médula ósea. Aunque muestra cierta inestabilidad, la IL-5 tiende a tener valores normales en la médula ósea. El tratamiento también parece inducir la normalización de las citocinas inmunosupresoras en el ganglio linfático. Sin embargo, la sobreexpresión continua de IFN-γ en las células de los ganglios linfáticos apunta hacia el mantenimiento de una respuesta inflamatoria local a pesar de la actividad del fármaco para promover la remisión de los signos clínicos, y el aumento de la expresión del gen IFN-γ en las células sanguíneas mononucleares 1 mes después del tratamiento sugiere el pre Por otro lado, la IL-4 y la IL-5 se mantienen reguladas en las células sanguíneas mononucleares, así como en la IL-10 y la TGF-β, lo que indica la inhibición de la respuesta inmune de Th2 y Treg incluso durante la mejora clínica de los perros. También en la médula ósea, el tratamiento no indujo la normalización de la expresión del gen IL-4.
El efecto de las terapias farmacológicas utilizadas en el estudio actual en la expresión génica de las citoquinas se investigó en las citocinas que no se vieron afectadas significativamente por la infección por parásitos (Tp0). Aunque las terapias combinadas parecen tener resultados similares, no fue posible encontrar un patrón distintivo, que muestre citoquinas y efectos dependientes del tejido. La actividad del fármaco posiblemente potenciada por antígenos de parásitos libres parece favorecer principalmente la generación de citoquinas.
El estudio actual permite una visión general del efecto de las dos terapias anti-leishmaniales más utilizadas, la miltefosina y el antimoniato de meglumina en asociación con el alopurinol, en la inversión de la progresión de CanL en perros infectados naturalmente, incluida la remisión de los signos clínicos, la normalización de los parámetros hematológicos, bioquímicos Ambas terapias combinadas son efectivas en el tratamiento de la CanL, favoreciendo la recuperación clínica de todos los perros y la sobreexpresión de las citocinas proinflamatorias, apuntando hacia la persistencia de entornos inmunitarios inflamatorios que pueden dirigir la inactivación de los parásitos al menos durante los 3 meses iniciales del tratamiento. El estudio actual también demuestra que las citocinas antiinflamatorias y reguladoras no parecen desempeñar un papel clave en la respuesta inmune de CanL. Además, las terapias combinadas también parecen desempeñar un papel directo en la generación de citoquinas. Estos son hallazgos relevantes, ya que ambos son dos de los protocolos más utilizados en el tratamiento de esta parasitosis zoonótica, la evolución de la respuesta inmune mediada por células generada durante estos tratamientos específicos debe estudiarse más a fondo. Con la reciente implementación de la miltefosina para el tratamiento de la canL en Brasil, un país extremadamente endémico para la leishmaniosis canina y humana, se convierte en un tema de garantizar lo mejor para el fortalecimiento de la protección de la salud pública.
Declaración de disponibilidad de datos
Los datos sin procesar que respaldan las conclusiones de este manuscrito serán puestos a disposición por los autores, sin reservas indebidas, de cualquier investigador cualificado.
Declaración ética
El estudio sobre animales fue revisado y aprobado por el Comité de Ética y Bienestar Animal (CEBEA-Comissão de Ética e Bem-Estar Animal) de la Facultad de Medicina Veterinaria de la Universidad de Lisboa. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
GS-G, CM, MS e IF concibió y diseñó el estudio. MS, CM, MP, JG, JC, AB, AR, JM y IF recogieron muestras. MS, LG e IF procesaron muestras e hicieron pruebas microscópicas, moleculares y serológicas posteriores. MS y CM llevaron a cabo los experimentos. MS, GS-G, IF y MB analizaron los datos. MS y GS-G realizaron análisis estadísticos. MS, GS-G y IF redactaron el manuscrito. GS-G, IF, GA-P, MB, AD, LT, AVR, MB y DS-M hicieron revisiones en profundidad del manuscrito. Todos los autores leyeron y aprobaron el manuscrito final.
Financiación
La financiación para este trabajo fue proporcionada por la Fundación Portuguesa para la Ciencia y la Tecnología (FCT) (PTDC/CVT/118566/2010), el Centro de Investigação Interdisciplinar em Sanidade Animal (CIISA), la Faculdade de Medicina Veterinaria, Universidade de Lisboa, a través del proyecto UID/CVT/00276/2019 (Financiado por FCT) y Global Health MS (SFRH/BD/101467/2014) obtuvo una beca de doctorado de la Fundación Portuguesa para la Ciencia y la Tecnología (FCT).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Agradecimientos
Los autores desean agradecer la cooperación y toda la ayuda proporcionada por los veterinarios y el personal del Hospital Universitario de la Facultad de Medicina Veterinaria de la Universidad de Lisboa (FMV-ULisboa), junto con M.Sc. Telmo Pina Nunes por el asesoramiento estadístico y un reconocimiento especial a los propietarios y sus respectivos perros por su contribución a este estudio.
Abreviaturas
ALT, alanina aminotransferasa; AST, aspartato aminotransferasa; BID, bis in die; BUN, nitrógeno de urea en sangre; CanL, leishmaniosis canina; cDNA, ADN complementario; CG, grupo de control; CLWG, grupo de trabajo de leishmaniasis canina; CPDA-1, citrato dextrosa aden ARN, ácido ribonucleico; SID, semel in die; Th1, T-Helper tipo-1; Th2, T-Helper tipo-2; TGF-β, factor de crecimiento transformador beta; TNF-α, factor de necrosis tumoral alfa; Treg, células T reguladoras; UPC, relación de creatinina de proteína urinaria.
Referencias
1. ¿QUIÉN? Control de las Leishmaniases: Informe de una reunión del Comité de Expertos de la OMS sobre el Control de las Leishmaniases. Serie de informes técnicos de la OMS no 949. Organización Mundial de la Salud (2010), p. 1–186. Disponible en línea en: http://apps.who.int/iris/bitstream/10665/44412/1/WHO_TRS_949_eng.pdf (consultado el 23 de mayo. 2018).
2. Solano-Gallego L, Koutinas A, Miró G, Cardoso L, Pennisi MG, Ferrer L, et al. Instrucciones para el diagnóstico, la estadificación clínica, el tratamiento y la prevención de la leishmaniosis canina. Veterinario Parasitol. (2009) 165:1–18. doi: 10.1016/j.vetpar.2009.05.022
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. Manna L, Vitale F, Reale S, Picillo E, Neglia G, Vescio F, et al. Estudio de la eficacia de la miltefosina y el alopurinol en perros con leishmaniosis. Veterinario J. (2009) 182:441–5. doi: 10.1016/j.tvjl.2008.08.009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
4. Mateo M, Maynard L, Vicher C, Bianciardi P, Miró G. Estudio comparativo sobre la eficacia a corto plazo y los efectos adversos del antimoniato de mitefosina y meglumina en perros con leishmaniosis natural. Parasitol Res. (2009) 105:155–62. doi: 10.1007/s00436-009-1375-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
5. Miró G, Oliva G, Cruz I, Cañavate C, Mortarino M, Vischer C, et al. Estudio clínico multicéntrico y controlado para evaluar la eficacia y seguridad de la miltefosina y el alopurinol para la leishmaniosis canina. Vet Dermatol. (2009) 20:397–404. doi: 10.1111/j.1365-3164.2009.00824.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
6. Woerly V, Maynard L, Sanquer A, Eun HM. Eficacia clínica y tolerancia de la miltefosina en el tratamiento de la leishmaniosis canina. Parasitol Res. (2009) 105:463–9. doi: 10.1007/s00436-009-1404-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
7. Solano-Gallego L, Miró G, Koutinas A, Cardoso L, Pennisi MG, Ferrer L, et al. Directrices de LeishVet para el manejo práctico de la leishmaniosis canina. Vectores de parásitos. (2011) 4:1-16. doi: 10.1186/1756-3305-4-86
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Directrices de LeishVet (2018). Leishmaniosis canina y felina. Un resumen para el veterinario en prácticas. 4a edición. Disponible en línea en: http://www.leishvet.org/wp-content/uploads/2018/04/LeishVet-Guidelines-4Ed.pdf (consultado el 23 de mayo de 2018).
9. Sociedad Internacional de Interés Renal. Preparación de IRIS de la ERC. Sociedad Internacional de Interés Renal (2016). Disponible en línea en: http://www.iris-kidney.com/guidelines/staging.html (consultado el 23 de mayo de 2018).
10. Paltrinieri S, Solano-Gallego L, Fondati A, Lubas G, Gradoni L, Castagnaro M, et al. Directrices para el diagnóstico y la clasificación clínica de la leishmaniasis en perros. J Am Vet Med Assoc. (2010) 236:1184–91. doi: 10.2460/javma.236.11.1184
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. João A, Pereira MA, Cortes S, Santos-Gomes GM. quimioterapia de leishmaniasis canina: estado clínico del perro y riesgo de transmisión de leishmanía. J Vet Med A Physiol Clin Med. (2006) 53:540–5. doi: 10.1111/j.1439-0442.2006.00869.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
12. Ikeda-Garcia FA, Lopes RL, Marques FJ, de Lima VMF, Morinishi CK, Bonello FL, et al. Evaluación clínica y parasitológica de perros infectados naturalmente por Leishmania (Leishmania) chagasi sometidos a tratamiento con antimoniato de meglumina. Veterinario Parasitol. (2007) 143:254–9. doi: 10.1016/j.vetpar.2006.08.019
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
13. Frézard F, Demicheli C, Ribeiro RR. Antimoniales pentavalentes: nuevas perspectivas para las drogas antiguas.Moléculas. (2009) 14:2317-36. doi: 10.3390/molecules14072317
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. McGwire BS, Satoskar AR. Leishmaniasis: síndromes clínicos y tratamiento. QJM. (2014) 107:7–14. doi: 10.1093/qjmed/hct116
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Pérez-Victoria FJ, Sánchez-Cañete MP, Seifert K, Croft SL, Sundar S, Castanys S, et al. Mecanismos de resistencia experimental de Leishmania a la miltefosina: implicaciones para el uso clínico. Actualización de resistencia a las drogas. (2006) 9:26–39. doi: 10.1016/j.drup.2006.04.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Sundar S, Olliaro P. Miltefosina en el tratamiento de la leishmaniasis: evidencia clínica para la gestión del riesgo clínico informado. El Maneo De Riesgo De Clin. (2007) 3:733-40.
17. Bianciardi P, Brovida C, Valente M, Aresu L, Cavicchioli L, Vischer C, et al. Administración de antimoniato de mitefosina y meglumina en perros sanos: evaluación clínico-patológica del impacto en los riñones. Toxicol Pathol. (2009) 37:770–5. doi: 10.1177/0192623309344088
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
18. Dorlo T, Balasegaram M, Beijnen J, de Vries P. Miltefosina: una revisión de su farmacología y eficacia terapéutica en el tratamiento de la leishmaniasis. J Antimicrob Chemother. (2012) 67:2576–97. doi: 10.1093/jac/dks275
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Denerolle P, Boudoiseau G. Tratamiento combinado de alopurinol y antimonio frente a antimonio solo y alopurinol solo en el tratamiento de la leishmaniasis canina (96 casos). J Vet Int Med. (1999) 13:413–5. doi: 10.1111/j.1939-1676.1999.tb01455.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Ribeiro R, Michalick M, Silva M, Santos C, Frézard F, Silva S. Leishmaniasis canina: una visión general del estado actual y las estrategias de control. Biomed Res Int. (2018) 2018:3296893. doi: 10.1155/2018/3296893
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Haldar AK, Sen P, Roy S. Uso del antimonio en el tratamiento de la leishmaniasis: estado actual y direcciones futuras. Mol Biol Int. (2011) 2011:571242. doi: 10.4061/2011/571242
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Yasur-Landau D, Jaffe CL, David L, Baneth G. Resistencia al alopurinol en Leishmania infantum de perros con recaída de la enfermedad. PLoS Negl Trop Dis. (2016) 10:e0004341. doi: 10.1371/journal.pntd.0004341
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
23. Mosmann TR, Moore KW. El papel de la IL-10 en la regulación cruzada de las respuestas TH1 y TH2. Immunol Hoy. (1991) 12:49–53. doi: 10.1016/S0167-5699(05)80015-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Pinelli E, van der Kaaij SY, Slappendel R, Fragio C, Ruitenberg EJ, Bernadina W, et al. Detección de la expresión del gen de las citoquinas caninas por reacción en cadena de transcripolímeroasa inversa.Inmunopático inmune veterinario. (1999) 69:121–6. doi: 10.1016/S0165-2427(99)00048-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Santos-Gomes GM, Rosa R, Leandro C, Cortes S, Romão P, Silveira H. Expresión de citocinas durante el resultado de la infección experimental canina por Leishmania infantum. Inmunopático inmune veterinario.(2002) 88:21-30. doi: 10.1016/S0165-2427(02)00134-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
26. Rodrigues OR, Marques C, Soares-Clemente M, Ferronha MH, Santos-Gomes GM. Identificación de células T reguladoras durante la infección infantil experimental de Leishmania. Inmunobiología. (2009) 214:101–11. doi: 10.1016/j.imbio.2008.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
27. Belkaid Y, Piccirillo CA, Mendez S, Shevach EM, Sacks DL. Las células T reguladoras CD4+CD25+ controlan la persistencia y inmunidad mayores de Leishmania. Naturaleza. (2002) 420:502–7. doi: 10.1038/nature01152
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
28. Alves CF, de Amorim IF, Moura EP, Ribeiro RR, Alves CF, Michalick MS, et al. La expresión de IFN-gamma, TNF-alfa, IL-10 y TGF-beta en los ganglios linfáticos se asocia con la carga de los parásitos y la forma clínica de enfermedad en perros infectados naturalmente con Leishmania (Leishmania) chagasi. Inmunopático inmune veterinario. (2009) 128:349–58. doi: 10.1016/j.vetimm.2008.11.020
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
29. Rodríguez-Cortés A, Carrillo E, Martorell S, Todolí F, Ojeda A, Martínez-Flórez A, et al. Respuesta inmune compartimental en la leishmaniasis: patrones cambiantes a lo largo de la enfermedad. PLoS ONE. (2016) 11:e0155224. doi: 10.1371/journal.pone.0155224
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
30. Helhazar M, Leitão J, Duarte A, Tavares L, da Fonseca IP. Infección natural de especies de roedores sinántroposMus musculus y Rattus norvegicus por Leishmania infantum en Sesimbra y Sintra-Portugal.Vectores de parásitos. 6:88. doi: 10.1186/1756-3305-6-88
31. Gal A, Loeb E, Yisaschar-Mekuzas Y, Baneth G. Detección de Ehrlichia canis por PCR en diferentes tejidos obtenidos durante la necropsia de perros encuestados por ehrlichiosis monocítica canina de ocurriendo naturalmente. Veterinario J. (2008) 175:212–7. doi: 10.1016/j.tvjl.2007.01.013
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
32. Jefferies R, Ryan UM, Muhlnickel CJ, Irwin PJ. Dos especies de Babesia canina en Australia: detección y caracterización por PCR. Parasitol. (2003) 89:409–12. doi: 10.1645/0022-3395(2003)089[0409:TSOCBI]2.0. CO;2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
33. Kidd L, Maggi R, Diniz PP, Hegarty B, Tucker M, Breitschwerdt E. Evaluación de ensayos de PCR convencionales y en tiempo real para la detección y diferenciación de la Rickettsia del grupo de fiebre manchada en sangre de perro. Microbiol veterinario. (2008) 129:294–303. doi: 10.1016/j.vetmic.2007.11.035
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Peters IR, Ayuda CR, Calvert EL, Hall EJ, Day MJ. Cuantificación del ARNm de citoquinas en la mucosa duodenal canina histológicamente normal mediante RT-PCR en tiempo real. Inmunopático inmune veterinario. (2005) 103:101-11. doi: 10.1016/j.vetimm.2004.08.020
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
35. Huang YC, Hung SW, Jan TR, Liao KW, Cheng CH, Wang YS, et al. Los linfocitos de baja expresión CD5 en la sangre periférica canina muestran características de las células asesinas naturales. J Leukoc Biol. (2008) 84:1501–10. doi: 10.1189/jlb.0408255
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
36. Menezes-Souza D, Corrêa-Oliveira R, Guerra-Sá R, Giunchetti RC, Teixeira-Carvalho A, Martins-Filho AO, et al. Perfiles de citocinas y factores de transcripción en la piel de perros infectados naturalmente por Leishmania (Leishmania)chagasi que presentan una densidad de parásitos cutáneos y un estado clínico distintos. Veterinario. Parasitol. (2011) 177:39–49. doi: 10.1016/j.vetpar.2010.11.025
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Yu DH, Noh DH, Song RH, Park J. El piruvato de etilo reduce el factor de necrosis tumoral alfa y la interleucina (IL)-6 y regula la IL-10 en las células mononucleares de sangre periférica canina estimuladas por lipopolisacáridos. J Vet Med Sci. (2010) 72:1379–81. doi: 10.1292/jvms.09-0590
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Sauter SN, Allenspach K, Gaschen F, Gröne A, Ontsouka E, Blum JW. Expresión de citocinas en un sistema de cultivo ex vivo de muestras duodenales de perros con enteropatías crónicas: modulación por bacterias probióticas. Dominis Anim Endocrinol. (2005) 29:605-22. doi: 10.1016/j.domaniend.2005.04.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
39. Barbosa MA, Alexandre-Pires G, Soares-Clemente M, Marques C, Rodrigues OR, de Brito TV, et al. Expresión del gen de citoquinas en los tejidos de perros infectados por Leishmania infantum. J Comp Pathol. (2011) 145:336–44. doi: 10.1016/j.jcpa.2011.03.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Rodrigues OR, Moura RA, Gomes-Pereira S, Santos-Gomes GM. El complejo H-2 influye en la expresión del gen de las citoquinas en los macrófagos infectados por los infantes de Leishmania. Inmunol celular. (2006) 243:118–26. doi: 10.1016/j.cellimm.2007.01.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
41. Carvalho EM, Bacellar O, Barral A, Badaro R, Johnson WD. La inmunosupresión específica del antígeno en la leishmaniasis visceral es mediada por células. J Clin Invest. (1989) 83:860–4. doi: 10.1172/JCI113969
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
42. Torres M, Bardagí M, Roura X, Zanna G, Ravera I, Ferrer L. Seguimiento a largo plazo de perros diagnosticados con leishmaniosis (etapa clínica II) y tratados con antimoniato de meglumina y alopurinol. Veterinario J.(2011) 188:346–51. doi: 10.1016/j.tvjl.2010.05.025
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
43. Manna L, Corso R, Galiero G, Cerrone A, Muzj P, Gravino AE. Seguimiento a largo plazo de perros con leishmaniosis tratados con antimoniato de meglumina más alopurinol frente a mitefosina más alopurinol.Vectores de parásitos. (2015) 8:289. doi: 10.1186/s13071-015-0896-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
44. Quinnell RJ, Courtenay O, Shaw MA, Day MJ, Garcez LM, Dye C, et al. Respuestas de citocinas tisulares en la leishmaniasis visceral canina. J Infecta a Dis. (2001) 183:1421–4. doi: 10.1086/319869
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
45. Kenney RT, Sacks DL, Gam AA, Murray HW, Sundar S. Respuestas de citocinas esplénicas en kala-azar indio antes y después del tratamiento. J Infecta a Dis. (1998) 177:815–8. doi: 10.1086/517817
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
46. Melby PC, Tryon VV, Chandrasekar B, Freeman GL. Clonación de ADNc de citoquinas de hámster sirio (Mesocricetus auratus) y análisis de la expresión de ARNm de citoquinas en leishmaniasis visceral experimental. Infecta el sistema inmunológico. (1998) 66:2135–42.
47. Peters N, Sacks D. Privilegio inmunológico en sitios de infección crónica: Leishmania y células T reguladoras.Immunol Rev. (2006) 213:159–79. doi: 10.1111/j.1600-065X.2006.00432.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
48. Maia C, Campino L. Perfiles de células citoquinas y fenotípicas de la infección infantil de Leishmania en el perro. J Trop Med. (2012) 2012:541–71. doi: 10.1155/2012/541571
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
49. Gomes-Pereira S, Rodrigues OR, Santos-Gomes GM. Dinámica de los subconjuntos de linfocitos CD62L/CD45RB CD4+ y CD8+ en los tejidos hepáticos y esplénicos durante la leishmaniasis visceral murina.Immunol Lett. (2004) 95:63-70. doi: 10.1016/j.imlet.2004.06.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
50. Alexandre-Pires G, de Brito MT, Algueró C, Martins C, Rodrigues OR, da Fonseca IP, et al. Leishmaniasis canina Perfil inmunofenotípico de leucocitos en diferentes compartimentos de perros sintomáticos, asintomáticos y tratados. Inmunopático inmune veterinario. (2010) 137:275–83. doi: 10.1016/j.vetimm.2010.06.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
51. Garden OA, Pinheiro D, Cunningham F. Todas las criaturas grandes y pequeñas: células T reguladoras en ratones, humanos, perros y otras especies de animales domésticos. Int Immunopharmacol. (2011) 11:576–88. doi: 10.1016/j.intimp.2010.11.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
52. Nathan CF, Hibbs JB. Papel de la síntesis de óxido nítrico en la actividad antimicrobiana de los macrófagos.Curr Opin Immunol. (1991) 3:65-70. doi: 10.1016/0952-7915(91)90079-G
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: leishmaniosis canina, células mononucleares de sangre periférica, ganglio linfático, médula ósea, expresión génica de citoquinas, antimoniato de meglumina, miltefosina, alopurinol
Cita: Santos MF, Alexandre-Pires G, Pereira MA, Marques CS, Gomes J, Correia J, Duarte A, Gomes L, Rodrigues AV, Basso A, Reisinho A, Meireles J, Santos-Mateus D, Brito MTV, Tavares L, Santos-Gomes GM y da Fonseca IP (2019) Antimoniato de Meglumina y Miltefosina combinados con Veterinario. Ciencia. 6:362. doi: 10.3389/fvets.2019.00362
Recibido: 15 de junio de 2019; Aceptado: 01 de octubre de 2019;
Publicado: 18 de octubre de 2019.
Editado por:
Dirk Werling, Royal Veterinary College (RVC), Reino Unido
Revisado por:
Robin James Flynn, Universidad de Liverpool, Reino Unido
Kenneth James Genovese, Servicio de Investigación Agrícola, Departamento de Agricultura de los Estados Unidos, Estados Unidos
Copyright © 2019 Santos, Alexandre-Pires, Pereira, Marques, Gomes, Correia, Duarte, Gomes, Rodrigues, Basso, Reisinho, Meireles, Santos-Mateus, Brito, Tavares, Santos-Gomes y da Fonseca.
*Correspondencia: Isabel Pereira da Fonseca, ifonseca@fmv.ulisboa.pt
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser hecha por su fabricante no está garantizado o respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía