El inhibidor de la prolactina cambia la producción de testosterona en cabras de cachemira
El inhibidor de la prolactina cambia la producción de testosterona, la morfología testicular y la expresión de genes relacionados en cabras de cachemira
 Meijing Chen1†
Meijing Chen1†  Chunhui Duan1†
Chunhui Duan1†  Xuejiao Yin1
Xuejiao Yin1  Xianglong Li2
Xianglong Li2  Xiaona Liu1
Xiaona Liu1  Lechao Zhang1
Lechao Zhang1  Sicong Yue1
Sicong Yue1  Yingjie Zhang1*
Yingjie Zhang1*  Yueqin Liu1*
Yueqin Liu1*- 1Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de Hebei, Baoding, China
- 2Facultad de Ciencia y Tecnología Animal, Universidad Normal de Ciencia y Tecnología de Hebei, Qinhuangdao, China
La prolactina tiene funciones multifacéticas en la lactancia, el crecimiento, el metabolismo, la osmorregulación, el comportamiento y la reproducción de los animales. Este estudio tuvo como objetivo investigar la participación de la prolactina en la función testicular en cabras de cachemira. Veinte cabras de cachemira fueron asignadas aleatoriamente al grupo de control (CON) o al grupo de tratamiento con bromocriptina (BCR, bromocriptina, inhibidor de la prolactina). Muestras de sangre y testículos recolectadas para su análisis después de 30 días de tratamiento. Los resultados indicaron que, en comparación con el grupo CON, el BCR disminuyó significativamente (p < 0,05) las concentraciones séricas de prolactina, y aumentó significativamente (p < 0,05) los niveles de testosterona y hormona luteinizante (LH) en el día 30. El nivel sérico de la hormona folículo estimulante (FSH) no se vio afectado (p > 0,05) por el tratamiento. El diámetro medio del túbulo seminífero y el espesor del epitelio espermatogénico se incrementaron (p < 0,05) en el grupo BCR. Posteriormente, realizamos secuenciación de ARN y análisis bioinformático para identificar los genes y vías clave asociados con la regulación de la espermatogénesis o la función de secreción de testosterona. Se identificaron un total de 142 genes expresados diferencialmente (DEGs) (91 estaban regulados al alza y 51 a la baja). La ontología genética (GO) y la Enciclopedia de Genes y Genomas de Kioto (KEGG) revelaron que los DEG estaban principalmente involucrados en la matriz extracelular (MEC), la biosíntesis de hipopótamos y hormonas esteroideas, que están relacionadas con la función testicular. La expresión de los genes SULT2B1, CYP3A24 y CYP3A74 en la vía de biosíntesis de hormonas esteroideas aumentó significativamente (p < 0,05) en el grupo BCR, lo que fue validado por qRT-PCR. Estos resultados proporcionan una base para comprender los mecanismos subyacentes a la regulación de la función testicular por prolactina en cabras de cachemira.
1. Introducción
La espermatogénesis y la producción de testosterona son funciones importantes de los testículos (1). La función testicular normal depende de las vías hormonales endocrinas y paracrinas (2), incluida la hormona estimulante del folículo (FSH), la hormona luteinizante (LH) y la testosterona (3). La prolactina (PRL) es una hormona polipeptídica involucrada en varias funciones biológicas, como la lactancia, el rendimiento del crecimiento, el comportamiento animal, el metabolismo y la reproducción, y actúa junto con la FSH y la LH para regular la función testicular en ratas macho adultas, hámsters y ratones (4, 5). La PRL es sintetizada y secretada principalmente por las células lactotrofas de la glándula pituitaria anterior y actúa a través de su receptor de membrana PRL (PRLR) (6). El PRLR se ha identificado en los testículos de varias especies, incluidos carneros (7), ratas (8), yaks (9) y humanos (4). Los estudios han revelado que la PRLR en los testículos de carnero se expresa en las células de Leydig y las células germinales en los túbulos seminíferos, y el sitio de expresión y el patrón del gen receptor indican un papel crucial de la PRL en la regulación de la esteroidogénesis y la espermatogénesis (7).
Varios estudios han demostrado que el nivel anormal de PRL afecta la función reproductiva. La hiperprolactinemia, en la que los niveles circulantes de PRL son más altos que los de la población de referencia, puede provocar una disminución de la producción de espermatozoides e infertilidad en los hombres (10); y conducen a una disminución de los niveles de LH y FSH en ratas (11). Además, las observaciones clínicas en hombres infértiles hipoprolactinémicos han demostrado que el restablecimiento de los niveles normales de PRL conduce a un aumento de la densidad y calidad de los espermatozoides y restaura la fertilidad, lo que sugiere un papel de la PRL en la regulación de los testículos y las glándulas accesorias (12). La bromocriptina (BCR), un agonista del receptor de dopamina ampliamente utilizado para estudiar la función de la PRL, puede reducir la concentración de PRL en la sangre de los mamíferos (13). Un estudio en carneros (Ovis aries) sugirió que la función testicular está influenciada por la hipoprolactinemia inducida por BCR (14). Sin embargo, otro estudio mostró que la función testicular y la fertilidad no se vieron afectadas en ratones knockout de PRLR (15). La supresión de la concentración de PRL mediante BCR disminuye el volumen testicular, la producción de espermatozoides y la secreción de testosterona en la carnero (16). Un estudio en ratas macho adultas ilustró que el nivel sérico de PRL suprimido por 2-bromo-α-ergocriptina reduce el peso del órgano reproductor, pero aumenta el nivel sérico de LH, mientras que la FSH no se ve afectada (17). A pesar de esto, las vías a través de las cuales la PRL regula la función de los testículos siguen sin estar claras. Tampoco está claro si los niveles de PRL afectan la secreción de testosterona y la fertilidad en cabras macho.
En el presente estudio, planteamos la hipótesis de que la PRL puede cambiar los niveles séricos de hormonas y la expresión de genes relacionados para influir en la función reproductiva. Para probar esta hipótesis, investigamos los efectos de la inhibición de PRL en los indicadores bioquímicos séricos, morfológicos testiculares y ARNm expresados diferencialmente mediante secuenciación del transcriptoma, y tratamos de dilucidar los mecanismos moleculares que subyacen a la regulación de PRL de los testículos en cabras macho de cachemira.
2. Materiales y métodos
2.1. Declaración ética
Este estudio se llevó a cabo bajo la dirección del Comité de Cuidado y Uso de Animales de la Universidad Agrícola de Hebei (número de aprobación: 2023133).
2.2. Animales y experimentos
El estudio se llevó a cabo en la granja de cabras de cachemira Qinglong Lihong (Qinhuangdao, China) del 17 de agosto de 2020 al 1 de octubre de 2020. Todas las cabras tuvieron libre acceso a agua dulce y fueron alimentadas dos veces al día (07,00 y 15,00 h) durante todo el experimento, de acuerdo con los requisitos para la cría y manejo de cabras de granja. Todas las cabras fueron alojadas en corrales individuales. Se seleccionaron veinte cabras macho sanas (Capra hircus, raza caprina Yanshan Cashmere, 10 meses de edad, peso corporal = 22,98 ± 1,95 kg) y se asignaron aleatoriamente a dos grupos: 1) tratamiento con BCR (n = 10, 0,06 mg/kg de peso corporal) y 2) el grupo control (CON, n = 10; igual volumen de agua). El BCR se administró en forma de comprimidos disueltos en agua que se rociaron sobre el alimento concentrado en la alimentación de la mañana. La dosis se basó en las instrucciones de dosificación dadas en Zhang et al. (13) y Dicks et al. (18), que fueron de aproximadamente 0,05 mg/kg de peso corporal a 0,07 mg/kg de peso corporal. El experimento se llevó a cabo durante 45 días, con un período de adaptación de 15 días.
2.3. Recogida de muestras
Se registraron los pesos corporales de las cabras los días 0 y 30 antes de la alimentación matutina, y se calculó la ganancia media diaria (GMD).
Antes de la alimentación matutina, se obtuvieron muestras de sangre por venopunción yugular de cada cabra en tubos promotores de la coagulación de 5 ml en los días 0, 15 y 30. Las muestras se centrifugaron inmediatamente a 3000 × g durante 15 min para recolectar suero y se almacenaron a -20 °C hasta el análisis.
En el día 30 de tratamiento, todas las cabras fueron sacrificadas en un matadero local antes de la alimentación matutina para recoger los testículos. Los testículos izquierdos se sumergieron en formaldehído al 10% para su análisis histológico. Una parte de las muestras testiculares del testículo derecho se congeló inmediatamente en nitrógeno líquido y luego se almacenó en un refrigerador a -80 °C para la posterior extracción de ARN y proteínas.
2.4. Análisis hormonal
Las concentraciones séricas de PRL, testosterona, FSH y LH se determinaron utilizando kits comerciales de ensayo inmunoenzimático ligado a enzimas (ELISA) de cabra (Nanjing jiancheng Bio, Nanjing, China), de acuerdo con las instrucciones del fabricante. La absorbancia (DO) de cada pozo se midió a 450 nm y se generó una curva estándar. Con base en la curva estándar, las concentraciones de cada muestra se calcularon como ng/mL, ng/L, mUI/mL y mUI/mL, respectivamente.
2.5. Evaluación morfológica testicular
Los testículos extirpados se fijaron en formaldehído al 10% y se mantuvieron a temperatura ambiente durante la noche. Los tejidos fijados fueron deshidratados por máquina automática de deshidratación en concentraciones ascendentes de baños de etanol graduados (75, 85, 95 y 100%). A continuación, los tejidos se infiltraron con parafina. Los tejidos testiculares se seccionaron en secciones de 5 μm de grosor. Después de la eliminación de la cera, los portaobjetos se tiñeron con hematoxilina y eosina (H&E) y se sellaron con goma neutra. Seleccionamos al azar ocho muestras de cada grupo y cada portaobjetos fue analizado en al menos cinco campos diferentes. Los diámetros de los túbulos seminíferos y el espesor del epitelio espermatogénico se capturaron y midieron con un microscopio digital Panoramic 250 (3DHISTECH, Budapest, Hungría) a × 400 aumentos.
2.6. Aislamiento del ARN y evaluación de la integridad del ARN
El ARN total de cada muestra de testículo se extrajo utilizando el reactivo TRIzol (Invitrogen, Carlsbad, CA, Estados Unidos) de acuerdo con las instrucciones del fabricante. La muestra de ARN se calificó mediante electroforesis en gel de agarosa al 1% para detectar posible contaminación y degradación. A partir de entonces, se examinaron y midieron la pureza, la concentración, la integridad y la cantidad de ARN utilizando el espectrofotómetro NanoPhotometer® y el kit de ensayo RNA Nano 6.000 del sistema Bioanalyzer 2.100, respectivamente.
2.7. Preparación de bibliotecas, secuenciación de ARN y análisis de datos
Para crear la biblioteca, se utilizaron 3 mg de ARN de alta calidad de cada muestra y el kit de preparación de la biblioteca de ARN ultradireccional NEBNext para Illumina (NEB E7420). Se utilizó la depleción de ARN ribosómico (ARNr) y el método trenzado para la biblioteca de ARN (19). Después de la construcción de la biblioteca, la concentración de la biblioteca se midió con el fluorímetro Qubit®y se ajustó a 1 ng/μL. Se utilizó un Bioanalizador Agilent 2.100 para examinar el tamaño del inserto de la biblioteca. Las bibliotecas cualificadas se agruparon y secuenciaron en plataformas Illumina utilizando la estrategia PE150 (150 nt de extremo emparejado) en Novogene Bioinformatics Technology Co., Ltd. (Pekín, China). Los datos en bruto (lecturas sin procesar) en el formato FASTQ se procesaron primero utilizando scripts Perl internos. Además, los datos limpios se filtraron a partir de las lecturas sin procesar recortando y filtrando las lecturas que contenían adaptador, más del 10% de nucleótidos desconocidos (N) y más del 50% de nucleótidos con Qphred ≤20. Simultáneamente, se calcularon los contenidos Q20, Q30 y GC de los datos limpios. Todos los análisis posteriores se realizaron sobre la base de datos limpios de alta calidad y se mapearon en el genoma de referencia de Capra hircus utilizando HISAT2 (20).
2.8. Análisis de expresión diferencial y enriquecimiento funcional de ARNm
La cuantificación génica se realizó mediante el software StringTie y se obtuvieron fragmentos por kilobase de secuencia de transcripción por millones de lecturas mapeadas (FPKM). La expresión diferencial se analizó mediante el DESeq2 (21), y el umbral del valor p ajustado <0,05 y |log2(fold change)| ≥ 1 se consideraron genes de expresión diferencial (DEGs) en CON vs. BCR. Además, realizamos la anotación de ontogenia génica (GO) de los DEG utilizando el paquete GOseq R y el análisis de enriquecimiento de la Enciclopedia de Genes y Genomas de Kioto (KEGG) utilizando el sistema de anotación basado en ortología KEGG (KOBAS).
2.9. PCR cuantitativa en tiempo real (qRT-PCR)
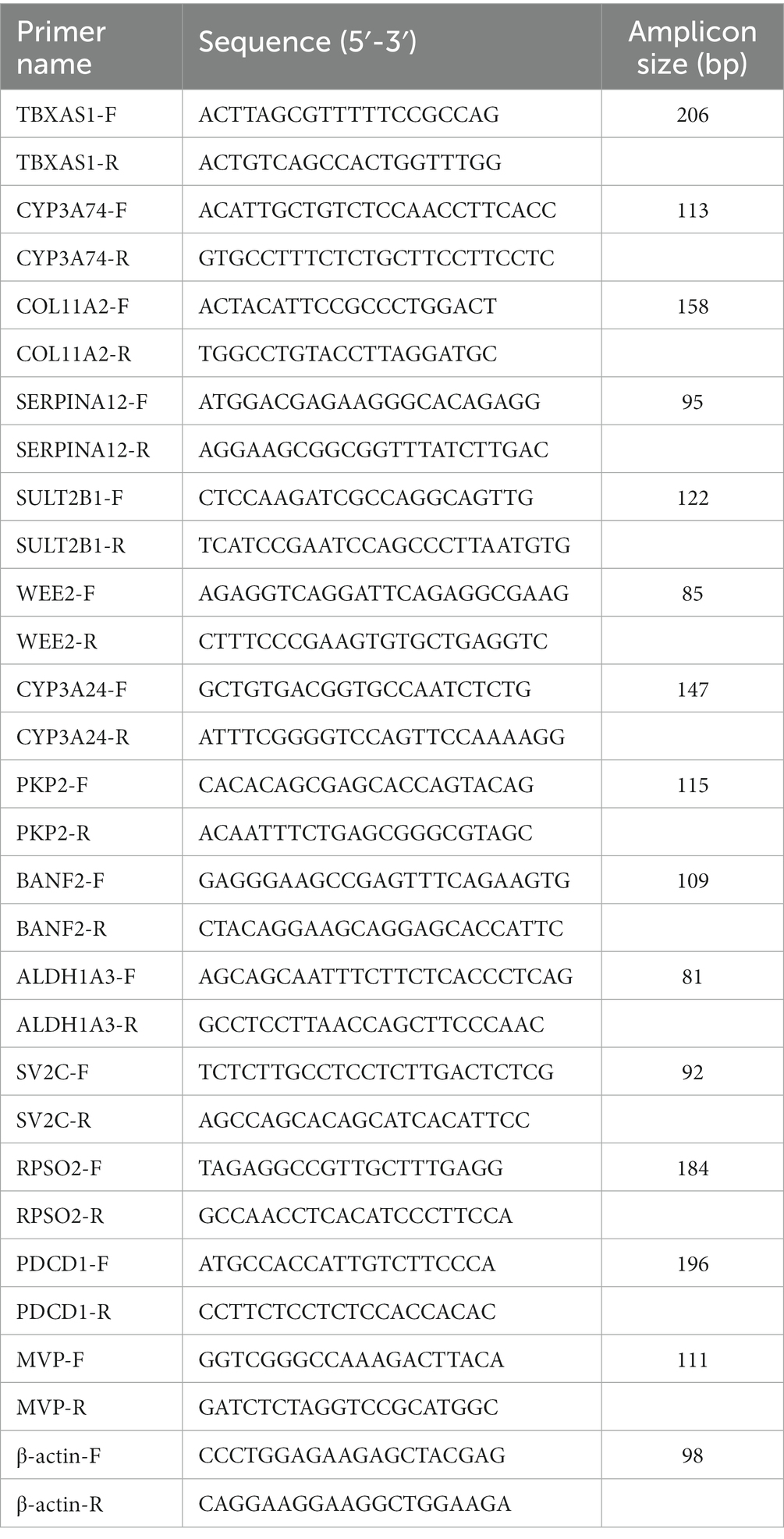
Para verificar la precisión de la RNA-Seq, se seleccionaron aleatoriamente 14 ARNm de expresión diferencial (DE) para qRT-PCR. El ARN total se extrajo de los tejidos utilizando el reactivo TRIzol (Invitrogen, Carlsbad, CA, Estados Unidos) de acuerdo con las instrucciones del fabricante, y se transcribió de forma inversa a ADNc utilizando un kit Evo M-MLV RT con borrador de ADNg para qRT-PCR (Preciso, Hunan, China). La qRT-PCR se realizó utilizando el SYBR Green Master Mix (Vazyme, Nanjing, China) y se llevó a cabo en un sistema ABI QuantStudio 7 Flex. La qRT-PCR se realizó de acuerdo con los siguientes procedimientos: 95 °C durante 3 min, seguido de 40 ciclos de amplificación en dos pasos de 95 °C durante 10 s y 60 °C durante 30 s. Las secuencias de cebadores se enumeran en la Tabla 1. Los niveles de expresión relativa se calcularon mediante los 2−ΔΔCt con β-actina como gen endógeno de referencia.
2.10. Análisis estadístico
Todos los experimentos se realizaron por triplicado, y la significación estadística entre los dos grupos se evaluó mediante la prueba t de Student utilizando SPSS (versión 21.0; SPSS, Chicago, Estados Unidos). Los datos se presentan como media ± error estándar de la media. p < 0,05 se consideró estadísticamente significativo.
3. Resultados
3.1. Peso corporal de la cabra de cachemira
Los pesos corporales de las cabras de cachemira en los dos grupos se presentan en la Tabla 2. El tratamiento con BCR no afectó significativamente (p > 0,05) el peso corporal o GMD de las cabras.
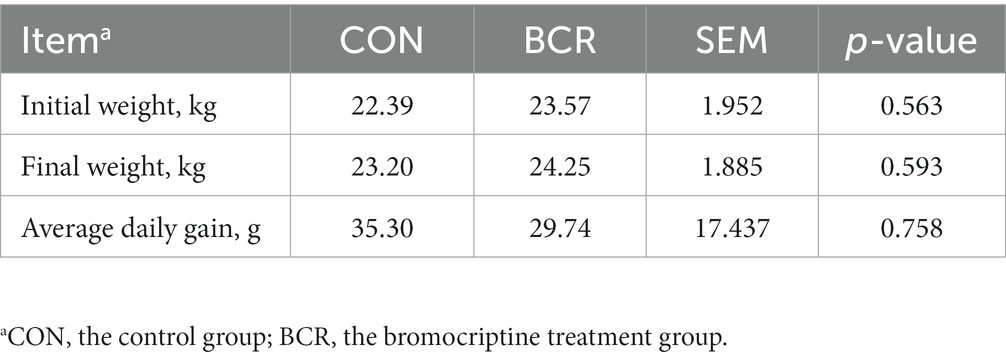 Tabla 2. Efectos de la bromocriptina en el rendimiento del crecimiento de cabras macho de cachemira.
Tabla 2. Efectos de la bromocriptina en el rendimiento del crecimiento de cabras macho de cachemira.
3.2. Concentraciones séricas de PRL, testosterona, FSH y LH
No hubo diferencias en las concentraciones séricas de PRL, testosterona, FSH o LH (p > 0,05) en los días 0 y 15 (Figura 1). En comparación con el grupo CON, la BCR disminuyó significativamente (p < 0,05) las concentraciones séricas de PRL y aumentó significativamente los niveles de testosterona y LH (p < 0,05) el día 30 (Figura 1). El nivel sérico de FSH no se vio afectado (p > 0,05) por el tratamiento en el día 30.
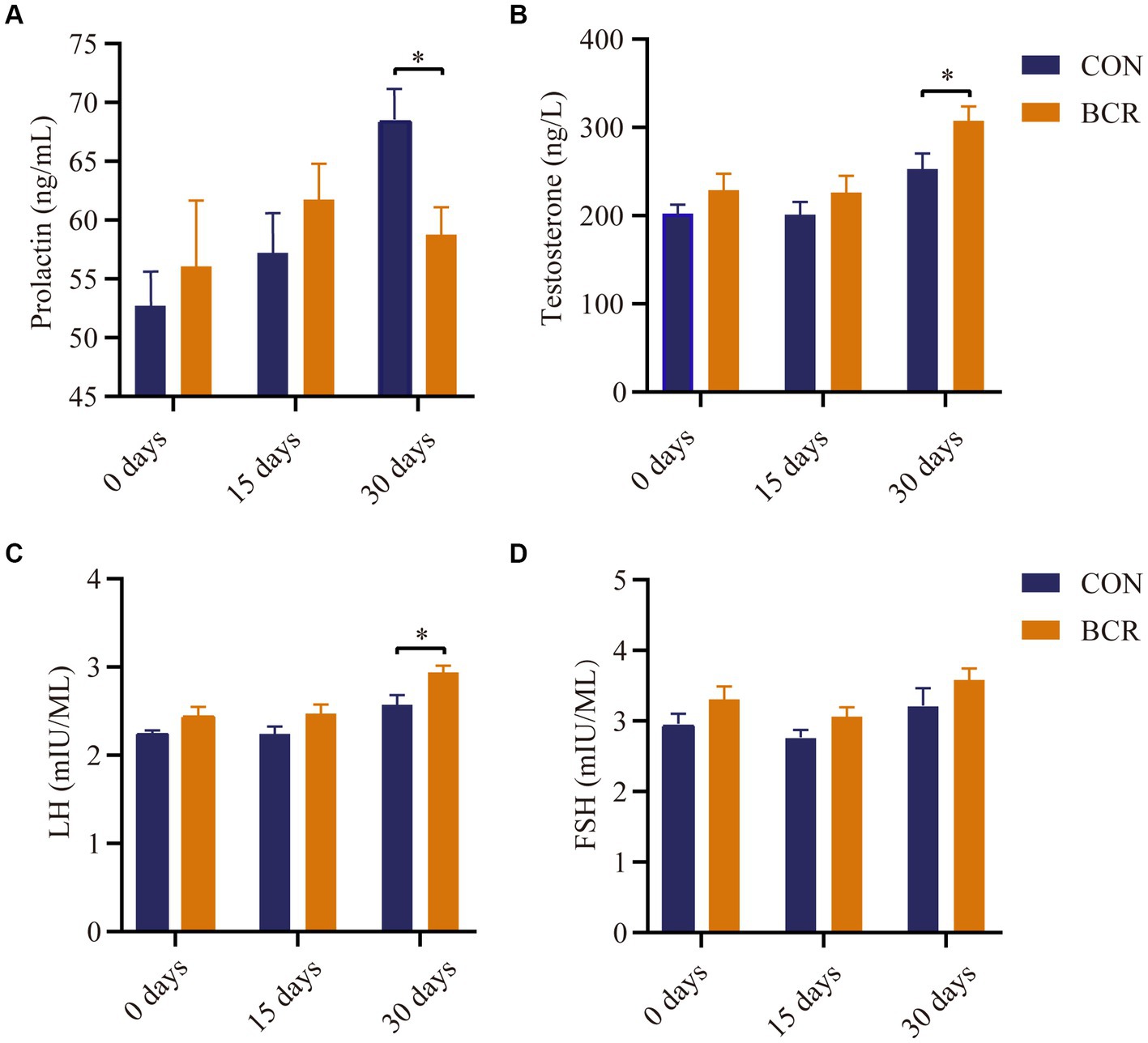 Figura 1. Efectos de la bromocriptina sobre la concentración sérica de (A) prolactina, (B) testosterona, (C) LH y (D) FSH. Los valores son la media ± error estándar de la media. FSH: hormona estimulante del folículo; LH: hormona luteinizante; CON, el grupo de control; BCR, el grupo de tratamiento con bromocriptina; *p < 0,05.
Figura 1. Efectos de la bromocriptina sobre la concentración sérica de (A) prolactina, (B) testosterona, (C) LH y (D) FSH. Los valores son la media ± error estándar de la media. FSH: hormona estimulante del folículo; LH: hormona luteinizante; CON, el grupo de control; BCR, el grupo de tratamiento con bromocriptina; *p < 0,05.
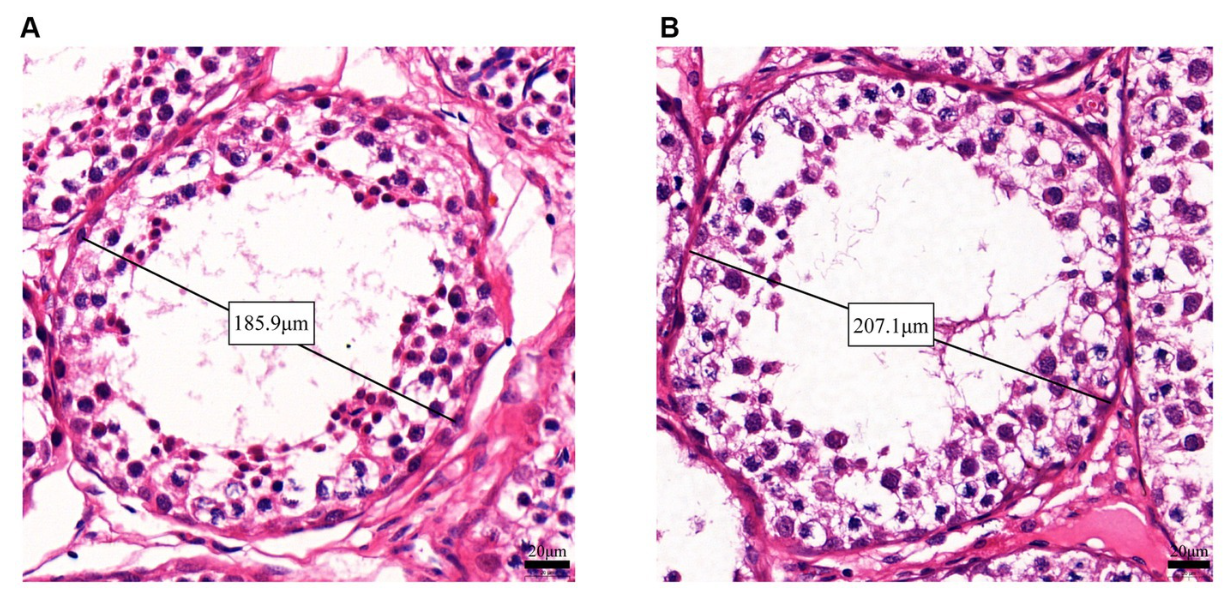
3.3. Morfología testicular
La morfología testicular de los dos grupos se muestra en la Figura 2. El diámetro medio del túbulo seminífero fue significativamente mayor en el grupo BCR en comparación con el grupo CON (203,62 ± 5,55 μm vs. 180,53 ± 5,70 μm, p < 0,05). Además, el grosor del epitelio espermatogénico en el grupo BCR fue significativamente mayor que el del grupo CON (57,06 ± 2,10 μm vs. 54,12 ± 2,30 μm, p < 0,05).
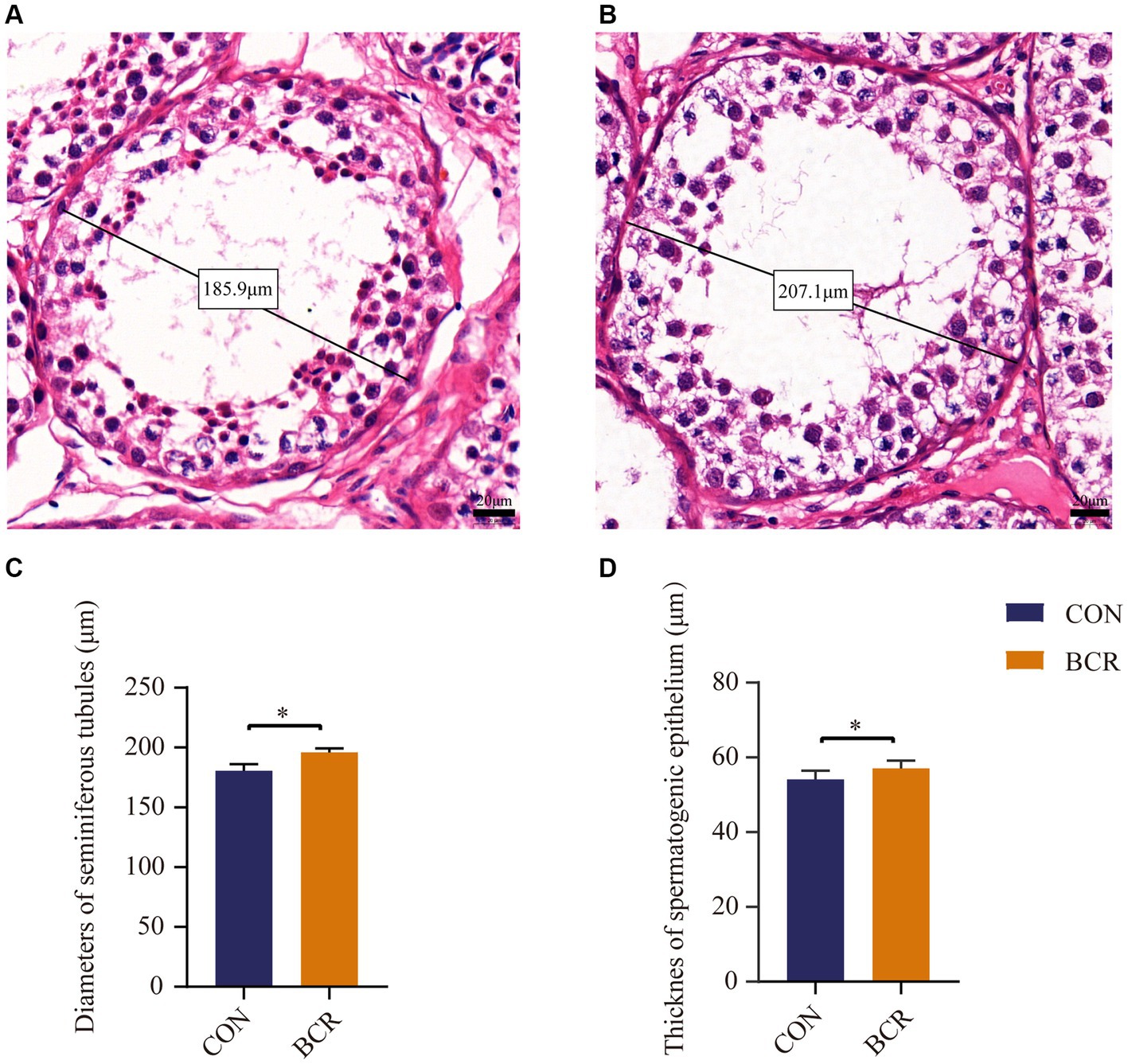 Figura 2. Diámetro de los túbulos seminíferos y espesor del epitelio espermatogénico de testículo caprino de dos grupos con tinción HE. Túbulos seminíferos en los testículos de (A) el grupo CON y (B) el grupo BCR que representan diámetros bajo aumento de mayor potencia. Barra de escala = 20 μm. Los diámetros de los túbulos seminíferos (C) y el grosor del epitelio espermatogénico (D) en los testículos de cabra. Los valores son la media ± error estándar de la media. CON: el grupo de control; BCR: grupo de tratamiento con bromocriptina; *p < 0,05.
Figura 2. Diámetro de los túbulos seminíferos y espesor del epitelio espermatogénico de testículo caprino de dos grupos con tinción HE. Túbulos seminíferos en los testículos de (A) el grupo CON y (B) el grupo BCR que representan diámetros bajo aumento de mayor potencia. Barra de escala = 20 μm. Los diámetros de los túbulos seminíferos (C) y el grosor del epitelio espermatogénico (D) en los testículos de cabra. Los valores son la media ± error estándar de la media. CON: el grupo de control; BCR: grupo de tratamiento con bromocriptina; *p < 0,05.
3.4. Identificación de los DEG
Se analizaron los datos de secuenciación de ARN para los dos grupos y se obtuvieron 82.351.036-106.053.662 lecturas brutas y 81.827.660-105.359.700 lecturas limpias (Tabla 3). Se identificaron un total de 142 DEG (91 regulados al alza, 51 regulados a la baja) en los grupos CON vs. BCR (valor p ajustado <0,05 y |log2(fold change)| ≥ 1; Figura 3A). Los detalles del ARNm se presentan en la Tabla Suplementaria S1. La Figura 3B mostró el agrupamiento jerárquico de los ARNm expresados diferencialmente (DE).
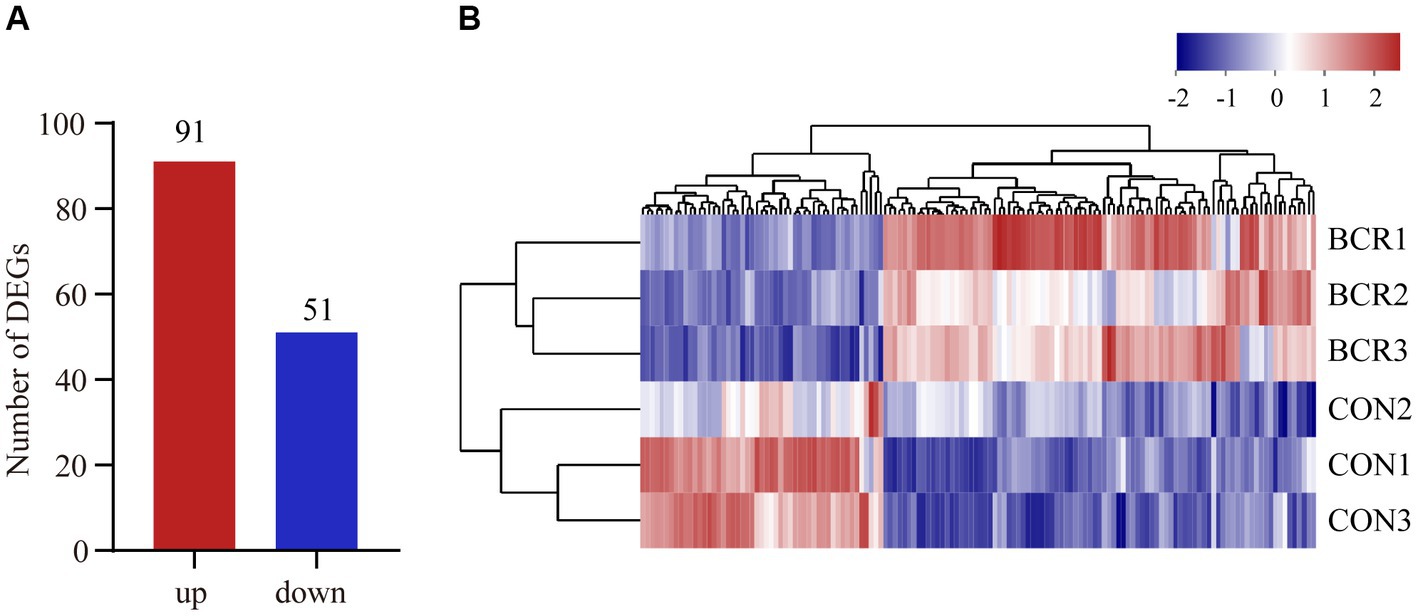 Figura 3. Análisis de genes expresados diferencialmente (DEGs) entre los grupos CON y BCR. (A) Cantidad de DEG mostrados como un gráfico de barras. (B) Mapa de calor de agrupamiento jerárquico de DEGs. El rojo representa la regulación positiva y el azul representa la regulación descendente.
Figura 3. Análisis de genes expresados diferencialmente (DEGs) entre los grupos CON y BCR. (A) Cantidad de DEG mostrados como un gráfico de barras. (B) Mapa de calor de agrupamiento jerárquico de DEGs. El rojo representa la regulación positiva y el azul representa la regulación descendente.
3.5. Análisis de enriquecimiento y anotación funcional de los DEG
De acuerdo con el análisis GO, 64 términos GO se enriquecieron significativamente entre los grupos CON y BCR (p < 0,05; Cuadro complementario S2). Los 30 términos principales de GO se enumeran en la Figura 4A. Estos términos GO están involucrados en procesos biológicos, como la regulación del ciclo celular meiótico, el transporte transmembrana, la adhesión celular y la modificación postraduccional de proteínas. Las funciones moleculares están asociadas con la actividad de la sulfotransferasa, la unión de iones de calcio, los constituyentes estructurales de la matriz extracelular (MEC) y la actividad estructural de las moléculas. El análisis de KEGG indicó que numerosas vías estaban asociadas con la biosíntesis de hormonas esteroides y la espermatogénesis, incluida la biosíntesis de hormonas esteroideas, la interacción entre la MEC y el receptor y la vía de señalización de Hippo (Figura 4B y Tabla Suplementaria S3). En particular, encontramos que el miembro 2 de la familia B de la sulfotransferasa 1 (SULT2B1) y la subfamilia A del citocromo P450 de la familia 3 (CYP3A24 y CYP3A74) están involucrados en la vía de señalización de la biosíntesis de hormonas esteroideas.
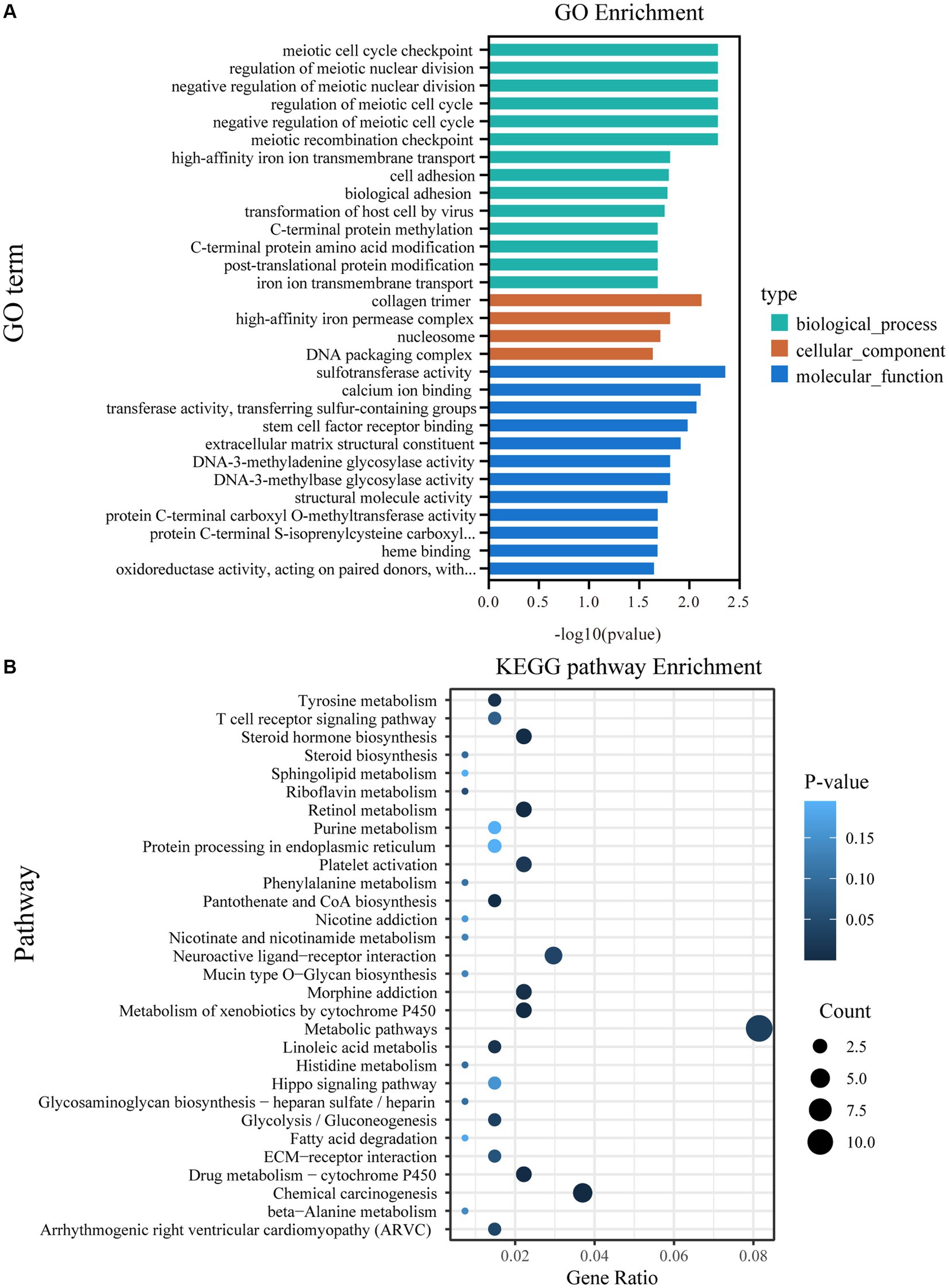 Figura 4. Análisis de las vías GO y KEGG de los DEG. (A) Los 30 términos GO más enriquecidos. (B) Las 30 vías KEGG más enriquecidas; GO, Ontología de genes; KEGG, Enciclopedia de Genes y Genomas de Kioto; DEGs, genes expresados diferencialmente.
Figura 4. Análisis de las vías GO y KEGG de los DEG. (A) Los 30 términos GO más enriquecidos. (B) Las 30 vías KEGG más enriquecidas; GO, Ontología de genes; KEGG, Enciclopedia de Genes y Genomas de Kioto; DEGs, genes expresados diferencialmente.
3.6. Validación de ARNm de DE mediante PCR cuantitativa en tiempo real
Para validar nuestros resultados de RNA-Seq, se identificaron 14 ARNm de DE: TBXAS1, CYP3A24, CYP3A74, COL11A2, SERPINA12, SULT2B1, WEE2, PKP2, BANF2, ALDH1A3, SV2C, RPSO2, PDCD1 y MVP. Como se muestra en la Figura 5, los cambios relativos en el pliegue en el ensayo qRT-PCR fueron estadísticamente significativos (p < 0,05) y consistentes con los resultados de RNA-Seq, lo que indica la fiabilidad de nuestros datos de RNA-Seq.
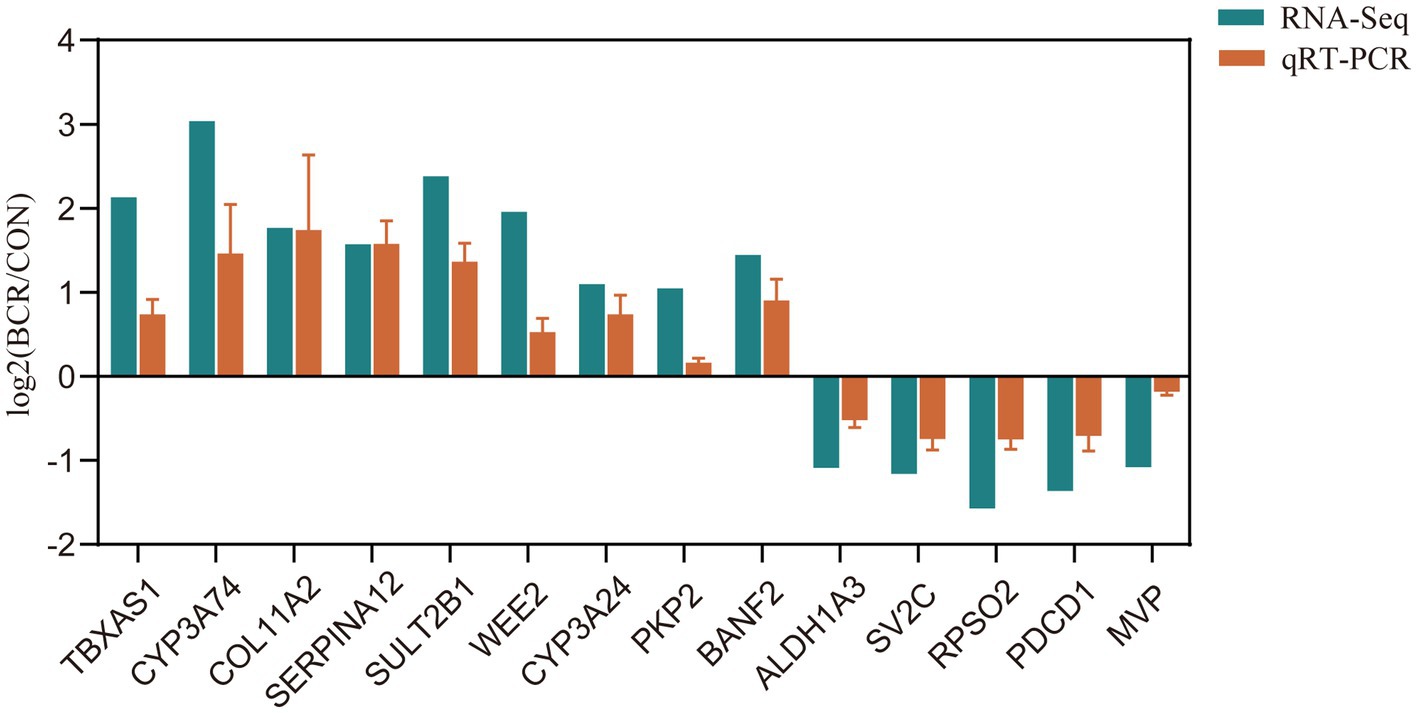 Figura 5. Validación qRT-PCR de DEGs seleccionados. Los gráficos de barras presentan la media ± el error estándar de la media; CON, el grupo de control; BCR, el grupo de tratamiento con bromocriptina; *p < 0,05.
Figura 5. Validación qRT-PCR de DEGs seleccionados. Los gráficos de barras presentan la media ± el error estándar de la media; CON, el grupo de control; BCR, el grupo de tratamiento con bromocriptina; *p < 0,05.
4. Discusión
La función endocrina testicular se logra mediante la producción de hormonas esteroides en las células de Leydig que regulan numerosos procesos fisiológicos críticos para la fertilidad masculina. En el presente estudio, investigamos los cambios en los niveles séricos de hormonas reproductivas, la morfología testicular y el transcriptoma después del tratamiento con un inhibidor de PRL, y los resultados fueron consistentes con nuestra hipótesis. El nivel sérico de PRL disminuyó, sin embargo, la eficacia de BCR sin afectar el crecimiento. De manera similar a los resultados obtenidos en ratas macho adultas (17), encontramos que la concentración de LH y testosterona en cabras estaba aumentada, lo que demuestra que concentraciones más bajas de PRL pueden ser beneficiosas para la producción de testosterona. Esta importante relación entre PRL y LH se describe mejor como «recíproca», lo que implica que mientras que PRL es alta y las gonadotrofinas son bajas (22), lo cual es consistente con nuestra investigación. La PRL estimula la esteroidogénesis en los testículos induciendo o manteniendo los receptores de LH en las células de Leydig y/o afectando la biosíntesis de andrógenos en las células de Leydig a través de la actividad de las enzimas esteroidogénicas (7). Después del tratamiento con BCR, el aumento del nivel sérico de LH podría mejorar la función testicular, incluida la producción de testosterona y la calidad del esperma (23). Al igual que la hiperprolactinemia en humanos, que puede revertirse con la terapia BCR, la mayor secreción de PRL en los carneros durante el solsticio de verano puede tener efectos perjudiciales sobre los espermatozoides (24). Por lo tanto, la regulación de la concentración sérica de PRL es beneficiosa a través de aumentos en las concentraciones de LH y testosterona.
También observamos cambios significativos en la morfología testicular en el grupo BCR que pueden estar relacionados con el aumento resultante de la testosterona y/o los cambios en la expresión génica. El mantenimiento de la función testicular es un proceso molecular complejo y armonizado que está regulado por numerosos genes (25-27). Comprender las diferencias funcionales y de composición a nivel molecular puede sentar las bases para conectar estas diferencias con el desarrollo testicular y la espermatogénesis en cabras. En este estudio, encontramos DEG (incluyendo VNN2, HS3ST2, SULT4A1, SULT2B1) entre los grupos de tratamiento que fueron identificados por la anotación funcional GO como involucrados en procesos biológicos asociados con la regulación del ciclo celular meiótico, el transporte transmembrana, la adhesión celular y la modificación de proteínas postraduccionales. En las células germinales de los carneros e hipotálamo-pituitarios desconectados y testículos de rata, el patrón de expresión del gen PRLR puede indicar un papel de la PRL en la regulación de la división celular, funcionando como inductor mitótico/meiótico, y/o en la diferenciación celular durante la espermatogénesis (5, 7). Nuestros resultados sugirieron que los DEG (incluidos VNN2, HS3ST2, SULT4A1, SULT2B1), que están significativamente enriquecidos en la regulación del ciclo celular meiótico, pueden proporcionar nuevos conocimientos sobre el mecanismo de la regulación de la espermatogénesis por PRL. También observamos una regulación positiva de SPATA25 después del tratamiento con BCR. La familia de la espermatogénesis (SPATA), que incluye SPATA6 (28), SPATA4 (28), SPATA17 (29) y SPATA19 (30), desempeña un papel fundamental en la regulación de la espermatogénesis.
Además, los términos GO para la adhesión celular, los trímeros de colágeno y los constituyentes estructurales de la MEC se relacionaron principalmente con la MEC (31-33), incluidos los genes YAP1, COL11A2, EVC y TM7SF2. Un análisis KEGG de los DEG también reveló las vías de «interacción entre la MEC y el receptor» relacionadas con la MEC. Como parte crítica de la pared del túbulo seminífero, la MEC afecta directamente a la espermatogénesis y apoya las funciones de Sertoli y de las células germinales en el epitelio seminífero (34), que son vitales para el movimiento de las células germinales a través de la barrera hematotesticular (BTB) durante la espermatogénesis (35). El testículo está compuesto por los túbulos seminíferos y los tejidos intersticiales. El aumento del diámetro del túbulo seminífero y el grosor de los epitelios seminíferos pueden estar asociados con estos genes relacionados con la MEC, que podrían mejorar la función testicular de las cabras.
Curiosamente, descubrimos que la biosíntesis de hormonas esteroides y la vía de señalización de los hipopótamos estaban enriquecidas y relacionadas con la secreción de testosterona y la espermatogénesis. Como principal efector de la vía de señalización de Hippo, la proteína 1 asociada a Yes (YAP1) desempeña un papel crucial en la regulación de varias funciones biológicas, como la proliferación, la diferenciación y la inhibición del contacto célula-célula (36). La testosterona es uno de los principales andrógenos representativos, que regula el desarrollo de los testículos y la espermatogénesis en los mamíferos (1). Las células de Leydig, las principales células endocrinas generadoras de testosterona, están altamente reguladas por la retroalimentación entre la LH y la hormona liberadora de LH (37, 38). La LH se une al receptor de la hormona luteinizante (LHR) en la membrana celular de Leydig y activa la proteína G acoplada a LHR, induce a la adenilato ciclasa a aumentar la concentración de AMPc y activa la proteína quinasa A (PKA) y Ras en las células de Leydig (39, 40). Estudios previos han sugerido que varios genes como el factor esteroidogénico 1 (SF-1), el receptor nuclear huérfano (NUR77) y el receptor Y1 del neuropéptido Y (NPY1R) están involucrados en la esteroidogénesis en las células de Leydig (41-44). NPY1R pertenece a la superfamilia de receptores acoplados a proteínas G y está involucrado en la vía del AMPc, que fue regulada a la baja por el tratamiento con BCR en el presente estudio. La biosíntesis de testosterona está mediada principalmente por la proteína reguladora aguda esteroidogénica (StAR), la familia del citocromo P450 (CYP17A1, CYP11A1), la hidroxiesteroide deshidrogenasa (HSD3B2, HSD17B3) y la LHR en las células de Leydig (45). Nuestro estudio reveló que la vía de señalización de la biosíntesis de hormonas esteroides estaba enriquecida y SULT2B1, CYP3A24 y CYP3A74 estaban reguladas al alza en el grupo BCR, lo que puede explicar el aumento de la producción de testosterona. Investigaciones anteriores también han demostrado que la sulfatación, la desulfatación y el transporte intracelular de las hormonas esteroides son la base de la acción de las hormonas esteroides (46). El sulfato de colesterol, generado por el SULT2B1 hidroxiesteroide, activa la proteína de unión al elemento regulador de esteroles 2 (SREBP2), promoviendo así la biosíntesis de colesterol (47). Por lo tanto, los resultados de RNA-Seq y qRT-PCR indicaron que los genes SULT2B1, CYP3A24 y CYP3A74, que se expresaron de manera diferente entre el grupo de inhibidores de CON y PRL, podrían ser los factores clave involucrados en la regulación de la función testicular por PRL. Sin embargo, nuestra investigación se estudió principalmente in vivo, los mecanismos reguladores de la producción de testosterona deben explorarse más a fondo en las células de Leydig. Por lo tanto, se requieren más estudios para delinear la función de estos genes característicos. Basándonos en los resultados de nuestra RNA-seq, investigaremos el papel del ARN no codificante y el ARN pequeño en la regulación de PRL de los testículos en las células de Leydig, y proporcionaremos nuevos conocimientos sobre los mecanismos moleculares de la regulación testicular en la cabra.
5. Conclusión
Nuestros hallazgos confirman que la supresión de la PRL aumenta las concentraciones séricas de LH y testosterona y aumenta el diámetro de los túbulos seminíferos y el grosor del epitelio espermatogénico. SULT2B1, CYP3A24, CYP3A74 genes, que están enriquecidos en la vía de biosíntesis de hormonas esteroideas, podrían ser factores esenciales implicados en la regulación de la función testicular mediada por PRL. En general, nuestro estudio proporciona una comprensión de los mecanismos subyacentes a la regulación de la función testicular por PRL.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres de los repositorios y los números de acceso se pueden encontrar en: https://www.ncbi.nlm.nih.gov/, PRJNA977458.
Declaración ética
El estudio en animales fue aprobado por este estudio se llevó a cabo bajo la guía del Comité de Cuidado y Uso de Animales de la Universidad Agrícola de Hebei (número de aprobación: 2023133). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
MC: software, análisis formal y redacción – borrador original. CD: metodología, curación de datos y términos. XY: escritura – revisión y edición. XiaoL, LZ y SY: investigación. YZ e YL: conceptualización, recursos, administración de proyectos y captación de fondos. XianL: validación y visualización. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
Este trabajo fue apoyado por el Sistema de Investigación Agrícola de China – cabra de cachemira y ovejas de lana (subvención número CARS-39) y el Programa de Investigación e Innovación para Graduados Universitarios de la Provincia de Hebei (subvención número CXZZBS2023076).
Reconocimientos
Agradecemos a Qinglong Lihong Cashmere Goat Farm por proporcionarnos el material que necesitábamos para este estudio.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1249189/full#supplementary-material
Referencias
1. Mäkelä, JA , Koskenniemi, JJ , Virtanen, HE y Toppari, J . Desarrollo de testículos. Endocr Rev. (2019) 40:857–905. doi: 10.1210/er.2018-00140
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Sofikitis, N , Giotitsas, N , Tsounapi, P , Baltogiannis, D , Giannakis, D y Pardalidis, N . Regulación hormonal de la espermatogénesis y la espermiogénesis. J Esteroide Biochem Mol Biol. (2008) 109:323–30. doi: 10.1016/j.jsbmb.2008.03.004
3. Oduwole, OO , Huhtaniemi, IT y Misrahi, M . Se revisan los papeles de la hormona luteinizante, la hormona estimulante del folículo y la testosterona en la espermatogénesis y la foliculogénesis. Int J Mol Sci. (2021) 22:12735. doi: 10.3390/ijms222312735
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Cabello, WM , Gubbay, O , Jabbour, HN y Lincoln, GA . Expresión del receptor de prolactina en testículos humanos y tejidos accesorios: localización y función. Mol Hum Reprod. (2002) 8:606–11. doi: 10.1093/molehr/8.7.606
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Dombrowicz, D , Sente, B , Closset, J y Hennen, G . Efectos dependientes de la dosis de la prolactina humana en el testículo de rata inmaduro hipofisectomizado. Endocrinología. (1992) 130:695–700. doi: 10.1210/endo.130.2.1733717
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Bernardo, V , Joven, J y Binart, N . Prolactina: un factor pleiotrópico en la salud y la enfermedad. Nat Rev Endocrinol. (2019) 15:356–65. doi: 10.1038/s41574-019-0194-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Jabbour, HN y Lincoln, GA . Expresión del receptor de prolactina en el testículo del carnero: localización, activación funcional e influencia de las gonadotrofinas. Endocrinol de células molares. (1999) 148:151–61. doi: 10.1016/s0303-7207(98)00220-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Hondo, E , Kurohmaru, M , Sakai, S , Ogawa, K y Hayashi, Y . Expresión del receptor de prolactina en células espermatogénicas de rata. Biol Reprod. (1995) 52:1284–90. doi: 10.1095/biolreprod52.6.1284
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. La, Y , Ma, F , Ma, X , Bao, P , Chu, M , Liang, C, et al. Expresión diferente de LHR, PRLR, GH e IGF1 durante el desarrollo testicular del yak. Reprod Domest Anim. (2022) 57:221–7. doi: 10.1111/rda.14044
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Corona, G , Mannucci, E , Pescador, AD , Lotti, F , Ricca, V , Balercia, G, et al. Efecto de la hiperprolactinemia en pacientes masculinos que consultan por disfunción sexual. J Sex Med. (2007) 4:1485–93. doi: 10.1111/j.1743-6109.2007.00569.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Gill-Sharma, MK , Aleem, M , Sethi, G , Choudhary, J , Padwal, V , D’Souza, S, et al. Efectos antifertilidad de la flufenazina en ratas macho adultas. J Endocrinol Investig. (2003) 26:316–26. doi: 10.1007/BF03345179
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Ufearo, CS y Orisakwe, OE . Restauración de las características normales de los espermatozoides en hombres infértiles hipoprolactinémicos tratados con metoclopramida y prolactina humana exógena. Clin Pharmacol Ther. (1995) 58:354–9. doi: 10.1016/0009-9236(95)90253-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Zhang, L , Duan, C , Guo, Y , Zhang, Y y Liu, Y . La inhibición de la prolactina promueve la activación secundaria del folículo cutáneo en cabras de cachemira. J Anim Sci. (2021) 99:skab079. doi: 10.1093/jas/skab079
14. Regisford, EG y Katz, LS . Efectos de la hipoprolactinemia inducida por bromocriptina sobre la secreción de gonadotropinas y la función testicular en carneros (Ovis aries) durante dos temporadas. J Reprod Fértil. (1993) 99:529–37. doi: 10.1530/jrf.0.0990529
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Binart, N , Melaine, N , Pineau, C , Kercret, H , Touzalin, AM , Imbert-Bolloré, P, et al. La función reproductiva masculina no se ve afectada en ratones deficientes en receptores de prolactina. Endocrinología. (2003) 144:3779–82. doi: 10.1210/en.2003-0409
16. Lincoln, GA , Townsend, J y Jabbour, HN . Acciones de la prolactina en los testículos de oveja: una prueba de la hipótesis del cebado. Biol Reprod. (2001) 65:936–43. doi: 10.1095/biolreprod65.3.936
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Nag, S , Sanyal, S , Ghosh, KK y Biswas, Nuevo México . Supresión de prolactina y desarrollo espermatogénico en ratas maduras. Un estudio cuantitativo. Horm Res. (1981) 15:72–7. doi: 10.1159/000179436
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Pollas, P , Russel, AJ y Lincoln, GA . El papel de la prolactina en la reactivación de los folículos pilosos en relación con la muda en cabras de cachemira. J Endocrinol. (1994) 143:441–8. doi: 10.1677/joe.0.1430441
19. Parkhomchuk, D , Borodina, T , Amstislavskiy, V , Banaru, M , Hallen, L , Krobitsch, S, et al. Análisis del transcriptoma mediante secuenciación específica de cadena de ADN complementario. Ácidos nucleicos Res. (2009) 37:E123. doi: 10.1093/nar/gkp596
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Kim, D , Langmead, B y Salzberg, S.L. . Hisat: un alineador de empalme rápido con bajos requisitos de memoria. Métodos Nat. (2015) 12:357–60. doi: 10.1038/nmeth.3317
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Amor, MI , Huber, W y Anders, S . Estimación moderada del cambio de plegamiento y dispersión para los datos de RNA-Seq con deseq2. Genoma Biol. (2014) 15:550. doi: 10.1186/s13059-014-0550-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Phillipps, Recursos Humanos , Yip, SH y Grattan, República Dominicana . Patrones de secreción de prolactina. Endocrinol de células molares. (2020) 502:110679. doi: 10.1016/j.mce.2019.110679
23. Flores-Gil, VN , Toledano-Díaz, A , Velázquez, R , Oteo, M , López-Sebastián, A y Santiago-Moreno, J . Papel de los cambios en las concentraciones plasmáticas de prolactina en la criorresistencia de espermatozoides de carnero y macho. Domest Anim Endocrinol. (2021) 76:106624. doi: 10.1016/j.domaniend.2021.106624
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Segal, S , Yaffe, H , Laufer, N y Ben-David, M . Hiperprolactinemia masculina: efectos sobre la fertilidad. Fértil estéril. (1979) 32:556–61. doi: 10.1016/s0015-0282(16)44359-1
25. Zhu, Z , Li, C , Yang, S , Tian, R , Wang, J , Yuan, Q, et al. Dinámica del transcriptoma durante la espermatogénesis humana: predicción de los posibles genes clave que regulan la generación de gametos masculinos. Sci Rep. (2016) 6:19069. doi: 10.1038/srep19069
26. Cabili, MN , Trapnell, C , Goff, L , Koziol, M , Tazon-Vega, B , Regev, A, et al. La anotación integrativa de ARN no codificantes intergénicos humanos grandes revela propiedades globales y subclases específicas. Genes Dev. (2011) 25:1915–27. doi: 10.1101/gad.17446611
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Lecluze, E , Jégou, B , Rolland, AD y Chalmel, F . Nuevas herramientas transcriptómicas para comprender el desarrollo y las funciones de los testículos. Endocrinol de células molares. (2018) 468:47–59. doi: 10.1016/j.mce.2018.02.019
28. Li, X , Yao, X , Xie, H , Deng, M , Gao, X , Deng, K, et al. Efectos de SPATA6 sobre la proliferación, apoptosis y esteroidogénesis de células de Leydig de ovejas Hu in vitro. Teriogenología. (2021) 166:9–20. doi: 10.1016/j.theriogenology.2021.02.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Miyamoto, T , Tsujimura, A , Miyagawa, Y , Koh, E , Sakugawa, N , Miyakawa, H, et al. A single nucleotide polymorphism in SPATA17 may be a genetic risk factor for Japanese patients with meiotic arrest. Asian J Androl. (2009) 11:623–8. doi: 10.1038/aja.2009.30
30. Mi, YJ , Shi, Z , and Li, J . Spata19 is critical for sperm mitochondrial function and male fertility. Mol Reprod Dev. (2015) 82:907–13. doi: 10.1002/mrd.22536
31. Kamranvar, SA , Rani, B , and Johansson, S . Cell cycle regulation by integrin-mediated adhesion. Cells. (2022) 11:2521. doi: 10.3390/cells11162521
32. De Martino, D y Bravo-Cordero, JJ . Colágenos en cáncer: reguladores estructurales y guardianes de la progresión del cáncer. Cáncer Res. (2023) 83:1386–92. doi: 10.1158/0008-5472.CAN-22-2034
33. Liu, C , Pei, M , Li, Q y Zhang, Y . La matriz extracelular descelularizada media la construcción y regeneración de tejidos. Frente Med. (2022) 16:56–82. doi: 10.1007/s11684-021-0900-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Mayerhofer, A , Walenta, L , Mayer, C , Eubler, K y Welter, H . Células peritubulares testiculares humanas, mastocitos e inflamación testicular. Andrología. (2018) 50:e13055. doi: 10.1111/and.13055
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Chen, H , Miao, X , Xu, J , Pu, L , Li, L , Han, Y, et al. Alteraciones de los perfiles de ARNm y ARNl asociadas a la matriz extracelular y a la espermatogénesis en cabras. Anim Biosci. (2022) 35:544–55. doi: 10.5713/ab.21.0259
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Ou, C , Sol, Z , Él, X , Li, X , Ventilador, S , Zheng, X, et al. Dirigirse al eje de señalización YAP1/LINC00152/FSCN1 previene la progresión del cáncer colorrectal. Adv Sci (Weinh). (2020) 7:1901380. doi: 10.1002/advs.201901380
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Shima, Y , Miyabayashi, K , Haraguchi, S , Arakawa, T , Otake, H , Baba, T, et al. Contribución de las células de Leydig y Sertoli a la producción de testosterona en testículos fetales de ratón. Mol Endocrinol. (2013) 27:63–73. doi: 10.1210/me.2012-1256
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Kaprara, A y Huhtaniemi, informático . El eje hipotálamo-hipófisis-gónada: Cuentos de ratones y hombres. Metabolismo. (2018) 86:3–17. doi: 10.1016/j.metabol.2017.11.018
39. Aghazadeh, Y , Zirkin, BR y Papadopoulos, V . Regulación farmacológica de la maquinaria de transporte de colesterol en células esteroidogénicas de los testículos. Vitam Horm. (2015) 98:189–227. doi: 10.1016/bs.vh.2014.12.006
40. Haider, SG . Biología celular de las células de Leydig en los testículos. Int Rev Cytol. (2004) 233:181–241. doi: 10.1016/S0074-7696(04)33005-6
41. Martín, LJ , Boucher, N , Brousseau, C y Tremblay, JJ . El receptor nuclear huérfano NUR77 regula la transcripción estelar inducida por hormonas en células de Leydig a través de la cooperación con la proteína quinasa I, dependiente de Ca2+/calmodulina. (2008) 22:2021–37. doi: 10.1210/me.2007-0370
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Maira, M , Martens, C , Batsche, E , Gauthier, Y y Drouin, J . Potenciación específica del dímero de la actividad transcripcional NGFI-B (Nur77) por la vía de la proteína quinasa a y el reclutamiento de coactivadores dependientes de AF-1. Mol Cell Biol. (2003) 23:763–76. doi: 10.1128/MCB.23.3.763-776.2003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Korner, M , Waser, B , Thalmann, GN y Reubii, JC . Alta expresión de receptores NPY en el testículo humano. Endocrinol de células molares. (2011) 337:62–70. doi: 10.1016/j.mce.2011.01.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Allen, CD , Waser, B , Korner, M , Reubi, JC , Lee, S y Rivier, C . El neuropéptido Y actúa dentro de los testículos de la rata para inhibir la secreción de testosterona. Neuropéptidos. (2011) 45:55–61. doi: 10.1016/j.npep.2010.10.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Zirkin, BR y Papadopoulos, V . Células de Leydig: formación, función y regulación. Biol Reprod. (2018) 99:101–11. doi: 10.1093/biolre/ioy059
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Mueller, Testigo de Jehová , Gilligan, LC , Idkowiak, J , Arlt, W y Foster, Pensilvania . La regulación de la acción de los esteroides por sulfatación y desulfatación. Endocr Rev. (2015) 36:526–63. doi: 10.1210/er.2015-1036
47. Xu, D , Ma, R , Ju, Y , Canción, X , Niu, B , Hong, W, et al. El sulfato de colesterol alivia la colitis ulcerosa al promover la biosíntesis de colesterol en las células epiteliales del colon. Nat Commun. (2022) 13:4428. doi: 10.1038/s41467-022-32158-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: prolactina, testículos, RNA-Seq, ARNm, biosíntesis de hormonas esteroideas
Cita: Chen M, Duan C, Yin X, Li X, Liu X, Zhang L, Yue S, Zhang Y y Liu Y (2023) El inhibidor de la prolactina cambia la producción de testosterona, la morfología testicular y la expresión de genes relacionados en cabras de cachemira. Frente. Vet. Sci. 10:1249189. doi: 10.3389/fvets.2023.1249189
Recibido: 28 de junio de 2023; Aceptado: 10 de octubre de 2023;
Publicado: 26 Octubre 2023.
Editado por:
Wenping Hu, Academia China de Ciencias Agrícolas, China
Revisado por:
Gan Shangquan, Academia de Ciencias Agrícolas y de Recuperación de Xinjiang (XAARS), China Takeshi Ohkubo, Universidad de Ibaraki, Japón
Jinquan Li, Universidad Agrícola de Mongolia Interior, China Yuxin Yang, Universidad del Noroeste A&F, China
Derechos de autor © 2023 Chen, Duan, Yin, Li, Liu, Zhang, Yue, Zhang y Liu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Yingjie Zhang, de zhangyingjie66@126.com; Yueqin Liu, liuyueqin66@126.com
†Estos autores han contribuido igualmente a este trabajo y comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía