El suplemento dietético de almidón de patata crudo en cerdos destetados podría reducir la infección por Salmonella Typhimurium
El suplemento dietético de almidón de patata crudo en cerdos destetados podría reducir la infección por Salmonella Typhimurium al alterar la composición del microbioma y mejorar el estado inmunitario
 Seung-Won Yi1
Seung-Won Yi1  Han Gyu Lee1
Han Gyu Lee1  Eunju Kim1
Eunju Kim1  Young-Hun Jung1
Young-Hun Jung1  Eun-Yeong Bok1
Eun-Yeong Bok1  Ara Cho1
Ara Cho1  Yoon Jung Do1
Yoon Jung Do1  Tai-Young Hur1
Tai-Young Hur1  Sang-Ik Oh1,2*
Sang-Ik Oh1,2*- 1División de Enfermedades y Sanidad Animal, Instituto Nacional de Ciencia Animal, Administración de Desarrollo Rural, Wanju-gun, Jeollabuk-do, República de Corea
- 2Laboratorio de Patología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional de Jeonbuk, Iksan, Jeollabuk-do, República de Corea
Backgorund: Salmonella enterica serovar Typhimurium (ST) es uno de los agentes causantes de la gastroenteritis en cerdos. Los cerdos alimentados con una dieta suplementada con fécula cruda de patata (RPS) han mejorado la salud intestinal mediante la alteración de la composición de la microbiota y la producción de ácidos grasos de cadena corta (AGCC). Este estudio tuvo como objetivo evaluar los efectos de la suplementación con RPS en la reducción de la gravedad de la infección y la excreción fecal en cerdos infectados con ST.
Métodos: Los cerdos experimentales destetados se dividieron en dos grupos: CON (n = 6) alimentados con una dieta a base de maíz/soja y TRT (n = 6) suplementados con RPS al 5%. Después de 21 días, los cerdos fueron inoculados con TS y se monitoreó su peso corporal, signos clínicos y excreción fecal de TS durante 14 días. A los 14 días después de la inoculación (dpi), se recolectaron los tejidos de yeyuno, ciego, íleon y colon de cerdos sacrificados, y se compararon las lesiones histopatológicas y la expresión génica de citoquinas. Además, se analizaron muestras de sangre a 2 dpi para el enriquecimiento de la ontología génica. Además, el microbioma intestinal se analizó mediante secuenciación metagenómica de ARNr 16S y la concentración de AGCC se midió mediante cromatografía de gases.
Resultados: La ganancia de peso diaria promedio fue significativamente mayor en TRT que en CON durante el período de infección por ST; sin embargo, las puntuaciones histopatológicas de las lesiones fueron significativamente más bajas en TRT que en CON. La abundancia relativa de nueve géneros de bacterias productoras de butirato y acetato aumentó significativamente en TRT en comparación con la de solo dos bacterias productoras de acetato en CON. Entre los genes implicados en la respuesta inmunitaria, el nivel de expresión de IL-18 fue significativamente menor en el yeyuno y el colon en TRT que en CON. Además, la expresión de Reg3γ fue significativamente diferente en el ciego y el colon de ambos grupos.
Conclusión: La dieta suplementada con RPS en cerdos destetados podría dar lugar a un predominio de bacterias productoras de butirato y acetato, reduciendo la gravedad de la infección por ST al mejorar el estado inmunológico.
1. Introducción
La salmonela es un importante patógeno transmitido por los alimentos que puede causar infecciones en humanos y animales (1). Entre los diversos serovares de Salmonella, las infecciones por Salmonella no tifoidea son un importante problema de salud pública en todo el mundo (1). Los cerdos son una fuente importante de infección por Salmonella no tifoidea para los seres humanos, especialmente Salmonella enterica serovar Typhimurium (ST) (2). La inflamación intestinal causada por la infección por Salmonella puede alterar la microbiota comensal y las barreras intestinales, lo que hace que las bacterias colonicen los tejidos del intestino del huésped (3, 4), lo que provoca diarrea, enterocolitis fibrinonecrótica y deshidratación en los cerdos (5).
Una microbiota intestinal sana puede reducir la gravedad de la infección por Salmonella; por lo tanto, una dieta de suplementos alimenticios que apoye las poblaciones microbianas beneficiosas es una estrategia potencial en la granja para controlar la infección por Salmonella en cerdos (6, 7). El almidón resistente (RS) es una fuente importante de hidratos de carbono accesibles a la microbiota, ya que se digiere en el intestino grueso y no en el delgado (8). La alimentación con RS puede aumentar los ácidos grasos de cadena corta (AGCC) en el tracto intestinal, lo que resulta en una mejora de las funciones de barrera, una mayor tolerancia a los organismos comensales y una reducción de la inflamación en el tejido intestinal (9, 10). El almidón de patata cruda (RPS) es un ingrediente común de RS que mejora la fermentación en el tracto digestivo y aumenta los niveles de citoquinas proinflamatorias y antiinflamatorias (11). Recientemente, los estudios han demostrado que la alimentación con RPS podría aumentar la expresión génica relacionada con la función de barrera cecal y mejorar el sistema inmunológico de la mucosa en animales (8, 12).
Nuestro estudio anterior reveló que el consumo de RPS podría promover el crecimiento de microbios beneficiosos, promoviendo la producción de AGCC en cerdos destetados (13). Por lo tanto, planteamos la hipótesis de que la alimentación con RPS como suplemento podría reducir la gravedad de la infección por ST y la excreción fecal en cerdos destetados. El objetivo de este estudio fue determinar el efecto de la alimentación con RPS en la reducción de la gravedad de la infección por ST en cerdos destetados comparando la excreción y colonización del ST, las lesiones histopatológicas, la composición de la microbiota y las respuestas inmunológicas en cerdos inoculados con ST alimentados con dietas RS y no RS. Los hallazgos podrían proporcionar métodos potenciales para prevenir la infección por ST en cerdos mediante la alteración de la composición del microbioma y la mejora de las respuestas inmunitarias.
2. Materiales y métodos
2.1. Ética animal
Todos los experimentos fueron aprobados por el Comité de Ética Animal del Instituto Nacional de Ciencia Animal de la República de Corea (Aprobación No. NIAS 2021-503).
2.2. Animales, dietas experimentales e inoculación de Salmonella Typhimurium
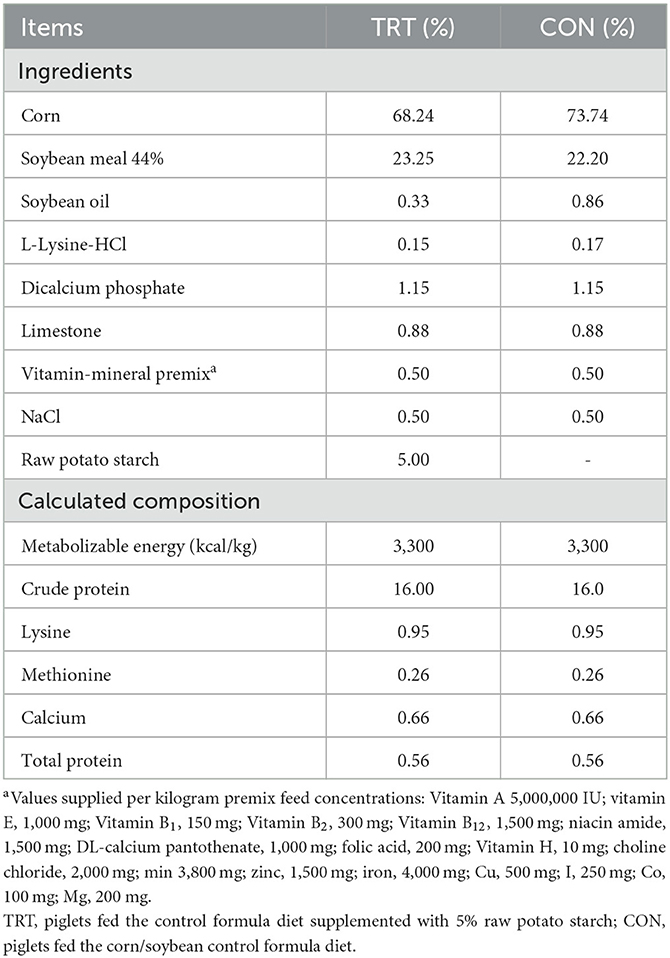
Doce lechones machos castrados (Landrace × Yorkshire, de 25 días de edad) se obtuvieron del mismo rebaño en una granja comercial. El peso promedio de los cerdos fue de 5,00 ± 0,8 kg. Todos los cerdos fueron cuidadosamente monitoreados diariamente durante 3 días antes del experimento de la dieta. Durante el período de adaptación, se confirmó que todos los cerdos eran seronegativos para la fiebre aftosa, el síndrome respiratorio y reproductivo porcino, la peste porcina clásica, la infección por Mycoplasma spp. y la infección por Salmonella spp. Además, no se detectaron Salmonella spp. y Escherichia coli en las muestras fecales de los cerdos experimentales. Los lechones (de 28 días de edad) se dividieron aleatoriamente en dos grupos: el grupo de tratamiento (TRT, n = 6) y el grupo de control negativo (CON, n = 6). La dieta CON se formuló de acuerdo con los requerimientos nutricionales sugeridos por el estándar coreano de alimentación para cerdos, y los cerdos TRT fueron alimentados con la dieta CON suplementada con RPS al 5% durante 21 días (Tabla 1). Después de 21 días, la dieta de los cerdos TRT (de 49 días de edad) se cambió a la dieta CON hasta el final del experimento. Posteriormente, todos los cerdos experimentales de 49 días de edad fueron inoculados por vía oral con 1 × 108 unidades formadoras de colonias de la cepa ST LT2 (ATCC 19585). Los cerdos infectados con ST fueron sacrificados 14 días después de la inoculación bacteriana e inmediatamente necropsiados para recolectar las muestras de tejido.
2.3. Muestreo y evaluación de la excreción de Salmonella
Las muestras fecales se recolectaron a los 0 y 21 días después de la alimentación (dpf) y a los 2, 5, 8 y 11 días después de la inoculación del ST (dpi). Los tejidos fecales e intestinales (yeyuno, íleon, colon y ciego) se recolectaron de cerdos sacrificados a 14 dpi. El caldo Rappaport-Vassiliadis R10 (BD, Sparks, MD, EE.UU.) que contenía las muestras fecales y de tejido (1 g) se incubó inmediatamente a 42 °C durante 24 h, y un asa del cultivo de RV se rayó en CHROMagar Salmonella Plus (CHROMagar, París, Francia). Por último, las colonias de malva se identificaron como ST mediante reacción en cadena de la polimerasa (PCR) utilizando el kit de PCR AccuPower Salmonella spp. 3-Plex (Bioneer, Daejeon, Corea).
2.4. Histopatología e inmunohistoquímica
Las muestras de tejido del yeyuno, íleon, ciego y colon de cerdos necropsiados (a 14 dpi) se fijaron en formol tamponado neutro al 10% y se incluyeron en cera de parafina. Posteriormente, los tejidos seccionados de 4 μm de espesor se tiñeron con hematoxilina y eosina utilizando un protocolo estándar de laboratorio y se tiñeron inmunohistoquímicamente con anti-Salmonella Typhimurium (BS-4801R; Thermo Fisher Scientific, Rockford, IL, EE. UU.). Por último, se puntuaron las lesiones histopatológicas (de 0 a 5) utilizando parámetros previamente descritos, como el acortamiento y erosión de las vellosidades, la presencia y concentración de TS y la infiltración de células inflamatorias (14).
2.5. Análisis de la comunidad microbiana
El ADN se extrajo utilizando el kit DNeasy PowerSoil (Qiagen, Hilden, Alemania) siguiendo las instrucciones del fabricante. Los amplicones de la región V3-V4 se generaron y secuenciaron siguiendo el protocolo de preparación de la biblioteca de secuenciación metagenómica Illumina 16S. Posteriormente, se realizó la secuenciación de extremos pareados del amplicón utilizando la plataforma MiSeq (Illumina, San Diego, CA, USA). Posteriormente, se realizó el análisis bioinformático descrito en nuestro estudio previo (13). Por último, los datos de secuenciación se organizaron según los dos grupos experimentales (TRT y CON) con fines analíticos.
2.6. Medición de las concentraciones de AGCC
El acetato, el butirato y el propionato se seleccionaron en función de sus diferencias específicas informadas en nuestro estudio previo (13). Las concentraciones fecales de AGCC se determinaron utilizando un cromatógrafo de gases de la serie Agilent 6890 (Agilent Technologies, Santa Clara, CA, EE. UU.) junto con espectrometría de masas (13).
2.7. Cuantificación de citoquinas en tejido gastrointestinal
Se analizaron los tejidos de yeyuno, ciego y colon de cerdos a 14 dpi para la cuantificación de citoquinas. En primer lugar, el ARN total se aisló utilizando el RNeasy Mini Kit (Qiagen, Hilden, Alemania) y se transcribió inversamente en ADNc utilizando un kit de síntesis de ADNc de alta capacidad (Applied Biosystems, Foster City, CA, EE. UU.) siguiendo las instrucciones del fabricante. Además, se cuantificó la expresión relativa de siete genes mediante PCR con transcripción inversa (RT) (RT-PCR), incluidos cuatro genes relacionados con la función de barrera intestinal [claudina (CLDN), ocludina (OCLN), zonula occludens-1 (ZO-1)], y la proteína 3-gamma derivada de los islotes en regeneración (Reg3γ), y tres genes relacionados con la respuesta inmune contra Salmonella infección, incluyendo interleucina (IL)-10, IL-17A e IL-18. En particular, la RT-PCR se realizó utilizando el sistema de PCR en tiempo real ABI 7500 (Applied Biosystems) en las siguientes condiciones: 10 min a 95 °C, 40 ciclos a 95 °C durante 15 s, la temperatura de recocido de cada cebador durante 30 min y 72 °C durante 15 s. Las temperaturas de cebado y recocido se enumeran en la Tabla 2. Por último, se determinó la expresión cambio de pliegue mediante el parámetro 2−ΔΔCt Método con el gen beta-actina como gen de referencia endógeno para normalizar el nivel de expresión génica diana.
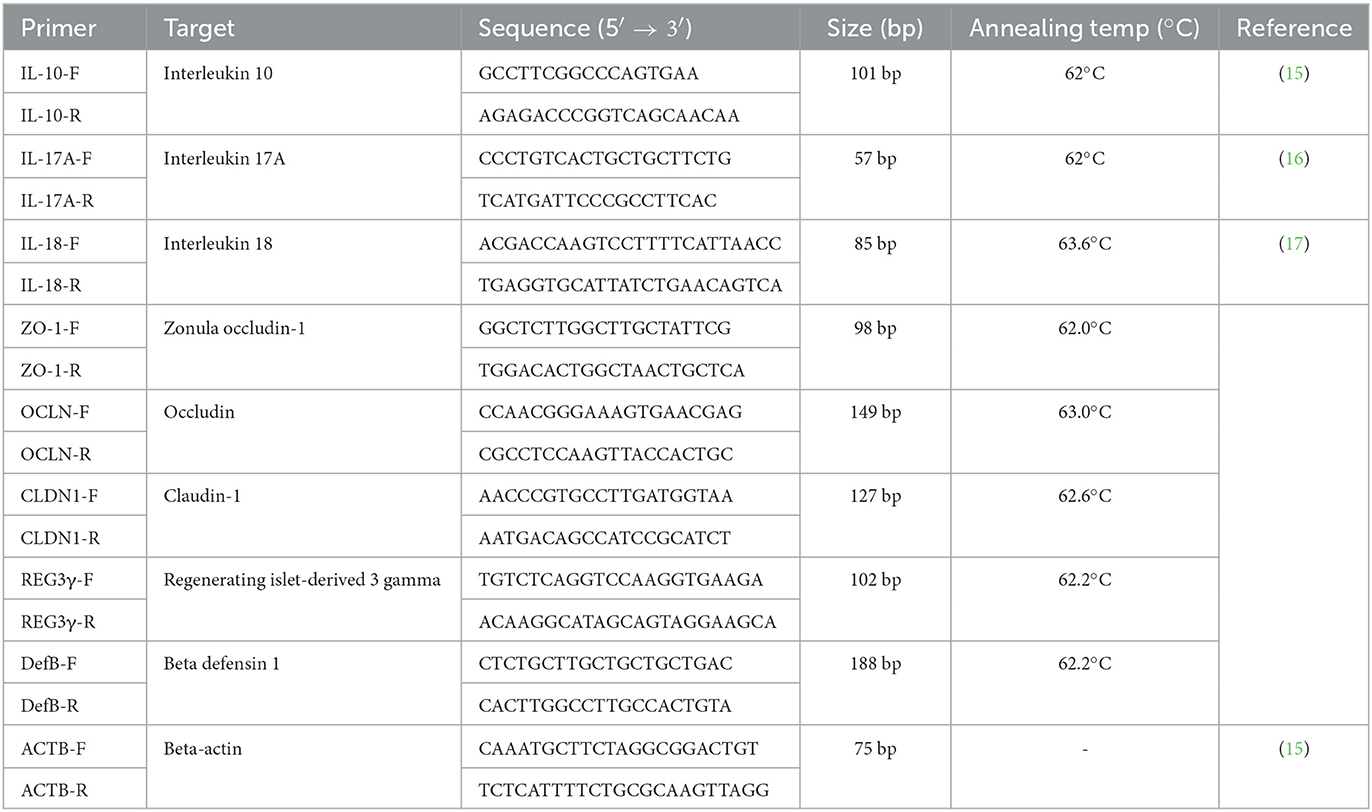 Tabla 2. La información del cebador y la condición de PCR para la reacción en cadena de polímeros cuantitativa en tiempo real.
Tabla 2. La información del cebador y la condición de PCR para la reacción en cadena de polímeros cuantitativa en tiempo real.
2.8. Datos de secuenciación de ARN y análisis de genes expresados diferencialmente (DEG)
El ARN total se obtuvo de todos los cerdos experimentales a 2 ppp utilizando un tubo de ARN sanguíneo Tempus (Applied Biosystems, Seúl, Corea). Para producir el transcriptoma, TNT Research Corporation Limited (Anyang, Corea) llevó a cabo la construcción de bibliotecas de ARN y ADNc y la secuenciación de ARN como se describió anteriormente (18). Por último, se analizaron los DEGs en sangre de los grupos TRT y CON en función del nivel de expresión de cada transcrito, tal y como se ha descrito anteriormente (18).
2.9. Análisis estadístico
Se utilizaron las pruebas de suma de rangos de Kruskal-Wallis y Wilcoxon no apareadas para comparar las diversidades alfa de la composición del microbioma fecal en los grupos TRT y CON a 14 ppp y tres puntos de tiempo (0, 21 ppd y 14 ppp), respectivamente. Todos los análisis estadísticos adoptaron un valor P de 0,05 como valor de corte y una puntuación de análisis discriminante lineal (LDA) de 2,0 utilizando el software QIIME versión 2.0. Además, la diversidad beta se visualizó mediante una matriz de análisis de coordenadas principales (PCoA) utilizando la distancia de Bray-Curtis y la versión 2.0 del software QIIME. Además, se utilizó el tamaño del efecto LDA (LEfSe) para determinar el efecto específico sobre la abundancia relativa de taxones en los grupos RS y no RS. Los taxones con una diferencia significativa (P < 0,05) entre ambos grupos se sometieron al análisis LEfSe, y se consideró que aquellos con una puntuación LDA > 2,0 habían sido significativamente alterados después de la infección por Salmonella en el grupo TRT en comparación con los del grupo CON. Por último, se compararon los cambios significativos en la ganancia media diaria (GMD), las puntuaciones histopatológicas de las lesiones y las concentraciones de AGCC entre los grupos TRT y CON mediante la prueba t de Student utilizando el software SPSS (versión 26.0; IBM, Armonk, Nueva York, Estados Unidos).
3. Resultados
3.1. Comportamiento vegetativo y excreción fecal de Salmonella Typhimurium
Comparamos los cerdos del grupo TRT (alimentados con dieta suplementada con RPS) con los del grupo CON (Figura 1A). La GMD durante el período de alimentación (de 0 a 21 dpf) fue de 0,15 y 0,12 kg/día en los grupos TRT y CON, respectivamente; sin embargo, la GMD durante el período de infección por ST (de 0 a 14 dpi) en el grupo TRT (0,27 kg/día) fue significativamente mayor (P = 0,010) que en el grupo CON (0,15 kg/día) (Figura 1B). Además, el grupo TRT mostró reducciones marcadas en el desprendimiento de ST a los 8 y 11 ppp en comparación con el grupo CON [8 dpi: 33,3% (TRT) vs. 66,7% (CON) y 11 dpi: 16,7% (TRT) vs. 50,0% (CON)] (Figura 1C).
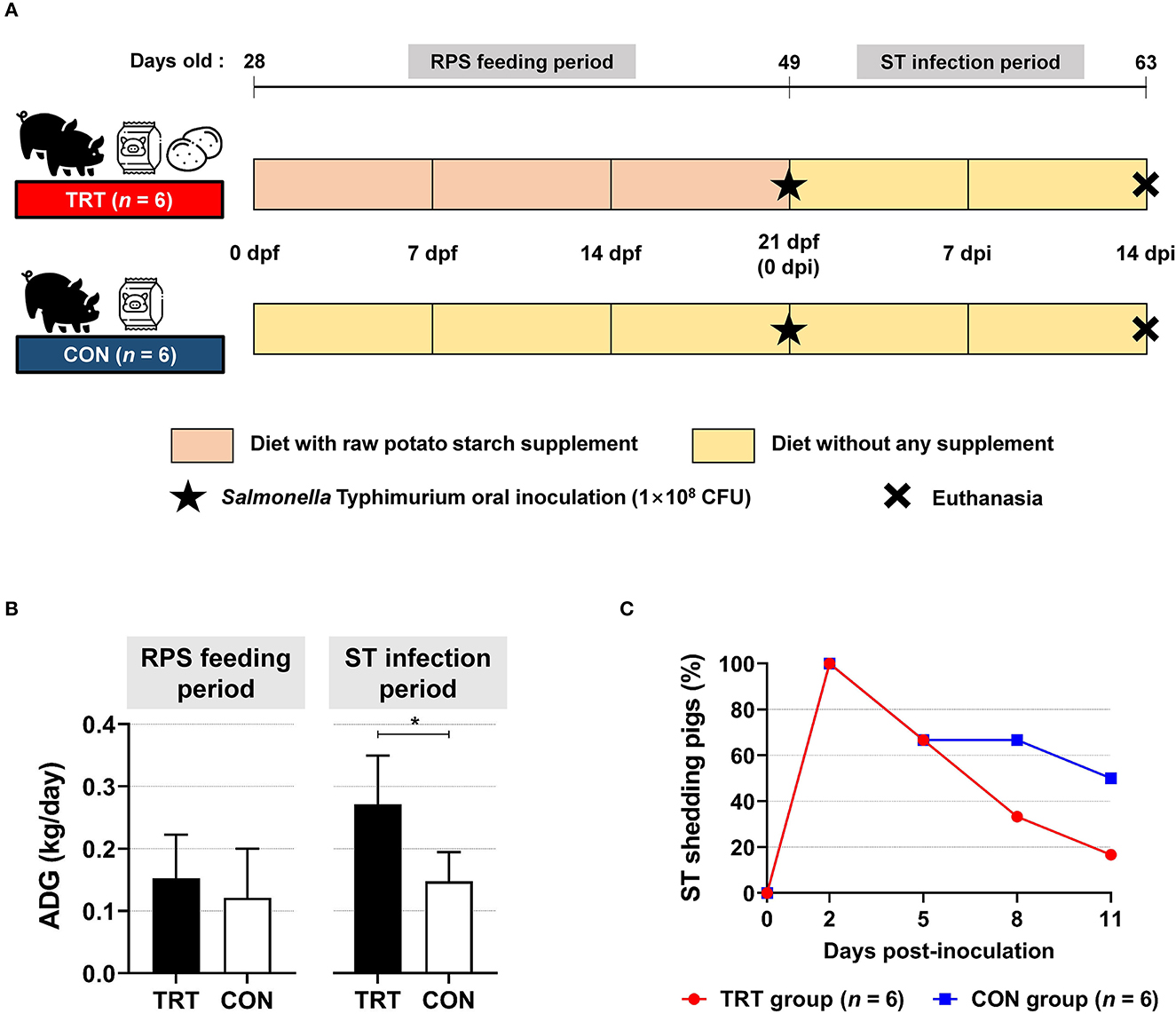 Figura 1. Efecto del suplemento dietético RPS en cerdos destetados infectados con Salmonella Typhimurium (ST). A) Esquema experimental. (B) Ganancias medias diarias (GMD) en cerdos alimentados con RS (TRT) y no alimentados con RS (CON) durante dos períodos experimentales. *P < 0,05. (C) Aislamiento de ST en muestras fecales de TRT y CON hasta 11 días después de la inoculación.
Figura 1. Efecto del suplemento dietético RPS en cerdos destetados infectados con Salmonella Typhimurium (ST). A) Esquema experimental. (B) Ganancias medias diarias (GMD) en cerdos alimentados con RS (TRT) y no alimentados con RS (CON) durante dos períodos experimentales. *P < 0,05. (C) Aislamiento de ST en muestras fecales de TRT y CON hasta 11 días después de la inoculación.
3.2. Lesiones histopatológicas y aislamiento de Salmonella Typhimurium en tejidos
Aunque se observaron lesiones histopatológicas y ST en ambos grupos (Figura 2A), los cerdos CON exhibieron un daño organostral más severo que los cerdos TRT, indicado por las puntuaciones histopatológicas promedio totales de lesiones en el yeyuno, íleon, ciego y colon [TRT (1,8 ± 0,9) vs. CON (3,6 ± 1,3), P < 0,001] (Figura 2B). Además, las puntuaciones medias en el íleon de los cerdos TRT (1,2 ± 0,4), ciego (1,2 ± 0,4) y colon (2,5 ± 0,5) fueron significativamente más bajas (P < 0,001, P = 0,001 y P < 0,001, respectivamente) que las de los cerdos CON (3,5 ± 0,8), ciego (4,5 ± 0,5) y colon (4,3 ± 0,7).
 Figura 2. Lesiones histopatológicas en cerdos de experimentación y aislamiento de Salmonella Typhimurium (ST) en tejidos de órganos intestinales. (A) Hematoxilina y eosina representativas y tinción inmunohistoquímica (anti-ST) del íleon (a, e), ciego (b, f), yeyuno (c, g) y colon (d, h). (B) Puntuaciones histopatológicas de los órganos intestinales (yeyuno, íleon, ciego y colon). *P < 0,05. (C) Aislamiento del ST de los órganos intestinales (yeyuno, íleon, ciego y colon). *P < 0,05.
Figura 2. Lesiones histopatológicas en cerdos de experimentación y aislamiento de Salmonella Typhimurium (ST) en tejidos de órganos intestinales. (A) Hematoxilina y eosina representativas y tinción inmunohistoquímica (anti-ST) del íleon (a, e), ciego (b, f), yeyuno (c, g) y colon (d, h). (B) Puntuaciones histopatológicas de los órganos intestinales (yeyuno, íleon, ciego y colon). *P < 0,05. (C) Aislamiento del ST de los órganos intestinales (yeyuno, íleon, ciego y colon). *P < 0,05.
En el caso de los tejidos intestinales, la tasa estimada de aislamiento de ST de los cerdos TRT fue inferior a la de los cerdos CON (Figura 2C). La tasa de aislamiento del yeyuno de los cerdos TRT (0%, cero de seis cerdos) fue significativamente (P = 0,046) menor que la de los cerdos CON (50,0%, tres de seis cerdos). Además, se detectó ST en el íleon de un solo cerdo CON. Por último, un cerdo TRT (16,7%) y cuatro cerdos CON (66,7%) albergaron TS en el ciego, y las bacterias se aislaron del tejido del colon en todos los cerdos, excepto en un cerdo TRT.
3.3. Comunidades bacterianas y concentración de AGCC
Se comparó la diversidad alfa en la microbiota fecal entre los grupos TRT y CON y los puntos temporales (0, 21 dpf y 14 dpi) (Figura 3A). Se analizaron cuatro índices, incluyendo el número de variantes de secuencia de amplicones (ASV), los índices de riqueza de Chao1 y los índices de diversidad de Shannon y Gini-Simpson. La prueba de Kruskal-Wallis no mostró diferencias significativas en los cuatro índices de diversidad alfa: el número de índices de riqueza ASV (P = 0,7) y Chao1 (P = 0,7), y los índices de Shannon (P = 0,59) y Gini-Simpson (P = 0,59). Para el grupo TRT, el índice de Gini-Simpson (P = 0,016) fue significativamente mayor a los 14 dpi que a los 0 y 21 dpf. Además, los índices de Gini-Simpson (P = 0,0015) y Shannon (P = 0,0017) fueron significativamente más bajos en el grupo CON que en el grupo TRT a 14 dpi. Además, realizamos análisis de diversidad beta para investigar la estructura de la comunidad bacteriana a 14 dpi; los resultados se presentan como un gráfico de ordenación PCoA basado en matrices de distancia de Bray-Curtis. La diversidad beta difirió entre los grupos TRT y CON a 14 dpi; sin embargo, no se observaron diferencias significativas entre ambos grupos (P = 0,529). Las comunidades bacterianas durante la infección por ST en el grupo TRT se desplazaron hacia la izquierda a lo largo del eje PC1 en la dirección opuesta a las del grupo CON (Figura 3B). Además, el análisis de LEfSe mostró que 9 géneros bacterianos y 11 especies de microbios fecales aumentaron significativamente (P<0.05) en el grupo TRT; sin embargo, la abundancia de solo dos géneros y tres especies aumentó significativamente en el grupo CON (Figura 3C).
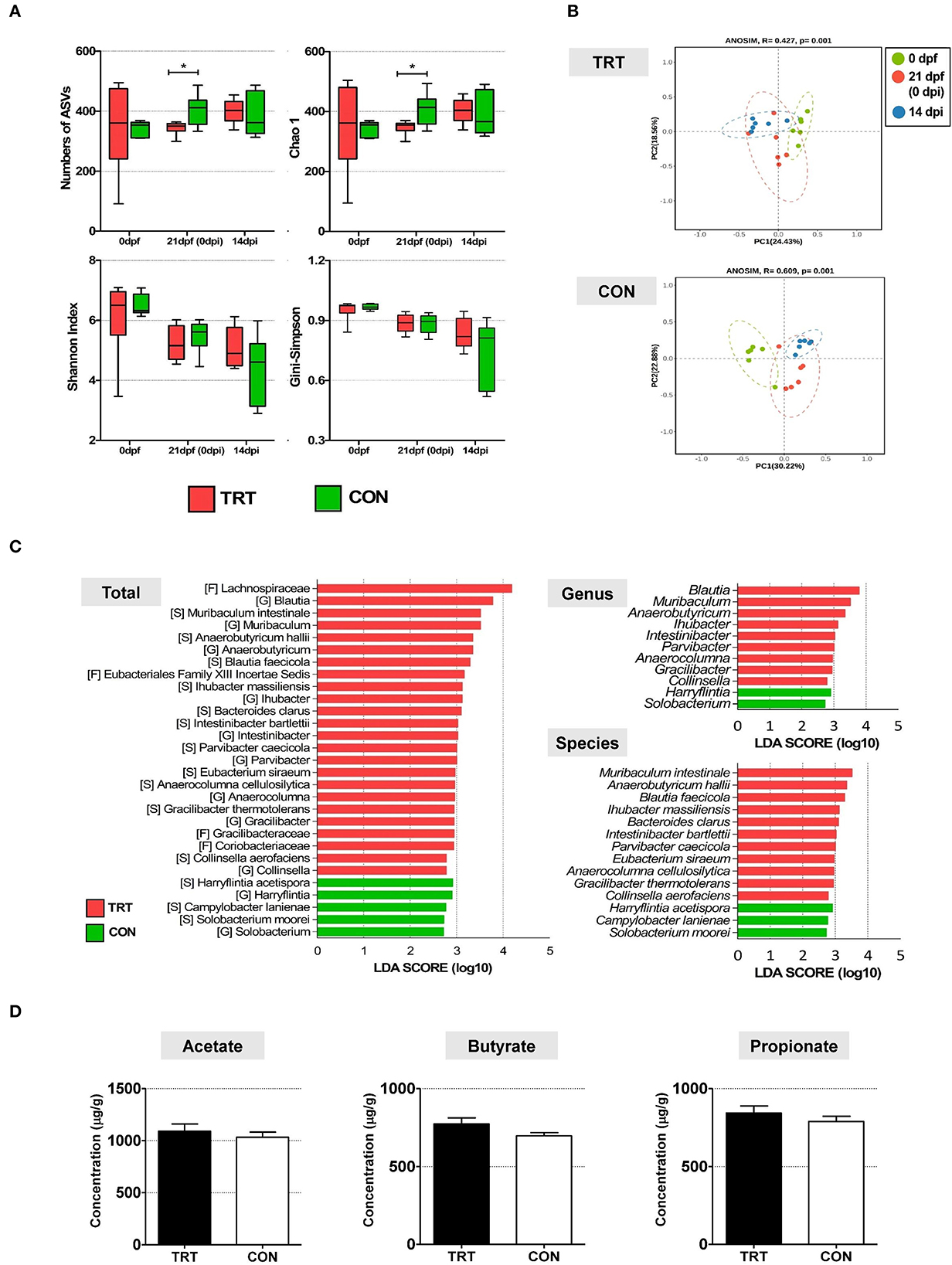 Figura 3. Comparación de la alteración de la diversidad y composición de la microbiota y la concentración de AGCC en cerdos alimentados con RPS (TRT) y cerdos no alimentados con RPS (CON) después de la inoculación de Salmonella Typhimurium (a 14 dpi). (A) Comparación de la diversidad alfa del microbioma de las heces entre TRT y CON. Los cuatro índices incluyeron el número de ASV, los índices de riqueza de Chao1 y los índices de diversidad de Shannon y Gini-Simpson. (B) PCoA de análisis de diversidad beta basado en la matriz de disimilitud de Bray-Curtis. (C) LEfSe reveló los tamaños de efecto biológico predichos de taxones diferenciales en la microbiota fecal entre TRT y CON. Las puntuaciones de LDA muestran una diferencia significativa en la abundancia y consistencia de los taxones bacterianos detectados a nivel de género y especie. (D) Concentraciones de tres AGCC (acetato, propionato y butirato) (μg/g) en muestras fecales TRT y CON a 14 dpi. *P < 0,05.
Figura 3. Comparación de la alteración de la diversidad y composición de la microbiota y la concentración de AGCC en cerdos alimentados con RPS (TRT) y cerdos no alimentados con RPS (CON) después de la inoculación de Salmonella Typhimurium (a 14 dpi). (A) Comparación de la diversidad alfa del microbioma de las heces entre TRT y CON. Los cuatro índices incluyeron el número de ASV, los índices de riqueza de Chao1 y los índices de diversidad de Shannon y Gini-Simpson. (B) PCoA de análisis de diversidad beta basado en la matriz de disimilitud de Bray-Curtis. (C) LEfSe reveló los tamaños de efecto biológico predichos de taxones diferenciales en la microbiota fecal entre TRT y CON. Las puntuaciones de LDA muestran una diferencia significativa en la abundancia y consistencia de los taxones bacterianos detectados a nivel de género y especie. (D) Concentraciones de tres AGCC (acetato, propionato y butirato) (μg/g) en muestras fecales TRT y CON a 14 dpi. *P < 0,05.
Se evaluaron las concentraciones de tres AGCC (acetato, butirato y propionato) en todas las muestras fecales experimentales de cerdo (14 dpi) para investigar el efecto de las comunidades bacterianas alteradas en los grupos TRT y CON (Figura 3D). Los niveles de los tres AGCC fueron más altos en el grupo TRT que en el grupo CON. Además, las concentraciones de acetato, butirato y propionato fueron de 1.090,8 ± 170,3 μg/g, 843,3 ± 110,6 μg/g y 773,6 ± 93,8 μg/g, respectivamente, en el grupo TRT, y de 1.033,4 ± 120,4 μg/g, 789,3 ± 81,6 μg/g y 697,3 ± 49,6 μg/g, respectivamente, en el grupo CON.
3.4. Expresión de citoquinas
La expresión relativa de ARNm de la citoquina proinflamatoria IL-18 fue significativamente menor en el yeyuno [0,00010 ± 0,00014 (TRT) vs. 0,41 ± 0,11 (CON); P = 0,0139] y dos puntos del grupo TRT [0,00003 ± 0,00002 (TRT) vs. 0,73 ± 0,05 (CON); P = 0,00001] que en los del grupo CON (Figura 4A). Además, la citoquina antiinflamatoria IL-10 se expresó menos en el yeyuno, el ciego y el colon. Además, la expresión de la citoquina proinflamatoria IL-17A fue mayor en el colon del grupo TRT que en el colon del grupo CON; sin embargo, las diferencias fueron insignificantes debido a las grandes desviaciones entre las muestras.
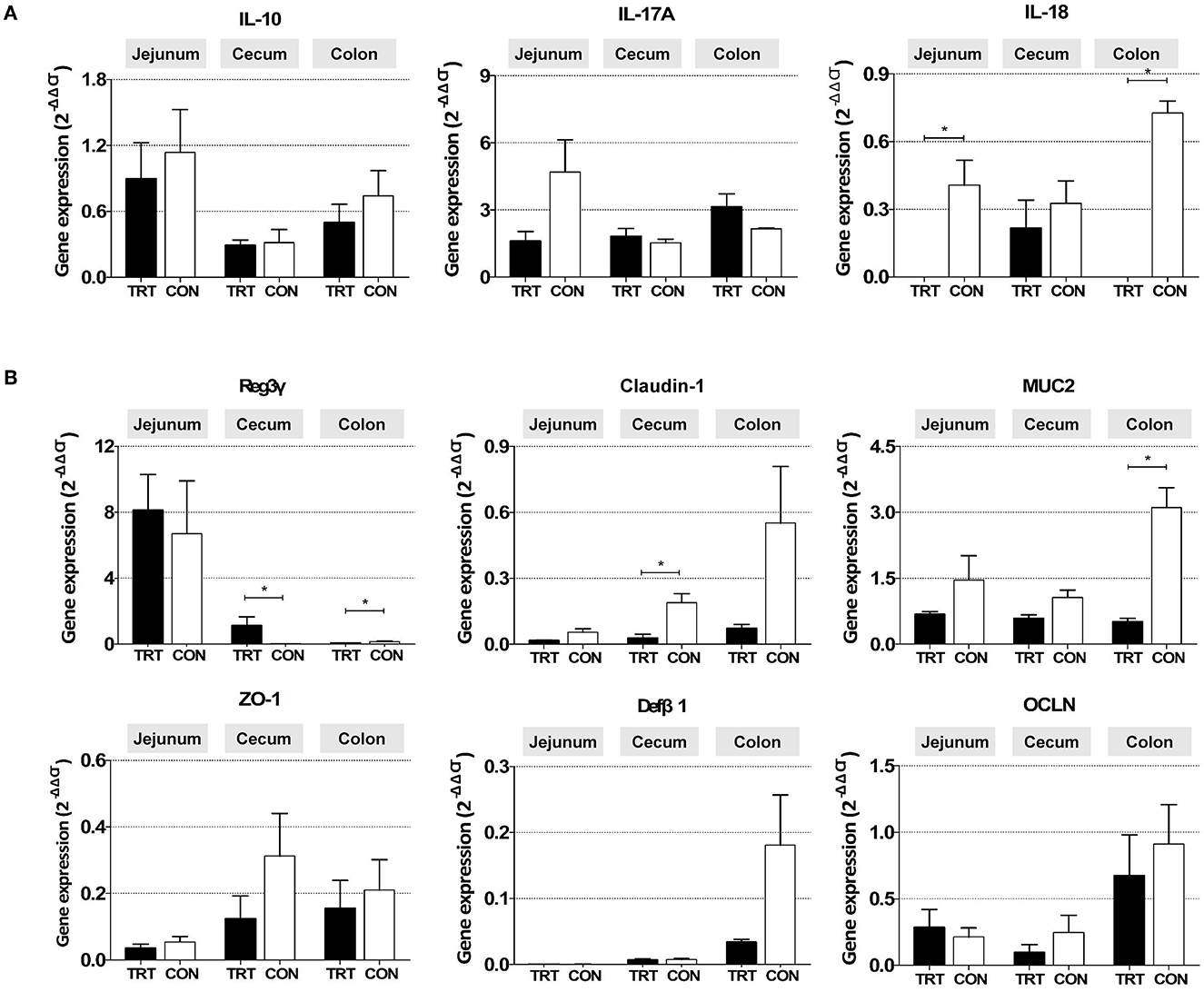 Figura 4. Expresión génica de ARNm en tres órganos intestinales (yeyuno, ciego y colon) de cerdos alimentados con RPS (TRT) y no alimentados con RPS (CON) después de la inoculación de Salmonella Typhimurium (a 14 dpi). (A) Genes asociados con la respuesta inflamatoria (IL-10, IL-17A e IL-18). (B) Genes asociados con la función de barrera intestinal (Reg3γ, Claudin-1, MUC2, Zo-1, Defβ1 y OCLN). *P < 0,05.
Figura 4. Expresión génica de ARNm en tres órganos intestinales (yeyuno, ciego y colon) de cerdos alimentados con RPS (TRT) y no alimentados con RPS (CON) después de la inoculación de Salmonella Typhimurium (a 14 dpi). (A) Genes asociados con la respuesta inflamatoria (IL-10, IL-17A e IL-18). (B) Genes asociados con la función de barrera intestinal (Reg3γ, Claudin-1, MUC2, Zo-1, Defβ1 y OCLN). *P < 0,05.
Entre los genes relacionados con la barrera intestinal, la expresión del gen del péptido antimicrobiano Reg3γ fue significativamente mayor en el ciego [1,120 ± 0,535 (TRT) vs. 0,023 ± 0,004 (CON); P = 0,0309] pero menor en el colon del grupo TRT [0,073 ± 0,012 [TRT] vs. 0,148 ± 0,036 (CON); P = 0,0190] que en los del grupo CON (Figura 4B). Además, los niveles relativos de expresión de ARNm de CLDN-1 en el ciego [0,216 ± 0,124 (TRT) vs. 0,327 ± 0,099 (CON); P = 0,0254] y MUC2 en el colon [0,51 ± 0,08 (TRT) vs. 3,11 ± 0,45 (CON); P = 0,0095] fueron significativamente menores en el grupo TRT que en el grupo CON. Sin embargo, se observaron diferencias insignificantes en la expresión de CLDN-1 en el yeyuno y el colon, MUC2 en el yeyuno y el ciego, y los otros tres genes (ZO-1, OCLN y DefB1) en el yeyuno, el ciego y el colon entre los dos grupos de alimentación.
3.5. Análisis del transcriptoma de la muestra de sangre
Se recopiló un promedio de 6,7 Gb de datos brutos para cada muestra a partir de la secuenciación del transcriptoma de extremo pareado utilizando la plataforma Illumina NovaSeq 6000. Los datos brutos se sometieron a control de calidad utilizando Trimmomatic (ver. 0.38), y los datos recortados se mapearon utilizando HISAT2 ver. 2.1.0 (alineador Bowtie2). A continuación, las lecturas asignadas se ensamblaron mediante la opción StringTie-e versión 1.3.4d. Posteriormente, los genes obtenidos se filtraron excluyendo aquellos con al menos un recuento cero, quedando 12.189 genes para el análisis de DEG. En total, se consideró que 424 genes se expresaban diferencialmente en función del nivel umbral (fold change [log2] ≥ 2 y P < 0,05) (Figura 5A). Por último, se determinó la función biológica de 424 DEGs mediante la ontología génica (GO) y las vías de la Enciclopedia de Genes y Genomas de Kioto utilizando la herramienta DAVID 6.8. La Figura 5B muestra el análisis funcional GO del proceso biológico (top 20), componente celular (top 12) y función molecular (top 6).
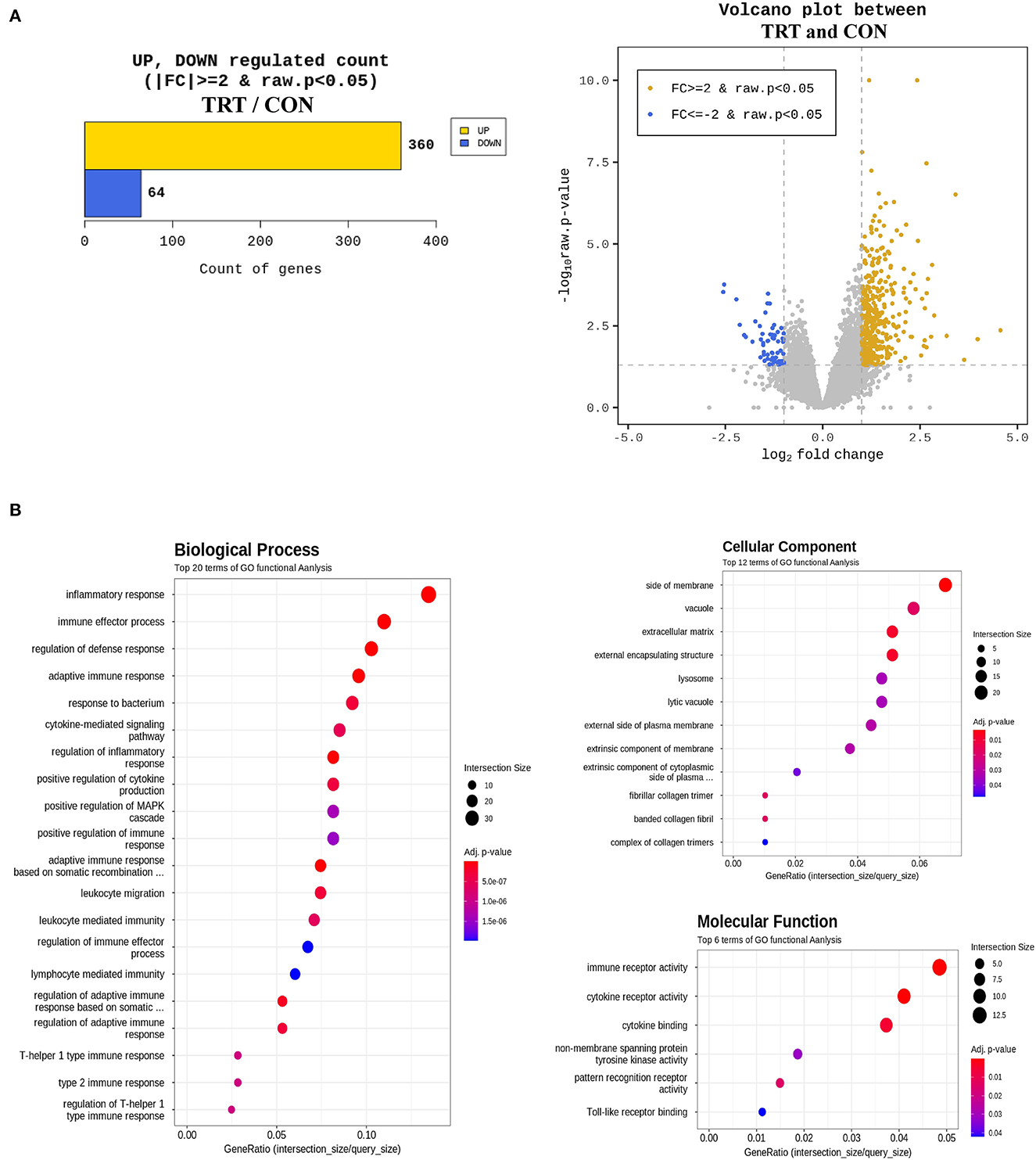 Figura 5. Análisis de enriquecimiento de genes expresados diferencialmente (DEG) y ontología génica (GO) en muestras de sangre de cerdos alimentados con RPS (TRT) y no alimentados con RPS (CON) a los 2 d después de la inoculación de Salmonella Typhimurium. (A) Número de genes regulados al alza y a la baja después de la comparación de los valores normalizados utilizando el paquete DESeq2. (B) GOTERM_Biological proceso, GOTERM_Cellular componente y GOTERM_Molecular función.
Figura 5. Análisis de enriquecimiento de genes expresados diferencialmente (DEG) y ontología génica (GO) en muestras de sangre de cerdos alimentados con RPS (TRT) y no alimentados con RPS (CON) a los 2 d después de la inoculación de Salmonella Typhimurium. (A) Número de genes regulados al alza y a la baja después de la comparación de los valores normalizados utilizando el paquete DESeq2. (B) GOTERM_Biological proceso, GOTERM_Cellular componente y GOTERM_Molecular función.
4. Discusión
La salmonela es uno de los principales agentes causantes de la diarrea en los cerdos, amenazando la seguridad alimentaria y la salud humana. Según los informes, la inflamación local en cerdos infectados con Salmonella puede causar cambios en el microbioma intestinal, favoreciendo la supervivencia de Salmonella (4, 19). Anteriormente revelamos que la alimentación con RPS de cerdos destetados podría mejorar la salud intestinal al mantener el equilibrio de bacterias beneficiosas y promover la producción de AGCC (13). Por lo tanto, investigamos la composición de la microbiota intestinal y la respuesta inmunológica para prevenir la infección por ST en cerdos alimentados con RPS.
El RPS es un SR tipo II que puede disminuir el peso corporal (PC) en humanos y animales. Sin embargo, la GMD de los cerdos TRT no fue significativamente diferente de la de los cerdos CON durante el período de alimentación RPS (hasta 21 dpf), lo que coincide con el hallazgo de nuestro estudio previo (13). Aunque la infección por Salmonella en cerdos reduce el peso corporal y la GMD (20), la GMD de los cerdos TRT fue significativamente mayor que la de los cerdos CON durante el período de infección por ST. Estos hallazgos podrían explicar el efecto promotor de la salud intestinal en cerdos alimentados con RPS, ya que la GMD en cerdos está fuertemente relacionada con la morfología intestinal (21). Además, una microbiota intestinal sana y sus AGCC derivados podrían prevenir la colonización de bacterias patógenas al disminuir la permeabilidad de la mucosa intestinal (13, 22). Las lesiones histopatológicas en los tejidos de los órganos intestinales de los cerdos TRT fueron significativamente más leves que las de los cerdos CON. Además, la excreción fecal del ST se redujo en los cerdos alimentados con RPS (TRT) a los 8 dpi. Estos resultados sugieren una mejor salud intestinal después de la dieta post-destete suplementada con RPS.
La abundancia de nueve géneros bacterianos aumentó significativamente en los cerdos TRT, entre los cuales Blautia (P = 0,0374), Muribaculum (P = 0,0104), Anaerobutyricum (P = 0,0374) y Anaerocolumna (P = 0,0247) fueron las principales bacterias productoras de butirato (23-26). Blautia se considera un nuevo probiótico potencial debido a su capacidad para producir bacteriocina (sactíptido y lanthipéptido), inhibir la colonización bacteriana patógena y regular las respuestas inflamatorias (25). Por lo tanto, especulamos que el aumento de la abundancia de Blautia podría haber contribuido a las lesiones histopatológicas leves y a la reducción de la colonización del ST en los tejidos de los órganos intestinales de los cerdos TRT. Yuan et al. (27) demostraron que los metabolitos de Muribaculum podrían mejorar la función y la integridad de la barrera intestinal, evitando la fuga de mediadores inflamatorios a la circulación sistémica. Además, el género Anaerobutyricum y su subtaxón A. hallii (P = 0.0374) aumentaron más en el grupo TRT que en el grupo CON. A. hallii es una potencial bacteria probiótica de próxima generación debido a su capacidad para producir propionato y butirato (28). Además, las cuatro principales bacterias productoras de acetato en TRT, Intestinibacter (P = 0,0250), Anaerocolumna (P = 0,0247), Gracilibacter (P = 0,0374) y Collinsella (P = 0,0250), fueron más prevalentes en el grupo TRT que en el grupo CON. Según se informa, la anaerocolumna descompone la celulosa, los oligosacáridos, los polisacáridos y los ácidos orgánicos en fuentes de energía (29). Además, Gracilibacter puede degradar la glucosa, e Intestinibacter está implicado en el consumo de mucina al degradar la fucosa (30). Por último, Collinsella se correlaciona significativa y positivamente con la mayoría de los ácidos biliares y está relacionada con el metabolismo de los lípidos (31). Por el contrario, la abundancia de solo dos géneros, Harryflintia (P = 0,0463) y Solobacterium (P = 0,0278) aumentó en el grupo CON, que solo puede producir acetato (32, 33). Lawhon et al. (34) informaron que la proporción desequilibrada de AGCC (p. ej., alta concentración de acetato y baja concentración de butirato/propionato) podría causar una infección por ST más invasiva. Además, la abundancia de Harryflintia se redujo cuando los ratones fueron alimentados con altas concentraciones de RPS (0-10%) (35). Aunque las abundantes especies Campylobacter lanienae (P = 0,0222) y Solobacterium moorei (P = 0,0278) son comunes en el tracto gastrointestinal de los cerdos, han surgido como una causa potencial de gastroenteritis humana (32, 36).
Nuestro estudio anterior mostró que la alimentación con RPS al 5% resultó en concentraciones significativamente más altas de acetato, butirato y AGCC totales en cerdos sanos (13). Sin embargo, en el presente estudio, los tres AGCC en los grupos TRT y CON no mostraron diferencias significativas, a pesar del aumento del número de bacterias productoras de butirato. Según se informa, el TS utiliza y disminuye el butirato derivado de la microbiota al alterar la composición de la microbiota intestinal; En consecuencia, el epitelio intestinal cambia a la fermentación del lactato (37, 38). Además, se informó que concentraciones suficientes de butirato y propionato permitieron la supresión de la inflamación intestinal inducida por el ST mediante la regulación de la expresión de los genes responsables de la invasión y patogénesis del ST; Además, aumentaron la sensibilidad de los patógenos a la represión mediada por butirato de la expresión génica relacionada con la invasión (34, 37). En este caso, el consumo de butirato por ST podría no aumentar significativamente las concentraciones de butirato y propionato en el intestino de los cerdos TRT; sin embargo, esto puede afectar la gravedad y los resultados de colonización bacteriana en cerdos alimentados con RS.
En el presente estudio, la expresión de ARNm de Reg3γ (gen del péptido antimicrobiano) aumentó notablemente en el ciego y el colon de los cerdos TRT. Reg3γ restringe la colonización bacteriana de la superficie de la mucosa intestinal y mantiene la segregación espacial entre las bacterias y el epitelio intestinal (39). Por lo tanto, la escasa colonización de ST en cerdos TRT podría deberse a la mayor expresión de Reg3γ en ciego y colon. Además, los niveles de expresión de ARNm de IL-18 y las puntuaciones histopatológicas se redujeron significativamente en el colon de los cerdos TRT. Estudios previos han sugerido que la IL-18 es necesaria para iniciar la inflamación de la mucosa (40, 41). Además, la regulación positiva de la IL-18 es fundamental para la patogénesis de la destrucción de tejidos y la gravedad de la gastroenteritis en humanos y ratones (41, 42). Por lo tanto, la alta expresión de γ de Reg3y la baja expresión de IL-18 en TRT se relacionan con la reducción de la colonización del ST y los resultados histopatológicos.
En este estudio, el análisis de GO reveló que los DEG regulados al alza estaban principalmente involucrados en las respuestas inmunitarias e inflamatorias a 2 dpi. Los cinco procesos biológicos principales fueron la respuesta inflamatoria, el proceso efector inmunitario, la regulación de la respuesta de defensa, la respuesta inmunitaria adaptativa y la respuesta a las bacterias. Además, el análisis de enriquecimiento de GO de la DEG regulada al alza incluyó la actividad del receptor inmune, la actividad del receptor de citocinas y la unión a citocinas. Estos resultados son consistentes con los hallazgos previos de que las características inflamatorias alcanzaron su punto máximo y la infiltración inflamatoria aumentó significativamente en los tejidos del intestino delgado de lechones infectados con ST a los 2 dpi (43, 44). Teniendo en cuenta estos resultados junto con los resultados de la qPCR, el análisis GO reveló que la infección por ST desencadenó respuestas inmunitarias en la fase temprana. A 2 dpi, los niveles de transcripción de las proteínas de unión estrecha claudina y ocludina (CLDND1 y OCEL1) en sangre aumentaron en 22,33 y 1,21 veces, respectivamente. Sin embargo, a los 14 dpi, los genes se expresaron menos en el grupo TRT que en el grupo CON. Este resultado sugiere que CLDN y OCLN podrían haberse expresado antes, por lo que no es necesario por 14 ppp. Además, a 2 dpi, los genes de citoquinas relacionados con la inflamación, la subunidad alfa y la subunidad beta de IL-10 (IL10Rα e IL10RB) mostraron aumentos de 1,62 y 2,23 veces, respectivamente, y el gen IL-17 (IL17B) mostró un aumento de 41 veces. Además, observamos aumentos de 4,84, 2,49 y 1,91 veces en los genes del receptor de IL-18 (IL18R1), la proteína de unión (IL18BP) y la IL18, respectivamente. Sin embargo, excluyendo la IL-17A en el colon, la IL-10 y la IL-17A fueron más bajas en todos los tejidos examinados en este estudio, y la IL-18 fue significativamente menor en el yeyuno y el colon del grupo TRT que en los del grupo CON. Según se informa, la sobreexpresión de Reg3γ induce una alta inmunosupresión (45). Por lo tanto, la drástica reducción de los genes de citoquinas en nuestro estudio podría deberse a un aumento significativo de la γ Reg3a los 14 ppp.
En general, los resultados demuestran que la dieta suplementada con RS podría prevenir la infección por TS en cerdos destetados y proporcionar información sobre los mecanismos subyacentes a las respuestas inmunitarias de los cerdos alimentados con RS contra la infección por TS. Sin embargo, existen algunas limitaciones a la hora de proporcionar una conclusión general sobre el uso de la alimentación con RS como medida preventiva para el TS en los cerdos. En primer lugar, este estudio se llevó a cabo en un número limitado de cerdos; por lo tanto, es posible que los resultados no representen la población porcina general. Se requieren más estudios con tamaños de muestra más grandes y diferentes razas de cerdos para validar estos hallazgos. En segundo lugar, el experimento con animales se llevó a cabo en condiciones controladas; Por lo tanto, los resultados pueden ser difíciles de replicar inmediatamente en una granja porcina. En el futuro se requiere un experimento de aplicación en unidades agrícolas reales.
5. Conclusión
Los resultados del estudio sugieren que alimentar a los cerdos destetados con RPS, un SR tipo II, podría mejorar la salud intestinal y reducir la infección por ST. El grupo TRT mostró una GMD más alta durante el período de infección y lesiones histopatológicas más leves en los órganos intestinales que el grupo CON. Además, los cerdos TRT mostraron una marcada reducción en la excreción de ST en comparación con la de los cerdos CON. Estos resultados sugirieron que la alimentación con RPS en cerdos destetados podría reducir las pérdidas económicas en la granja debido a la infección por ST. La microbiota intestinal del grupo TRT mostró una mayor abundancia de cuatro bacterias principales productoras de butirato y cuatro bacterias principales productoras de acetato. El aumento de los niveles de estas bacterias beneficiosas podría haber contribuido a promover la salud intestinal y reducir la colonización del ST en el grupo TRT. Además, la expresión de Reg3γ aumentó notablemente en los cerdos TRT, lo que impidió la colonización de ST en los cerdos alimentados con RPS. En general, nuestros hallazgos destacan el uso potencial de RPS como una intervención dietética para mejorar la salud intestinal y reducir las infecciones por Salmonella en cerdos.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres de los repositorios y los números de acceso se pueden encontrar en: https://www.ncbi.nlm.nih.gov/bioproject; PRJNA881483, PRJNA952690.
Declaración ética
Todos los experimentos fueron aprobados por el Comité de Ética Animal del Instituto Nacional de Ciencia Animal de la República de Corea (Aprobación No. NIAS 2021-503).
Contribuciones de los autores
S-IO hizo contribuciones sustanciales a la concepción y el diseño de la obra y revisó el manuscrito antes de la presentación. S-WY se encargó de los análisis de laboratorio, la curación de datos y la interpretación de los datos experimentales. S-WY, HL, EK y S-IO fueron responsables de los experimentos e investigaciones con animales. S-WY, Y-HJ, E-YB, AC, YD, T-YH y S-IO fueron responsables de la validación de datos y los recursos. S-WY y S-IO escribieron el borrador original. Todos los autores leyeron y aprobaron el manuscrito final.
Financiación
Este estudio contó con el apoyo del Programa de Becas RDA 2021 del Instituto Nacional de Ciencia Animal, Administración de Desarrollo Rural, el «Programa de Investigación Cooperativa para el Desarrollo de la Ciencia y la Tecnología Agrícola (Título del proyecto: Desarrollo de la microbiota intestinal para la prevención de enfermedades intestinales y su impacto en la inmunidad del huésped en cerdos, Proyecto No. PJ01564401)», y Administración de Desarrollo Rural de la República de Corea.
Reconocimientos
Los autores agradecen a Hyung Joon Lee por su apoyo técnico en la recolección de muestras de los cerdos.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Callaway TR, Edrington TS, Anderson RC, Byrd JA, Nisbet DJ. La ecología microbiana gastrointestinal y la seguridad de nuestro suministro de alimentos en relación con la Salmonella. J Anim Sci. (2008) 86:E163-72. doi: 10.2527/jas.2007-0457
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Oh SI, Kim JW, Chae M, Jung JA, So B, Kim B, et al. Caracterización y resistencia a los antimicrobianos de aislados de Salmonella Typhimurium de cerdos clínicamente enfermos en Corea. J Food Prot. (2016) 79:1884–90. doi: 10.4315/0362-028X. JFP-16-131
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Bescucci DM, Moote PE, Ortega Polo R, Uwiera RRE, Inglis GD. Salmonella enterica serovar typhimurium modula temporalmente la microbiota entérica y las respuestas del huésped para superar la resistencia a la colonización en cerdos. Appl Environ Microbiol. (2020) 86:E01569–20. doi: 10.1128/AEM.01569-20
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Drumo R, Pesciaroli M, Ruggeri J, Tarantino M, Chirullo B, Pistoia C, et al. Salmonella enterica serovar Typhimurium explota la inflamación para modificar la microbiota intestinal porcina. Las células frontales infectan el microbiol. (2016) 5:106. doi: 10.3389/fcimb.2015.00106
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Costa MO, Fouhse J, Silva APP, Willing B, Harding JCS. Poner la microbiota a trabajar: Los efectos epigenéticos del tratamiento antibiótico en los primeros años de vida se asocian con vías inmunológicas y una reducción de la necrosis epitelial tras la exposición in vitro con Salmonella Typhimurium. PLoS UNO. (2020) 15:e0231942. doi: 10.1371/journal.pone.0231942
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Argüello H, Estellé J, Leonard FC, Crispie F, Cotter PD, O’Sullivan O, et al. Influencia de la microbiota intestinal en la colonización, la resistencia a la salmonela y el patrón de excreción de los cerdos expuestos de forma natural. mSystems. (2019) 4:E00021–19. doi: 10.1128/mSystems.00021-19
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Doyle MP, Erickson MC. Oportunidades para mitigar la contaminación por patógenos durante la producción de alimentos en la granja. Int J Microbiol Alimentario. (2012) 152:54–74. doi: 10.1016/j.ijfoodmicro.2011.02.037
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Trachsel J, Briggs C, Gabler NK, Allen HK, Loving CL. El almidón de patata resistente a la dieta altera las comunidades microbianas intestinales y sus metabolitos, y los marcadores de la regulación inmunitaria y la función de barrera en los cerdos. Frente Immunol. (2019) 10:1381. doi: 10.3389/fimmu.2019.01381
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Trachsel JM, Bearson BL, Kerr BJ, Shippy DC, Byrne KA, Loving CL, et al. Ácidos grasos de cadena corta y taxones bacterianos asociados con la reducción de Salmonella enterica serovar I 4, (5), 12: i: Excreción en cerdos alimentados con una dieta suplementada con almidón de patata resistente. Especificaciones de Microbiol. (2022) 3:e0220221. doi: 10.1128/spectrum.02202-21
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Van Der Hee B, Wells JM. Regulación microbiana de la fisiología del huésped por ácidos grasos de cadena corta. Tendencias Microbiol. (2021) 29:700–12. doi: 10.1016/j.tim.2021.02.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Regmi PR, Metzler-Zebeli BU, Gänzle MG, Van Kempen TATG, Zijlstra RT. El almidón con alto contenido de amilosa y baja digestibilidad in vitro aumenta el flujo intestinal de nutrientes y la fermentación microbiana y promueve selectivamente las bifidobacterias en los cerdos. J Nutr. (2011) 141:1273–80. doi: 10.3945/jn.111.140509
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Qin SM, Zhang KY, Ding XM, Bai SP, Wang JP, Zeng QF. Efecto de los niveles de almidón de patata resistente a la dieta sobre el rendimiento del crecimiento, la concentración plasmática de citoquinas y la salud intestinal en patos de carne. Poult Sci. (2019) 98:3523–32. doi: 10.3382/ps/pez186
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Yi SW, Lee HG, So KM, Kim E, Jung YH, Kim M, et al. Efecto de la alimentación con fécula de patata cruda en la dinámica de composición del microbioma intestinal de los lechones. Anim Biosci. (2022) 35:1698–710. doi: 10.5713/ab.22.0045
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Argüello H, Estellé J, Zaldívar-López S, Jiménez-Marín Á, Carvajal A, López-Bascón MA, et al. La infección temprana por Salmonella Typhimurium en cerdos altera la composición y funcionalidad del microbioma, principalmente en la mucosa del íleon. Sci Rep. (2018) 8:7788. doi: 10.1038/s41598-018-26083-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Walsh AM, Sweeney T, Bahar B, Flynn B, O’Doherty JV. El efecto de la suplementación con quitooligosacáridos sobre la morfología intestinal, las poblaciones microbianas seleccionadas, las concentraciones de ácidos grasos volátiles y la expresión génica inmune en el cerdo destetado. Animal. (2012) 6:1620–6. doi: 10.1017/S1751731112000481
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Ryan MT, O’Shea CJ, Collins CB, O’Doherty JV, Sweeney T. Efectos de la suplementación dietética con Laminaria hyperborea, Laminaria digitata y Saccharomyces cerevisiae en la vía IL-17 en el colon porcino. J Anim Sci. (2012) 90:263–5. doi: 10.2527/jas.53802
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Bouwhuis MA, Mcdonnell MJ, Sweeney T, Mukhopadhya A, O’Shea CJ, O’Doherty JV. Los extractos de algas marinas y los galactooligosacáridos mejoran la salud intestinal de los cerdos tras el desafío con Salmonella Typhimurium. Animal. (2017) 11:1488–96. doi: 10.1017/S1751731117000118
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. López BI, Santiago KG, Lee D, Ha S, Seo K, ARN. análisis del transcriptoma basado en secuenciación (RNA-seq) en la respuesta inmunitaria del ganado Holstein a la vacuna muerta contra el virus de la diarrea viral bovina tipo I. Animales. (2020) 10:344. doi: 10.3390/ani10020344
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Díaz-Ochoa VE, Lam D, Lee CS, Klaus S, Behnsen J, Liu JZ, et al. La salmonela mitiga el estrés oxidativo y prospera en el intestino inflamado al evadir el secuestro de manganeso mediado por calprotectina. Microbio huésped celular. (2016) 19:814–25. doi: 10.1016/j.chom.2016.05.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Price KL, Totty HR, Lee HB, Utt MD, Fitzner GE, Yoon I, et al. Uso del producto de fermentación de Saccharomyces cerevisiae sobre el rendimiento del crecimiento y la microbiota de cerdos destetados durante la infección por Salmonella. J Anim Sci. (2010) 88:3896–908. doi: 10.2527/jas.2009-2728
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Park S, Lee JJ, Yang BM, Cho JH, Kim S, Kang J, et al. La proteasa dietética mejora el rendimiento del crecimiento, la digestibilidad de los nutrientes y la morfología intestinal de los cerdos destetados. J Anim Sci Technol. (2020) 62:21–30. doi: 10.5187/jast.2020.62.1.21
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Jeong YD, Ko HS, Hosseindoust A, Choi YH, Chae BJ Yu DJ, et al. Producto de fermentación a base de lactobacilos y nivel de lactosa en el alimento para cerdos destetados: efectos sobre la morfología intestinal, la microbiota, la emisión de gases y coliformes intestinales específicos. Livest Sci. (2019) 227:90–6. doi: 10.1016/j.livsci.2019.06.018
23. Berni Canani R, Sangwan N, Stefka AT, Nocerino R, Paparo L, Aitoro R, et al. La fórmula suplementada con Lactobacillus rhamnosus gg expande las cepas bacterianas productoras de butirato en bebés alérgicos a los alimentos. ISME J. (2016) 10:742–50. doi: 10.1038/ismej.2015.151
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Lagkouvardos I, Lesker TR, Hitch TCA, Gálvez EJC, Smit N, Neuhaus K, et al. El estudio de secuencia y cultivo de Muribaculaceae revela nuevas especies, preferencia de hospederos y potencial funcional de esta familia aún no descrita. Microbioma. (2019) 7:28. doi: 10.1186/s40168-019-0637-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Liu X, Mao B, Gu J, Wu J, Cui S, Wang G, et al. Blautia: ¿un nuevo género funcional con posibles propiedades probióticas? Microbios intestinales. (2021) 13:1–21. doi: 10.1080/19490976.2021.1875796
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Shetty SA, Zuffa S, Bui TPN, Aalvink S, Smidt H, De Vos WM. Reclasificación de Eubacterium hallii como Anaerobutyricum hallii gen.nov, comb nov, y descripción de Anaerobutyricum soehngenii sp nov, una bacteria productora de butirato y propionato a partir de heces infantiles. Int J Syst Evol Microbiol. (2018) 68:3741–6. doi: 10.1099/ijsem.0.003041
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Yuan Y, Zhou J, Zheng Y, Xu Z, Li Y, Zhou S, et al. Efectos beneficiosos de los extractos ricos en polisacáridos de hojas de Apocynum venetum sobre la microbiota hipoglucémica e intestinal en ratones diabéticos tipo 2. Farmacia Biomédica. (2020) 127:110182. doi: 10.1016/j.biopha.2020.110182
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Engels C, Ruscheweyh HJ, Beerenwinkel N, Lacroix C, Schwab C. El microbio intestinal común Eubacterium hallii también contribuye a la formación de propionato intestinal. Microbiol frontal. (2016) 7:713. doi: 10.3389/fmicb.2016.00713
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Ueki A, Ohtaki Y, Kaku N, Ueki K. Descripciones de Anaerotaenia torta gen. nov, sp nov y Anaerocolumna cellulosilytica gen nov, sp nov aisladas de un reactor metanogénico de desechos de ganado y reclasificación de Clostridium aminovalericum, Clostridium jejuense y Clostridium xylanovorans como especies de Anaerocolumna. Int J Syst Evol Microbiol. (2016) 66:2936–43. doi: 10.1099/ijsem.0.001123
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Forslund K, Hildebrand F, Nielsen T, Falony G, Le Chatelier E, Sunagawa S, et al. Desenredar las firmas del tratamiento de la diabetes tipo 2 y la metformina en la microbiota intestinal humana. Naturaleza. (2015) 528:262–6. doi: 10.1038/nature15766
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Wang J, Li Y, Cao C, Yang R, He M, Yan J, et al. Modificaciones de la microbiota intestinal periparturienta en cerdas Shaziling en relación con los ácidos biliares. Metabolitos. (2023) 13:68. doi: 10.3390/metabo13010068
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Alauzet C, Aujoulat F, Lozniewski A, Ben Brahim S, Domenjod C, Enault C, et al. Una nueva mirada al género Solobacterium: un análisis retrospectivo de veintisiete casos de infección por S. moorei y una revisión de las bases de datos de secuencias y de la literatura. Microorganismos. (2021) 9:1229. doi: 10.3390/microorganismos9061229
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Petzoldt D, Breves G, Rautenschlein S, Taras D. Harryflintia acetispora gen. nov, sp nov, aislado de ciego de pollo. Int J Syst Evol Microbiol. (2016) 66:4099–104. doi: 10.1099/ijsem.0.001317
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Lawhon SD, Maurer R, Suyemoto M, Altier C. Los ácidos grasos intestinales de cadena corta alteran la expresión génica y la virulencia de la invasión de Salmonella Typhimurium a través de bara/sira. Mol Microbiol. (2002) 46:1451–64. doi: 10.1046/j.1365-2958.2002.03268.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Smith AD, Chen C, Cheung L, Ward R, Hintze KJ, Dawson HD. El almidón de patata resistente altera el microbioma cecal y la expresión génica en ratones alimentados con una dieta occidental basada en datos de NHANES. Nutr delantero. (2022) 9:782667. doi: 10.3389/fnut.2022.782667
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Fornefett J, Busch A, Döpping S, Hotzel H, Rimek D. Gastroenteritis bacteriana causada por el patógeno zoonótico putativo Campylobacter lanienae: primer caso notificado en Alemania. Accede a Microbiol. (2021) 3:000199. doi: 10.1099/acmi.0.000199
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Bronner DN, Faber F, Olsan EE, Byndloss MX, Sayed NA, Xu G, et al. La ablación genética de la utilización de butirato atenúa la enfermedad gastrointestinal por Salmonella. Microbio huésped celular. (2018) 23:266–73. doi: 10.1016/j.chom.2018.01.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Rivera-Chávez F, Zhang L, Faber F, López CA, Byndloss MX, Olsan EE, et al. El agotamiento de los clostridios productores de butirato de la microbiota intestinal impulsa una expansión luminal aeróbica de la Salmonella. Microbio huésped celular. (2016) 19:443–54. doi: 10.1016/j.chom.2016.03.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Vaishnava S, Yamamoto M, Severson KM, Ruhn KA Yu X, Koren O, et al. La lectina antibacteriana RegIIIgamma promueve la segregación espacial de la microbiota y el huésped en el intestino. Ciencia. (2011) 334:255–8. doi: 10.1126/science.1209791
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Fournout S, Dozois CM, Yerle M, Pinton P, Fairbrother JM, Oswald E, et al. Clonación, localización cromosómica y expresión tisular del gen de la interleucina-18 porcina. Inmunogenética. (2000) 51:358–65. doi: 10.1007/s002510050630
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Müller AA, Dolowschiak T, Sellin ME, Felmy B, Verbree C, Gadient S, et al. Una respuesta de perforina de células NK provocada a través de IL-18 controla la cinética de inflamación de la mucosa durante la infección intestinal por Salmonella. PLoS Pathog. (2016) 12:e1005723. doi: 10.1371/journal.ppat.1005723
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Nowarski R, Jackson R, Gagliani N, de Zoete MR, Palm NW, Bailis W, et al. El equilibrio epitelial de IL-18 controla la función de barrera en la colitis. Celda. (2015) 163:1444–56. doi: 10.1016/j.cell.2015.10.072
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Bellido-Carreras N, Argüello H, Zaldívar-López S, Jiménez-Marín Á, Martins RP, Arce C, et al. Infección por Salmonella Typhimurium a lo largo del tracto gastrointestinal porcino y tejidos linfoides asociados. Veterinario Pathol. (2019) 56:681–90. doi: 10.1177/0300985819843682
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Collado-Romero M, Aguilar C, Arce C, Lucena C, Codrea MC, Morera L, et al. La proteómica cuantitativa y el análisis bioinformático proporcionan nuevos conocimientos sobre la respuesta dinámica del intestino porcino a Salmonella Typhimurium. Las células frontales infectan el microbiol. (2015) 5:64. doi: 10.3389/fcimb.2015.00064
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Liu X, Zhou Z, Cheng Q, Wang H, Cao H, Xu Q, et al. Aceleración de la tumorigénesis pancreática bajo microambiente inmunosupresor inducida por sobreexpresión de Reg3g. Muerte celular Dis. (2017) 8:E3033. doi: 10.1038/cddis.2017.424
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: diarrea, microbioma, fécula cruda de patata, almidón resistente, Salmonella Typhimurium, cerdo destetado, citoquina, transcriptoma
Cita: Yi S-W, Lee HG, Kim E, Jung Y-H, Bok E-Y, Cho A, Do YJ, Hur T-Y y Oh S-I (2023) El suplemento dietético de almidón de patata cruda en cerdos destetados podría reducir la infección por Salmonella Typhimurium al alterar la composición del microbioma y mejorar el estado inmunológico. Frente. Vet. Sci. 10:1183400. doi: 10.3389/fvets.2023.1183400
Recibido: 10 de marzo de 2023; Aceptado: 02 de mayo de 2023;
Publicado: 23 mayo 2023.
Editado por:
Balamuralikrishnan Balasubramanian, Universidad de Sejong, República de Corea
Revisado por:
Muhammad Akbar Shahid, Universidad Bahauddin Zakariya, Pakistán
Guiyan Yang, Universidad de California, Davis, Estados Unidos
Derechos de autor © 2023 Yi, Lee, Kim, Jung, Bok, Cho, Do, Hur y Oh. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Sang-Ik: Oh, sioh@jbnu.ac.kr
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía