Enfermedad del tracto respiratorio superior en pacientes pediátricos felinos
Introducción
La enfermedad del tracto respiratorio superior felino de origen infeccioso tiene amplia distribución y es una causa importante de morbilidad y mortalidad en gatitos y, en especial, en aquellos que viven en condiciones de hacinamiento o estrés.1 Los signos clínicos de esta enfermedad son de gravedad variable e incluyen letargia, inapetencia, estornudos, hiperemia conjuntival, secreción ocular y/o nasal serosa o mucopurulenta, hipersalivación y, en algunos casos, aflicción respiratoria causada por bronconeumonía y muerte.
En los gatitos, múltiples patógenos pueden causar la enfermedad del tracto respiratorio superior. Si viven en condiciones de hacinamiento, las coinfecciones son comunes y contribuyen a agravar la enfermedad. Los patógenos con mayor prevalencia en todo el mundo son el herpesvirus felino de tipo 1 (HVF-1) y el calicivirus felino (CVF). Las secreciones mucopurulen- tas, en los gatos infectados por estos virus, son el resultado de infecciones secundarias por parte de bacterias oportunistas, como Streptococcus spp., Staphylococcus spp., Pasteurella multocida y Escherichia coli. Las causas bacterianas primarias de la enfermedad del tracto respiratorio superior felino incluyen Bordetella bronchiseptica, Chlamydia felis, Mycoplasma spp. Streptococcus canis y Streptococcus equi subspp. zooepidemicus tienen un papel ocasional como patógenos primarios en refugios y aglomeraciones de gatos.
Este artículo ofrece una revisión de las principales causas de la enfermedad del tracto respiratorio superior en gatitos y una actualización sobre las estrategias para su tratamiento y prevención.
Infección por herpesvirus
felino de tipo 1

Probablemente, la mayoría de los gatos son expuestos al HVF-1 durante su vida. El virus sobrevive menos de 1 día a temperatura ambiental y es fácilmente inactivado por la mayoría de los desinfectantes. Debido a esto, la transmisión ocurre sobre todo a través del contacto directo, aunque los fómites son, probablemente, una forma importante de transmisión en los ámbitos superpoblados. El HVF-1 ha sido detectado, por medio de cultivos, en el 0-39% de los gatos con enfermedad del tracto respiratorio superior, aunque cuando se usó la determinación más sensible por PCR tuvo una prevalencia cercana al 100% en algunos grupos de gatos con enfermedad respiratoria aguda.2 La prevalencia de la eliminación viral en gatos aparentemente sanos varía entre 0 y 10% y, más a menudo, es inferior al 2%.1,3-9 Después de la recuperación, casi todos los gatitos infectados desarrollan infección latente, principalmente en el ganglio trigémino. La eliminación del virus, con signos clínicos concurrentes de enfermedad del tracto res- piratorio superior o sin ellos, se reactiva en menos de la mitad de los gatos con infección latente, 4-12 días después de una situación estresante.10 Se piensa que, en las gatas, la reactivación de la eliminación viral durante la lactancia es un importante factor contribuyente de nuevas infecciones en gatitos.
En los gatitos con infección por HVF-1, los signos clínicos son de gravedad variable e incluyen desde estornudos y conjuntivitis intermitentes hasta grave bronconeumonía y muerte. Aunque el HVF-1 prefiere replicarse en las temperaturas más bajas del tracto respiratorio superior, es más probable que las infecciones sistémicas con viremia ocurran en los neonatos. El daño del epitelio respiratorio superior puede ser seguido por osteólisis de los cornetes nasales y desarrollo de sinusitis y rinitis persistentes o recurrentes.
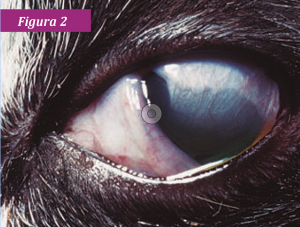
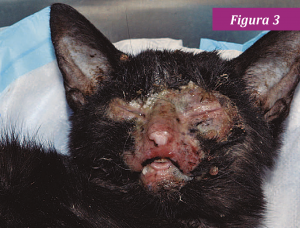
En los gatitos con anquilobléfaron fisiológico (adherencia de los bordes ciliares de los párpados), la infección ocular puede conducir al acúmulo de pus en el saco conjuntival (conjuntivitis neonatorum) (fig. 1). El simbléfaron (adherencia de la conjuntiva a la córnea) también puede ocurrir y producir ceguera (fig. 2). La replicación del HVF-1 en las células epiteliales corneales11 puede ser seguida, en algunos animales, por ulceración corneal dendrítica o geográfica y queratitis. En ocasiones, la infección por HVF-1 se asocia con una grave dermatitis facial ulcerativa y eosinofílica (fig. 3).
Infección por calicivirus
Al igual que el HVF-1, el CVF es una causa frecuente de enfermedad del tracto respiratorio superior felino (la infección causada por este virus representa entre el 10 y más del 50% de los casos). Genéticamente, los calicivirus aislados en todo el mundo corresponden a un grupo único, pero con alta diversidad. Los gatos infectados pueden desarrollar infección persistente en los tejidos orofaríngeos (más de 1 mes de duración) con eliminación viral, en ausencia de signos clínicos obvios. Estos animales son una importante fuente de infección para otros gatos. En muchos casos, la eliminación viral termina semanas o meses después de la infección, pero en unos pocos animales continúa durante toda la vida. Un solo gato puede estar infectado con muchas variantes del CVF al mismo tiempo, cada una derivada de la cepa infectante original como resultado de mutación genética, deriva genética y presión de selección.12 Debido a este estado de portador, en algunas poblaciones, uno de cada cinco gatos sanos puede eliminar CVF.7 Este virus sobrevive en el ambiente hasta 28 días y es resistente a los desinfectantes de rutina compuestos por derivados de amonio cuaternario.13 Como consecuencia de esto, los fómites son una importante forma de transmisión.
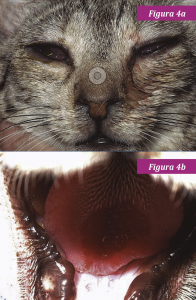
Los signos clínicos de la infección por CVF son muy variables. La glositis ulcerativa y la ulceración del plano nasal, la conjuntiva y la piel sugieren la presencia de esta enfermedad, pero no todos los gatos infectados tienen compromiso de la cavidad oral; por ejemplo, algunos sólo presentan secreción ocular y/o nasal (fig. 4).
La infección persistente con CVF también se ha asociado con estomatitislinfoplasmo cítica y ulceroproliferativa crónica, que involucra la mucosa lateral de los arcos palatoglosos (estomatitis caudal), la mucosa alveolar de las áreas premolar y molar y, algunas veces, la mucosa bucal (mucositis alveolar/bucal), aunque esto se describe con mayor frecuencia en gatos adultos jóvenes que en gatitos.14-16
En Estados Unidos y Europa, se han aislado cepas de CVF de alta virulencia durante brotes de una enfermedad febril sistémica grave en gatos, que se conoce como enfermedad sistémica virulenta.17-22 Sus signos clínicos incluyen anorexia, fiebre (a menudo, temperatura corporal de 40,6 °C), pérdida de peso, ulceración de la boca y las almohadillas digitales y secreción ocular y/o nasal. Las cepas que causan la enfermedad sistémica virulenta infectan no sólo las células epiteliales del tracto respiratorio superior y la cavidad oral, sino también las células endoteliales, los hepatocitos, los neumonocitos y las células acinares pancreáticas.23 Los signos clínicos diferenciales de la enfermedad sistémica virulenta son edema cutáneo, alopecia, formación de costras y ulceración. El edema ocurre con mayor frecuencia en la cabeza y los miembros, pero también puede tener una distribución generalizada; la presentación de costras y úlceras es más prominente sobre la nariz, en labios, en pabellones auriculares, alrededor de los ojos y en la porción distal de los miembros. Algunos gatos desarrollan aflicción respiratoria grave, en ocasiones, causada por edema pulmonar o efusión pleural.
El compromiso del tracto gastrointestinal, el hígado y el páncreas puede asociarse con vómitos, ictericia y/o diarrea. También pueden presentarse tendencias hemorrágicas, resultantes de la vasculitis y la coagulación intravascular diseminada, que se manifiestan como petequias o equimosis y, rara vez, epistaxis y hematoquecia. Los gatos con infecciones peragudas pueden morir sin evidenciar otros signos, más allá de la fiebre. En muchos brotes, gatos de refugio hospitalizados han sido la fuente de infección y la cepa de CVF involucrada fue diferente, aunque una investigación reciente ha identificado sustituciones de aminoácidos comunes en el gen de las proteínas de la cápside, que permitirían diferenciar las cepas que causan la enfermedad sistémica virulenta de aquellas menos patogénicas.24 Los gatos adultos vacunados y saludables son los afectados con mayor gravedad por la enfermedad sistémica virulenta, pero ésta también ha sido descrita en gatitos. Por lo general, los brotes se resuelven en unos 2 meses, una vez instituidas las medidas de control apropiadas.
Clamidiosis
Las clamidias son bacterias intracelulares obligadas que causan, principalmente, una conjuntivitis folicular aguda, crónica o recurrente en gatos adultos jóvenes. La especie que más afecta a los gatos es Chlamydia felis; sin embargo, en Europa, recientemente se ha detectado ADN similar al del patógeno humano Chlamydia pneumoniae en hisopados oculares de gatos con conjuntivitis.25
En los gatos con clamidiosis, los hallazgos del examen físico incluyen conjuntivitis, quemosis, secreción ocular serosa o mucopurulenta y blefaroespasmo. Los signos de compromiso respiratorio, como estertores, secre- ción nasal serosa o mucopurulenta y estornudos, pueden acompañar a la conjuntivitis. Las clamidias también podrían tener un papel en otros trastornos sistémicos y reproductivos felinos, que permanecen mal caracterizados.
La infección por C. felis es detectada con mayor frecuencia en gatos de 2-12 meses de edad. Los gatitos menores de 2 meses podrían ser protegidos por los anticuerpos maternos, aunque se han descrito infecciones neonatales. Los cuerpos elementales clamidiales (forma infecciosa del organismo) sobreviven sólo unos pocos días a temperatura ambiental y son fácilmente inactivados por la mayoría de los desinfectantes, por lo que la transmisión ocurre principalmente por contacto directo. Como resultado de esto, las infecciones por C. felis son identificadas con mayor frecuencia en lugares que alojan a múltiples gatos y, en especial, en criaderos. En gatos de 218 refugios de rescate, establecimientos de reproducción y casas privadas de Europa, la higiene subóptima fue un factor de riesgo para la infección. El ADN de C. felis no suele ser detectado en los hisopados conjuntivales de gatos sanos.26 Las coinfecciones causadas por otros patógenos respiratorios, como HVF-1 y CVF, son comunes y pueden contribuir a agravar los signos clínicos.
Bordetelosis
Bordetella spp. es un cocobacilo gramnegativo pequeño y pleomórfico. La única especie de este género conocida como causa de enfermedad en perros y gatos es B. bronchiseptica, pero hay una gran cantidad de cepas de este microorganismo que varían en su virulencia y su especificidad por determinados huéspedes. Mediante tipicación molecular se ha comprobado que las cepas que infectan a los perros pueden pasar a los gatos y viceversa.27-29 Al igual que las infecciones respiratorias virales, la bordetelosis tiene especial prevalencia en gatos de algunos refugios, tiendas de mascotas y lugares de embarque, donde un gran número de animales potencialmente estresados pueden estar en íntimo contacto. Es usual que la infección por B. bronchiseptica sea concurrente con infección viral respiratoria y/o infección por Mycoplasma spp. B. bronchiseptica puede persistir en el ambiente durante, al menos, 10 días y es capaz de desarrollarse en fuentes naturales de agua,30 pero es susceptible a la mayoría de los desinfectantes, siempre que se los use de forma correcta. B. bronchiseptica puede ser aislada de gatos aparentemente sanos, pero en esta especie se ha asociado claramente con enfermedad respiratoria. En un gran estudio realizado en Europa con 1748 gatos de refugios, criaderos y hogares privados, la posibilidad de detección de B. bronchiseptica fue directamente proporcional al número de gatos alojados. En instituciones de rescate, el aumento de la seroprevalencia se asoció con mala higiene.1
La gravedad de los signos clínicos de la bordetelosis difiere considerablemente y puede reflejar factores tales como cepa bacteriana, inmunidad del huésped y coinfecciones. Los gatos pueden presentar estornudos y secreción ocular y nasal mucopurulenta, pero no suelen tener tos.31 Los gatitos jóvenes tienen más probabilidades que los adultos de manifestar signos clínicos y pueden desarrollar una bronco neumonía grave y potencialmente letal, así como taquipnea, cianosis y muerte.
Micoplasmosis
Mycoplasma spp. es una bacteria fastidiosa, que carece de pared celular y se encuentra en las membranas mucosas de todas las especies mamíferas. El espectro de micoplasmas que infectan a perros y gatos no se conoce por completo, ya que ha sido difícil la precisa identificación de las especies. Debido a que los micoplasmas son comúnmente aislados del tracto respiratorio superior de gatos sanos, ha sido un desafío determinar su papel en la enfermedad del tracto respiratorio superior felino. Los factores de estrés, como hacinamiento, la infección respiratoria viral concurrente y la falta de higiene, también podrían promover la proliferación y la transmisión de micoplasmas. Varios estudios han encontrado un aumento de la prevalencia de esta bacteria en gatos con conjuntivitis o enfermedad del tracto respiratorio superior, cuando se los comparó con gatos sanos.26,32,33 Algunas especies de Mycoplasma (como M. felis) tienen más probabilidades de ser causa de enfermedad que otras. Los signos clínicos incluyen secreción nasal y estornudos, secreción ocular serosa o mucopurulenta, hiperemia conjuntival y, posiblemente, queratitis.
Estreptococosis
Las bacterias del género Streptococcus son cocos grampositivos, que se dividen a lo largo de un único eje, formando pares y cadenas de microorganismos. A menudo, los estreptotocos invaden tejidos de forma oportunista cuando se produce una brecha en las barreras normales del huésped. Los estreptococos que infectan a los gatos varían desde comensales de baja virulencia hasta microorganismos de alta virulencia capaces de causar enfermedad grave y muerte. Cuando son transmitidos desde el tracto vaginal durante el parto, pueden causar bacteriemia y sepsis neonatales. También pueden acceder a la circulación sistémica a través de la vena umbilical. Los gatos jóvenes pueden desarrollar rinosinusitis purulenta y neumonía en asociación con infecciones causadas por otros patógenos respiratorios. Se han producido brotes de neumonía, rinosinusitis purulenta y meningoencefalitis causados por S. canis y S. equi subspp. zooepidemicus en gatos alojados en refugios.34-37 Como resultado de esto, Streptococcus spp. no siempre debe ser descartado como invasor secundario cuando es aislado durante brotes de enfermedad del tracto respiratorio superior. El aislamiento del mismo microorganismo de múltiples gatos afectados de una comunidad o un refugio puede agregar evidencia para establecer su papel primario como causa de enfermedad.
Diagnóstico
En los gatitos, no es fácil distinguir la causa de la enfermedad respiratoria basándose sólo en los signos clínicos, debido a que todos los patógenos producen un espectro similar de manifestaciones. Aunque la presencia de ulceración corneal es compatible con infección por HVF-1 y la glositis ulcerativa es más habitual con infección por CVF, las infecciones respiratorias mixtas con virus y bacterias son de presentación común en los ámbitos caracterizados por el hacinamiento y complican el diagnóstico. Dadas la naturaleza ampliamente diseminada de la enfermedad en los gatitos y la habitual resolución de los signos clínicos leves o moderados sin tratamiento, sólo se llevan a cabo pruebas diagnósticas específicas para identificar patógenos del tracto respiratorio superior cuando los signos clínicos son graves (por ej., cuando incluyen neumonía) o persistentes (más de 7-10 días) o cuando hay afectados múltiples animales en un lugar y se requiere información para guiar el tratamiento y establecer estrategias de control. Las pruebas disponibles para el diagnóstico de las infecciones del tracto respiratorio superior incluyen cultivo bacteriano (para Streptococcus spp. y Bordetella spp.) y PCR (para todos los patógenos mencionados en este artículo). Los cultivos celulares de virus (aislamiento) y clamidias son ofrecidos por algunos laboratorios (por ej., Animal Health Diagnostic Center de la Universidad de Cornell) y tienen la posibilidad de identificar nuevos patógenos respiratorios o establecer un diagnóstico cuando la PCR es negativa. Esta prueba debería considerarse cuando ocurren brotes con signos clínicos atípicos, como aquellos asociados con alta tasa de mortalidad de gatitos. La serología ha sido usada para investigar la causa de brotes que involucraban cepas hipervirulentas de CVF.
Tanto los resultados positivos como los negativos de las pruebas diagnósticas destinadas a identificar patógenos del tracto respiratorio superior felino deben ser interpretados con cautela por los motivos expuestos en la tabla 1. Los paneles para PCR que pueden detectar múltiples patógenos respiratorios pueden ser útiles para evaluar hisopados orofaríngeos o conjuntivales de gatos enfermos y sanos residentes en un mismo lugar, con el propósito de comprender el rango de patógenos presentes y su asociación con la enfermedad; la prueba también debería realizarse en gatos individuales cuando se está considerando el tratamiento con drogas antivirales especí cas. Los anestésicos tópicos y la fluoresceína, al parecer, disminuyeron la sensibilidad de la PCR en personas con infecciones por herpesvirus, por lo que deberían evitarse si va a obtener un hisopado conjuntival.38 Al tomar las muestras de cada gato, hay que usar guantes de examinación limpios y el hisopo sólo debe tocar el sitio anatómico a evaluar.

Los gatitos con signos de enfermedad del tracto respiratorio superior deben ser examinados por un patólogo veterinario tan pronto como sea posible después de la muerte o la eutanasia. La necropsia puede permitir la identificación de inclusiones virales en los tejidos respiratorios. Pueden efectuarse tinciones inmunohistoquímicas, PCR, cultivos bacterianos o cultivos celulares para aumentar la sensibilidad de la detección de patógenos respiratorios en los tejidos obtenidos durante la necropsia (fig. 5). La PCR y los cultivos celulares pueden tener la sensibilidad óptima para la identificación de una infección viral cuando obtener un diagnóstico es de vital importancia.
Tratamiento
En los neonatos felinos abandonados y alojados en refugios, las infecciones agudas leves o moderadas son muchas y, en gran parte, se resuelven con el tiempo sin la necesidad de tratamiento antimicrobiano. Los gatitos con enfermedad del tracto respiratorio superior moderada o grave, que presentan secreción mucopurulenta, pueden requerir cuidados de sostén consistentes en fluidoterapia, antibioticoterapia para la infección bacteriana secundaria y nutrición enteral por medio de sondas de alimentación temporarias. Debido a su actividad contra Bordetella spp. y Mycoplasma spp., se recomienda la administración de doxiciclina (10 mg/kg por vía oral cada 24 horas o 5 mg/kg por vía oral cada 12 horas) cuando el tratamiento antimicrobiano parece ser necesario. Si se sospecha o confirma una clamidiosis, se recomienda extender el tratamiento durante 4 semanas y tratar a todos los gatos que viven en el mismo lugar. La amoxicilina (12-20 mg/kg cada 12 horas) es una segunda opción razonable para el tratamiento de las infecciones bacterianas secundarias en los gatos con enfermedad del tracto respiratorio superior, pero no tiene actividad contra los micoplasmas. La hospitalización y el tratamiento con líquidos parenterales, antimicrobianos, nebulización y suplementación de oxígeno pueden ser necesarios para los gatitos que desarrollan enfermedad grave del tracto respiratorio superior y bronconeumonía. Por lo general, la enfermedad aguda del tracto respiratorio superior se resuelve al cabo de 2-3 semanas con cuidados de sostén, pero algunos gatos sufren frecuentes recidivas y complicaciones crónicas, como secreción nasal recurrente o persistente y queratitis.
El uso de drogas antivirales debe ser considerado en los gatitos con manifestaciones graves o persistentes de infección por HVF-1 (por ej., queratitis, conjuntivitis grave y dermatitis facial ulcerativa). El famciclovir (40-90 mg/kg por vía oral cada 8 horas) es la droga antiviral más potente y segura y ha sido bien tolerada cuando se administró por vía oral a gatitos.39 El tratamiento con este agente produjo una significativa mejoría clínica en gatos con enfermedad por herpesvirus tanto aguda como crónica y disminuyó la eliminación viral.40,41 Se han utilizado preparaciones oftálmicas tópicas que contienen idoxuridina, trifluridina, vidarabina y, en menor extensión, aciclovir para el tratamiento de la queratitis herpética, aunque su verdadera eficacia no ha sido extensamente estudiada. Estos fármacos requieren una frecuente aplicación tópica (5-6 veces por día) y su uso prolongado puede causar irritación o ulceración corneal. El cidofovir es una prometedora opción para tratamiento tópico (solución al 0,5% en forma de lágrimas artificiales; se administra 2 veces por día) con probada actividad contra el HVF-1 in vitro y en gatos infectados experimentalmente.42 Hay varias revisiones recientes que el lector puede consultar para obtener más información sobre las drogas antivirales sistémicas y tópicas para gatos con infección por HVF-1.39,43,44 Debido a que se han descrito cepas de HVF-1 resistentes, las drogas como el famciclovir sólo deberían usarse si el gato presenta signos graves compatibles con infección causada por este virus y, preferiblemente, si el diagnóstico ha sido confirmado mediante pruebas moleculares.
El interferón-α recombinante humano y el interferón-ω recombinante felino, los cuales inhiben in vitro la replicación del HVF-1, han sido administrados por vía parenteral, tópica (para queratitis) y oral a gatos infectados por este virus. En general, no ha habido una respuesta clínica obvia y uniforme al tratamiento y se carece de ensayos clínicos controlados que hayan evaluado estos agentes en un gran número de gatos. Por su parte, el aminoácido lisina ha sido eficaz en gatos con conjuntivitis herpesviral cuando se administró en foma de tabletas45 y redujo la reactivación de la eliminación viral en gatos con infección latente.46 Sin embargo, los beneficios de la lisina han sido recientemente cuestionados por su aparente inactividad en estudios in vitro y su falta de eficacia cuando fue administrada a gatos de refugios.47 Por último, en la actualidad, se está evaluando la efectividad de una vacuna intranasal (como agente inmunoterapéutico) en gatos con enfermedad del tracto respiratorio superior, con algunos resultados preliminares prometedores.48
Prevención
La prevención de la enfermedad del tracto respiratorio superior en gatitos de criaderos o refugios se basa en la minimización del estrés y el hacinamiento, la desinfección, la cuarentena y la vacunación. Durante los últimos 5 años, se ha vuelto más evidente que las medidas para reducir el estrés y el hacinamiento tienen un impacto significativo en la reducción de la incidencia de esta enfermedad49 y podrían ser más importantes que la cuarentena. Los gatos deben ser alojados de manera individual, lejos de perros que ladran, y deben disponer de un lugar para refugiarse o esconderse. El lector puede consultar otros textos para obtener más información sobre la reducción del estrés en los refugios. Las barreras entre gatos deben ser impermeables y los animales deben estar separados al menos por 1,2-1,5 m para evitar la transmisión por aerosoles. La desinfección debe efectuarse con productos activos contra el CVF, como peroximonosulfato de potasio (Trifectant, Virkon S), hipoclorito de sodio (lavandina) diluido en una solución detergente a razón de 1:32, o solución de peróxido de hidrógeno con acelerador. Son indispensables un apropiado tiempo de contacto y un lavado de manos completo.
Desde hace varias décadas, se encuentran disponibles vacunas contra el HVF-1 y el CVF, pero no brindan una completa protección y la enfermedad sigue teniendo una amplia distribución en la población felina. El desarrollo de infecciones en gatitos, antes de completar la serie primaria de vacunas, empeora la situación. Sin embargo, cuando las infecciones neonatales son un problema en los criaderos, la vacunación de la madre antes del apareamiento es preferible a la vacunación durante la preñez y puede servir para prolongar la persistencia de los anticuerpos maternos.50 La vacunación de los gatitos a partir de las 4 semanas de edad podría ser considerada en las gaterías que tienen una alta tasa de enfermedad del tracto respiratorio superior de origen viral. La serie primaria de vacunas se aplica cada 3-4 semanas a partir de las 16-20 semanas de vida.51 Ninguna de estas vacunas previene la infección, el desarrollo del estado de portador ni la reactivación de la eliminación del HVF-1 en caso de estrés, pero ellas pueden reducir la gravedad de la enfermedad y la duración del lapso de eliminación del virus.10,52,53 Cuando en los criaderos fallan otras medidas de control, pueden considerarse el destete temprano y el aislamiento de los gatitos a partir de las 4 semanas de edad.
Referencias
Helps CR, Lait P, Damhuis A, et al. Factors associated with upper respiratory tract disease caused by feline herpesvirus, feline calicivirus, Chlamydophila felis and Bordetella bronchiseptica in cats: experience from 218 European catteries. Vet Rec 2005;156:669–73.
Veir JK, Ruch-Gallie R, Spindel ME, et al. Prevalence of selected infectious organisms and comparison of two anatomic sampling sites in shelter cats with upper respira- tory tract disease. J Feline Med Surg 2008;10:551–7.
Bech-Nielsen S, Fulton RW, Cox HU, et al. Feline respiratory tract disease in Louisiana. Am J Vet Res 1980;41:1293–8.
Ellis TM. Feline respiratory virus carriers in clinically healthy cats. Aust Vet J 1981;57:115–8.
Harbour DA, Howard PE, Gaskell RM. Isolation of feline calicivirus and feline herpesvirus from domestic cats 1980 to 1989. Vet Rec 1991;128:77–80.
Shewen PE, Povey RC, Wilson MR. A survey of the conjunctival ora of clinically normal cats and cats with conjunctivitis. Can Vet J 1980;21:231–3.
Wardley RC, Gaskell RM, Povey RC. Feline respiratory viruses: their prevalence in clinically healthy cats. J Small Anim Pract 1974;15:579–86.
Coutts AJ, Dawson S, Willoughby K, et al. Isolation of feline respiratory viruses from clinically healthy cats at UK cat shows. Vet Rec 1994;135:555–6.
Ruch-Gallie RA, Veir JK, Hawley JR, et al. Results of molecular diagnostic assays targeting feline herpesvirus-1 and feline calicivirus in adult cats administered modi ed live vaccines. J Feline Med Surg 2011;13:541–5.
Gaskell R, Dawson S, Radford A, et al. Feline herpesvirus. Vet Res 2007;38: 337–54.
Nasisse MP, Guy JS, Davidson MG, et al. Experimental ocular herpesvirus infection in the cat. Sites of virus replication, clinical features and effects of corticosteroid administration. Invest Ophthalmol Vis Sci 1989;30:1758–68.
Radford AD, Turner PC, Bennett M, et al. Quasispecies evolution of a hypervariable region of the feline calicivirus capsid gene in cell culture and in persistently infected cats. J Gen Virol 1998;79(Pt 1):1–10.
Doultree JC, Druce JD, Birch CJ, et al. Inactivation of feline calicivirus, a Norwalk virus surrogate. J Hosp Infect 1999;41:51–7.
Belgard S, Truyen U, Thibault JC, et al. Relevance of feline calicivirus, feline immunodeficiency virus, feline leukemia virus, feline herpesvirus and Bartonella henselae in cats with chronic gingivostomatitis. Berl Munch Tierarztl Wochenschr 2010;123:369–76.
Dowers KL, Hawley JR, Brewer MM, et al. Association of Bartonella species, feline calicivirus, and feline herpesvirus 1 infection with gingivostomatitis in cats. J Feline Med Surg 2010;12:314–21.
Hennet PR, Camy GA, McGahie DM, et al. Comparative ef cacy of a recombinant feline interferon omega in refractory cases of caliciviruspositive cats with caudal stomatitis: a randomised, multicentre, controlled, doubleblind study in 39 cats. J Feline Med Surg 2011;13:577–87. 340 Sykes
Hurley KE, Pesavento PA, Pedersen NC, et al. An outbreak of virulent systemic feline calicivirus disease. J Am Vet Med Assoc 2004;224:241–9.
Pedersen NC, Elliott JB, Glasgow A, et al. An isolated epizootic of hemorrhagiclike fever in cats caused by a novel and highly virulent strain of feline calicivirus. Vet Microbiol 2000;73:281–300.
Reynolds BS, Poulet H, Pingret JL, et al. A nosocomial outbreak of feline calicivirus associated virulent systemic disease in France. J Feline Med Surg 2009; 11:633–44.
Schulz BS, Hartmann K, Unterer S, et al. Two outbreaks of virulent systemic feline calicivirus infection in cats in Germany. Berl Munch Tierarztl Wochenschr 2011;124:186–93.
Radford AD, Gaskell RM. Dealing with a potential case of FCV-associated virulent systemic disease. Vet Rec 2011;168:585–6.
Coyne KP, Jones BR, Kipar A, et al. Lethal outbreak of disease associated with feline calicivirus infection in cats. Vet Rec 2006;158:544–50.
Pesavento PA, Stokol T, Liu H, et al. Distribution of the feline calicivirus receptor junctional adhesion molecule a in feline tissues. Vet Pathol 2011;48:361–8.
Poulet H. Virulent systemic calicivirus strains: what makes them so special? In: ISCAID-Merial ECVIM Pre-congress Symposium. Liverpool (United Kingdom), September 11, 2013. p. 33.
Sibitz C, Rudnay EC, Wabnegger L, et al. Detection of Chlamydophila pneumoniae in cats with conjunctivitis. Vet Ophthalmol 2011;14(Suppl 1):67–74.
Low HC, Powell CC, Veir JK, et al. Prevalence of feline herpesvirus 1, Chlamydophila felis, and Mycoplasma spp DNA in conjunctival cells collected from cats with and without conjunctivitis. Am J Vet Res 2007;68:643–8.
Binns SH, Speakman AJ, Dawson S, et al. The use of pulsedeld gel electrophoresis to examine the epidemiology of Bordetella bronchiseptica isolated from cats and other species. Epidemiol Infect 1998;120:201–8.
Dawson S, Jones D, McCracken CM, et al. Bordetella bronchiseptica infection in cats following contact with infected dogs. Vet Rec 2000;146:46–8.
Foley JE, Rand C, Bannasch MJ, et al. Molecular epidemiology of feline bordetellosis in two animal shelters in California, USA. Prev Vet Med 2002;54: 141–56.
Kirilenko NI. Survival of Bordetella pertussis in the air and on some objects. Zh Mikrobiol Epidemiol Immunobiol 1965;42:39–42 [in Russian].
Binns SH, Dawson S, Speakman AJ, et al. Prevalence and risk factors for feline Bordetella bronchiseptica infection. Vet Rec 1999;144:575–80.
Haesebrouck F, Devriese LA, van Rijssen B, et al. Incidence and significance of isolation of mycoplasma felis from conjunctival swabs of cats. Vet Microbiol 1991;26:95–101.
Holst BS, Hanas S, Berndtsson LT, et al. Infectious causes for feline upper respiratory tract disease: a case-control study. J Feline Med Surg 2010;12: 783–9.
Tillman PC, Dodson ND, Indiveri M. Group G streptococcal epizootic in a closed cat colony. J Clin Microbiol 1982;16:1057–60.
Britton AP, Davies JL. Rhinitis and meningitis in two shelter cats caused by Streptococcus equi subspecies zooepidemicus. J Comp Pathol 2010;143:70–4.
Blum S, Elad D, Zukin N, et al. Outbreak of Streptococcus equi subsp. zooepidemicus infections in cats. Vet Microbiol 2010;144:236–9.
Pesavento PA, Bannasch MJ, Ba- chmann R, et al. Fatal Streptococcus canis infections in intensively housed shelter cats. Vet Pathol 2007;44:218–21.
Goldschmidt P, Rostane H, Saint-Jean C, et al. Effects of topical anaesthetics and uorescein on the real-time PCR used for the diagnosis of herpesviruses and Acanthamoeba keratitis. Br J Ophthalmol 2006;90:1354–6.
Maggs DJ. Antiviral therapy for feline herpesvirus infections. Vet Clin North Am Small Anim Pract 2010;40:1055–62.
Malik R, Lessels NS, Webb S, et al. Treatment of feline herpesvirus-1 associated disease in cats with famciclovir and related drugs. J Feli- ne Med Surg 2009;11: 40–8.
Thomasy SM, Lim CC, Reilly CM, et al. Evaluation of orally administered famciclovir in cats experimentally infected with feline herpesvirus type-1. Am J Vet Res 2011;72:85–95.
Fontenelle JP, Powell CC, Veir JK, et al. Effect of topical ophthalmic application of cidofovir on experimentally induced primary ocular feline herpesvirus-1 infection in cats. Am J Vet Res 2008;69:289–93.
Maggs DJ. Ocular pharmacology and therapeutics. In: Maggs DJ, Miller PE, Ofri R, editors. Slatter’s fundamentals of veterinary ophthalmology. 5th edition. St Louis (MO): Elsevier; 2013.
Sykes JE. Antiviral and immunomodulatory drugs. In: Sykes JE, editor. Canine and feline infectious diseases. 1st edition. St Louis (MO): Elsevier; 2014. p. 54–65.
Stiles J, Townsend WM, Rogers QR, et al. Effect of oral administration of L-lysine on conjunctivitis caused by feline herpesvirus in cats. Am J Vet Res 2002;63: 99–103.
Maggs DJ, Nasisse MP, Kass PH. Ef cacy of oral supplementation with L-lysine in cats latently infected with feline herpesvirus. Am J Vet Res 2003;64:37–42.
Rees TM, Lubinski JL. Oral supple- mentation with L-lysine did not prevent upper respiratory infection in a shelter population of cats. J Feline Med Surg 2008;10: 510–3.
Bradley A, Kinyon J, Frana T, et al. Ef cacy of intranasal administration of a modified live feline herpesvirus 1 and feline calicivirus vaccine against disease caused by Bordetella bronchiseptica after experimental challenge. J Vet Intern Med 2012;26:1121–5.
Tanaka A, Wagner DC, Kass PH, et al. Associations among weight loss, stress, and upper respiratory tract infection in shelter cats. J Am Vet Med Assoc 2012; 240:570–6.
Radford AD, Addie D, Belak S, et al. Feline calicivirus infection. ABCD guidelines on prevention and management. J Feline Med Surg 2009;11:556–64.
Scherk MA, Ford RB, Gaskell RM, et al. 2013 AAFP feline vaccination advisory panel report. J Feline Med Surg 2013;15:785–808.
Sykes JE, Browning GF, Anderson G, et al. Differential sensitivity of culture and the polymerase chain reaction for detection of feline herpesvirus 1 in vaccinated and unvaccinated cats. Arch Virol 1997;142:65–74.
Sussman MD, Maes RK, Kruger JM. Vaccination of cats for feline rhinotracheitis results in a quantitative reduction of virulent feline herpesvirus-1 latency load after challenge. Virology 1997;228:379–82.
Jane E. Sykes*
* PhD. Departamento de Medicina y Epidemiología, Universidad de California, Davis (Estados Unidos). Trabajo publicado en la revista Selecciones Veterinarias.

