Enfermedad respiratoria bovina: causas, prevención y manejo, y estudio de caso

Enfermedad respiratoria bovina: causas, prevención y manejo, y estudio de caso
- Nina Gammage analiza una enfermedad desafiante y ubicua antes de ofrecer un estudio de caso para su análisis.
- Este artículo se publicó originalmente en Vet Times Livestock 6.3 (invierno de 2020).
La interacción ineludible entre los patógenos, el medio ambiente y los factores de la pantorrilla a menudo da lugar al desarrollo del desafiante y omnipresente complejo de enfermedad respiratoria bovina (BRDC).
El daño pulmonar primario, a menudo iniciado por virus respiratorios, promueve la infección bacteriana oportunista, lo que resulta en neumonía clínica. La mala salud pulmonar, a menudo basada en una vivienda inadecuada, predispone a la enfermedad y retrasa la recuperación.
Esto afecta negativamente al bienestar y tiene implicaciones financieras significativas a través de los costos inmediatos asociados con el brote, las reducciones continuas en las tasas de crecimiento y los episodios posteriores de la enfermedad. Las enfermedades respiratorias cuestan a la industria ganadera del Reino Unido unos 80 millones de libras esterlinas al año, desde 30 libras esterlinas en casos leves hasta 500 libras esterlinas si un animal muere (Scott, 2009). Estos costes continuos pueden tener un efecto en cadena en la capacidad de los agricultores para implementar estrategias para prevenir futuros brotes.
Al considerar los agentes infecciosos, los componentes no infecciosos y las medidas de control, se puede hacer un plan para reducir el riesgo de BRDC y minimizar el impacto en caso de que se produzcan brotes.
Patógenos primarios
La rinotraqueítis bovina infecciosa (IBR) está comúnmente implicada tanto en el BRDC como en el patógeno primario. Es causada por el virus del herpes bovino 1 (VHB-1), que persiste en la población a través de una fase latente que se cree que ocurre en el nervio trigémino (Andrews, 2004), lo que resulta en portadores clínicamente sanos que pueden dar negativo serológicamente, pero que eliminarán el virus de forma intermitente en períodos de estrés
Se desconoce la verdadera prevalencia del VHB-1 en el Reino Unido; sin embargo, en 1998 un estudio mostró que el 69 % de los 341 rebaños lecheros tenían anticuerpos BHV-1 presentes en la leche a granel ELISA (Paton et al, 1998). En los brotes, la morbilidad puede alcanzar hasta el 100 %, y la mortalidad se cita entre el 1 % y el 10 % (Nandi et al, 2009). Experimentalmente, se ha propuesto un período de incubación de entre 3 y 7 días, aunque en situaciones de brote de 10 a 20 días es más común (Andrews, 2004).
La infección sin complicaciones con parainfluenza-3 bovina (PI3), por el contrario, no suele producir una enfermedad grave. El PI3 es un virus de ARN y exclusivamente un patógeno respiratorio, que rara vez, si es que alguna vez, causa una infección sistémica. El ganado adulto, en particular, experimenta una infección asintomática a leve (Campbell, 2015), y el papel importante de PI3 es predisponer al ganado inmaduro a la infección por patógenos virales y bacterianos secundarios a través de dos vías primarias. El primero es a través del daño directo a los mecanismos de aclaramiento respiratorio y al parénquima pulmonar, que promueve el establecimiento de una infección en el parénquima comprometido a través de la transferencia de bacterias desde las vías respiratorias superiores. El segundo es que la respuesta del sistema inmunitario a la infección bacteriana se ve reducida por la infección viral (Czuprynski et al, 2004).
El virus sincitial respiratorio bovino (BRSV) es un virus de ARN que causa la enfermedad primaria a través de la formación de células sincitiales a través de su efecto citopático. Debido a su predilección por los pulmones, donde predispone a una infección bacteriana secundaria, el BRSV también es un componente principal del BRDC. Los anticuerpos derivados de la madre reducen la gravedad de la neumonía, pero no proporcionan una inmunidad sólida. Los brotes de BRSV se caracterizan por una alta morbilidad y una mortalidad de hasta el 20 % (Campbell, 2015).
Las principales vías de transmisión de estos patógenos primarios son por aerosoles y fómites contaminados con secreciones nasales (MacLachlan y Duboui, 2017), y estas representan áreas críticas para el control de BRDC. La aplicación temprana de estrictas medidas de bioseguridad puede contener un brote hasta un cobertizo y reducir profundamente la morbilidad. Es crucial garantizar que todo el personal agrícola esté involucrado y a bordo, ya que las medidas de bioseguridad solo son efectivas si son llevadas a cabo por todos los que entran o salen del cobertizo.
Ganadería
Si bien es universalmente aceptado que BRDC es un complejo infeccioso, los ensayos no han logrado replicar el cuadro clínico general a través de la exposición a virus o bacterias individuales (Jericho y Langford, 1978). Las especies bacterianas comúnmente implicadas también se cultivan fácilmente a partir de las vías respiratorias del ganado normal (Allen et al, 1992), lo que indica que la etiología del BRDC se basa en elementos de predisposición no infecciosos. La figura 1 muestra la naturaleza estacional del BRDC, y la mayoría de las infecciones ocurren dentro de un mes después de la vivienda. El estrés de albergar y mezclar ganado de diferentes edades en un espacio aéreo compartido es un precursor reconocido de la neumonía.
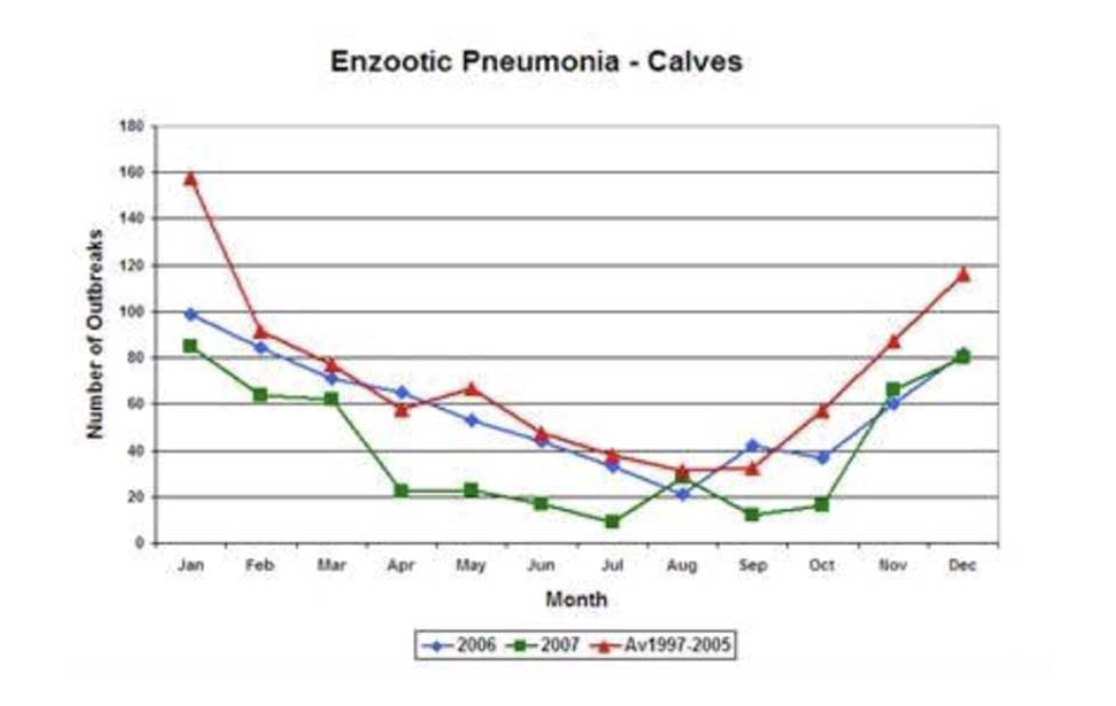
Los factores ambientales, como las tasas de ventilación y almacenamiento, desempeñan un papel importante en la salud pulmonar, y no se puede exagerar su importancia. En un escenario de brote, los cambios drásticos en el diseño de los edificios a menudo no son practicables de inmediato, pero el plan de salud del año siguiente debería considerar mejoras en la vivienda. Comprender el plan de negocios y los objetivos de una granja para los próximos cinco años puede guiar las discusiones sobre los desarrollos; por ejemplo, se puede planificar un nuevo cobertizo o sistema de ventilación. Sin embargo, ten en cuenta que, una vez considerados, estos cambios pueden no ser posibles.
El «MOT de neumonía» de la Junta de Desarrollo de Agricultura y Horticultura explica los cálculos para la ventilación y el almacenamiento en términos sencillos, y es un excelente punto de partida para las discusiones sobre el diseño y la planificación de cobertizos.
Se pueden tomar medidas prácticas para abordar el medio ambiente en caso inmediato de un brote. Estos incluyen:
- Evaluación del cobertizo. ¿Dónde se reúnen los terneros? ¿Están cómodamente espaciados o acurrucados junto a la puerta donde fluye el aire fresco? La condensación dentro del techo y las telarañas sobre las salidas son otros indicadores de mala ventilación.
- Evaluar la calidad del aire a la altura de la pantorrilla. ¿Puedes respirar cómodamente sin toser cuando te inclinas hasta la altura de la pantorrilla? Un fuerte olor a amoníaco se puede aliviar mejorando la ventilación (ver más adelante) o aumentando la frecuencia de la ropa de cama.
- Mejora del drenaje: haz la prueba de silenciamiento. ¿Puedes arrodillarte (sin impermeabilización) en la ropa de cama sin mojarte las rodillas? De lo contrario, se debe aumentar la cantidad de ropa de cama.
- Mejorar la ventilación. Si el embarque de Yorkshire está presente, retire cada segundo tablero o abra las puertas en cada extremo del cobertizo para fomentar el flujo de aire. Sin embargo, ten cuidado de no crear corrientes de aire.
- Reducir la densidad de población. Dividir los terneros en casos clínicos y presuntos subclínicos. Retire los casos clínicos a un área separada: si no hay un espacio aéreo separado, muévalos para evitar el contacto de nariz a nariz.
Factores de ternero
Los anticuerpos derivados de la madre desempeñan un papel fundamental en la inmunidad contra el BRDC. La concentración de proteína total sérica influye en la aparición, la edad de inicio y la gravedad de la neumonía; sin embargo, este efecto se reduce a medida que el ternero envejece (Arthur et al, 1998). Los costes medios del fracaso de la transferencia pasiva (FPT) por ternero se estiman en 53 y 71 libras esterlinas para los productos lácteos y la carne de vacuno, respectivamente (Raboisson et al, 2016).
En terneros jóvenes, la comprobación de la proteína total es una forma efectiva de comprobar si hay FPT, lo que se considera que se ha producido si la concentración sérica de IgG es inferior a 10 mg/ml (5,2 g/dl; Faber et al, 2005).
En Escocia, las granjas deben conocer su estado de diarrea viral bovina (DVB) como parte del plan de erradicación de la BVD. BVD Free England es un plan voluntario. La presencia de animales infectados persistentemente puede causar una infección transitoria en terneros que no son de IB, lo que resulta en inmunosupresión y contribuye al desarrollo de BRDC. Una investigación sobre la neumonía debería incluir la determinación del estado de la BVD de los animales afectados con vistas a abrir un debate más amplio, tal vez cuando la situación inmediata esté bajo control.
Tratamiento
La terapia antibiótica está dirigida a infecciones bacterianas secundarias. Los oportunistas más significativos son Mannheimia haemolytica, Pasteurella multocida y Haemophilus somni. Idealmente, se deberían llevar a cabo investigaciones para guiar la selección de antibióticos. Sin embargo, en una situación de brote, la elección de antibióticos suele ser empírica.
Bajo las directrices de la Alianza de Uso Responsable de Medicamentos en la Agricultura, las fluoroquinolonas, las cefalosporinas de tercera y cuarta generación y los macrólidos de acción prolongada solo deben utilizarse para casos clínicos y no preventivamente. Un método rentable para seleccionar el ganado para el tratamiento es la medición de las temperaturas rectales, que debe registrarse y volver a verificarse 24 horas más tarde para controlar la eficacia del tratamiento, de acuerdo con el uso responsable de las directrices de antibióticos.
La duración del tratamiento es importante, pero debe tenerse en cuenta que la recurrencia de la infección bacteriana puede ocurrir en hasta el 25 % de los casos, lo que requiere repetir el tratamiento con antibióticos después de 5 a 14 días. Esto no indica un fallo de los antibióticos, sino la reinfección de los pulmones dañados cuando los niveles de antibióticos caen por debajo de las concentraciones efectivas (Scott, 2009).
La terapia de apoyo implica controlar la pirexia y la inflamación en los pulmones mediante la administración de AINE o esteroides. Una reducción de la temperatura estimulará el apetito y aumentará el comportamiento de los terneros, promoviendo una recuperación más rápida. La deshidratación también debe corregirse, si está presente, ya sea mediante terapia de fluido oral o intravenosa. Se debate el mecanismo de acción del clenbuterol, pero se reconoce que da un beneficio clínico cuando se usa fuera de licencia, IV a 0,5 μg/kg a 0,8 μg/kg (Nuytten et al, 1986).
Prevención
La vacunación desempeña un papel clave en el aumento del estado inmunitario, pero no prevendrá las enfermedades por sí sola. La mala bioseguridad o los factores ambientales abrumadores pueden ser fácilmente mal diagnosticados por los agricultores como un fracaso de la vacuna, lo que reduce su fe en la vacuna y el consejo del veterinario que la prescribió. Garantizar una excelente salud de los terneros ofrece a las vacunas las posibilidades óptimas de éxito. Si bien los rebaños cerrados minimizan el riesgo de introducir enfermedades, esto no se ajusta a todos los modelos de negocio agrícolas. La bioseguridad, en particular la cuarentena, debe desempeñar un papel clave en el control de enfermedades para todos los rebaños y a menudo se pasa por alto.
En un mundo ideal, se alcanzarían acuerdos de compra entre granjas con protocolos de vacunación en previsión de la enfermedad asociada con el estrés de la mezcla y el transporte. En la mayoría de las circunstancias, esto no es práctico o no es financieramente viable.
El plan Surecalf, puesto a prueba en 2007, promueve la vacunación antes de la venta para reducir el impacto del estrés y el transporte en la eficacia de la vacuna. Los terneros prevacunados alcanzan primas de 36 a 57 libras esterlinas por animal de 300 kg (datos de terneros vendidos a través de United Auctions, Escocia en 2008, 2009 y 2012-2014). Desafortunadamente, a partir de la discusión personal del autor con los agricultores, parece existir una renuencia a aumentar el desembolso para las existencias, combinada con una percepción limitada de los beneficios de dicho plan. Tal vez la educación de los clientes, en particular con respecto a los beneficios financieros de evitar los brotes de BRDC, podría fomentar la participación.
Conclusión
La DRB es el resultado de una interacción compleja entre muchos factores, incluidos los patógenos virales y bacterianos; el medio ambiente local, incluida la ventilación y la densidad de población; y el estado inmunitario de la pantorrilla. Como tal, puede ser difícil de tratar y puede tener efectos prolongados en el crecimiento y el bienestar. Como dice el viejo adagio, es mejor prevenir que curar.
Afortunadamente, hay vacunas eficaces disponibles para aumentar la inmunidad a los patógenos virales primarios. Si bien estas vacunas son excelentes herramientas, tanto el agricultor como el veterinario tienen la responsabilidad de proporcionar condiciones óptimas para lograr la máxima eficacia, proporcionando una vivienda adecuada y previniendo enfermedades simultáneas.
Para las granjas donde BRDC es un problema, entender el negocio es clave para las discusiones sobre la mejora del alojamiento. Cuando no sean posibles cambios importantes, no se desanime: mire lo que puede abordar a nivel local y haga un plan viable para llevar adelante.
Informe de caso
En este caso, se compraron 24 bueyes de tiendas de limusina cruzadas, que van desde los 13 meses de edad hasta los 16 meses de edad, directamente en una granja lechera. El ganado había sido vacunado previamente con Rispoval 4 (Zoetis). A su llegada, fueron alojados con 300 cabezas de ganado que iban desde los 6 meses hasta los 18 meses de edad en un solo espacio aéreo. El ganado que ya estaba en la unidad había sido comprado como terneros y fue vacunado con Rispoval 4.
- Presenting signs
Approximately two weeks after arrival, signs of respiratory disease were identified among the youngest bought-in cattle. Lethargy and inappetence were noted; this progressed rapidly to pyrexia, dyspnoea, and coughing, with a serous ocular and nasal discharge.
Disease spread throughout the majority of the cattle; however, the bought-in cattle were most severely affected and several became recumbent. The nasal discharge rapidly became purulent as secondary bacterial infection became established.
- Diagnostics
Nasopharyngeal and conjunctival swabs were taken from the most severely affected cattle, and submitted for fluorescent antibody titre (FAT). The result was received the same day and was positive for IBR.
- Treatment
The severely affected animals were treated with a primary IV dose of 6mg/kg danofloxacin (A180, Zoetis) and 0.5mg/kg meloxicam (Metacam, Boehringer Ingelheim), repeated at 48 and 72 hours respectively. The in-contacts were treated with 20mg/kg oxytetracycline (Oxytetrin, MSD) as a safeguard against common opportunistic pathogens, including Gram-negative bacteria, such as P multocida, M haemolytica and H somni(Lopez, 2007).
All stock (both in-contacts and “clean”) were vaccinated with a modified live vaccine (IBR Marker Live, Zoetis) intranasally to provide rapid local immunity and reduce virus shedding (World Organisation for Animal Health, 2010).
Following discussion with Zoetis’ technical advisors, an off-licence protocol was used – two doses, 10 days apart – to provide cover in the face of the outbreak. This vaccination protocol was extended to include an IM dose of IBR Marker Live every six months thereafter to provide ongoing protection.
- Biosecurity measures
Initial precautions included isolation and disinfection protocols around the infected shed. This was crucial to prevent disease spread while a vaccination protocol was implemented.
The worst affected cattle were removed to a separate shed to prevent further exposure of healthy cattle, and to better allow for nursing and observation. As multiple farm workers were involved and it was imperative biosecurity measures were followed strictly, written protocols were posted outside of the affected sheds. These included:
- Affected cattle to be managed – that is, fed or bedded, for example – after all other cattle.
- The tractor and mixer wagon could be used for feeding the cattle in the affected sheds, provided all of the other animals on the farm had been fed beforehand.
- The tractor and mixer wagon were to be parked away from any sheds.
- The most severely affected animals were to be fed and bedded using a wheelbarrow and pitchfork used exclusively for this purpose. These were to be left in the shed where the animals were housed.
- Any equipment used in the affected sheds was not to be used for any other animals on the farm.
- Boots and waterproof leggings to be thoroughly disinfected using Sorgene 5 disinfectant before entering or leaving the affected sheds.
- Hands to be thoroughly washed with chlorhexidine (Hibiscrub) by everyone before entering or leaving the affected sheds.
- Outcome and follow-up
Containment of the outbreak was successful, as respiratory disease was not spread to other sheds. In this outbreak, morbidity and mortality were 60% and 7% respectively.
A quarantine/vaccination protocol was put in place to prevent introducing disease on to the farm in future. Incoming stock were quarantined for two weeks in a designated quarantine shed. Those aged younger than three months of age were vaccinated intranasally with IBR Marker Live, followed by an IM dose administered three months later.
Animals aged older than three months of age received a single IM dose. After the primary protocol, all animals would receive IBR Marker Live boosters within six months in accordance with the farm protocol and continue with six-monthly boosters.
- Discussion
The main concern regarding this case was the apparent breakdown in vaccination, as both the bought-in stores and the cattle already on the farm had been vaccinated with Rispoval 4. Although vaccination may reduce shedding of virus, it does not prevent viraemia (World Organisation for Animal Health, 2010).
This provides a possible explanation for the clinical signs seen in the vaccinated cattle; however, the severe disease seen in the bought-in animals suggests a failure in vaccination in this group – either incorrect information had been given regarding the status of these animals or the protocol had not been followed according to the data sheet.
Strict biosecurity and a quarantine period before entering the farm would allow early detection of diseased cattle and would prevent spread of new pathogens to the existing herd. In combination with vaccination, this would provide good protection against infectious disease.
While useful as a rapid diagnostic tool, nasopharyngeal swabs are often contaminated with nasal flora and FAT may have a low sensitivity (Gibbs, 2001).
PCR techniques are becoming increasingly used, but results take one or two days and improvements to specificity are required (World Organisation for Animal Health, 2010).
Both of these tests provide limited information on concurrent disease. Immunosuppressive diseases, such as BVD, could have a critical effect on cattle health and vaccine efficacy.
The management of this case could have been improved by collecting samples for paired serology on the first day and again two weeks later. This would have guided future vaccination protocols by confirming the presence of BHV-1 and providing information regarding concurrent viral pathogens, such as BVD, RSV or PI3.
The relatively high mortality may have been due to late veterinary involvement and the introduction of mixed pathogens into a naïve herd (Lopez, 2007). Had the vet been involved more promptly, biosecurity and isolation protocols would have been in place earlier and may have reduced the severity of disease.
The relatively low morbidity may be attributable to previous vaccination.
A contributing factor to the spread of disease in this outbreak was the building design. While not overcrowded, multiple age groups of cattle were sharing the same air space. Ideally, no more than 30 animals should be in one air space (Andrews, 2004).
While this would require a drastic rethink of the use of buildings on this particular farm, the farmer can improve biosecurity by keeping smaller batches of cattle together in groups according to age.
Referencias
- Allen JW et al (1992). Cambios en la flora bacteriana de las vías respiratorias superiores e inferiores y recuentos de células diferenciales de lavado broncoalveolar en terneros de corrales de engorde tratados por enfermedades respiratorias, Can J Vet Res 56(3): 177-183.
- Andrews AH (2004). Enfermedad respiratoria de la pantorrilla. En Andrews AH, Blowey RW, Boyd H y Eddy RG (eds), Bovine Medicine (2a edición), Blackwell Science, Oxford: 240-246.
- Arthur GA et al (1998). Asociaciones entre inmunidad pasiva y morbilidad y mortalidad en novillas lecheras en Florida, EE. UU., Prev Vet Med 34(1): 31-46.
- Campbell J (2015). Infecciones virales del tracto respiratorio en el ganado, Manual de TME, https://msdmnls.co/3iTa3TQ
- Czuprynski CJ et al (2004). Complejidades de la patogénesis de las infecciones por Mannheimia haemolytica y Haemophilus somnus: ¿desafíos y posibles oportunidades de prevención? Anim Health Res Rev 5(2): 277-282.
- Faber SN et al (2005). Estudio de caso: efectos de la ingestión de calostro en el rendimiento lactativo, Prof Anim Sci 21(2005): 420-425.
- Gibbs A (2001). Enfoque práctico para el control de la neumonía en terneros alojados, en la práctica 23(1): 32-39.
- Jericho KW y Langford EV (1978). Neumonía en terneros producidos con aerosoles del herpesvirus bovino 1 y Pasteurella haemolytica, Can J Comp Med42(3): 269-277.
- López A (2007). Sistema respiratorio. En Merchant T (ed), Pathologic Basis of Veterinary Disease (4th edn), Mosby Elsevier, Missouri: 522-526.
- MacLachlan NJ y Dubovi EJ (2017). Virología veterinaria de Fenner (5a edición), Elsevier, Ámsterdam: 328-356.
- Nandi S et al (2009). Infecciones por el virus del herpes bovino en bovino, Anim Health Res Rev 10(1): 85-98.
- Nuytten J et al (1986). La influencia del clenbuterol en la disnea inducida por la prostaglandina F2 alfa en terneros, Vet Res Commun 10(6): 453-461.
- Paton DJ et al (1998). Prevalencia de anticuerpos contra el virus de la diarrea del virus bovino y otros virus en la leche cisterna a granel en Inglaterra y Gales, Vet Rec 142(15): 385-391.
- Raboisson D et al (2016). Fracaso de la transferencia inmune pasiva en terneros: un metanálisis sobre las consecuencias y la evaluación del impacto económico, PLoS One 11(3): e0150452.
- Scott P (2009). Enfermedad respiratoria en unidades de cría de productos lácteos y carne de vacuno,https://bit.ly/3dmo3Et
- Organización Mundial de Sanidad Animal (2010). Rinotraqueítis bovina infecciosa/vulvovaginitis pustulosa infecciosa, https://bit.ly/34NBzNH
- Zoetis (2013). Surecalf – Hoja de datos de Rispoval 4.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

