Estudio anatómico del espacio subaracnoideo que rodea el ganglio trigémino en caballos
 Richard Becker1*
Richard Becker1* Kati Haenssgen2
Kati Haenssgen2 Christina Precht3
Christina Precht3 Oleksiy-Zakhar Khoma4
Oleksiy-Zakhar Khoma4 Ruslan Hlushchuk4
Ruslan Hlushchuk4 Christoph Koch1
Christoph Koch1 Sabine Kaessmeyer2
Sabine Kaessmeyer2 Mathieu de Preux1*
Mathieu de Preux1*- 1Departamento de Medicina Veterinaria Clínica, Facultad Vetsuisse, Instituto Suizo de Medicina Equina (ISME), Universidad de Berna, Berna, Suiza
- número arábigoDivisión de Anatomía Veterinaria, Departamento de Investigación Clínica y Salud Pública Veterinaria, Facultad de Veterinaria, Universidad de Berna, Berna, Suiza
- 3División de Radiología Clínica, Facultad Vetsuisse, Universidad de Berna, Berna, Suiza
- 4Instituto de Anatomía, Universidad de Berna, Berna, Suiza
Introducción: El movimiento de cabeza mediado por el trigémino equino es un trastorno neuropático doloroso comparable a la neuralgia del trigémino en los seres humanos. La destrucción selectiva de las fibras del dolor dentro del ganglio del trigémino, llamada rizotomía, es el tratamiento quirúrgico de elección para la neuralgia idiopática del trigémino refractaria al tratamiento médico en humanos. El ganglio del trigémino humano está encerrado por un hueco dural llamado cueva de Meckel o del trigémino, en el que el ganglio está rodeado por un espacio subaracnoideo lleno de líquido cefalorraquídeo (LCR). Durante la rizotomía de glicerol, el glicerol se inyecta percutáneamente en este espacio lleno de líquido cefalorraquídeo. Hasta ahora, la información sobre la anatomía del receso dural y el espacio subaracnoideo que rodea el ganglio trigémino es escasa en los caballos. El objetivo de este estudio fue explorar si existe un espacio subaracnoideo lleno de LCR alrededor del ganglio trigémino en los caballos.
Materiales y métodos: Se investigaron seis cabezas de cadáveres equinos para detectar la acumulación de LCR alrededor del ganglio con una resonancia magnética de 3 Tesla. Después de la disección anatómica para exponer la raíz del trigémino, se inyectó un agente de contraste radiopaco a base de polímeros a través del poro trigeminus en el espacio subaracnoideo (cisternografía). La delineación exacta y el volumen de la acumulación del agente de contraste se determinaron en las siguientes tomografías microcomputarizadas y segmentación. Finalmente, se examinó histológicamente la distribución del agente de contraste dentro del espacio subaracnoideo en tres especímenes.
Resultados: En los 12 especímenes incluidos en este estudio, el ganglio del trigémino estaba rodeado por un espacio subaracnoideo formando una cisterna del trigémino. El volumen medio de la cueva del trigémino en este estudio fue de 0,31 mL (±DE: 0,11 mL). Se observó la distribución del agente de contraste a lo largo de los nervios periféricos (es decir, nervio oftálmico, maxilar y/o mandibular) en 7 de los 12 especímenes.
Discusión/conclusión: Existe un espacio subaracnoideo que rodea el ganglio del trigémino en el caballo y podría ser el objetivo de la rizotomía de glicerol en caballos que sufren de sacudidas de cabeza mediadas por el trigémino. Sin embargo, la relevancia clínica de la distribución del agente de contraste a lo largo de los nervios periféricos aún no se ha evaluado.
1 Introducción
El movimiento de cabeza mediado por el trigémino en el caballo es un trastorno doloroso caracterizado por sacudidas, sacudidas o sacudidas violentas, generalmente verticales, de la cabeza que pueden intensificarse bajo ciertas condiciones, generalmente durante el ejercicio (1, 2). Se cree que los signos clínicos son el resultado de un dolor neuropático inducido por una disfunción sensorial del nervio trigémino (3), que puede ser lo suficientemente grave como para llevar a un retiro deportivo prematuro o incluso a la eutanasia por razones de bienestar (2, 4). El movimiento de cabeza mediado por el trigémino equino como trastorno neuropático es en muchos aspectos similar a la neuralgia del trigémino humano (3). En consecuencia, se han propuesto enfoques terapéuticos de la medicina humana para el tratamiento de los caballos afectados. En los seres humanos, la destrucción quirúrgica selectiva de las fibras del dolor dentro del ganglio del trigémino, llamada rizotomía, es el tratamiento quirúrgico de elección para la neuralgia idiopática del trigémino refractaria al tratamiento médico (5).
En los seres humanos, el ganglio del trigémino está encerrado por una protuberancia de la paquimeninge (duramadre). Por lo tanto, dos capas durales rodean el ganglio trigémino en forma de media luna y el plexo trigémino (un término comúnmente utilizado en la literatura humana para describir la distribución plexual en forma triangular del nervio trigémino con anastomosis entre los fascículos nerviosos) (6, 7). Esta bolsa dural se conoce comúnmente como cueva de Meckel o cueva del trigémino (8-10). Dentro de la cueva del trigémino, el ganglio está envuelto por la leptomeninge (pia mater y aracnoidea encephali) y el espacio subaracnoideo situado en medio, con su contenido, el líquido cefalorraquídeo, formando la cisterna del trigémino (6). Esta cisterna del trigémino es la estructura a la que se dirige la rizotomía percutánea de glicerol para el tratamiento de la neuralgia del trigémino (11). En este procedimiento, el glicerol se inyecta percutáneamente en la cisterna del trigémino utilizando una aguja insertada a través del agujero oval. Esto permite que el glicerol se acumule directamente alrededor del nervio trigémino dentro de la cueva del trigémino, lo que luego conduce a la destrucción selectiva de sus fibras de dolor, causando un alivio inmediato del dolor (12, 13). La precisión de la colocación de la aguja en la cueva del trigémino se evalúa principalmente en imágenes fluoroscópicas. La combinación de la cisternografía de contraste con la fluoroscopia nativa, en la que la cisterna del trigémino se llena con un agente de contraste radiopaco, puede ayudar a determinar el volumen apropiado de glicerol a inyectar para cada individuo (13).
Hasta donde saben los autores, aún no se ha descrito en el caballo un espacio subaracnoideo dentro de un receso dural que rodea el nervio trigémino y el ganglio, similar a la cueva del trigémino en los humanos. Por lo tanto, no está claro si existe una cisterna de trigémino llena de LCR y podría usarse como estructura objetivo para la rizotomía de glicerol en el caballo. Sin embargo, se han intentado rizotomías percutáneas de glicerol del ganglio trigémino en caballos, en un entorno experimental y en casos clínicos de sacudida de cabeza mediada por trigémino (14, 15). Estos procedimientos de rizotomía se realizaron mediante tomografía computarizada (TC) para inyectar el glicerol directamente en el tejido ganglionar, pero dieron lugar a numerosas complicaciones, como hemorragia y meningitis (14). Ni el informe sobre el trabajo experimental ni el de los casos clínicos incluyeron estudios de contraste para determinar el patrón de distribución de las sustancias inyectadas ni información detallada sobre las estructuras anatómicas objetivo. Además, los informes no mencionaron la posibilidad de apuntar a una cisterna de trigémino llena de LCR, ya que se describe para el tratamiento de la neuralgia del trigémino en humanos (14, 15).
La evaluación retrospectiva de las imágenes de resonancia magnética (RM) de 3 Tesla (3 T) archivadas de cabezas de equinos del departamento de radiología clínica de la Facultad Vetsuisse de Berna reveló sistemáticamente acumulaciones de líquido de intensidad de señal similar al LCR que rodea el ganglio trigémino. Por lo tanto, planteamos la hipótesis de que un espacio subaracnoideo lleno de LCR, comparable a la cueva del trigémino en los humanos, también existe en los caballos.
Por lo tanto, el objetivo principal de este estudio fue explorar la estructura anatómica en la que se encuentra esta acumulación de líquido que rodea al ganglio trigémino equino. Los objetivos específicos fueron:
1. Describir la anatomía del ganglio trigémino y el espacio circundante lleno de líquido en cabezas cadavéricas equinas mediante resonancia magnética 3 T.
2. Medir el volumen del espacio lleno de líquido mediante cisternografía de contraste y posterior análisis de conjuntos de datos tomográficos microinformáticos.
3. Evaluar histológicamente la distribución del material de fundición utilizado para la cisternografía de contraste dentro de la cueva del trigémino y sus capas meníngeas.
2 Materiales y métodos
2.1 Especímenes cadavéricos
Se recolectaron cabezas cadavéricas de 6 caballos propiedad del cliente, sin antecedentes conocidos de sacudidas de cabeza mediadas por trigémino o enfermedad del sistema nervioso central y sacrificadas por razones no relacionadas con el propósito del estudio. Los cadáveres fueron donados después de que los propietarios firmaran un formulario de consentimiento informado, permitiendo el uso de tejidos e imágenes con fines de investigación. Un rango de edad de 4 a 17 años, comúnmente reportado para caballos afectados por sacudidas de cabeza mediadas por trigémino (16), se utilizó como criterio de inclusión para evitar artefactos relacionados con la edad.
2.2 Resonancia magnética
La resonancia magnética se realizó dentro de 1 h después de la eutanasia. Las cabezas se desarticularon a nivel de la articulación atlantooccipital y se colocaron en posición supina en el pórtico de RM para la adquisición de imágenes. Las imágenes de resonancia magnética se adquirieron con una unidad de resonancia magnética 3 T (Magnetom Vida, Siemens Healthineers, Zürich, Suiza) e incluyeron una secuencia de gradiente de eco preparado para magnetización reconstruible en 3D ponderada en T1 (MP-RAGE) en plano sagital con un tamaño de vóxel de 0,55 × 0,55 × 0,9 mm3, una secuencia TSE ponderada en T2 en planos sagitales y transversales y una secuencia de recuperación de inversión atenuada en fluido ponderada (FLAIR) en T2 en plano transversal.
2.3 Cisternografía de contraste
La primera cabeza de cadáver se almacenó congelada después del estudio de resonancia magnética por razones logísticas. Todas las cabezas de cadáveres posteriores no se almacenaron, congelaron y se prepararon para la fundición del espacio subaracnoideo inmediatamente después de la RMN. Además, se realizó la fundición en la cabeza del cadáver no fijada para evitar artefactos de contracción inducidos por formaldehído. Después de la extracción de la calvaria, la duramadre se separó cuidadosamente de la membrana aracnoidea subyacente para visualizar su extensión y obtener acceso a la cara dorsal del cerebro. Este último se extirpó mediante una combinación de disección digital contundente y afilada para exponer la protuberancia y las raíces del trigémino. El porus trigeminus (un término comúnmente utilizado en la literatura humana, pero no incluido en la Nomina Anatomica Veterinaria) se identificó como la abertura de la bolsa dural a través de la cual el nervio trigémino ingresa a la cueva del trigémino en la cara lateroventral de la cavidad craneal, entre el cerebro y el cerebelo (Figura 1). Se introdujo una aguja de 25 G y 40 mm ligeramente doblada con una punta roma bajo control visual directo entre el aracnoideo y la piamadre en el poro trigeminado para acceder al espacio subaracnoideo de la cueva del trigémino. A continuación, se inyectó lentamente en el espacio subaracnoideo un agente de contraste radiopaco a base de polímeros (μAngiofil®, Fumedica AG, Muri, AG, Suiza) en el espacio subaracnoideo hasta que se observó un reflujo fuera del poro. Durante la inyección, la cabeza del cadáver se mantuvo en una posición ligeramente inclinada, mirando hacia abajo rostralmente, para promover la difusión rostral del agente de contraste. La TC-cisternografía con contraste se realizó después de un tiempo de polimerización de unos 30 min. Las cabezas de los cadáveres se colocaron en posición prona en el pórtico de una TC de haz cónico (CBCT; O-arm 2, Medtronic, Louisville, Colorado), y se adquirió un CBCT-scan volumétrico de alta definición utilizando 120 kV y 150 mNas. Posteriormente, las cabezas de los cadáveres se fijaron y se almacenaron en formaldehído al 4%. Todos los procedimientos descritos anteriormente (es decir, resonancia magnética, moldeo del espacio subaracnoideo y CBCT) se realizaron dentro de las 5 h y las cabezas de los cadáveres se sumergieron en una solución de formaldehído al 4%.

2.4 Microtomografía computarizada
Después de un tiempo mínimo de fijación de 25 días en formaldehído, las cabezas se cortaron con una sierra de cinta en bloques de 10 × 5 × 5 cm centrados sobre cada ganglio trigémino. Posteriormente, cada muestra se escaneó utilizando un sistema nanoCT multiescala (SkyScan 2214, Bruker microCT, Kontich, Bélgica). La fuente de rayos X se ajustó a una tensión de tubo de 110,0 kV y una corriente de tubo de 110 μA en promedio. El espectro de rayos X fue filtrado por un filtro de aluminio de 1 mm de espesor antes de la incidencia en el detector de panel plano. Para cada muestra, registramos un conjunto de 2 o 1 escaneos apilados superpuestos a la altura de la muestra, cada pila se registró con 3.601 proyecciones de 3.072 × 1.944 píxeles a cada 0,1° en una rotación de muestra de 360°. Cada proyección se expuso en promedio durante 760 ms. En total, se analizaron 23 pilas. Las imágenes de proyección de tomografía microcomputarizada (microCT) adquiridas se reconstruyeron mediante retroproyección en una pila de imágenes 3D con el software NRecon (NReconServer64bit, Bruker, MicroCT, Kontich, Bélgica) utilizando una corrección de artefacto de anillo de 5 y una corrección de endurecimiento del haz del 80%. Todo el proceso dio como resultado conjuntos de datos con un tamaño de lado de vóxel isométrico de 30,0 μm. Utilizando el software CTVox (Bruker, microCT, Kontich, Bélgica), se visualizaron los conjuntos de datos virtuales en 3D. El volumen de fundición radiopaco inyectado en el espacio subaracnoideo se determinó mediante segmentación dentro de los conjuntos de datos 3D obtenidos y utilizando el software CTAn (Bruker, MicroCT, Kontich, Bélgica). Para cada muestra, las mediciones de segmentación y volumen se repitieron tres veces por el mismo observador (R.B.) y cada vez en una orientación diferente en reconstrucciones multiplanares. La variabilidad intraobservador de las mediciones se evaluó mediante la realización de diagramas de Bland-Altman entre la primera y la segunda, la segunda y la tercera, y la primera y la tercera. Los datos recopilados se analizaron mediante el software estadístico R (v4.1.2; R Equipo Central 2021). Los gráficos de Bland-Altman se obtuvieron a través del paquete ggplot2 R (v3.3.3) (17).
2.5 Histología
Después de la microTC, se cortaron 3 bloques de 3 muestras diferentes en rodajas de aproximadamente 2 mm de grosor para el examen histológico del ganglio trigémino y sus meninges circundantes. En dos bloques, el ganglio trigémino se seccionó paralelamente al porus trigeminus. En el último bloque, las rodajas se seccionaron perpendicularmente al porus trigeminus. Posteriormente, las rodajas se fijaron en una solución tamponada con formaldehído al 4%, se descalcificaron con Ossa Fixona® (Diagonal GmBH & Co. KG, Münster, Alemania), se deshidrataron con etanol/Neoclear y se incrustaron en parafina. Los portaobjetos de 2 μm de espesor se seccionaron y se tiñeron con hematoxilina y eosina (HE). Para facilitar la diferenciación del tejido conectivo y meníngeo de los fascículos nerviosos, los portaobjetos también se tiñeron con tinción tricrómica de Masson-Goldner.
La criofijación se realizó en dos cortes procedentes de dos especímenes diferentes. Las rodajas se fijaron en una solución tamponada de formaldehído al 4%, se descalcificaron con Ossa Fixona® y luego se trataron con sacarosa al 20% para evitar la cristalización del agua al congelarse. Posteriormente, se cargaron en un recipiente de congelación, se congelaron a -80 °C, se seccionaron en rodajas de 5 μm de espesor y se tiñeron con tricrómico de Masson-Goldner y HE. Todas las secciones fueron evaluadas y capturadas con un microscopio digital (VHX 5100, Keyence, Osaka, Japón).
3 Resultados
3.1 Población de estudio
La edad de los 6 caballos osciló entre los 11 y los 16 años (media 14 años, mediana 15 años). Se incluyeron 3 caballos árabes (2 yeguas, 1 castrado), 2 Warmbloods (1 yegua, 1 castrado) y 1 Franches-Montagnes (yegua). El peso corporal osciló entre 415 y 607 kg (el peso corporal medio fue de 537,5 kg).
3.2 Resonancia magnética
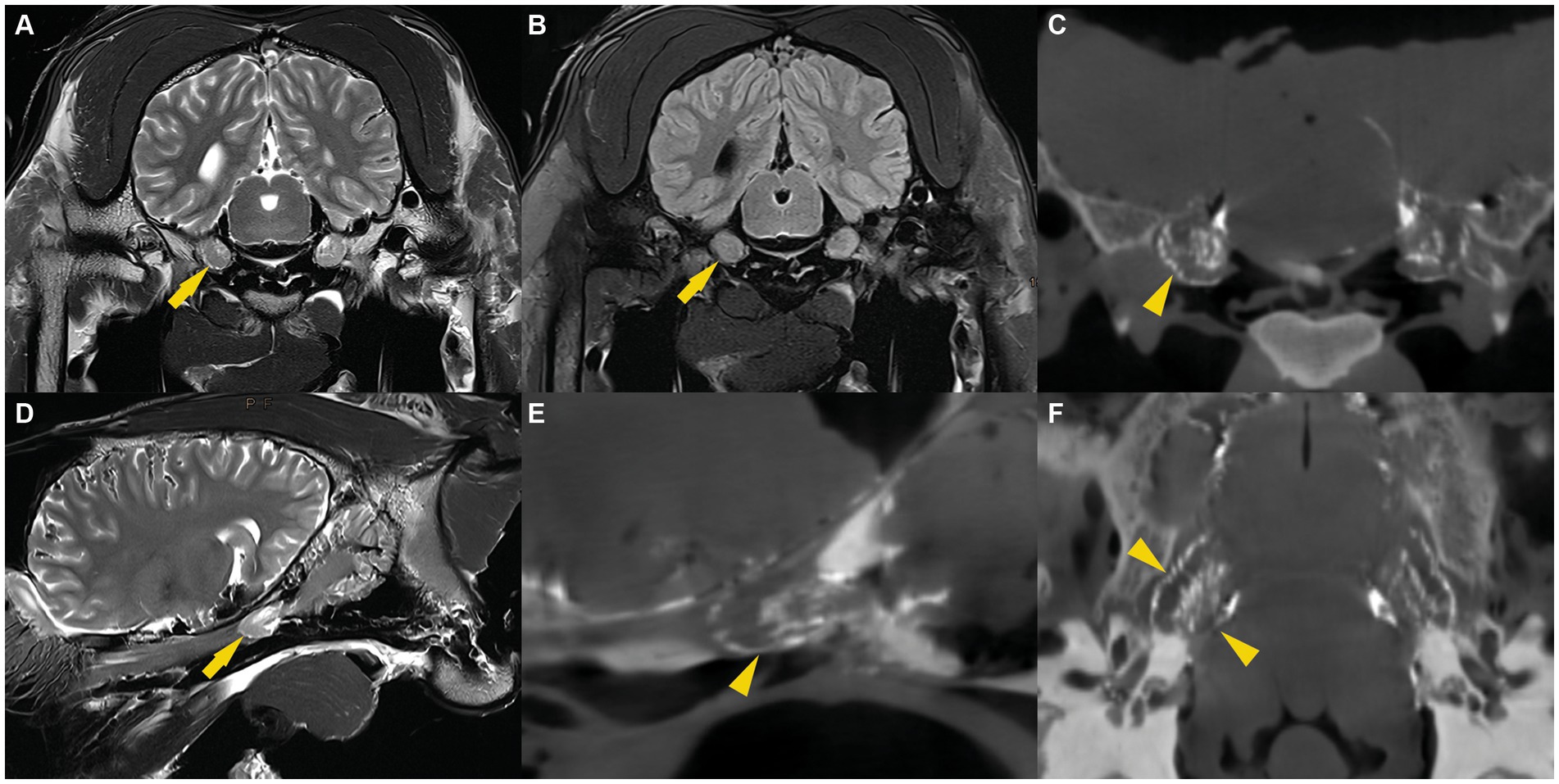
Las imágenes de RM fueron evaluadas por un radiólogo certificado (C.P.) y permitieron consistentemente la visualización bilateral de la acumulación de líquido de intensidad de señal similar al LCR alrededor del ganglio trigémino. El patrón de distribución del LCR fue similar en todos los especímenes. En las imágenes transversales transversales de EET ponderadas en T2, una sutil línea de demarcación fluida rodeaba el ganglio trigémino. Además, se identificó una cantidad variable de líquido, dispuesto en un patrón trabecular, entre los haces de fibras nerviosas y el ganglio del trigémino. Ambas características distintivas fueron más pronunciadas en la cara axial del ganglio trigémino. Estas imágenes se compararon con secuencias FLAIR ponderadas en T2 en plano transversal, que también mostraron una señal de fluido suprimida que rodea el cerebro, el cerebelo y el ganglio trigémino (Figura 2). Esto confirmó la naturaleza del líquido que rodea el ganglio trigémino por la líquido cefalorraquídeo. En las imágenes sagitales, se detectó una señal de fluido hiperintensa en las secuencias T2 de TSE y una señal de fluido suprimida en las secuencias FLAIR ponderadas en T2 alrededor del ganglio del trigémino. La línea fluida que rodea la cara rostral del ganglio trigémino mostró consistentemente una forma cónica y convexa. Caudalmente al ganglio del trigémino, pero dentro de la cueva del trigémino, el líquido estaba dispuesto en un patrón trabecular que se asemejaba al patrón de distribución en las imágenes transversales (Figura 2).
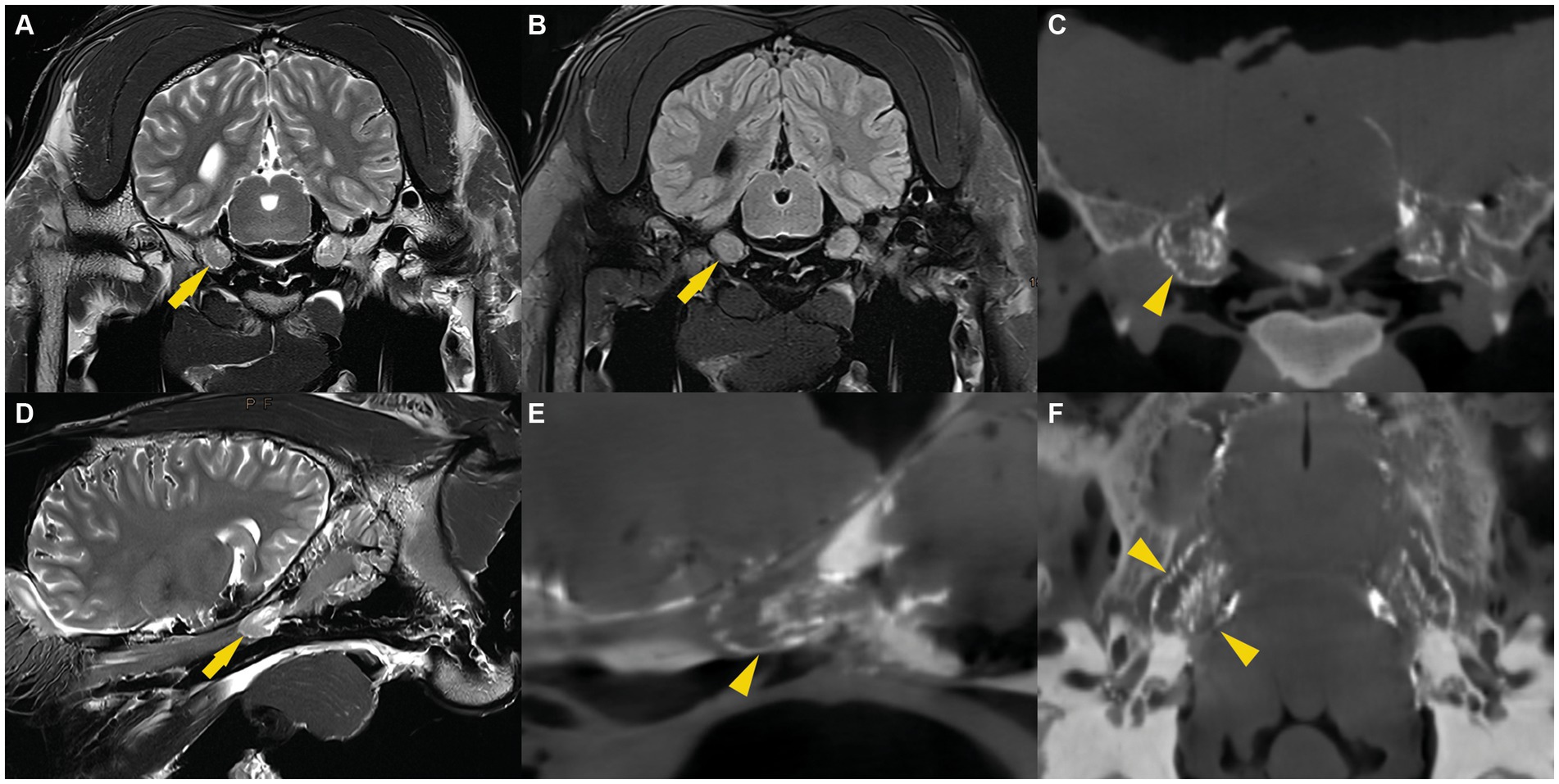
3.3 Cisternografía de contraste
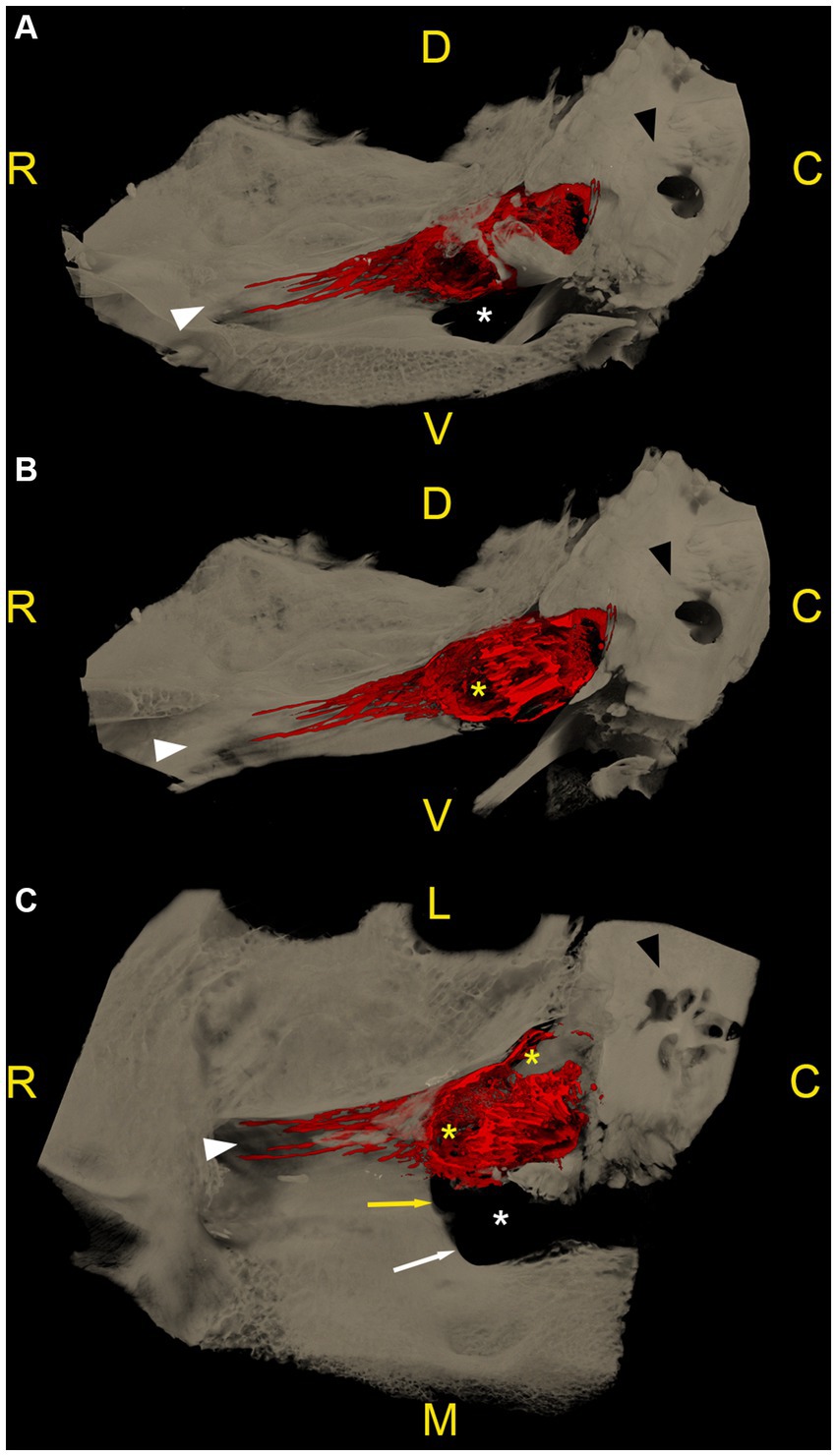
En las imágenes CBCT, el material de fundición radiopaca era reconocible como una línea hiperintensa y bien delineada que rodeaba el ganglio del trigémino y se encontraba dentro de la cueva del trigémino. Para cada espécimen, se compararon las imágenes de RMN (pre-cisternografía) y las imágenes CBCT (post-cisternografía). La distribución del material de fundición radiopaco dentro de la cueva del trigémino fue similar a la distribución del LCR en las imágenes de RM, lo que sugiere que el material de fundición se había inyectado en el espacio subaracnoideo (lleno de LCR) (Figura 2). En dos cuevas del trigémino de dos cabezas de cadáveres diferentes, la forma del molde radiopaco difiere significativamente de las otras 10 cuevas del trigémino, incluidas las contralaterales. Allí, el material de fundición tenía márgenes indefinidos e irregulares y no se extendía tan rostralmente como en los otros. Esto presumiblemente fue el resultado de una perforación inadvertida de las meninges durante la inyección del material de fundición.
El reflujo del agente de contraste durante la inyección a través del poro del trigémino fue visible en todos los especímenes como una señal focal de hiperatenuación en las imágenes CBCT. Esta señal hiperatenuante se localizó caudal al ganglio trigémino en la fosa craneal media y posterior de la cavidad craneal y no causó artefactos radiológicos que afectaran la interpretación de las imágenes.
3.4 Microtomografía computarizada
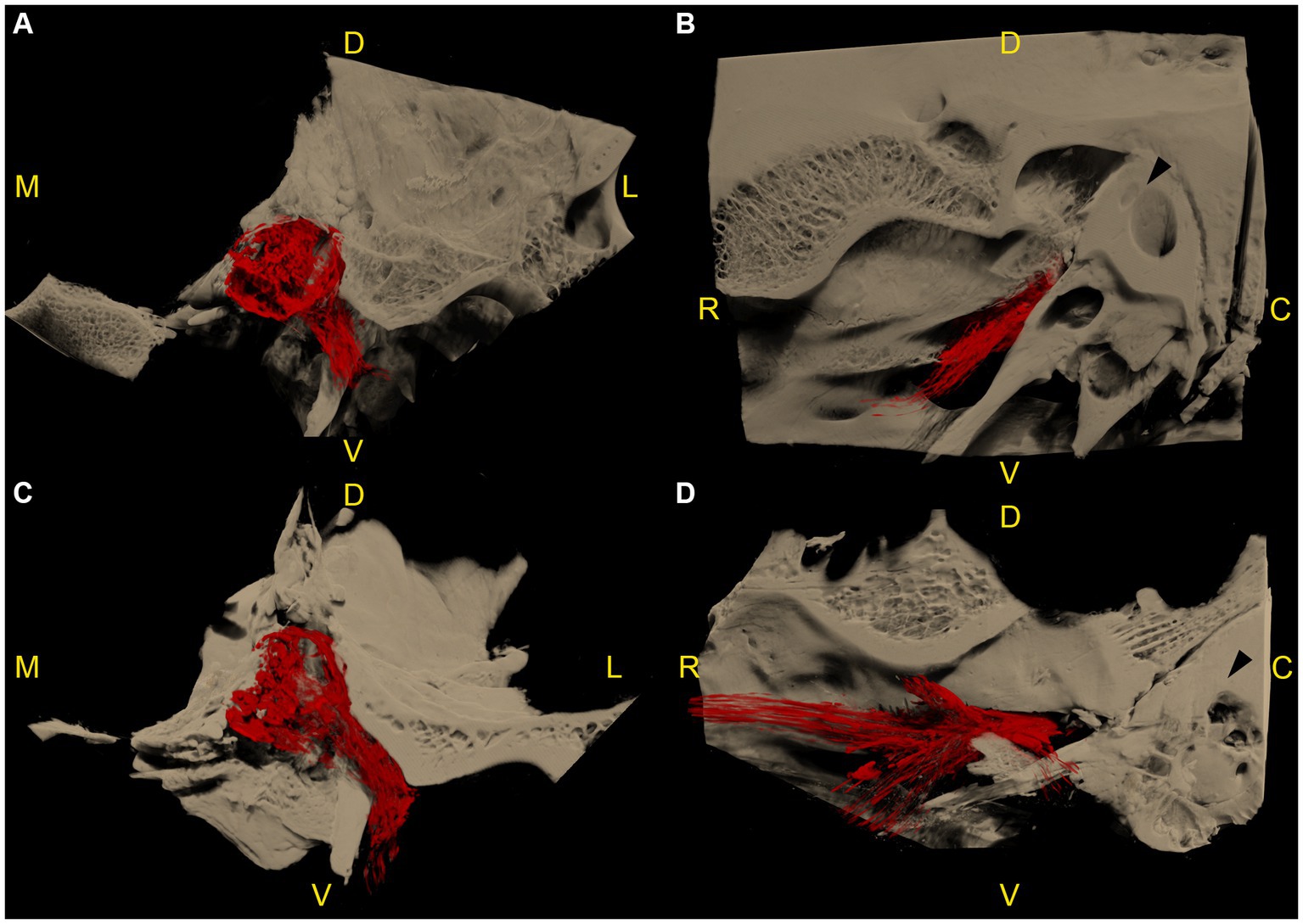
Se realizaron microtomografías computarizadas de los ganglios del trigémino izquierdo y derecho en las 6 cabezas de cadáver, lo que dio como resultado 12 especímenes disponibles para la segmentación. En todos los especímenes, la acumulación de material de fundición radiopaco se localizó dorsal y lateralmente al foramen lacerum, con su borde rostral terminando sobre el borde rostral del foramen lacerum, la incisión carotídea lateral, la escotadura ovalada y la escotadura espinosa, respectivamente. Lateralmente, la acumulación de contraste radiopaco se asoció estrechamente con el meato acústico interno y la parte petrosa del hueso temporal de la fosa craneal media (Figura 3).
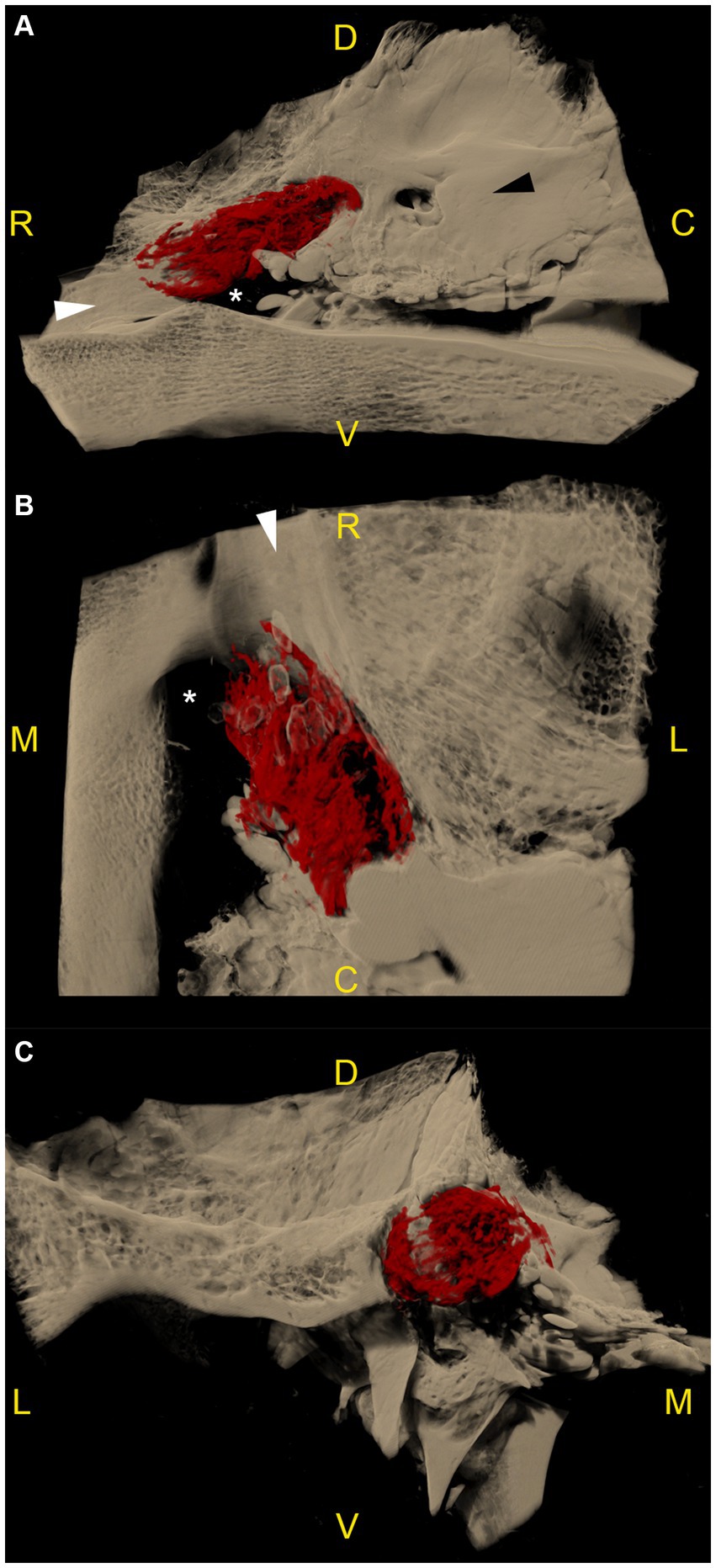
El patrón de distribución del material de fundición radiopaco fue similar en 10 de los 12 especímenes (incluidos los dos especímenes congelados-descongelados), con una forma ovoide/maní orientada hacia el rostro caudal, y una muesca a mitad de su longitud causada por la ramificación del nervio mandibular desde la superficie lateral del ganglio. El agente de contraste se acumuló principalmente en los dos tercios caudales del espacio subaracnoideo. En el plano de la sección transversal, la acumulación de contraste se presentó principalmente en la cara axial del espacio subaracnoideo (Video Suplementario S1). Varios defectos de relleno longitudinal eran visibles dentro del material de fundición, lo que daba lugar a un patrón trabecular (Videos Suplementarios S2, S3). En el tercio rostral, el agente de contraste se acumuló pobremente alrededor de la cara rostral del ganglio trigémino y el origen del nervio oftálmico y maxilar (Figura 3). El límite caudal de la cueva del trigémino varió en forma, debido al reflujo de material de fundición a través del poro trigemino durante la inyección. Sin embargo, la alta resolución de las microtomografías computarizadas permitió una identificación precisa del poro trigememenos de forma ovalada en todas las exploraciones y, por lo tanto, la diferenciación entre los artefactos de reflujo y el espacio subaracnoideo objetivo.
Como ya se observó en la cisternografía con contraste CBCT, en 2 de los 12 especímenes procedentes de dos especímenes cadavéricos diferentes, la forma de la acumulación de material de fundición radiopaco varió considerablemente y no fue comparable a la de los otros 10 especímenes, incluidos los contralaterales. En esos especímenes, los márgenes del material de fundición estaban mal definidos, eran irregulares y no llegaban tan lejos como en los otros especímenes. Estos hallazgos posiblemente fueron el resultado de una perforación inadvertida de las meninges, que ya se sospechaba durante la inyección del material de fundición.
En 7 de los 12 especímenes, una cantidad variable de agente de contraste radiopaco se distribuyó a lo largo del recorrido de la cara proximal de las ramas principales del nervio trigémino, en 3 de 12 alrededor del nervio mandibular (Figura 4), en 3 de 12 alrededor del nervio maxilar y oftálmico (Figura 5), y en 1 de cada 12 especímenes alrededor de las tres ramas principales del nervio trigémino. En un espécimen, el agente de contraste no solo se distribuyó alrededor del origen del nervio mandibular, sino que también se extendió a lo largo del curso del nervio mandibular a través del foramen lacero y a lo largo de los nervios que se ramifican fuera de la cavidad craneal (Figura 4; Video complementario S4).
La evaluación de los diagramas de Bland-Altman reveló un límite estrecho de concordancia, una variabilidad consistente entre los gráficos y ningún sesgo sistemático, lo que pone de manifiesto la baja variabilidad intraobservador entre las tres mediciones. Por lo tanto, se calculó el valor medio de las tres mediciones para cada ganglio del trigémino y se describió como el volumen medio del material de fundición radiopaca.
El volumen medio del material de fundición radiopaco contenido en cada espacio subaracnoideo osciló entre 0,13 y 0,48 mL, con un volumen medio global (media de los 12 valores medios) de 0,31 mL (±DE: 0,11 mL). Los dos especímenes que exhibieron una mala distribución de agentes de contraste tuvieron los valores medios más bajos en general (0,13 y 0,16 mL). Al excluir esos dos especímenes, el volumen medio global alcanzó 0,34 mL (±DE: 0,09 mL).
3.5 Histología
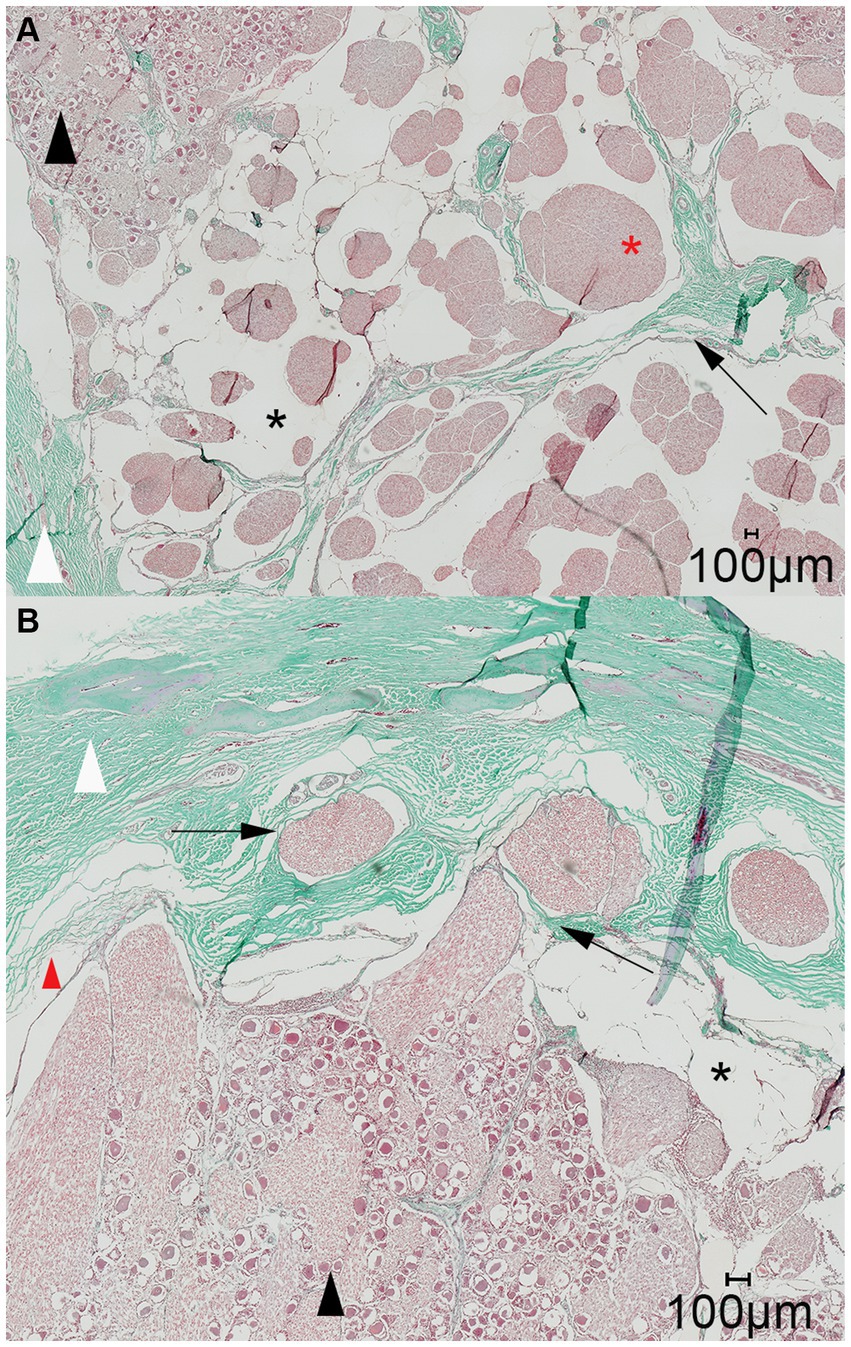
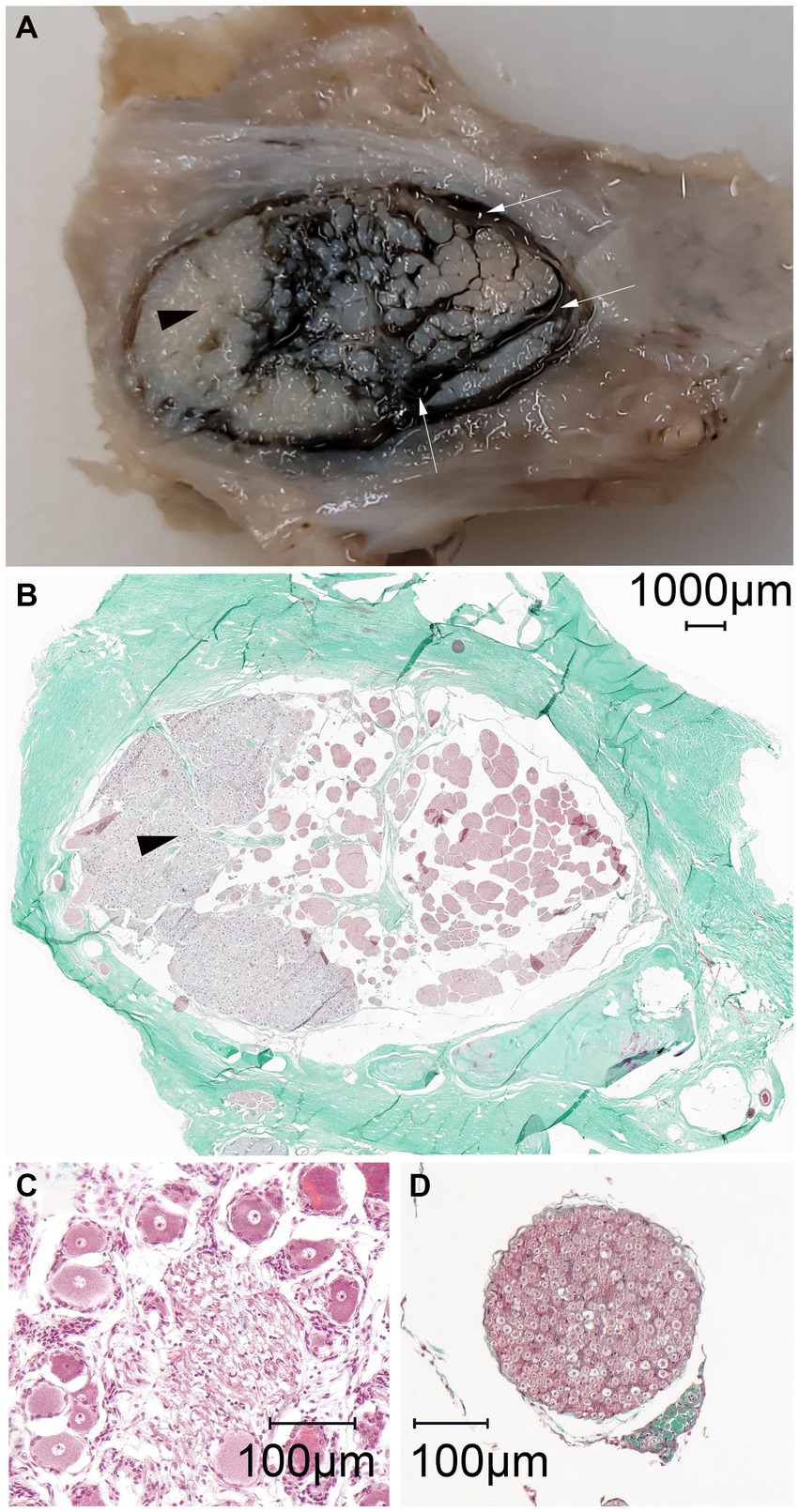
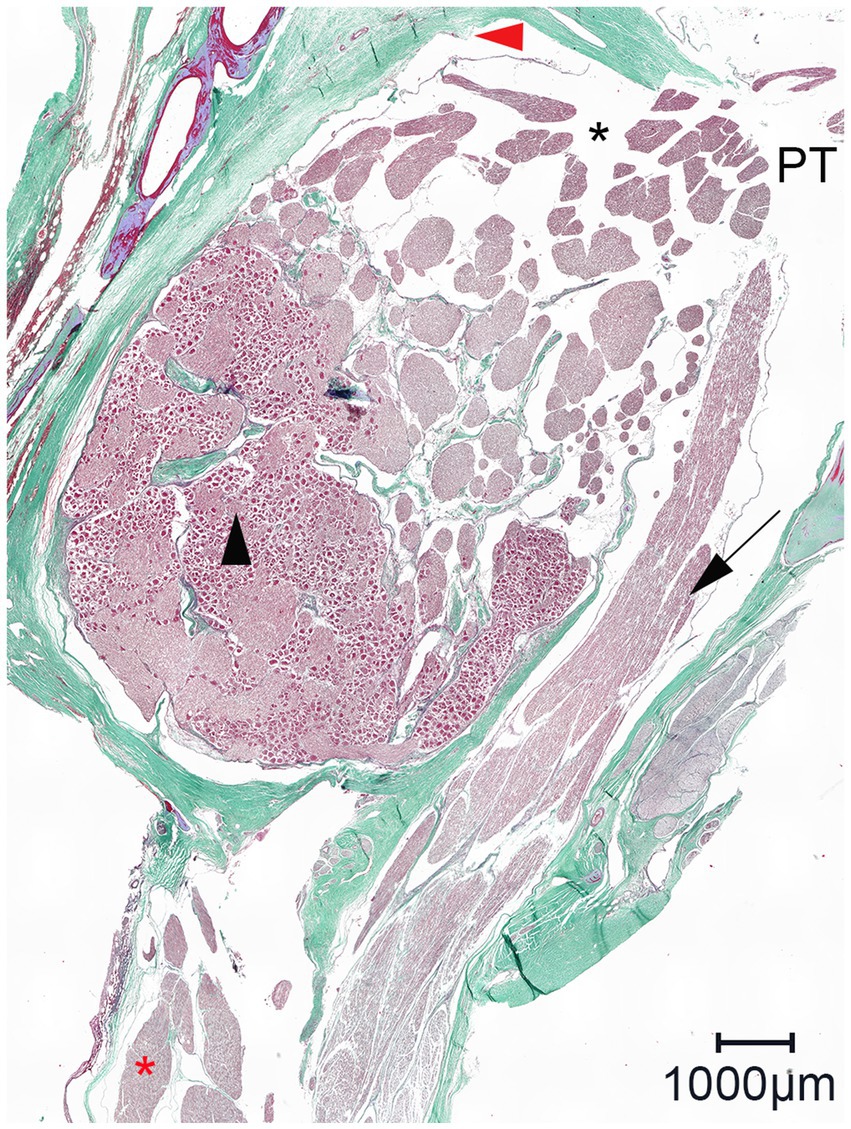
Se evaluó histológicamente la distribución del material de fundición dentro del espacio subaracnoideo en tres especímenes. Esto incluyó dos especímenes con un patrón de distribución normal y un espécimen con mala distribución, debido a la sospecha de perforación inadvertida de las meninges. En todos los portaobjetos histológicos se produjeron artefactos de contracción que causaron el desprendimiento de la aracnoidea de la duramadre. La inspección macroscópica de las secciones transversales y sagitales de los bloques fijados en formol antes del corte para la histología reveló una acumulación trabecular del material de fundición coloreado a base de polímero (μAngiofil) que rodea los haces de nervios grises (Figura 6). Posteriormente, el μAngiofil sólido se lavó tras la preparación de los portaobjetos para el examen histológico, lo que impidió su detección microscópica. Sin embargo, el espacio subaracnoideo donde se había acumulado el polímero todavía era claramente visible como un espacio en blanco, formando una cisterna trigémino que rodeaba los fascículos nerviosos y estaba encerrada por la membrana aracnoidea. El patrón de la cisterna del trigémino coincidió con la estructura trabecular de los fascículos nerviosos rodeados por el polímero verde visible en el bloque fijado en formol, confirmando la inyección del material de fundición en el espacio subaracnoideo (Figura 6). En portaobjetos de ambas orientaciones de corte (paralelo y perpendicular al poro trigémino), los tabiques durales se proyectaron en la cisterna del trigémino seguidos de trabeculaciones aracnoideas que envolvieron las fibras del nervio trigémino (Figura 7).
En los portaobjetos histológicos de ambas orientaciones de corte, los fascículos nerviosos perforaron por separado la duramadre en la cara lateral de la cueva del trigémino (Figura 7). Después de atravesar la membrana porosa, los fascículos nerviosos se unieron para formar el nervio periférico. En los portaobjetos histológicos orientados perpendicularmente al poro trigeminal, se observaron fascículos nerviosos adicionales que viajaban dentro de la cueva del trigémino desde el poro trigémino en la cara inferior de la cueva del trigémino en dirección lateroventral ventral al ganglio del trigémino hacia el nervio mandibular. A nivel del ganglio del trigémino, estos fascículos nerviosos parecen estar separados del ganglio del trigémino por un tabique dural (Figura 8).
4 Discusión
Los resultados de este estudio cadavérico confirman la presencia de un espacio subaracnoideo formando una cisterna en la cueva del trigémino del caballo. En las imágenes de resonancia magnética, una acumulación de líquido de intensidad similar al LCR rodea estrechamente el ganglio trigémino, lo que sugiere la presencia de un espacio subaracnoideo. En este estudio, este espacio se inyectó con éxito con un material de fundición radiopaca, como lo confirmaron los patrones de distribución similares del LCR en las imágenes de RM y del material de fundición en la cisternografía de contraste CBCT y se verificaron mediante el examen histológico posterior del ganglio trigémino. El examen microtomográfico del espacio subaracnoideo moldeado proporcionó información adicional sobre su extensión y sobre el patrón de difusión del material fundido dentro de la cueva del trigémino y a lo largo de las ramas principales del nervio trigémino.
En los seres humanos, los segmentos del nervio trigémino contenidos dentro de la cueva del trigémino son el ganglio del trigémino y el plexo del trigémino (Figura 1) (7). El espacio subaracnoideo dentro de la cueva del trigémino se encuentra posteriormente al ganglio del trigémino, ya que se cree que el aracnoideo se adhiere firmemente al ganglio del trigémino en su superficie anterior (Figura 1) (6). Sin embargo, aún no se ha llegado a un consenso sobre la arquitectura meníngea y se han discutido tres modelos de la relación entre las meninges y el ganglio trigémino para describir el curso y el final de la membrana aracnoidea y la duramadre alrededor del ganglio trigémino y sus divisiones (18, 19). Con base en la distribución del agente de contraste en el espacio subaracnoideo determinada por el análisis de microCT, en este estudio fue posible dividir el nervio trigémino equino en dos partes, como se observó en humanos (7). El ganglio del trigémino se localizó rostralmente dentro de la cueva del trigémino. Tras la cisternografía de contraste y la microtomografía computarizada, se caracterizó por una falta de agente de contraste debido a su alta densidad tisular, lo que obviamente no permitía la penetración del agente de contraste. El plexo del trigémino se localizó dentro de los dos tercios caudales de la cueva del trigémino, cerca del poro trigémino, y se observó una mayor acumulación de agente de contraste con defectos de llenado longitudinal y un patrón trabecular. Este último indicó que el plexo trigémino se encuentra dentro de un ensanchamiento del espacio subaracnoideo, comparable a la cisterna del trigémino humano. En la cisterna de los caballos, el espacio subaracnoideo que contenía el LCR no solo estaba situado en la periferia del nervio, sino también entre los fascículos nerviosos, es decir, el plexo trigémino (Figura 1). En las imágenes de resonancia magnética, igualmente se observó que el líquido se disponía en un patrón trabecular entre los fascículos nerviosos y el ganglio trigémino. Esto explica el patrón trabecular de la distribución del agente de contraste en esta región. Cuando los fascículos nerviosos convergieron rostralmente para formar el ganglio del trigémino, la columna del agente de contraste se desplazó hacia la periferia axial del ganglio del trigémino, e incluso desapareció focalmente (principalmente abaxialmente) debido a la adherencia de la membrana aracnoidea al tejido ganglionar.
En los seres humanos, el volumen de la cueva del trigémino se puede evaluar radiológicamente en las imágenes de RM preoperatorias y asciende a un volumen medio de 0,4 mL. Sin embargo, este volumen se refiere a todo el volumen de la cueva del trigémino, incluyendo el nervio trigémino y el ganglio (20). En los pacientes sometidos a una rizotomía de glicerol, el volumen estimado de glicerol a inyectar puede evaluarse intraoperatoriamente mediante la realización de una cisternografía de contraste bajo guía fluoroscópica, es decir, llenando la cueva del trigémino con un agente de contraste radiopaco hasta que se observe el desbordamiento de la cisterna del trigémino en la cavidad craneal. Allí, el volumen promedio reportado de la cisterna del trigémino es de 0,25 mL, y rara vez supera los 0,4 mL (13).
En el presente estudio, el volumen promedio total del espacio subaracnoideo equino dentro de la cueva del trigémino fue de 0,34 mL. En estudios experimentales y clínicos que informaron sobre procedimientos de rizotomía de glicerol en caballos, se inyectó un volumen de 1,6 a 1,9 mL de glicerol (14, 15). De acuerdo con los resultados del presente estudio, este volumen inyectado probablemente excede la capacidad de la cueva del trigémino en el caballo. Curiosamente, el volumen de la cueva del trigémino en caballos y en humanos es comparable. El área inervada por el nervio trigémino es más ancha en los caballos, por lo que el número de fascículos nerviosos es mayor, lo que resulta en una sección transversal más grande del ganglio trigémino. De hecho, Newton contó alrededor de 500 fascículos nerviosos y una media de aproximadamente 1,5 millones de fibras en la raíz equina normal del trigémino (4), mientras que alrededor de 50 fascículos nerviosos y 150.000 fibras se contaron en la raíz del trigémino en los seres humanos (21, 22).
La anatomía de la cueva del trigémino ya ha sido estudiada en otras especies animales. Kanpolat estableció un abordaje percutáneo del ganglio trigémino en perros comparable a la técnica quirúrgica en humanos (23) en base a la cual se examinó histopatológicamente el ganglio trigémino tras la inyección de 0,15 mL de glicerol en el ganglio trigémino (24). Curiosamente, Isik et al. informaron que no existe un espacio subaracnoideo alrededor del ganglio trigémino en los perros (24). En contraposición a esto, Santifort et al. describieron leptomeninges y un espacio subaracnoideo alrededor de las raíces nerviosas del trigémino y el ganglio del trigémino en perros comparable a la cueva del trigémino en humanos (25). A pesar de que la cueva del trigémino en los perros era sutil, también sospechaban de la variabilidad individual en la morfología de la cueva del trigémino canino (25). Sin embargo, en estos estudios, no se han realizado mediciones volumétricas de la cueva del trigémino (23-25). Lunsford et al. inyectaron glicerol en la cisterna del trigémino de gatos para investigar los efectos electrofisiológicos e histopatológicos del glicerol. Sobre la base de la evaluación macroscópica del tamaño y la ubicación del ganglio y el nervio del trigémino, seleccionaron un volumen de 0,05 mL de glicerol, pero no evaluaron la morfología del ganglio del trigémino y una cueva del trigémino a nivel microscópico (26). Más recientemente, Herta et al. llevaron a cabo un estudio anatómico en conejos para proporcionar pautas para las operaciones percutáneas en el ganglio trigémino en esta especie como modelo animal para la investigación en humanos (27). Describieron la presencia de una cisterna cerrada de trigémino a la que se le inyectaron 0,5 mL de glicerol. Sin embargo, observaron un flujo de salida del agente de contraste hacia la fosa posterior y fuera de la cánula inyectora al realizar la cisternografía de contraste con este volumen, lo que sugiere que se deben inyectar cantidades más pequeñas de glicerol en conejos (27).
En las microtomografías computarizadas de la cueva del trigémino de nuestro estudio, el agente de contraste se distribuyó en 7/12 muestras a lo largo de las caras proximales de los nervios periféricos, principalmente a lo largo del nervio mandibular. En consecuencia, se pudo observar una continuidad entre el agente de contraste en la cisterna del trigémino y alrededor de los nervios periféricos. En las imágenes de resonancia magnética no se observó acumulación de líquido cefalorraquídeo alrededor de los nervios periféricos. Por lo tanto, se podría argumentar que la distribución del agente de contraste a lo largo de los nervios periféricos fue causada por una presión excesiva aplicada al inyectar el polímero, posiblemente creando un agrandamiento artificial del espacio subaracnoideo alrededor de las divisiones del trigémino. Sin embargo, el porus trigeminus representa el camino de menor resistencia para el polímero, lo que explica el reflujo que se produce durante el proceso de inyección y disminuye la probabilidad de una presión excesiva en la cavidad del trigémino durante la inyección.
La explicación más probable para la distribución del agente de contraste alrededor de los nervios periféricos radica en la arquitectura meníngea específica de la cueva del trigémino de los caballos. En los seres humanos, las vainas periféricas de las tres divisiones del trigémino son una continuación directa de la pared meníngea de la cueva del trigémino (28, 29). Extracranealmente, las vainas durales de las tres divisiones se fusionan con el epineuro (28). La cueva del trigémino y la vaina dural de los nervios periféricos están separadas por un área cribiforme, una membrana porosa a través de la cual pasan las raicillas nerviosas (28, 29). Curiosamente, la raíz motora de la división mandibular entra en una vaina separada en la pared inferior de la cueva del trigémino, desde donde converge con la vaina dural periférica del nervio mandibular (28). En caballos, se han realizado evaluaciones histológicas del ganglio trigémino en varios estudios. Sin embargo, la arquitectura meníngea microanatómica de la cueva del trigémino y de sus nervios ramificados aún no se ha investigado a fondo (4, 14, 30, 31). Los hallazgos histológicos de este estudio apoyan la presencia de un área cribiforme, lo que podría explicar la distribución del agente de contraste alrededor del nervio periférico. La raíz motora del nervio trigémino también parecía emerger de la cueva del trigémino hacia la periferia en una vaina dural separada en los caballos (Figura 8). Sin embargo, el tamaño de la muestra histológica fue demasiado pequeño para una descripción precisa del curso de la raíz motora y, por lo tanto, amerita una investigación más profunda.
La distribución del agente de contraste alrededor de las raiclas de los nervios periféricos puede ser clínicamente relevante cuando se intenta una rizotomía de glicerol. Hasta donde saben los autores, aún no se ha reportado una distribución periférica de glicerol después de la inyección en la cueva del trigémino en humanos. También se sabe poco sobre el modo de acción y la degradación del glicerol, pero es probable que la salida de glicerol ocurra de la misma manera que el líquido cefalorraquídeo. Sobre la base de los resultados del presente estudio, se puede esperar una acumulación de glicerol alrededor de los nervios periféricos, lo que podría conducir a una mayor duración de la acción sobre las células nerviosas. En el caso de los nervios puramente sensoriales de las divisiones oftálmica y maxilar, esto puede ser deseable, ya que posiblemente podría conducir a un mayor efecto citotóxico y, por lo tanto, a un mejor resultado del tratamiento. Sin embargo, el efecto de un contacto prolongado entre el glicerol y el nervio mandibular, que contiene la raíz motora (Figura 1) responsable de la función masticatoria (es decir, inervar los músculos masetero, temporal y pterigoideo) aún no se ha dilucidado. Cuando se inyecta glicerol en la cisterna del trigémino, aún podría producirse contacto entre el glicerol y el nervio mandibular y su raíz motora. En humanos, la disfunción masticatoria ocurrió como complicación después de la rizotomía del trigémino por radiofrecuencia en el 4,1% de los pacientes en un estudio (32), y después de la compresión con balón (en el 7% de los pacientes), pero no después de la rizotomía de glicerol (33, 34). Winter et al. no observaron disfunción masticatoria en los ocho caballos sometidos a inyección percutánea de glicerol en el ganglio del trigémino (14). Sin embargo, en este estudio, la precisión de la colocación de la aguja inyectable se controló en la TC y no en las imágenes de RM. Por lo tanto, no se pudo determinar si la punta de la aguja estaba colocada en la cisterna del trigémino, y que se produjo una acumulación de glicerol dentro de la cisterna del trigémino y posiblemente una distribución alrededor del nervio mandibular. En consecuencia, se requiere más investigación para determinar si el glicerol induciría disfunción masticatoria cuando se inyecta en la cisterna del trigémino en un entorno clínico.
Sin embargo, los resultados presentados en este estudio muestran que existe un espacio subaracnoideo que forma una cisterna en la cueva del trigémino y que podría ser el objetivo de un procedimiento de rizotomía de glicerol en el caballo. La cisterna del trigémino se localiza dorsal al borde lateral del foramen lacerum, directamente rostral al meato acústico interno. Esto significa que la mayor acumulación de líquido dentro de la cisterna del trigémino se encuentra en el aspecto axial de la cueva del trigémino y en el tejido ganglionar remoto a denso. Además, se podía llegar a esta parte de la cisterna del trigémino a través del foramen lacerum mediante un abordaje percutáneo directo.
Una limitación del presente estudio es inherente a su naturaleza cadavérica experimental. La cisternografía de contraste se realizó en cabezas de cadáveres frescos, desarticuladas en la articulación atlanto-occipital y después de la extracción de la pantorrilla. La pérdida resultante de la presión intracraneal fisiológica, combinada con el colapso del espacio subaracnoideo debido a la salida de LCR, podría haber causado la penetración inadvertida del aracnoideo durante la inyección del agente de contraste en dos especímenes, en los que la acumulación de agente de contraste dentro de la cueva del trigémino estaba mal definida y distribuida en las estructuras de los tejidos blandos circundantes. Para minimizar el riesgo de penetración inadvertida, la punta de la aguja hipodérmica de 25G se desafiló y se dobló ligeramente para seguir el contorno del ganglio trigémino. En caballos vivos, una presión intracraneal fisiológica y un espacio subaracnoideo no colapsado y lleno de LCR podrían dar lugar a un mayor volumen de LCR dentro de la cueva del trigémino, facilitando así la inyección y evitando la salida temprana de glicerol hacia la fosa posterior.
Para garantizar la sustitución completa del líquido cefalorraquídeo por el agente de contraste a base de polímeros durante la inyección, las cabezas de los cadáveres se mantuvieron en una posición inclinada, asegurando que la cueva del trigémino estuviera lo más orientada verticalmente posible mientras que el porus trigeminus permanecía horizontal. Como el agente de contraste inyectado tiene una densidad más alta que el líquido cefalorraquídeo y es hidrofóbico, se acumula progresivamente en la cueva del trigémino y expulsa el líquido cefalorraquídeo fuera de la cueva del trigémino hacia la fosa posterior. Además, la orientación vertical de la cavidad del trigémino durante la inyección evitó la salida inadvertida del agente de contraste durante la solidificación del polímero. Sin embargo, la orientación de la cabeza solo se basó en observaciones empíricas durante los ensayos cadavéricos preliminares, y no se evaluó el efecto de otras orientaciones de la cabeza en el patrón de distribución y en la evaluación volumétrica del agente de contraste. Además, la inclusión de cabezas de cadáver de diferentes razas, con conformaciones ligeramente variables, impidió exactamente la misma posición durante cada inyección. Esto podría haber resultado en un flujo temprano del agente de contraste de la cueva del trigémino y residuos de LCR dentro de la cueva del trigémino, induciendo así una subestimación de la medición volumétrica microtomográfica de la cueva del trigémino. Esta subestimación podría haber sido potenciada por el atrapamiento de burbujas de aire dentro del agente de contraste, que ocasionalmente se detectaron dentro de la cisterna del trigémino en cortes microtomográficos.
Otras limitaciones de este estudio incluyen el pequeño tamaño de la muestra y la heterogeneidad de los especímenes cadavéricos. Aunque todos los caballos incluidos eran adultos y de tamaño y peso comparables, no se pueden descartar variaciones anatómicas específicas de la raza con respecto a la forma y el tamaño de la cueva del trigémino. Además, no se puede proporcionar información sobre el volumen de la cueva del trigémino en ponis, razas de caballos de tiro u otros équidos. Se necesitan estudios adicionales para evaluar las diferencias entre las razas e investigar si existe una correlación entre el tamaño del caballo y el volumen de la cueva del trigémino. La primera cabeza de cadáver se almacenó congelada después del estudio de resonancia magnética. Sin embargo, dado que el proceso de congelación y descongelación podía perjudicar la evaluación histológica de las meninges, las cabezas posteriores se sometieron a todos los procedimientos descritos anteriormente inmediatamente después de la RMN. No se observaron diferencias en el tamaño, el volumen o la distribución del contraste en la cabeza congelada en comparación con las cabezas de cadáver posteriores.
En conclusión, a pesar de varias décadas de investigación sobre el movimiento de la cabeza mediado por el trigémino, todavía no existe un tratamiento seguro y eficaz para los équidos que padecen esta dolorosa afección. El desarrollo de nuevas opciones terapéuticas es crucial para ayudar a los caballos más gravemente afectados, especialmente aquellos que son refractarios al tratamiento médico. Este estudio anatómico es la primera descripción detallada de la cueva equina del trigémino y sus límites, y por lo tanto una base importante para el desarrollo de una técnica de rizotomía controlada y confiable en caballos. Se necesitan más estudios para evaluar la idoneidad de la cueva equina del trigémino como estructura objetivo principal para la rizotomía con glicerol.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración de ética
No se requirió aprobación ética para los estudios con animales de acuerdo con la legislación local y los requisitos institucionales porque esta investigación se realizó en partes de cadáveres de animales sacrificados o sacrificados por razones no relacionadas con este estudio y, por lo tanto, exentos de revisión ética de acuerdo con las directrices del Kanton de Berna, Suiza. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
RB: Conceptualización, Investigación, Metodología, Visualización, Escritura – borrador original. KH: Conceptualización, Metodología, Supervisión, Redacción – revisión y edición. CP: Conceptualización, Metodología, Redacción – revisión y edición. O-ZK: Metodología, Redacción – revisión y edición. RH: Metodología, Redacción – revisión y edición. CK: Conceptualización, Escritura – revisión y edición. SK: Conceptualización, Supervisión, Redacción – revisión y edición. MP: Conceptualización, Investigación, Metodología, Supervisión, Redacción – Revisión y Edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Los autores desean agradecer a los radiólogos de la División de Radiología Clínica de la Facultad de Vetsuisse de la Universidad de Berna, S. Petit, N. Pfister y C. Stettler por su ayuda en la adquisición de resonancias magnéticas, y a A. Glarner, G. Vorburger y V. Gaschen por preparar las muestras anatómicas e histológicas. Los autores también desean agradecer a Jonathan Hudlet por su ayuda en la creación del gráfico esquemático de la cueva del trigémino. RB también quiere dar las gracias a todo el equipo del Instituto Suizo de Medicina Equina.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1424890/full#supplementary-material
Referencias
1. Lane, JG, y Mair, TS. Observaciones sobre el movimiento de la cabeza en el caballo. Veterinario Equino J. (1987) 19:331–6. doi: 10.1111/j.2042-3306.1987.tb01424.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Pickles, K, Madigan, J y Alemán, M. Sacudida de cabeza idiopática: ¿sigue siendo idiopática? Veterinario J. (2014) 201:21–30. doi: 10.1016/j.tvjl.2014.03.031
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Alemán, M, Williams, DC, Brosnan, RJ, Nieto, JE, Pickles, KJ, Berger, J, et al. Conducción nerviosa sensorial y potenciales evocados somatosensoriales del nervio trigémino en caballos con sacudida de cabeza idiopática. J Veterinario Pasante Med. (2013) 27:1571–80. doi: 10.1111/jvim.12191
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Newton, S.A. Anatomía funcional del nervio trigémino del caballo Universidad de Liverpool (2001) Disponible en: https://ethos.bl.uk/OrderDetails.do?uin=uk.bl.ethos.505576.
5. Jones, MR, Urits, I, Ehrhardt, KP, Cefalu, JN, Kendrick, JB, Park, DJ, et al. Una revisión exhaustiva de la neuralgia del trigémino. Curr Dolor de cabeza Rep. (2019) 23:74. doi: 10.1007/s11916-019-0810-0
6. Youssef, S, Kim, E-Y, Aziz, KMA, Hemida, S, Keller, JT y van Loveren, HR. El abordaje interdural subtemporal de los schwannomas trigéminos en forma de mancuerna: prosección cadavérica. Neurocirugía. (2006) 59:ONS270-7; discusión ONS277-8. doi: 10.1227/01.NEU.0000227590.70254.02
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Bernard, F, Mercier, P y Sindou, M. Anatomía morfológica y funcional del plexo triangular del trigémino como entidad anatómica: una revisión sistemática. Surg Radiol Anat. (2019) 41:625–37. doi: 10.1007/s00276-019-02217-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Meckel, JF. Tractatus anatomico physiologicus de quinto pare nervorum cerebri. Göttingae: Apud Abram Vanden – hoeck, Acad Typogr, (Tesis) (Göttingae, Alemania: Abram Vandenhoeck) (1748).
9. Ferner, H. Zur Anatomie der intrakranialen Abschnitte des nervus trigeminus. Z anat entwicklungsgesch. (1948) 114:108–22. doi: 10.1007/BF00523558
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Janjua, RM, Al-Mefty, O, Densler, DW y Shields, CB. Relaciones durales de la cueva de Meckel y pared lateral del seno cavernoso. Enfoque Neurosurgido. (2008) 25:E2. doi: 10-3171/FOC.2008.25.12.E2
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Liu, G. El nervio trigémino y sus conexiones centrales En: NR Miller y NJ Newman, editores. Neurooftalmología clínica de Walsh y Hoyt. Filadelfia: Lippincott Williams y Wilkins (2005). 1233–51.
12. Håkanson, S. Neuralgia del trigémino tratada mediante la inyección de glicerol en la cisterna del trigémino. Neurocirugía. (1981) 9:638–41. doi: 10.1227/00006123-198112000-00005
13. Kondziolka, D, y Lunsford, LD. Rizotomía percutánea de glicerol retrogasseriano para la neuralgia del trigémino: técnica y expectativas. Enfoque Neurosurgido. (2005) 18:E7–4. doi: 10-3171/foc.2005.18.5.8
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Winter, JC, Haist, V, y Feige, K. Examen de la eficacia de una inyección de glicerol en el nervio trigémino como base para el tratamiento del movimiento de la cabeza en el caballo. Pferdeheilkunde. (2014) 30:252–62. doi: 10.21836/pem20140301
15. Uhlendorf, F, Müller, JMV, Winter, JC y Feige, K. Tratamiento del temblor de cabeza idiopático con una inyección de glicerol en el ganglio del trigémino en una yegua de sangre caliente de 5 años. Pferdeheilkunde. (2011) 27:585–8. doi: 10.21836/pem20110602
16. Newton, SA, Knottenbelt, DC, y Eldridge, PR. Sacudida de cabeza en caballos: posible etiopatogenia sugerida por los resultados de las pruebas diagnósticas y varios regímenes de tratamiento utilizados en 20 casos. Veterinario Equino J. (2000) 32:208–16. doi: 10.2746/042516400776563617
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Wickham, H. Primeros pasos con ggplot 2 En: H Wickham, editor. ggplot2: Gráficos elegantes para el análisis de datos. Cham: Springer International Publishing (2016). 11–31.
18. Joo, W, Yoshioka, F, Funaki, T, Mizokami, K y Rhoton, AL Jr. Anatomía microquirúrgica del nervio trigémino. Clin Anat. (2014) 27:61–88. doi: 10.1002/ca.22330
19. Bond, JD, Xu, Z, Zhang, H y Zhang, La cueva de Meckel y la somatotopía del ganglio del trigémino. Neurocirugía Mundial. (2021) 148:178–87. doi: 10.1016/j.wneu.2021.01.081
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Cheng, R, Wang, T, Cai, Y, Chai, S, Shen, L, Xu, D, et al. La consistencia entre la cueva de Meckel preoperatoria reconstruida en 3D y el balón intraoperatorio da como resultado una compresión percutánea con balón. J Dolor Res. (2023) 16:2929–37. doi: 10.2147/JPR. S420283
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Ziyal, IM, Sekhar, LN, Özgen, T, Söylemezoğlu, F, Alper, M, y Beşer, M. El nervio trigémino y el ganglio: un estudio anatómico, histológico y radiológico que aborda el abordaje transtrigémino. Surg Neurol. (2004) 61:564–73. doi: 10.1016/j.surneu.2003.07.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Jannetta, PJ. Descripción macroscópica (mesoscópica) del nervio trigémino y el ganglio humano. J Neurocirugía. (1967) 26:109–11. doi: 10.3171/jns.1967.26.1part2.0109
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Kanpolat, Y. Abordaje percutáneo del ganglio trigémino en perros. J Métodos Neurosci. (1979) 1:375–81. doi: 10.1016/0165-0270(79)90026-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Işik, N, Pamir, MN, Benli, K, Erbengi, A, Erbengi, T y Ruacan, S. Inyección experimental de glicerol trigémino en perros: evaluación histopatológica por microscopía óptica y electrónica. Stereotact Funct Neurosurg. (2002) 79:94–106. doi: 10.1159/000070105
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Santifort, KM, Glass, EN, Pumarola, M, y Aige, GV. Hallazgos microanatómicos con relevancia para el realce del ganglio trigémino en imágenes de resonancia magnética ponderada en T1 post-contraste en perros. Veterinario delantero Sci. (2023) 10:1256947. doi: 10.3389/fvets.2023.1256947
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Lunsford, LD, Bennett, MH, y Martínez, AJ. Inyección experimental de glicerol trigémino. Efectos electrofisiol, morphol, arco neurol. (1985) 42:146–9. doi: 10.1001/archneur.1985.04060020060016
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Herta, J, Wang, W-T, Höftberger, R, Breit, S, Kneissl, S, Bergmeister, H, et al. Modelo animal experimental para procedimientos percutáneos utilizados en la neuralgia del trigémino. Acta Neurochir. (2017) 159:1341–8. doi: 10.1007/s00701-017-3162-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Li, Y, Zhang, X-A y Qi, S. Características anatómicas de la vaina dural del nervio trigémino. Cabeza, Cuello. (2016) 38:E185-8. doi: 10.1002/hed.23968
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Wysiadecki, G, Tubbs, RS, Iwanaga, J, Radek, M, Walocha, J, Brzeziński, P, et al. Estudio microanatómico de las granulaciones aracnoideas y de la arquitectura meníngea alrededor de la cueva de Meckel. Neurosurg Rev. (2023) 46:50. doi: 10.1007/s10143-023-01954-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Roberts, VL, Fews, D, McNamara, JM y Love, S. Desmielinización de la raíz nerviosa del trigémino no observada en seis caballos diagnosticados con sacudida de cabeza mediada por el trigémino. Veterinario delantero Sci. (2017) 4:72. doi: 10.3389/fvets.2017.00072
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Beltrán, E, Grundon, R, Stewart, J, Biggi, M, Holloway, A y Freeman, C. Diagnóstico por imágenes: neuritis unilateral del trigémino que imita el tumor de la vaina del nervio periférico en un caballo. Ecografía Radiol Veterinaria. (2016) 57:E1–4. doi: 10.1111/vru.12272
32. Kanpolat, Y, Savas, A, Bekar, A, y Berk, C. Rizotomía percutánea controlada por radiofrecuencia del trigémino para el tratamiento de la neuralgia idiopática del trigémino: experiencia de 25 años con 1600 pacientes. Neurocirugía. (2001) 48:524–34. doi: 10.1097/00006123-200103000-00013
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Kouzounias, K, Lind, G, Schechtmann, G, Winter, J y Linderoth, B. Comparación de la compresión percutánea con balón y la rizotomía de glicerol para el tratamiento de la neuralgia del trigémino. J Neurocirugía. (2010) 113:486–92. doi: 10.3171/2010.1.JNS091106
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Bender, M, Pradilla, G, Batra, S, See, A, Bhutiani, N, James, C, et al. Efectividad de la rizotomía repetida de glicerol en el tratamiento de la neuralgia del trigémino recurrente. Neurocirugía. (2012) 70:1125–34. doi: 10.1227/NEU.0b013e31823f5eb6
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: sacudida de cabeza mediada por trigémino, cueva del trigémino, cueva de Meckel, tomografía por resonancia magnética, cisternografía con contraste, microtomografía, histología, rizotomía
Cita: Becker R, Haenssgen K, Precht C, Khoma O-Z, Hlushchuk R, Koch C, Kaessmeyer S y de Preux M (2024) Un estudio anatómico del espacio subaracnoideo que rodea el ganglio trigémino en caballos, en preparación para una rizotomía controlada de glicerol en équidos. Frente. Vet. Sci. 11:1424890. doi: 10.3389/fvets.2024.1424890
Recibido: 28 de abril de 2024; Aceptado: 08 de julio de 2024;
Publicado: 18 de julio de 2024.
Editado por:
Alonso Guedes, Universidad de Minnesota Twin Cities, Estados Unidos
Revisado por:
Santosh K. Mishra, Universidad Estatal de Carolina del Norte, Estados
Unidos Jean-Marie Graïc, Universidad de Padua, Italia
Derechos de autor © 2024 Becker, Haenssgen, Precht, Khoma, Hlushchuk, Koch, Kaessmeyer y de Preux. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Richard Becker, richard.becker@rubecker.de; Mathieu de Preux, mathieu.depreux@unibe.ch
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía