Estudios de seguridad multinivel del ingrediente Anti Fel d 1 IgY en alimentos para gatos
 Ray A. Matulka1*
Ray A. Matulka1* Larry Thompson2
Larry Thompson2 David Corley2
David Corley2- 1Burdock Group Consultants, Orlando, FL, Estados Unidos
- número arábigoNestlé Purina PetCare Global Resources, Inc., St. Louis, MO, Estados Unidos
Los pollos expuestos a antígenos producen anticuerpos IgY, de estructura similar a la IgG de los mamíferos. Las gallinas expuestas a un alérgeno producido por los gatos (Fel d 1) dan lugar a la producción de IgY específica anti-Fel d 1 (AFD1), que se concentra de forma natural en la yema de huevo. Se evaluó la seguridad de un ingrediente de un producto de huevo de gallina que contenía AFD1 en un estudio de tolerancia aleatorizado, controlado y ciego de 26 semanas en gatos e in vitro para detectar efectos mutagénicos y genotóxicos. El estudio in vivo se llevó a cabo con grupos alimentados con croquetas que contenían 0, 7, 39 o 66 ppm de AFD1. Los parámetros examinados fueron: observaciones clínicas, peso corporal, consumo de alimentos, química sérica, hematología, coagulación sanguínea, análisis de orina y controles de mortalidad y morbilidad. Se evaluaron los posibles efectos mutagénicos de AFD1 utilizando el ensayo de mutación inversa bacteriana a concentraciones de hasta 2,78 ppm y las posibles aberraciones cromosómicas estructurales de hasta 3 ppm utilizando linfocitos de sangre periférica humana (HPBL). Después de 6 meses de alimentación a los gatos, no hubo diferencias significativas entre los grupos de control y ninguno de los grupos de prueba en ninguno de los parámetros analizados. No se observaron aumentos significativos de mutaciones o aberraciones cromosómicas en las pruebas con o sin activación metabólica (S9). Estos estudios muestran que AFD1 fue bien tolerado en gatos a niveles probados y no induce aberraciones mutagénicas o cromosómicas en las condiciones del estudio.
Introducción
La tenencia de mascotas se ha mantenido estable o ha aumentado en los Estados Unidos y en todo el mundo, y los gatos son la segunda mascota doméstica más frecuente. Sin embargo, la sensibilización a los alérgenos de los gatos se estima en ~12,1% de la población de 6 años o más (1). El principal alérgeno de los gatos es la secretoglobina Fel d 1, una proteína de función desconocida producida por la piel y por las glándulas salivales y lagrimales de los gatos (2-5). El Fel d 1 producido en la saliva se distribuye en el pelo del gato a través del aseo y se dispersa en el medio ambiente en el pelo mudado y la caspa (células secas de la piel).
La industria de alimentos para mascotas se centra en la salud y el bienestar de las mascotas y su relación con sus dueños, desarrollando formas innovadoras para que las personas y sus mascotas vivan una vida mejor. Por ejemplo, el pollo (Gallus gallus domesticus) se ha criado para obtener carne y huevos durante al menos 3.000 años (6), pero solo recientemente se han identificado y probado componentes del huevo que benefician a los gatos y otros animales.
El huevo es un ingrediente único y complejo del alimento que contiene los nutrientes necesarios para apoyar la vida temprana del pollo, incluidas las proteínas de anticuerpos de inmunoglobulina (Ig) y (IgY) inmunológicamente activas (7, 8). Se ha desarrollado un ingrediente para su uso en alimentos para gatos que contiene anticuerpos IgY dirigidos contra el antígeno Fel d 1 (AFD1). El ingrediente se recubre sobre la comida seca para gatos y, a medida que la comida se mastica y se come, el AFD1 se une a múltiples epítopos de Fel d 1 en la saliva del gato. A continuación, el Fel d 1 unido y neutralizado se extiende al pelo del gato a través del aseo y se libera en el medio ambiente. Mientras que Fel d 1 activo, no unido, es un alérgeno potente, Fel d 1 unido a AFD1 es incapaz de unirse a la IgE y no es reconocido como alérgeno por el ser humano sensibilizado. Este nuevo enfoque para reducir la exposición alergénica a Fel d 1 mediante el uso de AFD1 se evaluó recientemente en un período de alimentación de 10 semanas en el que los gatos consumieron un alimento que contenía el ingrediente anti-Fel d 1 que contiene IgY, AFD1 (9). El consumo de AFD1 redujo significativamente el Fel d 1 activo en el pelo del gato, siendo los gatos los que produjeron la mayor cantidad de Fel d 1 demostrando la mayor disminución de Fel d 1 en el pelo.
Las gallinas producen naturalmente IgY en respuesta a la exposición a antígenos en su entorno, y todos los ovoproductos contienen IgY (7). El ingrediente AFD1 pertenece a una categoría única: mientras que los productos de huevo que contienen IgY se han incluido con frecuencia en las dietas de los gatos durante muchos años, un producto de yema de huevo producido comercialmente que contiene anticuerpos dirigidos contra la proteína Fel d 1 no se ha comercializado anteriormente y actualmente se desconoce el efecto diario de la unión a la proteína Fel d 1 secretada. Los ingredientes nuevos o los ingredientes con propiedades novedosas deben someterse a una rigurosa evaluación de seguridad en las condiciones de uso previstas antes de su comercialización como alimento para animales de compañía (10). Con este fin, se realizaron estudios para garantizar la seguridad de AFD1 para su uso en alimentos para gatos. En este artículo se presentan los resultados de un estudio de tolerancia multinivel de 26 semanas en gatos y la evaluación del potencial de genotoxicidad del ingrediente utilizando métodos estándar in vitro.
Materiales y métodos
Pruebe el ingrediente de alimentación
Nestlé Purina PetCare Global Resources, Inc. proporcionó un ingrediente de ovoproducto que contiene inmunoglobulinas IgY específicas para el antígeno Fel d 1. El ingrediente del producto de huevo es un polvo de yema de huevo procesado granular de color blanquecino con un máximo del 5% de humedad, más del 28% de proteína y un máximo del 7% de cenizas, que proporciona al menos 1,000 partes por millón (ppm) de Anti-fel d1 IgY.
Productos químicos y materiales
El ensayo de mutación inversa bacteriana utilizó 2-aminoantraceno (2-AA), 2-nitrofluoreno (2-NF), azida de sodio (SA), 9-aminoacridina (9-AAD), metanosulfonato de metilo (MMS), dimetilsulfóxido (DMSO) y agua obtenida de Sigma-Aldrich (Saint Louis, MO). La mezcla de activación metabólica S9 de hígado de rata inducida por Aroclor 1254 se compró a MolTox® (Boone, NC). Los componentes de los medios utilizados para este ensayo incluyeron D-biotina, L-histidina (0,5 mM), agar selecto BBL y L-triptófano, agar y caldo de nutrientes Oxoid No. 2 y agar superior personalizado (todos de MolTox®). El vehículo de control fue agua biorreactiva filtrada estéril (Sigma-Aldrich, St. Louis, MO).
En el ensayo de aberración cromosómica de linfocitos de sangre periférica humana (HPBL) se utilizó agua (Ricerca BioSciences; Concord, OH), mitomicina C (MMC) (Sigma-Aldrich), ciclofosfamida (CP) (Sigma-Aldrich) y agua destilada estéril para dilución (Thermo Fisher Scientific; Waltham, MA).
Dieta Felina
Antes de la aleatorización para el uso en el estudio, los gatos pasaron de una dieta estándar de laboratorio 1 a una dieta comercial de pollo y arroz para gatos secos para adultos de acuerdo con una directiva veterinaria. Cuatro dietas de prueba fueron producidas por Nestlé Purina PetCare Global Resources, Inc. El ingrediente AFD1 se mezcló con un sistema de saborizantes y luego se aplicó a la dieta de control que proporcionó AFD1 a niveles de 0 ppm (control), 7 ppm, 39 ppm, 66 ppm, respectivamente. A partir del día 1, todos los gatos fueron alimentados con su dieta asignada en las cantidades necesarias para satisfacer su requerimiento diario de energía, determinado por el uso de su peso corporal más reciente.
Gatos y organismos
Se utilizaron cepas de prueba de Salmonella typhimurium (derivada de los cultivos del Dr. Bruce Ames) y Escherichia coli (de la Colección Nacional de Bacterias Industriales y Marinas, Aberdeen, Escocia) en el ensayo de mutación inversa bacteriana realizado en BioReliance (Rockville, MD). En el ensayo de aberración cromosómica se utilizó HPBL obtenido de un varón humano sano no fumador (30 años de edad).
El estudio dietético utilizó un grupo de 42 gatos domésticos adultos sanos, compuesto por 21 machos y 21 hembras. Los gatos tenían entre 1 y 3 años de edad al inicio del estudio, con pesos corporales que oscilaban entre los 2,4 y los 6,1 kg. Los machos fueron castrados y las hembras estaban intactas, nulíparas y no preñadas. A los gatos se les asignó un número de identificación único antes de la aleatorización que se utilizó para identificar todos los registros y especímenes derivados de cada gato. Antes del inicio del estudio, los gatos fueron vacunados al menos una vez contra la rabia y al menos dos veces (con tres semanas de diferencia o más) con vacunas contra la rinotraqueítis felina, el calicivirus, la panleucopenia y la Chlamydia psittaci. Los gatos no habían recibido ningún medicamento, excepto las vacunas, dentro de los 30 días posteriores al día 1 del estudio.
Diseño Experimental
Ensayos de mutación inversa bacteriana
El ensayo de mutación inversa bacteriana se utilizó para evaluar la capacidad de la AFD1 para inducir mutaciones puntuales en cinco cepas de Salmonella typhimurium y una cepa de Escherichia coli (WP2 uvrA), tanto en presencia como en ausencia de un sistema de activación metabólica exógeno S9, de acuerdo con protocolos estándar (OECD 471). El ensayo se realizó bajo las Buenas Prácticas de Laboratorio (cGLP) vigentes de acuerdo con el Capítulo 21 del Código de Regulaciones Federales (CFR) Sección 58 (GLP para estudios de laboratorio no clínicos) y siguió la guía 471 de la Organización para la Cooperación y el Desarrollo Económicos (OCDE) (julio de 1997).
El ensayo bacteriano se llevó a cabo en dos fases: un ensayo inicial de citotoxicidad-mutación que indicó un rango de concentración para el ensayo de confirmación, y un ensayo de mutagenicidad confirmatorio posterior que utilizó las cepas de prueba de S. typhimurium TA98, TA100, TA1535 y TA1537 (Discovery Partners International, San Diego, CA) y la cepa de prueba de E. coli WP2 uvrA (Colección Nacional de Bacterias Industriales y Marinas, Aberdeen, Escocia) para determinar el potencial de mutación inducida por el producto AFD1. Para el estudio de toxicidad inicial, se prepararon concentraciones de AFD1 a 0,00083, 0,00278, 0,0083, 0,0278, 0,083, 0,278, 0,83, 2,78 ppm en agua, el control del vehículo. La parte confirmatoria del ensayo involucró el vehículo, el control positivo y los niveles de concentración de 0,0278, 0,083, 0,278, 0,83, 2,78 ppm AFD1 aplicados a cada cepa del probador por triplicado. Los controles positivos sin activación de S9 fueron 2-NF para TA98, SA para TA100 y TA1535, 9-AAD para TA1537 y MMS para WP2 urvA. El control positivo con activación de S9 fue 2-AA para todas las cepas de bacterias.
Las placas se prepararon mediante la adición de 0,1 ml de suspensión bacteriana (≥0,3 × 109 células/ml en la fase logarítmica tardía), se añadieron 0,1 ml de dilución de ingredientes para vehículos o piensos de prueba y 0,5 ml de S9 o mezcla simulada a 2,0 ml de agar superior selectivo fundido a 45 ± 2 °C. La alícuota del ingrediente del pienso problema se sustituyó por 0,05 ml del control positivo adecuado, cuando fue necesario.
Todas las placas se marcaron con un microscopio de disección para determinar la condición del césped de fondo bacteriano, donde una reducción o ausencia del césped indica la toxicidad de los ingredientes del alimento de prueba. El precipitado se evaluó visualmente después del período de incubación. La toxicidad y el grado de precipitación se puntuaron en relación con las placas incubadas en el vehículo de control.
Para cada placa replicada, se calculó y reportó la media y la desviación estándar del número de revertantes por placa. Para que se considere positivo para la mutagenicidad, el ingrediente del pienso ensayo que contenga AFD1 deberá provocar un aumento de la media de revertentes por placa de al menos una cepa del ensayo durante un mínimo de dos concentraciones crecientes (≥3 veces el valor medio de control del vehículo para las cepas TA1535 y TA1537, y ≥2 veces el valor medio del testigo del vehículo para las cepas TA98, TA100, y WP2 uvrA, y por encima del rango de control aceptable del vehículo correspondiente para las cepas ensayadas). Una respuesta equívoca es un aumento biológicamente relevante en el recuento de reversibles que solo cumple parcialmente los criterios para una respuesta positiva. Se determinó que una respuesta era negativa si no era ni positiva ni equívoca.
Ensayo de aberración cromosómica
El ensayo de aberración cromosómica in vitro en mamíferos se utilizó para detectar aberraciones cromosómicas estructurales mediante la exposición de HPBL al producto AFD1, así como a controles positivos y vehiculares concurrentes, en presencia y ausencia de un sistema de activación metabólica exógeno. El ensayo se realizó bajo GLP de acuerdo con 21 CFR 58 y siguió la guía 473 (11) de la Organización para la Cooperación y el Desarrollo Económicos (OCDE).
Los HPBL se trataron con sustancia problema, control de vehículo o control positivo durante 4 h en ausencia y presencia de S9, y durante 20 h en ausencia de S9. El vehículo fue agua estéril (Gibco, MA) y el control positivo para las pruebas en ausencia de S9 fue MMC y CP en presencia de S9. Inicialmente se realizó un ensayo preliminar de toxicidad, analizando nueve concentraciones de AFD1 que oscilaron entre 0,0003 y 3 ppm (la concentración límite para este ensayo). Para la toxicidad preliminar y los ensayos in vitro definitivos, se recolectaron células ~20 h después del inicio (~1,5 ciclos celulares normales) para su análisis durante la metafase de la primera división. Se añadió colcemida® 2 h antes de la recolección celular, momento en el que se recolectaron las células, se trataron con cloruro de potasio 0,075 M, se lavaron con fijador y se prepararon portaobjetos, y se tiñeron con Giemsa. Las concentraciones evaluadas en el ensayo definitivo fueron de 0,75, 1,5 y 2,25 ppm para el punto de tiempo de exposición de 4 h no activado y de 1,5, 2,25 y 3 ppm en los puntos de tiempo de exposición de 4 h activados S9 y los puntos de tiempo de exposición de 20 h no activados.
El índice mitótico se registró como el porcentaje de células en mitosis por cada 500 células contadas. Se examinaron y puntuaron un mínimo de 300 dispersiones celulares de metafase que contenían 46 centrómeros de cada concentración (150 por duplicado) para detectar aberraciones de tipo cromátida (por ejemplo, roturas de cromátidas e isocromátidas y figuras de intercambio como intercambios simétricos y asimétricos, triradiales y reordenamientos complejos) y de tipo cromosómico (es decir, roturas, intercambios de deleción, desintegraciones cromosómicas y brechas). AFD1 se consideraría clastogénico si al menos una de las concentraciones de prueba exhibiera un aumento estadísticamente significativo (P ≤ 0,05) y dependiente de la concentración en las aberraciones estructurales o numéricas en comparación con el control negativo concurrente, y los resultados estuvieran fuera del límite de control del 95% de los datos históricos de control negativo.
Estudio dietético felino de 26 semanas
El personal que alimentaba a los gatos, recogía las observaciones clínicas, los pesos corporales y de consumo de alimentos, los exámenes oftalmológicos, el cuidado de los gatos, la socialización y la recopilación y el análisis de patología clínica se cegaron para las tareas grupales relacionadas con los ingredientes de los piensos. El director del estudio, la gerencia, el coordinador del estudio y el personal que transfería el alimento a los contenedores no fueron cegados. El protocolo fue revisado y aprobado por un Comité Institucional de Cuidado y Uso de Animales (IACUC, por sus siglas en inglés) y se consultó a un veterinario en el diseño general del estudio.
Antes del inicio del estudio, los gatos fueron examinados para asegurar una buena salud y fueron aclimatados durante 13 días y, en general, observados para detectar cambios en la salud y el bienestar. Luego, los gatos fueron observados dos veces al día para detectar cambios registrados en la apariencia general o el comportamiento. Los gatos fueron colocados aleatoriamente en habitaciones (divididas por sexo) y alojados individualmente. La temperatura ambiente media y la humedad relativa fueron de 18-29°C y de 50 ± 20%, respectivamente, con un fotoperiodo diario de 12 h. Cada habitación mantuvo un promedio diario mínimo de 10,75 renovaciones de aire/h. Todos los gatos del estudio participaron en la socialización, que incluyó juegos grupales en la habitación de los gatos, así como interacciones con técnicos y juguetes. Cada grupo asignado de gatos fue socializado y ejercitado por separado de otros grupos.
Los gatos fueron asignados aleatoriamente a uno de cuatro grupos, cada uno compuesto por cinco machos y cinco hembras. El estudio fue aleatorizado, controlado y ciego. El estudio comenzó el día 0; El grupo 1 recibió 39 ppm, el grupo 2 recibió 0 ppm, el grupo 3 recibió 66 ppm y el grupo 4 recibió 7 ppm de AFD1 en la dieta; La parte de alimentación del estudio se llevó a cabo durante 26 semanas. Los gatos fueron alimentados inicialmente de acuerdo con los requerimientos energéticos para el peso corporal de cada gato (basado en el alimento que proporcionaba 4.102 kcal de energía/kg de dieta y las necesidades metabólicas de los gatos a 59 kcal/kg de peso corporal) y esta cantidad se incrementaba o disminuía semanalmente si el peso corporal de un gato cambiaba en un 5% o más en relación con el peso inicial. Durante el estudio, se encontró que este horario de alimentación resultó en un aumento de peso. Por lo tanto, después del día 100 del estudio, se proporcionaron cantidades de alimento a cada uno de los gatos en función de un sistema de puntuación de la condición corporal [The Nestlé Purina Body Condition System; (12)] utilizando una escala del 1 al 9 completada por el veterinario tratante al menos dos veces al mes durante el resto del estudio, de modo que los gatos mantuvieron una puntuación de condición corporal de 4 a 6.
Las observaciones diarias (que incluyen, entre otros, cambios en la piel, el cabello, los ojos, las membranas mucosas, la función respiratoria, autonómica y del sistema nervioso central, la actividad motora y el patrón de comportamiento) se completaron al menos una vez al día a partir del día de la aleatorización y se completaron observaciones clínicas detalladas por personal técnico capacitado al menos semanalmente desde el día de la aleatorización hasta el final del estudio. La consistencia de las heces se evaluó diariamente. Los pesos corporales se determinaron al menos una vez antes de la aleatorización y aproximadamente semanalmente hasta el final del estudio. Los alimentos frescos se proporcionaron una vez al día y el consumo se cuantificó diariamente desde al menos 2 semanas antes del primer día de alimentación con AFD1; Los alimentos no consumidos se midieron en gramos aproximadamente a la misma hora todos los días. El agua del grifo filtrada se proporcionó ad libitum. Las evaluaciones oftálmicas se realizaron antes del primer día de alimentación con AFD1, luego en las semanas 13 y 26.
Durante el estudio se recogieron muestras de sangre y orina para química clínica, coagulación sanguínea, hematología y análisis de orina. Después de un ayuno nocturno, se recolectó sangre (en tubos recubiertos de citrato de sodio para los parámetros de coagulación, en tubos recubiertos de K2EDTA para los parámetros hematológicos, en tubos recubiertos de heparina de litio para el análisis de taurina y para los parámetros de química clínica, la muestra se recolectó en un tubo de gel activador de coágulos) ~ 7 días antes del inicio del estudio (pero después de al menos 7 días con dieta de control), luego nuevamente en el día 100 (±3 días), y dentro de 1 semana del último día de alimentación con AFD1 (día 182). La orina se recolectó en una bandeja durante el período diurno utilizando arena no absorbente, o cuando se obtuvo una muestra inadecuada, la cama no absorbente se dejó durante la noche para su recolección a la mañana siguiente. El análisis hematológico se realizó con el sistema de hematología Advia 120, el análisis de química clínica se realizó con el sistema de química clínica Advia 1800 y el análisis de orina se realizó con el sistema Clinitek Advantus (Siemens, Malvern, PA). La coagulación sanguínea se analizó utilizando el analizador de coagulación compacto® Stago STA (Diagnostica Stago, Inc., NJ).
Se evaluaron los siguientes parámetros hematológicos: recuento total de glóbulos rojos (RBC) (eritrocitos), ancho de distribución de glóbulos rojos (RDW), hemoglobina (HGB), hematocrito (HCT), volumen corpuscular medio (VCM), hemoglobina corpuscular media (MCH), concentración media de hemoglobina corpuscular (CMCH), morfología citológica, recuento total de plaquetas, volumen plaquetario medio (VPM), ancho de distribución plaquetaria (PDW), plaquetas (PLTS), neutrófilos (NEU); ancho de distribución de hemoglobina (HDW), recuento total de glóbulos blancos (WBC; leucocitos), linfocitos (Linfa), monocitos (Mono), eosinófilos (Eosin), basófilos (Baso), frotis diferencial de sangre y recuento de reticulocitos (Retic) (absoluto y relativo). Se analizaron los parámetros tiempo de protrombina (TP), tiempo de tromboplastina parcial activada (TTA) y tiempo de tromboplastina (TT), así como los siguientes parámetros de química clínica: glucosa, nitrógeno ureico sérico, creatinina (Creat), proteína total, albúmina (ALB), globulina, relación albúmina/globulina (A/G), bilirrubina total, alanina aminotransferasa (ALT), sorbitol deshidrogenasa (SOD), fosfatasa alcalina (ALP), gamma-glutamil transferasa (GGT), aspartato aminotransferasa (AST), calcio (Calc), fósforo inorgánico (Phos), sodio (Na+), potasio (K+), cloruro (Cl–) y ácidos biliares totales. Los parámetros analizados a partir de la orina fueron: claridad, color, gravedad específica, sangre, cetonas, proteínas y examen microscópico de sedimento, urobilinógeno, bilirrubina, glucosa, pH, leucocitos y nitritos.
Análisis estadístico
Estudios de genotoxicidad
No se realizó un análisis estadístico para los resultados del ensayo de mutación inversa bacteriana, ya que los análisis estadísticos no son necesarios como parte de las directrices del protocolo OECD 471 (13).
Para el estudio de aberración cromosómica, se analizó estadísticamente una comparación por pares de la frecuencia de células aberrantes en cada grupo con el vehículo utilizando la prueba exacta de Fisher (P ≤ 0,05). También se utilizó la prueba de tendencia de Cochran-Armitage para evaluar la capacidad de respuesta dependiente de la concentración.
Estudio dietético felino de 26 semanas
Los grupos de ingredientes de los piensos de prueba se compararon con el grupo de control. Se calcularon la media y las desviaciones estándar para todos los datos cuantitativos. Los datos medios de los grupos continuos™ (p. ej., consumo de alimentos, peso corporal, patología clínica) que se examinaron estadísticamente se evaluaron para determinar la igualdad u homogeneidad de la varianza utilizando la estructura estadística del árbol de decisión de Provantis.
La estructura estadística del Árbol de Decisión incluyó análisis de varianza (ANOVA) y covarianza (ACOVA), análisis no paramétrico de la varianza, pruebas por pares mediante la prueba de Dunnett para datos paramétricos y no paramétricos, pruebas t simples y la prueba de Bartlett para homogeneidad de la varianza. Se completó una determinación de la «mejor» transformación para cada variable para el uso de análisis paramétrico o no paramétrico. También se determinó el uso de posibles covariables y la homogeneidad de medias. A continuación, se analizaron los datos para comprobar la tendencia relacionada con el nivel de AFD1 y, en caso afirmativo, el grupo de AFD1 más bajo administrado se vio afectado, basándose en el Test de Williams (datos paramétricos) o el Test de Shirley (datos no paramétricos). Si no se encontró ningún efecto de tendencia, pero los datos mostraron falta de homogeneidad de medias en la transformación anterior, entonces los datos se analizaron mediante una prueba de Dunnett escalonada (datos paramétricos) o una prueba de acero modificada (datos no paramétricos) para evaluar la diferencia significativa con el grupo de control. Se realizaron todas las pruebas por pares especificadas, utilizando la prueba t de Student (paramétrica) o mediante límites de confianza no paramétricos en las diferencias medianas (no paramétricos) entre los datos. En general, las pruebas estadísticas se realizaron como pruebas bilaterales y los resultados se tomaron como significativos con niveles de probabilidad (P) de < 0,05 o < 0,01, con la excepción de las pruebas de tendencia (Williams y Shirley), donde solo se analizó el nivel superior mediante una prueba bilateral.
Resultados y Discusión
Ensayo de mutación inversa bacteriana
El ensayo inicial de toxicidad-mutación se realizó a 0,00083, 0,00278, 0,0083, 0,0278, 0,083, 0,278, 0,83 y 2,78 ppm de AFD1 en agua, con AFD1 formando suspensiones viables de 0,75 a 75 ppm y soluciones de 0,0225 a 0,225 ppm. No se observó precipitado ni toxicidad. No se observaron respuestas mutagénicas positivas con ninguna de las cepas de prueba, ya sea en presencia o ausencia de mezcla de activación metabólica S9 en el ensayo inicial (Tabla 1).
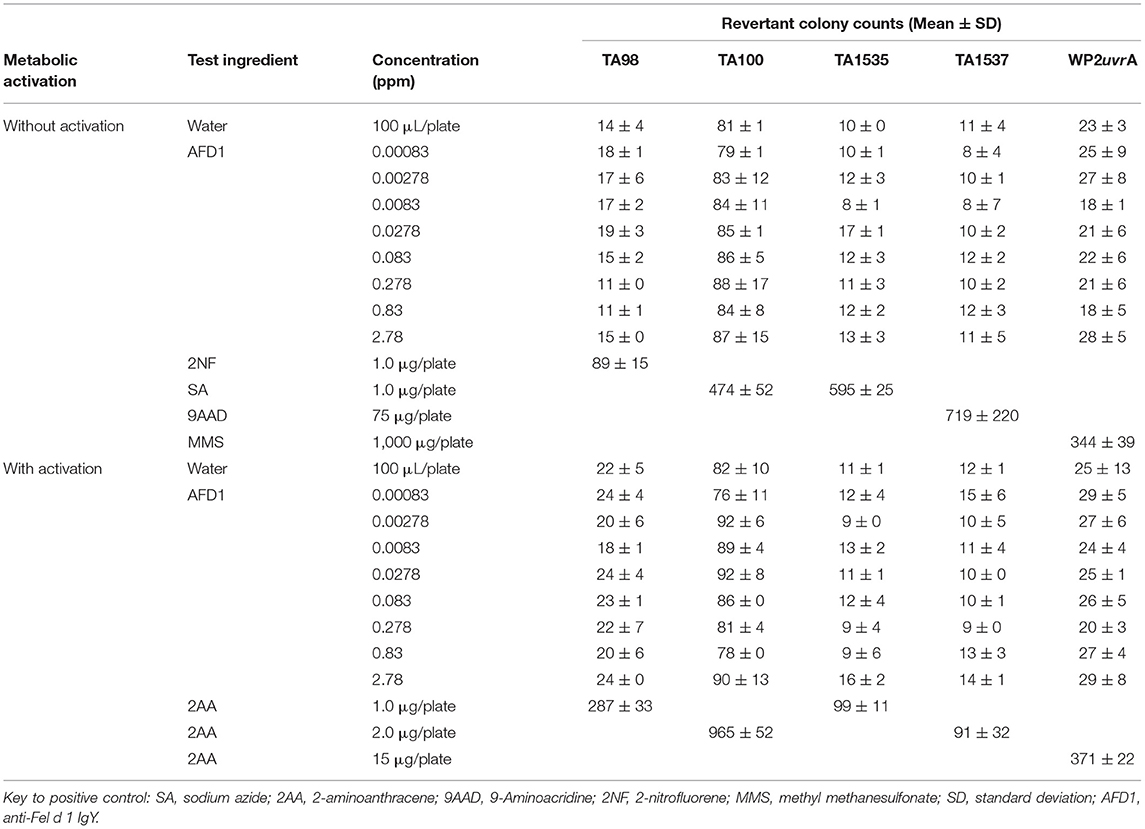
Tabla 1. Ensayo de mutación inversa bacteriana: ensayo de toxicidad inicial.
Según los resultados del ensayo inicial, las concentraciones de AFD1 en el ensayo confirmatorio fueron: 0,0278, 0,083, 0,278, 0,83 y 2,78 ppm. Al igual que en el ensayo inicial, no se observó precipitado ni citotoxicidad. No se observaron respuestas mutagénicas positivas en ninguna de las cepas evaluadoras en presencia o ausencia del sistema de activación metabólica S9 (Tabla 2). La aplicación de los controles positivos dio como resultado los aumentos esperados en la formación de colonias revertidas.
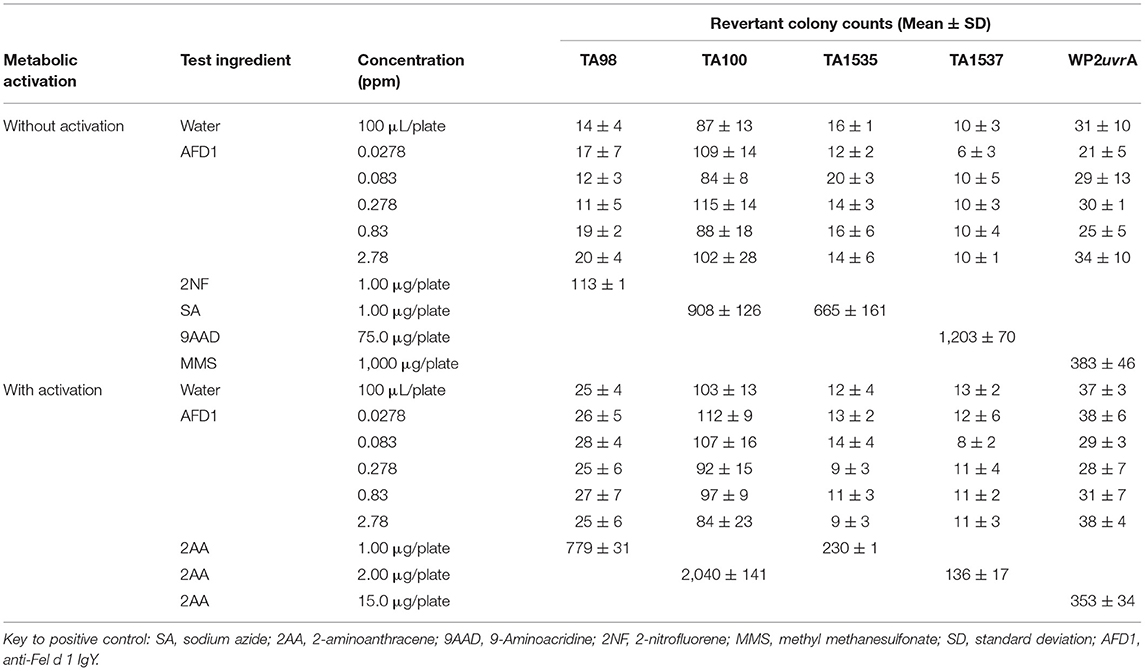
Tabla 2. Ensayo de mutación inversa bacteriana: ensayo confirmatorio de mutagenicidad.
Ensayo de aberración cromosómica
La citotoxicidad, definida como una reducción del ≥50% en el índice mitótico en relación con el control del vehículo, no se observó a ninguna concentración en ninguno de los tres grupos en los ensayos preliminares o confirmatorios. El precipitado visible se observó en la concentración más alta (3 ppm AFD1) al final del período en el ensayo preliminar. Sobre la base de la falta de citotoxicidad y formación de precipitados, las concentraciones de AFD1 elegidas para el ensayo de aberración cromosómica fueron 0,375, 0,75, 1,5, 2,25 y 3 ppm. Al final del período de aberración cromosómica, se observó precipitado visible a concentraciones mayores o iguales a 2,25 ppm en el grupo de exposición no activado de 4 h y a 3 ppm en los grupos de exposición de 4 h activados S9 y los grupos de exposición no activados de 20 h.
Los resultados de los controles positivos y del vehículo indicaron que se cumplieron todos los criterios para un ensayo válido (debido a que los grupos no activados y activados por S9 se analizaron simultáneamente, se eliminó el control positivo para el punto de tiempo de exposición de 4 horas no activado). No se observaron aumentos significativos (P > 0,05) o dependientes de la concentración en las aberraciones estructurales o numéricas (células poliploides o endorreduplicadas) en los grupos tratados con AFD1, con o sin activación metabólica S9 (Tabla 3).
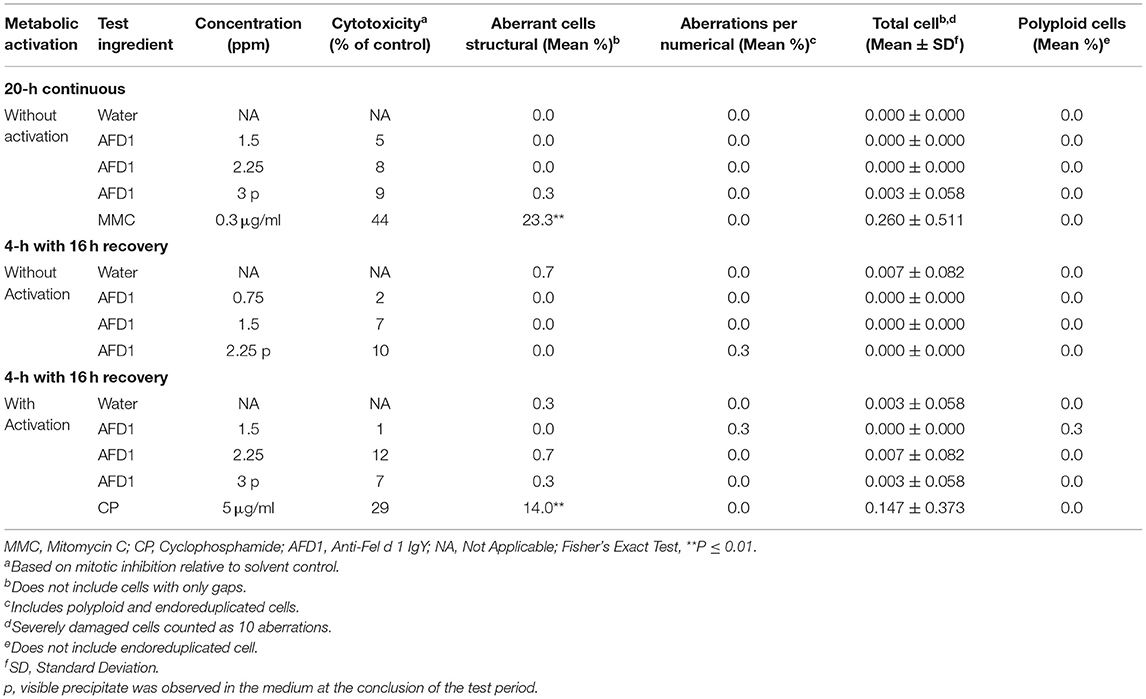
Estudio dietético felino
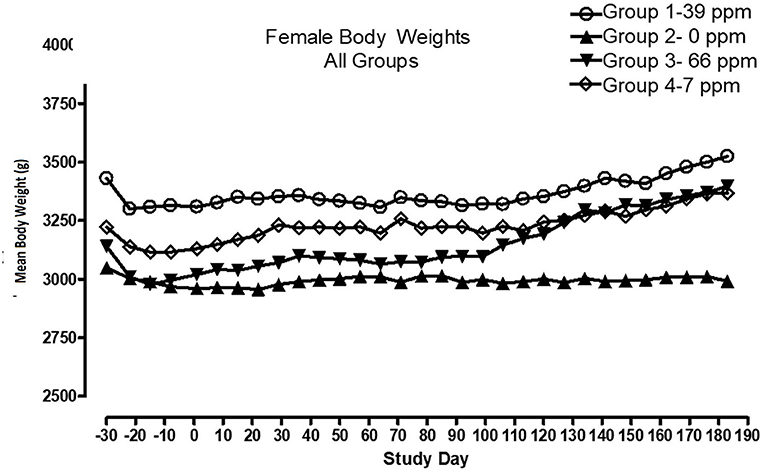
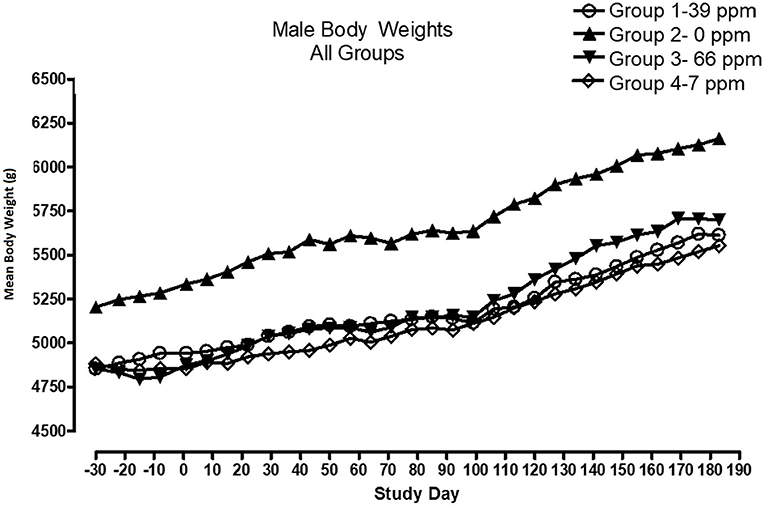
Todos los gatos se mantuvieron en buen estado de salud durante el estudio. El análisis estadístico encontró que los datos para este estudio en vivo eran de naturaleza paramétrica. Los datos originalmente proporcionados en unidades de Système Internationale (SI) fueron convertidos a unidades convencionales para esta publicación. No hubo diferencias significativas entre los grupos de prueba y control en cuanto al peso corporal (Figuras 1, 2) o el aumento de peso corporal (datos no mostrados) en los gatos machos al final del estudio. Entre los días 36 y 43 se produjeron aumentos de peso corporal medios más bajos en los grupos de alimentación de 7 y 66 ppm, pero esto no fue una respuesta dependiente de la concentración de AFD1 y solo fue de naturaleza transitoria, por lo que no se relacionó con el consumo de AFD1. Hubo un aumento estadísticamente significativo (P < 0,05) en la ganancia de peso corporal promedio en el grupo femenino de 66 ppm en el período de consumo del día 120-127, en comparación con el grupo de control respectivo (datos no mostrados), pero el peso corporal promedio de las mujeres en los grupos consumidores de AFD1 no fue significativamente diferente del grupo de control. El peso corporal promedio en los grupos de 7 y 39 ppm aumentó 7,85 y 6,38%, respectivamente, y estuvo dentro de la variación biológica normal.
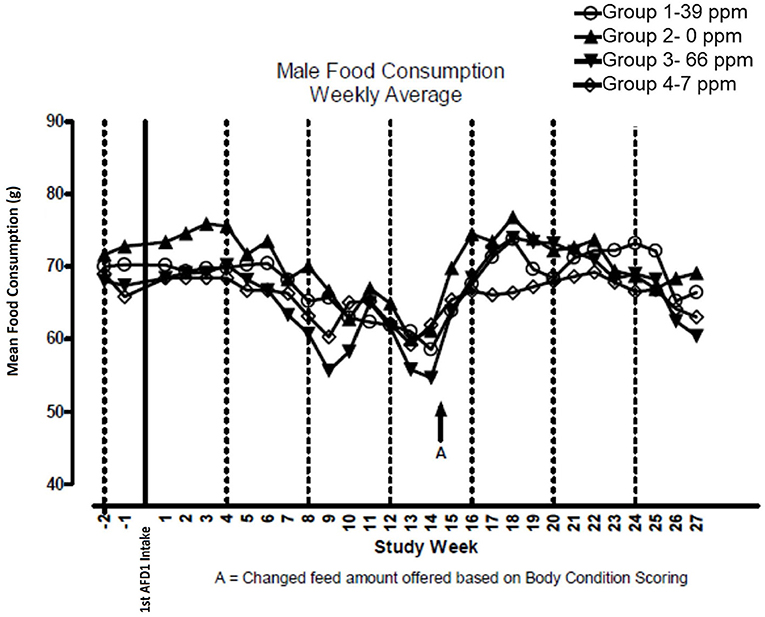
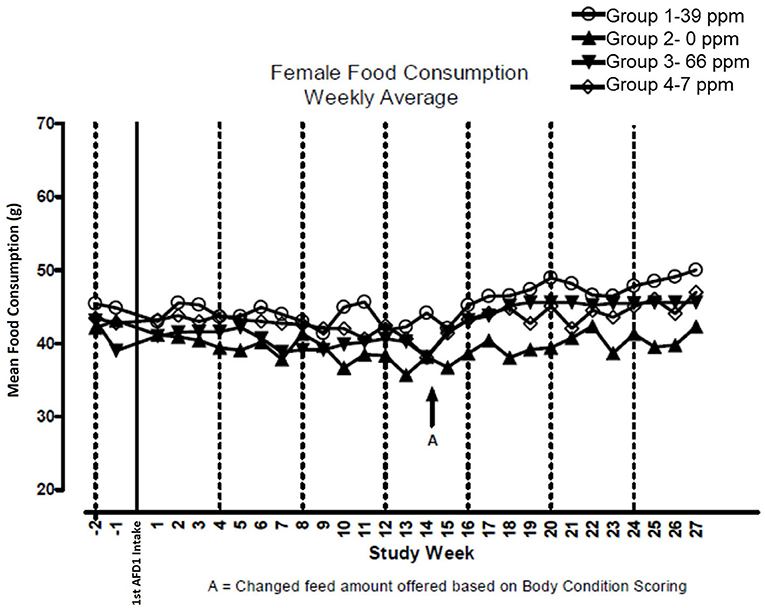
No hubo diferencias significativas en el consumo de alimentos que contenían 7, 39 o 66 ppm de AFD1 en comparación con el grupo de control (P > 0,05) para gatos machos o hembras en el estudio. Los valores medios de consumo semanal de alimentos se presentan en la Figura 3 (hombres) y la Figura 4 (mujeres). No hubo diferencias estadísticamente significativas entre los grupos de control y de prueba en el consumo de alimentos en ninguno de los días medidos durante el estudio. Antes del Día 100, la cantidad de comida ofrecida a cada gato se variaba cada semana para intentar mantener el peso corporal dentro de un rango del 5% de su peso corporal del Día 1, sin dejar de satisfacer la necesidad metabólica de 59 kcal/kg de peso corporal (PC). Dado que el aumento de peso corporal continuó incluso con la alteración de la cantidad de alimento proporcionado, después del día 100 el alimento se ajustó al menos semanalmente de acuerdo con la Puntuación de Condición Corporal de Nestlé Purina [la cantidad de alimento administrada al gato aumentó si la Puntuación de Condición Corporal estaba por debajo de 4 y disminuyó si la Puntuación de Condición Corporal estaba por encima de 6 (12)], Mantener las necesidades metabólicas de los gatos. Los gatos machos consumieron un promedio de 0, 0,09, 0,51 y 0,83 mg AFD1 /kg de peso corporal/día; las gatas consumieron un promedio de 0, 0,09, 0,53 y 0,88 mg de AFD1/kg de peso corporal/día para los grupos de 0, 7, 39 y 66 ppm de alimento, respectivamente, que fue menor que los 0,11, 0,55 y 1,1 mg/kg de peso corporal/día esperados para los grupos respectivos.
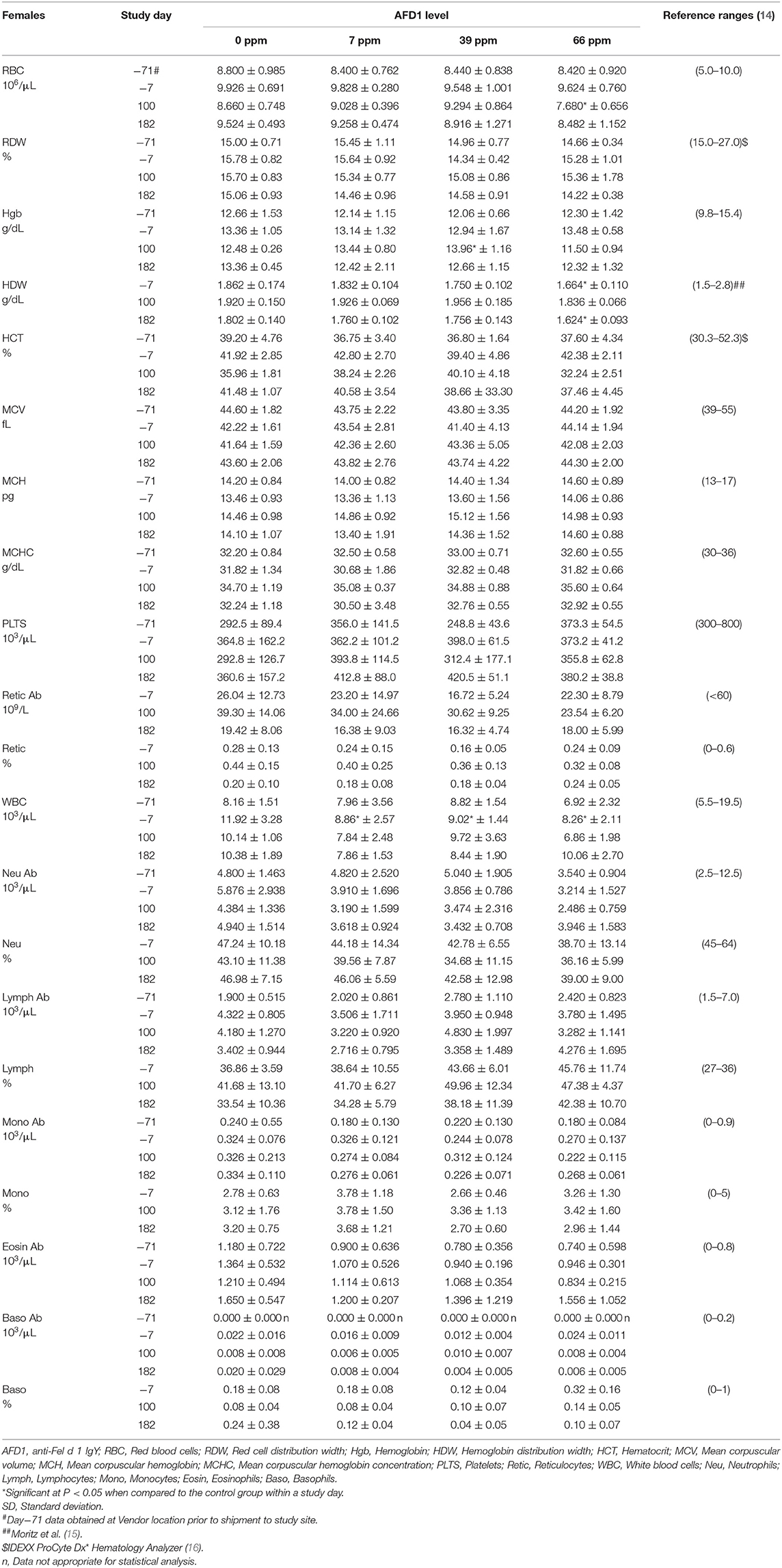
Los datos de patología clínica fueron típicos de gatos clínicamente sanos, y generalmente similares entre los grupos en cada intervalo de recolección. Hubo diferencias estadísticamente significativas (P < 0.05) en los reticulocitos absolutos y porcentuales en los grupos de alimentación masculina de 7 y 66 ppm en el día 182 (Tabla 4) que no se atribuyeron a la alimentación con AFD1, ya que no hubo una relación grupo-respuesta, variación considerable en estos parámetros antes de la alimentación con AFD1, los valores estuvieron dentro de los niveles de referencia publicados [% rango de reticulocitos: 0.0–0.6%; (14)] y reticulocitos en el rango de «103/μL»: <60 × 103/μL; (14) y la falta de cambios significativos en los parámetros de los eritrocitos maduros (es decir, RBC, HGB o HCT).
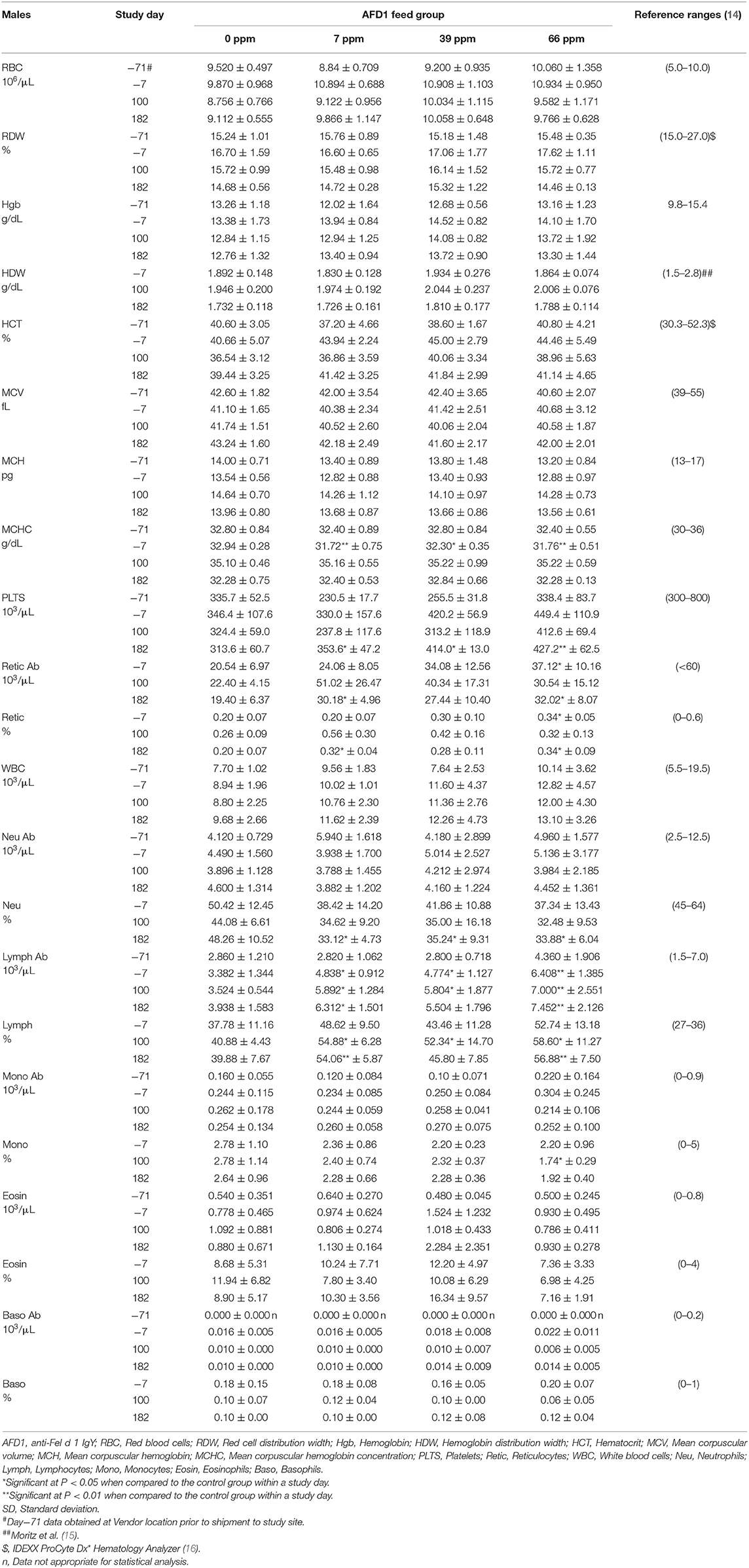
Los recuentos de plaquetas variaron considerablemente entre los grupos en cada intervalo de recolección, como es típico de los gatos clínicamente sanos. Trumel et al. (17) encontraron que el coeficiente de variación (CV, %) fue del 14,8% para la variabilidad intraindividual y del 18,9% para la interindividual para un conjunto de 14 gatos durante un estudio de tres meses. Los recuentos medios de plaquetas significativamente más altos observados en los grupos masculinos el día 182 (Tabla 4) no se atribuyeron a la AFD1 debido a la falta de una respuesta clara al nivel de AFD1 y al hecho de que las mujeres no se vieron afectadas de manera similar (Tabla 5). Un hombre control estaba inapropiado e hipoactivo el día 157 y tenía un recuento de plaquetas más bajo (121 × 103/μL /μL) sin que se obtuviera ningún valor de VPM y no se observaran grumos de plaquetas en el frotis de sangre. El gato volvió a estar hipoactivo (pero no inapetante) en los días 158-160, pero no se encontraron anomalías durante el resto del estudio para este gato. El recuento de plaquetas de este gato también fue ligeramente inferior (193 × 103/μL) en el día 7, pero >300 × 103/μL en los días 100 y 182. Este macho control se recuperó mientras aún estaba en estudio con alimentación continua de dieta de control y tenía valores de patología clínica poco notables en el día 182.
Obtener recuentos precisos de plaquetas en gatos es un desafío, ya que la aglomeración, un evento común en gatos individuales, causa recuentos espuriamente más bajos (18). Además, los grumos de plaquetas no siempre son evidentes en el frotis de sangre, pero la amplia variación en el MPV en este estudio (~9-20 fL) indicó la amplia gama de tamaños de plaquetas y/o la presencia de grumos de plaquetas. Las diferencias en los recuentos de plaquetas en este estudio se atribuyeron a la variabilidad biológica de gatos clínicamente sanos (17).
El aumento estadísticamente significativo de HBG en el grupo femenino de 39 ppm en el día 100 no se atribuyó a AFD1 debido a la falta de un efecto de respuesta relacionado con AFD1 y a la falta de cambios concurrentes en el recuento de glóbulos rojos o en los niveles de HCT (Tabla 5), y estuvo dentro del rango de HBG (~9,8-15,4) informado por Merck (14). La media más baja (P < 0,05) de HDW en el grupo femenino de 66 ppm en el día 182 no se atribuyó a AFD1 ni fue de naturaleza adversa, ya que el valor medio de HDW en el día 182 prácticamente no cambió con respecto al valor en el día 7 de aclimatación y, por lo tanto, era un indicador de variación biológica normal, y estaba dentro del intervalo de referencia publicado de 1,4-2,0 g/dL [140-200 g/L; (19)].
Los recuentos absolutos de linfocitos medios significativamente más altos observados en todos los grupos masculinos proporcionaron AFD1 en el día 100 y en los grupos masculinos de 7 ppm y 66 ppm en el día 182 tuvieron desviaciones estándar muy amplias y fueron típicas de excitación fisiológica (nerviosa) con liberación de epinefrina que resultó en una contracción esplénica seguida de la liberación de linfocitos en la circulación (20). Esto ocurre comúnmente en gatos, y los recuentos no fueron patológicos ni claramente dependientes del nivel de AFD1; Trumel et al. (17) informaron niveles absolutos de linfocitos que variaron de ~1.0 a casi 7.0 × 103/μL con un intervalo de referencia de >10.0, mientras que Merck (14) establece un rango de referencia absoluto de linfocitos de 1.5-7.0 (× 103/μL). No se observaron elevaciones significativas similares en los grupos femeninos cuando se compararon con el grupo de control respectivo en ningún intervalo. El aumento en el número absoluto de linfocitos dio lugar a aumentos significativos simultáneos en los valores porcentuales de linfocitos, que fueron superiores al rango de referencia disponible públicamente [% de linfocitos: 27–36%; (14)]. Aunque hubo disminuciones significativas en el porcentaje de neutrófilos en todos los grupos de machos tratados en el día 182, la falta de una respuesta basada en el nivel de AFD1 y la falta de cambios simultáneos en los recuentos medios absolutos de neutrófilos indican que los cambios estadísticos no se debieron al consumo de la sustancia problema y no fueron de naturaleza adversa. De manera similar, la falta de cambios significativos en los recuentos absolutos medios de monocitos y la falta de respuesta relacionada con el nivel indica que la disminución significativa en el porcentaje de monocitos en el grupo de 66 ppm no estuvo relacionada con AFD1 y no fue adversa. Los valores porcentuales de monocitos también estuvieron dentro de los rangos de referencia disponibles públicamente [0–5%; (14)]. El análisis citológico no encontró hallazgos morfológicos anormales (datos no mostrados).
Las diferencias estadísticamente significativas observadas en los valores medios de TT variaron en efecto (aumentaron o disminuyeron), con valores más altos en los grupos de 7 ppm y 66 ppm de hombres y mujeres (Tabla 6), y en el grupo de 39 ppm de hombres en el día 100, y valores más bajos para los grupos de 7, 39 y 66 ppm en mujeres el día 182. Los cambios en los valores de TT no aumentaron o disminuyeron consistentemente con el aumento del consumo de AFD1 (ya sea con el tiempo o en cantidad) y no fueron consistentes con las disminuciones observadas en APTT en los grupos femeninos de AFD1 o disminuciones significativas en la función hepática (como se discute a continuación). Además, no hubo una respuesta clara relacionada con AFD1 y la mayoría de los valores medios de TT en los grupos de AFD1 variaron <2 s de los del grupo control; por lo tanto, estos efectos no fueron de naturaleza patológica y no se consideraron relacionados con el consumo de ingredientes AFD1. Las diferencias estadísticamente significativas observadas en los valores medios de PT en los grupos de mujeres de 7, 39 y 66 ppm en el día 100 no se atribuyeron a AFD1 debido a la falta de una respuesta relacionada con AFD1 y no se observaron en el día 182 después de la alimentación continua de AFD1 y los valores se encontraban dentro de los rangos de referencia disponibles públicamente [PT: de 10,0 a 15,3 s; (21)]. Similar al APTT [intervalo de referencia entre 11,2 y 16,0 s; (21)], el valor medio de PT en las hembras de control en el día 100 fue mayor que el valor medio de otros grupos en cualquier intervalo, lo que indica aún más que un valor ligeramente mayor en el grupo de control aumentó la probabilidad de que los valores encontrados en los grupos consumidores de AFD1 fueran estadísticamente más bajos que el valor de control.
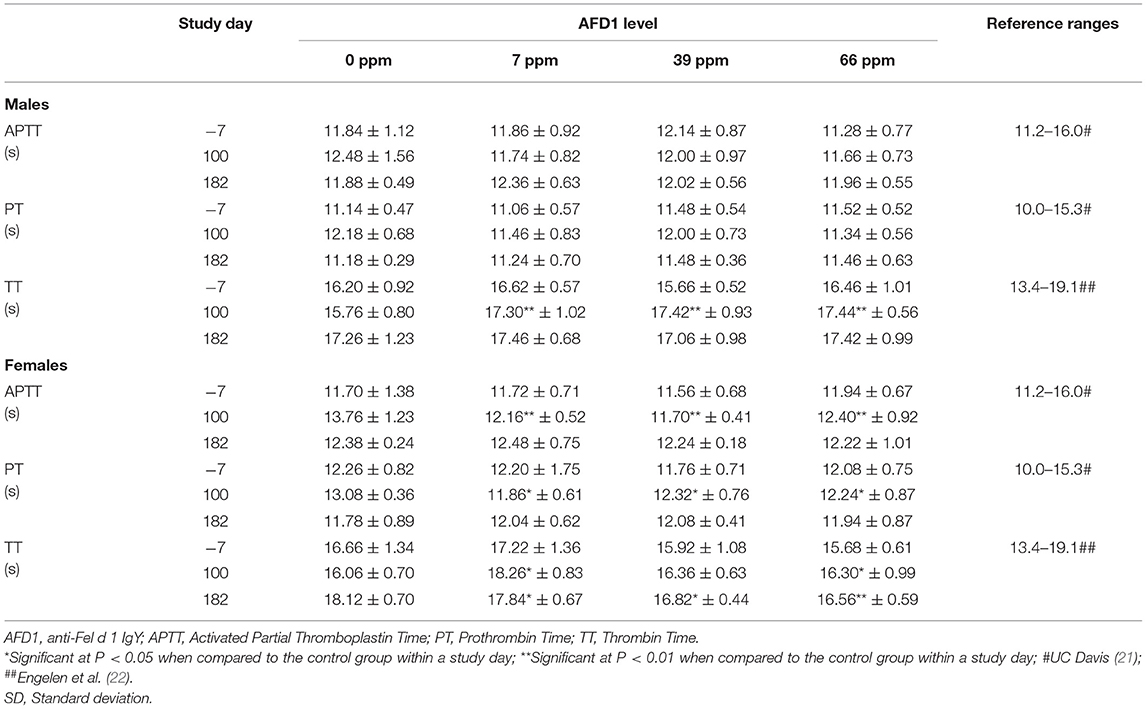
Tabla 6. Análisis de la coagulación de gatos machos y hembras alimentados con sangre AFD1 (media ± DE).
Las diferencias significativas en los valores hematológicos entre los grupos de tratamiento con AFD1 y el grupo de control no siguieron una progresión específica relacionada con el tratamiento, no fueron consistentes entre los grupos masculino y femenino y estuvieron dentro de los rangos de referencia disponibles públicamente. Hubo diferencias significativas en las concentraciones de reticulocitos entre los grupos de 7 y 66 ppm de AFD1 masculinos, en comparación con el grupo de control, pero este efecto no fue dependiente de la concentración, no se observó en los grupos de mujeres y no reflejó ningún cambio en los parámetros de los eritrocitos maduros (es decir, RBC, HGB o HCT), sin disminuciones resultantes en los recuentos de linfocitos que indicaran una incapacidad de maduración/diferenciación de los reticulocitos. Los recuentos más altos de plaquetas encontrados en los grupos masculinos el día 182 no fueron consistentes con los efectos observados en los grupos femeninos y variaron considerablemente; no se encontró una relación paralela clara entre los cambios en los recuentos de plaquetas y el RDW, MCV o HCT, un efecto que puede ocurrir durante una respuesta toxicológica para cualquiera de estos parámetros (23).
Los datos de química clínica se proporcionan en la Tabla 7 (hombres) y la Tabla 8 (mujeres). Se observó hemólisis mínima a leve en el suero de muchos gatos, pero no hubo ningún efecto aparente en los resultados químicos. No se midió la SDH en el grupo masculino Cat 22 de 66 ppm el día 182 debido a que la muestra era insuficiente, y los ácidos biliares no se midieron en el grupo de 66 ppm hembra Cat 30 el día 100 (inadvertidamente no se corrió). Los datos de química sérica fueron generalmente similares entre los grupos, con algunas observaciones notables que se describen a continuación. En general, todos los valores medidos estaban dentro de los rangos esperados para gatos clínicamente sanos (24). No se encontró ningún efecto de la dieta AFD1 sobre los niveles de taurina en sangre total en los gatos machos (Tabla 7), sin diferencias dependientes de AFD1 en ningún intervalo, cuando se comparó con el grupo control respectivo (P > 0,05).
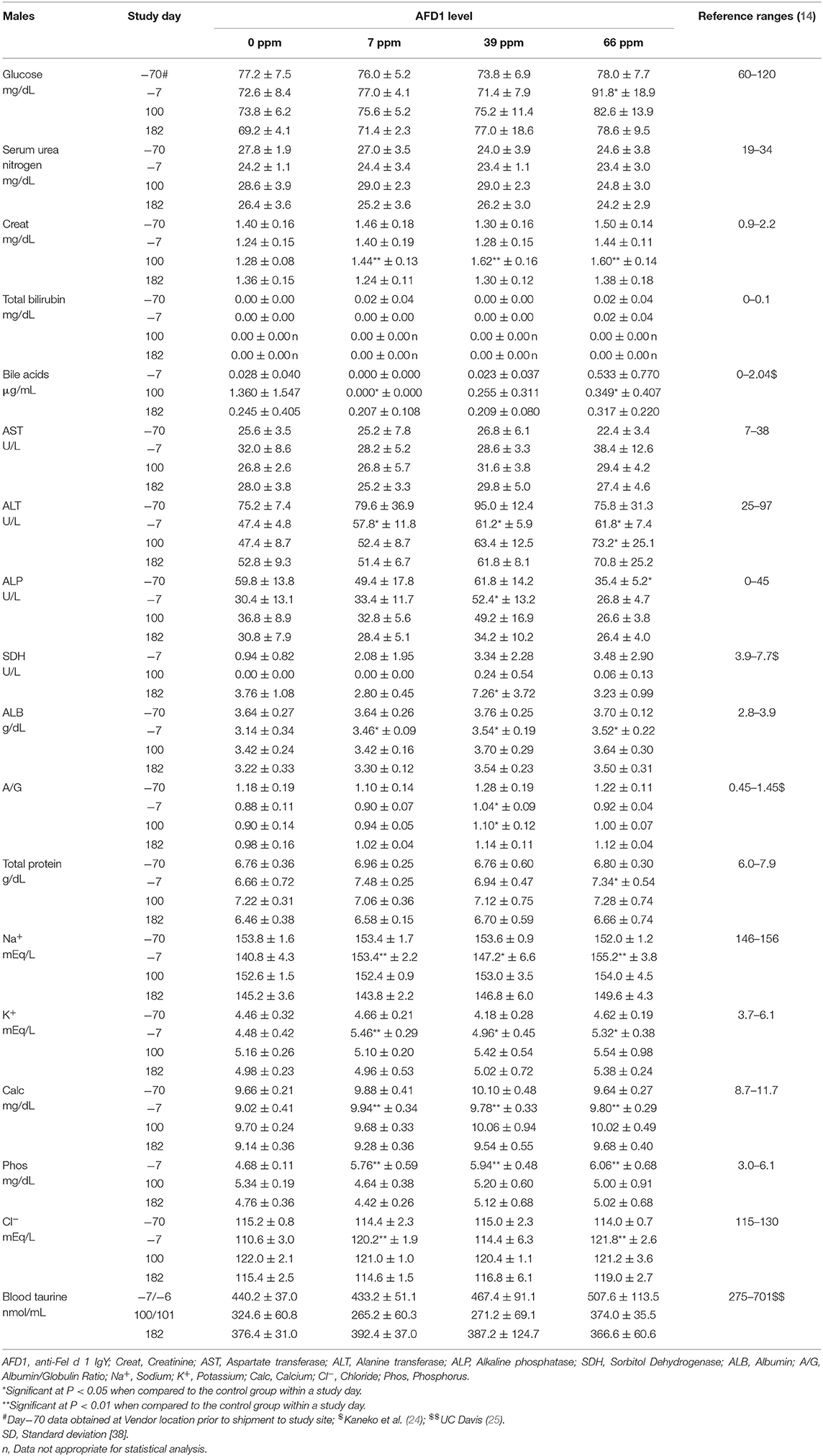
Tabla 7. Valores de química clínica (media ± DE) en gatos machos antes y durante la alimentación con AFD1.
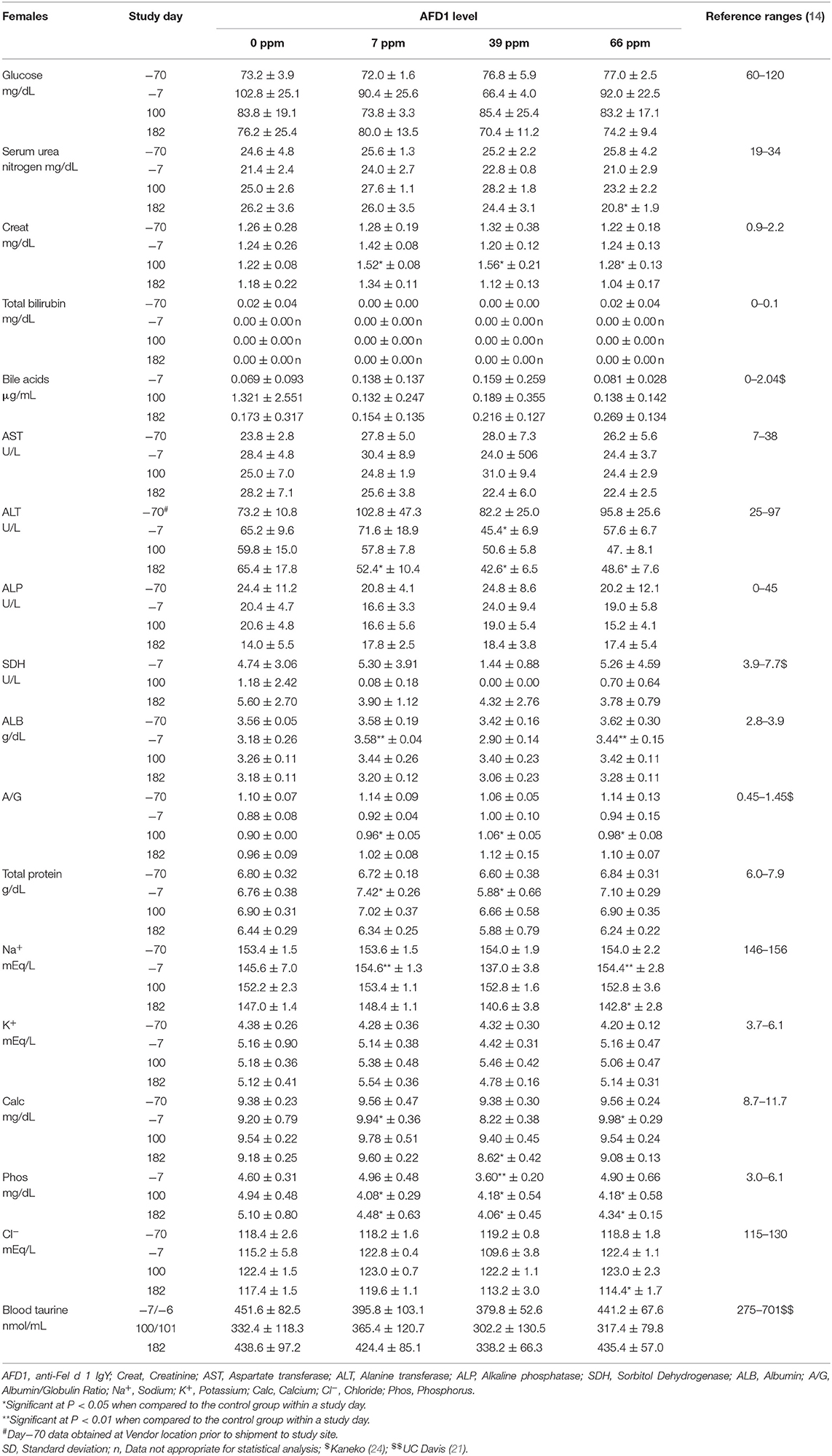
En el día 100, las concentraciones medias de ácidos biliares estadísticamente más bajas observadas en los grupos de machos de 7 y 66 ppm no tuvieron relación con la AFD1 dietética, porque se esperan niveles bajos de ácidos biliares en mamíferos clínicamente sanos y en ayunas [rango de referencia: 0–2,04 μg/mL; (24)] y un aumento del nivel de ácidos biliares séricos en ayunas es indicativo de una disminución de la función hepática (26). Por el contrario, debe tenerse en cuenta que la hembra control Cat 20 tenía una concentración de ácidos biliares >5,72 μg/mL en el día 1002. El valor más alto en esta hembra puede haber sido el resultado de un período de ayuno más largo y no estuvo acompañado de cambios concurrentes en otros parámetros hepatobiliares como GGT (reportado en 0 para todos los controles y grupos y puntos de tiempo de alimentación AFD1; datos no mostrados) o ALP (Tabla 8) y, por lo tanto, se atribuyó a la variación biológica normal (26).
En el día 100, la actividad media de ALT fue estadísticamente significativamente mayor en el grupo de machos de 66 ppm en relación con el grupo de machos de control respectivo debido a una actividad ligeramente mayor (>100 U/L) en Cat 23; el valor de ALT para este hombre también fue ligeramente más alto en el día 182, pero el valor medio para el grupo de hombres de 66 ppm no fue estadísticamente significativo diferente de los controles. Los valores de ALT para los grupos fueron significativamente mayores que los del grupo control antes del inicio del (día-7), lo que puede haber influido en la significación estadística en el día 100 e indica una falta de significación biológica. No se observaron cambios estadísticamente significativos al comparar las medias de otros parámetros hepatocelulares (AST, GGT, SDH, ácidos biliares y bilirrubina total) de los grupos masculinos alimentados con AFD1 con los de los controles respectivos. Se consideró que la diferencia estadísticamente significativa en la ALT media para el grupo masculino de 66 ppm en el día 100 (Tabla 7) estaba dentro de la variación biológica normal y no estaba relacionada con el ingrediente que contenía AFD1 en el alimento. En el día 182, los valores medios de ALT fueron significativamente más bajos en todos los grupos de mujeres alimentadas con AFD1, lo que no se considera un efecto toxicológico, no respondieron a AFD1 y se mantuvieron dentro de los valores de referencia normales [25-97 U/L; (14)] excepto para el grupo de 7 ppm en el día 70 (102,8 ± 47,3 U/L), que no se relacionó con la administración de la dieta AFD1.
La actividad de SDH generalmente oscila entre ~0 y 15 U/L en gatos clínicamente sanos (27). En el día 182, el grupo masculino de 39 ppm tuvo una actividad media de SDH estadísticamente más alta que el control concurrente. La actividad media mínimamente mayor fue causada por los valores individuales (>10 U/L) en los gatos machos 2 (11,8 U/L) y 5 (10,7 U/L). Este valor medio mínimamente más alto en el grupo de machos de 39 ppm no se atribuyó al ingrediente AFD1 porque se observaron valores individuales similares (>10 U/L) en tres hembras en el día de aclimatación-7 [grupo de 7 ppm Cat 39 (11,5 U/L) y 66 ppm grupo Gatos 26 (10,2 U/L) y 29 (10,1 U/L)], Los valores estaban dentro o por debajo de los valores de referencia, por lo que se consideró que estaban dentro de la variación biológica normal. Los aumentos en la SDH por encima de los rangos normales son una preocupación potencial para la lesión de los hepatocitos, pero los niveles de SDH más bajos que los típicos no se consideran un evento adverso.
En el día 100, se observaron concentraciones medias de creatinina estadísticamente más altas en todos los grupos masculinos y femeninos alimentados con AFD1. Los aumentos en estos grupos no se observaron en el día 182 (con alimentación continua), estuvieron dentro de los rangos de referencia para animales sanos [0,9-2,2 mg/dL; (14)] y no dependían del nivel de AFD1 (ya que las concentraciones de Creat no aumentaban con el aumento de los niveles de consumo de AFD1); los cambios en los niveles de Creat se consideraron incidentales al consumo de AFD1.
Las diferencias estadísticamente significativas en las relaciones medias A/G no tienen significado biológico sin cambios notables en la albúmina o en las concentraciones totales de globulina calculadas. Las relaciones medias A/G significativamente más altas en el día 100 para el grupo masculino de 39 ppm y todos los grupos femeninos alimentados con AFD1 simplemente reflejaron la proporción mínimamente mayor de albúmina en relación con la globulina. No hubo aumentos biológicamente relevantes en la albúmina media ni disminuciones en las concentraciones medias de globulina en los mismos grupos en esos intervalos. Además, se consideró que los valores estaban dentro de la variabilidad biológica normal [rango de referencia de ALB a 2,8-3,9 g/dL y globulina a 2,6-5,1 g/dL; (14)], comparables a los valores obtenidos antes de la alimentación con ingredientes de ensayo. Existe una variación biológica sustancial dentro de la población de gatos que es evidente en los valores hematológicos y bioquímicos (17), lo que puede explicar la variación en estos valores observada en este estudio. Sin embargo, la incorporación de la sustancia problema no tuvo un efecto claro de respuesta al nivel de AFD1 que fuera toxicológicamente relevante. Al igual que en los gatos machos, no se encontró ningún efecto de la dieta AFD1 sobre los niveles de taurina en sangre total en las gatas (Tabla 8) en ningún grupo alimentado con AFD1, en comparación con el grupo control (P > 0,05).
En el día 182, se observó una concentración media de calcio significativamente menor en el grupo femenino de 39 ppm (8,62 ± 0,42 mg/dL); la diferencia con respecto al grupo de control respectivo se consideró incidental al ingrediente AFD1 debido a la falta de una respuesta relacionada con AFD1 y los niveles de calcio casi dentro de los rangos de referencia publicados [8,7-11,7 mg/dL; (14)]. La hipocalemia puede ser un indicador de enfermedad renal (14), pero en este estudio no hubo cambios significativos en las concentraciones séricas de proteínas totales, nitrógeno ureico sérico o creatinina sérica en el mismo grupo de estudio en el mismo momento del estudio, o en el grupo femenino de 66 ppm, lo que confirma una falta de efecto de respuesta a AFD1 en la prueba y cambios en otros parámetros indicativos de problemas renales que se esperarían si el efecto estuviera relacionado con el artículo de prueba. Aunque estadísticamente significativos, los valores medios mínimamente más bajos de fósforo inorgánico observados en todos los grupos de mujeres alimentadas con AFD1 en los días 100 y 182 no tuvieron relevancia biológica (aproximadamente la mitad de las concentraciones medias de calcio), no dependieron del nivel de AFD1, dentro de los rangos de referencia publicados [3,0-6,1 mg/dL; (14)] y se considera incidental. La hipofosfatemia clínicamente significativa es poco común en los gatos y puede ser un problema de salud si se presentan niveles prolongados de <2.5 mg/dL (28), lo que no ocurrió en este estudio.
La concentración media de sodio fue estadísticamente significativamente menor en el grupo femenino de 66 ppm el día 182 (Tabla 8). Esta disminución mínima se consideró incidental al ingrediente AFD1 debido a la falta de una respuesta clara relacionada con AFD1; de hecho, el valor medio para el grupo de 39 ppm de mujeres fue menor, pero no significativamente diferente, de las hembras de control [rango de referencia: 146-156 mEq/L de sodio; (14)] tanto en el día-7 como en el día 182, lo que indica concentraciones variables de sodio sérico para este estudio. La hiponatremia (considerada ~11-15 unidades por debajo de los rangos de referencia) no ocurrió en este estudio (29).
La disminución estadísticamente significativa en el cloruro medio observado para el grupo femenino de 66 ppm en el día 182 se consideró incidental al ingrediente AFD1 debido a la falta de un efecto claro de respuesta relacionado con el nivel de AFD1. Al igual que con el sodio, el valor medio de cloruro fue menor en las hembras de 39 ppm que en las hembras de 66 ppm, pero la diferencia no fue estadísticamente significativa con respecto al valor medio de las hembras de control. Por el contrario, hubo aumentos estadísticamente significativos en los niveles de cloruro en el día 7 en los grupos masculinos de 7 y 66 ppm; sin embargo, estas concentraciones estaban dentro de los rangos de referencia [115-130 mEq/L; (14)]. Las concentraciones de fósforo en los grupos de tratamiento masculino fueron significativamente mayores que en el grupo de control en el día 7 (antes del inicio del estudio), pero estaban dentro de los rangos de referencia [3,0-6,1 mg/dL; (14)] y no se observaron efectos significativos en los varones para este parámetro durante el resto del estudio. Las concentraciones de fósforo disminuyeron significativamente (P < 0,05) en los grupos de 7, 39 y 66 ppm de mujeres en los días 100 y 182 del estudio, pero nuevamente estas concentraciones estaban dentro de los rangos de referencia disponibles públicamente [3,0-6,1 mg/dL; (14)] y las ligeras disminuciones no se consideraron toxicológicamente relevantes y no fueron paralelas al consumo de cantidades crecientes de AFD1; por lo tanto, los cambios en las concentraciones de fósforo no se consideraron relacionados con AFD1. Los cambios en los parámetros de química clínica no fueron indicativos de una acción toxicológica significativa de AFD1 en el riñón, el hígado o cualquier otro órgano, ya que los cambios significativos en un parámetro (como la disminución de ALT para los grupos femeninos de AFD1) no se correlacionan con un efecto toxicológico en el órgano (es decir, el hígado) y no fueron consistentes con otros parámetros relacionados.
No hubo ningún efecto de la AFD1 dietética sobre ninguno de los parámetros del análisis de orina ni sobre las observaciones del examen microscópico de sedimentos en orina (datos no mostrados). La orina estaba bien concentrada, y los resultados fueron generalmente anodinos y similares entre los grupos de control y prueba en cada intervalo de recolección (Días-6, 100 y 182 del estudio; datos no mostrados).
Conclusiones
No se observaron alteraciones biológicamente significativas en los parámetros de química clínica, hematología, coagulación o análisis de orina que pudieran atribuirse a la dieta AFD1 suministrada a gatos adultos durante 182 días (es decir, 26 semanas) a los niveles analizados. Al igual que con todos los análisis de criterios de valoración clínicos y hematológicos, existe una cierta cantidad de variación intraindividual e interindividual, de modo que es necesaria una evaluación sistemática de los datos para determinar la salud del sujeto (30). Dentro de este estudio hubo variaciones en los parámetros de química clínica y hematología individuales de los gatos, pero no hubo un efecto consistente que estuviera fuera de los rangos de referencia publicados que indicaran una respuesta toxicológica en los gatos, cuando los parámetros se evaluaron en su conjunto (17, 30, 31). De manera similar a los resultados encontrados en este estudio de alimentación, Satyaraj et al. (9) encontraron variaciones en el peso corporal que ocurren durante el consumo de la dieta que contiene AFD1 (por ejemplo, un aumento general en el peso corporal), pero una reducción en la cantidad de comida proporcionada a los gatos ayudó a que los gatos regresaran al peso corporal inicial. El aumento del peso corporal indica que la dieta que contiene AFD1 fue apetecible en ambos estudios y no inhibió el mantenimiento corporal. Además, la disminución de los niveles activos de Fel d 1 en el pelo de gato reportada en el estudio de Satyaraj et al. (9) no dio lugar a efectos adversos que requirieran la eliminación de ninguno de los gatos del estudio, ya que solo uno de los 105 gatos que consumió la dieta que contenía AFD1 no completó el estudio (el único gato no se retiró por los efectos adversos del consumo de la dieta, sino por tener una «personalidad díscola»). Un estudio adicional realizado por Satyaraj et al. (32) analizó el efecto del consumo del anticuerpo AFD1 por gatos en la reducción del antígeno Fel d 1 salival, encontrando que el AFD1 redujo significativamente las concentraciones de saliva Fel d 1 activa dentro de las 3 semanas posteriores al consumo tanto en un ensayo de alimentación de 6 semanas como en un ensayo de alimentación de 4 semanas. Las dietas de prueba contenían un producto de huevo seco calculado para proporcionar ~ 8 ppm (sobre la base de la materia seca) AFD1. El segundo ensayo utilizó un grupo de tratamiento y un grupo de control, con el 86% de los gatos alimentados con una dieta que contenía AFD1 mostrando una reducción en la Fel d 1 activa salival de al menos el 20%, en comparación con solo el 38% de los gatos de control (32). Los estudios de genotoxicidad del ingrediente AFD1 muestran una falta de potencial para formar efectos mutagénicos o aberraciones cromosómicas, ya que según la Cláusula Delaney de la Ley Federal de Alimentos, Medicamentos y Cosméticos (Ley FFD&C), los aditivos alimentarios que se ha descubierto que inducen cáncer en humanos o animales no se pueden agregar a los alimentos.
Los huevos de gallina y los productos derivados del huevo se han consumido de forma segura durante siglos. El uso de IgY concentrado de huevos de gallina es más reciente, pero también se ha demostrado que es seguro en otras especies (33-37). En este trabajo se evaluó la seguridad del anticuerpo IgY específico de Fel d 1 cuando se administra a gatos y se evaluó el potencial de esta IgY específica para promover efectos mutagénicos o genotóxicos. Cuando se añadió a la comida seca para gatos y se les proporcionó a los gatos durante 26 semanas, no se observaron efectos adversos atribuidos a AFD1 en los niveles analizados. La falta de potencial mutagénico y la ausencia de formación de aberraciones cromosómicas en un estudio conforme a la OCDE confirma la falta de genotoxicidad del ingrediente AFD1. No se observaron alteraciones biológicamente significativas en los datos de patología clínica que pudieran atribuirse a AFD1 en croquetas de gato durante 26 semanas a los niveles analizados.
La sensibilidad a los alérgenos derivados de los gatos es una de las principales razones para renunciar a los refugios y sirve como barrera para la adopción y propiedad de gatos (38-43). Se estima que aproximadamente el 12,1% de la población estadounidense mayor de 6 años está sensibilizada a los alérgenos de los gatos (44), y hasta el 26% de los europeos adultos (45). Evitar sistemáticamente a los gatos como mascotas domésticas no siempre es práctico, y la inmunoterapia subcutánea específica para alérgenos felinos no siempre resulta en una inhibición completa de los síntomas de alergia conjuntival, nasal y bronquial (46). Una reducción en la cantidad de Fel d 1 alergénico liberado en el medio ambiente a través de la muda de pelo y la caspa podría reducir la carga de alérgenos en el medio ambiente sin cambiar la producción natural de Fel d 1 de un gato ni afectar negativamente la salud del gato. Se ha demostrado que la reducción de la carga alergénica es beneficiosa para las personas alérgicas (47, 48). Los estudios reportados aquí muestran que el ingrediente AFD1 es seguro cuando se incorpora a alimentos completos y equilibrados para gatos.
Declaración de disponibilidad de datos
Los conjuntos de datos relacionados con la seguridad generados para este estudio se incluyen en el artículo/material complementario.
Declaración de Ética
El estudio en animales fue revisado y aprobado por el Comité Institucional de Cuidado y Uso de Animales (IACUC). Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
DC y LT ayudaron a preparar el protocolo, supervisaron parcialmente los estudios y contribuyeron en la preparación del manuscrito. RM ayudó a iniciar y monitorear los estudios realizados, y preparó y editó el manuscrito.
Conflicto de intereses
DC y LT son empleados de Nestlé Purina PetCare Global Resources, Inc. RM fue compensado por el seguimiento del estudio y la preparación del manuscrito.
Reconocimientos
Los autores desean agradecer a la Sra. Carrie Kennedy por la gestión del proyecto para este conjunto de estudios y a la Dra. Kimberly May por su aporte científico en el análisis de los datos.
Notas
1. ^No se proporcionó una dieta específica que los gatos consumían anteriormente; sin embargo, los gatos de repuesto se colocaron en la dieta Purina Savor Chicken and Rice si no estaban inscritos en el estudio.
2. ^Las mediciones del estudio se obtuvieron en unidades SI; Se utilizó un factor de conversión de 2.44 para proporcionar concentración en unidades convencionales.
Referencias
1. Dávila I, Domínguez-Ortega J, Navarro-Pulido A, Alonso A, Antolín-Amerigo D, González-Mancebo E, et al. Documento de consenso sobre alergia a perros y gatos. Alergia. (2018) 73:1206–22. doi: 10.1111/all.13391
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Bartholomé K, Kissler W, Baer H, Kopietz-Schulte E, Wahn U. ¿De dónde viene el alérgeno gato 1? J Alergia Clin Immunol. (1985) 76:503–6. doi: 10.1016/0091-6749(85)90734-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Charpin C, Mata P, Charpin D, Lavaut MN, Allasia C, Vervloet D. Distribución de alérgenos Fel d I en el pelaje y la piel de gato. J Alergia Clin Immunol. (1991) 88:77–82. doi: 10.1016/0091-6749(91)90303-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Grönlund H, Saarne T, Gafvelin G, van Hage M. El principal alérgeno de los gatos, Fel d 1, en el diagnóstico y la terapia. Int Arch Allergy Immunol. (2010) 151:265–74. doi: 10.1159/000250435
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Bonnet B, Messaoudi K, Jacomet F, Michaud E, Fauquert JL, Caillaud D, et al. Una actualización sobre los alérgenos moleculares de los gatos: Fel d 1 y ¿qué más? Capítulo 1: Fel d 1, el principal alérgeno de los gatos. Alergia Asma Clin Immunol. (2018) 14:14. doi: 10.1186/s13223-018-0239-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Al-Nasser A, Al-Khalaifa H, Al-Saffar A, Khalil F, Al-Bahouh M, Ragheb G, et al. Descripción general de la taxonomía y domesticación de pollos. Worlds Poultry Sci J. (2007) 63:285–300. doi: 10.1017/S004393390700147X
7. Patterson R, Youngner JS, Weigle WO, Dixon FJ. El metabolismo de las proteínas séricas en la gallina y el pollito y la secreción de proteínas séricas por el ovario de la gallina. J Gen Physiol. (1962) 45:501–13. doi: 10.1085/jgp.45.3.501
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Base de datos nacional de nutrientes del USDA como referencia estándar. Informe completo (todos los nutrientes) 01125: Huevo, yema, crudo, fresco. (2017). Disponible en línea en: https://ndb.nal.usda.gov/ndb/foods/show/114?format=Full (consultado el 18 de julio de 2019).
9. Satyaraj E, Gardner C, Filipi I, Cramer K, Sherril S. Reducción de Fel d 1 activo de gatos utilizando un anticuerpo IgY antiFel d 1 huevo. Immun Inflamación Dis. (2019) 7:68–73. doi: 10.1002/iid3.244
10. FFDCA. Código de los Estados Unidos, Título 21 – Alimentos y Medicamentos, Capítulo 9 – Ley Federal de Alimentos, Medicamentos y Cosméticos. (2019). Disponible en línea en: https://legcounsel.house.gov/Comps/Federal%20Food,%20Drug,%20And%20Cosmetic%20Act.pdf
11. OCDE 473. Prueba Nº 473. Ensayo de aberración cromosómica in vitro en mamíferos. (2016). Disponible en línea en: http://www.oecd.org/publications/test-no-473-in-vitro-mammalian-chromosomal-aberration-test-9789264264649-en.htm (consultado el 17 de julio de 2019).
12. Laflamme D. Desarrollo y validación de un sistema de puntuación de la condición corporal para gatos: una herramienta clínica. Práctica felina. (1997) 25:13–7.
13. OCDE 471. Guía de la OCDE para pruebas de productos químicos, prueba de mutación inversa bacteriana. (1997). Disponible en línea en: http://www.oecd.org/chemicalsafety/risk-assessment/1948418.pdf (consultado el 17 de julio de 2019).
14. Merck. Manual Merck: Manual Veterinario. (2019). Disponible en línea en: https://www.merckvetmanual.com/special-subjects/reference-guides (consultado el 19 de septiembre de 2019).
15. Moritz A, Fickenscher Y, Meyer K, Failing K, Weiss DJ. Valores de referencia de hematología canina y felina para el sistema de hematología ADVIA 120. Veterinario Clin Pathol. (2004) 33:32–8. doi: 10.1111/j.1939-165X.2004.tb00347.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Laboratorios IDEXX. Intervalos de referencia del analizador de hematología ProCyte Dx*. Software Vetlab* Station versión 4.48. (2017). Disponible en línea en: https://idexxcom-live-b02da1e51e754c9cb292133b-9c56c33.aldryn-media.com/filer_public/db/1d/db1d2a1e-ea9c-47fc-9695-1eda2be34199/procyte-dx-reference-ranges-en.pdf (consultado el 26 de noviembre de 2019).
17. Trumel C, Monzali C, Geffré A, Concordet DV, Hourqueig L, Braun JPD, et al. Variación biológica hematológica y bioquímica en gatos de laboratorio. J Am Assoc Lab Anim Sci. (2016) 55:503–9.
18. Riond B, Wabmuth AK, Hartnack S, Hofmann-Lehmann R, Lutz H. Estudio sobre la cinética y la influencia de la agregación y desagregación de plaquetas felinas. BMC Vet Res. (2015) 11:276. doi: 10.1186/s12917-015-0590-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Yankin I, Schaer M, Johnson M, Meland T, Londoño LA. Envenenamiento persistente de víbora en un gato. J Feline Med Surg Rep. Abierta (2017) 3:2055116917737463. doi: 10.1177/2055116917737463
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Stockham SL, Keeton KS, Szladovits B. Evaluación clínica de la leucocitosis: distinción de leucocitosis causadas por trastornos o afecciones inflamatorias, glucocorticoides, fisiológicas y leucémicas. Veterinario Clin Pequeño Anim Pract. (2003) 33:1335–57. doi: 10.1016/S0195-5616(03)00098-6
21. Hospital Docente de Medicina Veterinaria Davis de la Universidad de California. Intervalos de referencia de química clínica. (2010). Disponible en línea en: https://www.vetmed.ucdavis.edu/sites/g/files/dgvnsk491/files/local_resources/pdfs/lab_pdfs/UC_Davis_VMTH_Chem_Reference_Intervals.pdf (consultado el 16 de julio de 2019).
22. Engelen C, Moritz A, Barthel R, Bauer N. Intervalos de referencia preliminares y el impacto del tiempo de almacenamiento de citrato para la trombelastografía en gatos, incluidos delta y la curva de velocidad. BMC Vet Res. (2017) 13:366. doi: 10.1186/s12917-017-1278-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Kumar D, Kasukurti P, Murthy S. Eritrocitos y plaquetas: un análisis crítico de su relación ontogénica a través de parámetros automatizados. J Clin Diagn Res. (2017) 11:EC05–8. doi: 10.7860/JCDR/2017/25153.9807
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Kaneko JJ, Harvey JW, Bruss ML. Apéndice IX. Valores de referencia de analito sanguíneo en animales pequeños y algunos animales de laboratorio. En: Kaneko JJ, Harvey JW, Bruss ML, editores. Bioquímica Clínica de Animales Domésticos. 5ª ed. San Diego, CA: Academic Press. (1997). págs. 895-9.
25. Hospital de Enseñanza Médica Veterinaria Davis de la Universidad de California. Datos de referencia de aminoácidos para gatos. (2019). Disponible en línea en: https://www.vetmed.ucdavis.edu/index.php/labs/reference-data-cats (consultado el 2 de diciembre de 2019).
26. Tennant BC. Capítulo 13 – Función hepática. En: Kaneko JJ, Harvey JW, Bruss ML, editores. Bioquímica Clínica de Animales Domésticos. 5ª ed. San Diego, CA: Academic Press (1997). págs. 327-52. doi: 10.1016/B978-012396305-5/50014-2
27. Kramer JW, Hoffmann WE. Capítulo 12 – Enzimología clínica. En: Kaneko JJ, Harvey JW, Bruss ML, editores. Bioquímica Clínica de Animales Domésticos. 5ª ed. San Diego, CA: Academic Press (1997). págs. 303-25. doi: 10.1016/B978-012396305-5/50013-0
28. Justin RB, Hohenhaus AE. Hipofosfatemia asociada a alimentación enteral en gatos. J Veterinario Pasante Med. (1995) 9:228–33. doi: 10.1111/j.1939-1676.1995.tb01072.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Ueda Y, Hopper K, Epstein SE. Incidencia, gravedad y pronóstico asociados con la hiponatremia en perros y gatos. J Veterinario Pasante Med. (2015) 5:801–7. doi: 10.1111/jvim.12581
30. Barras de refuerzo AH, Boon GD, Christian JA. Perfil bioquímico en perro y gato. En: Serie de Manuales Clínicos de Nestlé Purina. Wilmington, Carolina del Norte: The Gloyd Group, Inc. (2004). págs. 1-108.
31. Klaassen JK. Valores de referencia en medicina veterinaria. Medicina de Laboratorio. (1999) 30:194–7. doi: 10.1093/labmed/30.3.194
32. Satyaraj E, Li Q, Sun P, Sherrill S. El ingrediente de huevo que contiene anticuerpos anti-Fel d1 immunoglobulin Y reduce los niveles de alérgenos en la saliva del gato. J Feline Med Surg. (2019) 21:875–81. doi: 10.1177/1098612X19861218
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Ikemori Y, Kuroki M, Peralta RC, Yokoyama H, Kodama Y. Protección de terneros neonatos contra la colibacilosis entérica mortal mediante la administración de yema de huevo en polvo de gallinas inmunizadas con Escherichia coli enterotoxigénica K99-piliada. Am J Vet Res. (1992) 53:2005–8.
34. Cocíname, trot DL. IgY: componente inmunológico de los huevos como fuente de inmunidad pasiva para ls y humanos. Worlds Poultry Sci J. (2005) 66:215–26. doi: 10.1017/S0043933910000279
35. Vega CG, Bok M, Vlasova AN, Chattha KS, Fernandez FM, Wigdorovitz A, et al. Los anticuerpos IgY protegen contra la diarrea inducida por rotavirus humano en el modelo de enfermedad de lechones gnotobióticos neonatales. PLoS UNO. (2012) 7:E42788. doi: 10.1371/journal.pone.0042788
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Schade R, Gutiérrez Calzado E, Sarmiento R, Aníbal Chacana P, Porankiewicz-Asplund J, Raúl Terzolo H. Anticuerpos contra la yema de huevo de gallina (tecnología IgY): una revisión del progreso en la producción y el uso en investigación y medicina humana y veterinaria. Animación de laboratorio alternativa. (2005) 33:129–54. doi: 10.1177/026119290503300208
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Sudjarwo SA, Indriyani W, Nasronudin N, Sudjarwo GW, Koerniasari K. Toxicidad oral aguda de la inmunoglobulina Y (IgY) contra el VIH en ratones. J Appl Pharm Sci. (2015) 5:123–6. doi: 10.7324/JAPS.2015.50218
38. Eriksson P, Loberg J, Andersson M. Un estudio de los refugios de gatos en Suecia. Bienestar Anim. (2009) 18:283–8.
39. Asociación Protectora de Animales de Estados Unidos. Mantener mascotas (perros y gatos) en hogares: un estudio de retención de tres fases. Fase I: Razones para no tener un perro o gato. (2012). Disponible en línea en: http://www.americanhumane.org/app/uploads/2016/08/aha-petsmart-retention-study-phase-1.pdf (consultado el 3 de junio de 2019).
40. Coe JB, Young I, Lambert K, Dysart L, Nogueira Borden L, Rajić A. Una revisión exploratoria de las investigaciones publicadas sobre la renuncia de animales de compañía. J Appl Anim Welfare Sci. (2014) 17:253–73. doi: 10.1080/10888705.2014.899910
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Weiss E, Gramann S, Drain N, Dolan E, Slater M. Modificación de la evaluación de la felina y la capacidad de predecir los comportamientos de los gatos adoptados en sus nuevos hogares. Animales. (2015) 5:71–88. doi: 10.3390/ani5010071
42. Zito S, Morton J, Vankan D, Paterson M, Bennett PC, Rand J, et al. Razones por las que las personas entregan gatos sin dueño y sin dueño a los refugios de animales australianos y barreras para asumir la propiedad de gatos sin dueño. J Appl Anim Welfare Sci. (2016) 19:303–19. doi: 10.1080/10888705.2016.1141682
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Svanes C, Zock J, Anto J, Dharmage S, Norbäck D, Wjst M, et al. ¿Influyen el asma y la alergia en la tenencia posterior de mascotas? Un análisis de la infancia y la edad adulta. J Alergia Clin Immunol. (2018) 118:691–8. doi: 10.1016/j.jaci.2006.06.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Konradsen JR, Fujisawa T, van Hage M, Hedlin G, Hilger C, Kleine-Tebbe J, et al. Alergia a los animales peludos: nuevos conocimientos, enfoques diagnósticos y desafíos. J Alergia Clin Immunol. (2015) 135:616–25. doi: 10.1016/j.jaci.2014.08.026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Heinzerling LM, Burbach GJ, Edenharter G, Bachert C, Bindslev-Jensen C, Bonini S, et al. GA(2)LEN skin test study I: GA(2)LEN harmonization of skin prick testing: novel sensitization patterns for inhalant allergins in Europe. Alergia. (2009) 64:1498–506. doi: 10.1111/j.1398-9995.2009.02093.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Dhami S, Kakourou A, Asamoah F, Agache I, Lau S, Marek J, et al. Inmunoterapia con alérgenos para el asma alérgica: revisión sistemática y metanálisis. Alergia. (2017) 72:1825–48. doi: 10.1111/all.13208
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Wickman M. Cuando las alergias complican las alergias. Alergia. (2005) 60:14–8. doi: 10.1111/j.1398-9995.2005.00852.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: felino, IgY, Fel d 1, alergénico, genotoxicidad
Cita: Matulka RA, Thompson L y Corley D (2020) Estudios de seguridad multinivel del ingrediente Anti Fel d 1 IgY en la comida para gatos. Frente. Vet. Sci. 6:477. doi: 10.3389/fvets.2019.00477
Recibido: 19 de julio de 2019; Aceptado: 05 de diciembre de 2019;
Publicado: 08 de enero de 2020.
Editado por:
Chi-Chung Chou, Universidad Nacional Chung Hsing, Taiwán
Revisado por:
Valerie Wong, IDEXX Laboratories, Inc., Estados
Unidos Leshuai Zhang, Universidad de Soochow, China
Derechos de autor © 2020 Matulka, Thompson y Corley. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Ray A. Matulka, rmatulka@burdockgroup.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía