Evaluación de la seguridad de un tampón utilizado en la liofilización de plaquetas caninas
 Evaluación de la seguridad de un tampón utilizado en la liofilización de plaquetas caninas: reacción de hipersensibilidad tipo I en perros causada por albúmina sérica bovina
Evaluación de la seguridad de un tampón utilizado en la liofilización de plaquetas caninas: reacción de hipersensibilidad tipo I en perros causada por albúmina sérica bovina
 Hee-Jae Choi1
Hee-Jae Choi1  Mu-Young Kim2
Mu-Young Kim2  Hyun-Jung Han1,3*
Hyun-Jung Han1,3*- 1Departamento de Emergencias Veterinarias y Cuidados Críticos, Facultad de Medicina Veterinaria, Universidad de Konkuk, Seúl (República de Corea)
- 2Departamento de Cirugía Veterinaria, Facultad de Medicina Veterinaria, Universidad de Konkuk, Seúl (República de Corea)
- 3Centro KU para la Ciencia Médica de la Sangre Animal, Universidad de Konkuk, Seúl, República de Corea
Introducción: El presente estudio fue diseñado para evaluar la seguridad de las sustancias generalmente utilizadas en la preparación de productos plaquetarios liofilizados (LPPs) debido a que la posibilidad de una respuesta inmune a la albúmina sérica bovina (BSA) se consideró alta cuando se utilizó la tecnología previamente descrita.
Métodos: Se realizó una prueba cutánea intradérmica, seguida de una prueba de provocación de fármacos, para observar los eventos adversos e identificar las sustancias responsables de una respuesta inmunitaria. Se utilizaron cinco beagles machos (2 años de edad) con un peso de 12 a 14 kg. Los perros estaban clínicamente sanos y no tenían antecedentes de uso de medicamentos. Se realizó una prueba cutánea intradérmica con cada sustancia [es decir, ácido etanosulfónico 4-(2-hidroxietil)-1-piperazina, cloruro de sodio, cloruro de potasio, bicarbonato de sodio, teofilina, trehalosa y BSA] utilizada en el método de liofilización convencional.
Resultados: En la prueba cutánea intradérmica, tres perros dieron positivo en el lugar de la inyección de BSA y mostraron signos clínicos después de la inyección intradérmica, incluyendo náuseas y vómitos. Para la prueba de provocación de drogas, todos los perros recibieron dos inyecciones intravenosas de una solución tampón LPP. La inyección inicial estaba desprovista de BSA, mientras que la inyección posterior contenía BSA. Los tres perros que habían reaccionado a la BSA en la prueba cutánea intradérmica mostraron eventos adversos como letargo, vómitos y náuseas inmediatamente después de la inyección intravenosa del tampón LPP que contenía BSA. Todos los perros se recuperaron sin complicaciones después del tratamiento sintomático en ambas pruebas.
Discusión: La alta incidencia y gravedad de las reacciones de hipersensibilidad tipo I observadas en este estudio sugieren que la BSA no es adecuada como componente de la LPP canina.
1 Introducción
Se han llevado a cabo numerosas investigaciones sobre la liofilización de plaquetas en medicina humana y veterinaria para abordar los desafíos asociados con la recolección y conservación de plaquetas frescas y la mejora de su accesibilidad para la transfusión de plaquetas (1-4). Las plaquetas liofilizadas tienen varias ventajas, incluida una vida útil extremadamente larga y un almacenamiento y transporte convenientes. Sin embargo, a temperaturas inferiores a 20 °C, las plaquetas se activan y la estructura de la membrana sufre una deformación irreversible, como la transición de una forma discoide a una forma esférica, activando así los filopodios y secretando gránulos α (1, 2). Para minimizar la desintegración estructural en estado liofilizado, se utilizan sustancias protectoras como el paraformaldehído o los sacáridos para evitar el deterioro de las propiedades estructurales y funcionales intrínsecas de las plaquetas (3). Los sacáridos como la trehalosa, la dextrosa y la polisacarosa-400 se utilizan comúnmente.
La albúmina, una proteína biológica simple que se encuentra predominantemente en el plasma sanguíneo, está comúnmente involucrada en la prevención de la agregación plaquetaria durante los procesos de secado y rehidratación. Además, tiene un papel importante en el proceso de liofilización al servir como agente de carga y estabilizar las plaquetas (3). En los estudios publicados hasta la fecha (3-5), se ha utilizado albúmina heteróloga, como la albúmina sérica humana o bovina (ASC), debido a la escasez y disponibilidad de albúmina sérica canina. La BSA es una proteína soluble en agua derivada de las vacas. En varios experimentos de laboratorio, el BSA se ha utilizado generalmente como un estándar de concentración de proteínas y se ha agregado a los medios de cultivo celular para funcionar como estabilizador o para apoyar el crecimiento celular (6). El mecanismo de protección sigue sin estar claro, aunque se sabe que el BSA mejora la recuperación posterior a la congelación y la supervivencia de las células liofilizadas al aumentar la temperatura de transición vítrea de la muestra, y se utiliza ampliamente como tampón extracelular en la liofilización de las células (7-9).
Sin embargo, la preocupación más importante en el uso de BSA para plaquetas liofilizadas caninas es el potencial para inducir una respuesta inmune en los receptores, debido a las diferencias de especies. En medicina veterinaria, los investigadores han informado que el BSA podría ser inmunogénico en perros, por lo que no es adecuado para uso terapéutico (10, 11). Ohmori et al. (11) describieron una posible reacción de hipersensibilidad a la ASB en perros y la relación entre la ASB en medicamentos intravenosos y la ingestión de carne de res. Por lo tanto, el uso de BSA en la liofilización de plaquetas puede inducir respuestas inmunitarias como reacciones de hipersensibilidad inmediatas o retardadas, que pueden poner en peligro la vida en pacientes críticos.
Sin embargo, hasta la fecha, la mayoría de los estudios sobre plaquetas liofilizadas han utilizado BSA como sustituto de la albúmina sérica canina, debido a la disponibilidad limitada y al alto costo de la albúmina específica canina. A pesar de su uso común, las preocupaciones persistentes con respecto a la inmunogenicidad de BSA impulsaron nuestra hipótesis de que los componentes de BSA en plaquetas caninas liofilizadas podrían inducir una respuesta inmune grave. Este estudio fue diseñado para evaluar la seguridad in vivo de materiales comúnmente utilizados en la preparación de productos plaquetarios liofilizados caninos (LPP), incluyendo BSA. Los objetivos de este estudio fueron: (4) evaluar exhaustivamente la seguridad y la viabilidad comercial de la LPP existente producida en laboratorio en perros, al tiempo que se evaluaban los peligros potenciales asociados con el uso de BSA para la liofilización de plaquetas caninas, y (12) investigar la viabilidad y la necesidad de alternativas más seguras para BSA en la producción de plaquetas liofilizadas caninas.
2 Materiales y métodos
2.1 Animales
Se utilizaron cinco beagles machos de 2 años de edad con un peso de 12 a 14 kg. Los perros estaban clínicamente sanos y no tomaban ningún medicamento que pudiera influir en las respuestas inmunitarias. Fueron alimentados rutinariamente con alimentos secos a base de carne de res y mostraron una buena tolerancia sin ninguna reacción adversa aparente. Los resultados de los análisis de sangre, incluidos los hemogramas completos, los electrolitos séricos y los productos químicos, estuvieron dentro de los rangos de referencia para todos los perros. Este estudio fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Konkuk (Seúl, República de Corea; número de aprobación: KU21059).
2.2 Diseño del estudio y clasificación de los grupos experimentales
El presente estudio fue diseñado y realizado para evaluar la seguridad de cada una de las sustancias frecuentemente utilizadas en la producción de LPPs caninos. ácido etanosulfónico 4-(2-hidroxietil)-1-piperazina (HEPES), cloruro de sodio (NaCl), cloruro de potasio (KCl), bicarbonato de sodio (NaHCO)3), se evaluaron los niveles de teofilina, trehalosa, dextrosa, polisacarosa-400 y BSA al 5%. Estos objetos se inyectaron por vía intradérmica y luego por vía intravenosa en perros beagle sanos, y los perros fueron monitoreados en busca de signos clínicos que indicaran una respuesta inmune.
2.3 Prueba cutánea intradérmica
Cada componente del tampón (es decir, HEPES, NaCl, KCl, NaHCO3, teofilina, trehalosa, dextrosa, polisacarosa-400 y BSA al 5%) para las pruebas cutáneas intradérmicas (IDST). La IDST se administró en el tórax lateral. El vello se eliminó suavemente con una maquinilla eléctrica sin utilizar ningún agente químico, y los puntos de inyección se marcaron para garantizar una distancia mínima de 2 cm entre cada sitio. Utilizando una aguja de calibre 26 conectada a una jeringa desechable de 1 ml, las inyecciones se administraron a un volumen de 0,05 ml de solución salina estéril (es decir, control negativo), 0,05 ml de fosfato de histamina a una concentración de 1:100.000 (es decir, control positivo) y todos los componentes tampón individuales diluidos en una concentración de 1:1.000, después de una preparación adecuada. Los sitios de prueba se evaluaron a los 15 minutos y 30 minutos después de la inyección, garantizando la prevención de cualquier interferencia o daño por parte de los animales.
Las reacciones se puntuaron asignando una puntuación de 0 a la inyección de solución salina y una puntuación de 4+ al control positivo. Se utilizaron evaluaciones subjetivas para comparar las respuestas alergénicas entre los dos grupos de control. Un índice de reacción de 2+ o superior se consideró potencialmente significativo y requirió una correlación completa con el material inyectado.
2.4 Prueba de provocación de drogas (inyección intravenosa)
La prueba de provocación farmacológica se llevó a cabo mediante la administración intravenosa de la solución tampón LPP con o sin el componente sospechoso de inducir reacciones durante el IDST. Si los perros presentaban reacciones cutáneas después de la IDST, se procedió a la prueba de provocación de drogas después de la remisión completa de la erupción cutánea (es decir, 1 mes después de la IDST).
Antes de la inyección intravenosa, se colocó un catéter intravenoso de 22 G en la vena cefálica izquierda de cada perro. La solución de control negativo se administró utilizando una solución tampón LPP sin el material sospechoso. Después de inyectar el control negativo, el tampón LPP que contiene todos los componentes en un volumen equivalente a la dosis terapéutica de LPP (3,3 × 109 PLTs/kg) se inyectó lentamente por vía intravenosa en cada perro durante 15 min. La inyección intravenosa se suspendió inmediatamente en caso de reacciones adversas, y el perro sintomático recibió el tratamiento adecuado, según fuera necesario. Todos los perros fueron monitoreados durante 14 días después de la prueba.
2.5 Examen previo y posterior a la prueba
Examen físico: Se realizó un examen físico completo, que consistió en la observación general del comportamiento y el nivel de conciencia, la evaluación del color de las membranas mucosas y el tiempo de llenado capilar para cada perro antes y después de las inyecciones intradérmicas e intravenosas. Se monitorizaron y registraron los signos vitales, que incluían la presión arterial sistémica (rango de referencia: 90-140 mmHg), la frecuencia respiratoria (rango de referencia: 15-30 lpm), la frecuencia del pulso (rango de referencia 80-160 lpm) y la temperatura rectal (rango de referencia: 38-39 °C). El índice de choque, definido como la frecuencia cardíaca/presión arterial sistólica, se evaluó antes y después de la inyección intravenosa para evaluar cualquier choque oculto o en curso (11). En caso de cualquier evento adverso potencialmente mortal, se suspendió la inyección y se proporcionó tratamiento de apoyo, según fuera necesario.
Signos clínicos: En el presente estudio, los perros fueron observados durante un cierto período después de cada prueba. Los perros fueron monitoreados de cerca para detectar signos clínicos que indicaran reacciones adversas como cambios en el nivel de conciencia, fiebre, náuseas, vómitos, edema y otros signos de shock. Los perros fueron observados durante 24 h y 2 semanas después de la IDST y después de una sola inyección intravenosa, respectivamente.
Análisis hematológico: Se realizó un hemograma completo a cada perro utilizando un sistema de hematología por citometría de flujo (ProCyte Dx; IDEXX Laboratories, Inc., Westbrook, ME, Estados Unidos). Las concentraciones de plaquetas, glóbulos rojos y glóbulos blancos se analizaron como examen previo a la prueba. No se analizaron los resultados de la bioquímica sérica.
Indicador de Naranjo: El Algoritmo de Naranjo, también conocido como Escala de Probabilidad de Reacciones Adversas a Medicamentos, utiliza un conjunto de aproximadamente 10 criterios de evaluación de causalidad (13). Estos criterios se puntúan individualmente. La puntuación total determina el grado de causalidad entre un evento clínico identificado y la administración del fármaco. La interpretación de las puntuaciones es la siguiente: una puntuación total de 9 o superior indica una relación causal definida, una puntuación entre 5 y 8 sugiere una relación causal probable, una puntuación entre 1 y 4 indica una posible relación causal y una puntuación de 0 o inferior implica una relación causal dudosa. Después del experimento, todos los perros fueron puntuados utilizando el indicador Naranjo.
2.6 Métodos estadísticos
Los datos obtenidos se sometieron a un análisis estadístico descriptivo que incluyó el cálculo de frecuencias y medias absolutas y relativas utilizando el software Microsoft Office Excel 2013 (Microsoft, Estados Unidos de América).
3 Resultados
En la Tabla 1 se presenta un resumen de los resultados del estudio. Los detalles sobre los registros de signos vitales, los eventos adversos, el tratamiento y las puntuaciones de cada sistema de puntuación se proporcionan en el Material Complementario. Tres perros (3/5; 60%) desarrollaron reacciones cutáneas después de la IDST. Se observó una respuesta positiva en los sitios de inyección del sitio de control positivo (es decir, fosfato de histamina) y el sitio de BSA. En la inspección visual, se asignó una puntuación de 4+ al control positivo y al sitio de inyección de BSA (Figura 1). Los perros que mostraron reacciones cutáneas positivas a la BSA desarrollaron respuestas cutáneas locales y demostraron reacciones sistémicas, especialmente después de la inyección intradérmica de BSA durante el IDST. Los tres perros sintomáticos tuvieron náuseas y dos perros vomitaron. No se produjeron cambios notables en los signos vitales antes y después de la IDST. Dos (2/5; 40%) perros que no desarrollaron ningún signo clínico tuvieron resultados negativos de IDST, excepto en el sitio de control positivo.
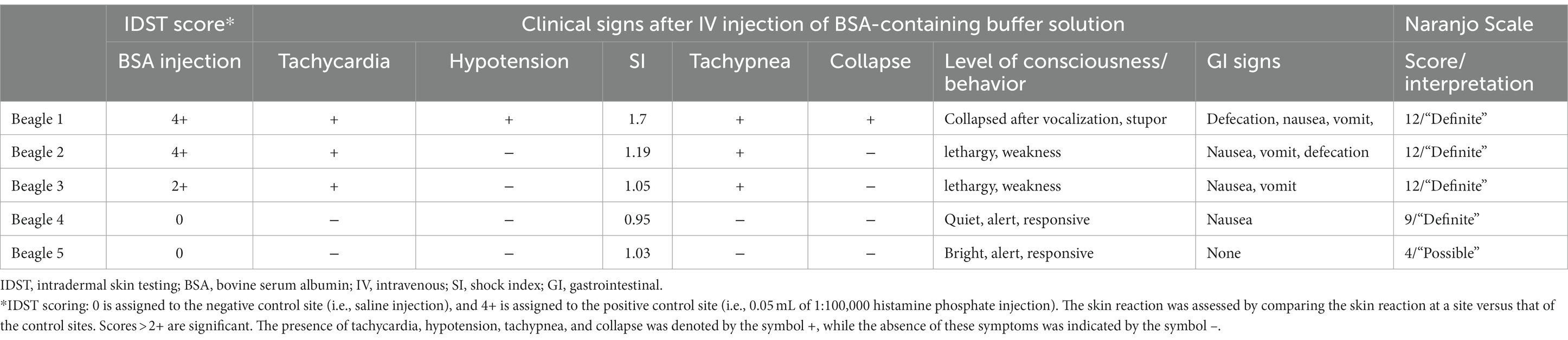 Tabla 1. Puntuaciones de las pruebas cutáneas intradérmicas, signos clínicos después de la inyección intravenosa de BSA y puntuación de la escala de Naranjo en cinco perros beagle.
Tabla 1. Puntuaciones de las pruebas cutáneas intradérmicas, signos clínicos después de la inyección intravenosa de BSA y puntuación de la escala de Naranjo en cinco perros beagle.
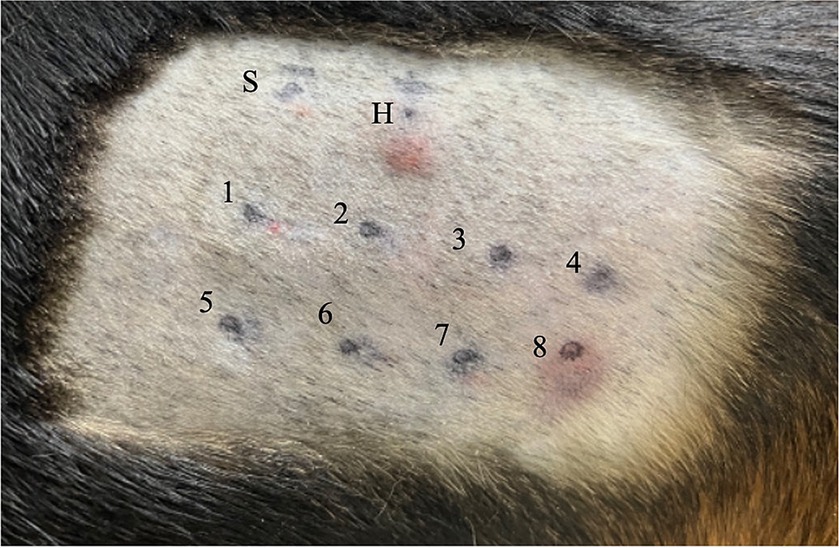
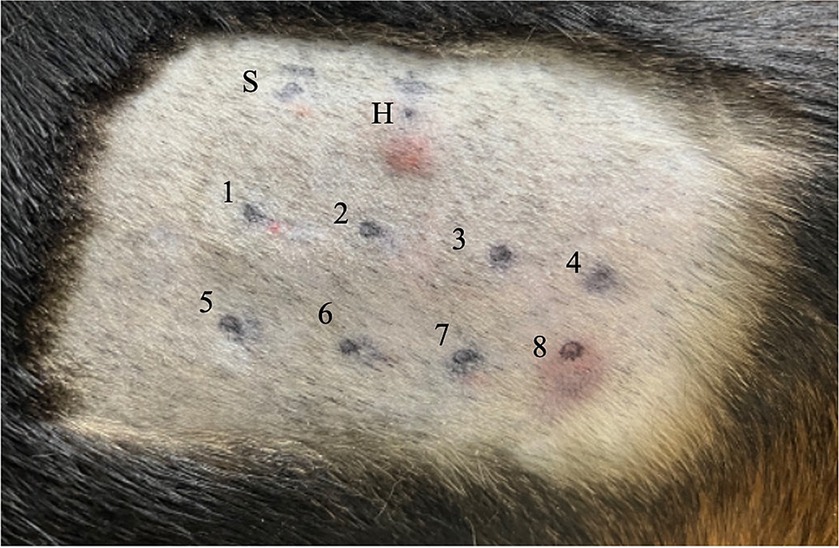 Figura 1. Resultados de la prueba cutánea intradérmica para Beagle 1. Cada sitio de inyección se indica de la siguiente manera: el sitio S se inyecta con solución salina estéril 0,9 (es decir, control negativo); sitio H, 0,05 mL de fosfato de histamina 1:100.000 (es decir, control positivo); sitio 1, NaCl; sitio 2, KCl; sitio 3, NaHCO3; sitio 4, teofilina; sitio 5, trehalosa; sitio 6, dextrosa; sitio 7, polisacarosa-400; y el sitio 8, BSA. Se ha producido una reacción positiva, con una puntuación de 4+, basada en la inspección visual, en los sitios H y 8. NaCl, cloruro de sodio; KCl: cloruro de potasio; NaHCO3, bicarbonato de sodio; BSA: albúmina sérica bovina.
Figura 1. Resultados de la prueba cutánea intradérmica para Beagle 1. Cada sitio de inyección se indica de la siguiente manera: el sitio S se inyecta con solución salina estéril 0,9 (es decir, control negativo); sitio H, 0,05 mL de fosfato de histamina 1:100.000 (es decir, control positivo); sitio 1, NaCl; sitio 2, KCl; sitio 3, NaHCO3; sitio 4, teofilina; sitio 5, trehalosa; sitio 6, dextrosa; sitio 7, polisacarosa-400; y el sitio 8, BSA. Se ha producido una reacción positiva, con una puntuación de 4+, basada en la inspección visual, en los sitios H y 8. NaCl, cloruro de sodio; KCl: cloruro de potasio; NaHCO3, bicarbonato de sodio; BSA: albúmina sérica bovina.
Cuatro perros presentaron signos clínicos sistémicos a leves graves después de la inyección intravenosa de un tampón que contenía BSA. Los Beagles 1, 2 y 3 tuvieron respuestas adversas inmediatas, incluyendo alteración del estado mental, vómitos, vocalización, defecación y angioedema poco después del inicio. Por lo tanto, se detuvo la inyección. Los tres perros tuvieron reacciones positivas a BSA en IDST. El Beagle 4, que tuvo una reacción negativa a la BSA en el IDST, presentó síntomas gastrointestinales leves, como náuseas y vómitos.
El Beagle 1 colapsó repentinamente con múltiples síntomas gastrointestinales como náuseas y vómitos, y la presión arterial sistólica disminuyó drásticamente de 154 mmHg a 98 mmHg. La frecuencia cardíaca del perro aumentó de 96 lpm a 170 lpm. El índice de choque se elevó por encima de 1, habiendo aumentado de 0,62 a 1,7, lo que indicaba una mayor probabilidad de shock anafiláctico. La administración de la solución tampón LPP se detuvo inmediatamente. El perro se recuperó después del tratamiento con epinefrina (0,01 mg/kg IV), difenhidramina (2 mg/kg IV), bolo cristaloide (20 ml/kg IV), maropitant (1 mg/kg SC) y famotidina (1 mg/kg IV, lentamente durante 5 min). Los Beagles 2 y 3 también mostraron un estado mental alterado, debilidad, náuseas, vómitos, defecación y angioedema facial poco después del inicio de la inyección de BSA. Los perros se recuperaron sin complicaciones después del tratamiento de apoyo con antihistamínicos, antieméticos, protectores gastrointestinales y fluidoterapia intravenosa. El Beagle 4 presentó náuseas después de la inyección de tampón que contenía BSA; por lo tanto, se administró un antiemético. El Beagle 4 se recuperó espontáneamente sin más tratamiento de emergencia. Finalmente, el Beagle 5 recibió una inyección intravenosa sin ningún evento adverso. No se observaron otros efectos adversos en ninguno de los cinco perros durante el período de observación de 14 días (Tabla 1).
El indicador Naranjo fue puntuado para todos los perros (Tabla 2). Se obtuvieron puntuaciones correspondientes a «definitivo» para los cuatro perros reactivos, y puntuaciones correspondientes a «posible» para el 5º beagle, que no presentó síntomas clínicos tras la inyección intravenosa (13).
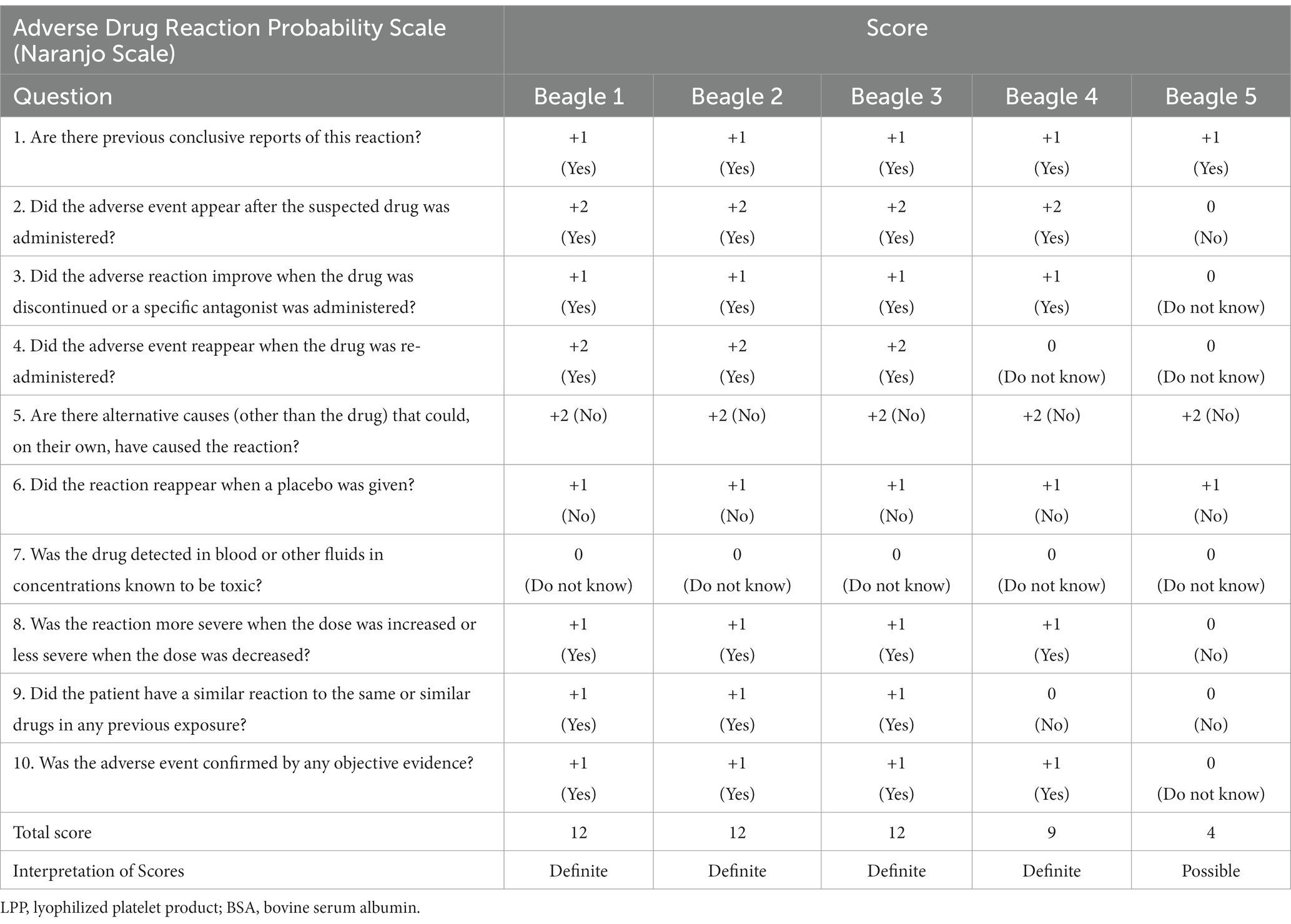 Tabla 2. Puntuaciones de la escala de probabilidad de reacciones adversas a medicamentos Naranjo en cinco perros beagle evaluados después de la inyección de tampón LPP que contenía BSA.
Tabla 2. Puntuaciones de la escala de probabilidad de reacciones adversas a medicamentos Naranjo en cinco perros beagle evaluados después de la inyección de tampón LPP que contenía BSA.
4 Discusión
El presente estudio fue diseñado para evaluar la seguridad de las sustancias generalmente utilizadas para la liofilización de plaquetas (3-5, 12) antes de desarrollar productos plaquetarios liofilizados caninos listos para usar. Los resultados del estudio actual indican que la BSA, una proteína heteróloga para perros, no es adecuada para la fabricación de productos plaquetarios liofilizados caninos debido a problemas de seguridad inmunológica.
La BSA es una proteína barata y fácilmente disponible que se utiliza en diversos productos y procedimientos biológicos, como vacunas pediátricas, inseminación artificial, adhesivos tisulares, agentes hemostáticos y sistemas de administración de nanocáncer (14-18). Aunque solo se utiliza una pequeña cantidad que se considera segura, se están reportando repetidamente casos de anafilaxia en humanos. En 2008, Pagán et al. (14) reportaron un caso de reacción anafiláctica en una mujer de 30 años sometida a inseminación artificial estándar. La prueba de punción cutánea, los resultados de inmunoglobulina E (IgE) y la inmunotransferencia de electroforesis en gel de poliacrilamida dodecilsulfato de sodio IgE sugirieron fuertemente que la BSA presente en el medio de cultivo de inseminación podría ser el origen de la reacción anafiláctica. De Silva et al. (18) investigaron a pacientes con alergia a la leche de vaca que desarrollaron anafilaxia en respuesta a las vacunas en Sri Lanka. Con base en los hallazgos del estudio antes mencionado, la BSA en las vacunas causó reacciones alérgicas en niños con alergia a la leche de vaca porque el 76,5% de los niños de la cohorte estaban sensibilizados a BSA, según los resultados de IgE específica de BSA.
Se han reportado reacciones de hipersensibilidad a las inyecciones orales, intradérmicas, intramusculares e intravenosas de BSA en perros (10, 19–23). Sobre la base de estos estudios, el BSA es inadecuado para su uso terapéutico en caninos. Mosley et al. (10) se propusieron evaluar el potencial de la BSA como una opción de tratamiento alternativo rentable y fácilmente disponible para reemplazar la albúmina sérica humana, que se usa comúnmente en perros hipoalbumínicos. De acuerdo con una encuesta realizada por Yozova et al. (24), 1.134 veterinarios de 42 países han informado de que la albúmina sérica humana se utiliza con más frecuencia que la albúmina canina, a pesar de los riesgos potenciales asociados a los efectos adversos. Este estudio experimental reveló reacciones adversas en perros sanos después de dos inyecciones de BSA. Con una dosis intravenosa de 500 mg/kg de BSA, un perro (1/10; 10%) desarrolló reacciones inmediatas como urticaria leve y prurito después de la primera inyección. Después de la segunda inyección en dos perros, se produjo una reacción grave de hipersensibilidad tipo I en uno (50%) de los perros. Ohmori et al. (19) informan que el BSA incluido en las vacunas para perros puede funcionar como un alérgeno, y pueden ocurrir reacciones alérgicas en los perros después de la vacunación. Los hallazgos de los estudios antes mencionados sugieren que el BSA es inadecuado como agente terapéutico para los perros, y puede desencadenar una respuesta alérgica cuando se usa como vacuna. La anafilaxia causada por la vacunación es poco frecuente; Por lo tanto, los veterinarios siempre deben ser cautelosos porque la vacunación puede provocar manifestaciones cardiovasculares o respiratorias potencialmente mortales (10, 21, 22).
En este estudio, se realizó una prueba cutánea intradérmica para identificar las posibles respuestas inmunogénicas a cada componente. Las pruebas cutáneas intradérmicas y de punción cutánea se emplean ampliamente en la medicina humana porque son prácticas, convenientes y confiables. El IDST sirve como el medio principal para evaluar la sensibilización a las drogas sospechosas (25, 26). La IDST se utiliza habitualmente en medicina veterinaria, especialmente para el diagnóstico de enfermedades mediadas por IgE. Los alérgenos individuales se inyectaron por vía intradérmica (generalmente, 0,05 ml de volumen) en el sitio IDST. En la interpretación de la IDST, las puntuaciones de reacción cutánea >2+ se consideran potencialmente significativas y deben interpretarse en combinación con los signos clínicos y la historia clínica (25, 26).
En este estudio, tres perros con puntuaciones de reacción cutánea superiores a 2+ para BSA mostraron náuseas después de la inyección de BSA durante el IDST. Entre estos perros, dos desarrollaron una reacción cutánea sustancial con una puntuación de 4+ en respuesta a la BSA y posteriormente experimentaron náuseas y vómitos. Estos perros estaban clínicamente sanos antes de la IDST y no tenían antecedentes de enfermedades ni medicamentos. Dado que los síntomas gastrointestinales se manifestaron en tres perros con respuestas positivas a BSA en IDST en este estudio, es muy probable que BSA funcione como un alérgeno sustancial en perros.
Las reacciones adversas a la medicación se diagnostican de la siguiente manera: Se evalúan las historias clínicas y los signos clínicos cuando se sospecha una reacción de hipersensibilidad al medicamento. Las pruebas cutáneas o de laboratorio se realizan cuando existe la posibilidad de hipersensibilidad a los medicamentos en función de los antecedentes y los síntomas del paciente. Si están disponibles, se pueden agregar pruebas in vitro (27, 28). Los resultados positivos de las pruebas cutáneas o de laboratorio indican que el fármaco sospechoso puede causar hipersensibilidad. Las pruebas de provocación están indicadas cuando la droga desencadenante no puede ser identificada por pruebas cutáneas o de laboratorio (27, 28).
En este estudio, se utilizaron inyecciones intravenosas de solución tampón LPP con o sin BSA para la prueba de provocación de fármacos. Tres perros que tuvieron una respuesta cutánea positiva en el IDST anterior mostraron signos clínicos sistémicos agudos como estado mental alterado, debilidad, vómitos y angioedema facial después de la inyección de una solución tampón que contenía BSA. Además, entre los dos perros que no mostraron ninguna respuesta significativa durante el IDST, un perro experimentó un inicio inmediato de náuseas al iniciar una inyección intravenosa de la solución tampón que contenía BSA. En un estudio previo de Mosley et al. (10) en el que se inyectó un concentrado de BSA para evaluar su uso clínico en 10 perros sanos, se observaron reacciones agudas como reacción anafiláctica grave (hipersensibilidad tipo I), urticaria leve y prurito en tres perros después de la inyección intravenosa. La reacción a la inyección de BSA fue similar a la observada en este estudio.
La hipersensibilidad se puede clasificar en función de las células implicadas y de la velocidad a la que se produce la reacción. La hipersensibilidad de tipo I se manifiesta en dos etapas distintas: la sensibilización y la etapa de efecto posterior. La reexposición de un huésped presensibilizado al antígeno puede dar lugar a reacciones agudas caracterizadas por vasodilatación y contracción del músculo liso. En el presente estudio, se produjo una respuesta inmunitaria aguda inmediatamente después de la inyección de BSA, y los perros sintomáticos mostraron signos típicos como edema, náuseas, vómitos y cambios en el nivel de conciencia. En particular, los perros de este estudio mantuvieron una dieta regular de alimentos secos que consistía principalmente en carne de vacuno y mostraron una buena tolerancia sin reacciones adversas significativas. Nuestra hipótesis es que esta dieta puede haber contribuido a la fase de sensibilización, influyendo potencialmente en las respuestas inmunitarias observadas. Por lo tanto, la probabilidad de hipersensibilidad tipo I es plausible. Estas respuestas inmunitarias se resolvieron después del tratamiento de emergencia, incluida la administración de epinefrina y antihistamínicos.
El algoritmo de Naranjo, también llamado Escala de Naranjo, es un cuestionario desarrollado por Naranjo et al. para evaluar la probabilidad de reacciones adversas a medicamentos en medicina humana (13). El algoritmo de Naranjo consta de 10 preguntas que se responden con «Sí», «No» o «No sé». Se asignaron diferentes puntos a cada respuesta y se evaluó la puntuación total. Las 10 preguntas incluyen la relación entre los medicamentos y la ocurrencia de eventos adversos a medicamentos, como la administración y la ocurrencia de eventos adversos a medicamentos; la reacción del paciente después de la interrupción o readministración del fármaco; evaluación de la posibilidad de que otras fuentes distintas al fármaco y la enfermedad subyacente del paciente puedan estar implicadas; y elementos como la presencia o ausencia de una reacción similar al fármaco, la respuesta a la administración de placebo, la medición de la concentración del fármaco y la presencia o ausencia de una prueba objetiva que respalde los eventos adversos del fármaco. Se sabe que el algoritmo de Naranjo tiene una alta precisión predictiva para la determinación de verdaderas reacciones adversas a medicamentos en casos sospechosos (13, 29). La escala de Naranjo se utiliza ocasionalmente para pacientes veterinarios cuando surge una sospecha de reacción adversa a un medicamento, debido a la ausencia de una escala equivalente en medicina veterinaria (30-32). Dada la considerable sospecha de hipersensibilidad tipo I inducida por la ASC en nuestro estudio y la ausencia de una escala de probabilidad de reacciones adversas a medicamentos específica diseñada para medicina veterinaria, empleamos la escala de Naranjo, una herramienta comúnmente utilizada en medicina humana. En el estudio actual, la puntuación de la escala de Naranjo fue «definitiva» para los cuatro perros sintomáticos, lo que sugiere una alta probabilidad de que la BSA actúe como un alérgeno significativo. En el presente estudio, se desarrollaron signos clínicos significativos después de la inyección intradérmica intravenosa de un tampón que contenía BSA. Teniendo en cuenta los resultados de este estudio y la Escala de Probabilidad de Reacciones Adversas a Medicamentos de Naranjo, que obtuvo una puntuación «definitiva» en cuatro perros (4/5, 80%), la inclusión de BSA en el tampón LPP canino supone un alto riesgo de inducir reacciones de hipersensibilidad tipo I. Por lo tanto, se recomienda evitar el BSA en perros, especialmente cuando se preparan plaquetas liofilizadas. El BSA debe excluirse de los componentes del tampón LPP para prevenir reacciones anafilácticas en pacientes que reciben productos plaquetarios liofilizados.
Este estudio tuvo algunas limitaciones. En primer lugar, no realizamos pruebas in vitro, como las pruebas serológicas. Si se hubieran realizado pruebas serológicas, los perros sin signos clínicos o con signos clínicos leves podrían haber tenido un aumento en los niveles séricos de IgE. Las pruebas de IgE cutánea y sérica son complementarias; Por lo tanto, la aplicación simultánea de ambas pruebas debe considerarse en estudios que investiguen poblaciones sensibilizadas (33). No se pudo proceder con las pruebas específicas de IgE debido a la falta de muestras de suero. Se justifican estudios adicionales que incluyan pruebas de IDST e IgE sérica. Por último, el pequeño tamaño de la muestra en el presente estudio puede haber dado lugar a errores de tipo 2.
En conclusión, el BSA parece ser un componente inapropiado para la fabricación de productos plaquetarios liofilizados caninos debido a su potencial inmunogenicidad debido a las diferencias de especies, como se indica en el presente estudio. Aunque el BSA se ha utilizado comúnmente para la estabilización y restauración de la morfología plaquetaria apropiada después de la resuspensión de plaquetas liofilizadas, los resultados del presente estudio sugieren que se requiere un material alternativo para sustituir al BSA para la fabricación de plaquetas liofilizadas caninas. Además, teniendo en cuenta el alto riesgo de reacciones de hipersensibilidad a la BSA en perros, se debe tener precaución con cualquier producto que contenga BSA destinado a ser utilizado en perros, incluidas las vacunas, los medicamentos, los adhesivos tisulares y los agentes hemostáticos.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Konkuk. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
H-JC: Conceptualización, Curación de datos, Redacción – borrador original. M-YK: Conceptualización, Investigación, Escritura – Revisión y Edición. H-JH: Metodología, Supervisión, Redacción – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que este estudio se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como potenciales conflictos de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1344037/full#supplementary-material
Abreviaturas
BSA: Albúmina sérica bovina; HEPES: ácido etanosulfónico 4-(2-hidroxietil)-1-piperazina; IDST: Prueba cutánea intradérmica; LPP: Producto plaquetario liofilizado; NaCl, cloruro de sodio; KCl: Cloruro de potasio; NaHCO3, bicarbonato de sodio; IgE: Inmunoglobulina E.
Referencias
1. Hoffmeister, KM, Felbinger, TW, Falet, H, Denis, CV, Bergmeier, W, Mayadas, TN, et al. El mecanismo de eliminación de las plaquetas de la sangre enfriada. Célula. (2003) 112:87–97. doi: 10.1016/s0092-8674(02)01253-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Tablin, F, Wolkers, WF, Walker, NJ, Oliver, AE, Tsvetkova, NM, Gousset, K, et al. Reorganización de la membrana durante el enfriamiento: implicaciones para la estabilización a largo plazo de las plaquetas. Criobiología. (2001) 43:114–23. doi: 10.1006/cryo.2001.2355
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Bode, AP, y Fischer, TH. Plaquetas liofilizadas: cincuenta años de elaboración. Artif Cells Blood Substit Biotechnol. (2007) 35:125–33. doi: 10.1080/10731190600974962
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Pietramaggiori, G, Kaipainen, A, Ho, D, Orser, C, Pebley, W, Rudolph, A, et al. Plaquetas liofilizadas con trehalosa para la cicatrización de heridas. Regeneración reparadora de heridas. (2007) 15:213–20. doi: 10.1111/j.1524-475X.2007.00207.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Read, MS, Reddick, RL, Bode, AP, Bellinger, DA, Nichols, TC, Taylor, K, et al. Preservación de las propiedades hemostáticas y estructurales de las plaquetas liofilizadas rehidratadas: potencial para el almacenamiento a largo plazo de plaquetas secas para transfusión. Proc Natl Acad Sci. (1995) 92:397–401. doi: 10.1073/pnas.92.2.397
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Wolkers, WF, Walker, NJ, Tamari, Y, Tablin, F y Crowe, JH. Hacia una aplicación clínica de plaquetas humanas liofilizadas. Cell Preserv Technol. (2003) 1:175–88. doi: 10.1089/153834402765035617
7. Zhou, X, Zhu, H, Zhang, S, Zhu, F, Chen, G y Yan, L. Liofilización de plaquetas humanas: influencia de la trehalosa intracelular y los protectores extracelulares. Crio-Letras. (2006) 27:43–50.
8. Shinyashiki, N, Yamamoto, W, Yokoyama, A, Yoshinari, T, Yagihara, S, Kita, R, et al. Transiciones vítreas en soluciones acuosas de proteína (albúmina sérica bovina). J Phys Chem B. (2009) 113:14448–56. DOI: 10.1021/JP905511W
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Tang, M, Wolkers, WF, Crowe, JH y Tablin, F. Las plaquetas de sangre humana rehidratadas liofilizadas regulan el pH intracelular. Transfusión. (2006) 46:1029–37. doi: 10.1111/j.1537-2995.2006.00838.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Mathews, MC. El uso de albúmina sérica bovina concentrada en caninos. Veterinario Anaesth Analg. (2005) 32:14–5. doi: 10.1111/j.1467-2995.2005.00232a_2.x.
11. Porter, AE, Rozanski, EA, Sharp, CR, Dixon, KL, Price, LL, y Shaw, SP. Evaluación del índice de choque en perros que se presentan como emergencias. J Vet Emerg Crit Care. (2013) 23:538–44. doi: 10.1111/vec.12076
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Wolkers, WF, Walker, NJ, Tablin, F y Crowe, JH. Las plaquetas humanas cargadas con trehalosa sobreviven a la liofilización. Criobiología. (2001) 42:79–87. doi: 10.1006/cryo.2001.2306
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Naranjo, CA, Busto, U, Sellers, EM, Sandor, P, Ruiz, I, Roberts, EA, et al. Método para estimar la probabilidad de reacciones adversas a medicamentos. Clin Pharmacol Ther. (1981) 30:239–45. doi: 10.1038/clpt.1981.154
14. Pagán, JA, Postigo, I, Rodríguez-Pacheco, JR, Peña, M, Guisantes, JA, y Martínez, J. La albúmina sérica bovina contenida en el medio de cultivo utilizado en la inseminación artificial es un factor importante de riesgo de anafilaxia. Fértil estéril. (2008) 90:2013.e17–9. doi: 10.1016/j.fertnstert.2008.05.055
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Sipahi, S, Ozceker, D, Gokcay, G, Guler, N, y Tamay, Z. Un caso de anafilaxia a la vacunación contra el sarampión en un lactante con alergia a la leche de vaca. Pediatr Alergia Immunol Pulmonol. (2019) 32:135–8. doi: 10.1089/ped.2019.0993
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Hilger, C, Clark, E, Swiontek, K, Chiriac, A, Caimmi, D, Demoly, P, et al. Anafilaxia al adhesivo tisular de albúmina sérica bovina en un paciente no alérgico a la carne. J Investig Allergol Clin Immunol. (2020) 30:369–71. doi: 10.18176/jiaci.0522
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Solanki, R, Rostamabadi, H, Patel, S, y Jafari, SM. Sistemas de nano-administración anticancerígenos basados en nanopartículas de albúmina sérica bovina: una revisión crítica. Int J Bio Macromol. (2021) 193:528–40. doi: 10.1016/j.ijbiomac.2021.10.040
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. De Silva, R, Dasanayake, WMDK, Wickramasinhe, GD, Karunatilake, C, Weerasinghe, N, Gunasekera, P, et al. Sensibilización a la albúmina sérica bovina como posible causa de reacciones alérgicas a las vacunas. Vacuna. (2017) 35:1494–500. doi: 10.1016/j.vaccine.2017.02.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Ohmori, K, Masuda, K, DeBoer, DJ, Sakaguchi, M y Tsujimoto, H. Análisis de inmunotransferencia para componentes reactivos a IgE del suero fetal de terneros en perros que desarrollaron reacciones alérgicas después de la vacunación no antirrábica. Veterinario Inmunol Inmunopatíaco. (2007) 115:166–71. doi: 10.1016/j.vetimm.2006.10.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Ohmori, K, Masuda, K, Kawarai, S, Yasuda, N, Sakaguchi, M y Tsujimoto, H. Identificación de la albúmina sérica bovina como componente de la carne de vacuno reactivo a la IgE en un perro con hipersensibilidad alimentaria frente a la carne de vacuno. J Vet Med Sci. (2007) 69:865–7. doi: 10.1292/jvms.69.865
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Yoshida, M, Mizukami, K, Hisasue, M, Imanishi, I, Kurata, K, Ochiai, M, et al. Anafilaxia después de la vacunación antirrábica para perros en Japón. J Vet Med Sci. (2021) 83:1202–5. doi: 10.1292/jvms.21-0090
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Ohmori, K, Masuda, K, Maeda, S, Kaburagi, Y, Kurata, K, Ohno, K, et al. Reactividad de la IgE a los componentes de la vacuna en perros que desarrollaron reacciones alérgicas de tipo inmediato después de la vacunación. Veterinario Inmunol Inmunopatíaco. (2005) 104:249–56. doi: 10.1016/j.vetimm.2004.12.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Mcconnell, LH, Arkins, JA, y Fink, JN. Anticuerpo homocitotrópico inducido contra albúmina sérica bovina en perros no atópicos. J Alergia Clin Immunol. (1973) 52:47–54. doi: 10.1016/0091-6749(73)90120-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Yozova, ID, Howard, J, Sigrist, NE y Adamik, K. Tendencias actuales en la terapia de reemplazo de volumen y el uso de coloides sintéticos en animales pequeños: una encuesta basada en Internet (2016). Front Vet Sci. (2017) 4:140. doi: 10.3389/fvets.2017.00140
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Muller, WH, Griffin, CE, y Campbell, KL. Dermatología de pequeños animales de Muller y Kirk. Ámsterdam: Elsevier Academic Press (2012).
26. Taszkun, I. Los resultados de las pruebas cutáneas intradérmicas (IDST) en perros con dermatitis atópica del voivodato de Lublin. Pol J Vet Sci. (2011) 14:95–101. doi: 10.2478/v10181-011-0014-y
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Brockow, K, Przybilla, B, Aberer, W, Bircher, AJ, Brehler, R, Dickel, H, et al. Guía para el diagnóstico de reacciones de hipersensibilidad a medicamentos. Allergo J Int. (2015) 24:94–105. doi: 10.1007/s40629-015-0052-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Wohrl, S. Estudio clínico de las reacciones adversas a medicamentos. Experto Rev Dermatol. (2007) 2:217–31. doi: 10.1586/17469872.2.2.217
29. Murayama, H, Sakuma, M, Takahashi, Y y Morimoto, T. Mejora de la evaluación de las reacciones adversas a los medicamentos utilizando el algoritmo de Naranjo en la práctica diaria: el estudio de eventos adversos a los medicamentos de Japón. Pharmacol Res Perspect. (2018) 6. DOI: 10.1002/PRP2.373
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Cain, CL, Bradley, CW, Vmd, II y Mauldin, EA. Características clínicas e histológicas de la eritrodermia de inicio agudo en perros con enfermedad gastrointestinal: 18 casos (2005-2015). J Am Vet Med Assoc. (2017) 251:1439–49. doi: 10.2460/javma.251.12.1439
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Geum, M, Ko, H, Na, Y y Kim, H. Reacción adversa cutánea a un medicamento en un perro después del tratamiento con firocoxib. Vet Med Sci. (2021) 7:1504. doi: 10.1002/vms3.541
32. Lecru, L, Combarros, D, Castilla-Castaño, E, Delverdier, M, Cadiergues, M, y Pressanti, C. Reporte de caso: resultado positivo de una sospecha de reacción asociada a medicamentos (mediada por el sistema inmunológico) en un bulldog francés macho de 4 años de edad. Front Vet Sci. (2021) 8:8. doi: 10.3389/fvets.2021.728901
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. de Vos, G. Pruebas cutáneas versus pruebas de IgE específicas en suero: ¿cuál es mejor para diagnosticar la sensibilización a los aeroalérgenos y predecir la alergia clínica? Curr Alergia Asma Rep. (2014) 14:430–7. DOI: 10.1007/s11882-014-0430-z
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: evento adverso, albúmina sérica bovina, hipersensibilidad, producto plaquetario liofilizado, transfusión plaquetaria
Cita: Choi H-J, Kim M-Y y Han H-J (2024) Evaluación de la seguridad de un tampón utilizado en la liofilización de plaquetas caninas: reacción de hipersensibilidad tipo I en perros causada por albúmina sérica bovina. Frente. Vet. Sci. 11:1344037. doi: 10.3389/fvets.2024.1344037
Recibido: 24 de noviembre de 2023; Aceptado: 26 de enero de 2024;
Publicado: 12 de febrero de 2024.
Editado por:
Katja-Nicole Adamik, Universidad de Berna, Suiza
Revisado por:
Christiane Hilger, Instituto de Salud de Luxemburgo, Luxemburgo
Alex Lynch, Universidad Estatal de Carolina del Norte, Estados Unidos
Derechos de autor © 2024 Choi, Kim y Han. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY). S
*Correspondencia: Hyun-Jung Han, ab1234@konkuk.ac.kr
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

