Evaluación de las propiedades funcionales del hidrolizado de proteínas de la dieta y del aceite procedente de residuos de pescado
 Ana R. J. Cabrita1*
Ana R. J. Cabrita1* Carolina Barroso1
Carolina Barroso1 Ana Patrícia Fontes-Sousa2
Ana Patrícia Fontes-Sousa2 Alexandra Correia3,4
Alexandra Correia3,4 Luzia Teixeira3,4
Luzia Teixeira3,4 Margarida R. G. Maia1†
Margarida R. G. Maia1† Manuel Vilanova3,4
Manuel Vilanova3,4 Timur Yergaliyev5,6
Timur Yergaliyev5,6 Amélia Camarinha-Silva5,6
Amélia Camarinha-Silva5,6 António J. M. Fonseca1
António J. M. Fonseca1- 1REQUIMTE, Red de Química y Tecnología, LAQV, Laboratorio de Química Verde, ICBAS, Facultad de Medicina y Ciencias Biomédicas, Universidad de Oporto, Oporto, Portugal
- número arábigoDepartamento de Inmunofisiología y Farmacología, Centro de Investigación Farmacológica e Innovación de Medicamentos (MedInUP), ICBAS, Facultad de Medicina y Ciencias Biomédicas, Hospital Veterinario de la Universidad de Oporto (UPVET), Universidad de Oporto, Oporto, Portugal
- 3ICBAS – Facultad de Medicina y Ciencias Biomédicas, Universidad de Oporto, Oporto, Portugal
- 4i3S – Instituto de Investigação e Inovação em Saúde, Universidad de Oporto, Oporto, Portugal
- 5HoLMiR – Centro de Investigación del Microbioma Ganadero de Hohenheim, Universidad de Hohenheim, Stuttgart, Alemania
- 6Instituto de Ciencia Animal, Universidad de Hohenheim, Stuttgart, Alemania
El hidrolizado de pescado y el aceite de producción local del sector agroalimentario constituyen una solución sostenible tanto para el problema de la eliminación de residuos de pescado como para el sector de los alimentos para animales de compañía, con beneficios potenciales para la salud de los animales. Este estudio evaluó los efectos de la sustitución dietética de hidrolizado de camarones principalmente importados (5%) y aceite de salmón (3%; dieta control) con hidrolizado de pescado producido localmente (5%) y aceite (3,2%) obtenido de desechos de peces (dieta experimental) sobre los marcadores de inflamación sistémica, los niveles de adipocinas, la función cardíaca y la microbiota fecal de perros adultos. Las muestras y mediciones se tomaron de un ensayo de alimentación realizado de acuerdo con un diseño cruzado con dos dietas (control y experimental), seis perros Beagle adultos por dieta y dos períodos de 6 semanas cada uno. La dieta experimental, con mayor contenido de ácidos docosahexaenoico (DHA) y eicosapentaenoico (EPA), disminuyó los triglicéridos plasmáticos y la actividad de la enzima convertidora de angiotensina, tendiendo también a disminuir el colesterol total. No se observaron efectos de la dieta sobre los niveles séricos de las citocinas proinflamatorias interleucina (IL)-1β, IL-8 e IL-12/IL-23 p40, y sobre los niveles séricos de la adipocina antiinflamatoria adiponectina. La presión arterial, la frecuencia cardíaca y las mediciones ecocardiográficas fueron similares entre las dietas, con la única excepción de la relación entre el diámetro de la aurícula izquierda y la aorta, que fue mayor en los perros alimentados con la dieta experimental, pero sin relevancia clínica. La dieta no afectó significativamente la concentración de inmunoglobulina A fecal. En cuanto al microbioma fecal, Megasphaera fue el género más abundante, seguido de Bifidobacterium, Fusobacterium y Prevotella, siendo las abundancias relativas de los géneros Fusobacterium e Ileibacterium afectadas positivamente por la dieta experimental. En general, los resultados del ensayo a corto plazo realizado sugieren que el hidrolizado de camarón y el aceite de salmón pueden ser reemplazados por hidrolizado de proteínas y aceite de subproductos de pescado sin afectar los marcadores inflamatorios sistémicos, la estructura y la función cardíaca, pero potencialmente beneficiando a los géneros bacterianos asociados con un microbioma saludable. Teniendo en cuenta el alto contenido de DHA y EPA y las propiedades antioxidantes del aceite de pescado y el hidrolizado, valdría la pena evaluar en el futuro sus efectos a largo plazo sobre los marcadores inflamatorios y su papel en las enfermedades cardíacas caninas espontáneas y realizar análisis metabolómicos y metagenómicos para dilucidar la relevancia de los cambios en la microbiota en el intestino.
1 Introducción
En los últimos años, varios estudios han explorado los subproductos de pescado para producir diversos productos de alto valor agregado como concentrados de proteínas, péptidos bioactivos, aceites de pescado, entre otros (1). Estos productos se pueden utilizar como ingredientes en la producción de alimentos destinados al consumo humano, sin embargo, el desarrollo de formulaciones de alimentos para mascotas ha surgido como una solución muy prometedora y económicamente viable. De hecho, estas fuentes de proteínas y lípidos son una excelente opción para enriquecer los alimentos para mascotas en aminoácidos y ácidos grasos esenciales con la ventaja de la ausencia de factores antinutricionales o proteínas alergénicas y beneficios potenciales para la salud del animal (2, 3). Las principales bioactividades de los hidrolizados de pescado reportadas en la literatura incluyen actividades antioxidantes, antihipertensivas, antiobesidad, antiinflamatorias, anticancerígenas, antimicrobianas y neuroprotectoras (4, 5).
El aceite de pescado se puede destacar por el contenido de ácidos grasos poliinsaturados de cadena larga (PUFA), a saber, ácido eicosapentaenoico (EPA, 20:5 n-3) y ácido docosahexaenoico (DHA, 22:6 n-3). Estos AGPI omega (n)-3 de cadena larga son precursores de varios metabolitos que actúan como mediadores lipídicos y son beneficiosos en la prevención de ciertas enfermedades, siendo utilizados en dietas terapéuticas (p. ej., cardiovascular, renal, gastrointestinal, ortopédica y dermatológica) a dosis altas (6-10).
Además de los beneficios económicos, nutricionales y de bioactividad asociados a la valorización de los subproductos pesqueros en el sector de los alimentos para mascotas, esto también permite aumentar la sostenibilidad medioambiental del sector. De hecho, el creciente número de animales de compañía ha suscitado preocupaciones sobre su sostenibilidad, y la industria de alimentos para mascotas está comenzando a abordar este problema, particularmente a través de la búsqueda de fuentes alternativas de proteínas y alimentos energéticos (11-13).
Un estudio reciente (14) demostró que la inclusión dietética de hidrolizado y aceite de pescado obtenidos localmente de los desechos de pescado en sustitución del hidrolizado de camarones y el aceite de salmón importados principalmente de terceros países fue bien aceptada por los perros, ya que no afectó la ingesta de alimentos, la digestibilidad o las características fecales, pero promovió el índice de EPA, DHA y omega-3 en la sangre, lo que sugiere un efecto potencial promotor de la salud. Para obtener más información sobre el posible papel funcional de estos recursos reciclados, el presente estudio utilizó muestras y mediciones recogidas durante el experimento anterior (14) para evaluar los efectos sobre los parámetros de salud, incluidas las moléculas efectoras inmunitarias, la microbiota fecal y la función cardíaca.
2 Materiales y métodos
El ensayo fue aprobado por el Comité de Ética Animal de la Facultad de Medicina y Ciencias Biomédicas de la Universidad de Oporto, autorizado por la Dirección General de Alimentación y Medicina Veterinaria de Portugal (Permiso N° 0421/000/000/2021), y realizado por científicos capacitados en ciencia de animales de laboratorio (FELASA, categoría C) en línea con las buenas prácticas de bienestar animal (Directiva de la Unión Europea 2010/63/UE).
2.1 Animales, dietas y diseño experimental
Los detalles sobre los animales, las dietas y el diseño experimental del ensayo se informaron anteriormente (14). En resumen, 12 perros Beagle adultos sanos (2 machos intactos, 4 machos castrados y 6 hembras esterilizadas), de 5,4 ± 0,57 años, con un peso de 11,8 ± 2,20 kg con una puntuación de condición corporal de 4,3 ± 0,69 (evaluados según una escala de 9 puntos; 15), y alojados en el criadero de la Facultad de Medicina y Ciencias Biomédicas de la Universidad de Oporto. Se utilizó como dieta control una dieta comercial para perros adultos de tamaño mediano (Sorgal Pet Food, Ovar., Portugal) con la inclusión de un 5% de hidrolizado de camarones (Symrise Aqua, Ecuador) y un 3% de aceite de salmón (Symrise Aqua, Noruega). La dieta experimental estuvo compuesta por los mismos ingredientes de la dieta control, con ligeros ajustes en grano de trigo (6.0 y 7.5% para la dieta control y experimental), concentrado de arveja (7.0 y 5.0%) y grasa de ave (5.0 y 5.3%), y la sustitución de 5% de hidrolizado de camarones por 5% de hidrolizado de pescado, y 3% de aceite de salmón por 3.2% de aceite de pescado. El hidrolizado de pescado se obtuvo por hidrólisis enzimática con la serina endopeptidasa inespecífica de Bacillus licheniformis Alcalase 2.4 L (Novozymes®, Bagsvaerd, Dinamarca) y el aceite de pescado se obtuvo a partir de subproductos de pescado compuestos por cabezas, colas, piel, lonchas y pescado entero principalmente de salmón, dorada, lubina y pescado rojo, y proporcionados por un grupo de empresas (Empresa Transformadora de Subprodutos Animais S.A., ETSA, Loures, Portugal) dedicada al reciclaje en el sector alimentario.
Anteriormente se presentó una caracterización detallada de ambas dietas (14). En resumen, en comparación con la dieta control, la dieta experimental presentó menor contenido de proteína bruta (27,0 vs. 29,1 g 100 g-1 de materia seca, MS), pero perfil de aminoácidos similar, y mayor contenido de extracto etéreo (11,6 vs. 10,4 g 100 g-1 MS) con un mayor porcentaje de AGPI n-3 (6,44 vs. 3,48 g 100 g-1 de ácidos grasos totales), particularmente EPA (1,25 vs. 0,355 g 100 g-1 de ácidos grasos totales), ácido docosapentaenoico (C22:5 n-3; 0,360 vs. 0,116 g 100 g-1 ácidos grasos totales) y DHA (1,96 vs. 0,494 g 100 g-1 ácidos grasos totales), y un menor porcentaje de AGPI n-6 (22,1 vs. 27,0 g 100 g-1 ácidos grasos totales).
Antes del inicio del ensayo, se consideró que los perros estaban clínicamente sanos en función de un examen exhaustivo realizado por un veterinario. Además, dada la edad y raza de los perros, se realizó un ecocardiograma basal, que reveló un engrosamiento de las valvas de la válvula mitral en todos los casos, compatible con enfermedad mixomatosa de la válvula mitral. Se observó regurgitación leve de la válvula mitral en siete perros, ninguno de los cuales mostró signos de remodelación cardíaca (etapa B1) (16). La severidad de la regurgitación mitral se evaluó semicuantitativamente midiendo la relación entre el área de chorro máximo del regurgitante mitral y el área auricular izquierda mediante Doppler color. Un resultado de <5% se consideró traza, entre 5 y 20% se consideró leve, entre 20 y 50% se consideró moderado y >50% se consideró grave (17, 18). Los perros se dividieron en dos grupos bloqueados por sexo y recibieron las dietas de control y experimentales en dos períodos experimentales consecutivos de 6 semanas cada uno siguiendo un acuerdo cruzado. Los animales fueron alimentados individualmente dos veces al día (8:30 h y 17:00 h) con la ración diaria calculada de acuerdo con la puntuación de condición corporal (15) y el peso corporal ideal (PC) para satisfacer los requerimientos de energía metabolizable (19).
2.2 Extracción y análisis de sangre
Se recogieron muestras de sangre de cada perro en 1 día de la última semana de cada período experimental antes de la comida de la mañana, desde la vena yugular hasta los tubos de EDTA BD Vacutainer (VWR International, Carnaxide, Portugal) y VACUETTE BD Vacutainer® SST™ II con activador de coágulos y gel separador (Becton, Dickinson and Company, Franklin Lakes, NJ, EE. UU.). La sangre se dejó coagular durante 60 minutos a temperatura ambiente antes de la centrifugación a 1200 g durante 10 minutos. Se recolectó el suero, se dividió en alícuotas y se almacenó a -80 °C hasta el análisis. La insulina, el colesterol LDL, el colesterol HDL, la aldosterona, el factor de crecimiento similar a la insulina (IGF-1), las citocinas, la leptina y la adiponectina se analizaron en suero, mientras que los demás parámetros analizados se midieron en plasma con EDTA. Se utilizó un analizador de volumen medio (Cobas c501, Roche Diagnostics, Indianápolis, IN, EE. UU.) para analizar proteínas totales, albúmina, glucosa, creatinina, urea, alanina aminotransferasa, fosfatasa alcalina, colesterol total, triglicéridos y proteína C reactiva. La concentración de globulina se determinó como la diferencia entre la proteína total y la albúmina. La troponina I, IGF-1 (Siemens Immulite 2000, Siemens Healthineers, Erlanger, Alemania), la insulina (Siemens Advia Centaur, Siemens Healthineers) y la angiotensina II (Snibe Maglumi, Shenzhen, China) se analizaron mediante inmunoensayos de quimioluminiscencia. El colesterol LDL y HDL, y la actividad de la enzima convertidora de angiotensina se determinaron mediante espectrometría de absorción molecular (Siemens Atellica, Siemens Healthineers). El NT-pro-BNP se cuantificó mediante ELISA utilizando el ensayo cardiopet proBNP canino (IDEXX Laboratories, Westbrook, ME, USA). La actividad de la aldosterona y la renina plasmática se midió mediante radioinmunoensayos (Gamma WIZARD 2470 Perkin Elmer, Waltham, MA, USA).
Para evaluar el efecto de la dieta sobre la inflamación sistémica basal, se cuantificaron las concentraciones de las citocinas proinflamatorias factor de necrosis tumoral (TNF)-α, interleucina (IL)-1β, IL-8, IL-12/IL-23 p40 e interferón (IFN)-γ, y de la citocina antiinflamatoria IL-10 en el suero utilizando los siguientes kits de ELISA, según las instrucciones del fabricante: IL-1β (DY3747; Canine DuoSet ELISA, R&D Systems, Oxford, Reino Unido), IL-10 (DY735; Canine DuoSet ELISA, R&D Systems), IL-12/IL-23 p40 (DY1969; Canine DuoSet ELISA, R&D Systems), TNF-α (DY1507, Canine DuoSet ELISA, R&D Systems), IFN-γ (DY781B, Canine DuoSet ELISA, R&D Systems) e IL-8 (3114-1H-20, ELISA Flex Bovine IL-8, Mabtech AB, Nacka, Suecia). La detección colorimétrica se realizó utilizando un lector de microplacas Multiskan EX (Thermo Fisher Scientific, Carlsbad, MA, USA) utilizando el software Ascent (Thermo Fisher Scientific). También se utilizaron kits de ELISA específicos para adipocinas caninas para analizar las concentraciones séricas de leptina (Canine Leptin Cat. No. EZCL-31 K, Merck Millipore, Darmstadt, Alemania) y adiponectina (Canine Adiponectin ELISA Kit, Cat. No. RD-ADP-c, Reddot Biotech Inc., Kelowna, Canadá), siguiendo las instrucciones del fabricante. Para la cuantificación de adiponectina, las muestras de suero se diluyeron previamente 1:1000 en medio salino tamponado con fosfato (PBS) para estar dentro del rango de la curva estándar (100-1,562 ng mL-1). Para la cuantificación de la leptina, se aplicaron 20 μL de muestras de suero a cada pocillo en placa que contenía 80 μL de tampón de ensayo, según lo recomendado por el fabricante. Se utilizó un fotómetro de microplaca Multiskan™ FC (Thermo Fisher Scientific) con el software SkanIt 3.1 para medir la absorbancia a 450 nm y determinar la concentración de la muestra a través de la curva logística de cuatro parámetros.
2.3 Presión arterial, ecocardiograma y electrocardiograma
Se realizaron mediciones de presión arterial, ecocardiograma y electrocardiograma en cada perro durante 1 día de la última semana de cada período experimental. Todos los procedimientos se realizaron mientras los perros estaban conscientes y sin sedación. La evaluación fue realizada y analizada por un solo investigador. Las presiones sistólicas, diastólicas y arteriales medias se midieron utilizando un sistema oscilométrico no invasivo de presión arterial específico para veterinarios (Vet20 SunTech; SunTech Medical Inc., Morrisville, Carolina del Norte, EE. UU.), de acuerdo con las directrices de consenso del Colegio Americano de Medicina Interna Veterinaria (ACVIM) (20). Se promediaron cinco lecturas por perro para determinar los valores de presión arterial.
Después de obtener las mediciones de la presión arterial, los perros se sometieron a un afeitado para crear una ventana para la ecocardiografía. La ecocardiografía convencional (2D, modo M, Doppler color y Doppler espectral), con electrocardiograma simultáneo de una sola derivación, se realizó utilizando un transductor phased-array M5S (1,5-4,5 MHz) y un ecocardiógrafo GE Logiq S8 XDclear (GE HealthCare, Chicago, IL, EE. UU.), tras un período de reposo de 15 minutos. Los datos fueron almacenados digitalmente para mediciones posteriores, siguiendo las directrices del Comité de Ecocardiografía de la Especialidad de Cardiología de la ACVIM (21). El gel acústico se aplicó sobre el transductor y directamente sobre la piel recortada. Para minimizar la variabilidad, un solo operador capacitado registró tres mediciones consecutivas para cada parámetro, como se recomendó anteriormente (22).
Para las vistas paraesternales derechas, los perros se colocaron en decúbito lateral derecho. Se aplicó la imagen en modo M en la vista del eje corto paraesternal derecho a nivel de los músculos papilares del ventrículo izquierdo para evaluar el tabique interventricular (SVI), el diámetro interno del ventrículo izquierdo (VI) y la pared posterior del VI (PAVI) en diástole (d) y sístole (s). El LVIDd se normalizó a BW mediante la fórmula (23):
El acortamiento fraccional (FS) y la fracción de eyección (FE) del VI se calcularon de la siguiente manera (24):
Se utilizó la vista de eje largo paraesternal derecho con modo M guiado en 2D para medir el intervalo de separación entre el punto E y el septal (EPSS) en el plano de las válvulas mitrales.
Los diámetros de la aurícula izquierda (AI) y de la aorta (Ao) se midieron desde la vista del eje corto paraesternal derecho a nivel del Ao alineado con la comisura de las cúspides aórticas no coronarias y coronarias izquierdas durante la diástole ventricular precoz, siguiendo los protocolos establecidos que excluyen las venas pulmonares (25). Se calculó y documentó la relación LA/AO (LA/AO).
Las velocidades de flujo pulmonar se evaluaron mediante imágenes Doppler de onda pulsada desde la vista del eje corto paraesternal derecho. Los flujos aórtico y mitral se evaluaron con Doppler de onda pulsada desde las vistas apical paraesternal izquierda de 5 y 4 cámaras, respectivamente. Para el flujo transmitral, el volumen de la muestra se colocó justo por encima de las valvas de la válvula mitral durante la diástole, y se midieron las velocidades máximas de flujo durante la diástole temprana (onda E) y la contracción auricular (onda A).
La frecuencia cardíaca (FC) se calculó directamente a partir de los intervalos entre latidos del trazado electrocardiográfico. El volumen sistólico (VS) se derivó como la diferencia entre el VED y el VES, donde el VED representa el volumen diastólico final calculado mediante la fórmula:
y la VSE denota el volumen sistólico final, calculado mediante:
El gasto cardíaco (GC) se determinó como producto de la VS y la FC (24).
2.4 Concentración de inmunoglobulina A fecal y microbiota
En 5 días de la última semana de cada período experimental, se colectó el total de heces excretadas por los perros. Las muestras individuales se pesaron, mezclaron, submuestrearon en diferentes lugares e inmediatamente se congelaron a -20 °C durante toda la recolección para su posterior análisis de la concentración de inmunoglobulina A (IgA) y el microbioma fecal. Inmediatamente antes de realizar estos análisis, las heces se descongelaron para permitir la mezcla, y se compusieron por período y perro. Las muestras se almacenaron a -20 °C durante un período no superior a 3 meses.
Para el análisis de IgA, las muestras fecales se descongelaron, homogeneizaron y se sometieron a extracción salina, según el método descrito por Peters, Calvert (26), con modificaciones. Brevemente, se añadió 1 g de muestra fecal fresca a 10 mL de tampón de extracción (PBS que contenía 0,5% Tween 20, Sigma-Aldrich, St. Louis, MO, USA), completamente homogeneizado con vórtice y centrifugado a 1500 × g, 5°C, durante 20 min. A continuación, se añadieron 80 μL de una solución concentrada al 25× de un cóctel completo™ de inhibidores de la proteasa sin EDTA (04693132001, Roche, Basilea, Suiza) en PBS a 2 mL de sobrenadante, se homogeneizaron mediante vórtice y se centrifugaron a 15000 × g, 5 °C, durante 15 min. A continuación, los sobrenadantes se alícutras y se almacenaron a -20 °C hasta el análisis. Las concentraciones de IgA fecal se determinaron utilizando un kit comercial de ELISA (Dog IgA ELISA Quantitation Set, E44-104, Bethyl Laboratories Inc., Montgomery, TX, EE. UU.), de acuerdo con las instrucciones del fabricante.
Las muestras se diluyeron 1:1000 o 1:2000 en tampón de dilución, de acuerdo con la determinación previa de dilución óptima, y el análisis se realizó por duplicado. La detección colorimétrica se realizó utilizando un lector de microplacas Multiskan EX (Thermo Fisher Scientific) utilizando el software Ascent (Thermo Fisher Scientific).
Para el análisis del microbioma, el ADN fecal se extrajo con E.Z.N.A. ® Stool DNA Kit (Omega Bio-tek, Inc., Norcross, GA, USA), siguiendo el protocolo del proveedor. Después de la extracción del ADN, se utilizaron cebadores dirigidos a la región V4 del gen 16S rRNA (adelante: GTGYCAGCMGCCGCGGTAA, reverso: GGACTACNVGGGTWTCTAAT) con adaptadores adjuntos y códigos de barras. Después de la amplificación, las muestras se purificaron y secuenciaron en un secuenciador Illumina Novaseq 6.000. Las lecturas en bruto se importaron a Qiime2 (27). Los cebadores/adaptadores fueron eliminados por el cutadapt (28). La eliminación de ruido, el filtrado de calidad, la fusión de lecturas emparejadas y la eliminación de quimeras fueron realizadas por el dada2 (29). La clasificación taxonómica de las variantes de secuencia de amplicones (ASV) se llevó a cabo mediante consenso basado en VSEARCH (30) y clasificadores preajustados basados en sklearn (31) contra la base de datos Silva (v138.1, 16S 99%) (32). Las lecturas de referencia fueron preprocesadas por RESCRIPt (33). La diversidad alfa se evaluó mediante los índices de entropía de Shannon (34) y diversidad filogenética de Faith (35), y la diversidad beta mediante distancias UniFrac ponderadas (36). Las métricas de diversidad alfa se compararon mediante la prueba de Wilcoxon (37) para muestras dependientes, y las distancias de diversidad beta mediante la prueba de Adonis (999 permutaciones) (38). Los géneros diferencialmente abundantes (solo para los recuentos de géneros con abundancia relativa ≥1% y prevalencia ≥20%) se detectaron mediante el análisis discriminante lineal Effect Size (LEfSe) (39). Los valores p obtenidos de LEfSe se ajustaron mediante el procedimiento de Benjamini-Hochberg (40). Solo las características con p-adj > 0.05 y LDA > 2 se consideraron diferencialmente abundantes.
2.5 Análisis estadístico
Los datos se analizaron utilizando el procedimiento mixto del paquete de software Statistical Analysis Systems (SAS 2021, release 3.1.0., SAS Institute, Cary, NC, EE. UU.). El modelo incluyó la dieta, el período y la secuencia dietética como efectos fijos y el animal dentro de la secuencia dietética como efecto aleatorio. El nivel de significancia se estableció en p < 0,05 y se consideró una tendencia para p < 0,10. La secuencia dietética no afectó a ninguno de los parámetros medidos, excepto a la concentración sérica de insulina y a la presión arterial sistólica.
3 Resultados
3.1 Química clínica de la sangre
La dieta experimental disminuyó los triglicéridos plasmáticos (p = 0,008) y la actividad de la enzima convertidora de angiotensina (p = 0,013), tendiendo también a disminuir el colesterol total (p = 0,062; Tabla 1). No se observaron efectos de la dieta en los demás parámetros sanguíneos analizados (Tabla 1).
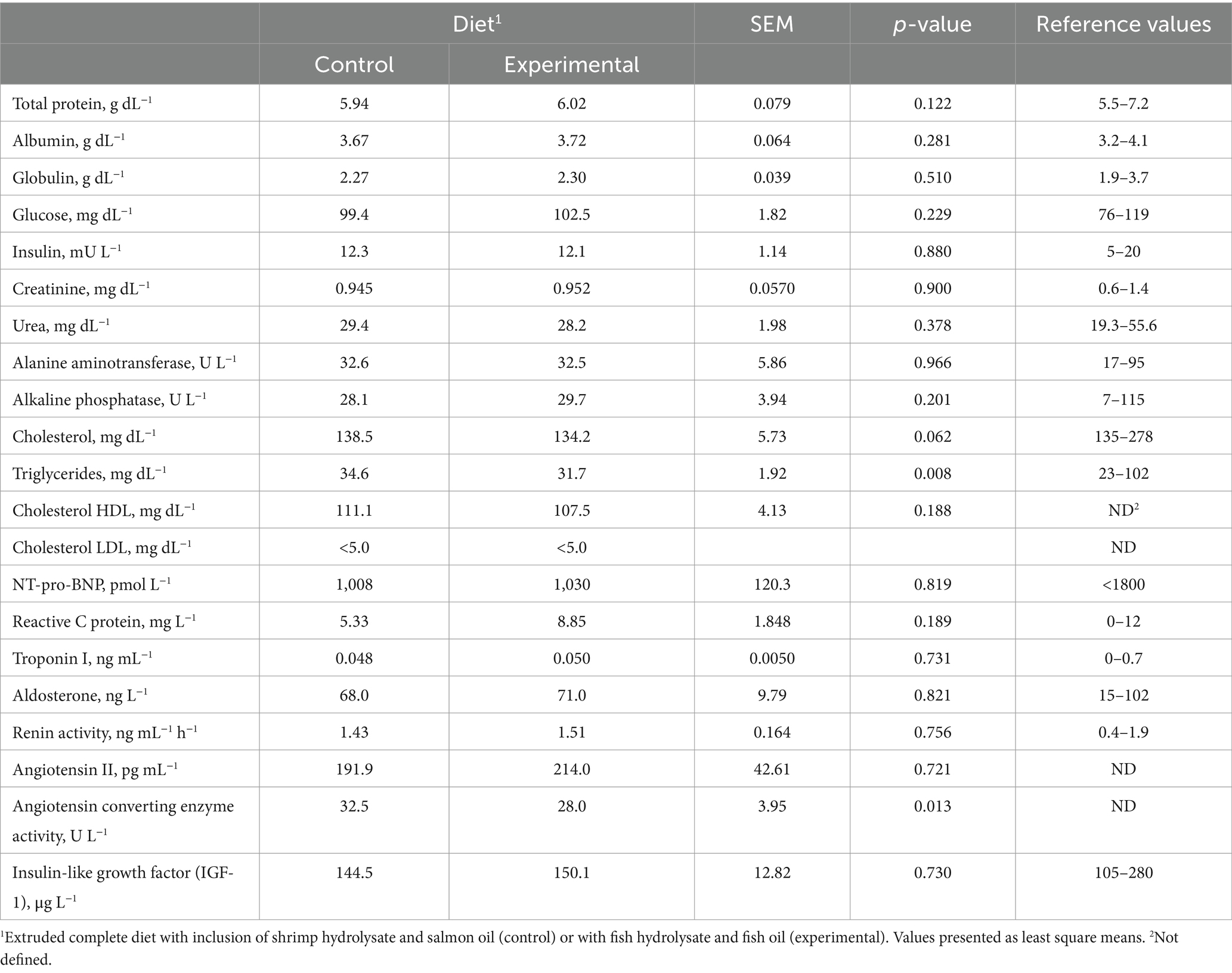
3.2 Concentraciones séricas de citocinas y adipocinas
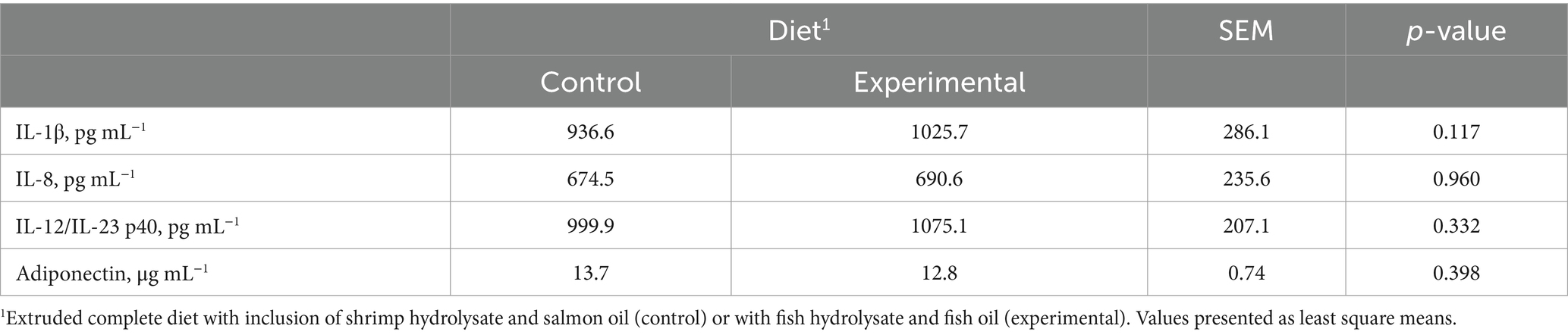
La dieta no afectó significativamente los niveles séricos de las citocinas proinflamatorias IL-1β (p = 0,117), IL-8 (p = 0,960) e IL-12/IL-23 p40 (p = 0,332), y los niveles séricos de la adipocina antiinflamatoria adiponectina (p = 0,398; Tabla 2). Las concentraciones de IL-10, TNF-α e IFN-γ estuvieron por debajo de los niveles de detección (31,2 pg. mL-1, 15,6 pg. mL-1 y 31,2 pg. mL-1, respectivamente) para la mayoría de los animales, independientemente de la dieta (datos no mostrados). Además, los niveles séricos de la adipocina proinflamatoria leptina también estuvieron por debajo del nivel de detección (0,3438 ng mL-1) para todas las muestras de perro analizadas, aunque los controles de calidad ELISA 1 y 2 estuvieron dentro del rango esperado (2,52 y 13,52 ng mL-1, respectivamente).
3.3 Presión arterial, electrocardiograma y ecocardiograma
El trazado electrocardiográfico obtenido durante el examen ecocardiográfico reveló ritmo sinusal en todos los perros y en las condiciones experimentales. Los valores de presión arterial y frecuencia cardíaca no mostraron ninguna diferencia entre la dieta control y la experimental, con la única excepción de la presión arterial sistólica que tendió (p = 0,097) a ser mayor en los perros alimentados con la dieta experimental (Tabla 3).
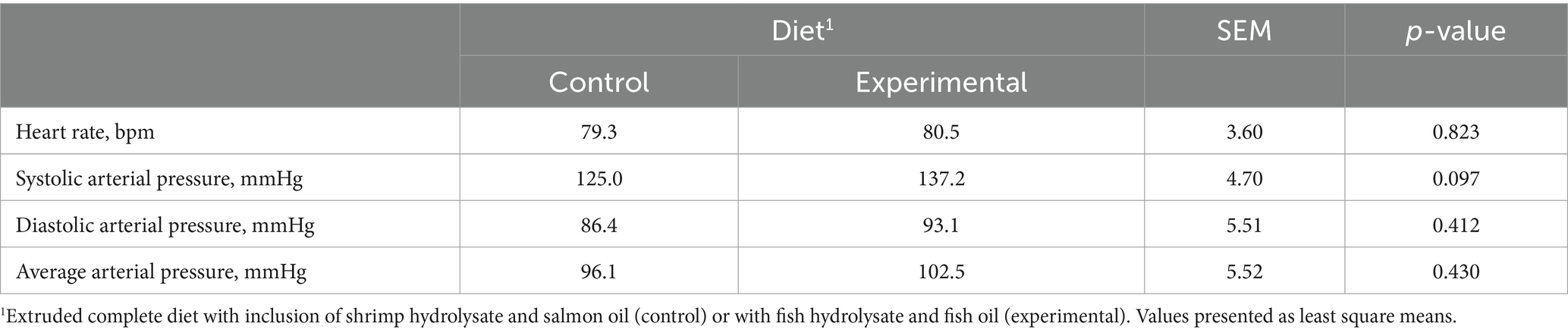
En cuanto a la evaluación ecocardiográfica, la relación LA/Ao en los perros que siguieron la dieta experimental mostró un aumento significativo (p = 0,029) en comparación con la dieta control, sin que se observaran otras diferencias significativas en las demás mediciones ecocardiográficas (Tabla 4).
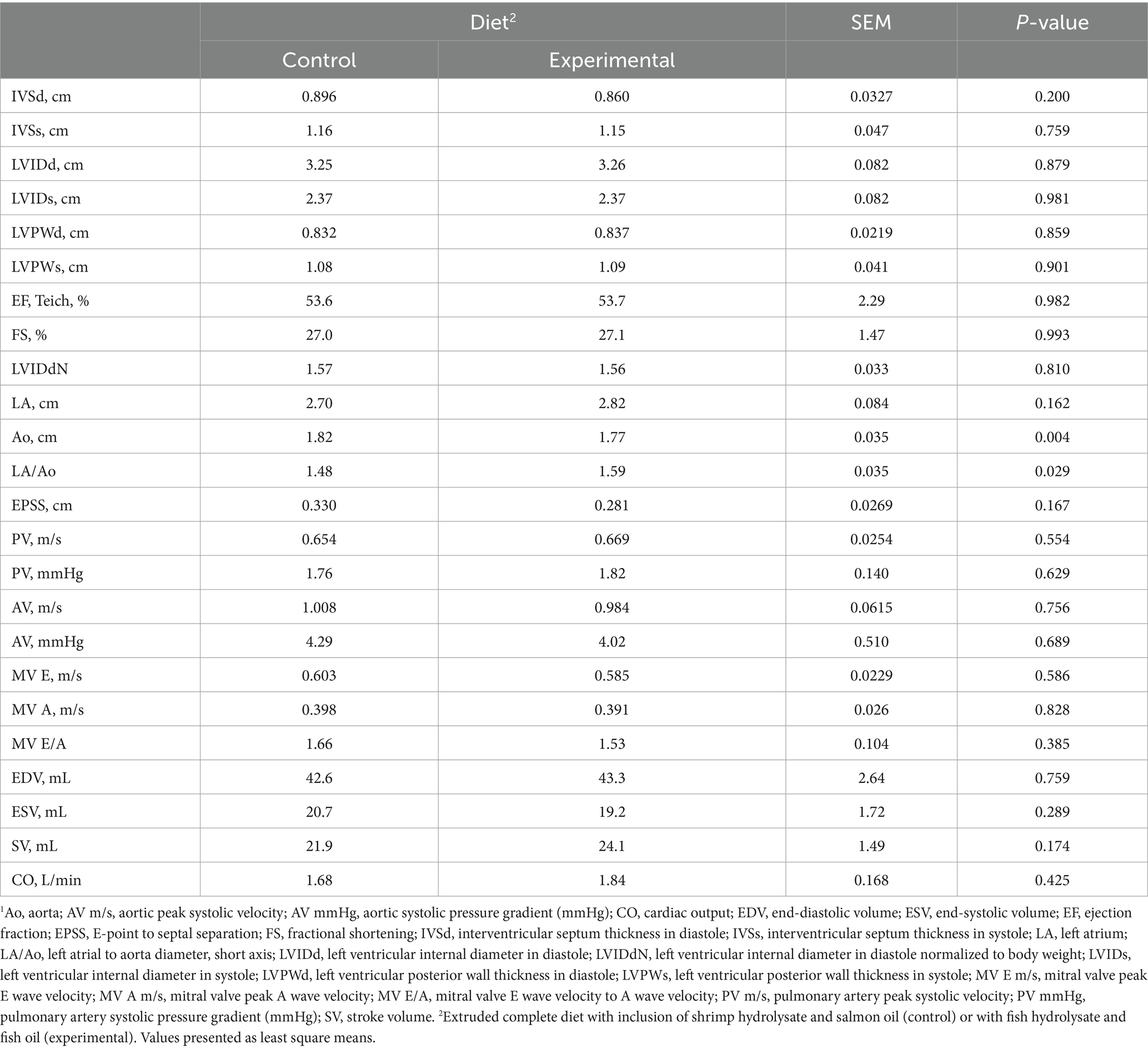
Tabla 4. Efecto de las dietas control y experimentales sobre los parámetros del ecocardiograma. 1
3.4 Concentración de inmunoglobulina A fecal y microbiota
La dieta no afectó significativamente las concentraciones de IgA fecal que promediaron 5,31 y 7,37 mg g-1 de heces secas (SEM = 1,496) para la dieta control y experimental, respectivamente (p = 0,200).
No se detectaron diferencias significativas (p = 0,155) en la diversidad beta (expresada por UniFrac ponderado) entre las dietas control y experimental cuando se probaron con Adonis (Figura 1A). De manera similar, la dieta (Figura 1B) no afectó significativamente las métricas de diversidad alfa (entropía de Shannon y Faith PD) del microbioma fecal de los perros, aunque la entropía de Shannon tuvo una tendencia a ser mayor en la dieta experimental (p = 0,064).
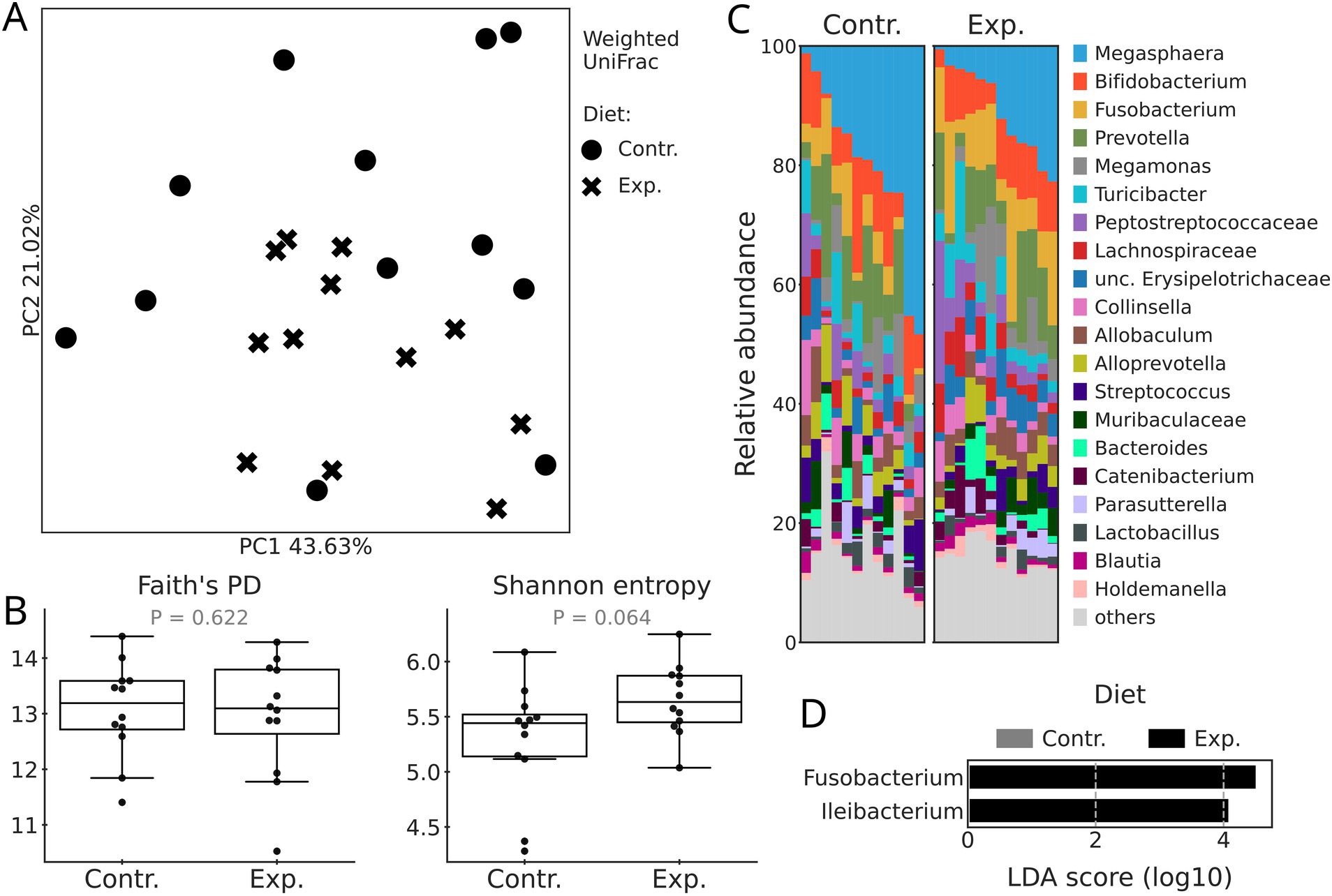
Tanto en las dietas control como en las experimentales, Megasphaera fue el género más abundante, seguido de Bifidobacterium, Fusobacterium y Prevotella (Figura 1C). Una prueba de abundancia diferencial (LEfSe) mostró que las abundancias relativas de solo dos géneros, Fusobacterium e Ileibacterium, fueron mayores en la dieta experimental (Figura 1D).
4 Discusión
El hidrolizado de pescado y el aceite obtenidos del sector agroalimentario local contribuyen tanto al problema de la eliminación de residuos de pescado como a la sostenibilidad del sector de los alimentos para animales de compañía. El presente estudio evaluó los efectos de la sustitución dietética de hidrolizado de camarones y aceite de salmón por hidrolizado y aceite de pescado sobre los marcadores de inflamación sistémica, los niveles de adipocinas, la función cardíaca y la microbiota fecal de perros adultos a partir de un ensayo de alimentación informado anteriormente (14).
Los parámetros clínicos de química sanguínea evaluados estaban todos dentro de los rangos normales para caninos sanos. La tendencia a una disminución del colesterol total y una disminución significativa de los triglicéridos observada con la dieta experimental podría atribuirse principalmente a su mayor contenido en DHA y EPA, como se verificó en estudios previos (41, 42). Aunque no se conocen claramente, los mecanismos de acción de los AGPI omega-3 podrían atribuirse, entre otros, a la regulación de factores de transcripción que reducen la lipogénesis, al aumento de la ß-oxidación y a la estimulación de la actividad de la lipoproteína lipasa (43-45).
La leptina, una adipocina proinflamatoria secretada principalmente por el tejido adiposo y que se correlaciona positivamente con el contenido de grasa corporal (46, 47), estuvo por debajo del nivel de detección en todas las muestras de perro analizadas, aunque los controles de calidad de ELISA estuvieron dentro del rango esperado. De manera similar, se demostró por otros que utilizaron el mismo kit comercial de ELISA utilizado aquí que en perros con peso ideal los niveles de leptina eran indetectables en la mayoría de los animales, en contraste con los animales obesos en los que los niveles de leptina eran detectables (48). Los niveles de la adipocina adiponectina, que puede tener propiedades antiinflamatorias (49), fueron detectables en todos los animales dentro del rango reportado por otros para perros sanos (50). La disminución de los niveles séricos de adiponectina en perros se ha asociado con la obesidad (51, 52). Durante este estudio no se observaron cambios en los niveles de adiponectina, lo que concuerda con que no se detectaron cambios en el peso corporal.
El hidrolizado de proteínas y el aceite de subproductos de pescado no influyeron significativamente en los niveles basales de inflamación, lo que está en consonancia con los niveles similares de proteína C reactiva detectados en el suero de perros con dietas controladas y experimentales. Se observó una alta variabilidad en los niveles séricos de las citocinas proinflamatorias IL-1β, IL-8 e IL-12/IL-23 p40 entre los diferentes perros, independientemente de la dieta, mientras que IL-10, TNF-α e IFN-γ estuvieron por debajo de los límites de detección para la mayoría de los animales. Investigaciones previas han reportado variaciones en los niveles de diferentes citocinas entre los individuos, independientemente de la raza, la edad y el sexo, siendo los niveles séricos de las citocinas IL-10, TNF-α e IFN-γ generalmente reportados como bajos o indetectables (53-56). El aumento de los niveles séricos de IL-8 e IL-1β se ha asociado con inflamación aguda y crónica originada por diversas condiciones patológicas (53, 57-59), incluida la enfermedad cardíaca (52, 60). La ausencia de diferencias en los niveles de estas citocinas particulares en el presente estudio está en línea con la ausencia de alteraciones significativas en los parámetros hematológicos y cardíacos.
Las proteínas hidrolizadas se han utilizado en dietas para perros con reacciones adversas a los alimentos o trastornos gastrointestinales (61). En varios estudios, la inclusión de hidrolizados de proteínas no afectó significativamente los niveles séricos o plasmáticos de citocinas (62, 63). Sin embargo, la inclusión de larvas de mosca soldado negra e hidrolizados de proteína de Schizochytrium similares a microalgas en la dieta disminuyó la IL-8 sérica, lo que sugiere un papel antiinflamatorio potencial para estos hidrolizados particulares en perros (64). Los resultados discrepantes informados sobre la inclusión dietética de hidrolizados de proteínas en perros pueden explicarse por muchas variables, incluido el origen del hidrolizado, el porcentaje de inclusión y la duración del ensayo de alimentación.
En el presente estudio, ambas dietas fueron administradas a perros sanos y contienen aceite de origen pesquero, rico en EPA y DHA (14). El papel del EPA y el DHA en la inflamación es pleiotrópico al influir en varios procesos biológicos, como la composición y fluidez de la membrana celular, la producción de prostaglandinas E (PGE), leucotrienos B (LTB), resolvinas y protectinas, y las vías de señalización implicadas en la expresión de genes proinflamatorios (65, 66). La sustitución del hidrolizado de camarones y el aceite de salmón por hidrolizado y aceite de pescado condujo a un aumento de los contenidos de EPA y DHA, lo que resultó en concentraciones significativamente más altas de estos PUFA en los glóbulos rojos de los perros alimentados con la dieta experimental (2,02 frente a 1,41 g, 100 g-1 de EPA y 1,75 frente a 1,17 g 100 g-1 de DHA para la dieta experimental y de control). respectivamente) (14). En una gran cohorte humana basada en la comunidad, las concentraciones de EPA y DHA de los glóbulos rojos se correlacionaron inversamente con varios marcadores de inflamación (67). En esta línea, varios autores han sugerido que las dietas enriquecidas con EPA y DHA podrían utilizarse como parte de tratamientos antiinflamatorios en perros con enfermedades inflamatorias crónicas. Así, la introducción de aceite de pescado en las dietas de perros de diferentes razas condujo a una disminución de la producción celular de los mediadores proinflamatoriosPGE2 o LTB4 (68, 69) y a una disminución de la producción de IL-1β por parte de las células sanguíneas mononucleares (6). El presente estudio muestra que el hidrolizado de camarón y el aceite de salmón pueden ser reemplazados por hidrolizado de proteínas y aceite de subproductos de pescado sin afectar los marcadores inflamatorios sistémicos. Aun así, dado que se observaron diferencias en el contenido de EPA y DHA de los glóbulos rojos de los perros alimentados con la dieta experimental, se necesitan más estudios que utilicen períodos más largos de suplementos dietéticos para evaluar los efectos a largo plazo de estos recursos alimenticios.
El presente estudio demuestra que una dieta experimental que contiene hidrolizado y aceite de pescado no tiene impacto significativo en la mayoría de los parámetros relacionados con la estructura y función cardíaca, como lo indican los resultados obtenidos de los biomarcadores cardíacos (NT-proBNP y troponina I), la presión arterial y las evaluaciones ecocardiográficas; Además, es importante mencionar que todos los parámetros se sienten dentro del rango de referencia para un perro adulto sano (20, 70, 71). Si bien se observó un aumento significativo en la relación LA/Ao ecocardiográfica, un marcador de agrandamiento de la aurícula izquierda, en el grupo de dieta experimental, todos los valores se mantuvieron dentro del rango de referencia para los perros (72). Estos hallazgos sugieren que la dieta bajo investigación no afecta la remodelación cardíaca; Sin embargo, es importante señalar que la evaluación se llevó a cabo durante un corto período de tiempo. Por lo tanto, es crucial evaluar los efectos a largo plazo de la dieta en la salud cardíaca. En la enfermedad mixomatosa de la válvula mitral, la afección cardíaca natural más prevalente en los perros, el agrandamiento de la aurícula izquierda sirve como el indicador independiente más confiable de la progresión de la enfermedad cardíaca. Esta enfermedad se asocia con cambios en el metabolismo energético, estrés oxidativo e inflamación. Curiosamente, un estudio previo demostró que una dieta suplementada con una mezcla que incluía triglicéridos de cadena media, EPA y DHA, magnesio, taurina y vitamina E, reducía la presión arterial sistólica y el agrandamiento de la aurícula izquierda en perros con enfermedad de la válvula mitral mixomatosa preclínica temprana (estadios B2 y C), atribuía varias propiedades, incluidos sus efectos antioxidantes y antiinflamatorios (73). Teniendo en cuenta las propiedades antioxidantes del hidrolizado y el aceite de pescado, valdría la pena evaluar en el futuro su papel en las etapas avanzadas de la enfermedad cardíaca, con remodelación cardíaca secundaria y/o insuficiencia cardíaca. Se han reportado niveles más bajos de adiponectina sérica en perros con enfermedad valvular (74, 75), de acuerdo con estudios en ratones y humanos que muestran un papel de esta adipocina en el sistema cardiovascular (76, 77). De acuerdo con que no se observaron cambios significativos en los parámetros cardíacos, no observamos cambios significativos en los niveles séricos de adiponectina en los animales alimentados con la dieta experimental.
Además, la dieta experimental disminuyó la actividad de la enzima convertidora de angiotensina, lo que sugiere un papel potencial de esta dieta en la mitigación del sistema renina-angiotensina-aldosterona, un sistema neurohormonal que funciona para preservar el volumen intravascular y la presión de perfusión en situaciones de disminución del gasto cardíaco (78). Además, teniendo en cuenta la dosis recomendada de 40 mg kg-1 de peso corporal de EPA y 25 mg kg-1 de DHA para lograr un efecto cardioprotector (6), la ingesta de EPA y, en particular, de DHA con la dieta experimental (18 mg kg-1 peso corporal de EPA y 28 mg kg-1 peso corporal de DHA) podría beneficiar la función cardíaca de los perros.
La dieta experimental que contenía hidrolizado y aceite de pescado no tuvo un efecto significativo sobre la IgA fecal y la composición del microbioma fecal canino en comparación con una dieta comercial comúnmente utilizada que incluía hidrolizado de camarones y aceite de salmón. La IgA secretora, la inmunoglobulina más abundante en las secreciones mucosas, desempeña un papel importante en la inmunidad de la mucosa y promueve la salud intestinal (79). La IgA secretora intestinal es un importante modulador de la microbiota intestinal (80), y también ocurre lo contrario, como está bien documentado en la forma en que la microbiota intestinal impulsa la producción de IgA (81, 82). Solo dos géneros, Fusobacterium e Ileibacterium, aumentaron su abundancia relativa cuando se aplicó la dieta experimental. Se debe tener cuidado al sacar conclusiones sólidas de estos resultados, ya que los autores son conscientes de las limitaciones del uso de LEfSe en dicho análisis (83). Siendo Fusobacterium un productor de butirato que utiliza las vías de degradación de la lisina para producir butirato a partir de fuentes de proteínas, se ha informado de un aumento en su abundancia en perros alimentados con dietas altas en proteínas (84-86). Sin embargo, en el presente estudio, la dieta experimental presentó un contenido de proteínas y lisina ligeramente menor que la dieta control, sin observarse diferencias en la concentración de butirato entre las dietas (14). Fusobacterium, a pesar de estar asociado con la enfermedad inflamatoria intestinal (87) y el cáncer colorrectal (88) en humanos, se atribuye al microbioma saludable en los perros (89). No hay mucha información disponible sobre el papel que desempeña Ileibacterium en la salud de los perros, pero en ratones, este género se asoció con menores riesgos de inflamación y disbiosis (90, 91). Los resultados demuestran que la dieta que contiene hidrolizado y aceite de pescado puede utilizarse como sustituto del hidrolizado de camarones sin cambios drásticos en el microbioma fecal de los perros, al tiempo que puede propagarse géneros bacterianos asociados con el microbioma canino sano. Se sabe que las temperaturas de almacenamiento previas al procesamiento pueden afectar la composición del microbioma intestinal en los perros (92). Sin embargo, a pesar de que las muestras de este estudio no se almacenaron a la temperatura óptima, siguen protocolos estandarizados optimizados de recolección de muestras, almacenamiento y procesamiento, siempre que todas las muestras se trataron en las mismas condiciones, los hallazgos no se vieron afectados por ello. Sin embargo, un análisis metabolómico y metagenómico adicional podría ser útil para dilucidar la relevancia y el papel de estos cambios en la microbiota en el intestino.
5 Conclusión
El presente estudio a corto plazo muestra que la sustitución del hidrolizado de camarón y el aceite de salmón importados por aceite de pescado e hidrolizado de producción local de la industria agroalimentaria no afectó a los marcadores inflamatorios sistémicos, la estructura y la función cardíaca, pero potencialmente benefició a los géneros bacterianos asociados con un microbioma canino saludable. Los estudios futuros deben abordar los efectos a largo plazo de estos recursos alimenticios y su papel en las enfermedades cardíacas caninas espontáneas.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres de los repositorios y los números de acceso se pueden encontrar en: https://www.ebi.ac.uk/ena, PRJEB74498.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética Animal de la Facultad de Medicina y Ciencias Biomédicas de la Universidad de Oporto, autorizado por la Dirección General de Medicina Alimentaria y Veterinaria de Portugal (Permiso Nº 0421/000/000/2021). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
ARJC: Conceptualización, Análisis formal, Obtención de fondos, Investigación, Administración de proyectos, Recursos, Supervisión, Redacción – borrador original, Redacción – revisión y edición. CB: Análisis formal, Investigación, Redacción – revisión y edición. APF-S: Investigación, Redacción – revisión y edición. AC: Análisis formal, Investigación, Redacción – revisión y edición. LT: Análisis formal, Investigación, Redacción – revisión y edición. MM: Redacción – revisión y edición. MV: Redacción – revisión y edición. TY: Análisis formal, Investigación, Redacción – revisión y edición. AC-S: Análisis formal, Investigación, Redacción – revisión y edición. AF: Conceptualización, Análisis formal, Obtención de fondos, Investigación, Recursos, Supervisión, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El (los) autor(es) declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo contó con el apoyo financiero de la Fundación Portuguesa para la Ciencia y la Tecnología (FCT/MCTES; UIDB/50006/2020 DOI: 10.54499/UIDB/50006/2020) a través de fondos nacionales. Los autores reconocen el proyecto HealthyPetFood (POCI-01-0247-FEDER-047073) apoyado por el programa Portugal 2020 a través del Fondo Europeo de Desarrollo Regional. El contrato de MRGM fue financiado a través del DL 57/2016–Norma transitória (SFRH/BPD/70176/2010) por FCT. Los autores también agradecen el apoyo del Grupo de Alto Rendimiento y Computación en la Nube del Zentrum für Datenverarbeitung de la Universidad de Tübingen, el estado de Baden-Württemberg a través de bwHPC, y la Fundación Alemana de Investigación (DFG) (Grant no. INST 37/935-1FUGG).
Reconocimientos
Los autores agradecen, de la Facultad de Medicina y Ciencias Biomédicas de la Universidad de Oporto, Portugal, a Sílvia Azevedo por la asistencia técnica y las determinaciones analíticas, a Margarida Guedes y Patrícia Alves por la asistencia técnica durante toda la recolección de ensayos in vivo, y al personal del criadero por la asistencia y mantenimiento de los perros. Los autores agradecen a Tiago Aires de Sorgal, Sociedade de Óleos e Rações, S.A., por el suministro de las dietas y a André Almeida y Ana Rosa de Indústria Transformadora de Subprodutos, S.A. por el suministro del hidrolizado y el aceite de pescado.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El autor o autores declararon ser miembros del comité editorial de Frontiers, en el momento de la presentación. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Ghaly, AE, Ramakrishnan, VV, Brooks, MS, Budge, SM y Dave, D. Residuos de procesamiento de pescado como fuente potencial de proteínas, aminoácidos y aceites: una revisión crítica. J Microb Bioch Tech. (2013) 5:107–29. doi: 10.4172/1948-5948.1000110
2. Araujo, J, Sica, P, Costa, C, y Márquez, MC. Hidrólisis enzimática de residuos de pescado como alternativa para producir productos de alto valor añadido. Valorización de la biomasa residual. (2021) 12:847–55. doi: 10.1007/s12649-020-01029-x
3. Rodrigues, M, Rosa, A, Almeida, A, Martins, R, Ribeiro, T, Pintado, M, et al. Ácidos grasos omega-3 procedentes de subproductos de pescado: extracción y aplicación innovadoras en alimentos y piensos. Proceso de Bioprod Alimentario. (2024) 145:32–41. doi: 10.1016/j.fbp.2024.02.007
4. Gao, R, Yu, Q, Shen, Y, Chu, Q, Chen, G, Fen, S, et al. Producción, propiedades bioactivas y posibles aplicaciones de los hidrolizados de proteínas de pescado: avances y desafíos. Tendencias Food Sci Technol. (2021) 110:687–99. doi: 10.1016/j.tifs.2021.02.031
5. Heffernan, S, Giblin, L, y O’Brien, N. Evaluación de la actividad biológica de los hidrolizados de proteínas musculares de peces utilizando sistemas de modelos in vitro. Química de los alimentos. (2021) 359:129852. doi: 10.1016/j.foodchem.2021.129852
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Freeman, LM, Rush, JE, Kehayias, JJ, Ross, JN Jr, Meydani, SN, Brown, DJ, et al. Alteraciones nutricionales y efecto de la suplementación con aceite de pescado en perros con insuficiencia cardíaca. J Veterinario Pasante Med. (1998) 12:440–8. doi: 10.1111/j.1939-1676.1998.tb02148.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Neumayer, HH, Heinrich, M, Schmissas, M, Haller, H, Wagner, K, y Luft, FC. Mejora de la insuficiencia renal aguda isquémica mediante la administración dietética de aceite de pescado en perros conscientes. J Am Soc Nephrol. (1992) 3:1312–20. doi: 10.1681/ASN. V361312
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Roush, JK, Cross, AR, Renberg, WC, Dodd, CE, Sixby, KA, Fritsch, DA, et al. Evaluación de los efectos de la suplementación dietética con ácidos grasos omega-3 de aceite de pescado sobre la carga de peso en perros con artrosis. J am vet med assoc. (2010) 236:67–73. doi: 10.2460/javma.236.1.67
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Blaskovic, M, Rosenkrantz, W, Neuber, A, Sauter-Louis, C, y Mueller, RS. El efecto de una formulación spot-on que contiene ácidos grasos poliinsaturados y aceites esenciales en perros con dermatitis atópica. Veterinario J. (2014) 199:39–43. doi: 10.1016/j.tvjl.2013.10.024
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Simpson, KW, Miller, ML, Loftus, JP, Rishniw, M, Frederick, CE y Wakshlag, JJ. Ensayo controlado aleatorio de dietas de pescado hidrolizado en perros con enteropatía crónica. J Veterinario Pasante Med. (2023) 37:2334–43. doi: 10.1111/jvim.16844
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Okin, GS. Impactos ambientales del consumo de alimentos por parte de perros y gatos. PLoS Uno. (2017) 12:e0181301. doi: 10.1371/journal.pone.0181301
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Swanson, KS, Carter, RA, Yount, TP, Aretz, J y Buff, PR. Sostenibilidad nutricional de los alimentos para mascotas. Adv Nutr. (2013) 4:141–50. doi: 10.3945/an.112.003335
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Pedrinelli, V, Teixeira, FA, Queiroz, MR, y Brunetto, MA. Impacto ambiental de las dietas para perros y gatos. Sci Rep. (2022) 12:18510. doi: 10.1038/s41598-022-22631-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Cabrita, ARJ, Maia, MRG, Alves, AP, Aires, T, Rosa, A, Almeida, A, et al. El hidrolizado de proteínas y el aceite de los desechos de pescado revelan su potencial como ingredientes de alimentos para perros. Frente Vet Sci. (2024) 11:1372023. doi: 10.3389/fvets.2024.1372023
15. Laflamme, D. Desarrollo y validación de un sistema de puntuación de la condición corporal para perros. Práctica canina. (1997) 22:10–5.
16. Keene, BW, Atkins, CE, Bonagura, JD, Fox, PR, Häggström, J, Fuentes, VL, et al. Directrices de consenso de ACVIM para el diagnóstico y tratamiento de la enfermedad mixomatosa de la válvula mitral en perros. J Veterinario Pasante Med. (2019) 33:1127–40. doi: 10.1111/jvim.15488
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Liu, B, Leach, SB, Pan, W, Zheng, F, Jia, L, Zhou, X, et al. Resultado preliminar de un nuevo dispositivo de cierre de borde a borde para controlar la regurgitación mitral en perros. Frente Vet Sci. (2020) 7:597879. doi: 10.3389/fvets.2020.597879
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Chetboul, V, y Tissier, R. Evaluación ecocardiográfica de la enfermedad degenerativa de la válvula mitral canina. J Vet Cardiol Off J Eur Soc. (2012) 14:127–48. doi: 10.1016/j.jvc.2011.11.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. FEDIAF. Pautas nutricionales para alimentos completos y complementarios para perros y gatos. Bruselas: FEDIAF (2021).
20. Acierno, MJ, Brown, S, Coleman, AE, Jepson, RE, Papich, M, Stepien, RL, et al. Declaración de consenso de ACVIM: pautas para la identificación, evaluación y manejo de la hipertensión sistémica en perros y gatos. J Veterinario Pasante Med. (2018) 32:1803–22. doi: 10.1111/jvim.15331
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Thomas, WP, Gaber, CE, Jacobs, GJ, Kaplan, PM, Lombard, CW, Moise, NS, et al. Recomendaciones de patrones en ecocardiografía bidimensional transtorácica en perro y gato. Comité de Ecocardiografía de la Especialidad de Cardiología, Colegio Americano de Medicina Interna Veterinaria. J Veterinario Pasante Med. (1993) 7:247–52. doi: 10.1111/j.1939-1676.1993.tb01015.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Gottdiener, JS, Bednarz, J, Devereux, R, Gardin, J, Klein, A, Manning, WJ, et al. Recomendaciones de la Sociedad Americana de Ecocardiografía para el uso de la ecocardiografía en ensayos clínicos. J am Soc Echocardiogr. (2004) 17:1086–119. doi: 10.1016/j.echo.2004.07.013
23. Cornell, CC, Kittleson, MD, Della Torre, P, Häggström, J, Lombard, CW, Pedersen, HD, et al. Allometric scaling of M-mode cardiac measurements in normal adult dogs. J Vet Intern Med. (2004) 18:311–21. doi: 10.1111/j.1939-1676.2004.tb02551.x
24. Chetboul, V, Bussadori, C, and Madron, E. Global left ventricle systolic function assessment In: E Madron, editor. Clinical echocardiography of the dog and cat. Amsterdam: Elsevier (2012). 111–25.
25. Hansson, K, Häggström, J, Kvart, C, and Lord, P. Left atrial to aortic root indices using two-dimensional and M-mode echocardiography in cavalier king Charles spaniels with and without left atrial enlargement. Vet Radiol Ultrasound. (2002) 43:568–75. doi: 10.1111/j.1740-8261.2002.tb01051.x
26. Peters, IR, Calvert, EL, Hall, EJ, and Day, MJ. Measurement of immunoglobulin concentrations in the feces of healthy dogs. Clin Diagn Lab Immunol. (2004) 11:841–8. doi: 10.1128/CDLI.11.5.841-848.2004
27. Bolyen, E, Rideout, JR, Dillon, MR, Bokulich, NA, Abnet, CC, Al-Ghalith, GA, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2. Nat Biotechnol. (2019) 37:852–7. doi: 10.1038/s41587-019-0209-9
28. Martin, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet J. (2011) 17:200. doi: 10.14806/ej.17.1.200
29. Callahan, BJ, McMurdie, PJ, Rosen, MJ, Han, AW, Johnson, AJA, and Holmes, SP. DADA2: high-resolution sample inference from Illumina amplicon data. Nat Methods. (2016) 13:581–3. doi: 10.1038/nmeth.3869
30. Rognes, T, Flouri, T, Nichols, B, Quince, C, and Mahé, F. VSEARCH: a versatile open source tool for metagenomics. PeerJ. (2016) 4:e2584. doi: 10.7717/peerj.2584
31. Pedregosa, F, Varoquaux, G, Gramfort, A, Michel, V, Thirion, B, Grisel, O, et al. Scikit-learn: machine learning in Python. J Mach Learn Res. (2011) 12:2825–30.
32. Quast, C, Pruesse, E, Yilmaz, P, Gerken, J, Schweer, T, Yarza, P, et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools. Nucleic Acids Res. (2013) 41:D590–6. doi: 10.1093/nar/gks1219
33. Robeson, MS II, O’Rourke, DR, Kaehler, BD, Ziemski, M, Dillon, MR, Foster, JT, et al. RESCRIPt: Reproducible sequence taxonomy reference database management. PLoS Comput Biol. (2021) 17:e1009581. doi: 10.1371/journal.pcbi.1009581
34. Shannon, CE. A mathematical theory of communication. Bell Syst Tech J. (1948) 27:379–423. doi: 10.1002/j.1538-7305.1948.tb01338.x
35. Faith, D. Conservation evaluation and phylogenetic diversity. Biol Conserv. (1992) 61:1–10. doi: 10.1016/0006-3207(92)91201-3
36. Lozupone, C, Lladser, M, Knights, D, Stombaugh, J, and Knight, R. UniFrac: an effective distance metric for microbial community comparison. ISME J. (2011) 5:169–72. doi: 10.1038/ismej.2010.133
37. Wilcoxon, F. Individual comparisons by ranking methods. Biom Bull. (1945) 1:80. doi: 10.2307/3001968
38. Anderson, MJ. A new method for non-parametric multivariate analysis of variance. Austral Ecol. (2001) 26:32–46. doi: 10.1111/j.1442-9993.2001.01070.pp.x
39. Segata, N, Izard, J, Waldron, L, Gevers, D, Miropolsky, L, Garrett, WS, et al. Metagenomic biomarker discovery and explanation. Genome Biol. (2011) 12:R60. doi: 10.1186/gb-2011-12-6-r60
40. Benjamini, Y, and Hochberg, Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing. J Royal Stat Soc. (1995) 57:289–300. doi: 10.1111/j.2517-6161.1995.tb02031.x
41. de Albuquerque, P, De Marco, V, Vendramini, THA, Amaral, AR, Catanozi, S, Santana, KG, et al. Supplementation of omega-3 and dietary factors can influence the cholesterolemia and triglyceridemia in hyperlipidemic schnauzer dogs: a preliminary report. PLoS One. (2021) 16:e0258058. doi: 10.1371/journal.pone.0258058
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Jackson, Michigan, y Jewell, DE. La alimentación de aceite de pescado y triglicéridos de cadena media a los caninos afecta a los lípidos estructurales y energéticos circulantes, a los endocannabinoides y a los perfiles de metabolitos no lipídicos. Fronteras en veterinaria. Frente Vet Sci. (2023) 10:1168703. doi: 10.3389/fvets.2023.1168703
43. Toth, PP, Dayspring, TD y Pokrywka, GS. Tratamiento farmacológico para la hipertrigliceridemia: fibratos y ácidos grasos omega-3. Curr Atheroscler Rep. (2009) 11:71–9. DOI: 10.1007/s11883-009-0012-z
44. Watts, GF, y Karpe, F. Triglicéridos y dislipidemia aterogénica: extendiendo el tratamiento más allá de las estatinas en el paciente cardiovascular de alto riesgo. Corazón. (2011) 97:350–6. doi: 10.1136/hrt.2010.204990
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Bornfeldt, KE. Reducción de triglicéridos por ácidos grasos omega-3: un mecanismo mediado por las N-acil taurinas. J Clin Invertir. (2021) 131:558. doi: 10.1172/JCI147558
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Cortese, L, Terrazzano, G, y Pelagalli, A. Leptina y perfil inmunológico en la obesidad y sus enfermedades asociadas en perros. Int J Mol Sci. (2019) 20:392. doi: 10.3390/ijms20102392
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Kiernan, K, y MacIver, Nueva Jersey. El papel de la adipocina leptina en la función de las células inmunitarias en la salud y la enfermedad. Frente Immunol. (2020) 11:622468. doi: 10.3389/fimmu.2020.622468
48. Tvarijonaviciute, A, Ceron, JJ y Martínez-Subiela, S. Evaluación de cinco ELISA para la medición de las concentraciones de leptina en perros. Am J Vet Res. (2011) 72:169–73. doi: 10.2460/ajvr.72.2.169
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Feijóo-Bandín, S, Aragón-Herrera, A, Moraña-Fernández, S, Anido-Varela, L, Tarazón, E, Roselló-Lletí, E, et al. Adipoquinas e inflamación: foco en las enfermedades cardiovasculares. Int J Mol Sci. (2020) 21:711. doi: 10.3390/ijms21207711
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Damoiseaux, C, Merveille, AC, Krafft, E, Da Costa, AM, Gomart, S, Jespers, P, et al. Efecto de los determinantes fisiológicos y las enfermedades cardíacas sobre las concentraciones plasmáticas de adiponectina en perros. J Veterinario Pasante Med. (2014) 28:1738–45. doi: 10.1111/jvim.12433
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Muñoz-Prieto, A, Cerón, JJ, Martínez-Subiela, S, Mrljak, V, y Tvarijonaviciute, A. Una revisión sistemática y meta-análisis de las mediciones séricas de adiponectina en el marco de la obesidad canina. Animales. (2020) 10:1650. doi: 10.3390/ani10091650
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Tropf, M, Nelson, OL, Lee, PM, y Weng, HY. Variables cardíacas y metabólicas en perros obesos. J Veterinario Pasante Med. (2017) 31:1000–7. doi: 10.1111/jvim.14775
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Franco-Martínez, L, Muñoz-Prieto, A, Busato, F, Karveliene, B, Stadaliene, I, Ceron, JJ, et al. Evaluación de la presencia de gingivitis como factor de confusión en la evaluación del estado inflamatorio en suero y saliva de perros con diabetes mellitus. BMC Vet Res. (2024) 20:116. doi: 10.1186/s12917-024-03962-8
54. Barthélemy, A, Rannou, B, Forterre, M, Verwaerde, P, Bonnet-Garin, JM, Pouzot-Nevoret, C, et al. Differences between coagulation and cytokine profiles in dogs of different ages. Vet J. (2015) 205:410–2. doi: 10.1016/j.tvjl.2015.05.012
55. Zois, NE, Moesgaard, SG, Kjelgaard-Hansen, M, Rasmussen, CE, Falk, T, Fossing, C, et al. Circulating cytokine concentrations in dogs with different degrees of myxomatous mitral valve disease. Vet J. (2012) 192:106–11. doi: 10.1016/j.tvjl.2011.05.009
56. Calvalido, J, Wood, GA, Mutsaers, AJ, Wood, D, Sears, W, y Woods, JP. Comparación de los niveles séricos de citocinas entre perros con linfoma multicéntrico y perros sanos. Veterinario Immunol Immunopathol. (2016) 182:106–14. doi: 10.1016/j.vetimm.2016.10.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Prachar, C, Kaup, F y Neumann, S. Interleucina-1 beta (IL-1β) en la sangre periférica de perros como posible marcador para la detección de etapas tempranas de inflamación. Abrir J Vet Med. (2013) 3:302–8. doi: 10.4236/ojvm.2013.37049
58. Choi, SW, Kim, YH, Kang, MS, Jeong, Y, Ahn, JO, Choi, JH, et al. Concentración sérica de citoquinas inflamatorias en perros con sospecha de pancreatitis aguda. Veterinario Sci. (2021) 8:051. doi: 10.3390/vetsci8030051
Resumen de PubMed | Texto completo de Crossref | Google Académico
59. Safra, N, Hitchens, PL, Maverakis, E, Mitra, A, Korff, C, Johnson, E, et al. Los niveles séricos de citocinas de la inmunidad innata se elevan en perros con osteopatía metafisaria (osteodistrofia hipertrófica) durante la enfermedad activa y la remisión. Veterinario Immunol Immunopathol. (2016) 179:32–5. doi: 10.1016/j.vetimm.2016.08.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
60. Piantedosi, D, Musco, N, Palatucci, AT, Carriero, F, Rubino, V, Pizzo, F, et al. Perfil proinflamatorio e inmunológico de perros con valvulopatía mixomatosa mitral. Veterinario Sci. (2022) 9:326. doi: 10.3390/vetsci9070326
61. Cueva, Nueva Jersey. Dietas de proteínas hidrolizadas para perros y gatos. Vet Clin Pequeño Anim Prac. (2006) 36:1251–68. doi: 10.1016/j.cvsm.2006.08.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
62. Zinn, KE, Hernot, DC, Fastinger, ND, Karr-Lilienthal, LK, Bechtel, PJ, Swanson, KS, et al. Los sustratos de proteína de pescado pueden sustituir eficazmente la harina de subproductos de aves de corral cuando se incorporan a las dietas de perros mayores de alta calidad. J Anim Physiol Anim Nutr. (2009) 93:447–55. doi: 10.1111/j.1439-0396.2008.00826.x
63. Pinto, CFD, de Oliveira, BB, Bortolo, M, Guldenpfennig, R, Marx, FR y Trevizan, L. Hígado de pollo hidrolizado utilizado como fuente única de proteína animal en la dieta y su efecto sobre las citocinas, las inmunoglobulinas y el perfil de la microbiota fecal de perros adultos. PLoS Uno. (2022) 17:E0271932. doi: 10.1371/journal.pone.0271932
Resumen de PubMed | Texto completo de Crossref | Google Académico
64. Wei, Y, Xue, L, Ma, D, Weng, Y, Liu, M, Li, L, et al. El efecto del hidrolizado de proteínas dietéticas de larvas de mosca soldado negra y Schizochytrium sobre la palatabilidad, los metabolitos de nutrientes y el estado de salud en perros beagle. Meta. (2024) 14:165. doi: 10.3390/metabo14030165
Resumen de PubMed | Texto completo de Crossref | Google Académico
65. Innes, JK y Calder, PC. Ácidos grasos omega-6 e inflamación. Prostaglandinas leukot essent ácidos grasos. (2018) 132:41–8. doi: 10.1016/j.plefa.2018.03.004
66. Serhan, CN y Levy, BD. Resolvinas en la inflamación: aparición de la superfamilia de mediadores pro-resolutivos. J Clin Invertir. (2018) 128:2657–69. doi: 10.1172/JCI97943
Resumen de PubMed | Texto completo de Crossref | Google Académico
67. Fontes, JD, Rahman, F, Lacey, S, Larson, MG, Vasan, RS, Benjamin, EJ, et al. Red blood cell fatty acids and biomarkers of inflammation: a cross-sectional study in a community-based cohort. Atherosclerosis. (2015) 240:431–6. doi: 10.1016/j.atherosclerosis.2015.03.043
68. Wander, RC, Hall, JA, Gradin, JL, Du, SH, and Jewell, DE. The ratio of dietary (n-6) to (n-3) fatty acids influences immune system function, eicosanoid metabolism, lipid peroxidation and vitamin E status in aged dogs. J Nutr. (1997) 127:1198–205. doi: 10.1093/jn/127.6.1198
69. Waldron, MK, Hannah, SS, and Bauer, JE. Plasma phospholipid fatty acid and ex vivo neutrophil responses are differentially altered in dogs fed fish- and linseed-oil containing diets at the same n-6:n-3 fatty acid ratio. Lipids. (2012) 47:425–34. doi: 10.1007/s11745-012-3652-7
70. de Madron, É. 2 – Normal echocardiographic values: TM, 2D, and doppler spectral modes In: V Chetboul and C Bussadori, editors. Clinical echocardiography of the dog and cat. St. Louis, MI: Elsevier Masson (2015). 21–37.
71. Oyama, MA. Using cardiac biomarkers in veterinary practice. Vet Clin North Am Small Anim Pract. (2013) 43:1261–72, vi. doi: 10.1016/j.cvsm.2013.07.010
72. Rishniw, M, and Erb, HN. Evaluation of four 2-dimensional echocardiographic methods of assessing left atrial size in dogs. J Vet Intern Med. (2000) 14:429–35.
73. Li, Q, Heaney, A, Langenfeld-McCoy, N, Boler, BV, y Laflamme, DP. La intervención dietética reduce el agrandamiento de la aurícula izquierda en perros con enfermedad mixomatosa preclínica temprana de la válvula mitral: un estudio controlado aleatorio ciego en 36 perros. BMC Vet Res. (2019) 15:425. doi: 10.1186/s12917-019-2169-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
74. Kuleš, J, Bilić, P, Horvatić, A, Kovačević, A, Guillemin, N, Ljubić, BB, et al. Perfil del proteoma sérico en la valvulopatía crónica canina utilizando un enfoque proteómico cuantitativo basado en TMT. J Proteoma. (2020) 223:103825. doi: 10.1016/j.jprot.2020.103825
Resumen de PubMed | Texto completo de Crossref | Google Académico
75. Kim, HS, Kang, JH, Jeung, EB y Yang, MP. Concentraciones séricas de leptina y adiponectina en perros con enfermedad mixomatosa de la válvula mitral. J Veterinario Pasante Med. (2016) 30:1589–600. doi: 10.1111/jvim.14570
Resumen de PubMed | Texto completo de Crossref | Google Académico
76. Peng, J, Chen, Q y Wu, C. El papel de la adiponectina en las enfermedades cardiovasculares. Cardiovas Pathol Off J Soc Cardiovas Pathol. (2023) 64:107514. doi: 10.1016/j.carpath.2022.107514
77. Zhao, S, Kusminski, CM, y Scherer, PE. Adiponectina, leptina y trastornos cardiovasculares. Circ Res. (2021) 128:136–49. doi: 10.1161/CIRCRESAHA.120.314458
Resumen de PubMed | Texto completo de Crossref | Google Académico
78. Sotillo, S, Ward, JL, Guillot, E, Domenig, O, Yuan, L, Smith, JS, et al. Dosis-respuesta de benazepril sobre biomarcadores de las vías clásicas y alternativas del sistema renina-angiotensina-aldosterona en perros. Sci Rep. (2023) 13:2684. doi: 10.1038/s41598-023-29771-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
79. Cerutti, A, Chen, K y Chorny, A. Respuestas de inmunoglobulinas en la interfaz mucosa. Annu Rev Immunol. (2011) 29:273–93. doi: 10.1146/annurev-immunol-031210-101317
Resumen de PubMed | Texto completo de Crossref | Google Académico
80. Nakajima, A, Vogelzang, A, Maruya, M, Miyajima, M, Murata, M, Son, A, et al. La IgA regula la composición y la función metabólica de la microbiota intestinal favoreciendo la simbiosis entre bacterias. J Exp Med. (2018) 215:2019–34. doi: 10.1084/jem.20180427
Resumen de PubMed | Texto completo de Crossref | Google Académico
81. Yang, C, Mogno, I, Contijoch, EJ, Borgerding, JN, Aggarwala, V, Li, Z, et al. Los niveles de IgA fecal están determinados por las diferencias en el nivel de cepa de Bacteroides ovatus y son modificables por la manipulación de la microbiota intestinal. Microbio huésped celular. (2020) 27:467–75. doi: 10.1016/j.chom.2020.01.016
Resumen de PubMed | Texto completo de Crossref | Google Académico
82. Bunker, JJ, Drees, C, Watson, AR, Plunkett, CH, Nagler, CR, Schneewind, O, et al. Superantígenos de células B en la microbiota intestinal humana. Sci Transl Med. (2019) 11:9356. doi: 10.1126/scitranslmed.aau9356
83. Nearing, JT, Douglas, GM, Hayes, MG, MacDonald, J, Desai, DK, Allward, N, et al. Los métodos de abundancia diferencial del microbioma producen resultados diferentes en 38 conjuntos de datos. Nat Commun. (2022) 13:342. doi: 10.1038/s41467-022-28034-z
Resumen de PubMed | Texto completo de Crossref | Google Académico
84. Martínez-López, LM, Pepper, A, Pilla, R, Woodward, AP, Suchodolski, JS y Mansfield, C. Efecto de las dietas altas en proteínas, proteínas hidrolizadas y altas en fibra alimentadas secuencialmente en la microbiota fecal de perros sanos: un estudio cruzado. Anim Microb. (2021) 3:42. doi: 10.1186/s42523-021-00101-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
85. Bermingham, EN, Maclean, P, Thomas, DG, Cave, NJ y Young, W. Las familias bacterianas clave (Clostridiaceae, Erysipelotrichaceae y Bacteroidaceae) están relacionadas con la digestión de proteínas y energía en perros. ParesJ. (2017) 5:E3019. doi: 10.7717/peerj.3019
Resumen de PubMed | Texto completo de Crossref | Google Académico
86. Phimister, FD, Anderson, RC, Thomas, DG, Farquhar, MJ, Maclean, P, Jauregui, R, et al. Uso del metaanálisis para comprender los impactos del contenido de proteínas y grasas de la dieta en la composición de la microbiota fecal de perros domésticos (Canis lupus familiaris): un estudio piloto. Microbiología. (2024) 13:E1404. DOI: 10.1002/mbo3.1404
Resumen de PubMed | Texto completo de Crossref | Google Académico
87. Gevers, D, Kugathasan, S, Denson, LA, Vázquez-Baeza, Y, Van Treuren, W, Ren, B, et al. El microbioma sin tratamiento previo en la enfermedad de Crohn de nueva aparición. Microbio huésped celular. (2014) 15:382–92. doi: 10.1016/j.chom.2014.02.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
88. Castellarin, M, Warren, R, Freeman, J, Dreolini, L, Krzywinski, M, Strauss, J, et al. La infección por Fusobacterium nucleatum es prevalente en el carcinoma colorrectal humano. Genoma Res. (2012) 22:299–306. doi: 10.1101/gr.126516.111
Resumen de PubMed | Texto completo de Crossref | Google Académico
89. Vázquez-Baeza, Y, Hyde, E, Suchodolski, J y Knight, R. La enfermedad inflamatoria intestinal canina y humana se basan en redes de disbiosis superpuestas pero distintas. Nat Microbiol. (2016) 1:16177. doi: 10.1038/nmicrobiol.2016.177
Resumen de PubMed | Texto completo de Crossref | Google Académico
90. Liu, Y, Luo, L, Luo, Y, Zhang, J, Wang, X, Sun, K, et al. Las propiedades prebióticas del té verde y oscuro contribuyen a los efectos protectores de la colitis inducida por químicos en ratones: un estudio sobre el trasplante de microbiota fecal. J Agric Food Chem. (2020) 68:6368–80. doi: 10.1021/acs.jafc.0c02336
Resumen de PubMed | Texto completo de Crossref | Google Académico
91. Truong, V-L, y Jeong, W-S. Funciones antioxidantes y antiinflamatorias de los polifenoles del té en las enfermedades inflamatorias intestinales. Ciencia Alimenticia Bienestar Humano. (2022) 11:502–11. doi: 10.1016/j.fshw.2021.12.008
92. Barko, P, Nguyen-Edquilang, J, Williams, DA y Gal, A. Composición del microbioma fecal y diversidad de heces caninas criopreservadas en diferentes condiciones de duración y almacenamiento. PLoS Uno. (2024) 19:e0294730. doi: 10.1371/journal.pone.0294730
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: evaluación cardíaca, microbiota fecal, desechos de pescado, funcionalidad, respuesta inmunitaria, alimentos para mascotas
Cita: Cabrita ARJ, Barroso C, Fontes-Sousa AP, Correia A, Teixeira L, Maia MRG, Vilanova M, Yergaliyev T, Camarinha-Silva A y Fonseca AJM (2024) Evaluación de las propiedades funcionales del hidrolizado de proteínas dietéticas y el aceite de desechos de pescado sobre los parámetros inmunológicos caninos, los biomarcadores cardíacos y la microbiota fecal. Frente. Vet. Sci. 11:1449141. doi: 10.3389/fvets.2024.1449141
Received: 14 June 2024; Accepted: 29 October 2024;
Published: 11 November 2024.
Edited by:
Patricia Massae Oba, University of Illinois at Urbana-Champaign, United States
Reviewed by:
Ananda Felix, Federal University of Paraná, Brazil
Vivian Pedrinelli, NutricareVet, Brazil
Copyright © 2024 Cabrita, Barroso, Fontes-Sousa, Correia, Teixeira, Maia, Vilanova, Yergaliyev, Camarinha-Silva and Fonseca. This is an open-access article distributed under the terms of the Creative Commons Attribution License (CC BY).
*Correspondence: Ana R. J. Cabrita, arcabrita@icbas.up.pt
†Dirección actual: Margarida R. G. Maia, Laboratorio Asociado TERRA, Instituto Superior de Agronomía, LEAF – Centro de Investigación en Vinculación de Paisaje, Medio Ambiente, Agricultura y Alimentación, Universidade de Lisboa, Lisboa, Portugal
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

