Evaluación del músculo diafragmático en gatos con enfermedades cardiopulmonares
Espesor diafragmático tomográfico computarizado: un método prometedor para la evaluación del músculo diafragmático en gatos con enfermedades cardiopulmonares
 Phasamon Saisawart1
Phasamon Saisawart1  Somchin Sutthigran1
Somchin Sutthigran1  Hathaiphat Suksangvoravong1
Hathaiphat Suksangvoravong1  Chutimon Thanaboonnipat1
Chutimon Thanaboonnipat1  Sukullaya Ritthikulprasert2
Sukullaya Ritthikulprasert2  Kittipong Tachampa3
Kittipong Tachampa3  Nan Choisunirachon1*
Nan Choisunirachon1*- 1Departamento de Cirugía, Facultad de Ciencias Veterinarias, Universidad de Chulalongkorn, Bangkok, Tailandia
- 2Departamento de Medicina, Facultad de Ciencias Veterinarias, Universidad de Chulalongkorn, Bangkok, Tailandia
- 3Departamento de Fisiología, Facultad de Ciencias Veterinarias, Universidad de Chulalongkorn, Bangkok (Tailandia)
La disfunción diafragmática (DD) se define como un debilitamiento del músculo diafragmático y puede ser una causa no detectada de disnea. Los objetivos de este estudio fueron explorar la localización diafragmática adecuada, medir el grosor diafragmático (DT), evaluar el efecto de los factores intrínsecos sobre la DT y comparar la DT entre gatos sanos y enfermos, utilizando 33 gatos sanos y 15 gatos enfermos. Se realizó un estudio retrospectivo, analítico y de casos y controles mediante tomografía computarizada (TC) felina toracoabdominal. Dos radiólogos revisaron de forma independiente todas las imágenes para verificar la fiabilidad inter e intraobservador y la mejor posición para medir la DT. También se estudiaron los efectos del sexo, la edad y el peso corporal, y se establecieron valores de corte para detectar anomalías de DT. Los resultados mostraron que la ubicación apropiada para la medición de la DT fue en el borde ventral de la placa craneal del primer cuerpo vertebral lumbar (L1) debido a su mayor confiabilidad intra e interobservador. En esta localización, se observó una diferencia significativa en la DT entre el hemidiafragma derecho e izquierdo (p = 0,01). Solo el sexo tuvo un impacto en los valores de DT. Curiosamente, los DT de los gatos afectados por enfermedades cardiorrespiratorias, tanto en el lado derecho como en el izquierdo, eran significativamente más delgados que los de los gatos sanos. En conclusión, la TC es un método de imagen fiable para determinar la atrofia muscular diafragmática. El borde ventral de la placa terminal craneal de L1 se recomienda para medir el DT, y el sexo fue el único factor que afectó la medición del DT.
1 Introducción
La disfunción diafragmática (DD) es una afección caracterizada por la pérdida de fuerza muscular diafragmática, que puede ser unilateral o bilateral. La DD es una causa poco reconocida de insuficiencia respiratoria, disnea, cianosis y muerte. Puede ser causada por varias enfermedades que involucran el sistema nervioso central, el nervio frénico, la unión neuromuscular y los músculos respiratorios (1, 2). Además, afecciones como la insuficiencia cardíaca congestiva (3), las enfermedades pulmonares (4), del espacio pleural (5), de las vías respiratorias (6) y las enfermedades renales crónicas (7) pueden afectar la función diafragmática. Estas enfermedades deterioran la función diafragmática al aumentar la resistencia respiratoria y la carga de trabajo respiratorio. Posteriormente, reducen el movimiento diafragmático y provocan atrofia muscular.
La disfunción diafragmática puede evaluarse mediante parámetros clínicos y/o diagnósticos por imagen. Las técnicas de diagnóstico por imagen pueden mostrar características anatómicas, como el grosor diafragmático (DT), la contracción diafragmática (8) y el movimiento (9, 10). Se han utilizado varias modalidades de imagen para determinar la función diafragmática, incluyendo la radiografía (11), la fluoroscopia (11), la ecografía (US) (8), la resonancia magnética (RM) (11) y la tomografía computarizada (11, 12). Sin embargo, cada técnica tiene sus limitaciones, como la exposición a la radiación ionizante de la radiografía, la fluoroscopia y la tomografía computarizada, y la disponibilidad limitada de máquinas de resonancia magnética. Aunque la ecografía está ampliamente disponible, actúa como una técnica libre de radiación en tiempo real y proporciona altos grados de sensibilidad y especificidad, depende del operador (11, 13).
A pesar de la exposición a la radiación X, la TC ofrece información anatómica superior sobre los pulmones y las vías respiratorias. Recientemente, la TC ha ganado popularidad porque se puede utilizar como herramienta de diagnóstico para enfermedades respiratorias en humanos afectados por COVID-19 (12, 14), trastorno obstructivo crónico (15), asma (16) y DD (1, 15, 17, 18). Además, la DT en pacientes con DD por ventilación mecánica (17), enfermedad pulmonar obstructiva crónica (15) y parálisis diafragmática (1) puede evaluarse mediante imágenes de TC.
Un número limitado de estudios han demostrado la aplicación de parámetros diafragmáticos, en particular la excursión diafragmática, utilizando métodos ultrasonográficos en la práctica clínica veterinaria. Estos incluyen distinguir entre el movimiento diafragmático normal y paralizado (19), la evaluación de la disfunción diafragmática en caninos con trastornos de la columna cervical (20) y la detección de parálisis diafragmática en varios modelos animales, incluida una llama (21), gatos (22) y un poni (23). Aunque la DT es un parámetro fiable para evaluar la DD en humanos, no se dispone de información sobre las mediciones de DT por tomografía computarizada en animales de compañía. Este estudio tuvo como objetivo explorar una ubicación diafragmática apropiada para medir la DT, evaluar el efecto de factores intrínsecos como la edad, el peso corporal (PC) y el sexo en el valor de DT, y comparar la DT entre gatos sanos y enfermos utilizando imágenes de TC. Planteamos la hipótesis de que la medición de la DT está influenciada por la ubicación del diafragma y que las DT son diferentes entre gatos sanos y enfermos.
2 Materiales y métodos
2.1 Animales
Se trata de un estudio retrospectivo, analítico y de casos y controles. Todos los datos retrospectivos incluidos fueron aprobados por el Comité de Hospitales de Pequeños Animales de la Facultad de la Universidad de Chulalongkorn (aprobación n.º S.392/2565). Se incluyeron en el estudio todos los datos de gatos que se sometieron a un protocolo de TC toracoabdominal post-contraste. La información clínica como edad, PC, sexo, estado castrado e historia previa se obtuvo de las historias clínicas digitales a través del sistema de información hospitalaria. Posteriormente, los pacientes se dividieron en dos grupos: gatos sanos o enfermos. Los criterios de inclusión para cada grupo fueron los siguientes: Gr. Incluí imágenes de TC de gatos que se confirmó clínicamente que estaban sanos y que fueron adquiridas para otros fines, como estudios de estructura intratorácica (24), mientras que Gr. II incluyó imágenes de TC de gatos con anomalías del parénquima pulmonar, incluido el patrón pulmonar intersticial o alveolar, derrame pleural y enfermedades cardiovasculares. Se excluyeron los pacientes que tenían antecedentes de enfermedades que pudieran interferir con la estructura diafragmática o la función neuromuscular, como rotura diafragmática, enfermedad intervertebral cervical, cirugía diafragmática y cervical previa, fracturas costales y anomalías intraabdominales que indujeran compresión diafragmática, como organomegalia intraabdominal, embarazo o derrame peritoneal. Además, se excluyeron las imágenes de TC de calidad inadecuada debido al campo de visión incompleto y a los artefactos de movimiento.
2.2 Protocolo de medición de TC
Desde agosto de 2018 hasta febrero de 2023, las imágenes de TC se recogieron con un escáner de TC helicoidal de 64 cortes (Optima CT660, GE Healthcare, Tokio, Japón) bajo anestesia general, realizada por anestesiólogos. Todos los gatos fueron intubados y la anestesia se mantuvo a través de un respirador (SV-2000, SOARMED, Taiwán). Las imágenes de TC (tamaño de matriz de 512 × 512, espesor de corte de 0,625-1,25 mm) se adquirieron en 10 minutos. Posteriormente, las imágenes de TC se recuperaron del Sistema de Archivo y Comunicación de Imágenes en formato Digital y de Comunicaciones en Medicina (DICOM) y se volvieron a analizar en una estación de trabajo de unidad que no era de TC con un monitor de 2.560 × 1.440 píxeles utilizando el software de visualización DICOM (OsiriX, Ginebra, Suiza) con un ancho de ventana de 350 unidades Hounsfield (HU) y un nivel de ventana de 40 HU por dos radiólogos con 3 años (P.S.) y 20 años (N.C.) de experiencia.
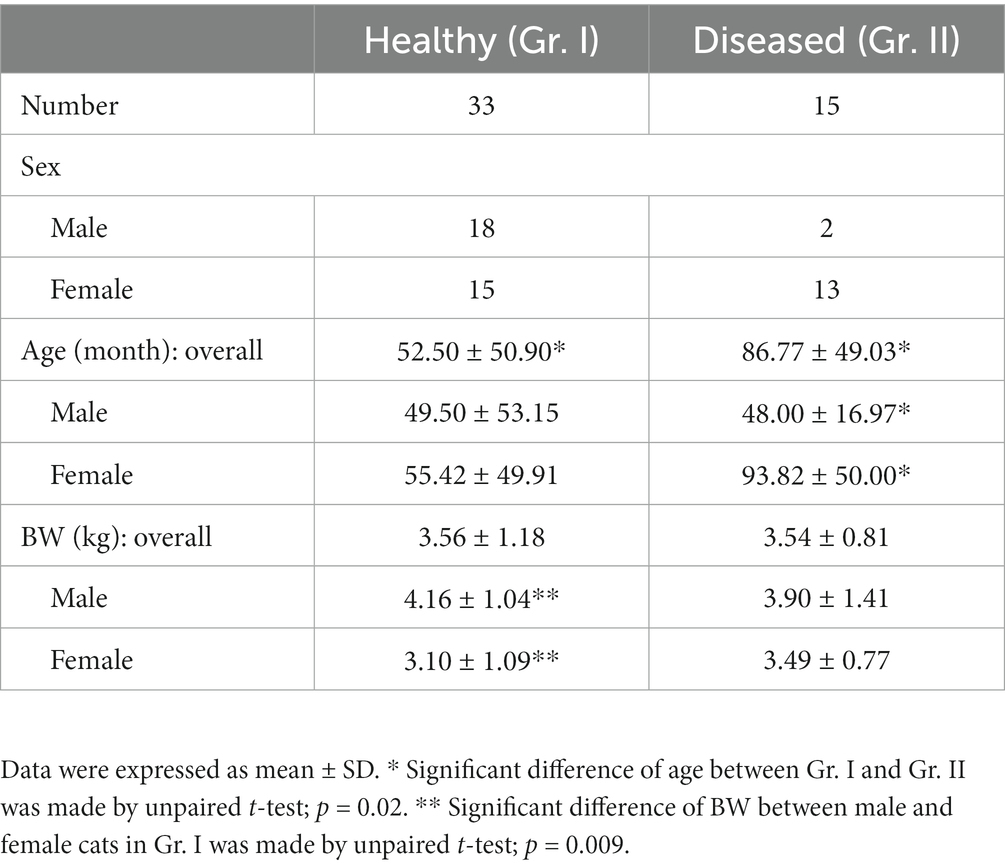
En primer lugar, se probó una ubicación diafragmática apropiada para la medición de DT en Gr. I. Se realizó una reconstrucción multiplanar para revelar la crura de cada hemidiafragma en la placa terminal craneal de las primeras vértebras lumbares (L1) en el plano axial. Los DT de cada hemidiafragma se midieron utilizando un calibrador digital en tres áreas diferentes de la ubicación diafragmática dorsal (20): (i) en el borde ventral de L1; (ii) en el área paramediana de cada cúpula; y (iii) en la parte más lateral adosada a la zona costera (Figura 1). A continuación, se probaron las fiabilidades inter e intraobservador. Para evaluar la fiabilidad intraobservador, las imágenes de TC fueron examinadas dos veces por el mismo operador, con 1 semana de diferencia. Para probar la confiabilidad entre observadores, las imágenes de TC fueron medidas por dos operadores experimentados en un orden aleatorio para cada medición. Se seleccionó una ubicación diafragmática apropiada para la medición de DT de acuerdo con las mayores fiabilidades intra e interobservador. La misma técnica de medición se utilizó para evaluar el DT en Gr. II.
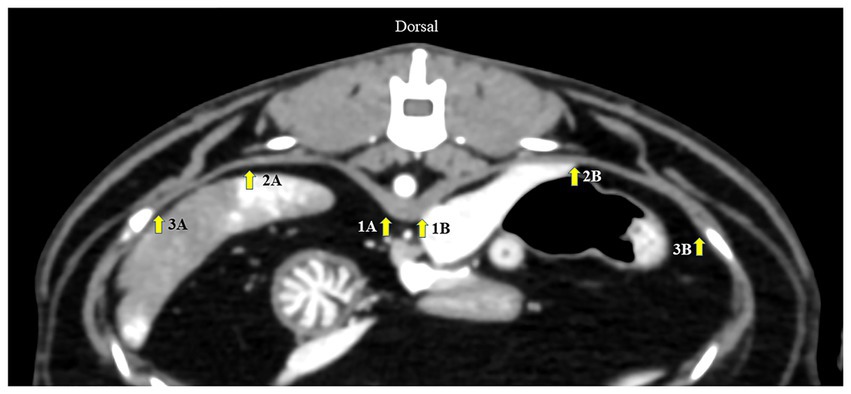 Figura 1. Imagen de tomografía axial computarizada que muestra la medición del espesor diafragmático desde tres puntos diferentes: (1) a nivel del borde ventral de la placa terminal craneal de L1, (2) la paramediana de cada cúpula y (3) la parte más lateral de la costal del diafragma. A representa el diafragma izquierdo y B representa el diafragma derecho.
Figura 1. Imagen de tomografía axial computarizada que muestra la medición del espesor diafragmático desde tres puntos diferentes: (1) a nivel del borde ventral de la placa terminal craneal de L1, (2) la paramediana de cada cúpula y (3) la parte más lateral de la costal del diafragma. A representa el diafragma izquierdo y B representa el diafragma derecho.
Para eliminar el efecto de la variación del tamaño corporal en la DT, se midió el diámetro aórtico (Ao) en el borde ventral de la placa terminal craneal de L1 y se comparó entre los grupos. Además, para eliminar el efecto del volumen muscular general entre los grupos, también se midieron las superficies musculares epaxiales derecha e izquierda, incluidos los grosores de los músculos rectos abdominales en la parte media del abdomen indicados por el nivel de la parte craneal de la cuarta vértebra lumbar (L4), y se compararon entre los grupos (Figura 2). Todos los parámetros se midieron tres veces y se promediaron.
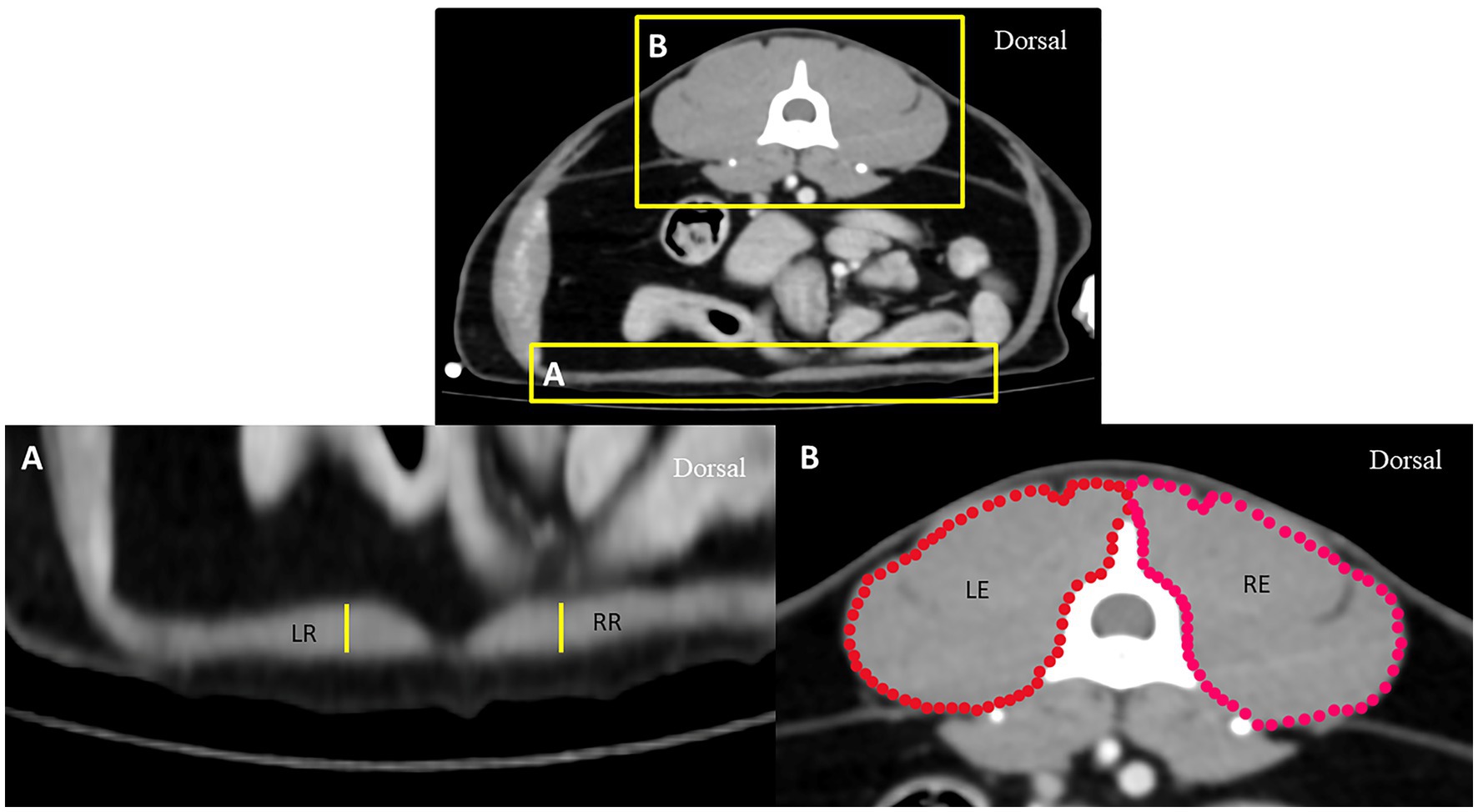 Figura 2. Tomografía axial computarizada que demuestra métodos de medición del grosor del músculo recto abdominal (A) y de la superficie del músculo epaxial (B) a nivel de la vértebra L4: RR representa el grosor del músculo recto abdominal en el lado derecho, LR representa el grosor del músculo recto abdominal en el lado izquierdo, RE representa la superficie del músculo epaxial derecho, y LE representa la superficie del músculo epaxial izquierdo.
Figura 2. Tomografía axial computarizada que demuestra métodos de medición del grosor del músculo recto abdominal (A) y de la superficie del músculo epaxial (B) a nivel de la vértebra L4: RR representa el grosor del músculo recto abdominal en el lado derecho, LR representa el grosor del músculo recto abdominal en el lado izquierdo, RE representa la superficie del músculo epaxial derecho, y LE representa la superficie del músculo epaxial izquierdo.
2.3 Análisis estadístico
Los datos se analizaron con el programa Prism8 (GraphPad Software, CA, Estados Unidos). La normalidad de cada conjunto de datos se analizó mediante la prueba de Shapiro-Wilk. Todos los datos clínicos de los gatos inscritos se describieron como datos descriptivos. Las fiabilidades interobservador e intraobservador se evaluaron mediante puntuaciones de coeficientes de correlación intraclase con intervalos de confianza (IC) del 95%. El efecto de la edad, el peso corporal y el sexo en los DT derechos e izquierdos se evaluó mediante el análisis de correlación de Pearson. Se utilizó una prueba t de Student para las comparaciones entre los grupos. La curva de características de funcionamiento del receptor (ROC) para Gr. Para el cálculo de los valores de corte de DT se utilizaron I y Gr. II. Se calculó el intervalo de confianza (IC) del 95% y el área bajo la curva ROC (AUC). La significación estadística se definió como un valor de p de <0,05.
3 Resultados
3.1 Datos demográficos clínicos
En este estudio, 48 gatos cumplieron con los criterios de inclusión y luego fueron divididos en 2 grupos: 33 gatos en Gr. I y 15 gatos en Gr. II. Las características demográficas de los pacientes se muestran en la Tabla 1. Los gatos del Gr. II eran significativamente mayores que los del Gr. I. Los BW fueron similares entre los dos grupos. En gr. I, los gatos machos eran significativamente más pesados que las gatas (p = 0,009). Además, las gatas eran significativamente mayores que los machos en Gr. II (p = 0,02). Había Doméstico de Pelo Corto (n = 23), Americano de Pelo Corto (n = 3), Persa (n = 5), y un gato de cada una de las siguientes razas de Scottish Fold y Khoa Manee en Gr. I, mientras que los gatos del Gr. II eran todos domésticos de pelo corto (n = 15). Los gatos del Gr. II se vieron afectados por nódulos pulmonares (n = 6), derrame pleural (n = 4), enfermedades intersticiales (n = 2), insuficiencia cardíaca congestiva (n = 1), masa intratorácica (n = 1) y neumonía (n = 1).
3.2 Ubicación diafragmática para la medición de DT
Los valores de DT entre tres localizaciones de cada hemidiafragma en Gr. I, incluidas las fiabilidades inter e intraobservador, se muestran en el Cuadro 2. El DT en el borde ventral de la placa terminal craneal de L1 tuvo la mayor confiabilidad inter e intraobservador. Por lo tanto, se seleccionó esta ubicación para evaluar DT durante el resto del experimento.
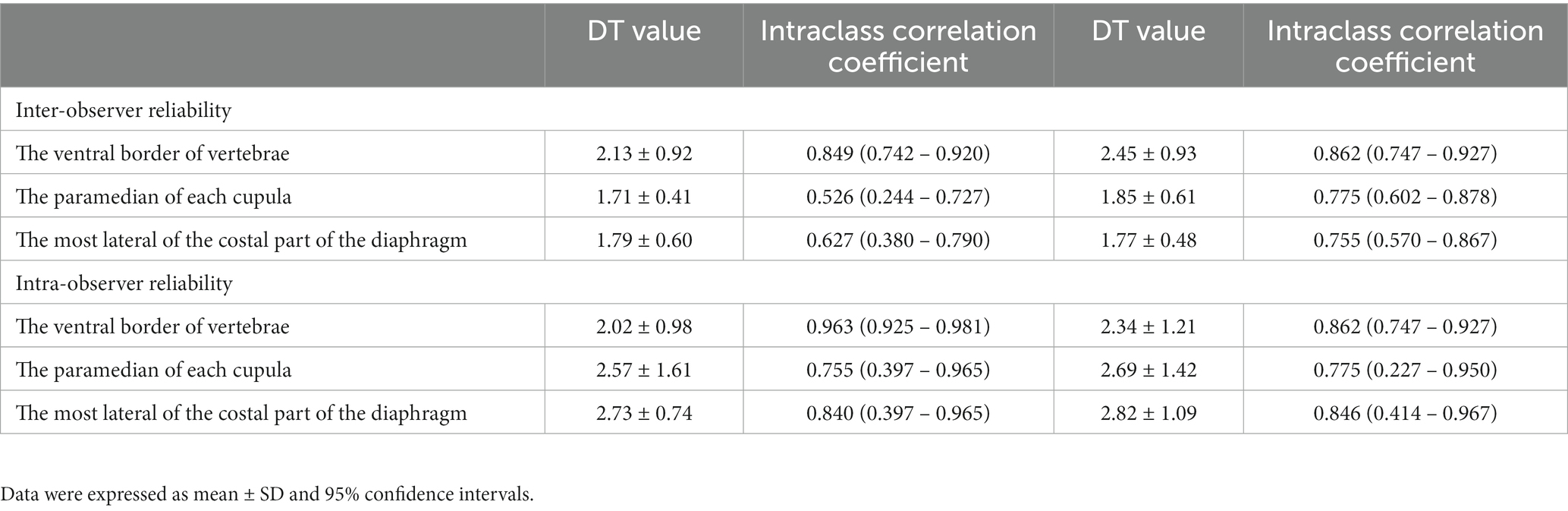 Tabla 2. Valores de DT, confiabilidad inter e intraobservador para las mediciones de espesor diafragmático para cada ubicación.
Tabla 2. Valores de DT, confiabilidad inter e intraobservador para las mediciones de espesor diafragmático para cada ubicación.
3.3 Comparación de los valores de DT entre gatos sanos y enfermos
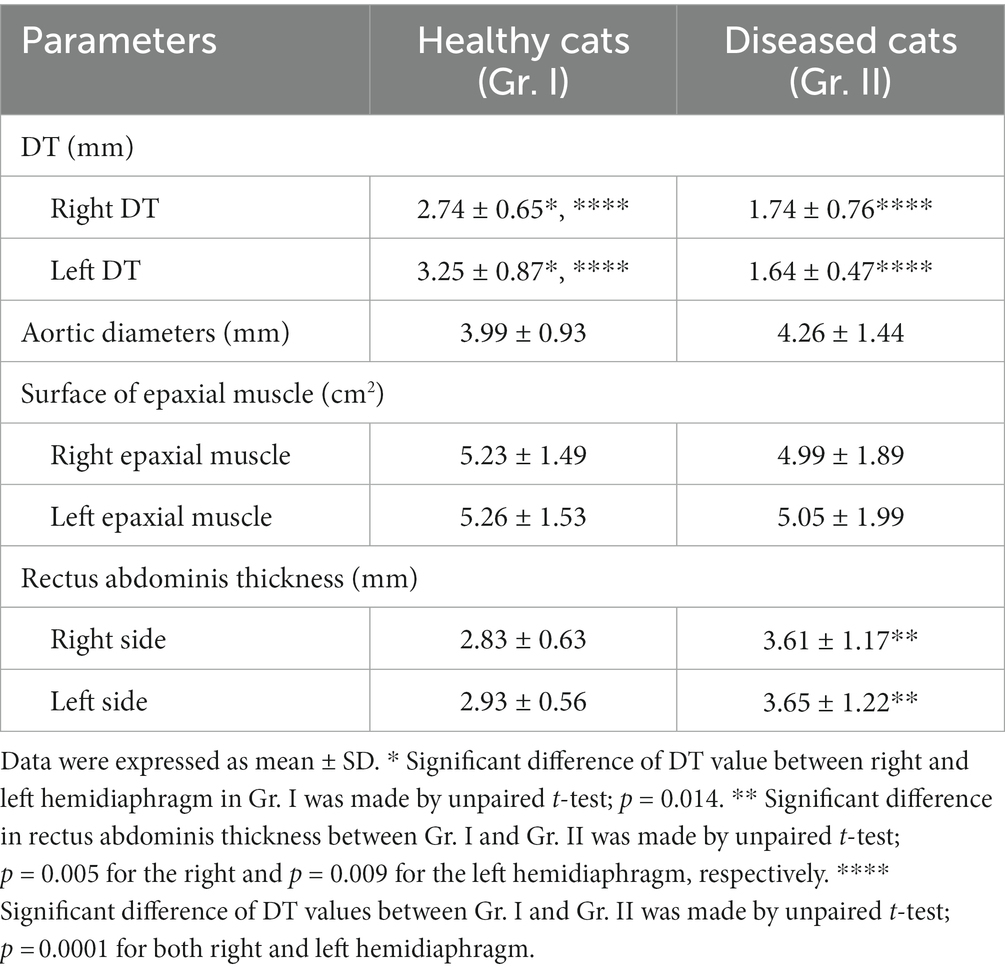
Los valores de DT de los gatos en Gr. I y Gr. II se enumeran en la Tabla 3. En gr. I, el DT del hemidiafragma izquierdo a nivel de L1 fue significativamente mayor que el del lado derecho (p = 0,014), mientras que los DT del Gr. II fueron similares en cada lado. El efecto de los datos demográficos clínicos sobre los DT de gatos en Gr. I se muestra en la Figura 3. Edad (r = 0,064, p = 0,721; r = 0,006, 141 p = 0,971, para el hemidiafragma derecho e izquierdo, respectivamente) y el peso corporal (r = 0,145, p = 0,463; r = 142 0,054, p = 0,783, para el hemidiafragma derecho e izquierdo, respectivamente) no se correlacionaron significativamente con los DT. Sin embargo, los DT del hemidiafragma derecho e izquierdo de las mujeres fueron mayores que los de los hombres (p = 0,013 y 0,014 para el hemidiafragma derecho e izquierdo, respectivamente).
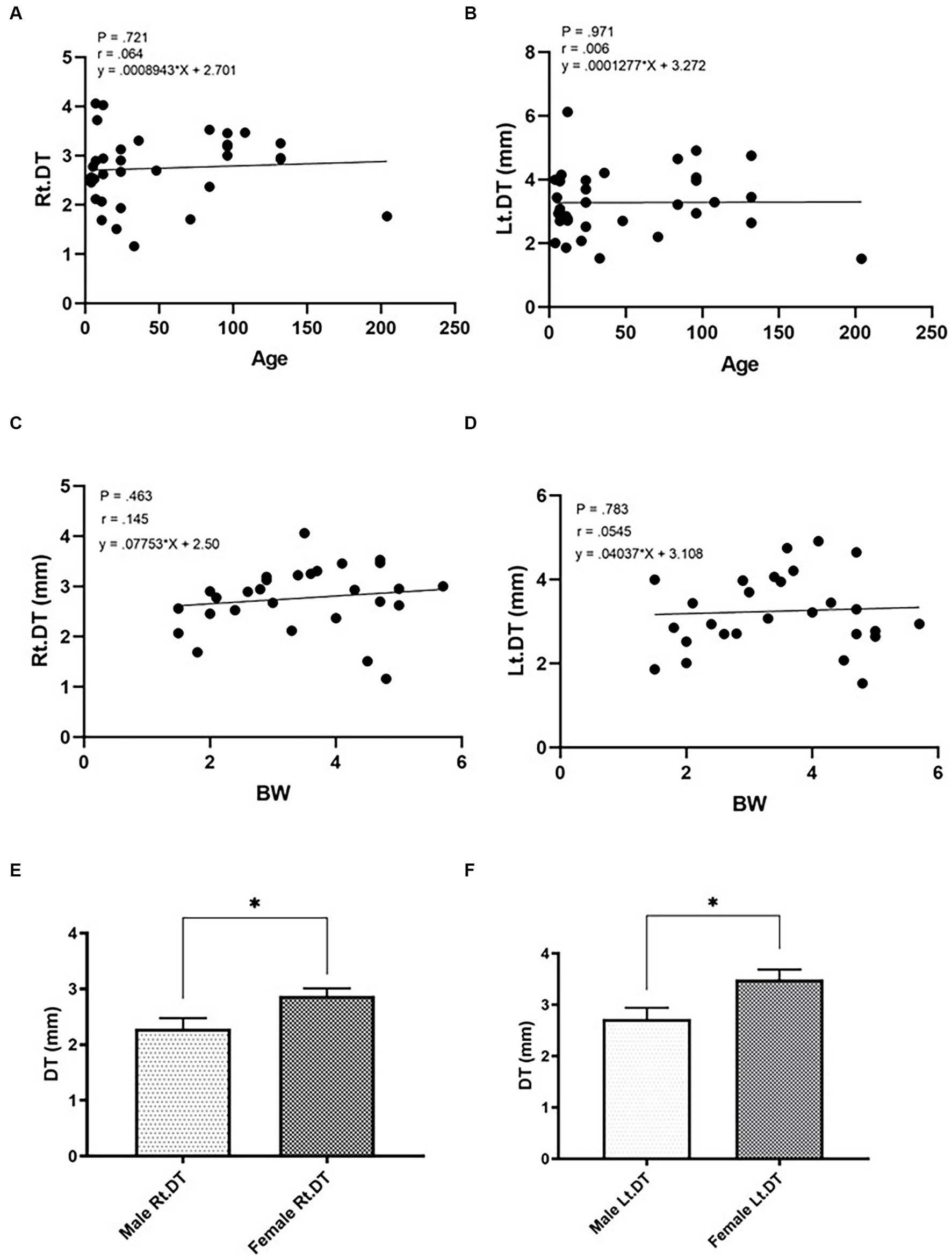 Figura 3. Correlaciones entre el grosor diafragmático (DT) y factores intrínsecos de los gatos como la edad (A,B; A = hemidiafragma derecho, B = hemidiafragma izquierdo), BW (C,D; C = hemidiafragma derecho, D = hemidiafragma izquierdo) y sexo (E,F; E = macho, F = hembra) de gatos sanos. *Diferencia significativa; p < 0,05.
Figura 3. Correlaciones entre el grosor diafragmático (DT) y factores intrínsecos de los gatos como la edad (A,B; A = hemidiafragma derecho, B = hemidiafragma izquierdo), BW (C,D; C = hemidiafragma derecho, D = hemidiafragma izquierdo) y sexo (E,F; E = macho, F = hembra) de gatos sanos. *Diferencia significativa; p < 0,05.
Teniendo en cuenta tanto el hemidiafragma derecho como el izquierdo, los DT en Gr. I fueron significativamente mayores que los del Gr. II (p < 0,0001 y p < 0,0001 para el hemidiafragma derecho e izquierdo, respectivamente). El Ao y la superficie de los músculos epaxiales no fueron significativamente diferentes entre los grupos. Sin embargo, el grosor del recto abdominal en Gr. II fue significativamente mayor que el de Gr. I (p = 0,005 y p = 0,009 para el hemidiafragma derecho e izquierdo, respectivamente) (Tabla 3).
La curva ROC para DT se muestra en la Figura 4. Los valores de corte de DT entre Gr. I y Gr. II fueron de 2,04 mm para la derecha (AUC: 0,888, IC 95%: [0,784–0,992]; p < 0,001, con una sensibilidad del 84,6% y una especificidad del 81,8%), y 2,06 mm para el hemidiafragma izquierdo (AUC: 0,937, IC 95%: [0,869–1,00]; p < 0,0001, con una sensibilidad del 92,3% y una especificidad del 87,9%, respectivamente.
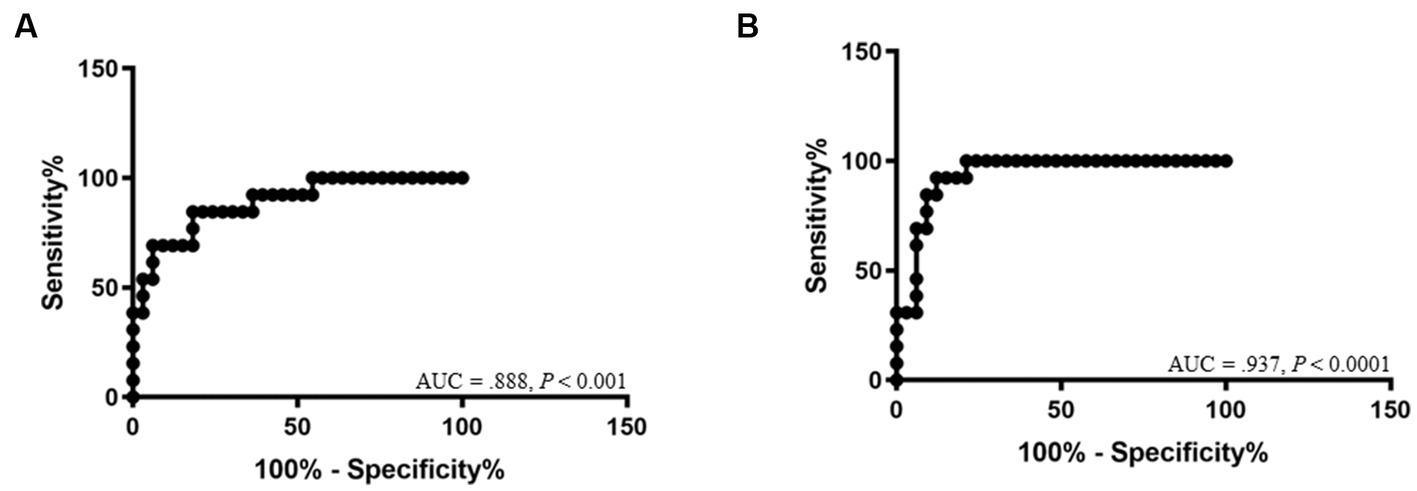 Figura 4. Las curvas características de funcionamiento del receptor muestran el área bajo la curva (AUC) y el valor p de importancia para el diagnóstico de disfunción diafragmática del hemidiafragma derecho (A) y del hemidiafragma izquierdo (B).
Figura 4. Las curvas características de funcionamiento del receptor muestran el área bajo la curva (AUC) y el valor p de importancia para el diagnóstico de disfunción diafragmática del hemidiafragma derecho (A) y del hemidiafragma izquierdo (B).
4 Discusión
El diafragma es el principal músculo implicado en la respiración. Las enfermedades que reducen el grosor del diafragma pueden conducir a la DD. Posteriormente, afecta la respiración, induce hipoxia y causa cianosis y muerte (4, 25, 26). Aunque un DT delgado no es una anomalía diafragmática directa, refleja un debilitamiento de la función muscular del diafragma. Este estudio es el primero en investigar los valores de DT tomográficos computarizados en gatos sanos y enfermos. En el grupo de gatos sanos, los valores de DT fueron de 2,74 ± 0,65 mm y de 3,25 ± 0,87 mm para los hemidiafragmas derecho e izquierdo, respectivamente. Para el grupo enfermo, los valores de DT fueron de 1,74 ± 0,76 mm y de 1,64 ± 0,47 mm para el hemidiafragma derecho e izquierdo, respectivamente. Además, se establecieron valores de corte de 2,04 mm para el hemidiafragma derecho (sensibilidad 84,6%, especificidad 81,8%) y de 2,06 mm para el hemidiafragma izquierdo (sensibilidad 92,3%, especificidad 87,9%). Estos resultados se pueden utilizar como referencia en el futuro.
Hasta donde sabemos, este es el primer estudio que explora la ubicación óptima para la medición de DT mediante TC en animales. Nuestro estudio mostró que el borde ventral de la placa terminal craneal L1 en el plano axial era la ubicación más confiable debido a su alta confiabilidad intra e interobservador, lo cual es consistente con un estudio previo en humanos (27). La determinación del contorno del músculo diafragmático es difícil en el área diafragmática paramediana de cada cúpula y en la parte diafragmática más lateral unida al hueso costal porque es delgada y su atenuación es igual a la del hígado en el lado derecho y al bazo en el lado izquierdo, incluso en la fase de realce posterior al contraste. Lo que explica la menor confiabilidad inter e intraobservador en estos lugares. Además, el hemidiafragma izquierdo era más grueso que el hemidiafragma derecho en el borde ventral de la placa terminal craneal L1 en nuestro estudio, lo que contrasta con varios estudios en humanos en los que se informó que el hemidiafragma derecho era más grueso que el izquierdo (27). De acuerdo con la anatomía normal del gato, los músculos diafragmáticos de la región lumbar se originan en pares desde la cara ventral de las primeras tres o cuatro vértebras lumbares y se abren en abanico para unirse al tendón central en las regiones dorsales. El crus derecho es considerablemente más grande que el izquierdo en el borde ventral de L3 o L4. Debido a que el crus derecho se origina más caudalmente que el crus izquierdo, se vuelve más delgado antes, lo que puede explicar este hallazgo a nivel de L1 (28).
Los gatos enfermos eran mayores que los sanos, lo que era de esperar, ya que la incidencia de enfermedades cardiorrespiratorias es mayor en los gatos de edad avanzada. La edad o el peso corporal no afectaron a la DT en gatos sanos. Sin embargo, el sexo fue un factor importante que influyó en la DT. La mayoría de los estudios en humanos encontraron una discrepancia en esta información, ya que los DT de los pacientes masculinos eran más gruesos que los de las mujeres (8, 13, 29), mientras que otro estudio afirmó que no había diferencia estadística en el DT entre sexos (30). Martin et al. han informado que los niveles bajos de testosterona podrían afectar el rendimiento del músculo esquelético, haciendo que se vuelva más delgado y débil, especialmente en el diafragma (31). Los hombres sanos normalmente tienen niveles de testosterona más altos que las mujeres (32, 33), lo que puede ser el factor principal que causa una DT más gruesa en los humanos. Sin embargo, en nuestro estudio se contrastaron los DT felinos entre sexos, ya que el DT de las hembras fue más grueso que el de los machos. Esto puede deberse a condiciones específicas de cada especie. Por lo tanto, se debe realizar un estudio prospectivo para evaluar la DT en diferentes sexos, comparando los factores hormonales relativos, para proporcionar más información.
Se compararon varios parámetros, como el peso corporal, la ao, la superficie muscular epaxial y el grosor del músculo recto abdominal, para minimizar el efecto de la enfermedad crónica en los diferentes volúmenes musculares generales entre los grupos. Los resultados no mostraron diferencias estadísticas en el peso corporal, el Ao o la superficie muscular epaxial. Esto puede implicar que los tamaños corporales observados a través del peso corporal, el ao y el volumen muscular general observado a través de la superficie muscular epaxial en ambos grupos fueron similares. Por lo tanto, la DT de gatos sanos y enfermos difiere en concurrencia con las enfermedades intratorácicas. Para observar el volumen muscular general a través de la superficie muscular epaxial y el grosor de los músculos respiratorios accesorios en el abdomen a través del recto abdominal, se seleccionó el área abdominal media en la parte craneal de L4 como ubicación para la evaluación debido a su simple aplicabilidad. Curiosamente, los músculos de los gatos enfermos tenían un grosor del recto abdominal significativamente mayor que los de los gatos sanos. Esto podría deberse a un músculo respiratorio accesorio como el recto abdominal, que tiene una mayor carga de trabajo para compensar la respiración durante la debilidad diafragmática (34).
Este estudio tuvo algunas limitaciones. En primer lugar, el protocolo de TC no estaba estandarizado porque se trataba de un estudio retrospectivo. En segundo lugar, el grado de atrofia de la crus puede haber sido afectado por el momento de las tomografías computarizadas después del inicio de la DD, y no pudimos determinar el grado de cronicidad de estos trastornos. En tercer lugar, a pesar de la obvia diferencia en los DT entre los grupos, los DT pueden ser diferentes entre las fases de la respiración. El DT será más grueso durante la inspiración y más delgado durante la espiración (35). El presente estudio, que utilizó imágenes de TC, no pudo comparar los DT entre las fases respiratorias debido a que es un modelo retrospectivo. Por lo tanto, el efecto que influye en la fase respiratoria sobre el diafragma normal y el afectado por la enfermedad debe investigarse más a fondo utilizando imágenes de TC con compuerta respiratoria o ecografía para ver cómo afecta el ciclo respiratorio al diafragma tanto en gatos sanos como en aquellos con problemas respiratorios para obtener un resultado más fiable.
En conclusión, un lugar fiable para medir la DT en gatos es el borde ventral de la placa terminal craneal de L1, debido a su alta fiabilidad intra e interobservador. La edad y el peso corporal no afectaron el valor de DT en gatos sanos; sin embargo, el sexo jugó un papel importante en la determinación del valor de DT. Un valor de corte de 2,04 y 2,06 mm para los hemidiafragmas derecho e izquierdo, respectivamente, con alta sensibilidad y especificidad, puede utilizarse como guía para predecir la DD en gatos sin interferencia de la atrofia muscular inducida por enfermedades crónicas.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Contribuciones de los autores
PS y NC realizaron el concepto/diseño, el análisis/interpretación de los datos, la redacción del manuscrito y la revisión crítica del manuscrito. SS realizó el análisis/interpretación de los datos, la revisión crítica del manuscrito y aprobó el manuscrito. HS, SR, KT y CT revisaron críticamente el manuscrito y lo aprobaron. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
Se agradece la beca de la Escuela de Posgrado de la Universidad de Chulalongkorn para conmemorar el 72º aniversario de Su Majestad el Rey Bhumibol Aduladej y el 90º aniversario del Fondo de la Universidad de Chulalongkorn (Fondo de Dotación Ratchadaphiseksomphot) (subvención número GCUGR1125661061D.061).
Reconocimientos
Los autores desean expresar un agradecimiento especial a la Unidad de Diagnóstico por Imágenes del Hospital de Pequeños Animales de la Facultad de Ciencias Veterinarias de la Universidad de Chulalongkorn.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Sukkasem, W, Moftah, SG, Kicska, G, Godwin, JD, Pipavath, S y Stern, E. Atrofia de Crus: precisión de la tomografía computarizada en el diagnóstico de la parálisis diafragmática. J Imágenes del tórax. (2017) 32:6. doi: 10.1097/RTI.000000000000000276
2. McCool, FD, y Tzelepis, GE. Disfunción del diafragma. N Engl J Med. (2012) 366:932–42. doi: 10.1056/NEJMra1007236
3. Cross, TJ, Kim, CH, Johnson, BD y Lalande, S. Las interacciones entre los sistemas respiratorio y cardiovascular en la insuficiencia cardíaca sistólica. J Appl Physiol (1985). (2020) 128:214–24. doi: 10.1152/japplphysiol.00113.2019
4. Ricoy, J, Rodríguez-Núñez, N, Álvarez-Dobaño, JM, Toubes, ME, Riveiro, V, y Valdés, L. Disfunción diafragmática. Neumología. (2019) 25:223–35. doi: 10.1016/j.pulmoe.2018.10.008
5. Aguilera García, Y, Palkar, A, Koenig, SJ, Narasimhan, M, y Mayo, PH. Evaluación de la función del diafragma y las presiones pleurales durante la toracocentesis. Pecho. (2020) 157:205–11. doi: 10.1016/j.chest.2019.07.019
6. Corbellini, C, Boussuges, A, Villafañe, JH y Zocchi, L. La pérdida de movilidad diafragmática en sujetos con EPOC moderada a muy grave puede mejorar después de la rehabilitación pulmonar hospitalaria. Respir Care. (2018) 63:1271–80. doi: 10.4187/respcare.06101
7. Figueiredo, PH, Lima, MM, Costa, HS, Gomes, RT, Neves, CD, Oliveira, ES, et al. El papel de la debilidad muscular inspiratoria en la capacidad funcional en pacientes en hemodiálisis. PLoS Uno. (2017) 12:e0173159. doi: 10.1371/journal.pone.0173159
8. Boussuges, A, Rives, S, Finance, J, Chaumet, G, Vallée, N, Risso, JJ, et al. Evaluación ecográfica del grosor y engrosamiento del diafragma: valores de referencia y límites de normalidad en posición sentada. Front Med (Lausana). (2021) 8:742703. doi: 10.3389/fmed.2021.742703
9. Boussuges, A, Finance, J, Chaumet, G, y Brégeon, F. Movimiento diafragmático registrado por ultrasonografía en modo m: límites de normalidad. ERJ Open Res. (2021) 7:00714–2020. doi: 10.1183/23120541.00714-2020
10. Boussuges, A, Rives, S, Finance, J y Brégeon, F. Evaluación de la función diafragmática mediante ecografía: enfoque actual y perspectivas. Casos de World J Clin. (2020) 8:2408–24. doi: 10.12998/wjcc.v8.i12.2408
11. Laghi, FA, Saad, M, y Shaikh, H. Técnicas de imagen por ultrasonido y no ultrasonido en la evaluación de la disfunción diafragmática. BMC Pulm Med. (2021) 21:85. doi: 10.1186/s12890-021-01441-6
12. Luo, N, Zhang, H, Zhou, Y, Kong, Z, Sun, W, Huang, N, et al. Utilidad de la TC de tórax en el diagnóstico de la neumonía por COVID-19. Diagn Interv Radiol. (2020) 26:437–42. doi: 10.5152/dir.2020.20144
13. Boon, AJ, Sekiguchi, H, Harper, CJ, Strommen, JA, Ghahfarokhi, LS, Watson, JC, et al. Sensibilidad y especificidad de la ecografía diagnóstica en el diagnóstico de la neuropatía frénica. Neurología. (2014) 83:1264–70. doi: 10.1212/WNL.0000000000000000841
14. Aljondi, R, y Alghamdi, S. Valor diagnóstico de las modalidades de imagen para COVID-19: revisión exploratoria. J Med Internet Res. (2020) 22:E19673. doi: 10.2196/19673
15. Donovan, AA, Johnston, G, Moore, M, Jensen, D, Benedetti, A, Coxson, HO, et al. Morfología del diafragma evaluada por tomografía computarizada en la enfermedad pulmonar obstructiva crónica. Ann Am Thorac Soc. (2021) 18:955–62. doi: 10.1513/AnnalsATS.202007-865OC
16. Walker, C, Gupta, S, Hartley, R, y Brightling, CE. Tomografía computarizada en el asma grave: utilidad e implicaciones clínicas. Curr Opin Pulm Med. (2012) 18:42–7. doi: 10.1097/MCP.0b013e32834db255
17. Lee, GD, Kim, HC, Yoo, JW, Lee, SJ, Cho, YJ, Bae, K, et al. La tomografía computarizada confirma una reducción del grosor del diafragma en pacientes con ventilación mecánica. J Cuidado crítico. (2016) 33:47–50. doi: 10.1016/j.jcrc.2016.02.013
18. Ni, Y-N, Xu, H, Li, W-J, Sun, J-K, Liang, B-M y Liang, Z-A. ¿Podría la pérdida de espesor del diafragma medida por tomografía computarizada predecir la tasa de reintubación? J Enfermedad del tóraco. (2020) 12:581–91. doi: 10.21037/jtd.2019.12.125
19. Choi, M, Lee, N, Kim, A, Keh, S, Lee, J, Kim, H, et al. Evaluación del movimiento diafragmático en perros normales y con parálisis diafragmática mediante ecografía en modo m. Ecografía Radiol Veterinaria. (2014) 55:102–8. doi: 10.1111/vru.12126
20. Drury, BL, Brinkman, EL, Gambino, JM, Lee, AM, Wills, RW y Beasley, MJ. La disfunción diafragmática en perros con trastornos de la columna cervical antes y después de la cirugía mediante fluoroscopia, ecografía en modo movimiento y radiografía no fue diferente a la de un grupo de perros de control. Ecografía Radiol Veterinaria. (2020) 61:353–63. doi: 10.1111/vru.12833
21. Bedenice, D, Mazan, MR, Kuehn, H, y Hoffman, AM. Parálisis diafragmática por degeneración del nervio frénico en una llama. J Veterinario Pasante Med. (2002) 16:603–6. doi: 10.1892/0891-6640(2002)016<0603:dpdtpn>2.3.co; 2
22. Vignoli, M, Toniato, M, Rossi, F, Terragni, R, Manzini, M, Franchi, A, et al. Parálisis hemidiafragmática postraumática transitoria en dos gatos. J Pequeña Anim Pract. (2002) 43:312–6. doi: 10.1111/j.1748-5827.2002.tb00080.x
23. Amory, H, Lomba, F, Lekeux, PM, Solal, AN, Jauniaux, TP y Desmecht, DJ. Parálisis diafragmática bilateral en un pony. J Am Vet Med Assoc. (1994) 205:587–91.
24. Thammasiri, N, Thanaboonnipat, C, Choisunirachon, N y Darawiroj, D. Consideraciones multifactoriales para las evaluaciones de ganglios linfáticos intratorácicos de gatos sanos en imágenes tomográficas computarizadas. BMC Vet Res. (2021) 17:59. doi: 10.1186/s12917-021-02771-7
25. Dubé, BP y Dres, M. Disfunción del diafragma: enfoques diagnósticos y estrategias de tratamiento. J Clin Med. (2016) 5:13. doi: 10.3390/jcm5120113
26. Mirabile, VS, Shebl, E, Sankari, A, y Burn, B. Insuficiencia respiratoria. En: StatPearls. Treasure Island (FL): StatPearls Publishing (2023) Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK526127/.
27. Ufuk, F, Çakmak, P, Sagtas, E, Herek, D, Arslan, M, y Yagci, B. Las mediciones del grosor del diafragma en tomografía computarizada: fiabilidad intra e interobservador. Istanb Med J. (2019) 20:101–6. doi: 10.4274/imj.65471
28. Hudson, LC, y Hamilton, WP. Sistema respiratorio En: B Smith, editor. Atlas de anatomía felina para veterinario. Jackson, WY: Teton Newmedia (2010). 144.
29. Scarlata, S, Mancini, D, Laudisio, A, Benigni, A, y Antonelli, IR. Reproducibilidad y correlatos clínicos del movimiento diafragmático en decúbito supino medido por ecografía en modo m en voluntarios sanos. Respiración. (2018) 96:259–66. doi: 10.1159/000489229
30. Oguri, M, Okanishi, T, Ikeguchi, T, Ogo, K, Kanai, S, Maegaki, Y, et al. Influencia del sexo en el grosor del diafragma utilizando un método para determinar el grosor de la íntima media en adultos jóvenes sanos. BMC Med Imaging. (2022) 22:26. doi: 10.1186/s12880-022-00748-y
31. Martins, G, Verdeal, JCR, Tostes, H, da Silva, ARO, Tessarollo, B, Rocha, NN, et al. Terapia con testosterona y rendimiento del diafragma en un paciente masculino con COVID-19: reporte de un caso. Diagnóstico. (2022) 12:535. doi: 10.3390/diagnostics12020535
32. Clark, RV, Wald, JA, Swerdloff, RS, Wang, C, Wu, FCW, Bowers, LD, et al. Gran divergencia en las concentraciones de testosterona entre hombres y mujeres: marco de referencia para atletas de élite en la competición específica de sexo en el deporte, una revisión narrativa. Clin Endocrinol. (2019) 90:15–22. doi: 10.1111/cen.13840
33. van Anders, SM, Steiger, J y Goldey, KL. Efectos del comportamiento de género sobre la testosterona en mujeres y hombres. Proc Natl Acad Sci. (2015) 112:13805–10. doi: 10.1073/pnas.1509591112
34. LoMauro, A, Aliverti, A, Perchiazzi, G y Frykholm, P. Cambios fisiológicos y mecanismos compensatorios por la acción de los músculos respiratorios en un modelo porcino de lesión del nervio frénico. J Appl Physiol. (2021) 130:813–26. doi: 10.1152/japplphysiol.00781.2020
Palabras clave: cardiorrespiratorio, tomografía computarizada, diafragma, felino, medición
Cita: Saisawart P, Sutthigran S, Suksangvoravong H, Thanaboonnipat C, Ritthikulprasert S, Tachampa K y Choisunirachon N (2023) Grosor diafragmático tomográfico computarizado: un método prometedor para la evaluación del músculo diafragmático en gatos con enfermedades cardiopulmonares. Frente. Vet. Sci. 10:1247531. doi: 10.3389/fvets.2023.1247531
Recibido: 26 de junio de 2023; Aceptado: 21 de noviembre de 2023;
Publicado: 14 diciembre 2023.
Editado por:
Alessia Cordella, Universidad de Pensilvania, Estados Unidos
Revisado por:
Biswajit Bhowmick, Universidad de Tennessee, Estados Unidos Sarah Bouyssou, VCA Inc., Estados
Unidos
Derechos de autor © 2023 Saisawart, Sutthigran, Suksangvoravong, Thanaboonnipat, Ritthikulprasert, Tachampa y Choisunirachon. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Nan Choisunirachon, nan.c@chula.ac.th
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía