Explorando la dinámica de elevación de las comunidades bacterianas ruminales en el ganado
 Explorando la dinámica de elevación de las comunidades bacterianas ruminales en el ganado de 900 a 3.600 metros mediante secuenciación 16S de longitud completa
Explorando la dinámica de elevación de las comunidades bacterianas ruminales en el ganado de 900 a 3.600 metros mediante secuenciación 16S de longitud completa
 Shuli Yang1,
Shuli Yang1,  Jieyi Zheng1,
Jieyi Zheng1,  Shichun He2,
Shichun He2,  Zaimei Yuan3,
Zaimei Yuan3,  Rongjiao Wang2,4 y
Rongjiao Wang2,4 y  Dongwang Wu2*
Dongwang Wu2*- 1Laboratorio Provincial Clave de Diseño Molecular Animal y Cría Precisa, Facultad de Ciencias de la Vida e Ingeniería, Universidad de Foshan, Foshan, China
- 2Laboratorio clave de nutrición animal y ciencia de la alimentación de la provincia de Yunnan, Universidad Agrícola de Yunnan, Kunming, China
- 3Centro de Prevención y Control de Enfermedades Animales de Kunming, Kunming, China
- 4Academia Panzhihua de Ciencias Agrícolas y Forestales, Panzhihua, China
La diversidad y abundancia de microorganismos ruminales sirven como indicadores no solo de la capacidad digestiva y metabólica del huésped, sino también de su estado de salud. Las complejas comunidades microbianas en el rumen están influenciadas en diversos grados por la adaptabilidad ambiental. En este estudio, recolectamos 24 muestras de líquido ruminal de 24 bovinos machos sanos en tres regiones de Yunnan, China. Utilizando el análisis de datos de secuenciación de amplicones de ARNr 16S, examinamos las variaciones en los microorganismos ruminales entre el ganado alimentado a altitudes de 900 m, 1800 m y 3.600 m. Los factores ambientales relacionados con la altitud no superaron la filogenia como la principal fuerza impulsora detrás de la evolución convergente de la composición del microbioma ruminal del ganado amarillo. Sin embargo, tuvieron un impacto en la diversidad alfa del microbioma ruminal y la coevolución del microbioma central. El cambio de altitud influyó notablemente en la diversidad y riqueza de la microbiota ruminal, destacando el efecto ambiental de la altitud. A medida que aumentaba la altitud, se observó un aumento en la abundancia de Firmicutes y Bacteroidetes, mientras que la abundancia de Proteobacteria ruminal y Kiritimatiellaeota disminuyó. Es importante destacar que, a nivel de género, el género central exhibió distintos cambios dinámicos a medida que aumentaba la altitud. Los rumiantes exhiben la capacidad de adaptar su tipo de intestino de acuerdo con la altitud, optimizando así la utilización de energía, especialmente en entornos de gran altitud. Estos descubrimientos ofrecen información valiosa sobre la coevolución de las interacciones huésped-microbio durante la adaptación de rumiantes a diversos entornos altitudinales.
Introducción
El intestino de los animales alberga una vasta población de microbios, y un creciente cuerpo de investigación indica que la flora intestinal es extensa y vital para la nutrición y la salud animal (1-4). Las alteraciones en la composición de la microbiota intestinal pueden influir en los fenotipos del huésped asociados con la digestión, el desarrollo, la inmunidad y el comportamiento (5). Los metabolitos bioactivos producidos por la flora intestinal influyen en los procesos fisiológicos del huésped, la regulación del sistema inmunológico y la secreción de hormonas (6, 7). La composición, diversidad y función de la comunidad microbiana están estrechamente asociadas con factores como las especies animales, la dieta, el medio ambiente y otras variables (8-10). La compleja interacción del genoma del huésped, la nutrición y el entorno de vida gobierna la composición y actividad de la flora intestinal (11). Las interacciones dan forma a la composición funcional de las especies de flora intestinal y contribuyen a la respuesta al estrés ambiental. El impacto de la microecología intestinal animal en la fisiología del huésped ha sido durante mucho tiempo un punto focal de la investigación ecológica, particularmente bajo condiciones ambientales cambiantes. Por ejemplo, a pesar de las condiciones desafiantes encontradas a grandes altitudes, muchos animales prosperan y desarrollan mecanismos fisiológicos específicos. La flora intestinal puede desempeñar un papel crucial en la adaptación al entorno de la meseta (12). Ciertos estudios sugieren que los microbios intestinales desempeñan un papel en ayudar a los animales a adaptarse a grandes altitudes. Los genes microbianos del rumen de yaks y ovejas a gran altitud mostraron un enriquecimiento significativo en la vía de producción de ácidos grasos volátiles, mientras que los genes microbianos ruminales del ganado a baja altitud mostraron un enriquecimiento en la vía de metanogénesis (13). Las pikas que se han adaptado al ambiente frío y con poco oxígeno a gran altitud demostraron una mayor diversidad microbiana intestinal, concentración de ácidos grasos volátiles y capacidad de degradación de la celulosa en comparación con las pikas que residen en áreas de baja altitud (14). Los resultados de la investigación indican que los monos rhesus en ambientes de gran altitud exhiben una mayor abundancia de Firmicutes a Bacteroidetes en su flora intestinal, junto con una presencia elevada de ruminococcaceae y Christensenellaceae. Estos factores contribuyen potencialmente a su adaptación a grandes altitudes (15).
El ganado amarillo exhibe una notable adaptabilidad a diversos entornos de altitud, lo que los convierte en un modelo ideal para explorar la coadaptación entre entornos extremos de meseta y gradientes de altitud. Como resultado, ofrecen la oportunidad de investigar el impacto de las diferentes altitudes en la composición y funcionalidad de la abundancia de la flora intestinal. Actualmente, hay investigaciones limitadas sobre la interacción entre la microflora ruminal y los huéspedes en rumiantes a diferentes altitudes. En nuestro estudio anterior, observamos efectos significativos de la altitud en los microbios ruminales de los yaks (16). El objetivo de este estudio es investigar variaciones significativas en la microbiota ruminal del ganado que reside a diferentes altitudes, mejorando así nuestra comprensión de cómo la microbiota ruminal influye en la adaptación del huésped a distintos hábitats. Los hallazgos proporcionarán información de referencia valiosa para la investigación en medicina microbiana realizada en entornos de gran altitud.
Materiales
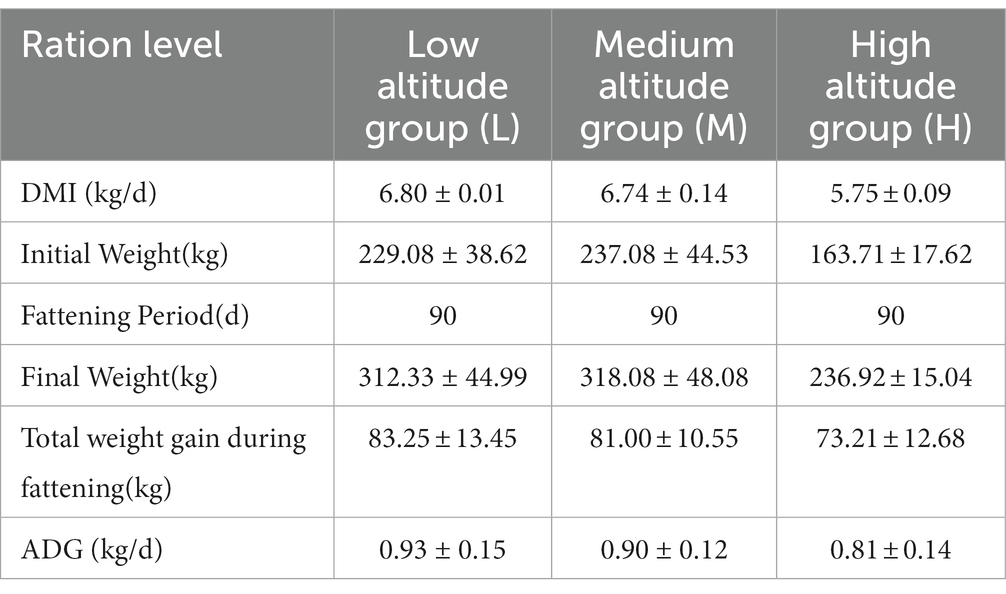
Todos los animales involucrados en este experimento han recibido la aprobación del Comité de Protección y Utilización de Animales de la Universidad Agrícola de Yunnan, China, y se han adherido a las directrices del Comité de Ética de Animales de Laboratorio. La recolección de fuentes y muestras animales experimentales se llevó a cabo de acuerdo con estas regulaciones. El grupo H (n = 6) estaba ubicado en el pasto de Tiancheng Lun Zhu Agricultural Products Development Co., Ltd., en el norte del condado de Shangri-La. El sitio experimental tenía una altitud promedio de 3.600 metros y pertenecía a un clima monzónico templado. La temperatura diaria promedio máxima fue de 13 ° C, la temperatura diaria promedio mínima fue de 1 ° C, la precipitación anual fue de 600 mm y la humedad relativa fue del 65%. El grupo L (n = 6) estaba situado en Jiangcheng Xinfutai Agricultural Development Co., Ltd., ubicada en el oeste del condado de Jiangcheng. La altitud media del sitio era de 900 metros, y pertenecía a un clima húmedo monzónico de montaña subtropical. La temperatura media anual fue de 18.1°C. El grupo M (n = 12) se posicionó en Jinjiang Green Beef Cattle Breeding Co., LTD, en la parte sur de la ciudad de Anning. El sitio tenía una altitud de 1800 metros y experimentaba un clima subtropical. La temperatura media anual fue de 14,9 °C, con temperaturas máximas y mínimas extremas de 31,5 °C y -7,8 °C, respectivamente. Los tres grupos experimentales fueron alimentados en graneros con una dieta que consiste en maíz de ensilaje entero y maíz molino, como se describe en la Tabla 1, que proporciona información sobre la composición de la dieta y los niveles nutricionales. La Tabla 2 presenta los efectos de diferentes elevaciones en el engorde del ganado amarillo. El período de alimentación duró 90 días, durante los cuales se midieron los pesos de los animales en el primer y último día antes de la alimentación de la mañana. Dos horas después de la alimentación matutina final, se insertó un catéter en el rumen y se recolectaron muestras de líquido ruminal utilizando un muestreador de vacío. Para cada animal, se recolectaron 30 ml de líquido ruminal y se dividieron en tres partes, cada una colocada en un tubo de polipropileno de 10 ml y se almacenó rápidamente en nitrógeno líquido. Las muestras se transportaron al laboratorio y se almacenaron en un refrigerador a -80 ° C.
 Tabla 1. Composición de nutrientes del ensilaje de maíz entero (base de materia seca, excepto para el contenido de materia seca que es de base fresca).
Tabla 1. Composición de nutrientes del ensilaje de maíz entero (base de materia seca, excepto para el contenido de materia seca que es de base fresca).
Extracción y secuenciación de ADN
El ADN de la comunidad microbiana se extrajo utilizando el EZNA Stool DNA Kit (Omega Bio-Tek, Norcross, Georgia, Estados Unidos), siguiendo las instrucciones del fabricante. El ADN se cuantificó utilizando un fluorómetro Qubit y el kit de ensayo Qubit dsDNA BR (Invitrogen, EE.UU.), y la calidad se evaluó mediante la ejecución de una alícuota en un gel de agarosa al 1%. Las regiones variables V1-V9 del gen bacteriano 16S rRNA se amplificaron utilizando cebadores de PCR degenerados, 27F (5′-AGRGTTYGATYMTGGCTCAG-3′) y 1492R (5′-RGYTACCT TGTTACGACTT-3′) (17). Tanto los cebadores delanteros como los inversos se etiquetaron con adaptadores Illumina, pad y secuencias de enlazador. El enriquecimiento por PCR se llevó a cabo en una reacción de 50 μL que contenía 30 ng de plantilla, cebador de PCR de fusión y mezcla maestra de PCR. Las condiciones de ciclo de PCR fueron las siguientes: 94 °C durante 3 min, seguido de 30 ciclos de 94 °C durante 30 s, 56 °C durante 45 s y 72 °C durante 45 s, con una extensión final a 72 °C durante 10 min. Los productos de PCR se purificaron utilizando perlas AmpureXP y se eluyeron en tampón Elution. Las bibliotecas se evaluaron utilizando el bioanalizador Agilent 2.100 (Agilent, Estados Unidos). Las bibliotecas validadas se secuenciaron en la plataforma Illumina MiSeq (BGI, Shenzhen, China) utilizando las tuberías estándar de Illumina, generando lecturas de extremo pareado de 2 × 300 pb.
Análisis de secuencias
Los datos sin procesar se filtraron para eliminar la contaminación del adaptador y las lecturas de baja calidad, lo que resultó en lecturas limpias. Las lecturas de extremo emparejado con superposiciones se combinaron para formar etiquetas. Estas etiquetas se agruparon posteriormente en Unidades Taxonómicas Operativas (OTU) con una similitud de secuencia del 97%. Los rangos taxonómicos se asignaron a secuencias representativas de las OTU utilizando el Ribosomal Database Project (RDP) Naive Bayesian Classifier v.2.2. La diversidad alfa, la diversidad beta y la identificación de diferentes especies se analizaron con base en las OTU y los rangos taxonómicos. La agrupación de etiquetas en OTU se realizó utilizando el software USEARCH (v7.0.1090). La clasificación taxonómica de las secuencias representativas de OTU se realizó utilizando el clasificador del Proyecto de Base de Datos Ribosómica (RDP) v.2.2 entrenado en la base de datos Greengene_2013_5_99, con un valor de confianza de corte de 0,5. Las etiquetas filtradas se agruparon en OTU con una similitud del 97%. El número de OTU por muestra representa principalmente el nivel de diversidad de la muestra. Se enumeraron las OTU de cada grupo, y los diagramas de Venn se crearon utilizando el software de diagramas de Venn en R (v3.1.1) para resumir los ID de OTU comunes y específicos.
Con base en la información de abundancia de las OTU, se calculó la abundancia relativa de cada OTU en cada muestra. El Análisis de Componentes Principales (PCA) de las OTU se realizó utilizando los valores de abundancia relativa con el paquete ade4 en R (v3.1.1). La cobertura de Good, las diversidades alfa (incluidos los índices Inverse Simpson y Shannon), la riqueza (número observado de OTU) y la uniformidad (uniformidad de Shannon) se calcularon utilizando Mothur V.1.31.2. El análisis de diversidad beta se realizó utilizando QIIME (v1.80). Dado que había diferencias en la profundidad de secuenciación entre las muestras, la normalización se introdujo mediante la extracción aleatoria de secuencias de acuerdo con el número mínimo de secuencia en todas las muestras. Las secuencias extraídas formaron un nuevo archivo ‘OTU table biom’, y la distancia de diversidad beta se calculó en función de este archivo. Los resultados estadísticos, incluidas las diferencias de diversidad beta entre grupos, los histogramas de abundancia de especies y los histogramas que comparan las diferencias en especies clave, se graficaron utilizando R (v3.4.1). La tipificación de la comunidad bacteriana se realizó utilizando R (v3.4.1). La predicción de la función KEGG se realizó utilizando R (v3.2.1) y el software PICRUSt2 v2.3.0-b. El software LEfSe se utilizó para el análisis diferencial de especies.
Resultados
Análisis de la diversidad microbiana ruminal
Se identificaron un total de 1.644 OTU en los tres grupos experimentales: gran altitud, altitud media y baja altitud. El grupo de altitud alta tenía 1.355 OTU, el grupo de altitud media tenía 1.374 OTU y el grupo de baja altitud tenía 1.144 OTU. Como se muestra en la Figura 1A, un total de 889 OTU estaban presentes en los tres grupos experimentales, con 177 OTU exclusivas para el grupo de gran altitud, 101 OTU únicas para el grupo de altitud media y 26 OTU únicas para el grupo de baja altitud.
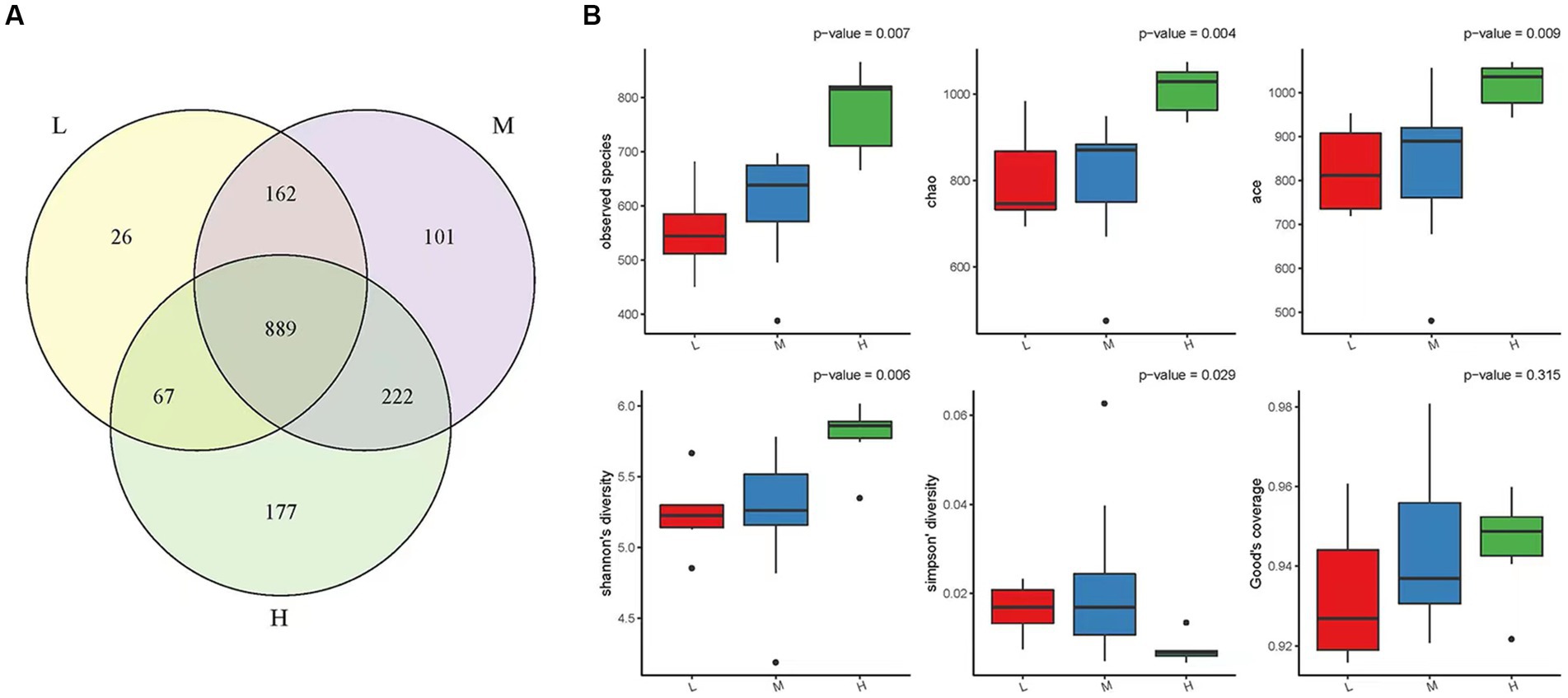 Figura 1. (A) Diagrama de Venn OTU. En la figura, diferentes gráficos de color representan diferentes muestras o diferentes grupos, y el número de partes superpuestas es el número de OTU compartidas entre dos muestras o dos grupos. Del mismo modo, el número de múltiples partes superpuestas se refiere al número de OTU compartidas entre múltiples muestras o grupos. Grupo de baja altitud (L), grupo de altitud media (M), grupo de gran altitud (H). (B) Gráfico de la diversidad alfa. Se incluyen el índice de especies observadas, el índice Chao, el índice ACE, el índice Shannon, el índice Simpson y el índice de buena cobertura. Cuanto mayores sean los primeros cuatro índices, cuanto menor sea el quinto índice, más abundantes serán las especies en la muestra. Grupo de baja altitud (L), grupo de altitud media (M), grupo de gran altitud (H).
Figura 1. (A) Diagrama de Venn OTU. En la figura, diferentes gráficos de color representan diferentes muestras o diferentes grupos, y el número de partes superpuestas es el número de OTU compartidas entre dos muestras o dos grupos. Del mismo modo, el número de múltiples partes superpuestas se refiere al número de OTU compartidas entre múltiples muestras o grupos. Grupo de baja altitud (L), grupo de altitud media (M), grupo de gran altitud (H). (B) Gráfico de la diversidad alfa. Se incluyen el índice de especies observadas, el índice Chao, el índice ACE, el índice Shannon, el índice Simpson y el índice de buena cobertura. Cuanto mayores sean los primeros cuatro índices, cuanto menor sea el quinto índice, más abundantes serán las especies en la muestra. Grupo de baja altitud (L), grupo de altitud media (M), grupo de gran altitud (H).
La diversidad alfa se evaluó utilizando parámetros como el índice de especies observadas, el índice de Chao, el índice ACE, el índice de Shannon, el índice de Simpson y el índice de buena cobertura basado en la abundancia (Figura 1B). El índice de especies observadas, el índice Chao, el índice ACE y el índice de Shannon mostraron una tendencia creciente en los grupos de baja, media y alta altitud, lo que indica que la diversidad y riqueza de la microbiota ruminal en el grupo de gran altitud fueron las más altas (p < 0,05). Además, el índice de Simpson, que refleja la diversidad de especies de las comunidades, mostró que la diversidad de microorganismos ruminales en el grupo de gran altitud era mayor que en el grupo de altitud media-baja.
Se detectaron 19 filos (Figura Suplementaria S1A) en las muestras de las tres regiones de elevación, que representaron más del 0,1% de la abundancia de la comunidad a nivel de filo. Los filos dominantes fueron Bacteroidetes, Firmicutes, Proteobacteria y Kiritimatiellaeota. La abundancia relativa de Firmicutes y Bacteroidetes fue de 21.55, 23.41 y 31.03% en altitudes bajas, medias y altas, respectivamente, mientras que Kiritimatiellaeota tuvo abundancias relativas de 28.62, 34.64 y 38.52% en las mismas altitudes. Esta tendencia indicó un aumento obvio en la abundancia relativa con el aumento de la altitud (Figura 2). La proporción de Firmicutes a Bacteroidetes fue de 0,75, 0,67 y 0,80 en bovinos amarillos a altitudes bajas, medias y altas, respectivamente.
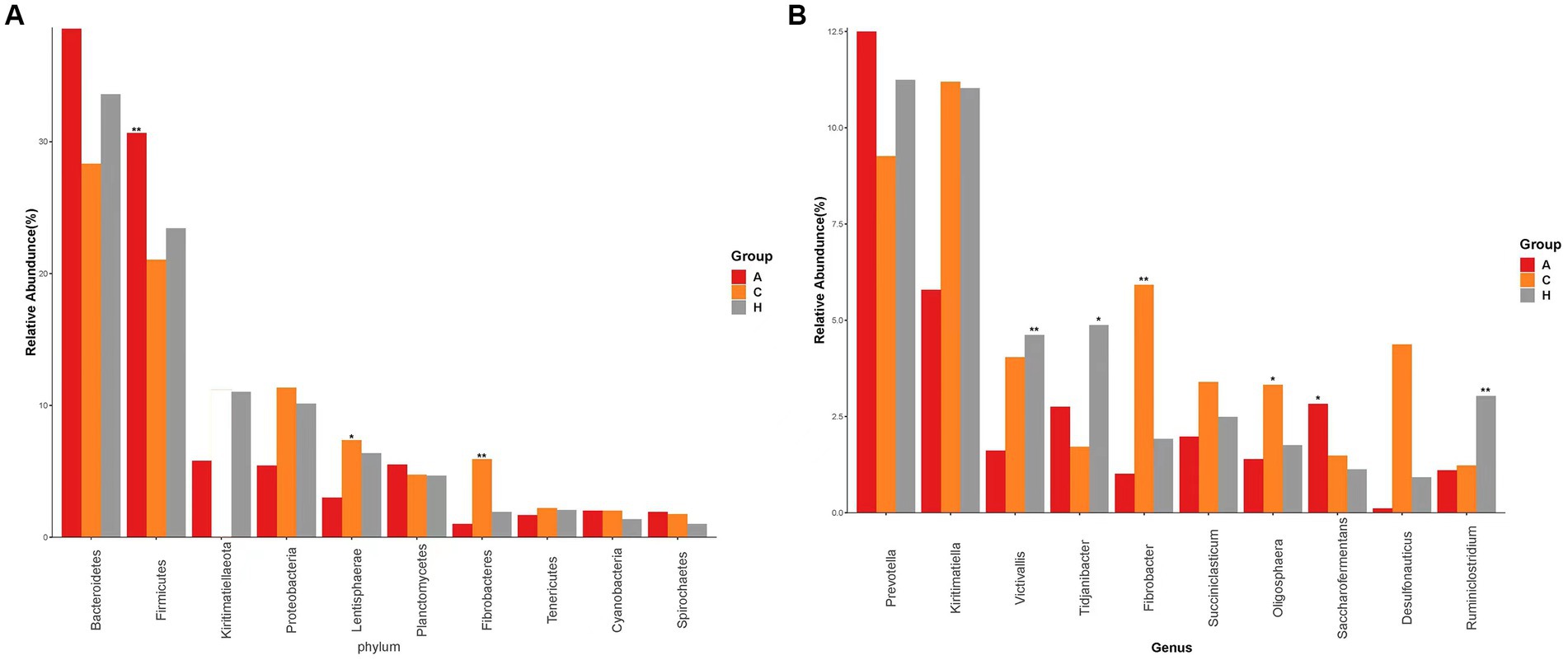 Figura 2. Especies con la abundancia de los 10 primeros, que muestran la abundancia relativa promedio de cada grupo y la importancia de la prueba de diferencia (marcada con un «*» en la parte superior del gráfico de barras si corresponde, no marcado si no). (A) Comparación de filos dominantes en el grupo de baja altitud, grupo de altitud media, grupo de altitud alta. (B) Comparación de géneros dominantes en el grupo de baja altitud, grupo de altitud media, grupo de altitud alta. Grupo de baja altitud (L), grupo de altitud media (M), grupo de gran altitud (H).
Figura 2. Especies con la abundancia de los 10 primeros, que muestran la abundancia relativa promedio de cada grupo y la importancia de la prueba de diferencia (marcada con un «*» en la parte superior del gráfico de barras si corresponde, no marcado si no). (A) Comparación de filos dominantes en el grupo de baja altitud, grupo de altitud media, grupo de altitud alta. (B) Comparación de géneros dominantes en el grupo de baja altitud, grupo de altitud media, grupo de altitud alta. Grupo de baja altitud (L), grupo de altitud media (M), grupo de gran altitud (H).
La abundancia de Proteobacteria y Kiritimatiellaeota en el rumen mostró una disminución a medida que aumentaba la altitud. Además, la abundancia relativa de Firmicutes, Lentisphaerae y Fibrobacteres mostró diferencias significativas entre los microorganismos del rumen del ganado amarillo en altitudes bajas, medias y altas. En las 24 muestras analizadas (Figura Suplementaria S1B), identificamos 33 géneros, siendo Prevotella y Kiritimatiella las más abundantes en los tres niveles de elevación en el rumen del ganado amarillo. En particular, se observaron cambios distintos y dinámicos a nivel de género en bacterias ruminales a medida que aumentaba la altitud.
Ambiente de elevación y microbios diferenciales
La composición de la comunidad procariota en el rumen exhibe variaciones significativas tanto a nivel de filo como de género. Para investigar las comunidades microbianas diferenciales entre los grupos de altitud baja, media y alta, utilizamos el análisis de tamaños de efecto discriminante lineal (LEfSe), incluido LDA (análisis discriminante lineal) (Figura 3A). Los resultados de LEfSe mostraron que los grupos microbianos con efectos significativos se mostraron en diferentes colores en los grupos de baja, media y alta altitud. Entre estos grupos, el grupo de gran altitud tenía el mayor número de microorganismos diferentes (Figura Suplementaria S2). La microbiota intestinal característica en el grupo de baja altitud incluyó Fibrobacterias, Fibrobacteraceae y Lentisphaerae. Victivallaceae fue predominante en el grupo de altitud media, mientras que Bacteroidetes y Clostridial fueron prominentes en el grupo de altitud alta. Teniendo en cuenta los informes que sugieren que el tipo intestinal puede reflejar diferencias funcionales, investigamos si la comunidad bacteriana ruminal del ganado amarillo podría clasificarse en grupos funcionales en función de las variaciones de altitud. El análisis de componentes principales (ACP) reveló distintos tipos intestinales formados por las muestras a través del análisis diferencial de Bray-Curtis. Cada grupo se caracterizó por cambios en la abundancia de su género representativo, el enterotipo 1 exhibió Kiritimatiella y Desulfonauticus, mientras que el enterotipo 2 mostró una alta abundancia de Aeromonas (Figura 3B).
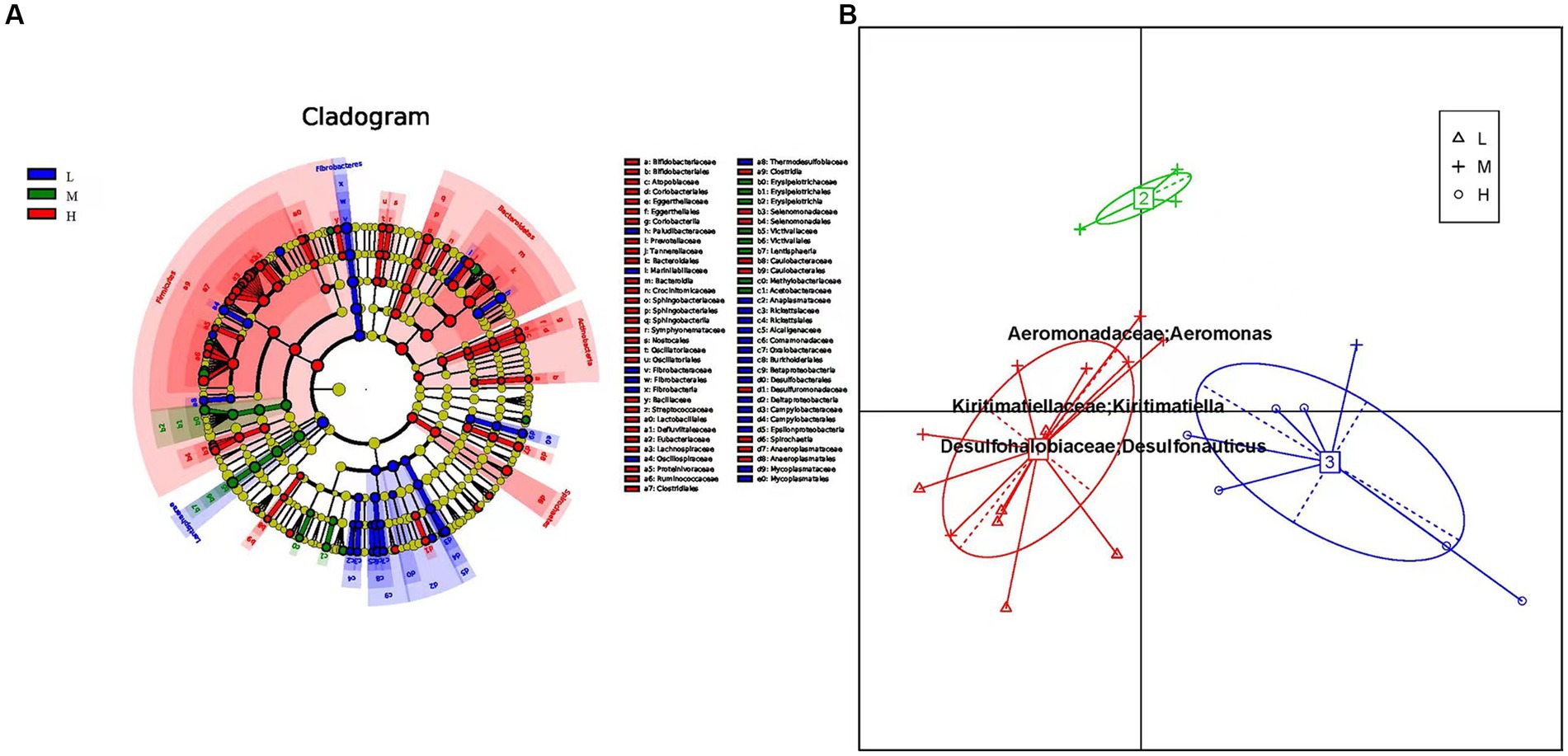 Figura 3. (A) Los diagramas de conglomerados fueron analizados por LEfSe. Diferentes colores representan diferentes grupos, nodos de diferentes colores representan la microbiota que juega un papel importante en el grupo representado por el color, un círculo de color representa un biomarcador y la leyenda en la esquina superior derecha es el nombre del biomarcador. Los nodos amarillos indican taxones microbianos que no jugaron un papel importante en las diferentes agrupaciones. De adentro hacia afuera, cada círculo se divide en especies de fila, clase, orden, familia y género. (B) Análisis de enterotipos. La abscisa representa el componente principal uno, y la ordenada representa el componente principal dos, que son los dos componentes principales con la mayor tasa de contribución de varianza.
Figura 3. (A) Los diagramas de conglomerados fueron analizados por LEfSe. Diferentes colores representan diferentes grupos, nodos de diferentes colores representan la microbiota que juega un papel importante en el grupo representado por el color, un círculo de color representa un biomarcador y la leyenda en la esquina superior derecha es el nombre del biomarcador. Los nodos amarillos indican taxones microbianos que no jugaron un papel importante en las diferentes agrupaciones. De adentro hacia afuera, cada círculo se divide en especies de fila, clase, orden, familia y género. (B) Análisis de enterotipos. La abscisa representa el componente principal uno, y la ordenada representa el componente principal dos, que son los dos componentes principales con la mayor tasa de contribución de varianza.
Función prevista y metabolismo de la microbiota ruminal
Las predicciones de la abundancia de la función de la comunidad bacteriana KEGG se obtuvieron utilizando PICRUST2. En los grupos de baja, media y alta altitud, las abundancias relativas de metabolismo y procesamiento de información genética fueron de 79,72 y 14,44%, respectivamente (Figura 4A). Se identificaron un total de 29 vías bioquímicas entre las funciones metabólicas. Las funciones relacionadas con el metabolismo de cofactores y vitaminas, el metabolismo de los carbohidratos y el metabolismo de los aminoácidos se enriquecieron en todas las muestras (Figura 4B). Además, la microflora de los grupos de baja, media y alta altitud exhibió otras funciones funcionales, como procesos celulares, sistemas orgánicos, procesamiento de información ambiental, enfermedades humanas y procesamiento de información genética.
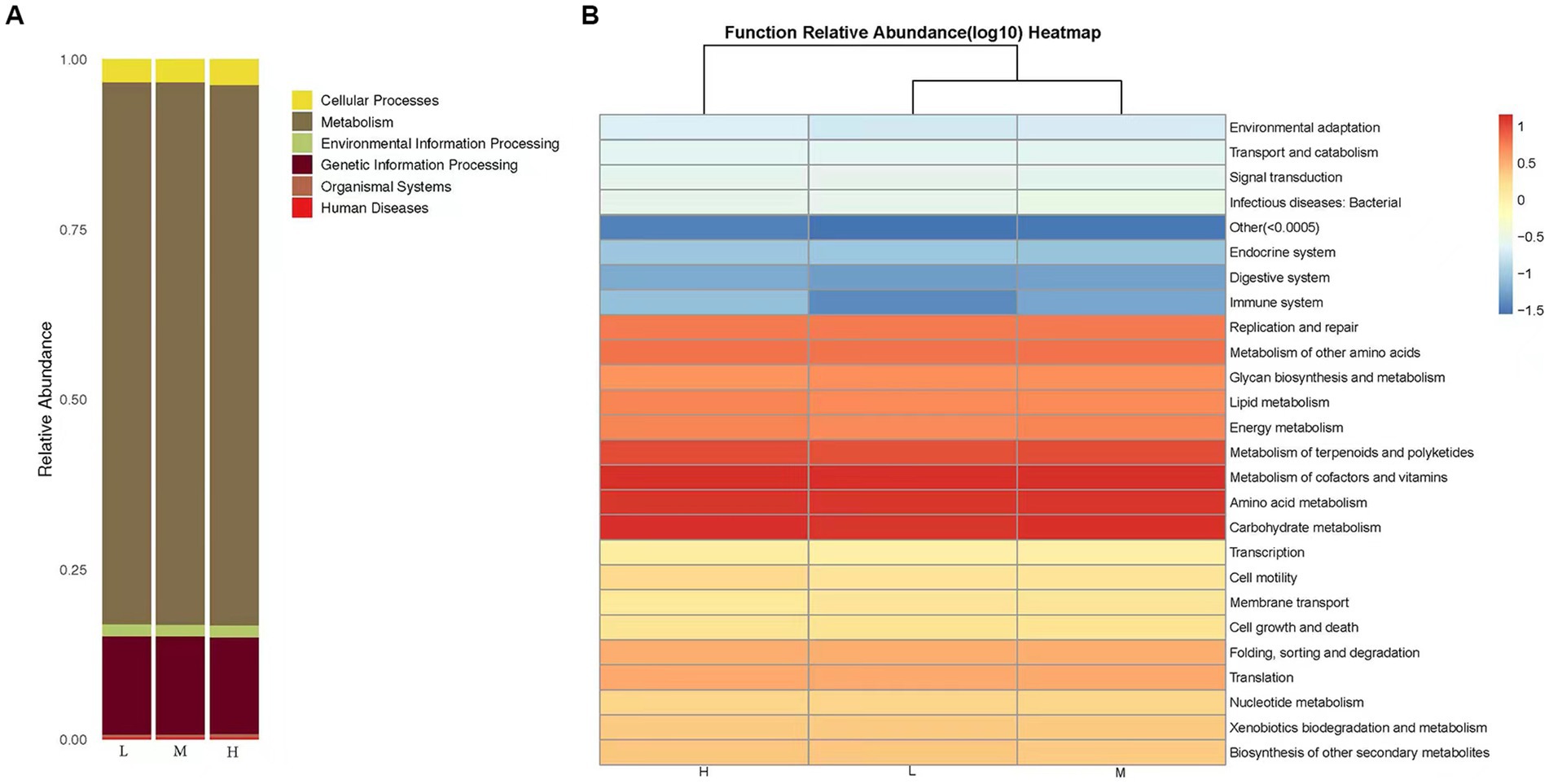 Figura 4. (A) Gráfico de barras de clasificación KEGG. La función de microbiota predicha basada en la base de datos KEGG, el eje horizontal representa la muestra y el eje vertical representa la abundancia relativa de la función predicha. (B) Mapa de calor de la abundancia funcional prevista. La agrupación longitudinal indica la similitud de la predicción funcional entre diferentes muestras. Cuanto más cerca esté la distancia, más corta será la longitud de la rama, lo que indica que la predicción funcional y la abundancia de muestras son más similares. La agrupación horizontal indica que la abundancia de esta función es similar en cada muestra.
Figura 4. (A) Gráfico de barras de clasificación KEGG. La función de microbiota predicha basada en la base de datos KEGG, el eje horizontal representa la muestra y el eje vertical representa la abundancia relativa de la función predicha. (B) Mapa de calor de la abundancia funcional prevista. La agrupación longitudinal indica la similitud de la predicción funcional entre diferentes muestras. Cuanto más cerca esté la distancia, más corta será la longitud de la rama, lo que indica que la predicción funcional y la abundancia de muestras son más similares. La agrupación horizontal indica que la abundancia de esta función es similar en cada muestra.
Discusión
Los microbios intestinales de los animales están influenciados por varios factores, como la dieta, la genética, la edad, las condiciones ambientales, como la altitud y la ubicación geográfica (18-21). Este estudio se centra en explorar la relación entre la composición bacteriana ruminal y la función en el ganado amarillo con respecto a la altitud. Los microbios intestinales juegan un papel importante en la adaptación del huésped a diferentes entornos diversos (22, 23), proporcionando nutrientes esenciales y manteniendo la homeostasis intestinal (24, 25). Estudios previos han demostrado que diferentes elevaciones tienen efectos específicos sobre la composición y la función de fermentación de los microbiomas ruminales en yaks de pastoreo (26). Además, se ha observado que el entorno de altitud impulsa la evolución convergente de la diversidad α y la microbiota indicadora en la microbiota intestinal animal (27). La microbiota intestinal de los huéspedes presenta características distintas según los diferentes hábitats de altitud (28). Las características compartidas de la microbiota intestinal en varias elevaciones sugieren una coevolución entre la microbiota intestinal de los mamíferos y sus huéspedes (29). Numerosos estudios han demostrado que las alteraciones en la altitud pueden influir en los cambios en la microecología intestinal, afectando posteriormente la estructura y función de la flora intestinal de los mamíferos (30). La diversidad de la población intestinal está profundamente influenciada por la altitud, con notables distinciones observadas entre las poblaciones de gran altitud y las de baja altitud. Las comunidades microbianas intestinales en yaks a diferentes altitudes fueron dominadas por Firmicutes (63,42%) y Bacteroidetes (47,4%) a nivel de filo (16). Debido al estrés por frío, los rumiantes a grandes altitudes pueden experimentar una mayor dependencia de los carbohidratos, lo que requiere que Firmicutes y Bacteroidetes suministren energía adicional para fines de mantenimiento.
La interacción entre la flora intestinal y el huésped no solo regula el metabolismo, sino que también sirve como un puente crucial que conecta el medio ambiente y el huésped, ayudando así al huésped a adaptarse mejor a diferentes entornos (17). El análisis de diversidad reveló una tendencia creciente tanto en la diversidad como en la uniformidad de las bacterias del rumen entre el ganado en áreas de baja, media y alta altitud. En este estudio, el ganado amarillo de todas las regiones de altitud fue alimentado con la misma dieta para mantener la uniformidad, destacando la altitud como el factor principal que influye en los cambios en la diversidad microbiana del rumen. Estudios previos han demostrado una mayor diversidad de la comunidad bacteriana ruminal y un mayor contenido de ácidos grasos volátiles (AGV) en yaks a una altitud de 4.700 m sobre el nivel del mar en la meseta Qinghai-Tíbet en comparación con aquellos en altitudes medias y bajas (31). A través de la agrupación de muestras, se observó que las bacterias ruminales del ganado amarillo en altitudes bajas, medias y altas no se agruparon principalmente en la rama evolutiva, sino que los individuos dentro de la misma altitud exhibieron agrupación. En términos del número de microorganismos endémicos, el número de bacterias ruminales endémicas a gran altitud fue significativamente mayor que en altitudes medias y bajas, pero la mayoría de los microorganismos centrales en las tres altitudes eran comunes. La coevolución del sistema bacteriano huésped-intestino ha formado un microbio central común bajo la influencia de diferentes elevaciones (32).
La pradera en diferentes elevaciones exhibe variaciones de riqueza de especies y el forraje encontrado dentro de ellas posee un valor nutricional variable (33). Como resultado, el grupo de gran altitud mostró una diversidad bacteriana significativamente mayor en comparación con el grupo de baja altitud. En general, se observa que una mayor diversidad y riqueza de bacterias intestinales se asocian con un microbioma intestinal del huésped sano y estable (34). En contraste con el grupo de baja altitud, el grupo de gran altitud exhibió una mayor abundancia de Bacteroidetes y Firmicutes en el rumen. Estas bacterias juegan un papel crucial en la descomposición de las fibras y la celulosa, proporcionando la energía necesaria para el huésped (35). Además, el grupo de gran altitud mostró una notable tendencia al alza en la relación Firmicutes/Bacteroidetes en comparación con los grupos de baja y media altitud. La elevada proporción de Firmicutes a Bacteroidetes en el rumen del grupo de gran altitud indica una mayor propensión a la deposición de grasa (36, 37). Los estudios han revelado una diferencia significativa en la proporción de Firmicutes a Bacteroidetes en el microbioma gastrointestinal entre rumiantes de gran altitud y de baja altitud. Se ha demostrado que la mayor proporción observada en rumiantes de gran altitud afecta la deposición de energía (38). La altitud afecta el metabolismo energético del microbioma intestinal y la capacidad de descomponer sustancias como la fibra y la celulosa (39). Kiritimatiellaeota está involucrada en la vía biosintética de arginina y ácidos grasos, utilizando así nitrógeno en los alimentos y produciendo energía (23). En este estudio, se encontró que la abundancia de Kiritimatiellaeota ruminal en el grupo de altitud media-alta era significativamente menor que en el grupo de altitud media-baja. Kiritimatiellaeota juega un papel particularmente crucial en el rumen de los herbívoros (40).
En comparación con el grupo de gran altitud, los grupos de altitud media y baja mostraron una mayor actividad en las vías biosintéticas de arginina y ácidos grasos. En respuesta a las fluctuaciones de altitud, el microbioma intestinal puede adaptar su tasa metabólica y mejorar la extracción de energía de los carbohidratos complejos, promoviendo así la coevolución entre el huésped y los microbios. Prevotella, el género con la mayor abundancia en el rumen en todos los grupos de altitud, significa una dinámica digestiva óptima y contribuye a la homeostasis intestinal. Por lo tanto, una mayor diversidad de Prevotella y otros microorganismos que degradan la fibra mejora la capacidad de fermentación de la microbiota, promoviendo la salud intestinal (41). La investigación ha indicado que una alta proporción de Prevotella-Bacteroides puede afectar la digestión de la fibra y el metabolismo de la glucosa (42). La proporción de Prevotella-Bacteroides en el rumen del grupo de altitud media-alta fue significativamente mayor que la del grupo de baja altitud. Esta simbiosis huésped-Prevotella establecida desde hace mucho tiempo, desarrollada a través de cientos de miles de años de coevolución, puede resultar en interacciones huésped-microbiano comprometidas, lo que afecta la salud del huésped.
Las abundancias relativas de Tannerella, Prevotella y Eubacterium aumentaron con el aumento de la altitud. Las respuestas fisiológicas del huésped a la altitud, como los cambios en la función inmune y el metabolismo, pueden afectar la composición de la comunidad microbiana. Además, Firmicutes/Bacteroidetes en el grupo de gran altitud mostró una tendencia obvia al alza en comparación con el grupo de baja y media altitud. La proporción de Firmicutes a Bacteroidetes en el rumen del grupo de gran altitud fue mayor, lo que indica que una mejor deposición de grasa crea un ambiente donde Tannerella, Prevotella y Eubacterium prosperan y establecen mayores abundancias relativas en comparación con otros grupos microbianos. El aumento en las abundancias relativas de Tannerella, Prevotella y Eubacterium con mayor altitud puede atribuirse a una combinación de factores ambientales, adaptaciones fisiológicas del huésped. La disminución en la abundancia relativa de Fibrobacter y Kiritimatiella con el aumento de la altitud podría atribuirse a cambios en las condiciones ambientales. Por otro lado, la abundancia relativa significativamente mayor de Butyrivibrio en el grupo de gran altitud sugiere su capacidad para adaptarse y prosperar en las condiciones únicas que se encuentran en altitudes más altas, potencialmente influenciadas por ambos factores ambientales.
Este estudio proporciona información valiosa sobre la flora intestinal y su funcionalidad. Dilucidamos la composición de las bacterias ruminales y la información funcional del genoma en ganado de granja a diferentes altitudes. Entre estos hallazgos, los tipos intestinales de Kiritimatiellaceae se observan predominantemente en el grupo de baja a media altitud, mientras que los tipos de Desulfonauticus intestinal están más concentrados en el grupo de gran altitud, probablemente debido a su adaptación a ambientes fríos. Investigaciones anteriores han demostrado que la proporción del contenido de carbohidratos en la dieta en los babuinos influye directamente en la transformación del patrón intestinal del huésped. Por lo tanto, los cambios en el contenido de proteínas dietéticas y carbohidratos específicos de la altitud pueden ofrecer una explicación intrigante para la dinámica de los enterotipos y ayudar a identificar el enterotipo de rumiantes de gran altitud (43). En este estudio, la evidencia más notable de cambios inducidos por elevación en los tipos intestinales se observó en el tipo 2 y el tipo 3 en altitudes medias y altas, mientras que el tipo 1 se mantuvo estable en altitudes bajas. Este hallazgo sugiere que la coevolución a largo plazo entre el huésped y el medio ambiente contribuye a la dinámica distinta de los tipos intestinales, desempeñando un papel vital en la formación de rumiantes y la adaptación a ambientes extremos de gran altitud. Los atributos funcionales del microbioma intestinal gobiernan las interacciones entre el huésped y el microbioma, dando forma en última instancia a su relación mutua (44). Los hallazgos del análisis de PICRUSt2 revelaron distintas variaciones en la microflora ruminal del ganado amarillo en las tres regiones de altitud, siendo el metabolismo la función más prominente y activa. Específicamente, el metabolismo de los carbohidratos y el metabolismo de los aminoácidos fueron predominantes. Curiosamente, nuestro estudio también descubrió una sorprendente similitud en la composición genética funcional de los microbios del rumen entre el ganado en las tres elevaciones. Estos resultados implican que las bacterias del rumen en el ganado exhiben una mayor sensibilidad a la adaptabilidad ambiental en comparación con las bacterias intestinales.
Conclusión
Los factores ambientales de altitud no reemplazan la filogenia en la conducción de la evolución convergente de la composición del microbioma del rumen del ganado amarillo. Sin embargo, ejercen una influencia en la diversidad alfa del microbioma ruminal y la coevolución del microbioma central. En particular, ciertos géneros clave, incluidos Tannerella, Ruminobacter y Prevotella, demuestran asociaciones con el entorno de altitud. Nuestros hallazgos sugieren que las regiones de gran altitud proporcionan un ambiente más favorable para la fermentación bacteriana ruminal en comparación con las áreas de baja altitud o altitud media. Además, puede existir una evolución convergente entre el microbioma central y el huésped. Estos resultados indican que los microorganismos ruminales en el ganado amarillo de áreas de gran altitud se han adaptado a ambientes extremos, lo que les permite maximizar la eficiencia de utilización del alimento.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio / repositorios y el número (s) de acceso se pueden encontrar en el artículo / material complementario.
Declaración ética
Todos los animales utilizados en este experimento fueron aprobados por el comité de protección y utilización de animales de la Universidad Agrícola de Yunnan, China (protocolo # 2018-009), y se cumplieron las pautas del Comité de Ética de Animales de Laboratorio en el manejo experimental de animales.
Contribuciones del autor
DW y SY hicieron contribuciones sustanciales a la concepción o diseño de los experimentos. SY y ZY realizaron los experimentos. RW y SH analizaron los datos. DW y ZY escribieron el artículo. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Esta investigación fue apoyada por la Fundación de Investigación Científica del Departamento de Educación de la Provincia de Yunnan (2023 J0518), la Fundación Nacional de Ciencias Naturales de China (32060762), la Fundación de Investigación Doctoral de la Universidad Agrícola de Yunnan (KY2022-53), el Proyecto de Investigación del Departamento de Educación de la Provincia de Guangdong (2022ZDZX4041) y los Proyectos de Investigación Fundamental Agrícola de Yunnan (202301BD070001-095).
Reconocimientos
Agradecemos a los investigadores de nuestros laboratorios por su dedicación y arduo trabajo. Nos gustaría agradecer a todos los que hicieron posible esta tesis.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1169573/full#supplementary-material
Referencias
1. Yasuda, K, Oh, K, Ren, B, Tickle Timothy, L, Franzosa Eric, A, Wachtman Lynn, M, et al. Biogeografía de la mucosa intestinal y microbioma lúmenal en el macaco Rhesus. Microbio huésped celular. (2015) 17:385–91. doi: 10.1016/j.chom.2015.01.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Siller, M, Zeng, Y, y Hinterleitner, R. ¿Pueden los microbios impulsar las Treg para suprimir la sensibilidad a los alimentos? Tendencias Immunol. (2020) 41:967–71. doi: 10.1016/j.it.2020.09.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Pennisi, E . ¿Cómo ayudan los microbios intestinales a los herbívoros? Contando las formas. Ciencia. (2017) 355:236. doi: 10.1126/science.355.6322.236
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Zhang, Z, Tang, H, Chen, P, Xie, H, y Tao, Y. Desmitificando la manipulación de la inmunidad del huésped, el metabolismo y los tumores extraintestinales por el microbioma intestinal. Objetivo de transducción de señal ther. (2019) 4:41. DOI: 10.1038/S41392-019-0074-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Suzuki, TA . Vínculos entre la variación natural en el microbioma y la aptitud del huésped en la naturaleza. Integr Comp Biol. (2017) 57:756–69. DOI: 10.1093/ICB/ICX104
6. Han, H, Yi, B, Zhong, R, Wang, M, Zhang, S, Ma, J, et al. De la microbiota intestinal al apetito del huésped: metabolitos derivados de la microbiota intestinal como reguladores clave. Microbioma. (2021) 9:162. DOI: 10.1186/S40168-021-01093-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Linz, D, Gawałko, M, Sanders, P, Penders, J, Li, N, Nattel, S, et al. ¿Afecta la microbiota intestinal al ritmo auricular? Causalidades y especulaciones. Eur Corazón J. (2021) 42:3521–5. DOI: 10.1093/EURheartj/EHAB467
8. Shi, PJ, Meng, K, Zhou, ZG, Wang, YR, Diao, QY, y Yao, B. La especie huésped afecta a la comunidad microbiana en el rumen caprino. Lett Appl Microbiol. (2008) 46:132–5. doi: 10.1111/j.1472-765X.2007.02274.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Carmody, RN, Gerber, GK, Luevano, JM Jr, Gatti, DM, Somes, L, Svenson, KL, et al. La dieta domina el genotipo del huésped en la configuración de la microbiota intestinal murina. Microbio huésped celular. (2015) 17:72–84. doi: 10.1016/j.chom.2014.11.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Yatsunenko, T, Rey, FE, Manary, MJ, Trehan, I, Dominguez-Bello, MG, Contreras, M, et al. Microbioma intestinal humano visto a través de la edad y la geografía. Naturaleza. (2012) 486:222–7. doi: 10.1038/nature11053
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Nicholson, JK, Holmes, E, Kinross, J, Burcelin, R, Gibson, G, Jia, W, et al. Interacciones metabólicas de la microbiota huésped-intestino. Ciencia. (2012) 336:1262–7. doi: 10.1126/science.1223813
12. Lan, D, Ji, W, Lin, B, Chen, Y, Huang, C, Xiong, X, et al. Correlaciones entre las estructuras de la comunidad de microbiota intestinal de los tibetanos y la geografía. Sci Rep. (2017) 7:16982. DOI: 10.1038/S41598-017-17194-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Zhang, Z, Xu, D, Wang, L, Hao, J, Wang, J, Zhou, X, et al. Evolución convergente de microbiomas ruminales en mamíferos de altura. Curr Biol. (2016) 26:1873–9. doi: 10.1016/j.cub.2016.05.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Li, H, Qu, J, Li, T, Wirth, S, Zhang, Y, Zhao, X, et al. La simplificación de la dieta selecciona una alta diversidad microbiana intestinal y una fuerte capacidad de fermentación en pikas de gran altitud. Aplicación Microbiol Biotechnol. (2018) 102:6739–51. DOI: 10.1007/S00253-018-9097-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Yue, B-S, Zhang, W, Jiao, L, Liu, R, Zhang, Y, Ji, Q, et al. El efecto de la exposición a gran altitud y bajo oxígeno en las comunidades microbianas intestinales en ratones. PLoS One. (2018) 13:203701. doi: 10.1371/journal.pone.0203701
16. Suzuki, TA, Martins, FM y Nachman, MW. Variación altitudinal de la microbiota intestinal en ratones domésticos salvajes. Mol Ecol. (2019) 28:2378–90. DOI: 10.1111/mec.14905
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Zhao, J, Yao, Y, Li, D, Xu, H, Wu, J, Wen, A, et al. Caracterización de la microbiota intestinal en seis poblaciones geográficas de macacos Rhesus chinos (Macaca mulatta), lo que implica una adaptación al entorno de gran altitud. Microb Ecol. (2018) 76:565–77. DOI: 10.1007/S00248-018-1146-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Wu, D, Vinitchaikul, P, Deng, M, Zhang, G, Sun, L, Wang, H, et al. Exploración de los efectos del cambio de altitud sobre bacterias y hongos en el rumen del yak (Bos grunniens). Arco Microbiol. (2021) 203:835–46. DOI: 10.1007/S00203-020-02072-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Takahashi, S, Tomita, J, Nishioka, K, Hisada, T, and Nishijima, M. Development of a prokaryotic universal primencing for simultaneous analysis of Bacteria and Archaea using next-generation sequencing. PLoS One. (2014) 9:E105592. doi: 10.1371/journal.pone.0105592
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Li, G, Li, J, Kohl, KD, Yin, B, Wei, W, Wan, X, et al. Los cambios en la dieta influenciados por el pastoreo del ganado dan forma a la composición de la microbiota intestinal y las redes de co-ocurrencia en una especie local de roedores. J Anim Ecol. (2019) 88:302–14. doi: 10.1111/1365-2656.12920
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Perofsky, AC, Lewis, RJ, y Meyers, LA. Terrestrialidad y transferencia bacteriana: un estudio comparativo de microbiomas intestinales en mamíferos malgaches simpátricos. ISME J. (2019) 13:50–63. DOI: 10.1038/S41396-018-0251-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Wan, X, Li, J, Cheng, Z, Ao, M, Tian, R, McLaughlin, RW, et al. El microbioma intestinal de un delfín jorobado del Indo-Pacífico (Sousa chinensis) varado cerca del estuario del río Perla. China Integr Zool. (2021) 16:287–99. doi: 10.1111/1749-4877.12477
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Li, Y, Zhang, T, Shi, M, Zhang, B, Hu, X, Xu, S, et al. Caracterización de la microbiota intestinal y cortisol fecal, T3 e IgA en ciervos almizcleros de bosque (Moschus berezovskii) desde el nacimiento hasta el destete. Integre Zool. (2021) 16:300–12. doi: 10.1111/1749-4877.12522
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Greene, LK, Williams, CV, Junge, RE, Mahefarisoa, KL, Rajaonarivelo, T, Rakotondrainibe, H, et al. Un papel para la microbiota intestinal en la diferenciación del nicho del huésped. ISME J. (2020) 14:1675–87. DOI: 10.1038/S41396-020-0640-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Guo, N, Wu, Q, Shi, F, Niu, J, Zhang, T, Degen, AA, et al. Dinámica estacional de la interacción dieta-microbiota intestinal en la adaptación de los yaks a la vida a gran altura. NPJ Biofilms Microbio. (2021) 7:38. DOI: 10.1038/S41522-021-00207-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Chung, H, y Kasper, DL. Mecanismos inmunes estimulados por la microbiota para mantener la homeostasis intestinal. Curr Opin Immunol. (2010) 22:455–60. doi: 10.1016/j.coi.2010.06.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Wu, X, Zhang, H, Chen, J, Shang, S, Yan, J, Chen, Y, et al. Análisis y comparación del microbioma del lobo bajo diferentes factores ambientales utilizando tres datos diferentes de secuenciación de próxima generación. Sci Rep. (2017) 7:11332. DOI: 10.1038/S41598-017-11770-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Han, L, Xue, W, Cao, H, Chen, X, Qi, F, Ma, T, et al. Comparación de los parámetros de fermentación ruminal y microbiota de yaks de diferentes regiones de altitud en el Tíbet, China. Frente. virol. (2021) 12:807512. DOI: 10.3389/fmicb.2021.807512
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Wang, X, Wu, X, Shang, Y, Gao, Y, Li, Y, Wei, Q, et al. La gran altitud impulsa la evolución convergente de la diversidad alfa y la microbiota indicadora en los microbiomas intestinales de los ungulados. Microbiol frontal. (2022) 13:953234. doi: 10.3389/fmicb.2022.953234
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Zhang, J, Gao, H, Jiang, F, Liu, D, Hou, Y, Chi, X, et al. Análisis comparativo de la composición microbiana intestinal y las funciones en la gacela de Przewalski (Procapra przewalskii) de diversos hábitats. Microbiol frontal. (2022) 13:913358. DOI: 10.3389/fmicb.2022.913358
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Gao, H, Chi, X, Li, G, Qin, W, Song, P, Jiang, F, et al. La diversidad microbiana intestinal y las funciones estabilizadoras mejoran la adaptabilidad de la meseta del salvaje tibetano (Equus kiang). Microbiología. (2020) 9:1150–61. doi: 10.1002/mbo3.1025
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Fan, Q, Wanapat, M, Yan, T, and Hou, F. Altitude influence microbial diversity and herbage fermentation in the rumen of yaks. BMC Microbiol. (2020) 20:370. DOI: 10.1186/S12866-020-02054-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Groussin, M, Mazel, F, y Alm, EJ. Co-evolución y co-especiación de los sistemas de bacterias del intestino huésped. Microbio huésped celular. (2020) 28:12–22. doi: 10.1016/j.chom.2020.06.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Ram, J . Biodiversidad y conservación de praderas de altura de Uttaranchal himalaya. Boletín Nat. Inst. Ecol. (2005) 15:11–7.
35. Petersen, C, y Round, JL. Definición de la disbiosis y su influencia en la inmunidad y la enfermedad del huésped. Microbiol celular. (2014) 16:1024–33. DOI: 10.1111/CMI.12308
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Dai, X, Tian, Y, Li, J, Luo, Y, Liu, D, Zheng, H, et al. Análisis metatranscriptómicos de la degradación de polisacáridos de la pared celular vegetal por microorganismos en el rumen de vaca. Aplicación Environ Microbiol. (2015) 81:1375–86. doi: 10.1128/AEM.03682-14
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Turnbaugh, PJ, Backhed, F, Fulton, L, y Gordon, JI. La obesidad inducida por la dieta está relacionada con alteraciones marcadas pero reversibles en el microbioma intestinal distal del ratón. Microbio huésped celular. (2008) 3:213–23. doi: 10.1016/j.chom.2008.02.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Magne, F, Gotteland, M, Gauthier, L, Zazueta, A, Pesoa, S, Navarrete, P, et al. La relación Firmicutes/Bacteroidetes: ¿un marcador relevante de disbiosis intestinal en pacientes obesos? Nutrientes. (2020) 12:12051474. doi: 10.3390/nu12051474
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Ma, Y, Ma, S, Chang, L, Wang, H, Ga, Q, Ma, L, et al. Adaptación de la microbiota intestinal a gran altitud en animales autóctonos. Biochem Biophys Res Commun. (2019) 516:120–6. doi: 10.1016/j.bbrc.2019.05.085
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Sun, G, Zhang, H, Wei, Q, Zhao, C, Yang, X, Wu, X, et al. Análisis comparativos de la microbiota fecal en muflón europeo (Ovis orientalis musimon) y oveja azul (Pseudois nayaur) que viven a baja o gran altitud. Microbiol frontal. (2019) 10:1735. DOI: 10.3389/fmicb.2019.01735
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Baniel, A, Amato, KR, Beehner, JC, Bergman, TJ, Mercer, A, Perlman, RF, et al. Los cambios estacionales en el microbioma intestinal indican respuestas plásticas a la dieta en geladas silvestres. Microbioma. (2021) 9:26. DOI: 10.1186/S40168-020-00977-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Fehlner-Peach, H, Magnabosco, C, Raghavan, V, Scher, JU, Tett, A, Cox, LM, et al. Distintos perfiles de utilización de polisacáridos de aislados de Prevotella copri intestinales humanos. Microbio huésped celular. (2019) 26:680–690.e5. doi: 10.1016/j.chom.2019.10.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Tett, A, Pasolli, E, Masetti, G, Ercolini, D, y Segata, N. Prevotella diversity, niches and interactions with the human host. Nat Rev Microbiol. (2021) 19:585–99. DOI: 10.1038/S41579-021-00559-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Ren, T, Grieneisen, LE, Alberts, SC, Archie, EA, and Wu, M. Development, diet and dynamism: longitudinal and cross-sectional predictors of gut microbial communities in wild baboons. Environ Microbiol. (2016) 18:1312–25. doi: 10.1111/1462-2920.12852
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Lin, L, Xie, F, Sun, D, Liu, J, Zhu, W, and Mao, S. La diafonía entre el microbioma ruminal y el huésped estimula el desarrollo del epitelio ruminal en un modelo de cordero. Microbioma. (2019) 7:83. DOI: 10.1186/S40168-019-0701-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: microbiología ruminal, ganado, microbioma, bacterias, altitud
Cita: Yang S, Zheng J, He S, Yuan Z, Wang R y Wu D (2023) Explorando la dinámica de elevación de las comunidades bacterianas del rumen en el ganado que alimenta al granero de 900 a 3.600 metros mediante secuenciación 16S de longitud completa. Frente. Vet. Sci. 10:1169573. doi: 10.3389/fvets.2023.1169573
Recibido: 19 de febrero de 2023; Aprobado: 03 Julio 2023;
Publicado: 17 julio 2023.
Editado por:
Amlan Kumar Patra, Universidad de Langston, Estados Unidos
Revisado por:
Houqiang Luo, Facultad Vocacional de Ciencia y Tecnología de Wenzhou, China Li Min, Academia de Ciencias Agrícolas de Guangdong (GDAAS), China
Derechos de autor © 2023 Yang, Zheng, He, Yuan, Wang y Wu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Dongwang Wu, danwey@163.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía