Expresión del receptor de vitamina D en páncreas canino normal e inflamado
Expresión del receptor de vitamina D, CYP24A1 y CYP27B1 en páncreas canino normal e inflamado
 Dohee Lee1
Dohee Lee1  Sanggu Kim2
Sanggu Kim2  Yoonhoi Koo1 †
Yoonhoi Koo1 †  Yeon Chae1
Yeon Chae1  Juwon Wang1
Juwon Wang1  Soochong Kim2
Soochong Kim2  Taesik Yun1
Taesik Yun1  Mhan-Pyo Yang1
Mhan-Pyo Yang1  Byeong-Teck Kang1
Byeong-Teck Kang1  Hakhyun Kim1*
Hakhyun Kim1*- 1Laboratorio de Medicina Interna Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional de Chungbuk, Cheongju, República de Corea
- 2Laboratorio de Patología Veterinaria y Señalización Plaquetaria, Facultad de Medicina Veterinaria, Universidad Nacional de Chungbuk, Cheongju, República de Corea
La vitamina D desempeña un papel en los procesos antiinflamatorios, y la alteración de su metabolismo se asocia con los procesos inflamatorios de la pancreatitis. Este estudio se realizó para evaluar la expresión del receptor de vitamina D (VDR) y las dos enzimas principales que regulan el metabolismo de la vitamina D, 1α-hidroxilasa (CYP27B1) y 24-hidroxilasa (CYP24A1), en el páncreas canino y para comparar sus grados de inmunoreactividad entre páncreas normal e inflamado. Se obtuvieron cinco tejidos pancreáticos normales e inflamados de seis perros. La expresión de VDR, CYP24A1 y CYP27B1 se determinó inmunohistoquímicamente, y el grado de inmunotinción se evaluó semicuantitativamente. El VDR se expresó en los conductos, acinos e islotes de Langerhans de páncreas normales y en los conductos y acinos de los inflamados. Hubo una diferencia significativa en la puntuación de inmunorreactividad para VDR en los islotes de Langerhans entre la puntuación normal (mediana, 3 [rango intercuartílico, 2-7,5]) y los tejidos pancreáticos inflamados (puntuación 0 [0-0,5], p = 0,03). CYP24A1 se expresó en los conductos e islotes de Langerhans tanto en páncreas normales como inflamados, mientras que CYP27B1 se expresó en los conductos y acinos en solo algunos tejidos pancreáticos normales e inflamados. Este estudio mostró que la expresión de VDR disminuyó en páncreas inflamados y demostró expresión de CYP24A1 y CYP27B1 en el páncreas canino por primera vez. Estos hallazgos indican que el páncreas podría regular el metabolismo y la actividad biológica de la vitamina D y sugieren que una disminución de estos podría estar relacionada con la fisiopatología de la pancreatitis.
1. Introducción
La pancreatitis, una enfermedad inflamatoria del páncreas, es la enfermedad pancreática exocrina más común en perros (1). Los signos clínicos incluyen vómitos, dolor abdominal y anorexia en perros, y podría conducir al síndrome de respuesta inflamatoria sistémica o síndromes de disfunción orgánica múltiple, que son potencialmente mortales (1, 2). Se ve facilitada por respuestas inmunes innatas o adaptativas (3) y se han sugerido diversas etiologías y factores de riesgo de pancreatitis (4). De los cuales se sugiere que la alteración del metabolismo de la vitamina D está asociada con procesos inflamatorios de pancreatitis en roedores y humanos, presumiblemente debido al papel biológico de la vitamina D, incluidos los efectos antiinflamatorios, inmunorreguladores y antifibróticos (5-8). Sin embargo, la información sobre la asociación entre la pancreatitis canina y la alteración del metabolismo de la vitamina D es limitada.
El metabolismo de la vitamina D se regula a través de procesos complejos que involucran dos enzimas principales (6). En el riñón, la 1α-hidroxilasa (CYP27B1) convierte la 25-hidroxivitamina D [25(OH)D] en 1,25-dihidroxivitamina D [1,25(OH)2D], una forma biológicamente activa que realiza sus funciones biológicas al unirse al receptor de vitamina D (VDR) en los tejidos diana (6, 9). La enzima 24-hidroxilasa (CYP24A1), uno de los principales genes diana del VDR (10, 11), está regulada al alza por el VDR activado y convierte los metabolitos de la vitamina D en una forma biológicamente inactiva (12). Por lo tanto, la actividad biológica de la vitamina D está determinada por el grado de VDR, CYP24A1 y expresión CYP27B1 (13).
Estudios previos revelaron que el VDR se expresa en el páncreas canino (14) y las concentraciones séricas de VDR disminuyeron en perros con pancreatitis aguda (15). Estos hallazgos sugieren que la pancreatitis podría estar relacionada con cambios en la expresión de VDR en los tejidos pancreáticos caninos; sin embargo, ningún estudio ha investigado la expresión de VDR en páncreas canino inflamado. Además, la expresión de CYP24A1 y CYP27B1, principalmente abundante en los riñones, fue reportada en el páncreas de los humanos (16–19); Sin embargo, su expresión en el tejido pancreático en perros no ha sido investigada. Teniendo en cuenta que VDR está presente en el páncreas canino y CYP24A1 y CYP27B1 están estrechamente involucrados en el metabolismo de la vitamina D y sus funciones biológicas, vale la pena investigar la expresión de estas enzimas en los tejidos pancreáticos caninos.
El objetivo de este estudio fue (1) evaluar la expresión de VDR, CYP24A1 y CYP27B1 en tejido pancreático normal e inflamado en perros y (2) comparar el grado de inmunorreactividad entre páncreas normal e inflamado utilizando un método semicuantitativo. Planteamos la hipótesis de que el tejido pancreático inflamado mostraría menos expresión de VDR que en el tejido pancreático normal y que CYP24A1 y CYP27B1 se expresarían en páncreas canino.
2. Materiales y métodos
2.1. Adquisición por ejemplo
Este estudio fue aprobado por el Comité de Ética de la Universidad Nacional de Chungbuk, Corea del Sur (CBNUA-1988-22-01). Se recolectaron muestras de tejido pancreático de seis perros que se sometieron a pancreatectomía parcial, fueron sacrificados o murieron por diversas razones en el Hospital de Enseñanza Veterinaria de la Universidad Nacional de Chungbuk. Los clientes de cada perro dieron su consentimiento informado para donar y almacenar muestras de tejido para futuras investigaciones. En algunos perros, se recolectaron bloqueos de dos sitios pancreáticos (cabeza pancreática y cuerpo / cola) si su apariencia era muy diferente; Se recogieron 10 muestras de tejido pancreático de seis perros (Tabla 1). Todas las muestras se obtuvieron dentro de las 2 h de la eutanasia o muerte para reducir la influencia de la autólisis y se fijaron en formalina al 10%. Las muestras obtenidas fueron fijadas en formalina e incrustadas en parafina según métodos estándar (20).
2.2. Evaluación histopatológica
Todos los bloques de tejido fijados en formalina e incrustados en parafina se seccionaron en rodajas de 5 μm de espesor y se tiñeron con hematoxilina (Harris Hematoxylin; BBC Biochemical, WA, Estados Unidos) y eosina (Eosin Y; BBC Bioquímica).
Cuando se identificaron cambios histopatológicos en el tejido pancreático, incluyendo inflamación neutrofílica y linfocítica, necrosis pancreática, necrosis grasa peripancreática, edema, fibrosis y atrofia, la muestra se clasificó como pancreatitis (21). En todas las muestras de tejido clasificadas como pancreatitis, se registró el tipo de células inflamatorias infiltradas y se evaluó el grado histopatológico semicuantitativo en función del área de superficie afectada por una lesión. Cuando el <10%, 10-40 y > 40% de la sección evaluada se vieron afectados por una lesión, la muestra se clasificó como pancreatitis leve, moderada y grave, respectivamente (21).
Cuando los cambios histopatológicos estaban ausentes o se observaron cambios mínimos, las muestras se definieron como páncreas normal.
2.3. Inmunohistoquímica
Anticuerpos contra VDR (MA1-710; Thermo Fisher Scientific, CA, Estados Unidos), CYP24A1 (PA5-21704; Thermo Fisher Scientific) y CYP27B1 (ab206655; Abcam, MA, Reino Unido) se utilizaron para inmunohistoquímica (Tabla 2). Se prepararon cinco secciones de micrómetros de espesor de cada bloque fijado en formalina e incrustado en parafina en portaobjetos recubiertos de silano. Después de la desparafinización y rehidratación con xileno y alcoholes, los portaobjetos se lavaron con agua del grifo durante 10 minutos. La recuperación de antígenos se realizó hirviendo portaobjetos lavados en tampón Tris-EDTA (pH 9,0) durante 10 min en un microondas y se mantuvo a temperatura ambiente (RT) durante 30 min. Luego, los portaobjetos recuperados con antígeno se lavaron e incubaron con 3% de H.2O2 durante 10 min en RT. Los portaobjetos lavados se bloquearon con suero de cabra al 5% (Vector Laboratories, CA, Estados Unidos) en solución salina tamponada con fosfato (PBS) durante 1 h, seguido de lavado con PBS. Los portaobjetos se incubaron con anticuerpos primarios (Tabla 2) a 4 °C durante la noche. Después de lavar los portaobjetos con PBS, se incubaron con anticuerpos secundarios diluidos durante 30 minutos en anticuerpos secundarios RT de acuerdo con las instrucciones del fabricante. Anticuerpo secundario anti-rata (Vectastain® ABC Kit, PK-6104; Vector Laboratories) se utilizó para VDR y anticuerpo secundario anti-conejo (Vectastain® ABC Kit, PK-6101; Vector Laboratories) se utilizaron para CYP24A1 y CYP27B1. La relación de dilución para los anticuerpos secundarios fue de 1:200. Los portaobjetos se lavaron en PBS y se incubaron con reactivo ABC (Vectastain® ABC Kits, PK-4000; Vector Laboratories) durante 30 min en RT. Después de lavar nuevamente los portaobjetos con PBS durante 5 min, la visualización se realizó incubándolos en solución de tetraclorhidrato de 3,3′-diaminobencidina (Vector® DAB Substrate Kit, SK-4100; Laboratorios vectoriales) durante 10 min. Los portaobjetos fueron lavados y contrateñidos con hematoxilina durante 1 min. Las secciones de tejido de control negativo se tiñeron con PBS en lugar del anticuerpo primario y las secciones normales de parafina de tejido renal se utilizaron como controles positivos (material suplementario).
2.4. Cuantificación de células inmunorreactivas
El grado de inmunotinción se evaluó mediante un ensayo semicuantitativo de acuerdo con la puntuación inmunorreactiva (IRS) descrita por Remmele y Stegner (22-24) (Tabla 3). Todas las secciones teñidas histológicas e inmunohistoquímicas se escanearon con un escáner de diapositivas (Olympus VS200 Slide Scanner, Tokio, Japón) y fueron evaluadas por observadores expertos (SGK y SCK) utilizando el software ImageJ (National Institutes of Health, Bethesda, MD, Estados Unidos). El análisis y la interpretación del IRS fueron realizados por DL y HK. La intensidad de la tinción se calificó de la siguiente manera: 0 = no, 1 = débil, 2 = moderada y 3 = reacciones intensas. El porcentaje de células teñidas positivamente se calificó de la siguiente manera: 0 = <5%, 1 = 5-25%, 2 = 25-50%, 3 = 51-75% y 4 = >75% de las células teñidas. El IRS se calculó multiplicando la intensidad de la tinción y el porcentaje de células y se clasificó en un rango de 0 a 12. El IRS para cada diapositiva se clasificó de la siguiente manera: 0–1, negativo; 2–3, leve; 4–8, moderado; y 9–12, tinción fuertemente positiva. Cada muestra de tejido se calificó para la inmunorreactividad en tres partes, a saber, los conductos, acinos e islotes de Langerhans.
2.5. Análisis estadísticos
Los análisis estadísticos se realizaron utilizando el software estadístico comercial, Prism 9 (GraphPad Software Inc., La Jolla, CA). La prueba U de Mann-Whitney se utilizó para comparar el IRS de cada región entre los tejidos pancreáticos normales e inflamados. La significación estadística se fijó en p < 0,05.
3. Resultados
3.1. Comisión de estudio
Se recolectaron diez tejidos pancreáticos de seis perros con una edad media de 7,3 años (rango, 4,9-14 años). Las señales de los perros y las características de la muestra utilizadas en este estudio se muestran en la Tabla 1. Cinco muestras obtenidas de tres perros fueron diagnosticadas con pancreatitis (leve, n = 1; moderada, n = 1; pancreatitis grave, n = 3), y otras cinco muestras recogidas de tres perros fueron normales. En el grupo control, a un perro con meningoencefalitis de origen desconocido se le había administrado una combinación de prednisolona, micofenolato mofetilo y fenobarbital, a otro perro con epilepsia idiopática se le había administrado fenobarbital y al otro no tenía antecedentes de medicación antes de la presentación. En el grupo de pancreatitis, a un perro con un quiste ependimario se le había administrado una combinación de prednisolona, fenobarbital y bromuro de potasio, a otro perro con tumor del plexo coroideo se le había administrado ciclofosfamida, prednisolona y bromuro de potasio, y al otro con pancreatitis no tenía antecedentes farmacológicos. En el grupo de pancreatitis, dos perros tenían un aumento de la proteína C reactiva sérica (79,47 mg/dL y 170,98 mg/dL, respectivamente; VetChroma; Boditech Med Inc., República de Corea) y cPL (>1.000 μg/L en ambos; Vcheck cPL; BioNote, República de Corea). Los datos no estaban disponibles para el otro perro.
3.2. Expresión del receptor de vitamina D
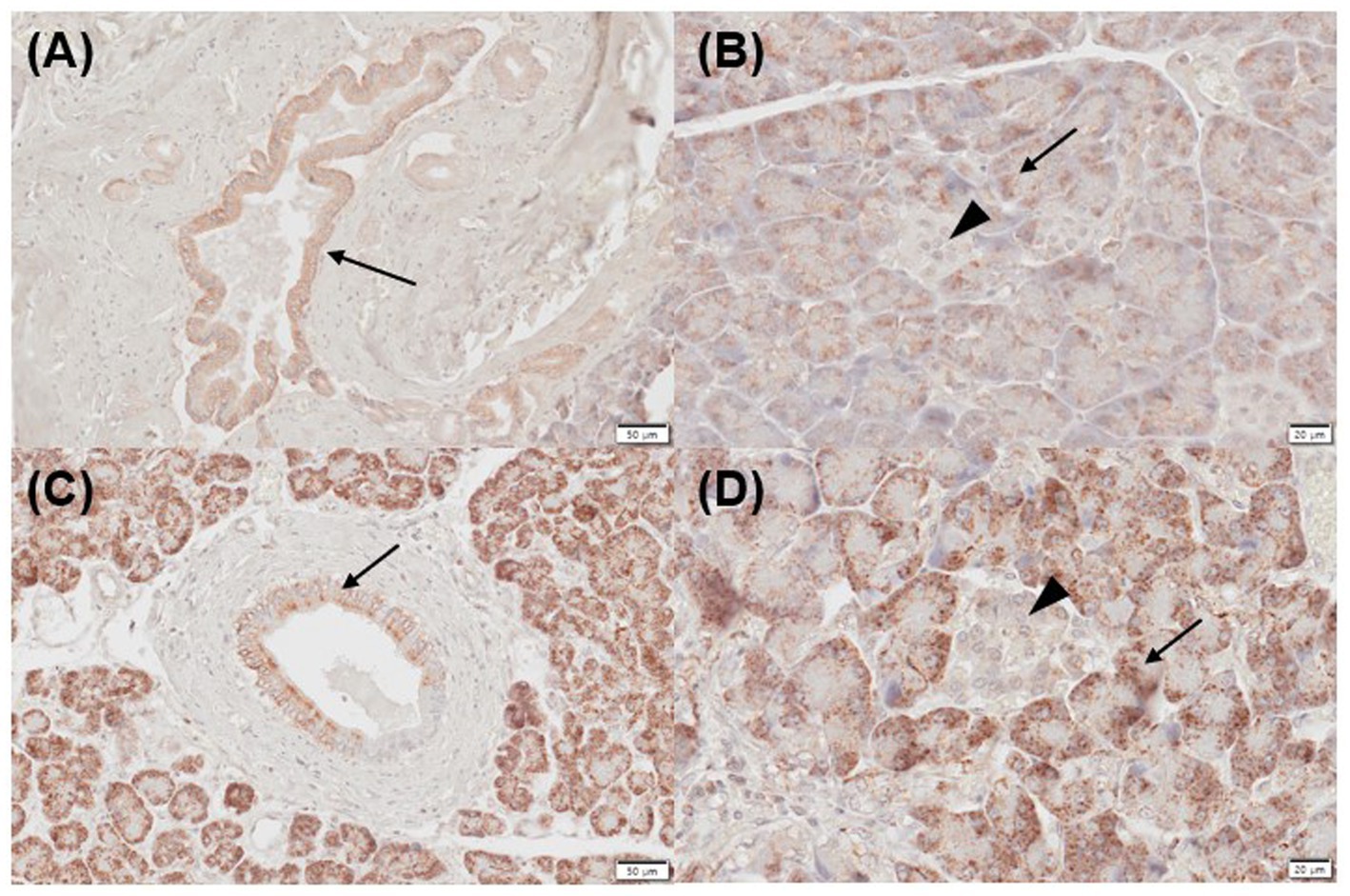
Tres de cinco muestras de páncreas normal (moderada, n = 2; fuertemente positiva, n = 1) e inflamadas (leve, n = 1; fuertemente positiva, n = 2) mostraron inmunorreactividad positiva para VDR en los conductos pancreáticos (Figuras 1A, C). Dos de los cinco páncreas normales e inflamados fueron fuertemente positivos para VDR en los acinos (Figuras 1B, D). En el páncreas normal, 4/5 secciones mostraron inmunorreactividad positiva (moderada, n = 3; fuertemente positiva, n = 1) para VDR en los islotes de Langerhans, y solo una sección fue negativa. Sin embargo, todos los portaobjetos de páncreas inflamados mostraron inmunorreactividad negativa para VDR en los islotes de Langerhans.
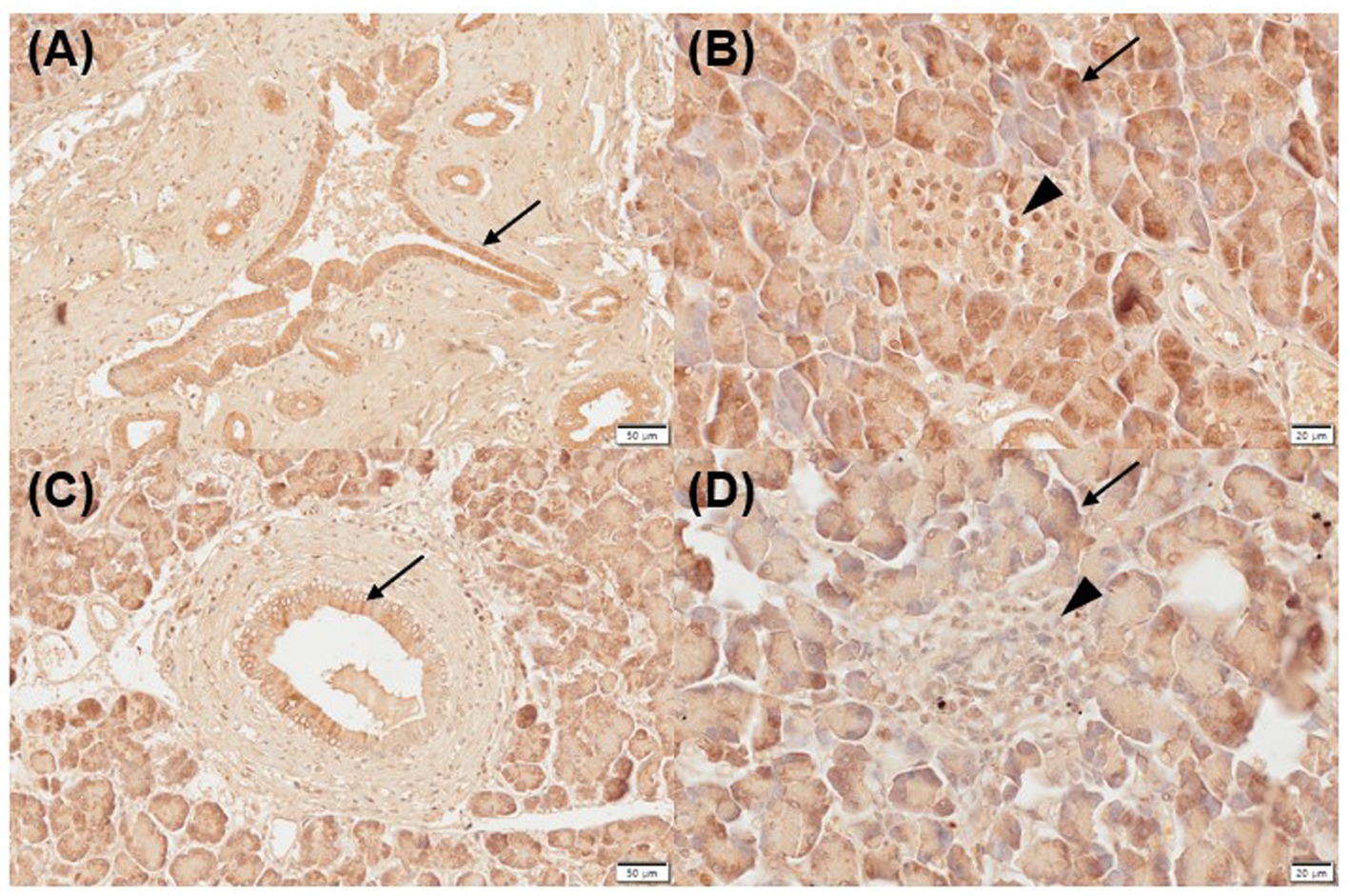 Figura 1. Expresión inmunohistoquímica de VDR en páncreas normal (A,B) e inflamado (C,D) en perros. Los páncreas normales fueron positivos para la expresión de VDR en los conductos pancreáticos [(A) flecha], acini [(B) flecha] e islotes de Langerhans [(B) punta de flecha]. Los páncreas inflamados fueron positivos para la expresión de VDR en los conductos pancreáticos [(C) flecha] y acini [(D) flecha] pero negativos en islotes de Langerhans [(D) punta de flecha]. Barras de escala: 50 μm (A,C) y 20 μm (B,D). VDR: receptor de vitamina D.
Figura 1. Expresión inmunohistoquímica de VDR en páncreas normal (A,B) e inflamado (C,D) en perros. Los páncreas normales fueron positivos para la expresión de VDR en los conductos pancreáticos [(A) flecha], acini [(B) flecha] e islotes de Langerhans [(B) punta de flecha]. Los páncreas inflamados fueron positivos para la expresión de VDR en los conductos pancreáticos [(C) flecha] y acini [(D) flecha] pero negativos en islotes de Langerhans [(D) punta de flecha]. Barras de escala: 50 μm (A,C) y 20 μm (B,D). VDR: receptor de vitamina D.
3.3. Expresión CYP24A1
Todas las muestras de páncreas normal (leve, n = 1; moderada, n = 3; fuertemente positiva, n = 1) e inflamadas (moderada, n = 3; fuertemente positiva, n = 2) mostraron inmunorreactividad positiva para CYP24A1 en los conductos pancreáticos (Figuras 2A, C), así como inmunomarcaje negativo para CYP24A1 en los acinos (Figuras 2B, D). Todas las muestras pancreáticas normales (moderadas, n = 3; positivas fuertes, n = 2) y 4/5 inflamadas (leves, n = 1; moderadas, n = 2; fuertemente positivas, n = 1) mostraron un etiquetado positivo para CYP24A1 en los islotes de Langerhans (Figuras 2B, D).
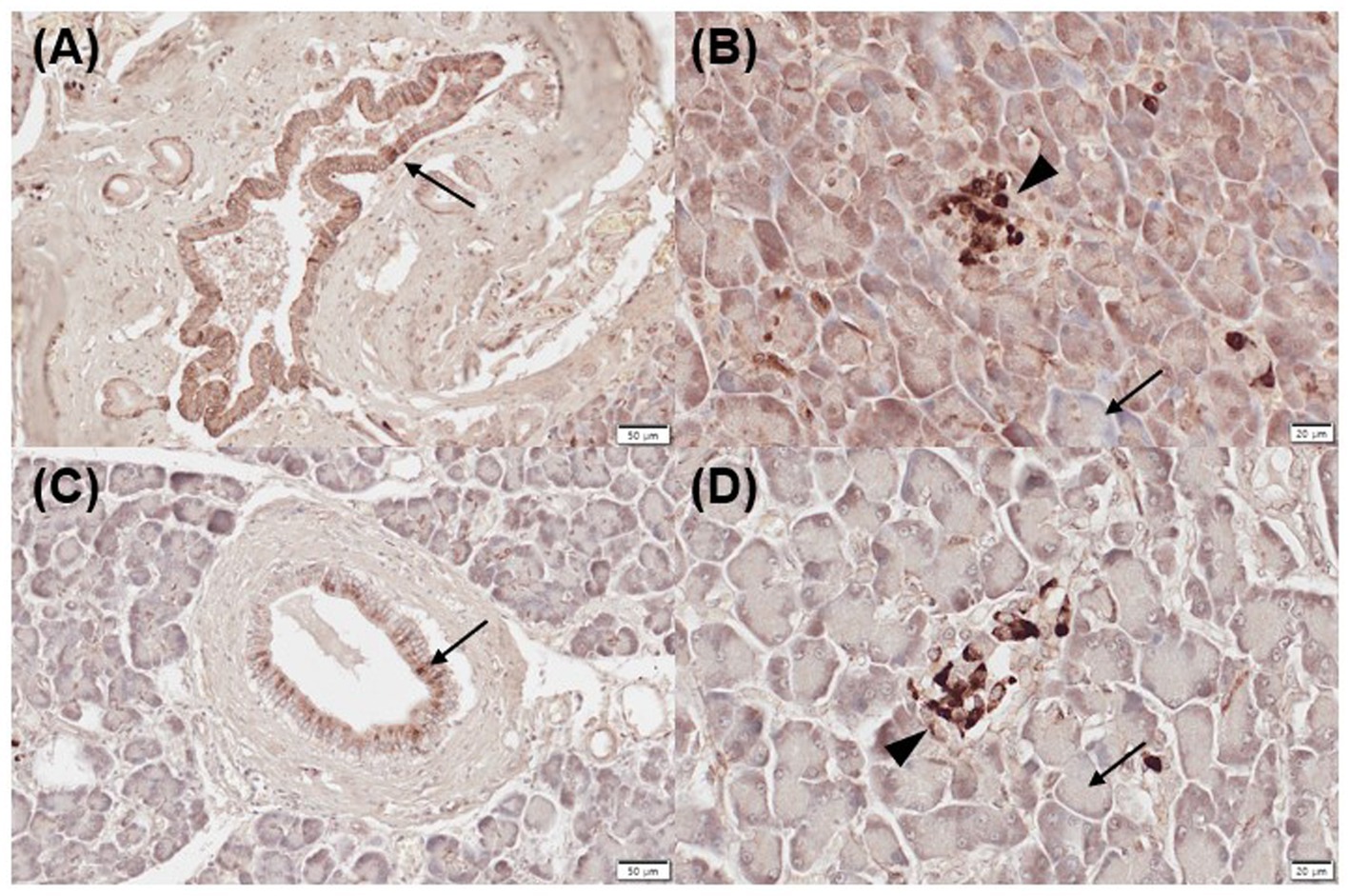 Figura 2. Expresión inmunohistoquímica de CYP24A1 en páncreas normal (A,B) e inflamado (C,D) en perros. (A) Los páncreas normales mostraron inmunotinción positiva para CYP24A1 en los conductos pancreáticos [(A) flecha] e islotes de Langerhans [(B) punta de flecha] pero no en acini [(B) flecha]. Los páncreas inflamados también fueron positivos para la expresión CYP24A1 en los conductos pancreáticos [(C) flecha] e islotes de Langerhans [(D) punta de flecha] pero no en acini [(D) flecha]. Barras de escala: 50 μm (A,C) y 20 μm (B,D). CYP24A1, 24-hidroxilasa.
Figura 2. Expresión inmunohistoquímica de CYP24A1 en páncreas normal (A,B) e inflamado (C,D) en perros. (A) Los páncreas normales mostraron inmunotinción positiva para CYP24A1 en los conductos pancreáticos [(A) flecha] e islotes de Langerhans [(B) punta de flecha] pero no en acini [(B) flecha]. Los páncreas inflamados también fueron positivos para la expresión CYP24A1 en los conductos pancreáticos [(C) flecha] e islotes de Langerhans [(D) punta de flecha] pero no en acini [(D) flecha]. Barras de escala: 50 μm (A,C) y 20 μm (B,D). CYP24A1, 24-hidroxilasa.
3.4. Expresión CYP27B1
Tres de cinco muestras pancreáticas normales (levemente positivas, n = 3) y 2/5 inflamadas (leves , n = 1; moderadamente positivas, n = 1) mostraron inmunorreactividad positiva para CYP27B1 en los conductos pancreáticos (Figuras 3A, C). Tres de cinco páncreas normales (leve, n = 1; moderado positivo, n = 1; fuerte positivo, n = 1) y 2/5 páncreas inflamados (fuerte positivo, n = 2) mostraron inmunomarcaje positivo para CYP27B1 en acinos (Figuras 3B, D). Los islotes de Langerhans no mostraron expresión CYP27B1 en la mayoría de los tejidos pancreáticos normales e inflamados (Figuras 3B, D), excepto solo 1/5 de páncreas normal e inflamado cada uno, que mostró inmunorreactividad leve.
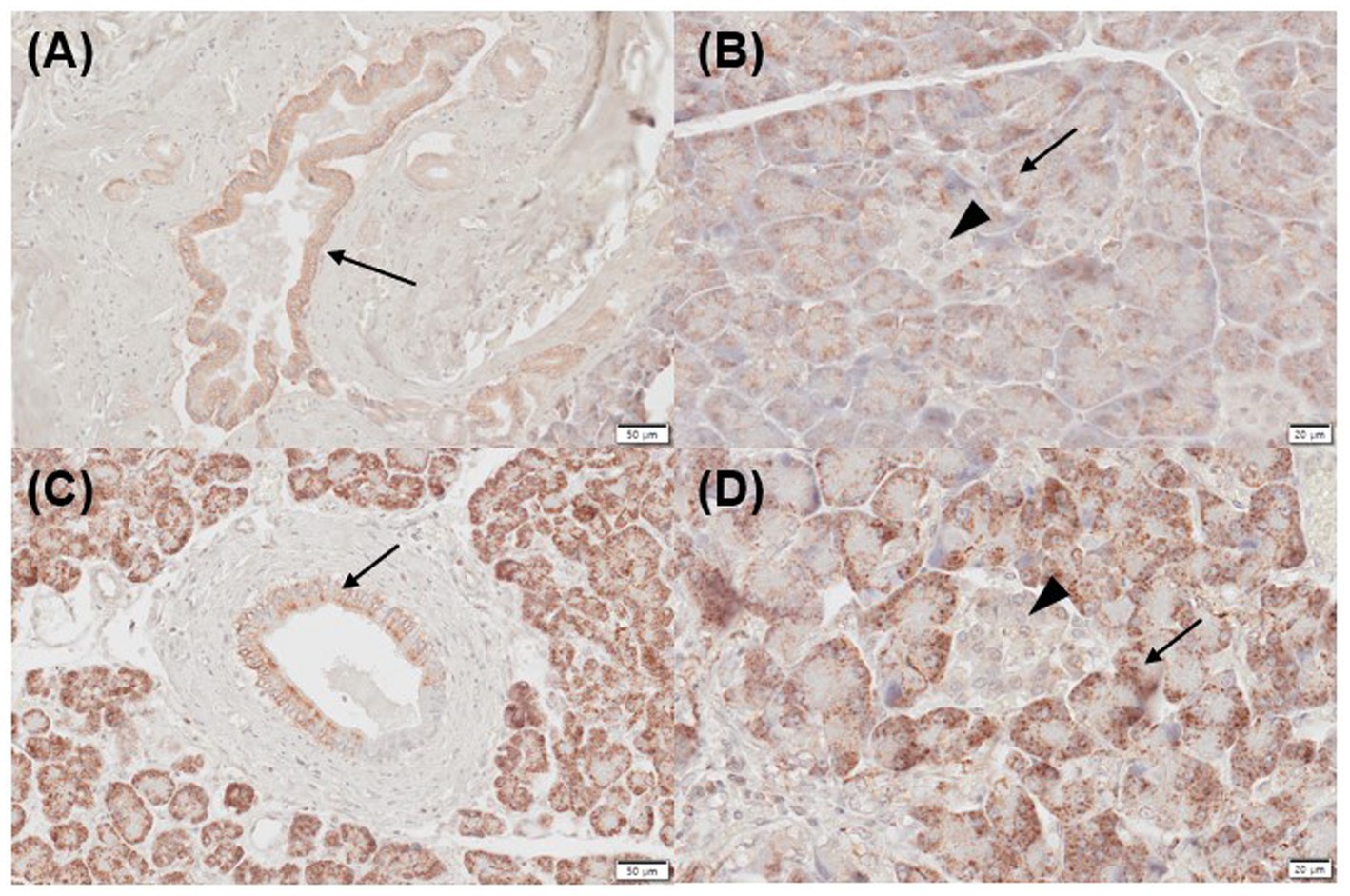 Figura 3. Expresión inmunohistoquímica de CYP27B1 en páncreas normal (A,B) e inflamado (C,D) en perros. (A) Los páncreas normales mostraron inmunotinción positiva para CYP27B1 en los conductos pancreáticos [(A) flecha] y acinos [(B) flecha]. (B) CYP27B1 estaba inmunomarcado en los conductos pancreáticos [(A) flecha] y acinos [(B) flecha]. La mayoría de las muestras de páncreas normal e inflamado no mostraron expresión de CYP27B1 en los islotes de Langerhans [(B,D) punta de flecha]. Barras de escala: 50 μm (A,C) y 20 μm (B,D). CYP27B1, 1-α hidroxilasa.
Figura 3. Expresión inmunohistoquímica de CYP27B1 en páncreas normal (A,B) e inflamado (C,D) en perros. (A) Los páncreas normales mostraron inmunotinción positiva para CYP27B1 en los conductos pancreáticos [(A) flecha] y acinos [(B) flecha]. (B) CYP27B1 estaba inmunomarcado en los conductos pancreáticos [(A) flecha] y acinos [(B) flecha]. La mayoría de las muestras de páncreas normal e inflamado no mostraron expresión de CYP27B1 en los islotes de Langerhans [(B,D) punta de flecha]. Barras de escala: 50 μm (A,C) y 20 μm (B,D). CYP27B1, 1-α hidroxilasa.
3.5. Comparación de las puntuaciones inmunorreactivas para el receptor de vitamina D, CYP24A1 y CYP27B1 en páncreas normal e inflamado
El IRS para VDR, CYP24A1 y CYP27B1 en cada región se muestra en la Tabla 4 y material suplementario. La mediana de IRS para VDR en los islotes de Langerhans fue significativamente diferente entre el páncreas normal (mediana [rango intercuartílico], 6 [2–7.5]) e inflamado (0 [0–0.5], p = 0.03). La mediana de IRS para VDR en el conducto pancreático y acini no fue significativamente diferente entre el páncreas normal e inflamado (p = 0,38 y p = 1,00, respectivamente). No hubo diferencias significativas en la mediana del RIR para CYP24A1 y CYP27B1 en el conducto (p = 0,21 y p = 0,65, respectivamente), acinos (p = 0,55 y p = 0,91, respectivamente) e islotes de Langerhans (p = 0,21 y p = 0,52, respectivamente) entre el páncreas normal e inflamado.
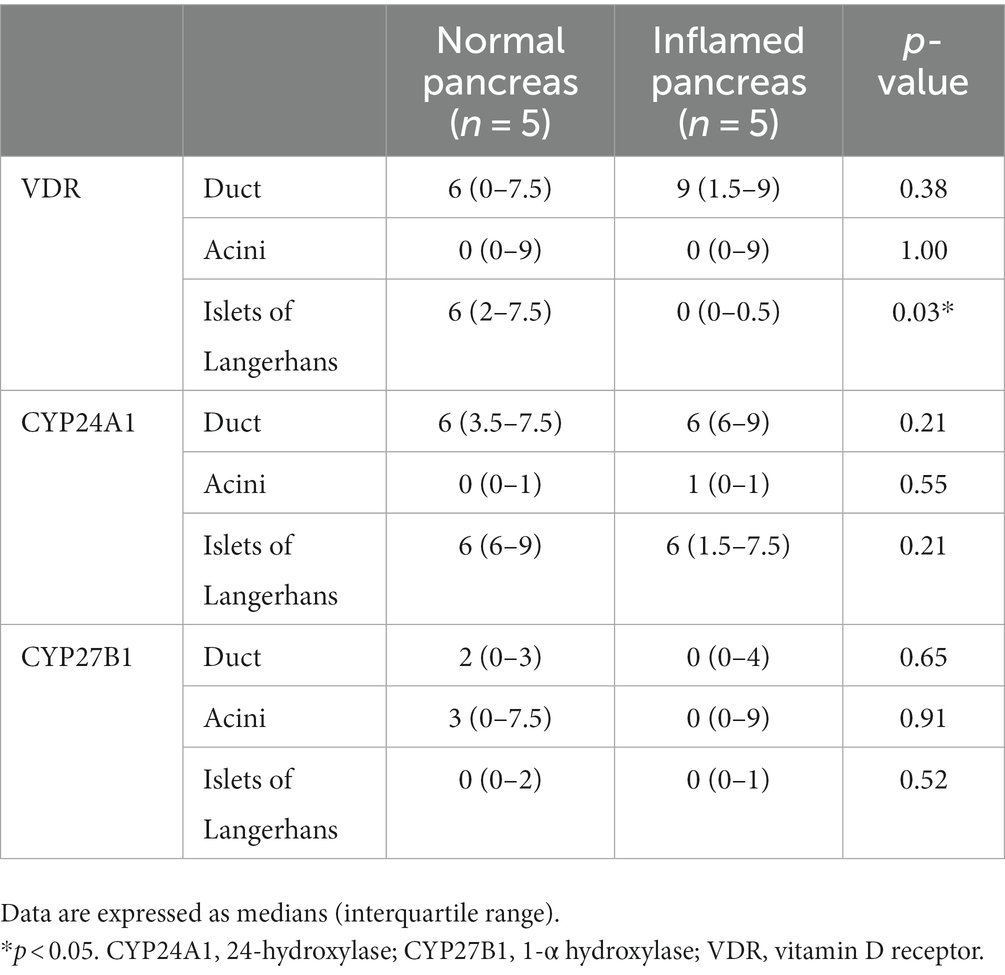 Tabla 4. Puntuación de inmunorreactividad para VDR, CYP24A1 y CYP27B1 en páncreas normal y páncreas inflamado.
Tabla 4. Puntuación de inmunorreactividad para VDR, CYP24A1 y CYP27B1 en páncreas normal y páncreas inflamado.
4. Discusión
El presente estudio mostró que el VDR se expresa en varias regiones del páncreas en perros, incluyendo el conducto, acinos e islotes de Langerhans, y su inmunorreactividad disminuyó significativamente en los islotes de Langerhans del páncreas inflamado. Además, este estudio mostró por primera vez que CYP24A1 y CYP27B1 se expresan en el páncreas canino. Por lo tanto, estos hallazgos sugieren que el páncreas está involucrado en el metabolismo de la vitamina D en perros mediante la regulación de enzimas relacionadas y que la actividad de la vitamina D probablemente disminuiría en la pancreatitis debido a la expresión interrumpida de VDR.
La RDV está ampliamente distribuida en el sistema esquelético y en los tejidos no esqueléticos, incluidos el riñón, el duodeno, el íleon y la piel (25-27). La expresión de VDR también se ha documentado en islotes de Langerhans y células acinares de páncreas humanos y de rata (28); sin embargo, solo hay un informe de expresión de VDR en el páncreas canino (14). Un estudio previo informó la expresión de VDR en el páncreas endocrino y exocrino en perros (14) y, de manera similar, el presente estudio mostró que VDR está presente en los islotes de Langerhans, acinos y conductos de páncreas canino. La presencia de VDR en el páncreas canino sugiere un papel previamente desconocido del páncreas en la regulación de la actividad biológica de la vitamina D y podría regular sistémicamente la homeostasis del calcio y la modulación inmune.
Un estudio previo mostró que la concentración sérica de VDR está disminuida en perros con pancreatitis aguda; sin embargo, no estaba claro qué órganos contribuyeron a la baja concentración sérica de VDR (15). Aunque el presente estudio incluyó solo tejidos pancreáticos y no otros donde la VDR está altamente expresada, como los riñones y el tracto gastrointestinal (25-27), se demostró que la expresión de VDR disminuyó en el tejido pancreático inflamado, lo que respalda que esto podría contribuir a las bajas concentraciones séricas de VDR en perros con pancreatitis. Curiosamente, la expresión de VDR se interrumpió en los islotes de Langerhans, y no se encontraron diferencias en la inmunorreactividad para VDR en los acinos. Este hallazgo es inesperado, dado que la pancreatitis es una enfermedad pancreática exocrina iniciada por la lesión de las células acinares (6). Por lo tanto, sería razonable suponer que la disrupción de VDR en el páncreas endocrino podría haberse debido a la regulación transcripcional en lugar de daño celular. La expresión de VDR está regulada transcripcionalmente por varias moléculas, incluyendo 1,25(OH)2D, hormona paratiroidea y factor de crecimiento de fibroblastos 23 (29, 30), y regulado diferencialmente en cada tejido; por ejemplo, tratamiento con 1,25(OH)2D mejoró la expresión de VDR en los riñones, pero no en el intestino (30). Aunque los niveles circulantes de 1,25(OH)2D en perros con pancreatitis no se determinaron, se informó una disminución de la concentración de 25 (OH) D en perros con pancreatitis (15, 31) y podría haber regulado negativamente la transcripción VDR en páncreas inflamados. No está claro si la transcripción VDR en la isla de Langerhans se ve más afectada que la de los conductos pancreáticos y acinos por diversos factores como 1,25(OH)2D. Estudios adicionales sobre el efecto del 1,25(OH) circulante2Los niveles D en la expresión de VDR en cada parte del páncreas (conductos, acinos e islotes de Langerhans) serían beneficiosos para identificar la fisiopatología de la interrupción de VDR en páncreas caninos inflamados.
VDR tiene efectos antiinflamatorios, y se ha sugerido que la vía VDR / NLRP3 (nucleotide-binding oligomerization domain-like receptor family pyrin domain containing 3) está relacionada con la inflamación pancreática (32, 33). Cuando las células acinares pancreáticas lesionadas liberan contenido intracelular, NLRP3 activa la caspasa-1 y estimula la inflamación (33). Activación de VDR con 1,25(OH)2D inhibe el inflamasoma NLRP3 y reduce la expresión de citoquinas inflamatorias (32). Se desconoce si el VDR presente en los islotes endocrinos podría afectar a las células inflamatorias para causar pancreatitis porque la investigación sobre su efecto sobre la inflamación generalmente se ha limitado a estudios in vitro. Sin embargo, teniendo en cuenta un estudio previo de perros con pancreatitis aguda que muestra que una concentración sérica más baja de VDR se asocia con un biomarcador inflamatorio sérico más alto (15), se puede proponer que la expresión interrumpida de VDR en el tejido pancreático inflamado podría contribuir a agravar la inflamación.
No existe un tratamiento específico para la pancreatitis. Por lo tanto, los tratamientos generalmente se limitan a la atención de apoyo, incluida la fluidoterapia para la reanimación o la rehidratación, los antieméticos, los analgésicos y el apoyo nutricional (2, 34). El presente estudio demostró que la expresión de VDR está disminuida en la pancreatitis canina y sugiere que VDR podría ser un objetivo potencial para tratar la pancreatitis en perros. Estudios previos revelaron que la suplementación con vitamina D aumenta la expresión del ARNm VDR y los niveles de proteína VDR (35-37). Además, la vitamina D podría usarse para prevenir los efectos adversos causados por la reducción de VDR en la pancreatitis canina. Sin embargo, la investigación sobre la expresión de VDR a nivel de proteína, en respuesta a la administración de vitamina D, se limita a células específicas en ciertos trastornos, como fibroblastos en pacientes humanos con enfermedad de Crohn (36) y células corticales cerebrales en estrés oxidativo (37). Para explorar el potencial de VDR como objetivo para tratar la pancreatitis en perros, sería beneficioso realizar estudios adicionales que evalúen la expresión de VDR y la inflamación en el páncreas después de la administración de suplementos de vitamina D.
Con el análisis inmunohistoquímico, el presente estudio mostró por primera vez que CYP24A1 y CYP27B1 estaban presentes en el páncreas canino. CYP24A1, un gen diana de VDR, codifica una enzima degradante que convierte 1,25(OH)2D en una forma inactiva y conduce a la inactivación de la vitamina D (11). En un estudio en humanos, CYP24A1 de páncreas normales se localizó principalmente en islotes endocrinos, pero no se expresó en glándulas exocrinas (18). Otro estudio en humanos mostró que CYP24A1 de los tejidos de pancreatitis crónica se expresó principalmente en los islotes endocrinos, conductos y acinos (38). No ha habido ningún informe previo que compare la expresión de CYP24A1 en páncreas normales e inflamados en medicina humana y veterinaria. En este estudio, CYP24A1 se expresó en los conductos pancreáticos y los islotes de Langerhans en el páncreas canino. Por lo tanto, este hallazgo sugiere que el páncreas está involucrado en el metabolismo de la vitamina D en los perros. Además, no hubo diferencia en las regiones expresadas o inmunorreactividad de CYP24A1 entre el páncreas normal e inflamado, y parecía que la inactivación de 1,25 (OH)2D vía CYP24A1 no está implicado en la fisiopatología de la pancreatitis. Sin embargo, un aumento en la expresión de CYP24A1 en el tejido pancreático se asocia con el desarrollo de adenocarcinoma ductal pancreático en humanos. Este tipo de adenocarcinoma se explica por una reducción de 1,25(OH)2D actividad que regula procesos tumorales como la proliferación, la apoptosis y la angiogénesis (19, 37). La investigación futura sobre la expresión de CYP24A1 en el tumor pancreático canino podría ser beneficiosa para comprender el papel del metabolismo de la vitamina D en la patogénesis de los tumores pancreáticos caninos, un trastorno pancreático que es poco común pero crucial en perros.
CYP27B1 se presenta clásicamente en el riñón y se encuentra en varios tejidos extrarrenales, incluyendo la piel, el tracto gastrointestinal y el páncreas (16, 17), y está involucrado en la síntesis de la forma biológicamente activa de la vitamina D. En el páncreas humano, CYP27B1 está presente en los islotes y conductos endocrinos (16-18). Este estudio mostró que CYP27B1 se expresó con poca frecuencia en los islotes endocrinos del páncreas canino y estaba presente en los islotes exocrinos y los conductos pancreáticos de algunos tejidos pancreáticos. Teniendo en cuenta que CYP27B1 es una enzima activadora de la vitamina D, el páncreas exocrino estaría estrechamente involucrado en la actividad de la vitamina D no solo secretando enzimas digestivas que promueven la absorción de vitaminas liposolubles (39) sino también convirtiendo 25 (OH) D en su forma activa. Además, parecía que la conversión de la forma inactiva de la vitamina D a su forma activa vía CYP27B1 no está asociada con el desarrollo de pancreatitis, considerando que no hubo diferencia en la inmunorreactividad de CYP27B1 entre el páncreas normal e inflamado.
Hubo algunas limitaciones en el presente estudio. En primer lugar, el tamaño de la muestra de cada grupo fue demasiado pequeño y, por lo tanto, insuficiente para dilucidar la asociación entre la gravedad de la pancreatitis y el nivel de expresión de VDR. Dos muestras con pancreatitis leve a moderada tuvieron mediana de RIR para VDR; 9 (rango intercuartílico, 9–9), 4.5 (0–9) y 0.5 (0–1) en los conductos pancreáticos, acinos e islotes de Langerhans, respectivamente. Además, tres muestras con pancreatitis grave tenían RIR de 3 (0-9), 0 (0-9) y 0 (0-0), respectivamente (datos no mostrados). Aunque la mediana del RIR para VDR tiende a ser menor en la pancreatitis grave que en la pancreatitis leve a moderada, no hubo diferencias significativas entre los dos grupos (p = 0,2, 0,74 y 0,22 en conductos, acinos e islotes de Langerhans, respectivamente). Sin embargo, los resultados falsos negativos causados por el error de tipo II podrían haberse encontrado y los resultados deben interpretarse con cautela dado el poder estadístico limitado. Sería beneficioso realizar estudios adicionales con un gran número de muestras de tejido pancreático. En segundo lugar, cada perro tenía un historial diferente de administración de medicamentos. En los seis perros incluidos en este estudio, a cuatro se les administraron fármacos antiepilépticos y tres con prednisolona. La línea celular de hepatoma humano tratada con fenobarbital mostró una regulación positiva de CYP24A1 genes (40), y la línea celular de osteosarcoma tratada con dexametasona mostró inhibición de la transcripción del gen VDR (41). Hay información limitada sobre el efecto de estos fármacos sobre la VDR, la CYP24A1 y la expresión de CYP27B1 en el páncreas o in vivo, y se necesitaría un estudio controlado de los antecedentes farmacológicos. Finalmente, este estudio no comparó la pancreatitis aguda y crónica, que podría afectar los niveles de VDR, CYP24A1 y CYP27B1 expresión.
En conclusión, este estudio mostró que la expresión de VDR disminuyó en los islotes de Langerhans durante la inflamación pancreática y demostró la expresión de CYP24A1 y CYP27B1 en páncreas canino por primera vez. Estos hallazgos sugieren que el páncreas podría regular el metabolismo y la actividad biológica de la vitamina D. Además, nuestro estudio establece el potencial de VDR como objetivo para el tratamiento de la pancreatitis canina. Se necesitan más estudios que investiguen el efecto de la suplementación con vitamina D en VDR para aclarar si la modificación del metabolismo de la vitamina D puede mejorar la pancreatitis en perros.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
Este estudio fue aprobado por el Comité de Ética de la Universidad Nacional de Chungbuk, Corea del Sur (CBNUA-1988-22-01). Los tejidos pancreáticos normales fueron obtenidos de un perro sacrificado por una razón no relacionada con el presente estudio, que fue aprobado por el Comité de Ética.
Contribuciones del autor
DL: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Software, Escritura – borrador original. SaK: Investigación, Metodología, Software, Redacción – borrador original, Visualización. YK: Investigación, curación de datos, redacción, revisión y edición. YC: Curación de datos, investigación, redacción: revisión y edición. JW: Curación de datos, investigación, redacción – revisión y edición. SoK: Investigación, Metodología, Software, Visualización, Redacción – revisión y edición. TY: Redacción – revisión y edición, conceptualización, análisis formal, supervisión. M-PY: Análisis formal, Supervisión, Redacción – revisión y edición, Validación. B-TK: Análisis formal, supervisión, validación, redacción – revisión y edición, conceptualización. HK: Conceptualización, Supervisión, Redacción – revisión y edición, Adquisición de fondos, Administración de proyectos.
Financiación
El(los) autor(es) declara(n) apoyado(s) financiero(s) fue recibido para la investigación, autoría y/o publicación de este artículo. Este trabajo fue apoyado por la subvención de la Fundación Nacional de Investigación de Corea (NRF) financiada por el Gobierno de Corea (MSIT; No. NRF-2021R1F1A1061799).
Reconocimientos
Los autores agradecen a todos los dueños y perros que han participado en este estudio.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1265203/full#supplementary-material
Abreviaturas
1,25(OH)2D, 1,25-dihidroxivitamina D; 25(OH)D, 25-hidroxivitamina D; CYP24A1, 24-hidroxilasa; CYP27B1, 1α-hidroxilasa; IRS: puntuación inmunorreactiva; NLRP3: Nucleotide-binding oligomerization domain-like receptor family pyrin domain containing 3; PBS: solución salina tamponada con fosfato; RT: temperatura ambiente; VDR: Receptor de vitamina D.
Referencias
1. Xenoulis, PG . Diagnóstico de pancreatitis en perros y gatos. J Small Anim Pract. (2015) 56:13–26. doi: 10.1111/jsap.12274
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Mansfield, C . Pancreatitis aguda en perros: avances en la comprensión, el diagnóstico y el tratamiento. Top Companion Anim Med. (2012) 27:123–32. doi: 10.1053/j.tcam.2012.04.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Inman, KS, Francis, AA, y Murray, NR. Papel complejo del sistema inmunitario en la iniciación y progresión del cáncer de páncreas. Mundo J Gastroenterol. (2014) 20:11160–81. doi: 10.3748/wjg.v20.i32.11160
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Cridge, H, Lim, SY, Algül, H, y Steiner, JM. Nuevos conocimientos sobre la etiología, los factores de riesgo y la patogénesis de la pancreatitis en perros: posibles impactos en la práctica clínica. J Vet Pasante Med. (2022) 36:847–64. DOI: 10.1111/JVIM.16437
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Cai, F, Hu, C, Chen, CJ, Han, YP, Lin, ZQ, Deng, LH, et al. Vitamina D y pancreatitis: una revisión narrativa de la evidencia actual. Nutrientes. (2022) 14:2113. doi: 10.3390/nu14102113
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Zheng, M, y Gao, R. Vitamina D: una estrella potencial para el tratamiento de la pancreatitis crónica. Frente Pharmacol. (2022) 13:902639. doi: 10.3389/fphar.2022.902639
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. el-Sharkawy, A, y Malki, A. Señalización de la vitamina D en la inflamación y el cáncer: mecanismos moleculares e implicaciones terapéuticas. Moléculas. (2020) 25:3219. doi: 10.3390/moléculas25143219
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Zhao, R, Zhang, W, Ma, C, Zhao, Y, Xiong, R, Wang, H, et al. Función inmunomoduladora de la vitamina D y su papel en la enfermedad tiroidea autoinmune. Frente Immunol. (2021) 12:574967. doi: 10.3389/fimmu.2021.574967
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Comité del Instituto de Medicina (EE.UU.) para revisar las ingestas dietéticas de referencia para la vitamina D y el calcio . Ingestas dietéticas de referencia para el calcio y la vitamina D. AC Ross, CL Taylor, AL Yaktine y HB ValleDel, editores. Washington (DC): National Academies Press (2011).
10. Pike, JW y Meyer, MB. El receptor de vitamina D: nuevos paradigmas para la regulación de la expresión génica por la 1,25-dihidroxivitamina D(3). Endocrinol Metab Clin N Am. (2010) 39:255–69. doi: 10.1016/j.ecl.2010.02.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Christakos, S, Dhawan, P, Verstuyf, A, Verlinden, L, y Carmeliet, G. Vitamina D: metabolismo, mecanismo molecular de acción, y efectos pleiotrópicos. Physiol Rev. (2016) 96:365–408. doi: 10.1152/physrev.00014.2015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Wei, D, Wang, L, Zuo, X, y Bresalier, RS. Vitamina D: promesas en el horizonte y retos para combatir el cáncer de páncreas. Cánceres (Basilea). (2021) 13:2716. doi: 10.3390/cánceres13112716
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Anderson, PH, May, BK, y Morris, HA. Metabolismo de la vitamina D: nuevos conceptos e implicaciones clínicas. Clin Biochem Rev. (2003) 24:13–26.
14. Palm, C, Hartmann, K, and Weber, K. Expression and immunolocalization of calcium transport proteins in the canine duodenum, kidney, and pancreas. Anat Rec (Hoboken). (2010) 293:770–4. doi: 10.1002/ar.21104
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Lee, D, Koo, Y, Chae, Y, Yun, T, Kang, BT, Yang, MP, et al. Concentraciones séricas de 25-hidroxivitamina D, receptor de vitamina D y proteína de unión a vitamina D en perros con pancreatitis aguda en comparación con perros control sanos. J Vet Pasante Med. (2023) 37: 1694–702. DOI: 10.1111/JVIM.16809
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Zehnder, D, Bland, R, Williams, MC, McNinch, RW, Howie, AJ, Stewart, PM, et al. Expresión extrarrenal de 25-hidroxivitamina d(3)-1 alfa-hidroxilasa. J Clin Endocrinol Metab. (2001) 86:888–94. DOI: 10.1210/JCEM.86.2.7220
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Bland, R, Markovic, D, Hills, CE, Hughes, SV, Chan, SL, Squires, PE, et al. Expresión de 25-hidroxivitamina D3-1alfa-hidroxilasa en islotes pancreáticos. J Esteroides Biochem Mol Biol. (2004) 89-90:121–5. doi: 10.1016/j.jsbmb.2004.03.115
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Schwartz, GG, Eads, D, Rao, A, Cramer, SD, Willingham, MC, Chen, TC, et al. Las células de cáncer de páncreas expresan 25-hidroxivitamina D-1 alfa-hidroxilasa y su proliferación es inhibida por la prohormona 25-hidroxivitamina D3. Carcinogénesis. (2004) 25:1015–26. doi: 10.1093/carcin/bgh086
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Gao, W, Wang, TF, Yi, W, y Tong, WM. Los efectos de la CYP24A1 sobre las características clínico-patológicas y el pronóstico del adenocarcinoma ductal pancreático. Transl Cancer Res. (2020) 9:4476–87. doi: 10.21037/tcr.2020.02.78
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Sadeghipour, A, y Babaheidarian, P. Making formalin-fixed, parafine embedded blocks. Métodos Mol Biol. (2019) 1897:253–68. doi: 10.1007/978-1-4939-8935-5_22
21. Newman, SJ, Steiner, JM, Woosley, K, Williams, DA, y Barton, L. Evaluación histológica y clasificación del páncreas exocrino en el perro. J Vet Diagn Investig. (2006) 18:115–8. DOI: 10.1177/104063870601800119
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Remmele, W, y Stegner, HE. Vorschlag zur einheitlichen definition eines immunreaktiven score (IRS) für den immunhistochemischen ostrogenrezeptor-nachweis (ER-ICA) im mammakarzinomgewebe [recomendación para la definición uniforme de una puntuación inmunorreactiva (IRS) para la detección inmunohistoquímica del receptor de estrógeno (ER-ICA) en el tejido del cáncer de mama]. Pathologe. (1987) 8:138–40.
23. Ditsch, N, Toth, B, Mayr, D, Lenhard, M, Gallwas, J, Weissenbacher, T, et al. La asociación entre la expresión del receptor de vitamina D y la supervivencia general prolongada en el cáncer de mama. J Histoquímica Citoquímica. (2012) 60:121–9. DOI: 10.1369/0022155411429155
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Kaemmerer, D, Peter, L, Lupp, A, Schulz, S, Sänger, J, Baum, RP, et al. Comparación de IRS y Her2 como esquemas de puntuación inmunohistoquímica en tumores neuroendocrinos gastroenteropancreáticos. Int J Clin Exp Pathol. (2012) 5:187–94.
25. Chokhandre, MK, Mahmoud, MI, Hakami, T, Jafer, M, e Inamdar, AS. Vitamina D y sus análogos en la nefropatía diabética tipo 2: una revisión sistemática. J Diabetes Metab Disord. (2015) 14:58. DOI: 10.1186/S40200-015-0186-6
26. Cartwright, JA, Gow, AG, Milne, E, Drummond, D, Smith, S, Handel, I, et al. Expresión del receptor de vitamina D en perros. J Vet Pasante Med. (2018) 32:764–74. DOI: 10.1111/JVIM.15052
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Battistini, C, Ballan, R, Herkenhoff, ME, Saad, SMI y Sun, J. La vitamina D modula la microbiota intestinal en las enfermedades inflamatorias intestinales. Int J Mol Sci. (2020) 22:362. DOI: 10.3390/IJMS22010362
28. Johnson, JA, Grande, JP, Roche, PC, y Kumar, R. Localización inmunohistoquímica del receptor 1,25 (OH) 2D3 y calbindina D28k en páncreas humano y de rata. Am J Phys. (1994) 267:E356–60. doi: 10.1152/ajpendo.1994.267.3.E356
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Healy, KD, Frahm, MA, y DeLuca, HF. La 1,25-dihidroxivitamina D3 regula al alza el receptor renal de vitamina D a través de la activación indirecta del gen y la estabilización del receptor. Arch Biochem Biophys. (2005) 433:466–73. doi: 10.1016/j.abb.2004.10.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Lee, SM, Meyer, MB, Benkusky, NA, O’Brien, CA, y Pike, JW. El impacto de la expresión y regulación de VDR in vivo. J Esteroides Biochem Mol Biol. (2018) 177:36–45. doi: 10.1016/j.jsbmb.2017.06.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Kim, DI, Kim, H, Son, P, Kang, JH, Kang, BT y Yang, MP. Concentraciones séricas de 25-hidroxivitamina D en perros con sospecha de pancreatitis aguda. J Vet Med Sci. (2017) 79:1366–73. DOI: 10.1292/JVMS.16-0647
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Rao, Z, Chen, X, Wu, J, Xiao, M, Zhang, J, Wang, B, et al. El receptor de vitamina D inhibe la activación de NLRP3 al impedir su desubiquitinación mediada por BRCC3. Frente Immunol. (2019) 10:2783. doi: 10.3389/fimmu.2019.02783
33. Ferrero-Andrés, A, Panisello-Roselló, A, Roselló-Catafau, J, y Folch-Puy, E. NLRP3 inflamación mediada por inflamasoma en pancreatitis aguda. Int J Mol Sci. (2020) 21:5386. DOI: 10.3390/IJMS21155386
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Mansfield, C, y Beths, T. Management of acute pancreatitis in dogs: a critical appraisal with focus on feeding and analgesia. J Small Anim Pract. (2015) 56:27–39. DOI: 10.1111/JSAP.12296
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Medeiros, JFP, de Oliveira Borges, MV, Soares, AA, Dos Santos, JC, de Oliveira, ABB, da Costa, CHB, et al. El impacto de la suplementación con vitamina D en la expresión génica VDR y la composición corporal en gemelos monocigóticos: ensayo controlado aleatorio. Sci Rep. (2020) 10:11943. DOI: 10.1038/S41598-020-69128-2
36. Gisbert-Ferrándiz, L, Cosín-Roger, J, Hernández, C, Macias-Ceja, DC, Ortiz-Masiá, D, Salvador, P, et al. Disminución de los niveles de proteína del receptor de vitamina D en los fibroblastos de la enfermedad de Crohn: efectos de la vitamina D. Nutrientes. (2020) 12:973. doi: 10.3390/nu12040973
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Alsulami, E, Alokail, M, Alghamedi, A, Alamro, A, and Haq, S. Effect of vitamin D treatment on VDR expression in primary cerebral cortical cells in induced oxidative stress. J Cell Biotechnol. (2020) 6:81–90. DOI: 10.3233/JCB-200020
38. Hummel, D, Aggarwal, A, Borka, K, Bajna, E, Kállay, E, y Horváth, HC. El sistema de vitamina D está desregulado en las enfermedades pancreáticas. J Esteroides Biochem Mol Biol. (2014) 144:402–9. doi: 10.1016/j.jsbmb.2014.07.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Sankararaman, S, Schindler, T, y Sferra, TJ. Manejo de la insuficiencia pancreática exocrina en niños. Nutr Clin Pract. (2019) 34:C27–42. DOI: 10.1002/NCP.10388
40. Lambert, CB, Spire, C, Claude, N, and Guillouzo, A. Dose- and time-dependent effects of phenobarbital on gene expression profiling in human hepatoma HepaRG cells. Toxicol Appl Pharmacol. (2009) 234:345–60. doi: 10.1016/j.taap.2008.11.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Godschalk, M, Levy, JR, and Downs, RW Jr. Los glucocorticoides disminuyen el número de receptores de vitamina D y la expresión génica en las células del osteosarcoma humano. J Bone Miner Res. (1992) 7:21–7. DOI: 10.1002/JBMR.5650070105
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: CYP24A1, CYP27B1, perro, inmunohistoquímica, tejido pancreático, pancreatitis, receptor de vitamina D
Cita: Lee D, Kim S, Koo Y, Chae Y, Wang J, Kim S, Yun T, Yang M-P, Kang B-T y Kim H (2023) Expresión del receptor de vitamina D, CYP24A1 y CYP27B1 en páncreas canino normal e inflamado. Frente. Vet. Sci. 10:1265203. doi: 10.3389/fvets.2023.1265203
Recibido: 22 de julio de 2023; Aprobado: 05 Septiembre 2023;
Publicado: 21 septiembre 2023.
Editado por:
DoHyeon Yu, Universidad Nacional de Gyeongsang, República de Corea
Revisado por:
Joong-Hyun Song, Universidad Nacional de Chungnam, República de Corea Woo-Jin Song, Universidad Nacional de Jeju, República de Corea Elena De Felice, Universidad de Camerino, Italia
Dong-In Jung, Universidad Nacional de Gyeongsang, República de Corea
Derechos de autor © 2023 Lee, Kim, Koo, Chae, Wang, Kim, Yun, Yang, Kang y Kim. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Hakhyun Kim, kimh@chungbuk.ac.kr
†DIRECCIÓN ACTUAL:
Yoonhoi Koo, Facultad de Medicina Veterinaria, Universidad Nacional de Kyungpook, Daegu, República de Corea
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía