Farmacocinética de mebendazol en plasma y líquido cefalorraquídeo

Farmacocinética de mebendazol en plasma y líquido cefalorraquídeo después de una dosis oral única en perros sanos
 Amy B. Yanke1*
Amy B. Yanke1*  Kendall E. Día1,2
Kendall E. Día1,2  Amanda R. Taylor3
Amanda R. Taylor3  Crisanta Cruz-Espíndola4
Crisanta Cruz-Espíndola4  Dawn M. Boothe4
Dawn M. Boothe4- 1Departamento de Ciencias Clínicas, Facultad de Medicina Veterinaria, Universidad de Auburn, Auburn, AL, Estados Unidos
- 2BluePearl Pet Hospital North Dallas, Lewisville, TX, Estados Unidos
- 3Southeast Veterinary Neurology, Boynton Beach, FL, Estados Unidos
- 4Departamento de Anatomía, Fisiología y Farmacología, Facultad de Medicina Veterinaria, Universidad de Auburn, Auburn, AL, Estados Unidos
Se necesitan terapias novedosas para el tratamiento de los gliomas. Mebendazol demostró previamente efectos antineoplásicos en líneas celulares de glioma canino a concentraciones inhibitorias medias in vitro (IC50) de 10 ng/ml. Nuestro estudio tuvo como objetivo ajustar la dosis oral de mebendazol necesaria para alcanzar concentraciones ≥ 10 ng / ml en el líquido cefalorraquídeo (LCR) de perros sanos. Se planteó la hipótesis de que sería necesaria una dosis oral de hasta 200 mg/kg. La primera fase fue un estudio de ajuste de dosis utilizando un total de 6 perros de razas mixtas que describieron dosis vs. concentraciones plasmáticas durante 72 h después de una dosis oral única de 50 mg / kg (n = 2), 100 mg / kg (n = 2) o 200 mg / kg (n = 2). Basado en la fase uno, los perros de fase dos (total de 9) recibieron 100 mg / kg (n = 4) o 200 mg / kg (n = 5) por vía oral y las muestras de sangre se recolectaron intermitentemente durante 60 h con muestras de LCR recolectadas intermitentemente durante 24 h. El mebendazol se cuantificó en plasma y LCR mediante cromatografía líquida de alta resolución. La mediana de las concentraciones plasmáticas máximas (Cmax) se alcanzó a los 7 ± 2 h (100 mg/kg) de 220 ng/ml (81, 283) y a las 15 ± 4 h (200 mg/kg) de 147 ng/ml (112, 298). El área respectiva bajo la curva (AUC: ng/ml/h) reportada como mediana fue de 2.119 (1.876, 3.288) frente a 3.115 (1.559, 4.972). Las concentraciones plasmáticas medianas (ng/ml) para 100 vs. 200 mg/kg fueron 47 (32, 52) vs. 65 (35, 104), respectivamente. Para el LCR, el valor medio para la Cmax (a 100 mg/kg vs. 200 mg/kg) fue de 8 (2, 28) vs. 21 (12, 27) y el AUC fue de 87 (22, 157) vs. 345 (92, 372), respectivamente. La biodisponibilidad relativa en LCR frente a plasma fue de 4 a 10%. Aunque varios animales demostraron signos clínicos indicativos de malestar gastrointestinal [es decir, vómitos (n = 2), diarrea (n = 2) o ambos (n = 1)], estos eventos no se consideraron graves. El CI in vitro50 para gliomas se puede alcanzar en LCR a 100 mg / kg (n = 1), sin embargo, una dosis de 200 mg / kg produjo concentraciones más consistentes.
1. Introducción
Los gliomas son tumores cerebrales primarios que surgen de las células gliales que se diferencian en astrocitomas, oligodendrogliomas o ependimomas. Estos tumores son comunes tanto en humanos como en caninos (1–4). Los gliomas caninos generalmente se diagnostican presuntamente en función de las características de la lesión por resonancia magnética (IRM), ya que el diagnóstico definitivo con una biopsia no se obtiene comúnmente (5). Como tal, su naturaleza agresiva y su ubicación intraaxial limitan la efectividad de las opciones de tratamiento disponibles tanto en medicina veterinaria como humana, que a menudo involucra múltiples modalidades de tratamiento que incluyen cirugía, radioterapia y / o agentes quimioterapéuticos como temozolomida (5-8). A pesar de la efectividad limitada de estas opciones de tratamiento, los dueños de perros con presuntos tumores gliales están cada vez más interesados en las opciones de tratamiento para sus compañeros caninos, particularmente aquellos que son menos invasivos y conscientes de los costos para permitir una mayor supervivencia y preservación de la calidad de vida. Debido a este interés, la investigación continua sobre nuevas terapias para los gliomas es un enfoque importante que tiene el potencial de beneficiar tanto a la medicina humana como a la veterinaria.
Los benzimidazoles (BZD), como el fenbendazol y el mebendazol, se desarrollaron originalmente como antihelmínticos para su uso en medicina humana y veterinaria (9-13). Recientemente se ha descubierto que las BZD tienen múltiples propiedades antineoplásicas contra varias líneas celulares de cáncer in vitro e in vivo (13-21). Su principal modo de acción se dirige a la tubulina, uno de los principales bloques de construcción de una célula que es crucial para la división celular (13, 14). Más específicamente, las BZD inhiben la polimerización de la tubulina e interrumpen la formación de microtúbulos que conducen a la detención celular (14-16). Las propiedades antineoplásicas adicionales de las BZD incluyen la inhibición de la vía del erizo, la inhibición de las quinasas (como MAPK14 / p38a) y los efectos antiangiogénicos (15-23). En la literatura humana reciente, se ha encontrado que las BZD inhiben el crecimiento y desarrollo de varios cánceres, incluidos los cánceres de pulmón de células no pequeñas, el carcinoma adrenocortical, el melanoma quimiorresistente, el cáncer de colon, el carcinoma hepatocelular y las neoplasias del sistema nervioso central (SNC) como el glioblastoma, otros gliomas y el meduloblastoma (13-26).
Investigaciones anteriores han demostrado in vitro efectos antitubulina y antineoplásicos de fenbendazol y mebendazol en tres líneas celulares de glioma canino, estableciendo una concentración inhibitoria media (IC50; CMI ) para cada fármaco (12). El CI in vitro50 de mebendazol se encontró que era de 10 ng / ml frente a aproximadamente 150 ng / ml para fenbendazol (12), lo que demuestra que el mebendazol es un fármaco más potente en comparación con el fenbendazol. Además, estudios previos han demostrado que dosis de 11-110 veces la dosis antihelmíntica de 22 mg / kg / día de mebendazol administradas a perros diariamente durante 2 meses no produjeron reacciones adversas o efectos sobre la función hepática (10). Datos no publicados de un estudio previo con fenbendazol en nuestro laboratorio revelaron un profundo malestar gastrointestinal en la cohorte de perros sanos. Estos hallazgos hacen que el mebendazol sea un mejor fármaco de elección para estudios adicionales como agente antineoplásico.
Documentar las concentraciones de mebendazol en el líquido cefalorraquídeo (LCR) de perros sanos y compararlas con lo que se ha demostrado que produce un aumento de la muerte de la línea celular de glioma in vitro es un paso crucial en la formulación de un ensayo clínico en pacientes con glioma canino. Sin demostrar que el mebendazol es capaz de cruzar la barrera hematoencefálica y lograr concentraciones detectables en el LCR canino sano, hay poco apoyo de que las BZD tengan algún uso como terapia potencial para los gliomas caninos. Los objetivos de este estudio fueron describir el curso temporal de las concentraciones plasmáticas de mebendazol en el plasma y el LCR cuando se administra por vía oral a perros sanos y, posteriormente, determinar una dosis oral de mebendazol necesaria para alcanzar y mantener las concentraciones previstas para ser terapéuticas para el tratamiento de gliomas en perros. Planteamos la hipótesis de que 1) las concentraciones plasmáticas caninas de mebendazol aumentarán de manera dependiente de la dosis y que 2) una dosis oral de hasta 200 mg / kg alcanzará concentraciones in vivo de al menos 10-20 ng / ml en el LCR de un perro sano, lo que se consideró concentraciones terapéuticas para el tratamiento de gliomas caninos según el estudio in vitro previo (12).
2. Materiales y métodos
2.1. Animales
Un total de seis (rango de edad: 2-10 años) hembras sanas (4 intactas, 2 esterilizadas) perros de raza mixta fueron adquiridos de una colonia de cría criada especialmente en laboratorio en la Facultad de Medicina Veterinaria de la Universidad de Auburn (AUCVM) para su uso en la fase 1 de este estudio. Se adquirieron tres perros machos machos intactos de raza mixta adicionales (rango de edad: 2-8 años) además de las seis perras originales (n = 9) para su uso en la fase 2 de este estudio. Al ingresar al hospital el día 0 de cada fase del estudio, a los perros se les dio ≥ 12 h para aclimatarse antes de comenzar la recolección de sangre (y la recolección de LCR, solo fase 2). Todos los perros estaban aparentemente sanos y se sometieron a exámenes físicos y neurológicos poco notables (realizados por los mismos investigadores durante todo el estudio) antes de la administración del medicamento. Además, se realizó un conteo sanguíneo completo (CSC), un panel de química sérica y un análisis de orina antes de la administración del medicamento para evaluar el estado de salud inicial. Los exámenes se realizaron diariamente hasta el final de la recolección de sangre para cada fase del estudio. La monitorización de los signos vitales (temperatura, frecuencia cardíaca, frecuencia respiratoria), la mentación y cualquier signo de dolor o malestar (por ejemplo, vocalización, elevación de los signos vitales, etc.) se evaluaron cada 6-8 h durante ambas fases del estudio. Los perros fueron hospitalizados durante las fases de recolección del estudio y fueron devueltos a las perreras de la colonia de cría entre las fases del estudio y, finalmente, al final de la fase 2 del estudio. Todos los procedimientos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Auburn.
2.2. Acceso vascular
En el día 0 de cada fase del estudio, todos los perros recibieron catéteres intravenosos colocados en las venas cefálicas izquierda o derecha. Todos los perros fueron fuertemente sedados con dexmedetomidina (5 μg / kg) y butorfanol (0,2 mg / kg) para la colocación de catéteres yugulares, como se describe en otra parte (27), para proporcionar acceso vascular para la recolección de muestras de sangre. Los catéteres yugulares se colocaron 12-24 h antes del inicio de la recolección de muestras. Los catéteres se enjuagaron con solución salina estéril heparinizada (0,9% NaCl) una vez al día y posteriormente se enjuagaron con solución salina estéril y se monitorizaron para determinar la permeabilidad y la limpieza cada 6 h. Se implementó el vendaje de rutina del catéter y se reemplazó según lo indicado por el diseño de recolección de muestras o según sea necesario según el paciente. Los catéteres se retiraron inmediatamente después de obtener la última muestra de sangre y se inspeccionaron los sitios de los catéteres para detectar cualquier evidencia de infección. Se colocaron vendajes de presión sobre el sitio del catéter durante 30 minutos después de la extracción y posteriormente se retiraron antes de regresar a las perreras de la colonia.
2.3. Administración de mebendazol
El mebendazol fue suministrado por un colaborador, el Dr. Gregory Riggins, profesor de neurocirugía y oncología en la Universidad Johns Hopkins, en una formulación en polvo. Si bien aún conserva la aprobación de la FDA para su uso en perros, el mebendazol ya no está disponible comercialmente en los Estados Unidos de América en la actualidad. Sobre la base de la dosis terapéutica conocida (10, 11) y la concentración de LCR objetivo del estudio, una dosis de 50 mg / kg, 100 mg / kg o 200 mg / kg se compuso en cápsulas para cada perro (una dosis por perro asignada aleatoriamente para cada fase del estudio) por la Farmacia del Hospital de Enseñanza Veterinaria de Animales Pequeños de la Universidad de Auburn. Durante la fase 1 (determinación de la dosis, n = 6 en total), dos perros fueron asignados aleatoriamente para recibir una dosis oral única de mebendazol de 50, 100 o 200 mg / kg. Durante la fase 2 (farmacocinética, n = 9 en total), los perros fueron aleatorizados para recibir una dosis única oral de mebendazol de 100 mg / kg (n = 4) o 200 mg / kg (n = 5). En el momento de la administración en ambos estudios, se utilizó una cantidad mínima de alimento para permitir la ingestión de la dosis; Los animales no recibieron una comida completa hasta 6 h después de la administración durante la fase 1 y no hasta aproximadamente 12-14 h después de la administración debido a los frecuentes períodos anestésicos durante la fase 2 para reducir el riesgo de regurgitación / aspiración.
2.4. Extracción de sangre
Durante la fase 1, se recolectaron muestras de sangre de todos los perros en los momentos 0, 0.5, 1, 2, 4, 6, 8, 12, 16, 20, 24, 48 y 72 h después de la administración de mebendazol. Durante la fase 2, esto fue similar, pero concluyó a las 60 h (en lugar de 72 h) después de la administración. Se utilizó la «técnica de tres jeringas» descrita para recolectar sangre estérilmente en cada momento de recolección y los catéteres se enjuagaron con 3 ml de solución salina estéril (0,9% NaCl) después (28). Las muestras de sangre no superaron los 6 ml en cada momento de la recolección. El volumen de células empaquetadas y los sólidos totales se monitorizaron cada 24 h para garantizar que no excedimos el 7% del volumen de sangre muestreado de peso corporal durante 24 h. Las muestras de sangre se almacenaron inicialmente en tubos Sarstedt S-Monovette® Neutral Z/4,9 ml. Las muestras de sangre se almacenaron a 0 °C durante no más de 10-20 minutos antes de la centrifugación. El plasma se obtuvo correctamente mediante centrifugación durante 5 min a 1.500 × g. Las muestras de plasma se transfirieron a través de una pipeta de plástico a un microtubo de tapón de rosca Sarstedt de 1,5 ml y luego se colocaron en -80 ° C para su almacenamiento hasta que se realizó el procesamiento. Las muestras se almacenaron durante aproximadamente 3 meses.
2.5. Recogida del MCA
Durante la fase 2, se recolectaron muestras de LCR de todos los perros en los momentos 1, 2, 3, 6, 12 y 24 h después de la administración de mebendazol. Todos los perros fueron colocados bajo anestesia general para la recolección de LCR. Los perros recibieron una inyección de butorfanol (0,2 mg/kg) y dexmedetomidina (5 μg/kg) como premedicación. Se utilizó propofol (3-6 mg/kg IV para efecto) para la inducción y luego se intubó a los perros con un tubo endotraqueal. Los perros se mantuvieron con isoflurano en oxígeno titulado al efecto. Los perros se mantuvieron bajo un solo evento anestésico durante tiempos de recolección de 1 a 3 h. Para las muestras en las horas 6, 12 y 24, se colocaron bajo eventos anestésicos separados para un total de 4 eventos anestésicos durante un período de tiempo de 24 h. Se utilizó una aguja espinal estéril de calibre 22 y 1,5 pulgadas para obtener aproximadamente 1 ml de LCR de la unión atlantooccipital en cada momento de la recolección. Este volumen de LCR eliminado se consideró seguro ya que se ha determinado que la producción de LCR canina es de 0,047 ml / min o alrededor de 68 ml / día (29). Cuando hubo evidencia de contaminación grave de la sangre, se desecharon unas gotas de LCR hasta que el líquido se aclaró y luego comenzó la recolección. Las muestras de LCR no se analizaron para determinar los recuentos de proteínas, glóbulos rojos o glóbulos blancos como parte de este estudio. Las muestras se recogieron en un microtubo de tapón de rosca Sarstedt de 1,5 ml y se almacenaron a 0 °C durante no más de 10-20 minutos antes de colocarlas en -80 °C para su almacenamiento hasta que se realizó el procesamiento. Las muestras se almacenaron durante aproximadamente 3 meses.
2.6. Análisis farmacocinético
El plasma de perro y el líquido cefalorraquídeo (LCR) se analizaron para determinar las concentraciones de mebendazol mediante cromatografía líquida de alta resolución (HPLC) con detección ultravioleta (UV) (30-33). El sistema HPLC consistía en un módulo de separación Waters 2.695 y un detector UV-Visible de 2.489 (Waters Corporation™, Milford, MA, EUA). La separación se logró con una columna Gemini C6, 5 μm, 150 × 3 mm (Phenomenex®, Torrance, CA, EUA) a 40 ° C (31-35). La fase móvil consistió en tampón de formiato de amonio 75:25, 20 mM (pH ajustado a 3,0 w/ácido fórmico):Acetonitrilo (VWR®, Radnor, PA, EUA) con un caudal ajustado a 1,5 ml/min (30, 34). El tiempo de retención para mebendazol fue de 6,8 min y la absorbancia UV se monitorizó a 314 nm (30-33). Se generó la curva estándar que osciló entre 10 y 1.000 ng/ml para plasma canino y de 5 a 500 ng/ml para LCR mediante la fortificación del plasma canino y la solución salina, respectivamente, con cantidades conocidas de mebendazol (Sigma-Aldrich®, St. Louis, MO, EUA) estándar de referencia y aceptado si el coeficiente de determinación (r2) fue de al menos 0,99 y las concentraciones previstas estaban dentro del ±10 % de las concentraciones reales (30). Brevemente, el mebendazol se cuantificó en plasma canino y LCR en base a modificaciones de ensayos previamente desarrollados (30-35). Para muestras de plasma y LCR, se añadieron 1.000 y 700 μl de acetonitrilo a tubos que contenían 500 y 350 μl de plasma canino y LCR, respectivamente (30, 31). El contenido de cada tubo se mezcló vigorosamente durante 30 s a través de vórtice, luego se sometió a centrifugación durante 10 minutos a 16,000 × g. El sobrenadante transparente se transfirió a un tubo de vidrio limpio, luego se evaporó a sequedad bajo una suave corriente de nitrógeno durante 40 minutos a 45 ° C (31). El residuo se reconstituyó con 250 μl de fase móvil, se enrojeció durante 20 s, y luego la solución se centrifugó a 16.000 × g durante 5 min. El sobrenadante se transfirió al vial y se inyectaron 100 μl en el sistema cromatográfico (30–32, 35).
El coeficiente de correlación lineal para mebendazol en plasma canino y LCR fue de 0,999. El límite de detección fue de 5 y 2,5 ng/ml para el plasma canino y el líquido cefalorraquídeo (LCR), respectivamente. El límite inferior de cuantificación fue de 10 y 5 ng/ml para el plasma canino y el LCR, respectivamente. La precisión (CV%) para mebendazol en plasma canino a 14, 26, 60, 120 y 800 ng/ml fue de 4,37, 2,69, 1,16, 5,90 y 1,51%, respectivamente. La precisión (% de recuperación) para mebendazol en plasma canino a 14, 26, 60, 125 y 800 ng/ml fue de 104,34, 99,40, 99,38, 100,28 y 101,64%, respectivamente. La precisión (CV%) para mebendazol en LCR canina a 5, 15, 75 y 300 ng/ml fue de 7,70, 2,63, 2,44 y 2,11%, respectivamente. La precisión (% de recuperación) para mebendazol en LCR canino a 5, 15, 75 y 300 ng/ml fue de 106,55, 100,10, 99,83 y 99,25%, respectivamente.
Los datos de concentración plasmática y de mebendazol en LCR frente a los datos de tiempo se sometieron a análisis no compartimental utilizando software informático (Phoenix® WinNonLin® V7, Pharsight, Cetara, Princeton, NJ, EUA). El área bajo la curva (AUC) hasta el infinito se determinó utilizando el método trapezoidal log-lineal. Se registró la concentración máxima real (Cmax) que se produjo en el momento de la concentración máxima (Tmax). La pendiente del componente terminal de la curva fármaco vs. tiempo se basó en la regresión no lineal. Debido a que el mebendazol no se administró por vía intravenosa, no se pudo confirmar la eliminación total del componente terminal y, por lo tanto, tanto la constante de la tasa de eliminación como la vida media se informaron como desaparición. La vida media se informó como media armónica + desviación pseudoestándar. Además, no se pudo determinar ni el aclaramiento (CL) ni el volumen de distribución (Vd). Otros parámetros incluyeron el tiempo medio de residencia (TMM) y el porcentaje del AUC que se extrapoló del componente terminal de la curva. La biodisponibilidad relativa (porcentaje) de mebendazol en LCR a plasma se calculó en base a la relación del AUC (AEV1/AEV2).
2.7. Análisis estadístico
La prueba de Kolmogorov-Smirnov se utilizó para determinar la normalidad entre los conjuntos de datos. Las estadísticas descriptivas se informaron como media ± desviación estándar (DE) o mediana y rango (mínimo, máximo) cuando no se distribuyeron normalmente. Se realizaron comparaciones entre dosis de 100 y 200 mg/kg para plasma o LCR (y entre estas dos fuentes) para parámetros farmacocinéticos clave mediante pruebas t de student y entre LCR y plasma mediante una prueba t pareada. Las diferencias fueron consideradas estadísticamente significativas a p ≤ 0,05.
3. Resultados
3.1. Fase 1 (determinación de la dosis)
Se detectaron concentraciones plasmáticas de mebendazol en todos los grupos de dosificación, con concentraciones plasmáticas máximas (Cmax [ng/ml] (mediana; rango) en Tmax [hrs]) notificadas para cada dosis respectiva de 132 ng/ml (65; 10, 235) a 3 h (50 mg/kg), 161 ng/ml (57; 6, 181) a 5 h (100 mg/kg) y 241 ng/ml (78; 9, 333) a las 2 h (200 mg/kg). Estos hallazgos parecieron ser dependientes de la dosis. La variabilidad fue marcada entre los sujetos pareados para cada dosis, y las concentraciones cayeron por debajo de los límites de detección a las 24 h en todas las dosis (Figura 1). Sobre la base de estos datos, la fase 2 del estudio se implementó con una dosis única de 100 mg / kg o 200 mg / kg para maximizar las concentraciones plasmáticas y de LCR.
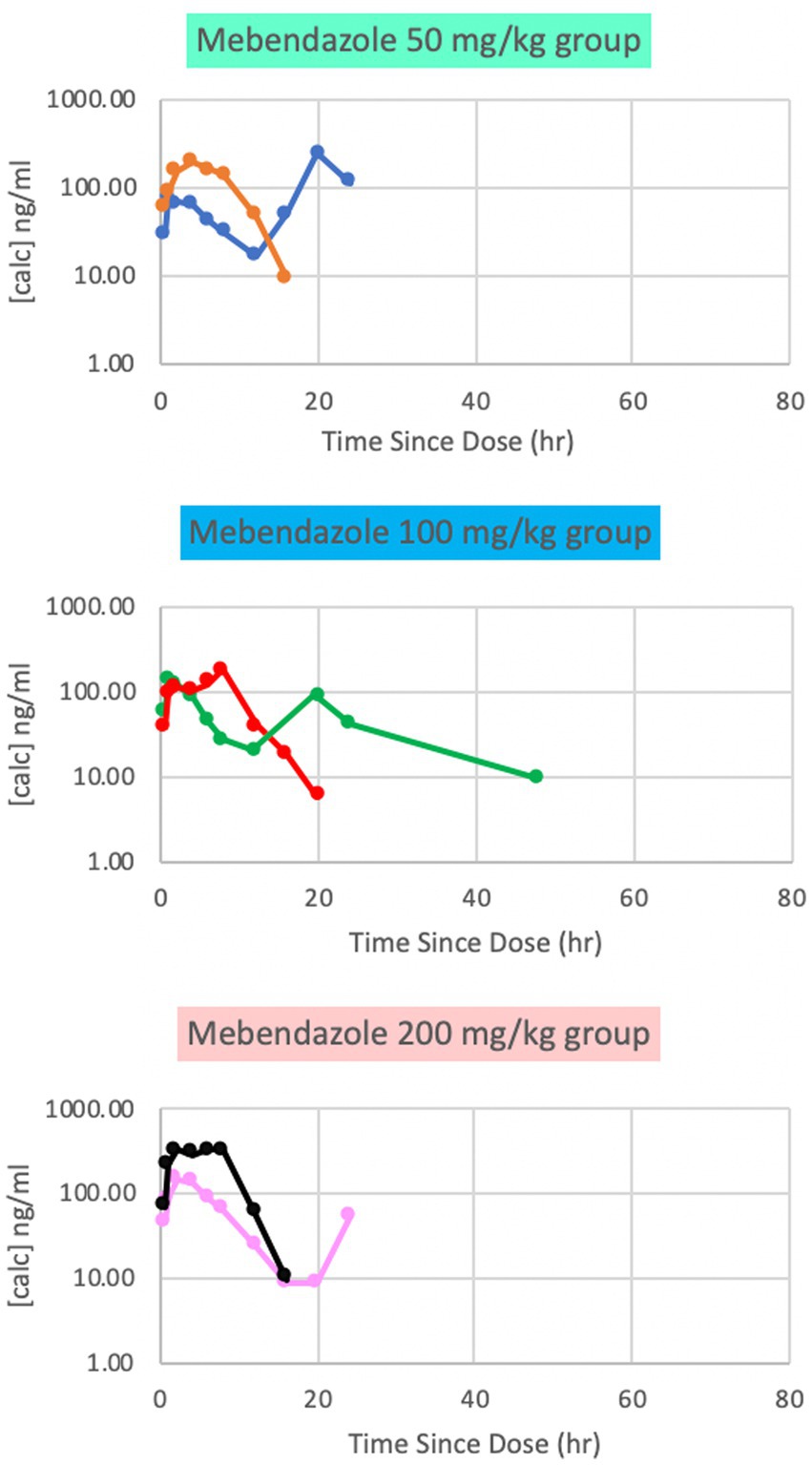 Figura 1. Concentraciones plasmáticas de mebendazol de fase 1 después de una dosis oral única de 50 mg/kg, 100 mg/kg y 200 mg/kg, respectivamente. Las concentraciones plasmáticas máximas se encontraban en puntos temporales variables entre las dosis.
Figura 1. Concentraciones plasmáticas de mebendazol de fase 1 después de una dosis oral única de 50 mg/kg, 100 mg/kg y 200 mg/kg, respectivamente. Las concentraciones plasmáticas máximas se encontraban en puntos temporales variables entre las dosis.
3.2. Fase 2 (farmacocinética)
La farmacocinética para cada dosis durante la Fase 2 se enumeran en la Tabla 1. Se proporcionan gráficos de concentración de fármaco vs. tiempo para dosis de 100 vs. 200 mg/kg alcanzadas en plasma (Figura 2) y LCR (Figura 3). Las diferencias significativas en las muestras de plasma entre las dos dosis se limitaron a Tmax (p = 0,01). El Tmax plasmático fue de 7 +/− 2 vs. 15 +/− 4 (con dosis de 100 vs. 200 mg/kg, respectivamente). Para el LCR, las diferencias significativas se limitaron al área bajo la curva (AUC; p = 0,016). La biodisponibilidad relativa (%) de mebendazol en el LCR en comparación con el plasma fue menor a 100 mg/kg (4 ± 3) en comparación con 200 mg/kg (10 ± 5), lo que tendió hacia la significación (p = 0,06). El AUC reveló una diferencia en las concentraciones plasmáticas y de LCR, sin embargo, se observó una cantidad moderada de variabilidad basada en la información de SD que comparó plasma y LCR. La Cmax_D (Cmax ajustada por dosis) fue mayor en plasma a la dosis de 200 mg/kg frente a 100 mg/kg (p = 0,04).
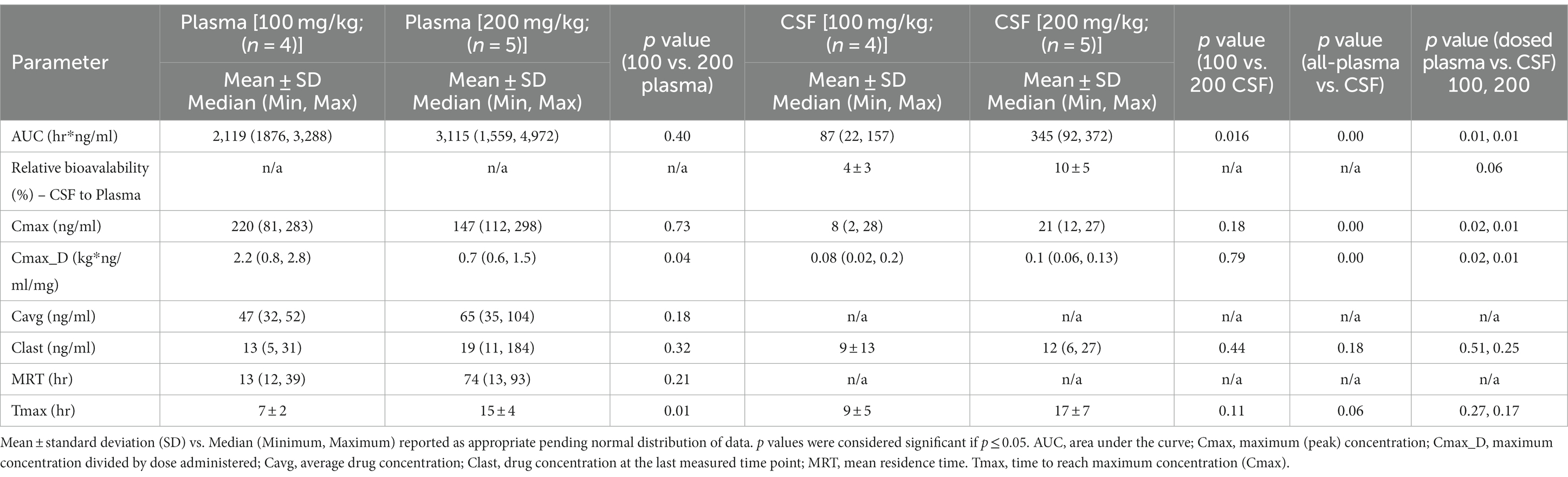 Tabla 1. Resultados farmacocinéticos de mebendazol después de la administración oral de 100 mg/kg (n = 4) o 200 mg/kg (n = 5) en perros aparentemente sanos (n = 9) informados en plasma y líquido cefalorraquídeo (LCR).
Tabla 1. Resultados farmacocinéticos de mebendazol después de la administración oral de 100 mg/kg (n = 4) o 200 mg/kg (n = 5) en perros aparentemente sanos (n = 9) informados en plasma y líquido cefalorraquídeo (LCR).
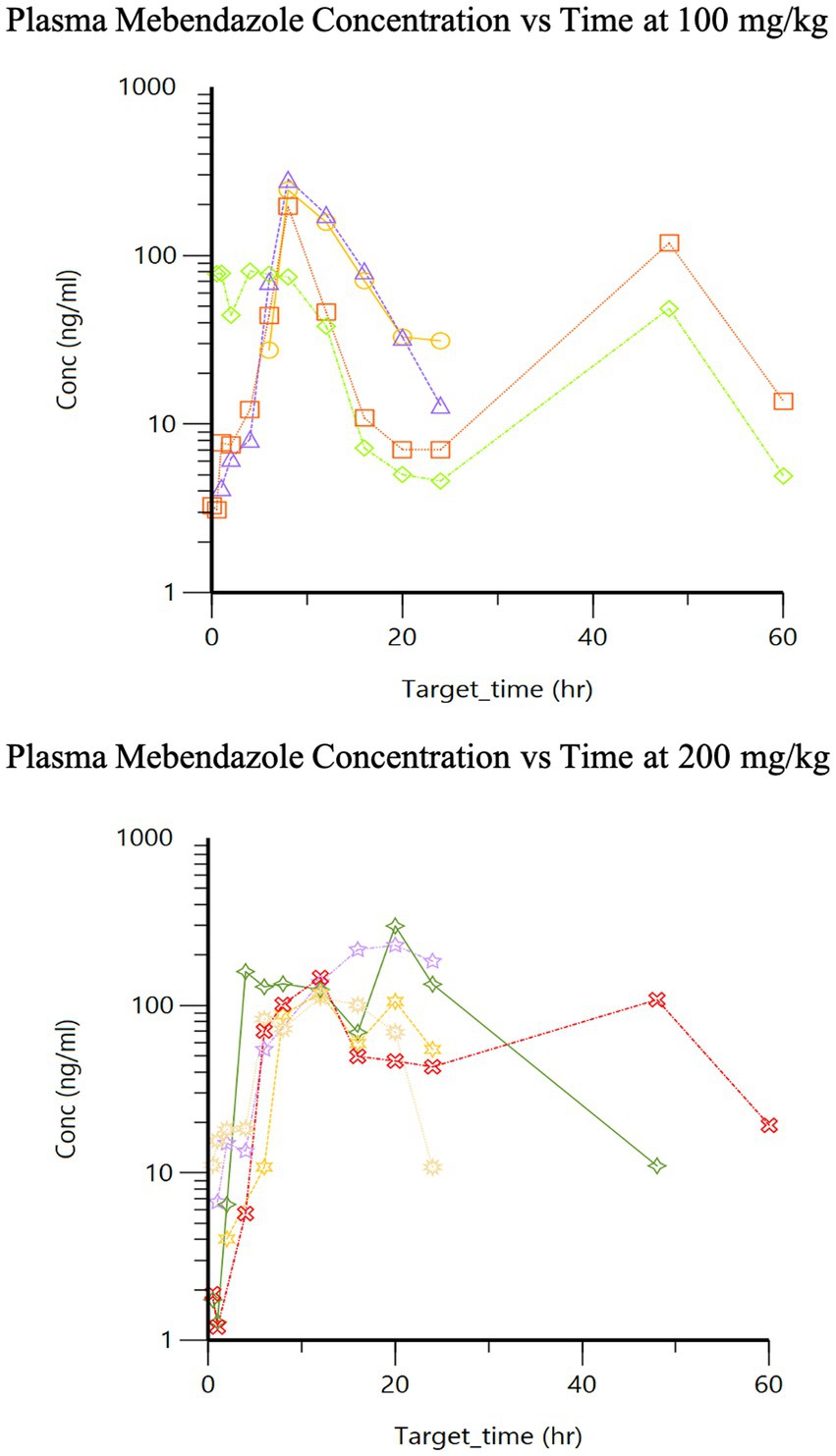 Figura 2. Concentraciones plasmáticas de mebendazol de fase 2 después de una dosis oral única de 100 mg/kg y 200 mg/kg, respectivamente.
Figura 2. Concentraciones plasmáticas de mebendazol de fase 2 después de una dosis oral única de 100 mg/kg y 200 mg/kg, respectivamente.
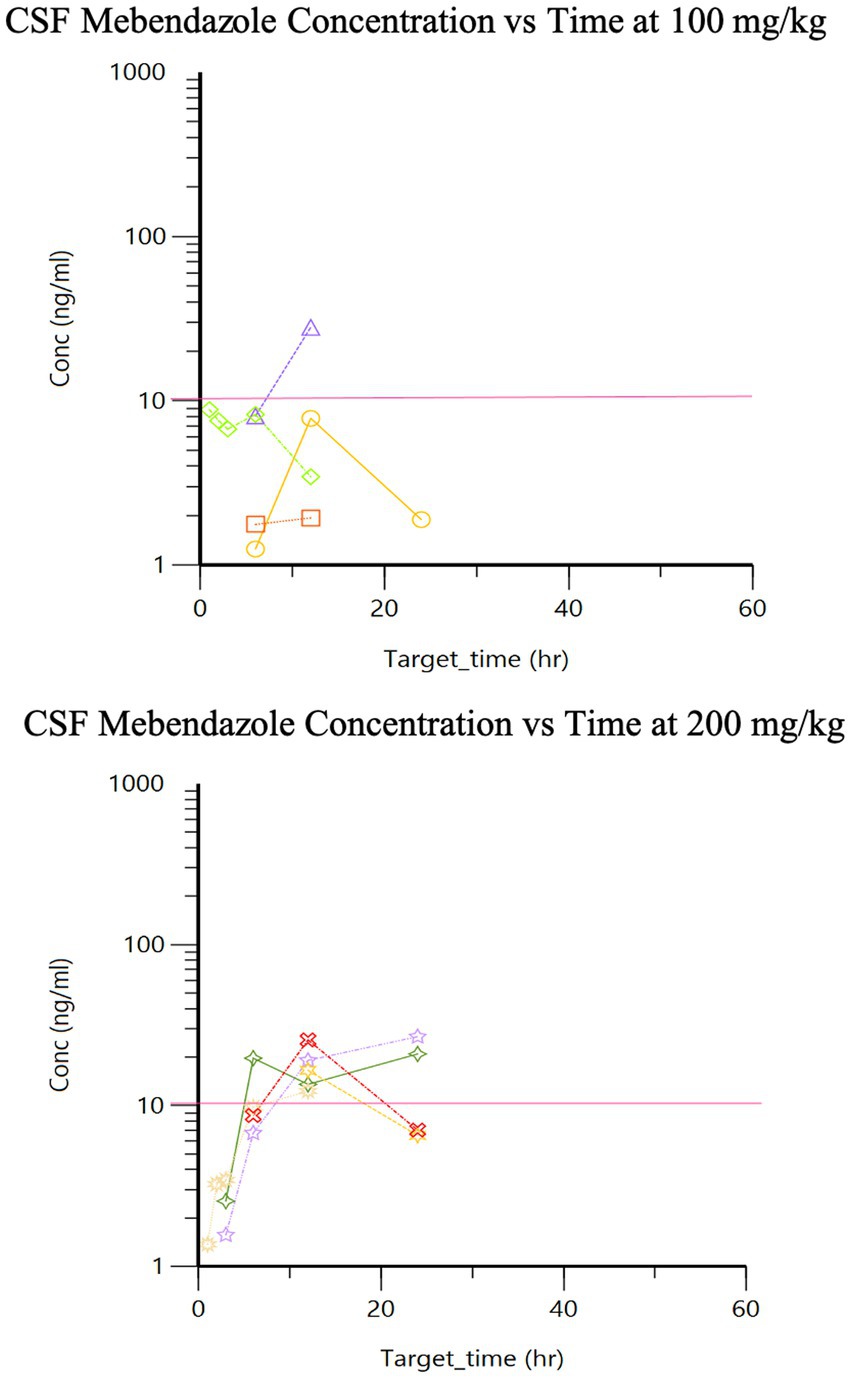 Figura 3. Concentraciones de mebendazol en LCR de fase 2 después de una dosis oral única de 100 mg/kg y 200 mg/kg, respectivamente (la línea rosa es la concentración objetivo, ≥10 ng/ml).
Figura 3. Concentraciones de mebendazol en LCR de fase 2 después de una dosis oral única de 100 mg/kg y 200 mg/kg, respectivamente (la línea rosa es la concentración objetivo, ≥10 ng/ml).
No se observaron eventos adversos profundos para estos perros sanos que recibieron mebendazol durante este estudio. Durante la fase 1, un perro desarrolló heces con motas de sangre franca y otro tuvo un episodio de diarrea mucoide, que se resolvió sin más intervenciones. Se observó que cinco de los seis perros defecaron verdes al menos una vez en el curso del estudio posterior a la administración del medicamento, relacionado con el color verde de las cápsulas de gelatina utilizadas para la administración de medicamentos. Durante la fase 2, se observó malestar gastrointestinal leve en cinco perros en total caracterizados por diarrea (n = 2, ambos en el grupo de 200 mg / kg), vómitos (n = 2, uno en el grupo de 100 mg / kg y uno en el grupo de 200 mg / kg), con un perro adicional del grupo de 100 mg / kg que tenía vómitos y diarrea); todo resuelto sin tratamiento adicional. Para aquellos que experimentaron vómitos, uno vomitó en el momento de la inducción (~ 20 min) después de la administración, sin embargo, no se observaron rastros del medicamento en el vómito. Los otros episodios fueron varias horas después de la administración (7 h vs. 12 h+). Los episodios de diarrea ocurrieron a las 8, 19 y 36 h después de la administración, respectivamente. En la fase 2, seis de cada nueve perros desarrollaron al menos un episodio de heces verdes durante el período de recolección de sangre.
4. Discusión
Este estudio demuestra una relación de concentración de dosis para mebendazol después de la administración oral en perros sanos y que el IC in vitro50 (0,03–0,08 μM, es decir, 10–20 ng/ml) para los gliomas (12) se puede alcanzar en el LCR a 100 mg/kg (n = 1 de 4 en este estudio), aunque 200 mg/kg pueden permitir un beneficio terapéutico más consistente (es decir, ≥10 ng/ml). No se pudo demostrar un cambio dependiente de la dosis en el área bajo la curva (biodisponibilidad relativa) para plasma o LCR porque los perros solo recibieron una dosis del fármaco (ambas dosis deben administrarse para determinar la biodisponibilidad relativa de cada perro); Sin embargo, numéricamente, según la comparación de los valores medios, el AUC de mebendazol fue mayor en plasma y especialmente en LCR cuando los perros recibieron una dosis de 200 mg / kg frente a 100 mg / kg. Hubo una marcada variabilidad individual que impidió la capacidad de generar una curva dependiente de la dosis dada la pequeña población muestral.
El segundo pico demostrado en nuestras curvas de concentración plasmática vs. tiempo (Figura 2) después de la administración oral puede representar variaciones individuales del metabolismo o probablemente un proceso metabólico de segundo paso (es decir, circulación enterohepática). Los puntos de tiempo adicionales para evaluar para una mayor eliminación pueden ser beneficiosos. Tampoco está claro cómo los efectos de la anestesia sobre la motilidad gastrointestinal o los alimentos podrían desempeñar un papel en la absorción total y/o el aclaramiento de este fármaco en nuestro estudio. Los datos no publicados de un estudio previo con fenbendazol en nuestro laboratorio pueden sugerir una mejor absorción con los alimentos. A todos los perros se les retuvo una comida completa durante las primeras 6 h durante la recolección de muestras de la primera fase del estudio y hasta después de un mínimo de 12 h para la segunda fase del estudio tratando de eliminar los efectos de los alimentos sobre el metabolismo de los medicamentos. Además, un total de 5 perros experimentaron malestar gastrointestinal (n = 2 vómitos, n = 2 diarrea, n = 1 ambos); Sin embargo, estos perros tenían el área más alta o casi más alta bajo la curva para sus grupos de dosificación, lo que sugiere que esto no influyó negativamente en la absorción de este medicamento. Una limitación de este estudio es la falta de administración intravenosa (IV) de este fármaco, lo que impidió determinar parámetros dependientes de la vía intravenosa, incluido el volumen de distribución y el aclaramiento, así como confirmar que el componente terminal de la concentración plasmática del fármaco frente a la curva de tiempo reflejaba la eliminación (en lugar de la absorción como ocurre con un modelo «flip-flop»). Puede ser beneficioso aumentar la frecuencia de dosificación para proporcionar un estado estacionario adicional de la concentración de mebendazol en plasma y LCR, y requeriría más investigación para comprender mejor el efecto de los alimentos en la absorción de este benzimidazol en particular.
Otra limitación de este estudio podría estar relacionada con la recolección y el análisis del LCR. Para este estudio, las muestras de LCR no se analizaron para determinar si las proteínas o los recuentos celulares (es decir, glóbulos rojos o glóbulos blancos) se centraron en la concentración del fármaco. Como tal, se observó cierta contaminación sanguínea grave durante el período de recolección del LCR. Para intentar limitar los efectos de esto, se permitió que la muestra fluyera hasta que estuviera muy clara, sin embargo, no está claro si esto podría afectar las concentraciones alcanzadas de LCR ni si esto podría afectar las muestras futuras. Esto ocurrió en un total de 5 perros (n = 1 del grupo de 100 mg / kg en el punto de tiempo de 1 h y n = 4 del grupo de 200 mg / kg). Para los perros en el grupo de 200 mg / kg, la contaminación de la sangre ocurrió en el punto de tiempo de 2 h y 3 h en un perro, en el punto de 3 h y 12 h en un perro, a las 12 h en un perro, y en los puntos de muestra 3, 6, 12 y 24 h en un perro. Debido a la variabilidad observada en las concentraciones de LCR en relación con la biodisponibilidad relativa de estas muestras, no parece obvio que la contaminación de la sangre contribuyera significativamente a estos valores.
A partir de este estudio, la pregunta sigue siendo si un CI in vitro50 se correlacionará con la actividad in vivo y si las concentraciones de tejido cerebral también reflejarán las concentraciones de LCR para finalmente dirigirse a las células tumorales. Aunque estas dos dosis fueron capaces de alcanzar concentraciones detectables de LCR, las concentraciones objetivo óptimas en el LCR para el tratamiento de gliomas caninos aún no se han determinado y esto no apoya las concentraciones sostenidas de LCR ni la capacidad de penetrar en el tejido cerebral en lugar del LCR. Determinar si podíamos o no alcanzar concentraciones terapéuticas de mebendazol en el plasma y el LCR en caninos sanos fue el primer paso para investigar más a fondo el uso de este fármaco como un tratamiento novedoso para los gliomas. Idealmente, un estudio de seguimiento para determinar si una dosis consistente de 200 mg / kg podría alcanzar consistentemente concentraciones de LCR consideradas terapéuticas en perros con gliomas. Sin embargo, dada la limitación del acceso del paciente y las preocupaciones éticas con respecto a un estudio farmacocinético en perros propiedad del cliente con una neoplasia del SNC probablemente fatal, los datos aquí pueden ser suficientes para apoyar un estudio de eficacia de fase II en perros afectados. En última instancia, la información de este estudio se utilizaría para determinar la eficacia del mebendazol como terapia adyuvante para los gliomas caninos para prolongar el tiempo de supervivencia en caninos con esta enfermedad mortal.
Declaración de disponibilidad de datos
Los datos brutos que apoyan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Auburn. El estudio se realizó de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones del autor
AY, KD, AT y DB concibieron y planificaron los experimentos. AY y KD realizaron los experimentos y comenzaron la preparación inicial del manuscrito. CC-E y DB analizaron las muestras de plasma y LCR. AY y DB analizaron los datos. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este estudio fue financiado por la subvención inicial Intramural Animal Health and Disease Research (AH&DR) de la Universidad de Auburn.
Reconocimientos
Mebendazol fue amablemente proporcionado por Gregory J. Riggins, profesor de Neurocirugía y Oncología en la Facultad de Medicina de la Universidad Johns Hopkins. Los autores agradecen a Bruce F. Smith, Director de la Iniciativa de Investigación en Cáncer de la Universidad de Auburn y Científico del Centro de Investigación Scott-Ritchey por el uso de sus perros de colonia para este estudio. Agradecemos a Jessica Price y Steve Waters por la coordinación del horario y la asistencia con los perros de la colonia. También agradecemos a Sharon Barney, Glenn Horne, Pia Laporte, Kodye Abbott y Laci MacKay por su asistencia técnica con la recolección de muestras y el monitoreo anestésico.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
El editor de manejo RB declaró una coautoría pasada con el autor AY.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Chen, L, Zhang, Y, Yang, J, Hagan, JP, and Li, M. Vertebrate animal models of glioma: understanding the mechanisms and developing new therapies. Biochim Biophys Acta – Rev Cáncer. (2013) 1836:158–65. doi: 10.1016/j.bbcan.2013.04.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Bentley, RT, Ahmed, AU, Yanke, AB, Cohen-Gadol, AA, y Dey, M. Los perros son el mejor amigo del hombre: en la enfermedad y en la salud. Neurooncología. (2017) 19:312–22. doi: 10.1093/neuonc/now109
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Song, R, Vite, C, Bradley, C y Cross, J. Evaluación postmortem de 435 casos de neoplasia intracraneal en perros y relación de la neoplasia con la raza, la edad y el peso corporal. J Vet Pasante Med. (2013) 27:1143–52. DOI: 10.1111/JVIM.12136
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Rossmeisl, JH, Jones, JC, Zimmerman, KL y Robertson, JL. Tiempo de supervivencia después del alta hospitalaria en perros con tumores cerebrales primarios tratados paliativamente. J Am Vet Med Assoc. (2013) 242:193–8. doi: 10.2460/javma.242.2.193
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Van Meervenne, S, Verhoeven, PS, De Vos, J, Gielen, IMVL, Polis, yo y Van Ham, amamos mi vida. Comparación entre el tratamiento sintomático y la suplementación con lomustina en 71 perros con lesiones intracraneales que ocupan espacio: masas intracraneales de lomustina. Veterinario Comp Oncol. (2014) 12:67–77. doi: 10.1111/j.1476-5829.2012.00336.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Stupp, R, Weller, M, Belanger, K, Bogdahn, U, Ludwin, SK, Lacombe, D, et al. Radioterapia más temozolomida concomitante y adyuvante para el glioblastoma. N Engl J Med. (2005) 352:987–96. doi: 10.1056/NEJMoa043330
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Dickinson, PJ. Avances en las modalidades de diagnóstico y tratamiento de tumores intracraneales. J Vet Pasante Med. (2014) 28:1165–85. DOI: 10.1111/JVIM.12370
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Hidalgo Crespo, E, Farré Mariné, A, Pumarola, I, Battle, M, Borrego Massó, JF, and Luján Feliu-Pascual, A. Survival time after surgical Deductking and Temozolomide adjuvant chemotherapy in canine intracranial gliomas. Veterinario Sci. (2022) 9:427. doi: 10.3390/vetsci9080427
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Van Cauteren, H, Marsboom, R, Vandenberghe, J, y Will, J. Estudios de seguridad que evalúan el efecto del mebendazol en la función hepática en perros. J Am Vet Med Assoc. (1983) 183:93–8.
11. McKellar, Q, y Scott, E. Los agentes antihelmínticos benzimidazoles-una revisión. J Vet Pharmacol Ther. (1990) 13:223–47. doi: 10.1111/j.1365-2885.1990.tb00773.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Lai, S, Castello, S, Robinson, A, y Koehler, J. Efectos antitubulina in vitro del mebendazol y el fenbendazol en las células del glioma canino: efectos de los benzimidazoles en el glioma canino. Veterinario Comp Oncol. (2017) 15:1445–54. DOI: 10.1111/vco.12288
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Pantziarka, P, Bouche, G, Meheus, L, Sukhatme, V, y Sukhatme, VP. Reutilización de medicamentos en oncología (ReDO): mebendazol como agente anticancerígeno. eCáncer. (2014) 8:485. doi: 10.3332/ecancer.2014.485
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Bai, RY, Staedtke, V, Aprhys, CM, Gallia, GL y Riggins, GJ. El mebendazol antiparasitario muestra un beneficio de supervivencia en 2 modelos preclínicos de glioblastoma multiforme. Neurooncología. (2011) 13:974–82. DOI: 10.1093/neuonc/nor077
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Mukhopadhyay, T, Sasaki J ichiro, Ramesh, R, y Roth, JA. El mebendazol provoca un potente efecto antitumoral en líneas celulares de cáncer humano tanto in vitro como in vivo. Clin Cancer Res. (2002) 8: 2962–2969.
16. Jichiro, S, Ramesh, R, Chada, S, Gomyo, Y, Roth, JA, y Mukhopadhyay, T. El fármaco antihelmíntico mebendazol induce el paro mitótico y la apoptosis mediante la despolimerización de la tubulina en células de cáncer de pulmón de células no pequeñas. Mol Cáncer Ther. (2002) 1:1201–9.
17. Larsen, AR, Bai, RY, Chung, JH, Borodovsky, A, Rudin, CM, Riggins, GJ, et al. Reutilización del antihelmíntico mebendazol como inhibidor del erizo. Mol Cáncer Ther. (2015) 14:3–13. doi: 10.1158/1535-7163.MCT-14-0755-T
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Nygren, P, Fryknäs, M, Ågerup, B, and Larsson, R. Repositioning of the anthelmintic drug mebendazole for the treatment for colon cancer. J Cancer Res Clin Oncol. (2013) 139:2133–40. DOI: 10.1007/S00432-013-1539-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Bai, RY, Staedtke, V, Rudin, CM, Bunz, F, y Riggins, GJ. Tratamiento efectivo de diversos modelos de meduloblastoma con mebendazol y su impacto en la angiogénesis tumoral. Neurooncología. (2015) 17:545–54. doi: 10.1093/neuonc/nou234
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Pourgholami, M, Woon, L, Almajd, R, Akhter, J, Bowery, P, y Morris, D. Supresión in vitro e in vivo del crecimiento de células de carcinoma hepatocelular por albendazol. Cáncer Lett. (2001) 165:43–9. doi: 10.1016/S0304-3835(01)00382-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Meco, D, Attinà, G, Mastrangelo, S, Navarra, P, and Ruggiero, A. Emerging perspectives on the Antiparasitic Mebendazole as a repurposed drug for the treatment of brain cancers. IJMS. (2023) 24:1334. doi: 10.3390/ijms24021334
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Ariey-Bonnet, J, Carrasco, K, Le Grand, M, Hoffer, L, Betzi, S, Feracci, M, et al. La predicción de dianas moleculares in silico revela el mebendazol como un potente inhibidor de MAPK14. Mol Oncol. (2020) 14:3083–99. doi: 10.1002/1878-0261.12810
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Guerini, T, Triggiani, L, Maddalo, M, Bonù, ML, Frassine, F, Baiguini, A, et al. Mebendazol como candidato para la reutilización de fármacos en oncología: una extensa revisión de la literatura actual. Cánceres. (2019) 11:1284. DOI: 10.3390/cánceres11091284
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Doudican, N, Rodriguez, A, Osman, I, y Orlow, SJ. Mebendazol induce la apoptosis a través de la inactivación de Bcl-2 en células de melanoma quimiorresistentes. Mol Cancer Res. (2008) 6:1308–15. doi: 10.1158/1541-7786.MCR-07-2159
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Bai, RY, Staedtke, V, Wanjiku, T, Rudek, MA, Joshi, A, Gallia, GL, et al. Penetración cerebral y eficacia de diferentes polimorfos de mebendazol en un modelo de tumor cerebral de ratón. Clin Cancer Res. (2015) 21:3462–70. doi: 10.1158/1078-0432.CCR-14-2681
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Dobrosotskaya, IY, Hammer, GD, Schteingart, DE, Maturen, KE, y Worden, FP. Mebendazol en monoterapia y control de la enfermedad a largo plazo en el carcinoma de corteza suprarrenal metastásico. Endocr Pract. (2011) 17:E59–62. DOI: 10.4158/EP10390. CR
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Williams, K, y Linklater, A. Central venous catheter placement: modified Seldinger technique. Breve de Clin. (2015):71–5.
28. Kirby, R, y Linklater, A, (2016). Monitoreo e intervención para el pequeño animal críticamente enfermo: La regla de 20 [internet]. Ames, Iowa: John Wiley & Sons, Inc. Disponible en: http://doi.wiley.com/10.1002/9781118923870 [Consultado el 27 de abril de 2023].
29. DeLahunta, A, Glass, E, and Kent, M. Veterinary neuroanatomy and clinical neurology. 4ª ed. St. Louis: Elsevier (2015). 545 págs.
30. Kang, YP, Yu, J, Huh, Y, Oh, JH, Kwon, CH, Lee, SJ, et al. Desarrollo del método de cromatografía líquida de alta resolución-detección ultravioleta para el cribado de mebendazol, clorsulón, diaveridina y ácido tolfenámico en muestras de alimentos de origen animal: determinación de medicamentos veterinarios por HPLC. Prueba de drogas anal. (2014) 6:246–56. DOI: 10.1002/DTA.1467
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Bistoletti, M, Moreno, L, Alvarez, L, and Lanusse, C. Multiresidue HPLC method to measure benzimidazole antihelmintics in plasma and egg from burning hens. Evaluación de perfiles de residuos de metabolitos de albendazol. Química de alimentos. (2011) 126:793–800. doi: 10.1016/j.foodchem.2010.11.084
32. Rummel, N, Chung, I, and Shaikh, B. Determination of albendazole, fenbendazole, and their metabolites in mouse plasma by high performance liquid chromatography using fluorescence and ultravioleta detection. J Liq Chromatogr Relat Technol. (2011) 34:2211–23. doi: 10.1080/10826076.2011.587219
33. Xiao, X, Zhao, Y, Zhou, Y, and Wang, Z. Plasma pharmacokinetics and muscle residue dynamics of mebendazole in Carassius auratus. J Vet Pharmacol Therap. (2017) 40:670–4. DOI: 10.1111/JVP.12398
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Klausz, G, Keller, É, Sára, Z, Székely-Körmöczy, P, Laczay, P, Ary, K, et al. Determinación simultánea de praziquantel, embonato de pirantel, febantel y sus metabolitos activos, oxfendazol y fenbendazol, en plasma de perro por cromatografía líquida/espectrometría de masas: determinación simultánea de tres antihelmínticos en plasma de perro por LC-MS. Cromatografía Biomédica. (2015) 29:1859–65. DOI: 10.1002/BMC.3507
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Permana, AD, Tekko, IA, McCarthy, HO, y Donnelly, RF. Nuevo método HPLC-MS para la cuantificación rápida y simultánea de metabolitos de doxiciclina, dietilcarbamazina y albendazol en plasma y órganos de ratas después de la administración oral concomitante. J Pharm Biomed Anal. (2019) 170:243–53. doi: 10.1016/j.jpba.2019.03.047
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: perro, glioma, mebendazol, farmacocinética, plasma, líquido cefalorraquídeo
Cita: Yanke AB, Day KE, Taylor AR, Cruz-Espindola C y Boothe DM (2023) Farmacocinética de mebendazol en plasma y líquido cefalorraquídeo después de una dosis oral única en perros sanos. Frente. Vet. Sci. 10:1231769. doi: 10.3389/fvets.2023.1231769
Recibido: 30 de mayo de 2023; Aprobado: 08 Agosto 2023;
Publicado: 28 agosto 2023.
Editado por:
R. Timothy Bentley, Universidad de Purdue, Estados Unidos
Revisado por:
Kari Foss, Universidad de Illinois en Urbana-Champaign, Estados Unidos Sami Al-Nadaf, Universidad de California, Davis, Estados
Unidos
Derechos de autor © 2023 Yanke, Day, Taylor, Cruz-Espindola y Boothe. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Amy B. Yanke, aby0003@auburn.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía
