Farmacocinética de una infusión intravenosa continua de hidromorfona en perros sanos
Farmacocinética de una infusión intravenosa continua de hidromorfona en perros sanos
 Candace Wimbish1
Candace Wimbish1  Alex M. Lynch1*
Alex M. Lynch1*  Heather K. Knych2
Heather K. Knych2  Yu Ueda1
Yu Ueda1  Kristen M. Mensajero3*
Kristen M. Mensajero3*- 1Departamento de Ciencias Clínicas, Facultad de Medicina Veterinaria, Universidad Estatal de Carolina del Norte, Raleigh, Carolina del Norte, Estados Unidos
- 2Laboratorio de Química Analítica Equina K.L. Maddy, Facultad de Medicina Veterinaria, Universidad de California, Davis, Davis, CA, Estados Unidos
- 3Departamento de Ciencias Biomédicas Moleculares, Facultad de Medicina Veterinaria, Universidad Estatal de Carolina del Norte, Raleigh, Carolina del Norte, Estados Unidos
Introducción: Las recomendaciones de dosificación para la infusión intravenosa de velocidad constante (IRC) de hidromorfona se derivan de simulaciones después de la administración de bolo IV. Si bien este régimen de dosis extrapolado se ha descrito clínicamente, aún no se ha descrito la farmacocinética (PK) de las infusiones de hidromorfona en perros. El objetivo del estudio fue describir la farmacocinética de la hidromorfona en perros sanos que recibieron un bolo intravenoso seguido de una IRC intravenosa durante 48 h.
Métodos: Se realizó un estudio experimental prospectivo que consistió en la administración de hidromorfona (0,1 mg/kg en bolo IV y luego CRI IV 0,01 mg/kg/h durante un período de 48 h) a 6 perros Beagle sanos. Las muestras de sangre se recogieron en 16 momentos entre 0 y 58 h en relación con el bolo inicial. Las concentraciones plasmáticas de hidromorfona se analizaron mediante cromatografía líquida de alta presión con detección por espectrometría de masas en tándem. Las estimaciones de los parámetros farmacocinéticos se obtuvieron con métodos compartimentales utilizando software disponible comercialmente.
Resultados: Se utilizó un modelo de dos compartimentos con eliminación de primer orden. Al final de la infusión, la mediana (rango) de las concentraciones plasmáticas de hidromorfona fue de 6,8 (5,5–19,6) ng/ml. La mediana del aclaramiento corporal total fue de 30,4 (19,8–36,7) ml/min/kg; el volumen de distribución en estado estacionario fue de 4,5 (3,2–7,8) L/kg; y la vida media de eliminación terminal fue de 11,2 (7,6-24,3) h.
Conclusión: La hidromorfona (0,1 mg/kg en bolo intravenoso y luego IRC intravenosa de 0,01 mg/kg/h) mantuvo las concentraciones plasmáticas en estado estacionario por encima del objetivo analgésico humano mínimo en perros Beagle sanos con efectos secundarios mínimos. Se necesitan más estudios para determinar las concentraciones plasmáticas efectivas de hidromorfona en perros dolorosos.
1 Introducción
El dolor no mitigado puede dar lugar a efectos fisiológicos adversos que aumentan la morbilidad del paciente, así como un impacto negativo en el bienestar (1, 2). Los opioides son el núcleo de las estrategias efectivas de manejo del dolor agudo en perros, y la hidromorfona es utilizada por el 72% de los veterinarios para este propósito (3). La hidromorfona tiene un gran volumen de distribución y se elimina rápidamente en perros, lo que significa que es necesaria una dosis frecuente en bolo para lograr concentraciones plasmáticas sostenidas y terapéuticamente efectivas (4). La hidromorfona administrada a una dosis de 0,1 mg/kg IV cada 2 h proporciona un efecto antinociceptivo adecuado en perros (4-6). Si bien la administración intravenosa (IV) en bolo de hidromorfona es rentable y confiable, la administración repetida en bolo requiere mucha mano de obra, corre el riesgo de picos y valles en el efecto analgésico y se asocia con efectos adversos que incluyen náuseas, emesis, vocalización y jadeo (7). Una infusión intravenosa de velocidad continua (IRC) de hidromorfona podría superar algunos, si no todos, de estos problemas. También existe una necesidad emergente de desarrollar nuevos regímenes de dosificación de opioides para animales pequeños. Algunos opioides son prohibitivamente caros en perros grandes, o ha habido problemas recientes en la cadena de suministro que han llevado a una disponibilidad inconsistente de opioides y, por último, existen serias preocupaciones sobre el uso de ciertos opioides debido al riesgo de desvío humano (3).
Se ha descrito la farmacocinética (PK) de varios protocolos de IRC intravenosa opioide en perros, pero la farmacocinética de la hidromorfona administrada por esta vía aún no se ha investigado, a pesar de las descripciones clínicas de su uso en perros (7). Estudios farmacológicos previos sugieren tasas de IRC intravenosa de 0,03 mg/kg/h para alcanzar y mantener concentraciones plasmáticas de 4 ng/ml, pero estas recomendaciones se basan en estudios de dosificación en bolo intravenoso único en los que se encontró que el aclaramiento era muy alto después de una dosis única (5, 6). Estas tasas sugeridas podrían ser demasiado altas en base al trabajo piloto realizado por nuestro grupo en un estudio que evaluó un bolo intravenoso único de hidromorfona y el uso de un dispositivo de administración subcutánea continua (8). Las infusiones de fentanilo tienen una acumulación variable en los perros dependiendo de la duración de la infusión, un fenómeno descrito como el tiempo medio sensible al contexto, de modo que cuanto más larga sea la infusión, mayor será la vida media de eliminación y, por lo tanto, el tiempo para compensar el efecto (9). Es plausible, pero se desconoce, si la hidromorfona administrada por el CRI podría comportarse de manera similar.
Por lo tanto, el objetivo principal de este estudio fue describir los parámetros farmacocinéticos de la hidromorfona después de un CRI intravenoso de 48 h administrado a perros sanos. Los objetivos secundarios del estudio fueron evaluar las puntuaciones seriadas de náuseas y sedación en los perros a los que se les administró hidromorfona.
2 Materiales y métodos
2.1 Animales
Se inscribieron seis perros Beagle criados con fines específicos. Hubo 4 perros machos castrados y 2 hembras esterilizadas, con un peso medio de 12,2 ± 2,6 kg y una edad media de 5,8 ± 2,6 años. Estos perros fueron evaluados como sanos en función de los hallazgos del examen físico y los análisis de laboratorio de rutina, incluido el hemograma completo y los perfiles bioquímicos séricos. Los perros fueron alojados en el Laboratorio de Recursos Animales de la Universidad Estatal de Carolina del Norte, donde se les proporcionó una dieta de mantenimiento dos veces al día, junto con agua ad libitum. El estudio fue aprobado por el Comité Institucional de Cuidado y Uso de Animales (Protocolo número 19-814-O).
2.2 Diseño del estudio
Para el estudio se utilizó un diseño experimental prospectivo. Un día antes del inicio del estudio, todos los perros fueron sedados con 125 mg/m2 dexmedetomidina1 se administra mediante inyección intramuscular para facilitar la colocación de un catéter de 18-Ga y 12 cm de un solo lumen para la toma de muestras de sangre seriadas2 en la vena yugular externa derecha o izquierda mediante una técnica de Seldinger modificada (10). Después de la colocación exitosa del catéter de muestreo, cada perro recibió 0,05 mg/kg de atipamezol por inyección intramuscular3 para antagonizar los efectos de la dexmedetomidina. Los catéteres de muestreo se mantuvieron mediante lavado con solución salina al 0,9% a intervalos de 6 h. El día del inicio del estudio, se colocó un catéter intravenoso periférico de 18 Ga4 se colocó en la vena cefálica derecha o izquierda de cada perro para ser utilizado para la hidromorfona5 administración.
Cada perro recibió un bolo de hidromorfona de 0,1 mg/kg IV, seguido inmediatamente de un IRC IV a razón de 0,01 mg/kg/h durante un período continuo de 48 h. La dosis de 0,01 mg/kg/h se basó en el trabajo preliminar realizado por nuestro grupo (8). Se obtuvieron muestras de sangre de los catéteres yugulares precolocados en 12 puntos de tiempo relativos a la administración del bolo de hidromorfona, correspondientes al valor basal (0 h), 0,08 h, 1 h, 2 h, 4 h, 8 h, 12 h, 18 h, 24 h, 30 h, 32 h, 40 h y 48 h. A las 48 h, se suspendió el CRI de hidromorfona IV y se obtuvieron otras 4 muestras de sangre durante las 10 h siguientes. Estos correspondieron a 50 h, 52 h, 55 h y 58 h en relación con el bolo inicial de hidromorfona. Los catéteres de muestreo se retiraron después de recolectar la muestra de sangre final.
Los perros fueron monitoreados continuamente durante el período de estudio. En cada momento, se registraron los signos vitales (frecuencia cardíaca y respiratoria), junto con las puntuaciones de sedación y náuseas previamente descritas en perros (11, 12). Brevemente, la puntuación de sedación consistió en la evaluación seriada de siete características del paciente: postura espontánea; reflejo palpebral; posición de los ojos; relajación de la mandíbula y la lengua; respuesta a la estimulación auditiva; resistencia a ser acostado en decúbito lateral; y comportamiento general (Cuadro complementario S1). La puntuación de náuseas, que siempre se realizaba antes de la puntuación de sedación, incluía una escala analógica visual basada en la evaluación por parte del operador de los signos de salivación, lamido de labios, letargo, inquietud, comportamiento circular y vómitos (Tabla suplementaria S2).
Además, se registraron los problemas relacionados con la administración del fármaco (p. ej., obstrucciones en el flujo de IRC intravenoso) si se produjeron.
2.3 Toma de muestras de sangre y análisis farmacocinético
Las muestras de sangre recogidas en cada momento se transfirieron a tubos de plástico que contenían heparina de litio6 y se colocan en hielo. Las muestras se centrifugaron a 3.500 ×g durante 10 min a 4°C dentro de los 60 min posteriores a la recolección. El plasma de las muestras centrifugadas se separó y se transfirió a crioviales de almacenamiento7 y almacenado a -80 °C hasta el análisis dentro de los 2 meses posteriores a la recolección.
Las concentraciones de hidromorfona se midieron utilizando métodos de cromatografía líquida y espectrometría de masas en tándem (LC-MS/MS) publicados anteriormente (13). Brevemente, para la cuantificación de hidromorfona, se realizó una validación parcial utilizando plasma canino como matriz. Para ambos analitos, los calibradores y las muestras de control negativo se prepararon frescas para cada ensayo cuantitativo. Además, se incluyeron muestras de control de calidad [plasma canino libre de fármacos fortificado con hidromorfona a tres concentraciones dentro de la curva estándar, alta, media y baja (160, 35, 0,3 ng/mL, respectivamente) con cada conjunto de muestras como una comprobación adicional de la precisión]. El límite de cuantificación (LOQ) fue de 0,1 ng/mL. El límite de detección (LOD) fue de 0,05 ng/mL. Se utilizó D3-hidromorfona como patrón interno. La respuesta para la hidromorfona fue lineal con un coeficiente de correlación de 0,99 entre 0,1 y 200 ng/mL, y todos los calibradores y controles de calidad se calcularon hacia atrás dentro del ±15% de las concentraciones nominales. Los parámetros farmacocinéticos de la hidromorfona se obtuvieron utilizando un software disponible en el mercado.8 Se evaluaron diferentes modelos compartimentales y opciones de ponderación para determinar la bondad del ajuste mediante la inspección visual de las gráficas observadas frente a las predichas, las gráficas residuales ponderadas frente a las observadas y predichas, y la comparación de los valores del criterio de información de Akaike. Todos los datos se incluyeron en los modelos farmacocinéticos, incluidas las muestras atípicas conocidas cuando se encontró que las líneas de infusión estaban ocluidas. Se determinó un modelo de infusión IV en bolo IV de dos compartimentos parametrizado por constantes de microtasa y ponderado por 1/Y*Y para describir mejor los datos.
2.4 Análisis estadístico
Se utilizó estadística descriptiva para resumir las concentraciones plasmáticas de hidromorfona y los resultados farmacocinéticos.9 Se utilizó una concentración plasmática de hidromorfona diana de 4 ng/ml para indicar las concentraciones mínimas de eficacia, basándose en datos humanos que indican un efecto antinociceptivo a esta concentración, aunque ningún estudio farmacodinámico ha confirmado esta diana (14, 15).
3 Resultados
Todos los perros completaron el estudio sin efectos adversos graves. La frecuencia cardíaca y la frecuencia respiratoria a lo largo del estudio se muestran en las figuras 1 y 2. La mediana (rango) de la frecuencia cardíaca durante la administración de hidromorfona fue de 88 (50-126) latidos/min, mientras que la mediana (rango) de la frecuencia respiratoria fue de 19 (12-52) respiraciones/min. Se observó jadeo después del bolo inicial de hidromorfona en cada perro, pero disminuyó sin más episodios de jadeo durante el período de estudio restante.
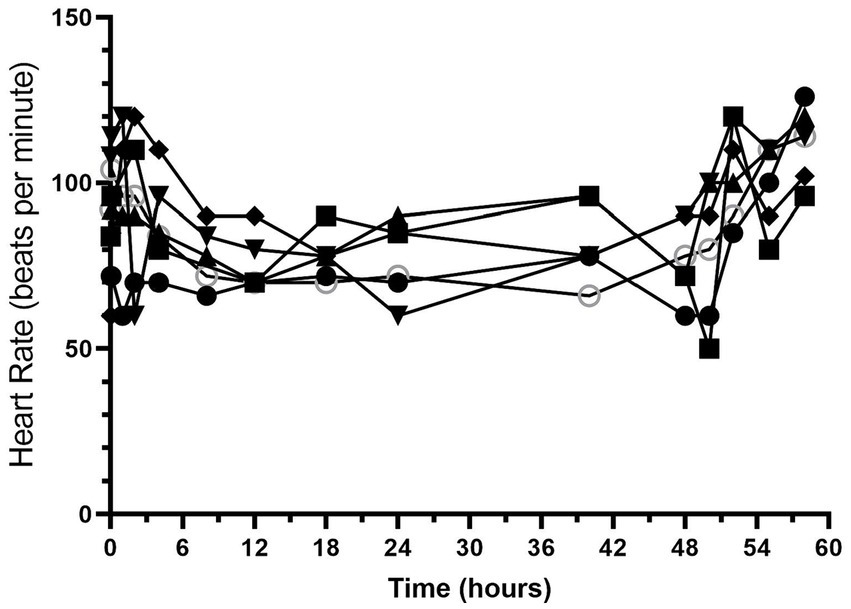 Figura 1. Frecuencia cardíaca (latidos/min) frente al tiempo (horas) de 6 perros durante la duración del estudio (0-60 h). A cada perro se le administró un bolo intravenoso de hidromorfona (0,1 mg/kg) seguido de una infusión intravenosa de hidromorfona a velocidad constante (0,01 mg/kg/h) durante 48 h.
Figura 1. Frecuencia cardíaca (latidos/min) frente al tiempo (horas) de 6 perros durante la duración del estudio (0-60 h). A cada perro se le administró un bolo intravenoso de hidromorfona (0,1 mg/kg) seguido de una infusión intravenosa de hidromorfona a velocidad constante (0,01 mg/kg/h) durante 48 h.
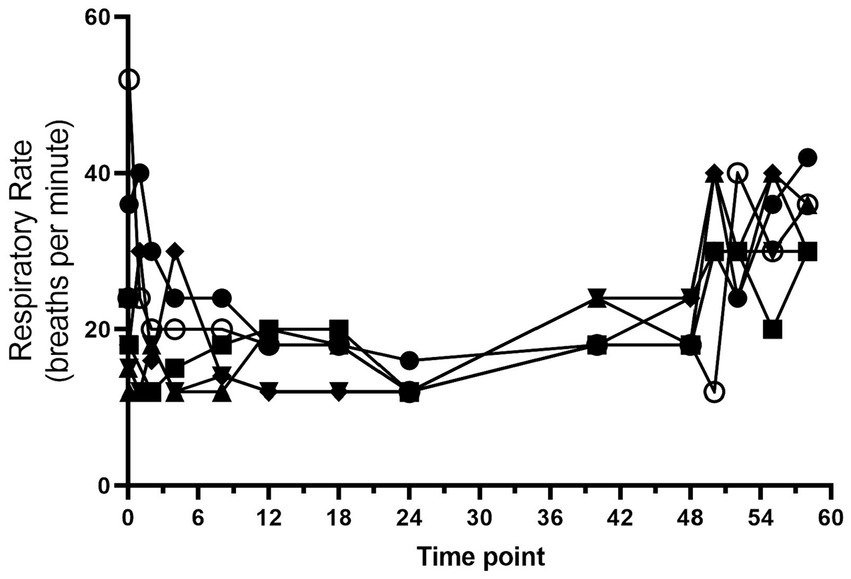 Figura 2. Frecuencia respiratoria (respiraciones/min) frente al tiempo (horas) de 6 perros durante la duración del estudio (0-60 h). A cada perro se le administró un bolo intravenoso de hidromorfona (0,1 mg/kg) seguido de una infusión intravenosa de hidromorfona a velocidad constante (0,01 mg/kg/h) durante 48 h.
Figura 2. Frecuencia respiratoria (respiraciones/min) frente al tiempo (horas) de 6 perros durante la duración del estudio (0-60 h). A cada perro se le administró un bolo intravenoso de hidromorfona (0,1 mg/kg) seguido de una infusión intravenosa de hidromorfona a velocidad constante (0,01 mg/kg/h) durante 48 h.
Las puntuaciones de sedación se muestran en la Figura 3 y en la Tabla Suplementaria S2. La mediana (rango) de la puntuación de sedación al inicio fue de 1 (1–2). Las puntuaciones de sedación aumentaron después de la administración de hidromorfona y se mantuvieron más altas que los valores basales durante la administración del CRI de hidromorfona. La mediana (rango) de la puntuación de sedación durante el CRI de hidromorfona fue de 6 (2,5-11). La mediana (rango) de la puntuación de sedación después de la interrupción de la hidromorfona fue de 0,8 (0-6).
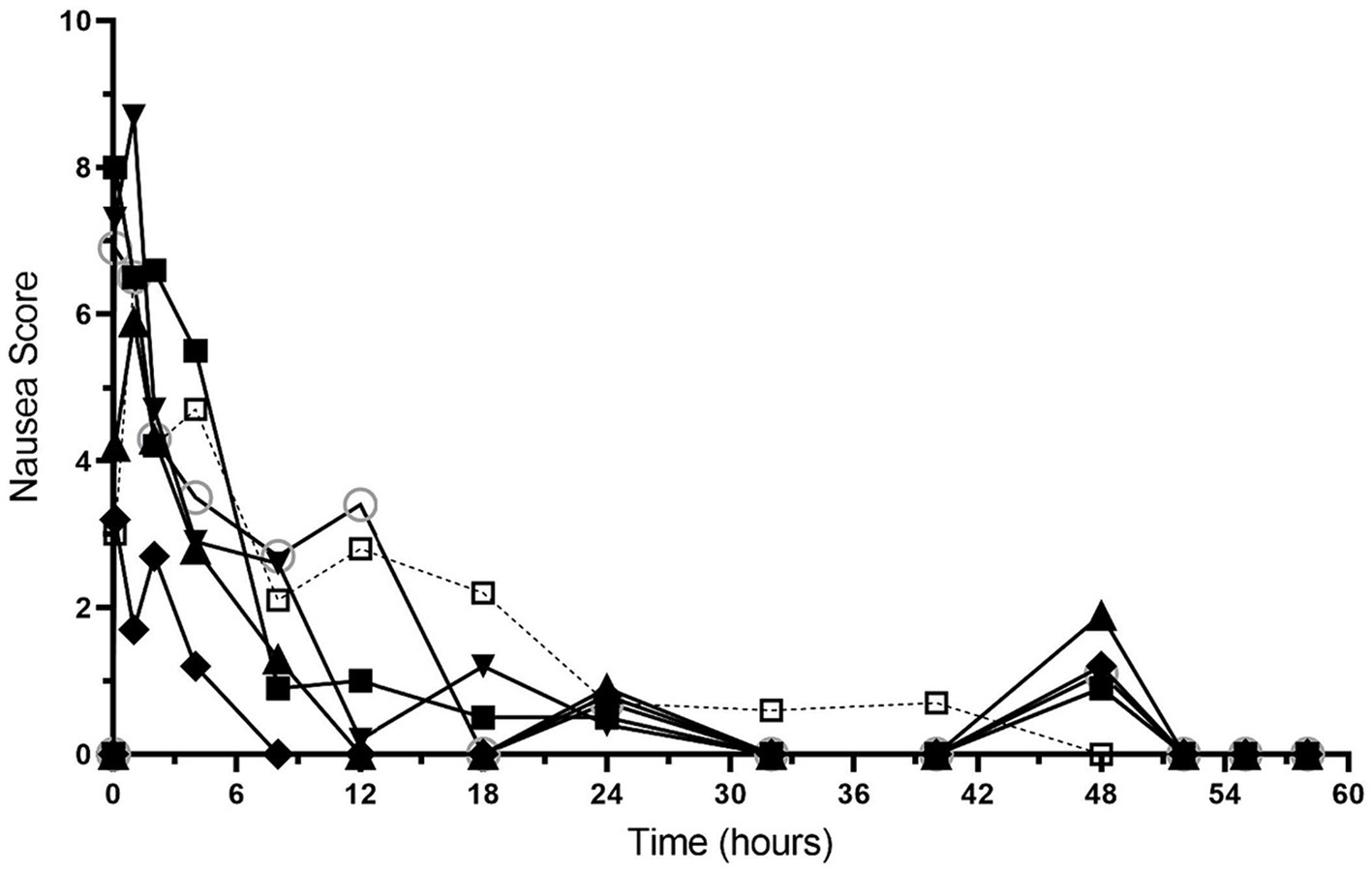 Figura 3. Puntuaciones de náuseas en función del tiempo (horas) de 6 perros durante la duración del estudio (0-60 h). A cada perro se le administró un bolo intravenoso de hidromorfona (0,1 mg/kg) seguido de una infusión intravenosa de hidromorfona a velocidad constante (0,01 mg/kg/h) durante 48 h.
Figura 3. Puntuaciones de náuseas en función del tiempo (horas) de 6 perros durante la duración del estudio (0-60 h). A cada perro se le administró un bolo intravenoso de hidromorfona (0,1 mg/kg) seguido de una infusión intravenosa de hidromorfona a velocidad constante (0,01 mg/kg/h) durante 48 h.
Las puntuaciones de náuseas se muestran en la Figura 4 y en la Tabla Suplementaria S3. Todos los perros tuvieron puntuaciones de náuseas de 0 (sin náuseas) al inicio del estudio, que aumentaron después de la administración del bolo de hidromorfona. La mediana (rango) de las puntuaciones de náuseas fue de 4,9 (1,2-8,7) durante las primeras 4 h después de la administración de hidromorfona y de 0,5 (0-3,5) entre los 8-48 h. Se registraron puntuaciones de náuseas de 0 después de la interrupción de la infusión de hidromorfona.
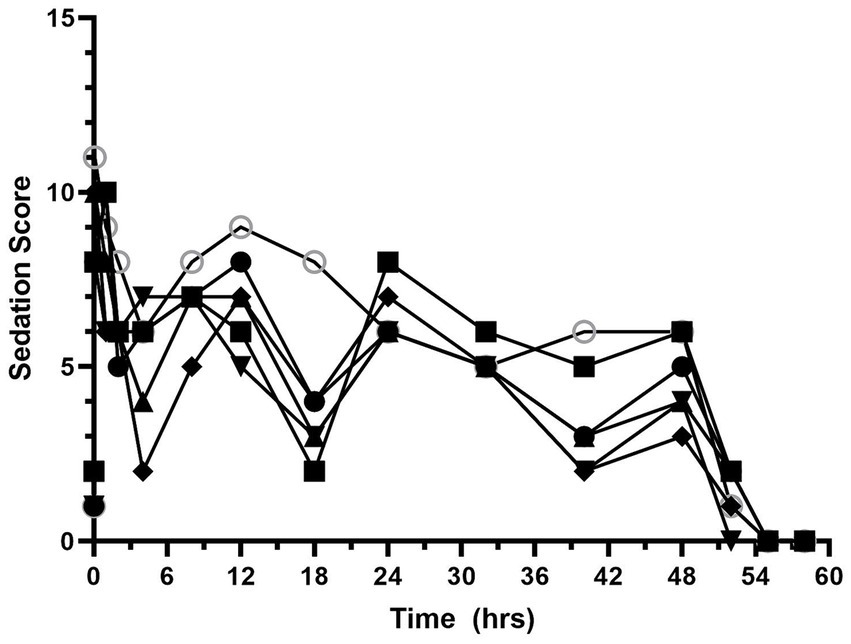 Figura 4. Puntuaciones de sedación en función del tiempo (horas) de 6 perros durante la duración del estudio (0-60 h). A cada perro se le administró un bolo intravenoso de hidromorfona (0,1 mg/kg) seguido de una infusión intravenosa de hidromorfona a velocidad constante (0,01 mg/kg/h) durante 48 h.
Figura 4. Puntuaciones de sedación en función del tiempo (horas) de 6 perros durante la duración del estudio (0-60 h). A cada perro se le administró un bolo intravenoso de hidromorfona (0,1 mg/kg) seguido de una infusión intravenosa de hidromorfona a velocidad constante (0,01 mg/kg/h) durante 48 h.
3.1 Farmacocinética
Al final del IRC intravenoso, la mediana de las concentraciones plasmáticas de hidromorfona fue de 6,8 ng/ml (mín.-máx. 5,5-19,6 ng/ml). Hubo cierta variabilidad en las concentraciones plasmáticas del fármaco a lo largo del tiempo en algunos perros (Figura 5; Figura suplementaria S1), aunque se observaron aumentos ocasionales en las concentraciones durante las perfusiones en algunos perros después de corregir las obstrucciones de la línea de perfusión. Un IRC intravenoso administrado a 0,01 mg/kg/h dio lugar a concentraciones plasmáticas de hidromorfona por encima de la diana terapéutica humana (4 mg/ml) durante todo el estudio. Las concentraciones de hidromorfona disminuyeron rápidamente después de la interrupción. Los parámetros farmacocinéticos derivados de los datos se muestran en la Tabla 1.
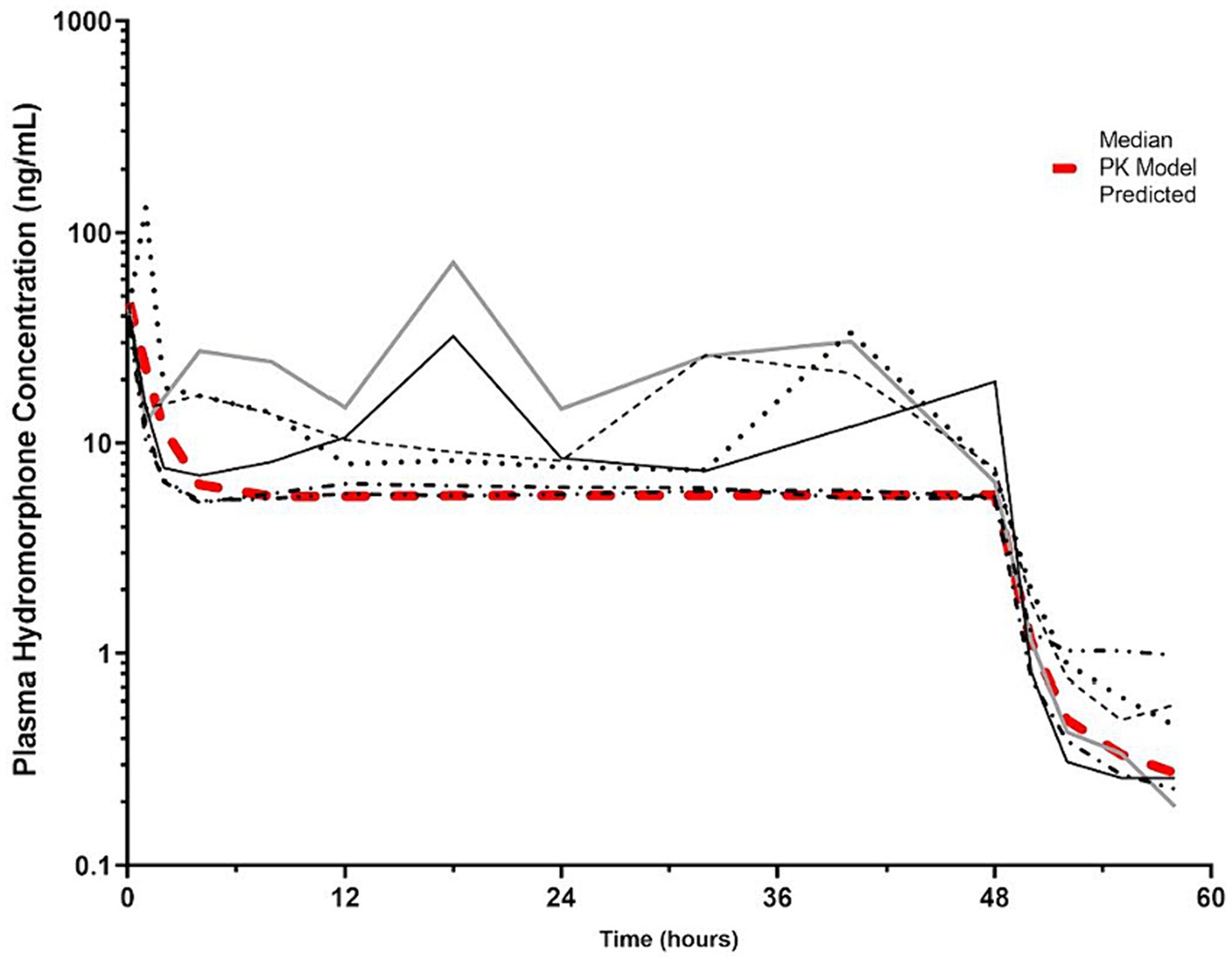 Figura 5. Concentraciones plasmáticas de hidromorfona (ng/mL) en función del tiempo (horas) de 6 perros durante la duración del estudio (0-60 h). A cada perro se le administró un bolo intravenoso de hidromorfona (0,1 mg/kg) seguido de una infusión intravenosa de hidromorfona a velocidad constante (0,01 mg/kg/h) durante 48 h. El modelo farmacocinético predicho se indica mediante la línea roja con hash. La concentración plasmática (4 ng/mL) que se ha notificado que tiene el efecto antinociceptivo mínimo en las personas se indica mediante la línea punteada (15).
Figura 5. Concentraciones plasmáticas de hidromorfona (ng/mL) en función del tiempo (horas) de 6 perros durante la duración del estudio (0-60 h). A cada perro se le administró un bolo intravenoso de hidromorfona (0,1 mg/kg) seguido de una infusión intravenosa de hidromorfona a velocidad constante (0,01 mg/kg/h) durante 48 h. El modelo farmacocinético predicho se indica mediante la línea roja con hash. La concentración plasmática (4 ng/mL) que se ha notificado que tiene el efecto antinociceptivo mínimo en las personas se indica mediante la línea punteada (15).
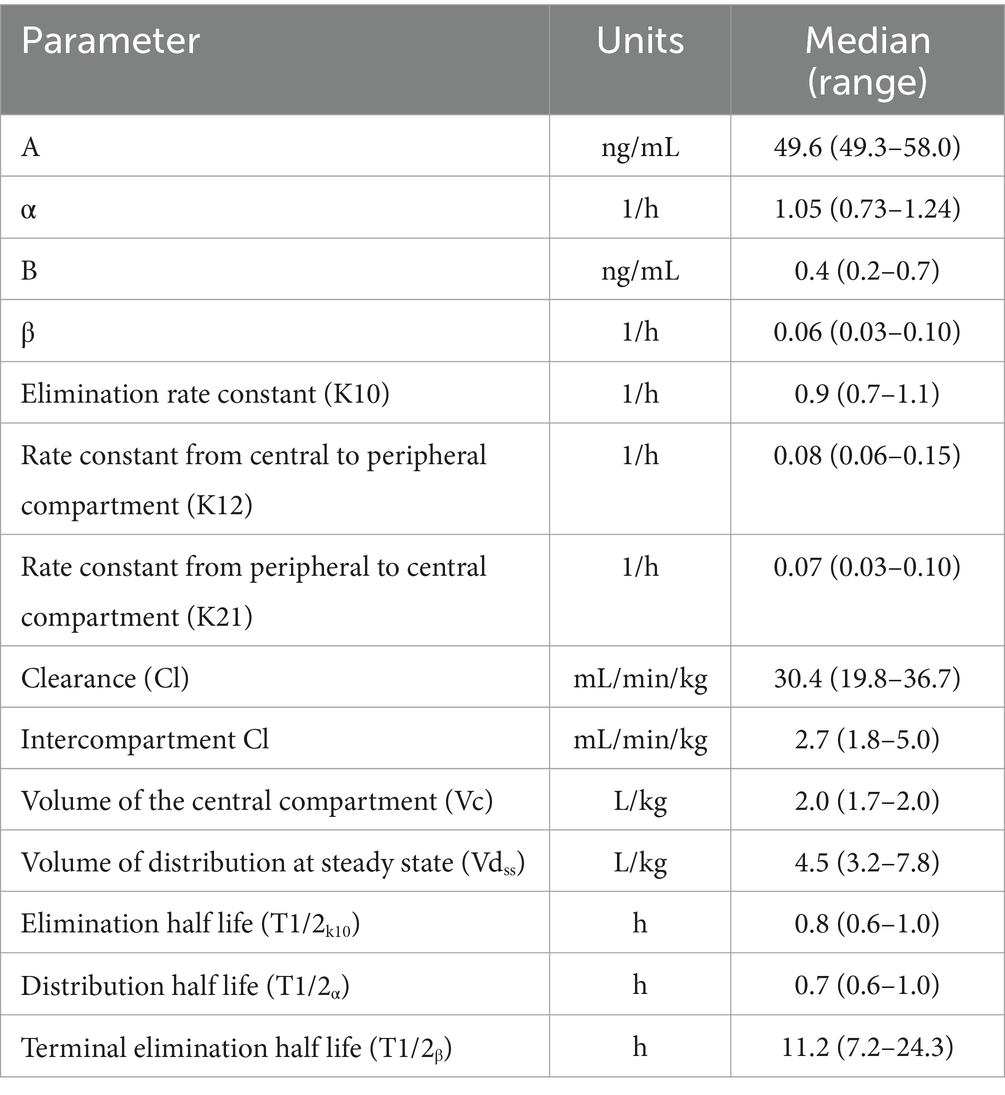 Tabla 1. Parámetros farmacocinéticos después de un bolo intravenoso de 0,1 mg/kg de hidromorfona seguido de una infusión intravenosa de velocidad constante de 0,01 mg/kg/h de hidromorfona durante 48 h en 6 perros.
Tabla 1. Parámetros farmacocinéticos después de un bolo intravenoso de 0,1 mg/kg de hidromorfona seguido de una infusión intravenosa de velocidad constante de 0,01 mg/kg/h de hidromorfona durante 48 h en 6 perros.
4 Discusión
Nuestro estudio experimental prospectivo fue diseñado para caracterizar los perfiles de farmacocinética de hidromorfona administrada por IRC IV durante un período de 48 h en perros sanos. Nuestros datos identificaron que un bolo intravenoso inicial de 0,1 mg/kg de hidromorfona, seguido inmediatamente de un IRC intravenoso de 0,01 mg/kg/h, mantuvo concentraciones plasmáticas en estado estacionario entre 8 y 12 ng/mL. Esto está por encima de la concentración plasmática mínima efectiva asociada con un efecto antinociceptivo en personas (4 ng/mL) (14, 15). En este estudio se observaron efectos adversos mínimos en los perros a los que se les administró el CRI de hidromorfona IV. Los perros fueron levemente sedados, pero con un impacto mínimo en la frecuencia respiratoria. Se observó una breve duración de las náuseas después de la administración de hidromorfona. No hubo acumulación aparente de fármaco durante la infusión y las concentraciones plasmáticas disminuyeron rápidamente una vez que se suspendió la perfusión. Mientras que la vida media de eliminación terminal (T1/2β) se calculó en casi 12 h, este hallazgo probablemente se deba a la sensibilidad del ensayo utilizado en este estudio (LOQ de 0,1 ng/ml en comparación con concentraciones más altas en informes anteriores) y es poco probable que estas concentraciones plasmáticas proporcionen analgesia clínicamente relevante (<1 ng/ml). Los resultados de nuestro estudio sugieren que las recomendaciones previas para dosis de hidromorfona IRC intravenosa (0,03 mg/kg/h) son más altas de lo necesario para alcanzar las dianas terapéuticas humanas de hidromorfona. Es necesario seguir trabajando para investigar si el objetivo humano también es apropiado para los perros.
Las infusiones de velocidad constante se utilizan para lograr una concentración plasmática constante de un fármaco y pueden minimizar los efectos adversos de los medicamentos en comparación con su uso con la dosificación en bolo. La hidromorfona intravenosa presenta un aclaramiento rápido y una vida media corta en perros, lo que hace que su administración sea ideal para el IRC. Previamente se evaluó la farmacocinética de la dosificación en bolo intravenoso de hidromorfona (4, 6). Estos datos se utilizaron para extrapolar que un IRC de 0,03 mg/kg/h alcanzaría 4 ng/mL en estado estacionario en 2 h (6). Los datos preliminares basados en un estudio de infusión subcutánea postularon que el CRI de 0,03 mg/kg/h puede ser superior al necesario para alcanzar los niveles terapéuticos (8). No existen estudios previos del CRI sobre la hidromorfona en perros, pero los estudios que informaron datos de bolo intravenoso único se compararon con nuestros resultados. Algunas estimaciones de parámetros de nuestro estudio son similares a estudios previos de bolo IV en perros que utilizaron análisis compartimentales o no compartimentales y perros Beagle (4, 6). Por ejemplo, el volumen de distribución en estado estacionario (Vdss) en nuestro estudio fue de 4,5 L/kg. Los valores de Vdss previamente informados después de un bolo de 0,1 mg/kg fueron de 4,2 L/kg (6), 4,5 L/kg (4) y 7,2 L/kg para un bolo de 0,2 mg/kg (4). Hubo diferencias interesantes en el aclaramiento corporal total en comparación con los valores informados anteriormente. Nuestros resultados revelaron un aclaramiento de 30,4 ml/min/kg, que es casi idéntico al flujo sanguíneo hepático en el perro (32 ml/min/kg) (16, 17). Estudios previos informaron de 106 ml/min/kg (6) y 68 ml/min/kg (4), que era mucho mayor que el flujo sanguíneo hepático y, aunque los autores especularon que el metabolismo extrahepático podría explicar estos valores, esto nunca se ha investigado. La hidromorfona es metabolizada por el hígado y los perros son bien conocidos por su capacidad para metabolizar los fármacos opioides (18). Las diferencias en los ensayos analíticos, los métodos farmacocinéticos y los regímenes de dosificación pueden explicar la variación informada en el aclaramiento, y tal vez estudios adicionales podrían ayudar a caracterizar mejor el aclaramiento de hidromorfona.
La hidromorfona es un agonista opioide mu que es siete veces más potente que la morfina. Se ha descrito la calidad y eficacia de la analgesia proporcionada a los perros por la hidromorfona en comparación con el fentanilo, el butorfanol y la oximorfona (7, 19, 20). Sin embargo, se han reportado numerosos efectos adversos con los bolos de hidromorfona, incluyendo náuseas, vómitos, defecación, excitación, disforia, jadeo, bradicardia y depresión respiratoria (18). En nuestro estudio, las puntuaciones de náuseas aumentaron durante las primeras 4 h de infusión de hidromorfona, lo que correspondió a concentraciones plasmáticas entre 9 y 41 ng/mL. Curiosamente, las puntuaciones de náuseas volvieron rápidamente a valores basales casi normales, mientras que los perros tuvieron puntuaciones de sedación más altas durante la duración de la infusión. Las puntuaciones de sedación fueron consistentes con las observaciones de perros que estaban subjetivamente tranquilos, alertas y receptivos. Todavía no se conoce el efecto sedante de la hidromorfona CRI en perros sistémicamente enfermos o cuando se combina con otros fármacos sedantes. Existe la posibilidad de un mayor riesgo de efectos adversos en estos casos (p. ej., riesgo de aspiración).
Hay varias limitaciones de este estudio, incluyendo el pequeño número de perros investigados y la uniformidad de esta cohorte de perros (perros Beagle de un peso corporal similar). Si bien esta homogeneidad es preferible para la evaluación farmacocinética, ya que limita la variabilidad en los datos, también excluye las diferencias que podrían observarse en otras razas, conformaciones o composición genética de los perros. Si bien anticipamos que los resultados de este estudio se pueden aplicar a poblaciones de animales que experimentan dolor, se necesita más trabajo para evaluar la eficacia de los IRC de hidromorfona en casos clínicos.
5 Conclusión
La hidromorfona administrada en bolo intravenoso y CRI durante 48 h a una dosis de 0,01 mg/kg/h dio lugar a concentraciones plasmáticas en estado estacionario por encima de la concentración plasmática mínima efectiva en los pacientes y se eliminó rápidamente tras la interrupción de la perfusión. Se observaron efectos mínimos en las puntuaciones de náuseas y frecuencias cardíacas y respiratorias, mientras que se observó sedación durante la duración de la infusión en perros.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por la Universidad Estatal de Carolina del Norte. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
CW: Escritura – borrador original, Escritura – revisión y edición. AL: Escritura – borrador original, Escritura – revisión y edición. HK: Escritura – borrador original, Escritura – revisión y edición. YU: Escritura – borrador original, Escritura – revisión y edición. KM: Escritura – borrador original, Escritura – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1362730/full#supplementary-material
Notas
1. ^Dexdomitor, Zoetis, Parsippany, Nueva Jersey.
2. ^Catéter intravenoso de uso extendido Jorvet, Jorgensen Laboratories LLC, Loveland, CO.
3. ^Antisedan, Zoetis, Parsippany, NJ.
4. ^BD Insyte, BD Sistemas de terapia de infusión Inc., Sandy, UT.
5. ^Clorhidrato de hidromorfona, Pfizer, Nueva York, NY.
6. ^BD Vacutainer; Franklin Lakes, Nueva Jersey.
7. ^VWR International Radnor, PA, Estados Unidos.
8. ^Phoenix Winnonlin Versión 8.0; Pharsight, Nueva Jersey, Estados Unidos.
9. ^Prisma de Graphpad versión 7.04, GraphPad Inc.
Referencias
1. Gruen, ME, Lascelles, BDX, Colleran, E, Gottlieb, A, Johnson, J, Lotsikas, P, et al. 2022 Pautas de manejo del dolor de la AAHA para perros y gatos. J Am Anim Hosp Assoc. (2022) 58:55–76. doi: 10.5326/JAAHA-MS-7292
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Mathews, K, Kronen, PW, Lascelles, D, Nolan, A, Robertson, S, Steagall, PV, et al. Directrices para el reconocimiento, la evaluación y el tratamiento del dolor: miembros del Consejo Mundial del Dolor de la WSAVA y coautores de este documento. J Pequeña Anim Pract. (2014) 55:E10–68. doi: 10.1111/jsap.12200
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Kogan, L, Hellyer, P, Rishniw, M, y Schoenfeld-Tacher, R. La epidemia de opioides en EE. UU. y su impacto en los veterinarios de medicina general de EE. UU. Front Vet Sci. (2019) 6:222. doi: 10.3389/fvets.2019.00222
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Guedes, AGP, Papich, MG, Rude, EP y Rider, MA. Farmacocinética y efectos fisiológicos de la hidromorfona intravenosa en perros conscientes. J Vet Pharmacol Ther. (2008) 31:334–43. doi: 10.1111/j.1365-2885.2008.00966.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Smith, LJ, KuKanich, B, Hogan, BK, Brown, C, Heath, TD y Krugner-Higby, LA. Farmacocinética de una hidromorfona encapsulada en liposomas de liberación controlada administrada a perros sanos. J Vet Pharmacol Ther. (2008) 31:415–22. doi: 10.1111/j.1365-2885.2008.00974.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. KuKanich, B, Hogan, BK, Krugner-Higby, LA, y Smith, LJ. Farmacocinética del clorhidrato de hidromorfona en perros sanos. Veterinario Anaesth Analg. (2008) 35:256–64. doi: 10.1111/j.1467-2995.2007.00379.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Biello, P, Bateman, SW y Kerr, CL. Comparación de infusiones de fentanilo e hidromorfona de tasa constante para el manejo del dolor en perros en una unidad de cuidados intensivos. Veterinario Anaesth Analg. (2018) 45:673–83. doi: 10.1016/j.vaa.2018.05.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Messenger, K, Enomot, H, Knych, H y Papich, M. Farmacocinética de la hidromorfona en perros después de un bolo intravenoso y administrado por vía subcutánea con la bomba de infusión RxActuator Mini-infuser®. Veterinario Anaesth Analg. (2021) 48:S995-6. doi: 10.1016/j.vaa.2021.08.032
9. Sano, T, Nishimura, R, Kanazawa, H, Igarashi, E, Nagata, Y, Mochizuki, M, et al. Farmacocinética del fentanilo después de una inyección intravenosa única y una infusión de velocidad constante en perros. Veterinario Anaesth Analg. (2006) 33:266–73. doi: 10.1111/j.1467-2995.2005.00266.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Portillo, E, Mackin, A, Hendrix, PK, Boyle, C, y Chrestman, L. Comparación de las técnicas de Seldinger modificado y colocación de catéter yugular a través de la aguja en el perro. J Vet Emerg Crit Care. (2006) 16:88–95. doi: 10.1111/j.1476-4431.2006.00147.x
11. Wagner, MC, Hecker, KG y Pang, DSJ. Niveles de sedación en perros: un estudio de validación. BMC Vet Res. (2017) 13:110. doi: 10.1186/s12917-017-1027-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. de la Puente-Redondo, VA, Tilt, N, Rowan, TG, y Clemence, RG. Eficacia de maropitant para el tratamiento y prevención de la emesis causada por la infusión intravenosa de cisplatino en perros. Am J Vet Res. (2007) 68:48–56. doi: 10.2460/ajvr.68.1.48
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Pypendop, BH, Ilkiw, JE y Shilo-Benjamini, Y. Biodisponibilidad de morfina, metadona, hidromorfona y oximorfona después de la administración bucal en gatos. J Vet Pharm Ther. (2014) 37:295–300. doi: 10.1111/jvp.12090
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Reidenberg, MM, Goodman, H, Erle, H, Gray, G, Lorenzo, B, Leipzig, RM, et al. Niveles de hidromorfona y control del dolor en pacientes con dolor crónico severo. Clin Pharmacol Ther. (1988) 44:376–82. doi: 10.1038/clpt.1988.167
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Coda, B, Tanaka, A, Jacobson, RC, Donaldson, G, y Chapman, RC. Analgesia con hidromorfona después de la administración de bolo intravenoso. Dolor. (1997) 71:41–8. doi: 10.1016/S0304-3959(97)03336-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Skerjanec, A, O’Brien, DW y Tam, TK. Mediciones del flujo sanguíneo hepático y cinética de verde de indocianina en un modelo de perro crónico. Pharm Res. (1994) 11:1511–5. doi: 10.1023/A:1018928930617
17. Davies, B y Morris, T. Parámetros fisiológicos en animales de laboratorio y humanos. Pharm Res. (1993) 10:1093–5. doi: 10.1023/A:1018943613122
18. Kukanich, B, y Wiese, AJ. Capítulo 11 opioides En: KA Grimm, LA Lamont, WJ Tranquilli, SA Greene y SA Robertson, editores. Anestesia y Analgesia Veterinaria: La Quinta Edición de Lumb y Jones. 5ª ed. Ames, IA: Wiley-Blackwell (2015). 207–26.
19. Bateman, SW, Haldane, S, y Stephens, JA. Comparación de la eficacia analgésica de la hidromorfona y la oximorfona en perros y gatos: un estudio aleatorizado ciego. Veterinario Anaesth Analg. (2008) 35:341–7. doi: 10.1111/j.1467-2995.2007.00387.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Kuo, WC y Keegan, RD. Efectos cardiovasculares, analgésicos y sedantes comparativos de la medetomidina, la medetomidina-hidromorfona y la medetomidina-butorfanol en perros. Am J Vet Res. (2004) 65:931–7. doi: 10.2460/ajvr.2004.65.931
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: infusión de velocidad constante, hidromorfona, perro, farmacocinética, dolor, opioide
Cita: Wimbish C, Lynch AM, Knych HK, Ueda Y y Messenger KM (2024) Farmacocinética de una infusión intravenosa continua de hidromorfona en perros sanos. Frente. Vet. Sci. 11:1362730. doi: 10.3389/fvets.2024.1362730
Recibido: 28 de diciembre de 2023; Aceptado: 21 de marzo de 2024;
Publicado: 15 de abril de 2024.
Editado por:
Chi-Chung Chou, Universidad Nacional Chung Hsing, Taiwán
Revisado por:
Andrew P. Woodward, Universidad de Canberra, Australia
Petra Cagnardi, Universidad de Milán, Italia
Derechos de autor © 2024 Wimbish, Lynch, Knych, Ueda y Messenger. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Alex M. Lynch, amlynch3@ncsu.edu; Kristen M. Messenger, kmmessen@ncsu.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


