Fluoruro de diamina de plata 38% en la reducción de la gingivitis en perros
Efectividad del fluoruro de diamina de plata 38% en la reducción de la gingivitis en perros: un ensayo clínico aleatorizado
 Amarett Kern1*
Amarett Kern1*  Tammy (Blanca) Rentería1
Tammy (Blanca) Rentería1  Marilynn L. Rothen2
Marilynn L. Rothen2  Lloyd A. Mancl3
Lloyd A. Mancl3  Peter Milgrom3
Peter Milgrom3- 1Inland Northwest Veterinary Dentistry and Oral Surgery, Coeur d’Alene, ID, Estados Unidos
- 2Gerente de Implementación de la Facultad de Odontología e Investigación, Centro Regional de Investigación Dental Clínica del Instituto de Ciencias de la Salud Traslacional, Universidad de Washington, Seattle, WA, Estados Unidos
- 3Departamento de Ciencias de la Salud Oral, Universidad de Washington, Seattle, WA, Estados Unidos
Introducción: La enfermedad periodontal es una enfermedad omnipresente en la medicina veterinaria de pequeños animales. Actualmente, la limpieza dental profesional regular y el cepillado diario de los dientes se consideran estándares de oro en la prevención de la enfermedad periodontal. Los esfuerzos para encontrar un preventivo no invasivo, rentable y fácil de usar para la enfermedad periodontal están en curso. El objetivo principal de este ensayo clínico aleatorizado doble ciego fue determinar si una sola aplicación de fluoruro de diamina de plata (SDF) al 38% en la superficie bucal de todos los dientes reduciría la gingivitis dentro de los 3 meses en perros con enfermedad periodontal en etapa dos.
Métodos: Veintinueve perros propiedad del cliente de 3 a 12 años de edad, 6 a 35 libras fueron aleatorizados 1: 1 en grupos activos y de control con placebo. Ambos grupos se sometieron a un tratamiento basal y un seguimiento de tres meses bajo anestesia general. El índice gingival (GI), el índice de placa (IP) y el índice de cálculo (IC) fueron evaluados y registrados en cada evento.
Resultados: Una sola aplicación de SDF 38% no redujo significativamente el IG en relación con el grupo de control. Sin embargo, la puntuación GI disminuyó significativamente en ambos grupos en relación con la línea de base, con una reducción del 53% en la puntuación GI promedio para los perros que recibieron tratamiento SDF 38% y una reducción del 44% para los perros que recibieron tratamiento con placebo. No hubo diferencias en las puntuaciones de IP o IC en comparación con los grupos control.
Conclusión: Se necesitan estudios de investigación adicionales para determinar si una aplicación más frecuente o una duración más larga del estudio producirían un resultado diferente.
Introducción
La enfermedad periodontal es una preocupación persistente en la medicina veterinaria de pequeños animales. Hasta el 80 por ciento de los perros tendrán gingivitis o periodontitis a los 2 años de edad (1). Los perros de razas pequeñas tienen un mayor riesgo (2) y el riesgo aumenta con la edad (3). La enfermedad periodontal es la causa más común de pérdida de dientes en perros (1) y su potencial para estar asociada con, o la causa de enfermedades sistémicas es una discusión en curso (4-8).
La fisiopatología de la gingivitis temprana y las etapas avanzadas de la enfermedad periodontal es el resultado de la compleja interacción entre los patógenos bacterianos y la respuesta inmune del huésped (5) a menudo exacerbada por la dentición apiñada o la maloclusión. La terapia que se dirige a un paso limitante de la velocidad a lo largo de este continuo podría reducir el riesgo de enfermedad periodontal y pérdida de dientes. El desarrollo de una terapia que previene la formación de una biopelícula de placa dental patógena es potencialmente uno de esos pasos. La gingivitis es un cambio inflamatorio reversible y es el primer cambio patológico definido en la primera etapa de la enfermedad periodontal (9). Si se puede reducir la acumulación de placa y la gingivitis, se puede disminuir el riesgo de enfermedad periodontal y pérdida de dientes.
Las limpiezas dentales profesionales regulares combinadas con el cepillado diario de los dientes son el estándar de oro para mantener la salud oral y dental (10). Las limpiezas dentales profesionales plantean desafíos para muchos propietarios debido al costo de la terapia y / o el miedo a la anestesia general. Algunas mascotas son refractarias al cepillado dental constante. Se ha informado que la adherencia del propietario a cepillarse los dientes diariamente a los perros oscila entre el 53% (11) y el 1% (12). Hay varios masticables dentales o golosinas disponibles que promocionan los beneficios para la salud oral. Sin embargo, estas afirmaciones no siempre están respaldadas por investigaciones científicas válidas. Se fomenta la medicina basada en la evidencia en odontología veterinaria para integrar la investigación clínicamente relevante y estadísticamente válida con la experiencia clínica y las necesidades del paciente (13). El Consejo de Salud Oral Veterinaria (VOHC) proporciona un recurso central para los productos veterinarios participantes, como masticables dentales, golosinas, aditivos alimentarios y de agua que se alinean con los estándares de medicina basados en la evidencia. Sin embargo, incluso en este contexto, el nivel de evidencia de efectividad puede parecer bajo. Las limitaciones comunes de los estudios sobre productos de cuidado dental aceptados son poblaciones de estudio pequeñas que impiden la generalización, plazos de seguimiento cortos y niveles basales bajos de enfermedad periodontal en la inscripción, lo que resulta en un efecto techo (14, 15). Por lo tanto, la utilidad clínica de estos productos aceptados sigue sin estar clara.
El fluoruro de diamina de plata (SDF) al 38% fue aprobado por la Administración de Alimentos y Medicamentos en 2014 como un tratamiento tópico en odontología humana (16). Desde entonces, su uso ha sido bien aceptado para prevenir y detener las caries dentales (17) y está incluido en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud (OMS) (18). Su eficacia para prevenir y detener las caries se mantiene cuando se aplica cada 6 a 12 meses (19). Además, existe un nuevo interés en la literatura de apoyo con respecto a su eficacia para prevenir y reducir el desarrollo de placa y, posteriormente, la gingivitis en humanos (20, 21).
El uso potencial de SDF 38% en perros se extrapola de su utilización en humanos. En los perros hay un cambio general en el microbioma oral de bacterias gramnegativas en la salud a bacterias grampositivas en la enfermedad periodontal (22). Sin embargo, Santibáñez et al. también encontraron que Porphyromonas, un género de bacterias gramnegativas, es la especie más abundante tanto en perros sanos como enfermos con un aumento de 2,7 veces en perros con enfermedad periodontal (23). Más específicamente, Niemiec et al. encontraron que Porphyromonas gulae apareció en abundancia creciente en el microbioma oral del perro desde la salud hasta la enfermedad periodontal (22). P. gulae está estrechamente relacionada y comparte factores de virulencia similares a Porphyromonas gingivalis, un patógeno clave en la cavidad oral humana en la enfermedad periodontal (24).
El género Porphyromonas es capaz de invadir las células epiteliales, activar la actividad de las citoquinas proinflamatorias, influir en la respuesta inmune innata y exacerbar la progresión de la enfermedad periodontal (23-25). Un estudio in vitro en humanos realizado por Ho et al. encontró que SDF 38% fue eficaz para inhibir el crecimiento de Porphyromonas gingivalis, atribuido a sus efectos bactericidas sobre bacterias gramnegativas (26). Esto apoya la investigación del uso de SDF 38% como terapia para retrasar la progresión de la enfermedad periodontal en perros.
Además, cuando se aplica a la superficie del diente, SDF 38% reacciona con hidroxiapatita, produciendo los metabolitos fosfato de plata, fluoruro de calcio e hidróxido de amonio (27). Se cree que los metabolitos de plata y fluoruro tienen un efecto sinérgico que resulta en actividad bactericida en organismos grampositivos y gramnegativos. Debido al mecanismo de acción de sus compuestos activos, SDF 38% puede ser prometedor en la prevención de la gingivitis en perros.
Si bien el autor no puede encontrar estudios de seguridad realizados específicamente en perros, la farmacocinética de SDF 38% se ha investigado en odontología humana y se ha encontrado que es segura. Tres estudios farmacocinéticos en humanos, incluido uno en niños, han abordado el potencial de pequeñas cantidades de SDF 38% para ser ingeridas y absorbidas a través del tracto gastrointestinal después de la aplicación a dientes sanos y enfermos. Los tres estudios encontraron que no hubo un aumento significativo en los niveles séricos sanguíneos por encima de los niveles basales previos al tratamiento, concluyendo que la aplicación de SDF 38% no planteó un problema de toxicidad (28-30).
El bajo riesgo de toxicidad en pacientes humanos después de la aplicación de SDF 38% a una superficie dental sana o enferma apoyó nuestro uso del producto en este estudio clínico. El estudio actual redujo aún más el potencial de ingestión aplicando SDF 38% solo a las superficies bucales y enjuagando la cavidad oral después de un minuto de contacto en la superficie del diente.
Un efecto adverso bien conocido de SDF 38% es su capacidad para teñir el sitio tratado de negro (26). El esmalte maduro y la dentina no cariosa no se tiñen (19) y no se produce tinción del tejido gingival (31). La aplicación al esmalte maduro en el estudio actual redujo el potencial de problemas estéticos asociados con la tinción. Un efecto adverso clínicamente relevante adicional de SDF 38% es una sensación de escozor al contacto con tejido ulcerado o inflamado (19). Un hallazgo repetido en la literatura es que las lesiones de tejidos blandos producen molestias menores y se resuelven en 48-72 h (26, 30, 32).
SDF 38% tiene el potencial de ser una terapia preventiva segura y efectiva o tratamiento para la enfermedad periodontal en medicina veterinaria. El objetivo de este estudio fue evaluar la efectividad del tratamiento SDF 38% en perros susceptibles a la enfermedad periodontal para reducir la gingivitis y la placa. La hipótesis probada fue que la limpieza dental profesional más el tratamiento tópico con SDF 38% sería más efectiva para reducir la gingivitis y la placa que la limpieza dental profesional sola. El estudio fue un ensayo aleatorizado doble ciego, controlado con placebo.
Materiales y métodos
Animales
Los perros propiedad del cliente fueron seleccionados por los mismos dos operadores (un Diplomado del Colegio Dental Veterinario Americano y un residente a tiempo parcial del Colegio Dental Veterinario Americano). Los propietarios proporcionaron su consentimiento informado por escrito. El estudio fue revisado y aprobado por el Comité de Cuidado y Uso de Animales de la Universidad de Washington (Protocolo 4,526-01, 6/24/21) después de considerar los riesgos y beneficios.
Ajuste
La inscripción y el tratamiento se llevaron a cabo en dos instalaciones: Ubicación del sitio uno: Una práctica de referencia de odontología / cirugía oral, Inland Northwest Veterinary Dentistry and Oral Surgery, Coeur D’Alene, Idaho. Ubicación sitio dos: Una clínica de práctica general, Lower Columbia Veterinary Clinic en Longview, Washington. El reclutamiento comenzó el 14 de septiembre de 2021 y los últimos datos de seguimiento se recopilaron el 01 de noviembre de 2022.
Criterios de inclusión/exclusión
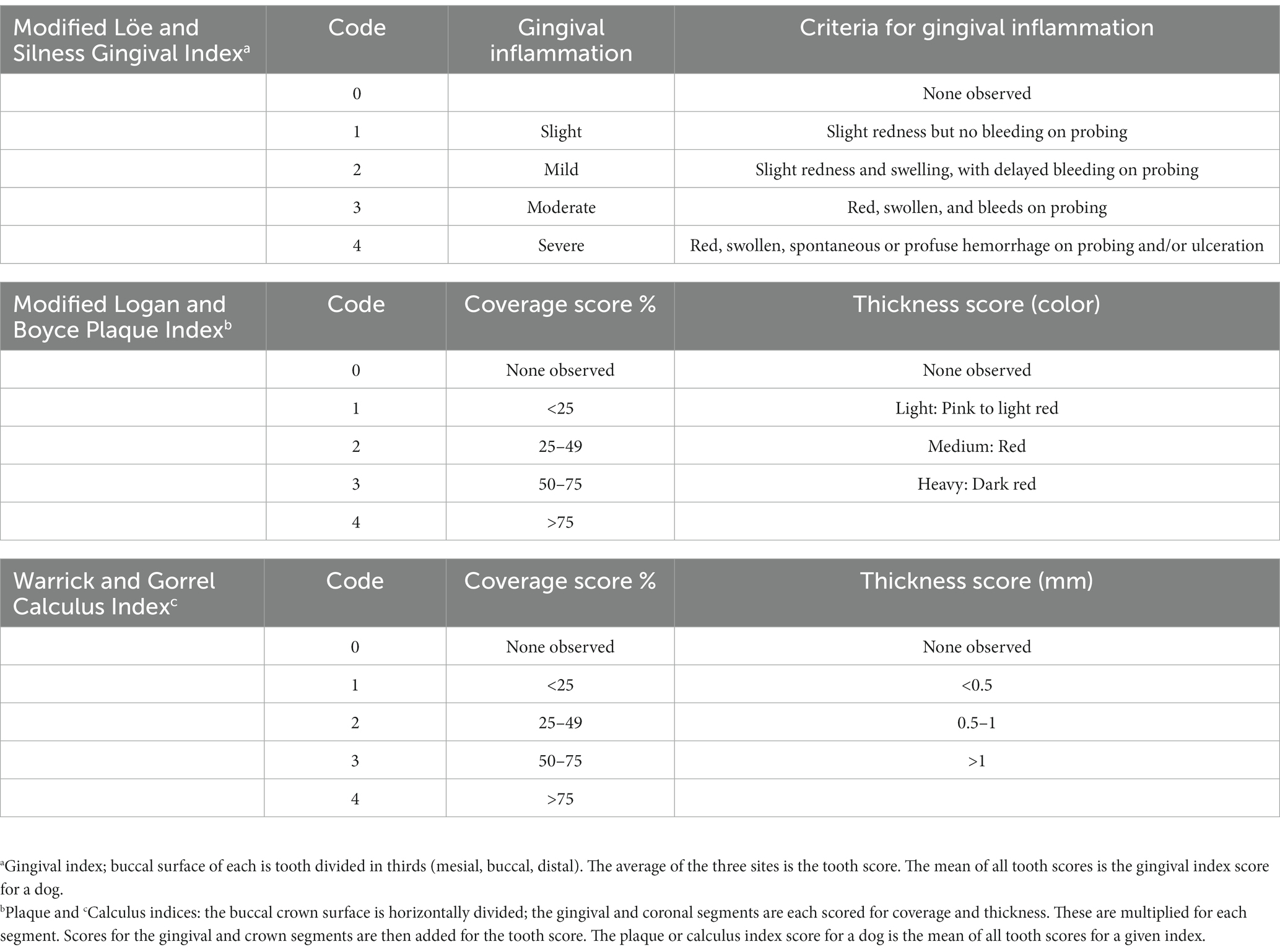
La inscripción en el estudio se basó en exámenes orales visuales realizados en perros despiertos en el examen de reclutamiento. Se requirió que los perros incluidos no tuvieran una enfermedad periodontal peor que la etapa dos, según lo definido por el American Veterinary Dental College (33) (Tabla 1) y un índice gingival de Löe y Silness modificado alrededor de dos (34). Se requería que los perros reclutados tuvieran la mayoría de sus dientes, incluyendo; tercer incisivo maxilar derecho, canino maxilar derecho, tercer premolar maxilar derecho, cuarto premolar maxilar derecho, primer molar maxilar derecho, tercer incisivo maxilar izquierdo, canino maxilar izquierdo, tercer premolar maxilar izquierdo, cuarto premolar maxilar izquierdo, primer molar maxilar izquierdo, canino mandibular derecho, tercer premolar mandibular derecho, cuarto premolar mandibular derecho, primer molar mandibular derecho, canino mandibular izquierdo, tercer premolar mandibular izquierdo, cuarto premolar mandibular izquierdo y primer molar mandibular izquierdo (35).
Para ser incluido, el perro necesitaba tener una puntuación de la Sociedad Americana de Anestesia no mayor de dos (36). Se completó una base de datos mínima que consiste en un examen físico general (auscultación cardíaca y pulmonar, palpación abdominal, temperatura corporal y peso registrados), evaluación de un conteo sanguíneo completo y un panel de química y una evaluación de salud oral para evaluar la salud general de cada perro antes de su aceptación en el estudio.
Se excluyó a un perro si se habían administrado inmunosupresores sistémicos, antibióticos o medicamentos periodontales localizados, incluido el gel® Doxirobe (hicolato de doxiciclina 8,5%) en los últimos 3 meses de comenzar el estudio. Los criterios de exclusión adicionales incluyeron recibir suplementos de 1-TetraDecanol Complex de venta libre, otros suplementos aprobados por VOHC, golosinas, aditivos o enjuagues orales que podrían afectar la condición del periodonto en los últimos 3 meses. También se excluyeron los perros que recibieron cepillado dental regular o aquellos que fueron alimentados con dietas dentales recetadas en los últimos 3 meses. No se permitieron terapias dentales, aparte de las descritas en el estudio, durante la duración de la participación del perro en el estudio.
Parámetros de revisión de animales y calendario de examen físico
Antes de cada sesión, se realizó y registró un examen físico general que incluía auscultación cardíaca y pulmonar, palpación abdominal, temperatura corporal, salud bucal y peso corporal. Se recopiló una breve historia del propietario y se registró para confirmar que cada perro estaba clínicamente sano y que el propietario no tenía nuevas preocupaciones después de su visita / examen de reclutamiento. Los parámetros del examen físico y la historia fueron recolectados y registrados por el mismo operador (QA).
Protocolo de anestesia
El protocolo de anestesia y el monitoreo del paciente se realizaron de manera idéntica en cada instalación, así como en cada sesión de terapia. Cada perro recibió gabapentina 50 mg/ml; 5-7.5 mg / kg por vía oral al ingresar a la clínica la mañana de su procedimiento para reducir la ansiedad. La premedicación fue una selección/combinación de; Metadona 10 mg/mL: 0.2-0.4 mg/kg por vía intramuscular, o Butorfanol 10 mg/mL: 0.2–0.4 mg/kg por vía intramuscular y Dexmedetomidina 500mcg/ml: 2-4mcg/kg por vía intramuscular. Después del tiempo apropiado hasta el inicio de la acción para la premedicación seleccionada, se colocó un catéter intravenoso de calibre 20 o 22 en la vena cefálica derecha o izquierda. Maropitant 10 mg/mL: 1 mg/kg se administró lentamente durante 5 min por vía intravenosa. El paciente fue preoxigenado con oxígeno de flujo durante 5 min antes de la inducción con Propofol 10 mg/mL: 4 mg/kg por vía intravenosa para hacer efecto. Después de la inducción, se realizó intubación endotraqueal y se mantuvo anestesia general con sevoflurano al 2%. Se utilizó anestesia local cuando se extrajeron los dientes o cuando se proporcionaron terapias periodontales. Bupivacaína (5 mg/mL): 1-2 mg/kg volumen total. Los signos vitales de cada paciente fueron monitoreados y registrados durante la anestesia general. Los parámetros incluyeron electrocardiograma, frecuencia respiratoria, porcentaje de saturación de oxígeno, temperatura, CO espiratorio final2 y presión arterial sistólica/diastólica y media. Se utilizó un Doppler para controlar la presión arterial sistólica en perros de menos de 10 kg para mejorar la precisión. Se proporcionó soporte de termorregulación. Se emplearon pocas variaciones de este protocolo de anestesia y no se necesitaron medicamentos de emergencia. Todos los parámetros y observaciones se registraron en una tabla de anestesia en cada sesión de tratamiento.
Medidas
Se recogieron el índice gingival (IG) de Löe y Silness modificado, el índice de placa de Logan y Boyce (PI) modificado y el índice de cálculo (IC) de Warrick y Gorrel (34) (Tabla 2). Se utilizó una solución reveladora (HurriView II,® Beutlich Pharmaceuticals, LLC, Bunnell, FL) para registrar el IP aplicándolo a las superficies bucales de los dientes del estudio y enjuagándolo suavemente después de 10 s. Los parámetros se registraron solo para la superficie bucal de los siguientes dientes; tercer incisivo maxilar derecho, canino maxilar derecho, tercer premolar maxilar derecho, cuarto premolar maxilar derecho, primer molar maxilar derecho, tercer incisivo maxilar izquierdo, canino maxilar izquierdo, tercer premolar maxilar izquierdo, cuarto premolar maxilar izquierdo, primer molar maxilar izquierdo, canino mandibular derecho, tercer premolar mandibular derecho, cuarto premolar mandibular derecho, primer molar mandibular derecho, canino mandibular izquierdo, tercer premolar mandibular izquierdo, cuarto premolar mandibular izquierdo y primer molar mandibular izquierdo (35). Si al perro le faltaba un diente objetivo, se reemplazaba por un diente de función caudal o rostral similar cuando era posible. La línea de base y el GI, IP e IC de seguimiento de tres meses fueron evaluados por el mismo examinador experimentado (MLR), quien completó el examen asistido por el mismo registrador experimentado (MKH). En el seguimiento, ni el examinador ni el registrador tuvieron acceso a las puntuaciones previas al tratamiento. Un examen oral completo y terapias dentales por parte del veterinario tratante se retrasaron hasta después de que se recopilaron y registraron los parámetros de investigación. Se tomaron radiografías dentales intraorales antes de registrar los parámetros de investigación para determinar la etapa de la enfermedad periodontal y si un diente del estudio requeriría extracción durante el tratamiento.
Aleatorización y asignación
El bioestadístico del estudio generó listas de aleatorización separadas para cada sitio. Los perros fueron aleatorizados 1:1 a los brazos de tratamiento.
Cegador
Los propietarios, el personal del estudio, incluido el médico tratante, el examinador y el registrador, y el bioestadístico estaban ciegos a la asignación del tratamiento.
Productos de prueba
El tratamiento activo fue solución acuosa de fluoruro de diamina de plata al 38% (fluoruro 5%, plata 25%, Advantage ArrestR, Elevate Oral Care LLC, West Palm Beach, FL). El tratamiento de comparación fue idéntico, excepto que no contenía ni fluoruro ni plata. Las soluciones de prueba y placebo fueron preparadas por Cascade Chemistry, Eugene, OR y se obtuvo un certificado de análisis del laboratorio que certifica el contenido de la solución.
Enmascaramiento
Los medicamentos de prueba se envasaron en botellas idénticas etiquetadas como A o B y el laboratorio conservó los códigos de los medicamentos hasta que se completaron el análisis de los datos.
Protocolo de aplicación
Las soluciones A o B fueron aplicadas de manera idéntica por el mismo operador después de la formación adecuada (AK). La cantidad de soluciones A y B aplicadas siguió las recomendaciones del fabricante. La superficie bucal de cada diente se secó suavemente con la jeringa aire/agua de la unidad dental. Para aplicar la solución, un microcepillo suministrado por el fabricante se sumergió en la solución y se aplicó a la superficie bucal de la corona de cada diente, con enfoque en el margen gingival libre. La solución se dejó en la superficie del diente durante 1 minuto y luego la superficie se enjuagó con agua destilada durante 1 minuto.
Tratamiento basal
Después de la recopilación de datos, se completó un examen oral completo que incluyó sondaje periodontal, anotación de patología oral y revisión de radiografías dentales intraorales tomadas antes de la recopilación de datos. Luego, las terapias necesarias, limitadas a extracciones, alisado radicular cerrado y radiografías dentales intraorales postoperatorias (si está indicado) fueron realizadas por el mismo operador (QA). Se completó una limpieza dental profesional que incluyó raspado ultrasónico, raspado manual de cada diente, seguido de pulido y un enjuague oral final con jeringa de aire/agua de la unidad dental. Después de completar las terapias orales, la solución A o B se aplicó tópicamente a la superficie bucal de todos los dientes.
Los propietarios recibieron instrucciones de no realizar terapias dentales en el hogar, incluido el cepillado de dientes hasta después del seguimiento de tres meses. Si se realizaban extracciones, se instruía a los propietarios para que controlaran las complicaciones. Se aconsejó un nuevo examen de revisión si se desarrollaron signos de inflamación, infección, mal olor oral o malestar.
Seguimiento de tres meses
Tres meses, media (DE) = 3,2 meses (0,4), después del tratamiento inicial, cada perro regresó para la segunda sesión. Los parámetros del estudio se recogieron bajo anestesia general de la misma manera que al inicio del estudio. Después de la recopilación de datos, se completó una limpieza dental profesional que incluyó raspado ultrasónico, raspado manual de cada diente, seguido de pulido y un enjuague oral final con jeringa de aire/agua de la unidad dental.
Si las extracciones se realizaron en el tratamiento inicial, la confirmación de la curación de la cirugía oral se completó en el seguimiento de tres meses. Se alentó al propietario a iniciar el cuidado dental en el hogar, siendo el cepillado diario de los dientes la recomendación principal.
Cálculo del tamaño de la muestra
La medida de resultado primaria fue la puntuación GI a los 3 meses después del tratamiento. Un estudio reciente de Mateo et al. (34) mostró una reducción del 20% en las puntuaciones de gingivitis, una reducción del 15% en las puntuaciones de placa y una reducción del 35% en las puntuaciones de cálculo de una masticación dental en comparación con ninguna intervención. El estudio Mateo y un estudio similar (15) inscribieron perros con niveles muy bajos de gingivitis, creando un techo en la efectividad potencial. En este estudio inscribimos perros con gingivitis establecida y, por lo tanto, esperábamos mayores reducciones. Con un tamaño de muestra de 15 perros por intervención, el poder estadístico fue del 80% para demostrar una reducción del 27% en la gingivitis, una reducción del 25% en la placa y una reducción del 67% en el cálculo debido a la intervención SDF del 38% en comparación con la intervención de control, basada en una prueba t de dos muestras de dos lados utilizando un nivel de significación de 0.05.
Análisis
Las puntuaciones GI, PI e IC para cada perro se calcularon como la puntuación media de todos los dientes marcados. Las estadísticas descriptivas, que incluyen media, desviación estándar, valores mínimos y máximos, mediana y percentiles 25 y 75, se informan mediante intervención para gingivitis, placa y puntuaciones de cálculo al inicio y 3 meses después del tratamiento. La distribución de los resultados se evaluó mediante la asimetría, las gráficas cuantil-cuantil normales, y la media y la mediana. Las distribuciones fueron simétricas y los resultados se distribuyeron aproximadamente normalmente.
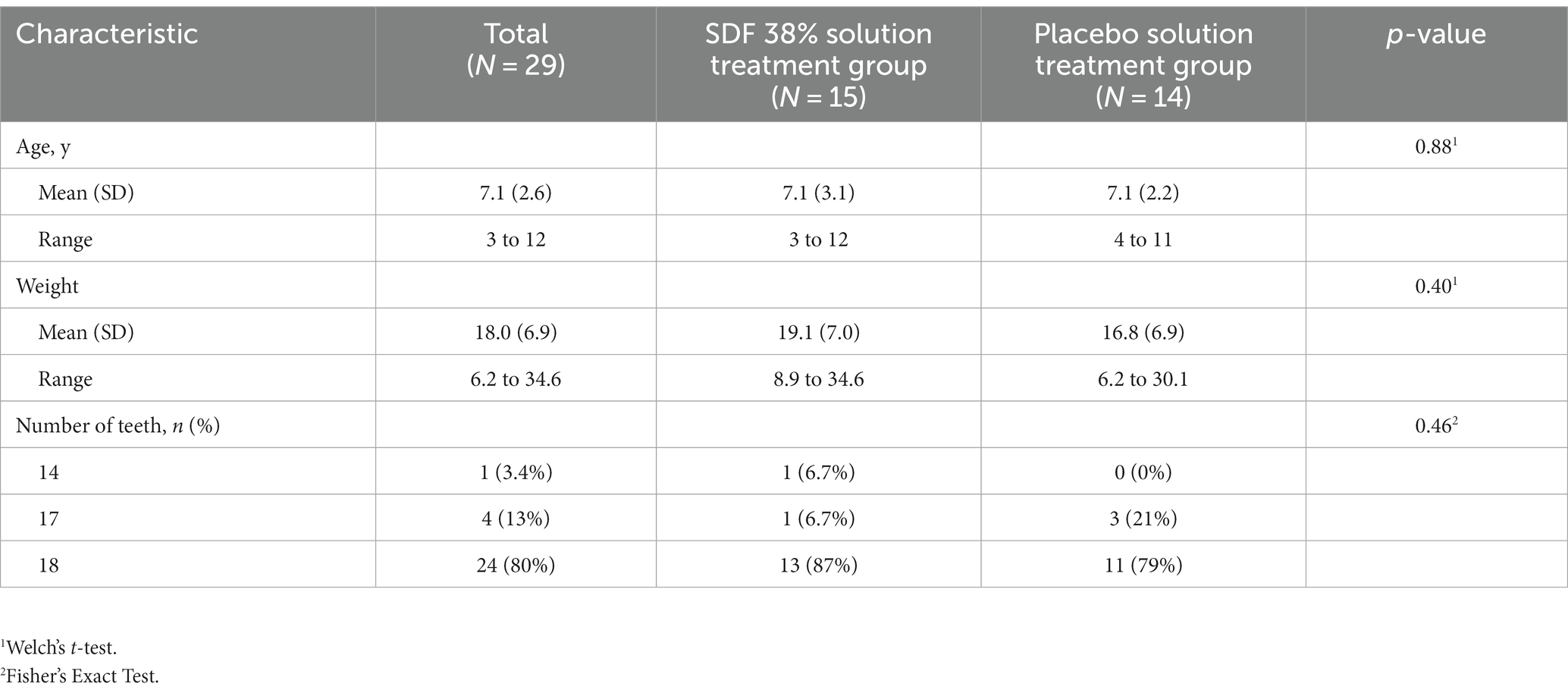
La edad y el peso de los perros al inicio se compararon entre los tratamientos con la prueba t de Welch y el número de dientes se comparó con la prueba exacta de Fisher. Los resultados se compararon entre los tratamientos al inicio y a los 3 meses mediante la prueba t de Welch y, dentro de cada tratamiento, el cambio entre el inicio y los 3 meses se comparó mediante pruebas t pareadas. Se utilizó regresión lineal con errores estándar robustos de heterocedasticidad para comparar los resultados a los 3 meses, ajustando los valores iniciales de los resultados, la edad y el peso y el tiempo de seguimiento entre el inicio y los 3 meses (37). Análisis adicionales evaluaron el impacto de los valores atípicos potenciales dado el pequeño tamaño de la muestra.
Se realizaron análisis similares para las puntuaciones de placa y cálculo. Se utilizó un nivel de significación bilateral de 0,05 para determinar la significación estadística y se informaron intervalos de confianza (IC) del 95% para todos los efectos del tratamiento para describir la precisión de las estimaciones del efecto del tratamiento. Todos los análisis estadísticos se realizaron utilizando el software estadístico R (Versión 4.2.0). Equipo central de R (2022). R: Un lenguaje y entorno para la computación estadística. R Foundation for Statistical Computing, Viena, Austria. URL https://www.R-project.org
Resultados
Se inscribieron treinta perros, de 3 a 12 años de edad, hembras (n = 20), machos (n = 10), con un peso de 6.25 a 34.6 libras. Un perro fue eliminado al final del estudio debido a la enfermedad periodontal avanzada encontrada bajo anestesia general, dejando 29 perros en el análisis final. El número de dientes que tenía cada perro fue similar entre ambos grupos de tratamiento. La solución de tratamiento A (n = 15) tenía cinco perros con uno o más dientes extraídos (cuatro perros con un diente extraído y un perro con tres dientes extraídos). La solución de tratamiento B (n = 14) tenía cinco perros con uno o más dientes extraídos (tres perros con un diente extraído y dos perros con dos dientes extraídos). Cuando se combinaron los grupos, el número de dientes del estudio presentes varió de 18/18 dientes en el 83% de los perros inscritos (24/29) a 14/18 dientes en el 3,4% de los perros inscritos (1/29) (Tabla 3). Quince razas estuvieron representadas: terrier/mix (n = 5), chihuahua/mix (n = 6), otras (n = 18) incluyendo 19 hembras (18 esterilizadas) y 10 machos (7 castrados). Ni la edad, el peso, el sexo ni la raza se asociaron con IG, IP o IC.
Ubicación del sitio y asignación del tratamiento
Nueve perros fueron tratados en Inland Northwest Veterinary Dentistry and Oral Surgery: el 33% (5/15) de los perros fueron asignados al grupo de tratamiento SDF 38% y el 29% (4/14) de los perros fueron asignados al grupo de tratamiento placebo en este lugar. Veinte perros fueron reclutados y tratados en la Clínica Veterinaria Lower Columbia, el 67% (10/15) de los perros fueron asignados al grupo de tratamiento SDF 38% y el 71% (10/14) de los perros fueron asignados al grupo de tratamiento placebo en este lugar.
Índice gingival – resultado primario
El IG fue similar entre ambos grupos de perros al inicio del estudio después de la asignación al grupo de tratamiento y antes de la aplicación de SDF 38% (Solución A) o placebo (Solución B). Al inicio del estudio, el IG para los perros que recibieron SDF 38% fue, media (DE) = 1,7 (0,5), versus GI para los perros que recibieron tratamiento con placebo, media (DE) = 1,8 (0,4; valor p = 0,82).
El GI se mantuvo similar entre los perros tratados con SDF 38% y los perros tratados con placebo en el examen de seguimiento de tres meses. IG para perros que recibieron SDF 38% de tratamiento, media (DE) = 0,8 (0,4), e IG para perros que recibieron tratamiento con placebo, media (DE) = 1,0 (0,4; valor p = 0,32). No hubo diferencias entre los grupos de tratamiento cuando se ajustó por el IG inicial, la edad, el peso, el sexo o la raza y el tiempo de seguimiento [diferencia (SDF – placebo) = -0,05, IC del 95%, -0,3 a 0,2, valor de p = 0,72].
Sin embargo, hubo una reducción significativa en el IG tanto para los perros tratados con SDF 38% como para los perros tratados con placebo en el examen de seguimiento de tres meses (valores de p <0.0001) con una reducción del 53% en la puntuación GI promedio para los perros que recibieron tratamiento SDF 38% y una reducción del 44% para los perros que recibieron tratamiento con placebo (Tabla 4).
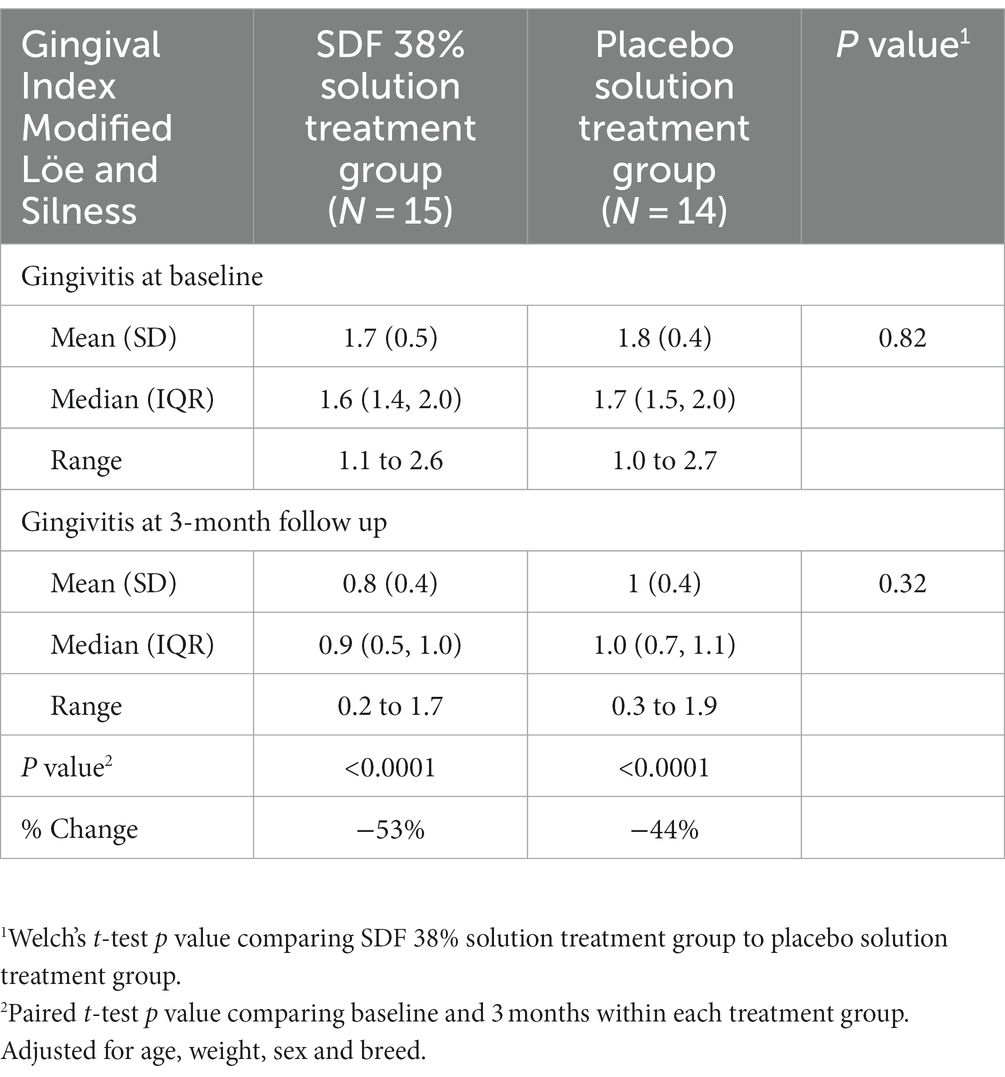 Tabla 4. Resultado primario: comparación del índice gingival al inicio y seguimiento de tres meses entre SDF 38% y perros tratados con placebo.
Tabla 4. Resultado primario: comparación del índice gingival al inicio y seguimiento de tres meses entre SDF 38% y perros tratados con placebo.
Índice de placa – resultado secundario
El IP también fue similar entre ambos grupos de perros al inicio del estudio después de la asignación del grupo de tratamiento y antes de la aplicación de SDF 38% o solución placebo. Los perros que recibieron SDF 38% de tratamiento tuvieron un IP de media (DE) = 8,9 (2,0), y los perros que recibieron tratamiento con placebo tuvieron un IP de media (DE) = 9,2 (2,4; valor p = 0,71).
En el examen de seguimiento de tres meses, el IP fue menor en los perros tratados con placebo, media (DE) = 7,7 (1,8), que en SDF 38% de los perros tratados, media (DE) = 9,2 (2,2; valor de p = 0,055), pero la diferencia ya no fue significativa cuando se ajustó por IP inicial, edad, peso y tiempo de seguimiento [diferencia (SDF – placebo) = 1,4, IC del 95%, −0,2 a 3,0, valor de p = 0,093].
En el examen de seguimiento de tres meses hubo una reducción no significativa del 3% para los perros tratados con SDF 38% (valor de p = 0,065) y una reducción no significativa del 16% para la condición placebo (valor de p = 0,079) (Tabla 5).
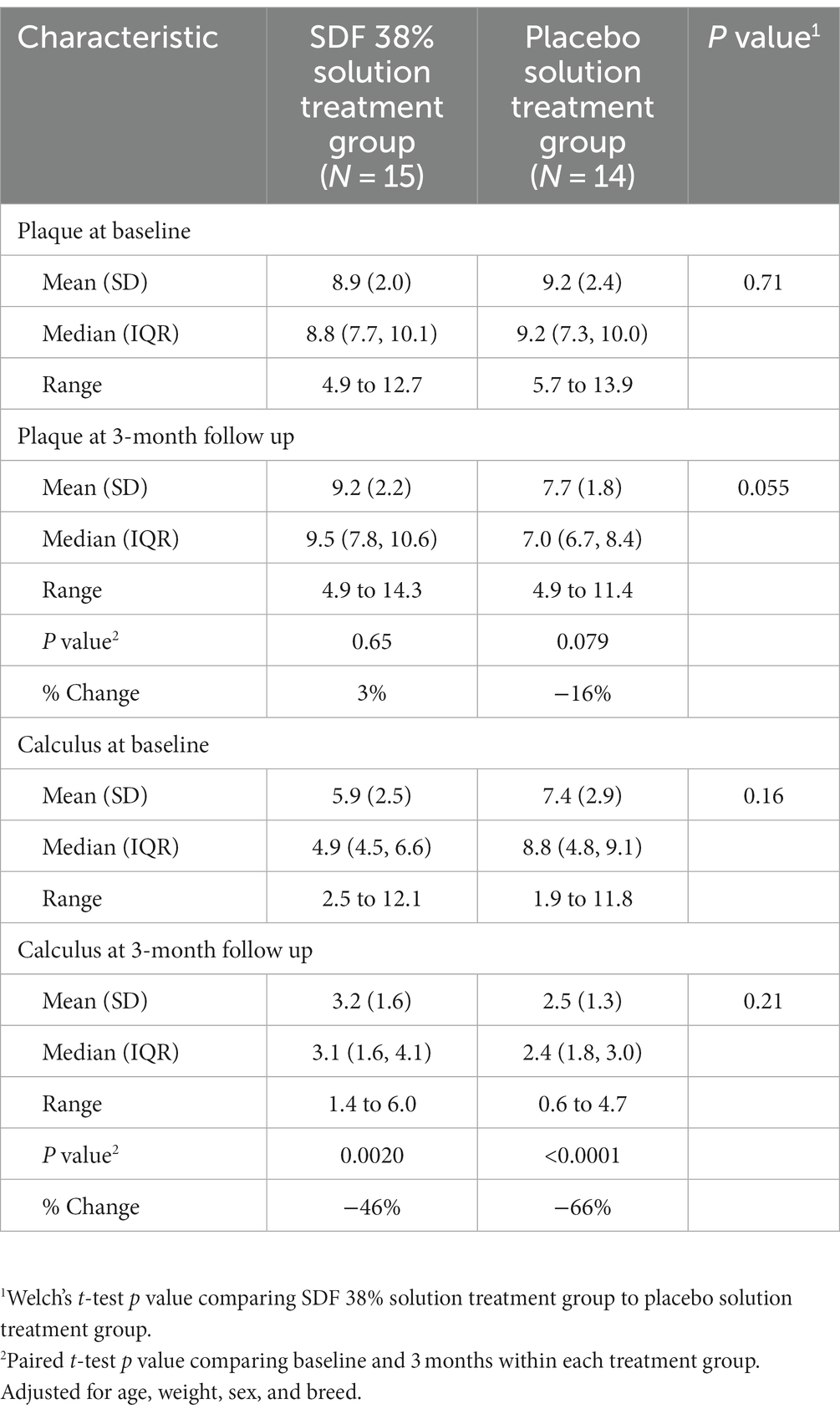 Tabla 5. Resultados secundarios: comparación de las puntuaciones de placa y cálculo al inicio y seguimiento de tres meses entre SDF 38% y perros tratados con placebo.
Tabla 5. Resultados secundarios: comparación de las puntuaciones de placa y cálculo al inicio y seguimiento de tres meses entre SDF 38% y perros tratados con placebo.
Índice de cálculo – resultado secundario
En el examen inicial después de la asignación del grupo de tratamiento y antes de la aplicación de la solución SDF al 38% o la solución placebo, hubo una diferencia insignificante en el IC para los perros que recibieron tratamiento con solución SDF al 38%, media (DE) = 5,9 (2,5), en comparación con los perros que recibieron tratamiento con solución placebo, media (DE) = 7,4 (2,9; valor p = 0,16).
En el examen de seguimiento de tres meses, el IC fue menor en los perros tratados con solución placebo, media (DE) = 2,5 (1,3), que en los perros tratados con solución SDF al 38%, media (DE) = 3,2 (1,6), pero la diferencia no fue estadísticamente significativa (valor de p = 0,21). Cuando se ajustó por IC basal, edad, peso y tiempo de seguimiento, el IC tampoco fue significativamente menor en los perros tratados con solución placebo que en los perros tratados con SDF 38% [diferencia (placebo – SDF) = 1.1; IC del 95%, -0.4 a 2.5; valor p = 0,14].
Hubo una reducción significativa en el IC tanto para los perros tratados con solución SDF al 38% (valor de p = 0,0020) como para los perros tratados con solución placebo (valor de p = <0,0001), con una reducción del 46% y 66% en la puntuación de IC promedio para cada uno, respectivamente (Tabla 5).
Daños
Los criterios de valoración específicos para los efectos perjudiciales, incluidos los signos clínicos indicativos de malestar por irritación gingival, cualquier complicación de la cirugía oral y tinción dental, se evaluaron en una llamada telefónica de seguimiento dentro de las 24 h siguientes al tratamiento inicial y al seguimiento de tres meses en sí. Las llamadas telefónicas de seguimiento fueron realizadas por el personal de apoyo veterinario con instrucciones para informar las inquietudes al veterinario tratante (AK).
Ningún propietario informó signos clínicos indicativos de malestar oral o preocupaciones con la tinción de los dientes en la llamada de seguimiento el día después del tratamiento inicial. La curación de la cirugía oral se confirmó a los tres meses de seguimiento. Los propietarios recibieron instrucciones de comunicarse con inquietudes antes de esta visita según sea necesario. No se informaron complicaciones de la cirugía oral en la población de estudio actual.
En general, no se informaron daños, y ningún animal fue retirado por el propietario o salido por los veterinarios tratantes por razones médicas o daños asociados con el fármaco del estudio.
Discusión
La capacidad de SDF 38% para reducir la gingivitis en humanos es un área de interés creciente (20, 21). Su uso potencial en perros para reducir la gingivitis está respaldado por paralelismos en el microbioma de la cavidad oral humana y la cavidad oral del perro en puntos a lo largo del espectro de la salud hasta la enfermedad periodontal (23-25), así como la capacidad de SDF 38% para mitigar los efectos de estos organismos sin causar daño al paciente (28, 30 y 31). Desafortunadamente, este estudio no pudo confirmar que SDF 38% fuera un tratamiento efectivo en perros para la prevención de la gingivitis cuando el tratamiento SDF 38% se aplicó después de una limpieza dental profesional en comparación con una limpieza dental profesional sola.
Una posible explicación para el fracaso en encontrar un efecto primario del tratamiento puede residir en el diseño del estudio actual. Los protocolos utilizados en los documentos que analizan la eficacia en la reducción de la gingivitis en humanos emplearon una aplicación más frecuente, hasta una vez por semana durante varias semanas (21). Este estudio utilizó un protocolo con una sola aplicación. Es posible que un estudio diseñado con aplicaciones más frecuentes produzca una mayor reducción de la gingivitis.
Los iones de plata tienen capacidad antimicrobiana y bactericida. Los iones de plata permanecen sin cambios después de la aplicación en células bacterianas muertas que actúan como un depósito para las partículas de plata. Cuando estos iones se liberan, son bactericidas para los organismos en proximidad (38). A pesar de la capacidad de SDF 38% para penetrar el esmalte a una profundidad de 25 micras (32), su capacidad para implementar sus efectos antimicrobianos y bactericidas en el diente sano de un perro aún no está clara. Puede ser que este producto se aplique mejor a los dientes que no han tenido recientemente una limpieza dental profesional, como se demostró en el estudio de Alshehri et al. (21).
No está claro si el índice gingival modificado para humanos es confiable y válido en perros. Una de esas variables que afecta la confiabilidad y validez de la medición es la pigmentación gingival. Un estudio de odontología humana realizado por Eid et al. encontró que el grado de pigmentación inducida por melanina en la encía tiene una correlación negativa con el grado de sangrado en el sondeo (39). Sin embargo, no hay estudios conocidos que evalúen si la pigmentación influye en el sangrado en el sondaje en perros. Además, se ha encontrado que la encía más delgada en humanos sangra más fácilmente (40). Del mismo modo, los perros de razas pequeñas tienen encía más delgada en comparación con las razas con mayor peso corporal y esto se ha correlacionado con un mayor riesgo de enfermedad periodontal en razas pequeñas (41). El autor desconoce la literatura que compara el grosor de la encía del perro con la encía humana. Un estudio de patología comparativa centrado en evaluar las diferencias en la encía humana y canina podría dilucidar si el índice gingival derivado de humanos es apropiado para su uso en estudios con perros.
Los resultados del estudio actual sugieren que las limpiezas dentales profesionales regulares son una terapia efectiva para reducir la gingivitis. Esto está de acuerdo con el estándar actual de atención para la medicina veterinaria cuando se maneja la enfermedad periodontal (14, 42).
Otras áreas de interés incluyen si SDF 38% podría ser un tratamiento beneficioso para la hipomineralización del esmalte en el perro. La hipomineralización del esmalte aumenta el riesgo de sensibilidad a la dentina, enfermedad periodontal, pulpitis, necrosis pulpar y trauma dental (43). En odontología humana, se ha demostrado que SDF 38% evita que las lesiones del esmalte se extiendan a la dentina (19). Sería interesante evaluar si este beneficio se puede replicar en casos de hipomineralización del esmalte en el perro.
Limitaciones
En el estudio actual, los perros fueron reclutados en base a exámenes orales visuales despiertos. Se conocen las limitaciones de diagnosticar la etapa de la enfermedad periodontal con precisión con un examen oral visual despierto. Wallis et al. destacaron esto al informar una disparidad entre los exámenes orales visuales despiertos versus los exámenes orales bajo anestesia y la prevalencia de periodontitis. La prevalencia de periodontitis basada en un examen oral visual despierto reportó niveles de 9.3-18.2%, mientras que se encontró una mayor prevalencia de periodontitis que osciló entre 44 y 100% cuando los perros fueron examinados bajo anestesia o post mortem (4). Bauer et al. encontraron que la concordancia entre los exámenes orales visuales despiertos y los exámenes orales bajo anestesia general, incluyendo sondeo periodontal y radiografías dentales intraorales, fue más débil para las etapas cero a dos de la enfermedad periodontal (44). El examen oral visual despierto proporcionó un desafío para este estudio al adherirse a nuestros criterios de inclusión basales de limitar el reclutamiento a la enfermedad periodontal en estadio dos. Una vez bajo anestesia general, se encontró que tres perros reclutados requerían la extracción de más de un diente (dos perros – dos dientes; un perro – tres dientes).
Se acordó que rechazar a estos pacientes del estudio después de la anestesia general no era razonable, ya que todavía tenían un número suficiente de dientes objetivo para la evaluación. Para los perros a los que se les extrajeron dientes, no se realizó el examen de revisión de dos semanas después de la cirugía oral para evaluar cualquier complicación postoperatoria, lo que podría subestimar la tasa de dehiscencia u otros efectos secundarios.
La duración de tres meses del estudio actual puede ser un factor limitante. Se consideró y eliminó una duración más corta debido a la resistencia de los propietarios a repetir estrechamente los eventos anestésicos de sus mascotas. No se eligió una duración más larga debido a la posible pérdida durante el seguimiento. Un diseño de estudio con revisiones más frecuentes y una duración más larga puede haber arrojado resultados diferentes.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Cuidado y Uso de Animales de la Universidad de Washington (Protocolo 4526-01, 6/24/21). Los estudios se realizaron de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
AK: Investigación, Recursos, Redacción – borrador original, Escritura – revisión y edición. TR: Administración de proyectos, recursos, redacción – revisión y edición. MLR: Curación de datos, investigación, recursos, supervisión, redacción: revisión y edición. LM: Curación de datos, análisis formal, recursos, software, validación, visualización, escritura: revisión y edición. PM: Conceptualización, adquisición de fondos, administración de proyectos, supervisión, visualización, redacción – revisión y edición.
Financiación
El estudio fue patrocinado por Elevate Oral Care LLC., West Palm Beach, FL. a través de una donación sin restricciones a la Universidad de Washington y el pago directo de los gastos de viaje de los investigadores a los dos sitios. Elevate Oral Care proporcionó la prueba y las soluciones de placebo sin costo para el estudio. Ningún personal de Elevate Oral Care tuvo contacto con los participantes ni tuvo ningún papel en el análisis o la interpretación de los datos del estudio.
Reconocimientos
Este proyecto fue apoyado por el Instituto de Ciencias de la Salud Traslacional, que está financiado por el Centro Nacional para el Avance de las Ciencias Traslacionales de los Institutos Nacionales de Salud bajo el número de premio UL1 TR002319.
Conflicto de intereses
PM es miembro de Advantage Silver Dental Arrest, LLC.
Los autores restantes declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. McFadden, T, and Marretta, SM. Consequences of untreated periodontal disease in dogs and cats. J Vet Dent. (2013) 30:266–75. doi: 10.1177/089875641303000413
2. Wallis, C, Pesci, I, Colyer, A, Milella, L, Southerden, P, Holcombe, LJ, et al. A longitudinal assessment of periodontal disease in Yorkshire terriers. BMC Vet Res. (2019) 15:1. doi: 10.1186/s12917-019-1923-8
3. Basuki, W, Rawlinson, J, Lothamer, C, Wheeler, R, and Prytherch, B. Evaluation of gingivitis in pregnant beagle dogs. J Vet Dent. (2019) 36:179–85. doi: 10.1177/0898756419892202
4. Wallis, C, and Holcombe, LJ. A review of the frequency and impact of periodontal disease in dogs. J Small Anim Pract. (2020) 61:529–40. doi: 10.1111/jsap.13218
5. Whyte, A, Bonastre, C, Monteagudo, LV, Les, F, Obon, J, Whyte, J, et al. Canine stage 1 periodontal disease: a latent pathology. Vet J. (1997) 201:118–20. doi: 10.1016/j.tvjl.2014.05.005
6. Pereira dos Santos, JD, Cunha, E, Nunes, T, Tavares, L, and Oliveira, M. Relation between periodontal disease and systemic diseases in dogs. Res Vet Sci. (2019) 125:136–40. doi: 10.1016/j.rvsc.2019.06.007
7. Pavlica, Z, Petelin, M, Juntes, P, Eržen, D, Crossley, DA, and Skalerič, U. Periodontal disease burden and pathological changes in organs of dogs. J Vet Dent. (2008) 25:97–105. doi: 10.1177/089875640802500210
8. Harvey, C . The relationship between periodontal infection and systemic and distant organ disease in dogs. Vet Clin North Am Small Anim Pract. (2022) 52:121–37. doi: 10.1016/j.cvsm.2021.09.004
10. Harvey, C, Serfilippi, L, and Barnvos, D. Effect of frequency of brushing teeth on plaque and calculus accumulation, and gingivitis in dogs. J Vet Dent. (2015) 32:16–21. doi: 10.1177/089875641503200102
11. Miller, BR, and Harvey, CE. Compliance with oral hygiene recommendations following periodontal treatment in client-owned dogs. J Vet Dent. (1994) 11:18–9. doi: 10.1177/089875649401100103
12. Sitzman, C . Evaluation of a hydrophilic gingival dental sealant in beagle dogs. J Vet Dent. (2013) 30:150–5. doi: 10.1177/089875641303000303
13. Roudebush, P, Logan, E, and Hale, F. Evidence-based veterinary dentistry: a systemic review of homecare for prevention of periodontal disease in dogs and cats. J Vet Dent. (2005) 22:6–15. doi: 10.1177/089875640502200101
14. Allan, RM, Adams, VJ, and Johnston, NW. Prospective randomized blinded clinical trial assessing effectiveness of three dental plaque control methods in dogs. J Small Anim Pract. (2019) 60:212–7. doi: 10.1111/jsap.12964
15. Carroll, MQ, Oba, PM, Sieja, KM, Alexander, C, Lye, L, de Godoy, MRC, et al. Effects of novel dental chews on oral health outcomes and halitosis in adult dogs. J Anim Sci. (2020) 98:9. doi: 10.1093/jas/skaa274
16. Fakhruddin, KS, Egusa, H, Ngo, HC, Panduwawala, C, Pesee, S, and Samaranayake, LP. Clinical efficacy and the antimicrobial potential of silver formulations in arresting dental caries: a systematic review. BMC Oral Health. (2020) 20:160. doi: 10.1186/s12903-020-01133-3
17. Seifo, N, Cassie, H, Radford, JR, and Innes, NPT. Silver diamine fluoride for managing carious lesions: an umbrella review. BMC Oral Health. (2019) 19:145. doi: 10.1186/s12903-019-0830-5
18. World Health Organization . Silver diamine fluoride. (2021). Available at: https://list.essentialmeds.org/recommendations/1231 (Accessed April 22, 2023).
19. Horst, JA, and Heima, M. Prevention of dental caries by silver diamine fluoride: Compendium continuing education in dentistry. Jamesburg, NJ: AEGIS publications, p.158–163. (2019).
20. Lim, GX, and Yang, J. Effect of silver diamine fluoride on hyperplastic gingivitis in an adult with intellectual disability–a case report. Spec Care Dentist. (2022) 42:73–9. doi: 10.1111/scd.12633
21. Alshehri, W . Effect of silver diamine fluoride on the treatment of gingivitis in geriatric patients. [Dissertation, doctoral dissertation]. College Station, TX: Texas A&M University (2020).
22. Niemiec, B, Gawor, J, Tang, S, and Prem, A. Krumbeck, the bacteriome of the oral cavity in healthy dogs and dogs with periodontal disease. Am J Vet Res. (2022) 83:50–8. doi: 10.2460/ajvr.21.02.0027
23. Santibanez, R, Rodriguez-Salas, C, Flores-Yanez, C, Garrido, D, and Thomson, P. Assessment of changes in the oral microbiome that occur in dogs with periodontal disease. Vet Sci. (2021) 8:12. doi: 10.3390/vetsci8120291
24. Morales-Olvarria, M, Nunez-Belmar, J, González, D, Vicencio, E, Rivas-Pardo, JA, Cortez, C, et al. Phylogenomic analysis of the Porphyromonas gingivalis – Porphyromonas gulae duo: approaches to the origin of periodontitis. Frontiers. Microbiology. (2023) 14:1226166. doi: 10.3389/fmicb.2023.1226166
25. Inaba, H, Nomura, R, Kato, Y, Takeuchi, H, Amano, A, Asai, F, et al. Adhesion and invasion of gingival epithelial cells by Porphyromonas gulae. PLoS One. (2019) 14:e0213309. doi: 10.1371/journal.pone.0213309
26. Ho, Y, Gyurko, R, Uzel, N, Steffensen, B, Xenoudi, P, Loo, C, et al. An in vitro pilot study on the effects of silver diamine fluoride on periodontal pathogens and three-dimensional scaffolds of human fibroblasts and epithelial cells. Int J Dent. (2022) 2022:9439096–8. doi: 10.1155/2022/9439096
27. Peng, JJY, Botelho, MG, and Matinlinna, JP. Silver compounds used in dentistry for caries management: a review. J Dent. (2012) 40:531–41. doi: 10.1016/j.jdent.2012.03.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Lin, Y, Rothen, ML, and Milgrom, P. Pharmacokinetics of 38% topical silver diamine fluoride in healthy adult volunteers. J Am Dent Assoc. (2019) 150:186–92. doi: 10.1016/j.adaj.2018.10.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Ellenikiotis, H . Farmacocinética de fluoruro de diamina de plata al 38% en niños. Pediatr Dent. (2021) 44:114–21.
30. Vasquez, E, Zegarra, G, Chirinos, E, Castillo, JL, Taves, DR, Watson, GE, et al. Farmacocinética sérica a corto plazo de fluoruro de plata diammina después de la aplicación oral. BMC Salud Oral. (2012) 12:60. DOI: 10.1186/1472-6831-12-60
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Castillo, JL, Rivera, S, Aparicio, T, Lazo, R, Aw, TC, Mancl, LL, et al. Los efectos a corto plazo del fluoruro de plata diammina en la sensibilidad dental: un ensayo controlado aleatorio. J Dent Res. (2011) 90:203–8. doi: 10.1177/0022034510388516
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Rosenblatt, A, Stamford, TC, and Niederman, R. Silver diamine fluoride: a caries «silver-fluoride bullet». J Dent Res. (2009) 88:116–25. doi: 10.1177/0022034508329406
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Colegio Dental Veterinario Americano . Nomenclatura dental veterinaria: Estadio de la enfermedad periodontal. (2023). Disponible en: https://www.avdc.org/nomenclature.html (consultado el 22 de abril de 2023).
34. Mateo, A, Torre, C, Crusafont, J, Sallas, A, y Jeusette, IC. Evaluación de la eficacia de un masticable dental para reducir la gingivitis, la placa dental, el cálculo y la halitosis en perros de raza de juguete. J Vet Dent. (2020) 37:22–8. doi: 10.1177/0898756420926766
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Harvey, CE, Laster, L, y Shofer, FS. Validación del uso de subconjuntos de dientes al aplicar el sistema de puntuación periodontal bucal total (TMPS) en perros. J Vet Dent. (2012) 29:222–6. doi: 10.1177/089875641202900402
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Muir, WW . Consideraciones para la anestesia general En: WJ Tranquilli, JC Thurmon, y KG Grimm, editores. Anestesia y analgesia veterinaria de Lumb y Jones. Ames, AI: Blackwell (2007). 17–30.
37. Long, JS, y Ervin, LH. Uso de errores estándar consistentes con heterocedasticidad en el modelo de regresión lineal. Am Stat. (2000) 54:217–24. doi: 10.1080/00031305.2000.10474549
38. Duangthip, D, Fung, MHT, Wong, MCM, Chu, CH y Lo, ECM. Efectos adversos del tratamiento con fluoruro de diamina de plata en niños en edad preescolar. J Dent Res. (2017) 97:395–401. DOI: 10.1177/0022034517746678
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Eid, AH . Impacto de la pigmentación de melanina en la inflamación gingival-análisis histopatológico y bioquímico. Dent J. (2012) 2:1289–94.
40. Singh, J, Rathod, VJ, Rao, PR, Patil, AA, Langade, DG, y Singh, RK. Correlación del grosor gingival con el ancho gingival, la profundidad de sondeo y el relleno papilar en dientes anteriores maxilares en estudiantes de una facultad de odontología en Navi Mumbai. Contemp Clin Dent. (2016) 7:535–8. doi: 10.4103/0976-237X.194117
41. Kyllar, M, Doskarova, B, and Paral, V. Morphometric assessment of periodontal tissues in relation to periodontal disease in dogs. J Vet Dent. (2013) 30:146–9. doi: 10.1177/089875641303000302
42. Stepaniuk, K . Periodontology In: HB Lobprise and RB Wiggs, editors. Veterinary dentistry, principles and practice. Philadelphia, PA: Lippencott-Raven (1997). 97–100.
43. Shope, B, Mitchell, P, and Carle, D. Developmental pathology and pedodontology In: HB Lobrise and J Dodd, editors. Wiggs veterinary dentistry: Principles and practice. Hoboken, NJ: John Wiley and Sons Inc (2019). 67–8.
Keywords: silver diamine fluoride, gingivitis, plaque index, periodontal disease prevention, dog
Citation: Kern A, Renteria T(, Rothen ML, Mancl LA and Milgrom P (2023) Effectiveness of silver diamine fluoride 38% on reduction of gingivitis in dogs: a randomized clinical trial. Front. Vet. Sci. 10:1255834. doi: 10.3389/fvets.2023.1255834
Received: 09 July 2023; Accepted: 01 September 2023;
Published: 20 September 2023.
Edited by:
Boaz Arzi, University of California, Davis, United States
Reviewed by:
Maria M. Soltero-Rivera, University of California, Davis, United States
Florian Boutoille, Centre Hospitalier Vétérinaire Atlantia, France
Derechos de autor © 2023 Kern, Renteria, Rothen, Mancl y Milgrom. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Amarett Kern, kern.amarett@gmail.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía