Golosinas que contienen cannabidiol (CBD) en la respuesta canina a una prueba de respuesta al miedo inducida por ruido
El impacto de la alimentación con golosinas que contienen cannabidiol (CBD) en la respuesta canina a una prueba de respuesta al miedo inducida por ruido
 Elizabeth M. Morris1
Elizabeth M. Morris1  Susanna E. Kitts-Morgan2
Susanna E. Kitts-Morgan2  Dawn M. Spangler2
Dawn M. Spangler2  Kyle R. McLeod1
Kyle R. McLeod1  João H. C. Costa1
João H. C. Costa1  David L. Harmon1*
David L. Harmon1*- 1Departamento de Ciencias Animales y de los Alimentos, Universidad de Kentucky, Lexington, KY, Estados Unidos
- 2Facultad de Medicina Veterinaria, Lincoln Memorial University, Harrogate, TN, Estados Unidos
El interés está aumentando con respecto al uso de cannabidiol (CBD) en animales de compañía debido a la evidencia anecdótica de efectos beneficiosos para el comportamiento y la salud. El propósito de esta investigación fue evaluar la influencia del CBD en las respuestas conductuales a estímulos inductores de miedo en perros. Se utilizaron dieciséis perros (18,1 ± 0,2 kg) en un experimento replicado de diseño cuadrado latino de 4 × 4 con tratamientos dispuestos en un factorial de 2 × 2, que consistió en control, 25 mg de CBD, trazodona (100 mg para 10-20 kg de peso corporal, 200 mg para 20,1-40 kg de peso corporal) y la combinación de CBD y trazodona. Se utilizó un modelo de fuegos artificiales de miedo inducido por el ruido para evaluar la eficacia del CBD después de 7 días de suplementación. Cada prueba duró un total de 6 minutos y consistió en una fase de habituación ambiental de 3 minutos sin ruido y una fase de ruido de 3 minutos con una pista de fuegos artificiales. El plasma se recolectó 1 h antes, inmediatamente después y 1 h después de la prueba para el análisis de cortisol. Los comportamientos en cada bloque de 3 minutos se grabaron en video y se ajustaron sensores de frecuencia cardíaca (FC) para la recopilación de parámetros de FC y variabilidad de FC. El personal de investigación que administraba las golosinas y analizaba los datos de comportamiento no tenía en cuenta los tratamientos administrados. Se comprobó la normalidad de los datos mediante el procedimiento UNIVARIADO en SAS, y luego se examinaron las diferencias mediante el procedimiento MIXED con efectos fijos de la interacción tratamiento, período, tiempo y tratamiento x tiempo. La duración de la inactividad y la FC aumentaron durante el primer minuto de la pista de fuegos artificiales en comparación con 1 minuto antes (P < 0,001 y P = 0,011, respectivamente), lo que indica que el modelo de fuegos artificiales generó con éxito una respuesta de miedo. La trazodona redujo el cortisol plasmático (P < 0,001), que no se vio afectado por el CBD (P = 0,104) o la combinación con CBD (P = 0,238). Ni el CBD ni la trazodona afectaron a la duración de la inactividad (P = 0,918 y 0,329, respectivamente). La trazodona aumentó el tiempo de permanencia con la cola relajada (P = 0,001). El CBD tendió a aumentar la FC (P = 0,093) y disminuyó el pico de las bandas de baja y alta frecuencia (LF y HF , P = 0,011 y 0,022, respectivamente). Estos resultados no respaldan un efecto ansiolítico del CBD en perros a los que se les administró 1,4 mg de CBD/kg de peso corporal/día.
Introducción
La aversión o reactividad al ruido es uno de los comportamientos temerosos más comunes en los perros, ya que entre el 40 y el 50% de los perros demuestran al menos un comportamiento temeroso en respuesta a la exposición al ruido (1, 2). Sin embargo, existe una variación considerable en las respuestas conductuales al ruido. Algunos perros reducirán su actividad, mientras que otros se volverán hiperactivos. Algunos cambios de comportamiento, como jadear y esconderse, son leves, mientras que otros, como la destructividad y el autotrauma, son más extremos y potencialmente peligrosos para la salud y el bienestar tanto del perro como del dueño (3). Tan extremo y perjudicial; El estrés asociado con el miedo reduce la salud general y la esperanza de vida (4, 5).
A pesar de la prevalencia de los comportamientos de aversión al ruido en los perros, con frecuencia no se tratan, ya que menos de un tercio de los dueños de perros informaron que buscarían asesoramiento para el tratamiento de la aversión al ruido (1). Los posibles regímenes de tratamiento para diversos comportamientos de aversión al ruido incluyen la desensibilización sistemática con un sistema de entrenamiento basado en EC y la administración de medicamentos o productos naturales (3). Existen varios medicamentos comúnmente recetados para el tratamiento de los trastornos del comportamiento canino asociados con el miedo y la ansiedad, incluidas las benzodiacepinas, los inhibidores selectivos de la recaptación de serotonina y los antidepresivos tricíclicos (6, 7). Sin embargo, algunos propietarios pueden dudar en administrar dichos medicamentos, ya sea debido a la posibilidad de efectos secundarios indeseables, prejuicios personales contra el uso de medicamentos o costo. Esto ha llevado a un mayor interés en el uso de productos de extractos naturales para alterar los comportamientos temerosos, como las feromonas para apaciguar a los perros o los suplementos orales como la L-teanina, un hidrolizado tríptico de proteína de leche e hidrolizado de pescado (8-12). Además, ha habido un renovado interés en el uso de cannabinoides, el cannabidiol (CBD) en particular, para regular los trastornos de ansiedad tanto en humanos como en animales de compañía (13).
El cannabidiol es uno de los más de 90 cannabinoides producidos por Cannabis sativa y se ha propuesto que ejerce varios efectos beneficiosos, como actuar como agente antiinflamatorio, inmunomodulador y ansiolítico (14-16). Pero a diferencia de Δ9-tetrahidrocannabinol (THC), el otro cannabinoide principal producido por C. sativa que es tóxico para los perros, el CBD no produce efectos psicoactivos debido a su baja afinidad por el receptor CB1 (17). Los posibles efectos ansiolíticos del CBD se han atribuido a varios mecanismos, incluida su activación de la 5-HT1A y su capacidad para activar indirectamente los receptores cannabinoides mediante la inhibición del metabolismo del endocannabinoide anandamida (18, 19). Esto ha producido un gran interés en el uso del CBD como una alternativa potencial a las terapias convencionales para reducir la ansiedad. Si bien hay un trabajo considerable que examina su uso como ansiolítico en modelos humanos y roedores [revisado extensamente en (19)], este efecto aún no se ha examinado en un modelo canino. Pero a pesar de la falta de evidencia, la ansiedad canina y la aversión al ruido son algunas de las razones más comunes por las que los dueños de mascotas buscan información y administran CBD a sus mascotas (20).
A medida que el interés y el uso del CBD en animales de compañía continúa aumentando, existe una necesidad crítica de investigación que evalúe tanto la seguridad como la eficacia del uso del CBD para la ansiedad canina. Por lo tanto, el objetivo del presente estudio fue evaluar la influencia del CBD en las respuestas conductuales a los estímulos que inducen miedo en perros, con la hipótesis subyacente de que el CBD reduciría las respuestas de miedo y ansiedad. Esta hipótesis se probó utilizando un modelo de fuegos artificiales de miedo y ansiedad inducidos por el ruido en el que se evaluó la eficacia del CBD comparando el CBD con un control positivo y negativo y con la combinación de CBD con el control positivo. Se esperaba que todos los tratamientos redujeran las respuestas de miedo y ansiedad en comparación con el control negativo.
Materiales y métodos
Este estudio fue revisado y aprobado por el comité institucional de cuidado y uso de animales de la Universidad Lincoln Memorial (LMU) (número de protocolo: 1811-RES) antes del inicio del estudio. Todo el alojamiento y la cría recibidos estaban de acuerdo con la Ley de Bienestar Animal, la Guía para el Cuidado y Uso de Animales de Laboratorio (8ª ed.) y todos los SOP de LMU aplicables.
Asignaturas y Vivienda
Veinticuatro perros adultos intactos (12 machos, 12 hembras; 1 a 5 años de edad; 17,7 ± 3,9 kg) de varias razas mixtas, incluyendo mezclas de Cur, Labrador, Sabueso, Bóxer, Pastor, Danés, Schipperkee, Springer Spaniel y Pit fueron recibidos de un refugio local para su inclusión en este estudio. Se pidió al refugio que proporcionara perros de 16 ± 4 kg. Además, el refugio fue informado y dio su consentimiento para el uso de los perros con fines de investigación antes de su llegada. Antes de comenzar el experimento, a cada perro se le realizó un hemograma completo (CBC) y un análisis químico del suero (IDEXX Laboratories, Inc., Westbrook, ME), junto con una evaluación física por parte de un veterinario y un examen fecal para descartar cualquier enfermedad subyacente que pudiera impedir la inscripción. Se excluyó a los perros que demostraron problemas graves de comportamiento, como agresión humana que pondría en peligro al personal de investigación, que estaban gravemente demacrados, clasificados como una puntuación de condición corporal < 2 en una escala de 5 puntos (donde uno está demacrado y cinco es obeso), o si sus evaluaciones iniciales revelaron una enfermedad subyacente que requería más que tratamientos de rutina (como perros con gusano del corazón positivo). Dos perros fueron excluidos del experimento debido a pruebas positivas de gusano del corazón y 4 perros adicionales fueron excluidos debido a otros problemas de salud o comportamiento. Los perros fueron alojados individualmente en jaulas de 1,2 × 1,8 m dentro de una de las dos perreras del Centro de Enseñanza Veterinaria DeBusk de la LMU. Los perros se estratificaron por sexo y se distribuyeron uniformemente entre las dos perreras.
Dietas y tratamientos
Los perros fueron alimentados con Purina Pro Plan EN Gastroentérico Dry Dog Food (Nestlé Purina Inc., St. Louis, MO) para satisfacer las necesidades diarias de energía metabolizable de los perros adultos intactos en el momento del mantenimiento, calculadas como (70 BW*0.75) * 1,8 y dividido en dos comidas alimentadas a ~0,730 y 1.830 h cada día. Los perros se pesaron y puntuaron la condición corporal (escala de 5 puntos) semanalmente y las dietas se ajustaron en consecuencia. Los tratamientos se organizaron en un factorial de 2 × 2 y consistieron en (1) control (tratamiento placebo), (2) 1,4 mg de CBD/kg de peso corporal/día, (3) trazodona + 0 mg de CBD y (4) 1,4 mg de CBD/kg de peso corporal/día + trazodona. La trazodona se dosificó a 100 mg para perros que pesaban entre 10,0 y 20,0 kg y a 200 mg para perros que pesaban entre 20,1 y 40 kg, según lo recomendado por el veterinario y basado en trabajos previos (21). Debido a que la trazodona no requiere un período de adaptación extenso, las tabletas de trazodona se dosificaron a través de un Pill Pocket (Mars Petcare US, Franklin, TN) la noche anterior y la mañana de la evaluación conductual.
El CBD era un componente de un extracto de cáñamo industrial patentado (AgTech Scientific, París, KY) que se incorporó a las golosinas y se administró en forma de dos golosinas diarias, y cada golosina contenía la mitad de la dosis diaria. Los grupos que no recibieron tratamiento con CBD recibieron golosinas de control (0 mg de CBD). Tanto las golosinas de control como las de CBD estaban compuestas por los siguientes ingredientes: pollo, hígado de pollo, carpa asiática, bagre y, en el caso de las golosinas de CBD, extracto de cáñamo industrial. La dosis de CBD se seleccionó en función de un estudio preliminar de palatabilidad que evaluó el aumento de los niveles de inclusión de CBD en el consumo de alimentos y golosinas (no publicado). Las golosinas se formularon para incluir CBD en una dosis de 2 mg/kg de peso corporal/día, basándose en una estimación de que los perros pesarían una media de 16 kg. Sin embargo, según el peso medio de los perros incluidos en el estudio, la dosis real de CBD fue de 1,4 mg/kg de peso corporal/día.
Las golosinas se ofrecieron únicamente como recompensa al volver a entrar en la perrera después de hacer ejercicio dos veces al día a ~0,700 y 1,800 h cada día. Se administraron tabletas de trazodona escondidas en Pill Pockets a ~ 1,830 h la noche anterior y 1,000 h la mañana de cada prueba de respuesta al miedo inducida por ruido. En esos días se administraron bolsas de píldoras vacías a los grupos de control y de tratamiento con CBD para garantizar que el personal de investigación que administraba las golosinas estuviera ciego en cuanto a los tratamientos administrados.
Sala de pruebas y equipos
La sala de pruebas era una sala de aislamiento de ~2,72 × 3,38 m ubicada en el lado opuesto del edificio en relación con donde se alojaban los perros. La habitación contenía una mesa y armarios montados en la pared, un conjunto de perreras metálicas cerradas y una cama de tela para perros. Los perros podían interactuar con estos objetos, pero ninguno obstruía la vista de las cámaras. Dos cámaras (Modelo BRC-Z700, Sony Co., Nueva York, NY y Modelo B07DQPS3KY, QallExpress International, China) se aseguraron en lados opuestos de la habitación cerca del techo, a ~ 2 m del suelo, para garantizar que los perros estuvieran a la vista en todo momento. Los perros fueron aislados en la sala de pruebas; Los adiestradores monitoreaban a los perros desde la habitación contigua a través de las cámaras y no podían ser vistos por los perros. Se colocaron dos altavoces Bluetooth (Bose Co., Framingham, MA) en lados opuestos de la habitación, cerca de las cámaras, para crear un efecto de sonido envolvente durante las pruebas de ruido. Entre las pruebas de cada perro, la habitación se limpió con Rescue™ Concentrate (Virox Animal Health, Oakville, ON, Canadá), un desinfectante acelerado a base de peróxido de hidrógeno.
Aclimatación
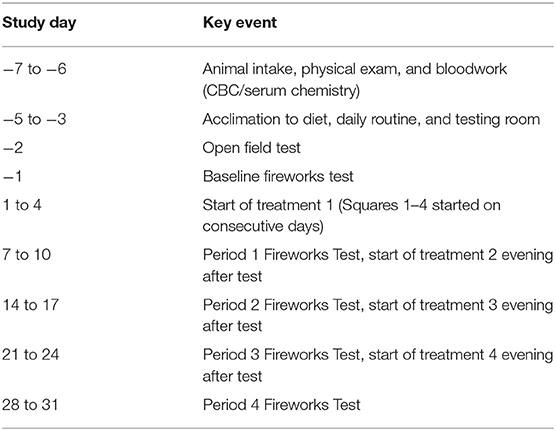
Después de la admisión y el ingreso en el estudio, todos los perros se adaptaron a su entorno, dieta, rutina diaria y a la sala de pruebas durante 3 días (Tabla 1), en la que los perros pasaron 6 minutos en la sala de pruebas donde se monitoreó el comportamiento, pero no se puntuó. Después de la adaptación en 3D se realizó una prueba de campo abierto de referencia, en la que se colocaron perros en la sala de pruebas, se puntuó el comportamiento, pero no se reprodujo ninguna pista de ruido (que se describe a continuación). Al día siguiente, se realizó una prueba de fuegos artificiales de referencia de 6 minutos (descrita a continuación). Tanto la prueba de campo abierto como la prueba de fuegos artificiales de referencia se utilizaron únicamente para seleccionar perros para su inclusión en el estudio. Perros que no muestran al menos un cambio de comportamiento entre la prueba de campo abierto y la prueba de fuegos artificiales; Se excluyeron del estudio comportamientos como encogerse, temblar, vocalizar, destructividad o meter la cola. Los perros incluidos en el estudio pasaron 6 minutos en la sala de pruebas todos los días durante todo el experimento para eliminar la posibilidad de cambios de comportamiento debido al nuevo entorno de la sala de pruebas. Con el fin de aclimatar a los perros al procedimiento de prueba, se colocaron bandas de monitor de frecuencia cardíaca en los perros para la adaptación diaria a la sala de pruebas. Además, se simularon extracciones de sangre en los días en que no se realizaron pruebas sujetando a los perros y sujetando las venas cefálicas y yugulares antes de colocarlos en la sala de pruebas. La prueba de fuegos artificiales se realizó el último día de cada período de 7 días (Tabla 1).
Pruebas de campo abierto y fuegos artificiales
Se utilizó un modelo de fuegos artificiales de miedo y ansiedad inducidos por el ruido para evaluar la efectividad de los tratamientos. Todos los perros recibidos del refugio (n = 24) recibieron 1 prueba de campo abierto y 1 prueba de fuegos artificiales de referencia. Todos los perros incluidos en el estudio (n = 16) también recibieron 1 prueba de fuegos artificiales por período de 7 días (5 pruebas de fuegos artificiales en total), cada una con una duración de 6 minutos. Durante la prueba de campo abierto, los perros se colocaron en la sala de pruebas y su comportamiento se registró en dos bloques de 3 minutos donde no se reprodujo ninguna pista de fuegos artificiales para evaluar el comportamiento de referencia de los perros en la sala de pruebas. Durante las pruebas de fuegos artificiales, el primer bloque de 3 minutos fue el mismo que la prueba de campo abierto en la que no se reprodujo ningún ruido (Pre-Noise), y la pista de fuegos artificiales se reprodujo a través de un sistema de altavoces estéreo (media) durante el segundo bloque de 3 minutos (Ruido).
En trabajos anteriores que utilizaron este modelo, se utilizó una pista de tormenta eléctrica para probar la respuesta de miedo inducida por el ruido en perros (9, 22). Sin embargo, se utilizó un video de fuegos artificiales (https://www.youtube.com/watch?v=5eLcHJLDlI8) porque según Blackwell et al. (1) un mayor porcentaje de perros responden a los fuegos artificiales que a las tormentas eléctricas. Esta prueba de respuesta al miedo inducida por ruido utilizada en este estudio fue una versión modificada de la desarrollada y validada por Araujo et al. (22). Utilizaron una prueba de 9 minutos que incluyó puntos de tiempo «antes», «durante» y «después» de la tormenta eléctrica. Debido a que no vieron diferencias de comportamiento (es decir, duración cerca de la puerta, duración de la inactividad) entre los puntos de tiempo «durante» y «después» del trueno, la prueba para este estudio se acortó a 6 minutos, terminando inmediatamente después de que terminara la pista de fuegos artificiales (punto de tiempo de ruido). Esto permitió que la recolección inmediata de muestras de sangre después de la prueba se obtuviera más rápidamente después de la prueba de fuegos artificiales. La media de 90 dB se seleccionó en base a trabajos previos (9, 22) que tuvieron éxito en la generación de una respuesta utilizando una trayectoria de tormenta eléctrica de igual o menor decibelio. Los comportamientos en cada bloque de tiempo de 3 minutos se registraron y analizaron como puntos de tiempo separados (Pre-Ruido y Ruido).
Diseño Experimental
Se incluyeron dieciséis perros (7 machos, 9 hembras; 1 a 4 años de edad, peso medio 18,1 ± 0,2 kg). Los perros fueron seleccionados en función de su respuesta conductual a la prueba de miedo inducida por el ruido de referencia (descrita anteriormente), en la que comportamientos como encogerse, sacudirse, vocalizar, destructividad y meter la cola al comienzo de la pista de fuegos artificiales indicaban que el perro era reactivo al ruido. Estos comportamientos se seleccionaron ya que se habían utilizado previamente para evaluar la reactividad al ruido (9, 12, 23). A continuación, los perros incluidos se organizaron en un experimento de diseño de 4 × 4 cuadrados latinos replicado en el que los perros dentro de cada cuadrado (4 perros por cuadrado) fueron asignados al azar para recibir uno de los cuatro tratamientos cada semana (períodos 1-4). Cada plaza se probó en días sucesivos con fines de programación. Los perros recibieron cada tratamiento durante un período de 7 días antes de cada una de las pruebas de respuesta al miedo inducido por el ruido (Tabla 1).
En los días de prueba, todos los procedimientos experimentales comenzaron a las 1.200 h. Las golosinas de CBD se administraron ~ 4 a 6 horas antes de la prueba, y la dosis matutina de trazodona se administró ~ 2 a 4 h antes de la prueba. Los perros recibieron la prueba a la misma hora cada semana. No se incluyó ningún período de lavado entre los períodos de tratamiento. En el momento de la finalización de este estudio (julio de 2018), había poca literatura disponible sobre la farmacocinética de la administración oral de CBD. Samara et al. (24) informaron que la vida media de la administración intravenosa de CBD era de 6 a 9 h, pero no tenían una estimación de una dosis oral. Para una dosis similar de trazodona, Jay et al. (21) informaron de una vida media de eliminación de 166 min. A partir de estas vidas medias, se decidió que el período de tratamiento de 7 días sería suficiente para permitir la eliminación de los tratamientos anteriores antes de la siguiente prueba y, al mismo tiempo, permitir la aclimatación al siguiente tratamiento. Además, las limitaciones de tiempo en la disponibilidad de las perreras en las que se alojaban los perros impidieron la inclusión de períodos de lavado.
Debido a las limitaciones de programación, la prueba comenzó tan pronto como los perros ingresaron a la sala de pruebas en los días de prueba. Esto no permitió que ni la VFC ni el comportamiento volvieran a la normalidad después del traslado de la perrera a la sala de pruebas. Para tener en cuenta esto, solo se utilizaron datos del último minuto del punto de tiempo previo al ruido para representar el comportamiento y la VFC de los perros durante ese punto de tiempo, que sirvieron como referencia de su comportamiento normal antes de que comenzara la pista de fuegos artificiales. Además, solo se utilizó el primer minuto del punto de tiempo de ruido para representar el comportamiento de los perros y la VFC durante ese punto de tiempo con el fin de evaluar la reacción inicial de los perros al tracto de fuegos artificiales.
Recogida de datos
El consumo de alimentos y golosinas, la consistencia de las heces, la frecuencia de eliminación, la actividad durante el ejercicio, el color de la membrana mucosa y otros indicadores del estado general de salud fueron monitoreados dos veces al día por el personal de investigación. También se monitoreó la evidencia de cualquier evento adverso, definido como cualquier aparición de síntomas que no se esperaría en perros normales. Sin embargo, no se observaron eventos adversos en ningún perro después de la administración de golosinas de CBD durante este estudio.
El día de cada prueba de fuegos artificiales, se recogieron muestras de sangre (5 ml) a través de la venopunción yugular o cefálica 1 h antes de la prueba, inmediatamente después de la prueba (5-10 min después del cese de la exposición al ruido) y nuevamente 1 h después de la prueba para el análisis de cortisol y CBD. Las muestras de sangre se recogieron en tubos de plasma de EDTA, se centrifugaron a 1.645 × g y se almacenaron a -80 °C para su posterior análisis. Las muestras de plasma se analizaron por duplicado para detectar cortisol utilizando un kit comercial de radioinmunoensayo (MP Biomedicals, LLC, Solon, OH). La sensibilidad notificada para el radioinmunoensayo fue de 1,7 ng/ml, y los coeficientes de variación intra e interensayo fueron de 5,3-8,9% y 7,5-9,3%, respectivamente.
Se utilizaron sensores de frecuencia cardíaca Polar H10 (Polar Electro Inc., Bethpage, NY) para la recopilación de parámetros de frecuencia cardíaca (FC) y variabilidad de la frecuencia cardíaca (VFC) a través de la conexión Bluetooth a una aplicación de iPhone (Heart Rate Variability Logger, Marco Altini). Los parámetros medidos se definen en la Tabla 2. En general, la FC aumentará y la VFC disminuirá en respuesta a estímulos estresantes como resultado de un aumento en la actividad del sistema nervioso simpático (25). Por lo tanto, se esperaría que un tratamiento efectivo disminuyera la FC y aumentara la VFC, lo que indica una mayor actividad parasimpática. Justo antes de las pruebas de campo abierto y fuegos artificiales, las bandas del monitor de frecuencia cardíaca se colocaron alrededor del pecho de los perros inmediatamente detrás de las patas delanteras, con la superficie de goma colocada ventralmente inmediatamente detrás de la pata delantera izquierda. El gel de electrodo se aplicó generosamente a la superficie de goma de la banda del transmisor para promover la conductividad. Debido a que todos los perros tienen el pelo corto y el uso de gel de electrodos, los perros no tuvieron que ser afeitados para promover la conductividad.
 TABLA 2. Definición de los parámetros de frecuencia cardíaca (FC) y variabilidad de la frecuencia cardíaca (VFC).
TABLA 2. Definición de los parámetros de frecuencia cardíaca (FC) y variabilidad de la frecuencia cardíaca (VFC).
Dos cámaras montadas a ~2 m del suelo en esquinas opuestas de la sala de pruebas grabaron continuamente todos los datos de vídeo y audio de cada prueba. La duración de los comportamientos dados en la Tabla 3 fue registrada por un solo observador entrenado que fue cegado a los tratamientos utilizando el software The Observer XT (Noldus Information Technology Inc., Leesburg, VA). Tres de los perros incluidos en el estudio tenían la cola cortada y, como tales, no tenían datos sobre la postura de la cola. Las conductas evaluadas se seleccionaron en función de las medidas conductuales utilizadas en trabajos previos que evaluaban la ansiedad y el miedo caninos (5, 23, 26). Con base en estos estudios previos, se esperaba que la duración de los comportamientos temerosos, como jadear, encogerse y doblar la cola, aumentara durante la prueba de fuegos artificiales. Por lo tanto, se esperaba que un tratamiento eficaz disminuyera la duración de tales conductas de miedo. Los comportamientos en diferentes categorías de comportamiento (es decir, movimiento vs. postura de la cola) no eran mutuamente excluyentes, mientras que los comportamientos dentro de una categoría de comportamiento eran mutuamente excluyentes.
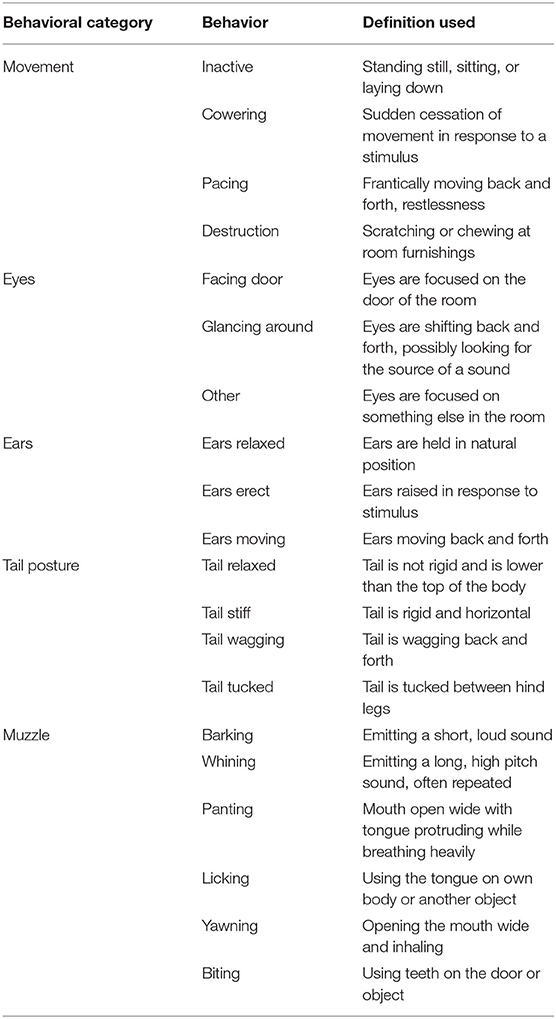 TABLA 3. Etograma de comportamientos rastreados por un solo observador entrenado ciego a los tratamientos con The Observer XT (Noldus Information Technology Inc., Leesburg, VA).
TABLA 3. Etograma de comportamientos rastreados por un solo observador entrenado ciego a los tratamientos con The Observer XT (Noldus Information Technology Inc., Leesburg, VA).
Análisis estadístico
La normalidad de la distribución de los datos se comprobó mediante el procedimiento UNIVARIADO en SAS (SAS Institute, Cary, NC) sobre el residuo de los datos. En los casos en que los datos no cumplían con los supuestos de normalidad, se realizó un análisis estadístico de la transformación logarítmica natural de los datos. Sin embargo, los datos se volvieron a transformar con fines de presentación de informes. El error estándar de los datos retrotransformados se calculó a partir de los límites de confianza de los datos transformados de la siguiente manera: SEM = (límite superior retrotransformado–límite inferior retrotransformado)/3,92. El denominador se relaciona con el valor Z de un intervalo de confianza del 95% (± 1,96). El encogimiento, el paseo, la destrucción, el movimiento de la cola, la cola metida y todos los comportamientos del hocico no pudieron analizarse debido a la insuficiencia de ocurrencias que impedían que los datos cumplieran con los supuestos de normalidad. Con la excepción de HR, pNN50 y HF, los parámetros no se distribuyeron normalmente y se analizaron utilizando el logaritmo natural de los datos.
A continuación, se analizó el cortisol en sangre mediante el procedimiento MIXED en SAS, incluidos los efectos fijos del CBD, la trazodona, el período (semanas 1-4), el tiempo (-60, 0 y 60 min), la interacción del CBD y la trazodona, y la interacción del CBD por la trazodona en el tiempo. Los efectos aleatorios incluyeron el cuadrado y el perro anidado dentro del cuadrado y el efecto repetido del tiempo. También se analizaron todos los datos de comportamiento y VFC del minuto 1 inmediatamente anterior (Pre-Ruido) y el primer minuto de la prueba de respuesta al miedo inducida por ruido (Ruido) utilizando el procedimiento MIXED en SAS, incluidos los efectos fijos del CBD, la trazodona, el período (Semanas 1-4), el tiempo (Pre-Ruido y Ruido) y todas las interacciones que lo acompañan. Los efectos aleatorios incluyeron el cuadrado y el perro anidado dentro del cuadrado y el efecto repetido del tiempo. Los efectos se consideraron significativos cuando P ≤ 0,05 y se consideraron tendencia cuando P ≤ 0,10.
Resultados
Cortisol en sangre
Hubo un efecto global de la menstruación sobre el cortisol sanguíneo (P = 0,024). El cortisol sanguíneo se redujo en el período 1 en comparación con los períodos 3 y 4 (P = 0,003 y 0,003, respectivamente), pero fue similar en todos los demás períodos (P > 0,05). El cortisol en sangre no se vio afectado por el momento de la recolección y el CBD (P = 0,189, 0,104, respectivamente). Del mismo modo, ni el CBD x trazodona, el tiempo × CBD, el tiempo × trazodona, ni el tiempo × CBD × las interacciones trazodona afectaron al cortisol sanguíneo (P = 0,238 0,772, 0,667 y 0,812, respectivamente). Sin embargo, la trazodona redujo las concentraciones de cortisol en sangre (Figura 1; P < 0,0001).
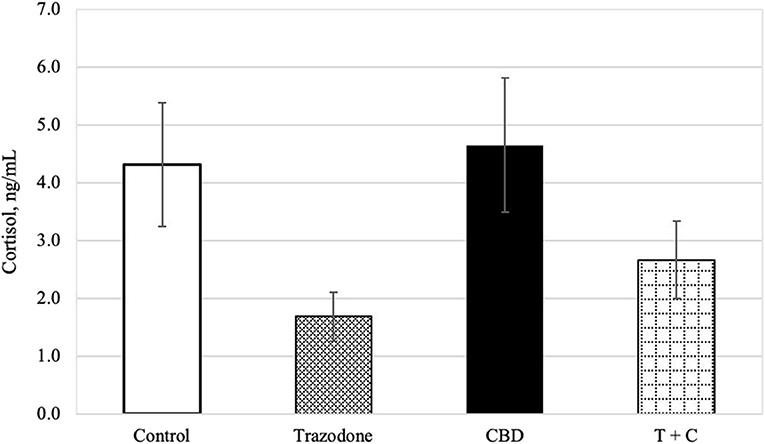 FIGURA 1. Concentración de cortisol (ng/mL) para cada tratamiento (n = 16), retrotransformado después del análisis. Las barras de error representan el error estándar de la media del tratamiento (SEM), que se calculó a partir del intervalo de confianza retrotransformado para cada tratamiento: SEM = (límite superior-límite inferior)/3,92. Debido a la falta de efecto del tiempo (P = 0,189) y a cualquier interacción con el tiempo (P > 0,05), se han combinado todos los puntos temporales (Pre-Ruido y Ruido). El tratamiento con trazodona redujo la concentración de cortisol (P < 0,001), mientras que no hubo efecto del CBD (P = 0,104) ni de la interacción CBD por trazodona (P = 0,238).
FIGURA 1. Concentración de cortisol (ng/mL) para cada tratamiento (n = 16), retrotransformado después del análisis. Las barras de error representan el error estándar de la media del tratamiento (SEM), que se calculó a partir del intervalo de confianza retrotransformado para cada tratamiento: SEM = (límite superior-límite inferior)/3,92. Debido a la falta de efecto del tiempo (P = 0,189) y a cualquier interacción con el tiempo (P > 0,05), se han combinado todos los puntos temporales (Pre-Ruido y Ruido). El tratamiento con trazodona redujo la concentración de cortisol (P < 0,001), mientras que no hubo efecto del CBD (P = 0,104) ni de la interacción CBD por trazodona (P = 0,238).
Frecuencia cardíaca y variabilidad de la frecuencia cardíaca
Hubo un efecto del período tanto en la FC como en la AVNN (Tabla 4; P = 0,005 y 0,046, respectivamente). La frecuencia cardíaca en el período 4 tendió a ser menor que en el período 1 (P = 0,075) y fue menor que en los períodos 2 y 3 (P = 0,004 y 0,001, respectivamente). La frecuencia cardíaca fue similar entre los períodos 1, 2 y 3 (P > 0,05). La media de intervalos latido a latido (AVNN) aumentó en el período 4 en comparación con todos los demás períodos (P = 0,021, 0,018 y 0,030, respectivamente), pero fue similar entre todos los demás períodos (P > 0,05). Todas las demás variables de FC y VFC no se vieron afectadas por el período (P > 0,05).
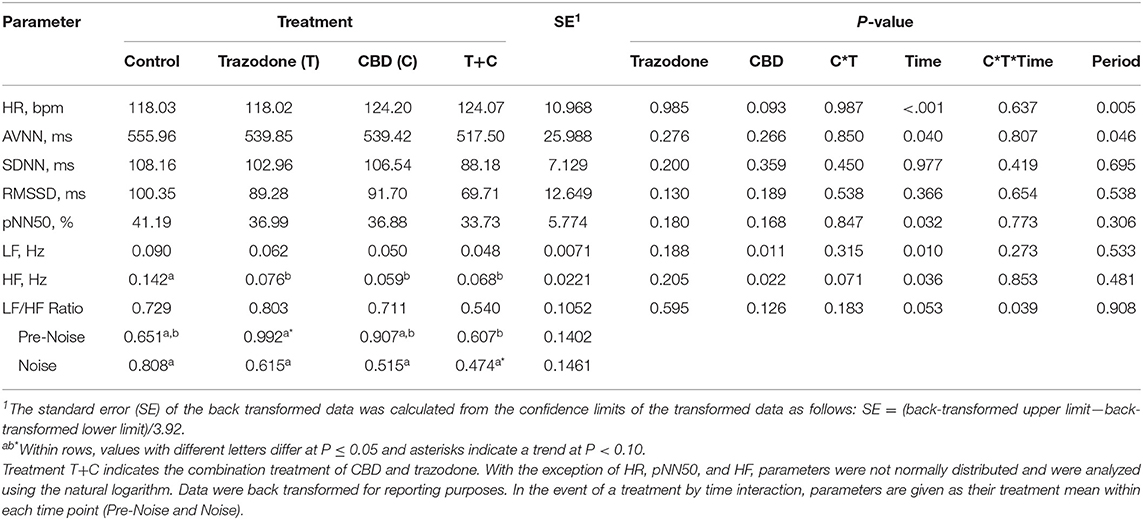 TABLA 4. Efecto de la interacción entre la trazodona (T), EL CBD (C), EL CBD por la trazodona (CT), el tiempo (Pre-Ruido y Ruido), el CBD por la trazodona por el tiempo (CTTime) y el período sobre los parámetros de la frecuencia cardíaca media (FC) y la variabilidad de la frecuencia cardíaca (HRV) durante 1 minuto inmediatamente antes (Pre-Ruido) y el primer minuto (Ruido) de las pruebas de respuesta al miedo inducidas por el ruido administradas después de cada período de tratamiento de 7 días.***
TABLA 4. Efecto de la interacción entre la trazodona (T), EL CBD (C), EL CBD por la trazodona (CT), el tiempo (Pre-Ruido y Ruido), el CBD por la trazodona por el tiempo (CTTime) y el período sobre los parámetros de la frecuencia cardíaca media (FC) y la variabilidad de la frecuencia cardíaca (HRV) durante 1 minuto inmediatamente antes (Pre-Ruido) y el primer minuto (Ruido) de las pruebas de respuesta al miedo inducidas por el ruido administradas después de cada período de tratamiento de 7 días.***
Con la excepción de SDNN y RMSSD, la FC y todas las demás variables de VFC se vieron afectadas por el punto de tiempo (Pre-Ruido vs. Ruido) (Tabla 4; P < 0,05). La FC fue menor durante el punto de tiempo previo al ruido en comparación con el punto de tiempo de ruido (P < 0,001), mientras que los parámetros de VFC afectados por el tiempo (AVNN, pNN50, LF y HF) fueron más altos durante el punto de tiempo previo al ruido que durante el punto de tiempo de ruido (P < 0,05). La relación LF/HF tendió (P = 0,053) a ser mayor en el punto de tiempo previo al ruido en comparación con el punto de tiempo de ruido.
El CBD tendió a aumentar la FC global (Tabla 4; P = 0,093) y disminución de la LF independientemente del momento (P = 0,011). Todos los tratamientos redujeron la IC en comparación con el control (P < 0,05). AVNN, SDNN, RMSSD y pNN50 no se vieron alterados por el CBD y la trazodona (P < 0,05). Ninguna variable de VFC se vio afectada por la interacción CBD por el tiempo ni la trazodona por el tiempo (P > 0,05). El CBD por trazodona por interacción temporal influyó en la relación LF/HF (P = 0,039). Durante el período previo al ruido, la trazodona tendió (P = 0,061) a aumentar la relación LF/HF en comparación con el control y aumentó la relación LF/HF en comparación con la combinación de CBD y trazodona (P = 0,038). Durante el punto de tiempo de ruido, la combinación de CBD y trazodona tendió (P = 0,083) a reducir la relación LF/HF en comparación con el control.
Comportamiento
No hubo efectos del período sobre ninguna variable conductual (Tabla 5; P > 0,05). Con la excepción de la puerta de frente y la cola relajada, todos los demás comportamientos se vieron afectados por el punto de tiempo (Pre-Ruido vs. Ruido; P < 0,05). Durante el punto de tiempo de ruido, la duración de la inactividad (P = 0,011), la mirada a su alrededor (P < 0,001) y el movimiento de los oídos (P < 0,001) aumentaron en comparación con su duración durante el punto de tiempo anterior al ruido. Por el contrario, la duración de Otros ojos, Oídos relajados, Orejas erectas y Cola rígida se redujeron durante el punto de tiempo de ruido en comparación con el punto de tiempo previo al ruido (P < 0,05). En ambos puntos temporales, los perros alimentados con CBD tendían (P = 0,072) a pasar menos tiempo concentrados en algo en la habitación (Otros Ojos). Por el contrario, la trazodona aumentó la duración total de Other Eyes (P = 0,044) y el tiempo pasado con la cola relajada (P = 0,001), pero el CBD no alteró la postura de la cola (P = 0,753). Ninguna variable conductual se vio afectada por la interacción CBD por tiempo ni por trazodona por tiempo (P > 0,05).
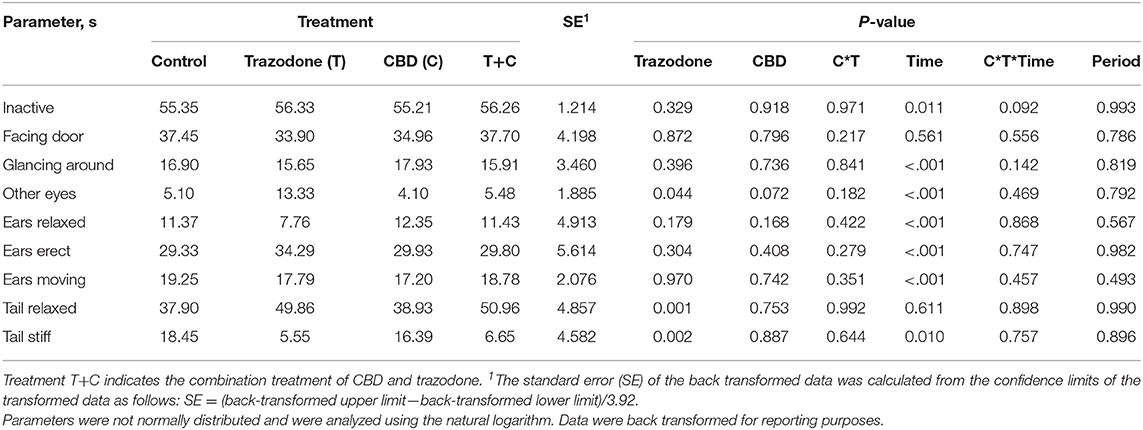 TABLA 5. Efecto de la interacción de la trazodona (T), CBD (C), CBD por trazodona (C*T), tiempo (Pre-Ruido y Ruido), CBD por trazodona por interacción temporal (C*T*Tiempo) y período en la duración de los parámetros conductuales durante 1 minuto inmediatamente antes (Pre-Ruido) y el primer minuto (Ruido) de las pruebas de respuesta al miedo inducidas por ruido administradas después de cada período de tratamiento de 7 días.
TABLA 5. Efecto de la interacción de la trazodona (T), CBD (C), CBD por trazodona (C*T), tiempo (Pre-Ruido y Ruido), CBD por trazodona por interacción temporal (C*T*Tiempo) y período en la duración de los parámetros conductuales durante 1 minuto inmediatamente antes (Pre-Ruido) y el primer minuto (Ruido) de las pruebas de respuesta al miedo inducidas por ruido administradas después de cada período de tratamiento de 7 días.
Estos cambios entre los puntos de tiempo de Pre-Ruido y Ruido pueden indicar que la prueba de fuegos artificiales generó la respuesta de comportamiento temeroso deseada. Sin embargo, los comportamientos de mirar a su alrededor y mover los oídos podrían considerarse una respuesta normal al escuchar un ruido fuerte y no necesariamente indican una respuesta temerosa al ruido. Sin embargo, dado que las conductas de miedo comunes medidas (acobardarse, caminar, vocalizaciones, etc.) no pudieron analizarse debido a la insuficiencia de ocurrencias, es difícil determinar si la prueba de fuegos artificiales fue lo suficientemente grave como para generar una respuesta de miedo.
Discusión
Desde la aprobación de la Ley de Mejora de la Agricultura de 2018, que eliminó el cáñamo industrial de la Ley de Sustancias Controladas y eliminó el CBD de la lista de medicamentos de la Lista I, el mercado del CBD derivado del cáñamo industrial ha podido expandirse considerablemente (27). Solo 1 año después de la aprobación de la ley, el mercado se estimó en $ 1.2 mil millones y se espera que crezca a más de $ 10 mil millones para 2024 (28). Gran parte de este crecimiento se puede atribuir a la percepción pública de los supuestos beneficios para la salud del CBD, incluidos los efectos analgésicos, antioxidantes, antiinflamatorios y ansiolíticos. Sin embargo, a pesar de la opinión pública general de que el CBD es un tratamiento seguro y eficaz para estas afecciones, la falta de claridad científica sobre la seguridad, la dosis y la eficacia del CBD hace que sea fundamental para la investigación continua tanto en humanos como en animales de compañía.
El presente estudio es uno de los primeros en describir el efecto del CBD en la respuesta al miedo y la ansiedad de los perros. La prueba de miedo-respuesta fue desarrollada y validada por Araujo et al. (22), en la que se colocó a los perros en la sala de pruebas durante 9 min y se reprodujo una pista de tormenta eléctrica de 3 a 6 min. En el estudio actual se utilizó una versión modificada de esta prueba, con una pista de fuegos artificiales en lugar de una pista de tormenta eléctrica, ya que la literatura previa ha demostrado que un mayor porcentaje de perros tienen miedo a los fuegos artificiales que a las tormentas eléctricas (1). Además, debido a que Araujo et al. (22) no observaron diferencias de comportamiento durante el período de tiempo «después del trueno», la prueba para este estudio se acortó a 6 minutos, terminando inmediatamente después de que terminó la pista de fuegos artificiales. Esto permitió que la recolección inmediata de muestras de sangre posteriores a la prueba se obtuviera dentro de los 10 minutos posteriores al final de la prueba de fuegos artificiales.
Si las concentraciones de cortisol hubieran disminuido con cada período posterior del experimento, habría sido una indicación de que los perros se estaban adaptando al estímulo sonoro. Si bien hubo un efecto del período sobre el cortisol, se debió a que el cortisol en los períodos 3 y 4 aumentó en comparación con el período 1. Esto puede indicar una mayor respuesta al estímulo sonoro tras una exposición repetida, lo que sugiere que los perros estaban siendo condicionados para estar estresados en la sala de pruebas a pesar de haber sido colocados en la sala en los días en que no se realizaban pruebas para evitar dicho condicionamiento. El potencial de aversión condicionada al lugar es una limitación del diseño cruzado utilizado en este estudio. Puede ser beneficioso en trabajos futuros incluir períodos de lavado o utilizar un diseño diferente para reducir el número de pruebas administradas a cada perro para prevenir este condicionamiento; sin embargo, este último requeriría un tamaño de muestra mayor que el que se necesita cuando se utiliza un diseño de cuadrado latino.
La falta de un efecto temporal sobre la concentración de cortisol en sangre también fue inesperada. Es posible que las concentraciones de cortisol no hayan cambiado porque la prueba de fuegos artificiales puede no haber producido un cambio suficiente en el miedo o el estrés en estos perros. Sin embargo, Landsberg et al. (9) demostraron que el uso de una prueba de respuesta al miedo inducida por el ruido de una tormenta eléctrica, también con un promedio de 90 dB, dio como resultado un cambio dependiente del tiempo en el cortisol en sangre, con concentraciones más altas 5 min después de la prueba en comparación con 1 h antes y después de las muestras de la prueba. Este efecto de tiempo no se replicó en este estudio. En cambio, las concentraciones de cortisol disminuyeron en cada punto de tiempo posterior, aunque no lo suficiente como para producir un efecto general del tiempo. Otros estudios también han demostrado que las concentraciones de cortisol en sangre y saliva alcanzan su punto máximo entre 5 y 20 minutos después de la exposición al ruido y comienzan a disminuir tan pronto como 30 minutos después de la exposición (23, 29, 30). Para este estudio, si bien la muestra de sangre tomada inmediatamente después de la prueba se tomó dentro de esta ventana, es posible que los niveles de cortisol aún no hubieran alcanzado su punto máximo después de la exposición al ruido. Sería beneficioso en trabajos futuros tomar muestras de sangre adicionales durante la primera hora después de la exposición al ruido para mostrar mejor los cambios de cortisol después de la exposición al ruido. Alternativamente, también es posible que la falta de efecto del tiempo sobre el cortisol se deba a un estrés inicial elevado debido al uso de animales de refugio. Franzini de Souza et al. (23) demostraron diferencias en las respuestas endocrinas y conductuales entre perros de laboratorio y de compañía en respuesta a estímulos sonoros. Si bien los animales de refugio no estuvieron representados en ese estudio, es posible que el aumento del estrés del entorno del refugio, el transporte y el nuevo entorno pueda afectar las concentraciones de cortisol y justifique una mayor investigación.
También es posible que el momento de la prueba influyera en las concentraciones de cortisol. Kolevská et al. (31) demostraron que los perros que no se sometieron a un régimen de ejercicio tenían las concentraciones más altas de cortisol en sangre entre 1.000 y 1.300 h y las concentraciones más bajas entre 1.600 y 1.900 h. Un patrón similar se observó en este experimento, con las concentraciones más altas de cortisol en la muestra pre-test de 60 min, que se habría tomado entre 1.200 y 1.400 h, y las concentraciones más bajas en el período de muestreo post-test de 60 min, que se habría tomado entre 1.400 y 1.600 h. Si bien las concentraciones de cortisol en sangre en muestras tomadas entre 1.300 y 1.600 h fueron más bajas que las tomadas entre 1.000 y 1.300 h (31), ese efecto no se observó en este estudio. Esto podría indicar que la prueba de respuesta al miedo inducida por el ruido afectó de hecho a las concentraciones de cortisol en sangre, manteniendo los niveles elevados durante la tarde en lugar de la caída normal esperada por el ritmo circadiano de la hormona. Estos resultados justifican una mayor investigación, y el trabajo futuro debería considerar la administración de la prueba de ruido más temprano en el día para tener en cuenta la posible influencia del ritmo circadiano del cortisol.
En humanos, se ha demostrado que la trazodona disminuye las concentraciones plasmáticas de cortisol en comparación con el placebo y se prescribe comúnmente para el tratamiento de la ansiedad, la depresión y para facilitar el sueño (7, 32). Si bien la trazodona no está actualmente etiquetada para su uso en perros, el uso no autorizado de trazodona es común para el tratamiento de los trastornos de ansiedad, así como para reducir la agitación y la angustia asociadas con el confinamiento posterior a la cirugía y la reducción del ejercicio (33, 34). En este experimento, el tratamiento con trazodona redujo las concentraciones de cortisol en sangre en comparación con todos los demás tratamientos. Por otro lado, el CBD no alteró las concentraciones plasmáticas de cortisol en comparación con el control en este experimento. En humanos, se ha demostrado que la administración de CBD atenúa la disminución de cortisol asociada con el ritmo circadiano de la hormona (35, 36). Mientras que otros suplementos ansiolíticos parecen reducir la ansiedad en los perros, al menos en parte, al reducir la respuesta del cortisol a los factores estresantes (9), los resultados de este estudio pueden sugerir que el CBD no ejerce un efecto ansiolítico al reducir las concentraciones de cortisol en sangre. Sin embargo, Hurd et al. (37) demostraron una disminución del cortisol salival cuando se administró una dosis de CBD a humanos de ~5 y 10 mg/kg de peso corporal, lo que puede indicar que la dosis de CBD seleccionada para este estudio (1,4 mg/kg de peso corporal) era demasiado baja para ejercer un efecto sobre el cortisol.
Otra posibilidad es que el CBD se administró demasiado temprano en el día de la prueba de fuegos artificiales. Trabajos recientes con otros productos orales de CBD con dosis similares a las de este estudio demostraron que el tiempo de concentración máxima de CBD es de alrededor de 1,5 h después de la administración y que la vida media de eliminación es de entre 1 y 4 h (16, 38, 39). Sin embargo, en el momento en que se completó este estudio (julio de 2018), estos trabajos sobre la farmacocinética del CBD aún no se habían publicado, y la literatura anterior (24) informó de una vida media mucho más larga para la administración intravenosa de CBD. Esto dio lugar a que las golosinas de CBD se administraran entre 4 y 6 h antes de la prueba en este estudio. En el futuro, puede ser necesario administrar tratamientos dentro de las 2 horas posteriores a la prueba de ruido para que el CBD tenga el mayor efecto. Esto se tuvo en cuenta en la administración de trazodona, ya que Jay et al. (21) informaron que la misma dosis de trazodona oral tenía una vida media de 166 min en perros.
Incluso si el CBD se administró demasiado pronto para ejercer un efecto ansiolítico, el CBD pareció inhibir la capacidad de la trazodona para reducir el cortisol en sangre en el tratamiento combinado en comparación con la trazodona sola. Esta observación puede respaldar trabajos anteriores que muestran que el CBD es un potente inhibidor de la familia de enzimas del citocromo P450, que es responsable del metabolismo de la trazodona a su metabolito activo, la m-clorofenilpiperazina, en el hígado (40, 41). Varios estudios han puesto de relieve estas posibles interacciones entre el CBD y los medicamentos, así como la falta de información sobre las dosis de CBD que pueden considerarse seguras para su uso, ya sea que se administren solas o en combinación con otros medicamentos (42-45). La posible interacción entre el CBD y la trazodona demostrada en este estudio respalda estas preocupaciones. Si bien se han realizado algunos trabajos que investigan las interacciones específicas entre el CBD y los medicamentos (46), puede ser desaconsejable administrar CBD concomitantemente con otros productos o medicamentos hasta que estas interacciones se diluciden más completamente.
De acuerdo con trabajos previos tanto en perros como en otras especies, la administración oral de CBD en este experimento fue bien tolerada. No se observaron eventos adversos gastrointestinales o constitucionales en los perros que recibieron CBD durante este estudio. Además, el consumo de alimentos y el peso corporal se mantuvieron constantes durante todo el experimento. Sin embargo, otros estudios que evalúan la seguridad de la administración oral de CBD en perros han informado de la posibilidad de que se produzcan efectos adversos, como letargo, problemas gastrointestinales como vómitos o diarrea, y cambios hematológicos como aumentos de las enzimas hepáticas (16, 39, 47, 48). Sin embargo, aparte de los análisis de sangre iniciales evaluados en el momento de la ingesta de animales del refugio, los cambios hematológicos no se evaluaron durante este experimento. Dado que los aumentos de las enzimas hepáticas pueden ser indicativos de una alteración de la función hepática, los efectos potenciales de la administración oral de CBD sobre los parámetros de química clínica deben monitorizarse en futuros trabajos.
La variabilidad de la frecuencia cardíaca se ha utilizado como medida del estrés y la ansiedad en varias especies animales, incluidos los perros. En particular, se ha realizado un trabajo considerable utilizando la VFC como un indicador del miedo y la ansiedad canina en respuesta a estímulos estresantes, en los que la VFC generalmente disminuye y la FC aumenta cuando los animales están bajo estrés, lo que indica una función parasimpática deteriorada y una desregulación del sistema nervioso autónomo (49-51). Los resultados de este estudio coinciden, mostrando un aumento de la FC y una disminución de la VFC (AVNN, pNN50, LF y HF) durante el estímulo de los fuegos artificiales en comparación con el punto de tiempo previo al ruido cuando no se reproducía ningún sonido. Como el AVNN representa el intervalo entre los latidos del corazón, se esperaba que la disminución del AVNN fuera paralela al aumento de la FC durante el estímulo de los fuegos artificiales. Se cree que el pNN50 se relaciona con la actividad parasimpática y también se esperaba que disminuyera con el aumento del estrés del estímulo de los fuegos artificiales (25, 52). La banda de baja frecuencia (LF) refleja principalmente la actividad de los barorreceptores en el corazón mientras está en reposo, pero puede ser generada por la actividad parasimpática, simpática o barorreceptora, dependiendo de la situación. A diferencia de otros parámetros de VFC, se espera que la banda LF aumente con el estrés, ya que se esperaría que un aumento en la actividad de los barorreceptores acompañara a un aumento en la presión arterial (25, 53). Esto no se replicó en este estudio, donde la LF disminuyó durante los estímulos de los fuegos artificiales. La banda de alta frecuencia (HF), o banda respiratoria, corresponde a las variaciones de la frecuencia cardíaca relacionadas con el ciclo respiratorio. A diferencia de la LF, la IC solo refleja la actividad parasimpática, y una IC más baja se correlaciona con el estrés y la ansiedad (54, 55). Debido a que la LF puede ser influenciada tanto por la actividad simpática como por la parasimpática, mientras que la IC solo es producida por la actividad parasimpática, la relación LF/HF se ha utilizado como una forma de estimar la actividad simpática frente a la parasimpática (56). Se cree que un aumento de la relación LF/HF indica un mayor impulso simpático, que se esperaría cuando se expone a estímulos estresantes y se ha demostrado en perros expuestos a estímulos sonoros (23, 29, 57). En este estudio, sin embargo, la relación LF/HF tendió a reducirse durante la pista de fuegos artificiales en comparación con el punto de tiempo previo al ruido. Esto, combinado con la reducción de la LF, puede indicar que la pista de fuegos artificiales no fue suficiente para causar una respuesta de miedo o estrés.
Además, el tracto de fuegos artificiales no alteró SDNN ni RMSSD en este estudio. La desviación estándar de los intervalos entre latidos (SDNN) mide cómo cambian los intervalos entre latidos a lo largo del tiempo y se ha demostrado que se reduce con el estrés (25, 52). Como tal, la SDNN generalmente se mide durante un período de recolección de 24 horas, aunque los períodos a corto plazo también se han utilizado para evaluar la variabilidad a corto plazo (58, 59). El RMSSD refleja la varianza latido a latido y se utiliza para estimar los cambios mediados por vagos en la VFC, lo que refleja la capacidad de autorregulación (56). La reducción de la RMSSD se ha asociado con el tabaquismo, el colesterol LDL alto y el estrés laboral en humanos y se ha demostrado que se reduce en perros sensibles al sonido en respuesta a la exposición al sonido (29, 55). Como algunos de los hallazgos de este estudio coinciden con trabajos anteriores y otros resultados entran en conflicto con lo que se esperaba tras la exposición a los fuegos artificiales, es posible que la prueba de fuegos artificiales no haya tenido éxito en generar la respuesta de miedo deseada. Sin embargo, algunas de estas pruebas contradictorias pueden ser el resultado del marco de tiempo ultracorto utilizado para registrar la VFC, particularmente para algunas variables que se miden más comúnmente durante períodos de tiempo más largos. El trabajo futuro debería considerar el registro de la VFC durante períodos de tiempo más largos para evaluar mejor los cambios. Solo la FC y la AVNN se vieron afectadas por el período del experimento, donde la FC se redujo en el período 4 y la AVNN aumentó en el período 4 en comparación con todos los demás períodos. Esto puede sugerir que los perros se estaban aclimatando al estímulo de los fuegos artificiales, una limitación para el diseño de este estudio. El trabajo futuro debe considerar períodos de lavado o un diseño de estudio que no requiera múltiples pruebas de respuesta al miedo inducidas por ruido para evitar este problema.
Hasta donde sabemos, no se ha realizado ningún trabajo para evaluar el efecto de la administración de CBD o trazodona sobre la VFC en perros, aunque existe cierta evidencia de que el CBD puede mejorar la VFC en humanos sanos (60). Dado que se ha demostrado que un aumento del estrés y la ansiedad debido a los estímulos sonoros aumenta la FC, la FL y la relación LF/HF, al tiempo que disminuye la RMSSD y la IC (23, 29, 57), se esperaba que tanto el CBD como la trazodona atenuaran estos cambios. En contraste con estas expectativas, tanto la LF como la HF fueron disminuidas por el CBD en este estudio en comparación con el control. Por el contrario, el CBD tendió a aumentar la FC, mientras que SDNN, RMSSD y pNN50 no se vieron afectados por el tratamiento. Mientras que la reducción de la LF indicaría que el CBD atenuó el aumento de la modulación simpática cardíaca, el aumento de la FC y la disminución de la IC sugieren lo contrario. La trazodona, de nuevo en contradicción con las expectativas, redujo la IC global en este estudio, tendió a aumentar la relación LF/HF durante el tiempo previo al ruido y no afectó a ningún otro parámetro de VFC. La combinación de CBD y trazodona también redujo la HF en comparación con el control y tendió a reducir la relación LF/HF en comparación con todos los demás tratamientos durante el momento de ruido cuando se reproducía la pista de fuegos artificiales. La falta de efecto sobre otros parámetros de VFC como SDNN y RMSSD puede deberse a que la pista de fuegos artificiales no produce un cambio en estas variables en lugar de una falta de efecto del tratamiento. Estos resultados contradictorios justifican una mayor investigación, sobre todo teniendo en cuenta la falta de información disponible sobre los efectos tanto del CBD como de la trazodona sobre la VFC en perros.
Cuando comenzó la pista de fuegos artificiales, hubo un cambio visible en el comportamiento de los perros en comparación con la prueba de campo abierto y el primer bloque de 3 minutos de las pruebas de respuesta al miedo inducido por ruido (Pre-Noise). Si bien esto puede indicar que la pista de fuegos artificiales fue capaz de generar la respuesta conductual deseada, también es posible que el cambio en el comportamiento fuera el resultado del interés de los perros en el ruido en lugar de una respuesta temerosa. Sin embargo, la considerable variabilidad en el tipo de respuestas observadas hace difícil dilucidar si el cambio se debió al miedo o si fue solo una respuesta refleja. La respuesta predominante fue una disminución de la actividad, que puede o no haber estado acompañada de una variedad de otros comportamientos, como una cola metida, temblores o vocalizaciones nerviosas como lloriqueos. Estos comportamientos temerosos habrían sido una mejor representación de los cambios de comportamiento debidos a la prueba de fuegos artificiales, ya que se han utilizado para evaluar dichos cambios en otros trabajos (9, 23, 29, 57). Sin embargo, estos comportamientos ocurrieron con muy poca frecuencia en este estudio para permitir un análisis estadístico. Esto puede ser indicativo de una falta de respuesta conductual a la prueba de fuegos artificiales. Sin embargo, como todos los perros fueron seleccionados para este experimento en función de la presentación de uno o más comportamientos temerosos durante las pruebas de referencia, esto puede simplemente resaltar la variación en las respuestas conductuales a la exposición al sonido. Se ha demostrado que otros suplementos ansiolíticos y medicamentos aumentan la actividad o la distancia recorrida utilizando este modelo (9, 22); sin embargo, ni el tratamiento con CBD ni con trazodona cambiaron la actividad en comparación con el control. Esto es particularmente sorprendente para los grupos de tratamiento que reciben trazodona, que previamente se ha demostrado que reduce visiblemente los comportamientos asociados con una serie de situaciones estresantes (34, 61, 62). Sin embargo, varios de estos estudios se basaron en encuestas completadas por los propietarios en lugar de datos objetivos para evaluar la efectividad.
Por el contrario, se ha demostrado que el CBD reduce los comportamientos ansiosos en modelos de ratones, ratas y humanos, pero en este momento hay poca o ninguna literatura sobre su efecto en el comportamiento canino. En modelos de ratón y rata, las respuestas a estímulos amenazantes o desagradables se evaluaron mediante varios métodos, incluyendo el laberinto elevado plus, la prueba de conflicto de Vogel, el condicionamiento contextual del miedo y el laberinto T elevado (63-65). El uso de estos modelos ha demostrado que la administración intraperitoneal de CBD en dosis que oscilan entre 1 y 20 mg/kg produce efectos ansiolíticos y algunas respuestas dependen de la dosis (18, 19). Aunque se utilizaron diferentes modelos de ansiedad en roedores, esto puede indicar que se necesita una dosis más alta para producir los cambios de comportamiento deseados asociados con la reducción del estrés y la ansiedad, particularmente si se administra por vía oral debido al considerable efecto de primer paso sobre el CBD en el hígado (24, 66). Las investigaciones futuras deberían investigar el efecto de una dosis más alta de CBD para perros por encima de la dosis probada en este estudio. Otra consideración importante es el tiempo de administración de CBD antes de la exposición al ruido. Como se mencionó anteriormente, se ha demostrado que el CBD oral tiene una vida media de <4 h (16, 38, 39), pero las golosinas de CBD en este experimento se dosificaron entre 4 y 6 h de prueba. Por lo tanto, es posible que la dosis utilizada en este estudio sea suficiente para generar un efecto ansiolítico si se dosifica más cerca de la prueba de fuegos artificiales. Alternativamente, el CBD puede necesitar una dosis de más de 7 días para producir efectos ansiolíticos. Se justifica una investigación futura sobre estas posibilidades.
Si bien no hubo efecto del período en ninguna variable conductual, la falta de respuesta conductual al tratamiento también podría deberse a la aclimatación de algunos de los animales a la pista de fuegos artificiales. Si bien los perros fueron seleccionados para su inclusión en el estudio en función de su reacción a la prueba de respuesta de miedo inducida por ruido de referencia, es posible que la exposición semanal al estímulo disminuyera la reacción de algunos de los perros durante las pruebas posteriores. Esta hipótesis está respaldada por el efecto del período sobre otras variables medidas en este estudio, incluyendo el cortisol plasmático, la FC y la AVNN. Esto pone de relieve una limitación importante del diseño de este estudio, en el que las limitaciones de tiempo impidieron los períodos de lavado. Para evitar este problema en trabajos futuros, los perros podrían ser bloqueados por su reacción a la prueba de referencia y asignados a un solo tratamiento durante la duración del estudio. Esto eliminaría la necesidad de múltiples pruebas de fuegos artificiales y permitiría espaciar las pruebas de referencia y de tratamiento a lo largo del tiempo, pero también requeriría un tamaño de muestra mucho mayor. Sin embargo, teniendo en cuenta el alto nivel de variabilidad en las respuestas conductuales a la prueba de fuegos artificiales, sería difícil garantizar una distribución uniforme de los perros incluso con bloqueo. Si es posible, sería ideal utilizar el diseño cruzado con períodos de lavado más largos para minimizar el potencial de aclimatación al estímulo estresante. La variabilidad en las respuestas conductuales también dificulta la cuantificación de las diferentes respuestas de miedo. Se midieron varias de las conductas de miedo más comunes (sacudidas, encogimiento, jadeo, etc.), pero no pudieron analizarse debido a la insuficiencia de ocurrencias, lo que puede explicarse en trabajos futuros agregando dichas conductas en una categoría de comportamiento. La inclusión de un grupo de control sin miedo también debe considerarse para trabajos futuros, ya que permitiría una mejor evaluación de los cambios en los comportamientos temerosos en perros reactivos.
Conclusiones
Los resultados del estudio actual no proporcionan un fuerte apoyo a un efecto ansiolítico del CBD en perros cuando se suplementa con 1,4 mg de CBD/kg de peso corporal/día. La trazodona, pero no el CBD, disminuyó la concentración plasmática de cortisol. Cuando se combina con trazodona, el CBD pareció atenuar los efectos de la trazodona sobre el cortisol plasmático. El cannabidiol disminuyó la LF y la HF, tendió a aumentar la FC y tendió a disminuir la duración de Otros Ojos. Por el contrario, la trazodona aumentó la duración de Other Eyes, aumentó el tiempo que se pasa con la cola relajada, redujo la HF y aumentó la relación LF/HF.
Sería beneficioso en futuros estudios utilizar dosis crecientes de CBD para aclarar cualquier efecto ansiolítico potencial, si está presente, y la dosis necesaria para provocar ese efecto. Este estudio demuestra la considerable variación en los comportamientos de ansiedad canina, lo que dificulta medir con precisión la respuesta a los tratamientos. Puede que no sea aconsejable administrar CBD de forma concomitante con otros productos o medicamentos, ya que los resultados de este estudio ponen de manifiesto las posibles interacciones farmacológicas asociadas al consumo de CBD. Teniendo en cuenta el creciente interés del uso de CBD en animales de compañía, la investigación continua es esencial para comprender los mecanismos por los cuales el CBD puede ejercer efectos ansiolíticos, así como los posibles riesgos, como las interacciones farmacológicas, asociados con la administración de CBD.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración de Ética
El estudio en animales fue revisado y aprobado por la Universidad Lincoln Memorial IACUC.
Contribuciones de los autores
DH, SK-M, KM y EM contribuyeron a la concepción y diseño del estudio. Los EM, SK-M y DS recogieron datos y muestras de sangre. JC proporcionó un software de análisis de comportamiento. EM realizó análisis de muestras y datos, análisis estadísticos y escribió el primer borrador del manuscrito. Todos los autores contribuyeron a la revisión del manuscrito, leyeron y aprobaron la versión enviada.
Financiación
Los autores declaran que este estudio recibió financiación de AgTech Scientific, París, KY. El financiador no participó en el diseño del estudio, la recopilación, el análisis, la interpretación de los datos, la redacción de este artículo ni la decisión de enviarlo para su publicación.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Reconocimientos
Agradecemos a los estudiantes de la Facultad de Medicina Veterinaria de la Universidad Lincoln Memorial H. Barnhart, M. Gottschalk, S. Swears, M. Grundhoefer, B. Price, K. Williams, L. Calvin, R. Keeley, M. Kight y A. Phan por su ayuda en el cuidado de los perros y la facilitación de la recolección de muestras y datos.
Referencias
1. Blackwell EJ, Bradshaw JWS, Casey RA. Respuestas de miedo a los ruidos en perros domésticos: prevalencia, factores de riesgo y co-ocurrencia con otras conductas relacionadas con el miedo. Appl Anim Behav Sci. (2013) 145:15–25. doi: 10.1016/j.applanim.2012.12.004
2. Tiira K, Sulkama S, Lohi H. Prevalencia, comorbilidad y variación conductual en la ansiedad canina. J Vet se comporta. (2016) 16:36–44. doi: 10.1016/j.jveb.2016.06.008
3. Sherman BL, Mills DS. Ansiedades y fobias caninas: una actualización sobre la ansiedad por separación y las aversiones al ruido. Vet Clin Pequeño Anim. (2008) 38:1081–106. doi: 10.1016/j.cvsm.2008.04.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Dreschel NA. Los efectos del miedo y la ansiedad en la salud y la esperanza de vida en perros de compañía. Appl Anim Behav Sci. (2010) 125:157–62. doi: 10.1016/j.applanim.2010.04.003
5. Dreschel NA, Granger DA. Reactividad fisiológica y conductual al estrés en perros con fobia a las tormentas eléctricas y sus cuidadores. Appl Anim Behav Sci. (2005) 95:153–68. doi: 10.1016/j.applanim.2005.04.009
6. Manual general de medicina clínica conductual para perros y gatos. St. Louis, MO: Elsevier Health Sciences. (2013).
7. Gruen ME, Roe SC, Griffith E, Hamilton A, Sherman BL. El uso de trazodona para facilitar el confinamiento postquirúrgico en perros. J Am Vet Med Assoc. (2014) 245:296–301. doi: 10.2460/javma.245.3.296
8. Araujo JA, de Rivera C, Ethier JL, Landsberg GM, Denenberg S, Arnold S, et al. Las tabletas ANXITANE reducen el miedo a los seres humanos en un modelo de laboratorio de comportamiento relacionado con la ansiedad. J Vet se comporta. (2010) 5:268–75. doi: 10.1016/j.jveb.2010.02.003®
9. Landsberg GM, Mougeot I, Kelly S, Milgram NW. Evaluación del miedo y la ansiedad inducidos por el ruido en perros: modificación por una nueva dieta suplementada con hidrolizado de pescado. J Vet se comporta. (2015) 10:391–8. doi: 10.1016/j.jveb.2015.05.007
10. Mills DS, Ramos D, Estelles MG, Hargrave C. A triple blind placebo-controlled investigation into the assessment of the effect of Dog Appeasing Pheromone (DAP) on anxiety related behaviour of problem dogs in the veterinary clinic. App Anim Behav Sci. (2006) 98:114–26. doi: 10.1016/j.applanim.2005.08.012
11. Palestrini C, Minero M, Cannas S, Berteselli G, Scaglia E, Barbieri S, et al. Efficacy of a diet containing caseinate hydrolysate on signs of stress in dogs. J Vet Behav. (2010) 5:309–17. doi: 10.1016/j.jveb.2010.04.004
12. Sheppard G, Mills DS. Evaluation of dog-appeasing pheromone as a potential treatment for dogs fearful of fireworks. Vet Rec. (2003) 152:432–6. doi: 10.1136/vr.152.14.432
13. Tambaro S, Bortolato M. Agentes relacionados con los cannabinoides en el tratamiento de los trastornos de ansiedad: conocimiento actual y perspectivas futuras. Reciente Pat. CND Drug Discov. (2012) 7:25–40. doi: 10.2174/157488912798842269
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Carrier EJ, Auchampach JA, Hillard CJ. Inhibición de un transportador de nucleósidos en equilibrio por cannabidiol: un mecanismo de inmunosupresión de cannabinoides. Proc Natl Acad Sci USA. (2006) 103:7895–900. doi: 10.1073/pnas.0511232103
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Crippa JA, Derenusson GN, Ferrari TB, Wichert-Ana L, Duran FLS, Martin-Santos R, et al. Bases neurales de los efectos ansiolíticos del cannabidiol (CBD) en el trastorno de ansiedad social generalizada: un informe preliminar. J Psicofarmaco. (2011) 25:121–30. doi: 10.1177/0269881110379283
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Gamble LJ, Boesch JM, Frye CW, Schwark WS, Mann S, Wolfe L, et al. Farmacocinética, seguridad y eficacia clínica del tratamiento con cannabidiol en perros con artrosis. Front Vet Sci. (2018) 5:165. doi: 10.3389/fvets.2018.00165
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Hanus LO, Tchilibon S, Ponde DE, Breuer A, Fride E, Mechoulam R. Derivados enantioméricos del cannabidiol: síntesis y unión a los receptores cannabinoides. Org Biomol Chem. (2005) 3:1116–23. doi: 10.1039/b416943c
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Blessing EM, Steenkamp MM, Manzanares J, Marmar CR. Cannabidiol como tratamiento potencial para los trastornos de ansiedad. Neuroterapéutica. (2015) 12:825–36. doi: 10.1007/s13311-015-0387-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Lee JC, Bertoglio LJ, Guimarães FS, Stevenson CW. Regulación del cannabidiol del procesamiento de la emoción y la memoria emocional: relevancia para el tratamiento de los trastornos relacionados con la ansiedad y el abuso de sustancias. Brit J Pharmacol. (2017) 174:3242–56. doi: 10.1111/bph.13724
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Kogan L, Schoenfeld-Tacher R, Hellyer P, Rishniw M. Conocimiento, experiencia y percepción de los veterinarios estadounidenses sobre el uso del cannabidiol para afecciones médicas caninas. Front Vet Sci. (2019) 5:338. doi: 10.3389/fvets.2018.00338
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Jay AR, Krotscheck U, Parsley E, Benson L, Kravitz A, Mulligan A, et al. Farmacocinética, biodisponibilidad y efectos hemodinámicos de la trazodona después de la administración intravenosa y oral de una dosis única a perros. Am J Vet Res. (2013) 74:1450–6. doi: 10.2460/ajvr.74.11.1450
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Araujo JAC, de Rivera C, Landsberg GM, Adams PE, Milgram NW. Desarrollo y validación de un nuevo modelo de laboratorio de miedo y ansiedad inducidos por el sonido en perros Beagle. J Vet se comporta. (2013) 8:204–12. doi: 10.1016/j.jveb.2012.10.008
23. Franzini de Souza CC, Maccariello CEM, Dias DPM, Almeida NADS, de Medeiros MA. Respuestas autonómicas, endocrinas y conductuales a los truenos en animales de laboratorio y de compañía. Physiol Behave. (2017) 169:208–15. doi: 10.1016/j.physbeh.2016.12.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Samara E, Bialer M, Mechoulam R. Farmacocinética del cannabidiol en perros. Medicamentos Metab Dispos. (1988) 16:469–72.
25. Kim HG, Cheon EJ, Bai DS, Lee YH, Koo BH. Estrés y variabilidad de la frecuencia cardíaca: un meta-análisis y revisión de la literatura. Investigaciones en Psiquiatría. (2018) 15:235–45. doi: 10.30773/pi.2017.08.17
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Korpivaara M, Laapas K, Huhtinen M, Schöning B, Overall K. Gel oromucoso de dexmedetomidina para la ansiedad aguda y el miedo asociados al ruido en perros: un estudio clínico aleatorizado, doble ciego y controlado con placebo. Rec. Veterinario (2017) 180:356. doi: 10.1136/vr.104045
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Johnson R. Definiendo el cáñamo: una hoja informativa. Informe del Servicio de Investigación del Congreso R 4472. Washington, DC (2019).
28. Diario de la industria del cáñamo. Libro de datos anual de la industria del cáñamo y el CBD. 2Nd edición. Lakewood, CO: Ann Holland Ventures, Inc. (2019).
29. Franzini de Souza CC, Dias DPM, Nascimento de Souza R, de Medeiros MA. Uso de respuestas conductuales y fisiológicas para puntuar la sensibilidad sonora en perros. PLoS UNO. (2018) 13:e0200618. doi: 10.1371/journal.pone.0200618
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Hydbring-Sandberg E, von Walter LW, Hoglund K, Svartberg K, Swenson L, Forkman B. (2004). Reacciones fisiológicas a la provocación del miedo en perros. J Endocrinol 180:439–48. doi: 10.1677/joe.0.1800439
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Kolevská J, Brunclík V, Svoboda M. Ritmo circadiano de la secreción de cortisol en perros de diferentes actividades diarias. Acta Vet Brno. (2003) 72:599–605. doi: 10.2754/avb200372040599
32. Monteleone P. Efectos de la trazodona sobre el cortisol plasmático en sujetos normales. Un estudio con los niveles plasmáticos de fármacos. Neuropsicofarmacología. (1991)5:61–4.
33. Chea B, Giorgi M. Trazodona: Una revisión de sus propiedades farmacológicas y su uso fuera de etiqueta en perros y gatos. Am J Anim Vet Sci. (2017) 12:188–94. doi: 10.3844/ajavsp.2017.188.194
34. Gruen ME, Sherman BL. Uso de trazodona como agente adyuvante en el tratamiento de los trastornos de ansiedad canina: 56 casos (1995-2007). J Am Vet Med Assoc. (2008) 233:1902–7. doi: 10.2460/javma.233.12.1902
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Appiah-Kusi E, Petros N, Wilson R, Colizzi M, Bossong MG, Valmaggia L, et al. Efectos del tratamiento con cannabidiol a corto plazo sobre la respuesta al estrés social en sujetos con alto riesgo clínico de desarrollar psicosis. Psicofarmacología. (2020) 237:1121–30. doi: 10.1007/s00213-019-05442-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Zuardi AW, Guimarães FS, Moreira AC. Efecto del cannabidiol sobre la prolactina plasmática, la hormona del crecimiento y el cortisol en voluntarios humanos. Braz J Med Biol Res. (1993) 26:213–7.
37. Hurd YL, Spriggs S, Alishayev J, Winkel G, Gurgov K, Kudrich C, et al. Cannabidiol para la reducción del deseo y la ansiedad inducidos por señales en individuos abstinentes de drogas con trastorno por consumo de heroína: un ensayo doble ciego aleatorizado controlado con placebo. Am J Psiquiatría. (2019) 176:911–22. doi: 10.1176/appi.ajp.2019.18101191
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Bartner LR, McGrath S, Rao S, Hyatt LK, Wittenburg LA. Farmacocinética del cannabidiol administrado por 3 métodos de administración en 2 dosis diferentes a perros sanos. Can J Vet Res. (2018) 82:178–83.
39. Deabold KA, Schwark WS, Wolf S, Wakshlag JJ. Farmacocinética de dosis única y evaluación preliminar de la seguridad con el uso de neutracéuticos de cáñamo ricos en CBD en perros y gatos sanos. Animales. (2019) 9:832. doi: 10.3390/ani9100832
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Rotzinger S, Fang J, Baker GB. La trazodona es metabolizada a m-clorofenilpiperazina por el CYP3A4 de fuentes humanas. Medicamentos Metab Dispos. (1998) 26:575.
41. Yamaori S, Ebisawa J, Okushima Y, Yamamoto I, Watanabe K. Potente inhibición de las isoformas del citocromo P450 3A humano por cannabidiol: papel de los grupos hidroxilo fenólicos en la fracción de resorcinol. Ciencia de la vida. (2011) 88:730–6. doi: 10.1016/j.lfs.2011.02.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Ewing LE, Skinner CM, Quick CM, Kennon-McGill S, McGill MR, Walker LA, et al. Hepatotoxicidad de un extracto de cannabis rico en cannabidiol en el modelo de ratón. Moléculas. (2019) 24:1694. doi: 10.3390/moléculas24091694
43. Foster BC, Abramovici H, Harris CS. Cannabis y cannabinoides: cinética e interacciones. Am J Med. (2019) 132:1266–70. doi: 10.1016/j.amjmed.2019.05.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Iffland K, Grotenhermen F. Una actualización sobre la seguridad y los efectos secundarios del cannabidiol: una revisión de los datos clínicos y los estudios relevantes en animales. Cannabinoide de Cannabis Res. (2017) 2:139–54. doi: 10.1089/can.2016.0034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Zendulka O, Dovrtelova G, Noskova K, Turjap M, Sulcova A, Hanus L, et al. Interacciones entre los cannabinoides y el citocromo P450. Curr Drug Metab. (2016) 17:206–26. doi: 10.2174/1389200217666151210142051
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Manini AF, Yiannoulos G, Bergamaschi MM, Hernandez S, Olmedo R, Barnes AJ, et al. Seguridad y farmacocinética del cannabidiol oral cuando se administra concomitantemente con fentanilo intravenoso en humanos. J Addict Med. (2015) 9:204–10. doi: 10.1097/ADM.000000000000000118
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. McGrath S, Bartner LR, Rao S, Kogan LR, Hellyer PW. Un informe de efectos adversos asociados con la administración de cannabidiol en perros sanos. Amer Holistic Vet Med Assoc. (2018) 52:34–8.
48. Vaughn D, Kulpa J, Paulionis L. Investigación preliminar de la seguridad del aumento de las dosis de cannabinoides en perros sanos. Front Vet Sci. (2020) 7:51. doi: 10.3389/fvets.2020.00051
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Craig L, Meyers-Manor JE, Anders K, Sütterlin S, Miller H. La relación entre la variabilidad de la frecuencia cardíaca y la agresión canina. Appl Anim Behav Sci. (2017) 188:59–67. doi: 10.1016/j.applanim.2016.12.015
50. Gacsi M, Maros K, Sernkvist S, Farago T, Miklosi A. Efecto de refugio seguro análogo humano del propietario: respuesta conductual y de frecuencia cardíaca a estímulos sociales estresantes en perros. PLoS UNO. (2013) 8:e58475. doi: 10.1371/journal.pone.0058475
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Wormald D, Lawrence AJ, Carter G, Fisher AD. Reducción de la variabilidad de la frecuencia cardíaca en perros domésticos afectados por problemas de comportamiento relacionados con la ansiedad. Phys Behave. (2017) 168:122–7. doi: 10.1016/j.physbeh.2016.11.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Shaffer F, Ginsberg JP. Una visión general de las métricas y normas de variabilidad de la frecuencia cardíaca. Frente Salud Pública. (2017) 5:258. doi: 10.3389/fpubh.2017.00258
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. McCraty R, Shaffer F. Variabilidad de la frecuencia cardíaca: nuevas perspectivas sobre los mecanismos fisiológicos, la evaluación de la capacidad de autorregulación y el riesgo para la salud. Glob Adv Health Med. (2015) 4:46–61. doi: 10.7453/gahmj.2014.073
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Grossman P, Taylor EW. Hacia la comprensión de la arritmia sinusal respiratoria: relaciones con el tono vagal cardíaco, evolución y funciones bioconductuales. Biol Psychol. (2007) 74:263–85. doi: 10.1016/j.biopsycho.2005.11.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Thayer JF, Yamamoto SS, Brosschot JF. La relación entre el desequilibrio autonómico, la variabilidad de la frecuencia cardíaca y los factores de riesgo de enfermedad cardiovascular. Int J Cardiol. (2010) 141:122–31. doi: 10.1016/j.ijcard.2009.09.543
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Shaffer F, McCraty R, Zerr CL. Un corazón sano no es un metrónomo: una revisión integradora de la anatomía del corazón y la variabilidad de la frecuencia cardíaca. Frente Psychol. (2014) 5:1040. doi: 10.3389/fpsyg.2014.01040
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Maccariello CEM, Franzini de Souza CC, Morena L, Dias DPM, de Medeiros MA. Efectos de la acupuntura sobre la variabilidad de la frecuencia cardíaca, los niveles de cortisol y la respuesta conductual inducida por el sonido del trueno en beagles. Physiol Behave. (2018) 186:37–44. doi: 10.1016/j.physbeh.2018.01.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Baek HJ, Cho CH, Cho J, Woo JM. Fiabilidad del análisis a ultra corto plazo como sustituto del análisis estándar de 5 minutos de la variabilidad de la frecuencia cardíaca. Telemed J E Salud. (2015) 21:404–14. doi: 10.1089/tmj.2014.0104
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Katayama M, Kubo T, Mogi K, Ikeda K, Nagasawa M, Kikusui T. La variabilidad de la frecuencia cardíaca predice el estado emocional en los perros. Procesos de comportamiento. (2016) 128:108–12. doi: 10.1016/j.beproc.2016.04.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Schmid K, Schonlebe J, Drexler H, Mueck-Weymann M. Los efectos del cannabis sobre la variabilidad de la frecuencia cardíaca y el bienestar en hombres jóvenes. Farmacopsiquiatría. (2010) 43:147–50. doi: 10.1055/s-0030-1248314
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Gilbert-Gregory SE, Stull JW, Rice MR, Herron ME. Efectos de la trazodona sobre los signos conductuales de estrés en perros hospitalizados. J Am Vet Med Assoc. (2016) 249:1281–91. doi: 10.2460/javma.249.11.1281
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Herron ME, Shreyer T. La práctica veterinaria pet-friendly: una guía para los profesionales. Vet Clin North Am Small Anim Pract. (2014) 44:451–81. doi: 10.1016/j.cvsm.2014.01.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Campos AC, de Paula Soares V, Carvalho MC, Ferreira FR, Vicente MA, Brandao ML, et al. Implicación de la neurotransmisión mediada por serotonina en la sustancia gris periacueductal dorsal sobre los efectos crónicos del cannabidiol en las respuestas de pánico en ratas. Psicofarmacología. (2013) 226:13–24. doi: 10.1007/s00213-012-2878-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Marinho ALZ, Vila-Verde C, Fogaca MV, Guimaraes FS. Efectos de las inyecciones intra-infralímbicas de cannabidiol en la corteza prefrontal en la modulación de las conductas emocionales en ratas: contribución de los receptores 5HT1A y experiencias estresantes. Behav Brain Res. (2015) 286:49–56. doi: 10.1016/j.bbr.2015.02.023
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Moreira FA, Aguiar DC, Guimaraes FS. Efecto ansiolítico del cannabidiol en la prueba de conflicto de Vogel en ratas. Prog Neuropsychopharmacol Biol Psiquiatría. (2006) 30:1466–71. doi: 10.1016/j.pnpbp.2006.06.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Trevaskis NL, Shackleford DM, Charman WN, Edwards GA, Gardin A, Appel-Dingemanse S, et al. El transporte linfático intestinal mejora la biodisponibilidad oral postprandial de un nuevo agonista de los receptores cannabinoides al evitar el metabolismo de primer paso. Pharm Res. (2009) 26:1486–95. doi: 10.1007/s11095-009-9860-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: cannabidiol, cbd, canino, comportamiento, miedo, fuegos artificiales
Cita: Morris EM, Kitts-Morgan SE, Spangler DM, McLeod KR, Costa JHC y Harmon DL (2020) El impacto de la alimentación con golosinas que contienen cannabidiol (CBD) en la respuesta canina a una prueba de respuesta al miedo inducida por ruido. Frente. Vet. Sci. 7:569565. doi: 10.3389/fvets.2020.569565
Recibido: 04 de junio de 2020; Aceptado: 20 de agosto de 2020;
Publicado: 22 Septiembre 2020.
Editado por:
Jeremy N. Marchant-Forde, Unidad de Investigación del Comportamiento Ganadero (USDA-ARS), Estados Unidos
Revisado por:
Suzanne T. Millman, Universidad Estatal de Iowa, Estados
Unidos Magda Alves De Medeiros, Universidad Federal Rural de Río de Janeiro, Brasil
Hannah Flint, Universidad de Purdue, Estados Unidos
Derechos de autor © 2020 Morris, Kitts-Morgan, Spangler, McLeod, Costa y Harmon. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: David L. Harmon, david.harmon@uky.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía