Hemoperfusión manual de carbono para el tratamiento de la toxicidad
 Lauren E. Haire
Lauren E. Haire Ámbar D. Vitalo
Ámbar D. Vitalo Ronald P. Gonçalves*
Ronald P. Gonçalves* Travis M. Lanaux
Travis M. Lanaux- Departamento de Ciencias Clínicas de Pequeños Animales, Universidad de Florida, Gainesville, FL, Estados Unidos
La purificación extracorpórea de la sangre (ECBP, por sus siglas en inglés) se ha convertido en una opción de tratamiento popular para la toxicidad de los medicamentos antiinflamatorios no esteroideos (AINE) en animales pequeños. Sin embargo, surgen desafíos cuando se usa ECBP para perros y gatos pequeños porque el volumen de cebado requerido por la mayoría de las plataformas ECBP basadas en máquinas puede ser excesivo, lo que lleva a la inestabilidad cardiovascular si no se usa un cebado sanguíneo. Este informe describe el uso exitoso de la hemoperfusión manual de carbono (MCHP) para reducir los niveles plasmáticos de meloxicam en un gato después de una sobredosis inadvertida y su uso en un perro después de una sospecha de ingestión de ibuprofeno. En ambos animales, MCHP redujo el volumen del circuito necesario para ECBP de 125 mL con un intercambio de plasma terapéutico basado en una máquina o 104 mL con una hemoperfusión de carbono en serie en una plataforma de hemodiálisis intermitente a solo 40-50 mL. En el gato, MCHP redujo los niveles plasmáticos de meloxicam en un 44%, y en ambos animales, el uso de MCHP en estas mascotas fue bien tolerado y seguro. Debido a la anemia preexistente, el gato requirió una transfusión de sangre, pero el perro no. La MCHP es técnicamente simple y se puede realizar en cualquier hospital con acceso a filtros de carbón y recursos de banco de sangre. Esta técnica puede representar una alternativa razonable para tratar las toxicidades de los AINE en animales que son demasiado pequeños para los métodos convencionales de descontaminación extracorpórea utilizando plataformas mecánicas sin utilizar un cebador sanguíneo o en lugares donde estas máquinas no están disponibles.
Introducción
La exposición a medicamentos antiinflamatorios no esteroideos (AINE) es una toxicidad veterinaria común (1, 2). Las posibles secuelas de la toxicidad de los AINE incluyen signos gastrointestinales (ulceración, vómitos, diarrea y melena), lesión renal aguda (IRA), disfunción neurológica y hepatotoxicidad (1). El tratamiento médico tradicional incluye la descontaminación gastrointestinal (para ingestiones orales), la administración de medicamentos gastroprotectores y la fluidoterapia intravenosa (IV) (1, 3-5). También se describe el tratamiento con emulsión lipídica intravenosa (ILE) (6-9).
Recientemente, las terapias de purificación de sangre extracorpórea (ECBP, por sus siglas en inglés) han ganado popularidad en el tratamiento de las toxicidades de los AINE en animales de compañía con la mitigación exitosa de los efectos de las toxicosis graves (4, 5, 8-17). Se ha informado que el intercambio plasmático terapéutico (TPE) reduce los niveles plasmáticos de AINE en un 51-85,5% después de una sola sesión (9, 10, 12-14). La hemoperfusión se ha reportado con menos frecuencia en animales pequeños, pero ha reducido con éxito los niveles plasmáticos de AINE en un 37-79%; Todos los informes anteriores utilizaron una plataforma de hemodiálisis intermitente con un dializador en serie y sorbentes de carbón más antiguos (15, 16). Sin embargo, los volúmenes de circuitos para los sistemas de tratamiento extracorpóreo disponibles comercialmente en los Estados Unidos son grandes. Por ejemplo, el volumen de cebado para el TPE basado en membrana disponible comercialmente en los Estados Unidos es de 125 ml ± 10%. 1 De manera similar, el volumen sanguíneo mínimo requerido para preparar un equipo de sangre de CI neonatal con una columna de hemoperfusión en serie y un dializador de baja eficiencia en la institución del autor es de 104 mL. 2,3 En el caso de los animales más pequeños, el ECBP normalmente requeriría una cebación sanguínea para prevenir la hipovolemia crítica y la pérdida de la perfusión tisular. La colocación de catéteres de hemodiálisis también es técnicamente más desafiante en pacientes más pequeños, y tanto la hemodiálisis como el TPE basado en máquinas requieren equipos costosos.
Aquí, reportamos el manejo exitoso de una sobredosis de meloxicam en un gato y la sospecha de ingestión de ibuprofeno en un perro usando hemoperfusión manual de carbono (MCHP) a través de una línea central de triple lumen usando un circuito de 40-50 mL y sin usar una máquina de hemodiálisis.
Caso 1
Un gato doméstico macho de pelo corto castrado de 11 meses de edad, con un peso de 3,5 kg, acudió al servicio de urgencias de un hospital terciario de referencia para la evaluación de una lesión por degloveing. No se pudo obtener una temperatura inicial, pero otros signos vitales estaban dentro de los límites normales. En el examen físico, se encontró que el gato tenía un dolor moderado con una gran lesión en la extremidad pélvica izquierda con miasis cutánea a lo largo de los márgenes de la herida. El resto del examen físico no fue destacable.
Tras el cuidado inicial de la herida sedada, el gato fue ingresado en la UCI. 4 Al día siguiente se inició tratamiento con meloxicam (0,1 mg/kg, SC, cada 24 h). Aproximadamente 24 h después de la dosis inicial, se administró inadvertidamente una dosis alta de meloxicam (0,48 mg/kg, SC). Inmediatamente después de la administración de la sobredosis de meloxicam al gato, se observó el error y se inició el tratamiento con famotidina (1,2 mg/kg, IV seguido de una IRC de 0,33 mg/kg/h, IV) y sucralfato (0,17 g/kg, PO, 8 h) además de los tratamientos previos.
Aproximadamente 8 horas después de la sobredosis, el ECBP fue elegido. El gato se consideró demasiado pequeño para el TPE basado en la máquina o la hemoperfusión de carbono (CHP) en una plataforma de hemodiálisis intermitente debido a los requisitos de volumen del circuito y la necesidad de múltiples unidades de sangre para cebar la máquina. El TPE manual se consideró demasiado lento, por lo que se decidió intentar el MCHP. Para facilitar la colocación de la vía central, el gato fue sedado con acepromazina (0,026 mg/kg, IV) y propofol (5,2 mg/kg, IV ajustado al efecto), y se colocó asépticamente un catéter de triple luz de 5,5 Fr, 8 cm, en la vena yugular externa izquierda utilizando la técnica de Seldinger modificada (18). Se seleccionó una columna de CHP (ImmutriX V100 Atlas) (véase la nota 2) y se creó un circuito cortando parte de la línea de un circuito de hemodiálisis neonatal (véase la nota 4) y ajustando el extremo cortado en el circuito con un adaptador de árbol de Navidad (Figura 1). Otros componentes del circuito incluían dos juegos de extensión de 53 cm, un juego de extensión de 7 cm, una llave de paso de tres vías, dos adaptadores macho-macho y una jeringa de 12 ml (Figura 1). La jeringa de 12 ml se utilizó para empujar la sangre a través del circuito, extrayendo la sangre a través de la vía central y devolviendo la sangre a través de un catéter intravenoso periférico para minimizar la recirculación de acceso. La columna de cebado de la columna era de 40 mL, el circuito creado era de aproximadamente 10 mL y el volumen total del circuito era de aproximadamente 50 mL. El circuito y la columna de hemoperfusión se cebaron con 1 L de solución salina al 0,9% que contenía 5.000 u/L de heparina no fraccionada, 500 mL de dextrosa al 5% en agua (D5W) y un segundo litro de solución salina al 0,9% según las instrucciones del fabricante de la columna de cogeneración. Al PET se le administró heparina no fraccionada para prevenir la coagulación en el circuito o en la columna (bolo de 25 u/kg seguido de IRC de 25 u/kg/h, IV). La anticoagulación se monitorizó con tiempos de coagulación activados (TCA) y se ajustó para mantener un TCA de 200-300 s (normal <120 s). A lo largo de la MCHP, se monitorizaron el ECG, la presión arterial, la mentación y la frecuencia respiratoria, así como los electrolitos, la glucosa en sangre y la PCV y el TS (Tabla 1). Antes del tratamiento con MCHP, el hematocrito del gato era bajo (Tabla 1), por lo que se transfundió una unidad de glóbulos rojos empaquetados (9,3 mL/kg, IV) durante 4 h antes, durante y después del tratamiento.
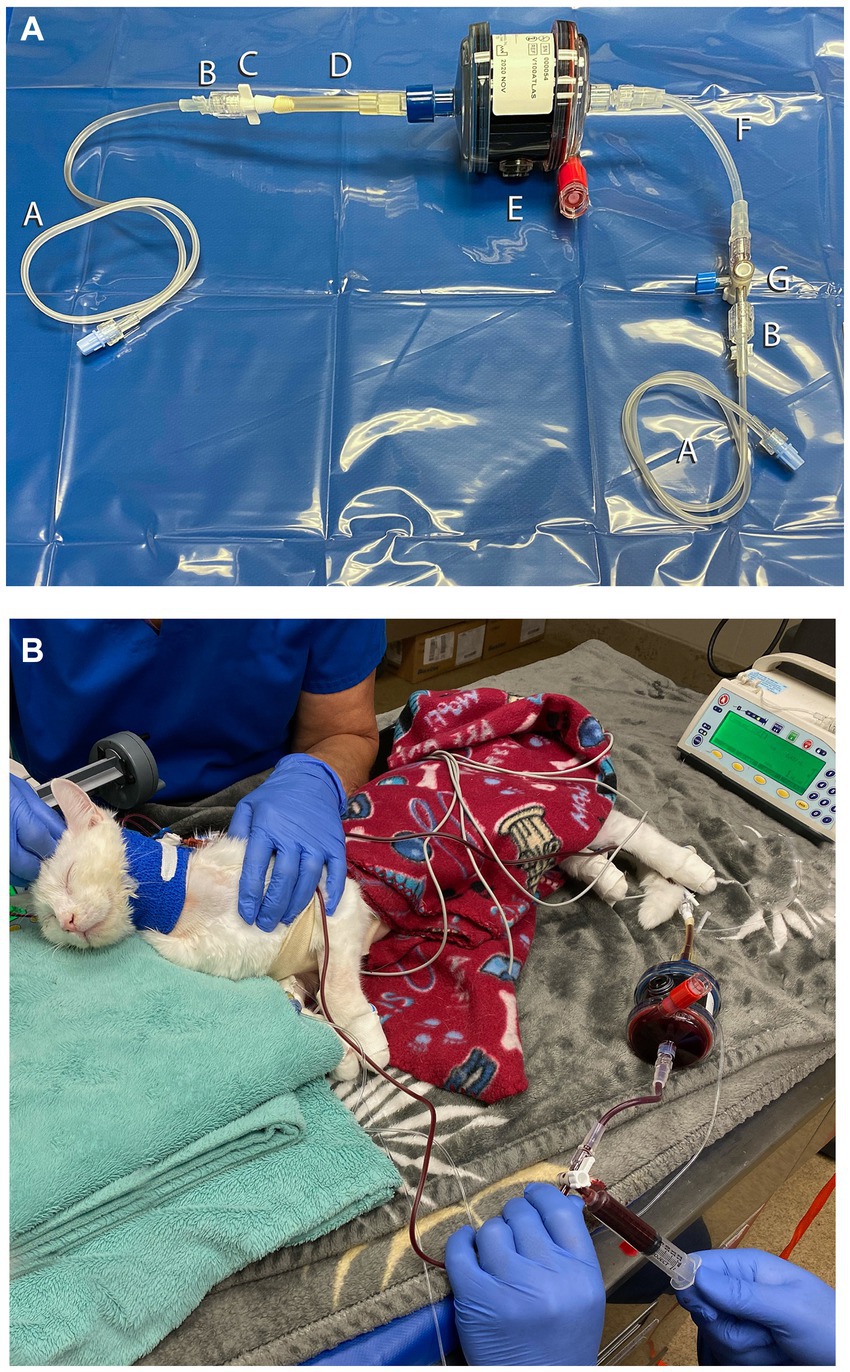
Se procesó un total de 1.171 mL de sangre, o aproximadamente 5,5 volúmenes de sangre, durante el período de tratamiento de 60 min con una tasa de flujo sanguíneo promedio de aproximadamente 19,5 mL/min. El volumen de sangre procesado se midió contando el número de jeringas utilizadas para empujar la sangre a través de la máquina. Al final del tratamiento, el circuito se enjuagó con 60 mL de solución salina al 0,9% para devolver la sangre a la mascota. Se observó hiperglucemia transitoria e hipocalcemia leve (Tabla 1), pero el gato no se vio afectado clínicamente por estos alteraciones, y se resolvieron sin intervención dentro de 1 h después de completar el tratamiento. Su anemia mejoró después de la finalización de la transfusión (Tabla 1).
Tras el tratamiento, se suspendió el tratamiento con meloxicam y el paciente se mantuvo con fluidoterapia intravenosa (LRS, 2,5 ml/kg/h, IV), famotidina (0,33 mg/kg/h, IV, IRC) y sucralfato (0,17 g/kg, VO, 8 h). Permaneció hospitalizado durante varios días para continuar con el manejo y monitoreo de la herida. El tratamiento con famotidina y sucralfato se interrumpió aproximadamente 36 h y 5 días después de la MCHP, respectivamente. Se observó que el gato estaba progresivamente anémico 5 días después de la MCHP (Tabla 2), sospechando que era secundario a la pérdida crónica de su gran herida. Se transfundió una segunda unidad de glóbulos rojos empaquetados (10,8 mL/kg, IV) para mejorar el suministro de oxígeno y la cicatrización de heridas. El día 13 de tratamiento, el gato se sometió a un cierre parcial de la herida. El gato fue dado de alta 14 días después del ingreso y 12 días después de la MCHP. No se recetaron medicamentos adicionales para tratar la toxicidad de meloxicam para llevar a casa. No se realizaron análisis de sangre repetidos para evaluar la función renal en las visitas de seguimiento durante las siguientes semanas para el cuidado de la herida. Sin embargo, el gato permaneció asintomático para la toxicosis por AINE y no pareció tener efectos adversos del tratamiento con MCHP.
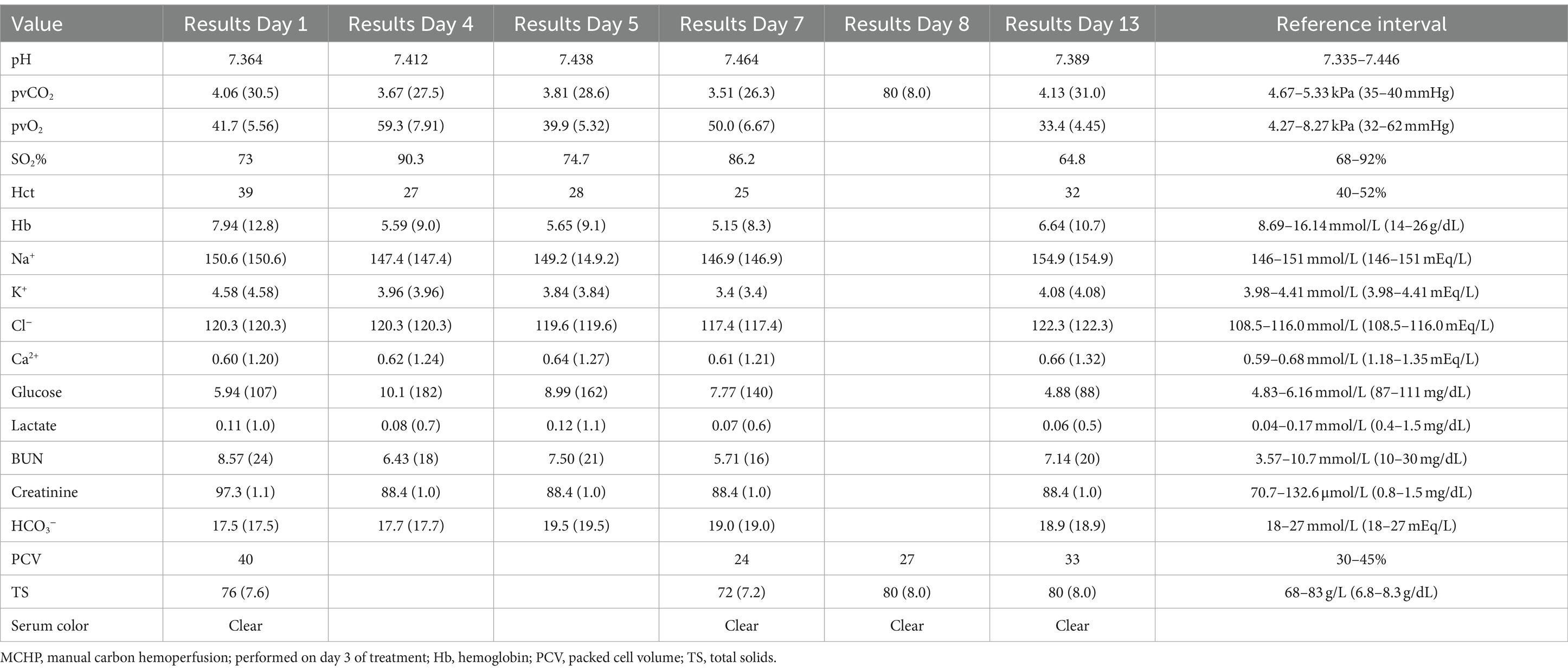
Tabla 2. Valores de laboratorio seriados antes, durante y después de la MCHP en el caso 1.
Inmediatamente antes y después del tratamiento con MCHP, así como 12 h y 24 h después de MCHP, se obtuvieron muestras de plasma de la vía central antes de la columna de hemoperfusión para la cuantificación de meloxicam mediante cromatografía líquida de rendimiento 5 (Tabla 3). Las muestras de sangre se recogieron en tubos sanguíneos de litio-heparina y se centrifugaron, y el plasma heparinizado se almacenó a -80 °C antes de su presentación. El despeje se calculó mediante la fórmula:
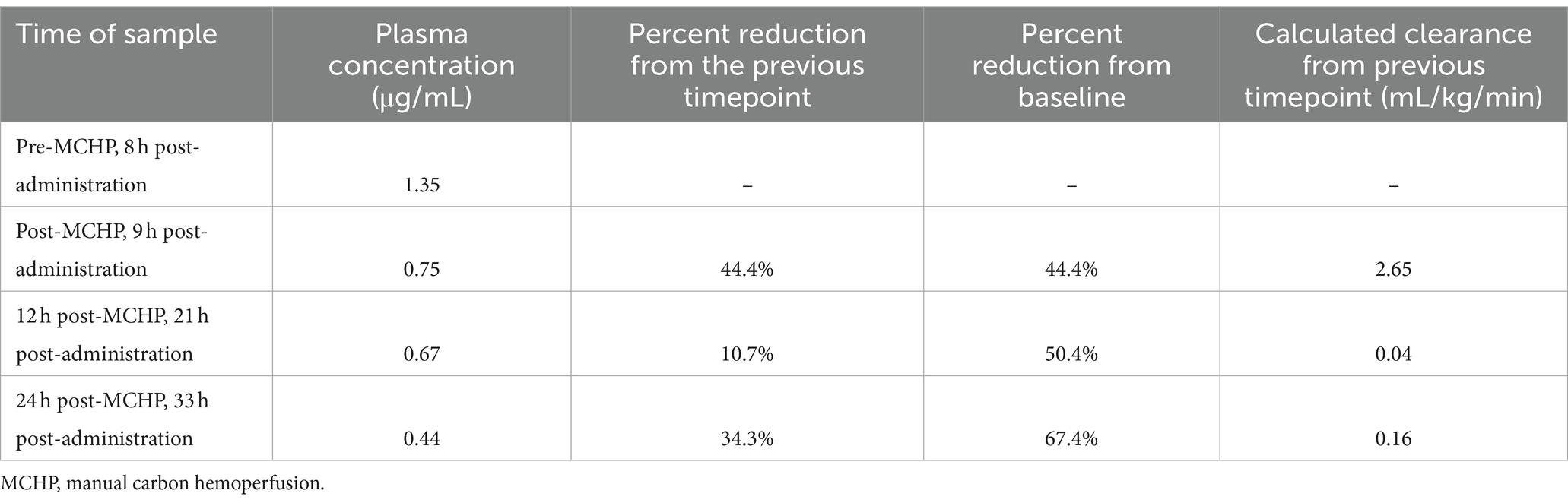
Tabla 3. Concentraciones plasmáticas de meloxicam antes y después de MCHP en el caso 1.
donde Kp es el aclaramiento plasmático de meloxicam (mL/kg/min); V es el volumen total de distribución de meloxicam (mLs); C0 es la concentración sérica inicial (μg/mL); Elextremo C es la concentración sérica final (μg/mL); t es la duración (min); y el peso corporal del paciente (kg) (17). La MCHP redujo las concentraciones plasmáticas de meloxicam en este gato en un 44,4% y proporcionó un aclaramiento plasmático de 2,65 mL/kg/min (Tabla 3).
Caso 2
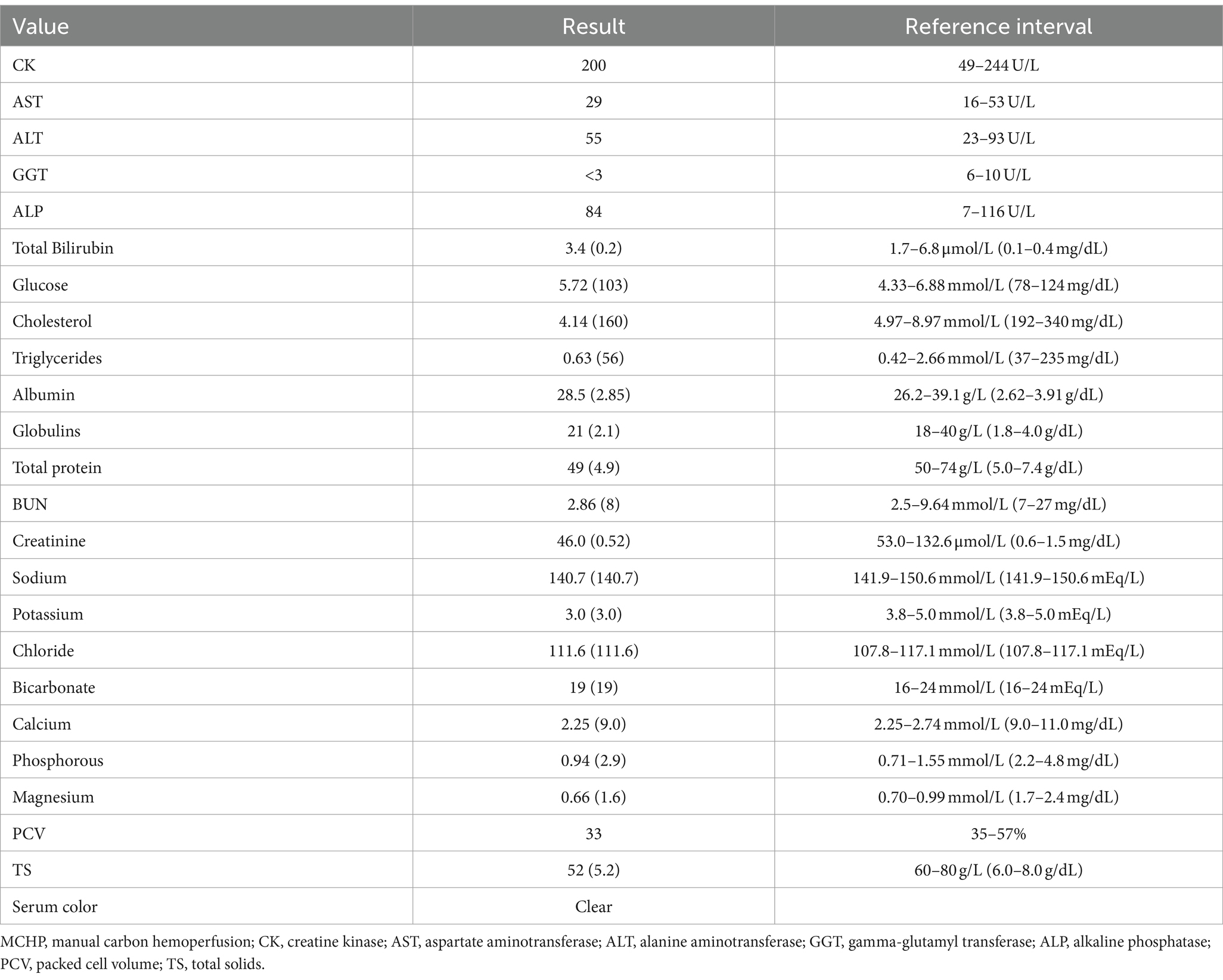
Una perra mestiza esterilizada de 1 año de edad, con un peso de 2,61 kg, fue presentada a una clínica satélite del servicio de urgencias y cuidados críticos de un hospital terciario de referencia para una posible ingestión de aproximadamente 50.200 mg de ibuprofeno en las 4-5 h previas a la presentación. La ingesta máxima posible para esta mascota fue de 3.703 mg/kg. El propietario intentó inducir el vómito con peróxido de hidrógeno en su casa, pero no tuvo éxito. No se informaron antecedentes médicos significativos. En el momento de su presentación en la clínica, los signos vitales de la perra eran normales y su examen físico no presentaba diferencias notables. Se realizó una gasometría y se monitorizaron la PCV y el TS, que revelaron hiperlactatemia leve, pero por lo demás no presentaban diferencias notables (Tabla 4). El vómito fue inducido con apomorfina (0,03 mg/kg, IV), y la mascota vomitó comida marrón parcialmente digerida y pedazos de plástico, pero no se observaron tabletas obvias. Se le administró maropitant (1 mg/kg, IV) y carbón activado sin sorbitol6 (10 mL/kg, PO). Debido a la preocupación por una posible ingestión masiva y una toxicidad grave de AINE, el perro fue remitido al campus principal del hospital terciario de referencia para recibir atención adicional.
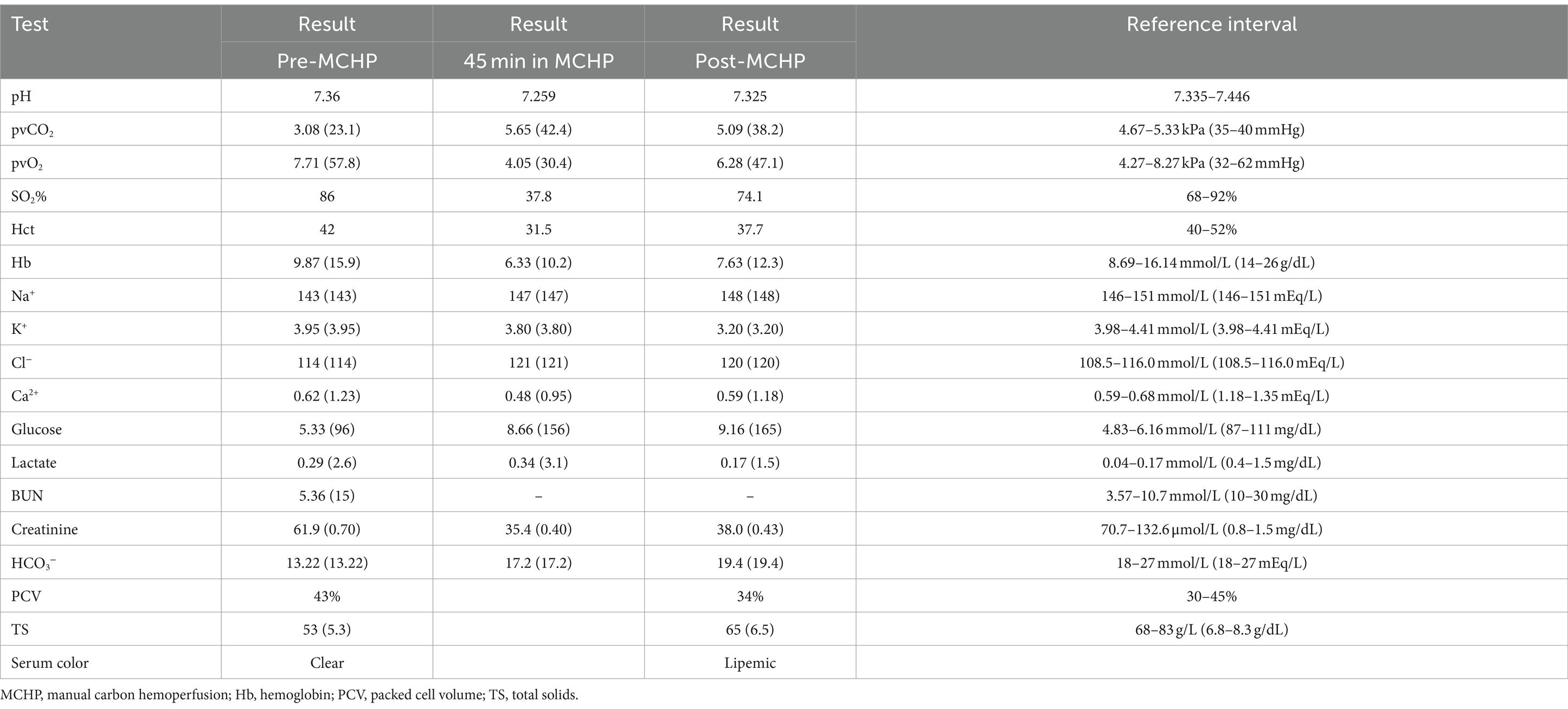
En el momento de su presentación en el hospital principal, la perra presentaba un leve taquicárdico (frecuencia cardíaca de 180 lpm), pero sus otros signos vitales eran normales y su examen físico no presentaba diferencias notables. Se le administró maropitant (1 mg/kg, IV), fluidoterapia intravenosa (LRS, 2,9 mL/kg/h), pantoprazol (1 mg/kg, IV, cada 12 h) y ILE intravenosa (bolo de 1,5 mL/kg seguido de una IRC de 0,25 mL/kg/min durante 60 min). Otros dos perros más grandes de la casa fueron tratados con TPE basado en máquinas, que es el estándar de atención para la toxicidad de los AINE en la institución del autor cuando está disponible debido a la alta unión a proteínas de estos medicamentos. Durante la administración de ILE, se decidió probar el ECBP para este perro debido a los efectos potencialmente tóxicos de ingerir incluso un solo comprimido (76 mg/kg). ILE fue descontinuado; No se registró el volumen total administrado. Al igual que en el caso anterior, este perro no se consideró un buen candidato para el TPE basado en máquinas debido a su pequeño tamaño. Se consideró la TPE manual, pero se rechazó debido al tiempo requerido para completar el tratamiento. La CHP basada en la máquina fue rechazada debido a la preocupación por el pequeño tamaño del paciente, y se eligió MCHP debido al requisito de volumen de circuito pequeño.
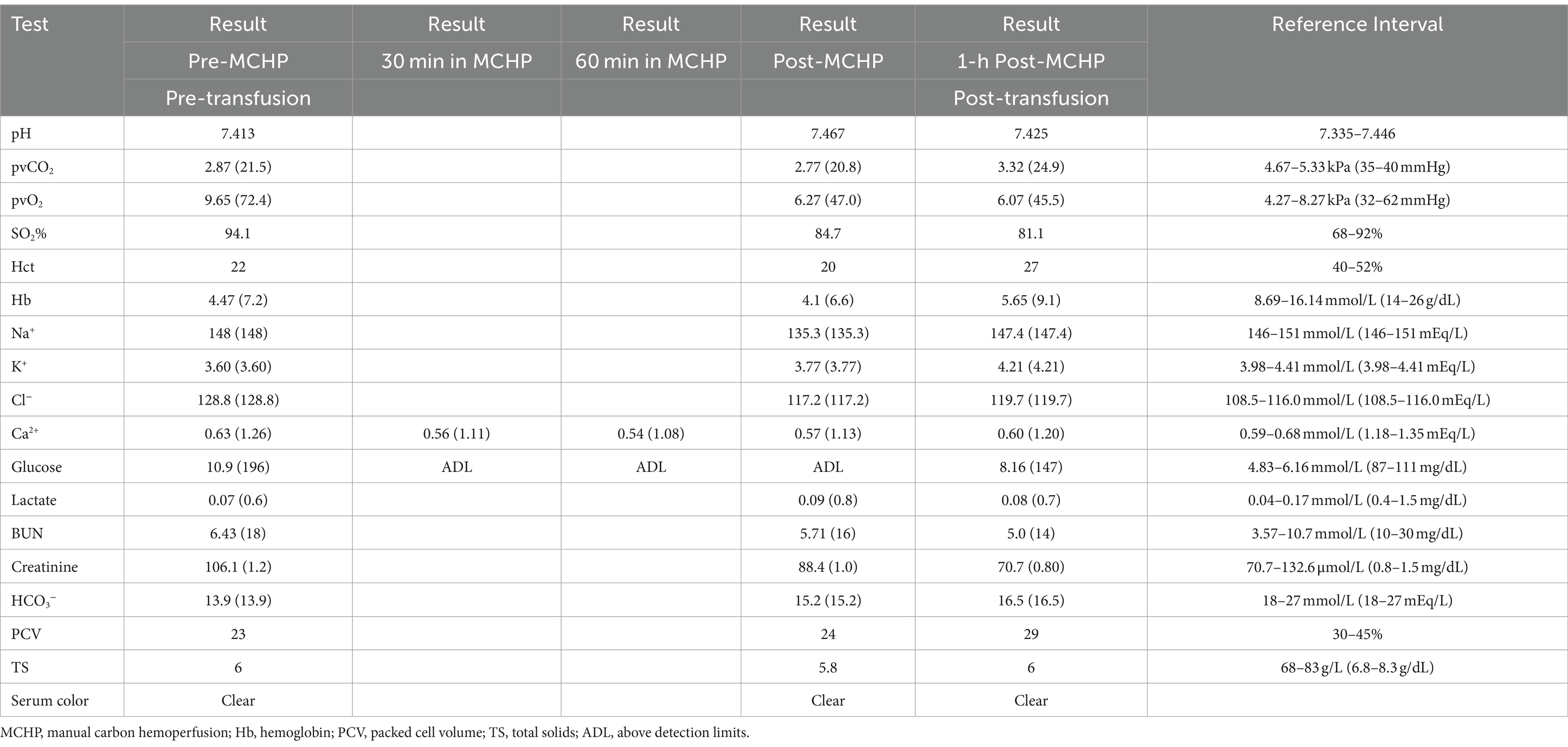
Para facilitar la colocación de la vía central, el perro fue sedado con butorfanol (0,2 mg/kg, IV) y dexmedetomidina (2 mcg/kg, IV). Se colocó un catéter de triple luz de 5,5 Fr x 8 cm en la vena yugular derecha mediante la técnica de Seldinger modificada. Se seleccionó una columna de cogeneración (ImmutriX v100 Atlas) y se creó un circuito con tres juegos de extensión intravenosa de 53 cm, una llave de paso, una jeringa de 12 mL y dos adaptadores macho a macho (Figura 2). El volumen de cebado de la columna fue de 40 mL, el circuito fue de aproximadamente 8 mL y el volumen total del circuito, incluida la columna, fue de aproximadamente 48 mL. Se preparó el circuito y se proporcionó anticoagulación y se controló de la misma manera que en el gato del caso 1. Se utilizó una jeringa de 12 mL conectada a la llave de paso para empujar la sangre a través del circuito, utilizando el puerto blanco para el acceso y el puerto marrón para el retorno de la sangre para minimizar la recirculación de acceso. Durante el tratamiento, se mantuvo la sedación con un bolo adicional de dexmedetomidina (2 mcg/kg, IV) y butorfanol CRI (0,2 mg/kg/h). A lo largo de la MCHP, se monitorizaron el ECG, la presión arterial, la mentación y la frecuencia respiratoria. Sus electrolitos, glucosa en sangre y PCV también se monitorearon de la misma manera similar a la del caso 1 (Tabla 4).
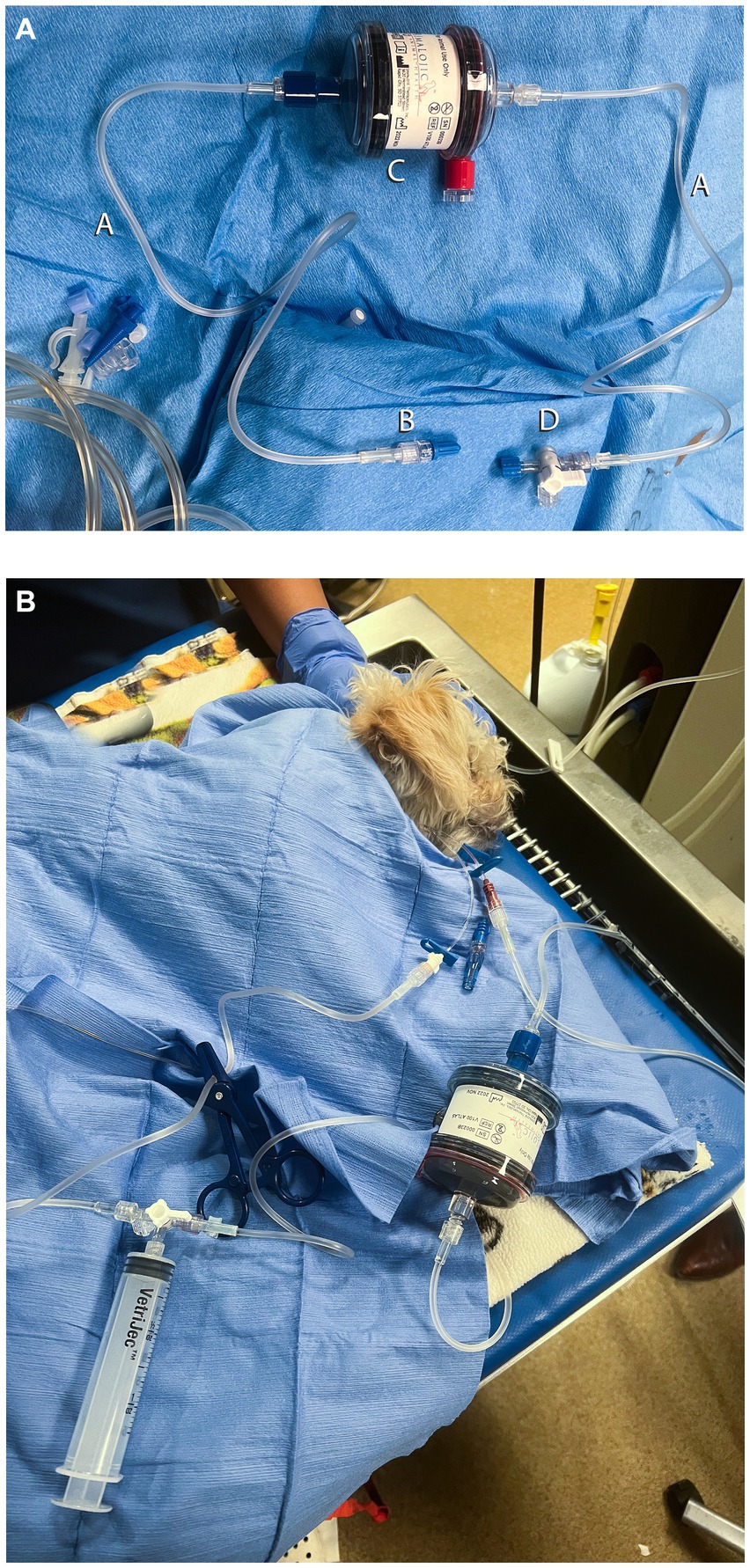
El paciente presentó hipertensión transitoria, hipotensión, hipotermia leve y regurgitación durante la PCHM. Se proporcionó calentamiento activo para corregir la hipotermia. La hipotensión se resolvió después de disminuir la tasa de flujo sanguíneo y administrar un bolo cristaloide (LRS, 10 mL/kg, IV). Se observó hipocalcemia moderada en el momento de la regurgitación y se corrigió con un bolo único de 0,5 mL/kg de gluconato de calcio IV, diluido 1:1 y administrado durante 10-15 min. A la mascota también se le administró ondansetrón (0,5 mg/kg, IV). El flujo continuo se proporcionó en alícuotas de 12 mL durante 90 min. El volumen sanguíneo estimado procesado fue de 4.320 mL o 18 volúmenes sanguíneos. Al final del tratamiento de 90 minutos, el aparato se enjuagó con 60 mL de solución salina estéril al 0,9% para devolver la sangre a la mascota. Después de la sesión, se repitió la gasometría venosa y la PCV/TS (Tabla 4). El paciente regurgitó una vez más, y ondansetrón y maropitant se repitieron a las dosis anteriores. El tratamiento con ILE no se continuó después de la sesión debido a la persistencia de la lipemia macroscópica.
Después del tratamiento, el paciente se mantuvo con líquidos intravenosos (LRS, 2,9 mL/kg/h, IV), N-acetilcisteína (bolo de 140 mg/kg seguido de 70 mg/kg, IV, cada 6 h), pantoprazol (1 mg/kg, IV, cada 12 h), maropitant (1 mg/kg, IV, cada 2 h), ondansetrón (0,5 mg/kg, IV, cada 8 h), colestiramina (2 g, PO, cada 8 h) y metoclopramida CRI (2 mg/kg/día, IV). El perro fue monitoreado en el hospital para detectar signos de toxicosis por AINE. No se observaron efectos secundarios gastrointestinales. Al día siguiente se realizó una química sérica, que no mostró evidencia de LRA ni hepatotoxicidad (Tabla 5). Se le recetó lansoprazol (1 mg/kg, VO, 12 h) para ser administrado en casa durante 5 días adicionales y dado de alta al día siguiente del ingreso. En el seguimiento, 24 horas después del alta, el perro estaba bien, sin signos externos de toxicidad por AINE o efectos adversos relacionados con el tratamiento con MCHP.
Antes e inmediatamente después del tratamiento con MCHP, se obtuvieron muestras de plasma de manera similar al Caso 1 y se enviaron para la cuantificación de ibuprofeno mediante cromatografía líquida de rendimiento. Ambas muestras estaban por debajo de los límites de detección.
Discusión
En este artículo, presentamos el uso de MCHP para tratar la sobredosis de meloxicam en un gato y la sospecha de toxicosis por ibuprofeno en un perro. En general, la cogeneración puede eliminar toxinas con una Vd de baja a moderada (<1 L/kg), hasta 40.000 Da, y una unión a proteínas muy alta (>99%) a través de la adsorción (19). Aunque es poco común, se ha reportado esta técnica en perros para tratar las toxicidades del carprofeno y el ibuprofeno. Todos los informes anteriores han utilizado una plataforma de hemodiálisis intermitente con un dializador en serie (15, 16, 19). El nuestro es el primer informe de CHP en el gato, el primer informe de CHP para tratar la toxicidad de meloxicam y el primer informe de una nueva terapia MCHP adaptada sin una plataforma de máquina o un dializador en serie en ambas especies.
Los informes anteriores que utilizaron columnas de hemoperfusión de carbón vegetal para tratar la toxicidad de los AINE en perros han logrado una reducción del 34-49,5% y un aclaramiento de 1,4-2,1 mL/kg/min para el carprofeno después de 1 h de tratamiento con un dializador en serie (16) y una reducción de hasta el 79% para el ibuprofeno después de 6 h de tratamiento con un dializador en serie, reemplazando la columna de hemoperfusión a mitad del tratamiento (15). En el gato descrito aquí, los niveles plasmáticos de meloxicam se redujeron en un 44,4% durante la sesión de MCHP de 1 h, en comparación con un 10,7% durante las 12 h siguientes y una reducción del 34,3% durante 12 h adicionales. El aclaramiento con MCHP fue de 2,65 mL/kg/min, que fue de 16 a 66 veces el aclaramiento intrínseco calculado en este gato durante las 12 a 24 h siguientes. En el perro, los niveles plasmáticos de ibuprofeno estaban por debajo de los límites de detección, por lo que no se pudo calcular el aclaramiento de ibuprofeno proporcionado por esta técnica. El perro fue incluido en este informe debido al novedoso circuito desarrollado para MCHP sin la necesidad de cortar y adaptar las líneas del circuito de hemodiálisis.
Los animales incluidos en este informe fueron tratados durante 60-90 minutos, según las recomendaciones del fabricante de la columna de CHP y los informes previos en perros que revelaron saturación de la columna después de 1-2 h (15, 16). Un caso reportado previamente logró una reducción de hasta el 79% después de cambiar la columna durante el tratamiento (15). Por lo tanto, se podrían haber logrado mayores niveles de reducción en el gato mediante el intercambio de la columna y la continuación del tratamiento.
En informes anteriores de CHP se ha utilizado una plataforma de IHD basada en una máquina y se ha realizado un tratamiento con la columna de carbón y un dializador en serie para prevenir la hipoglucemia y la hipocalcemia y proporcionar calentamiento a la sangre extracorpórea (15, 16). En los casos presentes, los circuitos se cebaron con una solución de dextrosa según las instrucciones del fabricante de la columna de cogeneración, evitando la hipoglucemia incluso sin el uso de un dializador en serie. No está claro por qué el gato tratado aquí se volvió marcadamente hiperglucémico, ya que esto no ha ocurrido en otros casos tratados con MCHP en la institución del autor, pero no se detectaron efectos adversos y la hiperglucemia se resolvió sin intervención. Se especula que la dextrosa en la transfusión de glóbulos rojos empaquetada o posiblemente la D5W residual en el circuito podrían haber contribuido a la hiperglucemia. Se observó hipocalcemia ionizada leve y transitoria en ambos animales. El gato no se vio afectado clínicamente y no se requirió suplementación. El perro experimentó náuseas y regurgitación, pero tanto la hipocalcemia como las náuseas se resolvieron con la administración de un bolo de gluconato de calcio. El calentamiento externo se proporcionó con un dispositivo de soporte de calor para evitar hipotermia significativa.
Además de la hipoglucemia y la hipocalcemia, la trombocitopenia, la leucopenia y la disminución de los factores de coagulación son complicaciones potenciales bien conocidas de la hemoperfusión (18, 19). En informes previos en animales pequeños, se han reportado trombocitopenia (15, 16) y coagulopatía clínicamente significativa (15), aunque estos informes utilizaron sorbentes de carbón activado más antiguos. En los pacientes actuales en los que se utilizaron más sorbentes de carbono biocompatibles, los recuentos de plaquetas y glóbulos blancos no se midieron inmediatamente antes o después del tratamiento, por lo que se desconoce si hubo disminuciones en alguna línea celular. No se observaron hemorragias significativas, petequiación ni signos clínicos de leucopenia o trombocitopenia. Se observó que el gato tenía trombocitopenia el día anterior al alta, pero se observó aglomeración y no se pudo estimar el recuento real de plaquetas.
En ambos animales, la hemoperfusión manual también permitió el uso de un catéter más pequeño de triple lumen, que está disponible en la mayoría de los hospitales de emergencia y evitó la necesidad de un catéter de hemodiálisis de mayor diámetro requerido para lograr un flujo sanguíneo adecuado utilizando plataformas tradicionales de IHD o TPE. Además, el circuito manual redujo el volumen de sangre extracorpórea a 40-50 mL desde volúmenes de circuito mayores que los volúmenes de las mascotas con técnicas tradicionales de ECBP basadas en máquinas. No se requirió una cebación de sangre para el perro que usaba el circuito manual, mientras que sin duda habría sido necesario para realizar ECBP basado en máquina de manera segura. Al gato se le administró una transfusión de sangre durante la sesión de MCHP debido a una anemia preexistente, que es similar a realizar un cebado de sangre. Aunque los autores no habrían realizado un cebado sanguíneo en este paciente si la anemia se hubiera resuelto, no podemos concluir que no sea necesario un cebado sanguíneo en gatos que utilizan esta técnica. Se administró una segunda transfusión durante el cuidado del gato debido a anemia recurrente 5 días después del tratamiento con MCHP. Los autores atribuyeron la anemia progresiva a la toma repetida de muestras de sangre y a la pérdida de sangre durante el cuidado continuo de la herida, pero no pueden excluir definitivamente la MCHP como un factor contribuyente.
Otras limitaciones de la MCHP, tal como se describe en este informe, incluyen la falta de un control preciso sobre la tasa de flujo sanguíneo y la falta de sensores de seguridad y alarmas para detectar complicaciones potencialmente fatales, como la coagulación en el circuito o los émbolos aéreos. Las direcciones de tratamiento futuras podrían incluir el uso de una bomba de transfusión de sangre para controlar las tasas de flujo con mayor precisión. Además, una limitación de la MCHP, como se describe en el Caso 1, es la necesidad de cortar las líneas de hemodiálisis para crear un circuito cerrado, lo que podría presentar riesgos para el mantenimiento de la esterilidad. Como esa conexión no era una conexión de bloqueo, también podría desprenderse durante la sesión y provocar una pérdida significativa de sangre y una pérdida de esterilidad. La configuración del circuito que utiliza adaptadores macho a macho en el Caso 2 se incluyó en este informe, ya que mitigó esos riesgos. El uso de conexiones de bloqueo DIN a Luer mitigaría esos riesgos; Estos conectores proporcionarían una conexión aún más segura entre el tubo de extensión y la columna de hemoperfusión.
Los dos animales presentados aquí fueron tratados simultáneamente con el tratamiento médico estándar (líquidos intravenosos, reductores de ácido gástrico y protectores gastrointestinales), como es la práctica habitual cuando se utilizan técnicas de ECBP para tratar la toxicidad de los AINE (4, 5, 8-16). No se observaron signos clínicos de sobredosis de AINE, como hemorragia gastrointestinal o lesión renal aguda, en ninguna de las mascotas, aunque se desconocen las contribuciones relativas de la MCHP frente al tratamiento médico estándar para la mitigación de los signos clínicos de toxicosis. Se requerirían estudios prospectivos para recomendar MCHP en lugar de tratamiento médico estándar, TPE o CHP tradicional basado en máquinas con un dializador en serie para tratar la toxicidad de los AINE en animales pequeños. Sin embargo, en los casos presentados aquí, el MCHP fue bien tolerado y técnicamente simple. En el gato, proporcionó una reducción significativa de los niveles plasmáticos de meloxicam sin complicaciones significativas, al tiempo que permitió la aplicación de ECBP a animales considerados demasiado pequeños para el tratamiento con plataformas tradicionales basadas en máquinas.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor de correspondencia.
Declaración ética
No se requirió aprobación ética para los estudios con animales de acuerdo con la legislación local y los requisitos institucionales porque se trata de un informe de caso de una técnica de tratamiento novedosa para una afección médica emergente. La técnica reportada se llevó a cabo con el interés de prevenir enfermedades o lesiones graves a los animales involucrados y se realizó de acuerdo con los altos estándares de atención proporcionados por las instituciones de los autores. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio. Se obtuvo el consentimiento informado por escrito de los propietarios de los animales para la publicación de este informe de caso.
Contribuciones de los autores
LH: Análisis formal, Investigación, Redacción – borrador original, Redacción – revisión y edición. AV: Conceptualización, Metodología, Redacción – borrador original. RG: Adquisición de fondos, Administración de proyectos, Recursos, Supervisión, Redacción, revisión y edición. TL: Conceptualización, Investigación, Metodología, Administración de proyectos, Recursos, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Los autores desean agradecer a Joshua W. McGill por su contribución a la optimización de fotos y la asistencia en la edición.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Abreviaturas
LRA: Lesión renal aguda; CHP: hemoperfusión de carbono; ECBP, Purificación de sangre extracorpórea; ILE: Emulsión lipídica intravenosa; IHD: Hemodiálisis intermitente; LRS, solución de ringer lactato; AINE, Antiinflamatorio no esteroideo; MCHP, Hemoperfusión manual de carbono; PCV: Volumen de celda empaquetada; TPE: Intercambio terapéutico de plasma; TS: Sólidos totales.
Notas
1. ^Juego Prismaflex™ TPE 2000, Baxter Healthcare Corp, Deerfield, IL.
2. ^Columna de hemoperfusión ImmutriX V100 Atlas, AimaLogic Animal Health, Rapidtown, SD.
3. ^Conjunto de sangre de bajo peso y bajo volumen de Gambro™ (Baxter Healthcare Corp, Deerfield, IL) con dializador Hemoflow™ F3 (Fresenius Kabi USA LLC, Lake Zurich, IL).
4. ^Los protocolos de sedación y otros tratamientos administrados al gato para el manejo de heridas están disponibles a pedido.
5. ^Laboratorio de Farmacología Clínica, Universidad Estatal de Carolina del Norte, Raleigh, Carolina del Norte.
6. ^ToxiBan®, que contiene 10% de MedChar™ y 6,25% de caolín, Lloyd Inc., Shenandoah, IA.
Referencias
1. McLean, MK, y Khan, SA. Toxicología de los antiinflamatorios no esteroideos frecuentemente encontrados en perros y gatos: una actualización. Veterinario Clin N Am. (2018) 48:969–84. doi: 10.1016/j.cvsm.2018.06.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Caloni, F, Cortinovis, C, Pizzo, F, Rivolta, M, y Davanzo, F. Estudio epidemiológico (2006-2012) sobre el envenenamiento de pequeños animales por medicamentos humanos y veterinarios. Registro veterinario. (2014) 174:222–2. doi: 10.1136/vr.102107
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Haldane, S . Antiinflamatorios no esteroideos En: D Silverstein y K Hopper, editores. Medicina de cuidados intensivos para pequeños animales. St. Louis, MO: Elsevier (2015). 394–9.
4. Butty, EM, Suter, SE, Chalifoux, NV, Lynch, AM, Mauro, KD, Moyle, RB, et al. Resultados de la toxicosis por antiinflamatorios no esteroideos tratados con recambio plasmático terapéutico en 62 perros. J Vet Int Med. (2022) 36:1641–7. doi: 10.1111/jvim.16507
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Chalifoux, NV, Butty, EM, Mauro, KD, Moyle, RB, Ehrhardt, CM, Robertson, JB, et al. Resultados de 434 perros con toxicosis por fármacos antiinflamatorios no esteroideos tratados con fluidoterapia, emulsión lipídica o intercambio terapéutico de plasma. J Vet Int Med. (2023) 37:161–72. doi: 10.1111/jvim.16603
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Herring, JM, McMichael, MA, Corsi, R, y Wurlod, V. Terapia de emulsión lipídica intravenosa en tres casos de sobredosis de naproxeno canino. J Vet Emerg Crit Care. (2015) 25:672–8. doi: 10.1111/vec.12307
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Bolfer, L, McMichael, M, Ngwenyama, TR, y O’Brien, MA. Tratamiento de la toxicosis por ibuprofeno en un perro con emulsión lipídica intravenosa. J am anim hosp assoc. (2014) 50:136–40. doi: 10.5326/JAAHA-MS-5979
8. Rosenthal, MG, y Labato, MA. Uso de recambio plasmático terapéutico para tratar la sobredosis de antiinflamatorios no esteroideos en perros. J Veterinario Pasante Med. (2019) 33:596–602. doi: 10.1111/jvim.15420
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Buseman, M, Blong, AE y Walton, RAL. Manejo exitoso de la toxicidad severa por carprofeno con intercambio manual de plasma terapéutico en un perro. J Vet Emerg Crit Care. (2022) 32:675–9. doi: 10.1111/vec.13203
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Kjaergaard, AB, Davis, JL, y Acierno, MJ. Tratamiento de la sobredosis de carprofeno con recambio terapéutico de plasma en un perro. J J Vet Emerg Crit Care. (2018) 28:356–60. doi: 10.1111/vec.12729
11. Groover, J, Londoño, LA, Tapia-Ruano, K, e Iacovetta, C. Purificación de sangre extracorpórea en pacientes veterinarios con intoxicación aguda: un estudio retrospectivo multicéntrico (2011-2018): 54 casos. J Vet Emerg Crit Care. (2022) 32:34–41. doi: 10.1111/vec.13100
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Kicera-Temple, K, Londoño, L, Lanaux, TM, y Buckley, GJ. Tratamiento de una sobredosis masiva de naproxeno con recambio de plasma terapéutico en un perro. Clin Case Rep. (2019) 7:1529–33. DOI: 10.1002/CCR3.2277
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Walton, S, Ryan, KA, Davis, JL y Acierno, M. Tratamiento de la sobredosis de meloxicam en un perro mediante intercambio de plasma terapéutico. J Vet Emerg Crit Care. (2017) 27:444–50. doi: 10.1111/vec.12607
14. Walton, S, Ryan, KA, Davis, JL y Acierno, M. Tratamiento de la intoxicación por ibuprofeno en un perro mediante intercambio de plasma terapéutico. J Vet Emerg Crit Care. (2017) 27:451–7. doi: 10.1111/vec.12608
15. Tauk, BS, y Foster, JD. Tratamiento de la toxicidad del ibuprofeno con hemoperfusión seriada de carbón vegetal y hemodiálisis en un perro. J Vet Emerg Crit Care. (2016) 26:787–92. doi: 10.1111/vec.12544
16. Fick, ME, Messenger, KM y Vigani, A. Eficacia de una sola sesión de hemoperfusión y hemodiálisis en serie en el tratamiento de la sobredosis de carprofeno en dos perros. J Vet Emerg Crit Care. (2020) 30:226–31. doi: 10.1111/vec.12931
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Chalhoub, S, Langston, CE y Poeppel, K. Acceso vascular para la terapia de reemplazo renal extracorpóreo en pacientes veterinarios. Vet Clin North Am Pequeño Anim Pract. (2011) 41:147–61. doi: 10.1016/j.cvsm.2010.09.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Ronco, C, y Bellomo, R. Heoperfusión: aspectos técnicos y estado del arte. Cuidado de críticos. (2022) 26:135. DOI: 10.1186/s13054-022-04009-W
Palabras clave: gatos, perros, antiinflamatorios no esteroideos, purificación de sangre extracorpórea, hemoperfusión
Cita: Haire LE, Vitalo AD, Gonçalves RP y Lanaux TM (2024) Informe de caso: Hemoperfusión manual de carbono para el tratamiento de la toxicidad por meloxicam en un gato y la sospecha de toxicidad por ibuprofeno en un perro. Frente. Vet. Sci. 11:1395967. doi: 10.3389/fvets.2024.1395967
Recibido: 04 de marzo de 2024; Aceptado: 19 de agosto de 2024;
Publicado: 18 de septiembre de 2024.
Editado por:
Philippe Jacques Berny, VetAgro Sup, Francia
Revisado por:
Yu Ueda, Universidad Estatal de Carolina del Norte, Estados
Unidos Maxime Cambournac, Centro Hospitalario Veterinario FREGIS, Francia
Derechos de autor © 2024 Haire, Vitalo, Gonçalves y Lanaux. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución (CC BY).
*Correspondencia: Ronald P. Gonçalves, rgoncalves@ufl.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

