Hipofisitis linfocítica en perros infectados con Leishmania spp.
Hipofisitis linfocítica en perros infectados con Leishmania spp.
 Edenilson Doná Frigerio1
Edenilson Doná Frigerio1  Cecilia de Castro Guizelini1
Cecilia de Castro Guizelini1  Giulia Gonçalves Jussiani1
Giulia Gonçalves Jussiani1  Karen Santos Março1
Karen Santos Março1  Guilherme Dias de Melo2
Guilherme Dias de Melo2  Tatiane Terumi Negrão Watanabe3
Tatiane Terumi Negrão Watanabe3  Gisele Fabrino Machado1*
Gisele Fabrino Machado1*- 1Departamento de Clínicas Veterinarias, Cirugía y Reproducción, Facultad de Medicina Veterinaria, Universidad Estatal de São Paulo, UNESP, Araçatuba, Brasil
- 2Institut Pasteur, Université Paris Cité, Unidad de Epidemiología y Neuropatología del Lyssavirus, París, Francia
- 3Departamento de Salud de la Población y Patobiología, Facultad de Medicina Veterinaria, Universidad Estatal de Carolina del Norte, Raleigh, NC, Estados Unidos
Fondo: La afectación morfológica de las glándulas endocrinas, como la glándula pituitaria, sigue sin investigarse en perros con leishmaniasis visceral canina. Por lo tanto, este estudio investigó la presencia de amastigotes de Leishmania spp. y caracterizó los cambios inflamatorios, destacando la participación de los linfocitos TCD3 en diferentes regiones de la glándula pituitaria de los perros.+
Métodos: Se recogieron muestras de 21 perros infectados naturalmente y 5 perros de control no infectados. Las diferentes regiones hipofisarias se analizaron en secciones histológicas teñidas con hematoxilina y eosina (HE) bajo microscopía óptica. La inflamación se clasificó por intensidad en una puntuación de 0 a 3, ausente (0), leve (1), moderada (2) y marcada (3). La evaluación inmunohistoquímica (IHC) se realizó en cinco campos de alta potencia (hot spot) en un objetivo 40x de cada región con conteo manual (Imagen J1.52ª) de los linfocitos TCD3 y para amastigotes analizados en objetivos 40x y 100x. Se utilizó la prueba de Shapiro-Wilk para evaluar la normalidad de los datos. Las diferencias entre los grupos se determinaron mediante la prueba de Mann Whitney. La correlación entre las variables se evaluó mediante la prueba de correlación de Sperman. p < 0,05 fueron considerados estadísticamente significativos.+
Resultados: Los amastigotes de las glándulas pituitarias de dos perros infectados se identificaron mediante IHC. La evaluación histopatológica teñida con hematoxilina y eosina mostró mayor intensidad de inflamación en las regiones pars distalis y pars intermedia de perros infectados. IHQ para linfocitos TCD3 mostró una mayor mediana de células inmunomarcadas en pars nervosa en el grupo infectado que en el grupo control (p < 0,05); y esperando una variación en la distribución y número de estas células en perros infectados naturalmente, la mediana del grupo control se consideró un punto de corte, también se observó un aumento de linfocitos T (p < 0,05) en la pars intermedia y pars distalis de un subgrupo infectado (n = 10). Se estableció una correlación moderada significativa entre la intensidad de la inflamación y el número de linfocitos TCD3 inmunomarcados en las regiones hipofisarias analizadas, caracterizando la aparición de hipofisitis.++
Conclusión: Estos hallazgos presuponen que la inflamación y / o el parásito en la región pituitaria pueden resultar en disfunción de la glándula, empeorando la condición clínica del paciente y comprometiendo la eficiencia del tratamiento y el pronóstico.
1. Introducción
La hipófisis, o glándula pituitaria, es un órgano neuroendocrino responsable de la interfaz de comunicación entre el hipotálamo y las glándulas endocrinas periféricas, cuya regulación es esencial para mantener la homeostasis de los organismos en situaciones fisiológicas y patológicas (1, 2). Por lo tanto, los cambios patológicos sistémicos pueden conducir a la desregulación y disfunción del sistema neuroendocrino (1). Los principales trastornos hipofisarios son de origen proliferativo en perros (3); Sin embargo, también se han reportado cambios inflamatorios en humanos, siendo la hipofisitis linfocítica la más común (4).
La hipofisitis es un trastorno inflamatorio crónico de origen primario o secundario que ocurre en la glándula pituitaria. La hipofisitis primaria es un trastorno autoinmune de etiología desconocida caracterizado por inflamación restringida a la glándula pituitaria, no asociada con otros trastornos inflamatorios sistémicos (4). La hipofisitis secundaria está relacionada con procesos inflamatorios locales inducidos por tumores, quistes o procesos sistémicos, como otras endocrinopatías autoinmunes, uso de medicamentos, enfermedades infecciosas y otras afecciones (4, 5).
Varios estudios han reportado hipofisitis primaria o secundaria que promueve trastornos endocrinos o neurológicos en perros; sin embargo, existen muchas limitaciones y divergencias en los estudios porque se considera una condición esporádica con la presencia de infiltrado inflamatorio que comprende linfocitos T CD3 (2, 3, 6-9). La hipofisitis relacionada con procesos infecciosos bacterianos, fúngicos, virales o parasitarios ha sido poco estudiada, aunque hay estudios disponibles en perros (2, 3), humanos (10) y otros animales (11). El parásito Trypanosoma brucei y T. congolense también se han detectado mediante análisis moleculares en el cerebro y la glándula pituitaria de ovejas durante la infección experimental, que se asocia con un aumento del cortisol plasmático e hiperplasia de la glándula suprarrenal (11).+
Los órganos circumventriculares (CVO) y el plexo coroideo pueden servir como rutas de entrada de parásitos y otros patógenos al tejido nervioso, como lo demuestran las infecciones con el parásito Trypanosoma brucei (12). Están desprovistos de la barrera hematoencefálica (BBB), pero tienen una barrera sangre-líquido formada por uniones oclusivas entre las células epiteliales del plexo coroideo y entre los tanicitos especializados que recubren las cavidades ventriculares que recubren las CVO (13). La neurohipófisis se clasifica como una CVO y carece de barreras efectivas porque tiene vasos fenestrados y es susceptible a la exposición a componentes circulatorios, como citoquinas, endotoxinas y patógenos, lo que representa un punto de acceso que influye directamente en el sistema nervioso central (SNC). Al igual que otros CVO, la neurohipófisis puede iniciar y modular la inflamación local (12, 14-16).
La leishmaniasis es una enfermedad zoonótica que se distribuye en todo el mundo y afecta a animales domésticos y salvajes (17). El parásito Leishmania infantum es el agente etiológico de la leishmaniasis visceral canina (CanL), catalogada como una de las enfermedades tropicales más letales y desatendidas a nivel mundial (18, 19). Los amastigotes infectan sistémicamente al huésped, causando estimulación crónica del sistema mononuclear fagocítico y confiriendo un carácter inmunomediado a la patogénesis de las lesiones (16), que está directamente relacionado con las manifestaciones clínicas (20, 21).
Los perros infectados pueden presentar enfermedades subclínicas o sistémicas, cuyos signos clínicos a menudo incluyen anorexia, hepatoesplenomegalia, linfadenmegalia y lesiones cutáneas (20). Además, otros órganos y tejidos, como la glándula tiroides (22), el corazón (23), el hígado y los riñones (24), así como el SNC (25), pueden verse afectados. Los estudios sobre la patogénesis de las manifestaciones neurológicas clínico-patológicas causadas por L. infantum son limitados. Sin embargo, los principales hallazgos neurológicos patológicos en estos estudios fueron lesiones inflamatorias y complicaciones vasculares (25).
Hasta la fecha, hasta donde saben los autores, no existen estudios sobre alteraciones histopatológicas hipofisarias en la leishmaniasis; Sin embargo, ya se han descrito trastornos endocrinos de origen pituitario primario en humanos (26) y modelos experimentales (27). La barrera hematoencefálica es permeable en la región hipofisaria, y hay estudios de afectación del tejido nervioso en perros con CanL con una descripción de la afectación de linfocitos T CD3 (28-31). El objetivo de este estudio investigó la presencia de Leishmania spp. amastigotes y linfocitos T CD3 en diferentes regiones de la glándula pituitaria de perros con CanL.++
2. Materiales y métodos
2.1. Ética
Todos los procedimientos y métodos utilizados en este estudio fueron realizados de acuerdo con el Comité de Ética y Experimentación Animal de la Facultad de Medicina Veterinaria, Universidad Estadual Paulista, UNESP, Araçatuba, Brasil (FOA-0354-2021).
2.2. Animales
Veintiséis perros (15 machos y 11 hembras), con edades comprendidas entre 1 y 7 años, y razas variadas, procedían del Hospital Veterinario de la FMVA-UNESP y del Centro de Control de Zoonosis de Araçatuba, Estado de São Paulo, Brasil.
2.3. Diagnóstico de la leishmaniasis visceral
El diagnóstico serológico se obtuvo mediante Enzyme-Linked Immunosorbent Assay (ELISA; cut-off >0,270) según Lima et al. (32) y/o investigación citológica directa del aspirado de ganglios linfáticos poplíteos (aspiración con aguja fina – FNA).
2.4. Diseño experimental
Veintiún perros que estaban infectados naturalmente con Leishmania ssp. y no vacunados o tratados por CanL se incluyeron en el grupo infectado (G1). Estos animales fueron sacrificados siguiendo el Manual de Vigilancia y Control LVC del Ministerio de Salud (33) y la Resolución 1000/2012 del Conselho Federal de Medicina Veterinária (34), que guían y permiten la eutanasia de perros después de que el diagnóstico fue confirmado por examen parasitológico y/o ensayo serológico. Además, cinco perros no infectados sin antecedentes de deterioro neurológico, cuya eutanasia se realizó «in extremis» después de sufrir un trauma severo como resultado de un accidente automovilístico, se incluyeron en el grupo de control (G2).
2.5. Recogida de muestras
Las necropsias se realizaron después de confirmar la muerte del animal. Fueron evaluados en el examen macroscópico, la ausencia o presencia de cambios para determinar la estadificación clínica de la enfermedad, según Mancianti et al. (35) y descrita por Reis et al. (36) está disponible en la Tabla Suplementaria S1. De acuerdo con el procedimiento estándar, se recolectaron muestras de varios órganos, incluida la glándula pituitaria. Después de la extirpación del encéfalo, se accedió a la hipófisis en la fosa pituitaria y la base del hueso esfenoides y la silla turca se eliminaron como un bloque con la glándula. Este bloque se fijó entero en formalina tamponada al 10% durante 24-48 h. La glándula se separó y se procesó en casetes individuales. Después de la incorporación de parafina, se analizaron las secciones histológicas teñidas con HE. La distinción del lóbulo anterior y posterior en la macroscopia, fue a veces un desafío. Debido a eso, algunas muestras tuvieron que ser reincluidas para corregir la orientación de las secciones histológicas. Sólo se evaluaron muestras con las tres regiones hipofisarias. Todas las muestras se fijaron en formalina tamponada al 10% y se procesaron para la incorporación de parafina. Las secciones histológicas (5 μm) se tiñeron con hematoxilina y eosina (HE) y se sometieron a tinción inmunohistoquímica (IHQ) (37).
2.6. Inmunohistoquímica
Se realizó inmunohistoquímica para detectar linfocitos TCD3 y buscar amastigotes de Leishmania spp. utilizando los anticuerpos primarios enumerados en la Tabla 1. Utilizamos suero hiperinmune heterólogo de ratones infectados experimentalmente con Leishmania (V.) shawi (cepa 15,789) como el anticuerpo primario para detectar Leishmania spp. (amablemente proporcionado por la Prof. Dra. Márcia Dalastra Laurenti, Laboratorio de Patología de Enfermedades Infecciosas de la FMUSP), y anticuerpo anti-CD3 (A0452, Dako) para la tinción de linfocitos T. Las secciones histológicas de tejido linfoide (ganglio linfático poplíteo) de un perro positivo para CanL, se muestran en la Figura Suplementaria S1; y se utilizaron amígdalas humanas para los linfocitos TCD3 para el control positivo de las reacciones.+
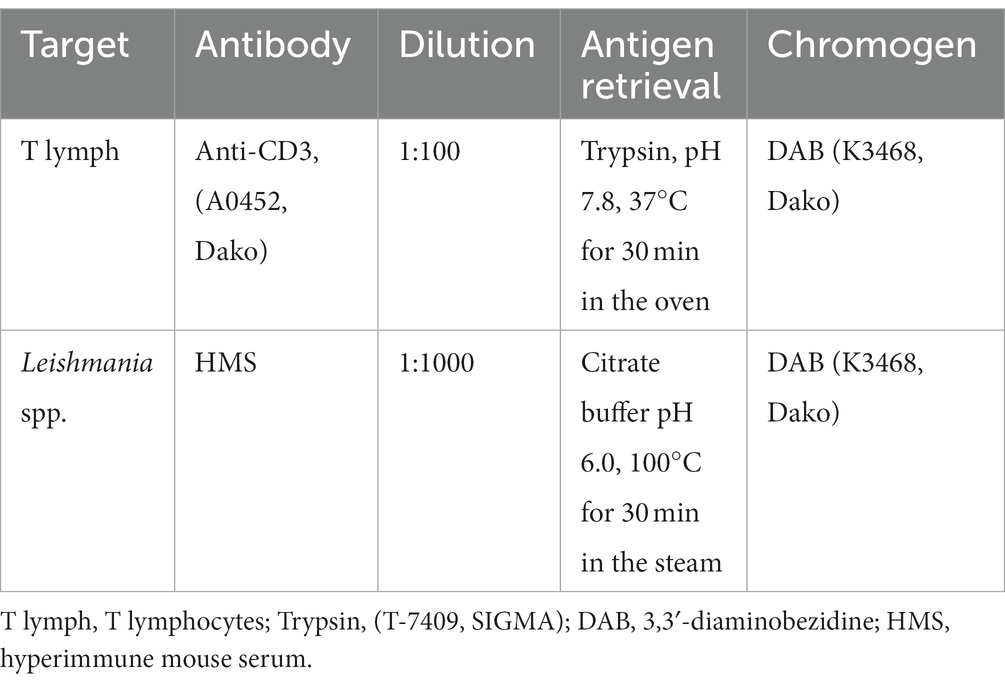 Tabla 1. Lista de anticuerpos, concentraciones, métodos de recuperación de antígenos y cromógenos utilizados en reacciones inmunohistoquímicas.
Tabla 1. Lista de anticuerpos, concentraciones, métodos de recuperación de antígenos y cromógenos utilizados en reacciones inmunohistoquímicas.
Para la desparafinación e hidratación, las secciones histológicas se sometieron a baños consecutivos de 5 minutos en xileno I, II y III, seguidos de hidratación en alcohol a concentraciones decrecientes (100, 95, 70 y 50%) y agua destilada. Para la búsqueda de amastigotes, se realizó la recuperación de antígenos (Tabla 1), seguida de tres lavados con solución salina tamponada con fosfato (PBS 1%, pH = 7,4). El bloque de peroxidasa se realizó sumergiendo las secciones en una solución de 50 mL de metanol, 50 mL de agua destilada y 2 mL de peróxido de hidrógeno durante 30 min a temperatura ambiente (25°C). Para detectar linfocitos TCD3, se bloqueó la peroxidasa endógena, seguida de la recuperación del antígeno. Después de lavar tres veces en PBS, las secciones se incubaron a temperatura ambiente (25 ° C) con un tampón de bloqueo que contenía 3 g de leche en polvo (Nestlé, Brasil) disuelto en 100 ml de solución salina tamponada (pH 7.4) durante 30 min a temperatura ambiente (25 ° C) para bloquear sitios no específicos. Los anticuerpos primarios se diluyeron en PBS (pH = 7,2) + suero bovino fetal (1%). Las diluciones estandarizadas de los anticuerpos primarios se enumeran en la Tabla 1.+
Los anticuerpos primarios se incubaron con secciones histológicas durante la noche durante 12-14 h a 4 °C en una cámara de humedad. Para el control negativo, se agregó un diluyente sin anticuerpo primario. Luego, los portaobjetos se incubaron con anticuerpos secundarios conjugados con peroxidasa (EnVisionTM FLEX – HRP; Dako, K8010) durante 45 min a temperatura ambiente (25°C). Después de tres lavados con PBS (pH = 7.4), se incubaron con un kit de sustrato DAB (K3468, Dako). Después de lavar con agua del grifo y contratinción con hematoxilina Harris, las secciones se deshidrataron, diafántaron y montaron con resina transparente (Entelan®) y cubreobjetos de vidrio. Los datos brutos de los animales y los resultados de las pruebas y exámenes evaluados están disponibles en el cuadro complementario S4.
2.7. Análisis histopatológico e inmunohistoquímico
Se observaron secciones histológicas de la glándula pituitaria teñidas con HE bajo un microscopio óptico (Olympus BX 50) para evaluar la presencia de formas amastigotes de Leishmania spp. y células inflamatorias en las regiones de la pars nervosa, pars intermedia y pars distalis. La cuantificación de las células inflamatorias se realizó por un método semicuantitativo, utilizando una escala de cuatro puntos (grado 0-3) modificada por Grano et al. (38), para representar la intensidad de la inflamación. Las secciones fueron evaluadas por dos observadores que identificaron la presencia e intensidad de la inflamación utilizando las siguientes puntuaciones, ausente (0), leve (1), moderada (2) y marcada (3) en cada región analizada.
La evaluación inmunohistoquímica de los linfocitos TCD3 se realizó utilizando un microscopio Olympus BX 50 junto con una cámara y una computadora. Las imágenes fueron capturadas de cinco campos de alta potencia (HPF; punto caliente) de las regiones de pars intermedia, pars distalis y pars nervosa, con un aumento final de ×400. Para el conteo manual de células inmunomarcadas con morfología consistente con la de linfocitos, se utilizó el software ImageJ 1.52, que se muestra en la Figura Suplementaria S2. Las marcas celulares intravasculares se excluyeron del análisis. La investigación de amastigotes de Leishmania spp. inmunomarcados se realizó bajo microscopía óptica, utilizando objetivos ×40 y ×100 y aumento final de ×400 y ×1.000 en todas las regiones mencionadas.+
2.8. Análisis estadístico
Se utilizó la prueba de Shapiro-Wilk para evaluar la normalidad de los datos. Las diferencias entre los grupos se determinaron mediante la prueba de Mann-Whitney para datos no paramétricos. La prueba de correlación de Spearman se utilizó para correlacionar la puntuación de inflamación con la estadificación clínica y el recuento medio de linfocitos TCD3 por región. La significación estadística se fijó en p < 0,05. Todos los análisis estadísticos se realizaron utilizando el software Prism (v8.0.1, GraphPad, La Jolla, CA, Estados Unidos).+
3. Resultados
3.1. Detección inmunohistoquímica de Leishmania infantum
La inmunodetección de Leishmania spp. en secciones hipofisarias mostró tinción positiva en el 9,52% (2/21) de las muestras. Las formas típicas de amastigote se localizaron en el citoplasma de los macrófagos y el intersticio de la pars intermedia de los perros infectados (Figura 1).
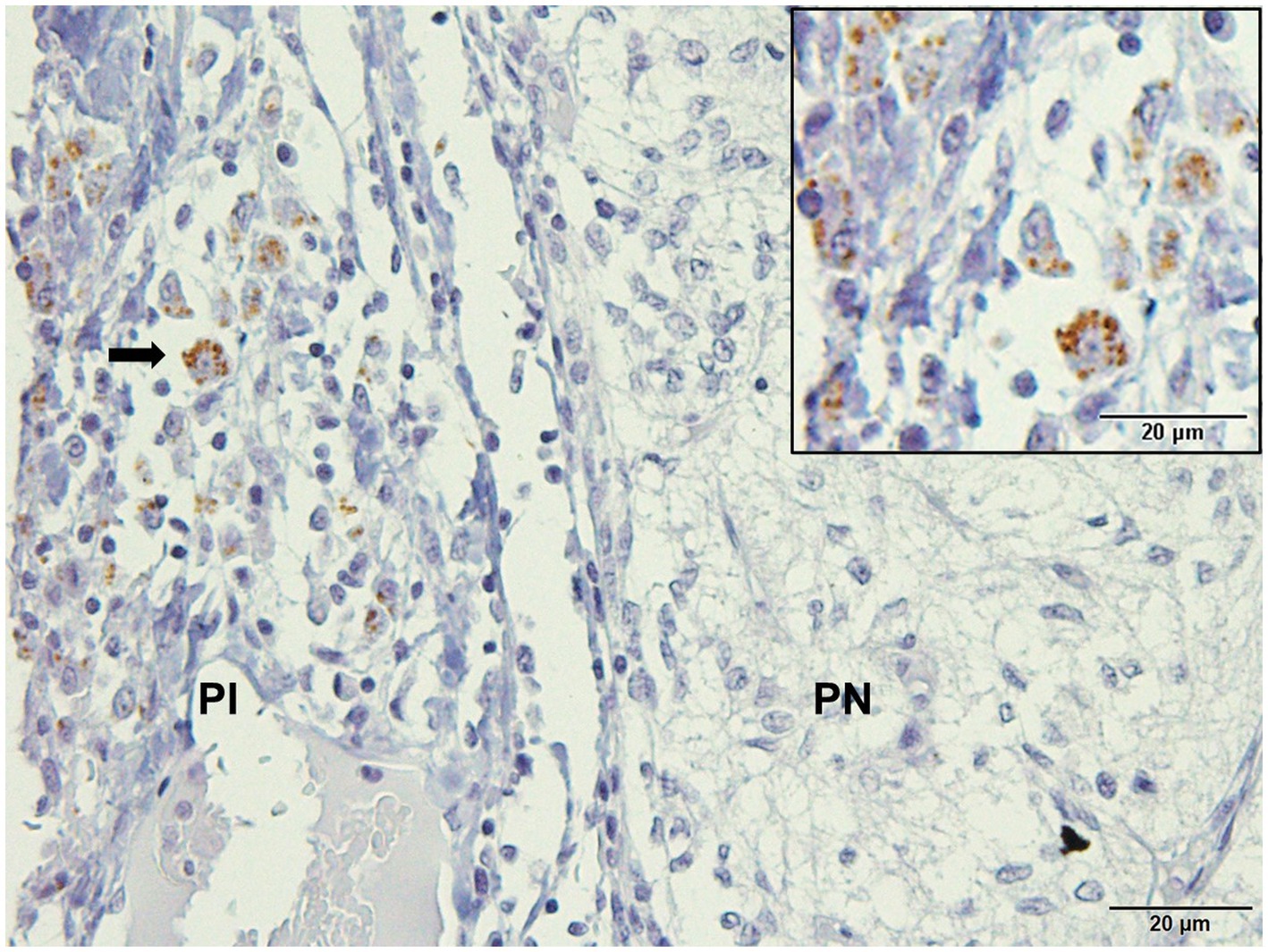 Figura 1. Microcrografía de la glándula pituitaria de un perro infectado con Leishmania spp. Inmunohistoquímica para la detección de amastigotes (flechas). Amastigotes inmunomarcantes positivos en el citoplasma de macrófagos y libres en pars intermedia (PI) de la adenohipófisis en el área marginal con pars nervosa (PN; suero hiperinmune de ratón +3,3′-diaminobezidina- DAKO; barra de escala = 20 μm).
Figura 1. Microcrografía de la glándula pituitaria de un perro infectado con Leishmania spp. Inmunohistoquímica para la detección de amastigotes (flechas). Amastigotes inmunomarcantes positivos en el citoplasma de macrófagos y libres en pars intermedia (PI) de la adenohipófisis en el área marginal con pars nervosa (PN; suero hiperinmune de ratón +3,3′-diaminobezidina- DAKO; barra de escala = 20 μm).
3.2. Estadificación clínica
Entre los perros del grupo infectado, el 52,38% fueron clasificados como sintomáticos, presentando al menos tres lesiones macroscópicas graves de la enfermedad, como alteraciones cutáneas difusas (alopecia, úlceras y dermatitis furfurfurácea), oculares (blefaritis y queratoconjuntivitis), emaciación marcada y otros signos clínicos característicos de CanL, como linfadenmegalia y onicogriposis. Los perros fueron clasificados como asintomáticos, sin lesiones evidentes, y oligosintomáticos, con lesiones cutáneas, pérdida leve de peso y linfadenomegalia, representando cada uno el 23,81% de los perros (Tabla Suplementaria S2).
3.3. Caracterización histopatológica
Los animales infectados (G1) mostraron un infiltrado inflamatorio compuesto por linfocitos, células plasmáticas y macrófagos raros en las regiones hipofisarias evaluadas (Figura 2; Cuadro suplementario S3). Se observaron células mononucleares en la pars intermedia de 11 animales (11/21), que se clasificó como discreta en 28,87% (6/21), moderada en 14,29% (3/21) y acentuada en 9,52% (2/21). En pars distalis, se observó la presencia de células inflamatorias en 13 animales (13/21), con intensidad discreta en el 28,57% (6/21) de los animales, moderada en el 23,80% (5/21) y acentuada en el 9,52% (2/21). En la pars nervosa, la inflamación fue evidente en nueve animales (9/21), con intensidad discreta en 33,33% (7/21) e intensidad moderada en 9,52% (2/21) (Figura 3). El grupo de animales no infectados (G2) mostró cambios mínimos, con la presencia discreta de grupos focales de células mononucleares en la pars distalis en el 40% (2/5) de los animales y el 20% (1/5) en la pars intermedia. La pars nervosa no mostró inflamación en el 100% (5/5) de los animales en el grupo control. No hubo correlación entre el estadio clínico de la leishmaniasis y la puntuación de inflamación en ninguna de las regiones hipofisarias del grupo infectado (G1): pars nervosa (p = 0,8565), pars intermedia (p = 0,1986) y pars distalis (p = 0,8284).
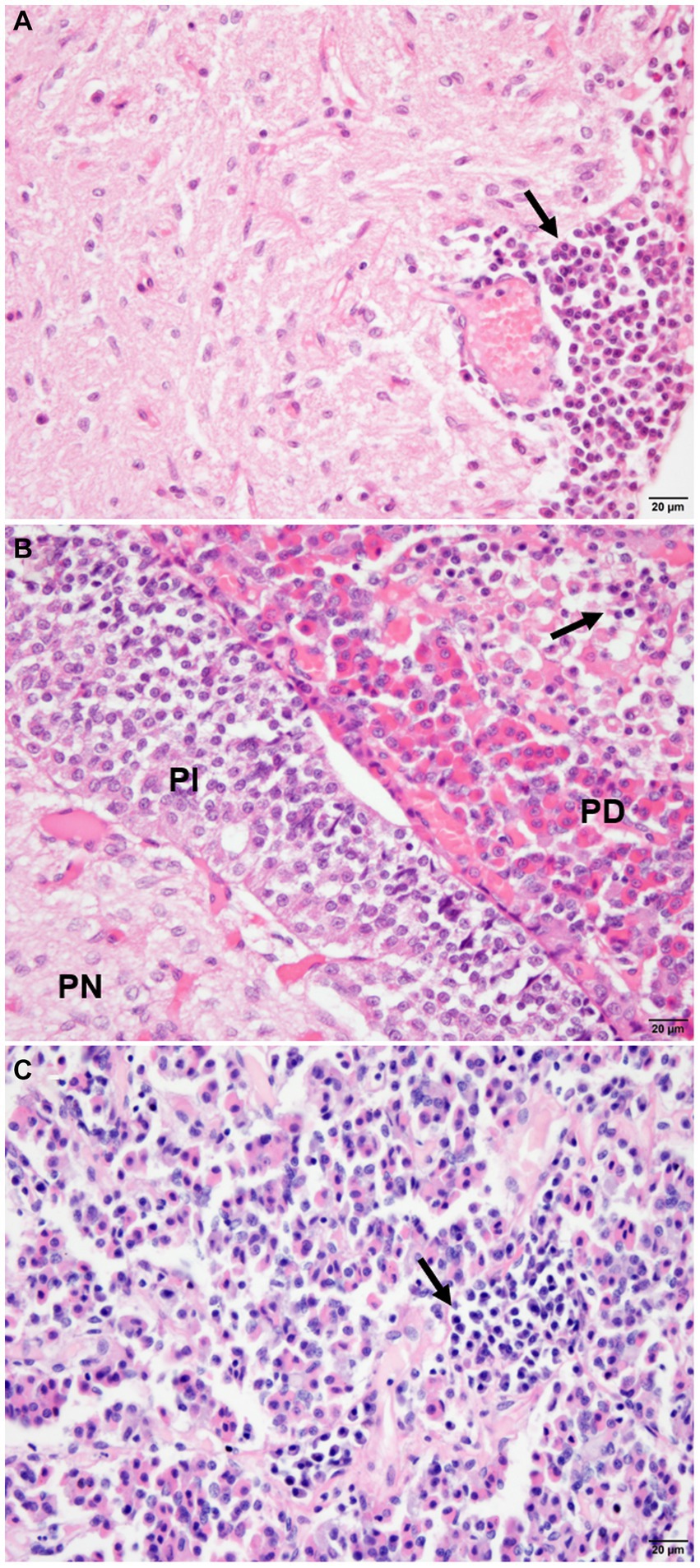 Figura 2. Microfotografía de las regiones hipofisarias de los perros (G1), que demuestra la distribución e intensidad de la inflamación compuesta por células mononucleares (flechas). (A) Nótese las células inflamatorias con distribución focal, perivascular en la pars nervosa (NP), con intensidad moderada. (B) Observar células inflamatorias entremezcladas con células cromófilas, acidófilas y basófilas con distribución focal e intensidad en pars distalis (PD), y ausencia de inflamación en pars intermedia (PI). (C) Nótese la inflamación con distribución focal y moderada en el parénquima en pars distalis (tinción HE, bar = 20 μm).
Figura 2. Microfotografía de las regiones hipofisarias de los perros (G1), que demuestra la distribución e intensidad de la inflamación compuesta por células mononucleares (flechas). (A) Nótese las células inflamatorias con distribución focal, perivascular en la pars nervosa (NP), con intensidad moderada. (B) Observar células inflamatorias entremezcladas con células cromófilas, acidófilas y basófilas con distribución focal e intensidad en pars distalis (PD), y ausencia de inflamación en pars intermedia (PI). (C) Nótese la inflamación con distribución focal y moderada en el parénquima en pars distalis (tinción HE, bar = 20 μm).
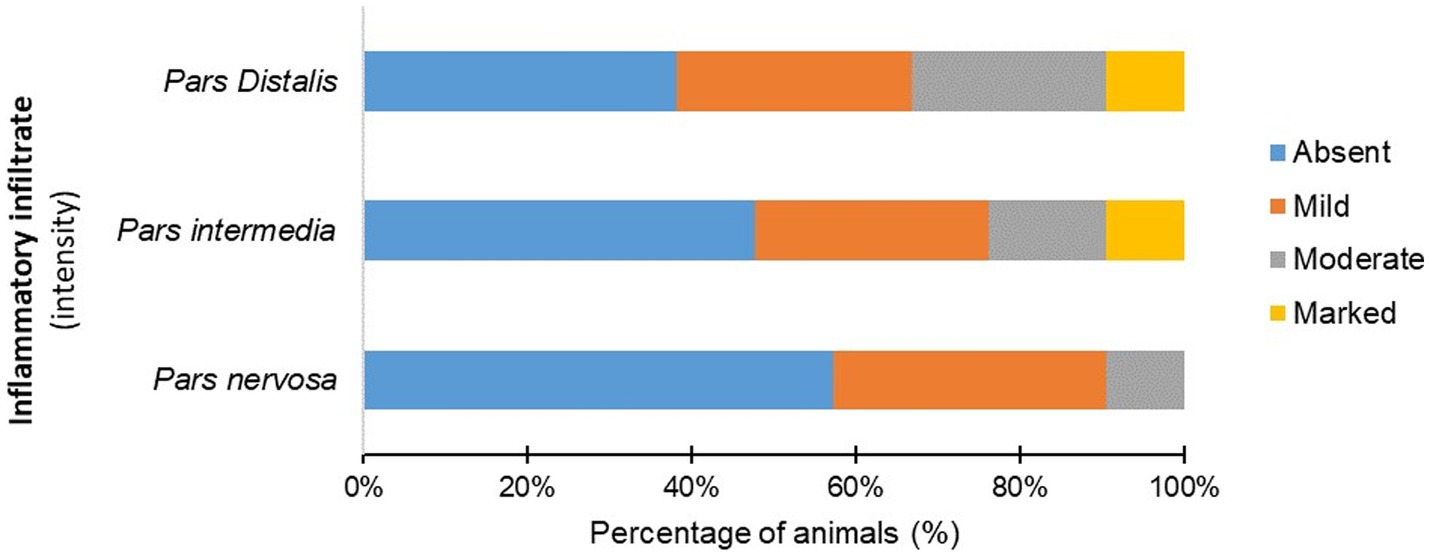 Figura 3. Porcentaje (%) de perros infectados (G1) según la intensidad de las células inflamatorias mononucleares observadas en la pars distalis, pars intermedia y pars nervosa.
Figura 3. Porcentaje (%) de perros infectados (G1) según la intensidad de las células inflamatorias mononucleares observadas en la pars distalis, pars intermedia y pars nervosa.
Además de la inflamación, no se observaron cambios como hiperplasia en la adenohipófisis. Y también en la pars nervosa, se observó una reacción glial (gliosis) en el 52,38% (11/21) de los perros del grupo infectado.
3.4. Inmunotinción de linfocitos TCD3+
La identificación y cuantificación de linfocitos TCD3 inmunomarcados se realizó en todas las regiones analizadas de la glándula pituitaria de perros infectados (n = 21) y control (n = 5). Las diferencias significativas entre los grupos se determinaron por región, con diferencia significativa entre G1 y G2 en la pars nervosa (p = 0,0357) y ninguna diferencia significativa entre G1 y G2 en la pars intermedia (p = 0,4935) y pars distalis (p = 0,4000; Figura 4).+
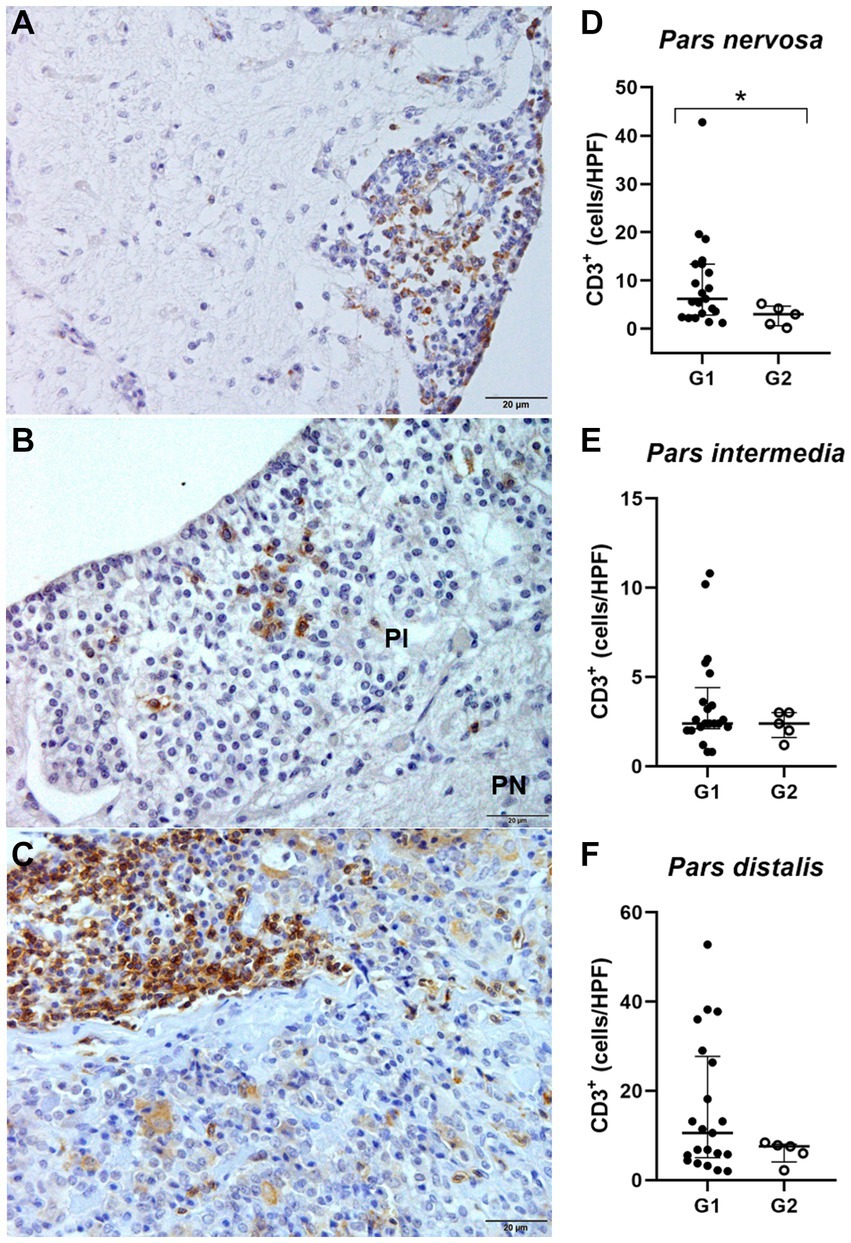 Figura 4. (A,C,E) Microfotografía que representa las regiones pars nervosa (PN), pars intermedia (PI) y pars distalis de la glándula pituitaria de un perro infectado con Leishmania spp., inmunohistoquímica para la detección de linfocitos T CD3 revelados con DAB DAKO (barra de escala = 20 μm). (B, D, F) Gráficos de dispersión que muestran el número de linfocitos TCD3 en las regiones hipofisarias de perros del grupo G1 (n = 21) y G2 (control n = 5). Las líneas horizontales representan los valores del rango mediano e intercuartílico. (B) El número de células TCD3 fue mayor en la pars nervosa (*p = 0,0357). (D,F) No hay diferencia en la pars intermedia (p = 0,4935) y pars distalis (p = 0,4000).+++
Figura 4. (A,C,E) Microfotografía que representa las regiones pars nervosa (PN), pars intermedia (PI) y pars distalis de la glándula pituitaria de un perro infectado con Leishmania spp., inmunohistoquímica para la detección de linfocitos T CD3 revelados con DAB DAKO (barra de escala = 20 μm). (B, D, F) Gráficos de dispersión que muestran el número de linfocitos TCD3 en las regiones hipofisarias de perros del grupo G1 (n = 21) y G2 (control n = 5). Las líneas horizontales representan los valores del rango mediano e intercuartílico. (B) El número de células TCD3 fue mayor en la pars nervosa (*p = 0,0357). (D,F) No hay diferencia en la pars intermedia (p = 0,4935) y pars distalis (p = 0,4000).+++
Debido a que estos animales están infectados naturalmente, se esperan observaciones en las variaciones en la distribución y el número de estas células entre los individuos, considerando que se desconoce el tiempo transcurrido desde la infección. Además, para homogeneizar las muestras en relación con el número de linfocitos T CD3 encontrados en los animales control, determinamos el número medio de CD3 en las respectivas regiones de la glándula pituitaria de los perros control y establecimos un punto de corte. Por lo tanto, seleccionamos un subgrupo de 10 animales dentro de los animales infectados que contenían un número de CD3 superior al promedio de los animales control. Esta subpoblación de animales del grupo G1, cuando se comparó con G2, mostró una diferencia significativa respecto a G2 en el número de linfocitos TCD3 observados en la pars intermedia (**p = 0,0070) y pars distalis (***p = 0,0007). Además, en la pars nervosa de perros infectados, se observó la diferencia entre G1 y G2 (*p = 0,0441), incluso con la eliminación de un solo perro que tenía el mayor número de células TCD3+ (n = 20; Figura 5).++++
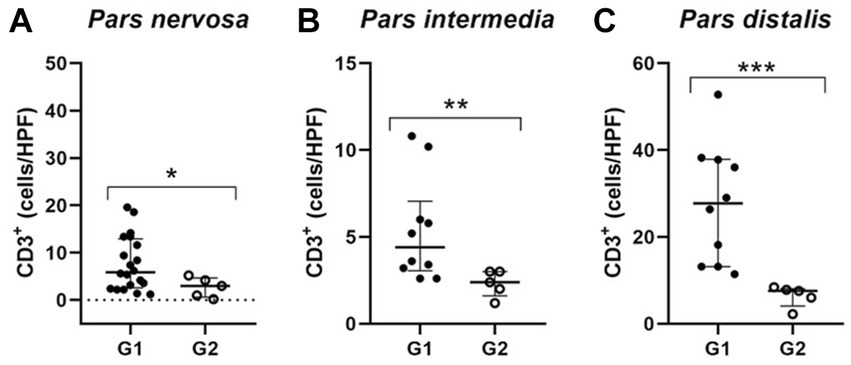 Figura 5. Gráficos de dispersión que muestran el número de linfocitos TCD3 en las regiones hipofisarias de las subpoblaciones G1. Las líneas horizontales representan los valores del rango mediano e intercuartílico. (A) En la evaluación de la pars nerviosa, el animal con el mayor número de células TCD3 fue retirado de los perros infectados (G1; n = 20), y cuando se compara con el grupo control (G2; n = 5), se mantuvo la diferencia estadística (* p = 0,0441); (B,C) la evaluación pars intermedia y pars distalis resultó en una subpoblación de diez perros infectados (G1; n = 10) con mayor número de células TCD3 en comparación con el grupo control (G2; n = 5) siendo seleccionado. Esta subpoblación de perros mostró un aumento significativo de las células TCD3, respectivamente ( ** p = 0,0070) y (*** p = 0,0007).++++
Figura 5. Gráficos de dispersión que muestran el número de linfocitos TCD3 en las regiones hipofisarias de las subpoblaciones G1. Las líneas horizontales representan los valores del rango mediano e intercuartílico. (A) En la evaluación de la pars nerviosa, el animal con el mayor número de células TCD3 fue retirado de los perros infectados (G1; n = 20), y cuando se compara con el grupo control (G2; n = 5), se mantuvo la diferencia estadística (* p = 0,0441); (B,C) la evaluación pars intermedia y pars distalis resultó en una subpoblación de diez perros infectados (G1; n = 10) con mayor número de células TCD3 en comparación con el grupo control (G2; n = 5) siendo seleccionado. Esta subpoblación de perros mostró un aumento significativo de las células TCD3, respectivamente ( ** p = 0,0070) y (*** p = 0,0007).++++
Realizamos una prueba de correlación para evaluar si la intensidad de la inflamación se asoció con el aumento de linfocitos TCD3. Se encontró correlación entre estos parámetros en las tres regiones hipofisarias: pars nervosa (**p = 0,0033), pars intermedia (*p = 0,0223) y pars distalis (*p = 0,0154; Figura 6).+
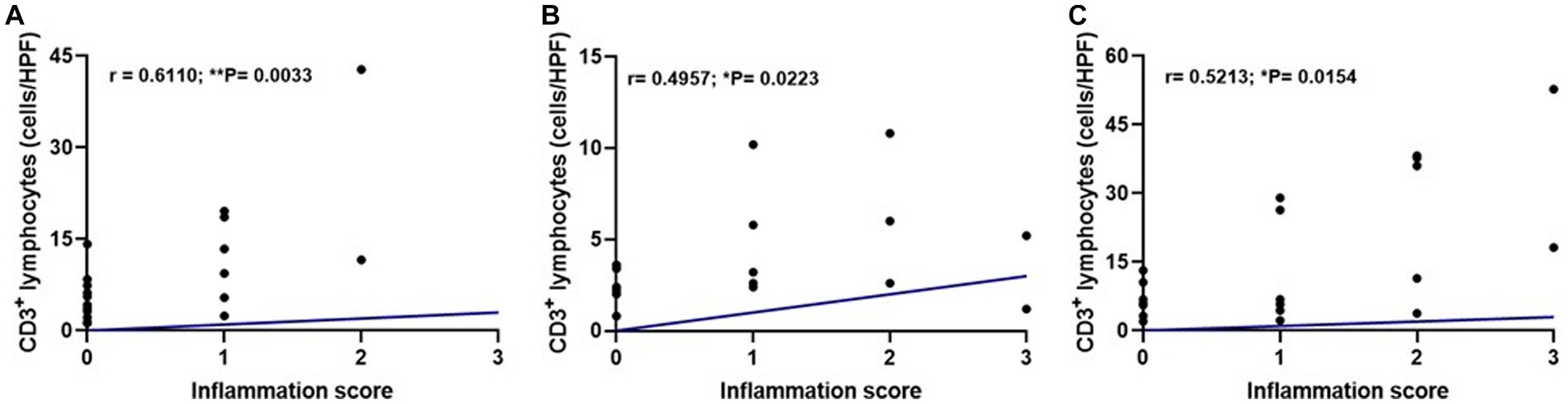 Figura 6. Gráficos de dispersión que muestran una correlación positiva moderada entre la puntuación de inflamación y la mediana del recuento de linfocitos TCD3 por región hipofisaria en el grupo infectado (G1, n = 21) utilizando la prueba de Spearman. (A) Pars nervosa (r = 0,6110; **p = 0,0033). (B) Pars intermedia (r = 0,4957; *p = 0,0223). (C) Pars distalis (r = 0,5213; *p = 0,0154).+
Figura 6. Gráficos de dispersión que muestran una correlación positiva moderada entre la puntuación de inflamación y la mediana del recuento de linfocitos TCD3 por región hipofisaria en el grupo infectado (G1, n = 21) utilizando la prueba de Spearman. (A) Pars nervosa (r = 0,6110; **p = 0,0033). (B) Pars intermedia (r = 0,4957; *p = 0,0223). (C) Pars distalis (r = 0,5213; *p = 0,0154).+
4. Discusión
Aunque CanL se reconoce como una enfermedad sistémica grave, pocos estudios han descrito su afectación neurológica y complicaciones, incluida la afectación hipofisaria. Encontramos inflamación difusa con la presencia de linfocitos T CD3 localizados principalmente en la pars distalis. También detectamos amastigotes del parásito en los órganos de dos animales, lo cual es relevante teniendo en cuenta el tropismo del parásito para varios órganos y su capacidad para promover una respuesta inmune específica del órgano. Estos hallazgos sugieren que la respuesta inmune podría promover alteraciones en la producción de hormonas en la glándula pituitaria y, en consecuencia, en todos sus órganos diana, afectando la condición clínica del animal o similar.+
La evaluación inmunohistoquímica de la glándula pituitaria de perros con CanL reveló la presencia de Leishmania spp. amastigotes en dos animales. Debido al pequeño número de amastigotes en el tejido hipofisario, la investigación del parásito fue ineficaz en las secciones teñidas con HE. Sin embargo, usando inmunohistoquímica, se observaron amastigotes inmunomarcados dentro y fuera del citoplasma de los macrófagos en la región de la pars intermedia de los dos perros. Este es el primer estudio de amastigotes de Leishmania spp. en la glándula pituitaria de perros, similar al encéfalo. Los estudios sobre la identificación de formas amastigotas de L. infantum en el plexo coroideo y las meninges de perros infectados naturalmente son limitados (28, 29, 31, 39, 40).
Similar a los hallazgos de estudios realizados en los cerebros de perros con CanL, la inflamación no se relacionó con la presencia de amastigotes en el tejido (30, 41-43). Una hipótesis sería que la inflamación sistémica crónica resultante de la infección por L. infantum, con producción de citoquinas y quimiocinas, podría alterar la permeabilidad de barrera (44-46). Además, se debe considerar la formación de inmunocomplejos que resultan en vasculitis, particularmente en el caso de la hipófisis, que es un órgano muy vascularizado y presenta puntos más permeables (47, 48). Sin embargo, el tejido nervioso también se ve afectado en perros con CanL, con la activación de las células gliales, lo que puede estar directamente relacionado con la modulación de la respuesta inflamatoria local y la alteración de la permeabilidad de la barrera (46).
Además de amastigotes, también observamos la presencia de un infiltrado inflamatorio compuesto por células mononucleares (por ejemplo, linfocitos, células plasmáticas y macrófagos). Hubo una correlación significativa moderada entre la intensidad de la inflamación y el número de linfocitos TCD3 en las regiones hipofisarias analizadas, como lo demuestra la detección inmunohistoquímica. Se observó un aumento del número de linfocitos TCD3 en la pars nervosa en el grupo infectado. Algunos trabajos referenciados en la literatura, como trabajos realizados por nuestro grupo, destacan el predominio de linfocitos T (49, 50). La citometría sería el método más adecuado para la caracterización y cuantificación de fenotipos de linfocitos T. Sin embargo, el pequeño tamaño de la glándula pituitaria impidió la evaluación histológica, inmunohistoquímica y de citometría de flujo.++
Los linfocitos en la glándula pituitaria se han descrito en perros con enfermedades concomitantes, como linfoma multicéntrico, osteoartritis, hiperplasia nodular en la pars distalis y adenoma hipofisario. La respuesta celular compuesta, con predominio de células TCD3, puede caracterizar hipofisitis linfocítica subclínica (9). En los seres humanos, la causa de la hipofisitis linfocítica sigue siendo desconocida, pero según la naturaleza de la inflamación, los linfocitos T son cruciales para el desarrollo de la enfermedad, y por lo tanto la hipótesis es que este trastorno es de origen inmune mediado (4, 51-53). Se han reportado lesiones inmunomediadas en perros con CanL, especialmente aquellas observadas en órganos altamente vascularizados como ojos y riñones (47, 54, 55).+
En la glándula pituitaria de los perros en este estudio, la mayor intensidad de inflamación se observó en la pars distalis y la pars intermedia de la adenohipófisis. En humanos con hipofisitis linfocítica, la adenohipófisis es el área más afectada (50). El proceso autoinmune posiblemente se dirige a subtipos específicos de células pituitarias, posiblemente causando daño a la hormona corticotrófica (ACTH), FSH / LH o células secretoras de TSH en la adenohipófisis (52, 53, 56).
En humanos, se han observado casos similares de hipofisitis linfocítica, destacando que estas células inflamatorias en la pars distalis y pars nervosa deben considerarse patológicas (51, 57, 58). Además, la hipofisitis linfocítica se ha asociado con hipopituitarismo, hipoadrenocorticismo secundario y alteración de la producción de ACTH y cortisol (7). También se considera una causa probable de muerte súbita en perros (2, 3, 6, 9).
Desafortunadamente, como este estudio se realizó en animales ingresados para necropsia, no pudimos realizar mediciones hormonales. Las investigaciones futuras que utilicen un mayor número de perros y correlacionen la aparición de hipofisitis con cambios hormonales serían valiosas para mejorar la importancia de los resultados presentados.
También se ha observado que los plasmocitos están involucrados en la inflamación en las glándulas pituitarias de los perros en este estudio. Este tipo de célula se observó mediante tinción HE de muestras de tejido hipofisario, y aunque la presencia de células plasmáticas se describe en casos de hipofisitis en humanos, este número es aparentemente menor en perros que en linfocitos TCD3. Estas células no fueron caracterizadas inmunohistoquímicamente en nuestro estudio. Similar a las evaluaciones realizadas en la hipofisitis humana, se necesitan más estudios para comprender la función de estas células en casos de hipofisitis linfocítica (9, 56).+
No se observó relación entre los signos clínicos de CanL presentados por los perros después de la estadificación clínica propuesta por Reis et al. (35, 36) y la intensidad de la inflamación en el tejido hipofisario. Estos datos sugieren que la inflamación de la glándula pituitaria no está relacionada con el estadio clínico del CanL. Nuestros hallazgos corroboran los de otros estudios que analizaron cambios en el cerebro en animales con CanL, donde no hubo correlación entre el estadio clínico de la enfermedad y la intensidad de la inflamación en el tejido nervioso (30, 38, 41, 50). Sin embargo, los perros evaluados estaban infectados naturalmente y, por lo tanto, un grupo heterogéneo en relación con la etapa de infección, lo que dificulta la comprensión de la evolución de los cambios inflamatorios en la glándula pituitaria.
La respuesta inmune anti-Leishmania incluye la producción de varias citoquinas (24), como el TNF, que pueden regular el sistema endocrino, pudiendo así inhibir la secreción de hormonas hipofisarias como la TSH (59) y la hormona gonadotrófica (60).
Se han reportado estudios de anomalías endocrinas en humanos con leishmaniasis visceral, como disfunción en la secreción de hormona antidiurética (ADH) y alteraciones en los ejes hipotalámico-hipofisario-suprarrenal, hipófisis-tiroides y pituitario-gonadal (26); Sin embargo, requieren más investigación en perros. Podemos inferir que la aparición de hipofisitis en CanL también puede resultar en la producción de citoquinas que pueden tener acción local o sistémica y pueden interferir directa o indirectamente con la producción de hormonas hipofisarias y contribuir a la modulación positiva o negativa de la respuesta del huésped a la infección (26, 45, 59, 60). Se necesitan más estudios para dilucidar los mecanismos y la patogénesis de CanL en la glándula pituitaria y sus consecuencias en la condición clínica del paciente. Se sugieren posibles mecanismos involucrados en la complicación de lesiones neurológicas en perros, como el efecto directo del parásito, las lesiones inmunomediadas relacionadas con la enfermedad y la vasculitis causada por efectos indirectos de la leishmaniasis (25, 47).
Este es el primer estudio de la presencia de Leishmania spp. amastigotes en la glándula pituitaria e hipofisitis en perros infectados con Leishmania spp. La presencia de linfocitos TCD3 y/o parásitos en la región hipofisaria presupone disfunción de la glándula y posible empeoramiento del estado clínico del paciente, comprometiendo la eficacia del tratamiento y el pronóstico.+
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Ética y Experimentación Animal de la Facultad de Medicina Veterinaria, Universidad Estatal de São Paulo, UNESP, Araçatuba, Brasil (FOA-0354-2021). Los estudios se realizaron de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
EF: ejecución del proyecto, recopilación y curación de datos, análisis de resultados y redacción del borrador. CG: recogida y tratamiento de datos, revisión crítica del texto. GJ: corrección y edición de partes significativas de la obra. KM: recopilación y procesamiento de datos, análisis estadístico. GuM: análisis estadístico y revisión crítica del texto. TW: revisión crítica del texto. GiM: coordinación de la planificación y ejecución de la actividad investigadora, obtención de apoyo financiero. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este estudio fue financiado en parte por la Coordenação de Aperfeiçoamento de Pessoal de Nível Superior, Brasil (CAPES), código de finanzas 001.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1208919/full#supplementary-material
Referencias
1. Perez-Castro, C, Renner, U, Haedo, MR, Stalla, GK, and Arzt, E. Especificidad celular y molecular de la fisiología de la glándula pituitaria. Physiol Rev. (2012) 92:1–38. doi: 10.1152/physrev.00003.2011
2. Polledo, L, Grinwis, GCM, Graham, P, Dunning, M, y Baiker, K. Hallazgos patológicos en las glándulas pituitarias de perros y gatos. Veterinario Pathol. (2018) 55:880–8. doi: 10.1177/0300985818784162
3. Miller, MA, Bruyette, DS, Scott-Moncrieff, JC, Owen, TJ, Ramos-Vara, JA, Weng, HY, et al. Hallazgos histopatológicos en glándulas pituitarias caninas. Veterinario Pathol. (2018) 55:871–9. DOI: 10.1177/0300985818766211
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Bellastella, A, Bizzarro, A, Coronella, C, Bellastella, G, Sinisi, AA, and De Bellis, A. Lymphocytic hypophysitis: a rare or underestimated disease? Eur J Endocrinol. (2003) 149:363–76. doi: 10.1530/eje.0.1490363
5. Langlois, F, Varlamov, EV, y Fleseriu, M. Hypophysitis, el espectro creciente de una enfermedad pituitaria rara. J Clin Endocrinol Metab. (2022) 107:10–28. doi: 10.1210/clinem/dgab672
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Adissu, HA, Hamel-Jolette, A, y Foster, RA. Adenohipofisitis linfocítica y adrenalitis en un perro con atrofia suprarrenal y tiroidea. Veterinario Pathol. (2010) 47:1082–5. DOI: 10.1177/0300985810382520
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Wolfesberger, B, Fuchs-Baumgartinger, A, Schwendenwein, I, Zeugswetter, F, and Shibly, S. Muerte súbita en un perro con hipofisitis linfoplasmacítica. J Comp Pathol. (2011) 145:231–4. doi: 10.1016/j.jcpa.2011.01.004
8. Meij, BP, Voorhout, G, Gerritsen, RJ, Grinwis, GCM, and Ijzer, J. Lymphocytic hypophysitis in a dog with diabetes insipidus. J Comp Pathol. (2012) 147:503–7. doi: 10.1016/j.jcpa.2012.04.006
9. Blomqvist, MA, Ley, C, Karlsson, HK, y Hanson, JM. Presencia de linfocitos CD3+ y CD79a+ en la glándula pituitaria de perros en el examen post mortem. J Comp Pathol. (2020) 176:116–21. doi: 10.1016/j.jcpa.2020.02.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Ben Abid, F, Abukhattab, M, Karim, H, Agab, M, Al-Bozom, I, and Ibrahim, WH. Am J Case Rep. (2017) 18:391–4. doi: 10.12659/AJCR.903233
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Anyogu, DC, Shoyinka, SVO, e Ihedioha, JI. Lesiones cerebrales y pituitarias-suprarrenales de infecciones por Trypanosoma brucei brucei y Trypanosoma congolense en los carneros enanos de África occidental: ¿está sobrevalorada la tripanotolerancia? Veterinario Pathol. (2022) 59:773–81. DOI: 10.1177/03009858221100432
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Bentivoglio, M, Kristensson, K, y Rottenberg, ME. Órganos circumventriculares y neurotropismo parasitario: ¿puertas descuidadas al cerebro? Frente Immunol. (2018) 9:2877. doi: 10.3389/fimmu.2018.02877
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Duvernoy, HM, y Risold, PY. Los órganos circumventriculares: un atlas de anatomía comparada y vascularización. Brain Res Rev. (2007) 56:119–47. doi: 10.1016/j.brainresrev.2007.06.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Kaur, C, y Ling, EA. Los órganos circumventriculares. Histol Histopathol. (2017) 32:879–92. doi: 10.14670/HH-11-881
15. Mastorakos, P, y McGavern, D. La anatomía e inmunología de la vasculatura en el sistema nervioso central. Sci Immunol. (2019) 4:1–15. doi: 10.1126/sciimmunol.aav0492
16. Taylor, MA, Coop, RL, and Wall, RL En: MA Taylor, RL Coop, and RL Wall, editors. Parasitología veterinaria. Parásitos de perros y gatos: Parásitos del hígado. 3ª ed. Publicación: Blackwell (2007). 980–3.
17. Desjeux, P. Human leishmaniases: epidemiology and public health aspects. Estadísticas de la salud mundial Q. (1992) 45:267–75.
18. Organización Mundial de la Salud. Control de las leishmaniasis. World Health Organ Tech Rep Ser. (2010) 949:22–6.
19. Maurício, IL, Stothard, JR, y Miles, MA. El extraño caso de Leishmania chagasi. Parasitol hoy. (2000) 16:188–9. doi: 10.1016/S0169-4758(00)01637-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Baneth, G. Leishmaniases En: CE Greene, editor. Enfermedades infecciosas del perro y el gato. 3ª ed. St. Louis: Elsevier Saunders (2006). 686–98.
21. Tizard, IR. Linfócitos T auxiliares e sua resposta aos antígenos: O receptor de antígeno do linfócito T En: IR Tizard, editor. Imunologia Veterinária. 9ª ed. Río de Janeiro: Elsevier Ltd (2014). 304–33.
22. Cortese, L, Oliva, G, Ciaramella, P, Persechino, A, y Restucci, B. Primary hypothyroidism associated with leishmaniasis in a dog. J Am Anim Hosp Assoc. (1999) 35:487–92. doi: 10.5326/15473317-35-6-487
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Rosa, FA, Leite, JHA, Braga, ET, Moreira, PRR, Baltazar, FH, Biondo, AW, et al. Lesiones cardíacas en 30 perros infectados naturalmente con Leishmania infantum Chagasi. Veterinario Pathol. (2014) 51:603–6. doi: 10.1177/0300985813493914
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Baneth, G, Koutinas, AF, Solano-Gallego, L, Bourdeau, P, and Ferrer, L. Canine leishmaniosis – new concepts and insights on an expanding zoonosis: part one. Tendencias Parasitol. (2008) 24:324–30. doi: 10.1016/j.pt.2008.04.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Giannuzzi, AP, Ricciardi, M, De Simone, A, y Gernone, F. Manifestaciones neurológicas en perros naturalmente infectados por Leishmania infantum: descripciones de 10 casos y una revisión de la literatura. J Small Anim Pract. (2017) 58:125–38. doi: 10.1111/jsap.12650
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Verde, FA, Verde, FA, Neto, AS, Almeida, PC y Verde, EM. Alteraciones hormonales en la leishmaniasis visceral (kala-azar). Am J Trop Med Hyg. (2011) 84:668–73. doi: 10.4269/ajtmh.2011.09-0171
27. Barros-Gonçalves, TD, Saavedra, AF, Silva-Couto, L, Ribeiro-Romão, RP, Bezerra-Paiva, M, Gomes-Silva, A, et al. El aumento de los niveles de cortisol se asocia con la gravedad de la leishmaniasis visceral experimental en un modelo de leishmania (L.) infantumhamster. PLoS Negl Trop Dis. (2021) 15:E0009987. doi: 10.1371/journal.pntd.0009987
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Grano, FG, Silva, JEDS, de, MGD, y Machado, GF. Leishmania escondite: amastigotes parásitos en el plexo coroides de un perro con signos neurológicos en un municipio endémico de Brasil. Vet Parasitol Reg Stud Reports. (2019) 17:100291. doi: 10.1016/j.vprsr.2019.100291
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Márquez, M, Pedregosa, JR, López, J, Marco-Salazar, P, Fondevila, D, and Pumarola, M. Leishmania amastigotes in the central nervous system of a naturally infected dog. J Vet Diagn Investig. (2013) 25:142–6. DOI: 10.1177/1040638712466728
30. Melo, GD, Marcondes, M, Vasconcelos, RO y Machado, GF. Entrada de leucocitos en el SNC de perros infectados naturalmente con Leishmania chagasi. Veterinario Parasitol. (2009) 162:248–56. doi: 10.1016/j.vetpar.2009.03.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Oliveira, V. Ocorrência de Leishmania infantum em Sistema Nervoso Central de Cães Naturalmente Infectados: Lesões Associadas e Isolamento Parasitológico de Tecidos e Líquor; (2016). Disponible en: https://www.arca.fiocruz.br/handle/icict/25391 (consultado el 13 de julio de 2022).
32. Lima, VMF, Gonçalves, ME, Ikeda, FA, Luvizotto, MCR, and Feitosa, MM. Anti-Leishmania anticuerpos en líquido cefalorraquídeo de perros con leishmaniasis visceral. Braz J Med Biol Res. (2003) 36:485–9. doi: 10.1590/S0100-879X2003000400010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Brasil. Manual de Vigilância e Controle da Leishmaniose Visceral. 1ª ed. 5rpt ed. Brasilia: Ministério da Saúde (2014). 120, il p.
34. Conselho Federal de Medicina Veterinária, en CFMV. Resolução no 1000, De 11 de Maio de 2012 – Dispõe Sobre Procedimentos e Métodos de Eutanásia em Outras Providências, pp. 1–9; (2012). Disponible en: http://ts.cfmv.gov.br/manual/arquivos/resolucao/1000.pdf. (Consultado el 03 de septiembre de 2022).
35. Mancianti, F, Gramiccia, M, Gradoni, L, y Pieri, S. Studies on canine leishmaniasis control. 1. Evolución de la infección de diferentes formas clínicas de leishmaniasis canina tras tratamiento antimonial. Trans R Soc Trop Med Hyg. (1988) 82:566–7. doi: 10.1016/0035-9203(88)90510-X
36. Reis, AB, Martins-Filho, OA, Teixeira-Carvalho, A, Giunchetti, RC, Carneiro, CM, Mayrink, W, et al. Respuesta inmune sistémica y compartimentada en la leishmaniasis visceral canina. Veterinario Immunol Immunopathol. (2009) 128:87–95. doi: 10.1016/j.vetimm.2008.10.307
37. Carson, FL, y Hladik, C. Histotechnology – A Self-Instructional Text. 3ª ed. Chicago: American Society of Consultant Pharmacists Press (2009).
38. Grano, FG, Silva JE, DS, Melo, GD, de Souza, MS, VMF, L, y Machado, GF. Receptores tipo toll y citoquinas en el cerebro y en el bazo de perros con leishmaniosis visceral. Veterinario Parasitol. (2018) 253:30–8. doi: 10.1016/j.vetpar.2018.02.030
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Macao, WL, Cortez de Sá, J, da Silva, APC, Rocha, AL, Mondêgo-Oliveira, R, de Andrade, FHE, et al. Principales lesiones en el sistema nervioso central de los perros debido a la infección por Leishmania infantum. BMC Vet Res. (2017) 13:255. DOI: 10.1186/S12917-017-1174-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Font, A, Mascort, J, Altimira, J, Closa, JM, and Vilafranca, M. Acute paraplejia associated with vasculitis in a dog with leishmaniasis. J Small Anim Pract. (2004) 45:199–201. doi: 10.1111/j.1748-5827.2004.tb00224.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Ikeda, FA, Laurenti, MD, Corbett, CE, Feitosa, MM, Machado, GF y Perri, SHV. Estudio histológico e inmunohistoquímico del sistema nervioso central de perros naturalmente infectados por Leishmania (Leishmania) chagasi. Braz J Vet Res Anim Sci. (2007) 44:5–11. doi: 10.11606/issn.1678-4456.bjvras.2007.26653
42. Santarém, N, Silvestre, R, Tavares, J, Silva, M, Cabral, S, Maciel, J, et al. Regulación de la respuesta inmune por antígenos secretados y no secretados por Leishmania. J Biomed Biotechnol. (2007) 2007:85154. DOI: 10.1155/2007/85154
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Revest, M, Donaghy, L, Cabillic, F, Guiguen, C, y Gangneux, JP. Comparación de los efectos inmunomoduladores de L. donovani y L. principales antígenos excretados-secretados, extractos particulados y solubles y parásitos viables en células dendríticas humanas. Vacuna. (2008) 26:6119–23. doi: 10.1016/j.vaccine.2008.09.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Koutinas, AF, y Koutinas, CK. Mecanismos patológicos subyacentes a los hallazgos clínicos en la leishmaniosis canina debida a Leishmania infantum/chagasi. Veterinario Pathol. (2014) 51:527–38. DOI: 10.1177/0300985814521248
45. Melo, GD, Seraguci, TF, Schweigert, A, Silva, JES, Grano, FG, Peiró, JR, et al. Las citoquinas proinflamatorias predominan en el cerebro de perros con leishmaniasis visceral: un modelo natural de neuroinflamación durante la infección parasitaria sistémica. Veterinario Parasitol. (2013) 192:57–66. doi: 10.1016/j.vetpar.2012.11.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Melo, GD, y Machado, GF. Reactividad glial en perros con leishmaniasis visceral: correlación con la infiltración de linfocitos T y con los títulos de anticuerpos anti-Leishmania en el líquido cefalorraquídeo. Tejido celular res. (2011) 346:293–304. DOI: 10.1007/S00441-011-1290-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Pumarola, M, Brevik, L, Badiola, J, Vargas, A, Domingo, M, y Ferrer, L. Leishmaniasis canina asociada con vasculitis sistémica en dos perros. J Comp Pathol. (1991) 105:279–86. DOI: 10.1016/S0021-9975(08)80196-X
48. Amar, AP, y Weiss, MH. Anatomía y fisiología pituitaria. Neurosurg Clin N Am. (2003) 14:11–23, v. doi: 10.1016/s1042-3680(02)00017-7
49. Alexandre-Pires, G, de Brito, MT, Algueró, C, Martins, C, Rodrigues, OR, da Fonseca, IP, et al. Leishmaniasis canina. Perfil inmunofenotípico de leucocitos en diferentes compartimentos de perros sintomáticos, asintomáticos y tratados. Veterinario Immunol Immunopathol. (2010) 137:275–83. doi: 10.1016/j.vetimm.2010.06.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Melo, GD, y Machado, GF. Afectación del plexo coroideo en perros con leishmaniasis visceral espontánea: una investigación histopatológica. Braz J Veterinario Pathol. (2009) 2:69–74.
51. Caturegli, P, Newschaffer, C, Olivi, A, Pomper, MG, Burger, PC y Rose, NR. Hipofisitis autoinmune. Endocr Rev. (2005) 26:599–614. DOI: 10.1210/ER.2004-0011
52. Falorni, A, Minarelli, V, Bartoloni, E, Alunno, A, y Gerli, R. Diagnosis and classification of autoimmune hypophysitis. Autoimmun Rev. (2014) 13:412–6. doi: 10.1016/j.autrev.2014.01.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Grau-Roma, L, Peckham, R, Paton, J, Stahel, A, and de Brot, S. Occurrence of primary lymphocytic hypophysitis in two horses and presence of scattered T-lymphocytes in the normal equine pituitary gland. J Vet Diagn Investig. (2017) 29:115–21. DOI: 10.1177/1040638716676292
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. García-Alonso, M, Blanco, A, Reina, D, Serrano, FJ, Alonso, C, y Nieto, CG. Inmunopatología de la uveítis en la leishmaniasis canina. Parásito Immunol. (1996) 18:617–23. doi: 10.1046/j.1365-3024.1996.d01-39.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. El Goulli, AF, Zribi, L, Sanhaji, R, Chabchoub, A, Bouratbine, A, Gharbi, M, et al. Estudio de manifestaciones oculares y respuesta inmune humoral en ojos de perros con leishmaniasis. Vet Med Sci. (2023) 9:625–37. DOI: 10.1002/VMS3.982
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Fehn, M, Sommer, C, Lüdecke, DK, Plockinger, U, y Saeger, W. Lymphocytic hypophysitis: light and electron microscopic findings and correlation to clinical appearance. Endocr Pathol. (1998) 9:71–8. DOI: 10.1007/BF02739954
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Milligan, SA, Katz, MS, Craven, PC, Strandberg, DA, Russell, IJ, y Becker, RA. Toxoplasmosis que se presenta como panhipopituitarismo en un paciente con el síndrome de inmunodeficiencia adquirida. Am J Med. (1984) 77:760–4. doi: 10.1016/0002-9343(84)90381-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Gubbi, S, Hannah-Shmouni, F, Verbalis, JG, y Koch, CA. Hypophysitis: an update on the novel forms, diagnosis and management of disorders of pituitary inflammation. Mejor Pract Res Clin Endocrinol Metab. (2019) 33:101371. doi: 10.1016/j.beem.2019.101371
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Pang, XP, Hershman, JM, Mirell, CJ y Pekary, AE. Deterioro de la función hipotalámica-pituitaria-tiroidea en ratas tratadas con factor de necrosis tumoral recombinante humano α (caquectina). Endocrinología. (1989) 125:76–84. DOI: 10.1210/endo-125-1-76
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: glándula pituitaria, inflamación, linfocito T, Leishmania infantum, inmunohistoquímica
Cita: Frigerio ED, Guizelini CdC, Jussiani GG, Março KS, de Melo GD, Watanabe TTN y Machado GF (2023) Hipofisitis linfocítica en perros infectados con Leishmania spp. 10:1208919. doi: 10.3389/fvets.2023.1208919
Recibido: 19 de abril de 2023; Aprobado: 31 de agosto de 2023;
Publicado: 14 septiembre 2023.
Editado por:
Gustavo A. Ramírez Rivero, Universitat de Lleida, España
Revisado por:
Marco Rosati, AstraZeneca, Reino Unido
Victor Alejandro Castillo, Universidad de Buenos Aires, Argentina
Copyright © 2023 Frigerio, Guizelini, Jussiani, Março, de Melo, Watanabe y Machado. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Gisele Fabrino Machado, gisele.fabrino@unesp.br
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

