Hormona antimülleriana como marcador diagnóstico de la degeneración testicular en perros
 Florin Petrișor Posastiuc1,2
Florin Petrișor Posastiuc1,2 Guilherme Rizzoto1
Guilherme Rizzoto1 Nicolae Tiberiu Constantin2*
Nicolae Tiberiu Constantin2* George Nicolae3
George Nicolae3 Koen Chiers4
Koen Chiers4 Alexandru Ilie Diaconescu2
Alexandru Ilie Diaconescu2 Andreea Iren Șerban5,6
Andreea Iren Șerban5,6 Ann Van Soom1
Ann Van Soom1 Mario arío Codreanu2
Mario arío Codreanu2- 1Departamento de Medicina Interna, Medicina de la Reproducción y de la Población, Facultad de Medicina Veterinaria, Universidad de Gante, Merelbeke, Bélgica
- número arábigoDepartamento de Ciencias Clínicas II, Facultad de Medicina Veterinaria, Universidad de Ciencias Agronómicas y Medicina Veterinaria de Bucarest, Bucarest, Rumania
- 3Departamento de Ciencias Paraclínicas, Facultad de Medicina Veterinaria, Universidad de Ciencias Agronómicas y Medicina Veterinaria de Bucarest, Bucarest, Rumania
- 4Departamento de Patobiología, Farmacología y Medicina Zoológica, Facultad de Medicina Veterinaria, Universidad de Gante, Merelbeke, Bélgica
- 5Departamento de Ciencias Preclínicas, Facultad de Medicina Veterinaria, Universidad de Ciencias Agronómicas y Medicina Veterinaria de Bucarest, Bucarest, Rumania
- 6Departamento de Bioquímica y Biología Molecular, Facultad de Biología, Universidad de Bucarest, Bucarest, Rumania
Introducción: La creciente prevalencia de infertilidad en perros machos en la práctica clínica refleja las tendencias actuales observadas en la medicina humana. La infertilidad adquirida es notablemente más común en los perros en comparación con las causas congénitas, con afecciones como la degeneración testicular que conducen a la pérdida irreversible de la fertilidad. Los métodos diagnósticos actuales para la degeneración testicular, como los exámenes histopatológicos y citológicos, se basan en la biopsia testicular o la aspiración con aguja fina, lo que los hace menos factibles para su uso rutinario. La hormona antimülleriana (AMH), producida por las células de Sertoli, ha surgido como un posible biomarcador alternativo para la salud testicular, que puede medirse en suero. Este estudio evalúa la AMH como un marcador potencial para la degeneración testicular, utilizando perros criptorquídeas como modelos para la fertilidad deteriorada y la histología testicular alterada.
Métodos: Se investigó la relación entre los niveles séricos de AMH y la expresión tisular de AMH con la alteración de la espermatogénesis y la alteración de la histología. Se determinaron los niveles séricos de AMH en individuos intactos, criptorquídicos y castrados utilizando un kit de ELISA inmunoenzimático y se compararon entre subgrupos en función de la ubicación testicular. La inmunoexpresión tisular de AMH se cuantificó diferencialmente en dos regiones de interés (ROIs), el espacio intersticial y el túbulo seminífero, tanto en gónadas descendidas como retenidas. Además, los testículos se analizaron mediante análisis histomorfométrico en túbulos seminíferos, mientras que la espermatogénesis se evaluó mediante la puntuación de Johnsen.
Resultados: Los niveles séricos de AMH se correlacionaron positivamente con la expresión de AMH evaluada tanto en el espacio intersticial (ρ = 0,494, p ≤ 0,01) como en los túbulos seminíferos (ρ = 0,610, p ≤ 0,001). Por el contrario, los niveles séricos de AMH mostraron una correlación negativa con el área del túbulo seminífero (ρ = −0,435, p ≤ 0,05). Las áreas de túbulos seminíferos más pequeñas se relacionaron con una mayor reactividad de AMH tanto en los túbulos seminíferos (ρ = −0,774, p ≤ 0,001) como en el espacio intersticial (ρ = −0,725, p ≤ 0,001). Además, las puntuaciones más bajas de Johnsen se asociaron con niveles séricos de AMH más altos (ρ = -0,537, p ≤ 0,01) y una expresión más alta de AMH tanto en los túbulos seminíferos (ρ = -0,756, p ≤ 0,001) como en el espacio intersticial (ρ = -0,679, p ≤ 0,001).
Discusión: Nuestros resultados sugieren que los niveles séricos más altos y la expresión tisular de AMH están relacionados con túbulos seminíferos más pequeños y puntuaciones de Johnsen más bajas, lo que refleja cambios degenerativos y disfunción de las células de Sertoli en los testículos retenidos. Dadas las similitudes en los mecanismos que aumentan los niveles de AMH en testículos afectados por la degeneración testicular, tanto en criptorquídea como en testículos no criptorquídeos, este estudio recomienda utilizar la AMH como marcador para el diagnóstico de la degeneración testicular en perros.
1 Introducción
La infertilidad en los perros machos se define como la incapacidad de aparearse o la incapacidad de fertilizar múltiples perras fértiles a pesar del momento óptimo de reproducción (1). Este tema es cada vez más importante en la práctica clínica, reflejando las tendencias observadas en la medicina humana (2, 3). En consecuencia, hay un enfoque creciente en el desarrollo de predictores objetivos para la fertilidad y la salud testicular en perros machos. Estos avances podrían facilitar la detección temprana de la disminución de la fecundidad, lo que permitiría una intervención oportuna. La infertilidad en perros machos se describe como congénita o adquirida, siendo esta última la causa más frecuentemente observada de fracaso reproductivo (4). La infertilidad adquirida, ligada a factores como alteraciones hormonales, enfermedades infecciosas, estrés, hipertermia, deficiencias nutricionales, toxinas y trastornos autoinmunes (5, 6), se ha atribuido notablemente a la degeneración testicular en perros, con una prevalencia reportada de hasta el 57,6% (1, 3, 7). Cuando algunos de estos factores entran en juego, pueden causar alteraciones significativas en la estructura testicular, lo que puede llevar a consecuencias irreversibles para la fertilidad. La degeneración testicular impacta directamente en la calidad del eyaculado, alterando progresivamente tanto la morfología de los espermatozoides como los parámetros de motilidad (8). Por lo tanto, los enfoques clínicos actuales implican evaluar la función reproductiva de los perros machos a través de análisis secuenciales de esperma. Cuando se detecta una disminución de la fertilidad y se inicia el tratamiento, se suele recomendar la reevaluación de la eyaculación después de un ciclo espermatogénico completo. Sin embargo, la espermatogénesis en perros dura aproximadamente 62 días, con 14 días adicionales para el tránsito del epidídimo (9). Dada la larga duración de este proceso, esperar a que la producción de espermatozoides mejore puede no ser efectivo. Los problemas durante este período pueden conducir a un cese completo de la espermatogénesis (10). Por lo tanto, la intervención oportuna es crucial para evitar perder oportunidades de tratamiento. Se pueden lograr evaluaciones más objetivas de la salud testicular a través de técnicas diagnósticas como exámenes histopatológicos y citológicos, después de biopsias testiculares y aspiraciones con aguja fina, respectivamente (11). Sin embargo, debido a su naturaleza invasiva y a las posibles complicaciones, ambos métodos rara vez se emplean.
Como alternativa, la determinación de la concentración de hormona antimülleriana (AMH) en suero o plasma se ha convertido recientemente en una herramienta prometedora para la evaluación de la función y la integridad testicular. La investigación realizada en ratones ha demostrado que la AMH es un biomarcador fiable para detectar el daño testicular secundario a la quimioterapia agresiva (12, 13). Del mismo modo, se ha recomendado la monitorización de los niveles séricos de AMH como un método útil para la detección precoz de la degeneración testicular causada por lesiones tóxicas en sementales (14). La AMH es una glicoproteína producida por las células de Sertoli (15, 16). Por lo tanto, los niveles de AMH deben relacionarse con la funcionalidad de las células de Sertoli, ya que se analizó en toros con degeneración testicular inducida por el calor (17). En perros, los resultados sugieren que la secreción de AMH aumenta no solo en las células de Sertoli inmaduras o tumorales, sino también en las células de Sertoli degenerativas (18). Además, la degeneración de las células de Sertoli puede conducir a una disminución de la producción espermatogénica, que también se caracteriza por un aumento de la producción de AMH (19). Otro estudio sugirió que las concentraciones séricas más altas de AMH se correlacionaron con un menor porcentaje de espermatozoides morfológicamente normales (20).
La criptorquidia se caracteriza por la imposibilidad de que uno o ambos testículos desciendan al escroto (21). Esta condición hace que los testículos estén expuestos a un ambiente térmico diferente en comparación con su ubicación escrotal normal (8), lo que puede conducir a cambios estructurales y funcionales (22-24) similares a los observados en individuos no criptorquídeos que experimentan degeneración testicular y posteriores caídas de la fertilidad (3).
En este estudio, se utilizaron perros criptorquídeos como modelos para la fertilidad alterada y la histología testicular alterada. El objetivo fue evaluar el potencial de la AMH como marcador de degeneración testicular y alteración de la espermatogénesis. Para lograr esto, investigamos los niveles séricos de AMH en perros criptorquídeos, intactos y castrados, y analizamos la expresión de AMH tanto en testículos retenidos como en gónadas descendidas. Finalmente, examinamos la relación entre los niveles de AMH, la histología testicular alterada y la espermatogénesis alterada.
2 Materiales y métodos
2.1 Recogida de muestras
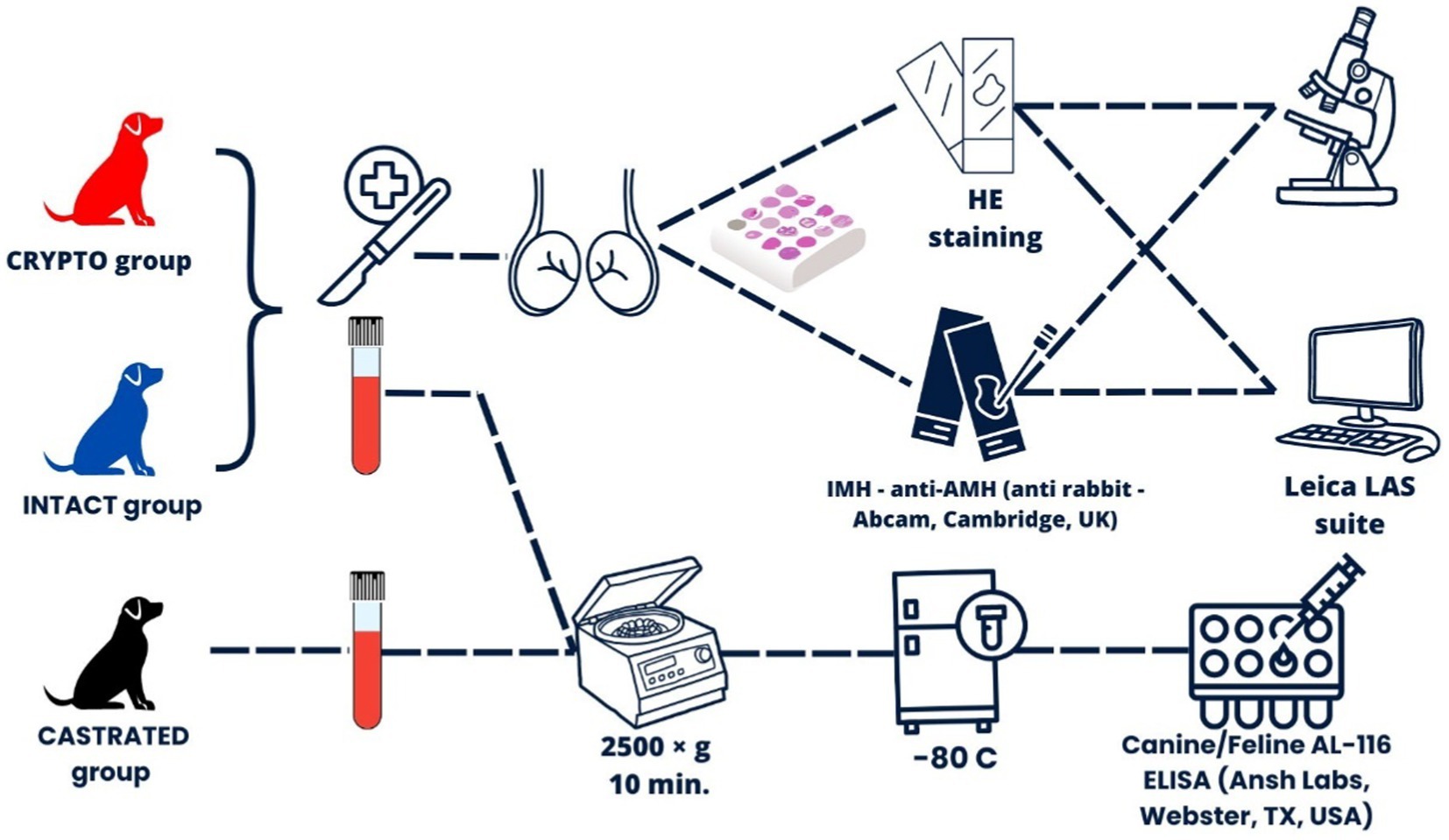
Un total de 50 perros machos de diversas edades y razas fueron reclutados para el estudio. Veinte perros con al menos un testículo retenido fueron clasificados en el grupo CRYPTO. Otros 20 varones intactos con ambos testículos localizados dentro del escroto fueron asignados al grupo INTACT. Además, se incluyeron 10 perros gonadectomizados bilateralmente como controles negativos, formando el grupo CASTRADO. Todos los perros se sometieron a un examen clínico y no se observaron preocupaciones con respecto a su salud general o reproductiva. Los pacientes con criptorquídeas fueron sometidos a exámenes ecográficos para confirmar la posición del testículo retenido antes de cualquier intervención quirúrgica propuesta.
La composición de los tres grupos en términos de edad, raza, estado de criptorquídea unilateral o bilateral y la ubicación del testículo retenido se detalla en la Tabla Suplementaria 1.
Se recogieron muestras de sangre de todos los perros que participaron en el estudio serológico. Las muestras se extrajeron de la vena cefálica y se almacenaron en tubos de recolección lisos de tapa roja sin aditivos (BD Vacutainer, Plymouth, Reino Unido). En el caso de los perros CRYPTO e INTACT, se tomaron muestras antes de someterse a la orquiectomía, y en el caso de los perros del grupo CASTRADO, las muestras se recogieron al menos 6 meses después de la castración. Después de dejar que la sangre coagulara durante 5 minutos a temperatura ambiente, las muestras se centrifugaron a 2.500×g durante 10 minutos. A continuación, el suero resultante se almacenó a -80 °C hasta su posterior procesamiento.
Diez perros de cada uno de los grupos CRYPTO e INTACT se sometieron a gonadectomía con el consentimiento del propietario. Ambas gónadas se fijaron en formol tamponado neutro al 10% y posteriormente se incrustaron en bloques de parafina. En el caso de las criptorquidas unilaterales, la gónada descendida contralateral estaba disponible para su análisis, con una excepción. Una criptorquídea unilateral solo tenía disponible el testículo retenido, ya que el escrotal había sido extirpado previamente mediante cirugía.
Todos los protocolos de muestreo fueron revisados y aprobados por el Comité de Ética de la Facultad de Medicina Veterinaria de Bucarest (Número de aprobación: EA n.º 34-03/2024).
2.2 Evaluación de los niveles séricos de AMH
Los niveles séricos de AMH se cuantificaron utilizando un kit de inmunoensayo validado de tres pasos tipo sándwich (Canine/Feline AL-116 ELISA, Ansh Labs, Webster, TX, USA), que se ha utilizado previamente en estudios con perros (25, 26). Cada pocillo recubierto de la microplaca se trató inicialmente con 75 μL de tampón de ensayo AMH canino, de acuerdo con las recomendaciones del fabricante. Posteriormente, después de añadir un volumen de 25 μL de calibradores, controles y muestras de suero, la placa se sometió a una incubación de 60 minutos a temperatura ambiente en un agitador de microplacas orbitales a 600 rpm. Después de la incubación, los pocillos se lavaron a fondo y se añadieron 100 μL de conjugado anticuerpo-biotina a cada pocillo, seguido de otra incubación en las mismas condiciones según el protocolo del fabricante. Después de pasos de lavado adicionales, los pocillos se trataron con la enzima conjugada Estreptavidina-HRP durante 30 min. La reacción se desarrolló con una incubación de 10 minutos utilizando 100 μL de solución de cromógeno TMB y se detuvo con 100 μL de solución de parada. La absorbancia de la placa se leyó a 450 nm, con corrección de la longitud de onda de fondo a 630 nm, utilizando un lector de microplacas de absorbancia PR 4100 (Bio-Rad Laboratories, Hercules, CA, USA). El coeficiente de variación intraensayo fue inferior al 10%. Dado que todas las muestras se procesaron simultáneamente en un solo lote, no se calculó ningún coeficiente de variación entre ensayos. El límite de detección del kit fue de 0,015 ng/mL.
2.3 Preparación de muestras de tejido
Los bloques de parafina previamente almacenados se seccionaron repetidamente a 4 μm para crear dos lotes diferentes. El primero se tiñó con hematoxilina y eosina (HE) y se dirigió a evaluación microscópica convencional, seguido de análisis histomorfométrico y evaluación de espermatogénesis. El segundo lote se reservó para la evaluación inmunohistoquímica.
Se analizaron secciones aleatorias de ambas gónadas descendidas (DES) del grupo INTACT. También se analizaron todos los testículos retenidos (RET) de los individuos criptorquídeos admitidos. Cuando estaba disponible, se evaluó el testículo contralateral (CONTRA) de las criptorquidas unilaterales. En la Tabla 1 se presenta una descripción detallada de la disponibilidad de muestras para las evaluaciones histológicas e inmunohistoquímicas.
2.3.1 Tinción inmunohistoquímica
Las secciones de tejido dedicadas se montaron en portaobjetos recubiertos de 3-aminopropiltrietoxisilano. Estos portaobjetos se sometieron a desparafinación con xileno, seguida de rehidratación en concentraciones decrecientes de etanol (100, 96, 50%) y 100% deH2O. Para la recuperación de antígenos, los portaobjetos se colocaron en una caja llena de agua destilada y tampón de citrato (pH 6.0), que luego se colocó dentro de una olla a presión que contenía 600 mL de agua destilada. El sistema (cocina + correderas) se calentó en el microondas a 850 W durante 12 min y luego a 300 W durante 10 min. Después de la recuperación, la caja que contenía los portaobjetos se enfrió a temperatura ambiente durante 20 minutos.
Después de un lavado de 5 minutos con PBS, se añadieron 200 μL de H2O2 a cada sección durante 5 min. A continuación, los portaobjetos se lavaron dos veces con PBS. El anticuerpo primario utilizado fue anti-AMH C-terminal (anti-conejo, Abcam, Cambridge, Reino Unido) en una dilución de 1:400 (diluyente de anticuerpos con reducción de fondo, DAKO Agilent – S3022832, Santa Clara, CA, EE. UU.). Los portaobjetos se incubaron con el anticuerpo primario diluido durante 30 minutos, se lavaron dos veces con PBS y luego se expusieron a 200 μL/portaobjetos de conejo Envision Link (DAKO Agilent – K400311-2) durante 30 minutos.
Después de esta incubación, los portaobjetos se lavaron dos veces en PBS durante 5 min y luego se trataron con 200 μL/portaobjetos de solución de 3,3-diaminobenzidina (DAB, DAKO Agilent – K346811-2) para una incubación final de 30 min. Finalmente, los portaobjetos se lavaron nuevamente en PBS durante 5 minutos, se contratiñeron con hematoxilina, se deshidrataron, se montaron con cubreobjetos y se almacenaron para su posterior análisis.
2.4 Análisis de muestras de tejido
Los portaobjetos fueron evaluados de forma ciega, por un operario capacitado, utilizando un microscopio Leica DM5500 B (Leica Microsystems CMS GmbH, Wetzlar, Alemania). La adquisición adicional de imágenes, el procesamiento digital y el análisis de píxeles se realizaron utilizando Leica Application Suite (LAS versión 4.13, Wetzlar, Alemania).
2.4.1 Histología general, espermatogénesis y evaluación histomorfométrica
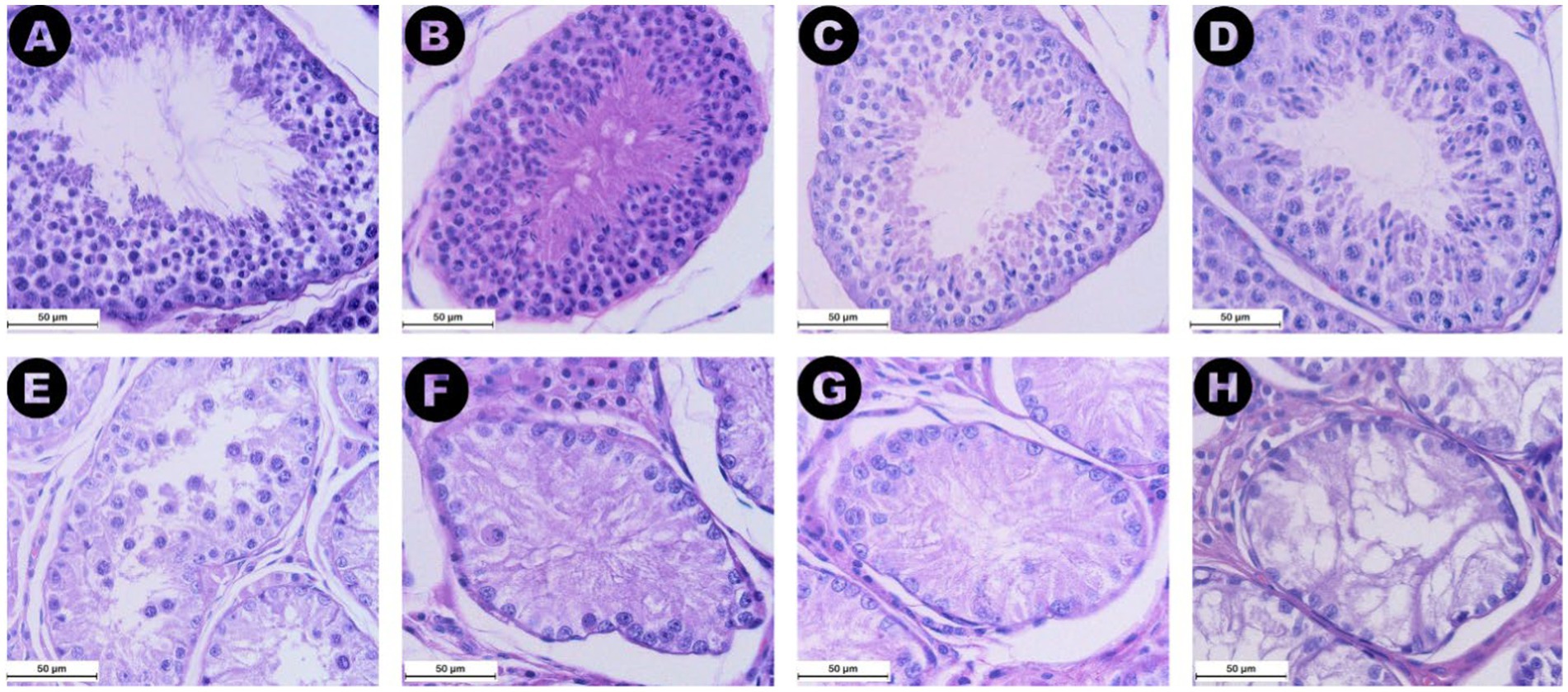
Utilizando los portaobjetos teñidos con HE, se analizaron 20 secciones de túbulos seminíferos y el compartimento intersticial vecino por muestra. Se evaluaron los rasgos histológicos generales específicos de la degeneración testicular, como la reducción del diámetro de los túbulos seminíferos, la disminución del número de células germinales y la fibrosis intersticial (27). Para la evaluación de la espermatogénesis, se evaluó la presencia de diferentes tipos de células dentro de los túbulos seminíferos: espermatogonias, espermatocitos, espermátidos, espermatozoides y células de Sertoli. A partir de esta evaluación, se asignó una puntuación del 1 al 10 a cada una de las 20 secciones, siguiendo los criterios de la escala de Johnsen adaptada para su uso en perros (28).
Además, se determinó el área de los túbulos seminíferos mediante una metodología similar a la utilizada anteriormente en los sementales (29). Específicamente, se visualizaron cinco túbulos redondos o casi redondos de las 20 secciones examinadas anteriormente con un aumento del 400× y se midieron en sus ejes mayor y menor. El área de los túbulos seminíferos se calculó mediante la fórmula:
2.4.2 Cuantificación de la expresión tisular de AMH
La cuantificación de la inmunotinción se realizó mediante análisis de píxeles en cinco imágenes diferentes obtenidas aleatoriamente por muestra, empleando una corrección de color estandarizada a través del balance de blancos y un umbral estandarizado. Los resultados se expresaron como porcentajes de áreas reactivas en relación con la superficie total de dos Regiones de Interés (ROI) predefinidas. Las ROI se definieron de la siguiente manera: ROI1: el túbulo seminífero, incluyendo toda el área intratubular; y ROI2: el espacio intersticial entre un mínimo de dos túbulos vecinos. Para ambos ROI, el área se determinó mediante el seguimiento de márgenes predefinidos y el uso de la herramienta de medición automatizada específica del software LAS.
2.5 Análisis estadístico
Los datos fueron procesados y sometidos a análisis estadístico utilizando el programa IBM SPSS versión 18.0 para Windows (IBM Corp., Armonk, NY, USA). La normalidad de las variables se evaluó mediante la prueba de Shapiro-Wilk, con un nivel de significancia de α = 0,05. Los resultados se presentaron como mediana y rango intercuartílico (RIC), identificándose y eliminando los valores atípicos con base en el método de RIC. Para las comparaciones entre múltiples grupos, se aplicó la prueba de Kruskal-Wallis para determinar las diferencias en la distribución de datos distribuidos no normalmente, seguida de comparaciones por pares con valores de significación ajustados mediante la corrección de Bonferroni. Para los datos pareados sin variables de agrupación, las diferencias se evaluaron mediante la prueba de rangos con signo de Wilcoxon. Se empleó el coeficiente de correlación de rangos de Spearman para investigar las posibles asociaciones dentro del conjunto de datos. La significación estadística se determinó considerando valores de p menores a 0,05. Se calculó la relación entre las variables edad y AMH en todos los individuos incluidos en el estudio serológico y con la exclusión de los sujetos castrados. Posteriormente, el resto de los individuos también se dividieron en jóvenes (rango de edad de 0 a 24 meses) y adultos (≥25 meses).
El diseño experimental se ilustra en la Figura 1.
3 Resultados
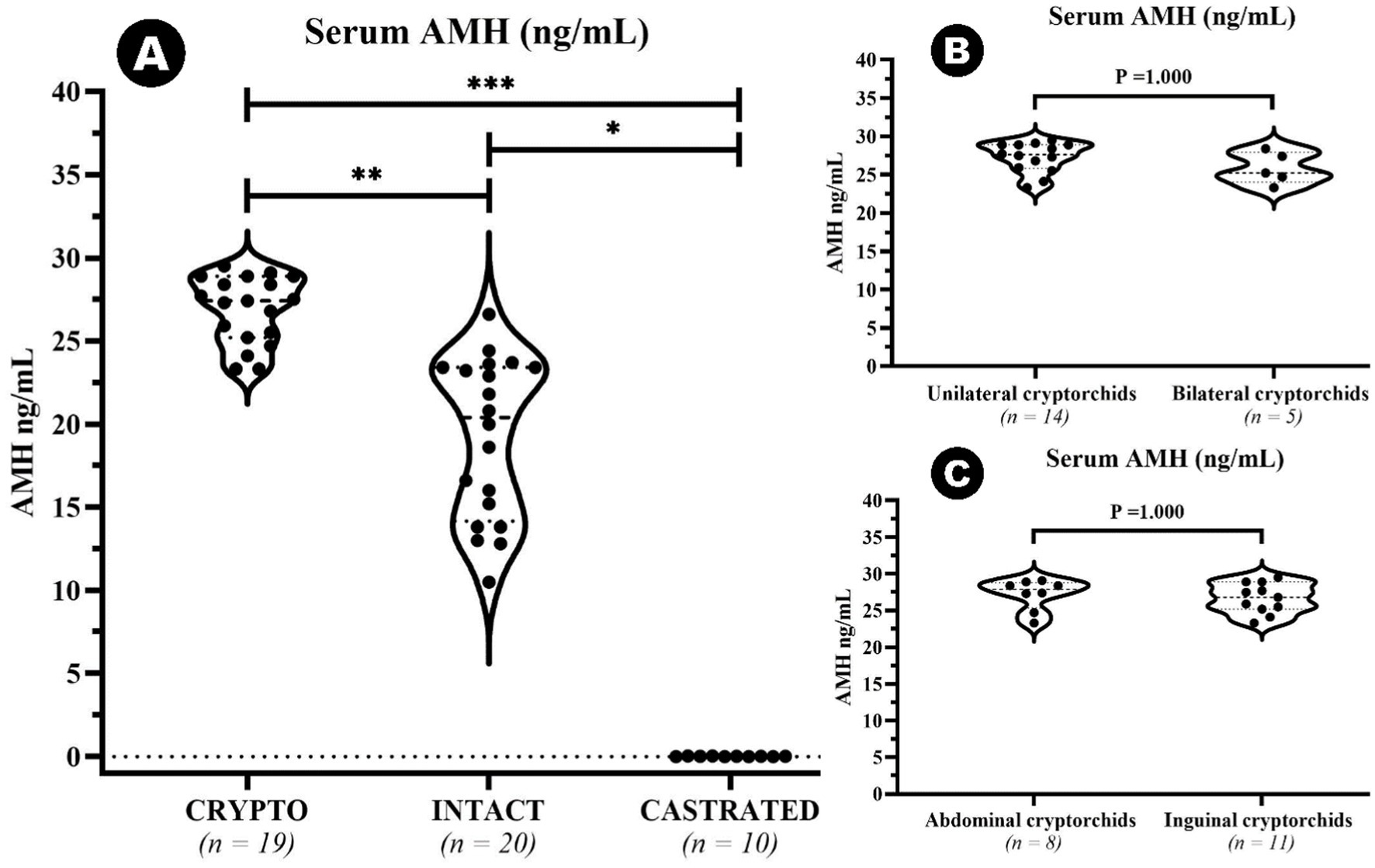
3.1 Niveles séricos de AMH y edad
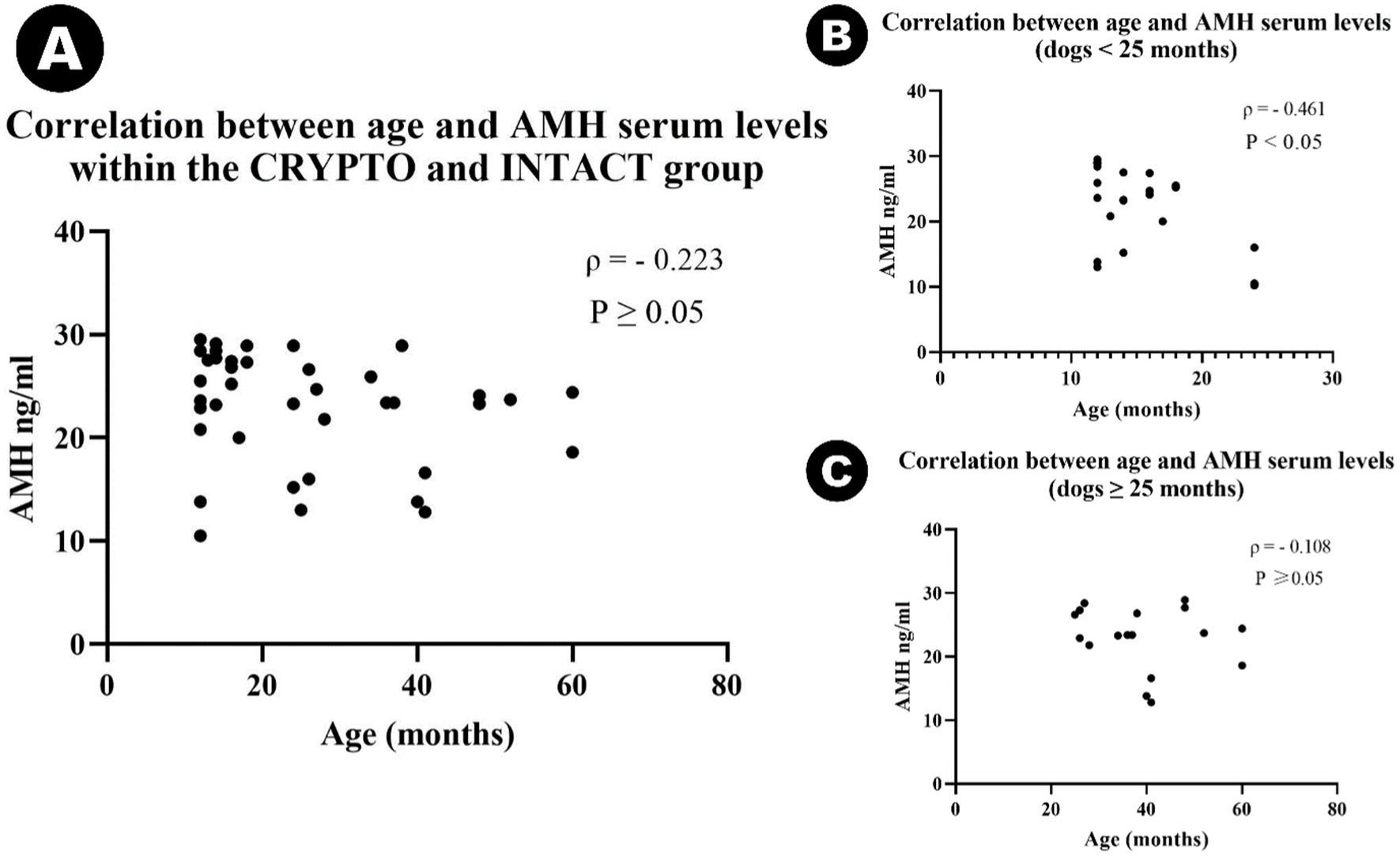
Se identificó un valor atípico en el grupo CRYPTO secundario a los cálculos de IQR. El valor de 10 ng/mL cayó por debajo del límite inferior (15,65 ng/mL) y, por lo tanto, se excluyó del análisis posterior. El resto de los datos sobre los niveles séricos de AMH mostraron diferencias significativas entre grupos específicos (Figura 2). El grupo CRYPTO tuvo niveles significativamente más altos de AMH (n = 19; mediana 27,4 ng/mL, IQR = 3,7) en comparación con los grupos INTACT (n = 20; mediana 20,4, IQR 9,25, p ≤ 0,01) y CASTRADOS (n = 10; 0,01 ± 0,01 ng/mL, p ≤ 0,001) (Figura 2A). Los sujetos del grupo CASTRATED (n = 20) mostraron solo valores séricos de AMH por debajo del límite de detección descrito del kit, lo que también provocó una diferencia significativa en comparación con los niveles séricos de AMH INTACT. Sin embargo, no se detectaron diferencias significativas entre las criptorquídeas unilaterales y bilaterales (p = 1.000) (Figura 2B), ni entre las criptorquídeas abdominales e inguinales (p = 1.000) (Figura 2C). Después de excluir el valor atípico en los valores de AMH, la mediana de edad en todos los grupos fue de 24 meses (n = 49, IQR = 27). No se observaron diferencias estadísticamente significativas en la distribución por edades entre los grupos CRYPTO, CASTRAED e INTACT p ≥ 0,05. En particular, se detectó una correlación negativa entre la edad y los niveles de AMH en todos los grupos (ρ = −0,415, p ≤ 0,01). Sin embargo, al calcular el análisis excluyendo a los individuos castrados, que suelen tener niveles bajos de AMH independientemente de la edad, la correlación entre la edad y los valores de AMH siguió siendo negativa (ρ = −0,223) pero ya no fue estadísticamente significativa (p ≥ 0,05) (Figura 3A). Además, cuando se investigó la relación entre la edad y los niveles séricos de AMH dentro de los grupos de edad separados, se identificó una correlación negativa entre las dos variables en perros menores de 24 meses (ρ = −0,461, p < 0,05) (Figura 3B). Por el contrario, esta correlación no fue significativa en la categoría de adultos (≥25 meses) (ρ = −0,108, p ≥ 0,05) (Figura 3C).
3.2 Análisis de tejidos
3.2.1 Histología general
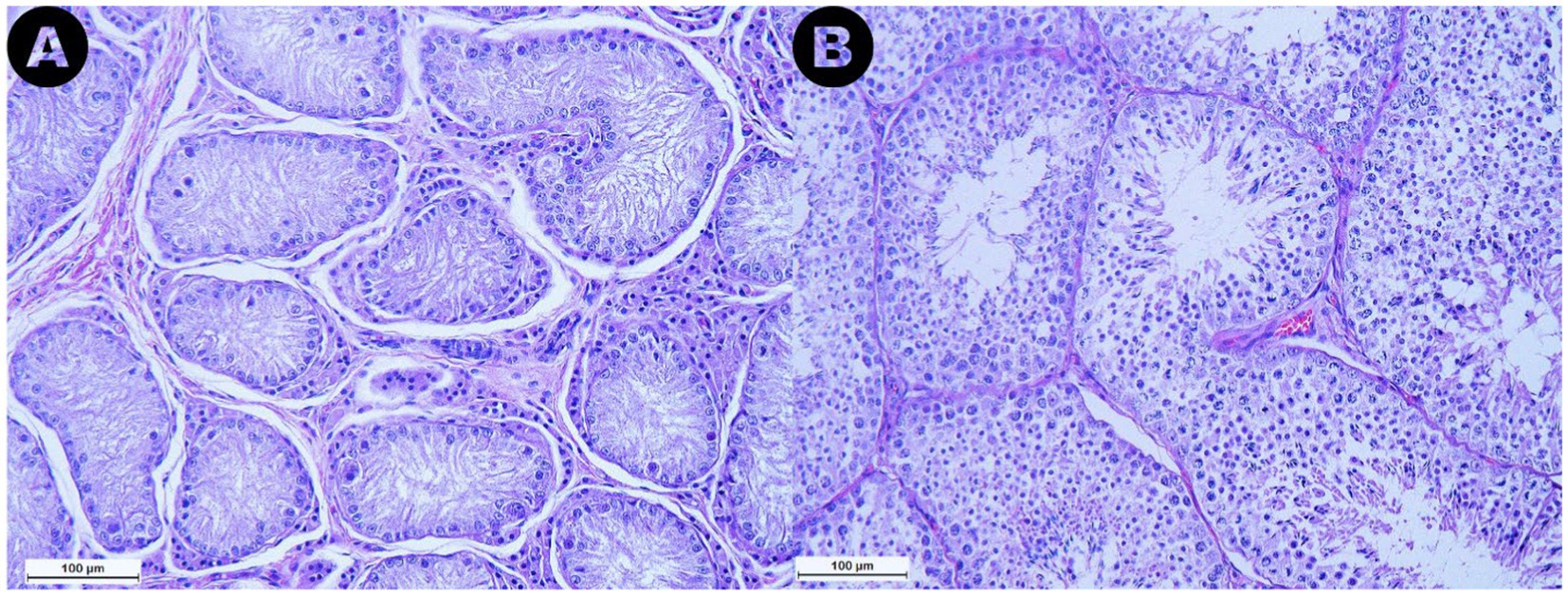
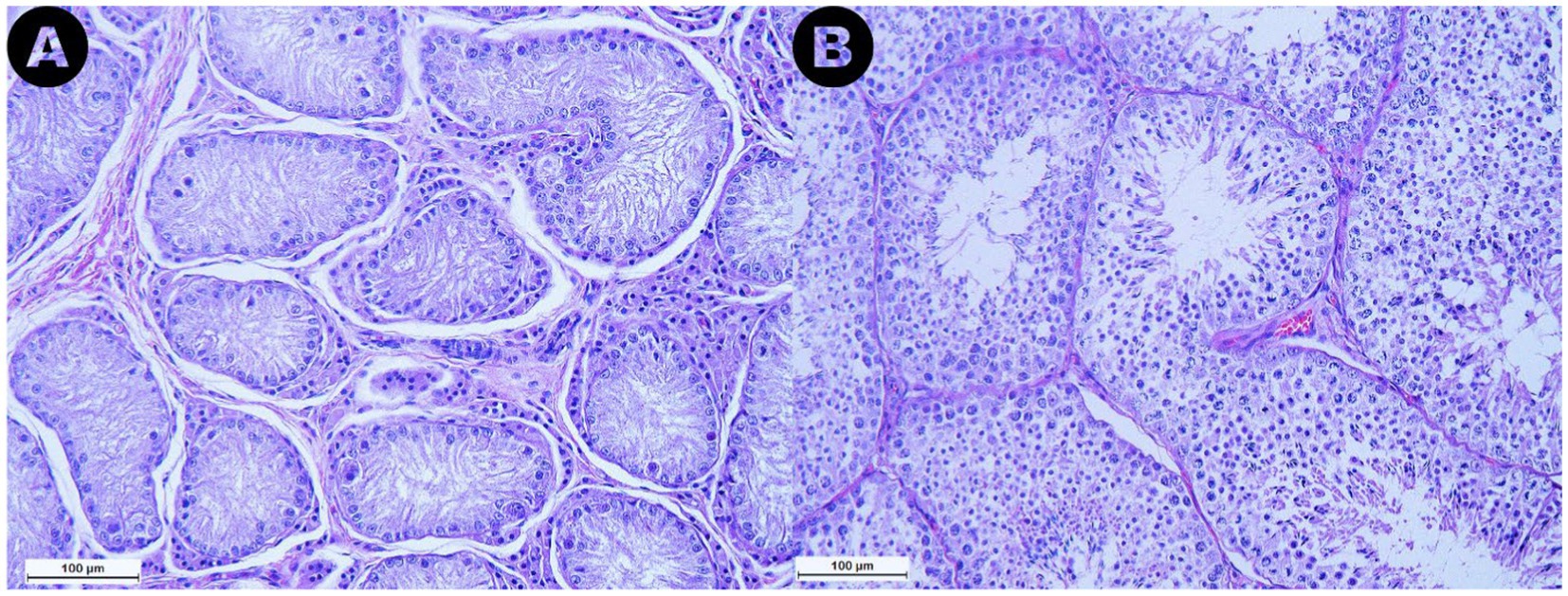
Las muestras analizadas de la categoría RET exhibieron túbulos seminíferos con pocas células germinales, con el 76,7% de las secciones de túbulos evaluadas clasificadas como túbulos solo de células de Sertoli. Además, se observó una marcada reducción o ausencia de la luz (Figura 4A). Además, se evidenció la degeneración seminífero de los túbulos, caracterizada por una pérdida general de los detalles celulares. La membrana basal que rodea los túbulos parecía engrosada en comparación con las muestras de los grupos CONTRA y DES. Además, en el espacio intersticial de los testículos RET, se observó subjetivamente un aumento en el número de células de Leydig, acompañado de una mayor cantidad de tejido conectivo (Figura 4A), en comparación con las muestras de DES (Figura 4B).
3.2.2 Zonas de túbulos seminíferos
Se encontraron áreas de túbulos significativamente más bajas en el grupo RET (mediana 13.027,40 μm2, IQR = 3.764,41) en comparación con el CONTRA (mediana 31.908,82 μm2, IQR = 7.061,17, p ≤ 0,05) y DES (mediana 38.339,93 μm2, IQR = 9.898,29, p ≤ 0,001) (Figura 5A). Sin embargo, no hubo diferencia significativa en las áreas de los túbulos seminíferos entre los testículos CONTRA y DES (p = 1.000) (Figura 5A), ni cuando se comparó la distribución de los valores entre las gónadas retenidas inguinalmente y las localizadas abdominalmente (p = 1.000). Curiosamente, los valores séricos más bajos de AMH fueron específicos de las áreas de túbulos seminíferos más altos (ρ = −0,435, p ≤ 0,05).

3.2.3 Puntuación de Johnsen
Todos los valores de la puntuación de la escala de Johnsen se han asignado a las secciones de las tres categorías, excepto las puntuaciones 1 y 6 (Figura 6). La puntuación de Johnsen para la categoría RET (mediana 2, IQR = 0,5) fue significativamente menor que la de los grupos CONTRA (mediana 9,2, IQR = 0,8, p ≤ 0,05) y DES (mediana 9,7, IQR = 0,4, p ≤ 0,001) (Figura 5B). Además, las puntuaciones más altas se asociaron con niveles séricos de AMH más bajos (ρ = −0,537, p ≤ 0,01) y túbulos seminíferos más grandes (ρ = 0,828, p ≤ 0,001). Al igual que en las áreas de túbulos seminíferos, la comparación entre la distribución de las puntuaciones de Johnsen asignadas a las gónadas inguinales y abdominales no mostró diferencias significativas (p = 1,000).
3.2.4 Cuantificación de la expresión tisular de AMH
La expresión de AMH se reveló como tinción marrón en ambos ROI (Figura 7). Se observó una mayor expresión de AMH en las células de Sertoli de los testículos retenidos, lo que resultó en niveles de expresión significativamente más altos en los túbulos seminíferos del grupo RET (mediana 32,42%, IQR = 15,11) en comparación con el grupo CONTRA (mediana 9,25%, IQR = 5,55, p ≤ 0,05) y el grupo DES (mediana 4,63%, IQR = 1,43, p ≤ 0,001). Sin embargo, la diferencia en la expresión de AMH entre los grupos CONTRA y DES no fue significativa (p = 0,444). La reactividad en el ROI del espacio intersticial fue menor que la expresión intratubular en todas las muestras (Z = −4,703, p < 0,001). Las comparaciones basadas en grupos mostraron que los valores de reactividad del espacio intersticial dentro de las muestras de DES (mediana 0,05%, IQR = 0,08) fueron más bajos en comparación con las muestras de RET (mediana 2,36%, IQR = 3,24, p ≤ 0,001), pero no difirieron significativamente de las muestras de CONTRA (mediana 0,12%, IQR = 0,15, p = 1,000). Además, los niveles de expresión de AMH intratubular e intersticial no variaron sustancialmente entre los testículos retenidos inguinalmente (p = 1.000) y las gónadas retenidas abdominalmente (p = 1.000).
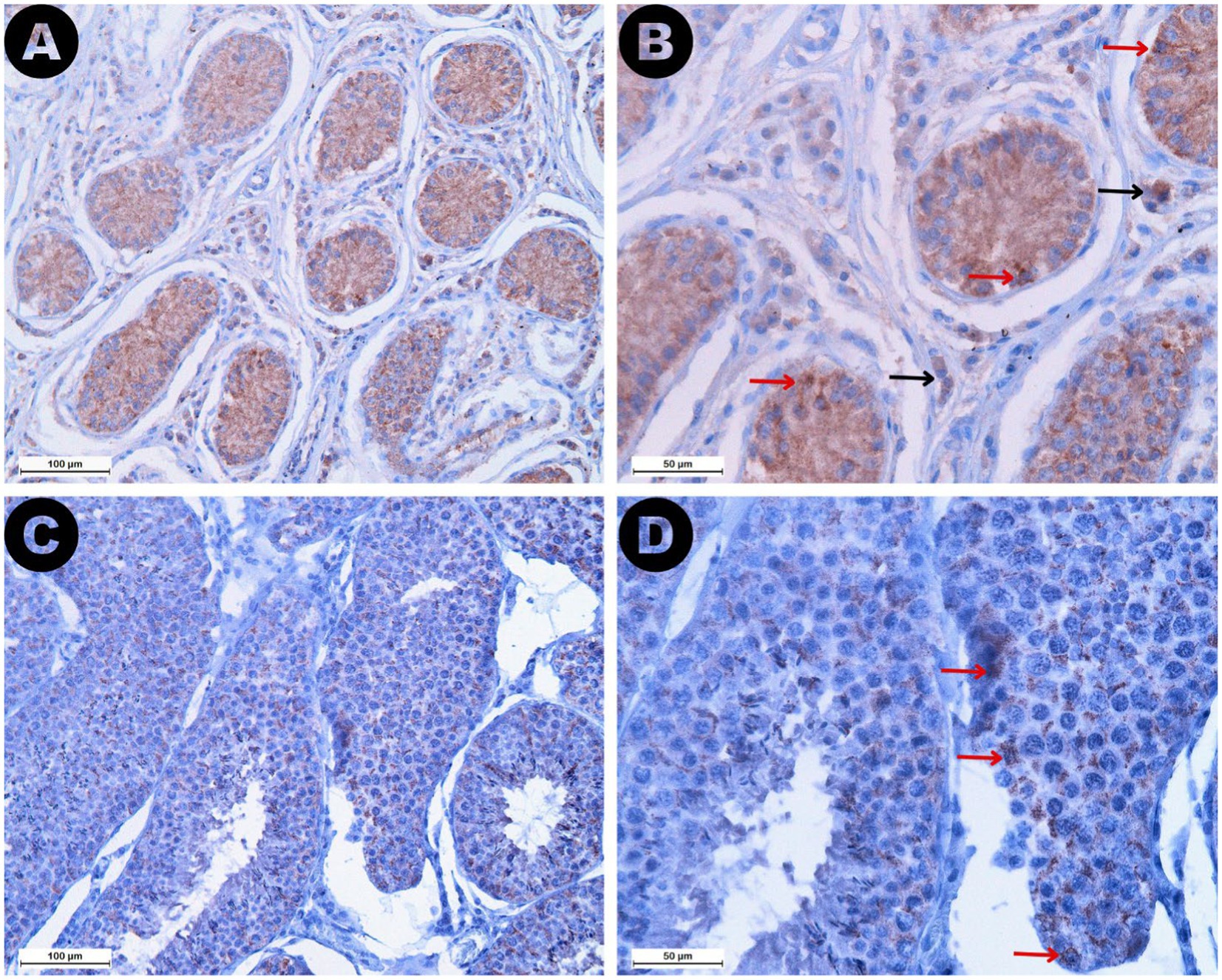
Curiosamente, los valores séricos de AMH se correlacionaron positivamente con la expresión de AMH tisular tanto en el espacio intersticial (ρ = 0,494, p ≤ 0,01) como en los túbulos seminíferos (ρ = 0,610, p ≤ 0,001). Por el contrario, los túbulos seminíferos más pequeños se asociaron con una mayor reactividad a la AMH en ambos ROI (túbulo seminífero: ρ = −0,774, p ≤ 0,001; espacio intersticial: ρ = −0,725, p ≤ 0,001). Del mismo modo, las puntuaciones de Johnsen disminuyeron a medida que aumentaba la expresión de AMH tisular en los dos compartimentos analizados (túbulo seminífero: ρ = −0,756, p ≤ 0,001; espacio intersticial: ρ = −0,679, p ≤ 0,001). Todas las correlaciones entre las variables analizadas se presentan brevemente en la Tabla 2.
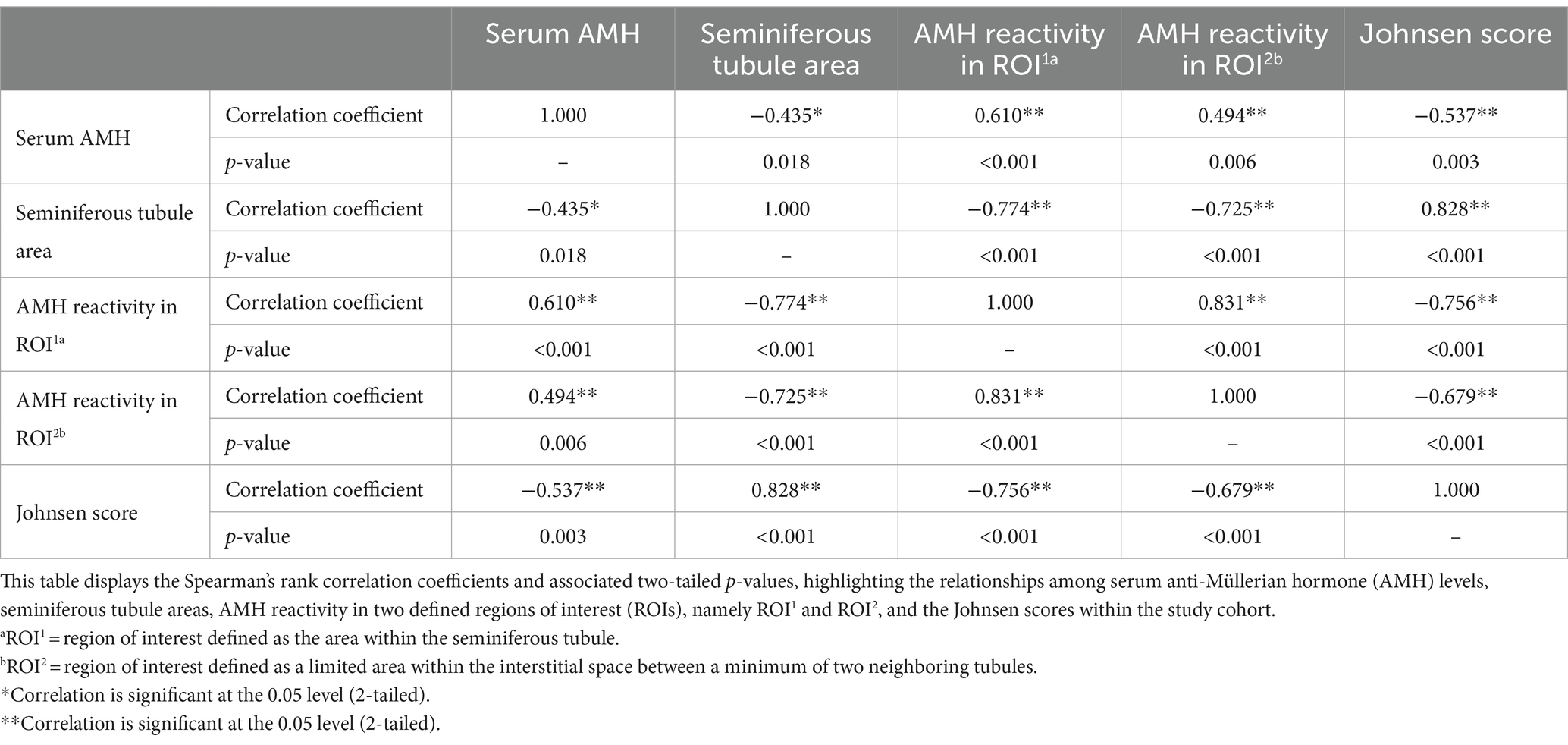
Tabla 2. Matriz de correlación de rangos de Spearman de las variables analizadas.
4 Discusión
En este estudio se evaluó el potencial de la AMH como biomarcador de la degeneración testicular y la alteración de la espermatogénesis. Se evaluaron los niveles séricos de AMH y la expresión tisular de AMH en relación con los hallazgos histológicos específicos de los procesos degenerativos y la detención espermatogénica identificados en perros criptorquídeos seleccionados.
Al igual que en otros estudios (26, 30), nuestros resultados demostraron la capacidad de la AMH sérica para identificar la presencia de tejido testicular funcional, como lo demuestran las diferencias significativas observadas entre los hombres castrados e intactos. Además, el ensayo logró diferenciar los individuos de criptorquídeas de aquellos con gónadas ubicadas en el escroto, lo que se alinea con estudios anteriores (30-32). Sin embargo, en nuestro estudio, no fue capaz de distinguir entre criptorquidia unilateral y bilateral ni determinar la localización del testículo retenido. Estos hallazgos sugieren que los niveles de AMH pueden estar más estrechamente relacionados con la intensidad de los procesos degenerativos que con el hecho de que una o ambas gónadas estén alteradas. Esto se apoya aún más en la observación de que, independientemente de la ubicación o del estado criptorquídeo bilateral o unilateral, los niveles de AMH fueron más altos en los individuos con túbulos seminíferos más pequeños y puntuaciones de Johnsen más bajas.
Múltiples estudios en humanos han demostrado consistentemente una correlación negativa entre la edad y los niveles séricos de AMH, lo que indica una disminución de AMH a medida que aumenta la edad (33, 34). Un estudio en particular también informó de la variabilidad en la tasa de este declive entre los individuos, que se atribuyó a las diferencias en la preservación de la producción de células de Sertoli durante el envejecimiento (34). En nuestro estudio, cuando se excluyeron del análisis los individuos castrados, esta correlación entre la edad y los niveles de AMH dejó de ser compatible. La relación entre estas variables fue evidente solo cuando los resultados se estratificaron por grupo de edad, lo que sugiere que esta asociación podría ser más relevante para los individuos más jóvenes. Sin embargo, debido al tamaño limitado de la muestra y a la desigual distribución por edades en el estudio, estos hallazgos deben interpretarse con precaución en las poblaciones caninas, ya que no establecen una tendencia definitiva.
Curiosamente, dos estudios en perros revelaron una correlación entre el aumento de los niveles de AMH y una disminución en la calidad del esperma (19, 20). Sin embargo, solo en uno de estos estudios se observó una relación entre la edad y los niveles de AMH (19). Esto indica que el envejecimiento por sí solo puede no explicar completamente las variaciones en los niveles de AMH, y que estos cambios podrían estar más estrechamente relacionados con alteraciones estructurales y funcionales en los testículos que ocurren secundarias al envejecimiento (28). No obstante, la relación entre la edad, la AMH y la degeneración testicular sigue sin estar clara, ya que ninguno de los estudios (19, 20) exploró la posible conexión entre los cambios degenerativos en los testículos y los niveles de AMH en el contexto de las evaluaciones de la calidad del esperma.
Ya se han descrito cambios estructurales degenerativos en los testículos de criptorquídeas caninos, incluida la reducción del tamaño del epitelio y los túbulos seminíferos junto con la degeneración celular que conduce a la espermatogénesis detenida (35, 36). Además, estas alteraciones se investigaron junto con los niveles de AMH en sementales criptorquídeos, revelando que los túbulos seminíferos más pequeños y las puntuaciones de Johnsen más bajas se asocian con niveles séricos de AMH más altos (29), similar a nuestros resultados. En los pacientes con criptorquídeas, estas alteraciones estructurales y funcionales se explican por los efectos del estrés térmico resultante del diferente régimen de temperatura al que se somete el testículo retenido. El estrés por calor puede ejercer sus efectos regulando a la baja proteínas de unión específicas, interfiriendo así con el proceso espermatogenético (37, 38). Además, las temperaturas elevadas pueden provocar estrés oxidativo, lo que en consecuencia resulta en la degeneración de las células germinales y puede afectar la función de las células de Sertoli (35, 39-41). El impacto del estrés térmico en las células de Sertoli también se ha demostrado en pacientes no criptorquídeos (17). Un estudio con toros sometidos a aislamiento escrotal reveló que la disfunción de las células de Sertoli inducida por el calor puede provocar alteraciones en los niveles de AMH, incluso en ausencia de un estado criptorquídea (17). Este efecto se explica por la capacidad del estrés térmico para inducir la reversión de las células de Sertoli a un fenotipo prepuberal inmaduro (42), similar a los testículos de criptorquídeas (43). De hecho, esta demaduración de las células de Sertoli se consideró la principal razón del aumento de la AMH sérica, mientras que otros factores fueron responsables de inducir la degeneración testicular aguda en los sementales (14). El mismo enfoque se adoptó en ratones y humanos expuestos a tratamientos gonadotóxicos (12). La administración de doxorrubicina y busulfán dio lugar a niveles séricos elevados de AMH, que se correlacionaron con una reducción significativa del tamaño de los túbulos seminíferos y una marcada pérdida de células germinales meióticas, incluidos espermatocitos, espermátidas y espermatozoides (12), en línea con nuestros hallazgos en criptorquidas.
De acuerdo con nuestros resultados, la expresión de AMH fue mayor en los túbulos seminíferos de los testículos retenidos en comparación con las gónadas descendidas, debido a que las células de Sertoli más reactivas de los testículos criptorquídeos fueron más reactivas. En otras palabras, la expresión tisular de AMH se intensificó en los túbulos comprimidos, mostrando pocas células germinales o solo células de Sertoli. Estos hallazgos se alinean con los datos publicados sobre sementales criptorquídeos y gatos en los que la tinción de AMH se correlacionó negativamente con las áreas de los túbulos seminíferos y las puntuaciones de Johnsen (29, 44). En perros, una mayor inmunotinción de AMH en los testículos retenidos también se explicó por la presencia de menos células germinales en los túbulos seminíferos, en comparación con las gónadas escrotales (31). Por lo tanto, la expresión tisular de AMH parece aumentar debido a cambios estructurales o funcionales dentro del testículo, asociados con la desdiferenciación o demaduración de las células de Sertoli, lo que lleva a niveles séricos elevados de AMH (14, 45). Los testículos de ratón gravemente dañados mostraron una mayor intensidad de tinción de AMH, identificando principalmente células de Sertoli reactivas, y correlacionándose con un mayor grado de apoptosis (12). En los testículos de hombres infértiles, la atrofia tubular se caracterizó por la coexpresión de AMH y CK-18 en las células de Sertoli (45). Este patrón de expresión fue específico para los túbulos que mostraron detención espermatogénica en la etapa de espermatogonia, así como en los túbulos que mostraron solo células de Sertoli (45), similares a nuestros túbulos 2 y 3 de la puntuación de Johnsen.
Inicialmente se pensó que el receptor AMH se localizaba exclusivamente en la membrana de las células de Sertoli, pero investigaciones posteriores también han identificado su presencia en las células de Leydig (46). Además, la interacción entre AMH y los receptores ubicados en las células de Leydig puede tener el potencial de inhibir la producción de testosterona (46). Curiosamente, en las muestras de testículos retenidas se observó una mayor reactividad en el espacio intersticial en comparación con el mismo compartimento de las gónadas descendidas, lo que sugiere una mayor interacción entre los receptores mencionados anteriormente y la AMH. Por lo tanto, podemos considerar que la AMH también podría reflejar la capacidad esteroidogénica del tejido testicular, que puede verse alterada por lesiones degenerativas como las observadas en sementales con degeneración testicular inducida térmicamente (47).
Los testículos descendidos contralaterales de criptorquidas unilaterales no difirieron significativamente de los testículos descendidos de individuos intactos en ninguno de los aspectos analizados. Estos hallazgos son consistentes con observaciones previas en perros, donde se hicieron comparaciones similares en tres categorías de edad diferentes, examinando varias etapas de desarrollo de las criptorquídeas (35). A la luz de esto y considerando que la AMH sérica no pudo diferenciar entre criptorquidas unilaterales y bilaterales, podemos plantear la hipótesis de que la AMH podría no ser efectiva para indicar si uno o ambos testículos están sufriendo degeneración testicular. Sin embargo, aún podría ser un marcador valioso para crear conciencia cuando comiencen a desarrollarse cambios estructurales en al menos una de las gónadas.
A pesar de los aspectos valiosos de este estudio, existen algunas limitaciones a considerar. Una limitación es la falta de recolección de eyaculación de los perros antes de la castración, lo que habría proporcionado información importante sobre la funcionalidad y morfología de los espermatozoides en el momento de la toma de muestras de sangre. Otra limitación es el uso de perros criptorquídeos como modelos para la degeneración testicular, junto con controles sanos que carecían de un historial reproductivo completo. Los estudios futuros podrían centrarse en perros que sufren diversos grados de degeneración debido a otras causas, como lesiones mecánicas o neoplasias, para profundizar en la comprensión de los mecanismos de degeneración testicular. Además, incluir solo perros con fertilidad comprobada como controles saludables podría ofrecer información más sólida para futuras investigaciones.
En conclusión, este estudio apoya el uso de AMH como biomarcador de la degeneración testicular, tal y como se ha demostrado en perros criptorquídeos. Esta condición presenta cambios estructurales y funcionales similares a los observados en los testículos descendidos afectados por agentes como el estrés térmico o los compuestos gonadotóxicos, que también inducen la degeneración testicular. Los niveles séricos elevados de AMH y el aumento de la expresión tisular de AMH en los testículos retenidos se correlacionaron estrechamente con el daño estructural y el deterioro de la espermatogénesis, lo que indica que la AMH refleja alteraciones significativas dentro del tejido testicular. Si bien la AMH sérica demuestra ser una herramienta mínimamente invasiva prometedora para la detección temprana de la disfunción testicular, sus limitaciones actuales para evaluar la gravedad de la degeneración resaltan la necesidad de más investigación y métodos de diagnóstico complementarios para mejorar la evaluación de la salud testicular y la fertilidad en perros machos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
Los estudios en animales fueron aprobados por el Comité Ético de la Facultad de Medicina Veterinaria de Bucarest (Número de aprobación: EA nr. 34-03/2024). Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
FP: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Visualización, Redacción – borrador original. GR: Recursos, Redacción – revisión y edición. NC: Investigación, Escritura – revisión y edición. GN: Investigación, Escritura – borrador original. KC: Investigación, Escritura – borrador original. AD: Investigación, Redacción – revisión y edición. AȘ: Investigación, Escritura – revisión y edición. AV: Recursos, Supervisión, Redacción – revisión y edición. MC: Supervisión, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Los autores agradecen al personal del Laboratorio de Patología Veterinaria de la Universidad de Gante por su ayuda en la preparación de las muestras y agradecen a Sarah Loomans por su excelente asistencia técnica. La colaboración entre los autores en este estudio contó con el apoyo del Ministerio de Educación de Rumanía a través de la Agencia de Préstamos y Subvenciones Estudiantiles, en el marco de la beca de movilidad HG 118/2023-2024, contrato n.º 3323/23.01.2024.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1481248/full#supplementary-material
Referencias
1. Domosławska, A, y Zdunczyk, S. Hallazgos clínicos y espermatológicos en perros machos con infertilidad adquirida: un análisis retrospectivo. Andrología. (2020) 52:1–8. doi: 10.1111/and.13802
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Aitken, RJ . La marea cambiante de la fertilidad humana. Hum Reprod. (2022) 37:629–38. doi: 10.1093/humrep/deac011
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Câmara, LBRM, Câmara, RD, Maiorino, FC, Júnior, VAS y Guerra, MMP. Trastornos testiculares caninos y su influencia en la morfología de los espermatozoides. Anim Reprod. (2014) 11:32–6.
4. Zdunczyk, S y Domoslawska, A. Efecto de los medicamentos sobre la fertilidad en perros machos: una revisión. Reprod Domest Anim. (2022) 57:949–56. doi: 10.1111/rda.14173
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Fontbonne, A . Infertilidad en perros machos: avances recientes. Rev Bras Reprod Anim. (2011) 35:266–73.
6. Gobello, C, y Corrada, Y. Infertilidad adquirida en perros machos con libido normal. Compend Contin Educ Pract Vet. (2004) 26:18–28.
7. Ortega-Pacheco, A, Rodríguez-Buenfil, J, Segura-Correa, J, Bolio-González, M, Jiménez-Coello, M, y Linde, FC. Condiciones patológicas de los órganos reproductivos de perros callejeros machos en los trópicos: prevalencia, factores de riesgo, hallazgos morfológicos y concentraciones de testosterona. Reprod Domest Anim. (2006) 41:429–37. doi: 10.1111/j.1439-0531.2006.00688.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Robinson, BR, Netherton, JK, Ogle, RA, y Baker, MA. Estrés térmico testicular, una perspectiva histórica y dos postulados de por qué las células germinales masculinas son sensibles al calor. Biol Rev. (2023) 98:603–22. doi: 10.1111/brv.12921
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Ibach, B, Weissbach, L, y Hilscher, B. Etapas del ciclo del epitelio seminífero en el perro. Andrología. (2009) 8:297–307. doi: 10.1111/j.1439-0272.1976.tb01659.x
10. Albañil, SJ . Una actualización sobre la infertilidad canina masculina. Veterinario Clin N Am pequeño anim pract. (2023) 53:1063–81. doi: 10.1016/j.cvsm.2023.04.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Gouletsou, PG, Galatos, AD, Leontides, LS, y Sideri, AI. Impacto de la aspiración con aguja fina o grande en el testículo del perro: evaluación ultrasonográfica, bacteriológica, anatomía macroscópica e histológica in vitro. Teriogenología. (2010) 74:1604–14. doi: 10.1016/j.theriogenology.2010.06.032
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Levi, M, Hasky, N, Stemmer, SM, Shalgi, R, y Ben-Aharon, I. La hormona antimülleriana es un marcador de toxicidad testicular inducida por la quimioterapia. Endocrinología. (2015) 156:3818–27. doi: 10.1210/en.2015-1310
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Levi, M, Popovtzer, A, Tzabari, M, Mizrachi, A, Savion, N, Stemmer, SM, et al. Cetuximab intensifica la toxicidad testicular inducida por cisplatino. Reprod Biomed Online. (2016) 33:102–10. doi: 10.1016/j.rbmo.2016.04.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Pozor, M, Conley, AJ, Roser, JF, Nolin, M, Zambrano, GL, Runyon, SP, et al. Hormona antimülleriana como biomarcador de la degeneración testicular aguda causada por agresiones tóxicas a los testículos de los sementales. Teriogenología. (2018) 116:95–102. doi: 10.1016/j.theriogenology.2018.05.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Walter, B . Hormona antimülleriana en la reproducción de perros y gatos. Reprod Domest Anim. (2020) 55:26–31. doi: 10.1111/rda.13603
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Posastiuc, FP, Diaconescu, AI, Constantin, NT, Micșa, C y Codreanu, DM. Posibles biomarcadores para el cáncer testicular en perros: trabajo preliminar para programas de detección innovadores: una revisión. Sci Works Ser C Vet Med. (2022) 67:100–7.
17. Ferrer, MS, Palomares, RA, Hurley, DJ, Norton, N, Bullington, AC, Hoyos-Jaramillo, A, et al. Cambios en la concentración sérica de testosterona y hormonas antimüllerianas en toros sometidos a aislamiento escrotal. Domest Anim Endocrinol. (2022) 78:106685. doi: 10.1016/j.domaniend.2021.106685
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Walter, B, Fischer, S, y Otzdorff, C. Concentraciones de hormonas antimullerianas en perros con atrofia testicular. En: 1er simposio europeo sobre reproducción animal. Nantes, Francia: Reproducción en animales domésticos. (2023). 191.
19. Hallberg, I, Olsson, H, Lau, A, Wallander, S, Snell, A, Bergman, D, et al. Factores endocrinos y caninos asociados a la calidad del semen. Sci Rep. (2024) 14:1–11. doi: 10.1038/s41598-024-51242-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Domain, G, Buczkowska, J, Kalak, P, Wydooghe, E, Banchi, P, Pascottini, OB, et al. Suero antihormona mülleriana: ¿un potencial biomarcador de la calidad del semen en sementales? Animales. (2022) 12:323. doi: 10.3390/ani12030323
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Johnston, S. D., Root Kustritz, M. V., y Schultz Olson, P. Teriogenología canina y felina. Filadelfia: WB Saunders Company. (2001). 341–343.
22. Pecile, A, Groppetti, D, Pizzi, G, Banco, B, Bronzo, V, Giudice, C, et al. Conocimientos inmunohistoquímicos sobre una patología oculta: la criptorquidia canina. Teriogenología. (2021) 176:43–53. doi: 10.1016/j.theriogenology.2021.09.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Luna, JH, Yoo, DY, Jo, YK, Kim, GA, Jung, HY, Choi, JH, et al. El criptoquidido unilateral induce cambios morfológicos en los testículos e hiperplasia de las células de Sertoli en un perro. Lab Anim Res. (2014) 30:185–9. doi: 10.5625/lar.2014.30.4.185
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Kawakami, E, Tsutsui, T, Yamada, Y y Yamauchi, M. Criptorquidia en el perro: ocurrencia de criptorquidia y calidad del semen en el perro criptorquídea. Japonés J Vet Sci. (1984) 46:303–8. doi: 10.1292/jvms1939.46.303
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Hollinshead, F, Walker, C, y Hanlon, D. Determinación del intervalo de referencia normal para la hormona anti-mülleriana (AMH) en perras y uso de AMH como predictor potencial del tamaño de la camada. Reprod Domest Anim. (2017) 52:35–40. doi: 10.1111/rda.12822
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Themmen, APN, Kalra, B, Visser, JA, Kumar, A, Savjani, G, de Gier, J, et al. El uso de la hormona antimülleriana como diagnóstico del estado de gonadectomía en perros. Teriogenología. (2016) 86:1467–74. doi: 10.1016/j.theriogenology.2016.05.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Foster, RA . Sistema reproductor masculino En: FJ Zachary editor. Bases patológicas de las enfermedades veterinarias. 6ª ed. St. Louis, Missouri: Elsevier (2017). 1194–222.
28. Merz, SE, Klopfleisch, R, Breithaupt, A y Gruber, AD. Envejecimiento y senescencia en los testículos caninos. Veterinario Pathol. (2019) 56:715–24. doi: 10.1177/0300985819843683
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Tsogtgerel, M, Komyo, N, Murase, H, Hannan, MA, Watanabe, K, Ohtaki, T, et al. Concentraciones séricas y expresiones testiculares del péptido similar a la insulina 3 y de la hormona antimülleriana en caballos machos normales y criptorquídeos. Teriogenología. (2020) 154:135–42. doi: 10.1016/j.theriogenology.2020.05.026
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Horňáková, L, Vrbovská, T, Pavl’ak, M, Valenčáková-Agyagosová, A, Halo, M y Hajurka, J. Evaluación de las concentraciones séricas de testosterona, 17β-estradiol y hormona antimülleriana en perros con criptorquidia y tumores testiculares. Pol J Vet Sci. (2017) 20:677–85. doi: 10.1515/pjvs-2017-0085
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Prapaiwan, N, Manee-in, S, Thanawongnuwech, R, y Srisuwatanasagul, S. Niveles de hormonas antimüllerianas en suero y testículos de perros machos: relaciones con el estado de castración y la criptorquidia abdominal bilateral. Teriogenología. (2023) 208:171–7. doi: 10.1016/j.theriogenology.2023.06.015
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Claes, A, Ball, BA, Almeida, J, Corbin, CJ y Conley, AJ. Concentraciones séricas de hormonas antimüllerianas en sementales: cambios en el desarrollo, variación estacional y diferencias entre sementales intactos, sementales criptorquídeas y castrados. Teriogenología. (2013) 79:1229–35. doi: 10.1016/j.theriogenology.2013.03.019
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Ramezani Tehrani, F, Mansournia, MA, Solaymani-Dodaran, M, Minooee, S y Azizi, F. Variaciones séricas de la hormona anti-Mulleriana y la testosterona total con el envejecimiento en hombres iraníes adultos sanos: un estudio basado en la población. PLoS Uno. (2017) 12:E0179634. doi: 10.1371/journal.pone.0179634
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Chong, YH, Dennis, NA, Connolly, MJ, Teh, R, Jones, GT, van Rij, AM, et al. Los hombres de edad avanzada tienen niveles bajos de hormona antimülleriana e inhibina b, pero con una alta variación interpersonal: un estudio transversal de las hormonas de células de Sertoli en 615 hombres que viven en la comunidad. PLoS Uno. (2013) 8:E70967. doi: 10.1371/journal.pone.0070967
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Hernández-Jardón, N, Rojas-Castañeda, JC, Landero-Huerta, D, Reyes-Cruz, E, Reynoso-Robles, R, Juárez-Mosqueda, M d L, et al. Criptorquidia: el perro como modelo de estudio. Frente Vet Sci. (2022) 13:9. doi: 10.3389/fvets.2022.935307
36. Posastiuc, F, Constantin, T, Micșa, C, Nicolae, G, Sprințu, I, Andrei, C, et al. ¿Es la hormona antimulleriana sérica un biomarcador útil para la atrofia testicular en perros? En: 1er simposio europeo sobre reproducción animal. Nantes: Reproducción en animales domésticos, (2023); 58: 261.
37. Cai, H, Ren, Y, Li, XX, Yang, JL, Zhang, CP, Chen, M, et al. El estrés térmico escrotal provoca una alteración transitoria en las uniones estrechas e inducción de la expresión de TGF-β. Int J Androl. (2011) 34:352–62. doi: 10.1111/j.1365-2605.2010.01089.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Yang, WR, Li, BB, Hu, Y, Zhang, L y Wang, XZ. El estrés oxidativo media los cambios inducidos por el calor de las proteínas de unión estrecha en las células sertoli porcinas a través de la inhibición de la vía CaMKKβ-AMPK. Teriogenología. (2020) 142:104–13. doi: 10.1016/j.theriogenology.2019.09.031
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Ishii, T, Matsuki, S, Iuchi, Y, Okada, F, Toyosaki, S, Tomita, Y, et al. Deterioro acelerado de las células espermatogénicas en ratones sod 1-knockout bajo estrés por calor. Libre Radic Res. (2005) 39:697–705. doi: 10.1080/10715760500130517
40. Ikeda, M, Kodama, H, Fukuda, J, Shimizu, Y, Murata, M, Kumagai, J, et al. Papel de las especies radicales de oxígeno en la apoptosis de células germinales testiculares de rata inducida por estrés térmico. Biol Reprod. (1999) 61:393–9. doi: 10.1095/biolreprod61.2.393
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Vigueras-Villaseñor, RM, Ojeda, I, Gutiérrez-Pérez, O, Chávez-Saldaña, M, Cuevas, O, María, DS, et al. Efecto protector del α-tocoferol sobre el daño a los testículos de rata por criptorquidia experimental. Int J Exp Pathol. (2011) 92:131–9. doi: 10.1111/j.1365-2613.2010.00757.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Aldahhan, RA, Stanton, PG, Ludlow, H, de Kretser, DM, y Hedger, MP. El tratamiento térmico agudo interrumpe la producción de proteínas relacionadas con la inhibina y la expresión génica en los testículos de ratas adultas. Endocrinol de células molinos. (2019) 498:110546. doi: 10.1016/j.mce.2019.110546
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Sharpe, RM, McKinnell, C, Kivlin, C, y Fisher, JS. Proliferación y maduración funcional de las células de Sertoli y su relevancia para los trastornos de la función testicular en la edad adulta. Reproducción. (2003) 125:769–84. doi: 10.1530/rep.0.1250769
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Posastiuc, FP, Rizzoto, G, Constantin, NT, Nicolae, G, Chiers, K, Diaconescu, AI, et al. Hormona antimülleriana en la criptorquidia felina: niveles séricos, expresión tisular e implicaciones para la salud testicular. Teriogenología. (2024) 230:54–60. doi: 10.1016/j.theriogenology.2024.09.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Steger, K, Rey, R, Louis, F, Kliesch, S, Behre, HM, Nieschlag, E, et al. Reversión del fenotipo diferenciado y bloqueo de maduración en células de Sertoli en testículo humano patológico. Hum Reprod. (1999) 14:136–43. doi: 10.1093/humrep/14.1.136
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Racine, C, Rey, R, Forest, MG, Louis, F, Ferré, A, Huhtaniemi, I, et al. Los receptores de la hormona antimülleriana en las células de Leydig son responsables de sus efectos sobre la esteroidogénesis y la diferenciación celular. Proc Natl Acad Sci. (1998) 95:594–9. doi: 10.1073/pnas.95.2.594
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: hormona antimülleriana, degeneración testicular, criptorquidia, espermatogénesis, infertilidad canina
Cita: Posastiuc FP, Rizzoto G, Constantin NT, Nicolae G, Chiers K, Diaconescu AI, Șerban AI, Van Soom A y Codreanu MD (2024) Hormona antimülleriana como marcador de diagnóstico para la degeneración testicular en perros: perspectivas de modelos de criptorquídeas. Frente. Vet. Sci. 11:1481248. doi: 10.3389/fvets.2024.1481248
Recibido: 15 de agosto de 2024; Aceptado: 24 de septiembre de 2024;
Publicado: 07 de octubre de 2024.
Editado por:
Stefan Gregore Ciornei, Iasi, Universidad de Ciencias de la Vida (IULS), Rumanía
Revisado por:
Gabriele Brecchia, Universidad de Milán, Italia
Mohammed Ahmed Elmetwally, Universidad de Mansoura, Egipto
Abdallah Mohamed, Universidad Estatal de Fort Valley, Estados Unidos
Derechos de autor © 2024 Posastiuc, Rizzoto, Constantin, Nicolae, Chiers, Diaconescu, Șerban, Van Soom y Codreanu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución (CC BY).
*Correspondencia: Nicolae Tiberiu Constantin, tiberiu.constantin@fmvb.usamv.ro
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía