IBR: sensibilización y opciones de control

IBR: sensibilización y opciones de control
- Mick Millar investiga la propagación y las causas de la rinotraqueítis infecciosa bovina, discutiendo los métodos de tratamiento y control.
Este artículo se publicó originalmente en Vet Times 48.05 (5 de febrero de 2018).
La rinotraqueítis bovina infecciosa es una enfermedad relativamente común, principalmente en el ganado lechero en el Reino Unido, causada por el herpesvirus bovino-1. Puede causar brotes de enfermedades graves, principalmente respiratorias, pero también puede estar asociado con signos más leves, como conjuntivitis y gotas menores de leche, así como enfermedades reproductivas, digestivas, nerviosas y posibles efectos en la productividad. La infección latente y el recrudescencia plantean dificultades para el diagnóstico y el control de la enfermedad dentro de un rebaño. Las opciones de control incluyen planes de bioseguridad, vacunación y acreditación.
La rinotraqueítis infecciosa bovina (IBR) es una enfermedad importante del ganado causada por el herpesvirus bovino-1 (BHV1/BoHV1).
Como virus del herpes, la infección provoca una infección de por vida del huésped, con reactivación y eliminación responsables de la propagación de la enfermedad. Un proceso similar da lugar a herpes zóster en humanos adultos después de la infección por el virus de la varicela cuando son niños. Una prueba de anticuerpos positiva indica que el animal está infectado.
El virus tiene distribución mundial y fue diagnosticado por primera vez en la década de 1950 en los Estados Unidos. Existen dos subtipos principales, BHV1.1 y BHV1.2, con algunas diferencias en el desprendimiento en el ganado entre los subtipos (Nettleton y Russell, 2017) y la presentación de la enfermedad.
El BHV1 puede causar IBR (enfermedad del tracto respiratorio superior y gota de leche), pero también con poca frecuencia enfermedad reproductiva, conocida como vulvovaginitis pustulosa infecciosa (VPI) en mujeres y balonopostitis pustulosa infecciosa en hombres. También puede provocar abortos, aunque este no es un diagnóstico común en el Reino Unido.
La prevalencia y la incidencia de enfermedades pueden variar, aunque en los rebaños afectados por el punto de vista endémica, al menos la mitad de los animales son seropositivos.
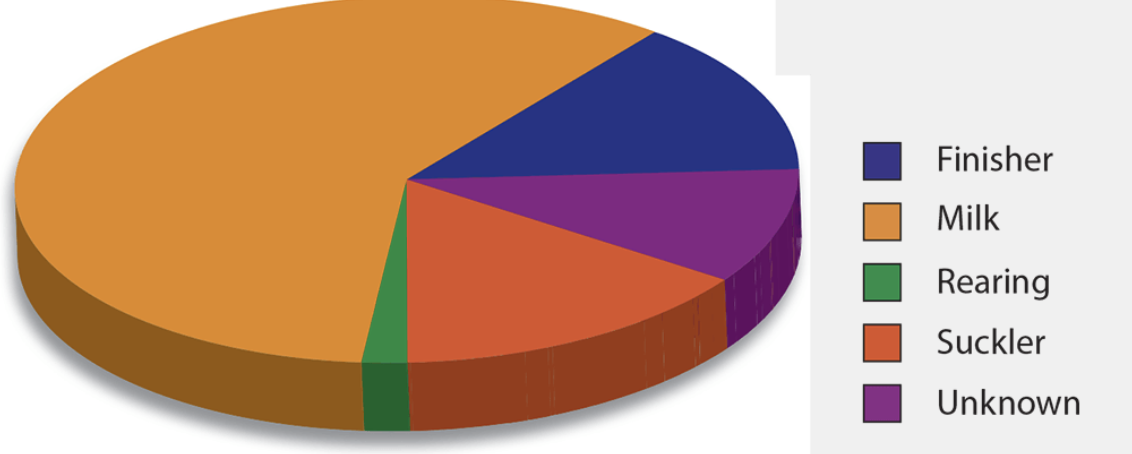
En 1998, se detectaron anticuerpos contra el IBR en la leche a granel del 69 por ciento de los rebaños lecheros probados en Inglaterra y Gales (Paton et al, 1998) y, en el suroeste de Inglaterra, Woodbine et al (2009) encontraron anticuerpos en al menos un animal en el 83,2 por ciento de los rebaños. En general, la enfermedad tiene una mayor prevalencia en rebaños lecheros (Nettleton y Russell, 2017; Figura 1). La enfermedad se ha erradicado en algunos países europeos, como Austria, Dinamarca, Finlandia, Noruega, Suecia y Suiza.
Propagación de la enfermedad
La enfermedad se introduce más comúnmente en un rebaño por animales comprados o por contacto relativamente cercano con ganado infectado (el virus se puede propagar en aerosol hasta 5 m). Se eliminan grandes cantidades de virus durante la enfermedad clínica primaria y del recrudecimiento de la infección en animales infectados latentemente.
En los rebaños lecheros infectados, el ganado joven a menudo permanece ingenuo hasta que se une a las vacas ordeñadoras, momento en el que puede ocurrir una enfermedad clínica. El virus puede sobrevivir hasta un mes a bajas temperaturas/alta humedad, y las excreciones nasales en la ropa y otros fómites pueden propagar la enfermedad a otras granjas (Nettleton y Russell, 2017). El semen de los toros infectados también puede propagar la enfermedad (Animal Health Ireland, 2016).
Enfermedad clínica
Las cuatro presentaciones clínicas son respiratorias, reproductivas, digestivas y nerviosas, siendo, con mucho, las más comunes las respiratorias (intelas respiratorias superiores), a menudo en novillas o ganado recién comprado.
Respiratorio
La IBR clásica es esencialmente una enfermedad de las vías respiratorias superiores y puede variar de signos leves, incluyendo:
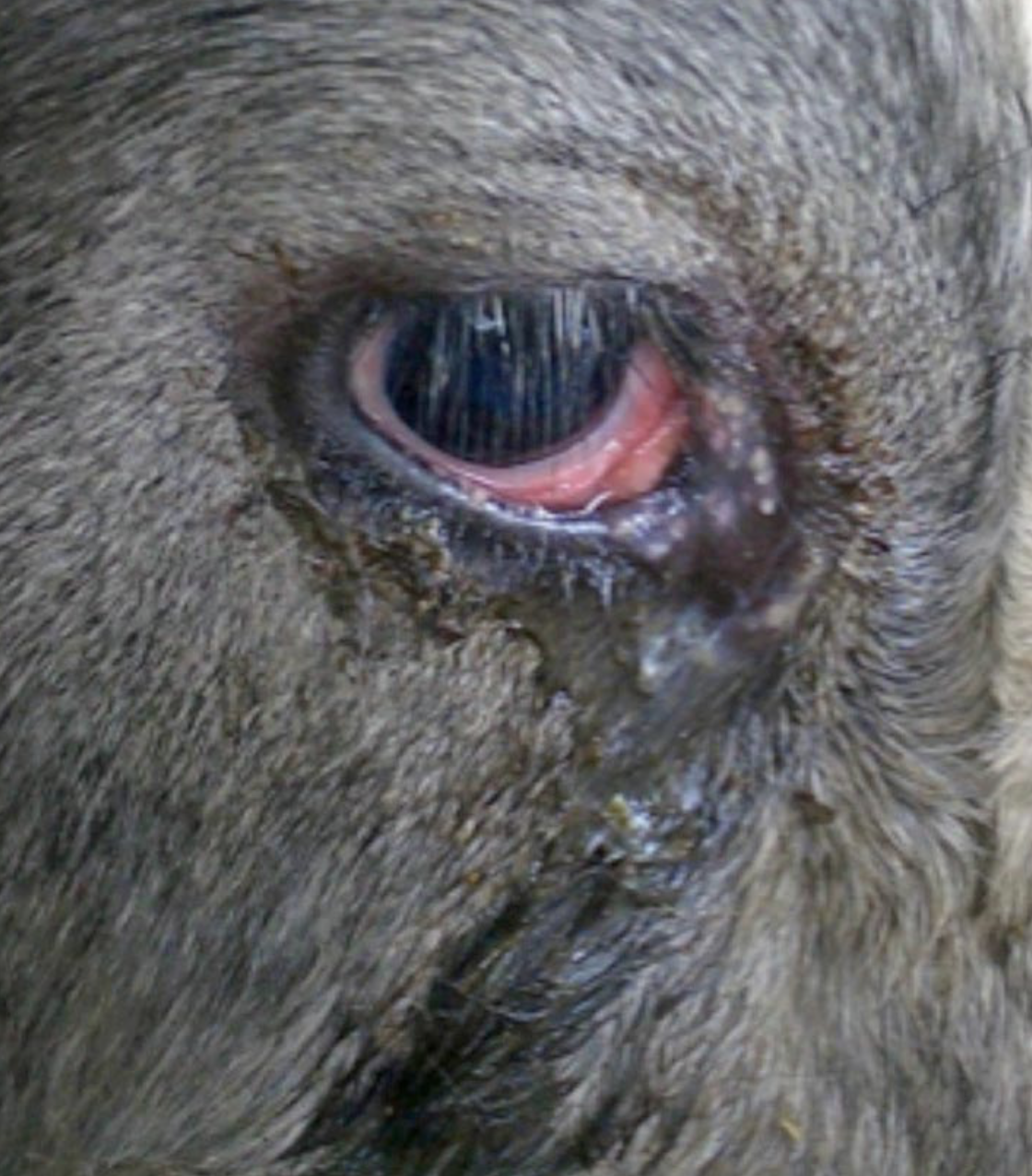
- conjuntivitis y epífora: esto puede ocurrir sin otros signos, por lo que debe considerarse si se presentan brotes de conjuntivitis sin queratitis (Gunning, 1981; Figura 2)
- aumento de la frecuencia respiratoria, enrojecimiento y erosión dentro de la nariz, y secreción nasal (cambio seroso a mucopurulento)
- La enfermedad grave puede incluir un espectro de signos, como:
- pirexia, anorexia y gota grave de leche
- secreción oculonasal y babeo
- tos y dificultad respiratoria grave que a menudo conducen a la muerte (con neumonía bacteriana secundaria grave en los pulmones, a menudo debido en parte a la aspiración de la mucosa traqueal necrótica)
En los terneros, la IBR no es un componente común de los brotes de neumonía, pero se ha descrito una enfermedad grave en animales neonatales (Nettleton y Russell, 2017).
En animales adultos, la gota de leche con signos clínicos leves es quizás la más común, pero se pueden observar brotes significativos de enfermedad en rebaños ingenuos (caída grave de la leche, muertes por traqueítis grave y bronconeumonía). También se han notificado efectos en la productividad, incluida la reducción del rendimiento de leche (Statham et al, 2015) y la reducción de la fertilidad.
Reproductivo
- El aborto (a medio o tardío) no es una manifestación común de infección en el Reino Unido (a diferencia de los EE. UU.) y es secundario a la infección de la presa (puede ser hasta 100 días después de un brote de enfermedad respiratoria). El diagnóstico se realiza por histopatología o PCR en el hígado fetal.
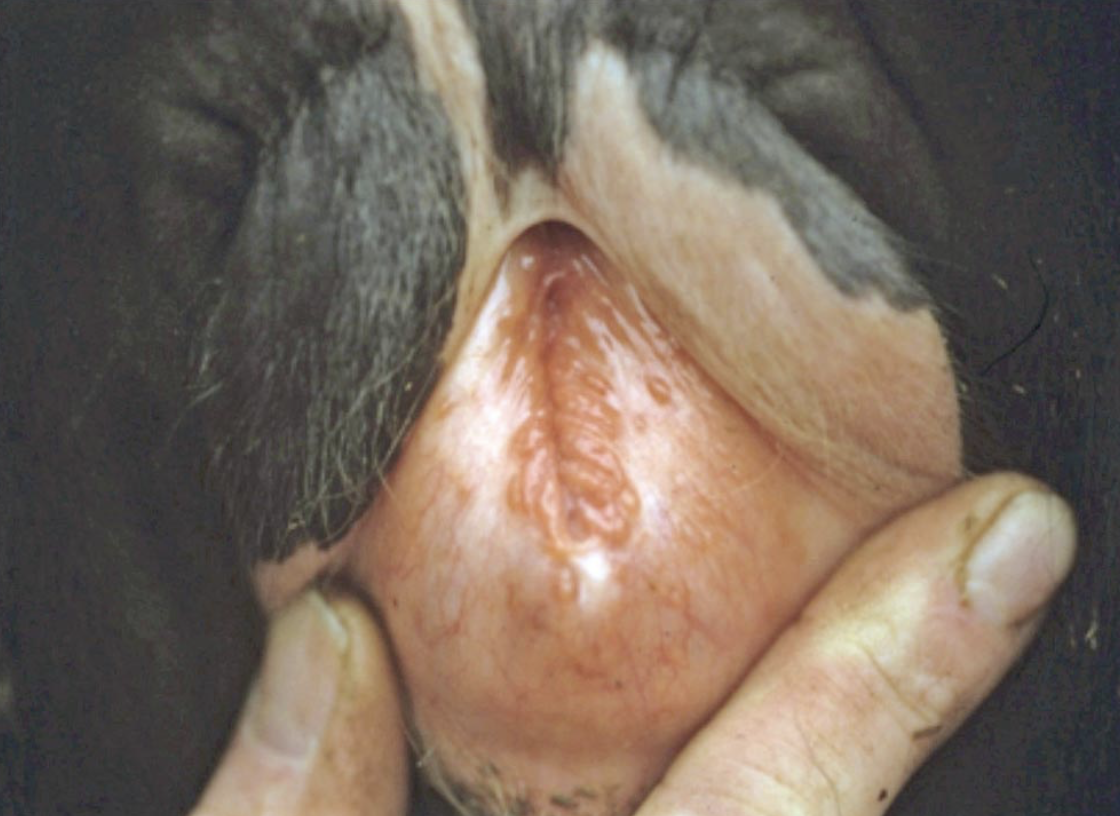
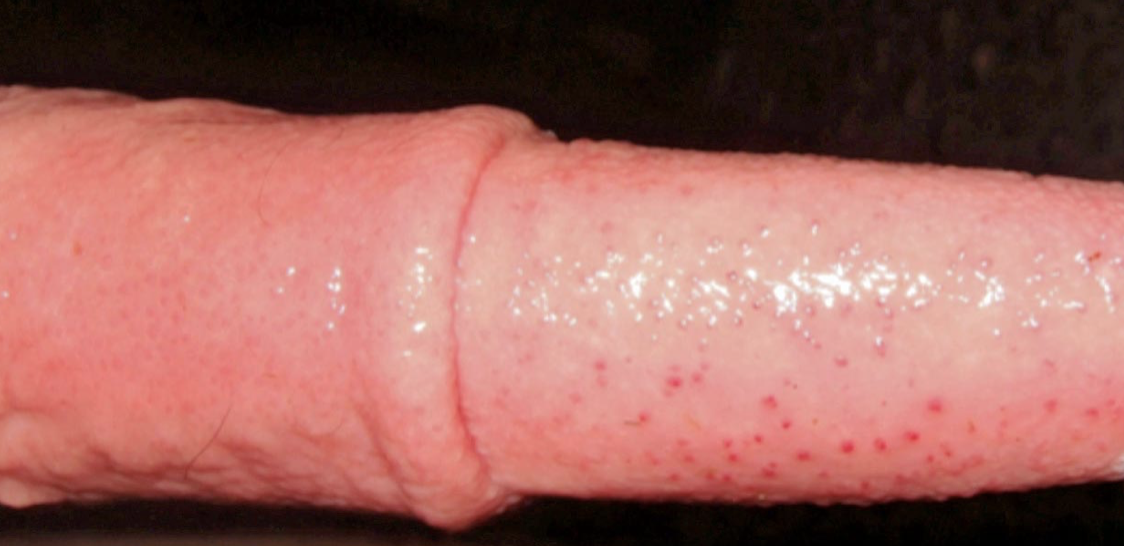
- La IPV/banopostitis pustulosa infecciosa (IPB) es un diagnóstico poco frecuente en el Reino Unido. Se observa edema y formación/ulceración de pústulas en la vulva y el pene (figuras 3 y 4).
Digestivo
Las presentaciones digestivas son una manifestación muy poco común de IBR que generalmente se observa en terneros, y pueden seguir a un brote de enfermedad respiratoria en bovinos mayores. Se pueden observar lesiones ulcerosas necróticas en el tracto alimentario superior (la orofaringe y el esófago). Por lo general, también se observan signos respiratorios en estos animales, pero se podría considerar IBR si se observan lesiones ulcerosas en el tracto gastrointestinal de los terneros en la autopsia.
Nervioso
Las presentaciones nerviosas también son una manifestación inusual de la infección por IBR y pueden ser una extensión de la infección orofaríngea en los terneros, y en el ganado mayor puede ser de transmisión sanguínea o de la mucosa nasal, lo que resulta en encefalitis (Penny et al, 2002).
Diagnóstico
La serología (detección de anticuerpos en el suero o la leche) y las pruebas de detección de virus (PCR) son las piedras angulares del diagnóstico. Los requisitos específicos para la recogida de muestras se pueden encontrar en la guía APHA sobre selección de muestras y pruebas, pero esencialmente:
Pruebas de PCR
- Se debe tomar muestras de los animales afectados, con secreción serosa en lugar de mucopurulenta.
- Los hisopos nasales y oculares frotados en la cavidad nasal o en la conjuntiva son adecuados: se someten al laboratorio lo antes posible.
- Idealmente, corte y coloque el extremo del hisopo (o hisopos) en solución salina tamponada con fosfato (PBS) o en un 0,9% de solución salina o medio de transporte de virus (VTM) si se va a retrasar para evitar que el hisopo se seque.
- Para reducir los costos, se pueden colocar hisopos de varios animales en un brote en el medio de transporte y solicitar una sola prueba de PCR, la que comúnmente disponible es la PCR multiplex (el virus RSS y el virus Pi3, entre otros), aunque algunos laboratorios ofrecen pruebas IBR individuales más baratas.
- También se puede utilizar líquido de lavado broncoalveolar (BAL), aunque generalmente se obtienen buenos resultados con hisopos (a diferencia de las pruebas de VRS y Pi3), por lo que no debería haber necesidad de hacer BAL en un animal vivo.
Serología
- La serología emparejada se utiliza para indicar la exposición reciente en brotes de infección respiratoria y muestras de suero («redtops») tomadas en el momento de la enfermedad (muestra aguda), y de dos a tres semanas después (convaleciente) mostrarán un aumento significativo si la infección fue responsable de la enfermedad.
- Alternativamente, se puede utilizar una serología convaleciente/extranitaria para indicar la presencia del virus dentro de un animal/rebaño.
- Las principales pruebas disponibles son los ELISA.
- Los ELISA indirectos (iELISA) se utilizan para el diagnóstico (serología emparejada) y se da un valor numérico para determinar si se ha producido la seroconversión a partir de muestras de suero emparejadas.
- Los ELISA de bloqueo (cELISA) se utilizan para determinar la presencia o ausencia de infección en un animal; por ejemplo, cuando se compra un toro en un rebaño, se importan/exportan animales y, por lo general, se da un resultado positivo o negativo en lugar de un valor numérico. Se consideran más sensibles que las iELISA, de ahí su uso en el comercio internacional y para la detección, y también se utilizan con vacunas de marcadores para detectar la exposición a virus de campo en lugar de anticuerpos vacunales.
- La detección de anticuerpos con leche a granel (generalmente iELISA) es una ayuda útil para detectar/monitorizar la infección por IBR en rebaños lecheros, y las muestras agrupadas de novillas que entran en el rebaño de ordeño se pueden utilizar para una detección más específica o para investigar brotes de sospecha de enfermedad. Las pruebas individuales de leche también están disponibles y tienen la ventaja de que los agricultores pueden tomar la muestra.
Autopsia
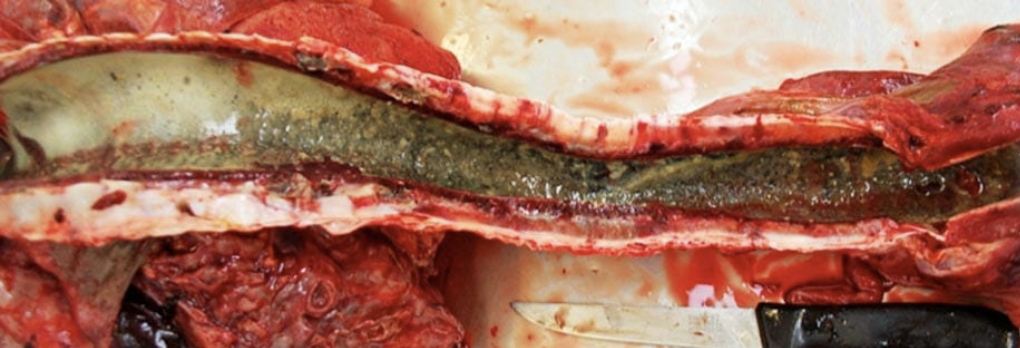
Es casi seguro que la IBR clásica asociada con la muerte de un animal se asocie con una rinotraqueítis grave (figuras 5 a 7) y neumonía secundaria (aspiración/bacteriana), a menudo con pleuresía (figura 8) debido a bacterias, incluida Mannheimia haemolytica (figura 9).
En estos casos, el diagnóstico generalmente se obtiene fácilmente frotando un hisopo liso en la mucosa de la tráquea o bifurcación bronquial (figura 10).
La sangre post mortem también se puede recoger y, por lo general, será adecuada (si no se haemolizada gravemente) para la serología; teniendo en cuenta que es posible que no haya pasado suficiente tiempo para la seroconversión. El tejido (tráquea y pulmones) también se puede recoger en formalina, ya que los cambios histopatológicos pueden ser diagnósticos: la inmunohistoquímica está disponible y se puede demostrar el virus in situ (figura 11).
Tratamiento y control
No existe un tratamiento específico para el IBR, solo un tratamiento de apoyo con antibióticos y AINE. Se recomienda el aislamiento de los animales que muestren signos clínicos.
El control se centra idealmente en mantener un rebaño libre (rebaño cerrado o cribado de animales comprados y bioseguridad: la infección se puede introducir en los fómites) y/o el uso de la vacunación para controlar la infección dentro de un rebaño, o ayudar a la erradicación.
Existen varios planes de acreditación de rebaños que proporcionan un enfoque estructurado para el control y la erradicación de la ayuda.
Vacunación
La vacunación puede prevenir enfermedades clínicas y reducir la propagación del virus, pero no previene la infección en animales expuestos al virus (Nettleton y Russell, 2017). Las vacunas de marcador se utilizan con mayor frecuencia en el Reino Unido (aunque las vacunas sin marcador todavía están disponibles).
La exposición al virus de campo se puede diferenciar del anticuerpo vacunal a través de la detección por parte de un cELISA específico de glicoproteína gE, que está ausente en las vacunas marcadores, diferenciando los animales infectados de los vacunados o la tecnología DIVA. Sin embargo, las vacunas sin marcador suelen formar parte de las vacunas combinadas, lo que puede complicar el uso de la serología para detectar la exposición a virus de campo, especialmente si el historial de los animales comprados es incierto.
Hay disponibles vacunas vivas e inactivadas:
- Las vacunas vivas (MI e intranasales) se pueden usar en terneros de 3 a 4 semanas de edad (repetidas después de 10 a 12 semanas de edad), y una dosis única es protectora en bovinos mayores de 3 meses, pero es necesario un refuerzo inicial de 6 meses, seguido de otros refuerzos 6 o 12 meses dependiendo de la vacuna utilizada. Se pueden utilizar en bovinos preñados (aunque algunas vacunas combinadas no pueden). Las vacunas vivas inducen una «respuesta rápida por respuesta inmune celular e inducción de inmunidad local», ayudando así a la recuperación después de la infección.
- Las vacunas inactivadas (IM o SC) «inducen la producción de anticuerpos neutralizantes circulantes» (Kerkhofs et al, 2003) y, por lo tanto, limitan la excreción del virus después de la reactivación en animales infectados (Bosch et al, 1997).
Las vacunas vivas son mejores para proporcionar protección contra enfermedades clínicas en animales vacunados, pero las vacunas inactivadas son mejores para limitar la desprendimiento en esos animales infectados.
Un protocolo de vacunación que puede proporcionar un buen control de la enfermedad y ayudar a la erradicación a nivel de rebaño incluye:
- uso de una vacuna viva impulsada por una vacuna inactivada 4 semanas después
- un refuerzo de la vacuna inactivado 12 meses después
Se cree que esta combinación reduce o previene el recrudecimiento del virus de las vacas portadoras, ayudando así a erradicar la infección dentro de un rebaño (Forrest, 2014).
Resumen
El IBR en el ganado es causado por un virus del herpes, por lo que los animales infectados permanecen infectados de por vida (la vacunación no libera a un animal de la infección) y los animales serológicamente positivos no deben comprarse en un rebaño libre de IBR. Es principalmente una enfermedad de las vías respiratorias superiores, pero una enfermedad grave puede provocar neumonía secundaria. Comúnmente no forma parte del complejo de neumonía de la pantorrilla, y con menos frecuencia puede causar enfermedades reproductivas (incluidos el aborto y la IPV/IPB), y enfermedades/patología digestivas y nerviosas.
Los signos clínicos comunes incluyen secreción nasal y ocular, y tos y estornudos con o sin pirexia, y se puede observar una enfermedad grave en animales ingenuos. La PCR es una prueba sensible para el diagnóstico, y las pruebas serológicas también son ayudas valiosas para el diagnóstico, y pueden diferenciar a los anticuerpos vacunales de la exposición al virus de campo (suponiendo que se utilice una vacuna marcadora).
Existen protocolos de vacunación que ayudan a la recuperación después de la infección (vacuna viva) y reducen la eliminación de virus en animales infectados (vacunas inactivadas), y estos pueden formar parte tanto de los planes de erradicación a nivel de rebaño como a nivel nacional.
Referencias
- Animal Health Ireland (2016). Folletos informativos del IBR,http://animalhealthireland.ie/? page_id=377
- Bosch JC, Kaashoek MJ y van Oirschot JT (1997). Las vacunas de marcadores 1 del herpesvirus bovino inactivado son más eficaces para reducir la excreción del virus después de la reactivación que una vacuna marcadora viva, Vacuna 15(14): 1.512-1.517.
- Forrest J (2014). Control y seguimiento de IBR en un rebaño lechero de 220 vacas después de la vacunación con un programa de vacunas con marcadores IBR vivos/inactivados, Práctica de ganado 22: 251.
- Gunning RF (1981). Enfermedad ocular en IBR, Registro veterinario 109(1): 23-24.
- Kerkhofs P, Renjifo X, Toussaint JF, Letellier C, Vanopdenbosch E y Wellemans G (2003). Mejora de la respuesta inmunitaria y la protección virológica de los terneros contra el herpesvirus bovino tipo 1 con una vacuna inactivada eliminada de gE, Vet Record 152(22): 681-686.
- Nettleton P y Russell G (2017) Actualización sobre la rinotraqueítis infecciosa bovina, en la práctica 39(6): 255-272.
- Paton DJ, Christiansen KH, Alenius S, Cranwell MP, Pritchard GC y Drew TW (1998). Prevalencia de anticuerpos contra el virus de la diarrea del virus bovino y otros virus en la leche de tanque a granel en Inglaterra y Gales, Registro veterinario 142(15): 385-391.
- Penny CD, Howie F, Nettleton PF, Sargison ND y Schock A (2002). Enfermedad respiratoria superior y encefalitis en terneros de vacuno neonatales causada por el herpesvirus bovino tipo 1, Registro veterinario 151(3): 89-91.
- Statham JM, Randall LV y Archer SC (2015). Reducción del rendimiento diario de leche asociado con la infección subclínica por el herpesvirus bovino 1, Registro Veterinario 177(13): 339.
- Woodbine KA, Medley GF, Moore SJ, Ramírez-Villaescusa AM, Mason S y Green LE (2009). Un estudio seroepidemiológico longitudinal de cuatro años del herpesvirus bovino tipo-1 (BHV-1) en bovinos adultos en 107 rebaños no vacunados en el suroeste de Inglaterra, BMC Veterinary Research 5: 5.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

