Investigación del efecto de la ketamina en la electroencefalografía en gatos con epilepsia

Investigación del efecto y la disponibilidad de ketamina en la electroencefalografía en gatos con epilepsia del lóbulo temporal
 Satoshi Mizuno1
Satoshi Mizuno1  Rikako Asada1
Rikako Asada1  Yoshihiko Yu1†
Yoshihiko Yu1†  Yuji Hamamoto1,2†
Yuji Hamamoto1,2†  Daisuke Hasegawa1*
Daisuke Hasegawa1*- 1Laboratorio de Neurología Clínica Veterinaria, Escuela de Graduados de la Universidad Nippon de Veterinaria y Ciencias de la Vida, Musashino, Japón
- 2Veterinary Medical Teaching Hospital, Nippon Veterinary and Life Science University, Musashino, Japón
En los últimos años, la electroencefalografía (EEG) en medicina veterinaria se ha vuelto importante no solo en el diagnóstico de la epilepsia, sino también en la determinación del foco epileptogénico. En gatos, la sedación y la inmovilización, generalmente con medetomidina o dexmedetomidina, son necesarias para colocar los electrodos y obtener registros estables del EEG del cuero cabelludo. En este estudio, planteamos la hipótesis de que, para gatos con epilepsia del lóbulo temporal (TLE), la ketamina, un sedante / anestésico y antagonista del N-metil-D-aspartato (NMDA) que activa el sistema límbico y también se usa para tratar el estado epiléptico refractario en perros, induciría suficiente sedación e inmovilización para EEG, así como inducir descargas epileptiformes interictales (IED) que son más pronunciadas que las inducidas con medetomidina. Obtuvimos registros de EEG de gatos TLE y gatos sanos a los que se les administró ketamina o medetomidina sola (estudio 1) o ketamina después de la sedación con medetomidina (estudio 2). En el estudio 1, la frecuencia de IED no mostró diferencias estadísticamente significativas entre ketamina y medetomidina tanto en TLE como en gatos sanos. Se observaron convulsiones en el 75% (9/12) de los gatos del grupo TLE con ketamina sola. Cuando se administró ketamina después de la sedación con medetomidina (estudio 2), 3/18 gatos en el grupo TLE desarrollaron convulsiones tónico-clónicas generalizadas y 1/18 gatos mostraron actividad convulsiva subclínica. Sin embargo, no se observaron convulsiones en todos los gatos sanos tanto en el estudio 1 como en el estudio 2. Se observó actividad de onda lenta a 2-4 Hz en muchos individuos después de la administración de ketamina, independientemente de los estudios y grupos, y el análisis cuantitativo en el estudio 2 mostró una tendencia hacia el aumento de las actividades de la banda delta en ambos grupos. Si bien no hubo diferencias significativas en el recuento de IED entre la medetomidina y la ketamina, la ketamina causó convulsiones en gatos con TLE similares a su tipo de convulsión habitual y con una mayor frecuencia de convulsiones. Nuestros resultados sugieren que la ketamina puede activar las descargas epileptiformes durante los registros de EEG. Sin embargo, se debe tener precaución para los gatos con TLE.
1. Introducción
La ketamina (KET) es un antagonista no competitivo del receptor N-metil-D-aspartato (NMDA) que se desarrolló en la década de 1960. Corssen et al. (1) informaron que el sistema corticotalámico se suprime mientras que el sistema límbico se activa en gatos que usan KET, por lo tanto, KET se conoce como un «anestésico disociativo». En medicina veterinaria, KET se usa generalmente para la restricción, sedación y analgesia. Además de estas aplicaciones, KET se ha utilizado recientemente para controlar el estado epiléptico (RSE) refractario (GABAérgico resistente a los medicamentos) en perros (2). Sin embargo, los estudios sobre los efectos de KET en la epilepsia son inconsistentes, con informes que indican que KET tiene efectos anticonvulsivos (3, 4), mientras que otros informes afirman que KET induce actividad convulsiva (5).
La electroencefalografía (EEG) es una de las herramientas diagnósticas más importantes en epilepsia y también ha llamado la atención para detectar la zona epileptogénica tanto para la clasificación de las convulsiones como para la cirugía de la epilepsia (6, 7). Sin embargo, en el campo veterinario, especialmente en gatos, el uso de EEG no es frecuente. Como un factor de esto, el EEG en gatos con pelaje de alta densidad y cuero cabelludo duro requiere sedación e inmovilización estrictas para la colocación de electrodos y el registro estable. Algunos estudios han reportado el uso de sedantes, típicamente medetomidina (MED) o el enantiómero de MED, dexmedetomidina, para realizar EEG del cuero cabelludo en perros y gatos (8-10). MED y dexmedetomidina producen efectos sedantes y analgésicos suficientes para el registro de EEG y pueden ser rápidamente antagonizados por la administración de atipamezol (11, 12). Por lo tanto, se prefiere MED o dexmedetomidina para el registro de EEG en animales. En un estudio de EEG canino con MED, los perros con convulsiones graves tuvieron una incidencia predominantemente mayor de descargas epileptiformes interictales (IED) que los perros de control (13). Sin embargo, hay casos en los que el IED no se puede detectar en las mediciones reales de EEG, incluso si el paciente tiene epilepsia, y se recomienda repetir las pruebas de EEG dependiendo del caso (14). Sin embargo, debido a las cargas asociadas con el EEG en animales, incluida la administración de sedantes, un agente que sea seguro y no interfiera con la detección de IED sería ideal.
En estudios previos, informamos gatos epilépticos espontáneos familiares (FSEC) con sospecha de epilepsia genética. Los FSEC tienen convulsiones límbicas focales espontáneas con o sin evolución a convulsiones tónico-clónicas generalizadas (GTCS) y, por lo tanto, se clasifican como epilepsia del lóbulo temporal (TLE) (15-21). Se presume que la zona epileptogénica de los FSEC existe en el hipocampo o la amígdala, que son partes del sistema límbico, o ambas según las evaluaciones previas de zonas sintomáticas, irritativas, de inicio convulsivo, estructuralmente anormales y de déficit funcional (22).
Aunque el EEG felino usando KET se examinó en el pasado (4, 5, 23-26), hasta donde sabemos, no hay informes de tales estudios realizados en gatos con TLE espontánea. Por lo tanto, planteamos la hipótesis de que el uso de TFE, que estimula el sistema límbico e inhibe la corteza, en EEG en gatos con TLE aumentaría el número de IED. Para verificar esta hipótesis, realizamos EEG del cuero cabelludo en gatos sanos y TLE después de la administración única de KET o MED (estudio 1). Luego, de acuerdo con los resultados del estudio 1, evaluamos el efecto de KET después de la sedación con MED sobre el EEG del cuero cabelludo en gatos con TLE (estudio 2).
2. Materiales y métodos
2.1. Animales
Este estudio, que incluye el cuidado y mantenimiento de la colonia de FSEC, gatos sanos y epilépticos genéticamente no relacionados con FSEC, fue aprobado por el Comité de Cuidado y Uso de Animales de la Universidad Veterinaria y de Ciencias de la Vida de la Nippon (números de acceso 2020K-3, 2021K-2, 2022K-2; el investigador principal es DH).
El estudio incluyó 24 gatos, divididos en dos grupos: el grupo TLE y el grupo control. El grupo de TLE incluyó 17 FSEC (Nos. 1-17) y un gato con TLE no relacionado con la cepa FSEC (No. 18). Los FSEC muestran el tipo típico de convulsiones de TLE felino, como automatismo orofacial, salivación, midriasis, giro de cabeza y, a veces, evolucionan a GTCS (27). Tanto los exámenes físicos como los neurológicos fueron normales. El Gato nº 18 tuvo una crisis convulsiva inicial a la edad de 50 meses y presentó crisis límbicas focales con o sin evolución a GTCS similares a las FSEC. Los exámenes físicos y neurológicos, el hemograma completo, la química sérica, el análisis de orina y la resonancia magnética no mostraron anomalías, y el EEG previo reveló IED (picos) en la región temporal anterior izquierda. Estos gatos fueron observados con convulsiones durante más de 1 año utilizando un sistema de monitoreo de video. En el grupo de TLE, se observaron convulsiones en los gatos No. 1 (12 convulsiones / año), No. 2 (19 convulsiones / año), No. 4 (1 convulsión / año) y No. 18 (14 convulsiones / año), mientras que otros gatos no tuvieron convulsiones en el año anterior a la inclusión en este estudio. Todos los gatos no han sido tratados con medicamentos antiepilépticos diarios para las convulsiones; sin embargo, recibieron tratamiento temporal para las convulsiones graves en racimo y/o el estado epiléptico, según correspondiera. El grupo TLE consistió en 12 hombres y 6 mujeres (3 de los cuales fueron castrados), y tuvo una mediana de edad y peso corporal de 127 meses (rango, 94-157) y 3,6 kg (rango, 2,5-7,2), respectivamente. El grupo de control incluyó 6 gatos sanos (números 19-24; 2 machos y 4 hembras) sin convulsiones documentadas. El grupo control tenía una mediana de edad y peso corporal de 94 meses (rango, 77-107) y 3,6 kg (rango, 3,1-6,4), respectivamente. La frecuencia de señalización y convulsiones para cada individuo en el momento de la inclusión del estudio se resume en la Tabla Suplementaria1.
2.2. Estudio 1: EEG por administración exclusiva de ketamina o medetomidina
2.2.1. Protocolo de sedación
Doce gatos (números 1-5 y 18 del grupo TLE, y números 19-24 del grupo control) fueron sometidos a EEG con la administración exclusiva de MED o KET en un día separado para cada individuo. Todos los gatos fueron restringidos en la alimentación y el consumo de alcohol durante 12 h antes de la grabación del EEG. El EEG se realizó una vez con MED (Domitor, Zenoaq, Japón) solo. El EEG también se realizó una vez con KET (Ketalar, Daiichi-Sankyo, Japón) solo, pero se realizó nuevamente (es decir, dos veces) en otro día si ocurrieron ataques epilépticos o si no se pudieron obtener suficientes registros de EEG, para confirmar la reproducibilidad. Cada prueba se realizó con al menos 1 semana de diferencia. MED (dosis mediana, 40 μg/kg; rango, 30-50) o KET (dosis mediana, 7,5 mg/kg; rango, 5,0-13,3) se administró por vía intramuscular de acuerdo con el estado de sedación de cada individuo. Todos los gatos sedados con MED recibieron una administración intramuscular del antagonista de MED atipamezol (Antisedan, Zenoaq, Japón) después del registro del EEG.®®®
2.2.2. Grabaciones de EEG
Los registros de EEG se realizaron mientras los gatos estaban bajo sedación adecuada. Después de colocar a los gatos en posición prona, se colocaron electrodos de aguja de registro por vía subcutánea en las regiones frontal bilateral (F3 / F4), central (C3 / C4), temporal (T3 / T4) y occipital (O1 / O2), así como tres líneas medias (Fz, Cz, Pz), y los electrodos de referencia y tierra se colocaron en el ápice de la nariz y el cuello, respectivamente (20) (Figura 1). Los EEG se midieron con una unidad de EEG digital (NeurofaxEEG-1200, Nihon Kohden, Japón) bajo los siguientes parámetros: frecuencia de muestreo, 1.000 Hz; sensibilidad, 5–10 μV/mm; constante de tiempo, 0.1–0.3 s; Filtro Hi-cut, 60 Hz; y tiempo total de grabación, 20–30 min. El electrocardiograma se monitorizó simultáneamente utilizando electrocardiogramas bipolares en la misma unidad de EEG.®
 Figura 1. Colocación de electrodos vista desde la cara dorsal de un gato. Los electrodos de registro son frontales bilaterales (F3/F4), centrales (C3/C4), temporales (T3/T4), occipitales (O1/O2) y 3 longitudinales de línea media (Fz, Cz, Pz) indicados en azul claro. El electrodo de referencia (R) se colocó en la superficie dorsal de la punta nasal, indicada en naranja, y el electrodo de tierra (E) se colocó al nivel de la apófisis espinosa axial, indicada en verde.
Figura 1. Colocación de electrodos vista desde la cara dorsal de un gato. Los electrodos de registro son frontales bilaterales (F3/F4), centrales (C3/C4), temporales (T3/T4), occipitales (O1/O2) y 3 longitudinales de línea media (Fz, Cz, Pz) indicados en azul claro. El electrodo de referencia (R) se colocó en la superficie dorsal de la punta nasal, indicada en naranja, y el electrodo de tierra (E) se colocó al nivel de la apófisis espinosa axial, indicada en verde.
2.2.3. Análisis visual del EEG
En el presente estudio, definimos y usamos «incidencia» como «la tasa de ocurrencia» y «frecuencia» como «Hz».
El montaje de EEG grabado se estableció para hacer referencia a la derivación y la derivación bipolar, incluida la derivación de referencia promedio. Los períodos estables registrados se seleccionaron al azar y se evaluaron durante un total de 5-10 minutos para evaluar la incidencia de IED por minuto. Un veterinario (SM) entrenado en lectura de EEG contó los IED. Si los períodos estables registrados fueron inferiores a 5 min, se excluyeron del análisis. Si se produjo una convulsión antes de que se pudiera registrar suficiente EEG, la evaluación de los IED en las mediciones del EEG bajo sedación KET se realizó después de que la convulsión hubiera terminado. Se contaron los IED que incluían picos, polipicos, picos y ondas y ondas agudas y se identificaron las regiones con la mayor incidencia de IED. Cuando un IED estaba completamente sincronizado en todas las derivaciones, se contaba como uno para todas las regiones. Se calculó la incidencia de IED (IED/min) en cada grupo, y se registró la presencia o ausencia de convulsiones después de la administración del fármaco y sus detalles. Si se observaron convulsiones después de la administración de TFE, las mediciones de EEG se realizaron nuevamente otro día, y el promedio de las dos mediciones se analizó como los IED para ese individuo. La incidencia de IED en cada grupo se analizó mediante la prueba de rango con signo de Wilcoxon. Los análisis estadísticos se realizaron utilizando R versión 4.1.0 (The R Foundation for Statistical Computing, Viena, Austria). La diferencia significativa en el análisis estadístico se definió como p < 0,05.
2.3. Estudio 2: EEG con administración de ketamina después de la sedación con medetomidina
2.3.1. Protocolo de sedación y registro del EEG
Sobre la base de los resultados del estudio 1, habíamos planificado investigar la utilidad potencial de KET como activador de EEG, es decir, aumentar el IED o inducir la actividad convulsiva, en el EEG del cuero cabelludo bajo sedación MED. Se incluyeron veinticuatro gatos (números 1-18 del grupo TLE y nº 19-24 del grupo control). Todos los gatos fueron restringidos en la alimentación y el consumo durante 12 h antes de la administración de MED. El registro de EEG se inició después de que el gato fue sedado por MED intramuscular y EEG se registró durante ≥10 min (MED), luego KET se administró por vía intravenosa y EEG se registró durante otros ≥10 min (MED-KET). La dosis mediana de MED hasta que cada individuo estuvo suficientemente sedado para realizar EEG fue de 30 μg/kg (rango, 30-50). La dosis de KET fue de 1,0 mg/kg, sin embargo, para los gatos (números 2 y 18) que desarrollaron estado epiléptico en el estudio 1, la dosis se redujo a 0,25 mg/kg. Y para el gato No. 3, que no fue sedado adecuadamente después de la administración de 1,0 mg / kg KET, se administró una dosis adicional de 0,5 mg / kg. Finalmente, la dosis mediana de KET intravenoso fue de 1,0 mg/kg (rango, 0,25–1,5). Después de 20-30 min de registro de EEG después de la administración de KET, se administró una dosis adecuada de atipamezol por vía intramuscular. Las condiciones de registro del EEG fueron las mismas que las descritas en el estudio 1.
2.3.2. Análisis visual del EEG
Los montajes del EEG registrado se construyeron de la misma manera que en el estudio 1. Los registros estables obtenidos en los períodos MED y MED-KET se seleccionaron aleatoriamente y se evaluaron para cada 5-10 min para evaluar la incidencia de IED por minuto. Si el tiempo total de las grabaciones evaluables fue de <5 min después de la administración de la TFE, las grabaciones se excluyeron del análisis. Para contar los IED e identificar las regiones de mayor incidencia, se utilizaron los mismos métodos descritos en el estudio 1. La incidencia de IED entre los períodos MED y MED-KET en cada grupo se analizó mediante la prueba de rango con signo de Wilcoxon. La diferencia significativa en el análisis estadístico se definió como p < 0,05.
2.3.3. Análisis cuantitativo del EEG
El análisis cuantitativo de EEG se estableció en la derivación de referencia promedio. Tanto en el período MED como en el MED-KET, se seleccionó visualmente un período libre de artefactos de 2 s (3 o 4 partes) durante cada período de grabación, y la actividad de fondo se analizó utilizando una transformada rápida de Fourier (FFT). Las bandas espectrales fueron 0.5–4.0 Hz para la banda delta, 4.1–8.0 Hz para la banda theta, 8.1–13.0 Hz para la banda alfa y 13.1–30.0 Hz para la banda beta. La potencia relativa de las bandas espectrales se calculó para todas las derivaciones y se promedió. Analizamos cada ventaja en cada individuo utilizando la prueba de rango con signo de Wilcoxon. La diferencia significativa en el análisis estadístico se definió como p < 0,05.
3. Resultados
3.1. Estudio 1: EEG por administración exclusiva de ketamina o medetomidina
Las grabaciones de EEG se obtuvieron de los 12 gatos a los que se les administró MED solamente y se realizaron solo una vez en cada gato. Por otro lado, se obtuvieron registros de EEG de gatos con administración de KET solo para 10/12 gatos. Dos gatos fueron excluidos del análisis de EEG: No. 18 del grupo TLE experimentó una convulsión inducida por la administración de KET, que duró más de 30 minutos (es decir, se desarrolló a estado epiléptico): y la administración de KET no pudo inducir suficiente sedación en el No. 22 del grupo control.
Durante el registro del EEG con MED solo, ningún TLE o gatos sanos mostraron convulsiones. Sin embargo, cuando se administró KET solo, todos los gatos en el grupo TLE (6/6) mostraron convulsiones clínicas, por lo tanto, el EEG con KET solo se realizó dos veces en todos los gatos TLE (un total de 12 registros). Se observaron convulsiones en gatos TLE en 9 de los 12 registros (75%), 6 de los cuales progresaron a GTCS. En algunos gatos TLE (3/6 gatos, 5/12 registros), las convulsiones no terminaron en 5 min espontáneamente, por lo que se utilizaron medicamentos anticonvulsivos (diazepam, midazolam, levetiracetam) para detener la convulsión. Los signos convulsivos observados después de la administración de KET se solaparon en parte con los observados en las crisis habituales espontáneas en 5/6 gatos (Tabla 1). Por otro lado, no hubo ningún gato que mostrara convulsiones en el grupo de control.
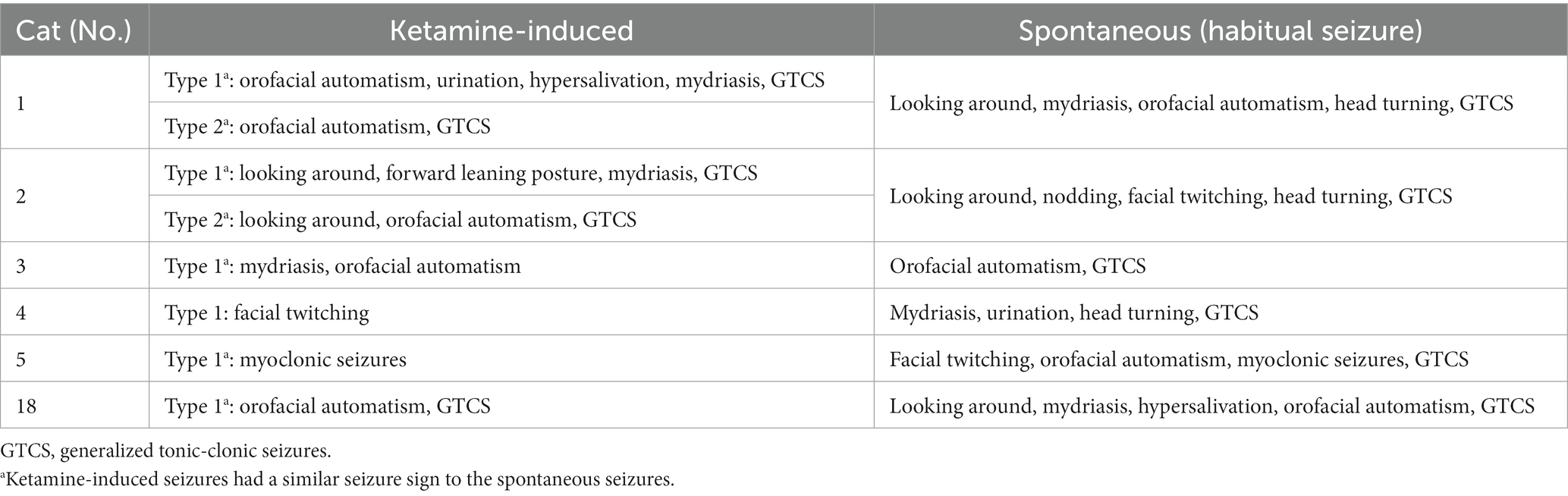 Tabla 1. Signos convulsivos observados durante la administración intramuscular de ketamina y convulsiones espontáneas en el grupo de epilepsia del lóbulo temporal.
Tabla 1. Signos convulsivos observados durante la administración intramuscular de ketamina y convulsiones espontáneas en el grupo de epilepsia del lóbulo temporal.
Después de la administración de KET, se observaron ondas lentas generalizadas de 2-4 Hz de forma intermitente en 4/5 gatos de los grupos TLE que estaban disponibles para el análisis (Figura 2). Dado que el número de ondas lentas tendía a disminuir con el tiempo, el número máximo de ondas lentas observadas en cada animal se determinó midiendo 1 minuto desde el momento en que se observaron las ondas lentas por primera vez. La incidencia media de ondas lentas en los gatos TLE fue de 26,3 ciclos/min. Esas ondas lentas intermitentes duraron de 20 a 40 minutos después de la administración de KET. Del mismo modo, se observaron ondas lentas intermitentes de 2-5 Hz en 2/5 gatos del grupo de control. Las ondas lentas se midieron de la misma manera que en el grupo TLE, la incidencia promedio de ondas lentas en el grupo control fue de 26,5 ciclos / min observados durante 20 minutos después de la administración de KET.
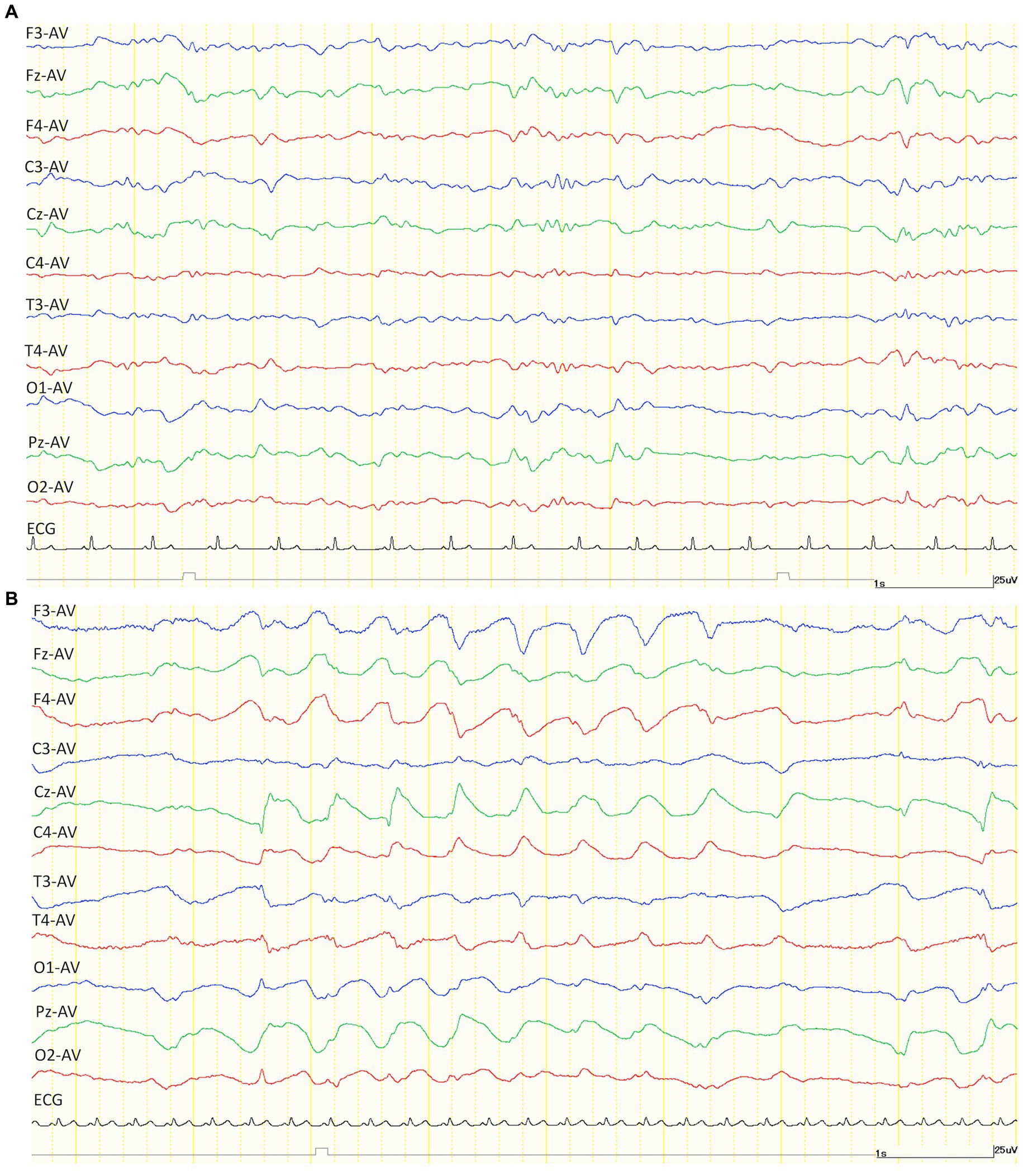 Figura 2. Ejemplos de trazas de EEG después de la administración intramuscular de medetomidina (30 μg/kg) sola (A) y ketamina (7,5 mg/kg) sola (B). En comparación con la medetomidina (A), el EEG después de la administración de ketamina mostró una onda lenta generalizada de aproximadamente 2 Hz. Ambos montajes de EEG se establecieron en derivación de referencia promedio (AV). ECG: electrocardiograma.
Figura 2. Ejemplos de trazas de EEG después de la administración intramuscular de medetomidina (30 μg/kg) sola (A) y ketamina (7,5 mg/kg) sola (B). En comparación con la medetomidina (A), el EEG después de la administración de ketamina mostró una onda lenta generalizada de aproximadamente 2 Hz. Ambos montajes de EEG se establecieron en derivación de referencia promedio (AV). ECG: electrocardiograma.
En comparación con la incidencia de IED bajo MED en cada individuo, la incidencia de IED bajo KET en el grupo TLE se activó (aumentó) en 2/5 gatos y se deprimió (disminuyó) en 3/5 gatos (KET: mediana, 0.70; rango, 0.15–2.70; rango intercuartil (IQR), 0.25–1.05 vs. MED: mediana, 1.10; rango, 0.70–2.00; IQR, 0,80–1,10). La incidencia de DEI bajo KET fue deprimida en todos los gatos del grupo control (5/5) (KET: mediana, 0,00; rango, 0,00–0,10; IQR, 0.00–0.10 vs. MED: mediana, 0.50; rango, 0,10–0,50; IQR, 0,20–0,50). No hubo diferencia significativa en la incidencia de IED entre KET y MED tanto en el TLE (p = 0,63) como en el grupo control (p = 0,06) (Figura 3). La incidencia y la región de mayor incidencia de IED se resumen en la Tabla 2. En el grupo de TLE, se compararon las regiones con mayor incidencia de IED entre KET y MED, y se encontró acuerdo en 3 de 5 casos.
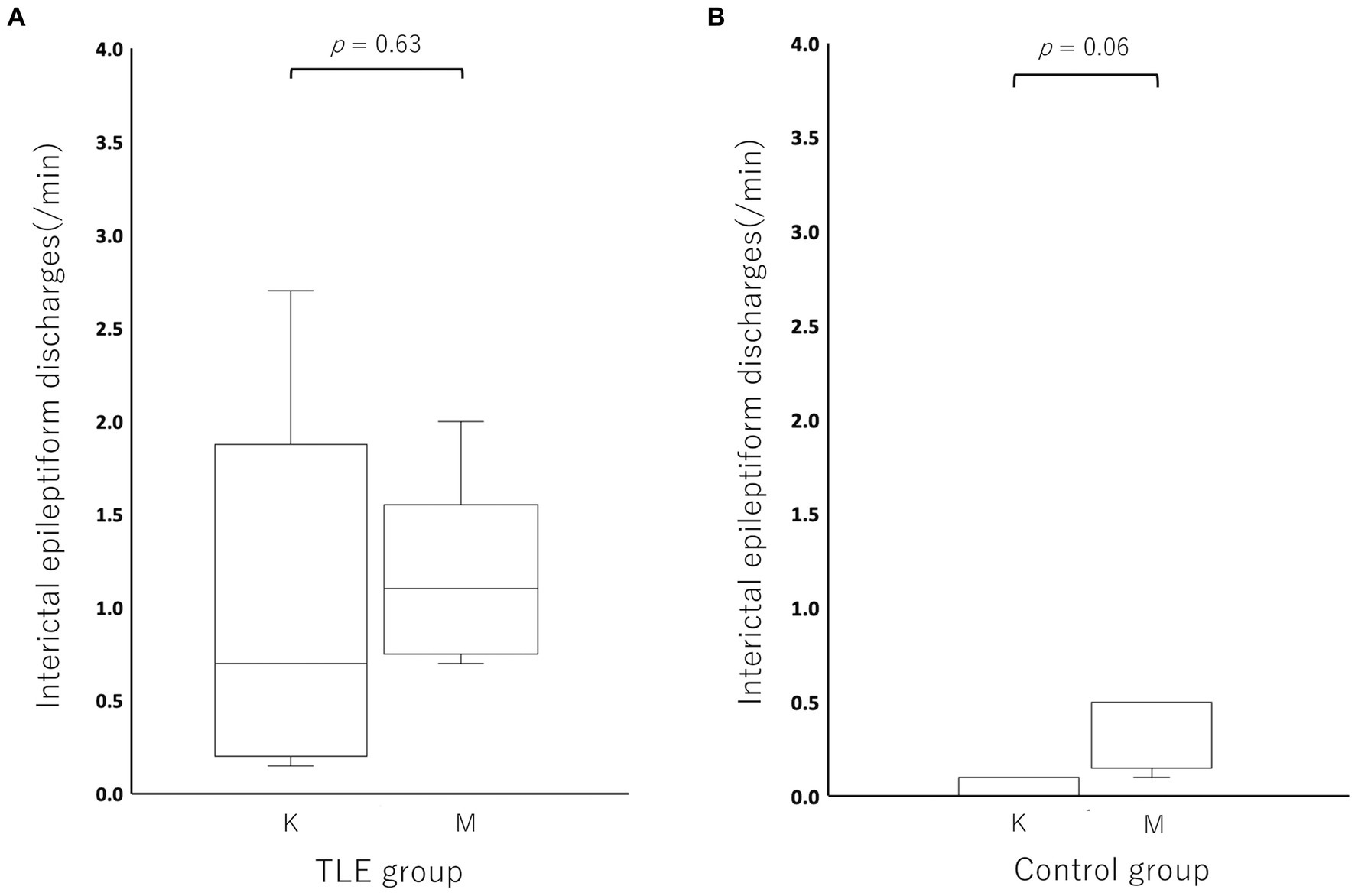 Figura 3. Diagramas de caja para comparar la incidencia de descargas epileptiformes interictales entre ketamina y medetomidina en el grupo de epilepsia del lóbulo temporal (TLE) (A) y el grupo control (B). No hubo diferencias significativas en los IED entre la ketamina y la medetomidina en el grupo de epilepsia del lóbulo temporal (p = 0,63) o en el grupo control (p = 0,06). K: ketamina; M: medetomidina.
Figura 3. Diagramas de caja para comparar la incidencia de descargas epileptiformes interictales entre ketamina y medetomidina en el grupo de epilepsia del lóbulo temporal (TLE) (A) y el grupo control (B). No hubo diferencias significativas en los IED entre la ketamina y la medetomidina en el grupo de epilepsia del lóbulo temporal (p = 0,63) o en el grupo control (p = 0,06). K: ketamina; M: medetomidina.
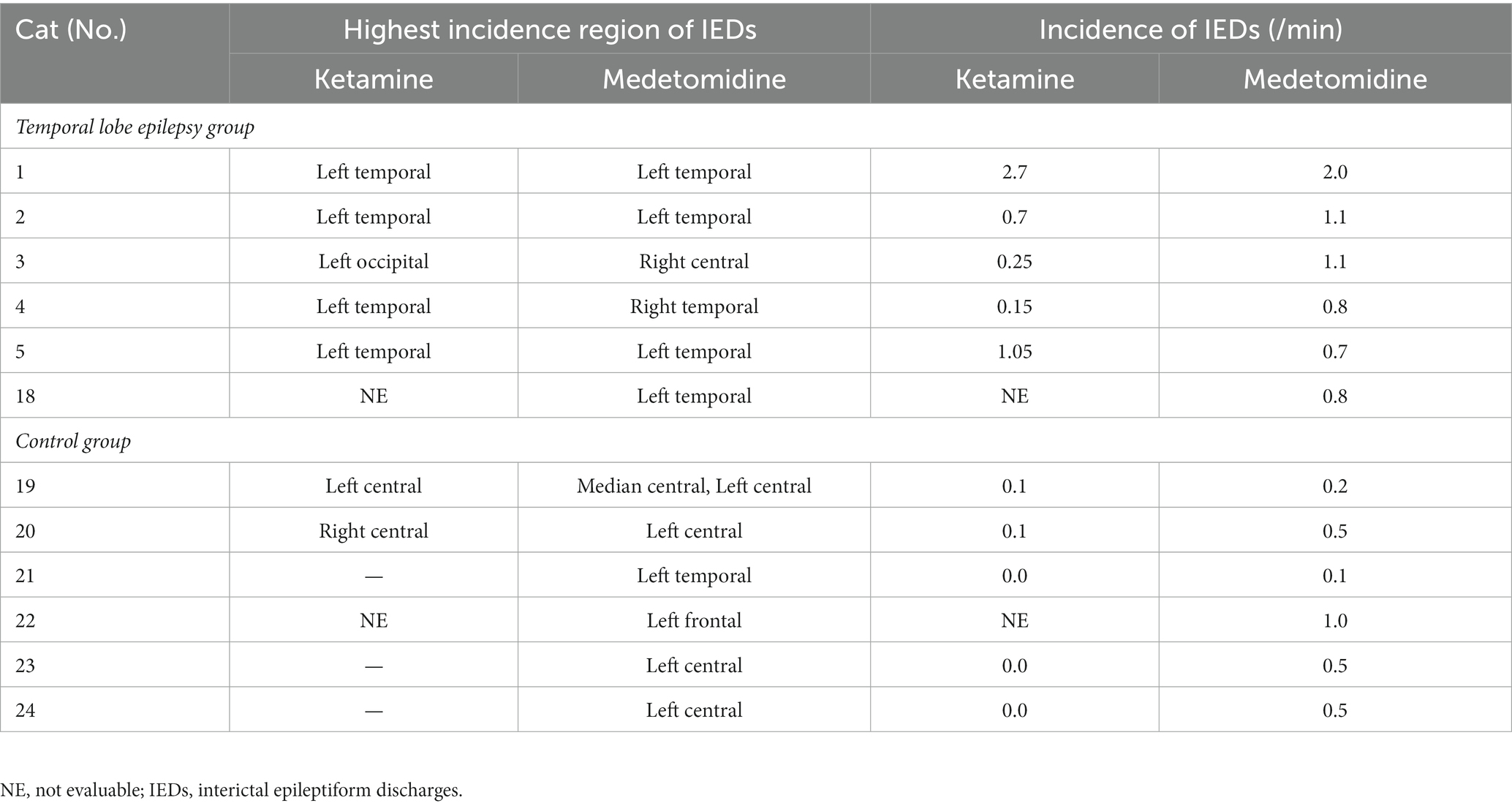 Tabla 2. La incidencia y la región de mayor incidencia de descargas epileptiformes interictales bajo ketamina o medetomidina.
Tabla 2. La incidencia y la región de mayor incidencia de descargas epileptiformes interictales bajo ketamina o medetomidina.
3.2. Estudio 2: EEG con administración de ketamina después de la sedación con medetomidina
Los registros de EEG estaban disponibles para 23/24 gatos, con un gato (No. 18 del grupo de TLE) excluido del análisis de EEG después de tener una convulsión que duró más de 30 minutos (estado epiléptico) después de la administración de KET.
Los 24 gatos no tuvieron convulsiones después de la administración de MED, mientras que tres gatos (números 1, 2 y 18) en el grupo TLE tuvieron GTCS después de la administración de KET. Además, se observó una actividad convulsiva focal subclínica en otro gato (n.º 7) del grupo de ELT (Figura 4). El sitio de esta ocurrencia de convulsiones subclínicas coincidió con la mayor incidencia de IED bajo MED y KET. De los 23 gatos que estaban disponibles para el análisis después de la administración de KET, 18 gatos tenían ondas lentas (12/16 del grupo TLE, 6/6 del grupo control). Al igual que en el estudio 1, se observaron ondas lentas generalizadas intermitentes de 1-4 Hz dentro de 1 min después de la administración de KET. Las ondas lentas tendieron a disminuir con el tiempo y se midieron de la misma manera que en el estudio 1. La incidencia promedio de ondas lentas en el grupo TLE fue de 43,8 ciclos/min, y la duración promedio fue de 9,1 min. La incidencia media de ondas lentas y la duración media en el grupo control fueron de 43,3 ciclos/min y 13,2 min, respectivamente. Los cambios en los hallazgos del EEG observados después de la administración de KET se resumen en la Tabla 3.
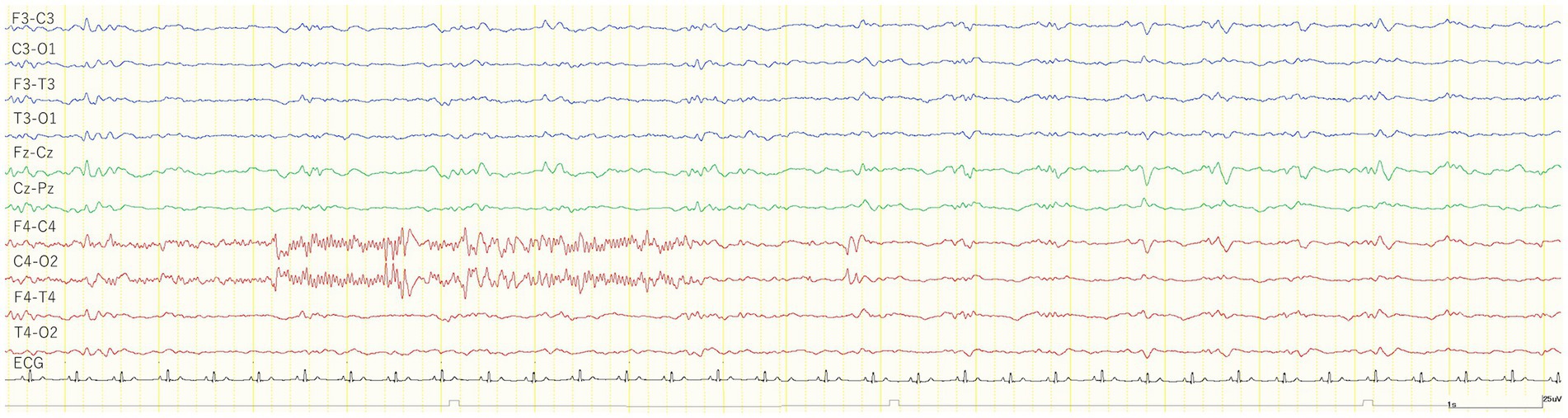 Figura 4. Rraza EEG de una convulsión subclínica observada 7 min después de la administración intravenosa de 1 mg/kg de ketamina durante la sedación con medetomidina (cat No. 7). El gato fue inmovilizado y no se observaron movimientos corporales antes y después de una convulsión subclínica. El montaje de EEG grabado se estableció en derivación bipolar. ECG: electrocardiograma.
Figura 4. Rraza EEG de una convulsión subclínica observada 7 min después de la administración intravenosa de 1 mg/kg de ketamina durante la sedación con medetomidina (cat No. 7). El gato fue inmovilizado y no se observaron movimientos corporales antes y después de una convulsión subclínica. El montaje de EEG grabado se estableció en derivación bipolar. ECG: electrocardiograma.
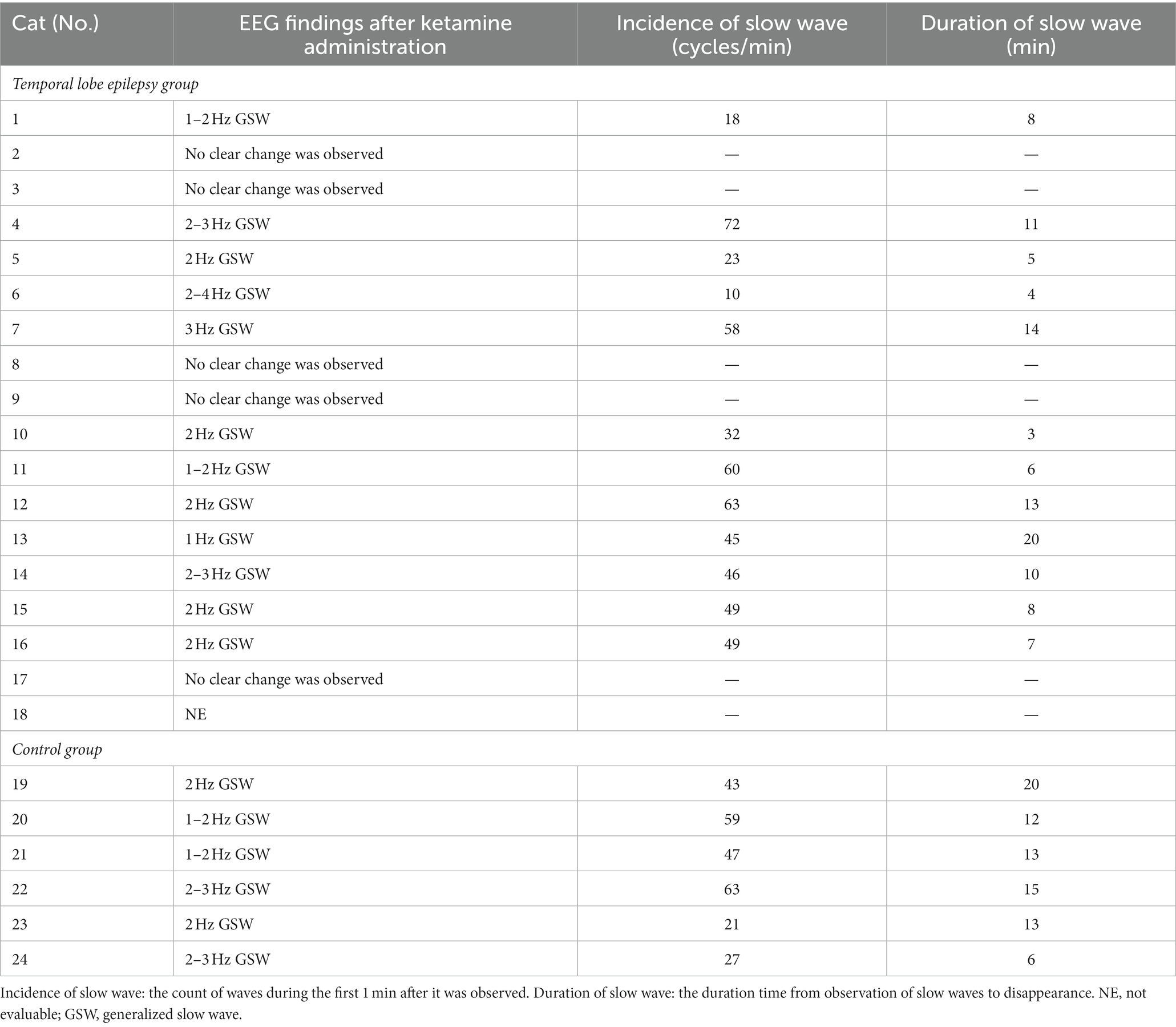 Tabla 3. Cambios en la actividad del EEG después de la administración de ketamina durante la sedación con medetomidina.
Tabla 3. Cambios en la actividad del EEG después de la administración de ketamina durante la sedación con medetomidina.
En comparación con el período MED en cada individuo, la incidencia de IED del período MED-KET en el grupo TLE se activó en 5/17 gatos, deprimida en 9/17 gatos y sin cambios en 3/17 gatos (MED: mediana, 0.80; rango, 0.10–3.60; IQR, 0,50–1,10 vs. MED-KET: mediana, 0,80; rango, 0,10–2,60; IQR, 0,20–1,30). En el grupo control, la incidencia de IED se activó en 4/6 gatos, se deprimió en 1/6 de gatos y se mantuvo sin cambios en 1/6 de gatos (MED: mediana, 0.10; rango, 0.00–1.20; IQR, 0,03–0,18 vs. MED-KET: mediana, 0,30; rango, 0.00–1.00; IQR, 0,13–0,40). No hubo diferencias significativas en la incidencia de DEI entre MED y MED-KET independientemente del grupo (grupo TLE, p = 0,53; grupo control, p = 0,25) (Figura 5). La incidencia y la región de mayor incidencia de IED se resumen en la Tabla 4. En el grupo de TLE, se observó concordancia de las regiones de mayor incidencia de DEI entre MED y MED-KET en 10 de 17 casos.
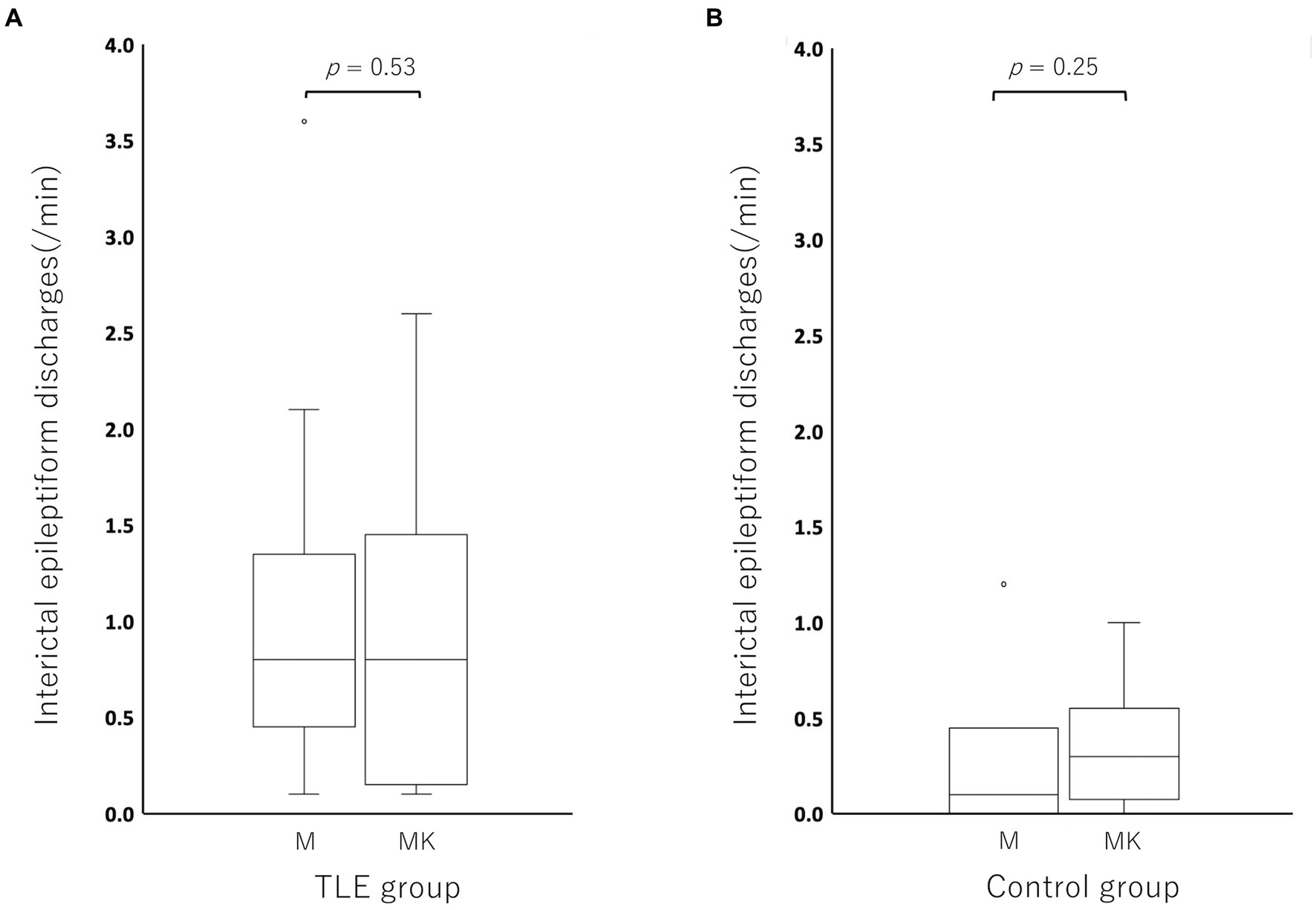 Figura 5. Diagramas de caja para comparar la incidencia de secreción epileptiforme interictal (DEI) entre medetomidina y ketamina después de la medetomidina en el grupo de epilepsia del lóbulo temporal (TLE) (A) y el grupo control (B). Los círculos en la parte superior del cuadro representan valores atípicos. No hubo diferencias significativas entre la medetomidina sola y la ketamina después de la medetomidina en el grupo de TLE (p = 0,52) o en el grupo control (p = 0,25). M: medetomidina; MK: administración de ketamina después de la sedación con medetomidina.
Figura 5. Diagramas de caja para comparar la incidencia de secreción epileptiforme interictal (DEI) entre medetomidina y ketamina después de la medetomidina en el grupo de epilepsia del lóbulo temporal (TLE) (A) y el grupo control (B). Los círculos en la parte superior del cuadro representan valores atípicos. No hubo diferencias significativas entre la medetomidina sola y la ketamina después de la medetomidina en el grupo de TLE (p = 0,52) o en el grupo control (p = 0,25). M: medetomidina; MK: administración de ketamina después de la sedación con medetomidina.
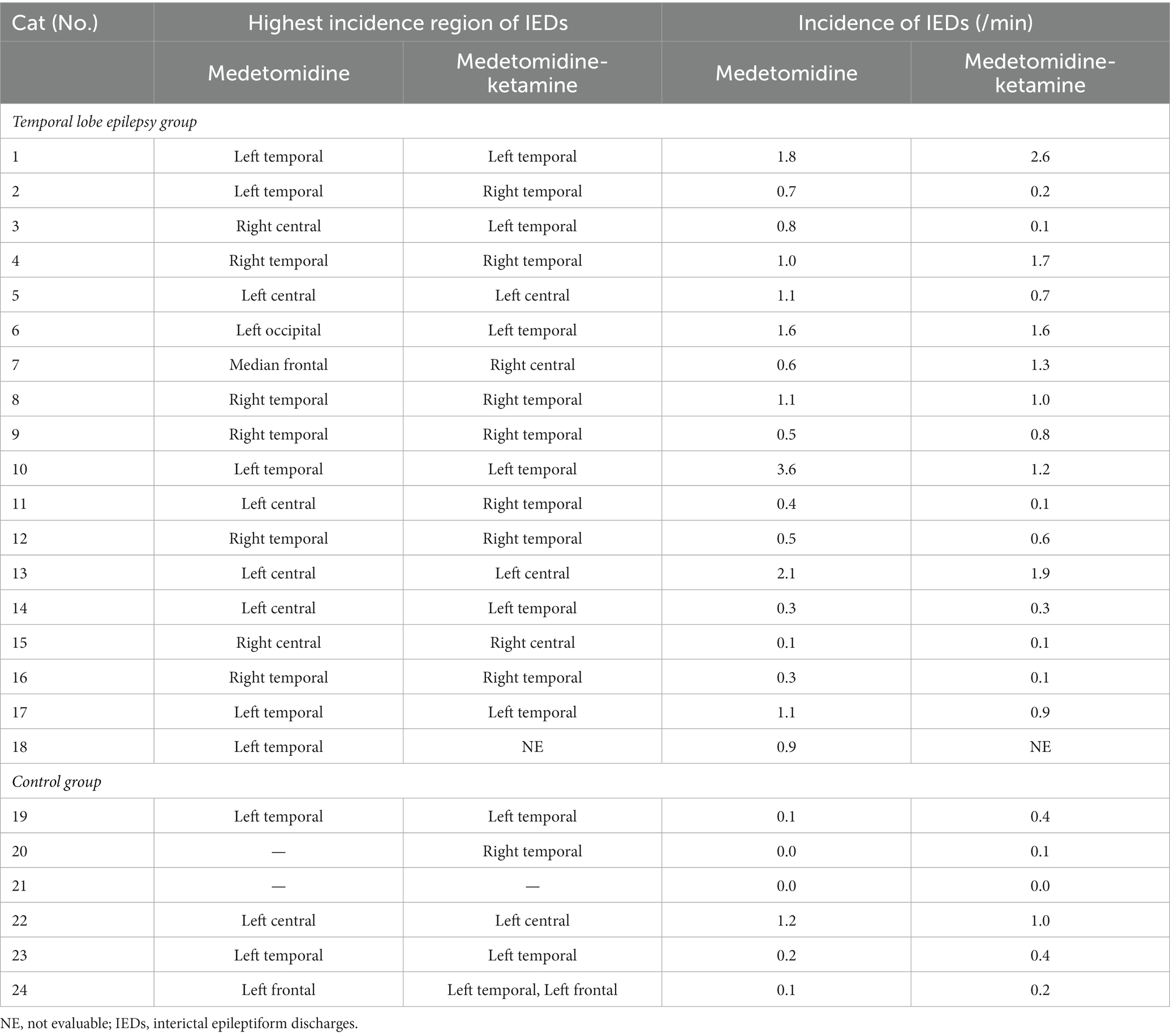 Tabla 4. La incidencia y la región de mayor incidencia de descargas epileptiformes interictales bajo medetomidina sola y ketamina después de la medetomidina.
Tabla 4. La incidencia y la región de mayor incidencia de descargas epileptiformes interictales bajo medetomidina sola y ketamina después de la medetomidina.
Para el análisis cuantitativo, se incluyeron 17 gatos del grupo TLE y 6 gatos del grupo control. El gato No. 18 fue excluido del análisis porque no se pudo registrar suficiente actividad EEG debido a la actividad convulsiva. En ambos grupos, hubo una tendencia hacia el aumento de la actividad delta después de la administración de KET cuando se comparó la potencia relativa mediana (Figura 6). Se observaron diferencias significativas entre MED y MED-KET en todos los sitios, excepto para la banda theta de C3 y la beta de F3, Fz, F4 y C4 en el grupo de TLE, y la theta de F3 y beta de F3 y C4 en el grupo control (Tabla complementaria 2).
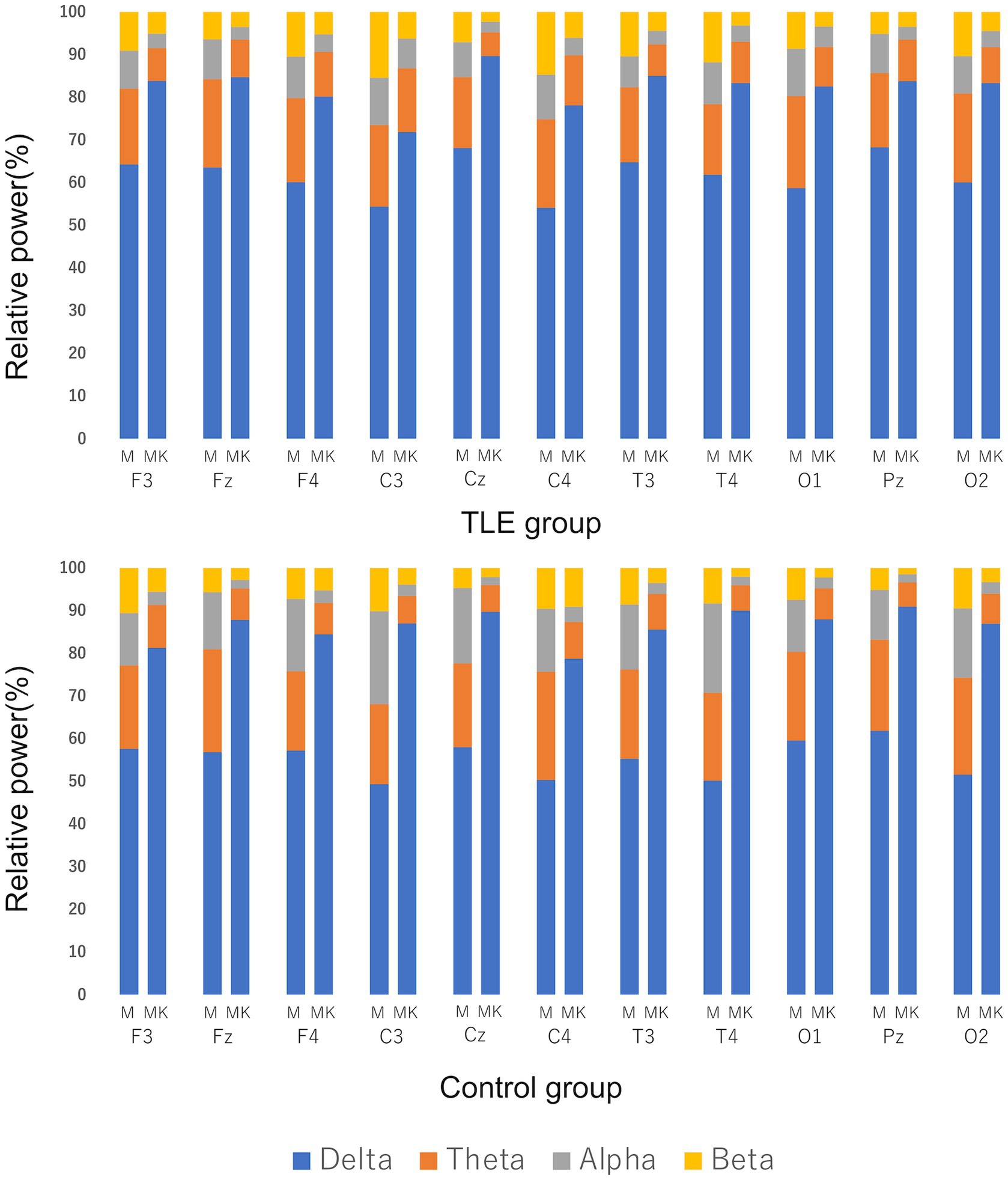 Figura 6. Comparación de la potencia relativa mediana utilizando registros EEG de medetomidina sola (M) y ketamina después de medetomidina (MK). La potencia relativa se definió como banda delta (0.5–4.0 Hz), banda theta (4.1–8.0 Hz), banda alfa (8.1–13.0 Hz) y banda beta (13.1–30.0 Hz). Las líneas verticales indican el porcentaje de la potencia relativa durante M y MK en cada sitio. Hubo un claro aumento en el porcentaje de bandas delta tanto en el grupo de epilepsia del lóbulo temporal (TLE) como en el grupo control.
Figura 6. Comparación de la potencia relativa mediana utilizando registros EEG de medetomidina sola (M) y ketamina después de medetomidina (MK). La potencia relativa se definió como banda delta (0.5–4.0 Hz), banda theta (4.1–8.0 Hz), banda alfa (8.1–13.0 Hz) y banda beta (13.1–30.0 Hz). Las líneas verticales indican el porcentaje de la potencia relativa durante M y MK en cada sitio. Hubo un claro aumento en el porcentaje de bandas delta tanto en el grupo de epilepsia del lóbulo temporal (TLE) como en el grupo control.
4. Discusión
En este estudio, investigamos los efectos de la KET intramuscular sola o la KET intravenosa bajo sedación MED sobre el EEG del cuero cabelludo en gatos sanos y gatos con TLE. No hubo diferencias significativas en la incidencia de IED entre MED y KET ni entre MED y MED-KET. En un informe anterior, KET suprimió las convulsiones focales en 6 de 16 gatos con foco epileptogénico producido por la penicilina, y no afectó a los IED en 10 gatos (4). Por otro lado, los estudios que utilizan KET en babuinos han reportado una activación generalizada de IED en el EEG del cuero cabelludo (28). En el presente estudio, la incidencia de IED tendió a ser deprimida tanto por KET solo como por MED-KET tanto en el grupo control como en el de TLE. Teniendo en cuenta el estudio previo de que KET suprimió el sistema corticotalámico y activó el sistema límbico (1), la tendencia en la disminución de la incidencia de IED en el presente estudio puede sugerir que KET tiene un efecto inhibitorio sobre el sistema corticotalámico en gatos. Aunque no hubo diferencias estadísticamente significativas para apoyar estas tendencias en el presente análisis, un factor puede ser la exclusión de los individuos que no tenían suficientes registros de EEG, especialmente con respecto a la administración de KET solo.
En el grupo de TLE, se observaron convulsiones clínicas en todos los gatos después de la administración de KET solo. La convulsión inducida por TFE en 5 de 6 gatos TLE fue similar a sus convulsiones habituales, es decir, convulsiones límbicas a la generalización (ver Tabla 1 para más detalles). Además, se observó una convulsión subclínica en un gato TLE (nº 7) después de la administración de KET después de la sedación MED, cuyo inicio coincidió con las regiones con mayor incidencia de IED. Aunque el mecanismo por el cual KET induce convulsiones no ha sido dilucidado, estos hechos sugieren que KET activó el sistema límbico, que es la zona epileptogénica de los gatos TLE en este estudio. Además, los tres gatos (números 1, 2 y 18) que tuvieron convulsiones clínicas inducidas por KET en ambos estudios tuvieron una mayor frecuencia de convulsiones (12, 19 y 14 por año, respectivamente) que los demás. Por lo tanto, si la zona epileptogénica se activa con la administración de KET puede depender de la frecuencia de las convulsiones.
En el ser humano adulto, se informa que la tasa de detección de descargas epilépticas es de aproximadamente el 50% en el examen inicial y aumenta a aproximadamente 80%-90% con pruebas repetidas (29). Sin embargo, a diferencia de los humanos, el EEG en gatos siempre requiere inmovilización con sedantes o anestésicos, y pocos EEG se repiten. Además, un sistema de EEG ambulatorio recientemente desarrollado para perros y humanos puede no ser adoptado para gatos debido a la naturaleza de los felinos y el tamaño y peso del equipo. En esta situación, capturar el inicio de las convulsiones clínicas durante un solo EEG del cuero cabelludo a menudo es difícil, dependiendo de la frecuencia de las convulsiones del individuo. Un informe anterior sugirió que las dosis bajas de KET pueden reducir los umbrales de convulsiones a los pocos minutos de la administración en personas con predisposición a la epilepsia focal (30). Teniendo en cuenta que pudimos capturar las convulsiones después de la administración de KET en comparación con MED sola en el presente estudio, la administración de KET puede ser útil para determinar la zona epileptogénica.
Tanto en los estudios de administración de KET sola (estudio 1) como de administración de KET después de MED (estudio 2), se observó la onda lenta generalizada tanto en el grupo TLE como en el de control. El análisis cuantitativo mostró que la banda delta en la actividad de fondo tanto en los grupos TLE como en los de control aumentó significativamente, mientras que otras bandas disminuyeron significativamente en la mayoría de las áreas. En un estudio con gatos, se informó que los cambios en el electrocorticógrafo durante la administración de KET bajo anestesia general con éter ocurrieron de manera dependiente de la dosis, con dosis inferiores a 5 mg/kg que causaron actividad beta generalizada y dosis superiores a 5 mg/kg que causaron ráfagas alternas de ondas lentas de polipico y ondas beta sincrónicas de alto potencial (4). En humanos, se informó que dosis bajas de KET causaron que el EEG mostrara oscilaciones rápidas en la beta alta y gamma baja, y que las oscilaciones lentas exhibidas por KET fueron más irregulares que las oscilaciones lentas causadas por propofol y dexmedetomidina (31). Ese informe también sugirió que las oscilaciones beta y gamma fueron causadas por la preferencia de la TFE por los receptores NMDA en las interneuronas inhibitorias, lo que, a su vez, aumentó la tasa metabólica cerebral, el flujo sanguíneo cerebral y las alucinaciones (31). Sin embargo, en el presente estudio, no observamos oscilaciones beta y, en el análisis cuantitativo del estudio 2, las oscilaciones beta se redujeron claramente y se observó una desaceleración generalizada visualmente reconocible (2-5 Hz) en muchos gatos después de la administración de KET. Las ondas lentas observadas en el estudio 1 pueden deberse a la inhibición cortical por KET, y la falta de oscilaciones rápidas como se informó en el pasado (bajo anestesia) puede deberse a una inmovilización insuficiente por KET solo, lo que puede haber enmascarado estas oscilaciones rápidas. La razón por la cual las oscilaciones beta se redujeron en el estudio 2 y se observaron ondas lentas en más individuos que en el estudio 1 (6/10 vs. 18/22) puede deberse a la inhibición cortical por KET y la preadministración de MED. La actividad de alto voltaje y baja frecuencia expresada como ritmos delta y theta se ha reportado como actividad de fondo inducida por MED en gatos (9). Además, se ha informado que la administración intraperitoneal de MED y KET en ratas aumenta las bandas de baja frecuencia con solo cambios menores en las bandas de alta frecuencia (32). Se ha informado que la actividad de banda de mayor frecuencia inducida por la TFE está asociada con un aumento de la tasa metabólica cerebral y el flujo sanguíneo cerebral al inhibir los receptores NMDA, como se describió anteriormente, mientras que se ha informado que el agonista alfa-2 (MED) disminuye el flujo sanguíneo cerebral (33). Por lo tanto, las oscilaciones rápidas en la beta alta y gamma baja pueden haber sido suprimidas en el presente estudio.
En estudios previos en gatos normales o modelos experimentales felinos que recibieron TFE, se administró KET bajo anestesia y se investigaron los cambios en el EEG (4, 5, 23-26). Uno de estos informes evaluó el efecto de KET sobre los IED en el modelo de convulsiones inducidas por penicilina de gatos; sin embargo, no se ha realizado una evaluación cuantitativa (4). Otro estudio informó que 5 de 22 (23%) gatos sanos a los que se administró una dosis anestésica de KET (20 mg / kg IM) mostraron convulsiones límbicas que evolucionaron a GTCS (23). Sin embargo, hasta donde sabemos, no hay ningún informe de administración de KET en gatos con TLE natural hasta el momento. En el presente estudio, utilizamos gatos con TLE natural para evaluar la actividad de fondo, la presencia de actividad convulsiva y la cantidad cuantitativa de IED bajo sedación inducida por KET. Consideramos que los resultados del presente estudio proporcionan una consideración importante para el uso de KET en gatos en el entorno clínico veterinario.
Reconocemos que hay varias limitaciones para el presente estudio. En primer lugar, en la comparación de los IED entre KET y MED, la mayoría de los recuentos de IED para KET en el grupo TLE se realizaron en mediciones de EEG post-ictal debido a una convulsión inducida inmediatamente después de la administración de KET. Se sabe que la supresión generalizada postictal del EEG (PGES) ocurre inmediatamente después de un ataque epiléptico (34). Los PGES generalmente se observan con mayor frecuencia en las convulsiones convulsivas que en las convulsiones focales, pero los informes sobre la frecuencia de ocurrencia y la duración son muy inconsistentes (35). Por lo tanto, PGES puede haber ocurrido después de convulsiones inducidas por TFE y redujo el número de IED en el presente estudio. En segundo lugar, se consideró la variación de la dosis de los agentes para obtener suficiente sedación para el registro de EEG como una posible razón de la variabilidad en los resultados de este estudio. Aunque KET puede producir cambios de EEG dependientes de la dosis como se mencionó anteriormente (4), la dosis de KET sola en este estudio estaba en el límite superior de una dosis de sedación típica porque estaba destinada a sedar lo suficiente para medir el EEG y evitar la depresión respiratoria. Por lo tanto, la gran variabilidad de la dosis entre los individuos puede haber afectado particularmente el análisis. Debido a las diferencias individuales en los efectos sedantes, la administración de KET sola puede resultar en un retraso de tiempo o sedación inadecuada antes de que se pueda realizar una medición de EEG. Si el lapso de tiempo entre la administración y la medición del EEG fue significativo, es posible que se haya pasado por alto una convulsión subclínica. Para confirmar los efectos agudos de KET inmediatamente después de la administración, como en este estudio, puede ser necesaria la administración simultánea de un sedante como MED. Alternativamente, se debe considerar el EEG bajo intubación, dada la posibilidad de depresión respiratoria. Cuando se administró una dosis anestésica de KET, esperábamos que se observaran las ráfagas reportadas de ondas lentas de polipico (es decir, bandas beta y delta elevadas) (4). Sin embargo, en los últimos años, sugirió que la administración de KET bajo control respiratorio apropiado podría suprimir la actividad del EEG (36). Por lo tanto, si se realiza un manejo respiratorio adecuado después de la administración de TFE, se puede observar una alteración notable en el espectro de potencia. Es necesario realizar más investigaciones sobre el efecto dosis-dependiente del KET sobre el EEG. En tercer lugar, el hecho de que muchos gatos incluidos en el presente estudio fueran mayores y que hubiera una amplia variación en la frecuencia de las convulsiones antes de la inclusión puede haber contribuido a la variabilidad en los resultados. Un estudio de EEG con dos grupos de gatos divididos según la edad bajo sedación con MED informó que los gatos mayores tenían un poder relativo significativamente mayor en las bandas theta, alfa y beta y más bajo en la banda delta que los gatos más jóvenes (9). Por lo tanto, en nuestro estudio MED-KET, el aumento significativo en la banda delta podría haber sido más pronunciado en nuestros gatos mayores que en una población de gatos jóvenes.
En el presente estudio, la MED produjo una sedación más estable que la KET sola en gatos con TLE, y las mediciones de EEG fueron factibles. Además, KET es fácil de inducir convulsiones en gatos con TLE. Por lo tanto, el KET de un solo uso como sedante para EEG no se recomienda a partir de los resultados de este estudio. Sin embargo, se sugiere que la EET puede ser útil para activar las actividades convulsivas en el EEG bajo sedación MED. Esta será una herramienta crítica para obtener EEG ictal para detectar la zona epileptogénica (zonas irritativas o de inicio convulsivo). Aunque la combinación de MED y KET se ha utilizado durante mucho tiempo como inducción anestésica en medicina veterinaria (11), se necesitará precaución para pacientes felinos con antecedentes de convulsiones. Recientemente, KET ha recibido una atención creciente en el manejo de RSE (2). Sin embargo, nuestros resultados enfatizan que «No use ketamina como primera línea para el tratamiento del estado epiléptico (o manejo de las convulsiones)» y «use ketamina después de la confirmación del estado epiléptico GABAérgico / resistente a las benzodiazepinas (refractario)». Si KET es un medicamento anticonvulsivo o proconvulsivo, los resultados actuales indican que KET tiene una característica proconvulsiva para gatos interictales con TLE y / o alta frecuencia de convulsiones.
Declaración de disponibilidad de datos
Los datos brutos que apoyan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Este estudio, que incluye el cuidado y mantenimiento de la colonia FSEC, gatos sanos y epilépticos genéticamente no relacionados con los FSEC, fue revisado y aprobado por el Comité de Cuidado y Uso de Animales de la Universidad Veterinaria y de Ciencias de la Vida de la Nippon (números de acceso 2020K-3, 2021K-2, 2022K-2; el investigador principal es DH).
Contribuciones del autor
SM, RA y DH diseñaron este estudio. SM y RA realizaron experimentos, adquisición de datos y análisis. SM escribió el borrador del manuscrito y realizó estadísticas. SM e YY realizaron la visualización de datos. YH, YY y DH realizaron la edición del borrador. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este estudio fue parcialmente apoyado por el Fondo de Promoción de la Investigación Científica (números de subvención 2022-16 y 2023-18) de la Corporación de Promoción y Ayuda Mutua para la Escuela Privada de Japón (PMAC).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1236275/full#supplementary-material
Referencias
1. Corssen, G, Miyasaka, M, y Domino, EF. Cambio de conceptos en el control del dolor durante la cirugía: anestesia disociativa con CI-581. Un informe de progreso. Anesth Analg. (1968) 47:746–59. doi: 10.1213/00000539-196811000-00022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Roynard, P, Bilderback, A, y Dewey, CW. Bolos de ketamina intravenosa para el tratamiento del estado epiléptico, el estado epiléptico refractario y las convulsiones en racimo: un estudio retrospectivo de 15 perros. Front Vet Sci. (2021) 8:547279. DOI: 10.3389/fvets.2021.547279
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Mccarthy, DA, Chen, G, Kaump, DH, and Ensor, C. General anestesia y otras propiedades farmacológicas de 2-(O-clorofenil)-2-metilamino ciclohexanona HCl (CI-581). J Nuevos medicamentos. (1965) 5:21–33. doi: 10.1002/j.1552-4604.1965.tb00219
4. Celesia, GG, y Chen, RC. Efectos de la ketamina en la actividad del EEG en gatos y monos. Electroencefalogr Clin Neurophysiol. (1974) 37:345–53. doi: 10.1016/0013-4694(74)90110-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Kayama, Y, e Iwata, K. El EEG, potenciales evocados y actividad de una sola unidad durante la anestesia con ketamina en gatos. Anestesiología. (1972) 36:316–28. DOI: 10.1097/00000542-197204000-00004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Pillai, J, y Sperling, MR. EEG interictal y el diagnóstico de epilepsia. Epilepsia. (2006) 1:14–22. doi: 10.1111/j.1528-1167.2006.00654.x
7. Hasegawa, D, Asada, R, Hamamoto, Y, Yu, Y, Kuwabara, T, Mizoguchi, S, et al. Resección cortical focal e hipocampectomía en un gato con epilepsia estructural resistente a los medicamentos. Front Vet Sci. (2021) 8:719455. DOI: 10.3389/FVETS.2021.719455
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Ukai, M, Hamamoto, Y, Yu, Y, Fujiwara-Igarashi, A, Fujita, M, and Hasegawa, D. Efficacy of zonisamide on interictal electroencephalography in familyl spontaneous epileptic cats. J Felino Med Surg. (2018) 20:962–7. doi: 10.1177/1098612X17740247
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Wrzosek, M, Nicpon, J, Bergamasco, L, Sammartano, F, Cizinauskas, S, and Jaggy, A. Visual and quantitative electroencephalographic analysis of healthy young and adult cats under medetomidine sedation. Veterinario J. (2009) 180:221–30. doi: 10.1016/j.tvjl.2007.11.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Soison, P, Aumarm, W, Tiraphut, B, Lekcharoensuk, C, Lusawat, A, Unnwongse, K, et al. Eficacia de la electroencefalografía del cuero cabelludo (EEG) como herramienta diagnóstica de apoyo en la epilepsia canina con dexmedetomidina. Thai J Vet Med. (2015) 45:435–42.
11. Cullen, LK. Sedación con medetomidina en perros y gatos: una revisión de su farmacología, antagonismo y dosis. H. Veterinario J. (1996) 152:519–35. DOI: 10.1016/S0007-1935(96)80005-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Siegenthaler, J, Pleyers, T, Raillard, M, Spadavecchia, C, y Levionnois, OL. Efecto de la medetomidina, dexmedetomidina, y su reversión con atipamezol sobre el reflejo de abstinencia nociceptivo en beagles. Animales. (2020) 10:1240. DOI: 10.3390/ANI10071240
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Utsugi, S, Saito, M, Sato, T, and Kunimi, M. Relationship between interictal epileptiform discharges under medetomidine sedation and clinical seizures in canine idiopathic epilepsy. Veterinario Rec. (2020) 187:67. DOI: 10.1136/VR.104947
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Krumholz, A, Wiebe, S, Gronseth, G, Shinnar, S, Levisohn, P, Ting, T, et al. Parámetro de práctica: evaluación de una aparente primera convulsión no provocada en adultos (una revisión basada en la evidencia): informe del subcomité de estándares de calidad de la Academia Americana de Neurología y la Sociedad Americana de Epilepsia. Neurología. (2007) 69:1996–2007. doi: 10.1212/01.wnl.0000285084.93652.43
15. Kuwabara, T, Hasegawa, D, Ogawa, F, Kobayashi, M, Fujita, M, Suzuki, H, et al. Un felino epiléptico espontáneo familiar cepa un nuevo modelo de epilepsia idiopática / genética. Epilepsia Res. (2010) 92:85–8. doi: 10.1016/j.eplepsyres.2010.08.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Hamamoto, Y, Hasegawa, D, Mizoguchi, S, Yu, Y, Wada, M, Kuwabara, T, et al. Cambios en los parámetros de resonancia magnética interictal y postictal temprana y de perfusión en gatos epilépticos espontáneos familiares. Epilepsia Res. (2017) 133:76–82. doi: 10.1016/j.eplepsyres.2017.04.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Hasegawa, D, Mizoguchi, S, Kuwabara, T, Hamamoto, Y, Ogawa, F, Matsuki, N, et al. Características electroencefalográficas de gatos epilépticos espontáneos familiares. Epilepsia Res. (2014) 108:1018–25. doi: 10.1016/j.eplepsyres.2014.05.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Mizoguchi, S, Hasegawa, D, Hamamoto, Y, Yu, Y, Kuwabara, T, Fujiwara-Igarashi, A, et al. Características de la resonancia magnética de difusión interictal y perfusión de gatos con epilepsia espontánea familiar. Am J Vet Res. (2017) 78:305–10. doi: 10.2460/ajvr.78.3.305
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Mizoguchi, S, Hasegawa, D, Kuwabara, T, Hamamoto, Y, Ogawa, F, Fujiwara, A, et al. Volumetría por resonancia magnética del hipocampo en gatos epilépticos espontáneos familiares. Epilepsia Res. (2014) 108:1940–4. doi: 10.1016/j.eplepsyres.2014.09.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Yu, Y, Hasegawa, D, Hamamoto, Y, Mizoguchi, S, Kuwabara, T, Fujiwara-Igarashi, A, et al. Características neuropatológicas del hipocampo y la amígdala en gatos con epilepsia espontánea familiar. Am J Vet Res. (2018) 79:324–32. DOI: 10.2460/AJVR.79.3.324
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Hamamoto, Y, Hasegawa, D, Yu, Y, Asada, R, Mizoguchi, S, Kuwabara, T, et al. Análisis estructural estadístico de gatos epilépticos espontáneos familiares mediante morfometría basada en vóxeles. Front Vet Sci. (2018) 5:172. DOI: 10.3389/FVETS.2018.00172
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Hasegawa, D. Técnicas diagnósticas para detectar la zona epileptogénica-fisiopatológica y análisis prequirúrgico de la epilepsia en perros y gatos. Veterinario J. (2016) 215:64–75. doi: 10.1016/j.tvjl.2016.03.005
23. Gourie-Devi, M, Cherian, L, and Shankar, SK. Convulsiones en gatos inducidas por la anestesia con clorhidrato de ketamina: un informe preliminar. India J Med Res. (1983) 77:525–8.
24. Weingarten, SM. Disociación de patrones de EEG límbico y neocortical en gatos bajo anestesia con ketamina. J Neurosurg. (1972) 37:429–33. DOI: 10.3171/JNS.1972.37.4.0429
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Black, JA, Golden, GT, y Fariello, RG. Activación con ketamina de la epilepsia corticoreticular experimental. Neurología. (1980) 30:315–8. DOI: 10.1212/WNL.30.3.315
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Mori, K, Kawamata, M, Mitani, H, Yamazaki, Y, y Fujita, M. Un estudio neurofisiológico de la anestesia con ketamina en el gato. Anestesiología. (1971) 35:373–83. DOI: 10.1097/00000542-197110000-00012
27. Kitz, S, Thalhammer, JG, Glantschnigg, U, Wrzosek, M, Klang, A, Halasz, P, et al. Revisión de la literatura experimental sobre la epilepsia del lóbulo temporal felino. J Vet Pasante Med. (2017) 31:633–40. DOI: 10.1111/JVIM.14699
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Gowda, S, y Szabó, CÁ. Efectos de la ketamina en EEG en babuinos con epilepsia genética generalizada. Epilepsia Res. (2019) 154:50–4. doi: 10.1016/j.eplepsyres.2019.04.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Salinsky, M, Kanter, R, y Dasheiff, RM. Efectividad de múltiples EEG en el apoyo al diagnóstico de epilepsia: una curva operacional. Epilepsia. (1987) 28:331–4. doi: 10.1111/j.1528-1157.1987.tb03652.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Celesia, GG, Chen, RC y Bamforth, BJ. Efectos de la ketamina en la epilepsia. Neurología. (1975) 25:169–72. DOI: 10.1212/WNL.25.2.169
31. Purdon, PL, Sampson, A, Pavone, KJ y Brown, EN. Electroencefalografía clínica para anestesiólogos parte I antecedentes y firmas básicas. Anestesiología. (2015) 123:937–60. doi: 10.1097/ALN.0000000000000841
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Jang, HS, Choi, HS, Lee, SH, Jang, KH, and Lee, MG. Evaluación de los efectos anestésicos de la medetomidina y la ketamina en ratas y su reversión con atipamezol. Veterinario Anaesth Analg. (2009) 36:319–27. doi: 10.1111/j.1467-2995.2009.00463.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Karlsson, BR, Forsman, M, Roald, OK, Heier, MS y Steen, PA. Efecto de la dexmedetomidina, un agonista alfa 2 selectivo y potente, sobre el flujo sanguíneo cerebral y el consumo de oxígeno durante la anestesia con halotano en perros. Anesth Analg. (1990) 71:125–9. DOI: 10.1213/00000539-199008000-00003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Lhatoo, SD, Faulkner, HJ, Dembny, K, Trippick, K, Johnson, C, y Bird, JM. Un estudio electroclínico de casos y controles de muerte súbita inesperada en epilepsia. Ana Neurol. (2010) 68:787–96. DOI: 10.1002/ANA.22101
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Bruno, E, y Richardson, MP. Supresión generalizada del EEG postictal e inmovilidad postictal ¿qué sabemos? Disord epiléptico. (2020) 22:245–51. DOI: 10.1684/EPD.2020.1158
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Chang, LC, Raty, SR, Ortiz, J, Bailard, NS, y Mathew, SJ. El uso emergente de ketamina para la anestesia y la sedación en lesiones cerebrales traumáticas. CNS Neurosci Ther. (2013) 19:390–5. DOI: 10.1111/CNS.12077
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: EEG, felino, secreción epileptiforme interictal, ketamina, medetomidina, convulsiones, LE
Cita: Mizuno S, Asada R, Yu Y, Hamamoto Y y Hasegawa D (2023) Investigación del efecto y la disponibilidad de ketamina en la electroencefalografía en gatos con epilepsia del lóbulo temporal. Frente. Vet. Sci. 10:1236275. doi: 10.3389/fvets.2023.1236275
Recibido: 07 Junio 2023; Aprobado: 10 de julio de 2023;
Publicado: 25 julio 2023.
Editado por:
Edward (Ned) E. Patterson, Universidad de Minnesota Twin Cities, Estados Unidos
Revisado por:
Alejandra Mondino, Universidad Estatal de Carolina del Norte, Estados Unidos
Sam Long, Hospital de Referencia Veterinaria, Australia
Derechos de autor © 2023 Mizuno, Asada, Yu, Hamamoto y Hasegawa. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Daisuke Hasegawa, disk-hsgw@nvlu.ac.jp
†Direcciones actuales: Yoshihiko Yu, Mitaka, Tokio, Japón Yuji Hamamoto, Laboratorio de Cirugía de Animales de Compañía, Universidad Rakuno Gakuen, Ebetsu, Japón
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía
