La amenaza de la enfermedad hemorrágica epizoónica a rumiantes domésticos y silvestres
LA AMENAZA DE LA ENFERMEDAD HEMORRÁGICA EPIZOÓTICA A RUMIANTES DOMÉSTICOS Y SILVESTRES
Descripción del virus, transmisión y distribución mundial
La enfermedad hemorrágica epizoótica (EHD del inglés Epizootic Hemorrhagic Disease), también conocida como enfermedad hemorrágica epizoótica del ciervo, está causada por el virus RNA de la enfermedad hemorrágica epizoótica (EHDV), perteneciente al género Orbivirus. Hasta la fecha se han identificado siete serotipos diferentes que se han detectado en Norte y Sudamérica, África, Asia, Oceanía, sur de Europa y Oriente Medio, y se han aislado dos serotipos candidatos aún en estudio (Figura 1) (Allison et al., 2012; Wright et al., 2014; Jiménez-Cabello et al., 2023). La nomenclatura de los serotipos va del 1 al 2 y del 4 al 8, ya que los estudios genéticos han confirmado que el serotipo 3, descrito originalmente en Nigeria, era realmente el serotipo 1 (Anthony et al., 2009). Este patógeno de declaración obligatoria tiene un importante rango de hospedadores, siendo capaz de infectar a diferentes especies de ungulados domésticos, incluyendo principalmente ganado vacuno en el que se han observado la gran mayoría de brotes, pero también se ha observado que el virus puede infectar oveja, cabra, cerdo, alpaca y yak. Entre sus hospedadores silvestres, los cérvidos son los más afectados, aunque también afecta a otras especies rumiantes, muchas de las cuales se encuentran amenazadas en mayor o menor grado, por lo que el impacto de esta enfermedad en las poblaciones salvajes podría llegar a tener importantes repercusiones (Figura 1) (Rivera et al., 2021; Jiménez-Cabello et al., 2023).
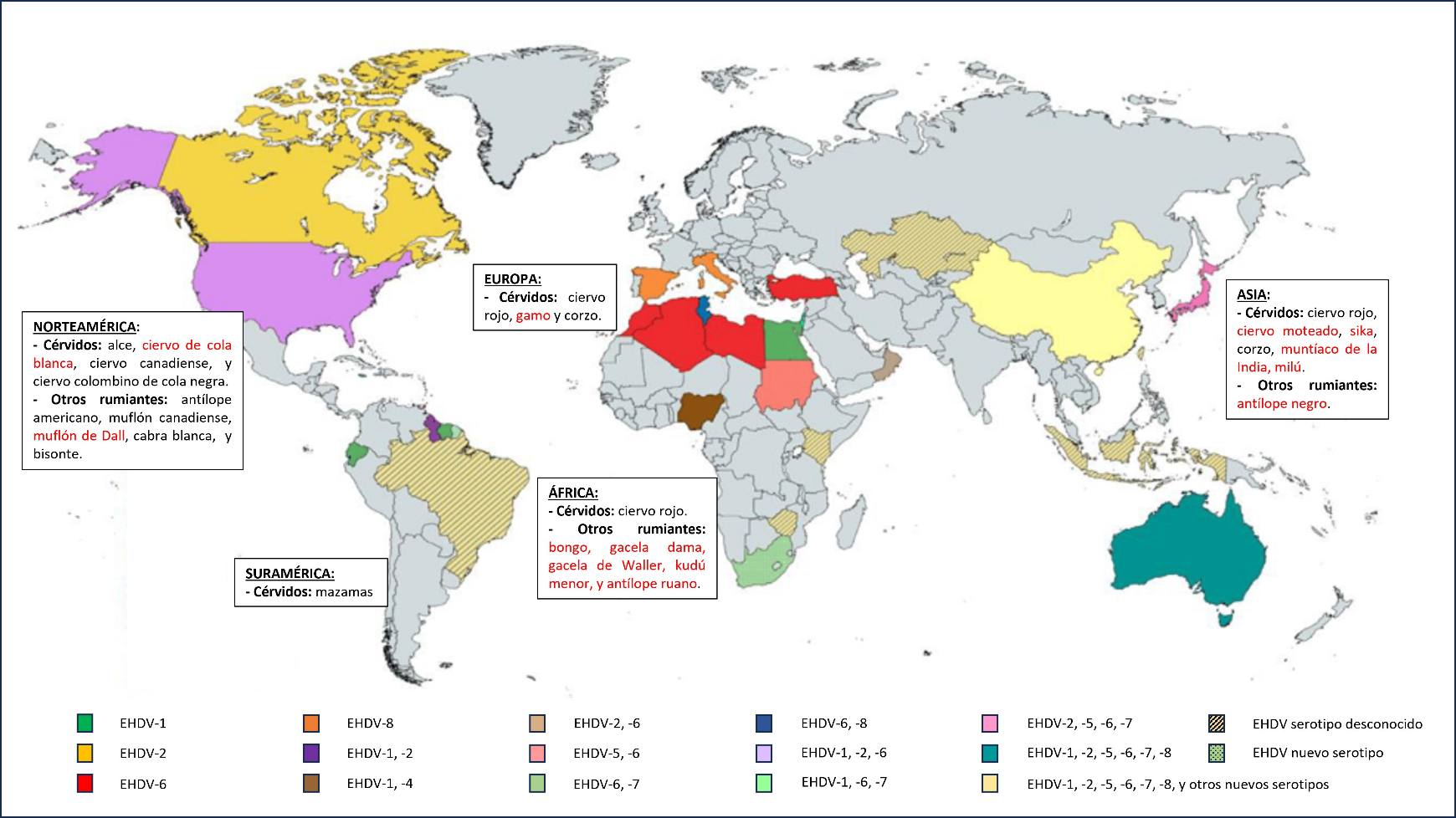 Figura 1. Distribución de los diferentes serotipos del EHDV a nivel mundial y especies silvestres afectadas descritas en cada continente. En rojo, las especies amenazadas. Adaptación de Jiménez-Cabello et al., 2023.
Figura 1. Distribución de los diferentes serotipos del EHDV a nivel mundial y especies silvestres afectadas descritas en cada continente. En rojo, las especies amenazadas. Adaptación de Jiménez-Cabello et al., 2023.
Se trata de un virus cercano filogenéticamente al virus de la lengua azul (BTV del inglés Blue Tongue Virus), estando ambos englobados en la familia Reoviridae, por lo que comparten varias similitudes, como la sintomatología. De hecho, los primeros registros de EHD datan del siglo XIX cuando se observó una enfermedad hemorrágica en cérvidos similar a la lengua azul del ganado, pero con pequeñas diferencias. En ese momento se le denominó como “síndrome o enfermedad hemorrágica del ciervo”, hasta que en 1955 cuando se describió por primera vez el EHDV en Estados Unidos, concretamente el serotipo EHDV-1, país en el que se han producido desde entonces pequeños brotes de forma periódica (Rivera et al., 2021). El primer brote importante en ganado vacuno se registró a finales de la década de los 50 en Japón, causado por el serotipo EHDV-2, que tuvo grandes repercusiones económicas en el país. Posteriormente se han ido notificando numerosos episodios repartidos por prácticamente todo el mundo, y describiendo el resto de serotipos (Figura 2) (Golender et al., 2017; Duan et al., 2022; Rivera et al., 2021; Jiménez-Cabello et al., 2023).
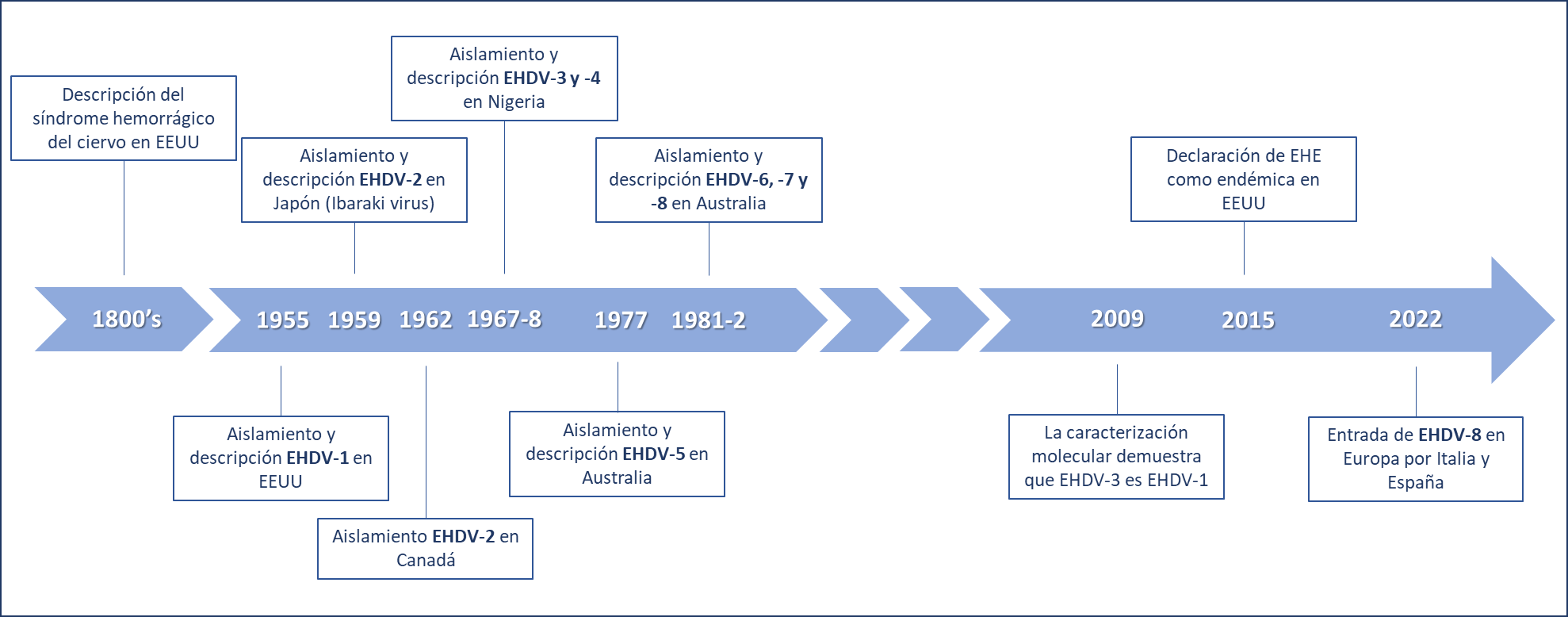 Figura 2. Distribución temporal de hitos en la descripción del EHDV.
Figura 2. Distribución temporal de hitos en la descripción del EHDV.
En lo relativo a los países de la cuenca mediterránea, antes del año 2000, había escasos informes sobre la presencia del EHDV. El primer informe se remonta a 1951 cuando en Israel se describió una enfermedad similar a la BT en ganado vacuno y ovino (Goldsmith y Komarov, 1951). La situación del EHDV en el Mediterráneo cambió después del año 2000. En 2001 se describieron casos clínicos en bovinos en Israel (Yeruham et al., 2005), identificándose al EHDV como la causa del brote, pero no se disponía de información sobre el serotipo. En 2004, se informó en Marruecos de un brote causado por EHDV-6 (cepa 318) (Albayrak et al., 2010). El mismo serotipo fue responsable de otro brote en el mismo país dos años después (OIE, 2006a). Ese mismo año, en el 2006, el EHDV-6 provocó brotes en Argelia y Túnez y un año después en Turquía (OIE, 2006b; OIE, 2006c, Temizel et al., 2009). También en 2006 se describieron casos clínicos en ganado bovino israelí (OIE, 2006d). El primer rebaño afectado se informó el 28 de agosto de 2006 y el virus se propagó desde este rebaño hacia el sur, hacia el Mar Muerto, y hacia el norte, a lo largo del valle del Jordán. En general, se informó de la enfermedad en 83 rebaños lecheros ubicados en 78 localidades rurales y en 22 rebaños de carne, la mayoría durante las primeras 8 semanas y algunos más hasta la tercera semana de noviembre. A diferencia de otros brotes en el Mediterráneo, se identificó al EHDV-7 como el serotipo responsable. Ese mismo año se describieron casos clínicos sospechosos de EHDV en Jordania. Por tanto, entre 2006 y 2007 se notificaron brotes causados por la infección por el EHDV en Argelia, Túnez, Marruecos, Israel, Jordania y Turquía. Estuvieron involucrados dos serotipos diferentes, el serotipo 6 (EHDV 318) y el serotipo 7. Ambos aislados eran patógenos y capaces de causar enfermedades en el ganado. No había información disponible sobre el posible origen de las dos cepas. A finales de los años 80 se identificó el EHDV-6 en Sudán, Bahréin y Omán, y es probable que este serotipo haya permanecido en la región hasta los recientes brotes. Por el contrario, el único lugar donde se evidenció la presencia del EHDV-7 además de Israel y Jordania es Australia. Un estudio publicado recientemente demostró que la distribución espacial del BTV en Israel es similar a la del EHD. La exposición a un virus endémico, el BTV, se puede utilizar para predecir la propagación espacial de un virus emergente, el EHDV; sin embargo, la exposición a virus endémicos está influenciada por la existencia de inmunidad colectiva. La ubicación de los brotes no puede predecirse analizando únicamente las condiciones ambientales, sino que también debe incluir la exposición al virus en años anteriores (Kedmi et al., 2011). Actualmente la EHD se considera enfermedad endémica en Estados Unidos, Australia y ciertas regiones de África y Asia. Sin embargo, Europa se ha mantenido libre de EHD hasta que en 2022 se observaron los primeros casos por EHDV-8 en Sicilia, Cerdeña y sur de España (Lorusso et al., 2023).
Al igual que el BTV, la transmisión del EHDV es principalmente a través de vectores del género Culicoides, mosquitos picadores muy presentes en regiones tropicales y templadas de todo el planeta. Además, este tipo de transmisión deriva en una marcada estacionalidad de los casos de EHD, observando el pico de mayor prevalencia entre julio y octubre (EFSA, 2009; Savini et al., 2011). No obstante, el aumento global de las temperaturas ha influido en la actividad de estos insectos, aumentando por un lado el periodo de presencia del moquito a lo largo del año, y por tanto afectando a la estacionalidad, y por otro lado favoreciendo una dispersión de Culicoides portadores del virus hacia regiones geográficas con un clima tradicionalmente más frío como Canadá o el norte de Estados Unidos, e incluso podrían llegar hasta regiones nórdicas (Allen et al., 2019; Gao et al., 2021). Por otro lado, algunos estudios demuestran la capacidad de transmisión del EHDV vía oral y fecal del EHDV-1 en ciervos de cola blanca (Gaydos et al., 2002a) o a través de contacto directo en ausencia de vectores, lo que puede llegar a ser preocupante en ganado ya que el tamaño de la cabaña aumenta el riesgo de transmisión de patógenos por estas vías, aunque no es posible determinar hasta qué punto epidemiológicamente son relevantes estas otras vías de infección (Gaydos et al., 2002). La transmisión transplacentaria se demostró mediante el aislamiento del EHDV-2 (Ibaraki) de órganos internos de fetos abortados (Ohashi et al., 1999). No se encontraron informes de aislamiento del EHDV en semen (Savini et al., 2011).
Entrada del EHV en Europa y situación actual en España
Se cree que el origen de los casos de EHDV-8 en España vino de Túnez donde ya se había informado de la presencia del mismo serotipo, el cual no se había aislado desde 1982 cuando se describió en Australia (Rivera et al., 2021; Sghaier et al., 2022). Tal y como alertaba la EFSA en su informe de 2009, la dispersión del virus a través de vectores artrópodos en las masas de aire procedentes de África es la vía de entrada principal más probable del virus a Europa, como ya ocurrió con la llegada del BTV-2 a Cerdeña (Walton and Osburn, 1992; EFSA, 2009).
Así, el 10 de noviembre del 2022 se notificó la primera detección del virus en Europa (Cerdeña) y tan solo 8 días después, el 18 de noviembre de 2022, se detectaron los primeros casos en España en ganado bovino, en las provincias de Cádiz (municipio del Campo de Gibraltar) y Sevilla (municipio El Pedroso). Fue en esta misma localidad sevillana donde se diagnosticó el primer caso de esta enfermedad en cérvidos (en España), el 23 de junio de 2023. A partir de ahí se han ido sucediendo las notificaciones de los focos en Andalucía y Extremadura hasta llegar al norte del país a principios de este mes de septiembre de 2023 (según datos del MAPA).
Actualmente, según los datos presentados en la actualización sobre la enfermedad el 11 de septiembre de 2023 por el Ministerio de Agricultura, Pesca y Alimentación, todo el territorio peninsular estaría afectado, salvo la Comunidad Autónoma de Galicia y las provincias de Barcelona, Girona y Tarragona en la Comunidad Autónoma de Cataluña. Las islas, tanto Baleares como Canarias también se mantienen libres de momento.
Signos clínicos, morbilidad y mortalidad
La EHD en rumiantes tiene una patogenia muy variable, pudiendo observar desde cuadros subclínicos hasta la muerte sobreaguda de animales infectados. Entre los factores que afectan al desarrollo y transmisión de la EHD se incluyen:
- Especie hospedadora: el EHDV afecta más a ganado vacuno, y entre los rumiantes silvestres al ciervo de cola blanca. Sin embargo, dentro de la misma especie, la raza también influye.
- Edad y estado inmunológico del hospedador. Algunos estudios sugieren que en la respuesta inmune el IFN juega un papel fundamental en la defensa frente al EHDV (Drolet et al., 2022).
- Presencia de especies vectores: los artrópodos Culicoidesse distribuyen por regiones tropicales y templadas, con especial preferencia por ambientes húmedos. Diversos estudios han demostrado la querencia de algunas especies de Culicoides por ambientes ganaderos (Elbers y Gonzales, 2023). Por otro lado, sólo las hembras son capaces de transmitir el virus ya que los machos no son hematófagos, y no todas las especies de Culicoides participan en la transmisión del virus.
- Serotipo de EHDV. Durante mucho tiempo, se creyó que, excepto el EHDV-2, el resto de serotipos de EHDV no causaban signos clínicos significativos en el ganado y, en consecuencia, se consideró la EHD como una enfermedad de menor importancia. Sin embargo, a lo largo de los años se ha informado que varios serotipos son patógenos para el ganado vacuno: EHDV-2, la cepa 318 del EHDV-6 y la cepa israelí del EHDV-7 (Savini et al., 2011). Si bien es cierto que la enfermedad provocada por otros serotipos del EDHV no suele cursar con sintomatología en rumiantes domésticos, incluso en losbrotes de Japón y Corea, que presentaron una mayor mortalidad, la mayoría de las infecciones fueron subclínicas (Kitano, 2004; Uchinuno et al., 2003). Sin embargo, es importante recordar que los animales asintomáticos o subclínicos pueden actuar como reservorios de infección y amplificar la circulación del virus.
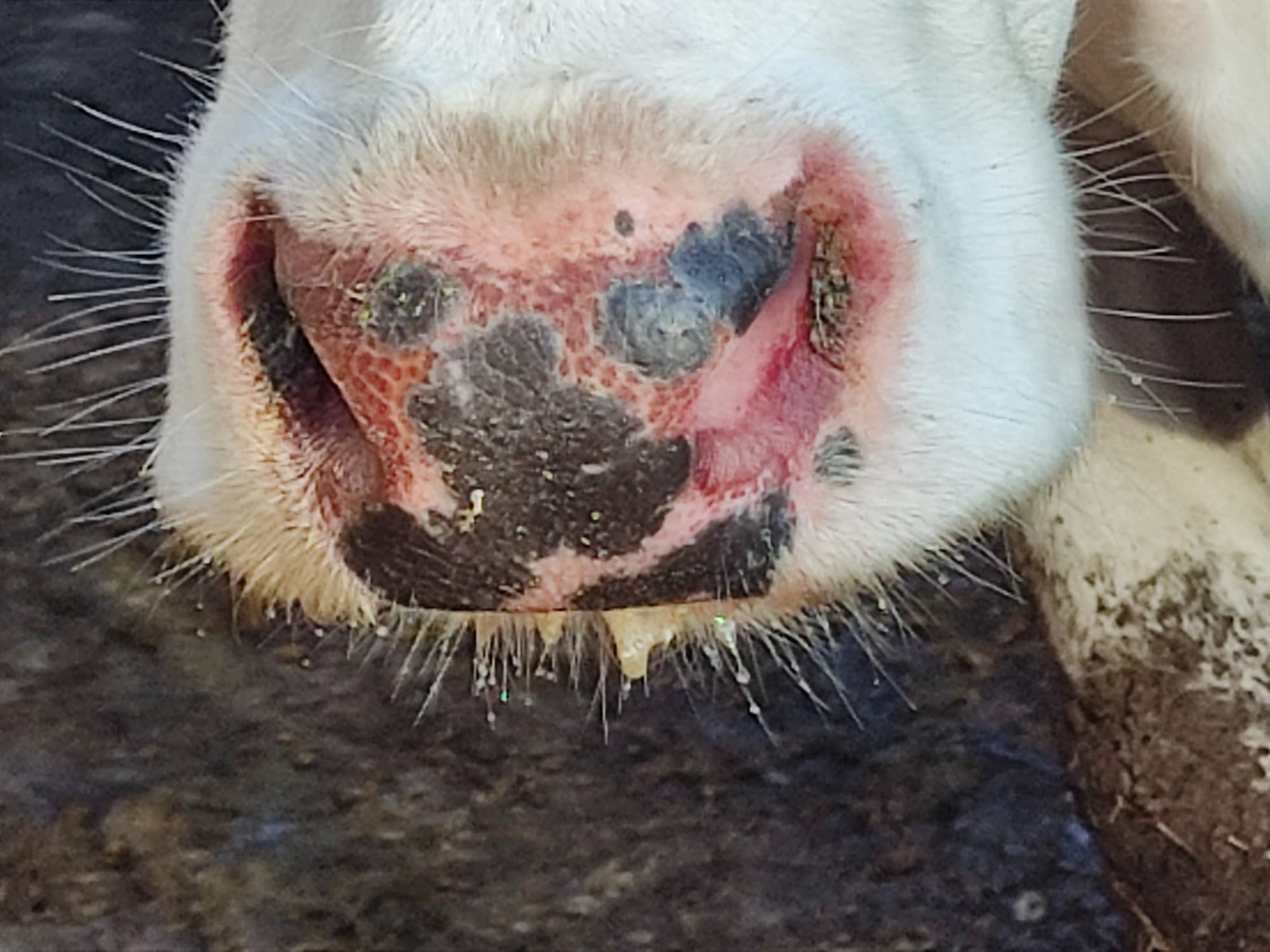
Los síntomas más frecuentes son fiebre, anorexia, conjuntivitis, secreción nasal y ocular, disnea y estomatitis ulcerosa, con enrojecimiento y descamación del hocico en mayor o menor grado (Imagen 1, 2, 3 y 4) (Yadin et al., 2008; Temizel et al., 2009). También se han observado edemas, hemorragias, erosiones y ulceraciones diferentes tejidos como piel, ubre o la pezuña (Imagen 5) (Yadin et al., 2008). En este último caso además los animales presentan una postura rígida y/o cojeras (Savini et al., 2011; Maclachlan et al., 2015). En ganado lechero, se ha observado también una fuerte reducción en la producción, observándose una alta correlación entre la seroprevalencia del EHDV y la pérdida de leche (Kedmi et al., 2010a). Los individuos más graves pueden presentar cianosis, petequias y erosiones en cavidad oral, diarrea sanguinolenta y disfagia severa, que puede derivar en una neumonía por aspiración y la muerte del individuo (Inaba, 1975, Yadin et al., 2008).

Imagen 1. estomatitis ulcerosa, con enrojecimiento y descamación del hocico en una vaca holstein de 4 años. Cedida por Jose Ángel Hernández
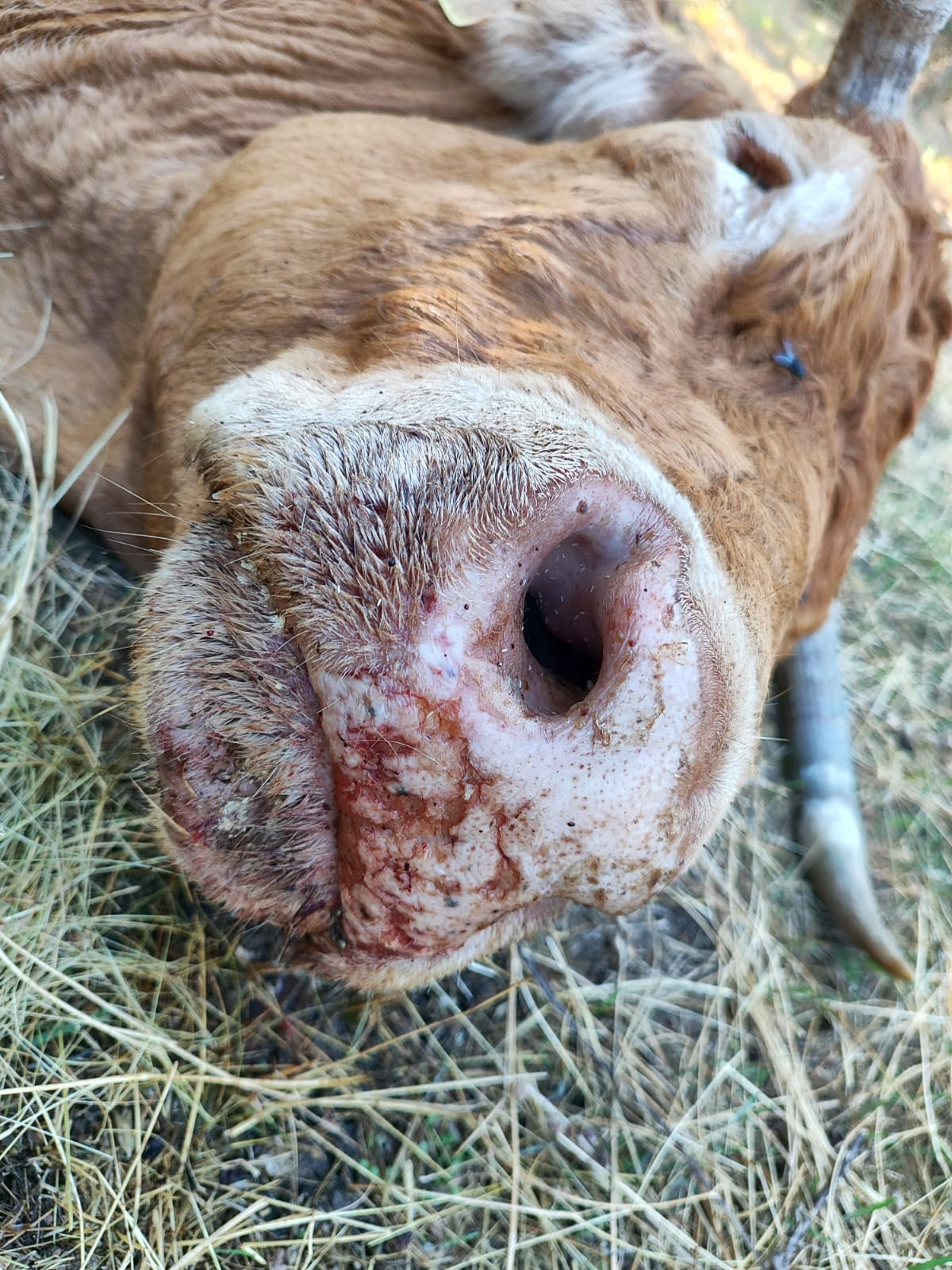 Imagen 2. Estomatitis ulcerosa con úlceras sangrantes en labios en vaca limusina. Imagen cedida por Alberto Magro
Imagen 2. Estomatitis ulcerosa con úlceras sangrantes en labios en vaca limusina. Imagen cedida por Alberto Magro
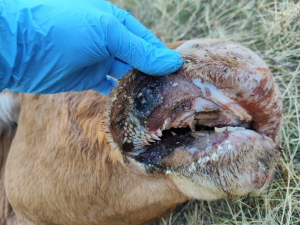
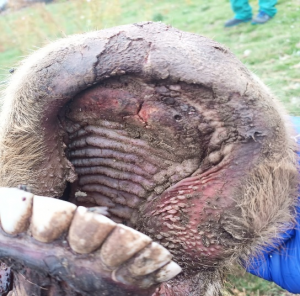
Imagen 3 y 4. Estomatitis ulcerativa con lesiones muy profundas en labios y paladar, con afectación también de las papilas linguales y bucales. Imágenes cedidas por Alberto Magro e Issac Pérez
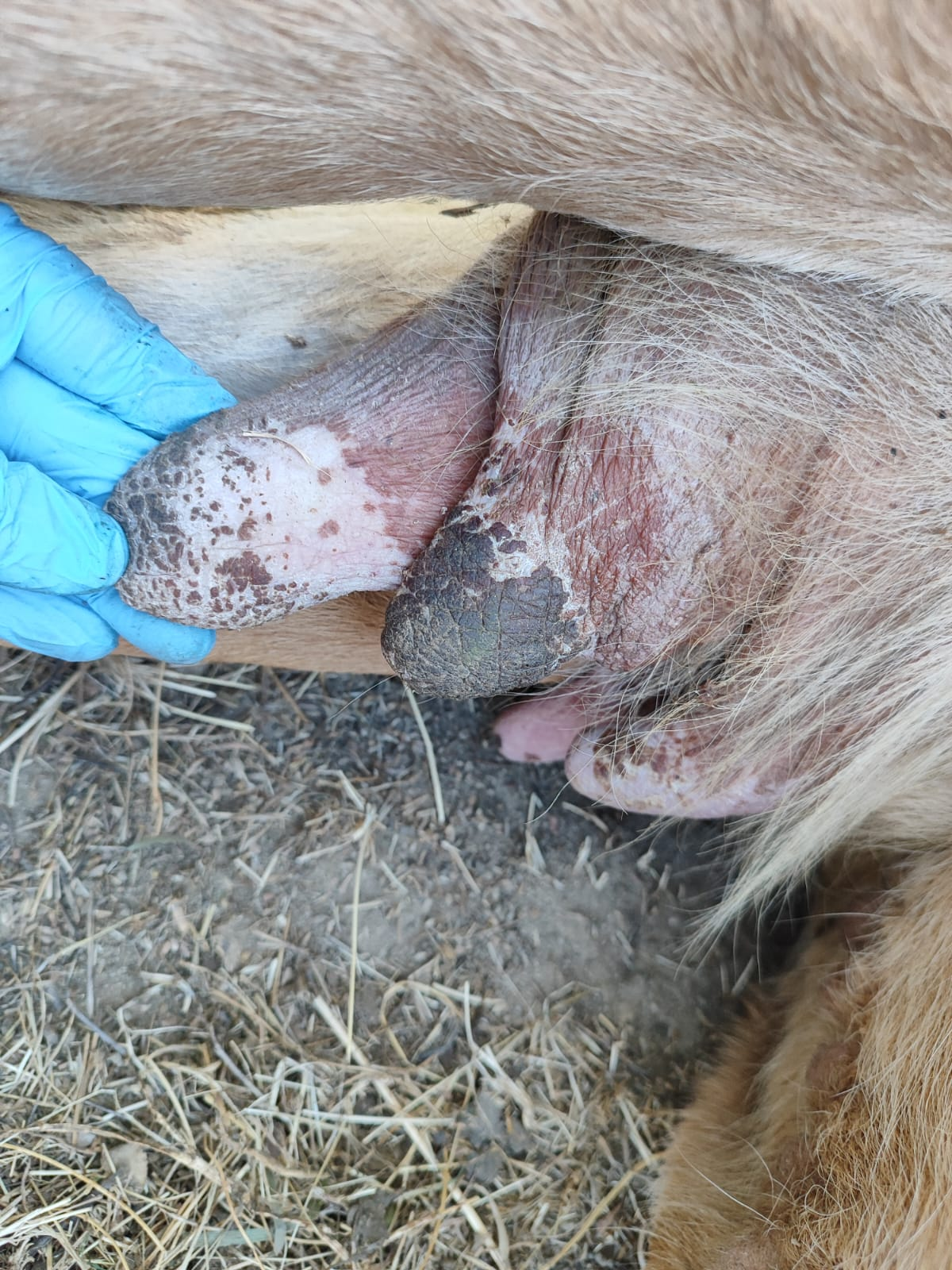 Imagen 5. Lesiones ulcerativas costrosas en pezones en hembra limusina
Imagen 5. Lesiones ulcerativas costrosas en pezones en hembra limusina
Se ha informado de problemas reproductivos como abortos, malformaciones fetales y muertes fetales después de la infección de animales gestantes, y en los casos que se están produciendo en España se están observando fetos momificados, terneros con síndrome de debilidad y deformidades en las extremidades posteriores. Además, el virus se ha aislado de los fetos afectados, lo que sugiere transmisión vertical (Ohashi et al., 1999).
En cuanto a los datos de morbilidad y mortalidad, los porcentajes varían mucho según el serotipo implicado y la región. Por ejemplo, en el año 2006, la cepa 318 del EHDV-6 causó un 20% de morbilidad y un 2,2% de mortalidad en el norte de África (Temizel et al., 2009), mientras que el EHDV-7 causó un 90-100% de morbilidad en el interior de Israel y un 5% en la región costera del mismo país, siento la tasa de mortalidad en ambos casos del 1,5% (Kedmi et al., 2010). Aún no hay datos publicados sobre la virulencia del EHDV-8, sin embargo, los datos recogidos en los últimos meses en bovino en España sugieren una morbilidad del 60-90%, con presencia de síntomas clínicos en el 10-20% de los animales afectados y una mortalidad entre 0,5-3%. Es importante destacar que, al igual que en otras patologías, estas tasas irán disminuyendo a medida que el ganado vaya adquiriendo inmunidad. Prueba de ello es el caso del EHDV-2 en Japón. En el brote de 1960, la morbilidad y mortalidad fueron mucho más bajas que las reportadas en el brote de 1959 (Omori et al., 1969).
La duración de la viremia en bovino infectado naturalmente se puede alargar hasta las 4-5 semanas, mientras que en bovino infectado experimentalmente se ha detectado el virus hasta 50 días post-infección (Gard y Melville, 1992; Aradaib et al., 1994b). Estos datos son muy similares a los obtenidos en cérvidos, en los que el virus se puede detectar desde el segundo día postinfección y durante más de 50 días en algunos casos.
Entre las especies silvestres, como ya se ha comentado, el ciervo de cola blanca es la especie más susceptible hasta la fecha, aunque no es la única especie capaz de desarrollar sintomatología. En ciervos infectados experimentalmente con EHDV-2, la presencia del virus en sangre dejó de detectarse en la mayoría de los casos a las 3 semanas desde la infección (Quist et al., 1997; Gaydos et al., 2002a; Gaydos et al., 2002b). En individuos jóvenes nacidos de madres que habían sido infectadas con el EHDV-2, se encontraron anticuerpos maternos en el suero hasta las 17-18 semanas de edad. La inmunidad pasiva no evitó la infección, pero sí pudo protegerlos contra la forma clínica grave de la enfermedad (Gaydos et al., 2002b)
En el ciervo de cola blanca se han descrito tres cuadros clínicos (EFSA, 2009; Rivera et al., 2021):
- Cuadro hiperagudo: fiebre alta, anorexia, debilidad, disnea y edema de cabeza y cuello. También puede observarse glositis y conjuntivitis y muerte súbita a las 8-36 horas de la infección, a veces incluso sin desarrollar signos. En los cadáveres es frecuente observar signos de alteración de la coagulación (diarrea sanguinolenta, hematuria, etc.), observándose una lesión vascular generalizada y posterior coagulación intravascular diseminada.El derrame pericárdico y el edema pulmonar pueden ser muy intensos en animales gravemente afectados. La tasa de mortalidad es muy alta en individuos con este cuadro (Hoff y Trainer, 1978; Beringer et al., 2000; Howerth et al., 2001; Gaydos et al., 2004; Pybus et al., 2014). La hemorragia y el edema pueden variar mucho en cuanto a extensión y distribución, pero normalmente están presentes en piel y tejido subcutáneo, cavidad oral, glándulas salivares, endocardio y miocardio, arteria pulmonar y aorta, abomaso y serosas (pleura y peritoneo), ganglios linfáticos y vejiga urinaria (Maclachlan et al., 2015). Histológicamente las lesiones características son hemorragia y necrosis, con trombosis en capilares y pequeños vasos de los tejidos afectados. La lengua, las glándulas salivales, el abomaso, la aorta y el miocardio son los más afectados. En 2013, Van Campen et al. y Favero et al., describieron lesiones similares en yaks y ciervos infectados por EDHV.
- Cuadro agudo o clásico: a los signos anteriores se suma la hiperemia en mucosas y cavidad oral, con sialorrea y hemorragias en diferentes tejidos (piel, corazón y tracto gastrointestinal, entre otros). También se han observado úlceras en cavidad oral, rumen y abomaso, y casos de laminitis y coronitis. La tasa de mortalidad en individuos con este cuadro también es alta.
- Cuadro crónico: la enfermedad dura varias semanas y los individuos se recuperan gradualmente, aunque algunos pueden sufrir secuelas como cojeras persistentes debido a laminitis. Los daños extensos en la mucosa digestiva pueden derivar en emaciación.
Repercusiones en producción y medioambiente.
Esta enfermedad tiene, como ya se ha visto en otros países, graves consecuencias económicas para el ganadero teniendo en cuenta la morbilidad y mortalidad de la EHD. Sin embargo, las repercusiones económicas no serían solo en el ámbito ganadero, si no que a nivel social se produciría un encarecimiento del precio de la carne y de la leche, al mantenerse la demanda y disminuir la oferta. Poniéndonos en el peor escenario, y basándonos en los informes de censo y producción de 2022 del MAPA, la EHD podría llegar a provocar pérdidas directas por la baja de animales de hasta 268 millones de euros anuales, a lo que habría que añadir pérdidas indirectas derivadas de los gastos veterinarios, de gestión y control de la enfermedad.
Además, habría que sumar la pérdida de activos por los abortos y la mortalidad perinatal, la disminución o pérdida de fertilidad y la disminución en la producción de leche, el aumento de los costes veterinarios, a pesar de que sólo se puede llevar a cabo un tratamiento paliativo, y costes derivados de las medidas de control implementadas. Según el estudio realizado por Kedmi et al. en 2009 y 2010 sobre el brote israelí de 2006, la infección fue capaz de causar una pérdida de leche promedio de 125 kg/vaca lechera, lo que suponía un 0,55-2% de la producción por lactación de las vacas afectadas. La reducción de leche estuvo fuertemente asociada al período de infección (septiembre, octubre o noviembre) y a la seroprevalencia del rebaño. En los rebaños afectados en septiembre de 2006 (1 mes del brote) las pérdidas observadas fueron de 207 kg/vaca lechera en promedio mientras que las observadas en los meses siguientes fueron de 137 y 52 kg/vaca lechera en promedio, respectivamente. La seropositividad del rebaño de 26-50%, 51-75% y 76-100% determinó pérdidas de 84, 133 y 204 kg de leche/vaca lechera, respectivamente. En España, teniendo en cuenta que el litro de leche se cotiza a 0,54€ (según datos de MAPA de abril de 2023), la estimación de pérdidas económicas por disminución de la producción lechera por EHD podría situarse en 79 millones de euros anuales.
Finalmente, en el caso de vacas que han abortado antes del secado, estas, además del descenso natural de leche por encontrarse a final de lactación, se sumaría el efecto de descenso patológico de producción, lo que conllevaría mantener animales “secos” (sin producción lechera) durante más tiempo. Todo ello supone un coste extra, considerando que el coste por tonelada de ración completa para vaca de leche es de 335,35 euros, según datos del MAPA.
Por otro lado, en los ecosistemas, es muy difícil determinar la morbilidad y mortalidad de la EHD ya que no todos los cadáveres son localizados. En regiones donde la EHD es endémica, como en Estados Unidos, la tasa de infección estimada en el ciervo de cola blanca es del 29%, con una tasa de mortalidad del 20%, similar a la seroprevalencia publicada en antílope americano (Gaydos et al., 2004; Dubay et al., 2006). Entre las especies de rumiantes silvestres, ésta es la más sensible, de forma que la prevalencia en el resto de rumiantes parece ser mucho menor con una supervivencia mucho más elevada. Sin embargo, existen muy pocos estudios al respecto, por lo que no se puede definir aún el impacto que tendrá la enfermedad en las poblaciones silvestres y por tanto en los ecosistemas.
Métodos de diagnóstico
El diagnóstico a través de los signos clínicos observados no es concluyente, ya que son los mismos que en la enfermedad de la lengua azul, y similares a otras enfermedades, aunque sí es orientativo. Por tanto, para confirmar el diagnóstico es necesario el aislamiento o detección del virus en sangre o tejidos (bazo y pulmón parecen ser los órganos diana del EHDV). Hoy en día, las técnicas de detección más sensibles para EHDV son la PCR con retrotranscripción (RT-PCR), tanto a punto final como a tiempo real. Existen protocolos estandarizados de la OMSA publicados en el manual de pruebas de los animales terrestres de la OIE (2021), tanto para la detección de todos los serotipos, como para la identificación de cada uno de ellos. Sin embargo, es importante tener en cuenta que una PCR positiva a EHDV demuestra la presencia de ARN viral, pero no que el virus sea infeccioso; para ello, las pruebas basadas en el aislamiento viral son fundamentales. El aislamiento del EHDV puede realizarse a partir de inoculación en cultivos celulares (líneas Vero, BHK o de insectos) o en huevos de gallina embrionados (Aradaib et al., 1995).
Para el estudio epidemiológico son muy relevantes las pruebas serológicas, ya que la presencia de anticuerpos indica una exposición al agente. Tradicionalmente, éstas se realizaban mediante la prueba de la virus neutralización. En la actualidad, destacan los ELISAs indirectos de competición para cada serotipo. Estos ELISAS permiten detectar anticuerpos tanto en el ganado bovino, como en otras especies.
Mecanismos de control de la EHD
Dadas las repercusiones socioeconómicas que podría llegar a tener la EHD en Europa, es imperativo establecer una serie de medidas que ayuden a controlar la transmisión y diseminación del virus. Entre todas las posibles medidas de control, una vez introducida la enfermedad en España, se recomendaría la implementación de campañas de vacunación frente a EHDV. Sin embargo, actualmente no hay ninguna vacuna disponible en Europa. En Japón se han desarrollado y comercializado dos vacunas: una monovalente atenuada (EHDV-2) y otra bivalente inactivada (EHDV-2 y virus de la fiebre efímera bovina). La primera tiene una alta capacidad inmunógena y es relativamente segura, sin embargo, el riesgo de reversión y fuga al ecosistema es mayor que en el caso de la vacuna inactivada (Spedicato et al., 2016). En Estados Unidos, donde EHDV-1 y –6 son endémicos, se emplean a menudo vacunas autógenas inactivadas para el control de la enfermedad en criadores de ciervos de cola blanca, aunque no existen datos sobre la eficacia de las mismas (EFSA, 2009). Actualmente se está estudiando la eficacia de una vacuna de subunidades frente a proteínas de la cápside de EHDV-2. Los resultados preliminares en ratones y ganado vacuno son prometedores con unos márgenes de seguridad muy amplios (Sunwoo et al., 2020). Finalmente, un equipo de investigadores de Reino Unido ha desarrollado una vacuna de subunidades frente a varias proteínas de la cápside, confiriendo inmunidad a los individuos inoculados frente a EHDV-1, -2 y –6 (Alshaikhahmed y Roy, 2016). Lo que está claro es que de seguir progresando la EHD por Europa, será necesaria una vacuna DIVA, eficaz frente a múltiples serotipos y segura, que permita la diferenciación entre individuos infectados naturalmente y vacunados.
Mientras esperamos la llegada de la vacuna, el control de los vectores es fundamental, ya que al replicarse los virus (tanto el BTV como el EHDV) en el endotelio de los vasos de los rumiantes infectados se produce una viremia prolongada asociada a las células en aquellos animales que sobreviven a la infección aguda, a pesar de presentar anticuerpos neutralizantes (Maclachlan et al., 2015). Al igual que en el control de la lengua azul, se recomienda la aplicación de insecticidas en áreas de descanso o nidos de Culicoides, la eliminación de nidos de los mismos, la revisión de establos y adaptación para evitar la entrada de mosquitos, el uso de piretroides y feromonas en el ganado (EFSA, 2009). Sin embargo, son pocos los estudios sobre distribución y comportamiento de los Culicoides en Europa que permitan definir las áreas de reproducción y descanso de los mismos.
Además, es importante la restricción de movimiento de los animales presentes en las regiones afectadas, acción que no se llevó a cabo en los brotes acaecidos en Israel y que junto con la acción del viento puedo aumentar la tasa de propagación (Kedmi et al., 2010c)
REFERENCIAS
Albayrak H, Ozan E, Gur S (2010). A serologic investigation of epizootic hemorrhagic disease virus (EHDV) in cattle and Gazella subgutturosa subgutturosa in Turkey. Animal Health Production, 42, 1589-1591.
Allen, S. E., Rothenburger, J. L., Jardine, C. M., Ambagala, A., Hooper-McGrevy, K., Colucci, N., … & Nemeth, N. M. (2019). Epizootic hemorrhagic disease in white-tailed deer, Canada. Emerging infectious diseases, 25(4), 832.
Allison, A. B., Holmes, E. C., Potgieter, A. C., Wright, I. M., Sailleau, C., Breard, E., … & Stallknecht, D. E. (2012). Segmental configuration and putative origin of the reassortant orbivirus, epizootic hemorrhagic disease virus serotype 6, strain Indiana. Virology, 424(1), 67-75.
Alshaikhahmed, K., & Roy, P. (2016). Generation of virus-like particles for emerging epizootic haemorrhagic disease virus: Towards the development of safe vaccine candidates. Vaccine, 34(8), 1103-1108.
Anthony, S. J., Maan, S., Maan, N., Kgosana, L., Bachanek-Bankowska, K., Batten, C., … & Mertens, P. P. C. (2009). Genetic and phylogenetic analysis of the outer-coat proteins VP2 and VP5 of epizootic haemorrhagic disease virus (EHDV): comparison of genetic and serological data to characterise the EHDV serogroup. Virus research, 145(2), 200-210.
Aradaib, I. E., Sawver, M. M., & Osburn, B. I. (1994). Experimental epizootic hemorrhagic disease virus infection in calves: virologic and serologic studies. Journal of Veterinary Diagnostic Investigation, 6(4), 489-492.
Aradaib, I. E., Akita, G. Y., Pearson, J. E., & Osburn, B. I. (1995). Comparison of polymerase chain reaction and virus isolation for detection of epizootic hemorrhagic disease virus in clinical samples from naturally infected deer. Journal of Veterinary Diagnostic Investigation, 7(2), 196-200.
Beringer J., Hansen L.P. & Stallknecht D.E. (2000). – An epizootic of hemorrhagic disease in white-tailed deer in Missouri. J. Wildl. Dis., 36, 588–591.
Burgu I., Akca Y., Hamblin C., Kitching P. (1991). Epizootic hemorrhagic-disease virus-antibodies in Turkey. Tropical Animal Health and Production, 23, 261-262
Bréard E., Sailleau C., Hamblin C., Graham S.D., Gourreau J.M. & Zientara S. (2004). – Outbreak of epizootic haemorrhagic disease on the island of Réunion. Vet. Rec., 155, 422–423.
Clavijo, A., Sun, F., Lester, T., Jasperson, D. C., & Wilson, W. C. (2010). An improved real-time polymerase chain reaction for the simultaneous detection of all serotypes of Epizootic hemorrhagic disease virus. Journal of veterinary diagnostic investigation, 22(4), 588-593.
Drolet, B. S., McGregor, B. L., Cohnstaedt, L. W., Wilson, W. C., & McVey, D. S. (2022). Reoviridae. Veterinary Microbiology, 679-692.
Duan, Y., Yang, Z., Zhu, P., Xiao, L., Li, Z., Li, Z., … & Zhu, J. (2022). A serologic investigation of epizootic hemorrhagic disease virus in China between 2014 and 2019. Virologica Sinica, 37(4), 513-520.
Dubay, S. A., Rosenstock, S. S., Stallknecht, D. E., & deVos Jr, J. C. (2006). Determining prevalence of bluetongue and epizootic hemorrhagic disease viruses in mule deer in Arizona (USA) using whole blood dried on paper strips compared to serum analyses. Journal of wildlife diseases, 42(1), 159-163.
Dudley R. (2013). – Epizootic hemorrhagic disease (EHD) outbreak in cattle in Nebraska. Proc. U.S. Anim. Hlth Assoc., 116, 189.
EFSA (2009). Panel on Animal Health and Welfare (AHAW). Scientific Opinion on Epizootic Hemorrhagic Disease. EFSA Journal, 7(12), 1418.
Eschbaumer, M., Wernike, K., Batten, C. A., Savini, G., Edwards, L., Di Gennaro, A., … & Hoffmann, B. (2012). Epizootic hemorrhagic disease virus serotype 7 in European cattle and sheep: Diagnostic considerations and effect of previous BTV exposure. Veterinary microbiology, 159(3-4), 298-306.
Favero C.M., Matos A.C., Campos F.S., Cândido M.V., Costa É.A., Heinemann M.B., Barbosa-Stancioli E.F. & Lobato Z.I. (2013). – Epizootic hemorrhagic disease in brocket deer, Brazil. Emerg. Infect. Dis., 19, 346–348.
Gao, H., Wang, L., Ma, J., Gao, X., Xiao, J., & Wang, H. (2021). Modeling the current distribution suitability and future dynamics of Culicoides imicola under climate change scenarios. PeerJ, 9, e12308.
Gard G.P., Melville L.F., 1992. Results of a decade’s monitoring for orbiviruses in sentinel cattle pastured in an area of regular arbovirus activity in Northern Australia. Bluetongue, African horse sickness, and related orbiviruses: Proceedings of the Second International Symposium, 85–89. Gaydos, J.K., Allison, A.B., Hanson B.A., Yellin A.S. (2002a). Oral and fecal shedding of epizootic hemorrhagic disease virus, serotype 1 from experimentally infected white-tailed deer. Journal of Wildlife Diseases, 38, pp. 166-168
Gaydos, J. K., Stallknecht, D. E., Kavanaugh, D., Olson, R. J., & Fuchs, E. R. (2002). Dynamics of maternal antibodies to hemorrhagic disease viruses (Reoviridae: Orbivirus) in white-tailed deer. Journal of wildlife diseases, 38(2), 253-257.
Gaydos J.K., Davidson W.R., Elvinger F., Howerth E.W., Murphy M., Stallknecht D.E. (2002b). Crossprotection between epizootic hemorrhagic disease virus serotypes 1 and 2 in white-tailed deer. Journal of Wildlife Diseases, 38 , pp. 720-728
Gaydos J.K., Crum J.M., Davidson W.R., Cross S.S., Owen S.F. & Stallknecht D.E. (2004). – Epizootiology of an epizootic hemorrhagic disease outbreak in West Virginia. J. Wildl. Dis., 40, 383–393.
Gibbs E.P. & Lawman M.J. (1977). – Infection of British deer and farm animals with epizootic haemorrhagic disease of deer virus. J. Comp. Pathol., 87, 335–343.
Gerdes G.H., Neser J.A., Barnard B.J. & Larsen J. (1996). – Stomatitis and coronitis in cattle: an insect-borne viral disease. J. S. Afr. Vet. Assoc., 67, 103–104.
Golender, N., Khinich, Y., Gorohov, A., Abramovitz, I., & Bumbarov, V. (2017). Epizootic hemorrhagic disease virus serotype 6 outbreak in Israeli cattle in 2015. Journal of Veterinary Diagnostic Investigation, 29(6), 885-888.
Golender, N.; Bumbarov, V.; Kovtunenko, A.; David, D.; Guini-Rubinstein, M.; Sol, A.; Beer, M.; Eldar, A.; Wernike, K (2021). Identification and Genetic Characterization of Viral Pathogens in Ruminant Gestation Abnormalities, Israel, 2015–2019. Viruses 13, 2136.
Goldsmith. Komarov (1951). A disease, similar to BT in cattle, sheep in Israel. Refuah Veterinarith, 8 (3), 96-100
Hoff G.L. & Trainer D.O. (1978). – Bluetongue and epizootic hemorrhagic disease viruses: their relationship to wildlife species. Adv. Vet. Sci. Comp. Med., 22, 111–132.
House C., Shipman L.D. & Weybright G. (1998). – Serological diagnosis of epizootic hemorrhagic disease in cattle in the USA with lesions suggestive of vesicular disease. Ann. N.Y. Acad.Sci., 849, 497–500.
Howerth E.W., Stallknecht D.E. & Kirkland P.D. (2001). – Bluetongue, epizootic hemorrhagic disease, and other orbivirus-related diseases. In Infectious diseases of wild mammals, 3rd Ed. (E.S. Williams & I.K. Baker, eds). Iowa State University Press, Ames, 77–97
Inaba U.(1975). Ibaraki disease and its relationship to bluetongue. Australian Veterinary Journal, 51, 178-185
Jiménez-Cabello, L., Utrilla-Trigo, S., Lorenzo, G., Ortego, J., & Calvo-Pinilla, E. (2023). Epizootic Hemorrhagic Disease Virus: Current Knowledge and Emerging Perspectives. Microorganisms, 11(5), 1339.
Kedmi, M., Galon, N., Herziger, Y., Yadin, H., Bombarov, V., Batten, C., Shpigel, N.Y., Klement, E., (2011). Comparison of the epidemiology of epizootic haemorrhagic disease and bluetongue viruses in dairy cattle in Israel. Vet J.; 190(1):77-83. doi: 10.1016/j.tvjl.2010.10.003
Kedmi M, Van Straten M, Ezra E, Galon N, Klement E (2010). Assessment of the productivity effects associated with epizootic hemorrhagic disease in dairy herds. J Dairy Sci. ;93(6):2486-95. doi: 10.3168/jds.2009-2850.
Kedmi M., Herziger Y., Galon N., Cohen R.M., Perel M., Batten C., Braverman Y., Gottlieb Y., Shpigel N., Klement E. (2010c). The association of winds with the spread of EHDV in dairy cattle in Israel during an outbreak in 2006. Preventive Veterinary Medicine, 96, 152-160
Kitano Y. 2004). – Ibaraki disease in cattle. In Infectious diseases of livestock, 2nd Ed. (J.A.W Coetzer & R.C. Tustin, eds). Oxford University Press, New York, 1221–1226
Lorusso, A., Cappai, S., Loi, F., Pinna, L., Ruiu, A., Puggioni, G., … & Savini, G. (2023). Epizootic hemorrhagic disease virus serotype 8, italy, 2022. Emerging Infectious Diseases, 29(5), 1063.
Maan, N. S., Maan, S., Nomikou, K., Johnson, D. J., El Harrak, M., Madani, H., … & Mertens, P. P. (2010). RT-PCR assays for seven serotypes of epizootic haemorrhagic disease virus & their use to type strains from the Mediterranean region and North America. PloS one, 5(9), e12782.
Maclachlan NJ, Zientara S, Savini G, Daniels PW. Epizootic haemorrhagic disease. Rev Sci Tech. 2015 Aug;34(2):341-51. doi: 10.20506/rst.34.2.2361. PMID: 26601439
Madani H., Casal J., Alba A., Allepuz A., Cêtre-Sossah C., Hafsi L., Kount-Chareb H., Bouayed-Chaouach N., Saadaoui H. & Napp S. (2011). – Animal diseases caused by orbiviruses, Algeria. Emerg. Infect. Dis., 17, 2325–2327.
Pybus M.J., Ravi M. & Pollock C. (2014). – Epizootic hemorrhagic disease in Alberta, Canada. J. Wildl. Dis.,50, 720–722.
Omori T., Inaba Y., Morimoto T., Tanaka Y., Ishitani, H. Kurogi (1969). Ibaraki virus, an agent of epizootic disease of cattle resembling bluetongue. I. Epidemiologic, clinical and pathologic observations and experimental transmission to calves. Japanese Journal of Microbiology, 13 (2), 139-157
Ohashi S., Yoshida K., Watanabe Y., Tsuda T. (1999). Identification and PCR-restriction fragment length polymorphism analysis of a variant of the Ibaraki virus from naturally infected cattle and aborted fetuses in Japan. Journal of Clinical Microbiology, 37, 3800-3803
Office International Epizooties (OIE), 2006a. Disease Information, 2 November 2006, vol. 19, No. 44. Available from: http://www.oie.int/eng/info/hebdo /AIS_78.HTM#Sec1.
Rivera, N. A., Varg , C., Ruder, M. G., Dorak, S. J., Roca, A. L., Novakofski, J. E., & Mateus-Pinilla, N. E. (2021). Bluetongue and Epizootic Hemorrhagic Disease in the United States of America at the Wildlife–Livestock Interface. Pathogens, 10(8), 915.
Quist C.F., Howerth E.W., Stallknecht D.E., Brown J., Pisell T., Nettles V.F. (1997). Host defense responses associated with experimental hemorrhagic disease in white-tailed deer. Journal of Wildlife Diseases, 33, pp. 584-599
Sailleau, C., Breard, E., Viarouge, C., Belbis, G., Lilin, T., Vitour, D., & Zientara, S. (2019). Experimental infection of calves with seven serotypes of Epizootic Hemorrhagic Disease virus: Production and characterization of reference sera. Veterinaria Italiana, 55(4), 339-346.
Savini, G., Afonso, A., Mellor, P., Aradaib, I. A. O., Yadin, H., Sanaa, M., … & Domingo, M. (2011). Epizootic haemorragic disease. Research in veterinary science, 91(1), 1-17.
Spedicato, M., Carmine, I., Teodori, L., Leone, A., Portanti, O., Marini, V., … & Savini, G. (2016). Innocuity of a commercial live attenuated vaccine for epizootic hemorrhagic disease virus serotype 2 in late-term pregnant cows. Vaccine, 34(12), 1430-1435.
Sghaier, S., Sailleau, C., Marcacci, M., Thabet, S., Curini, V., Ben Hassine, T., … & Lorusso, A. (2022). Epizootic haemorrhagic disease virus serotype 8 in tunisia, 2021. Viruses, 15(1), 16.
Sun, F., Cochran, M., Beckham, T., & Clavijo, A. (2014). Molecular typing of epizootic hemorrhagic disease virus serotypes by one-step multiplex RT-PCR. Journal of wildlife diseases, 50(3), 639-644.
Sunwoo, S. Y., Noronha, L. E., Morozov, I., Trujillo, J. D., Kim, I. J., Schirtzinger, E. E., … & Richt, J. A. (2020). Evaluation of A baculovirus-expressed VP2 subunit vaccine for the protection of white-tailed deer (Odocoileus virginianus) from epizootic hemorrhagic disease. Vaccines, 8(1), 59.
Temizel E.M., Yesilbag K., Batten C., Senturk S., Maan N.S., Mertens P.P. & Batmaz H. (2009). – Epizootic hemorrhagic disease in cattle, Western Turkey. Emerg. Infect. Dis.,15, 317–319.
Uchinuno Y., Ito T., Goto Y., Miura Y., Ishibashi K., Itou T. & Sakai T. (2003). – Differences in Ibaraki virus RNA segment 3 sequences from three epidemics. J. Vet. Med. Sci., 65, 1257–1263
Van Campen H., Davis C., Flinchum J.D., Bishop J.V., Schiebel A., Duncan C. & Spraker T. (2013). Epizootic hemorrhagic disease in yaks (Bos grunniens). J. Vet. Diagn. Invest., 25, 443–446.
Wright, I. M. (2014). Serological and genetic characterisation of putative new serotypes of bluetongue virus and epizootic haemorrhagic disease virus isolated from an alpaca (Doctoral dissertation).
Yadin H., Brenner J., Bumbrov V., Oved Z., Stram Y., Klement E., Perl S., Anthony S., Maan S., Batten C. & Mertens P.P.C. (2008). – Epizootic haemorrhagic disease virus serotype 7 in cattle in Israel. Vet. Rec., 162, 53–56.
Yeruham I., Yadin H., Abramovitch I. and Shama Z. (2005), Bovine ephemeral fever in a dairy cattle herd in the Jordan Valley. Veterinary Record, 156: 284-286. https://doi.org/10.1136/vr.156.9.284
https://www.mapa.gob.es/es/ganaderia/temas/produccion-y-mercados-ganaderos/sectores-ganaderos/vacuno-lechero/informacion-del-sector/informes.aspx
https://www.mapa.gob.es/es/estadistica/temas/estadisticas-agrarias/economia/precios-coyunturales-productos-ganaderos/
Autoras : Raquel Patrón y Bárbara Martín-Maldonado, profesoras de Veterinaria de la Universidad Europea de Madrid.


Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía
