La suplementación con probióticos multiespecies en la dieta en cerdos

La suplementación con probióticos multiespecies en la dieta con niveles reducidos de proteína cruda alteró la composición y función del microbioma intestinal y restauró los metabolitos derivados del microbioma en cerdos en crecimiento
 Robie Vásquez,
Robie Vásquez,  Cantó Hoon Km†,
Cantó Hoon Km†,  Ju Kyoung Oh†, Ji Hoon Song, In-Chan Hwang,
Ju Kyoung Oh†, Ji Hoon Song, In-Chan Hwang, 

 En Ho Kim y
En Ho Kim y  Dae-Kyung Kang*
Dae-Kyung Kang*- Departamento de Biotecnología Animal, Universidad Dankook, Cheonan, República de Corea
Tanto la proteína cruda (PC) como los probióticos pueden modular el microbioma intestinal del huésped, confiriendo así efectos beneficiosos. Sin embargo, los beneficios de la dieta baja en PC suplementada con probióticos multiespecie sobre el microbioma intestinal y sus metabolitos no se han investigado en cerdos. Por lo tanto, investigamos los efectos combinatorios de la dieta baja en PC suplementada con probióticos multiespecies sobre la composición, función y metabolitos microbianos del microbioma intestinal en cerdos en crecimiento. En total, se utilizaron 140 lechones de 6 semanas (Landrace × Yorkshire × Duroc) en este estudio. Los cerdos se dividieron en cuatro grupos con un diseño factorial de 2 × 2 basado en sus dietas: dieta proteica de nivel normal (16% CP; NP), dieta de bajo nivel proteico (14% CP; LP), NP con probióticos multiespecies (NP-P) y LP con probióticos multiespecies (LP-P). Después del ensayo de alimentación, se analizaron las muestras fecales de los cerdos. Las puntuaciones fecales mejoraron con la suplementación con probióticos, especialmente en el grupo LP-P. También observamos una alteración mediada por probióticos en el microbioma intestinal de los cerdos. Además, el grupo LP-P mostró una mayor riqueza y diversidad de especies en comparación con otros grupos. La adición de probióticos multiespecies en la dieta baja en CP también mejoró la producción de metabolitos de la microbiota intestinal, como los ácidos grasos de cadena corta (AGCC) y las poliaminas. El análisis de correlación reveló que Oscillospiraceae UCG-002, Eubacterium coprostanoligenes, Lachnospiraceae NK4A136 grupo y Muribaculaceae se asociaron positivamente con AGCC; y Prevotella, Eubacterium ruminantium, Catenibacterium, Alloprevotella, Prevotellaceae NK3B31 grupo, Roseburia, Butyrivibrio y Dialister se correlacionaron positivamente con poliaminas. La suplementación con probióticos multiespecie moduló la función del microbioma intestinal al regular al alza las vías para la digestión y utilización de proteínas, lo que podría contribuir a la producción de metabolitos enriquecidos en el intestino. Los resultados de este estudio demuestran que la suplementación con probióticos multiespecies puede complementar los efectos beneficiosos de los bajos niveles de PC en la alimentación de cerdos. Estos hallazgos pueden ayudar a formular estrategias de alimentación sostenible para la producción porcina.
1. Introducción
La dieta tiene un impacto sustancial en la salud y el rendimiento del ganado (Tilocca et al., 2017). En las explotaciones ganaderas, la composición de la dieta se optimiza continuamente para lograr el máximo rendimiento en términos de calidad y rentabilidad del producto animal. Un equilibrio entre las proporciones de carbohidratos (fibra) y proteína cruda (PC) en el alimento, junto con proporciones suficientes de vitaminas y minerales esenciales, es vital para mejorar el rendimiento del ganado. Numerosos estudios han demostrado el impacto del contenido de PC en la dieta en animales, especialmente cerdos (Chen et al., 2018; Yu et al., 2019; Liu et al., 2022). Los productos metabólicos de la fermentación de proteínas desempeñan importantes funciones reguladoras en el mantenimiento de la salud del huésped (Rist et al., 2013; Pieper et al., 2016). Sin embargo, el exceso de concentración de PC en la dieta tiene implicaciones negativas no solo para el crecimiento y la salud de los animales, sino también para el medio ambiente. Estudios previos han informado que la reducción del contenido de PC en la dieta mejora la diarrea post-destete en cerdos (Nyachoti et al., 2006; Heo y otros, 2010; Lynegaard et al., 2021), así como mejorar la salud intestinal porcina (Fan et al., 2017; Chen et al., 2018). Además, una menor CP dietética reduce la excreción de compuestos malolientes al medio ambiente (Clark et al., 2005; Cho et al., 2015). Una dieta baja en proteínas también mejora la calidad de la carne (Zhu et al., 2022). Estudios recientes también han demostrado que la reducción de la PC dietética conduce a la modulación del microbioma intestinal en cerdos, así como de sus metabolitos (Fan et al., 2017; Chen y otros, 2018; Yu et al., 2019; Zhu et al., 2022). Esta estrategia de alimentación puede ser ventajosa, pero también puede afectar negativamente el rendimiento de crecimiento de los cerdos. Varios estudios han revelado que la reducción de PC afectó el rendimiento de crecimiento de los cerdos potencialmente debido a la inhibición de la actividad de las enzimas de digestión y la morfología retardada de las vellosidades (Yu et al., 2019).
Por lo tanto, la dieta baja en PC generalmente se combina con otras estrategias de alimentación, como la suplementación de aminoácidos digeribles (Opapeju et al., 2008; Millet et al., 2018), antibióticos (Zhang et al., 2016), enzimas (como fitasa y xilanasa) (Atakora et al., 2011) o probióticos (Bhandari et al., 2010; Tang et al., 2019). La suplementación de alimentos para ganado con probióticos se está volviendo popular debido a su impacto positivo en el rendimiento de la producción y la salud del ganado (Barba-Vidal et al., 2019). Los probióticos ejercen efectos beneficiosos en los animales, como mejorar el rendimiento del crecimiento, la eficiencia alimenticia, la calidad de la carne y aliviar el estrés y la diarrea al destete (Zimmermann et al., 2016; Barba-Vidal et al., 2019). Los probióticos multiespecie, por otro lado, son una combinación de microbios «que contienen cepas de diferentes especies probióticas que pertenecen a uno o preferentemente más géneros» (Timmerman et al., 2004). Lo ideal es que cada componente de este tipo de probióticos se complemente entre sí, aumentando su eficacia como probiótico. Estudios previos han informado que la suplementación de probióticos multiespecies en la alimentación de cerdos es beneficiosa para la salud general y el rendimiento de los cerdos (Timmerman et al., 2004; Mori y otros, 2011; Kwak et al., 2021).
El microbioma intestinal se ha estudiado ampliamente para desarrollar estrategias para mejorar la calidad y el rendimiento de la producción ganadera, y para reducir la excreción de compuestos malolientes (Nowland et al., 2019). Los cambios en el microbioma intestinal y sus metabolitos tienen efectos beneficiosos o perjudiciales sobre la salud de los cerdos en crecimiento, lo que afecta su rendimiento de crecimiento (Dávila et al., 2013; Luise et al., 2021). Los metabolitos derivados del microbioma intestinal, como los ácidos grasos de cadena corta (AGCC), los ácidos grasos de cadena ramificada (AGCC) y las poliaminas, están muy influenciados por los niveles de PC y la suplementación de probióticos en la dieta (Dávila et al., 2013; Pieper et al., 2016; Luise y otros, 2021; Vásquez et al., 2022). En nuestro estudio anterior, exploramos los efectos de los probióticos multiespecie en el microbioma intestinal de cerdos en crecimiento (Oh et al., 2021). Sin embargo, no se dispone de datos suficientes sobre los efectos de la dieta baja en PC suplementada con probióticos multiespecies en el microbioma intestinal, así como en la producción de metabolitos, como AGCC y poliaminas, por el microbioma intestinal de cerdo. Por lo tanto, en el presente estudio, investigamos los beneficios potenciales de complementar los probióticos multiespecie a la dieta baja en PC en el microbioma intestinal y los metabolitos microbianos de los cerdos en crecimiento.
2. Materiales y métodos
2.1. Diseño experimental, animales y dietas
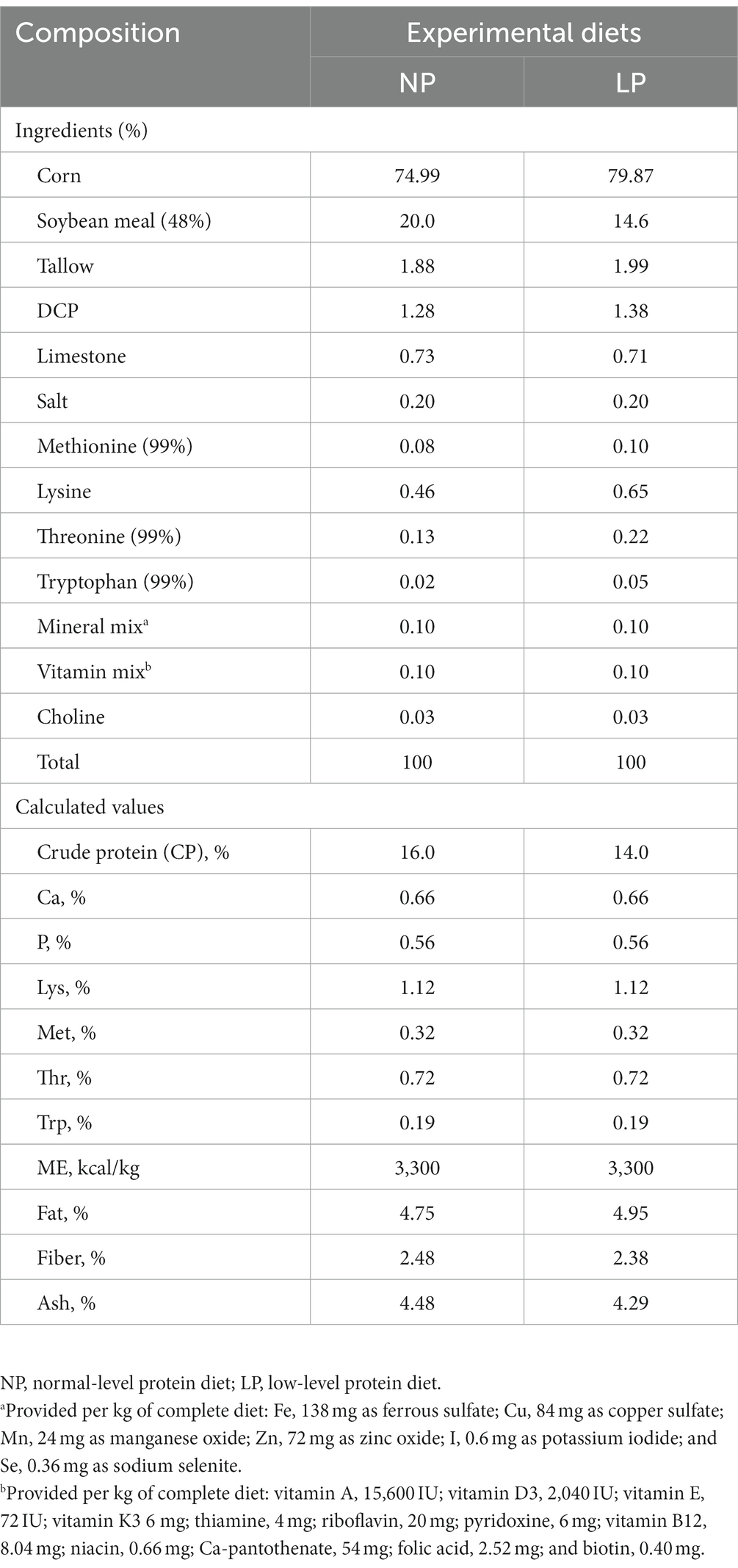
Todos los protocolos con animales utilizados en este estudio fueron aprobados por el Comité de Cuidado de Animales de la Universidad de Dankook (Número de aprobación: DK-2-2018). Un total de 140 lechones (Landrace × Yorkshire × Duroc) destetados a las 4 semanas de edad fueron utilizados en este estudio. El peso corporal promedio de los lechones fue de 25,01 ± 1,79 kg. Todos los animales fueron alimentados con la misma dieta basal después del destete durante 2 semanas. La composición de la dieta basal (Tabla 1) se formuló para cumplir o superar la nutrición recomendada por el Consejo Nacional de Investigación (NRC) para cerdos que pesan entre 25 y 50 kg (Consejo Nacional de Investigación, 2012). Los cerdos se dividieron aleatoriamente en los siguientes cuatro grupos con un diseño factorial de 2 × 2 basado en su dieta: dieta proteica de nivel normal (16% CP, NP), dieta de bajo nivel proteico (14% CP, LP), NP con suplementos probióticos multiespecies (NP-P) y LP con suplementos probióticos multiespecies (LP-P). El probiótico multiespecie estaba compuesto por Bacillus amyloliquefaciens G10 (2,5 × 108 unidades formadoras de colonias (UFC)/g de alimento), Levilactobacillus brevis M10 (1.2 × 108 UFC/g de alimentación), Bacillus subtilis (3,3 × 108 UFC/g de alimentación), y Limosilactobacillus reuteri RTR (1,2 × 108 UFC/g de alimentación). Estas especies han sido seleccionadas previamente por sus posibles características probióticas (Oh et al., 2021). Todos los cerdos fueron alojados en una habitación ambientalmente controlada. Cada corral contenía de 4 a 5 cerdos y estaba equipado con un autoalimentador unilateral y un bebedero de tetina para el acceso ad libitum al alimento y al agua. El período de alimentación duró 6 semanas. La puntuación fecal se evaluó diariamente de acuerdo con los siguientes criterios: (1) pellets duros y secos pero de baja masa, (2) heces duras y formadas, (3) heces blandas y formadas pero húmedas, (4) heces blandas y sin forma, y (5) heces líquidas acuosas (Park et al., 2018). El último día del experimento, se recogieron muestras fecales frescas del recto de los cerdos de cada grupo y se almacenaron a -80 ° C para su posterior análisis. Para el análisis de pH, las muestras fecales (0,5 g) se homogeneizaron en agua destilada, se recogió sobrenadante después de la centrifugación a 10.000 × g durante 10 min, y el pH se determinó utilizando un medidor de pH (Horiba, Japón). El contenido de humedad de las muestras fecales (0,5 g) se midió utilizando un analizador de humedad (Kett, Japón).
2.2. Preparación del probiótico multiespecie
El probiótico multiespecie se preparó según lo descrito por Oh et al. (2021). Brevemente, se utilizó un proceso de fermentación en estado sólido para preparar el probiótico. Posteriormente, el probiótico se procesó en forma de polvo y se mezcló con el alimento basal para lograr las dosis individuales finales. Genebiotech (Seúl, Corea del Sur) realizó la preparación de los probióticos multiespecie. El alimento mezclado con el probiótico se mantuvo en un recipiente estéril a 4 ° C. La viabilidad del probiótico se evaluó diariamente.
2.3. Determinación de los niveles de metabolitos fecales (AGCC, AGCC, lactato y poliaminas)
Se realizó cromatografía líquida de alta resolución (HPLC) para determinar los niveles de lactato, AGCC (acetato, propionato, butirato y valerato) y AGCC (isobutirato e isovalerato) en las muestras fecales; las muestras para HPLC se prepararon como se describió anteriormente (Zhang et al., 2022). Brevemente, las muestras fecales (0,5 g) se suspendieron en 1 ml de agua desmineralizada estéril, se enrojecieron durante 3 min y se centrifugaron a 10.000 × g durante 10 min a 4°C. El sobrenadante se recogió y filtró utilizando filtros de jeringa de PTFE de 0,22 μm. Las muestras se analizaron utilizando un sistema HPLC Agilent Infinity 1260 (Agilent, Estados Unidos) con columna Aminex HPX-87H (300 × 7,8 mm; Bio-Rad, Estados Unidos), equipado con detectores de índice de refracción y UV (λ = 210 nm). Las muestras (10 μL) se inyectaron utilizando un muestreador automático, mientras que la temperatura de la columna se mantuvo a 65 ° C. La fase móvil fue de 0.005 M H2Así que4, y el caudal se mantuvo en 0,6 ml/min para un tiempo total de ejecución de 35 min.
Las muestras fecales para el análisis de poliaminas (putrescina, cadaverina, histamina, espermidina y espermina) se prepararon de acuerdo con los métodos de derivatización descritos anteriormente (Yoon et al., 2015; Li et al., 2018), con ligeras modificaciones. Brevemente, las muestras fecales (0,5 g) se suspendieron en 1,5 mL de ácido perclórico 0,4 M (Sigma-Aldrich) y se virticieron a fondo, la suspensión se centrifugó a 13.000 × g durante 10 min, y se recogió el sobrenadante. A continuación, 2 M NaOH y NaHCO saturado3 se añadieron al sobrenadante, la solución se hizo reaccionar con cloruro de dansilo (5 mg/ml en acetona; Daejung, Corea del Sur) a 50°C durante 45 min. La reacción se detuvo agregando 25% de NH4OH e incubación a 50°C durante 15 min. El volumen de la mezcla de reacción se ajustó a 1,5 ml utilizando acetonitrilo (JT Baker, PA, Estados Unidos), seguido de centrifugación a 2.500 × g durante 5 min. El sobrenadante se recogió y filtró utilizando filtros de jeringa de PTFE de 0,22 μm. Las muestras (10 μL cada una) se analizaron utilizando un sistema HPLC Agilent Infinity 1260 (Agilent, Estados Unidos) equipado con una columna de fase inversa C-18 (150 × 4,6 mm, 5 μm) (Young Jin Biochrom, Corea del Sur) y un detector UV (λ = 254 nm). El acetonitrilo y el agua se utilizaron como fases móviles (gradiente lineal). La temperatura de la columna se ajustó a 30 ° C, y el caudal se mantuvo en 0,8 ml / min para un tiempo de funcionamiento total de 35 min. La concentración de cada metabolito se evaluó contra una curva de calibración generada utilizando estándares. Todos los estándares fueron comprados a Sigma-Aldrich (St. Louis, MO, Estados Unidos).
2.4. Secuenciación del gen 16S rRNA y análisis de la comunidad microbiana
El ADN genómico se extrajo de muestras fecales utilizando el kit de ADN QiaAmp PowerFecal Pro (Qiagen, Hilden, Alemania) de acuerdo con las instrucciones del fabricante. La concentración y pureza del ADN genómico se determinaron utilizando un espectrofotómetro UV (Molecular Devices, CA, Estados Unidos). Se utilizó la plataforma Illumina MiSeq (Illumina, CA, Estados Unidos) para amplificar la región hipervariable V3-V4 del gen 16S rRNA (CJ BioScience, Inc., Seúl, Corea del Sur). Los datos de secuenciación sin procesar obtenidos se procesaron utilizando la tubería Quantitative Insights Into Microbial Ecology (QIIME2) (Bolyen et al., 2019). Los cebadores y adaptadores se eliminaron de las secuencias sin procesar utilizando el complemento «cutadapt» en QIIME2 (Martin, 2011). El control de calidad de la secuencia y la construcción de la tabla de características se realizaron utilizando DADA2 (Callahan et al., 2016). Los análisis de diversidad filogenética se realizaron utilizando los plugins «q2-phylogeny» y «q2-diversity»; los clasificadores de características se entrenaron utilizando el complemento «q2-feature-classifier» dentro de QIIME2, utilizando la base de datos SILVA 138_99 (Quast et al., 2013). El análisis de coordenadas principales (PCoA) basado en la matriz de distancias de Bray-Curtis se realizó utilizando el complemento «q2-diversity» en QIIME2. Los índices de diversidad alfa (índices Chao1, entropía de Shannon y Simpson), el gráfico PCoA y los gráficos de barras de abundancia relativa se construyeron utilizando el paquete «ggplot2» en el programa R v.4.0.2 (Core R Team, 2019). Todos los datos metagenómicos generados en este estudio se han depositado en el National Center for Biotechnology Information (NCBI) Sequence Read Archive (SRA) (número de acceso del BioProject: PRJNA856074).
Los marcadores taxonómicos diferenciales para cada grupo se determinaron utilizando el paquete «run_lefse» (Cao, 2020) en el programa R basado en el tamaño del efecto del análisis discriminante lineal (LEfSe) (Segata et al., 2011). La predicción funcional basada en la base de datos de la Enciclopedia de Genes y Genomas de Kioto (KEGG) se realizó utilizando la Investigación filogenética de comunidades mediante la reconstrucción de estados no observados (PICRUSt2) (Douglas et al., 2020). Los análisis de correlación se realizaron calculando el coeficiente de correlación de Pearson utilizando el paquete «Hmisc» en R, y los datos se visualizaron utilizando el paquete «pheatmap» en R (Core R Team, 2019).
2.5. Análisis estadísticos
Los análisis estadísticos de la composición microbiana y los datos de concentración de metabolitos se realizaron utilizando R (Core R Team, 2019). La normalidad de la distribución de los datos se analizó mediante la prueba de Shapiro-Wilk. Se utilizó el análisis multivariado de varianza (MANOVA) para calcular los efectos de los niveles de PC, los probióticos y sus interacciones. Se utilizó el análisis unidireccional de varianza (ANOVA) con la prueba de Tukey para analizar las diferencias significativas entre los tratamientos. La corrección de la tasa de descubrimiento falso (FDR) se realizó según fuera necesario. La prueba de Kruskal-Wallis para la diversidad alfa y beta se realizó utilizando la tubería QIIME2. Se utilizó el análisis de varianza multivariante permutacional (PERMANOVA) para determinar diferencias significativas en la gráfica de PCoA. Los datos fueron considerados significativos a p < 0,05.
3. Resultados
3.1. Efecto del probiótico multiespecie sobre el pH y el contenido de humedad de las muestras fecales
Los análisis de muestras fecales (Tabla 2) revelaron que el pH disminuyó significativamente con la suplementación con probióticos (p < 0,001). Del mismo modo, el contenido de humedad y las puntuaciones fecales mejoraron significativamente después de la suplementación con probióticos, independientemente del nivel de PC (p = 0,04 y p < 0,01, respectivamente). Además, el grupo LP-P exhibió un contenido de humedad significativamente menor y mejores puntuaciones fecales que el grupo LP (p < 0,05).
 Tabla 2. Efecto de la suplementación con probióticos dietéticos sobre las puntuaciones fecales y el contenido de humedad del pH de muestras fecales de cerdos en crecimiento.
Tabla 2. Efecto de la suplementación con probióticos dietéticos sobre las puntuaciones fecales y el contenido de humedad del pH de muestras fecales de cerdos en crecimiento.
3.2. Efecto del probiótico multiespecie sobre los metabolitos fecales
Para investigar el efecto de la suplementación con probióticos multiespecies en piensos con nivel normal o bajo de CP en metabolitos derivados del microbioma intestinal, medimos los niveles de lactato, AGCC, BCFA y poliamina en las muestras fecales de cerdos en crecimiento (Tabla 3). Las concentraciones de acetato, propionato y valerato del grupo LP fueron menores que las del grupo NP. La suplementación con probióticos, independientemente del nivel de PC, aumentó significativamente los niveles de acetato fecal, propionato y valerato (p = 0.01, p = 0.04 y p = 0.006, respectivamente). Curiosamente, los niveles fecales de AGCC de LP-P fueron comparables con NP-P en comparación con LP solo. Sin embargo, no se observaron cambios significativos en los niveles de butirato fecal y lactato, y no se observaron diferencias en los niveles de isobutirato e isovalerato fecal. Los niveles de poliamina (putrescina, cadaverina, espermidina y espermina) del grupo LP se redujeron en comparación con los de los otros grupos; sin embargo, las diferencias no fueron significativas (p > 0,05). En comparación, NP-P y LP-P aumentaron marginalmente las concentraciones de estas poliaminas (p > 0,05).
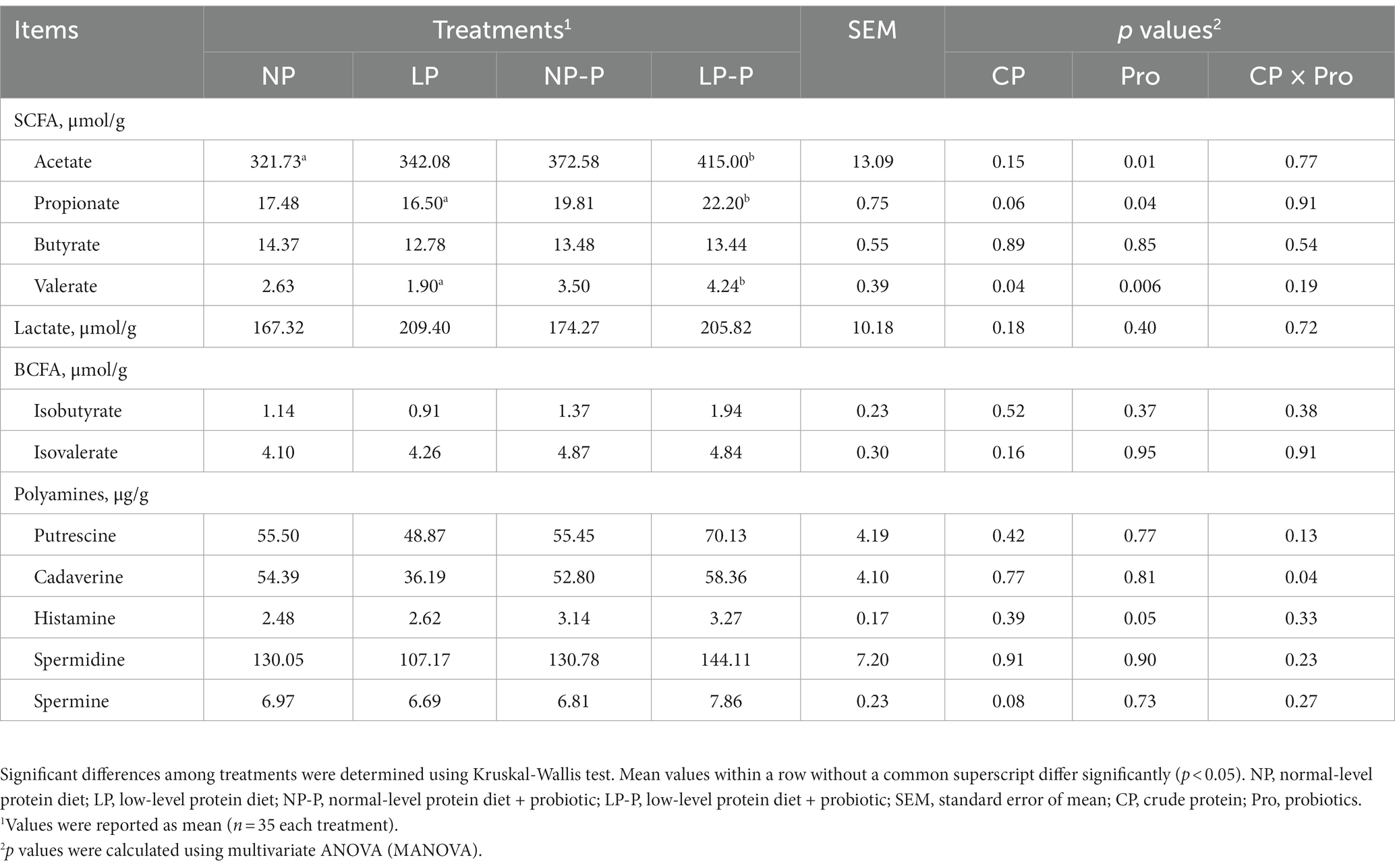 Tabla 3. Efecto de la suplementación con probióticos dietéticos sobre los metabolitos derivados del microbioma.
Tabla 3. Efecto de la suplementación con probióticos dietéticos sobre los metabolitos derivados del microbioma.
3.3. Efecto de los probióticos en la estructura y composición microbiana intestinal
Se examinó la estructura del microbioma intestinal y la composición de la comunidad de los cerdos en crecimiento de los cuatro grupos. La secuenciación del ARNr 16S produjo 32.171.215 lecturas sin procesar para 140 muestras, que contenían 15.415.965 lecturas válidas después de filtrar y eliminar las lecturas quiméricas. La longitud promedio de las lecturas válidas fue de 412 pb. Se generó una curva de rarefacción para verificar la idoneidad de las lecturas para los análisis posteriores (Figura suplementaria S1). Análisis de diversidad alfa (Figura 1A; Cuadro suplementario S1) reveló que el grupo LP-P mostró una riqueza de especies significativamente mayor que los otros grupos de tratamiento, según lo revelado por el índice Chao1 (p < 0,001). Del mismo modo, la diversidad de especies en el grupo LP-P fue significativamente mayor que en los otros grupos de tratamiento, con base en el índice de Shannon (p < 0,001); y tanto los grupos NP-P como LP-P exhibieron una mayor uniformidad de especies en comparación con la de los grupos LP y NP, según lo revelado por el índice de Simpson (p < 0,001). Por otro lado, el PCoA basado en la matriz de distancia de Bray-Curtis (Figura 1B) reveló distintos grupos entre dietas con y sin probióticos (p < 0,001). No se observaron diferencias significativas entre los grupos NP y LP, o NP-P y LP-P.
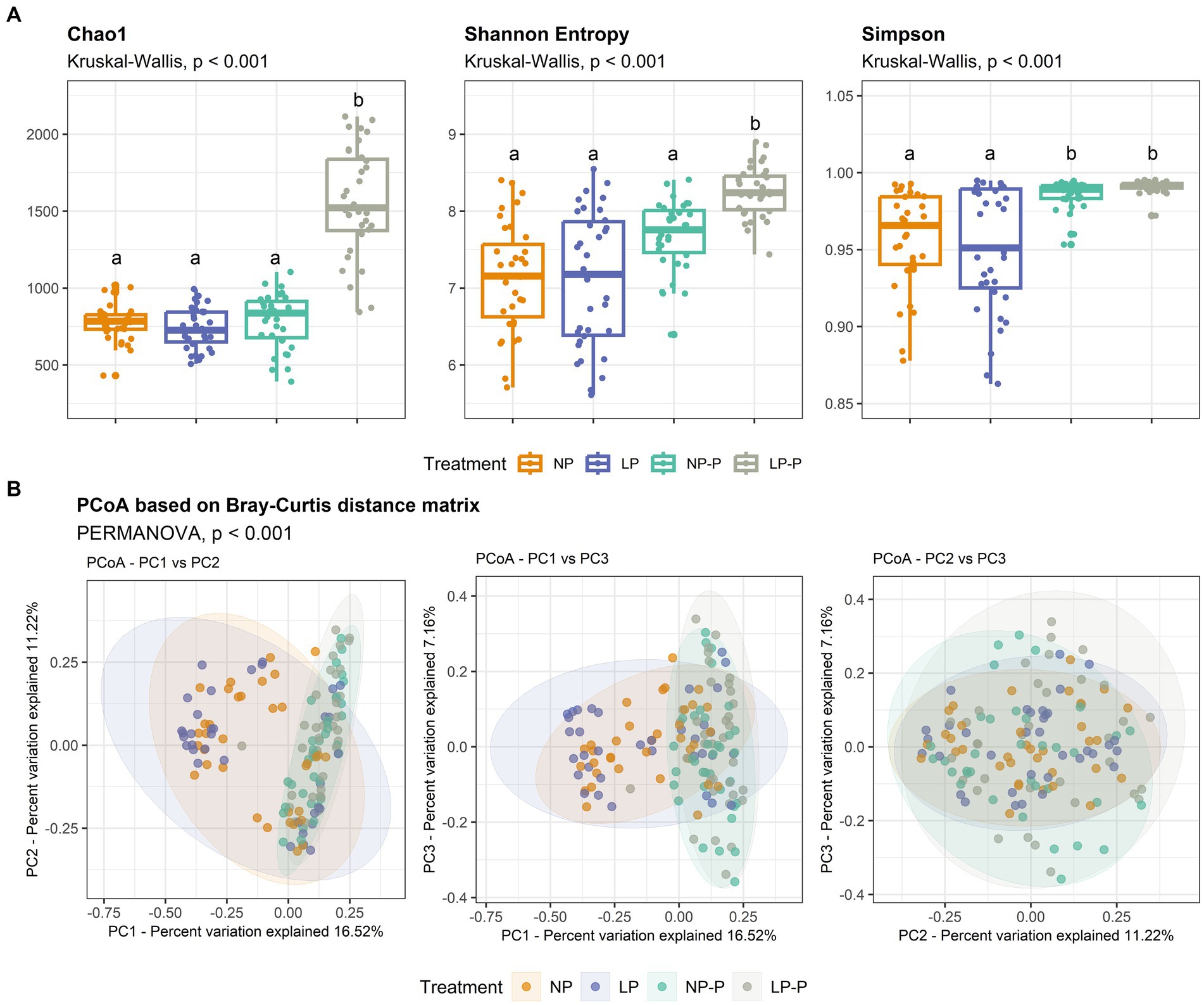 Figura 1. Cambios en la estructura del microbioma intestinal. Comparación de los índices de diversidad alfa Chao1, entropía de Shannon y Simpson (A). Las diferencias significativas entre los tratamientos se determinaron mediante la prueba de Kruskal-Wallis. Gráfica de análisis de coordenadas principales (PCoA) basada en la matriz de distancias de Bray-Curtis (B). NP: dieta proteica de nivel normal; LP: dieta de bajo nivel de proteínas; NP-P: dieta proteica de nivel normal + probiótico; LP-P, dieta proteica de bajo nivel + probiótico.
Figura 1. Cambios en la estructura del microbioma intestinal. Comparación de los índices de diversidad alfa Chao1, entropía de Shannon y Simpson (A). Las diferencias significativas entre los tratamientos se determinaron mediante la prueba de Kruskal-Wallis. Gráfica de análisis de coordenadas principales (PCoA) basada en la matriz de distancias de Bray-Curtis (B). NP: dieta proteica de nivel normal; LP: dieta de bajo nivel de proteínas; NP-P: dieta proteica de nivel normal + probiótico; LP-P, dieta proteica de bajo nivel + probiótico.
Además, observamos cambios en la composición del microbioma intestinal de los cerdos en crecimiento a nivel de filo y género. A nivel del filo (Figura 2A; Tabla Suplementaria S2), la suplementación con probióticos redujo la abundancia de Firmicutes (p < 0,001) mientras que aumentó la de Bacteroidota (p = 0,38), en comparación con la de los grupos sin suplementación con probióticos. La desulfobacterota se enriqueció tanto en el grupo NP como en el NP-P (0,28 y 0,33%, respectivamente; p < 0,001). Además, la abundancia de varios géneros bacterianos aumentó en los grupos probióticos (Figura 2B; Cuadro suplementario S3). Independientemente de los niveles de PC, grupo Prevotella NK3B31 (p < 0,001), Prevotella (p = 0,001), Muribaculaceae (p < 0,001), grupo Rikenellaceae RC9 (p < 0,001), grupo Eubacterium coprostanoligenes (p < 0,001), Selenomonadaceae no cultivada (p < 0,001) y Alloprevotella (p 0,001) y Alloprevotella (p < 4,136) se enriquecieron significativamente con suplementos probióticos. La abundancia de Lachnospiraceae NK0A001 se enriqueció con suplementos probióticos (p < 1,0), pero se observó un mayor aumento en el caso de la dieta CP normal. Por el contrario, la abundancia de Clostridium sensu stricto 001 y Terrisporobacter se redujo en los grupos LP-P y NP-P (p < 0,004). Por otro lado, tanto NP como NP-P enriquecieron la abundancia de Roseburia (p = 0,004) y Ruminococcus (p = 0,001); LP y LP-P tuvieron mayor población de Dialister (p < 0,003) y Megasphaera (p = <>,<>).
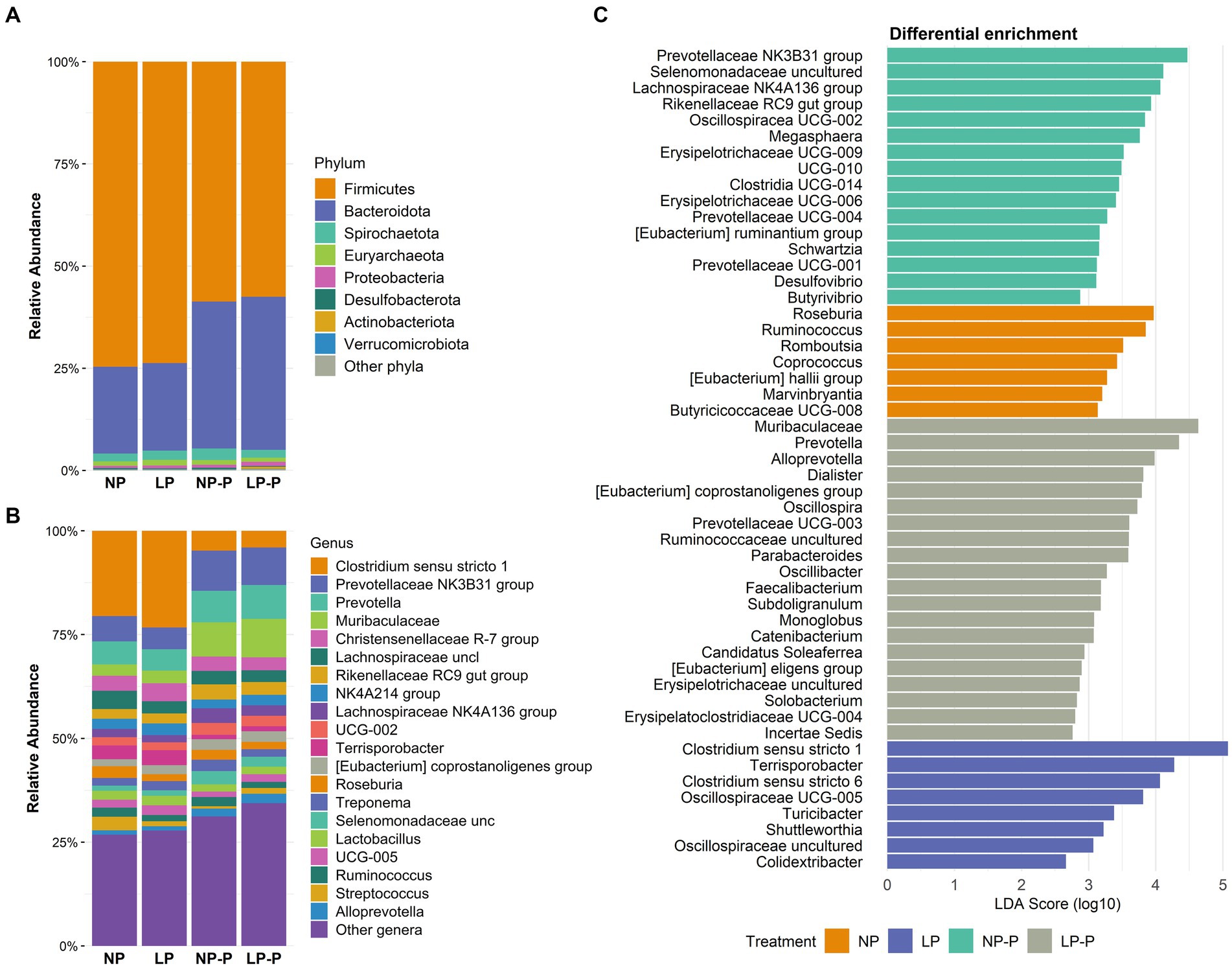 Figura 2. Cambios en la composición del microbioma intestinal. Abundancia relativa (%) a nivel de filo (A) y género (B). Análisis de abundancia diferencial (LEfSe) que muestra las características taxonómicas identificadas entre los tratamientos (C). NP: dieta proteica de nivel normal; LP: dieta de bajo nivel de proteínas; NP-P: dieta proteica de nivel normal + probiótico; LP-P, dieta baja en proteínas + probiótico.
Figura 2. Cambios en la composición del microbioma intestinal. Abundancia relativa (%) a nivel de filo (A) y género (B). Análisis de abundancia diferencial (LEfSe) que muestra las características taxonómicas identificadas entre los tratamientos (C). NP: dieta proteica de nivel normal; LP: dieta de bajo nivel de proteínas; NP-P: dieta proteica de nivel normal + probiótico; LP-P, dieta baja en proteínas + probiótico.
Para examinar los marcadores taxonómicos en cada grupo de tratamiento, se realizó un análisis de abundancia diferencial utilizando LEfSe (Figura 2C). NP dieta enriquecida diferencialmente Roseburia, Ruminococcus, Romboutsia, Coprococcus, Eubacterium hallii, Marvinbryantia y Butyricicoccaceae UCG-008; el grupo LP exhibió abundancia diferencial de Clostridium sensu stricto 1 y 6, Terrisporobacter y Oscillospiraceae no cultivadas. Mientras tanto, el grupo NP-P fue abundante en el grupo Prevotellaceae NK3B31, Selenomonadaceae no cultivadas, Lachnospiraceae NK4A136 grupo, Eubacterium ruminantium y Butyrivibrio; y el grupo LP-P tenía diferencialmente abundantes Muribaculaceae, Prevotella, Oscillospira, Alloprevotella y Catenibacterium.
3.4. Asociaciones entre el microbioma intestinal y los metabolitos fecales
A continuación, examinamos la asociación entre el microbioma intestinal y los metabolitos fecales. Los coeficientes de correlación de Pearson se calcularon y visualizaron utilizando un mapa de calor (Figura 3). Prevotella, Eubacterium ruminantium, Catenibacterium, Alloprevotella, Prevotellaceae NK3B31 grupo, Roseburia, Butyrivibrio, Dialister y Selenomonadaceae no cultivadas se correlacionaron positivamente con las concentraciones de poliaminas fecales. Oscillospiraceae UCG-002, Eubacterium coprostanoligenes, Erysipelatoclostridiaceae UCG-004, Desulfovibrio, Lachnospiraceae NK4A136 group, Muribaculaceae y UCG-010 tienen asociaciones positivas con SCFAs. Los BCFA (isobutirato e isovalerato) se asociaron positivamente con las abundancias de Parabacteroides, Alloprevotella, Prevotellaceae NK3B31, Erysipelatoclostridiaceae UCG-004, Lachnospiraceae NK4A136 grupo, Muribaculaceae, UCG-010 y Butyricicoccaceae UCG-008. Por el contrario, Romboutsia, Clostridium sensu stricto 1 y 6, Oscillospiraceae no cultivadas, Terrisporobacter, Marvinbryantia, Eubacterium hallii group y Turicibacter se asociaron negativamente con poliaminas fecales, AGCC y AGBC. Además, cabe destacar que la microbiota intestinal enriquecida por la adición del probiótico multiespecie (NP-P o LP-P) generalmente se asoció positivamente con metabolitos fecales y, a la inversa, la microbiota abundante en NP o LP tuvo una relación inversa con los metabolitos fecales.
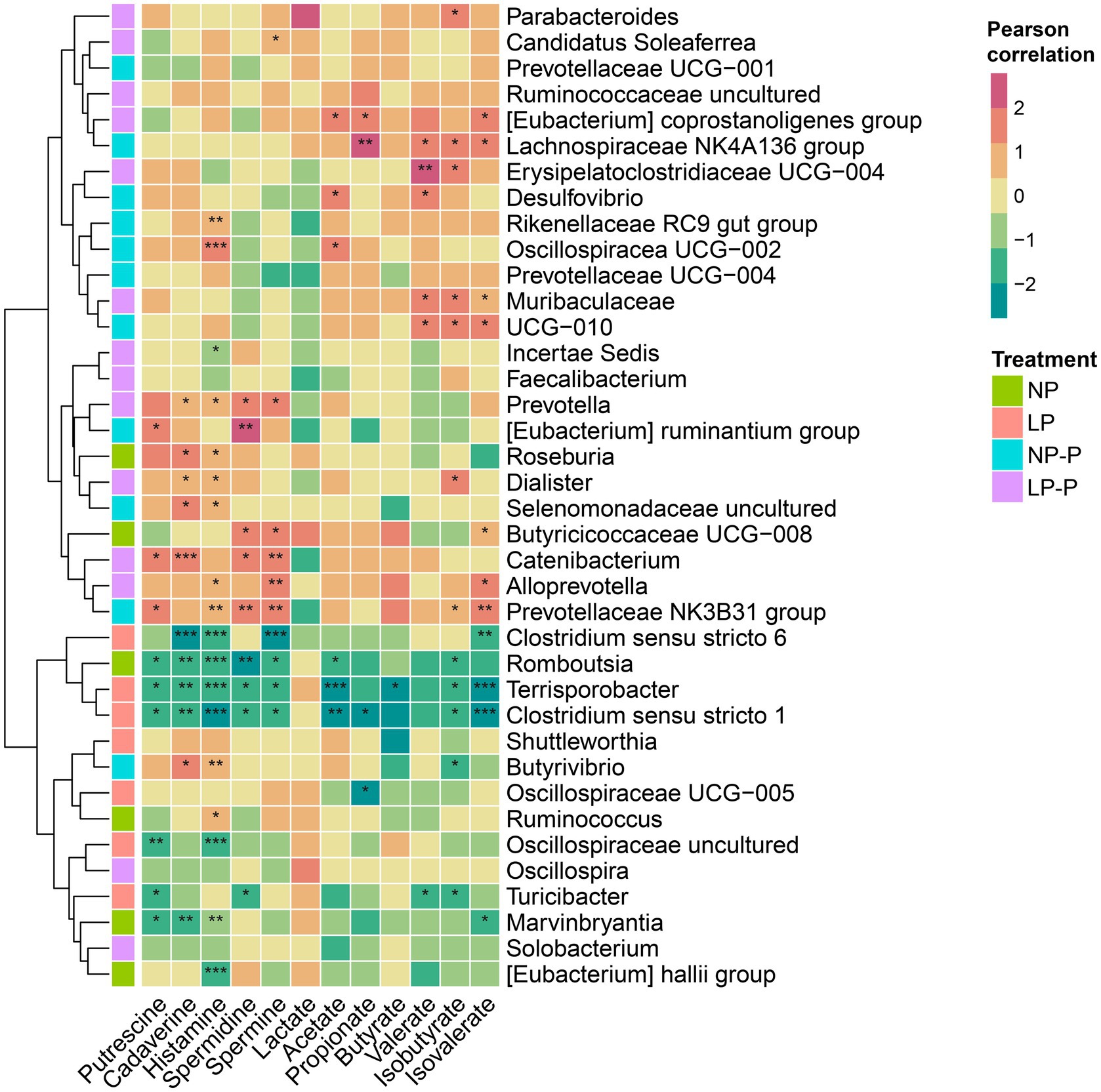 Figura 3. La composición del microbioma intestinal se correlaciona con los metabolitos fecales. Mapas de calor basados en coeficientes de correlación de Pearson que muestran la relación entre el microbioma intestinal y los niveles de metabolitos fecales (AGCC, BCFA, lactato, poliaminas). *, ** y *** representan p < 0,05, p < 0,01 y p < 0,001, respectivamente. NP: dieta proteica de nivel normal; LP: dieta de bajo nivel de proteínas; NP-P: dieta proteica de nivel normal + probiótico; LP-P, dieta proteica de bajo nivel + probiótico.
Figura 3. La composición del microbioma intestinal se correlaciona con los metabolitos fecales. Mapas de calor basados en coeficientes de correlación de Pearson que muestran la relación entre el microbioma intestinal y los niveles de metabolitos fecales (AGCC, BCFA, lactato, poliaminas). *, ** y *** representan p < 0,05, p < 0,01 y p < 0,001, respectivamente. NP: dieta proteica de nivel normal; LP: dieta de bajo nivel de proteínas; NP-P: dieta proteica de nivel normal + probiótico; LP-P, dieta proteica de bajo nivel + probiótico.
3.5. Predicción de los marcadores funcionales del microbioma intestinal
Para evaluar los efectos de la suplementación con probióticos multiespecies en la dieta sobre la función del microbioma intestinal de cerdos en crecimiento alimentados con diferentes niveles de PC, se predijeron vías metabólicas utilizando PICRUSt2 y la base de datos KEGG. Las vías KEGG para el metabolismo (aminoácidos, carbohidratos y energía) se seleccionaron y visualizaron en un mapa de calor (Figura 4). La adición de probióticos multiespecies alteró la función prevista del microbioma intestinal con respecto al metabolismo. Varias vías de metabolismo de aminoácidos mostraron mayor abundancia en los grupos NP-P y LP-P, como el metabolismo de D-alanina, glicina, serina y treonina, D-glutamina y D-glutamato, D-arginina y D-ornitina, fenilalanina, alanina, aspartato y glutamato. Mientras que el metabolismo de cisteína, metionina, histidina, triptófano y tirosina se enriqueció en los grupos NP y LP. Además, las vías del metabolismo de los carbohidratos fueron las más predichas en los grupos NP y LP, como la vía del fosfato de pentosa, el metabolismo de la fructosa y la manosa, el metabolismo del almidón y la sacarosa, el metabolismo de la galactosa, el metabolismo del azúcar amino y el azúcar de nucleótidos y el metabolismo del propanoato. Finalmente, las vías de recolección de energía, como el metabolismo del azufre, se enriquecieron en los grupos NP-P y LP-P, mientras que el metabolismo del nitrógeno se enriqueció en los grupos NP y LP.
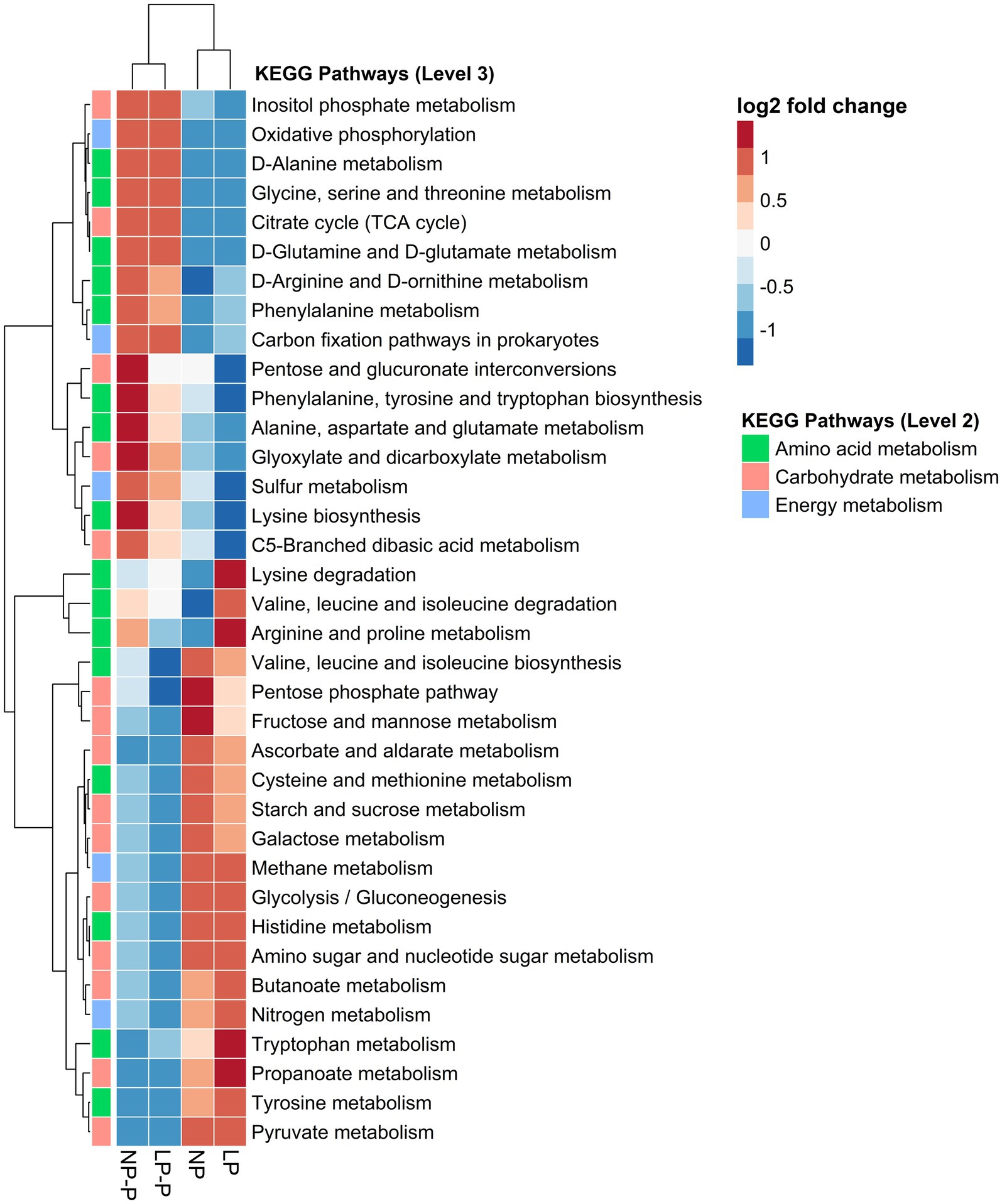 Figura 4. Cambios en la capacidad funcional del microbioma intestinal. Mapa de calor que muestra las abundancias relativas de las vías KEGG relacionadas con el metabolismo entre diferentes grupos. NP: dieta proteica de nivel normal; LP: dieta de bajo nivel de proteínas; NP-P: dieta proteica de nivel normal + probiótico; LP-P, dieta proteica de bajo nivel + probiótico.
Figura 4. Cambios en la capacidad funcional del microbioma intestinal. Mapa de calor que muestra las abundancias relativas de las vías KEGG relacionadas con el metabolismo entre diferentes grupos. NP: dieta proteica de nivel normal; LP: dieta de bajo nivel de proteínas; NP-P: dieta proteica de nivel normal + probiótico; LP-P, dieta proteica de bajo nivel + probiótico.
4. Discusión
En el presente estudio, observamos que la suplementación con probióticos multiespecie en la dieta moduló significativamente la estructura del microbioma intestinal de los cerdos en crecimiento; sin embargo, no se observaron efectos similares por los diferentes niveles de PC en la dieta. Estos resultados están de acuerdo con los resultados reportados por Tang et al. (2019) quienes mostraron que los probióticos tienen un efecto más significativo en el microbioma intestinal de los cerdos que los niveles de PC en la dieta. Los datos de un metaanálisis revelaron que la reducción del nivel de PC en un 2-3% puede no ser suficiente para influir en la microbiota intestinal, especialmente en un corto período de alimentación (Luise et al., 2021). Yu et al. (2019) informaron que la reducción de la PC del 17 al 14% no alteró la microbiota colónica de los cerdos. Además, la falta de diferencia entre la microbiota de NP y LP podría verse influenciada por la muestra elegida en el estudio actual (es decir, heces versus íleon), como señalan Pollock et al. (2019).
Además de la composición del microbioma intestinal, los metabolitos derivados de microbios, como los AGCC, los AGCC y las poliaminas, también afectan la salud intestinal del huésped. Los AGCC, principalmente butirato, propionato y acetato, se producen en el colon proximal como producto de la fibra y, en cierta medida, de la degradación de proteínas (Dávila et al., 2013; Louis y Flint, 2017). Estudios recientes han demostrado que estos metabolitos desempeñan un papel en la regulación de la homeostasis en el tracto gastrointestinal del huésped (TGI). Los AGCC estimulan la proliferación celular, suprimen las citoquinas proinflamatorias y mejoran la expresión de proteínas de unión estrecha (Grilli et al., 2016; Zhong et al., 2019; Han et al., 2020; Xu et al., 2020). Una reducción en el nivel de PC en la dieta podría reducir la capacidad de los comensales intestinales para producir metabolitos beneficiosos debido a la capacidad de fermentación deteriorada (Luise et al., 2021). Por lo tanto, esto podría ser un efecto no deseado de las estrategias de reducción de PC. En el presente estudio, observamos una disminución en los niveles de AGCC, como propionato y valerato, con disminución del nivel de PC, que se ha observado en estudios previos (Chen et al., 2018; Yu et al., 2019). Sin embargo, la adición de probióticos multiespecies aumentó los niveles de estos AGCC, especialmente en el grupo LP-P, lo que indica que los probióticos restauraron la capacidad del microbioma intestinal para producir AGCC. En contraste, la adición de probióticos multiespecies no alteró significativamente los niveles de lactato fecal, potencialmente ya que no hubo cambios en los niveles dietéticos de carbohidratos. Al igual que los AGCC, los AGCC, como el isobutirato y el isovalerato, son metabolitos bacterianos importantes. Aunque los BCFA están asociados con la fermentación de proteínas (Rist et al., 2013; Rios-Covian et al., 2020), el bajo nivel de CP o la suplementación con probióticos no ejercieron ningún efecto notable sobre los AGCC en el presente estudio. El análisis de correlación reveló que Oscillospiraceae UCG-002, Eubacterium coprostanoligenes, Lachnospiraceae NK4A136 grupo, Muribaculaceae y Oscillospiraceae UCG-010 se correlacionaron positivamente con los niveles de SCFA y BCFA. En contraste, Prevotellaceae no clasificadas, Prevotellaceae NK3B31 y Alloprevotella se correlacionaron positivamente solo con los niveles de BCFA. La familia bacteriana Lachnospiraceae y varios miembros del género Eubacterium producen AGCC (Biddle et al., 2013; Mukherjee et al., 2020). Además, Muribaculaceae y Oscillospiraceae están asociadas con una alta producción de AGCC (Smith et al., 2021; Yang y otros, 2021; You et al., 2022). Prevotella y Eubacterium son marcadores para la producción de AGCC y BCFA (Trefflich et al., 2021). Se ha demostrado que la suplementación con probióticos aumenta la capacidad del microbioma intestinal para producir AGCC debido a la proliferación de bacterias productoras de metabolitos en el TGI (Sakata et al., 2003).
Las poliaminas son el producto de la fermentación de aminoácidos por la microbiota intestinal (Matsumoto y Benno, 2007; Tofalo et al., 2019). La producción de poliaminas por el microbioma se ve altamente afectada por la cantidad y la fuente de proteínas dietéticas (Rist et al., 2013; Wen et al., 2018). Además, como metabolitos microbianos, las poliaminas tienen importantes funciones reguladoras, como la promoción del desarrollo del intestino delgado en lechones, la supresión de la inflamación (Liu et al., 2019) y las funciones reguladoras en la gestación porcina (Wu et al., 2005). Las poliaminas ejercen efectos beneficiosos sobre la producción porcina, como aumentar el crecimiento y aliviar los síntomas de diarrea (Van Wettere et al., 2016; Liu et al., 2019). Sin embargo, cantidades excesivas de poliaminas están relacionadas con el daño intestinal y la aparición de diarrea en lechones (Ewtushik et al., 2000; Teti y otros, 2002; Pieper et al., 2015). Las poliaminas también pueden contribuir a la producción de excreciones malolientes en cerdos (Jang y Jung, 2018). Algunos estudios han reportado que los probióticos podrían afectar los niveles de poliaminas en el TGI, aunque los resultados fueron inconsistentes (Matsumoto et al., 2011; Ding et al., 2021). Observamos un pequeño aumento en los niveles de poliaminas en el grupo LP-P, lo que indica una capacidad limitada del probiótico multiespecie para restaurar la producción de poliaminas por el microbioma intestinal. Sin embargo, el análisis de correlación mostró que varios comensales intestinales se asociaron positivamente con las concentraciones de poliaminas fecales. Prevotella produce poliaminas como la espermidina (Hanfrey et al., 2011; Nelson et al., 2015), y Eubacterium y Ruminococcus, ambos miembros del filo Firmicutes, podrían metabolizar aminoácidos, como ornitina, arginina y lisina, para producir poliaminas (Li et al., 2021). Roseburia y Dialister también pueden producir poliaminas (Nelson et al., 2015; Tamanai-Shacoori et al., 2017). Nuestros resultados sugieren fuertemente que la dieta baja en PC podría reducir los metabolitos beneficiosos del microbioma intestinal, pero la adición de probióticos podría restaurar la producción de metabolitos por los comensales intestinales en una dieta baja en PC.
Además, observamos que la reducción en el nivel de PC en la dieta también influyó en la función del microbioma intestinal, lo que es consistente con los resultados de estudios previos (Liu et al., 2021; Tao et al., 2021). Las vías relacionadas con el metabolismo de los aminoácidos se enriquecieron en los grupos LP-P y NP-P en comparación con los grupos NP o LP. Esto sugiere fuertemente que los probióticos pueden restaurar la capacidad del microbioma intestinal para utilizar proteínas no digeridas en el colon, mejorando así la producción de AGCC y poliaminas. Esto es consistente con la idea de que los probióticos mejoran la capacidad de digestión de proteínas del huésped (Wang y Ji, 2018; Peng et al., 2019; Akhtar et al., 2022). Además, las asociaciones de varios comensales que utilizan proteínas, como Prevotella, Alloprevotella, Eubacterium y Murabaculaceae con metabolitos relacionados con proteínas, podrían explicar el enriquecimiento de las vías del metabolismo de aminoácidos. Por lo tanto, planteamos la hipótesis de que se favoreció el enriquecimiento de las vías para el metabolismo de los aminoácidos en lugar de las vías de carbohidratos. El metabolismo de aminoácidos como glicina, treonina, glutamato, alanina y aspartato por las bacterias del colon puede producir AGCC, mientras que el metabolismo de lisina, arginina y ornitina produce poliaminas (Zhao et al., 2018). Además, la suplementación con probióticos favoreció las vías biosintéticas, como el ciclo de TCA; biosíntesis de fenilalanina, tirosina y triptófano; biosíntesis de lisina; e interconversión de pentosa y glucuronato. Según Portune et al. (2016), la función del microbioma puede cambiar a la utilización de compuestos nitrogenados para vías biosintéticas cuando hay una abundancia de otras fuentes de energía.
El pH fecal indica la capacidad de fermentación del colon. Un pH colónico más bajo es beneficioso para la salud intestinal, ya que puede suprimir el crecimiento de patógenos potenciales, mejorar la digestión de proteínas y puede indicar una mayor producción de metabolitos del microbioma intestinal, como los AGCC (Wen et al., 2018; Tang et al., 2019). Observamos que la suplementación con probióticos multiespecies resultó en una disminución significativa del pH fecal, lo que está de acuerdo con los resultados de estudios previos sobre el efecto de los probióticos en el pH colónico (Pereira et al., 2022). Una reducción en el nivel de CP dietética o la suplementación con probióticos mejora la puntuación fecal de los cerdos (Balasubramanian et al., 2018; Lu et al., 2018; Wen et al., 2018). Además, en el presente estudio, la adición de probióticos multiespecies a las dietas bajas en PC mejoró significativamente el contenido de humedad fecal y las puntuaciones fecales de los cerdos en crecimiento. Esto sugiere que el uso combinatorio de probióticos multiespecies con reducción de PC puede mejorar las heces acuosas en cerdos en crecimiento.
Este estudio tiene limitaciones. En primer lugar, el efecto de la reducción de la PC dietética puede tener un efecto más definitivo en otros segmentos del TGI que en el colon, que no fue explorado por el estudio actual. Además, no se midieron los efectos de la dieta baja en PC con probióticos multiespecie en la digestión o absorción real de proteínas, ya que este estudio se centró principalmente en el microbioma intestinal.
5. Conclusión
En el presente estudio, demostramos que la combinación de dieta baja en PC y suplementación con probióticos multiespecies mejoró las puntuaciones fecales de los cerdos. Además, los cerdos alimentados con probióticos multiespecies tenían una estructura y composición de microbioma distintas. Los cerdos alimentados con una dieta baja en PC con probióticos multiespecies tenían una mayor riqueza y diversidad de especies. La suplementación con probióticos multiespecies en alimentos con CP baja también alteró la actividad de digestión y utilización de proteínas del microbioma intestinal, lo que podría contribuir a concentraciones fecales más altas de AGCC y niveles de poliaminas marginalmente elevados. La población de microbiota intestinal como Oscillospiraceae UCG-002, Eubacterium coprostanoligenes, Lachnospiraceae NK4A136 grupo, Muribaculaceae Prevotella, Eubacterium ruminantium, Catenibacterium, Alloprevotella, Prevotellaceae NK3B31 grupo, Roseburia, Butyrivibrio y Dialister se asociaron con SCFA y niveles de poliaminas. Hasta donde sabemos, este es el primer estudio que describe los efectos de la suplementación con probióticos multiespecie y la dieta baja en PC en la función del microbioma intestinal. Por lo tanto, la suplementación con probióticos multiespecies puede complementar los efectos beneficiosos de los niveles bajos de PC en la alimentación de cerdos. Estos hallazgos pueden ayudar a formular estrategias de alimentación sostenible para la producción porcina. Los efectos de este enfoque combinado sobre la calidad de la producción animal y los aspectos medioambientales deben validarse aún más.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio / repositorios y el número (s) de acceso se pueden encontrar en el artículo / material complementario.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Cuidado de Animales de la Universidad de Dankook.
Contribuciones del autor
D-KK e IK: conceptualización. RV: curación, visualización y escritura de datos – borrador original. RV y SK: análisis formal y software. D-KK, IK y JO: metodología. RV, SK, JO, I-CH y JS: investigación. D-KK: redacción – revisión y edición. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por el Instituto Coreano de Planificación y Evaluación de Tecnología en Alimentación, Agricultura, Silvicultura y Pesca (IPET) a través del Programa de Apoyo a la Comercialización de Tecnología, financiado por el Ministerio de Agricultura, Alimentación y Asuntos Rurales (MAFRA) (Subvención No: 122038-2).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fmicb.2023.1192249/full#supplementary-material
Referencias
Akhtar, N., Cai, H. Y., Kiarie, E. G. y Li, J. (2022). Un nuevo Bacillus sp. con propiedades de crecimiento rápido y alta actividad enzimática que permite la fermentación eficiente de la harina de soja para mejorar la digestibilidad en cerdos en crecimiento. J. Appl. Microbiol. 133, 3–17. doi: 10.1111/jam.15268
Atakora, J. K. A., Moehn, S., Sands, J. S. y Ball, R. O. (2011). Efectos de la suplementación dietética de proteína cruda y fitasa-xilanasa de dietas basadas en granos de trigo sobre el metabolismo energético y el metano entérico en cerdos de engorde en crecimiento. Anim. Feed Sci. Technol. 166–167, 422–429. doi: 10.1016/j.anifeedsci.2011.04.030
Balasubramanian, B., Lee, S. I. y Kim, I. H. (2018). Inclusión de probióticos dietéticos multiespecie en el rendimiento del crecimiento, la digestibilidad de los nutrientes, los rasgos de calidad de la carne, la microbiota fecal y la puntuación de diarrea en cerdos en crecimiento y acabado. Ital. J. Anim. Sci. 17, 100–106. doi: 10.1080/1828051X.2017.1340097
Barba-Vidal, E., Martín-Orúe, S. M. y Castillejos, L. (2019). Aspectos prácticos del uso de probióticos en la producción porcina: una revisión. Livest. Sci. 223, 84–96. doi: 10.1016/j.livsci.2019.02.017
Biddle, A., Stewart, L., Blanchard, J. y Leschine, S. (2013). Desenredando las bases genéticas de la especialización fibrolítica por lachnospiraceae y ruminococcaceae en diversas comunidades intestinales. Diversidad 5, 627–640. DOI: 10.3390/D5030627
Bhandari, S. K., Opapeju, F. O., Krause, D. O. y Nyachoti, C. M. (2010). Nivel de proteína dietética y efectos de la suplementación con probióticos en la respuesta de los lechones al desafío de Escherichia coli K88: rendimiento y población microbiana intestinal. Livest. Sci. 133, 185–188. doi: 10.1016/j.livsci.2010.06.060
Bolyen, E., Rideout, J. R., Dillon, M. R., Bokulich, N. A., Abnet, C. C., Al-Ghalith, G. A., et al. (2019). Ciencia de datos de microbiomas reproducible, interactiva, escalable y extensible utilizando QIIME 2. Nat. Biotechnol. 37, 852–857. DOI: 10.1038/S41587-019-0209-9
Callahan, B. J., McMurdie, P. J., Rosen, M. J., Han, A. W., Johnson, A. J. A. y Holmes, S. P. (2016). DADA2: inferencia de muestras de alta resolución a partir de datos de amplicones Illumina. Métodos 13, 581–583. DOI: 10.1038/NMETH.3869
Cao, Y. (2020). microbiomaMarker: análisis de biomarcadores de microbioma. Disponible en: https://github.com/yiluheihei/microbiomeMarker (consultado el 20 de septiembre de 2022).
Chen, X., Song, P., Fan, P., He, T., Jacobs, D., Levesque, C. L., et al. (2018). La restricción moderada de proteínas en la dieta optimizó la microbiota intestinal y la barrera mucosa en el modelo de cerdo en crecimiento. Frente. Celda. Infecta. Microbiol. 8:246. doi: 10.3389/fcimb.2018.00246
Cho, S., Hwang, O. y Park, S. (2015). Efecto de los niveles de proteína dietética sobre la composición de compuestos olorosos y la ecología bacteriana en estiércol de cerdo. Asiático-Australas. J. Anim. 28, 1362–1370. doi: 10.5713/ajas.15.0078
Clark, O. G., Moehn, S., Edeogu, I., Price, J. y Leonard, J. (2005). Manipulación de proteínas dietéticas y polisacáridos sin almidón para controlar las emisiones de estiércol porcino. J. Medio ambiente. 34, 1461–1466. DOI: 10.2134/JEQ2004.0434
Equipo Core R (2019). Un lenguaje y entorno para la computación estadística. R encontrado. Stat. Comput. 2, disponible en: http://www.r-project.org (consultado el 31 de enero de 2023).
Dávila, A. M., Blachier, F., Gotteland, M., Andriamihaja, M., Benetti, P. H., Sanz, Y., et al. (2013). Reimpresión de «metabolismo luminal intestinal del nitrógeno: papel de la microbiota intestinal y consecuencias para el huésped». Pharmacol. 69, 114–126. doi: 10.1016/j.phrs.2013.01.003
Ding, H., Zhao, X., Ma, C., Gao, Q., Yin, Y., Kong, X., et al. (2021). La suplementación dietética con Bacillus subtilis DSM 32315 altera la microbiota intestinal y los metabolitos en lechones destetados. J. Appl. Microbiol. 130, 217–232. doi: 10.1111/jam.14767
Douglas, G. M., Maffei, V. J., Zaneveld, J. R., Yurgel, S. N., Brown, J. R., Taylor, C. M., et al. (2020). PICRUSt2 para la predicción de las funciones del metagenoma. Nat. Biotechnol. 38, 685–688. DOI: 10.1038/S41587-020-0548-6
Ewtushik, A. L., Bertolo, R. F. P. y Ball, R. O. (2000). Desarrollo intestinal de lechones destetados temprano que reciben dietas suplementadas con aminoácidos o poliaminas seleccionados. Can. J. Anim. 80, 653–662. doi: 10.4141/A99-134
Fan, P., Liu, P., Song, P., Chen, X. y Ma, X. (2017). La restricción moderada de proteínas en la dieta altera la composición de la microbiota intestinal y mejora la función de barrera ileal en el modelo de cerdo adulto. 7:43412. doi: 10.1038/srep43412
Grilli, E., Tugnoli, B., Foerster, C. J. y Piva, A. (2016). El butirato modula las citoquinas inflamatorias y los componentes de las uniones estrechas a lo largo del intestino de los cerdos destetados. J. Anim. 94, 433–436. DOI: 10.2527/jas.2015-9787
Han, Y., Zhao, Q., Tang, C., Li, Y., Zhang, K., Li, F., et al. (2020). El butirato mitiga los lechones destetados de la colitis inducida por lipopolisacáridos mediante la regulación de la microbiota y el metabolismo energético del eje intestino-hígado. Frente. Microbiol. 11:588666. doi: 10.3389/fmicb.2020.588666
Hanfrey, C. C., Pearson, B. M., Hazeldine, S., Lee, J., Gaskin, D. J., Woster, P. M., et al. (2011). La ruta biosintética alternativa de la espermidina es crítica para el crecimiento de Campylobacter jejuni y es la vía de poliamina dominante en la microbiota intestinal humana. J. Biol. Chem. 286, 43301–43312. DOI: 10.1074/JBC. M111.307835
Heo, J. M., Kim, J. C., Hansen, C. F., Mullan, B. P., Hampson, D. J. y Pluske, J. R. (2010). La alimentación con una dieta con un contenido de proteínas disminuido reduce tanto el contenido de nitrógeno en el tracto gastrointestinal como la diarrea posterior al destete, pero no afecta la digestibilidad aparente del nitrógeno en cerdos destetados desafiados con una cepa enterotoxigénica de Escheri. Anim. Feed Sci. Technol. 160, 148–159. doi: 10.1016/j.anifeedsci.2010.07.005
Jang, Y. N. y Jung, M. W. (2018). Cambios bioquímicos y origen biológico de las generaciones clave de compuestos de olor en purines de cerdo durante los períodos de almacenamiento en interiores: un enfoque de pirosecuenciación. Biomed. Res. Int. 2018:3503658. doi: 10.1155/2018/3503658
Kwak, M. J., Tan, P. L., Oh, J. K., Chae, K. S., Kim, J., Kim, S. H., et al. (2021). Los efectos de las formulaciones probióticas multiespecie sobre el rendimiento del crecimiento, el metabolismo hepático, la integridad intestinal y la microbiota fecal en cerdos en crecimiento-acabado. Anim. Feed Sci. Technol. 274:114833. doi: 10.1016/j.anifeedsci.2021.114833
Li, B., Liang, J., Hanfrey, C. C., Phillips, M. A. y Michael, A. J. (2021). El descubrimiento de las L-ornitina y L-lisina descarboxilasas ancestrales revela una evolución paralela y pseudoconvergente de la biosíntesis de poliaminas. J. Biol. Chem. 297:101219. doi: 10.1016/j.jbc.2021.101219
Li, L., Ruan, L., Ji, A., Wen, Z., Chen, S., Wang, L., et al. (2018). Análisis de aminas biógenas y aporte microbiano en alimentos fermentados tradicionales de Douchi. 8:12567. DOI: 10.1038/S41598-018-30456-Z
Liu, Y., Azad, M. A. K., Zhao, X., Zhu, Q. y Kong, X. (2022). Niveles de proteína cruda en la dieta Alterar la incidencia de diarrea, la inmunidad y la función de barrera intestinal de los mini cerdos Huanjiang durante diferentes etapas de crecimiento. Frente. Immunol. 13:908753. DOI: 10.3389/FIMMU.2022.908753
Liu, R., He, J., Ji, X., Zheng, W. y Yao, W. (2021). Una reducción moderada de la proteína cruda de la dieta proporciona un rendimiento de crecimiento comparable y mejora el metabolismo a través del cambio de la microbiota intestinal en cerdos de cría Sushan. Animales 11:1166. doi: 10.3390/ani11041166
Liu, B., Jiang, X., Cai, L., Zhao, X., Dai, Z., Wu, G., et al. (2019). La putrescina mitiga la atrofia intestinal mediante la supresión de la respuesta inflamatoria en lechones destetados. J. Anim. Sci. Biotechnol. 10:69. doi: 10.1186/s40104-019-0379-9
Louis, P. y Flint, H. J. (2017). Formación de propionato y butirato por la microbiota colónica humana. Entorno. Microbiol. 19, 29–41. doi: 10.1111/1462-2920.13589
Lu, X., Zhang, M., Zhao, L., Ge, K., Wang, Z., Jun, L., et al. (2018). Rendimiento de crecimiento y diarrea post-destete en lechones alimentados con una dieta suplementada con complejos probióticos. J. Microbiol. Biotecnología. 28, 1791–1799. doi: 10.4014/jmb.1807.07026
Luise, D., Chalvon-Demersay, T., Lambert, W., Bosi, P. y Trevisi, P. (2021). Metanálisis para evaluar el impacto de la reducción de la proteína cruda en la dieta en la salud intestinal de los cerdos después del destete. Ital. J. Anim. Sci. 20, 1386–1397. doi: 10.1080/1828051X.2021.1952911
Lynegaard, J. C., Kjeldsen, N. J., Bache, J. K., Weber, N. R., Hansen, C. F., Nielsen, J. P., et al. (2021). Un nivel de PC muy bajo redujo la diarrea y la productividad en cerdos destetados, pero no se encontraron diferencias entre las dietas posteriores al destete, incluida la harina de soja o el concentrado de proteína de soja. Animales 11:678. DOI: 10.3390/ANI11030678
Martín, M. (2011). Cutadapt elimina las secuencias de adaptador de las lecturas de secuenciación de alto rendimiento. EMBnet. J. 17:10. doi: 10.14806/ej.17.1.200
Matsumoto, M., y Benno, Y. (2007). La relación entre la microbiota y la concentración de poliaminas en el intestino humano: un estudio piloto. Microbiol. Immunol. 51, 25–35. doi: 10.1111/j.1348-0421.2007.tb03887.x
Matsumoto, M., Kurihara, S., Kibe, R., Ashida, H. y Benno, Y. (2011). La longevidad en ratones es promovida por la supresión inducida por probióticos de la senescencia colónica dependiente de la regulación positiva de la producción de poliaminas bacterianas intestinales. PLoS One 6:e23652. doi: 10.1371/journal.pone.0023652
Millet, S., Aluwé, M., De Boever, J., De Witte, B., Douidah, L., Van den Broeke, A., et al. (2018). El efecto de la reducción de proteína cruda sobre el rendimiento y el metabolismo del nitrógeno en lechones (de cuatro a nueve semanas de edad) alimentados con dos niveles dietéticos de lisina1. J. Anim. 96, 3824–3836. doi: 10.1093/jas/sky254
Mori, K., Ito, T., Miyamoto, H., Ozawa, M., Wada, S., Kumagai, Y., et al. (2011). La administración oral de suplementos microbianos multiespecie a las cerdas influye en la composición de la microbiota intestinal y los ácidos orgánicos fecales en sus lechones post-destetados. J. Biosci. Bioeng. 112, 145–150. doi: 10.1016/j.jbiosc.2011.04.009
Mukherjee, A., Lordan, C., Ross, R. P. y Cotter, P. D. (2020). Microbios intestinales del género filogenéticamente diverso Eubacterium y sus diversas contribuciones a la salud intestinal. Microbios intestinales 12:1802866. doi: 10.1080/19490976.2020.1802866
Consejo Nacional de Investigación (2012). Requerimiento de nutrientes de los cerdos. 11ª ed. National Research Council, Academy Press, Washington, DC, Estados Unidos.
Nelson, T. M., Borgogna, J.-L. C., Brotman, R. M., Ravel, J., Walk, S. T. y Yeoman, C. J. (2015). Aminas biógenas vaginales: ¿biomarcadores de vaginosis bacteriana o precursores de la disbiosis vaginal? Frente. Physiol. 6:253. DOI: 10.3389/FPHYS.2015.00253
Nowland, T. L., Plush, K. J., Barton, M. y Kirkwood, R. N. (2019). Desarrollo y función del microbioma intestinal y posibles implicaciones para la producción porcina. Animales 9:76. DOI: 10.3390/ANI9030076
Nyachoti, C. M., Omogbenigun, F. O., Rademacher, M. y Blank, G. (2006). Respuestas de rendimiento e indicadores de salud gastrointestinal en cerdos destetados temprano alimentados con dietas suplementadas con aminoácidos bajos en proteínas1. J. Anim. 84, 125–134. doi: 10.2527/2006.841125x
Oh, J. K., Vasquez, R., Kim, S. H., Hwang, I. C., Song, J. H., Park, J. H., et al. (2021). Los probióticos multiespecie alteran los ácidos grasos fecales de cadena corta y los niveles de lactato en cerdos destetados mediante la modulación de la microbiota intestinal. J. Anim. Sci. Technol. 63, 1142–1158. DOI: 10.5187/JAST.2021.E94
Opapeju, F. O., Rademacher, M., Blank, G. y Nyachoti, C. M. (2008). Efecto de las dietas suplementadas con aminoácidos bajos en proteínas sobre el rendimiento de crecimiento, la morfología intestinal, el peso de los órganos y las características de la digesta de cerdos destetados. Animal 2, 1457–1464. doi: 10.1017/S175173110800270X
Park, J. H., Lee, S. I. y Kim, I. H. (2018). Efecto de la suplementación dietética de β-glucano sobre el rendimiento del crecimiento, la digestibilidad de los nutrientes y las características de las heces en cerdos destetados. J. Appl. Anim. 46, 1193–1197. doi: 10.1080/09712119.2018.1481855
Peng, X.-P., Nie, C., Guan, W.-Y., Qiao, L.-D., Lu, L. y Cao, S.-J. (2019). Regulación de probióticos en el metabolismo de proteínas dietéticas en el intestino. Curr. Proteína Pept. Sci. 21, 766–771. DOI: 10.2174/1389203720666191111112941
Pereira, W. A., Franco, S. M., Reis, I. L., Mendonça, C. M. N., Piazentin, A. C. M., Azevedo, P. O. S., et al. (2022). Efectos beneficiosos de los probióticos en el ciclo de producción porcina: una visión general de los impactos clínicos y el rendimiento. Veterinario Microbiol. 269:109431. doi: 10.1016/j.vetmic.2022.109431
Pieper, R., Vahjen, W. y Zentek, J. (2015). Fibra dietética y proteína bruta: impacto en las características de fermentación microbiana gastrointestinal y la respuesta del huésped. Anim. Prod. Sci. 55:1367. doi: 10.1071/AN15278
Pieper, R., Villodre Tudela, C., Taciak, M., Bindelle, J., Pérez, J. F. y Zentek, J. (2016). Relevancia para la salud de la fermentación intestinal de proteínas en cerdos jóvenes. 17, 137–147. doi: 10.1017/S1466252316000141
Pollock, J., Hutchings, M. R., Hutchings, K. E. K., Gally, D. L. y Houdijk, J. G. M. (2019). Cambios en el microbioma ileal, pero no fecal, en respuesta al aumento del nivel de proteína en la dieta y la exposición enterotoxigénica a Escherichia coli en cerdos. Aplicación. Entorno. Microbiol. 85. doi: 10.1128/AEM.01252-19
Portune, K. J., Beaumont, M., Davila, A.-M., Tomé, D., Blachier, F. y Sanz, Y. (2016). El papel de la microbiota intestinal en el metabolismo de las proteínas dietéticas y los resultados relacionados con la salud: las dos caras de la moneda. Tendencias Food Sci. Technol. 57, 213–232. doi: 10.1016/j.tifs.2016.08.011
Quast, C., Pruesse, E., Yilmaz, P., Gerken, J., Schweer, T., Yarza, P., et al. (2013). El proyecto de base de datos de genes de ARN ribosómico SILVA: procesamiento de datos mejorado y herramientas basadas en la web. Ácidos nucleicos res. 41, 590–596. doi: 10.1093/nar/gks1219
Rios-Covian, D., González, S., Nogacka, A. M., Arboleya, S., Salazar, N., Gueimonde, M., et al. (2020). Una visión general sobre los ácidos grasos de cadena corta ramificados fecales a lo largo de la vida humana y en relación con el índice de masa corporal: factores dietéticos y antropométricos asociados. Frente. Microbiol. 11:973. DOI: 10.3389/FMICB.2020.00973
Rist, V. T. S., Weiss, E., Eklund, M. y Mosenthin, R. (2013). Impacto de la proteína dietética en la composición y actividad de la microbiota en el tracto gastrointestinal de los lechones en relación con la salud intestinal: una revisión. Animal 7, 1067–1078. doi: 10.1017/S1751731113000062
Sakata, T., Kojima, T., Fujieda, M., Takahashi, M. y Michibata, T. (2003). Influencias de las bacterias probióticas en la producción de ácidos orgánicos por bacterias cecales porcinas in vitro. Proc. Nutr. Soc. 62, 73–80. DOI: 10.1079/PNS2002211
Segata, N., Izard, J., Waldron, L., Gevers, D., Miropolsky, L., Garrett, W. S., et al. (2011). Descubrimiento y explicación de biomarcadores metagenómicos. Genoma Biol. 12:R60. DOI: 10.1186/GB-2011-12-6-R60
Smith, B. J., Miller, R. A. y Schmidt, T. M. (2021). Los genomas de Muribaculaceae ensamblados a partir de metagenomas sugieren impulsores genéticos de la respuesta diferencial al tratamiento con acarbosa en ratones. mSphere :6. DOI: 10.1128/msphere.00851-21
Tamanai-Shacoori, Z., Smida, I., Bousarghin, L., Loreal, O., Meuric, V., Fong, S. B., et al. (2017). Roseburia spp.: ¿un marcador de salud? Microbiol del futuro. 12, 157–170. DOI: 10.2217/FMB-2016-0130
Tang, W., Qian, Y., Yu, B., Zhang, T., Gao, J., He, J., et al. (2019). Efectos de la suplementación con Bacillus subtilis DSM32315 y el nivel de proteína cruda dietética sobre el rendimiento, la función de barrera intestinal y el perfil de microbiota en lechones destetados. J. Anim. 97, 2125–2138. doi: 10.1093/jas/skz090
Tao, X., Deng, B., Yuan, Q., Men, X., Wu, J. y Xu, Z. (2021). La dieta baja en proteínas crudas afecta el microbioma intestinal y el metaboloma de manera diferente en túmulos y cerdas jóvenes. Frente. Microbiol. 12:717727. doi: 10.3389/fmicb.2021.717727
Teti, D., Visalli, M. y McNair, H. (2002). Análisis de poliaminas como marcadores de condiciones fisiológicas (patológicas). J. Cromatografía. B 781, 107–149. doi: 10.1016/S1570-0232(02)00669-4
Tilocca, B., Burbach, K., Heyer, C. M. E., Hoelzle, L. E., Mosenthin, R., Stefanski, V., et al. (2017). Los cambios dietéticos en los estudios nutricionales dan forma a la composición estructural y funcional del microbioma fecal de los cerdos, de días a semanas. Microbioma 5:144. DOI: 10.1186/S40168-017-0362-7
Timmerman, H. M., Koning, C. J. M., Mulder, L., Rombouts, F. M. y Beynen, A. C. (2004). Probióticos monocepa, multicepa y multiespecie: una comparación de funcionalidad y eficacia. Int. J. Food Microbiol. 96, 219–233. doi: 10.1016/j.ijfoodmicro.2004.05.012
Tofalo, R., Cocchi, S. y Suzzi, G. (2019). Poliaminas y microbiota intestinal. Frente. Nutr. 6:16. doi: 10.3389/fnut.2019.00016
Trefflich, I., Dietrich, S., Braune, A., Abraham, K. y Weikert, C. (2021). Ácidos grasos de cadena corta y ramificada como marcadores fecales de la actividad de la microbiota en veganos y omnívoros. Nutrientes 13:1808. DOI: 10.3390/NU13061808
Van Wettere, W. H. E. J., Willson, N. L., Pain, S. J. y Forder, R. E. A. (2016). Efecto de la suplementación oral de poliaminas antes del destete sobre el crecimiento de lechones y las características intestinales. Animal 10, 1655–1659. doi: 10.1017/S1751731116000446
Vasquez, R., Oh, J. K., Song, J. H., y Kang, D.-K. (2022). Metabolitos producidos por el microbioma intestinal en cerdos: una revisión sobre sus funciones biológicas y la influencia de los probióticos. J. Anim. Sci. Technol. 64, 671–695. doi: 10.5187/jast.2022.e58
Wang, J. y Ji, H. (2018). Influencia de los probióticos en la digestión de proteínas dietéticas y la utilización en el tracto gastrointestinal. Curr. Proteína Pept. Sci. 20, 125–131. DOI: 10.2174/1389203719666180517100339
Wen, X., Wang, L., Zheng, C., Yang, X., Ma, X., Wu, Y., et al. (2018). Puntuaciones fecales y metabolitos microbianos en lechones destetados alimentados con diferentes fuentes y niveles de proteínas. Anim. Nutr. 4, 31–36. doi: 10.1016/j.aninu.2017.10.006
Wu, G., Bazer, F. W., Hu, J., Johnson, G. A. y Spencer, T. E. (2005). Síntesis de poliaminas a partir de prolina en la placenta porcina en desarrollo. Biol. Reprod. 72, 842–850. doi: 10.1095/biolreprod.104.036293
Xu, X., Yang, C., Chang, J., Wang, P., Yin, Q., Liu, C., et al. (2020). La suplementación dietética con probióticos compuestos y berberina altera el rendimiento de producción de lechones y la microbiota fecal. Animales 10:511. DOI: 10.3390/ANI10030511
Yang, J., Li, Y., Wen, Z., Liu, W., Meng, L. y Huang, H. (2021). Oscillospira – un candidato para los probióticos de próxima generación. Microbios intestinales 13:1987783. doi: 10.1080/19490976.2021.1987783
Yoon, H., Park, J. H., Choi, A., Hwang, H. J. y Mah, J. H. (2015). Validación de un método analítico de HPLC para la determinación de aminas biógenas en productos agrícolas y monitoreo de aminas biógenas en productos agrícolas fermentados coreanos. Toxicol. 31, 299–305. doi: 10.5487/TR.2015.31.3.299
You, H., Tan, Y., Yu, D., Qiu, S., Bai, Y., He, J., et al. (2022). El efecto terapéutico de la regulación mediada por SCFA del ambiente intestinal sobre la obesidad. Frente. Nutr. 9:886902. doi: 10.3389/fnut.2022.886902
Yu, D., Zhu, W. y Hang, S. (2019). Efectos de la dieta baja en proteínas sobre la morfología intestinal, la actividad de las enzimas digestivas, el nitrógeno ureico en sangre y la microbiota intestinal y los metabolitos en cerdos destetados. Arq. Anim. Nutr. 73, 287–305. doi: 10.1080/1745039X.2019.1614849
Zhang, C., Yu, M., Yang, Y., Mu, C., Su, Y. y Zhu, W. (2016). Efecto de la administración temprana de antibióticos sobre las comunidades bacterianas cecales y sus perfiles metabólicos en cerdos alimentados con dietas con diferentes niveles de proteína. Anaerobio 42, 188–196. doi: 10.1016/j.anaerobe.2016.10.016
Zhang, Q., Vasquez, R., Yoo, J. M., Kim, S. H., Kang, D.-K. y Kim, I. H. (2022). La suplementación dietética de Limosilactobacillus mucosae LM1 mejora las funciones inmunes y modula la microbiota intestinal sin afectar el rendimiento de crecimiento de los cerdos en crecimiento. Frente. Vet. Sci. 9:918114. doi: 10.3389/fvets.2022.918114
Zhao, J., Zhang, X., Liu, H., Brown, M. A. y Qiao, S. (2018). Composición y función de las proteínas dietéticas y la microbiota intestinal. Curr. Proteína Pept. Sci. 20, 145–154. doi: 10.2174/1389203719666180514145437
Zhong, X., Zhang, Z., Wang, S., Cao, L., Zhou, L., Sun, A., et al. (2019). El butirato de conducción microbiana regula la homeostasis yeyunal en lechones durante la etapa de destete. Frente. Microbiol. 10:3335. doi: 10.3389/fmicb.2018.03335
Zhu, C., Yang, J., Wu, Q., Chen, J., Yang, X., Wang, L., et al. (2022). La dieta baja en proteínas mejora la calidad de la carne y modula la composición de la microbiota intestinal en cerdos de engorde. Frente. Vet. Sci. 9. DOI: 10.3389/fvets.2022.843957
Zimmermann, J. A., Fusari, M. L., Rossler, E., Blajman, J. E., Romero-Scharpen, A., Astesana, D. M., et al. (2016). Efectos de los probióticos en el rendimiento del crecimiento porcino: un metanálisis de ensayos controlados aleatorios. Anim. Feed Sci. Technol. 219, 280–293. doi: 10.1016/j.anifeedsci.2016.06.021
Cita: Vasquez R, Kim SH, Oh JK, Song JH, Hwang I-C, Kim IH y Kang D-K (2023) La suplementación con probióticos multiespecies en la dieta con niveles reducidos de proteína cruda alteró la composición y función del microbioma intestinal y restauró los metabolitos derivados del microbioma en cerdos en crecimiento. Frente. Microbiol. 14:1192249. doi: 10.3389/fmicb.2023.1192249
Recibido: 23 de marzo de 2023; Aprobado: 23 de junio de 2023;
Publicado: 07 julio 2023.
Editado por:
Renpeng Du, Universidad de Heilongjiang, China
Revisado por:
Neeta Agarwal, Instituto Indio de Investigación Veterinaria (IVRI), India
Martin Nyachoti, Universidad de Manitoba, Canadá
Derechos de autor © 2023 Vasquez, Kim, Oh, Song, Hwang, Kim y Kang. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Dae-Kyung Kang, dkkang@dankook.ac.kr
†Direcciones actuales: Sang Hoon Kim, Departamento de Ciencias Farmacéuticas, Facultad de Farmacia, Florida A&M University, Tallahassee, FL, Estados Unidos
Ju Kyoung Oh, CJ CheilJedang, CJ Blossom Park, Suwon, República de Corea
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía