La variante AA del genotipo 1 de Homer se relaciona con el síndrome congénito de patas abiertas en lechones
La variante AA del genotipo 1 de Homer se relaciona con el síndrome congénito de patas abiertas en lechones al reprimir Pax7 en progenitores miogénicos
 Toni Schumacher1
Toni Schumacher1  Henry Reyer2
Henry Reyer2  Steffen Maak1
Steffen Maak1  Monika Röntgen1*
Monika Röntgen1*- 1Instituto de Biología Muscular y Crecimiento, Instituto de Investigación de Biología de Animales de Granja (FBN), Dummerstorf, Alemania
- 2Instituto de Biología Genómica, Instituto de Investigación de Biología de Animales de Granja (FBN), Dummerstorf, Alemania
Introducción: El síndrome congénito de patas abiertas (PCS, por sus siglas en inglés) porcino es un defecto congénito importante en los lechones, que provoca cojera y altas tasas de mortalidad. La patogenia multifactorial de la PSC no se conoce bien, pero incluye una herencia poligénica.
Métodos: Aquí, además de las investigaciones morfológicas, caracterizamos la expresión de genes miogénicos y las propiedades funcionales (proliferación y diferenciación) de las células precursoras/satélite miogénicas (SATC) en lechones PCS de 1 día de edad, compañeros de camada no afectados (LC) y lechones de camadas sanas (HC) libres de PCS. Además, los fenotipos de PCS se relacionaron con el Homer1_rs325197091 SNP dentro del locus Homer1, que se ha identificado como una posible causa hereditaria de PCS.
Resultados y discusión: Las muestras de musculus semitendinosus (ST) de lechones PCS tenían una mayor proporción de fibras tipo II, lo que refleja la inmadurez de las miofibras. Además, se observó atrofia de miofibras, un menor número de mionúcleos por fibra (ST) y una mayor actividad apoptótica (en el músculo ST y longissimus dorsi; LD) se encontraron en el grupo PCS. Una mayor proporción de mioblastos comprometidos con el ciclo (células Pax7/Ki67) se produjo en muestras de lechones afectados por PCS y, por otro lado, la expresión de ARNm de genes implicados en la diferenciación (diferenciación muscular 1; MyoD: miogenina; MyoG) fue reprimido en comparación con los HC. Los SATC cultivados de animales afectados por PCS mostraron un cambio temporal en la expresión máxima de Pax7, MyoD y MyoG hacia los días 3 y 4 de su régimen de diferenciación de 7 días. Los experimentos in vitro con SATC aisladas confirmaron el menor potencial de diferenciación y el retraso en la progresión de los procesos miogénicos en células de lechones con fenotipo PCS. Además, Pax7 y desmina se expresaron de manera diferente en Homer1_rs325197091 variantes de genotipo (GG, GA y AA). Ambos genes mostraron la expresión más baja en la variante homocigota AA, que se encontró con mayor frecuencia en animales afectados por PCS. La variante homocigota AA también se asoció con una menor expresión del subtipo 1 truncado de Homer205. Por lo tanto, planteamos la hipótesis de que en PCS, el equilibrio entre las proteínas Homer1 y sus funciones de señalización cambia de una manera perjudicial para el programa de diferenciación miogénica. Nuestros resultados demostraron efectos negativos directos del genotipo Homer1 AA sobre la expresión de Pax7, pero el modo exacto de acción aún debe ser dilucidado.++
1 Introducción
El síndrome congénito porcino de piernas abiertas (PCS) es un trastorno locomotor transitorio de los lechones recién nacidos que provoca debilidad muscular con extensión característica y abducción lateral de las patas traseras y, más raramente, delanteras. La inmovilidad resultante aumenta el riesgo de que los lechones afectados se lesionen o mueran por aplastamiento accidental por parte de la cerda o por inanición (1). Así, la alta incidencia (0,4% a >8%) y las tasas de mortalidad de hasta el 50% hacen que el PCS sea un problema para la industria porcina; En primer lugar, como fuente de pérdidas económicas significativas, pero también debido al considerable impacto negativo en el bienestar y la salud de los animales (2).
El PCS ha sido reconocido desde hace mucho tiempo como una enfermedad multifactorial (1, 3). Su patogenia está lejos de estar clara, pero implica una herencia poligénica (4), así como una multitud de factores ambientales y estresores [revisado en (2, 5)].
A nivel morfológico, no se encontraron cambios en el tamaño y la forma promedio de las miofibras en los lechones neonatos afectados por PCS (1, 6, 7). En cambio, el patrón de distribución en el área de la sección transversal de la miofibra (MCSA) cambió a tamaños más pequeños en los músculos PSC (8). Sin embargo, la hipoplasia miofibrilar (HFM), definida por una deficiencia y morfología irregular del material miofibrilar en los músculos del tronco y las extremidades, se ha descrito con frecuencia en relación con el PCS (5, 6, 9). Aunque la HFM afecta a más miofibras en lechones con CEP con síntomas clínicos, rara vez se han descrito procesos degenerativos, y también se ha encontrado algún grado de HFM en lechones neonatos sanos (1, 10, 11). En conjunto, estos datos se interpretan principalmente como un reflejo de una inmadurez reversible de las miofibras, principalmente de las fibras fetales secundarias (2).
A diferencia de los adultos, los neonatos, los músculos inmaduros se encuentran en un estado anabólico, y la síntesis de proteínas es muy sensible a los cambios agudos en la disponibilidad de nutrientes (12). Durante este período, una mayor tasa de síntesis de proteínas miofibrilares que sarcoplásmicas es responsable de la rápida acumulación de miofibrillas (12). La menor disponibilidad de nutrientes disminuyó la síntesis fraccional de proteínas; En concreto, la acreción de proteínas miofibrilares en un 25%, respectivamente (12, 13). De hecho, Ooi et al. (8) encontraron una regulación a la baja de varios genes estructurales del MHC en lechones PCS de 2 días de edad. Además, se ha demostrado que la prematuridad atenúa la activación de mTORC1 inducida por la alimentación, el inicio de la traducción y la síntesis de proteínas en el músculo esquelético de cerdos neonatos (14, 15). Por lo tanto, la baja ingesta de alimento en los lechones PCS perjudicará aún más el desarrollo miofibrilar y disminuirá sus posibilidades de supervivencia.
La conversión de fibras secundarias de tipo II a fibras de tipo I, y una disposición agrupada característica de estas últimas, es un componente importante de la maduración pre y postnatal de los músculos esqueléticos de cerdo (16, 17). Los lechones recién nacidos que sufrían de PCS tenían menos fibras de tipo I en sus músculos que los controles sanos (1). Se ha demostrado que las miofibras primarias de tipo I no se ven afectadas por la MFH (18), mientras que las fibras secundarias de tipo II son las más afectadas (7). Como la diferenciación de tipo de miofibras está regulada neuralmente, la inervación motora alterada, el acoplamiento defectuoso de excitación-contracción-contracción o los mecanismos contráctiles alterados pueden causar inmadurez de miofibras (2, 11, 16).
En el cerdo, el número de miofibras se fija en gran medida al nacer (19). Por lo tanto, el crecimiento temprano de las fibras musculares postnatales depende críticamente de la expansión sostenida y la acreción de mionúcleos de las llamadas células satélite (SATC). La funcionalidad del SATC está regulada principalmente por varios genes específicos del músculo. Típicamente, los SATC expresan la proteína homeobox 7 (Pax7) y/o el factor de determinación factor miogénico 5 (Myf5) (20). En el músculo adulto, solo entre el 1% y el 4% de los mionúcleos pertenecen a las SATC, y la mayoría de ellos se encuentran en estado de reposo. Por el contrario, el número de SATC es mucho mayor durante el período postnatal temprano. En el músculo porcino, aproximadamente el 60% de los mionúcleos son SATC durante la primera semana después del nacimiento, y de ellos, un alto porcentaje (90%) está proliferando (21, 22). En la población de mioblastos cíclicos, Myf5 y/o MyoD se coexpresan con Pax7 (20). A partir de estas células, se generan mioblastos competentes para la fusión que expresan miogenina (MyoG) (aproximadamente el 30% de la población). La fusión de SATC aporta ADN a las miofibras existentes, aumentando así su capacidad de síntesis de proteínas. Hemos demostrado que en lechones neonatos, una subpoblación de células que expresan Pax7 escapa de la diferenciación para formar un grupo de células de reserva que juega un papel importante en el establecimiento de la población adulta de SATC y para la reposición de la población proliferante en lechones de rápido crecimiento (23). Las SATC Pax7 y/o Myf5 positivas ya se encuentran durante el desarrollo prenatal, y las células precursoras de Pax7 contribuyen al crecimiento de las fibras musculares secundarias en el útero (19, 24). Un subconjunto de células que expresan Pax7 persisten hasta el final del período fetal, se ven envueltas por la lámina basal de las miofibras en desarrollo y establecen el grupo de SATC (19, 25). Dada la importancia de estas células en el desarrollo muscular prenatal y postnatal, parece sorprendente que hasta el momento no se hayan llevado a cabo investigaciones sobre el tamaño, la composición y la funcionalidad de las poblaciones de precursores miogénicos en PCS.
La evidencia del papel de la funcionalidad modificada de SATC en PCS proviene de las investigaciones de Ooi et al. (8). Estos autores encontraron atrofia miofibrosa caracterizada por la regulación positiva de la ubiquitina ligasa E3 MAFbx (FBXO3, atrogina) en los músculos longissimus dorsi (LD), semitendinoso (ST) y gastrocnemio de lechones de 2 días de edad con signos clínicos de PCS. A diferencia de MAFbx, P311, otro gen asociado a la atrofia muscular, se reguló sistemáticamente a la baja. P311 se expresa típicamente en los mioblastos y estimula la proliferación, mientras que la diferenciación terminal se retrasa (8). Su expresión aumenta durante la gestación y es alta en el músculo de crecimiento normal. Por lo tanto, la reducción de la expresión de P311 en los músculos PCS podría conducir a una menor disponibilidad de mioblastos para la hipertrofia de fibras postnatal. Hai et al. (26) confirmaron atrofia muscular y fuerte regulación positiva de MAFbx a nivel transcripcional y proteico en los músculos de un cerdo mutante que mostraba parálisis de las extremidades posteriores con un patrón de herencia recesivo. Curiosamente, los niveles de proteínas MyoD y MyoG estaban fuertemente regulados a la baja en los mutantes en comparación con los lechones de tipo salvaje (26).
La vía de proteólisis ubiquitina-proteasoma está implicada en las últimas etapas de la apoptosis (27), que es un proceso normal en el desarrollo muscular pre y postnatal. Se ha demostrado que la privación del factor de crecimiento/suero, el estrés oxidativo, el daño en el ADN y las alteraciones en la progresión del ciclo celular o el metabolismo celular pueden inducir la apoptosis en las células musculares (28). Los mioblastos replicativos se ven particularmente afectados, pero su susceptibilidad a la apoptosis depende del ciclo celular y la etapa de diferenciación, así como del nivel de madurez (29, 30). La inducción del inhibidor de la quinasa dependiente de ciclina p21, que es un paso importante en la miogénesis (31), también da lugar a un fenotipo más resistente a la apoptosis (32). Además, el IGF-II y el BCL-2 son factores de supervivencia conocidos y se expresan en mioblastos primarios neonatales y adultos (33, 34). De acuerdo con el papel de los procesos apoptóticos y de degradación de proteínas en PCS, Maak et al. (35) encontraron que varios genes (SQSTM1, SSRP1, DDIT4 y MAF) involucrados en la muerte celular se expresan de manera diferente entre los lechones PCS y sus compañeros de camada sanos.
Un estudio de asociación de genoma completo (GWAS, por sus siglas en inglés) identificó cuatro genes candidatos potenciales para PCS, entre ellos HOMER1 (4), que se expresa en gran medida en el tejido muscular (36). Investigaciones posteriores sobre los SNP vinculados a PCS dentro del locus HOMER1 revelaron un total de 19 SNP, de los cuales 12 estaban significativamente asociados con PCS. Más importante aún, 8 de estos SNPs asociados se localizaron en el intrón 4, que funciona como un promotor alternativo para la isoforma 1 truncada de HOMER205. Los estudios in vitro revelaron una importancia funcional de Homer1_rs339135425, cuyo alelo G podría crear un nuevo sitio de unión para un factor de transcripción, según lo informado por los ensayos de actividad promotora (37).
Las hipótesis comunes sobre los mecanismos patogénicos implicados en el desarrollo del fenotipo PCS incluyen una base poligénica e inmadurez muscular. Sin embargo, las células progenitoras miogénicas/SATC y su progenie, componentes principales del desarrollo muscular, nunca se han investigado en PCS. Por lo tanto, el objetivo principal de este estudio es la caracterización de las propiedades moleculares (genes miogénicos) y funcionales (proliferación y diferenciación) de la población de SATC en lechones PCS en comparación con compañeros de camada sin fenotipo clínico y lechones de camadas libres de PCS. A diferencia de otros genes relacionados con el PCS, se ha demostrado que Homer1 está implicado en el control de diversos procesos relacionados con el desarrollo muscular [revisado en (5)]. Además, se ha encontrado una sobrerrepresentación de ciertos alelos dentro del locus HOMER1 en animales afectados por PCS (37). Para averiguar cómo la expresión diferencial de isoformas específicas de HOMER1 está involucrada en la patogénesis de PCS, nos propusimos explorar los posibles efectos sobre los genes miogénicos y, por lo tanto, la funcionalidad de las células precursoras miogénicas.
2 Materiales y métodos
2.1 Animales
Los animales se obtuvieron de la unidad experimental porcina del Instituto de Biología de Animales de Granja. Todos los experimentos se realizaron con material obtenido de lechones machos de 1 día de edad de la raza autóctona alemana que fueron sacrificados siguiendo las directrices del Comité de Cuidado Animal del Estado de Mecklemburgo Pomerania Occidental, Alemania, basado en la Ley de Protección Animal. Los animales fueron sacrificados aturdiéndolos con un perno cautivo antes de la exanguinación. Dado que toda la manipulación y el muestreo de los animales se realizaron después de la muerte, los experimentos no deben considerarse experimentos con animales. Las sesiones de muestreo se llevaron a cabo cada 3 semanas después de los ciclos de cría de los animales, y cada una incluyó tres animales, un lechón afectado por PCS (PSC) que se seleccionó de acuerdo con un fenotipo visible (obducción lateral de una o más extremidades), un compañero de camada (LC) clínicamente no afectado y un lechón control (HC) sano de otra camada libre de PCS. También se seleccionaron los animales para igualar el peso al nacer (1,02 kg ± 0,15 kg). En total, se llevaron a cabo 20 sesiones de muestreo, de las cuales se muestrearon 63 animales para este estudio.
2.2 Métodos histológicos
Inmediatamente después del sacrificio, se extirparon muestras de tejido del musculus longissimus dorsi (LD) y del musculus semitendinosus (ST). A continuación, las muestras se congelaron inmediatamente en nitrógeno líquido y se almacenaron hasta su uso posterior a -80 °C. Para los análisis histológicos, se cortaron secciones transversales seriadas de 10 μm de espesor a -20 °C utilizando un criotomo Leica CM3050 S (Leica Microsystems, Wetzlar, Alemania).
2.2.1 Tinción de eosina para la cuantificación de fibras musculares
Las secciones recién cortadas se montaron directamente en portaobjetos y se dejaron secar a temperatura ambiente. A continuación, las secciones se fijaron durante 5 min con una solución de formaldehído al 4% estabilizada con calcio. El fijador se enjuagó con agua destilada. A continuación, el citoplasma se tiñó durante 5 min con una solución de eosina al 0,1%. La solución de tinción excesiva se enjuagó con agua destilada durante 5 min, y luego se deshidrataron secciones de tejido en una serie ascendente de alcohol que pasó de 70% (1 min) sobre 96% de alcohol (1 min) a alcohol absoluto (1 min) y un enjuague final en Xylol (5 min). A continuación, se cubrieron secciones en Eukitt (Merck, Darmstadt, Alemania).®
2.2.2 Tinción de ATPasa alcalina
Para evaluar el fenotipo muscular con respecto a la estructura del tipo de fibra, se utilizó la tinción alcalina de ATPasa para teñir las fibras musculares tipo II. Mediante la preincubación en condiciones ácidas o alcalinas, la enzima miosina-ATPasa de tipos específicos de fibra se inactiva, mientras que durante la tinción, el átomo de calcio de la enzima activa restante se sustituye por un átomo de cobalto, que finalmente precipitará como un compuesto negro insoluble. Las criosecciones recién montadas se incubaron a pH 4,2 durante 8 min en ácido acético que contenía 180 mM de CaCl2. A continuación, las secciones se enjuagaron dos veces durante 1 min con un tampón Tris de 100 mM que contenía 180 mM de CaCl2 ajuste a pH 7.8. Posteriormente, se realizó una incubación de 60 min con solución de Na-ATP (180 mM CaCl2, 49,6 mM de KCl y 2,7 mM de sal disódica de ATP ajustada a pH 7,8) a 37 °C. Luego, las secciones se incubaron en un CaCl al 2%2 Solución durante 3 min y enjuagar cuatro veces durante 30 s en agua destilada. El paso final de la tinción fue una incubación de 3 min al 1% (NH4)2S durante 3 min. Las secciones se enjuagaron nuevamente durante 5 minutos con agua corriente del grifo y finalmente se enjuagaron con agua destilada antes de montarlas en gelatina de glicerol.
2.2.3 Análisis de cortes teñidos histoquímicamente
Las secciones se fotografiaron con un microscopio Olympus BX43 con una cámara Olympus UC30 acoplada (Evident Europe, Hamburgo, Alemania). Los análisis se realizaron manualmente utilizando un puntero de lápiz y el paquete de software Cell^D (Evident, Hamburgo, Alemania). Se analizaron diez campos de visión de cada espécimen (Olympus BCX43 con objetivo 20×; 0,48 mm2 Área FOV) para la cuantificación de fibras musculares. La cuantificación del conglomerado de ATPasa se analizó en 5 FOV por espécimen (BCX43 con objetivo de 10×; 1,47 mm2 Área de campo de visión).
2.2.4 Ensayos TUNEL
Se realizaron ensayos TUNEL para cuantificar la cantidad de actividad apoptótica en muestras musculares utilizando el «Kit de Detección de Muerte Celular In situ» (Merck, Darmstadt, Alemania). Las criosecciones recién cortadas y montadas se fijaron con paraformaldehído/PBS al 4% durante 20 min en RT. El fijador se lavó con enjuague PBS durante 30 minutos. A continuación, el tejido se trató con una solución de Na-citrato al 0,1%. Después de un segundo paso de lavado con PBS, la mezcla TUNEL se incubó durante 60 min a 37°C en las secciones. Finalmente, las secciones se lavaron tres veces con PBS y luego se montaron en Roti-Mount FluourCare DAPI (Carl Roth, Karlsruhe, Alemania).®
2.2.5 Tinción por inmunofluorescencia
Las criosecciones se montaron y fijaron durante 10 min utilizando PBS de paraformaldehído al 4%. A continuación, las secciones se lavaron y permeabilizaron tres veces durante 10 min utilizando PBS que contenía 0,1% de Tween-20. Después de un nuevo lavado con PBS, las secciones se bloquearon con suero de cabra al 10% en PBS durante 30 min. A continuación, las secciones se incubaron con anticuerpos primarios contra conejo-anti-Ki67 (NB-600-1252: 1:90, Bio-Techne, Wiesbaden Nordenstadt, Alemania) y ratón anti-Pax7-c (DHSB; 1:45) durante la noche a 4°C. Después de un lavado adicional con PBS, las secciones se incubaron con los respectivos anticuerpos secundarios (cabra-anti-ratón-A-594 y cabra-anti-conejo-A-488; ambos 1:500 en BSA-PBS al 1%) durante 2 h en RT. Después de un último paso de lavado con PBS (dos veces durante 5 min), las secciones se cubrieron con Roti-Fluor Care DAPI (Carl Roth). Las microfotografías se tomaron con un microscopio de epifluorescencia Leica DM4000B (Leica Microsystems, Wetzlar, Alemania). El recuento de células para los núcleos teñidos con DAPI se realizó utilizando un script semiautomatizado de ImageJ, mientras que el recuento de células positivas o dobles positivas de Ki67 y Pax7 se realizó utilizando la herramienta de recuento manual de ImageJ. Para cada muestra, se analizaron 10 campos de visión elegidos al azar.®
2.3 Aislamiento y cultivo de células progenitoras miogénicas
Como se describió anteriormente (23), el músculo LD se diseccionó y digierió completamente con una solución de tripsina (4,000 U/mL) filtrada y luego administrada a un gradiente de Percoll, que consta de capas de 70%, 50%, 40% y 25%. Se aislaron dos subpoblaciones diferentes en la interfase del 50/70% (subpoblación lenta) y en la interfase del 40/50% (subpoblación rápida). A continuación, las células se resuspendieron y se cultivaron en un medio de crecimiento (αMEM con 20% de FBS, 100 U/mL de penicilina/estreptomicina, 5 μg/mL de gentamicina y 2,5 μg/mL de anfotericina). Para los ensayos de diferenciación miogénica, las células de la subpoblación 40/50 se sembraron en Matrigel (material de plástico recubierto con Matrigel diluido 1:50 e incubado durante 1 h a temperatura ambiente) en medio de diferenciación (αMEM con 2% de FBS, 100 U/mL de penicilina/estreptomicina, 5 μg/mL de gentamicina y 2,5 μg/mL de anfotericina) y se cultivaron durante 7 días. En cada día de muestreo (0, 1, 2, 3, 4, 7), las células se fotografiaron y se rasparon en el reactivo TRIzol (Thermo Fisher Scientific, Schwerte, Alemania) para realizar más estudios de expresión génica.®
2.4 Estudios de expresión génica
2.4.1 Toma de muestras de ARN del tejido muscular
El tejido muscular del ST se congeló en nitrógeno líquido directamente después de la toma de muestras y se almacenó a -80 °C hasta su uso posterior. Se colocaron muestras de tejido de aproximadamente 100 mg en un tubo Xiril Dispomix junto con 1 mL de reactivo de lisis QIAzol (Qiagen, Hilden, Alemania) y se homogeneizaron a 4000 rpm durante 15 s. A continuación, el homogeneizado se centrifugó a 12.000 g durante 10 min a 4°C. A continuación, el sobrenadante se mezcló con 200 μL de cloroformo y se mezcló bien durante 15 s antes de incubarse durante 3 min a temperatura ambiente. A continuación, la mezcla se centrifugó de nuevo a 12.000 g durante 15 min a 4 °C. Posteriormente, solo la fase acuosa superior se procesó posteriormente para la precipitación de ARN añadiéndola a 500 μL de isopropanol en un nuevo tubo de microcentrífuga y agitando cuidadosamente la mezcla. A continuación, el ARN se centrifugó a 20.000 g durante 30 min a 4 °C. El pellet de ARN se lavó una vez con etanol al 70%, se centrifugó a 7.500 g durante 5 min a 4 °C y luego se secó y eluyó en 100 μL de agua libre de ARNasa. El ARN se purificó utilizando un kit de limpieza de ARN basado en columna (Macherey-Nagel, Düren, Alemania) de acuerdo con las instrucciones del fabricante.®
2.4.2 Muestreo de ARN de cultivos celulares
Las células de los ensayos de diferenciación celular satélite se lavaron con PBS una vez y se colocaron en capas con 500 μL de TRIzol (Thermo Fisher Scientific, Schwerte, Alemania) antes de ser raspadas con un raspador celular. A continuación, las muestras celulares se almacenaron a -80 °C hasta su uso posterior. A continuación, se aisló el ARN mediante extracción estándar de tiocianato-fenol-cloroformo de guanidinio (38). En resumen, se añadieron 100 μL de cloroformo a cada una de las muestras de TRIzol y se agitaron vigorosamente en vórtice. Las muestras se incubaron durante 5 min a temperatura ambiente y luego se centrifugaron a 14.000 g durante 15 min a 4°C. Posteriormente, la fase acuosa se mezcló con 250 μL de isopropanol en un nuevo tubo de microcentrífuga y se agitó brevemente en vórtice. La muestra se incubó durante 10 min a temperatura ambiente y posteriormente se centrifugó a 20.000 g durante 30 min a 4°C. A continuación, el pellet se lavó con 500 μL de etanol al 70% y se centrifugó a 7.500 g durante 5 min a 4°C. El gránulo se secó y luego se disolvió en 30 μL de agua libre de ARNasa. El contenido de ARN se midió con un fotoespectrómetro (NanoDrop, Thermo Fisher Scientific) y las muestras se almacenaron a -80 °C hasta su uso posterior.®®
2.4.3 qPCR en muestras derivadas de muestras musculares y muestras in vitro
El diseño del cebador de qPCR se facilitó con el paquete de software BLAST del NCBI. Todos los pares de cebadores se diseñaron para ser uniones de exones que se extienden a fin de no recocer una posible contaminación del ADN genómico y se seleccionaron para tener temperaturas de recocido coincidentes para permitir que se procesen múltiples objetivos con el mismo protocolo de PCR.
La qPCR se realizó utilizando un kit de qPCR (Vazyme, Düsseldorf, Alemania) de acuerdo con las instrucciones del fabricante en 12,5 ng de plantilla de ADNc utilizando un programa de ciclo estándar con posterior análisis de la curva de fusión en un Light Cycler 96 (Roche, Mannheim, Alemania). Los datos brutos de fluorescencia de cada corrida se analizaron utilizando el software LinRegPCR (v2018.0) para el cálculo de los valores adecuados de eficiencia de qPCR (39, 40). Estos se utilizaron para dar cuenta de la eficiencia de amplificación de los pares de cebadores (Tabla 1) utilizando la ecuación dada por Pfaffl (41) y ampliarla para incorporar datos de expresión de múltiples genes de referencia como su media geométrica (42). PPIA, CSNK2A2 y AP3D1 se utilizaron como genes de referencia en estos análisis. Los datos de expresión génica se analizaron para determinar el cambio de pliegue en los lechones PCS y LC con respecto a los lechones HC.®
2.4.4 Detección y genotipado de polimorfismos de nucleótido único
Se utilizó tejido hepático para aislar el ADN genómico. Las muestras se lisaron con proteinasa K (Carl Roth). Se realizó una extracción de fenol-cloroformo utilizando tubos de gel Phase Lock de acuerdo con las recomendaciones del fabricante (5 Prime, Hamburgo, Alemania). El ADN genómico se precipitó, se volvió a suspender en tampón Tris-EDTA y se almacenó a -20 °C hasta su uso posterior. De acuerdo con los resultados publicados anteriormente (37), se seleccionó un SNP en la región intrónica de HOMER1 (rs325197091). Las reacciones en cadena de la polimerasa (PCR) se realizaron en un volumen de 20 μL que contenía 100 ng de ADN genómico con ADN polimerasa SupraThermTaq (GeneCraft, Münster, Alemania). Se utilizaron como cebadores TCAGCCAATCAATAAATAACCTTG y TATCCTATACAC GTTTCTTGTGTGCTG, lo que dio como resultado un producto de PCR con una longitud de fragmento de 809 bases. La PCR de aterrizaje tuvo las siguientes especificaciones: activación inicial a 95 °C durante 5 minutos, seguida de 10 ciclos de 15 s a 95 °C para la desnaturalización y 60 s a 63 °C-58 °C (caída de 0,5 °C por ciclo) para el recocido y el alargamiento. Posteriormente, se realizaron 30 ciclos de 15 s a 95°C, 1 min a 58°C y 1 min a 72°C, seguidos de 5 min a 72°C. Los productos de PCR se evaluaron para la amplificación específica en geles de agarosa al 1,5%. Los productos fueron digeridos por la enzima de restricción Xcel (Thermo Fisher). Las condiciones de reacción correspondientes fueron 16 h a 37 °C para la incubación y 20 min a 65 °C para la inactivación enzimática. Los fragmentos recuperados se separaron en geles de agarosa al 3% y se evaluaron.
2.5 Análisis estadístico
Los análisis estadísticos de las respectivas lecturas se llevaron a cabo utilizando el paquete de software GraphPad Prism 8 (GraphPad Software, Boston, Estados Unidos). Los gráficos de barras muestran las medias más la desviación estándar. La diferencia estadística entre los grupos se calculó mediante ANOVA de un factor con la prueba de comparación múltiple de Tukey. Se utilizó una prueba exacta de Fisher bilateral para comparar la distribución alélica en el locus HOMER1 entre los animales control y los afectados por PCS. Las diferencias entre grupos se consideraron significativas a p ≤ 0,05. Los niveles de significación se marcan de la siguiente manera: «» para p ≤ 0,05 ; «» para p ≤ 0,01; y «» para p ≤ 0,001.******
3 Resultados
3.1 Estructura muscular, tipificación de miofibras y ensayo TUNEL
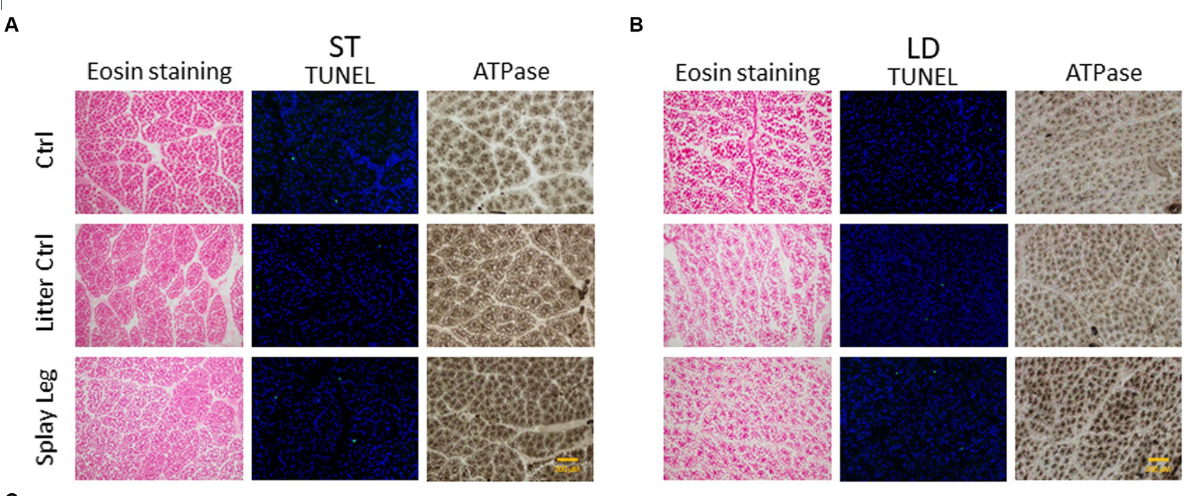
Se determinó el área de la sección transversal de las miofibras (MCSA), la densidad de las miofibras, los mionúcleos por fibra y las miofibras tipo II para todos los grupos. Además, se realizaron ensayos TUNEL para ver si los procesos apoptóticos podrían desempeñar un papel en los trastornos funcionales observados en los lechones PCS. En la Figura 1C se muestran secciones histológicas representativas de ST (Figura 1A) y LD (Figura 1B) y resultados resumidos.
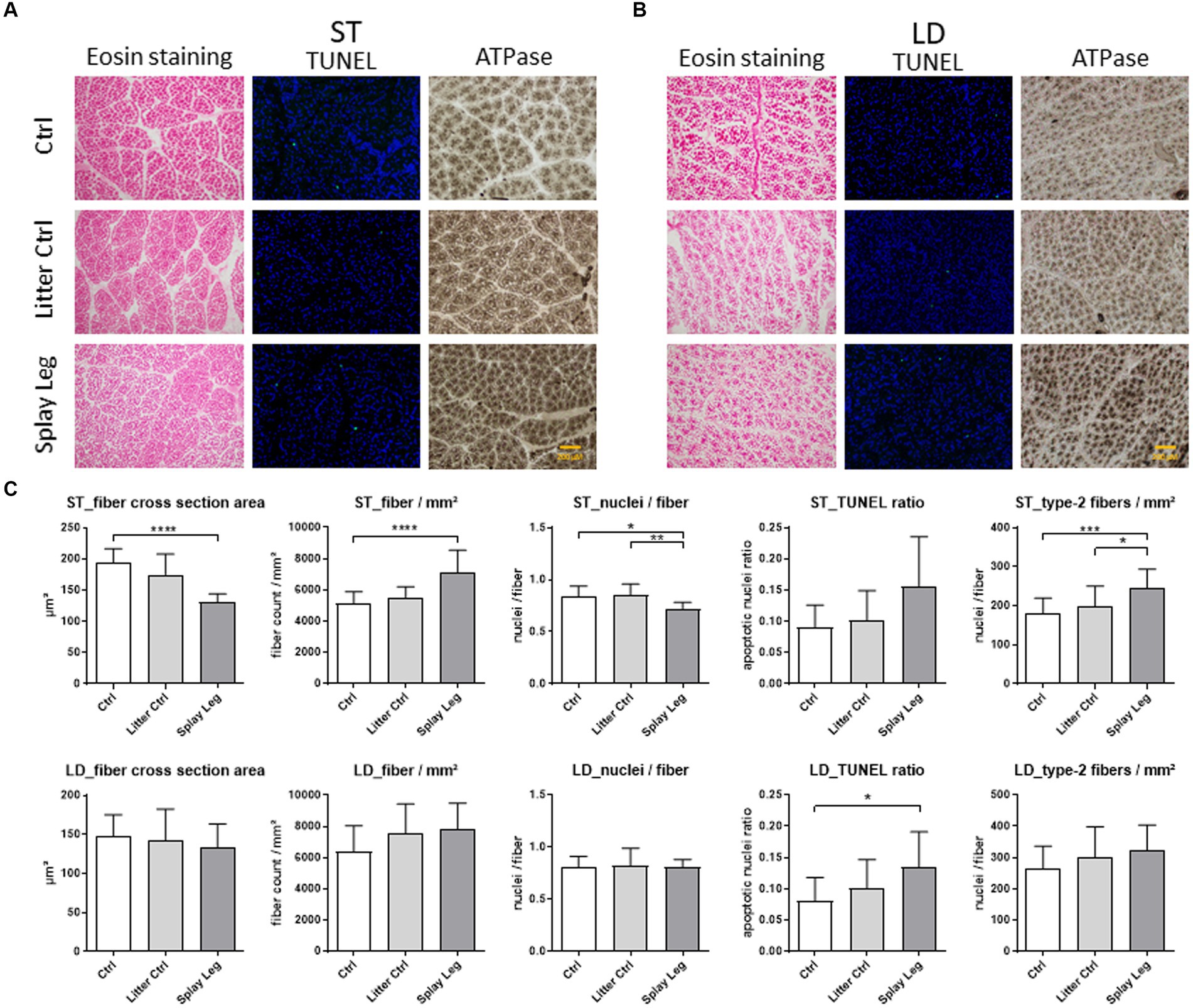 Figura 1. Portaobjetos representativos teñidos con eosina (izquierda), ensayo TUNEL (centro) o ATPasa alcalina (derecha) de muestras de control de 1 día de edad (fila superior), control de camada (fila central) o lechones de patas abiertas (papel inferior) de musculus semitendinosus (ST, A) y musculus longissimus dorsi (LD, B). Los diagramas (C) muestran los resultados del análisis cuantitativo de la estructura muscular, la actividad apoptótica (relación TUNEL) y el número de miofibras tipo II para ambos músculos. Los asteriscos denotan diferencias significativas entre los grupos (p < 0,05, p < 0,01 y p < 0,001). ******
Figura 1. Portaobjetos representativos teñidos con eosina (izquierda), ensayo TUNEL (centro) o ATPasa alcalina (derecha) de muestras de control de 1 día de edad (fila superior), control de camada (fila central) o lechones de patas abiertas (papel inferior) de musculus semitendinosus (ST, A) y musculus longissimus dorsi (LD, B). Los diagramas (C) muestran los resultados del análisis cuantitativo de la estructura muscular, la actividad apoptótica (relación TUNEL) y el número de miofibras tipo II para ambos músculos. Los asteriscos denotan diferencias significativas entre los grupos (p < 0,05, p < 0,01 y p < 0,001). ******
Se encontraron cambios estructurales significativos en el TS de lechones PCS de 1 día de edad solamente (Figura 1C). Específicamente, el MCSA se redujo fuertemente en los animales afectados por PCS en comparación con los lechones HC. De acuerdo con esto, se encontraron significativamente más miofibras por área analizada en el grupo PCS. Además, el número de núcleos por miofibra que reflejaban mayoritariamente las SATC fue significativamente menor en los lechones con fenotipo PCS que en los lechones LC y HC.
La tinción con ATPasa reveló un mayor número de fibras musculares tipo II en el ST de los animales afectados por PCS en comparación con los lechones LC y HC (Figura 1C).
Aunque la actividad apoptótica aumentó en los músculos ST y LD de los lechones PCS (Figura 1C), se observó una muerte celular significativa en las muestras de LD de los animales PCS solamente.
3.2 Abundancia de proteínas PAX7 y Ki67 en muestras de músculos ST y LD
Debido a que se encontró un menor número de núcleos por miofibra (ST) y un mayor grado de muerte celular (LD), investigamos la población de células progenitoras miogénicas con más detalle mediante la cuantificación de núcleos totales y la proporción de Pax7/Ki67+− SATC, Pax7/Ki67 y Pax7++−/Ki67 mioblastos (Figura 2A). El número mionuclear total fue similar para todos los grupos en las muestras de LD, mientras que aumentó en el grupo de PCS en comparación con ambos grupos de control en las muestras de ST (Figura 2B). Sin embargo, en ambos músculos, los animales PCS mostraron un número significativamente mayor de mioblastos positivos dobles Pax7/Ki67 en comparación con los grupos LC (músculo LD) o incluso ambos grupos de control (músculo ST) (Figura 2B).+
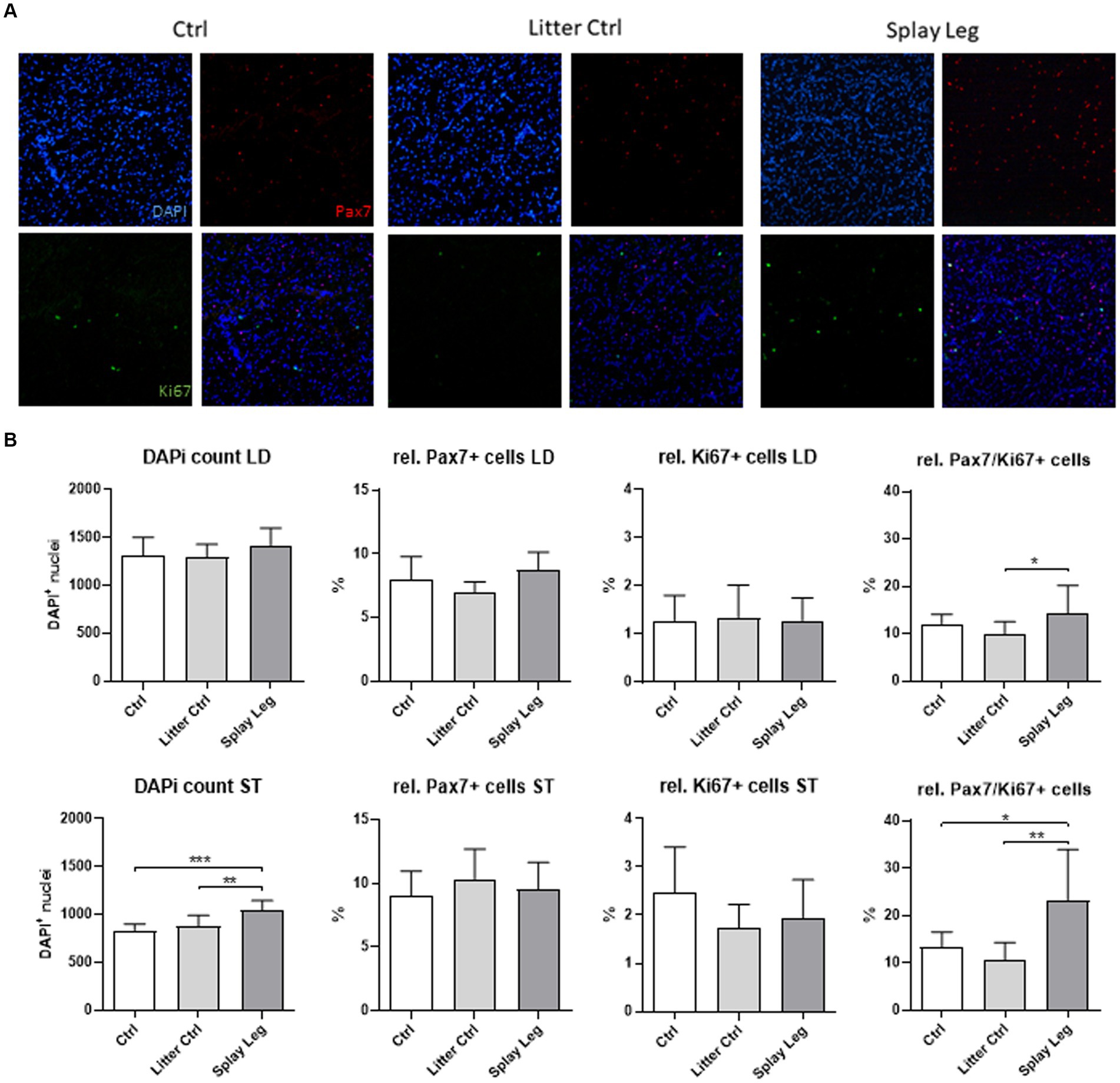 Figura 2. Portaobjetos representativos de muestras musculares teñidas para Pax7 (rojo), Ki67 (verde) y ADN (azul) (A). Análisis cuantitativo de muestras de lechones de control de 1 día de edad, control de camada y lechones de patas abiertas (B). Los asteriscos denotan diferencias significativas entre los grupos (p < 0,05, p < 0,01 y p < 0,001). ******
Figura 2. Portaobjetos representativos de muestras musculares teñidas para Pax7 (rojo), Ki67 (verde) y ADN (azul) (A). Análisis cuantitativo de muestras de lechones de control de 1 día de edad, control de camada y lechones de patas abiertas (B). Los asteriscos denotan diferencias significativas entre los grupos (p < 0,05, p < 0,01 y p < 0,001). ******
3.3 Expresión génica miogénica en muestras musculares
A continuación, investigamos un conjunto de genes miogénicos (Pax7, Myf5, MyoD, MyoG y desmina) en muestras del músculo ST.
Como se muestra en la Figura 3, el nivel de expresión de Myf5 y Pax7 fue similar en los grupos PCS y control, mientras que la expresión del marcador de proliferación MyoD se redujo significativamente en los grupos PCS y LC. Además, MyoG, que se expresa durante la diferenciación temprana, mostró una disminución significativa en la expresión de ARNm en PCS en comparación con los animales LC y HC (Figura 3). Por otro lado, se encontraron mayores niveles de expresión de desmina en los animales PCS en comparación con los lechones HC.
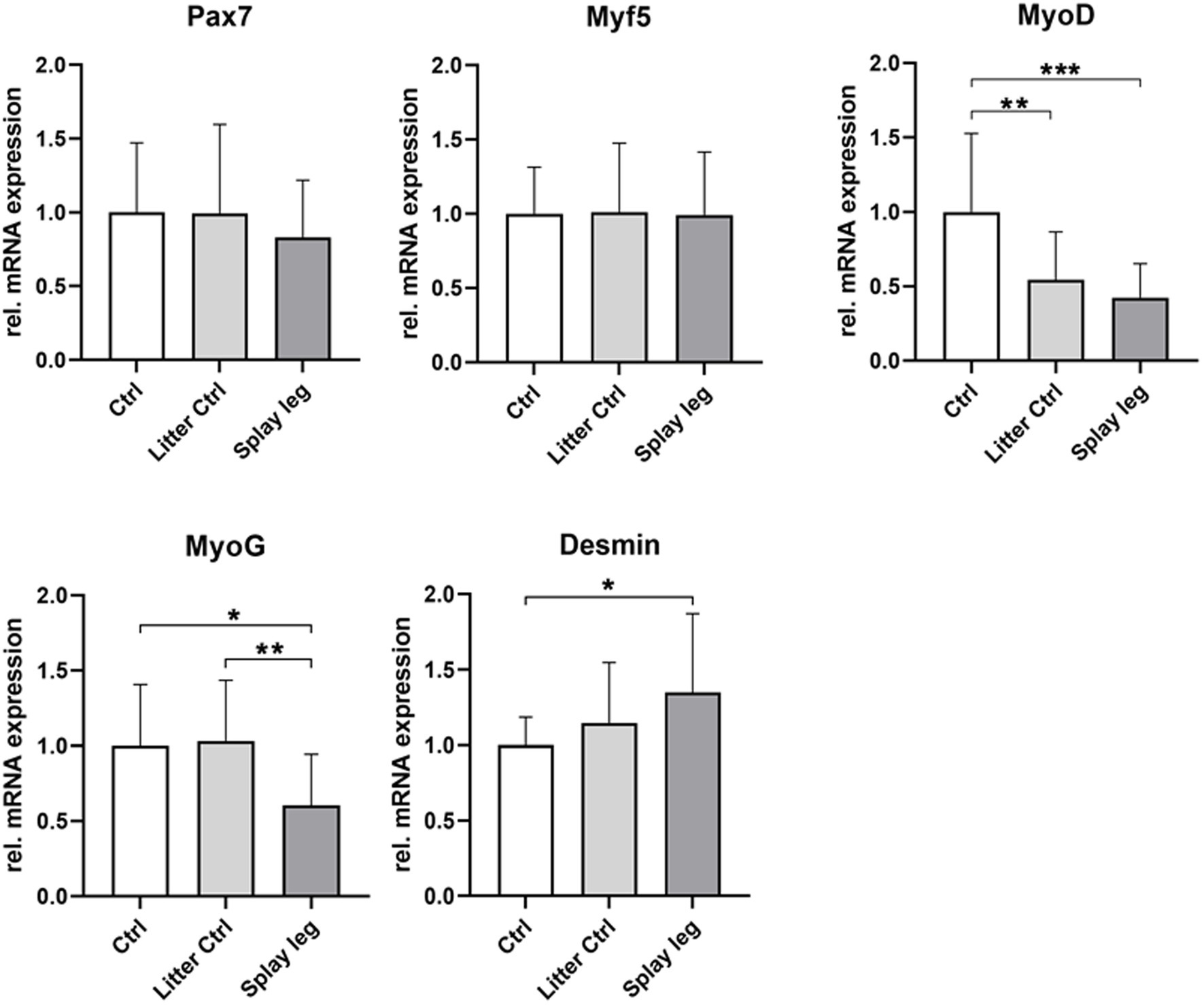 Figura 3. Expresión relativa de ARNm de los marcadores de diferenciación muscular Pax7, Myf5, MyoD, MyoG y desmina en el músculo semitendinoso de lechones de 1 día de edad. Los asteriscos denotan diferencias significativas entre los grupos (p < 0,05, p < 0,01 y p < 0,001). ******
Figura 3. Expresión relativa de ARNm de los marcadores de diferenciación muscular Pax7, Myf5, MyoD, MyoG y desmina en el músculo semitendinoso de lechones de 1 día de edad. Los asteriscos denotan diferencias significativas entre los grupos (p < 0,05, p < 0,01 y p < 0,001). ******
Los niveles más bajos de expresión de ARN de MyoD (HC y PCS) y MyoG (PCS solamente) apuntan a un potencial de diferenciación reprimido de las células precursoras miogénicas de lechones originarios de camadas con PCS.
3.4 Estudios in vitro sobre la capacidad de diferenciación de células satélite musculares aisladas
Para determinar si los efectos negativos observados sobre los genes miogénicos implicados en la diferenciación muscular son el resultado de condiciones sistémicas desfavorables o de déficits fisiológicos intrínsecos a las células, elegimos un enfoque in vitro para explorar el crecimiento y la diferenciación en células progenitoras musculares aisladas primarias del músculo LD. Si bien la capacidad general de proliferación celular no cambió en todos los grupos (datos no mostrados), las células aisladas de lechones afectados por PCS mostraron un proceso de diferenciación tardío. Por lo tanto, cultivamos células de todos los grupos en condiciones que promueven la diferenciación (reducción del factor de crecimiento) e investigamos los cambios temporales en el perfil de transcripción de los genes miogénicos mencionados anteriormente en el día 0 (día inicial del ensayo de diferenciación), 1, 2, 3, 4, 5 y 7 después de la inducción. Independientemente de su origen, las células fueron capaces de diferenciarse y fusionarse, como lo demuestra la formación de miotubos (Figura 4A). Sin embargo, el análisis microscópico cualitativo mostró una formación de miotubos menos pronunciada dentro del grupo PCS en los días 4 a 7 en comparación con el grupo HC.
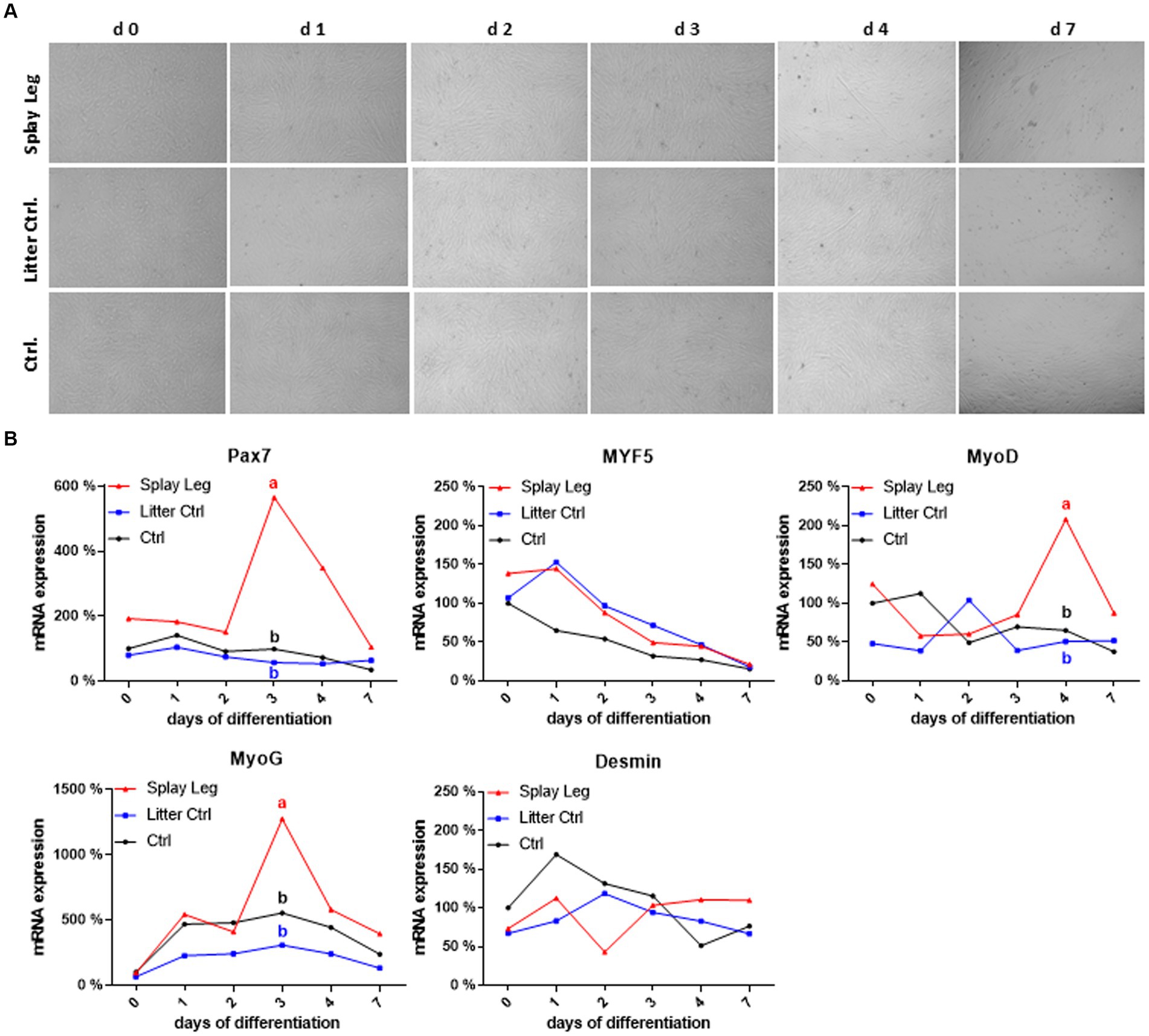 Figura 4. Microscopía óptica de células satélite primarias porcinas diferenciadas de musculus longissimus dorsi durante la diferenciación miogénica durante 7 días (A). Perfiles de expresión de ARNm de marcadores miogénicos seleccionados durante la diferenciación (B). Diferentes letras minúsculas denotan diferencias significativas entre los grupos en p < 0,05.
Figura 4. Microscopía óptica de células satélite primarias porcinas diferenciadas de musculus longissimus dorsi durante la diferenciación miogénica durante 7 días (A). Perfiles de expresión de ARNm de marcadores miogénicos seleccionados durante la diferenciación (B). Diferentes letras minúsculas denotan diferencias significativas entre los grupos en p < 0,05.
En ambos grupos de control, la expresión de Pax 7 fue relativamente constante, mientras que la expresión de Myf5 disminuyó continuamente en las células de HC solamente (Figura 4B). Como era de esperar, una reducción de la expresión de MyoD (estabilizándose en aproximadamente el 50% del valor inicial) y un aumento de la expresión de miogenina alcanzando su máximo en el día 3 caracterizaron el proceso de diferenciación en HC. Por el contrario, la expresión de Myf5 aumentó desde el día 0 hasta el día 1 en LC, que también mostró una regulación positiva tardía y más corta de MyoD, alcanzando un pico en el día 2. La cinética de la expresión de MyoG fue similar en ambos grupos control, con niveles de expresión algo más bajos en las células de los lechones LC. En comparación con las células HC, las de los animales afectados por PCS tenían niveles iniciales más altos de Pax7 y Myf5, y en cuanto a los controles de LC, la regulación negativa de Myf5 comenzó más tarde (en el día 1). Además, la cinética de expresión de Pax7, MyoD y MyoG se caracterizó por picos marcados en las células PSC. Para Pax7 y MyoD, esos picos ocurrieron en los días 3 y 4, respectivamente, cuando los niveles de expresión eran bajos en ambos grupos de control. Aunque la cinética de la expresión de MyoG fue similar para todos los grupos, mostrando un pico de expresión en el día 3, fue significativamente mayor en la CEP en comparación con ambos grupos de control. Por el contrario, Myf5 y Desmin no mostraron diferencias significativas entre los grupos (Figura 4B).
3.5 Estudios sobre los genotipos de Homer1, la expresión de isoformas y los efectos sobre el desarrollo miogénico
Un estudio reciente sugirió un vínculo entre un SNP específico en el locus de Homer1 (rs325197091) y la aparición de PCS. Este SNP se localizó en una región intrónica, que se identificó como un promotor potencial para una isoforma de Homer1 truncada (37).
Por lo tanto, genotipamos nuestras muestras de prueba en este locus. Las frecuencias genotípicas en los animales control fueron 0,23 (GG), 0,48 (GA) y 0,29 (AA). La frecuencia alélica se desplazó de 0,51 (G) y 0,49 (A) en los animales control a 0,39 (G) y 0,61 (A) en los animales afectados por PCS. Esta diferencia, sin embargo, no fue significativa (p = 0,1993), lo que probablemente se deba al número limitado de muestras.
A continuación, analizamos la abundancia relativa de ARNm de la isoforma 1 de Homer201 y la forma truncada 205. La PCR cuantitativa no reveló diferencias significativas en la expresión de la isoforma 201 de longitud completa. Por el contrario, la expresión de Homer1-205 fue significativamente menor en los lechones afectados por PCS que en los lechones HC, mientras que la diferencia entre LC y PCS no fue significativa (Figura 5).
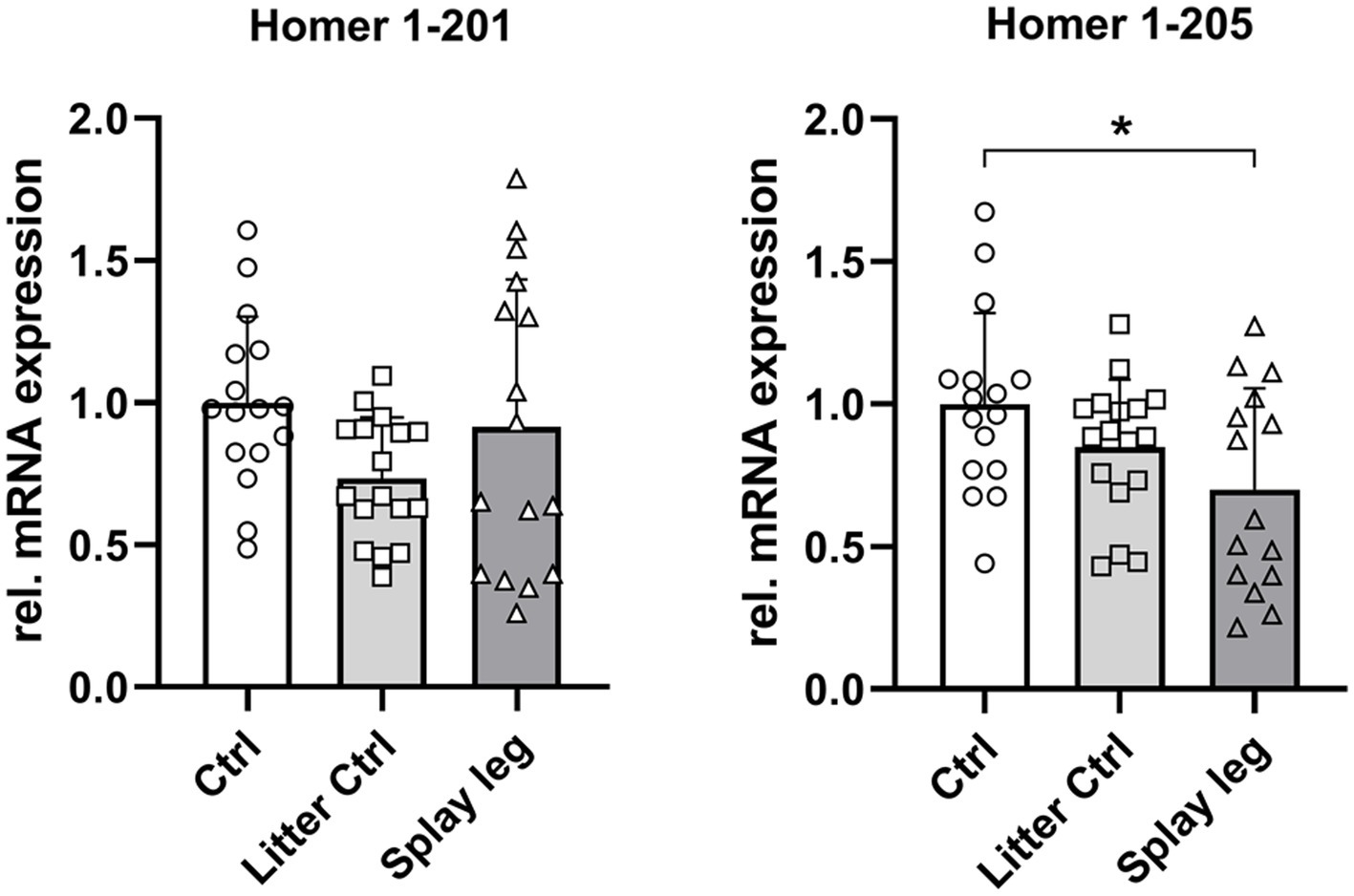 Figura 5. Abundancia relativa de ARNm de las isoformas 1 y 201 de Homer205 en muestras musculares de lechones de control, control de camada y patas separadas (significativamente diferente a p < 0,05).*
Figura 5. Abundancia relativa de ARNm de las isoformas 1 y 201 de Homer205 en muestras musculares de lechones de control, control de camada y patas separadas (significativamente diferente a p < 0,05).*
Para probar las consecuencias de los diferentes genotipos de SNP de Homer1 en la expresión de las isoformas de Homer1, reagrupamos todas las muestras en consecuencia.
La expresión de la transcripción completa de Homer 1 (201) fue casi idéntica en los genotipos GG y AA. Sin embargo, la expresión de Homer1-205 fue un 24% (p = 0,18) y un 41% (p < 0,01) menor en los genotipos AA en comparación con los genotipos GG y GA. Estos resultados pueden indicar una relevancia funcional de este SNP específico en la expresión de la isoforma truncada de Homer1 (Figura 6).
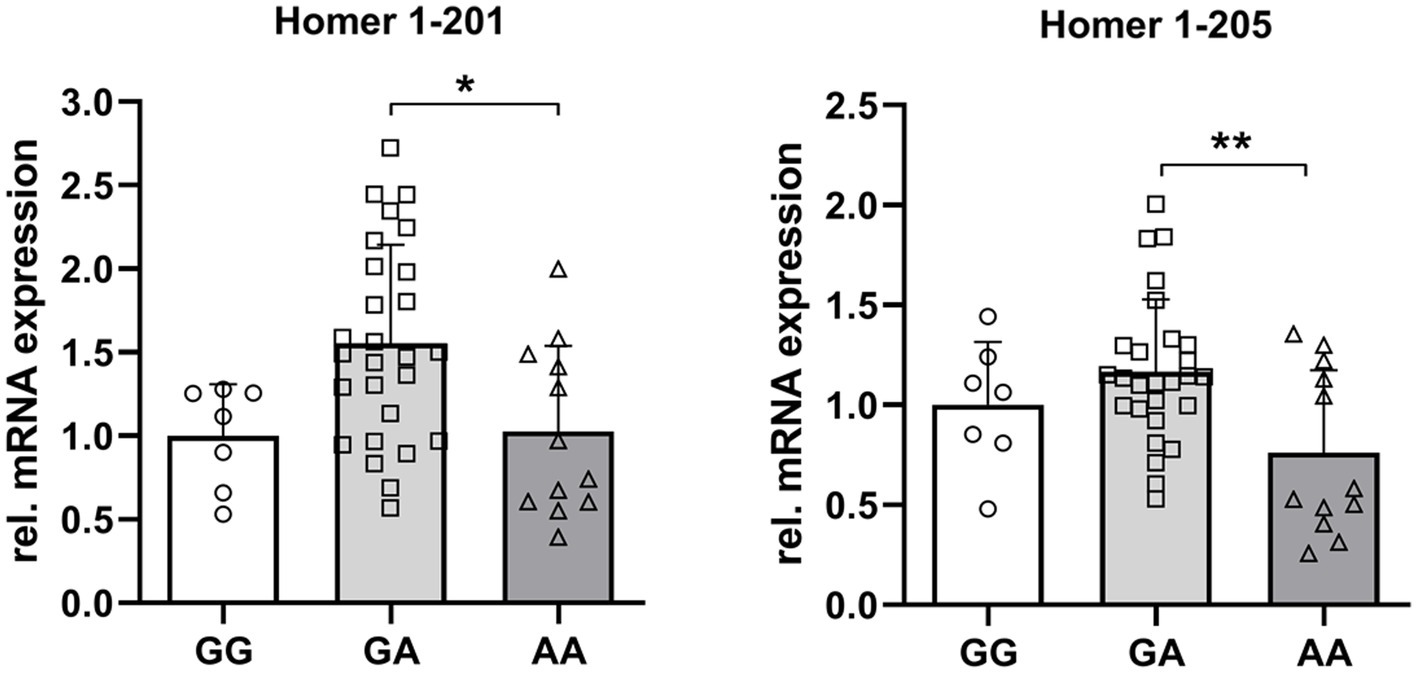 Figura 6. Abundancia relativa de ARNm de las isoformas 1 y 201 de Homer205 dependientes del genotipo en el rs_325197091 SNP del locus Homer1 porcino. Los asteriscos denotan diferencias significativas entre los grupos (p < 0,05 y p < 0,01).***
Figura 6. Abundancia relativa de ARNm de las isoformas 1 y 201 de Homer205 dependientes del genotipo en el rs_325197091 SNP del locus Homer1 porcino. Los asteriscos denotan diferencias significativas entre los grupos (p < 0,05 y p < 0,01).***
A continuación, reasignamos los niveles de expresión de genes miogénicos (datos mostrados en la Figura 3) a los genotipos Homer1.
Los niveles de expresión del marcador SATC Pax7 y desmina se relacionaron con el genotipo Homer1, con la menor expresión en la variante AA. Para la expresión de MyoG y MyoD, se observó una tendencia similar (Figura 7).
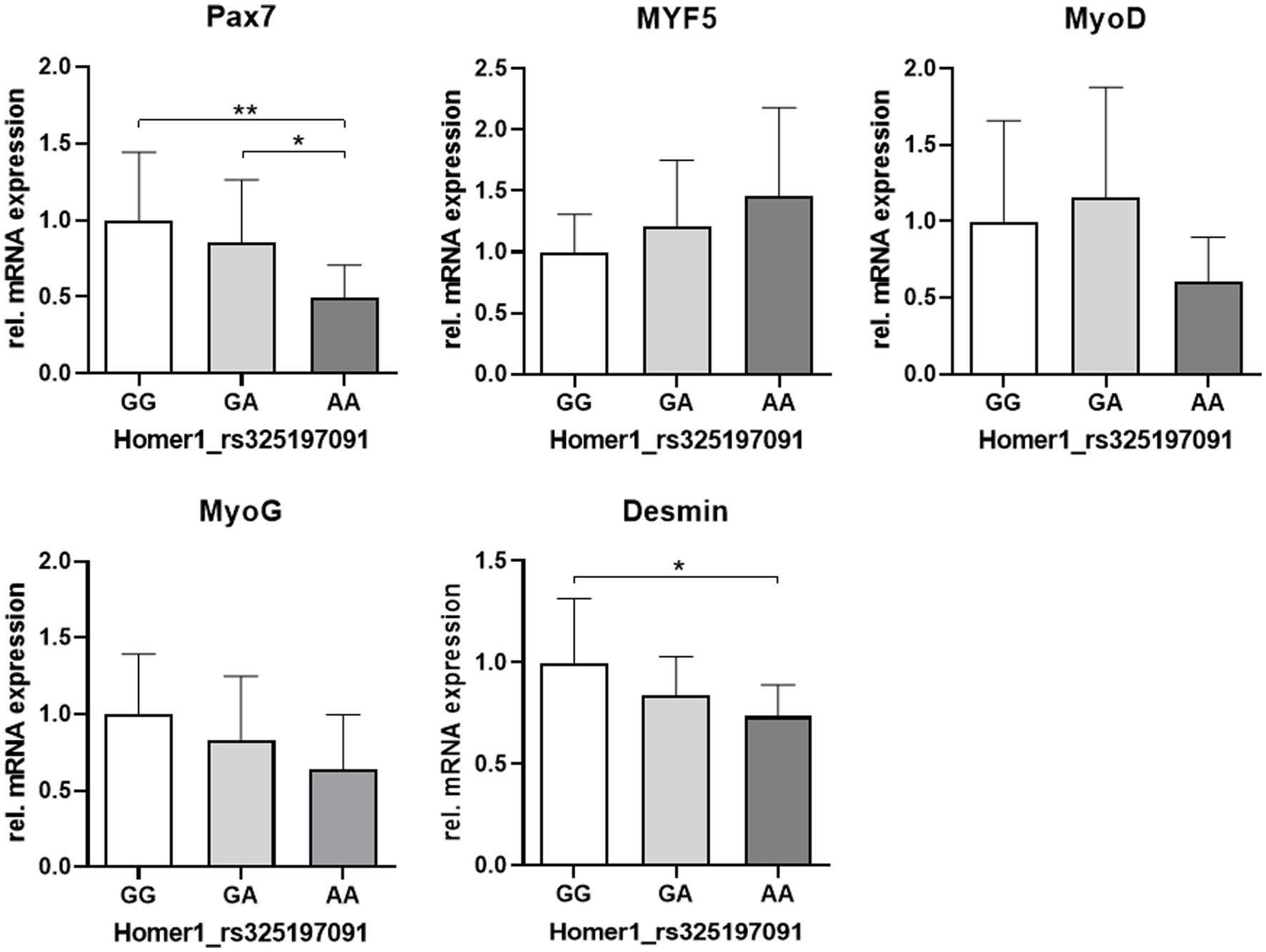 Figura 7. Abundancia relativa de ARNm de marcadores miogénicos relacionados con el genotipo en el locus HOMER1. Los asteriscos denotan diferencias significativas entre los grupos (p < 0,05 y p < 0,01).***
Figura 7. Abundancia relativa de ARNm de marcadores miogénicos relacionados con el genotipo en el locus HOMER1. Los asteriscos denotan diferencias significativas entre los grupos (p < 0,05 y p < 0,01).***
4 Discusión
En nuestro estudio, utilizamos tejidos musculares (ST y LD) y SATC aislados (LD) de lechones de 1 día de edad con PCS clínico y sus respectivos controles (LC y HC) para caracterizar los parámetros del tejido muscular, así como las propiedades moleculares y funcionales de la población de SATC. Además, se exploró la relación entre esas propiedades con los genotipos Homer1.
4.1 La reducción del cambio de miofibras rápido a lento, la atrofia de miofibras y el aumento de la actividad apoptótica caracterizan los músculos de lechones PCS de 1 día de edad
Los músculos LD y ST fueron seleccionados para nuestro estudio, ya que esos músculos son los más afectados por el PCS (7-9). Sin embargo, el músculo LD es un músculo ligero que contiene mayoritariamente miofibras de tipo II (17), mientras que el ST está compuesto por una parte superficial clara y una parte oscura profunda (43). Además, la cinética de los procesos de maduración y las tasas de crecimiento difieren marcadamente entre los músculos LD y ST (44).
Por ejemplo, la transformación de tipo II a tipo I en la porción profunda del ST comienza ya durante el desarrollo fetal tardío, mientras que comienza solo después del nacimiento en LD (16, 45). En consecuencia, al nacer, la relación entre las fibras tipo II y tipo I asciende a 5,7 y 26,0 en los músculos normales ST y LD, respectivamente (16, 17). Nuestros datos muestran un número significativamente mayor de miofibras tipo II en el ST de lechones PCS de 1 día de edad en comparación con ambos grupos de control. Estos resultados apuntan a una reducción del cambio de tipo de fibra rápida a lenta en el grupo PCS, lo que refleja un fuerte efecto negativo en la maduración prenatal de miofibras del ST (11). Las vías de señalización MEK1-ERK1/2 y calcineurina (CN)/factor nuclear de las células T activadas (NFAT) están implicadas en la activación de un programa oxidativo lento en los progenitores musculares y las miofibras (46, 47) y podrían alterarse en lechones PCS. Se ha demostrado que la promoción de las fibras musculares tipo I y, por lo tanto, un fenotipo oxidativo de contracción lenta, protege los músculos esqueléticos de la debilidad muscular y reduce la progresión de la distrofia muscular de Duchenne en humanos (46, 47). La mayor resistencia de las miofibras tipo I se relaciona entre otros factores con el aumento de los niveles de expresión de utrofina A, que también se regula de manera dependiente de CN/NFAT (48, 49). Por lo tanto, un menor número de miofibras de tipo I en el músculo ST, que se utiliza para la locomoción, podría contribuir significativamente al fenotipo PCS prenatal/neonatal. Esto podría explicarse por un mayor riesgo general de que las miofibras de tipo II se vean afectadas por la MFH, de modo que se supere el umbral crítico que conduce a la debilidad muscular (7, 50). Además, el tipo metabólico de la miofibra también afecta al número de SATC y a las propiedades de las células de reserva. Las fibras de tipo II tienen menos SATC que muestran un mayor potencial de autorrenovación e inician la diferenciación terminal más tarde que las de las fibras de tipo I (51).
Al igual que otros autores (8, 26, 52), encontramos una media de MCSA más pequeña junto con un mayor número de miofibras en las muestras de ST de los lechones PCS afectados en comparación con los lechones HC. Así, los lechones PSC de 1 día de edad mostraron una marcada atrofia miofibra en el músculo ST pero no en el LD. Este hallazgo se relaciona con el hecho de que el TS y el LD difieren mucho en sus tasas de crecimiento pre y postnatal (44), lo que per se determina la morfología variable de los músculos neonatales del ST o LD al nacer. Además de la síntesis intensiva de proteínas miofibrilares, el proceso de crecimiento prenatal incluye un fuerte aumento en el número total de núcleos. La mayoría de ellos se proporcionaron como nuevos mionúcleos a las fibras secundarias en crecimiento, lo que resultó en condiciones normales en una reducción del 18% de la población de SATC hasta el día 1 después del nacimiento (19). Los músculos de las extremidades traseras muestran una tasa de crecimiento mucho más alta (aproximadamente 3 veces) que el músculo LD durante el desarrollo prenatal. Además, de todos los músculos, la tasa de crecimiento prenatal es más baja en la LD, lo que resulta en la MCSA más baja al nacer (44). Por lo tanto, de acuerdo con nuestros resultados, la alteración del crecimiento prenatal tendrá efectos más fuertes en los músculos de rápido crecimiento, como el ST. Aquí, además de la reducción del crecimiento de miofibras, encontramos un menor número de mionúcleos por fibra en muestras de músculo ST de lechones PSC de 1 día de edad en comparación con ambos grupos de control. Esto apunta a un deterioro de la funcionalidad y/o pérdida de las SATC, específicamente durante el período de crecimiento intensivo de las miofibras secundarias antes del nacimiento (19). Curiosamente, en la mayoría de los estudios con lechones neonatos PCS, se encontró MFH pero no atrofia de miofibras en una amplia gama de músculos (1, 6, 7). Además, en la LD, solo se encontró una atrofia miofibra significativa relacionada con el PCS cuando los lechones investigados tenían al menos 2 días de edad (8, 26, 52). La LD es el único músculo con una mayor tasa de crecimiento después del nacimiento y, además, el tamaño de su fibra es el que más aumenta (44, 53). Por lo tanto, la aparición de efectos negativos sobre la hipertrofia miofibra, se relaciona con el inicio del crecimiento postnatal dependiente de SATC en la LD.
Se sabe que los procesos apoptóticos preceden a la atrofia medible de las miofibras (54). De hecho, mediante el uso del ensayo TUNEL, encontramos una actividad apoptótica significativamente mayor (LD) o numéricamente aumentada (ST) en los animales afectados por PCS en comparación con los HC. La apoptosis es un proceso rápido y las células afectadas se fagocitan inmediatamente (27, 54). Por lo tanto, incluso el número aparentemente pequeño de células apoptóticas en nuestro estudio indica una muerte celular masiva en el grupo de PSC. A diferencia de la necrosis, la apoptosis depende de los genes. De acuerdo, se ha demostrado que varios genes implicados en la muerte celular, concretamente el marcador de atrofia FBXO32 (MAFbx), están regulados al alza en el músculo de lechones con síntomas clínicos de PCS (8, 26, 35, 52).
Los mioblastos son más sensibles a la apoptosis, específicamente durante la transición a la diferenciación (29, 32, 55). Por lo tanto, puede producirse una elevación de la fracción TUNEL-positiva de las células musculares cuando se altera la interacción normal entre las vías que regulan la proliferación y la diferenciación. Por ejemplo, el aumento de la expresión de MAFbx en los músculos afectados por PCS condujo a la regulación a la baja de los niveles de proteínas MyoD y MyoG y a la degradación de MyoD, lo que resultó en una diferenciación defectuosa de mioblastos (26, 56).
Por lo tanto, en el siguiente paso, investigamos la población de progenitores ciclónicos con más detalle.
4.2 Una población de progenitores positivos para Pax7 proliferantes domina en el tejido de los lechones PCS
En el cerdo, una alta proporción de la población de SATC/progenitores expresa Pax7 en la fase proliferativa juvenil, pero estas células pueden diferir en su estado de diferenciación. Por lo tanto, tiñimos las células progenitoras con Pax7 y Ki67, un marcador de células que se dividen activamente, y evaluamos la proporción de Pax7/Ki67+−, Pax7/Ki67 y Pax7++−Células /Ki67. La población negativa a Ki67 podría representar SATC Pax7 no activados, mientras que Pax7/Ki67 y Pax7++++−Se activan las células /Ki67 (20, 57, 58).+
La proporción de Pax7/Ki67+− a los núcleos totales fue similar en todos los grupos y en ambos músculos. Esta población refleja células en las que Pax7 había inducido la retirada de la diferenciación y la transición a la quiescencia (59, 60). En los juveniles, este proceso es importante para formar el grupo de adultos SATC (59). Además, las SATC con alta expresión de Pax7 forman las llamadas células de reserva que son necesarias para reponer el grupo de SATC, pero también dan lugar a células de proliferación rápida con mayor potencial de diferenciación (23, 61). Curiosamente, la proporción de PAX7/Ki67+− Las células encontradas en este estudio (aproximadamente el 10%) concuerdan bien con los datos in vitro de Patruno et al. (62). Los autores aislaron las SATC del ST de lechones recién nacidos, y después de 1 semana en cultivo, encontraron un 13,6% de células positivas para Pax7. Así, de acuerdo con la naturaleza reversible del síndrome PCS (18), la proporción relativa de células de reserva se mantiene en el grupo PCS.
Sin embargo, la proporción de células Pax7/Ki67 fue marcadamente mayor en el grupo PCS de ambos músculos en comparación con LC (LD) o ambos grupos de control (ST). Así, PCS favorece la generación de progenitores comprometidos proliferantes que junto con Pax7 expresan los genes miogénicos Myf5 o MyoD (58, 63). Esta parece ser una característica de los músculos de los lechones con signos clínicos del síndrome, ya que la proporción de mioblastos Pax7/Ki67 es bastante reducida en las muestras del grupo LC en ambos músculos. Este cambio puede interpretarse como un reflejo de un potencial de diferenciación reducido en la población de progenitores miogénicos de lechones PCS (60). Sin embargo, la proporción de Pax7++++−Las células /Ki67 fueron similares en todos los grupos para la LD y solo se redujeron numéricamente en los grupos LC y PCS de la ST.+
Por lo tanto, para obtener información más directa sobre el potencial de diferenciación, a continuación investigamos la expresión de ARNm de una gama más amplia de genes miogénicos en muestras de músculo ST.
4.3 Menor expresión del regulador maestro miogénico MyoD a nivel de ARNm es una característica principal de los lechones PCS y de los controles de camada
En las muestras de tejido de ST, la expresión de ARNm de Pax7 y Myf5 fue similar en todos los grupos, mientras que el nivel de expresión de MyoD se redujo notablemente en las muestras de lechones LC y PCS en comparación con HC. Un gran número de genes relacionados con la diferenciación, por ejemplo, la creatina quinasa, el receptor de acetilcolina, MyoG, el inhibidor de la quinasa dependiente de ciclina p21 y la cadena ligera de miosina, son dianas de MyoD y pueden verse afectadas negativamente por la represión de MyoD (31, 64-68). Por lo tanto, una menor expresión de MyoD en los grupos LC y PCS significa que todos los lechones de las camadas afectadas tienen un mayor riesgo de desarrollar un fenotipo visible de patas abiertas debido a trastornos reguladores en varios niveles del proceso de diferenciación. Aquí, encontramos que la expresión de MyoG era normal en LC pero se redujo significativamente en los lechones PCS. MyoG es crucial para generar mioblastos competentes para la fusión y, por lo tanto, el crecimiento hipertrófico de las miofibras. Por lo tanto, la regulación negativa de MyoG podría contribuir a la atrofia de miofibras observada en el ST de PCS, pero no en los lechones LC.
En los músculos de los recién nacidos, la desmina se ha identificado como un sello distintivo de la replicación de mioblastos (69, 70). En este estudio, encontramos que la expresión de desmina está significativamente regulada al alza en el tejido ST del PCS en comparación con el grupo HC. Esto está de acuerdo con nuestro hallazgo de una mayor proporción de mioblastos Pax7/Ki67 en el tejido muscular de los lechones PCS. Por lo tanto, a diferencia del grupo LC, la mayoría de los mioblastos recién generados escapan a la diferenciación terminal en el grupo PCS, lo que también los hace más sensibles a la apoptosis (29). Sin embargo, queda por aclarar si otras dianas de MyoD además de MyoG también contribuyen a la expresión del fenotipo clínico de PCS y cómo lo hacen.++
Debido a que una multitud de factores extrínsecos, como la nutrición, pueden afectar la funcionalidad de SATC in vivo, realizamos ensayos de diferenciación in vitro con células aisladas y evaluamos el mismo panel de genes miogénicos para dilucidar si las propiedades intrínsecas de SATC celular se ven afectadas en lechones con síndrome de PCS.
4.4 In vitro, las células de los lechones PCS generan mioblastos comprometidos con el ciclo que muestran una diferenciación retardada
Cabe mencionar que las diferencias observadas entre los grupos en los niveles de expresión de ARNm en el día 0 (inducción de la diferenciación por reducción sérica del 20% al 2%) del experimento podrían indicar diferencias en la composición de la población de SATC. De acuerdo con los resultados sobre la abundancia de proteínas Pax7 y Ki67 en muestras de tejido LD, los niveles más altos de ARNm de Pax7 y MyoD parecen reflejar una población dominante de células Pax7/MyoD en proliferación en aislados de lechones PCS, mientras que esta población parece ser mucho más pequeña en células de lechones LC.++
Como se ha visto en el grupo HC, la expresión de Myf5 normalmente disminuye cuando las células comienzan a diferenciarse (71, 72). Sin embargo, la expresión de Myf5 es mayor en los lechones PCS (día 0 a 1) y LC (día 1) al inicio del experimento, y su regulación a la baja durante el período experimental es más lenta que en los lechones HC, lo que retrasará la entrada en el proceso de diferenciación en ambos grupos (72). Específicamente, las células aisladas de lechones LC regulan al alza Myf5 desde el día 0 hasta el día 1, lo que podría reflejar la formación de células de reserva (73). Esto también explicará la pequeña reducción de la expresión de MyoG en el grupo LC en comparación con el grupo HC, mientras que la cinética de expresión de MyoG es similar. De manera positiva, esto podría interpretarse como una respuesta adaptativa dirigida a regenerar el conjunto de celdas de reserva/SATC limitando la diferenciación terminal.
Sin embargo, se encontraron cambios sorprendentes en la cinética de expresión de Pax7, MyoD y MyoG en el grupo PCS. Al comienzo del experimento, parte de las células de los lechones PSC parecían reaccionar normalmente (regulación a la baja de MyoD y regulación al alza de MyoG) al medio de diferenciación. Sin embargo, en momentos posteriores, las células de los lechones PCS mostraron picos de expresión extremos de Pax7, MyoD y MyoG, que no se observaron en ningún grupo de control. Especialmente, la regulación positiva de Pax7 y MyoG en el mismo punto de tiempo fue sorprendente porque se sabe que su expresión es mutuamente excluyente durante la diferenciación (60). Por lo tanto, la única explicación razonable para esta observación es un aumento transitorio de progenitores miogénicos comprometidos (Pax7/MyoD) y células en una fase muy temprana de diferenciación (MyoD y/o MyoG), cuya transición a la diferenciación terminal se retrasa. De acuerdo, las microfotografías de estos cultivos diferenciados también muestran una formación de miotubos menos organizada al final del régimen de diferenciación.++++
4.5 La variante AA de Homer1 está relacionada con la patogénesis de PCS al reducir la expresión de Pax7
Homer1, debido a su papel como proteína de andamiaje y adaptador, es un actor crucial en una multitud de cascadas de señalización intracelular involucradas en la maduración miogénica. Por lo tanto, no es sorprendente que Homer1 haya sido considerado un gen candidato para la herencia del PCS en estudios genéticos previos sobre el PCS (4). En este estudio, el genotipado de muestras musculares de animales afectados por PCS reveló una tendencia hacia una mayor frecuencia de los alelos A que de G en el SNP Homer1_rs325197091, en contraste con los resultados de Xu et al. (37), quienes observaron una frecuencia significativamente mayor del alelo G en una muestra más grande de lechones de patas separadas. Sin embargo, el alelo A se relacionó significativamente con una disminución de la expresión de la isoforma Homer1-205 truncada en nuestro estudio, lo que está en línea con la mayor actividad promotora observada en lechones portadores del genotipo GG (37).
Sorprendentemente, la expresión del marcador SATC Pax7 se redujo significativamente en lechones con el genotipo AA en el locus Homer1, mientras que una comparación de los grupos fenotípicos (HC, LC y PCS) no reveló cambios significativos. Por lo tanto, nuestros resultados indican una relación directa entre el factor miogénico Pax7 y la patogénesis del PCS. Esto es corroborado por Seale et al. (74), mostrando que los ratones con mutación nula de Pax7 (Pax7−/−) desarrollaron debilidad muscular caracterizada por una marcha anormal, extremidades traseras separadas y atrofia miofibrosa parecida a la de los lechones con PSC. Además, la ausencia de Pax7 da lugar a una pérdida progresiva de SATC debido a la apoptosis y a los defectos del ciclo celular (25). Por lo tanto, en el contexto del crecimiento postnatal temprano, Pax7 es esencial para la supervivencia de los progenitores juveniles del músculo ciclista (25, 59). Al igual que en nuestro estudio, la apoptosis comienza inmediatamente después del nacimiento en la Pax7−/− modelo utilizado por Relaix et al. (25). Demostraron que la muerte celular se producía en mioblastos activos marcados por desmina. Por lo tanto, la reducción de la expresión de desmina en el genotipo AA de Homer1 podría, al menos en parte, reflejar el aumento de la actividad apoptótica que encontramos en muestras musculares de lechones PCS. Además de su función antiapoptótica, Pax7 es indispensable para la expansión de los progenitores musculares juveniles, manteniendo su potencial miogénico (23, 25). En concreto, Pax7 controla la activación de MyoD y, por tanto, la miogénesis (25). De acuerdo, hubo una tendencia a la disminución de la expresión de MyoD en la variante AA, que también muestra la menor expresión de MyoG y desmina, que son objetivos de MyoD. Además de la expresión de MyoG, la salida del ciclo celular es un paso esencial hacia la diferenciación terminal (73). La regulación positiva dependiente de MyoD del inhibidor de la quinasa dependiente de ciclina p21 es un componente integral de este proceso irreversible (67, 68, 75). Por lo tanto, una menor expresión de MyoD conducirá a una expresión reducida de p21, que también se sabe que es un regulador negativo crítico tanto de la proliferación como de la apoptosis (32, 67). Su alteración da lugar a un aumento de la proliferación y la apoptosis, pero reduce la formación de miotubos (67, 76, 77). De hecho, encontramos niveles bajos de MyoD y MyoG, una mayor proporción de células progenitoras proliferativas de Pax7/Ki67 y un aumento de la actividad apoptótica en muestras musculares de lechones PCS. Estos resultados concuerdan con los encontrados en estudios con MyoD++− o ratones deficientes en p21, lo que indica un retraso en la transición de mioblastos a miocitos (66, 75, 78). De hecho, nuestros ensayos in vitro con células aisladas confirmaron la cinética de diferenciación retardada en el grupo PCS.
A diferencia de Pax7, la expresión de Myf5 no se ve afectada negativamente por el genotipo AA y muestra una tendencia hacia la regulación positiva. Esto está de acuerdo con los datos de otros que muestran que la reducción de MyoD se asocia con la regulación positiva de Myf5 (79) y que la reducción de Pax7 no tiene ningún efecto sobre Myf5. Lo más importante es que Myf5 puede activar MyoG directamente, mientras que la activación de la miogénesis por Pax7 depende de MyoD (25, 66). Por lo tanto, Myf5 puede compensar parcialmente la MyoD en la regulación de la miogénesis.
5 Conclusión
En este estudio, mostramos por primera vez que el síndrome PCS incluye una funcionalidad alterada de la población progenitora miogénica postnatal temprana. Nuestros hallazgos revelan una mayor actividad apoptótica, una mayor proporción de progenitores comprometidos proliferantes (Pax7/Ki67) y un menor potencial de diferenciación como se refleja en la expresión reprimida de MyoD y MyoG. El desequilibrio entre la proliferación/muerte celular y la diferenciación tiene efectos negativos sobre el crecimiento hipertrófico postnatal y contribuye a la atrofia de miofibras relacionada con la PSC. Nuestros resultados revelaron que la variante HOMER1_rs325197091 A está sobrerrepresentada en el grupo PCS. La variante homocigota AA se asocia con una menor expresión del subtipo 1 de Homer205 y del marcador SATC Pax7, que es esencial para la producción de SATC funcional y la regulación de la miogénesis. Por otro lado, la expresión de Myf5 es mayor en este genotipo. Por lo tanto, se puede concluir que el equilibrio de las proteínas Homer1 y, por lo tanto, sus funciones reguladoras se ven afectadas de una manera perjudicial para el programa de diferenciación miogénica. Por lo tanto, nuestros resultados indicaron una relación directa entre un gen miogénico relevante y la patogénesis del PCS. Sin embargo, el modo exacto de acción para la regulación dependiente de Homer1-205 de la expresión de Pax7 aún debe ser dilucidado.++
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
No se requirió revisión ética ni aprobación para el estudio en animales participantes de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
TS y MR: concibieron y diseñaron el estudio. TS, HR y SM: recopilaron, compilaron y analizaron los datos. TS, SM y MR: redactó y editó el manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. La publicación de este artículo contó con el apoyo del Fondo de Acceso Abierto del FBN.
Reconocimientos
Los autores desean agradecer la excelente asistencia técnica de Marie Jugert-Lundt, Angela Steinborn y Kerstin Niemann.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Ducatelle, R, Maenhout, D, Coussement, W, y Hoorens, JK. Hipoplasia miofibrilada espontánea y experimental y su relación con la pata extendida en lechones recién nacidos. J Comp Pathol. (1986) 96:433–45. doi: 10.1016/0021-9975(86)90039-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Papatsiros, V. El síndrome de las patas abiertas en lechones: una revisión. Am J Anim Vet Sci. (2012) 7:80–3. doi: 10.3844/ajavsp.2012.80.83
3. Ooi, PT, Tee, TP y Lai, J. Pierna congénita porcina: una revisión. J Vet Malasia. (2012) 24:10–3.
4. Hao, X, Plastow, G, Zhang, C, Xu, S, Hu, Z, Yang, T, et al. Un estudio de asociación de genoma completo identifica genes candidatos para el síndrome de patas abiertas de lechones en diferentes poblaciones. BMC Genet. (2017) 18:64. doi: 10.1186/s12863-017-0532-4
5. Schumacher, T, Röntgen, M, y Maak, S. Síndrome congénito de piernas abiertas en lechones: conocimiento actual y un nuevo enfoque de la etiología. Front Vet Sci. (2021) 8:609883. doi: 10.3389/fvets.2021.609883
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Deutsch, K, y Done, JT. Hipoplasia miofibrilar congénita de lechones: ultraestructura de las fibras afectadas. Res Vet Sci. (1971) 12:176–7. doi: 10.1016/S0034-5288(18)34217-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Lukas, Z, Pivnik, L, Straka, I, Rampochova, J, Stepanova, L, Kaman, J, et al. Diferenciación postnatal precoz de las fibras musculares y aparición de hipoplasia miofibrilada en lechones. Acta Vet Brno. (1982) 51:31–45. doi: 10.2754/avb198251010031
8. Ooi, PT, da Costa, N, Edgar, J y Chang, KC. La pata porcina congénita se caracteriza por la atrofia de las fibras musculares asociada con un aumento relativo de MAFbx y una caída en la expresión de P311. BMC Vet Res. (2006) 2:23. doi: 10.1186/1746-6148-2-23
9. Thurley, D, Gilbert, F y Done, J. Pata congénita de lechones: hipoplasia miofibrilar. Rec. Veterinario (1967) 80:302–4. doi: 10.1136/vr.80.9.302
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Bergmann, V. Elektronenmikroskopische Befunde an der Skelettmuskulatur von neugeborenen Ferkeln mit Grätschstellung. Arch Exp Vet Med. (1976) 30:239–60.
11. Hanzlíková, V. Patrones histoquímicos en fibras musculares de lechones normales y de patas abiertas. Histoquímica. (1980) 67:311–9. doi: 10.1007/BF00692763
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Fiorotto, ML, Davis, TA, y Reeds, PJ. Regulación del recambio proteico miofibrilar durante la maduración en cachorros de rata normales y desnutridos. Am J Physiol Regul Integr Comp Physiol. (2000) 278:R845-54. doi: 10.1152/ajpregu.2000.278.4.R845
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Glore, SR y Layman, DK. Desarrollo celular del músculo esquelético durante los primeros períodos de restricción nutricional y posterior rehabilitación. Pediatr Res. (1983) 17:602–5. doi: 10.1203/00006450-198307000-00017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Fiorotto, ML, Columbus, DA, Steinhoff-Wagner, J, Suryawan, A, Nguyen, HV, y Davis, TA. El crecimiento muscular postnatal depende de la proliferación de células satélite, lo que demuestra un requerimiento específico de proteínas en la dieta. FASEB J. (2016) 30:1244.1. doi: 10.1096/fasebj.30.1_supplement.1244.1
15. Rudar, M, Naberhuis, JK, Suryawan, A, Nguyen, HV, Fiorotto, ML y Davis, TA. La prematuridad reduce la síntesis de proteínas en el músculo esquelético independientemente del peso corporal en cerdos recién nacidos. Pediatr Res. (2023) 94:143–52. doi: 10.1038/s41390-022-02456-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Beermann, DH, Cassens, RG, y Hausman, GJ. Una segunda mirada a la diferenciación del tipo de fibra en el músculo esquelético porcino. J Anim Sci. (1978) 46:125–32. doi: 10.2527/jas1978.461125x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Suzuki, A, y Cassens, RG. Estudio histoquímico de los tipos miofibrilares en el músculo del cerdo en crecimiento. J Anim Sci. (1980) 51:1449–61. doi: 10.2527/jas1981.5161449x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Jirmanova, I. La enfermedad de las piernas abiertas: ¿una forma de miopatía glucocorticoide congénita? Vet Res Commun. (1983) 6:91–101. doi: 10.1007/BF02214901
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Campion, DR, Richardson, RL, Kraeling, RR, y Reagan, JO. Cambios en la población de células satélite en el músculo esquelético fetal de cerdo. J Anim Sci. (1979) 48:1109–15. doi: 10.2527/jas1979.4851109x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Chang, Carolina del Norte, y Rudnicki, MA. Células satélite: los arquitectos del músculo esquelético. Curr Top Dev Biol. (2014) 107:161–81. doi: 10.1016/B978-0-12-416022-4.00006-8
21. Mesires, NT, y Doumit, ME. Proliferación y diferenciación de células satélite durante el crecimiento postnatal del músculo esquelético porcino. Am J Physiol Cell Physiol. (2002) 282:C899-906. doi: 10.1152/ajpcell.00341.2001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Zhu, H, Park, S, Scheffler, JM, Kuang, S, Grant, AL, y Gerrard, DE. Las células satélite porcinas están restringidas a un fenotipo que se asemeja a su origen muscular. J Anim Sci. (2013) 91:4684–91. doi: 10.2527/jas.2012-5804
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Miersch, C, Stange, K, Hering, S, Kolisek, M, Viergutz, T y Röntgen, M. La heterogeneidad molecular y funcional de las poblaciones de células satélite porcinas postnatales tempranas se asocia con el perfil bioenergético. Sci Rep. (2017) 7:45052. doi: 10.1038/srep45052
24. González, ML, Busse, NI, Waits, CM y Johnson, SE. Celdas satélite y su regulación en la ganadería. J Anim Sci. (2020) 98:1–13. doi: 10.1093/jas/skaa081
25. Relaix, F, Montarras, D, Zaffran, S, Gayraud-Morel, B, Rocancourt, D, Tajbakhsh, S, et al. Pax3 y Pax7 tienen funciones distintas y superpuestas en las células progenitoras musculares adultas. J Cell Biol. (2006) 172:91–102. doi: 10.1083/jcb.200508044
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Hai, T, Cao, C, Shang, H, Guo, W, Mu, Y, Yang, S, et al. Estudio piloto de producción a gran escala de cerdos mutantes mediante mutagénesis ENU. eLife. (2017) 6:e26248. doi: 10.7554/eLife.26248
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Smith, J. Factores de crecimiento muscular, ubiquitina y apoptosis en el músculo distrófico: la apoptosis disminuye con la edad en el ratón mdx. BAM. (1996) 6:279–84.
28. Stangel, M, Zettl, Reino Unido, Mix, E, Zielasek, J, Toyka, KV, Hartung, HP, et al. H2O2 y el estrés oxidativo mediado por óxido nítrico inducen apoptosis en los mioblastos del músculo esquelético de rata. J Neuropathol Exp Neurol. (1996) 55:36–43. doi: 10.1097/00005072-199601000-00004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Sandri, M, y Carraro, U. Apoptosis de los músculos esqueléticos durante el desarrollo y la enfermedad. Int J Biochem Cell Biol. (1999) 31:1373–90. doi: 10.1016/S1357-2725(99)00063-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Fimia, GM, Gottifredi, V, Passananti, C y Maione, R. La escisión internucleosómica de doble cadena del ADN apoptótico depende del grado de diferenciación en las células musculares. J Biol Chem. (1996) 271:15575–9. doi: 10.1074/jbc.271.26.15575
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Halevy, O, Novitch, BG, Spicer, DB, Skapek, SX, Rhee, J, Hannon, GJ, et al. Correlación de la detención del ciclo celular terminal del músculo esquelético con la inducción de p21 por MyoD. Ciencia. (1995) 267:1018–21. doi: 10.1126/science.7863327
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Wang, J y Walsh, K. Resistencia a la apoptosis conferida por los inhibidores de Cdk durante la diferenciación de miocitos. Ciencia. (1996) 273:359–61. doi: 10.1126/science.273.5273.359
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Stewart, CE y Rotwein, P. El factor de crecimiento similar a la insulina-II es un factor de supervivencia autocrino para diferenciar mioblastos. J Biol Chem. (1996) 271:11330–8. doi: 10.1074/jbc.271.19.11330
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Schöneich, C, Dremina, E, Galeva, N y Sharov, V. La apoptosis en la diferenciación de las células musculares C2C12 se dirige selectivamente a los miotubos deficientes en Bcl-2. Apoptosis. (2014) 19:42–57. doi: 10.1007/s10495-013-0922-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Maak, S, Boettcher, D, Tetens, J, Wensch-Dorendorf, M, Nürnberg, G, Wimmers, K, et al. Identificación de genes candidatos para la pierna abierta congénita en lechones mediante análisis alternativo de datos de microarrays de ADN. Int J Biol Sci. (2009) 5:331–7. doi: 10.7150/ijbs.5.331
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Soloviev, MM, Ciruela, F, Chan, WY, y McIlhinney, RAJ. El cerebro del ratón y los tejidos musculares expresan constitutivamente altos niveles de proteínas homer. Eur J Biochem. (2000) 267:634–9. doi: 10.1046/j.1432-1327.2000.01078.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Xu, S, Hao, X, Zhang, M, Wang, K, Li, S, Chen, X, et al. Los polimorfismos del gen HOMER1 se asocian con el síndrome de patas abiertas de lechones y un SNP significativo puede afectar su actividad promotora intrónica in vitro. BMC Genet. (2018) 19:110. doi: 10.1186/s12863-018-0701-0
38. Chomczynski, P, y Sacchi, N. Método de un solo paso de aislamiento de ARN mediante extracción ácida de tiocianato-fenol-cloroformo de guanidinio. Bioquímica anal. (1987) 162:156–9. doi: 10.1016/0003-2697(87)90021-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Ramakers, C, Ruijter, JM, Lekanne Deprez, RH, y Moorman, AFM. Análisis sin suposiciones de datos cuantitativos de reacción en cadena de la polimerasa (PCR) en tiempo real. Neurosci Lett. (2003) 339:62–6. doi: 10.1016/S0304-3940(02)01423-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Ruijter, JM, Ramakers, C, Hoogaars, WMH, Karlen, Y, Bakker, O, van den Hoff, MJB, et al. Eficiencia de amplificación: vinculación de la línea de base y el sesgo en el análisis de datos cuantitativos de PCR. Ácidos nucleicos Res. (2009) 37:e45. doi: 10.1093/nar/gkp045
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Pfaffl, MW. Un nuevo modelo matemático para la cuantificación relativa en RT-PCR en tiempo real. Ácidos nucleicos Res. (2001) 29:E45. doi: 10.1093/NAR/29.9.E45
42. Vandesompele, J, de Preter, K, Pattyn, F, Poppe, B, van Roy, N, de Paepe, A, et al. Normalización precisa de datos cuantitativos de RT-PCR en tiempo real mediante el promedio geométrico de múltiples genes de control interno. Genoma Biol. (2022) 3:Investigación0034. doi: 10.1186/gb-2002-3-7-research0034
43. Lefaucheur, L, Edom, F, Ecolan, P, y Butler-Browne, GS. Patrón de formación de fibras musculares en el cerdo. Dev Dyn. (1995) 203:27–41. doi: 10.1002/aja.1002030104
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Swatland, HJ. Crecimiento muscular en el cerdo fetal y neonatal. J Anim Sci. (1973) 37:536–45. doi: 10.2527/jas1973.372536x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Swatland, HJ. Desarrollo histoquímico de miofibras en lechones neonatos. Res Vet Sci. (1975) 18:253–7. doi: 10.1016/S0034-5288(18)33574-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Ljubicic, V, Burt, M, y Jasmin, BJ. El potencial terapéutico de la plasticidad músculo esquelética en la distrofia muscular de Duchenne: modificadores fenotípicos como dianas farmacológicas. FASEB J. (2014) 28:548–68. doi: 10.1096/fj.13-238071
47. Boyer, JG, Prasad, V, Song, T, Lee, D, Fu, X, Grimes, KM, et al. La señalización ERK1/2 induce el cambio lento del tipo de fibra del músculo esquelético y reduce la gravedad de la enfermedad de distrofia muscular. Visión de la JCI. (2019) 5:e127356. doi: 10.1172/jci.insight.127356
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Gramolini, AO, Belanger, G, Thompson, JM, Chakkalakal, JV, y Jasmin, BJ. El aumento de la expresión de utrofina en un músculo lento frente a uno rápido implica eventos postranscripcionales. Am J Physiol Cell Physiol. (2001) 281:C1300-9. doi: 10.1152/ajpcell.2001.281.4.C1300
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Chakkalakal, JV, Stocksley, MA, Harrison, MA, Angus, LM, Deschenes-Furry, J, St-Pierre, S, et al. La expresión del ARNm de utrofina, una se correlaciona con la capacidad oxidativa de los tipos de fibras musculares esqueléticas y está regulada por la señalización de calcineurina/NFAT. Proc Natl Acad Sci U S A. (2003) 100:7791–6. doi: 10.1073/pnas.0932671100
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Cox, CS, Baskerville, A, y Ward, PS. Análisis cuantitativo de imágenes del músculo esquelético de cerdos recién nacidos con hipoplasia miofibrilar y pierna abierta. Hno. Vet J. (1979) 135:370–5. doi: 10.1016/S0007-1935(17)32840-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Hashimoto, N, Murase, T, Kondo, S, Okuda, A e Inagawa-Ogashiwa, M. Reconstitución muscular por descendientes de células satélite musculares con propiedades similares a las células madre. Desarrollo. (2004) 131:5481–90. doi: 10.1242/dev.01395
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Wu, T, Zhang, X, Tian, M, Tao, Q, Zhang, L, Ding, Y, et al. El análisis del transcriptoma revela genes candidatos implicados en el síndrome de la pierna abierta en lechones. J Appl Gral. (2018) 59:475–83. doi: 10.1007/s13353-018-0454-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Fazarinc, G, Vrecl, M, Škorjanc, D, Čehovin, T y Čandek-Potokar, M. Dinámica de la transición de isoformas de cadena pesada de miosina en el músculo longissimus de cerdos domésticos y salvajes durante el crecimiento: un estudio comparativo. Animal. (2016) 11:164–74. doi: 10.1017/S175173111600131
54. Dupont-Versteegden, EE, Strotman, BA, Gurley, CM, Gaddy, D, Knox, M, Fluckey, JD, et al. La translocación nuclear de EndoG al inicio de la atrofia muscular por desuso y la apoptosis es específica de los mionúcleos. Am J Physiol Regul Integr Comp Physiol. (2006) 291:R1730-40. doi: 10.1152/ajpregu.00176.2006
55. Dee, K, Freer, M, Mei, Y y Weyman, CM. La apoptosis coincidente con la diferenciación de los mioblastos esqueléticos se retrasa por la inhibición de la caspasa 3 y se anula por la señalización constitutiva de Ras independiente de MEK. La muerte celular difiere. (2002) 9:209–18. doi: 10.1038/sj.cdd.4400930
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Tintignac, LA, Lagirand, J, Batonnet, S, Sirri, V, Leibovitch, MP, y Leibovitch, SA. Degradación de MyoD mediada por la ubiquitina ligasa SCF (MAFbx). J Biol Chem. (2005) 280:2847–56. doi: 10.1074/jbc. M411346200
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Gnocchi, VF, White, RB, Ono, Y, Ellis, JA, y Zammit, PS. Caracterización adicional de la firma molecular de células satélite musculares de ratón inactivas y activadas. PLoS Uno. (2009) 4:E5205. doi: 10.1371/journal.pone.0005205
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Dumont, NA, Wang, YX y Rudnicki, MA. Mecanismos intrínsecos y extrínsecos que regulan la función de las células satélite. Desarrollo. (2015) 142:1572–81. doi: 10.1242/dev.114223
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Lepper, C, Conway, SJ y Fan, CM. Las células satélite adultas y los progenitores musculares embrionarios tienen requisitos genéticos distintos. Naturaleza. (2009) 460:627–31. doi: 10.1038/nature08209
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Olguín, HC, y Olwin, BB. La regulación positiva de Pax-7 inhibe la miogénesis y la progresión del ciclo celular en las células satélite: un mecanismo potencial para la autorrenovación. Dev Biol. (2004) 275:375–88. doi: 10.1016/j.ydbio.2004.08.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Rocheteau, P, Gayraud-Morel, B, Siegl-Cachedenier, I, Blasco, MA, y Tajbakhsh, S. Una subpoblación de células madre adultas del músculo esquelético conserva todas las hebras de ADN moldear después de la división celular. Células. (2012) 148:112–25. doi: 10.1016/j.cell.2011.11.049
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Patruno, M, Caliaro, F, Martinello, T y Mascarello, F. Expresión de la proteína Pax7 del dominio de caja emparejada en células miogénicas aisladas del músculo semitendinoso porcino después del nacimiento. Célula tisular. (2008) 40:1–6. doi: 10.1016/j.tice.2007.08.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Neal, A, Boldrin, L, y Morgan, JE. La célula satélite en el músculo del ratón masculino y femenino, en desarrollo y adulto: células madre distintas para el crecimiento y la regeneración. PLoS Uno. (2012) 7:E37950. doi: 10.1371/journal.pone.0037950
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Lassar, AB, Buskin, JN, Lockshon, D, Davis, RL, Apone, S, Hauschka, SD, et al. Myod es una proteína de unión al ADN específica de secuencia que requiere una región de homología myc para unirse al potenciador de la creatina quinasa muscular. Células. (1989) 58:823–31. doi: 10.1016/0092-8674(89)90935-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Piette, J., Bessereau, J.L., Huchet, M., y Changeux, J.P. Dos sitios adyacentes de unión a MyoD1 regulan la expresión del gen de la subunidad alfa del receptor de acetilcolina. Naturaleza. (1990) 345:353–5. doi: 10.1038/345353a0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Yablonka-Reuveni, Z, Rudnicki, MA, Rivera, AJ, Primig, M, Anderson, JE, y Natanson, P. La transición de la proliferación a la diferenciación se retrasa en las células satélite de ratones que carecen de MyoD. Dev Biol. (1999) 210:440–55. doi: 10.1006/dbio.1999.9284
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Guo, K, Wang, J, Andres, V, Smith, RC y Walsh, K. La expresión inducida por MyoD de p21 inhibe la actividad de la quinasa dependiente de ciclina tras la diferenciación terminal de los miocitos. Mol Cell Biol. (1995) 15:3823–9. doi: 10.1128/MCB.15.7.3823
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Andrés, V, y Walsh, K. La expresión de miogenina, el retiro del ciclo celular y la diferenciación fenotípica son eventos temporalmente separables que preceden a la fusión celular en la miogénesis. J Cell Biol. (1996) 132:657–66. doi: 10.1083/jcb.132.4.657
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Kaufman, SJ y Foster, RF. Los mioblastos replicantes expresan un fenotipo específico del músculo. Proc Natl Acad Sci U S A. (1988) 85:9606–10. doi: 10.1073/pnas.85.24.9606
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Conboy, MJ, Karasov, AO y Rando, TA. Alta incidencia de segregación no aleatoria de la hebra molde y determinación asimétrica del destino en las células madre en división y su progenie. PLoS Biol. (2007) 5:E102. doi: 10.1371/journal.pbio.0050102
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Saitoh, O, Fujisawa-Sehara, A, Nabeshima, Y y Periasamy, M. Expresión de factores miogénicos en el músculo de la pechuga de pollo denervado: aislamiento del gen Myf5 de pollo. Ácidos nucleicos Res. (1993) 21:2503–9. doi: 10.1093/nar/21.10.2503
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Danoviz, ME, y Yablonka-Reuveni, Z. Células satélite del músculo esquelético: antecedentes y métodos para el aislamiento y el análisis en un sistema de cultivo primario. Métodos Mol Biol. (2012) 798:21–52. doi: 10.1007/978-1-61779-343-1_2
73. Viernes, BB, y Pavlath, GK. Una vía dependiente de calcineurina y NFAT regula la expresión del gen Myf5 en las células de reserva del músculo esquelético. J Cell Sci. (2001) 114:303–10. doi: 10.1242/jcs.114.2.303
Resumen de PubMed | Texto completo de CrossRef | Google Académico
74. Seale, P, Sabourin, LA, Girgis-Gabardo, A, Mansouri, A, Gruss, P, y Rudnicki, MA. Pax7 es necesario para la especificación de células satélite miogénicas. Células. (2000) 102:777–86. doi: 10.1016/S0092-8674(00)00066-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Zhang, P, Wong, C, Liu, D, Finegold, M, Harper, JW, y Elledge, SJ. p21CIP1 y p57KIP2 controlan la diferenciación muscular en el paso de la miogenina. Genes Dev. (1999) 13:213–24. doi: 10.1101/gad.13.2.213
Resumen de PubMed | Texto completo de CrossRef | Google Académico
76. Yang, SY y Goldspink, G. Diferentes roles del péptido Ec IGF-I (MGF) y el IGF-I maduro en la proliferación y diferenciación de mioblastos. FEBS Lett. (2002) 522:156–60. doi: 10.1016/S0014-5793(02)02918-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Qin, LL, Li, XK, Xu, J, Mo, DL, Tong, X, Pan, ZC, et al. El factor de crecimiento mecanogénico (MGF) promueve la proliferación e inhibe la diferenciación de las células satélite porcinas (PSC) mediante la regulación negativa de factores transcripcionales miogénicos clave. Bioquímica de células molinos. (2012) 370:221–30. doi: 10.1007/s11010-012-1413-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
78. Cornelison, DD, Olwin, BB, Rudnicki, MA, y Wold, BJ. MyoD−/− Las células satélite en cultivo de una sola fibra son defectuosas en la diferenciación y deficientes en MRF4. Dev Biol. (2000) 224:122–37. doi: 10.1006/dbio.2000.9682
Resumen de PubMed | Texto completo de CrossRef | Google Académico
79. Rudnicki, MA, Braun, T, Hinuma, S y Jaenisch, R. La inactivación de MyoD en ratones conduce a la regulación positiva del gen miogénico HLH Myf-5 y da como resultado un desarrollo muscular aparentemente normal. Células. (1992) 71:383–90. doi: 10.1016/0092-8674(92)90508-A
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: pierna abierta congénita porcina, PCS, SNP, homer1, miogénesis
Cita: Schumacher T, Reyer H, Maak S y Röntgen M (2023) La variante del genotipo AA de Homer 1 se relaciona con el síndrome congénito de patas abiertas en lechones al reprimir Pax7 en progenitores miogénicos. Frente. Vet. Sci. 10:1028879. doi: 10.3389/fvets.2023.1028879
Recibido: 26 de agosto de 2022; Aceptado: 06 de noviembre de 2023;
Publicado: 30 noviembre 2023.
Editado por:
Francisco Javier Salguero, Agencia de Seguridad Sanitaria del Reino Unido (UKHSA), Reino Unido
Revisado por:
Erika Jorge, Universidad Federal de Minas Gerais, Brasil
Caroline Fossum, Universidad Sueca de Ciencias Agrícolas, Suecia
Derechos de autor © 2023 Schumacher, Reyer, Maak y Röntgen. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Monika Röntgen, roentgen@fbn-dummerstorf.de
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía