Las vías de transmisión de la peste porcina africana durante un brote
 Ana Vasić1*
Ana Vasić1* Bojan Milovanović1
Bojan Milovanović1 Dimitrije Glišić1
Dimitrije Glišić1 Mihaela Kavran2
Mihaela Kavran2 Jasna Kureljušić1
Jasna Kureljušić1 Aleksandar Živulj3
Aleksandar Živulj3 Branislav Kureljušić1
Branislav Kureljušić1 Vesna Milićević1
Vesna Milićević1- 1Instituto Científico de Medicina Veterinaria de Serbia, Belgrado, Serbia
- número arábigoFacultad de Agricultura, Centro de Excelencia Una Salud, Universidad de Novi Sad, Novi Sad, Serbia
- 3Veterinarski specijalistički institut «Pančevo», Pančevo, Serbia
La peste porcina africana (PPA) es una enfermedad viral altamente contagiosa de cerdos domésticos y jabalíes (Sus scrofa) causada por un arbovirus-virus de la peste porcina africana (PPA), que se clasifica en la familia Asfarviridae. Aunque la principal vía de transmisión del virus de la peste porcina africana es el contacto directo entre los animales y las canales que liberan el virus de la peste porcina africana en el medio ambiente, el papel de otras vías de transmisión, como la contaminación ambiental o los insectos, sigue sin estar claro en gran medida. Durante una epidemia de PPA en Serbia en 2023, se recogieron muestras ambientales (suelo, piensos, agua e hisopos de los establos de cerdos) e insectos [que dieron lugar a la recolección de estadios adultos y/o larvarios de moscas no picadoras (Diptera: Calliphoridae y Muscidae)] en cuatro lugares del distrito de Banato Sur de Serbia. Para evaluar la posibilidad de que los insectos porten el virus de la PPA en los patios infectados, se ofrecieron trampas pegajosas para moscas y placas de Petri abiertas que contenían carne mezclada con tacos de algodón húmedos en tres lugares durante los cinco días del experimento en la zona de Belgrado. Además, para confirmar el papel de las moscas en la PPA en la vía de transmisión mecánica en Serbia, las larvas L2 y L3 de moscas (Lucilia sericata Meigan, 1826; Stomoxys calcitrans Linnaeus, 1758) se recolectaron de los cadáveres de cerdos de granjas infectadas, se cruzaron hasta adultos en el laboratorio y se colocó una harina de carne enriquecida con PPA en jaulas con moscas de tres días de edad (n = 52) para estimar la positividad de las moscas y la duración de la transmisión mecánica del PPA. Los resultados de las muestras ambientales no mostraron una detección positiva de ADN del virus de la PPA, lo mismo ocurrió con las muestras de trampas a base de carne y trampas pegajosas para moscas, mientras que el ADN del virus de la PPA se detectó en tres muestras que contenían huevos, larvas de moscas L1 y L3 recolectadas de cadáveres y moscas adultas (L. sericata). En condiciones experimentales, solo una mosca S. calcitrans dio positivo el día 1 después de la infección. Los resultados implican el posible papel de las moscas Lucilia sp. en la transmisión mecánica del virus de la peste porcina africana, así como de S. calcitrans en Serbia durante un brote, mientras que el ADN del virus de la peste porcina africana no se detectó en muestras ambientales en este estudio.
Introducción
La peste porcina africana (PPA) es una enfermedad hemorrágica altamente contagiosa de cerdos domésticos y jabalíes (Sus scrofa) causada por un arbovirus clasificado en la familia Asfarviridae y el género Asfivirus. En Europa, la presencia del virus de la peste porcina africana (PPA) genotipo II se detectó por primera vez en 2007 en Georgia (1), y en los años siguientes se extendió en dirección a Europa occidental hasta llegar a Serbia en 2019 (2). En los últimos años se ha detectado en Serbia el virus de la peste porcina africana tanto en cerdos domésticos como en jabalíes (3). Además, en Serbia han circulado múltiples cepas de PPA del genotipo II (4). Durante 2022 se detectó el virus de la peste porcina africana en diferentes localidades, en el oeste de Serbia (5) en cerdos domésticos potenciados por la estructura específica de las explotaciones porcinas en zonas rurales con bajas medidas de bioseguridad (6).
De acuerdo con la categorización de las explotaciones porcinas serbias dada por la Dirección Veterinaria del Ministerio de Agricultura, existen cinco tipos de producción: granjas comerciales (alta bioseguridad); granjas familiares tipo A (más de 10 animales, alta bioseguridad); granjas familiares tipo B (más de 10 animales, baja bioseguridad); traspatios (pocos cerdos para autoconsumo, mínima bioseguridad); y sistemas de pastoreo sin bioseguridad. La producción de traspatio en Serbia se centra en el consumo doméstico y las ventas locales para obtener ingresos adicionales, lo que a menudo implica el sacrificio doméstico, la alimentación con desechos y poca bioseguridad (7). Además, este tipo de producción porcina generalizada en las aldeas de Serbia no cumple ni siquiera con los estándares mínimos de bioseguridad. En un estudio, se demostró que la producción porcina de traspatio suele consistir en hasta cinco cerdos por explotación, destinada a la producción de cerdos de engorde (59,5%), situados dentro de una zona de caza o a menos de 1.000 metros de un coto de caza (61,8%), y aproximadamente el 60,7% de las explotaciones estaban situadas cerca de otras explotaciones porcinas a menos de 100 metros de distancia con contacto entre diferentes especies animales (como perros, gatos) en el 76,4% de las explotaciones y con. Vallado completo en el 57,3% de las explotaciones (8).
En el ciclo natural de África, donde se originó la PPA, las garrapatas blandas (Acari: Argasidae) del género Ornithodoros son reservorios y vectores, a través de la población de varias especies de cerdos silvestres [como el jabalí común (Phacochoerus africanus) y los cerdos silvestres (Potamochoerus larvatus)] (9). Las principales vías de transmisión del virus de la peste porcina africana en Europa incluyen la población de jabalíes y las actividades humanas (10) desde que la población establecida de la única especie vectora de garrapatas competente presente en Europa, Carios erraticus (Lucas, 1849), anteriormente Ornithodoros erraticus, se encuentra solo en áreas restringidas de la Península Ibérica (11). Las posibilidades de transmisión del virus de la PPA a través de diferentes especies de insectos como vectores mecánicos están bien establecidas para varias familias, como las moscas (Diptera: Muscidae) (12, 13), pero en gran parte el papel de los insectos como vectores en la epidemiología de la PPA en Europa no está claro y está siendo objeto de debate (13-15).
El virus de la peste porcina africana es muy resistente a factores ambientales (como el pH) y puede durar más de un año en sangre, unos meses en carne deshuesada e incluso algunos años en canales congeladas (1). Los experimentos confirmaron la excreción del virus de la peste porcina africana en los fluidos nasales, rectales y orales, así como en la cara y la orina de los animales infectados, lo que contamina los piensos, el agua, el suelo y el medio ambiente (16). Los piensos porcinos contaminados fueron responsables de al menos dos introducciones independientes de PPA en China en 2018 (17). Además, el virus de la peste porcina africana no es sensible al proceso de descomposición de los cadáveres y sobrevive hasta 112 días en el suelo forestal (1). En un estudio realizado en Alemania, el pH del suelo, la estructura del suelo y la temperatura ambiente desempeñaron un papel en la estabilidad del virus infeccioso de la PPA. Se demostró la presencia de PPA infecciosa en especímenes procedentes de arena estéril durante al menos tres semanas, de arena de playa durante un máximo de dos semanas, de tierra de jardín durante una semana y de suelo de pantano durante tres días, mientras que el PPA no se recuperó de dos suelos forestales ácidos (18). En Rumanía, se sospecha que la contaminación del agua del río Danubio es una causa de brote de PPA en una gran granja con estrictas medidas de bioseguridad (19). Se han evaluado las posibilidades de infección de cerdos a través de la ingestión de alimentos y agua contaminados, mostrando que la dieta líquida aumenta la infección por el virus de la PPA (20).
Para una mejor comprensión y exploración de acciones de manejo profiláctico y reactivo más efectivas contra el virus de la PPA en Serbia, se recomienda un enfoque basado en el individuo para investigar y considerar de manera integral todos los patrones locales de la enfermedad, incluidos los brotes característicos en jabalíes, los posibles puntos amplificadores, las fuentes de virus y otros posibles impulsores, como los hábitos de la población humana. y vectores. Es urgente la implementación de medidas basadas en el conocimiento (21).
En Serbia, se ha demostrado que los brotes y los procesos de erradicación del virus de la peste porcina africana en cerdos domésticos con un nivel de bioseguridad deficiente y bajo no dependen de la presencia de PPA en jabalíes, cuya implicación en la transmisión del virus de la PPA requiere más investigación (3). Además, durante los brotes en Serbia, las observaciones revelaron casos en los que la PPA se propagó rápidamente en circunstancias epidemiológicamente poco claras, a pesar de la implementación de investigaciones y medidas epidemiológicas oportunas y exhaustivas. Se sospechaba que podrían existir posibles vías o impulsores alternativos, que facilitarían la transmisión de enfermedades entre lugares, incluido el papel de la contaminación ambiental y/o los vectores artrópodos. El papel de estas dos posibles vías de transmisión del virus de la PPA en Serbia no está claro y no se ha estudiado lo suficiente. Por lo tanto, nuestro estudio tuvo como objetivo brindar más información sobre las vías de transmisión del virus de la PPA en Serbia a través de la detección del ADN del virus de la PPA en un entorno y de moscas insectos durante un brote. Además, se evaluó experimentalmente el papel de las moscas adultas (Lucilia sericata (Diptera: Calliphoridae), S. calcitrans) en la transmisión mecánica del virus de la peste porcina africana con el fin de determinar un marco temporal potencial en tiempo real y en condiciones de laboratorio.
Materiales y métodos
Área de estudio y descripción de las localidades de muestreo
Este estudio se realizó en unidades de producción porcina de traspatio y granjas comerciales consistentes con las características antes mencionadas en dos distritos vecinos de Serbia (área de la ciudad de Belgrado y distrito de Banato del Sur) (Figura 1). Todas las muestras se recolectaron durante los meses de julio y agosto de 2023 en unidades de producción de cerdos de traspatio (que en nuestro estudio consistieron en hasta 5 cerdos por unidad), donde la PPA fue previamente detectada por el Laboratorio Nacional de Referencia (NRL) en el Instituto Científico de Medicina Veterinaria de Serbia (hasta 48 h) antes de la implementación de las medidas de sacrificio y desinfección (Figura 1). La tasa de morbilidad establecida en los hogares se situó entre el 50 y el 70%, dependiendo del momento transcurrido entre el inicio de la enfermedad y el día de la toma de muestras.
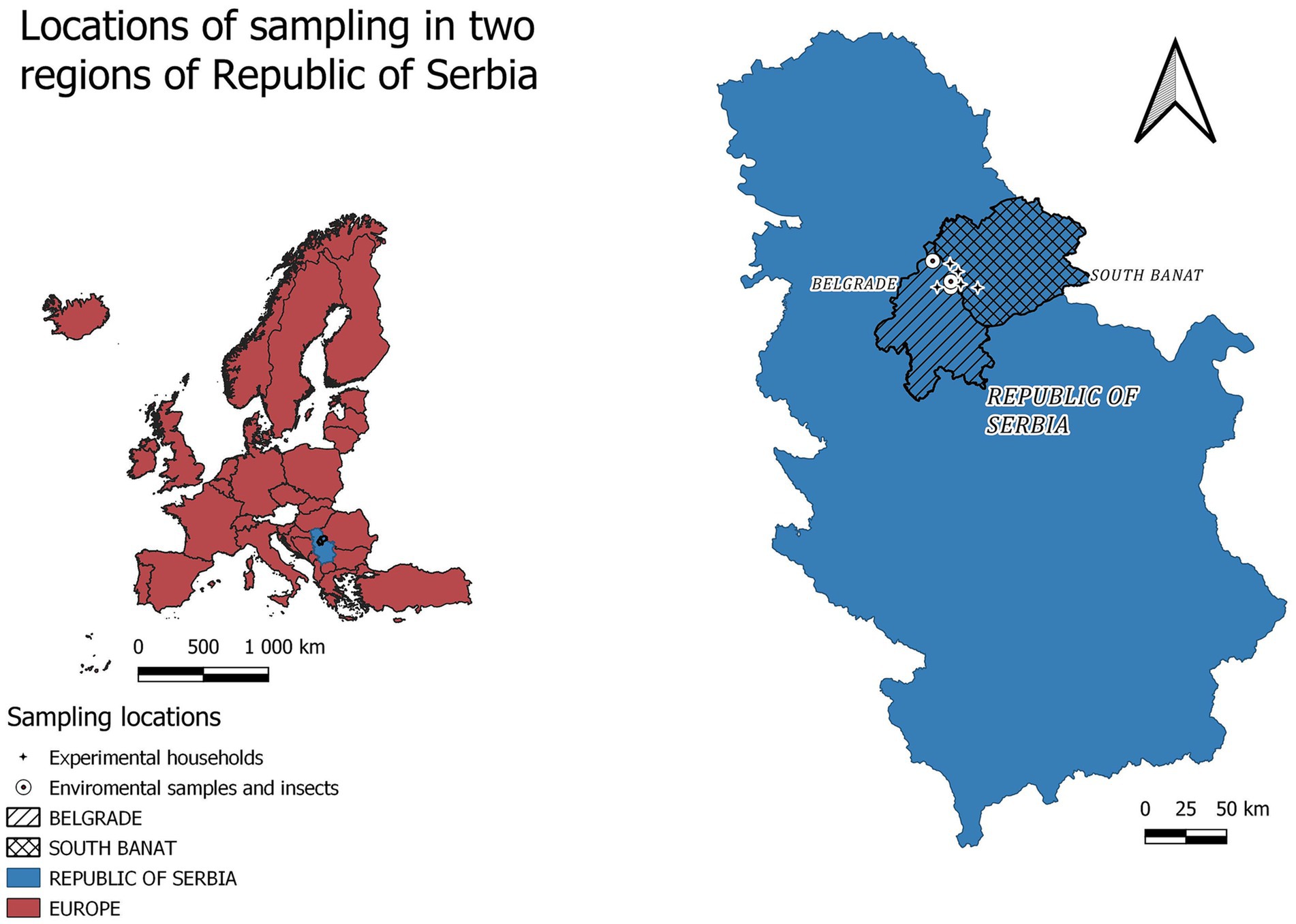
Las muestras ambientales (suelo, pienso, agua e hisopos ambientales de los establos de cerdos) se tomaron de cuatro localidades, dos en el área de la ciudad de Belgrado (Duboka bara-Palilula 44.875905, 20.612613 y Borča-Put za Crvenku 44.861237, 20.438505) y dos en el distrito de Banat Sur (Jabuka 44.943056, 20.593056 y Glogonj 44.983333, 20.5333333). Las muestras de suelo (n = 6) se tomaron de tres unidades de producción porcina de traspatio, en un radio de 10 metros del establo donde se encontraban los animales afectados, con base en la hipótesis de contaminación activa por fuga de aguas residuales. De un hogar en la localidad de Borca, se tomaron muestras de alimento (n = 3) de comederos completos donde existían rastros de alimento comercial, granos y desperdicios. Se tomaron muestras de agua potable (n = 3) en dos unidades de producción de cerdos de traspatio en Glogonj y una en la aldea de Jabuka. Los hisopos ambientales se tomaron directamente en el corral de cerdos con acceso al exterior (n = 12) y a 30 m del lugar donde vivían los animales enfermos (n = 3) en las cuatro localidades. Se tomaron muestras de insectos de hasta 20 moscas (n = 9) en dos localidades (Glogonj y Duboka bara-Palilula), mientras que se tomaron muestras de hasta 100 moscas en una granja comercial de cerdos, donde se confirmó la PPA (44,858669, 20,736289) directamente cerca de la entrada de los objetos de producción porcina (n = 3) y hasta a 30 m de distancia (n = 3). Además, los huevos de Muscidae (n = 2) y las etapas larvales (n = 5) se recogieron de los cadáveres de cerdos dispuestos incorrectamente por la carretera en Borča-Put za Crvenku.
Los hogares que albergaban trampas pegajosas para moscas y placas de Petri abiertas que contenían carne picada mezclada con tacos de algodón húmedos para evitar la desecación a las altas temperaturas del verano se ofrecieron en tres lugares del área de Belgrado, a saber, Reva (44.861237, 20.538505), Ovča (44.890923, 20.538998) y Besni fok (44.998121, 20.405613) durante cinco días de experimento de campo en agosto de 2023. Estas localidades se eligieron en función de la intensa actividad de PPA cercana y la accesibilidad con el consentimiento de los propietarios.
Se tomaron muestras de larvas de los estadios L2 y L3 para experimentos de transmisión del virus de la PPA en dos unidades de producción de cerdos de traspatio (45.015525, 20.385289; 44.861237, 20.438505), en Besni fok, localidad de Belgrado.
La temperatura media de verano en el área metropolitana de Belgrado en julio de 2023 fue de 24,7 °C, mientras que las temperaturas máximas durante el pico del día fueron de hasta 36 °C, según los datos del Servicio Hidrometeorológico de la República de Serbia.
Recogida y análisis de muestras
Las muestras ambientales de suelo se recogieron mediante muestreo directo de una capa superficial (hasta 5 cm de profundidad) con una espátula en una cantidad de 50 g a los recipientes de plástico desde el lugar cercano a los establos donde se criaron los animales infectados por el virus de la PPA. Las muestras de suelo se mezclaron completamente en suspensión al 10% en un medio esencial mínimo (MEM, Gibco, ThermoFisher Scientific, Waltham, MA, EE. UU.) enriquecido con antibióticos y antimicóticos (MycoZap, Lonza Bioscience, Basilea, Suiza) y se centrifugaron a 2000 × g durante 30 min. El sobrenadante se decantó y se utilizó para su posterior análisis.
El alimento se probó desde un comedero en una cantidad de 500 g. En el laboratorio, el alimento se mezcló completamente, luego, de cada muestra mezclada, se mezcló un gramo de alimento en suspensión al 10% en MEM (MEM, Gibco, ThermoFisher Scientific, Waltham, MA, EE. UU.) con antibióticos y antimicóticos (MycoZap, Lonza Bioscience, Basilea, Suiza), se centrifugaron a 2000 x g durante 30 min, se decantaron y se congelaron (a -80 °C) hasta su uso posterior.
El agua potable se tomó de los bebederos, de los que bebieron los cerdos, en contención estéril de 500 mL. Se recogieron muestras de agua de tres localidades y se llevaron al Instituto. Las muestras de agua se centrifugaron a 5000 × g durante 10 min, se decantaron y se congelaron (a -80 °C) hasta su uso posterior.
El equipo y las superficies metálicas, en el entorno directo de los animales infectados por el virus de la peste porcina africana en los establos de cerdos, se frotaron con hisopos prehumedecidos con solución de cloruro de natrio al 0,9% Los hisopos se sumergieron en 1 mL de solución salina tamponada con fosfato (PBS) y se sometieron a homogeneización. Posteriormente, las muestras se sometieron a centrifugación a 1500 × g durante 10 min. Los sobrenadantes resultantes se decantaron cuidadosamente y se conservaron a -80°C para su posterior análisis, siguiendo el protocolo de Gallardo et al. (22).
Las moscas adultas se recolectaron manualmente utilizando redes entomológicas, mientras que en una granja se colocaron trampas pegajosas para el propósito de la recolección. Las moscas fueron transferidas al NRL en el Instituto Científico de Medicina Veterinaria de Serbia en cadena de frío. Se tomó una submuestra representativa (n = 5 moscas por muestra seleccionada por un entomólogo) para la identificación morfológica de los insectos. Después de la identificación morfológica, las moscas se agruparon hasta 100 moscas en función de las características morfológicas observadas y se almacenaron a -80 °C para su posterior análisis. Los huevos y los estadios larvarios de Muscidae se recolectaron utilizando pinzas entomológicas, se llevaron al NRL, se submuestrearon para confirmar la especie de mosca y se almacenaron a -80 °C para su posterior análisis. La homogeneización se realizó con Tissuelyser II (Qiagen, Hilden Alemania) a 30 Hz durante 1 min.
Ensayos de transmisión del virus de la peste porcina africana en hogares con brotes de PPA
El atrayente para moscas para los ensayos de transmisión en hogares con brotes de PPA consistió en placas de Petri que contenían carne picada de vacuno (para consumo humano, comprada el día en que se colocaron las trampas), tacos y agua. Las muestras se dejaron durante tres días expuestas al contacto con insectos voladores. Posteriormente, se recolectaron placas de Petri y se transfirieron al laboratorio en congeladores de mano a +4°C. Estas muestras se dividieron en tres muestras de 1 g, homogeneizadas en Tissuelyser II (Qiagen, Hilden Alemania) a 30 Hz durante 1 min.
Preparación de las moscas de primera generación para experimentos de transmisión del virus de la peste porcina africana
Los estadios larvales L2 y L3 se tomaron de los cadáveres de cerdos muertos encontrados que dieron positivo para PPA. Las larvas recolectadas para la ubicación de Besni fok se dividieron en dos grupos, uno se analizó para la PPA y el otro se recolectó para la cría en el Instituto de Medicina Veterinaria de Serbia. Las larvas se seleccionaron en función de los estadios y las características morfológicas y se colocaron en doble contención. Las larvas, pupas y adultos se mantuvieron a 24-26°C, 60-70% de humedad relativa (HR). Las larvas fueron alimentadas con un 50% de fajos de papel húmedos, y un 50% de carne de ganado picada reemplazada cada dos días, mientras que a los adultos se les ofreció una solución de glucosa al 5% ad libitum. Las larvas L3 (n = 3) se analizaron para detectar la presencia de ADN del virus de la PPA mediante qPCR (23). Un total de 42 pupas en el primer experimento y 21 pupas en el segundo experimento fueron transferidas a jaulas de prueba modificadas, con ligeras modificaciones a las descritas en [(24); Figura 2]. Antes de los ensayos de transmisión del virus de la peste porcina africana, se tomaron moscas adultas (n = 3 por ensayo) para la identificación morfológica y la confirmación molecular de las especies.

Experimentos de transmisión del virus de la peste porcina africana
Los ensayos de transmisión del virus de la peste porcina africana se realizaron en dos ensayos consecutivos separados. Las moscas adultas de tres días de edad fueron privadas de la solución de glucosa 24 horas antes de los experimentos. Se les ofreció una harina de carne de cerdo (1 cm3) enriquecida con 100 μL de PPA titulado 6log10HAD50/mL. Antes y después de la alimentación, se tomaron muestras de control de la cepa viral y se controló el título de PPA mediante cuantificación por qPCR. La harina de carne se mantuvo durante 24 horas, y luego se reemplazó diariamente con carne sin PPA para imitar la transmisión a animales no infectados hasta 5 días después de la infección, dependiendo del número disponible de moscas. Se tomaron moscas (n = 3) para la identificación morfológica del insecto para confirmar la identidad. Las muestras del día 0 (n = 3) con fines de control se tomaron después de 1 h de exposición a la carne enriquecida con PPA.
Identificación de especies de insectos
La identificación morfológica de las larvas del tercer estadio y de las moscas adultas se realizó mediante claves de identificación morfológica (25-27).
Para confirmar la identificación morfológica, se analizó un número representativo de muestras utilizando métodos de biología molecular. Las moscas se mantuvieron en etanol al 70% que se retiró antes de la extracción del ADN y los insectos se dejaron en tubos abiertos de 2,0 mL para que se secaran, y se homogeneizaron en Tissuelyser II (Qiagen, Hilden, Alemania) a 30 Hz durante 1 min. La extracción de ADN se realizó utilizando un kit de purificación de ADN tisular, EURX, Polonia siguiendo las instrucciones del fabricante. El ADN aislado se mantuvo en -20\u00B0C. La identificación molecular de las moscas se realizó utilizando el protocolo descrito en Folmer et al. (1994), que estableció cebadores de ADN «universales» para amplificar un fragmento del gen de la subunidad I (COI) de la citocromo c oxidasa mitocondrial de invertebrados a partir de 11 filos.
La secuenciación de Sanger se realizó utilizando el servicio comercial de la empresa Macrogen (Ámsterdam, Países Bajos) y la Facultad de Biología de la Universidad de Belgrado (Belgrado, Serbia).
Aislamiento de ADN del virus de la peste porcina africana a partir de muestras ambientales y qPCR para la detección del virus de la peste porcina africana en muestras ambientales e insectos
La extracción del ADN viral se realizó utilizando el kit de patógenos IndiSpin (Indical Bioscience GmbH, Leipzig, Alemania), siguiendo estrictamente los protocolos especificados por el fabricante. Para identificar el genoma del virus de la PPA, en el estudio se empleó el conjunto de cebadores y sondas delineado en el trabajo de King et al. (23). La reacción de PCR cuantitativa (qPCR) se formuló utilizando 12,5 μL de Luna Universal Probe qPCR Master Mix (New England BioLabs, Ipswich, MA, EE. UU.), 1 μL de cada cebador a una concentración de 10 mM, 0,5 μL de una sonda de 10 mM y 5 μL de la plantilla de ADN extraída. Se añadió agua sin nucleasas para ajustar el volumen total de la mezcla de reacción a 25 μL. Las condiciones de termociclado de qPCR comenzaron con una desnaturalización inicial a 95 °C durante 1 min, seguida de una serie de 40 ciclos, cada uno de los cuales constaba de una fase de desnaturalización a 95 °C durante 15 s y una fase de recocido/extensión a 60 °C durante 30 s.
Resultados
Identificación morfológica de moscas y confirmación molecular de especies de moscas
En dos localidades (Glogonj y Duboka bara-Palilula), se identificaron morfológicamente submuestras de moscas no picadoras capturadas con redes entomológicas como L. sericata, Lucilia silvarum (Diptera: Calliphoridae) y Chrysomya albiceps (Diptera: Calliphoridae), mientras que las moscas en charcos de hasta 100 que se muestrearon cerca de la granja porcina Stari Tamiš se identificaron como M. domestica y S. calcitrans. La identificación molecular del insecto confirmó la presencia de L. sericata, C. albiceps y S. calcitrans. Además, los huevos de muscidae recolectados se identificaron como C. albiceps y L. sericata, mientras que los estadios larvarios recolectados del cadáver de cerdos en Borča-Put za Crvenku se identificaron como M. domestica y L. caesar (Diptera: Calliphoridae) utilizando métodos de biología molecular.
Las moscas adultas tomadas para la identificación morfológica antes de dos experimentos de transmisión fueron identificadas como L. sericata. Después de la identificación molecular de las especies de insectos, se confirmó la presencia de S. calcitrans en una muestra.
Detección del ADN del virus de la peste porcina africana
Todas las muestras ambientales (suelo, agua, alimento e hisopos) dieron negativo para la presencia de ADN del virus de la PPA.
El grupo de huevos de Muscidae (C. albiceps) y un grupo de larvas de estadio L1 (L. sericata) recolectados en el cadáver de cerdos enfermos en el lugar Borča-Put za Crvenku dieron positivo para la presencia de ADN de PPA (Ct = 29.3 y 33.4).
Todas las moscas tomadas para las pruebas de control antes de los experimentos dieron negativo.
Todas las placas de Petri que contenían carne en tres ubicaciones dieron negativo para la presencia de ADN del virus de la PPA.
Una mosca S. calcitrans muestreada el día 1 después de la infección dio positivo (Ct-34.2) en el primer grupo de ensayo experimental.
Discusión
Se detectaron brotes iniciales de PPA en Serbia en la población de cerdos domésticos (2). Las principales vías de transmisión en las unidades de producción porcina de traspatio parecen ser en su mayoría independientes del contacto con la población de jabalíes y estar relacionadas con actividades humanas y factores poco claros. Sin embargo, en 2023, el virus de la peste porcina africana se hizo presente en la parte oriental de Serbia y tenía tendencia a propagarse hacia el oeste.
Los datos de campo sugieren que las moscas adultas tienen un papel en la transmisión mecánica del virus de la PPA, pero el conocimiento de la dinámica de transmisión o de las especies exactas de moscas involucradas es insuficiente Un reciente estudio entomológico de la EFSA en Rumanía identificó el 62,96% de Stomoxys calcitrans (Diptera: Muscidae) y el 42,02% recolectó mosquitos hematófagos picadores (Diptera: Ceratopogonidae) como positivos para la presencia de ADN del virus de la PPA, lo que pone de relieve la necesidad de realizar estudios de competencia vectorial y de transmisión del virus en diferentes especies de insectos (14). En Estonia, en una granja infectada por el virus de la peste porcina africana, se detectó ADN viral en la mosca doméstica M. domestica (Diptera: Muscidae) y en una Drosophila spp. (Diptera: Drosophilidae) (13). En otro estudio, M. domestica, Calliphoridae (Diptera: Calliphoridae) y la mosca de los establos S. calcitrans (Diptera: Muscidae) también dieron positivo para la presencia de ADN del virus de la PPA (28). Se ha demostrado experimentalmente que la transmisión mecánica del virus de la PPA por S. calcitrans transmite el virus de la peste porcina africana a los cerdos domésticos 1 y 24 horas después de alimentarse de material infectado (29). Sin embargo, en el mismo trabajo experimental, la transmisión fallaba si aumentaba el intervalo entre la alimentación de material infectado y la de cerdos no infectados. También se demostró en condiciones experimentales que las moscas de los establos pueden transmitir el virus de la PPA si son ingeridas por cerdos domésticos ingenuos (30). Se ha detectado el virus de la peste porcina africana en varias partes del cuerpo de S. calcitrans hasta tres días después de la infección experimental (31). Además, el papel de la mosca verde común del biberón, L. sericata (Diptera: Calliphoridae), y de la mosca azul del biberón, C. vicina (Diptera: Calliphoridae), sedemostró experimentalmente cuando las larvas se reprodujeron experimentalmente en el tejido del bazo infectado con el virus de la PPA. Se concluyó que los estadios inmaduros de moscardón no juegan un papel relevante como reservorios o vectores mecánicos de adultos poco probables del virus de la PPA (32). Un estudio reciente demostró la dinámica de la transmisión del virus de la peste porcina africana en mosquitos representativos de pequeños insectos hematófagos, tabánidos y S. calcitrans a tres temperaturas de incubación diferentes (10 °C, 20 °C, 30 °C) (33). Se demostró que el virus de la peste porcina africana es viable en S. calcitrans a las 48 h después de la infección en el punto de muestreo a una temperatura de 30 °C, pero no más tarde (33), que es similar a las temperaturas de verano en Serbia. Dado que nuestro resultado mostró la presencia de ADN del virus de la peste porcina africana en S. calcitrans solo a las 24 h después de la infección a una temperatura de 27 ± 1 °C, planteamos la hipótesis de que este resultado está de acuerdo con los resultados de (33) y que cuanto mayor es la temperatura, menos viable es el virus de la PPA cuando se transmite a través de S. calcitrans. Sin embargo, nuestro resultado proviene de un ensayo de infección, y no de los insectos recolectados en el campo y, por lo tanto, se necesita más investigación en las condiciones de campo.
En nuestro estudio, pudimos confirmar el ADN del virus de la PPA en huevos y larvas recolectados en el campo de cadáveres de cerdos que dieron positivo para PPA, lo que está en correlación con los resultados de (32). La secuenciación posterior demostró que estas muestras positivas procedían de las moscas C. albiceps y L. sericata, respectivamente. Estos resultados están en correlación con Balmoş et al. (12) donde entre las diferentes especies de moscas que dieron positivo, la mayoría se clasificó como perteneciente a la familia Calliphoridae. Se sabe que las moscas adultas pueden propagar mecánicamente el virus de la peste porcina africana en áreas de hasta 2-3 km entre granjas porcinas (28) y, por lo tanto, podrían influir en la transmisión del virus de la peste porcina. Sin embargo, en nuestro estudio, las muestras (trampas de carne) de los hogares cercanos que se encontraron con un brote de PPA dieron negativo para el ADN del virus de la PPA, lo que pone de manifiesto la complejidad de la transmisión ambiental del virus de la PPA. Sin embargo, la transmisión del virus de la peste porcina africana a través de las moscas como vectores mecánicos no pudo descartarse sobre la base de estos resultados, ya que las condiciones ambientales (por ejemplo, altas temperaturas en verano, colocación de muestras en patios) podrían haber influido en los resultados.
El papel de las moscas L. sericata y C. vicina como vectores mecánicos ha sido previamente demostrado a partir de larvas que se alimentan de tejido infectado por el virus de la PPA (32). En nuestro enfoque, después de los resultados iniciales de la positividad del ADN del virus de la PPA en larvas de L. sericata recolectadas en el campo, utilizamos larvas negativas identificadas morfológicamente como L. sericata para desarrollar moscas adultas que se expondrían al título conocido de PPA con el objetivo de obtener información sobre la dinámica de transmisión en moscas adultas, es decir, la duración de la positividad del virus de la PPA, lo que podría implicar el papel en las transmisiones locales del virus de la PPA observadas en el campo. Nuestros resultados mostraron que ninguna mosca L. sericata dio positivo para el ADN del virus de la PPA, mientras que la única mosca identificada como S. calcitrans por identificación molecular de insectos fue positiva solo el día 1 del experimento de transmisión, 24 horas después de la exposición al virus de la PPA. No se observaron más positividad en ninguno de los dos experimentos. Este resultado pone de manifiesto una vez más el papel potencial de S. calcitrans como vector mecánico del virus de la PPA. Sin embargo, las limitaciones de este estudio son que no pudimos demostrar si el virus de la PPA se localizó al vuelo o se ingirió, ya que no se realizaron disecciones, ni si el virus de la PPA estaba vivo o no, mientras que solo se utilizaron métodos de biología molecular para la detección viral. Por lo tanto, no fue posible establecer si la transmisión del virus de la PPA sería posible a través de la ingestión de insectos enteros o perforando al animal susceptible.
En nuestro estudio, no pudimos detectar el ADN del virus de la PPA en muestras ambientales de suelo, agua, piensos e hisopos tomados directamente donde estaban presentes los animales enfermos. Esto podría deberse al número limitado de muestras en este estudio [muestras de suelo (n = 6), muestras de alimento (n = 3), hisopos ambientales (n = 15)], pero también podría deberse a la baja contaminación por PPA en el entorno donde se realizó el muestreo. Se demostró que la metodología de estudio aplicada es un tema crítico cuando se realizan pruebas de estabilidad (33). Además, el período de tiempo de muestreo (de 48 a 96 h desde el inicio de los signos clínicos, durante el procedimiento de sacrificio) podría haber influido en el resultado de este estudio, ya que las cargas virales altas en la sangre de los animales infectados por el virus de la PPA comienzan a estar presentes desde el quinto día después de la infección (34, 35). Por último, el muestreo se realizó durante un período de altas temperaturas estivales en Serbia que alcanzaron los 40 °C, lo que también podría haber influido en el resultado, ya que se muestra que la persistencia del virus de la PPA está disminuyendo con el aumento de la temperatura en las heces y la orina de los cerdos infectados con el virus de la PPA (36). Los resultados negativos obtenidos en este estudio no excluyen la posibilidad de transmisión del virus de la PPA a través de superficies contaminadas o fómites. Olsen et al. encontraron que los cerdos naïve no se infectaron si se pusieron en los corrales donde los cerdos ASF-pos habían estado alojados 3, 5 o 7 días antes, mientras que los cerdos naïve sí se infectaron si se insertaron 24 horas después de la extracción de los cerdos ASF-pos. Estos corrales no se limpiaron ni desinfectaron, mientras que la sangre visible se eliminó entre ellos (37). Las muestras ambientales se utilizan eficazmente para la detección del virus de la peste porcina africana en jabalíes (38).
La gestión eficaz de los brotes de PPA requiere un enfoque integral que tenga en cuenta los patrones locales de enfermedad, los brotes de jabalíes, las posibles manchas amplificadoras y las actividades humanas. En Serbia, los entornos de baja bioseguridad en zonas rurales con producción en el patio trasero han sido particularmente difíciles (39). En Serbia, la vía de transmisión dominante en los cerdos domésticos parece ser el contacto directo entre cerdos infectados y susceptibles, junto con la actividad humana (40).
Conclusión
La PPA sigue siendo una amenaza importante para las poblaciones porcinas, ya que su persistencia en el medio ambiente y su posible transmisión mediada por vectores complican los esfuerzos de control. El monitoreo continuo, la caracterización genética de las cepas virales y las estrategias de manejo integral son esenciales para un control eficaz de la PPA. La comprensión de las funciones de los diversos vectores y factores ambientales será crucial para desarrollar intervenciones más específicas y eficaces para prevenir y mitigar los brotes de PPA.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El manuscrito presenta investigaciones en animales que no requieren aprobación ética para su estudio.
Contribuciones de los autores
AV: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Supervisión, Validación, Visualización, Redacción – borrador original. BM: Investigación, Visualización, Escritura – revisión y edición. DG: Investigación, Redacción – revisión y edición. MK: Conceptualización, Investigación, Metodología, Supervisión, Redacción – borrador original. JK: Investigación, redacción, revisión y edición. AŽ: Investigación, Redacción – revisión y edición. BK: Investigación, Redacción – revisión y edición. VM: Conceptualización, Análisis formal, Obtención de fondos, Investigación, Metodología, Recursos, Supervisión, Redacción – revisión y edición.
Financiación
El (los) autor(es) declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio fue financiado por el Ministerio de Ciencia, Desarrollo Tecnológico e Innovación (Contratos Nº 451-3-66/2024-03/200030 y 451-03-66/2024-03/200117).
Reconocimientos
Los autores agradecen a Slavica Savić y Slađana Šaša por su excelente apoyo técnico.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El editor responsable FDF declaró una coautoría pasada con el autor BK.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Chenais, E, Depner, K, Guberti, V, Dietze, K, Viltrop, A, y Ståhl, K. Consideraciones epidemiológicas sobre la peste porcina africana en Europa 2014-2018. Porc Cura Manag. (2019) 5:1–10. doi: 10.1186/s40813-018-0109-2
2. Milicévić, V, Kureljušić, B, Maksimović Zorić, J, Savić, B, Stanojević, S, y Milakara, E. Primera aparición de peste porcina africana en Serbia. Acta Vet Brno. (2019) 69:443–9. doi: 10.2478/acve-2019-0038
3. Glišić, D, Milićević, V, Veljović, L, Milovanović, B, Kureljušić, B, Đorđević, I, et al. Patrones de transmisión del virus de la peste porcina africana en cerdos domésticos en Serbia. Patógenos. (2023) 12:1–10. doi: 10.3390/pathogens12010149
4. Glišić, D, Milićević, V, Krnjaić, D, Toplak, I, Prodanović, R, Gallardo, C, et al. El análisis genético revela múltiples regiones intergénicas y regiones variables centrales en las variantes del virus de la peste porcina africana que circulan en Serbia. Vet Res Commun. (2023) 47:1925–36. doi: 10.1007/s11259-023-10145-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. GF-TADs . (2019). Misión de Expertos Peste Porcina Africana Rep. Serbia Disponible en línea en: https://rr-europe.woah.org/app/uploads/2020/05/2019-12_sge-asf_serbia-en.pdf
6. Bálticos, S.G. (2019). Grupo Permanente de Expertos sobre la Peste Porcina Africana en la Región de los Países Bálticos y Europa Oriental en el marco de las GF-TADs. Misión de expertos sobre la peste porcina africana en Serbia INFORME. OIE.
7. Polaček, V, Mirčeta, J y Prodanov-Radulović, J. Factores de riesgo clave e impacto de la propagación de la peste porcina africana en la producción porcina en Serbia. Acta Vet Brno. (2021) 71:371–91. DOI: 10.2478/ACVE-2021-0032
8. Kureljušić, B, Savić, B, Milovanović, B, Jezdimirović, N, Glišić, D, Radulović, JP, et al. 27º Congreso de la Sociedad Internacional de Veterinaria Porcina 15º Simposio Europeo de Gestión de la Salud Porcina En: Evaluación de los factores de riesgo para la propagación de la peste porcina africana en las explotaciones porcinas de traspatio en el área de la ciudad de Belgrado (2024). 121. Sociedad Internacional de Veterinaria Porcina (IPVS).
9. Dixon, LK, Stahl, K, Jori, F, Vial, L, y Pfeiffer, DU. Epidemiología y control de la peste porcina africana. Annu Rev Anim Biosci. (2020) 8:221–46. doi: 10.1146/annurev-animal-021419-083741
10. Cwynar, P, Stojkov, J, y Wlazlak, K. Estado de la peste porcina africana en Europa. Virus. (2019) 11:1–17. doi: 10.3390/v11040310
11. Botija, S. (1963). Reservorios de PPA: Estudio del virus de la PPA en artrópodos mediante el ensayo de hemasorción.
12. Balmoș, OM, Ionică, AM, Horvath, C, Supeanu, A, Moțiu, M, Ancuceanu, BC, et al. El ADN del virus de la peste porcina africana está presente en moscas no picadoras recogidas en granjas de Rumanía. Vectores de parásitos. (2024) 17:278. doi: 10.1186/s13071-024-06346-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Herm, R, Tummeleht, L, Jürison, M, Vilem, A y Viltrop, A. Trazas de ADN del virus de la peste porcina africana detectadas en insectos recolectados de una granja porcina infectada en Estonia. Vet Med Sci. (2020) 6:100–4. DOI: 10.1002/VMS3.200
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Balmoș, O, Supeanu, A, Tamba, P, Cazan, C, Ionică, A, Ungur, A, et al. Prospección entomológica para estudiar la posible implicación de vectores artrópodos en la transmisión del virus de la peste porcina africana en Rumanía. Apoyo de la EFSA Publ. (2021) 18:6460. doi: 10.2903/sp.efsa.2021.EN-6460
15. Nielsen, SS, Alvarez, J, Bicout, DJ, Calistri, P, Depner, K, Drewe, JA, et al. Prioridades de investigación para colmar las lagunas de conocimiento en el control de la peste porcina africana: posible transmisión del virus de la peste porcina africana por vectores. EFSA J. (2021) 19:6676. doi: 10.2903/j.efsa.2021.6676
16. Mazur-Panasiuk, N, Żmudzki, J y Woźniakowski, G. Virus de la peste porcina africana: persistencia en diferentes condiciones ambientales y la posibilidad de su transmisión indirecta. J Vet Res. (2019) 63:303–10. doi: 10.2478/jvetres-2019-0058
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Wen, X, He, X, Zhang, X, Zhang, X, Liu, L, Guan, Y, et al. Las secuencias genómicas derivadas de muestras de alimento para cerdos y sangre seca para cerdos proporcionan información importante sobre la transmisión del virus de la peste porcina africana en China en 2018. Los microbios emergentes infectan. (2019) 8:303–6. doi: 10.1080/22221751.2019.1565915
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Carlson, J, Fischer, M, Zani, L, Eschbaumer, M, Fuchs, W, Mettenleiter, T, et al. Estabilidad del virus de la peste porcina africana en el suelo y opciones para mitigar el riesgo potencial de transmisión. Patógenos. (2020) 9:1–12. doi: 10.3390/pathogens9110977
19. Boklund, A, Cay, B, Depner, K, Földi, Z, Guberti, V, Masiulis, M, et al. Análisis epidemiológico de la peste porcina africana en la Unión Europea (noviembre de 2017 hasta noviembre de 2018). EFSA J. (2018) 16:5494. doi: 10.2903/j.efsa.2018.5494
20. Niederwerder, MC, Stoian, AMM, Rowland, RRR, Dritz, SS, Petrovan, V, Constance, LA, et al. Dosis infecciosa del virus de la peste porcina africana cuando se consume de forma natural en líquido o pienso. Emerge infecta dis. (2019) 25:891–7. doi: 10.3201/eid2505.181495
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Ladoşi, I, Ppuc, TA, y Ladoşi, D. El impacto de la peste porcina africana (PPA) en la producción de carne de cerdo en Rumanía: una revisión. Acta Vet Brno. (2023) 73:1–12. doi: 10.2478/acve-2023-0001
22. Gallardo, C, Sastre, P, Rueda, P, Gerilovych, A, y Scientific, S. Comprender y combatir la peste porcina africana. Wageningen: Wageningen Academic Publishers (2021).
23. King, DP, Reid, SM, Hutchings, GH, Grierson, SS, Wilkinson, PJ, Dixon, LK, et al. Desarrollo de un ensayo PCR TaqMan® con control de amplificación interna para la detección del virus de la peste porcina africana. J Métodos de Virol. (2003) 107:53–61. doi: 10.1016/S0166-0934(02)00189-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Körsten, C, Vasić, A, Al-Hosary, AA, Tews, BA, Răileanu, C, Silaghi, C, et al. Dinámica de excreción de arbovirus en mosquitos y su posible uso en estudios de competencia vectorial y vigilancia de arbovirus. Tropical Med Infect Dis. (2023) 8:410. doi: 10.3390/tropicalmed8080410
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. D’Assis Fonseca, ECM . Diptera Cyclorrhapha Calyptrata: Muscidae En: Manuales para la identificación de insectos británicos. Londres: Real Sociedad Entomológica (1968). 10.
26. Szpila, K . Clave para la identificación de moscas europeas y mediterráneas (Diptera, Calliphoridae) de tercer estadio de importancia forense. Entomol Forense Un Introd. (2010):43–56. doi: 10.1007/978-1-4020-9684-6_3
27. Szpila, K . Clave para la identificación de moscardones europeos y mediterráneos (Diptera, Calliphoridae) de importancia forense: moscas adultas. Identificación clave Eur Eur moscas adultas de importancia forense. Dordrecht: Springer (2015).
28. Turčinavičienė, J, Petrašiūnas, A, Bernotienė, R, Masiulis, M, y Jonušaitis, V. La contribución de los insectos a la dispersión del virus de la peste porcina africana: datos de granjas de cerdos domésticos en Lituania. Med Vet Entomol. (2021) 35:484–9. doi: 10.1111/mve.12499
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Mellor, PS, Kitching, RP, y Wilkinson, PJ. Transmisión mecánica del virus capripox y del virus de la peste porcina africana por Stomoxys calcitrans. Res Vet Sci. (1987) 43:109–12. doi: 10.1016/S0034-5288(18)30753-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Olesen, AS, Lohse, L, Hansen, MF, Boklund, A, Halasa, T, Belsham, GJ, et al. Infección de cerdos con el virus de la peste porcina africana por ingestión de moscas de los establos (Stomoxys calcitrans). Transbound emerg Dis. (2018) 65:1152–7. doi: 10.1111/tbed.12918
31. Olesen, AS, Hansen, MF, Rasmussen, TB, Belsham, GJ, Bødker, R, y Bøtner, A. Supervivencia y localización del virus de la peste porcina africana en moscas de establo (Stomoxys calcitrans) después de alimentarse de sangre virémica utilizando un alimentador de membrana. Microbiol veterinario. (2018) 222:25–9. doi: 10.1016/j.vetmic.2018.06.010
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Forth, JH, Amendt, J, Blome, S, Depner, K y Kampen, H. Evaluación de larvas de moscardón (Diptera: Calliphoridae) como posibles reservorios y vectores mecánicos del virus de la peste porcina africana. Transbound emerg Dis. (2018) 65:E210-3. doi: 10.1111/tbed.12688
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Blome, S, Schäfer, M, Ishchenko, L, Müller, C, Fischer, M, Carrau, T, et al. Supervivencia del virus de la peste porcina africana en piensos, materiales de cama y vectores mecánicos y su posible papel en la transmisión del virus. Apoyo de la EFSA Publ. (2024) 21:8776. doi: 10.2903/sp.efsa.2024.EN-8776
34. Blome, S, Gabriel, C, y Beer, M. Patogenia de la peste porcina africana en cerdos domésticos y jabalíes europeos. Res. de Virus (2013) 173:122–30. doi: 10.1016/j.virusres.2012.10.026
35. Nurmoja, I, Petrov, A, Breidenstein, C, Zani, L, Forth, JH, Beer, M, et al. Caracterización biológica de cepas del virus de la peste porcina africana genotipo II del noreste de Estonia en jabalí europeo. Transbound emerg Dis. (2017) 64:2034–41. doi: 10.1111/tbed.12614
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Davies, K, Goatley, LC, Guinat, C, Netherton, CL, Gubbins, S, Dixon, LK, et al. Supervivencia del virus de la peste porcina africana en excreciones de cerdos infectados experimentalmente con el aislado Georgia 2007/1. Transbound emerg Dis. (2017) 64:425–31. doi: 10.1111/tbed.12381
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Olesen, L, Lohse, L, Boklund, A, Halasa, T, Belsham, GJ, Rasmussen, TB, et al. Corto período de tiempo para la transmisibilidad del virus de la peste porcina africana desde un entorno contaminado. Transbound emerg Dis. (2018) 65:1024–32. doi: 10.1111/tbed.12837
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Varzandi, AR, Zanet, S, Seano, PB, Occhibove, F, Vada, R, Benatti, F, et al. Detección del virus de la peste porcina africana y del eDNA del jabalí en muestras de suelo y aguas turbias: hacia la vigilancia ambiental. Eur J Wildl Res. (2024) 70:1–6. DOI: 10.1007/s10344-023-01758-Z
39. Kureljušić, B., Savić, B., Milovanović, B., Jezdimirović, N., Glišić, D., Radulović-Prodanov, J, et al. (2024). Evaluación de los factores de riesgo para la propagación de la peste porcina africana en las explotaciones porcinas de traspatio en el área de la ciudad de Belgrado. Actas, 27º congreso internacional de la sociedad porcina y 15º simposio europeo de gestión de la salud porcina, 4-7 de junio de 2024, Leipzig, Alemania.
Palabras clave: virus de la peste porcina africana, moscas, medio ambiente, Lucilia sericata , Stomoxys calcitrans , Serbia
Cita: Vasić A, Milovanović B, Glišić D, Kavran M, Kureljušić J, Živulj A, Kureljušić B y Milićević V (2024) Las rutas de transmisión de la peste porcina africana durante un brote en Serbia julio-agosto de 2023: detecciones del virus de la peste porcina africana en muestras ambientales e insectos. Frente. Vet. Sci. 11:1467273. doi: 10.3389/fvets.2024.1467273
Recibido: 19 de julio de 2024; Aceptado: 28 de octubre de 2024;
Publicado: 15 de noviembre de 2024.
Editado por:
Francesca De Falco, Parque Científico AREA, Italia
Revisado por:
Anette Ella Boklund, Universidad de Copenhague, Dinamarca
Giovanni Sgroi, Instituto Zooprofiláctico Experimental del Sur de Italia (IZSM), Italia
Derechos de autor © 2024 Vasić, Milovanović, Glišić, Kavran, Kureljušić, Živulj, Kureljušić y Milićević. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Ana Vasić, ana.vasic@nivs.rs
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

