¿Lo dirán los glóbulos blancos? Una nueva herramienta potencial para evaluar el bienestar de los pollos de engorde
 Laura Raquel Ríos Ribeiro1*
Laura Raquel Ríos Ribeiro1* Elaine Cristina de Oliveira Sans2
Elaine Cristina de Oliveira Sans2 Ricardo Martins Santos3
Ricardo Martins Santos3 Cesar Augusto Taconelli4
Cesar Augusto Taconelli4 Roberta de Farías1
Roberta de Farías1 Carla Forte Maiolino Molento1
Carla Forte Maiolino Molento1- 1Laboratorio de Bienestar Animal, Departamento de Ciencia Animal, Universidad Federal de Paraná, Curitiba, Brasil
- número arábigoForo Nacional de Defensa Animal, Curitiba, Brasil
- 3Laboratorio de Inmunología, Universidad Católica Don Bosco, Campo Grande, Brasil
- 4Departamento de Estadística, Universidad Federal de Paraná, Curitiba, Brasil
Este estudio evaluó la evaluación cualitativa y cuantitativa de los leucocitos como posibles indicadores del bienestar de los pollos de engorde, contribuyendo a la limitada literatura sobre la morfología de los glóbulos blancos (WBC) como herramienta diagnóstica para el bienestar. Se evaluó el bienestar de los pollos de engorde dentro de cuatro galpones avícolas (PH) 1 a 4, cada uno en una granja diferente, utilizando indicadores en el campo de estados afectivos y salud, y se examinó la morfología de los leucocitos. Los estados afectivos se evaluaron mediante la Evaluación Cualitativa de la Conducta (QBA), con 25 expresiones conductuales puntuadas en una escala visual analógica (EVA) y agrupadas en dos categorías. Los indicadores de salud incluyeron evaluaciones de cojera, dermatitis de las almohadillas de los pies, dermatitis en las áreas mamaria y abdominal, quemaduras de corvejón y limpieza de plumas. Se recolectaron muestras de sangre, se realizaron recuentos diferenciales de leucocitos y se creó un score celular para el reconocimiento, clasificación e interpretación de la diversidad morfológica de heterófilos y linfocitos. También se determinó la relación heterófilos/linfocitos (H/L). Para el análisis de los resultados se utilizó estadística descriptiva y modelos lineales generalizados para respuestas binomiales. PH4 difirió de las otras granjas, mostrando una mayor frecuencia de aves dentro del grupo 1 de QBA (‘Alerta’ a ‘Desesperada’), mientras que las aves en PH1, PH2 y PH3 fueron más frecuentes en el grupo 2 de QBA (‘Relajadas’ a ‘Ocupadas positivamente’). Las proporciones elevadas de heterófilos en aves de PH4 (0,61, IC95%: 0,58; 0,64) y PH3 (0,60, IC95%: 0,57; 0,63) sugirieron mayores niveles de estrés y respuestas inflamatorias. Las aves en PH2 y PH4 mostraron una mayor frecuencia de problemas de salud como dermatitis y cojera, y mayores proporciones de anomalías en el número y la morfología de los leucocitos. PH3 y PH4 exhibieron mayores relaciones H/L de 3.03 y 2.58, respectivamente, consistentes con los indicadores de salud y comportamiento en el campo. Las muestras de sangre de aves en PH2 y PH4 mostraron una proporción de cambio tóxico del 90% en los heterófilos, mientras que en PH1 y PH3 fue del 70%, lo que indica altos niveles de morfología anormal de leucocitos en todos los PH. Los hallazgos enfatizan la naturaleza multifactorial de las deficiencias del bienestar, incluidas las condiciones ambientales, la salud y los estados afectivos. Esto pone de relieve la necesidad de contar con indicadores que reflejen los múltiples impactos en el bienestar, como los recuentos de leucocitos y las alteraciones morfológicas, que pueden servir como herramientas poderosas en la compleja tarea de evaluar el bienestar animal.
1 Introducción
La producción de alimentos de Brasil es una de las más grandes del mundo. La producción avícola ocupa el primer lugar a nivel mundial entre todas las especies animales utilizadas para la producción de alimentos. Brasil es uno de los principales productores y exportadores de pollo del mundo, mientras que el estado de Paraná es el mayor productor y exportador de carne de pollo de Brasil, representando más del 40% de las exportaciones brasileñas. La Asociación Brasileña de Proteína Animal (ABPA) informó que las exportaciones brasileñas de carne de pollo, incluyendo tanto productos frescos como procesados, alcanzaron los 3,90 millones de toneladas entre enero y septiembre de 2023, lo que supone un 6,5% más que el total exportado en el mismo período de 2022, con 3,66 millones de toneladas. En total, Brasil produjo 14,90 millones de toneladas de carne de pollo en 2023 y producirá hasta 15,30 millones de toneladas en 2024 (1). Por lo tanto, debido al gran número de individuos involucrados (2-4), la producción avícola puede ser considerada una prioridad en las iniciativas de bienestar animal en Brasil.
La mejora del bienestar animal (AW) puede ser impulsada por muchos factores, como las demandas de los consumidores y del mercado, los intereses corporativos, la implementación de nuevas políticas, la disponibilidad de fondos, los incentivos gubernamentales, los matices nacionales y regionales, las condiciones climáticas, la sostenibilidad y la reducción de la huella de carbono y los detalles específicos en la granja, como el diseño de las viviendas, las prácticas de gestión y la capacitación del personal (5, 6). Durante décadas, las preocupaciones expresadas por los consumidores y la evolución de las actitudes humanas hacia los animales han llevado a la discusión sobre posibles políticas globales para la AW en las granjas (7). Además, para que los sistemas de producción animal continúen, dependerán de la naturaleza ética y la sostenibilidad de los métodos de cría (2). Por ejemplo, las condiciones de cría y manejo, la actitud del productor hacia sus animales, la nutrición, el medio ambiente, la salud, el comportamiento y los sistemas de alimentación intensiva representan algunos de los factores que pueden afectar negativamente a la AW (8). Como tales, también pueden afectar a la opinión pública en relación con la aceptabilidad de la cría intensiva de pollos de engorde. Sin embargo, las reacciones públicas proporcionadas y el desarrollo de políticas adecuadas solo son posibles cuando se dispone de una evaluación adecuada de la AW. De hecho, para todos los aspectos de los esfuerzos hacia la mejora de la AW, las herramientas de evaluación fiables son esenciales.
La evaluación del bienestar animal es un campo multidisciplinar que implica varias medidas y combinaciones de indicadores fisiológicos y conductuales, junto con la aplicación de protocolos específicos, muchos de los cuales se centran en diferentes aspectos de la vida del animal (9); Bienestar (10). Los indicadores fisiológicos, como los niveles de glucocorticoides en sangre, la temperatura corporal y el recuento de leucocitos, proporcionan información valiosa sobre el estrés y la salud general de los animales. Además, las mediciones de comportamiento, como las restricciones conductuales que se imponen con frecuencia a los animales de granja y la expresión de signos de malestar o interacciones sociales anormales para la especie, juegan un papel crucial en la evaluación de la AW (11-16).
La mayoría de los protocolos de evaluación de la AW de las explotaciones agrícolas se diseñaron inicialmente para las características de las explotaciones agrícolas no tropicales; en consecuencia, se requieren protocolos de evaluación diseñados específicamente para los sistemas de producción animal brasileños, considerando los factores ambientales, sociales y económicos del país. La importación de normas de AW basadas en dichos protocolos también es compleja, lo que da lugar a situaciones en las que el cumplimiento de las normas de AW puede no mejorar la vida de los animales (17). Son muchos los retos que contribuyen a las dificultades en la aplicación de las normas de evaluación de los AW, como la diversidad de los sistemas de producción, las limitaciones de recursos, las limitadas reglamentaciones y leyes, los factores políticos y socioeconómicos, los problemas de aplicación y la formación y adaptación previa de los evaluadores (18).
Los métodos objetivos para evaluar la AW que se basan en una lista más corta de mediciones son muy relevantes, pero difíciles de identificar. Por lo tanto, se necesitan estudios detallados que propongan y detallen nuevos biomarcadores para evaluar la PTA (15, 19, 20). Una fuente candidata prometedora para los indicadores de AW es el sistema inmunitario, que desempeña un papel fundamental en la salud animal y está intrínsecamente relacionado con el bienestar. Los heterófilos y los linfocitos son células clave en el sistema inmunitario y sus proporciones proporcionan información valiosa sobre el estado inmunitario de las aves y su estado agudo y crónico en términos de estrés, fisiología y bienestar (21-23). Una consideración más detallada de las funciones de las características específicas de los glóbulos blancos puede contribuir a una mejor comprensión de su valor potencial como indicadores de AW.
Düpjan y Dawkins (24) han presentado evidencia que sugiere que un enfoque fundamental para mitigar el riesgo de enfermedades e infecciones radica en prácticas de manejo efectivas y una mejor regulación del bienestar animal. Además, las observaciones empíricas indican que los entornos que fomentan el bienestar por encima del estrés y la positividad por encima de la negatividad tanto en el contexto humano como en el animal pueden reducir la susceptibilidad a las enfermedades, lo que puede dar lugar a la atenuación de los síntomas y a una recuperación más rápida. Se necesitan estudios en las granjas para demostrar que las condiciones de alto grado de bienestar protegen eficazmente contra las enfermedades, ya sea en condiciones experimentales o en entornos comerciales. Las estrechas relaciones entre el cerebro, el microbioma intestinal, la inmunidad y el bienestar, junto con los vínculos establecidos entre la salud mental y física, corroboran la importancia de un alto nivel de bienestar como estrategia preventiva para la resistencia a las enfermedades (24-26).
La inducción de distrés puede provocar alteraciones en la respuesta inmune del animal, con asociaciones bien establecidas entre el eje hipotálamo-hipófisis-suprarrenal (HPA) y la modulación inmune (27, 28). El recuento de glóbulos blancos (WBC) y la relación heterófilos/linfocitos (H/L) se han utilizado como indicadores para evaluar la AW, como marcadores de estrés y, especialmente, como indicadores de distrés crónico (29, 30). Los nuevos desarrollos en cuanto al análisis de la morfología de los leucocitos parecen relevantes en este escenario. Durante el ciclo de producción, las aves pueden estar sometidas a estrés crónico, exposición a agentes infecciosos y otras condiciones desafiantes que pueden dar lugar a variaciones en la morfología de los leucocitos, con probables aumentos en los heterófilos de cambio tóxico. Los heterófilos tóxicos son leucocitos reconocidos por una serie de características morfológicas, especialmente la variabilidad en tamaño, color y cambios significativos en la granulación. Las principales características comúnmente observadas incluyen aumento del tamaño celular, citoplasma basófilo, con vacuolización citoplasmática escasa o extensa, gránulos anormales, núcleos hiposegmentados y degeneración y degranulación nuclear (31, 32).
Teniendo en cuenta la importancia de la búsqueda de nuevos indicadores de AW, en primer lugar, nuestro fundamento de base fue que el recuento y la evaluación de la morfología de los leucocitos en pollos de engorde sometidos a sistemas de cría intensiva pueden sufrir cambios, mostrando una asociación significativa con el grado de AW. Por lo tanto, nuestra hipótesis guía fue que existen asociaciones entre el número relativo y las características morfológicas de los leucocitos de pollos de engorde con indicadores de AW científicamente reconocidos a nivel de PH. Esta hipótesis sirvió como base para nuestra investigación sobre la relación entre los leucocitos de pollos de engorde y los indicadores de AW, guiando nuestro análisis e interpretación de los hallazgos del estudio.
Los objetivos de este estudio fueron: (1) estudiar el número relativo y las características morfológicas de los leucocitos de pollo de engorde como indicadores para la evaluación de la AW mediante la verificación de su asociación con indicadores de AW científicamente reconocidos a nivel de gallinero (PH) y (2) desarrollar un sistema integral de puntuación celular, respaldado por una guía de imágenes, centrado en las características morfológicas de los heterófilos y los linfocitos. demostrando la diversidad morfológica de estos tipos de células, y facilitando la evaluación e interpretación para evaluar el bienestar de los pollos de engorde. Con tales objetivos, pretendíamos proporcionar un conjunto de herramientas novedoso y práctico que mejorara nuestra capacidad para monitorear y, por lo tanto, contribuir a la mejora de los estándares de bienestar de los pollos de engorde en entornos de cría.
2 Materiales y métodos
2.1 Descripción de las explotaciones estudiadas y recogida de datos y tamaños muestrales
La recolección de datos de campo se realizó del 15 de noviembre de 2022 al 21 de noviembre de 2022 en fincas situadas en los municipios de Dourados, Fátima do Sul, Glória de Dourados y Laguna Caarapã, 225 km al suroeste de Campo Grande, la capital del estado. Se visitaron cuatro naves de producción avícola intensiva, cada una en una granja diferente, para evaluar el bienestar de las aves y recolectar muestras de sangre. Los procedimientos con animales fueron aprobados por el Comité de Ética en Uso de Animales de la Universidad Federal de Paraná, protocolo 023/2022.
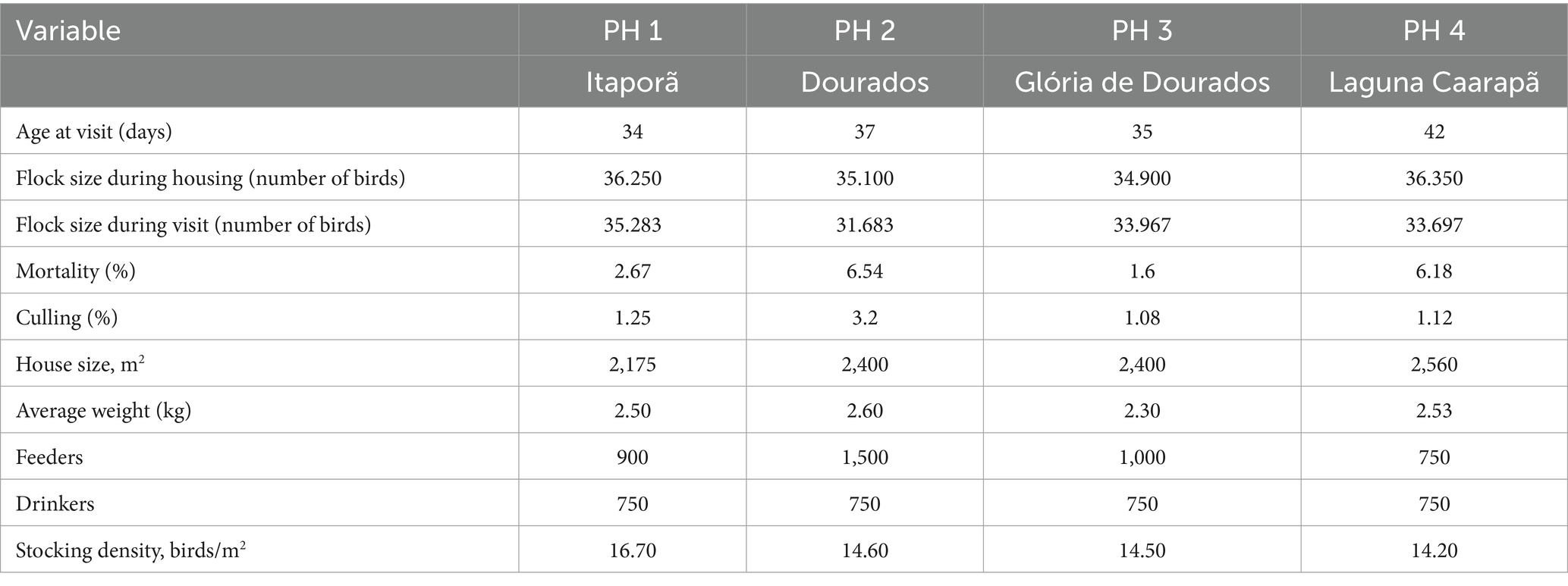
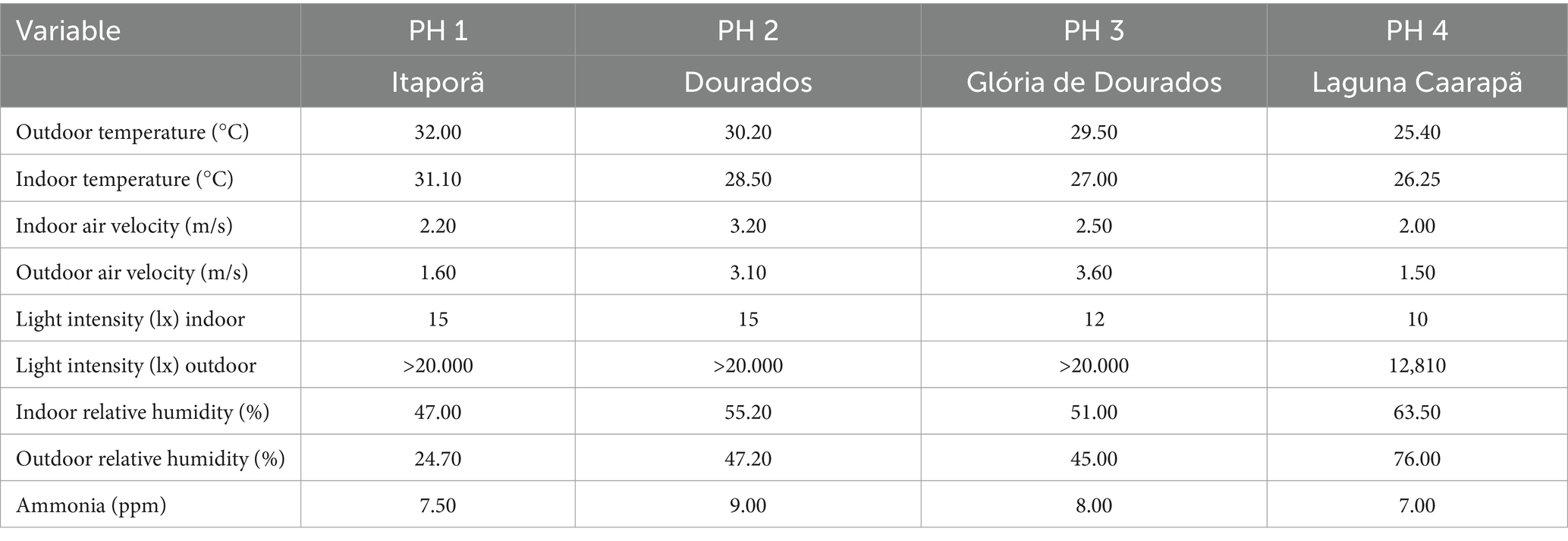
Para todos los PH evaluados, las temperaturas externas oscilaron entre 25.0 y 35.0°C, la humedad relativa interior entre 47 y 63%, la exterior entre 24 y 76%, la velocidad del aire interior entre 3.6 y 1.5 ms-1/h, y el nivel de amoníaco entre 7.0 y 8.5 ppm, respectivamente. Los tratamientos lumínicos consistieron en 18 h de luz artificial al día y una iluminancia media de 13 lx, proporcionando todo el periodo de oscuridad en un solo bloque (de 21 a 3 horas). Se utilizó un cuestionario y registros de parvadas para obtener información general como el número inicial de aves, el número de aves en la visita, su raza, edad y tasas de mortalidad y sacrificio (Tabla 1). Todas las unidades avícolas visitadas eran galpones cerrados con cortinas negras como material fijo para complementar las paredes parciales, climatizadas con ventiladores, extractores, nebulizadores y bebederos y comederos automáticos. Los granjeros participantes criaron machos de aves Ross y operaron en un sistema integrado dentro de la misma empresa. Las aves fueron evaluadas cuando tenían entre 34 y 42 días de edad (promedio de 5 ± 3 días antes del sacrificio) y pesaron en promedio 2,48 kg. Las evaluaciones en cada explotación se llevaron a cabo el mismo día y se llevaron a cabo de acuerdo con los procedimientos y el orden descritos en el Protocolo de Evaluación de la Calidad del Bienestar (10). La extracción de sangre siguió los protocolos estándar (33).
Durante la visita, dos evaluadores llevaron a cabo una evaluación parcial del bienestar en la granja utilizando el protocolo WQ® para aves de corral (10, 34), con las medidas seleccionadas de cojera, dermatitis de las almohadillas de las patas, dermatitis en las áreas mamaria y abdominal, quemaduras de corvejón y limpieza de plumas evaluadas en escalas ordinales, y la Evaluación Cualitativa del Comportamiento (QBA). El segundo autor tenía experiencia en la evaluación del bienestar de los pollos de engorde utilizando el protocolo WQ® desde 2011 y participó en todas las visitas a las granjas; Los demás evaluadores recibieron una formación adecuada antes de que comenzara la recopilación de datos. Las muestras de sangre se recogieron después de la evaluación de todos los demás indicadores. Las aves fueron sujetadas manualmente para la recolección de muestras, lo que tiende a activar cascadas de estrés, a pesar de que la inmovilización fue corta y suave. De acuerdo con el conocimiento actual, es probable que las respuestas al estrés agudo no sean significativas para el recuento diferencial de leucocitos, la relación heterófilos/linfocitos (H/L) y la morfología de los leucocitos (32, 35).
El tamaño muestral para la colecta de sangre fue de 80 aves por PH, con 320 muestras. Para determinar el tamaño de la muestra, se consideraron los cálculos de la media y la desviación estándar de la relación H/L en pollos de engorde. La fórmula utilizada para los cálculos fue n = 2 * SD2 * (Zα/2 + Zβ)2 / d2, donde SD es la desviación estándar obtenida de estudios previos o estudios piloto, Zα/2 es el valor crítico correspondiente al grado de confianza deseado, Zβ es la potencia de la prueba estadística y d representa el tamaño del efecto. Para esta investigación, se consideró un valor crítico para el grado de confianza de 1,96 (95%) y Zβ de 1,282, ya que se seleccionó un poder de prueba del 90%. Para determinar los indicadores de salud y el QBA, el tamaño de la muestra estuvo de acuerdo con lo establecido en el WQ® Assessment Protocol (10).
2.2 Toma de muestras de sangre
Se seleccionaron al azar ochenta aves por PH de las que no participaron en evaluaciones previas de WQ®, y se recolectó aproximadamente 1,0 mL de sangre. Con una jeringa, se extrajo sangre de la vena del ala y se colocó en tubos de vidrio esterilizados que contenían ácido etilendiaminotetraacético (EDTA) para evitar la coagulación de la sangre.
2.3 Evaluación de los indicadores ambientales
Se midieron parámetros ambientales para describir las condiciones de vida interior en todas las unidades, con la evaluación de indicadores de salud. Todos los datos se obtuvieron a nivel de aves, en ubicaciones equidistantes. La temperatura y la humedad relativa se evaluaron con Akso AZ77535 (Honk Kong, China). Para medir la velocidad del aire, la concentración de amoníaco (NH3) y la intensidad de la luz, se utilizaron los siguientes medidores: termohigrómetro-decibelímetro-luxímetro-anemómetro digital (THDLA-500) y detector único de NH3, respectivamente. Los resultados tanto para los indicadores de salud como para los parámetros ambientales se muestran en la Tabla 2.
2.4 Estados afectivos de las aves
El QBA se realizó en todas las casas. Este análisis cualitativo es una metodología que considera el lenguaje corporal de las aves, es decir, la calidad expresiva de cómo las aves se comportan e interactúan entre sí y con el entorno. Los lotes se evaluaron como se describe en el protocolo WQ® (10) y se puntuaron 25 expresiones conductuales en la escala visual analógica (EVA). La ausencia de expresión conductual se codificó en azul y la máxima expresión se codificó en rojo (6, 10, 34, 36). Los términos conductuales desarrollados para los hablantes nativos de portugués brasileño (37) utilizados fueron atento, letárgico, apático, aburrido, agitado, frustrado, con dolor, inquieto, perturbado, asustado, temeroso, angustiado, desesperado, relajado, activo, interesado, confiado, tranquilo, pacífico, inquisitivo, juguetón, vital, agresivo, cómodo y positivamente ocupado.
2.5 Evaluación de la salud
Se realizaron evaluaciones de salud en todos los HP, de acuerdo con los procedimientos descritos en el protocolo WQ®. Se utilizaron recintos móviles de plástico para separar las aves seleccionadas para la evaluación (Figuras 1A-D). En total, se seleccionaron aleatoriamente 10 aves en 10 localidades del PH para la evaluación de 100 aves por PH. Las aves fueron sujetadas manualmente para la evaluación de la dermatitis mamaria y la lesión abdominal (escala de 4 puntuaciones, donde cero era ausencia de lesión y tres lesión grave), limpieza del plumaje (escala de 4 puntos, donde cero identificaba plumaje limpio y tres muy sucio), pododermatitis (escala de 5 puntos, donde cero era ausencia de lesión y cuatro lesión grave), y quemadura de corvejón (escala de 3 puntos, donde cero era ausencia de lesión y dos lesiones graves). Todos los indicadores de salud fueron evaluados en la misma muestra de 100 aves por granja por el mismo evaluador (10, 34). El último indicador de salud evaluado fue la cojera, donde se estimuló individualmente a otras 150 aves por granja para que caminaran, y se realizó una inspección visual de la capacidad para caminar y se puntuó con una escala de seis puntos, donde cero era la marcha normal y cinco se dio a las aves que no podían caminar. La ubicación seleccionada se basó en el protocolo WQ® aplicado a los pollos de engorde. La ubicación en el PH fue generada por computadora. Todos los PH estaban en el mismo tamaño (10).

Teniendo en cuenta la naturaleza variada de los sistemas de puntuación y con el fin de demostrar e interpretar mejor los resultados, clasificamos las puntuaciones de la siguiente manera: puntuación 0 (normal); puntuación 1 (anomalía moderada); y puntuaciones de 2 a 3 (anomalía grave) para dermatitis mamaria y lesión abdominal y limpieza del plumaje; puntuación: 0 (normal); puntuación 1 (anomalía moderada); puntuación de 2 a 4 (anomalía grave) para pododermatitis y quemadura en el corvejón; y para cojera, la clasificación fue de 0 a 1 (normal); puntuaciones de 2 a 3 (anomalía moderada); y puntuaciones de 4 a 5 (anormalidad grave).
2.6 Análisis de sangre
Se procesaron las muestras de sangre y se preparó un frotis de sangre inmediatamente después de la recolección. Para cada ave, se colocó una gota de sangre en un portaobjetos de vidrio y, con el uso de un extensor, se realizó el frotis. Después de secarse al aire, los frotis se fijaron y tiñeron con una tinción hematológica rápida (PA205, Newprov, Brasil) o una solución de Giemsa de Wright (PA202, Newprov, Brasil). Las muestras fueron procesadas en el laboratorio de hematología de Unigran y en el laboratorio de Diagnóstico, ubicados en Dourados y Campo Grande, MS.
2.7 Recuentos diferenciales y sistema de puntuación de células
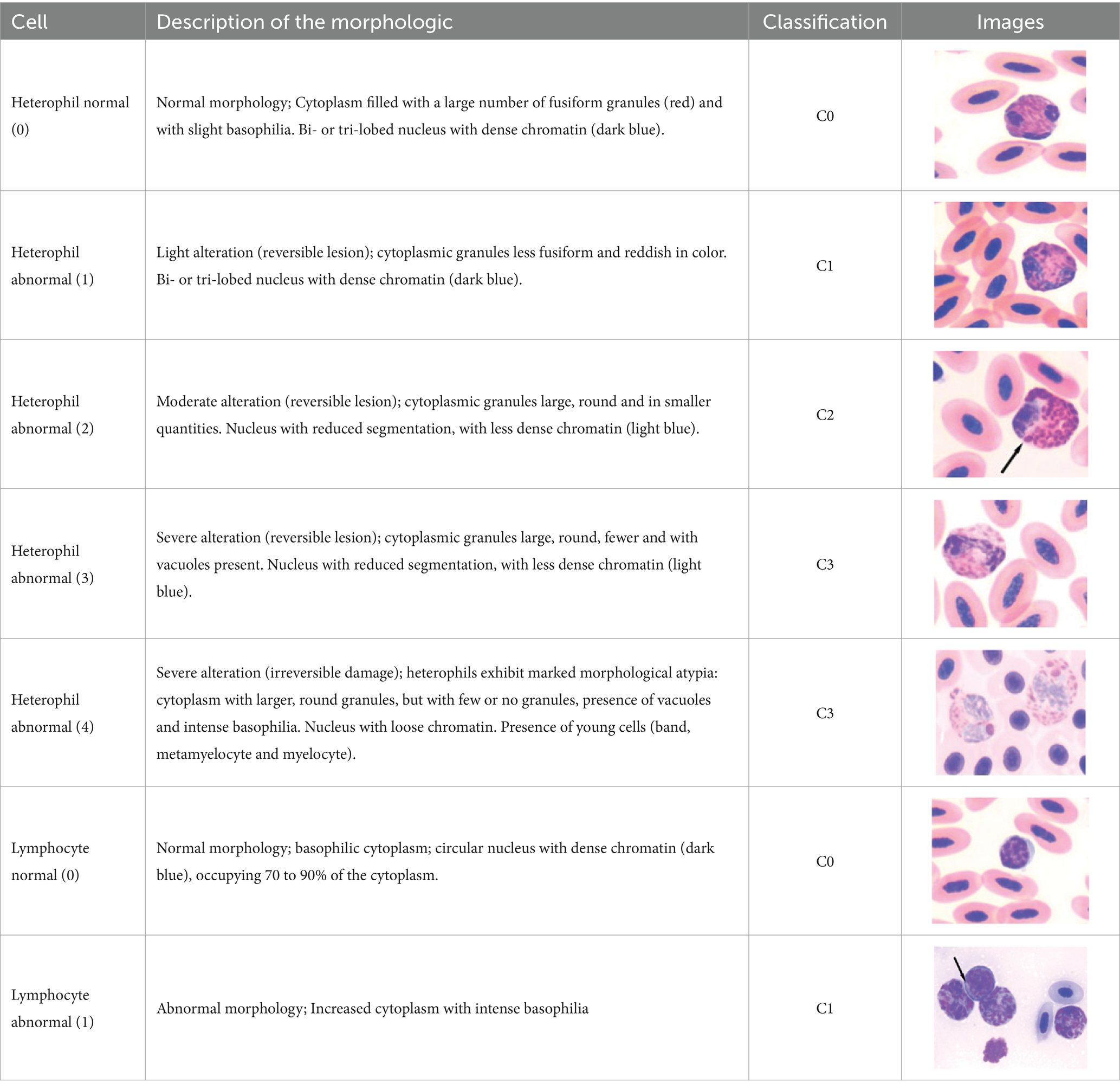
Los recuentos diferenciales de leucocitos se realizaron utilizando un microscopio óptico (MOC), Carl Zeiss Microscopy GmbH, modelo Axio Scope A1, con la ayuda del software de imágenes ZEN Lite (Blue Edition), con aumentos de 1.000×. Se contaron cien leucocitos, incluyendo heterófilos, heterófilos jóvenes, linfocitos, eosinófilos y monocitos, en al menos 10 campos por portaobjetos. Las imágenes de los frotis fueron fotografiadas con una cámara a color Axiocam 503 conectada al MOC. Adoptamos los criterios morfológicos para la clasificación de heterófilos descritos por (32, 38). Los heterófilos y linfocitos anormales se incluyeron en los recuentos diferenciales. Se creó una puntuación celular para el reconocimiento, clasificación e interpretación de la diversidad morfológica de heterófilos y linfocitos de pollos de engorde. Las puntuaciones de los heterófilos fueron de cero (ausencia de cambio en la morfología celular) a cuatro (cambio severo en la morfología celular), y las puntuaciones de linfocitos fueron de cero (ausencia de cambio en la morfología celular) a uno (con cambio en la morfología celular). Además, clasificamos las puntuaciones como 0 (normal), puntuaciones 1 a 2 (anomalía moderada) y puntuaciones 3 a 4 (anomalía grave) (Tabla 3). Se realizaron los recuentos y los análisis de las características morfológicas de los leucocitos y se aplicó una verificación cualitativa de la fiabilidad interobservador basada en la comparación simple de 48 análisis independientes de muestras de sangre realizadas por dos evaluadores, es decir, 12 lecturas por PH o el 15% de todas las muestras de sangre analizadas.
2.8 Determinación de la relación heterófilo/linfocito (H/L)
Se calculó la relación H/L para todas las aves de las que se extrajo sangre. La relación H/L se calculó dividiendo el número de heterófilos y el número de linfocitos (39).
2.9 Análisis estadístico
Se utilizó estadística descriptiva para verificar las principales características observadas por PH de la siguiente manera: indicadores ambientales (temperatura, humedad relativa, velocidad del aire, NH3 e intensidad lumínica); estados afectivos de las aves (atento, letárgico, apático, aburrido, agitado, frustrado, con dolor, inquieto, perturbado, asustado, temeroso, angustiado, desesperado, relajado, activo, interesado, confiado, tranquilo, pacífico, inquisitivo, juguetón, vitalicio, agresivo, cómodo y positivamente ocupado); indicadores de salud (dermatitis mamaria y lesión abdominal, limpieza del plumaje, pododermatitis y cojera); recuento diferencial de leucocitos; y clasificación e interpretación de la diversidad morfológica celular.
Las diferencias entre las proporciones de heterófilos, linfocitos, monocitos y la relación heterófilos a linfocitos para las aves en los diferentes PH se transformaron en un resultado binomial considerando el número de heterófilos, linfocitos y monocitos observados en 100 células sanguíneas. El modelo lineal generalizado binomial (GLM) es el enfoque de regresión habitual para este tipo de datos. Se utilizó un enfoque de cuasi-verosimilitud para evitar problemas de especificación errónea. Se realizó un análisis residual para evaluar el ajuste del modelo. Dicha información está disponible en la sección de análisis estadístico y ahora se presenta en la Tabla Suplementaria S5.
Para las variables de salud, se ajustaron modelos de regresión para las respuestas ordinales para evaluar la asociación entre el PH y las condiciones de salud de las aves. En este caso, se utilizó el modelo de regresión de probabilidades proporcionales para evaluar y comparar adecuadamente el PH. Se consideraron las pruebas de Wald y de razón de verosimilitud (LRT) para concluir sobre las diferencias entre la PH bajo los modelos de regresión cuasi-binomial y de probabilidades proporcionales, respectivamente. Los resultados se consideraron estadísticamente significativos cuando p < 0,05. Tanto para los indicadores sanguíneos como para los de salud, cuando las pruebas de Wald o LRT señalaron un resultado significativo, se llevó a cabo el procedimiento de diferencias honestamente significativas de Tukey (HSD de Tukeys) para comparar los pares de PH asegurando un nivel de significación global del 5%.
Para los términos individuales de QBA, se elaboró un mapa de calor para una mejor visualización de los adjetivos más prevalentes. Se trata de un método que se usa en el aprendizaje automático no supervisado para agrupar puntos de datos similares en clústeres. El algoritmo organiza los datos en una estructura jerárquica, donde los grupos de puntos de datos se agrupan en función de sus similitudes.
El PH se consideró como un efecto fijo y no aleatorio debido al pequeño número y la alta variabilidad del PH disponible. Se optó por comparar los resultados de los cuatro HP disponibles, en lugar de extrapolar estos resultados para una población más general de HP.
Finalmente, todos los análisis se realizaron con el software R para el cálculo estadístico versión 4.3.1 (40). Para el análisis de regresión se utilizaron las bibliotecas de R geepack, ordinal y emmeans (41-43).
3 Resultados
3.1 Estados afectivos de las aves
En la evaluación y clasificación del QBA, se identificaron dos grupos de comportamiento (grupo 1: «Atento» a «Desesperado» y grupo 2: «Relajado» a «Ocupado positivamente»). Se generó un mapa de calor (Figura 2) a partir de la puntuación de las 25 expresiones de comportamiento observadas en las aves a partir del conjunto de datos obtenidos por el QBA. La barra de color en el lado derecho muestra el VAS.
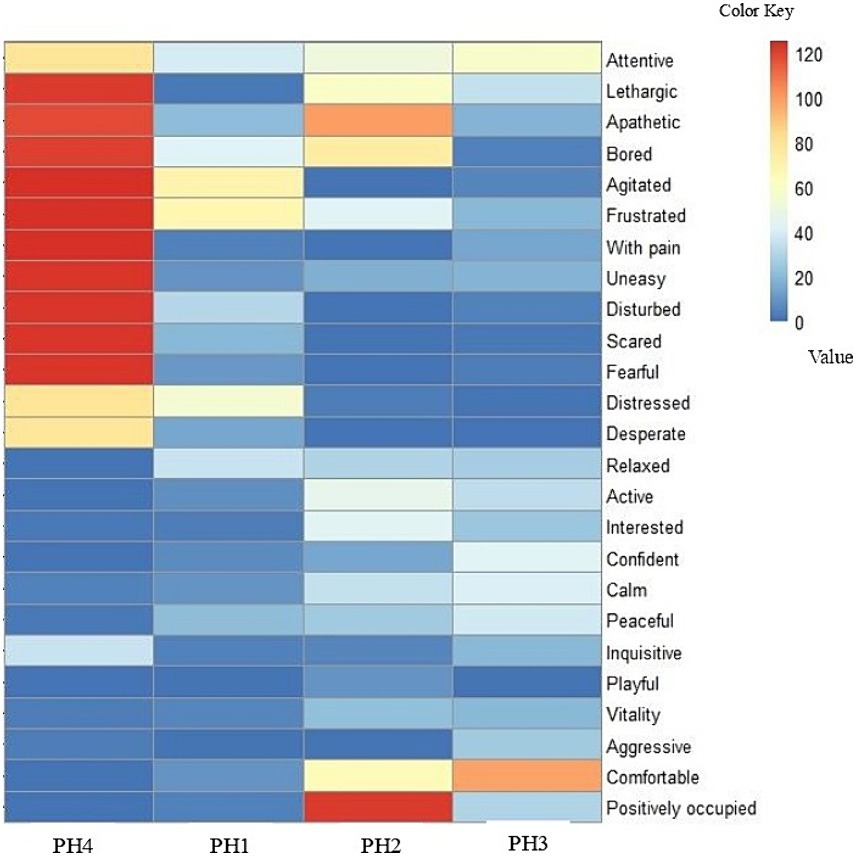
La ausencia de una expresión conductual específica se indica en azul, y su máxima expresión se indica en rojo (Figura 2). El PH 4 se diferenció de las otras granjas en que tuvo mayor frecuencia de comportamientos del grupo 1: atento, letárgico, apático, aburrido, agitado, frustrado, con dolor, inquieto, perturbado, asustado, temeroso, angustiado y desesperado. Estos comportamientos en el mapa están determinados por áreas más rojas. En contraste, los gallineros 1, 2 y 3 tuvieron menor frecuencia de comportamientos del grupo 1 y se clasificaron en el grupo 2: relajados, activos, interesados, confiados, tranquilos, pacíficos, inquisitivos, juguetones, vitales, agresivos, cómodos y ocupados positivamente. Estos comportamientos en el mapa están representados por el color azul y sus variaciones.
3.2 Evaluación de la salud
Para todos los indicadores de salud, hubo diferencias entre las viviendas (p < 0,001) (Figuras 3-7). En la Figura 3 se observa una mayor frecuencia de problemas para el PH 2, en el cual las proporciones de aves con puntajes 2 (moderado) y 3 (severo) se estimaron en 0.37 (IC95%: 0.29; 0.45) y 0.09 (IC95%: 0.04; 0.14), respectivamente (p < 0.05).
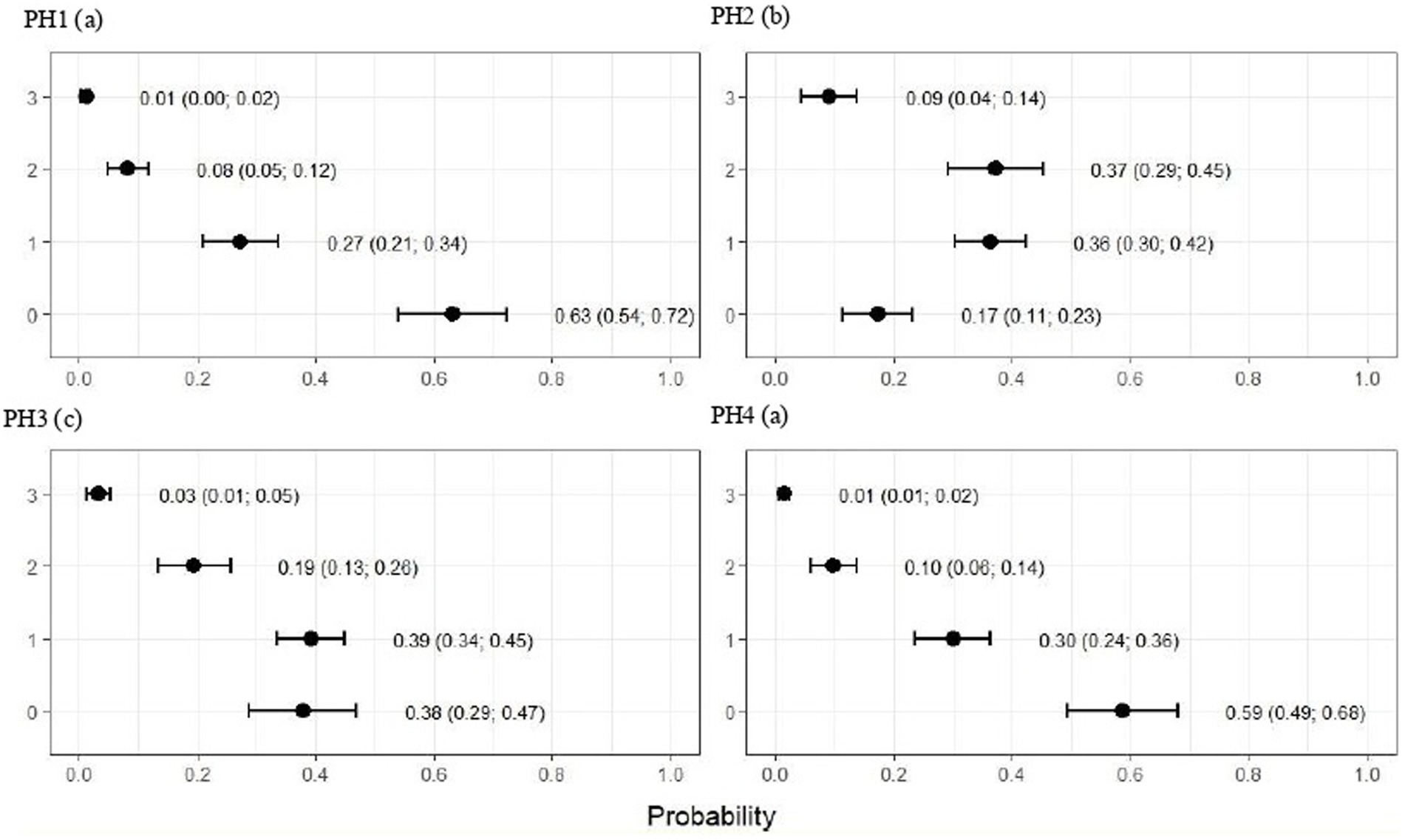
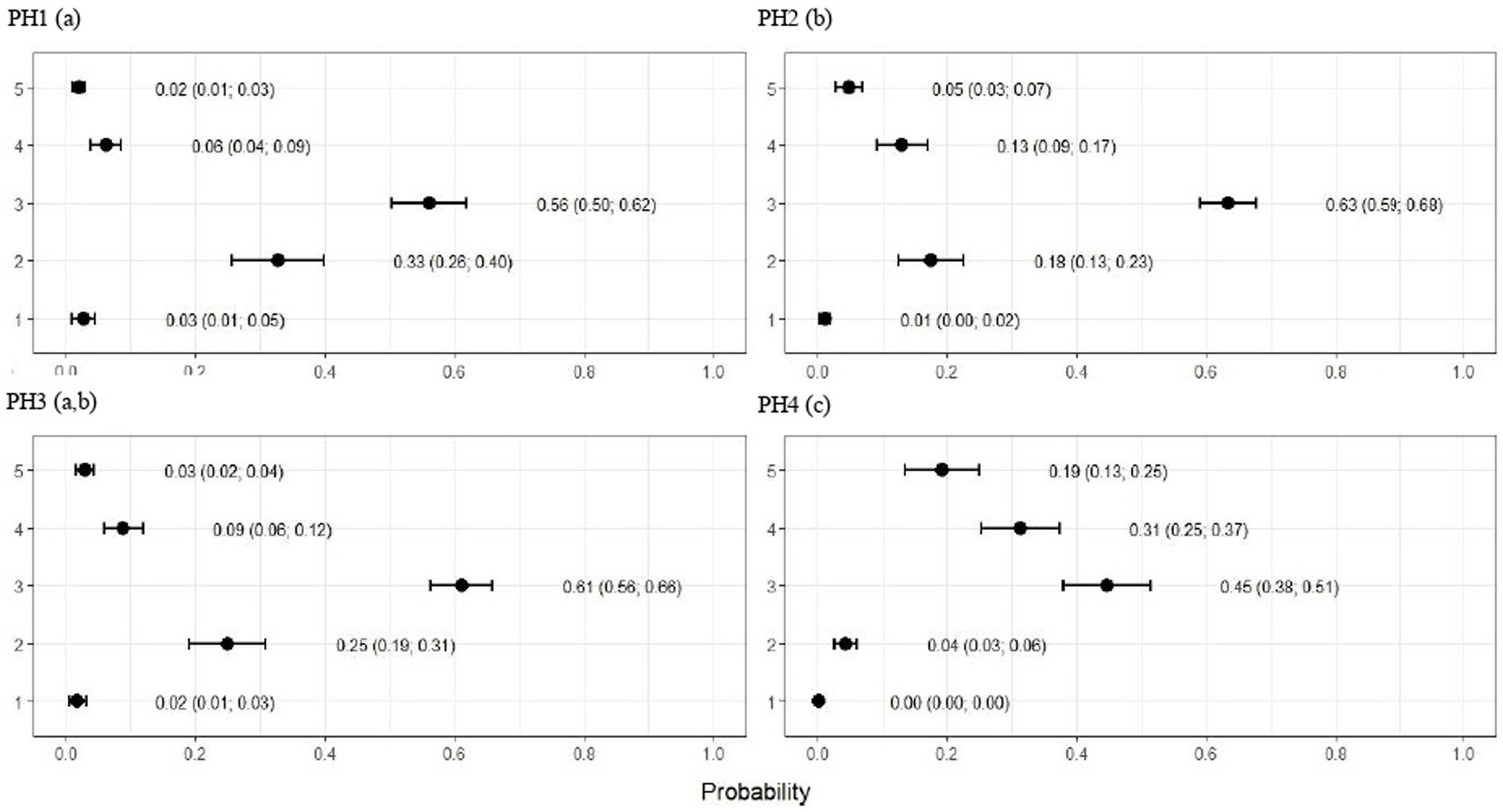
Para el PH 3, los resultados fueron intermedios, donde las proporciones de aves con puntaje 2 (moderado) se estimaron en 0.19 (IC95%: 0.13; 0.26) y con puntaje 3 (severo) en 0.03 (IC95%: 0.01; 0.05) con p < 0.05. Además, los PH1 y 4 observaron las frecuencias más bajas de dermatitis mamaria y abdominal, donde las proporciones de aves con puntaje 2 (moderado) se estimaron en 0,08 (IC95%: 0,05; 0,12) y 0,10 (IC95%: 0,06; 0,14) y con puntaje 3 (severo) en 0,01 (IC95%: 0,00; 0,02) y 0,01 (IC95%: 0,01; 0,02), respectivamente, y p < 0,05 (Figura 3).
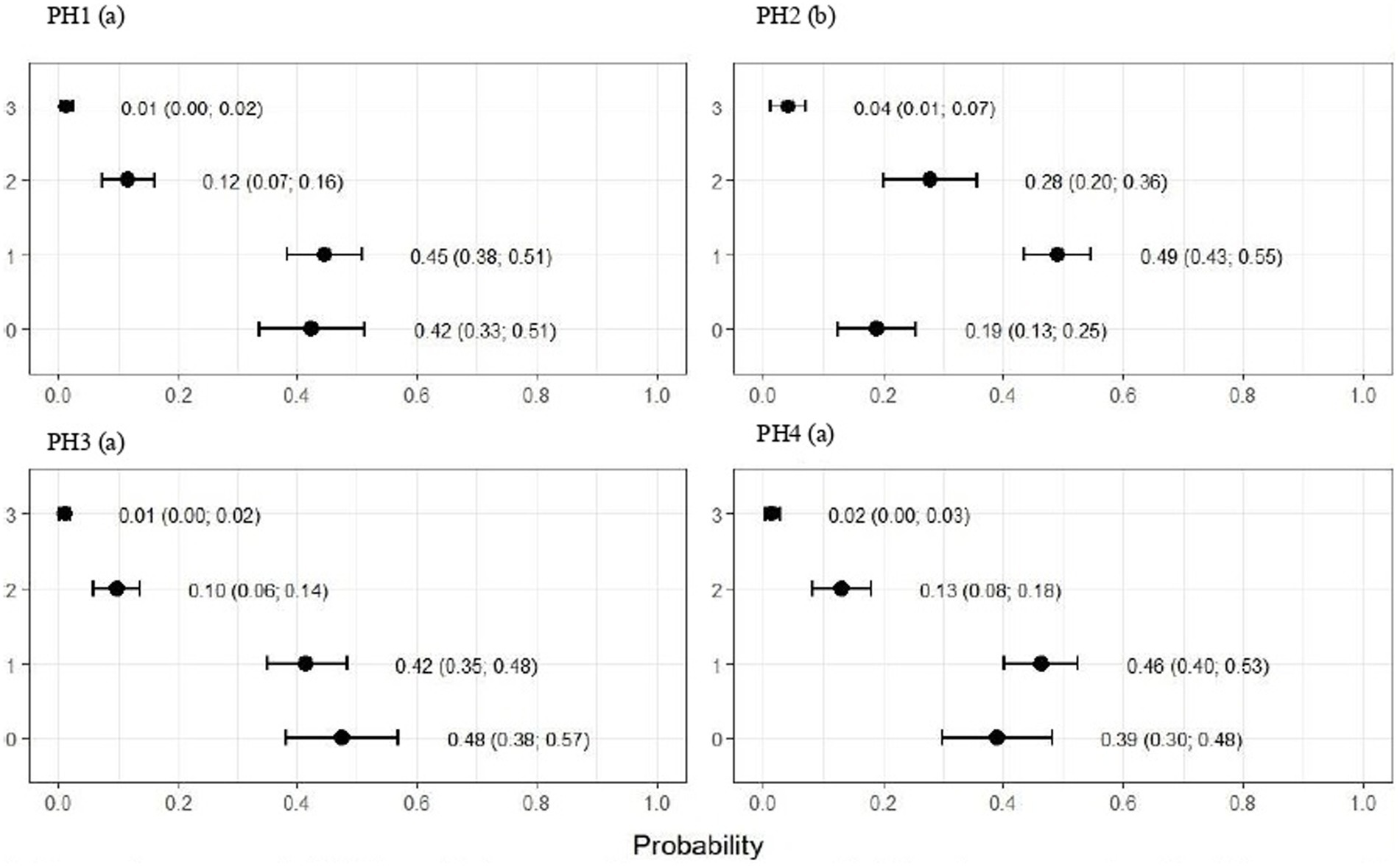
Los puntajes de plumaje para PH2 mostraron que las proporciones de aves con puntajes de 1 (ligero) y 2 (moderado) se estimaron en 0.49 (IC95%: 0.43; 0.55) y 0.28 (IC95%: 0.20; 0.36), respectivamente (p < 0.05). Para las aves de los otros galpones, no hubo diferencias significativas en la limpieza del plumaje, como se muestra en la Figura 4. Como se muestra en la Figura 5, las lesiones de pododermatitis fueron más frecuentes en la PH4. Las proporciones de puntajes iguales a 2 y 3 se estimaron en 0,31 (IC95%: 0,24; 0,38) y 0,27 (IC95%: 0,18; 0,35) y p < 0,05, respectivamente. Para la quemadura del corvejón, los puntajes fueron peores en las aves del PH 1, donde las proporciones de aves con puntajes de 1 (moderado) y 2 (severo) se estimaron en 0.42 (IC95%: 0.34; 0.48) y 0.04 (IC95%: 0.01; 0.06), respectivamente. Para el HP 2, los resultados fueron intermedios a 1 (0,23, IC95%: 0,13; 0,31). Las proporciones de aves en PH 3 y 4 con puntaje de 1 (moderado) se estimaron en 0.03 (IC95%: 0.00; 0.06) y 0.13 (IC95%: 0.07; 0.19) y PH 2 (severo) se estimaron en 0.00 (IC95%: 0.00; 0.01) y 0.01 (IC95%: 0.00; 0.02), con p < 0.05, respectivamente. Todos los resultados se muestran en la Figura 6.
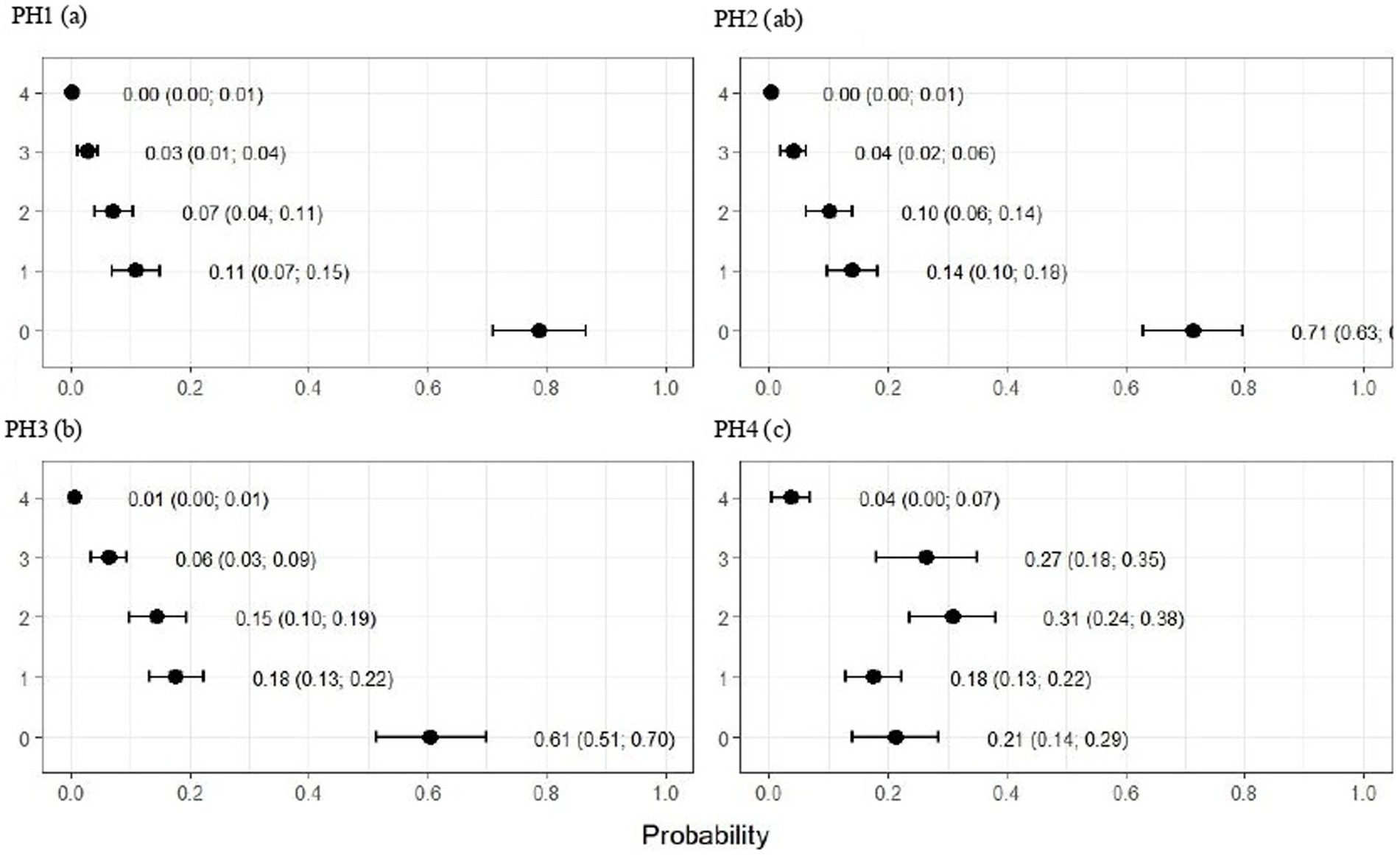
Como se observa en la Figura 7, las aves del PH 4 fueron las más afectadas por la cojera, donde las proporciones de aves con puntajes de 4 (anormalidad severa) y 5 (incapacidad para caminar) se estimaron en 0.31 (IC95%: 0.25; 0.37; p < 0,05) y 0,19 (IC95%: 0,13; 0,25; p < 0,05.), respectivamente. Para las otras casas, los puntajes fueron menores en las aves de PH 1 en comparación con PH 2 y 3, donde se observaron resultados intermedios.
3.3 Recuentos diferenciales y morfología celular
Los resultados obtenidos revelaron que el recuento relativo de heterófilos fue mayor en comparación con los valores de referencia, lo que indica heterofilia relativa en dos HP. De acuerdo con Thrall et al. (33), además de ser significativamente diferentes entre los PH (p < 0.05), los parámetros analizados correspondieron a los rangos superiores de 15 a 50% de los valores de referencia reportados para aves sanas.
Las diferencias estadísticas revelaron que la proporción estimada de heterófilos fue mayor en las aves de PH4 (p = 0,61, IC95%: 0,58; 0,64) y en las aves de PH3 (p = 0,60, IC95%: 0,57; 0,63), con p < 0,05, respectivamente (Figura 8). En aves PH2, los resultados fueron intermedios (p = 0,43, IC95%: 0,41; 0,46; p < 0,05), mientras que para la PH1 se observó un resultado menor para el recuento de heterófilos (p = 0,36, IC95%: 0,33; 0,39). Para los linfocitos, la proporción estimada en la sangre de las aves del grupo PH1 fue de 0,59 (p = 0,59), con un intervalo de confianza del 95% (IC 95%) que osciló entre 0,56 y 0,62 con p < 0,05. Para las aves en PH2, la proporción de linfocitos fue de 0,51 (p = 0,51), con un IC 95% que varió de 0,48 a 0,54 (p < 0,05); en PH4, la proporción estimada fue de 0,31 (p = 0,31), con un IC 95% que varió de 0,28 a 0,34, y finalmente, para las aves en PH3, la proporción estimada de linfocitos fue de 0,25 (p = 0,25), con un IC 95% que varió de 0,23 a 0,28. Con base en estos resultados, las aves de PH1 tuvieron la mayor proporción de linfocitos, seguidas de PH2, PH4 y PH3 en orden descendente.
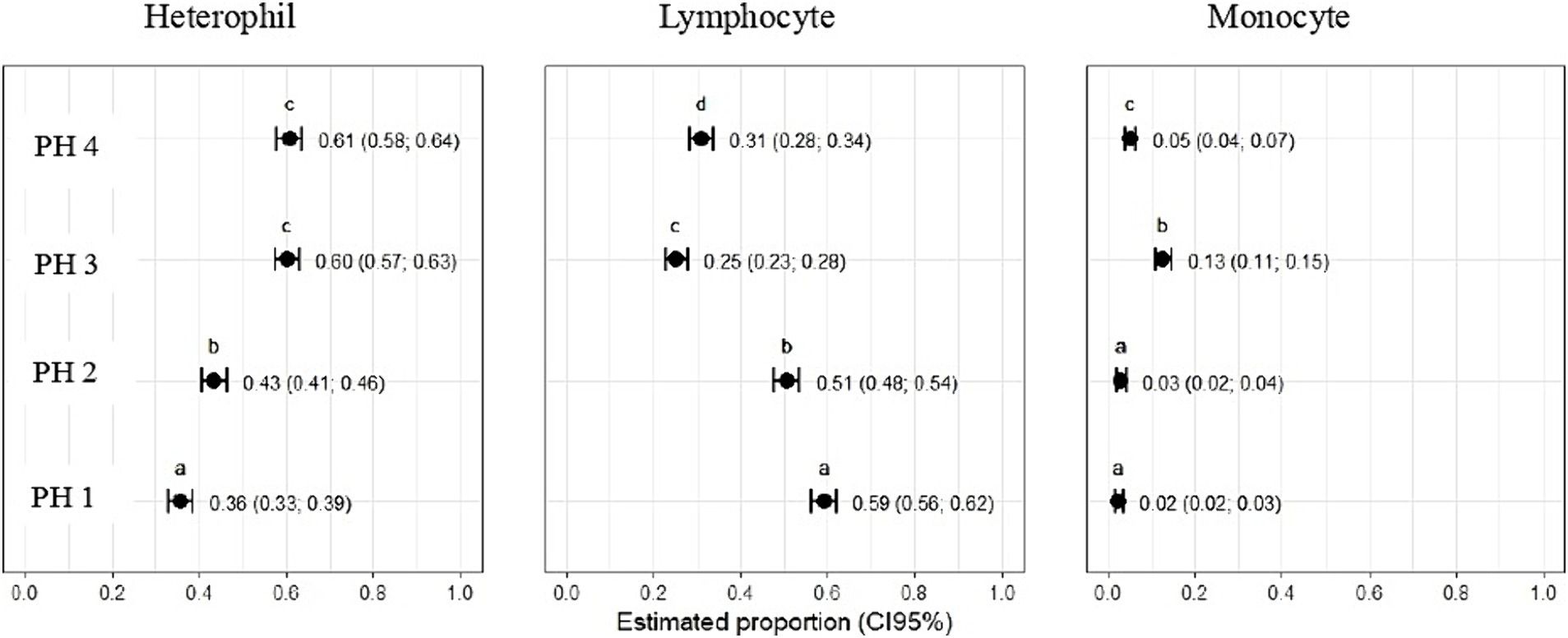
La proporción estimada de monocitos fue mayor para las aves PH3 0,13 (p = 0,13, IC95%: 0,11; 0,15), seguidas de las aves PH4 0,05 (p = 0,05, IC95%: 0,04; 0,07), las aves PH2 0,03 (p = 0,03, IC95%: 0,02; 0,04) y las aves PH1 0,02 (p = 0,02, IC95%: 0,02; 0,03). No hubo diferencias significativas entre la proporción de monocitos en la sangre de las aves de PH2 y PH1 (Figura 8).
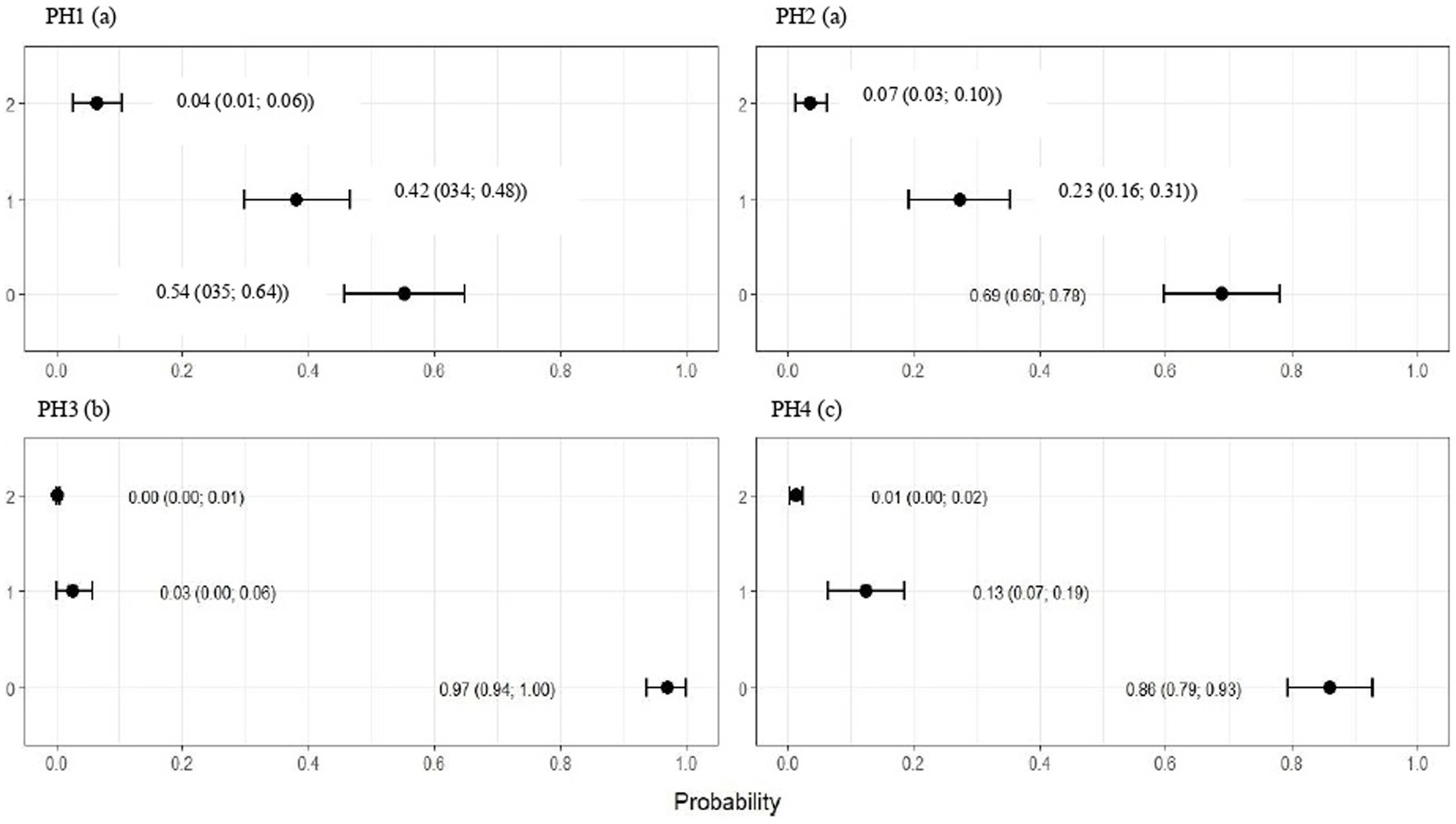
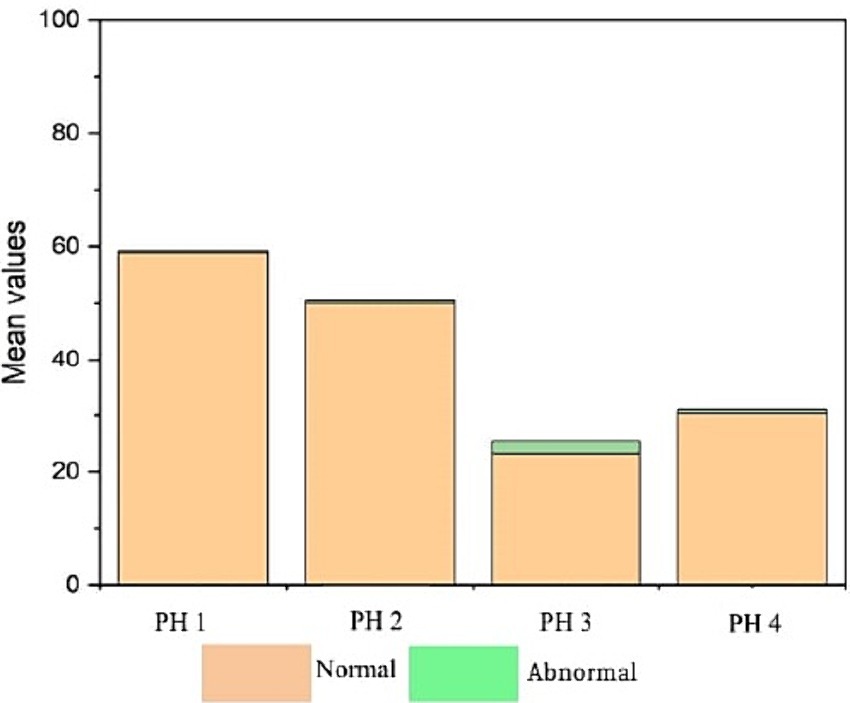
La Figura 9 indica que las aves de PH2 y PH4 mostraron resultados más críticos en cuanto a la morfología de los heterófilos, es decir, tuvieron una mayor proporción de heterófilos con más del 90% de células con puntuaciones de 3 y 4, lo que se clasificó como heterófilos de cambio tóxico debido a la anormalidad severa, mientras que las aves de PH1 y PH3 tuvieron una proporción de aproximadamente el 70% de células con puntuaciones de 3 y 4 (p < 0,05). Las aves de todas las casas presentaron características morfológicas normales para la mayoría de los linfocitos (puntaje 0) y exhibieron forma anormal solo en 0.9 ± 0.1% (puntaje 1), con una a un máximo de seis células anormales por frotis (Figura 10). En la Figura 11 se muestran las imágenes de la morfología heterófila de aves (Gallus gallus domesticus) de nuestro estudio.
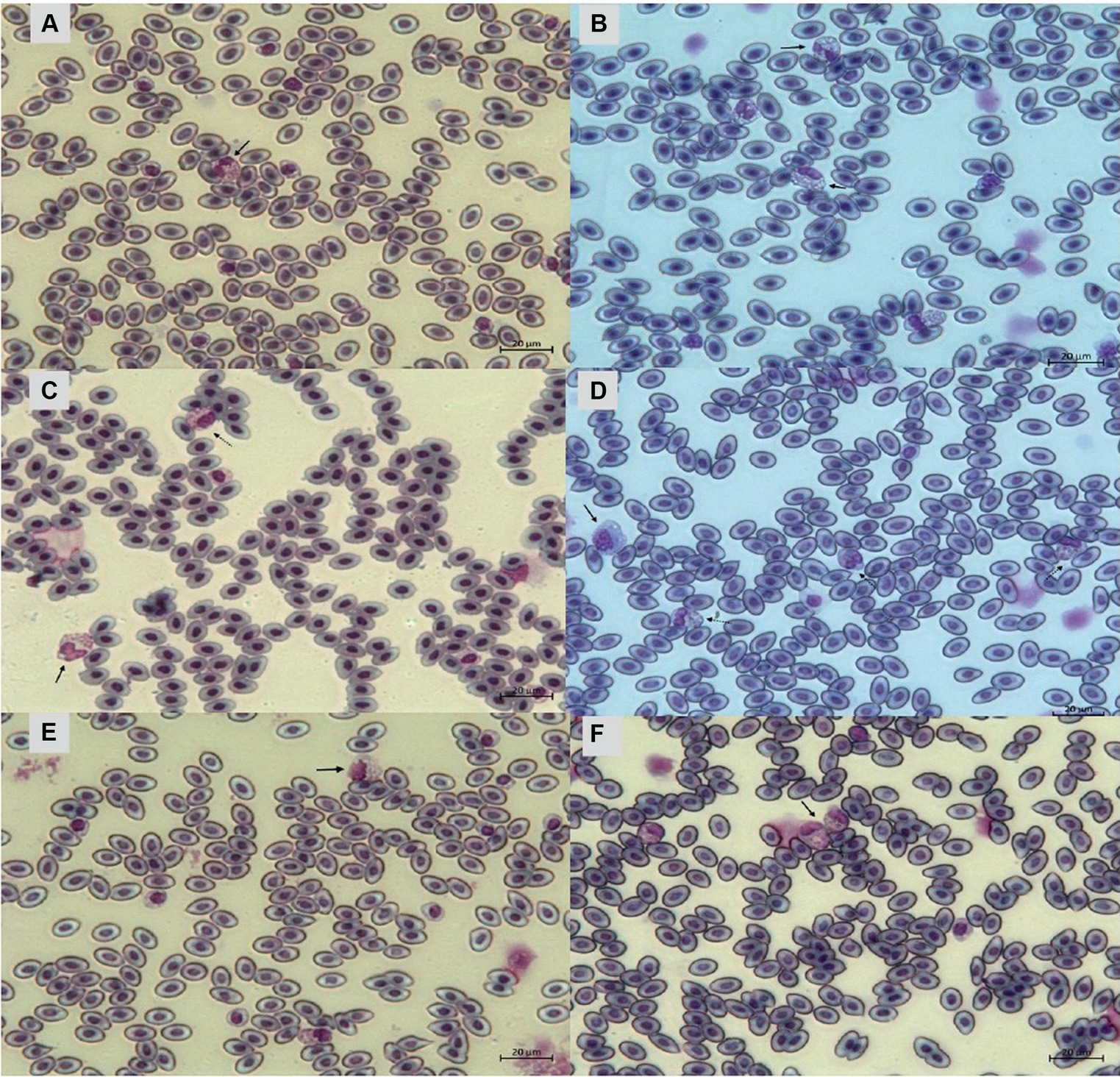
3.4 Relación heterófilos/linfocitos (H/L)
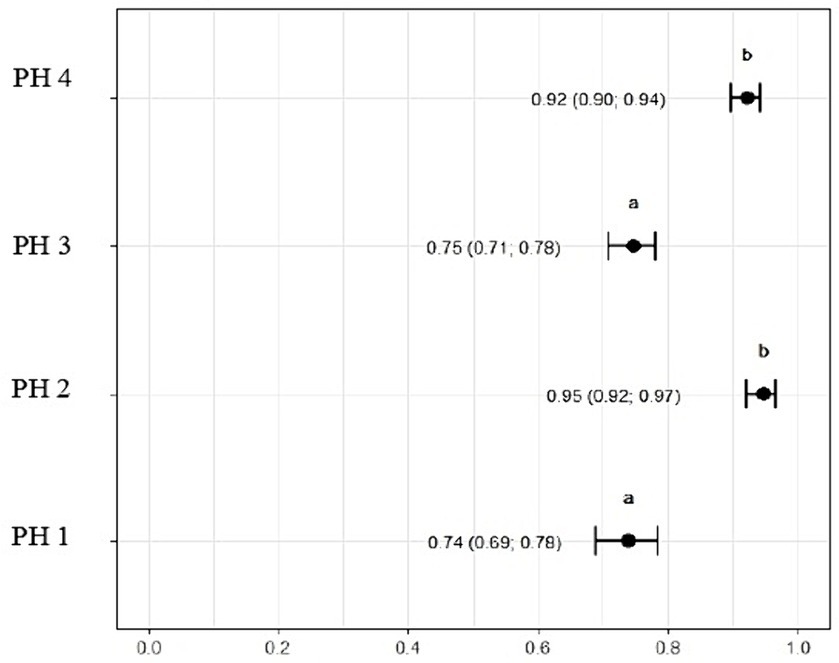
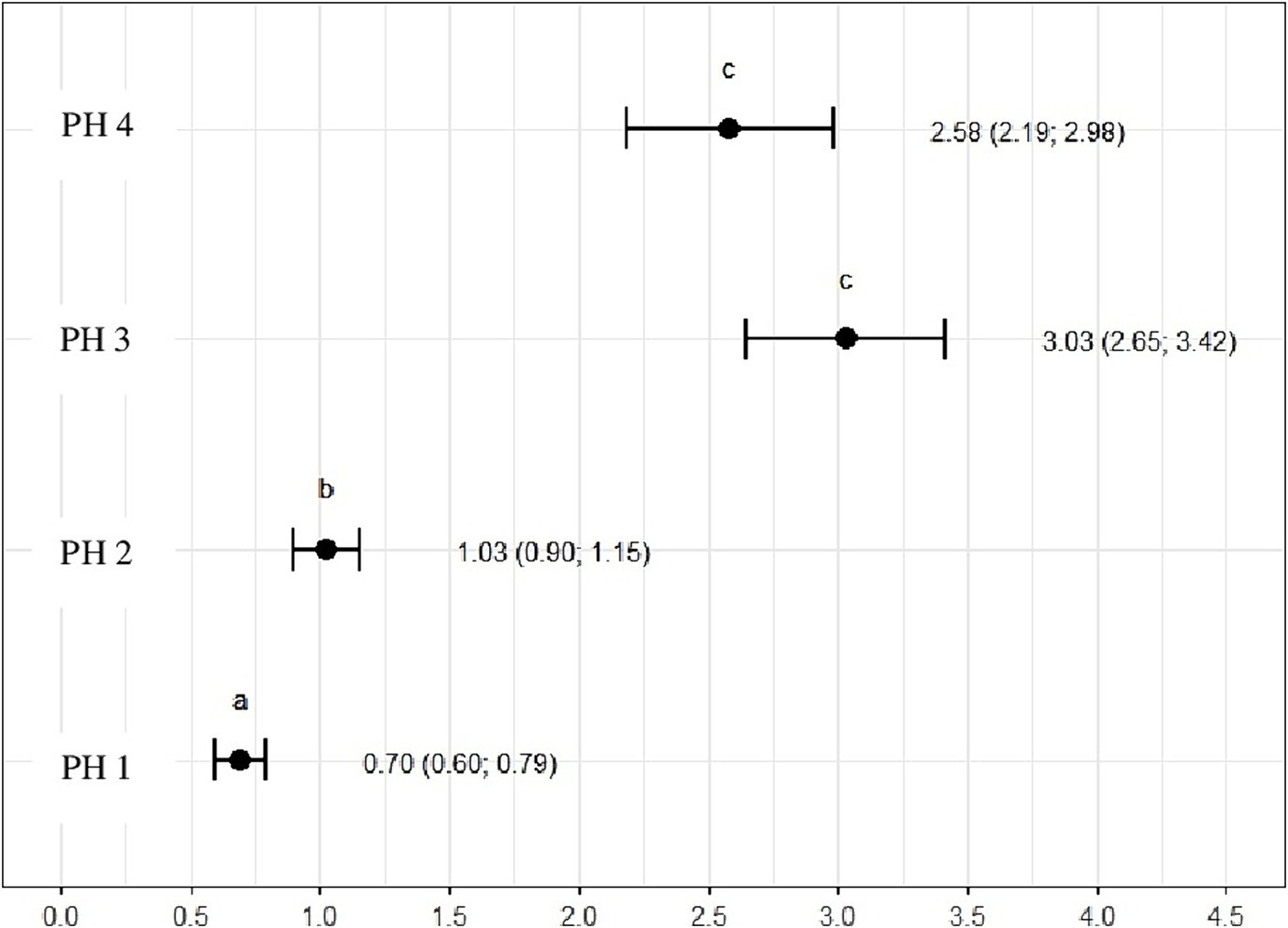
La relación de heterófilos a linfocitos fue mayor para las aves en PH3 3,03 (p = 3,03, IC95%: 2,65; 3,42) y PH4 2,58 (p = 2,58, IC95%: 2,19; 2,98). Para las aves PH2, los resultados fueron intermedios 1.03 (p = 1.03, IC95%: 0.90; 1.15), mientras que para las aves PH1, la proporción fue menor 0.70 (p = 0.70, IC95%: 0.60; 0.79) (Figura 11).
4 Discusión
Nuestros resultados proporcionan información sobre la contribución potencial de la evaluación cualitativa de los leucocitos, ya que parece proporcionar información relevante para la evaluación del bienestar de los pollos de engorde. A pesar del papel universalmente central de los heterófilos en las respuestas inflamatorias e infecciosas en especies de vertebrados, la literatura sobre el uso de la morfología celular como herramienta diagnóstica para el bienestar sigue siendo limitada.
El análisis de los recuentos y las características morfológicas de los leucocitos y las evaluaciones del bienestar en campo de las aves en el mismo PH presentaron una interesante gama de resultados que sugieren el potencial de las anomalías morfológicas de los heterófilos como una contribución a la evaluación del bienestar de las aves. A pesar de que los cuatro PH fueron clasificados como sistemas de confinamiento intensivo, que generalmente se caracterizan por condiciones de bajo bienestar (6, 37, 44), hubo una importante variación de bienestar entre ellos. Estos resultados permiten investigar cómo las evaluaciones de bienestar realizadas en campo se relacionan con indicadores fisiológicos obtenidos a partir de muestras de sangre, contribuyendo así a una mejor comprensión del bienestar de las aves en sistemas de confinamiento intensivo. El bienestar de los pollos de engorde está significativamente influenciado por las condiciones ambientales internas dentro del PH, incluyendo la temperatura, la humedad, la calidad de la cama, la ventilación, la iluminancia y las concentraciones de gases como NH3 y dióxido de carbono (CO2) (45-47). Nuestros resultados mostraron que las aves tenían diferentes niveles de bienestar, aunque las condiciones ambientales internas estaban dentro de los límites reglamentarios para los sistemas de producción intensiva de pollos. Coelho et al. (48) destacaron la importancia de prestar especial atención a las condiciones ambientales en los sistemas de producción avícola intensiva, especialmente en climas tropicales, ya que el clima externo interactúa de manera diferente con las condiciones ambientales internas. La variación permitió investigar cómo la evaluación del bienestar realizada en campo se relacionaba con los indicadores inmunológicos obtenidos de muestras de sangre.
La hematología puede contribuir al seguimiento de la PTA y la salud de los animales de granja, ya que tiende a reflejar los impactos que sufren los animales en relación con su bienestar, incluidos los impactos crónicos. Más específicamente, los leucocitos juegan un papel vital en la respuesta inmune y están involucrados en varios procesos inflamatorios (25, 49-51). Existe una tradición de considerar el recuento de WCB y la relación H/L para contribuir a la evaluación de la AW, y nuestros resultados confirman dicha contribución. En particular, el porcentaje de heterófilos fue mayor en PH 4 y 3, lo que sugiere posibles respuestas de estrés en las aves de estas granjas. Los heterófilos tienen un papel fundamental en la respuesta al estrés y la inflamación aguda en las aves (23, 52). Nuestros resultados originales en términos de las diferencias significativas en la morfología de los heterófilos comparando aves de diferentes PH también sugieren poder diagnóstico para este análisis, especialmente considerando que las diferencias parecían consistentes con las observadas para la evaluación del bienestar en el campo.
Los porcentajes de linfocitos también difirieron, siendo el PH 1 el que presentó los mayores recuentos. Estas diferencias en los perfiles sanguíneos sugieren variaciones en las respuestas inmunológicas y fisiológicas de las aves, que probablemente pueden atribuirse a diferentes factores relacionados con las condiciones de vida y los estímulos ambientales (30, 53), las alteraciones del hábitat (54), el estado higiénico de los alimentos, el agua y el medio ambiente, la exposición a patógenos (55), el intestino (56) y el uso de antibióticos y quimioterapias (57). Todos estos son factores que merecen una mayor investigación.
La relación H/L es un indicador crucial de estrés en las aves de corral (58). El estudio reveló que el PH3 tenía la mayor relación H/L, seguido del PH 4 y 2. Esto sugiere que las aves de estas granjas avícolas pueden estar experimentando más estrés en comparación con las aves de la granja avícola 1, que tenían la relación H/L más baja. El PH 2, a pesar de mostrar resultados intermedios para las proporciones celulares, se mantuvo con un valor H/L por encima del valor de referencia, revelando malas condiciones de bienestar y altos niveles de estrés (59). Estos hallazgos se alinean con la evaluación de los indicadores de salud y las variables sanguíneas como porcentaje y morfología de los heterófilos, indicando colectivamente variaciones en los niveles de estrés entre los HP, según lo reportado en la literatura (14, 23, 39, 58, 60).
Las aves de todos los PH presentaron puntuaciones altas de heterófilos de cambio tóxico (Figura 12), siendo las de PH2 y PH4 las que mostraron los peores resultados. Stacy et al. (32) describieron que los heterófilos y neutrófilos presentaban anomalías morfológicas bajo estímulos inflamatorios significativos, y estos cambios eran el resultado de la producción acelerada demandada por el organismo, lo que conducía a una maduración anormal, que se caracterizaba por la desincronización de la maduración nuclear y citoplasmática, junto con indicios de degeneración citoplasmática. Aparecieron heterófilos inmaduros en nuestros frotis de sangre, lo que sugiere que las aves participantes estaban lidiando con una inflamación activa. Por lo tanto, los resultados mostraron una respuesta de estrés inmunológico en aves, que parece estar asociada con la evaluación simultánea de la AW en granja. La morfología de los heterófilos en pollos de engorde algunos días antes del sacrificio suele verse afectada por una serie de factores (30). Durante el ciclo de producción, las aves pueden estar sometidas a estrés crónico, exposición a agentes infecciosos y otras condiciones desafiantes, lo que puede resultar en cambios en la morfología heterófila. Estos cambios a menudo incluyen características como el tamaño, la presencia de núcleos hiposegmentados, la vacuolación citoplasmática y granulaciones anormales (32), lo cual es compatible con nuestros resultados.
Las frecuencias más altas de dermatitis mamaria y abdominal, limpieza del plumaje y cojera encontradas en PH2 y PH4 sugirieron las peores condiciones ambientales dentro de estos PH en comparación con PH1 y PH3. Tales resultados son coherentes con los hallazgos de la siguiente manera: mayor porcentaje del número de heterófilos y peores resultados para las anomalías en la morfología de los heterófilos. Las mayores frecuencias de los indicadores como pododermatitis y cojera (salud), humedad relativa (ambiental), porcentaje de heterófilos maduros e inmaduros, morfología heterófila y relación H:L se encontraron en el PH4. Estos resultados pueden estar relacionados con el hecho de que la pododermatitis es un proceso inflamatorio, probablemente asociado con dolor y lesiones graves. Las expresiones conductuales observadas en estas aves también son coherentes: letárgicas, apáticas, aburridas, frustradas, dolorosas, inquietas, perturbadas, asustadas y temerosas (Figura 3). Weeks et al. (61) observaron que las aves de entre 39 y 49 días de edad permanecían acostadas, en promedio, el 76% del tiempo, y este porcentaje aumentó al 86% para las aves con una puntuación de 3 para cojera. Sans et al. (6) describieron que el tiempo medio de reposo fue del 55,0% y las puntuaciones de cojera 2 y 3 mostraron porcentajes elevados (82,9%). La privación de la complejidad ambiental y el incentivo también puede ser una causa de altas frecuencias de comportamiento de descanso. De acuerdo con Bailie et al. (62), las aves pueden realizar otras actividades si son estimuladas.
El QBA permitió clasificar los comportamientos de las aves en dos grupos distintos: de «Alerta» a «Desesperada» y de «Relajada» a «Positivamente ocupada». El análisis del mapa de calor (Figura 3) reveló que el PH 4 difiere de las otras granjas, con una mayor frecuencia de aves que exhiben comportamientos del primer grupo. Esto sugiere que estas aves pueden estar experimentando más estrés o condiciones desfavorables en comparación con las aves de las otras granjas, que mostraron menos actividad relacionada con los comportamientos del grupo 2. Estos resultados son consistentes con la tasa de mortalidad, el número de aves en la nave el día de la visita, los cambios en los indicadores de salud, especialmente la cojera, y finalmente el porcentaje de heterófilos y las puntuaciones celulares 3-4 para las aves de PH 2 y 4.
La evaluación de la salud de las aves clasificó varios indicadores de salud en diferentes categorías en función de la gravedad de sus condiciones. Los resultados revelan diferencias significativas entre el HP, siendo el PH 4 y el PH 2 los que en general puntúan peor en los indicadores de salud. En particular, los resultados para la pododermatitis y la quemadura del corvejón fueron mejores en la categoría «sin anomalías» (c1) para PH 3 y PH 4.
Fisiológicamente, los altos niveles de inflamación sugeridos por los recuentos de glóbulos blancos y las anomalías morfológicas pueden ser el resultado de muchos factores, como la respuesta a la liberación de moléculas llamadas patrones moleculares asociados al daño (DAMP), como resultado de la muerte celular (63, 64). Como muestran nuestros resultados, la morfología de los glóbulos blancos parece un buen candidato a biomarcador porque responde a una variedad de factores que impactan el bienestar en nuestras condiciones experimentales y se ha estudiado desde la década de 1960 (65), con una cantidad proporcional de conocimiento acumulado. Además, una condición interesante que indica la relación H/L de elección como parámetro para la evaluación del estrés y el bienestar es su alta heredabilidad, la cual es conocida ya que se utiliza como indicador de resistencia a enfermedades en la cría de aves. Esto es especialmente importante en pollos de engorde porque sugiere una característica que puede seleccionarse como marcador genético, capaz de identificar pollos con una mayor capacidad en la respuesta inmune, es decir, pollos más inmunocompetentes (58, 66). Dado que nuestros resultados mostraron un potencial relevante de las anomalías morfológicas de los heterófilos como indicador de bienestar, el estudio de su heredabilidad parece justificado.
En general, nuestro estudio mostró una alta proporción de aves que sufrían de dermatitis mamaria y abdominal y pododermatitis y cojera con menor limpieza del plumaje. Todos estos indicadores individuales de bienestar en la granja, que mostraban un bajo estado de bienestar de las aves, eran coherentes con la anomalía morfológica de los heterófilos y las proporciones de heterófilos a linfocitos (H/L) que se observaron.
Los indicadores inmunológicos pueden representar el estado de bienestar general, es decir, la combinación de una base multifactorial que integra el estado de bienestar medio de los animales dentro de una condición ambiental (PH) dada. Deseamos saber más sobre los WBC como indicadores; Sin embargo, debido al brote mundial de gripe aviar altamente patógena, la investigación ha sido limitada.
5 Conclusión
Las respuestas de estrés que se producen durante el periodo de cría y producción de los animales inducen efectos inmunomoduladores y adaptativos que alteran los recuentos y la morfología de las células de defensa. La comprensión de estos fenómenos en aves es limitada y generalmente se centra en el recuento de leucocitos y la relación heterófilos/linfocitos para medir el estrés. Nuestros resultados destacaron el impacto negativo de las condiciones ambientales y de manejo que existían en cada PH estudiado sobre los estados afectivos y los indicadores de salud seleccionados y los perfiles de leucocitos de las aves. Se necesitan urgentemente intervenciones específicas para mejorar el bienestar de las aves en los sistemas de cría intensiva; de acuerdo con la morfología heterófila, el bienestar de los pollos de engorde en la PH moderna es críticamente bajo. Los indicadores inmunológicos pueden representar el estado de bienestar general, es decir, la combinación de una base multifactorial que integra el estado de bienestar medio de los animales dentro de una determinada condición ambiental, de salud y de comportamiento.
También se sugieren consideraciones prácticas y el potencial de las características morfológicas de los leucocitos como indicadores de bienestar, constituyendo mediciones sensibles y de bajo costo. Los indicadores que reflejan múltiples impactos en el bienestar, como los recuentos de leucocitos y las alteraciones morfológicas, pueden convertirse en poderosos narradores en la compleja tarea de evaluar el bienestar de los animales, y parece que se justifica una mayor investigación, ya que los indicadores inmunológicos pueden resultar útiles como marcadores de bienestar tanto en el campo como en el matadero.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/Material complementario, y las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Ética en Uso de Animales del Campus Agropecuario (protocolo n.º 023/2022) de la Universidad Federal de Paraná, Curitiba, Brasil. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio. Se obtuvo el consentimiento informado por escrito de la(s) persona(s) para la publicación de cualquier imagen o dato potencialmente identificable incluido en este artículo.
Contribuciones de los autores
LR: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Visualización, Redacción – borrador original, Redacción – revisión y edición. ES: Curación de datos, Investigación, Metodología, Redacción – borrador original. RS: Curación de datos, redacción, revisión y edición. CT: Análisis formal, Redacción – borrador original, Redacción – revisión y edición. RF: Curación de datos, Redacción – borrador original. CM: Conceptualización, Obtención de fondos, Metodología, Supervisión, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Los autores declaran apoyo financiero de la UFPR y de la Fundación Araucaria. Además, este estudio fue financiado en parte por la Fundación CAPES – Coordinación para el Perfeccionamiento del Personal de Nivel Superior – Brasil – Código de Finanzas 001. CM recibe una beca de productividad del Consejo Nacional de Investigaciones Científicas, CNPq.
Reconocimientos
Los autores desean agradecer a todos los profesionales, ganaderos y a un socio de la industria de la carne de aves de corral, que contribuyeron a este estudio.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1384802/full#supplementary-material
1. ABPA – Asociación Brasileña de Proteína Animal . (2023). Informe anual. Disponible en: https://abpa-br.org/abpa-relatorio-annual (consultado el 13 de octubre de 2023).
2. Escoba, DM . Conceptos de bienestar animal En: A Knight, C Phillips y P Sparks, editores. Manual Routledge de bienestar animal. Londres y Nueva York: Routledge (2022). 12–21.
3. Krueger, A, Cruickshank, J, Trevisi, E, y Bionaz, M. Sistemas para la evaluación del bienestar en las granjas lecheras. J Dairy Res. (2020) 87:13–9. doi: 10.1017/S0022029920000461
4. Rowe, E, Dawkins, MS, y Gebhardt-Henrich, SG. Una revisión sistemática de la ganadería de precisión en el sector avícola: ¿la tecnología está enfocada a mejorar el bienestar de las aves? Animales. (2019) 9:614. doi: 10.3390/ani9090614
5. Leinonen, I, Williams, AG, y Kyriazakis, I. Los efectos de los cambios en el sistema de mejora del bienestar sobre los impactos ambientales de la producción de pollos de engorde y huevos. Poult Sci. (2014) 93:256–66. doi: 10.3382/ps.2013-03252
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Sans, ECDO, Tuyttens, FAM, Taconeli, CA, Rueda, PM, Ciocca, JR y Molento, CFM. Bienestar de pollos de engorde criados en dos tipos diferentes de naves industriales durante la temporada de invierno en el sur de Brasil. Hno. Poult Sci. (2021) 62:621–31. doi: 10.1080/00071668.2021.1908519
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Ingenbleek, P, Immink, VM, Spoolder, HAM, Bokma, MH y Keeling, LJ. Política de bienestar animal de la UE: desarrollo de un marco político global. Política Alimentaria. (2012) 37:690–9. doi: 10.1016/j.foodpol.2012.07.001
8. Cozzi, G, Brscic, M, y Gottardo, F. Principales factores críticos que afectan al bienestar del ganado vacuno de carne y terneros criados bajo sistemas de cría intensiva en Italia: una revisión. Ital J Anim Sci. (2009) 8:67–80. doi: 10.4081/ijas.2009.s1.67
9. Serra, M, Wolkers, CPB, y Urbinati, EC. Indicadores fisiológicos del bienestar animal. Rev Bras Zoociências. (2018) 19:70–96. doi: 10.34019/2596-3325.2018.v19.24726
10. Calidad del bienestar . (2009). Protocolo de evaluación de la calidad® del bienestar de las aves de corral. Lelystad, Holanda: 142p. Disponible en: http://www.welfarequality.net/en-us/home/ (Acceso: 04 set. 2023).
11. Ifelayo, II, Onize, IH, Faith, U, y Wodi, SM. Hematología y bioquímica sérica de cepas de pollos de engorde (cobbs y arbor-acre) alimentadas con jengibre (Zingiber officinale). GSC Biol Pharm Sci. (2020) 11:320–6. doi: 10.30574/gscbps.2020.11.2.0145
12. Karachaliou, CE, Koukouvinos, G, Goustouridis, D, Raptis, I, Kakabakos, S, Petrou, P, et al. Inmunosensores de cortisol: una revisión de la literatura. Biosensores. (2023) 13:285. doi: 10.3390/bios13020285
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Pacini, MI, Bonelli, F, Lubas, G, y Sgorbini, M. Relación entre los parámetros sanguíneos y el resultado en corzos rescatados. Animales. (2022) 12:3469. doi: 10.3390/ani12243469
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Escaneos, CG . Biología del estrés en aves de corral con énfasis en glucocorticoides y la relación heterófilo/linfocitos. Poult Sci. (2016) 95:2208–15. doi: 10.3382/ps/pew137
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Weimer, SL, Wideman, RF, Scanes, CG, Mauromoustakos, A, Christensen, KD, y Vizzier-Thaxton, Y. Una evaluación de los métodos para medir el estrés en pollos de engorde. Poult Sci. (2018) 97:3381–9. doi: 10.3382/ps/pey204
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Weimer, SL, Wideman, RF, Scanes, CG, Mauromoustakos, A, Christensen, KD y Vizzier-Thaxton, Y. Respuestas de estrés de los pollos de engorde a la intensidad de la luz, el tipo de piso y la debilidad de las patas según lo evaluado por las proporciones de heterófilos a linfocitos, corticosterona sérica, termografía infrarroja y latencia a la mentira. Poult Sci. (2020) 99:3301–11. doi: 10.1016/j.psj.2020.03.028
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Souza, APO, Sans, EC, Müller, BR, y Molento, CFM. Evaluación del bienestar de los pollos de engorde en granjas certificadas y no certificadas por GLOBALGAP® en Brasil. Anim Welf. (2015) 24:45–54. doi: 10.7120/09627286.24.1.045
18. Franchi, GA, Garcia, PR, and Silva, IJO. Welfare quality applied to the Brazilian dairy cattle. J Anim Behav Biometeorol. (2014) 2:60–5. doi: 10.14269/2318-1265.v02n02a04
19. Boonprasert, K, Yun, Y, Kosaruk, W, Towiboon, P, Tankaew, P, Punyapornwithaya, V, et al. A longitudinal study of hematology and stress biomarker profiles in young Asian elephants (Elephas maximus) in relation to elephant Endotheliotropic herpesvirus (EEHV) in Thailand. Animals. (2021) 11:2530. doi: 10.3390/ani11092530
20. Perera, TRW, Skerrett-Byrne, DA, Gibb, Z, Nixon, B, and Swegen, A. The future of biomarkers in veterinary medicine: emerging approaches and associated challenges. Animals. (2022) 12:2194. doi: 10.3390/ani12172194
21. Al-Murrani, WK, Al-Rawi, AJ, Al-Hadithi, MF y Al-Tikriti, B. Asociación entre la relación heterófilos/linfocitos, un marcador de «resistencia» al estrés y algunos rasgos de producción y aptitud en pollos. Hno. Poult Sci. (2006) 47:443–8. doi: 10.1080/00071660600829118
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Gross, WB, y Siegel, HS. Evaluación de la relación heterófilos/linfocitos como medida de estrés en pollos. Avian Dis. (1983) 27:972. doi: 10.2307/1590198
23. Maxwell, MH, y Robertson, GW. El leucocito heterófilo aviar: una revisión. Worlds Poult Sci J. (1998) 54:155–78. doi: 10.1079/WPS19980012
24. Düpjan, S, y Dawkins, MS. Bienestar animal y resistencia a las enfermedades: interacción de los estados afectivos y el sistema inmunológico. Front Vet Sci. (2022) 9:929805. doi: 10.3389/fvets.2022.929805
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Berghman, LR . Respuestas inmunitarias para mejorar el bienestar. Poult Sci. (2016) 95:2216–8. doi: 10.3382/ps/pew159
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. D’Acquisto, F . Inmunología afectiva: donde convergen las emociones y la respuesta inmune. Diálogos Clin Neurosci. (2017) 19:9–19. doi: 10.31887/DCNS.2017.19.1/fdacquisto
27. Allen, AP, Kennedy, PJ, Cryan, JF, Dinan, TG y Clarke, G. Marcadores biológicos y psicológicos de estrés en humanos: enfoque en la prueba de estrés social de Trier. Neurosci Biobehav Rev. (2014) 38:94–124. doi: 10.1016/j.neubiorev.2013.11.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Davis, AK, Maney, DL, y Maerz, JC. El uso de perfiles leucocitarios para medir el estrés en vertebrados: una revisión para ecólogos. Funct Ecol. (2008) 22:760–72. doi: 10.1111/j.1365-2435.2008.01467.x
29. Hickman, DL . Evaluación de la relación neutrófilos:linfocitos como indicador de distrés crónico en el ratón de laboratorio. Lab Anim (Nueva York). (2017) 46:303–7. doi: 10.1038/laban.1298
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Kumar, P, Ahmed, MA, Abubakar, AA, Hayat, MN, Kaka, U, Ajat, M, et al. Mejora del estado de bienestar animal y la calidad de la carne a través de la evaluación de biomarcadores de estrés: una revisión crítica. Ciencia de la carne. (2023) 197:109048. doi: 10.1016/j.meatsci.2022.109048
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Campbell, TW, y Krystan, RG. Hematología y citología de animales exóticos. Quinta ed. Hoboken, NJ: Wiley-Blackwell, Estados Unidos (2022). 696p págs.
32. Stacy, NI, Hollinger, C, Arnold, JE, Pendl, H, Nelson, PJ, y Harvey, JW. Desplazamiento a la izquierda y cambio tóxico en heterófilos y neutrófilos de vertebrados no mamíferos: una revisión comparativa, atlas de imágenes y consideraciones prácticas. Veterinario Clin Pathol. (2022) 51:18–44. doi: 10.1111/vcp.13117
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Thrall, MA, Weiser, G, Allison, RW, y Campbell, TW. Hematología y Bioquímica Clínica Veterinaria. 2ª ed. São Paulo: Rocca (2015). 688p págs.
34. Souza, APO, Soriano, VS, Schnaider, MA, and Molento, CFM. Development and refinement of three animal-based broiler chicken welfare indicators. Anim Welf. (2018) 27:263–74. doi: 10.7120/09627286.27.3.263
35. Cirule, D, Krama, T, Vrublevska, J, Rantala, MJ, y Krams, I. Un efecto rápido de la manipulación en los recuentos de glóbulos blancos en un ave paseriforme invernante: ¿una medida más práctica del estrés? J Ornithol (2012. (2012) 153:161–6. doi: 10.1007/s10336-011-0719-9
36. Vasdal, G, Gebhardt-Henrich, SG, Tahamtani, F, y Kittelsen, KE. Uso de percas en reproductoras comerciales de pollos de engorde: preferencia por el material de perca y efecto de la edad. Appl Anim Behav Sci. (2022) 253:105680. doi: 10.1016/j.applanim.2022.105680
37. Souza, APO, Wemelsfelder, F, Taconeli, CA, y Molento, CFM. Desarrollo de una lista de términos en portugués brasileño para la evaluación cualitativa del comportamiento de pollos de engorde. Anim Welf. (2021) 30:49–59. doi: 10.7120/09627286.30.1.049
38. Clark, P, Boardman, W, y Raidal, S. Atlas de hematología aviar clínica. Chichester: Wiley-Blackwell (2009). 200p p.
39. Cotter, PF . Un examen de la utilidad de las proporciones heterófilos-linfocitos en la evaluación del estrés de las gallinas enjauladas. Poult Sci. (2015) 94:512–7. doi: 10.3382/ps/peu009
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Equipo central de R . R: Un lenguaje y un entorno para la computación estadística. Viena, Austria: R Foundation for Statistical Computing (2023).
41. Christensen, R. H. B. (2022). Ordinal: modelos de regresión para datos ordinales. Versión del paquete R. Disponible en: https://CRAN.R-project.org/package=ordinal
42. Højsgaard, S, Halekoh, U, y Yan, J. El paquete R geepack para ecuaciones de estimación generalizadas. J Stat Softw. (2006) 15:1–11. doi: 10.18637/jss.v015.i02
43. Lenth, R. (2023). _emmeans: Medias marginales estimadas, también conocidas como Means_ de mínimos cuadrados. Paquete de R versión 1.8.9. Disponible en: https://CRAN.R-project.org/package=emmeans
44. Federici, JF, Vanderhalsset, R, Sans, ECO, Tuyttens, FAM, Souza, APO, y Molento, CFM. Evaluación del bienestar de los pollos de engorde en el sur de Brasil. Braz J Poult Sci. (2016) 18:133–40. doi: 10.1590/18069061-2015-0022
45. Ferraz, PFP, González, VC, Ferraz, GAS, Damasceno, FA, Osorio, JAS, y Conti, L. Evaluación de la variabilidad espacial de las variables ambientales de un galpón típico de gallinas ponedoras en Colombia: caso del estado de Antioquia. Agron Res. (2020) 18:1244–54. doi: 10.15159/AR.20.099
46. Nääs, IA, Garcia, RG, Baracho, MS, y Bichara, T. Ambiência para frangos de corte En: M Macari, AA Mendes, JF Menten, e IA Nääs, editores. Produção de frangos de corte. Campinas: Facta (2014). 111–32.
47. Rault, JL, Clark, K, Groves, PJ y Cronin, GM. Intensidad de luz de 5 o 20 lux en el comportamiento, bienestar y productividad de los pollos de engorde. Poult Sci. (2017) 96:779–87. doi: 10.3382/ps/pew423
48. Coelho, DJR, Tinôco, IFF, Souza, CF, Baptista, FJF, Barbari, M, y Oliveira, KP. Ambiente térmico de gallinero con paredes de mampostería en la etapa inicial de vida de pollos de engorde. Rev Bras Eng Agríc Ambient. (2019) 23:203–8. doi: 10.1590/1807-1929/agriambi.v23n3p203-208
49. Bonizzi, L, and Roncada, P. Welfare and immune response. Vet Res Commun. (2007) 31:97–102. doi: 10.1007/s11259-007-0073-9
50. Ménard, C, Pfau, ML, Hodes, GE y Russo, SJ. Mecanismos inmunológicos y neuroendocrinos del estrés, la vulnerabilidad y la resiliencia. Neuropsicofarmacología. (2017) 42:62–80. doi: 10.1038/npp.2016.90
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Staley, M, Conners, MG, Hall, K, y Miller, LJ. Vinculación del estrés y la inmunidad: la inmunoglobulina a como biomarcador fisiológico no invasivo en estudios de bienestar animal. Horm Compórtate. (2018) 102:55–68. doi: 10.1016/j.yhbeh.2018.04.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Birhan, M . Revisión sistemática sobre sistemas inmunes aviares. J Life Sci Biomed. (2019) 9:145–52. doi: 10.36380/scil.2019.jlsb23
53. Martín, LB . Estrés e inmunidad en vertebrados salvajes: el tiempo lo es todo. Gen Comp Endocrinol. (2009) 163:70–6. doi: 10.1016/j.ygcen.2009.03.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Messina, S, Edwars, DP, Eens, M, y Constantini, D. Respuestas fisiológicas e inmunológicas de aves y mamíferos a la degradación forestal: un meta-análisis. Biol Conserv. (2018) 224:223–9. doi: 10.1016/j.biocon.2018.06.002
55. Wlazlak, S, Pietrzak, E, Biesek, J y Dunisławska, A. Modulación del sistema inmunológico de los pollos: un factor clave en el mantenimiento de la producción avícola: una revisión. Poult Sci. (2023) 102:102785. doi: 10.1016/j.psj.2023.102785
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Kallam, NRK y Sejian, V. Salud intestinal e inmunidad en la mejora de la producción avícola. En: Avances en la Investigación en Nutrición Avícola. Intech (2021). págs. 1-21.
57. Jankowski, J, Tykałowski, B, Stępniowska, A, Konieczka, P, Koncicki, A, Matusevičius, P, et al. Parámetros inmunológicos en pollos tratados con antibióticos y probióticos durante los primeros años de vida. Animales. (2022) 12:1133. doi: 10.3390/ani12091133
Resumen de PubMed | Texto completo de Crossref | Google Académico
58. Zhang, J, Wang, J, Wang, Q, Cui, H, Ding, J, Wang, Z, et al. Bases inmunogenéticas de la proporción de heterófilos a linfocitos de pollo reveladas por el análisis de variantes indel de todo el genoma. J Integr Agric. (2023) 22:2810–23. doi: 10.1016/j.jia.2022.12.012
59. Siegel, PB, y Gross, WB. Principios generales del estrés y el bienestar En: T Grandin editor. Manejo y transporte de ganado. Wallingford, Reino Unido: CAB International (1993). 21–34.
60. Krams, I, Vrublevska, J, Cirule, D, Kivleniece, I, Krama, T, Rantala, MJ, et al. La relación heterófilos/linfocitos predice la magnitud de la respuesta inmune humoral a un nuevo antígeno en carboneros comunes (Parus major). Comp Biochem Physiol A Mol Integr Physiol. (2012) 161:422–8. doi: 10.1016/j.cbpa.2011.12.018
Resumen de PubMed | Texto completo de Crossref | Google Académico
61. Weeks, CA, Danbury, TD, Davies, HC, Hunt, P, y Kestin, SC. El comportamiento de los pollos de engorde y su modificación por cojera. Appl Anim Behav Sci. (2000) 67:111–25. doi: 10.1016/S0168-1591(99)00102-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
62. Bailie, CL, Ball, MEE y O’Connell, NE. Influencia de la provisión de luz natural y balas de paja en los niveles de actividad y la salud de las patas en pollos de engorde comerciales. Animal. (2013) 7:618–26. doi: 10.1017/S1751731112002108
Resumen de PubMed | Texto completo de Crossref | Google Académico
63. Fries, G. R. (2014). O papel da resiliência celular, estresse e epigenética na patofisiologia, progressão e resposta ao tratamento nos transtornos de humor. [Tesis de maestría], Universidade Federal do Rio Grande do Sul. Instituto de Ciências Básicas da Saúde, Programa de Pós-graduação em Ciências biológicas: Bioquímica, Porto Alegre, RS.
64. Stertz, L, Fries, GR, Rosa, AR, Kauer-Sant’anna, M, Ferrari, P, Paz, AVC, et al. Patrones moleculares asociados al daño y activación inmune en el trastorno bipolar. Acta Psychiatr Scand. (2015) 132:211–7. doi: 10.1111/acps.12417
Resumen de PubMed | Texto completo de Crossref | Google Académico
66. Campo, JL, y Dávila, SG. Estimación de la heredabilidad de la relación heterófilo: linfocitos en pollos por probabilidad máxima restringida: efectos de la edad, el sexo y el cruzamiento. Poult Sci. (2002) 81:1448–53. doi: 10.1093/ps/81.10.1448
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: bienestar animal, hematología, heterófilos, inflamación, leucocitos, linfocitos
Cita: Ribeiro LRR, Sans ECO, Santos RM, Taconelli CA, de Farias R y Molento CFM (2024) ¿Lo dirán los glóbulos blancos? Una herramienta potencialmente novedosa para evaluar el bienestar de los pollos de engorde. Frente. Vet. Sci. 11:1384802. doi: 10.3389/fvets.2024.1384802
Recibido: 10 de febrero de 2024; Aceptado: 03 de junio de 2024;
Publicado: 02 julio 2024.
Editado por:
Jesús R. Requena, Universidad de Santiago de Compostela, España
Revisado por:
Arlene García, Universidad Tecnológica de Texas, Estados
Unidos Leonie Jacobs, Virginia Tech, Estados Unidos
Copyright © 2024 Ribeiro, Sans, Santos, Taconelli, de Farias y Molento. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Laura Raquel Ríos Ribeiro, laura.ribeiro@ufpr.br
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

