Los adyuvantes influyen en las poblaciones de células inmunitarias presentes en el lugar de la inyección granuloma inducido por vacunas de paratuberculosis
Los adyuvantes influyen en las poblaciones de células inmunitarias presentes en el lugar de la inyección granuloma inducido por vacunas de paratuberculosis inactivadas de células enteras en ovejas
 Miguel Criado1,2*
Miguel Criado1,2*  Luis E. Reyes1
Luis E. Reyes1  Juan F. García Marín1,2
Juan F. García Marín1,2  Daniel Gutiérrez-Expósito1,2
Daniel Gutiérrez-Expósito1,2  David Zaico1,2
David Zaico1,2  José Espinosa1,2
José Espinosa1,2  Valentín Pérez1,2
Valentín Pérez1,2- 1Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad de León, León, España
- 2Instituto de Ganadería de Montaña (CSIC-ULE), Finca Marzanas-Grulleros, León, España
La vacunación es la herramienta más eficaz para el control de la paratuberculosis. En la actualidad, las vacunas disponibles previenen la progresión de la enfermedad clínica en la mayoría de los animales, pero no los protegen completamente contra la infección e inducen la formación de un granuloma en el lugar de la inyección. Los mecanismos precisos que operan en respuesta a la vacunación y al desarrollo de granulomas, así como el efecto que podrían desencadenar los adyuvantes, no se han investigado completamente. Por lo tanto, este estudio tuvo como objetivo investigar los granulomas inducidos en el lugar de la inyección por dos vacunas paratuberculosas inactivadas, que difieren en el adyuvante empleado. Dos grupos de corderos de 45 días de edad fueron inmunizados con dos vacunas disponibles comercialmente: una (n = 4) con Gudair y la otra (n = 4) con Silirum. Un tercer grupo (n = 4) no fue vacunado y sirvió como control. La respuesta humoral periférica se evaluó a lo largo del estudio mediante un ELISA indirecto comercial contra el anti-Mycobacterium avium subespecie paratuberculosis (MAP), y la respuesta inmunitaria celular se evaluó de manera similar mediante la liberación de IFN-γ y pruebas intradérmicas comparativas. Los granulomas en el lugar de la inyección se midieron durante el experimento y se tomaron muestras a los 75 días después de la vacunación (dpv) cuando los animales fueron sacrificados. A continuación, se determinó y evaluó el daño tisular, la distribución de antígenos y adyuvantes, así como la presencia y cantidad de células inmunitarias mediante métodos inmunohistoquímicos. Anticuerpos contra antígenos Map; un marcador general de macrófagos (Iba1), M1 (iNOS) y M2 (CD204); Se emplearon linfocitos T (CD3), B (CD20) y γδ T, proteínas MHC-II y NRAMP1, y citocinas IL-4, IL-10, TNF e IFN-γ. Silirum provocó una respuesta inmunitaria celular periférica más fuerte que Gudair, mientras que este último indujo granulomas más grandes y más daño tisular en el lugar de la inyección. Además, la distribución del antígeno adyuvante y Map a lo largo del infiltrado inflamatorio granulomatoso, así como la expresión de la célula NRAMP1, que está relacionada con la fagocitosis del antígeno, fueron muy irregulares. En los granulomas inducidos por Silirum, un mayor número de células que expresan MHC-II y TNF y un menor número de macrófagos M2 sugirieron una mejor presentación de antígenos, lo que podría deberse a la mejor distribución de antígenos y a la reducción del daño tisular inducido por esta vacuna.®®®®®
1 Introducción
La paratuberculosis (PTB) es una enfermedad infecciosa crónica causada por Mycobacterium avium subsp. paratuberculosis (Map) caracterizada por enteritis granulomatosa. Afecta a rumiantes de todo el mundo y está relacionada con importantes pérdidas económicas (1). El largo período de incubación y el carácter subclínico de esta enfermedad, junto con la falta de pruebas diagnósticas de alta sensibilidad, dificultan enormemente la detección de animales infectados (2). Las medidas de control basadas en pruebas y sacrificio han demostrado ser costosas y no del todo exitosas (3). Por lo tanto, la vacunación se considera el procedimiento de control más eficiente en términos de costo-beneficio (4).
En este momento, solo se dispone comercialmente de vacunas inactivadas para el control del PTB. Gudair y Silirum, producidos por Zendal (Porriño, España), están aprobados para su uso en pequeños rumiantes y bovinos, respectivamente. Mycopar, fabricado por Boehringer Ingelheim Vetmedica Inc., ha sido descontinuado recientemente (2019) en los Estados Unidos (5). Estas vacunas se administran por vía subcutánea y presentan varias desventajas, ya que todas inducen una inflamación crónica granulomatosa grave en el lugar de la inyección (6-8) e interfieren con las pruebas diagnósticas de tuberculosis (9, 10). A pesar de que reducen los signos clínicos, la excreción bacteriana y las pérdidas económicas en el rebaño o manada, no previenen la infección por Map y no brindan una protección completa para todos los animales vacunados (11, 12). La formación de granulomas se ha atribuido principalmente a los aceites minerales empleados como coadyuvantes en estas vacunas, cuyo objetivo es producir una emulsión con las bacterias y poder inducir una respuesta inmune fuerte y eficaz (13). Sin embargo, debido a su limitada biodegradabilidad y baja biocompatibilidad, pueden persistir durante largos períodos de tiempo, desencadenando una respuesta inmunitaria crónica con el reclutamiento de macrófagos. Como efecto secundario, aparece un granuloma en el lugar de la inyección, lo que afecta al bienestar animal, a la calidad de la canal e incluso a la investigación biomédica (7, 14). Sin embargo, estos granulomas están poco estudiados, no solo en las vacunas PTB, sino en todas las vacunas con coadyuvante de aceite.®®®
Se cree que el mecanismo principal detrás de los adyuvantes a base de aceite es la liberación lenta del antígeno en el lugar de la inyección (efecto depósito) (15, 16). La inducción exitosa de la memoria inmunológica comienza allí, con la activación local del sistema inmune innato. Después de la inyección, las células inmunitarias residentes activadas producen citocinas y quimiocinas proinflamatorias, que inducen el reclutamiento de otras células inmunitarias, incluidas las células presentadoras de antígenos (APC). Después de la maduración, las APC que expresan niveles más altos del complejo mayor de histocompatibilidad clase II (MHC-II) y otras moléculas coestimuladoras migran a los ganglios linfáticos drenantes, donde activan potentes respuestas de células B y/o células T secretoras de anticuerpos. Los adyuvantes facilitan la mayoría de los pasos de este proceso, pero los mecanismos particulares que determinan el efecto de los diferentes adyuvantes son poco conocidos (16, 17).
Por lo tanto, la caracterización de las poblaciones celulares presentes en el sitio de inoculación de la vacuna es crucial para comprender el desarrollo de los granulomas en el sitio de inyección (18) y el establecimiento de la respuesta inmune después de la vacunación (19). Los macrófagos son el componente principal de cualquier lesión granulomatosa (20), y su papel como APC es esencial en el desarrollo de la respuesta inmune (21, 22). Los macrófagos presentan una plasticidad extraordinaria y se han clasificado tradicionalmente en tipos M1 (activados clásicamente) y M2 (activados alternativamente), en una analogía con las respuestas de citoquinas Th1 y Th2 de las células T CD4+ (23-25). Las células M1 son activadas principalmente por interferón-γ (IFN-γ), mientras que las células M2 son activadas por interleucinas 4 y 10 (IL-4 e IL-10) (23). Se pueden distinguir por la expresión de diferentes marcadores, que pueden ser funcionales, como la óxido nítrico sintasa inducible (iNOS) y el factor de necrosis tumoral α (TNF) para los macrófagos M1 o proteínas de membrana como CD204 para los macrófagos M2. Sin embargo, esta clasificación, establecida in vitro, es bastante simplista y anticuada, y se está identificando una gama más amplia de diferenciaciones y funciones (26, 27). Los macrófagos también expresan de forma variable el complejo mayor de histocompatibilidad (MHC) de clase II, una molécula esencial para iniciar las respuestas inmunitarias. El MHC de clase II también se expresa en células dendríticas, monocitos y linfocitos B, que son otros APC principales en el sistema inmunológico de la piel (28, 29). Otra proteína esencial expresada por los macrófagos es la proteína 1 de macrófagos asociada a la resistencia natural (NRAMP1), una proteína integral de la membrana del lisosoma que es objetivo del fagosoma que contiene antígenos (30) y se ha relacionado con la resistencia contra infecciones por micobacterias (31). Por otro lado, los linfocitos juegan un papel secundario en el desarrollo de granulomas y están influenciados por el entorno de citoquinas generado por los macrófagos activados. Además, también se supone que las células T Th1 y Th2 afectan a la polarización de los macrófagos hacia los perfiles M1 y M2, respectivamente (32).
En el presente estudio, empleamos dos de las vacunas actualmente aprobadas contra el PTB, que fueron formuladas con el mismo antígeno (cepa 316F de Map inactivada) pero con diferentes adyuvantes: Gudair emplea un adyuvante de aceite mineral y Silirum un adyuvante de agua en aceite en agua (W/O/W), constituido por aceites minerales biocompatibles orgánicos y más refinados. La evaluación histopatológica de las características patológicas de los nódulos vacunales, principalmente la respuesta inflamatoria, la necrosis y el daño tisular inducido por estas vacunas en el punto de inoculación, es de gran interés. Dado que estas vacunas a base de aceite inducen daños tisulares graves, los patrones moleculares asociados al daño (DAMP) también son de igual interés. Estas moléculas se pueden encontrar en las células normales y se liberan bajo daño tisular o estrés; por lo tanto, podrían desempeñar un papel importante en la adyuvancia (33). Además, estos adyuvantes no solo actúan como inmunomoduladores, sino también como sistemas de administración, influyendo en la distribución del antígeno (34).®®
El objetivo de este estudio es evaluar y comparar las características histopatológicas, la distribución de antígenos y las células inmunes presentes en los granulomas inducidos por dos vacunas diferentes de PTB a los 75 días post-vacunación (dpv) en el sitio de inoculación subcutánea en la especie ovina. El estudio también se centra en el efecto de estos granulomas en las respuestas inmunitarias periféricas humorales y celulares específicas asociadas con la vacunación en este momento.
2 Materiales y métodos
2.1 Animales y diseño experimental
En este estudio se utilizaron un total de doce corderos de 1,5 meses de edad de la raza Churra. Los animales fueron seleccionados aleatoriamente y adquiridos de un rebaño comercial en el que no se habían reportado casos clínicos de TBP ni de ninguna otra enfermedad relevante en los últimos 5 años y se mantuvieron en las instalaciones experimentales del Instituto de Ganadería de Montaña CSIC-ULE (Grulleros, España) durante todo el experimento. Los corderos y sus madres dieron negativo para el ELISA de anticuerpos contra el PTB utilizando el kit comercial ID Screen Paratuberculosis Indirect (IDvet, Gabrels, Francia) y para el ensayo de liberación de γ de interferón γ (IFN- (IGRA), el kit de tuberculosis BOVIGAM™ (Thermo Fisher Scientific, Waltham, EE. UU.) (35). Después de 2 semanas de un período de adaptación, se dividieron en tres grupos, compuestos por cuatro animales cada uno. Todos los animales seguían una dieta basada en heno de hierba ad libitum, suplementada con un pienso compuesto convencional racionado, y tenían libre acceso al agua.®
La manipulación de los animales y la recogida de muestras se realizaron de acuerdo con la legislación de la Unión Europea (Ley 6/2013) relativa a los animales, su explotación, transporte, experimentación y sacrificio, el Real Decreto 118/2021 para la protección de los animales empleados en la investigación y la enseñanza, la Directiva 2010/63/UE, relativa a la protección de los animales utilizados con fines científicos. Todos los procedimientos fueron aprobados por el organismo de bienestar animal correspondiente (OEBA) y la Consejería de Agricultura y Ganadería de la Junta de Castilla y León (código de autorización ULE-02-2021). Todos los animales utilizados en este estudio fueron manejados en estricta conformidad con las buenas prácticas clínicas, y se hicieron todos los esfuerzos para minimizar el sufrimiento.
2.2 Vacunas e inoculación
Los animales pertenecientes al primer grupo (n = 4) fueron inoculados con Gudair (Zendal, Porriño, España), que utiliza el aceite mineral Marcol®TM 52 (ExxonMobil, Irving, TX, EE. UU.) en una doble suspensión estable, y la cepa 316F Map inactivada por calor, una deformación atenuada, a una concentración de 2,5 mg/ml. El segundo grupo (n = 4) fue vacunado con Silirum (Zendal, Porriño, España), que utiliza el mismo antígeno y cantidad, pero un adyuvante de agua en aceite en agua (W/O/W) del Montanide®TM Gama ISA (Seppic S.A., París, Francia), formada por una mezcla de aceite mineral y metabolizable. La inoculación se realizó a los 45 días de edad, con una dosis única de 1 ml de cada vacuna respectiva, por vía subcutánea en la región caudolateral derecha del cuello. Finalmente, el resto de los animales constituyeron el grupo control no vacunado (n = 4).
2.3 Examen clínico y toma de muestras
La toma de muestras de sangre se realizó a 0 dpv, 15 dpv, 30 dpv y 75 dpv. En cada ocasión, se tomaron dos muestras de sangre yugular en tubos Vacutainer (Becton Dickinson, Reino Unido), una en un tubo de 5 ml sin aditivos para obtener suero y otra en un tubo de 10 ml con heparina.
A 1 dpv, 2 dpv, 7 dpv, 15 dpv, 21 dpv, 30 dpv y 75 dpv, los animales se sometieron a examen clínico y se midió el nódulo en el lugar de la inyección con un calibrador (largo y ancho) y se evaluó, verificando la consistencia, los signos de dolor, la textura superficial y la presencia de adherencias o ulceración.
A 75 dpv, los corderos fueron sacrificados humanamente mediante sedación profunda con xilacina (Xilagesic, Calier, Barcelona, España) y posterior inyección intravenosa de embutramida, yoduro de mebezonio y clorhidrato de tetracaína (T61, MSD Animal Health), seguida de exanguinación. Se realizó una necropsia completa y se tomó el nódulo en el lugar de la inyección (excepto en los animales del grupo control, donde estaba ausente) de todos los animales para su examen histopatológico e inmunohistoquímico. Las muestras de tejido se fijaron en formalina tamponada neutra al 10% y se deshidrataron a través de una serie de alcohol graduado antes de ser incrustadas en cera de parafina.®®
2.4 Determinación de la respuesta inmune humoral mediante ELISA indirecto
Se empleó la prueba ELISA ID Screen Paratuberculosis Indirect (IDvet, Gabrels, Francia) para medir los niveles de anticuerpos específicos en los sueros obtenidos de las muestras de sangre sin anticoagulante. La prueba se realizó siguiendo las instrucciones del fabricante y, para su interpretación, la densidad óptica se midió espectrofotométricamente a una longitud de onda de 450 nm (OD®450), y los resultados se expresaron como un cociente entre la media de DO450 de cada suero de muestra duplicados y la media de DO450 de los sueros de control positivo duplicados en cada placa.
2.5 Ensayo de liberación de interferón γ
Para cada animal, dentro de las 3 h posteriores a la extracción de sangre, se incubaron dos alícuotas de 1,5 ml de las muestras de sangre heparinizadas en placas estériles de 24 pocillos con 100 μl de solución salina estéril tamponada con fosfato (PBS) o un antígeno derivado de proteína purificada aviar (PPDa) (CZ Veterinaria, Porriño, España), a una concentración final de 20 μg/ml. Después de la incubación (20 h a 37 °C), las placas se centrifugaron a 750 g durante 15 min, y el plasma se recolectó y almacenó a -20 °C (36-38). A continuación, se llevó a cabo el ensayo para la determinación de IFN-γ BOVIGAM TB Kit (Thermo Fisher Scientific, Waltham, EE.UU.) siguiendo las instrucciones del fabricante, interpretadas como se ha descrito anteriormente (37), y los resultados se expresaron como un cociente entre la DO media del plasma estimulado por PPDa y la DO media del mismo plasma incubado con PBS.®
2.6 Prueba intradérmica comparativa
La prueba intradérmica comparativa se realizó a 75 dpv. Tras medir los pliegues caudales con un cutimeter, se inyectaron 0,1 ml de PPDa (CZ Veterinaria, Porriño, España) y 0,1 ml de derivado proteico purificado bovino (PPDb) (CZ Veterinaria, Porriño, España), obtenidos a partir de 2500 UI de Mycobacterium avium cepa D4 y Mycobacterium bovis cepa AN-5 respectivamente en los pliegues caudales izquierdo y derecho. Después de 72 h, se volvieron a medir los pliegues y los resultados se expresaron como la diferencia entre esta medición y el espesor inicial en mm.
2.7 Histopatología
Para la evaluación histopatológica del nódulo en el lugar de la inyección, se tiñeron secciones de 3 μm de espesor con hematoxilina y eosina (HE) y con el método de Ziehl-Neelsen para la detección de bacilos acidorresistentes (AFB) y se examinaron bajo un microscopio óptico por dos patólogos veterinarios (MC y VP), ciegos a la identificación del animal.
2.8 Inmunohistoquímica
Los estudios inmunohistoquímicos de cada nódulo de vacunación se realizaron en secciones de tejido de 3 μm de espesor, colocadas en portaobjetos recubiertos de poli-L-lisina (portaobjetos SuperFrost Plus Adhesion -Thermo Fisher Scientific, Waltham, EE.UU.-). Después de la desparafinación e hidratación, las secciones se lavaron dos veces con tampón de lavado (Agilent Technologies, Santa Clara, EE. UU.) durante 5 min. A continuación, la peroxidasa endógena se bloqueó mediante la inmersión de las secciones en un H al 3 %2O2 en metanol durante 30 min en oscuridad a temperatura ambiente, lavado nuevamente, y la recuperación de antígeno se realizó mediante métodos basados en calor o enzimáticos, como se indica en la Tabla 1. Después de lavar dos veces, las secciones se incubaron con los anticuerpos primarios (enumerados en la Tabla 1), diluidos en diluyente de anticuerpos (Agilent Technologies, Santa Clara, EE. UU.), durante la noche a 4 °C en una cámara humidificada. Después del lavado, las secciones se incubaron durante 40 min a temperatura ambiente con el anticuerpo monoclonal o policlonal apropiado y el polímero marcado con peroxidasa de rábano picante (Agilent Technologies, Santa Clara, EE. UU.). A continuación, se determinó la localización de anticuerpos utilizando 3,3-diaminobenzidina (Agilent Technologies, Santa Clara, EE.UU.) como sustrato cromogénico de la peroxidasa. Las secciones se contratiñeron con hematoxilina de Mayer durante 10 s. Se utilizaron inmunoglobulinas apropiadas de especies e isotipos como controles negativos. Dependiendo del anticuerpo empleado, se utilizaron ganglios linfáticos de ovejas sanas o válvulas ileocecales de ovejas infectadas con Map como controles positivos.
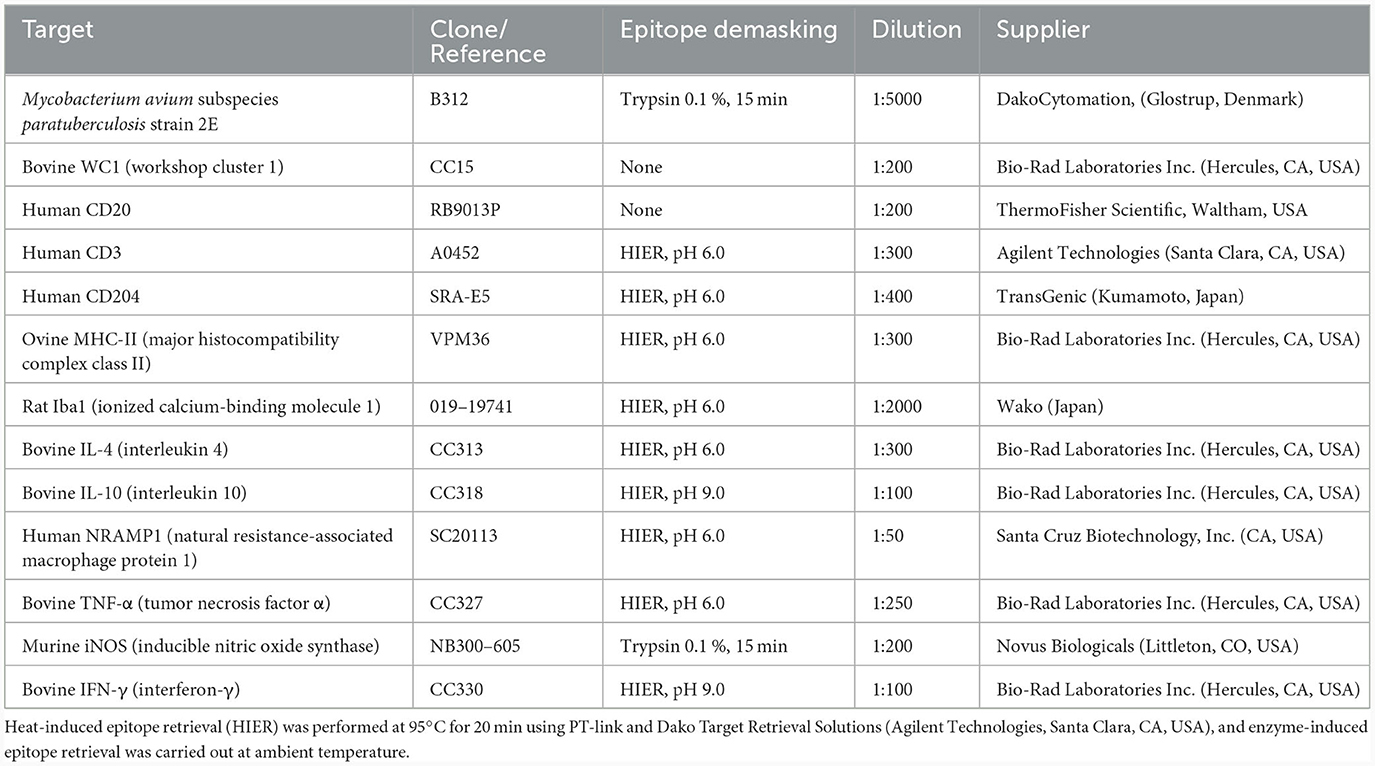 Tabla 1. Anticuerpos primarios, técnica de desenmascaramiento y dilución utilizados para inmunohistoquímica.
Tabla 1. Anticuerpos primarios, técnica de desenmascaramiento y dilución utilizados para inmunohistoquímica.
La distribución del antígeno Map se evaluó cualitativamente. En cuanto a las células inmunomarcadas positivamente para los diferentes marcadores, se evaluó su distribución en cada sección y se determinó un enfoque adecuado para el recuento celular para cada marcador. Los recuentos se realizaron en las áreas de inflamación granulomatosa, evitando la cápsula de tejido conectivo de los granulomas, así como las áreas necróticas. Los recuentos se realizaron en diez campos seleccionados aleatoriamente a 400 aumentos (campos de alta potencia -HPF-). En el caso de las secciones inmunoteñidas con el anticuerpo del grupo taller (WC) 1, se evaluaron 30 campos por portaobjetos, dada la escasez de linfocitos T γδ WC1+. Además, las células CD20+ se distribuyeron por todo el tejido inflamatorio en cantidades bajas, pero formaron una capa densa alrededor de la mayoría de los granulomas; Por lo tanto, se contaron diez campos en cada una de estas áreas.
Las micrografías se tomaron con el microscopio Nikon Eclipse E600, junto con una cámara digital Nikon DS-Fi1. Las imágenes son representativas de los granulomas inducidos por cada vacuna, a menos que se especifique lo contrario. El recuento celular y el análisis de imágenes se realizaron utilizando el software de procesamiento y análisis Image J (US National Institutes of Health, Bethesda, Maryland). La evaluación de todas las inmunotinciones fue realizada de forma independiente por dos patólogos (MC y VP), y los resultados discordantes se revisaron con un microscopio multicéfalo para llegar a un consenso.®®
2.9 Análisis estadístico
Los resultados de los diferentes parámetros analizados (ELISA de anticuerpos, datos de las pruebas IGRA y CID, tamaño de los nódulos de vacunación y recuentos inmunohistoquímicos) según los diferentes tipos de vacunas inoculadas y dpv, se presentan como medias y desviación estándar, calculados mediante procedimientos estadísticos descriptivos convencionales y representados por gráficos de barras y líneas. Se utilizó la prueba de Shapiro-Wilk para evaluar la normalidad de los datos. Se utilizaron pruebas paramétricas y no paramétricas dependiendo de la naturaleza de los datos.
En concreto, se utilizaron ANOVAs de medidas repetidas de dos vías para analizar el efecto de las diferentes vacunas sobre los niveles de anticuerpos, la respuesta al IFN-γ y la evolución del tamaño de los nódulos a lo largo del estudio. Cuando se detectó una interacción estadísticamente significativa entre la vacuna y el tiempo sobre el parámetro estudiado, se analizó el efecto de la vacuna en cada punto temporal. Se utilizaron análisis post-hoc, con un ajuste de Bonferroni, para revelar las diferencias significativas por pares entre los grupos y los puntos temporales. Se utilizó un ANOVA de un factor para analizar los resultados de la prueba CID. Se detectaron diferencias significativas en el aumento del grosor del pliegue caudal en función de la DPP empleada, y para el análisis post-hoc se utilizó la prueba HSD de Tukey para comparaciones múltiples. Además, se aplicó la prueba de correlación de Pearson para evaluar la relación entre los niveles de anticuerpos y los resultados de IGRA. Para el análisis de los recuentos celulares inmunohistoquímicos, se empleó la prueba U de Mann-Whitney (en el caso de los linfocitos T MHC-II, Iba1, iNOS, CD3, IL-4, IFN-γ y WC1 γδ) y la prueba t no apareada (linfocitos CD204, NRAMP1 y CD20) para identificar las diferencias estadísticamente significativas según la vacuna empleada. P < 0,05 se consideraron estadísticamente significativos. En las diferentes pruebas estadísticas se utilizaron los paquetes estadísticos rstatix, ggpubr, forcats, stringr, dplyr, purrr, readr, tidyr, tibble, ggplot2 y tidyverse. Todos los análisis estadísticos se realizaron con el software R versión 4.1.3 (39).
3 Resultados
3.1 Desarrollo del nódulo de vacunación, progresión clínica y patología macroscópica
Aparte del desarrollo de un nódulo en el lugar de la inyección, ninguno de los animales mostró ningún signo clínico o reacción adversa sistémica a la vacunación durante el experimento.
La evolución del tamaño del nódulo de vacunación se representa en la Figura 1A. Los datos se expresan como la media entre la longitud y la anchura del nódulo en mm. Los nódulos fueron mayores en los animales vacunados con Gudair a lo largo de todo el estudio, aunque esta diferencia solo fue significativa a los 7 (p < 0,01) y a los 21 dpv (p < 0,01). En las primeras 48 h, la evolución clínica del sitio de inoculación fue similar para ambos grupos. A las 24 h se detectó un eritema cutáneo leve y un aumento de la temperatura local. En el segundo día, se observó un engrosamiento difuso de tamaño variable y un aumento de la consistencia en algunos animales en el lugar de la inyección. A partir de entonces, los exámenes clínicos se realizaron semanalmente durante las primeras 4 semanas y luego a los 75 dpv. A continuación se describen el tamaño, la progresión clínica y los hallazgos patológicos macroscópicos de los nódulos de vacunación.®
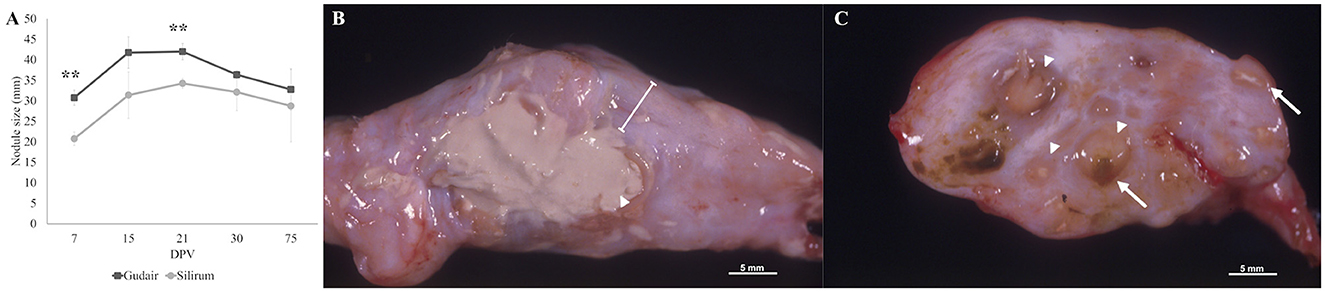 Figura 1. Evolución del tamaño del nódulo en el lugar de la inyección y morfología macroscópica en 75 dpv. (A) El tamaño medio de las barras de error del nódulo en el lugar de la inyección (en mm) representa el error estándar. Se indican diferencias significativas entre los grupos. p < 0,01. (B) Morfología macroscópica de un granuloma inducido por Gudair, donde una gran área de necrosis caseosa está rodeada por una cápsula fibrosa gruesa (línea). (C) Morfología macroscópica de un granuloma inducido por Silirum, compuesto por múltiples pequeños focos inflamatorios de tamaño variable (puntas de flecha) demarcados por tejido conjuntivo, algunos de ellos muestran un centro necrótico (flechas) y/o restos adyuvantes (material de color marrón amarillento).**®®
Figura 1. Evolución del tamaño del nódulo en el lugar de la inyección y morfología macroscópica en 75 dpv. (A) El tamaño medio de las barras de error del nódulo en el lugar de la inyección (en mm) representa el error estándar. Se indican diferencias significativas entre los grupos. p < 0,01. (B) Morfología macroscópica de un granuloma inducido por Gudair, donde una gran área de necrosis caseosa está rodeada por una cápsula fibrosa gruesa (línea). (C) Morfología macroscópica de un granuloma inducido por Silirum, compuesto por múltiples pequeños focos inflamatorios de tamaño variable (puntas de flecha) demarcados por tejido conjuntivo, algunos de ellos muestran un centro necrótico (flechas) y/o restos adyuvantes (material de color marrón amarillento).**®®
En los animales vacunados con Gudair, durante los primeros días, el grosor del nódulo aumentó rápidamente y, a los 15 dpv, los nódulos midieron un promedio de 41,7 mm y su superficie fue ligeramente irregular. En uno de los corderos, el engrosamiento afectaba al tejido muscular subyacente y tenía una base ancha y poco definida. A 21 dpv, la mayoría de los nódulos habían alcanzado su tamaño máximo, con un diámetro medio de 42 mm. A los 30 dpv, los nódulos eran de forma muy irregular, incluso lobulados en uno de los corderos, y uno de ellos desarrolló una fístula que liberó un material necrótico purulento. A los 75 dpv, las fístulas estaban presentes en dos animales y, en consecuencia, el tamaño del nódulo varió considerablemente entre los individuos (20 mm−43,5 mm). En el examen macroscópico post-mortem, los nódulos tenían un aspecto fibroso y áreas extensas de necrosis caseosa distribuidas difusamente (Figura 1B).®
En los animales vacunados con Silirum, a los 7 dpv, los nódulos de vacunación promediaron 20,75 mm. A lo largo de todo el experimento, fueron redondos, bien delimitados, con una superficie regular y una consistencia firme. A 21 dpv, los nódulos alcanzaron su tamaño máximo de una media de 34,25 mm. A los 75 dpv, los nódulos de vacunación eran más pequeños y uno de ellos presentaba una fístula. Macroscópicamente, se presentaron focos necróticos pequeños, múltiples y numerosos de 2 mm−3 mm en todo el nódulo (Figura 1C).®
3.2 Respuesta inmunitaria periférica
3.2.1 Respuesta inmune humoral
La producción de anticuerpos contra Map en los diferentes grupos vacunados a lo largo del experimento se muestra en la Figura 2A. Ambos grupos mostraron un aumento progresivo estadísticamente significativo (p < 0,0001) en los niveles de anticuerpos específicos a lo largo del tiempo, mientras que, para el grupo control, se mantuvieron constantes. Dentro de los grupos, este aumento fue significativo, con respecto a los niveles basales (0 dpv) en los animales vacunados con Gudair a 30 dpv (p < 0,01) y a 75 dpv (p < 0,0001), mientras que en los animales vacunados con Silirum, este aumento solo fue significativo a 75 dpv (p < 0,001). Comparativamente, desde los 15 dpv hasta el final del experimento, el grupo vacunado con Gudair mostró los títulos medios de anticuerpos más altos, y a los 75 dpv, fueron significativamente más altos (p < 0,05) que los animales vacunados con Silirum.®®®®
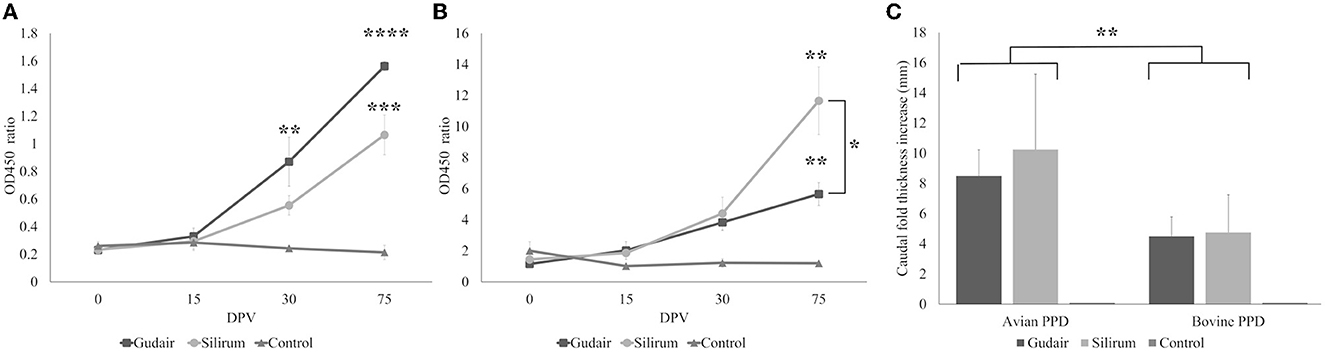 Figura 2. Evolución de la respuesta inmune periférica. Cinética de (A) producción de anticuerpos y (B) interferón-γ liberados en respuesta a la PPD aviar a lo largo del estudio. Los asteriscos indican aumentos significativos dentro de un grupo con respecto a los niveles de 0 dpv; Los corchetes indican diferencias significativas entre los grupos. (C) Los resultados de la prueba intradérmica comparativa (CID), expresados como un aumento en el grosor caudal después de la inoculación con PPD aviares o bovinas, representan diferencias entre PPD. Los resultados se expresan como media. Las barras de error representan el error estándar. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001.
Figura 2. Evolución de la respuesta inmune periférica. Cinética de (A) producción de anticuerpos y (B) interferón-γ liberados en respuesta a la PPD aviar a lo largo del estudio. Los asteriscos indican aumentos significativos dentro de un grupo con respecto a los niveles de 0 dpv; Los corchetes indican diferencias significativas entre los grupos. (C) Los resultados de la prueba intradérmica comparativa (CID), expresados como un aumento en el grosor caudal después de la inoculación con PPD aviares o bovinas, representan diferencias entre PPD. Los resultados se expresan como media. Las barras de error representan el error estándar. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001.
3.2.2 Respuesta inmunitaria celular
Los resultados de la prueba IGRA de los diferentes grupos se muestran en la Figura 2B. Los niveles de IFN-γ mostraron un patrón de evolución similar al de la producción de anticuerpos (coeficiente de correlación = 0,66; p < 0,00001), con un aumento progresivo a lo largo del estudio en ambos grupos vacunados. A los 75 dpv, este incremento fue significativo (p < 0,01), con respecto a los niveles basales (0 dpv) y significativamente mayor en los animales vacunados con Silirum que en Gudair (p < 0,05). No se observaron cambios significativos en el grupo control en ningún momento del estudio.®®
Por otro lado, los resultados de la prueba CID revelaron diferentes respuestas entre los grupos vacunados (Figura 2C). Después de la inyección con PPD bovina y aviar, los dos grupos vacunados mostraron un aumento significativo (p < 0,01) en el grosor del pliegue caudal con respecto al grupo control, en el que la reacción cutánea estuvo ausente. El aumento del grosor del pliegue caudal inducido por PPDa fue significativamente mayor (p < 0,01) que el inducido por PPDb en ambos grupos vacunados. En ambos casos, la respuesta más intensa se observó en los animales vacunados con Silirum, pero esta diferencia no fue significativa (p > 0,05).®
3.3 Estudio de los granulomas en el lugar de la inyección
3.3.1 Hallazgos histopatológicos y distribución de antígenos
En los animales vacunados con Gudair, en el punto de inoculación de la vacuna, se observó una inflamación granulomatosa severa de extensión variable, pero bien delimitada, expandiendo el tejido subcutáneo. Estaba compuesto por abundantes macrófagos y células gigantes de Langhans mezcladas con algunos linfocitos y, en menor medida, neutrófilos que se observaron principalmente alrededor de varios focos necróticos caseosos, en los que eran frecuentes extensas áreas de mineralización. La cantidad de linfocitos y neutrófilos presentes se relacionó inversamente, y la presencia de neutrófilos estuvo en relación directa con el grado de necrosis y daño tisular. La presencia de tejido fibroso fue prominente en todas las lesiones, y no solo en la periferia del área de inflamación granulomatosa, de modo que también se observó encapsulando granulomas más pequeños dentro del área inflamatoria. En los animales cuyos nódulos evolucionaron hasta convertirse en fístula, se observó una cavidad vacía comunicada con el exterior a través de una solución de continuidad en la piel, rodeada de una intensa inflamación granulomatosa y tejido fibroso. Entre el infiltrado inflamatorio se detectaron gotas lipídicas no teñidas. Fueron más grandes y abundantes que en el grupo de Silirum (Figura 3A), y el inmunomarcaje de Map reveló que persistían grandes cantidades de antígeno en algunos de ellos (Figura 3C), en depósitos bien definidos y en los focos necróticos, donde se encontraron los mayores depósitos de antígeno.®®
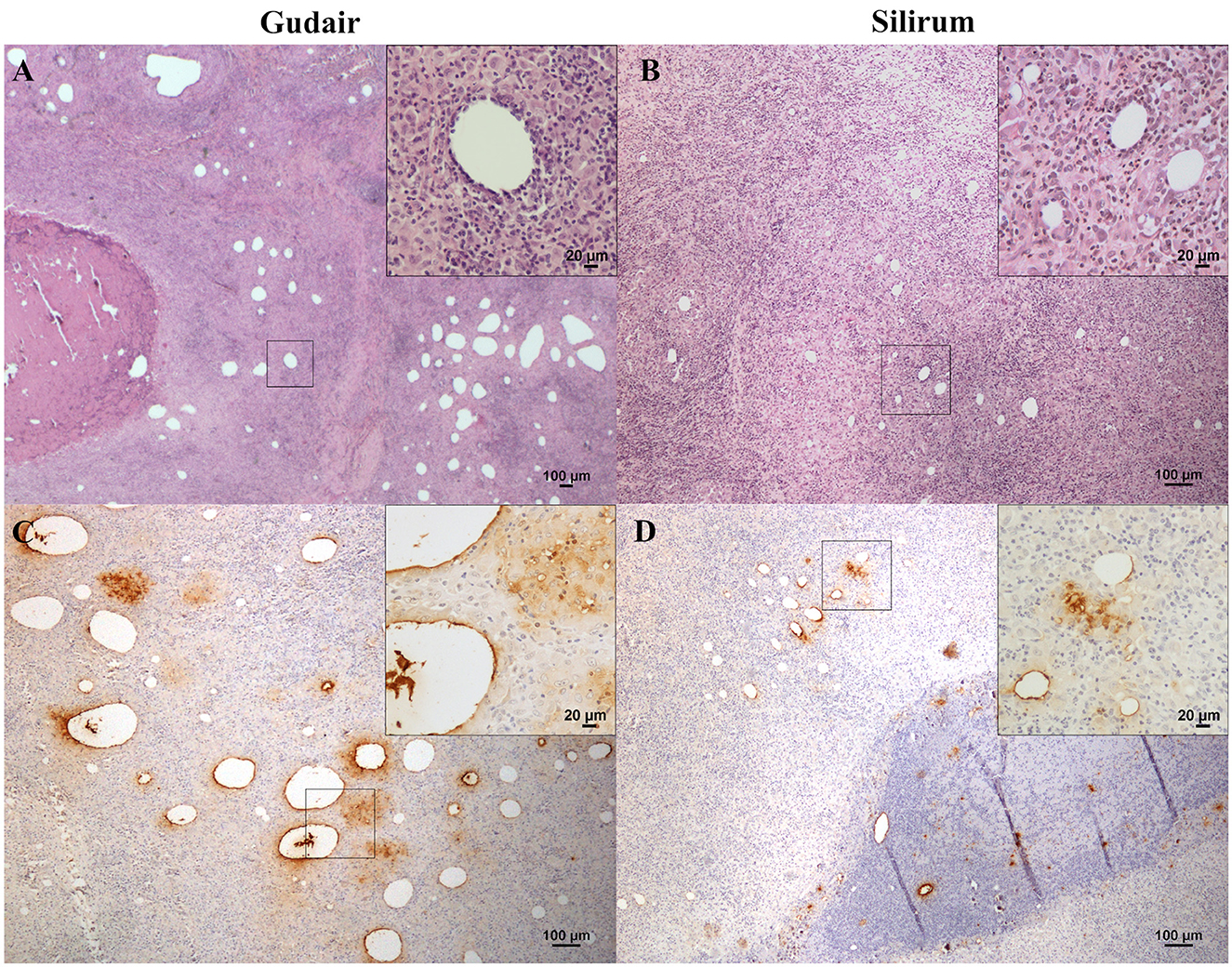 Figura 3. Granulomas inducidos por vacunas, histología y evaluación inmunohistoquímica de la distribución de antígenos. Histología de las lesiones granulomatosas inducidas por (A) Gudair: gotas de tamaño muy variable se distribuyeron por todo el tejido, rodeadas de una reacción inflamatoria compuesta por macrófagos y linfocitos (recuadro). Las áreas granulomatosas están encapsuladas por tejido fibroso. En la esquina izquierda se observa una zona necrótica inducida por la vacuna. (B) Silirum: las gotas de vacuna más pequeñas de tamaño homogéneo se distribuyen por todo el tejido y están rodeadas por tejido granulomatoso de composición celular similar (recuadro). El mapa de inmunohistoquímica antígeno de los granulomas inducidos por (C) Gudair muestra que persisten grandes cantidades de antígeno en y alrededor de algunas de las gotitas de la vacuna, en la esquina superior derecha del recuadro, se pueden ver macrófagos con adyuvante internalizado -material amorfo claro- y/o antígeno -inmunomarcado- y; en el grupo (D) Silirum, se pueden observar gotas más pequeñas y cantidades más bajas de antígeno, detalle en el recuadro. Las cifras son representativas de los granulomas inducidos por cada vacuna.®®®®
Figura 3. Granulomas inducidos por vacunas, histología y evaluación inmunohistoquímica de la distribución de antígenos. Histología de las lesiones granulomatosas inducidas por (A) Gudair: gotas de tamaño muy variable se distribuyeron por todo el tejido, rodeadas de una reacción inflamatoria compuesta por macrófagos y linfocitos (recuadro). Las áreas granulomatosas están encapsuladas por tejido fibroso. En la esquina izquierda se observa una zona necrótica inducida por la vacuna. (B) Silirum: las gotas de vacuna más pequeñas de tamaño homogéneo se distribuyen por todo el tejido y están rodeadas por tejido granulomatoso de composición celular similar (recuadro). El mapa de inmunohistoquímica antígeno de los granulomas inducidos por (C) Gudair muestra que persisten grandes cantidades de antígeno en y alrededor de algunas de las gotitas de la vacuna, en la esquina superior derecha del recuadro, se pueden ver macrófagos con adyuvante internalizado -material amorfo claro- y/o antígeno -inmunomarcado- y; en el grupo (D) Silirum, se pueden observar gotas más pequeñas y cantidades más bajas de antígeno, detalle en el recuadro. Las cifras son representativas de los granulomas inducidos por cada vacuna.®®®®
En los corderos vacunados con Silirum, la presencia de una inflamación granulomatosa, delimitada por el tejido conectivo, también fue una característica típica. Sin embargo, la fibrosis y la necrosis fueron menos extensas, y el componente celular inflamatorio predominó sobre el daño tisular. Las gotas de vacuna más pequeñas, homogéneas y dispersas eran menos abundantes que en el grupo anterior y estaban rodeadas de células epitelioides bien diferenciadas, células gigantes tipo Langhans y un gran número de linfocitos (Figura 3B). Los neutrófilos también estaban presentes en las áreas necróticas encontradas en el centro de los granulomas. Se observaron áreas de mineralización en algunas áreas necróticas. El inmunomarcaje map fue moderado en las gotas de la vacuna (Figura 3D), en las áreas necróticas y también, con frecuencia, en el citoplasma de las células epitelioides y gigantes ubicadas en la periferia de las gotas de la vacuna, lo que denota una intensa actividad fagocítica de estas células.®
La cantidad de bacilos teñidos con el método de Ziehl-Neelsen en las gotitas de la vacuna de ambos grupos fue muy baja, con solo una leve tinción positiva en algunos de ellos (datos no mostrados).
3.3.2 Evaluación inmunohistoquímica de las células inmunitarias presentes en el granuloma en el lugar de la inyección
3.3.2.1 Distribución de las células marcadas
Las células marcadas con la molécula adaptadora de unión al calcio ionizado 1 (Iba1), un marcador general de macrófagos, se observaron en el centro de los granulomas (Figuras 4A, B) y se encontraron en contacto directo con las áreas necróticas o las gotitas de la vacuna. Los macrófagos epitelioides se marcaron intensamente con este marcador, y la mayoría de las células gigantes multinucleadas de tipo Langhans mostraron una tinción más débil. El patrón de tinción fue citoplasmático, pero en el centro de los granulomas y alrededor de algunas gotitas de vacuna, las células también mostraron una intensa tinción membranosa (Figura 4B). El patrón de tinción en las células inmunomarcadas con el anticuerpo CD204 fue citoplasmático y más intenso en los macrófagos epitelioides que rodeaban las gotas de la vacuna y el centro necrótico de los granulomas (Figuras 4C, D). Las células gigantes multinucleadas se marcaron de forma variable. El inmunomarcaje de NRAMP1 mostró un patrón de tinción citoplasmático y se expresó en macrófagos epitelioides de intensidad variable, así como en células gigantes. Se observaron diferencias en la intensidad de tinción de los macrófagos NRAMP1+ entre los grupos. En los animales vacunados con Gudair, algunas gotas de la vacuna estaban rodeadas de macrófagos intensamente marcados, mientras que el resto estaban ligeramente teñidos o no se tiñeron en absoluto (Figura 4E). Por el contrario, en los animales vacunados con Silirum, la mayoría de los macrófagos que rodean las gotas de la vacuna mostraron un patrón de tinción más uniforme y más claro (Figura 4F).®®
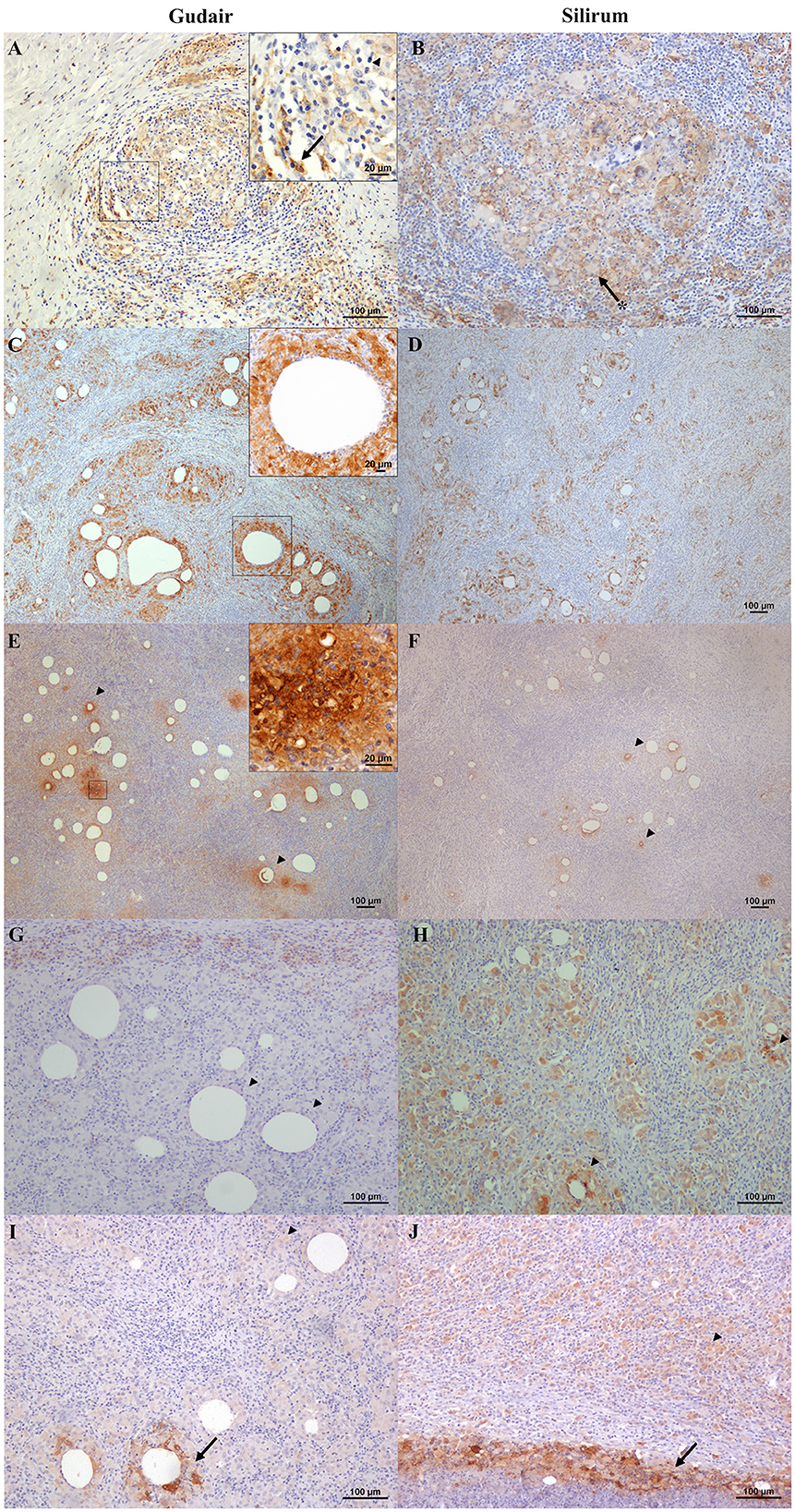 Figura 4. Expresión inmunohistoquímica de marcadores de macrófagos en los granulomas inducidos por vacunas. (A, C, E, G, I) Vacunas Gudair y (B, D, F, H, J) Silirum. (A, B) Las células Iba1+ están presentes y son abundantes en los granulomas inducidos por ambas vacunas, con una distribución similar. Los macrófagos no epitelioides presentes en la capa externa de los granulomas a menudo muestran una tinción fuerte y homogénea (flecha, recuadro), mientras que, en el centro del granuloma, los macrófagos epitelioides (punta de flecha, recuadro) y las células gigantes de Langhans (asterisco) muestran un fuerte patrón de tinción de membrana. (C, D) Los macrófagos inmunomarcados positivamente con CD204 están presentes en la primera capa celular alrededor de las gotas de la vacuna (recuadro) en los granulomas inducidos por ambas vacunas. (E) En los granulomas inducidos por Gudair, la proteína 1 de macrófagos asociados a la resistencia natural (NRAMP1) es expresada por la mayoría de los macrófagos epitelioides, cuya intensidad de tinción aumenta en algunas células ubicadas en las proximidades de solo algunas de las gotas de la vacuna (puntas de flecha), (F) En los inducidos por Silirum, la expresión de NRAMP1 muestra un patrón de tinción similar, pero los focos de células que muestran una alta expresión son más pequeños y menos abundantes (puntas de flecha). (G) Vacuna Gudair. Los macrófagos TNF+ moderadamente inmunoteñidos se pueden observar en la periferia de un granuloma formado alrededor de las gotas de la vacuna, mientras que los macrófagos epitelioides en la proximidad de las gotitas fueron negativos (puntas de flecha), (H) vacuna Silirum. Las células mostraron un fuerte inmunomarcaje positivo, particularmente alrededor de algunas de las gotas de la vacuna (puntas de flecha). Los macrófagos iNOS+ (I, J) están intensamente marcados en la proximidad de algunas de las gotitas de la vacuna y áreas necróticas (flechas), mientras que la mayoría de los macrófagos que forman los granulomas muestran una tinción más débil (puntas de flecha).®®®®®®
Figura 4. Expresión inmunohistoquímica de marcadores de macrófagos en los granulomas inducidos por vacunas. (A, C, E, G, I) Vacunas Gudair y (B, D, F, H, J) Silirum. (A, B) Las células Iba1+ están presentes y son abundantes en los granulomas inducidos por ambas vacunas, con una distribución similar. Los macrófagos no epitelioides presentes en la capa externa de los granulomas a menudo muestran una tinción fuerte y homogénea (flecha, recuadro), mientras que, en el centro del granuloma, los macrófagos epitelioides (punta de flecha, recuadro) y las células gigantes de Langhans (asterisco) muestran un fuerte patrón de tinción de membrana. (C, D) Los macrófagos inmunomarcados positivamente con CD204 están presentes en la primera capa celular alrededor de las gotas de la vacuna (recuadro) en los granulomas inducidos por ambas vacunas. (E) En los granulomas inducidos por Gudair, la proteína 1 de macrófagos asociados a la resistencia natural (NRAMP1) es expresada por la mayoría de los macrófagos epitelioides, cuya intensidad de tinción aumenta en algunas células ubicadas en las proximidades de solo algunas de las gotas de la vacuna (puntas de flecha), (F) En los inducidos por Silirum, la expresión de NRAMP1 muestra un patrón de tinción similar, pero los focos de células que muestran una alta expresión son más pequeños y menos abundantes (puntas de flecha). (G) Vacuna Gudair. Los macrófagos TNF+ moderadamente inmunoteñidos se pueden observar en la periferia de un granuloma formado alrededor de las gotas de la vacuna, mientras que los macrófagos epitelioides en la proximidad de las gotitas fueron negativos (puntas de flecha), (H) vacuna Silirum. Las células mostraron un fuerte inmunomarcaje positivo, particularmente alrededor de algunas de las gotas de la vacuna (puntas de flecha). Los macrófagos iNOS+ (I, J) están intensamente marcados en la proximidad de algunas de las gotitas de la vacuna y áreas necróticas (flechas), mientras que la mayoría de los macrófagos que forman los granulomas muestran una tinción más débil (puntas de flecha).®®®®®®
Las células inmunomarcadas positivamente con TNF mostraron una morfología consistente con macrófagos y un patrón de tinción citoplasmática, con diferencias entre los grupos. En los granulomas inducidos por Gudair, las células positivas estaban presentes alrededor de solo algunas de las gotitas de la vacuna, pero en general, se localizaron en la periferia de los granulomas (Figura 4G). Sin embargo, en los granulomas inducidos por Silirum, las células inmunomarcadas se identificaron en gran número en todo el tejido inflamatorio y alrededor de la mayoría de las gotitas de la vacuna (Figura 4H). En ambos grupos, la intensidad de la inmunotinción de iNOS fue variable entre las células, de modo que los macrófagos epitelioides que formaban la mayor parte del infiltrado granulomatoso estaban débilmente teñidos, pero algunos de los que rodean las áreas necróticas, o en la proximidad de neutrófilos, mostraron una fuerte intensidad de marcaje (Figuras 4I, J), sin diferencias entre los grupos.®®
Las células inmunomarcadas positivamente para el anticuerpo MHC-II mostraron un patrón variable. La mayoría de ellos eran morfológicamente consistentes con los macrófagos, pero algunos linfocitos también estaban teñidos (Figura 5B), y el patrón de tinción era a menudo granular (Figura 5C). Las células gigantes epitelioide y multinucleada de Langhans se tiñeron de leve a moderadamente (Figura 5B). Sin embargo, a veces los macrófagos epitelioides que forman los granulomas no fueron inmunomarcados (Figura 5A), particularmente en las muestras de Gudair. Además, algunas gotas de la vacuna estaban rodeadas de células intensamente marcadas, que, en algunos casos, mostraban una morfología consistente con las células dendríticas (Figura 5D), particularmente en granulomas inducidos por Silirum.®®
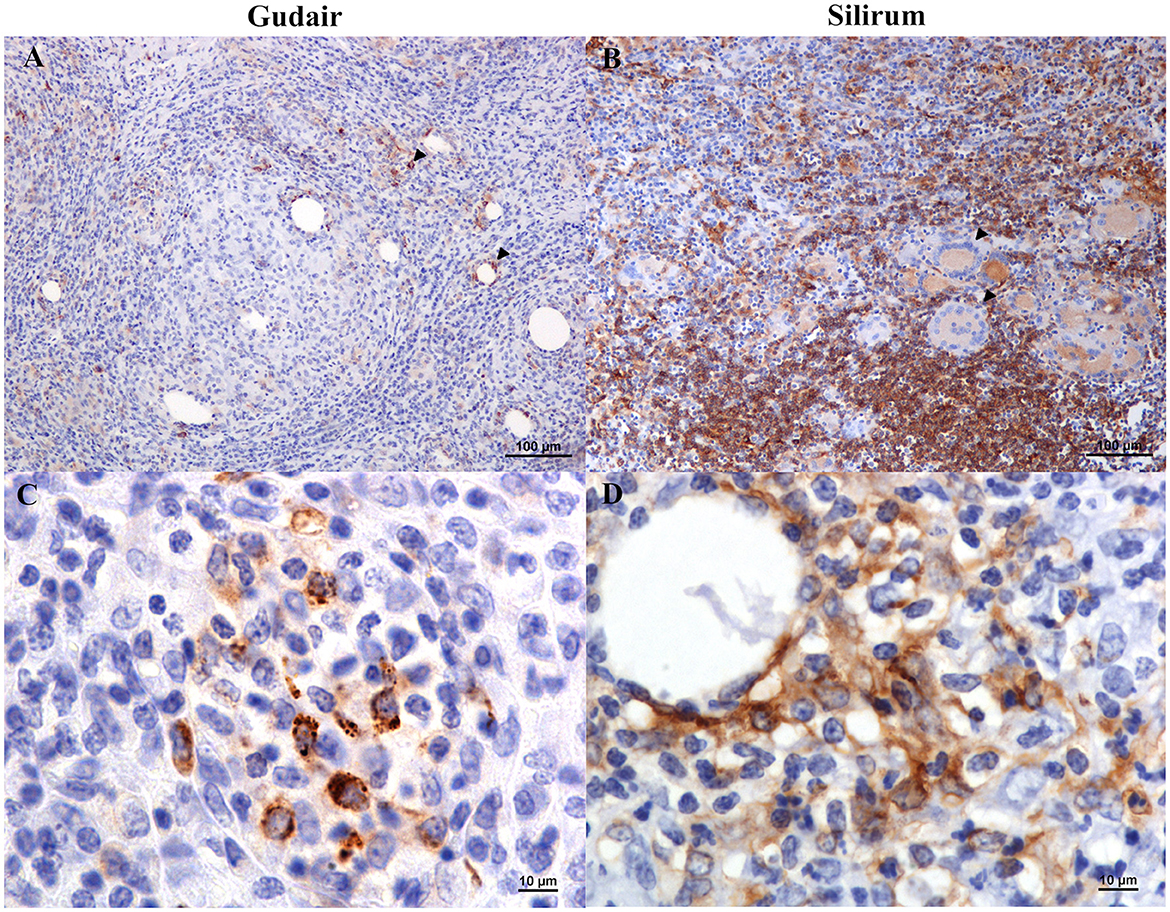 Figura 5. Granulomas inducidos por vacunas, inmunomarcaje de clase II (MHC-II) con complejos de histocompatibilidad mayor. (A) Vacuna Gudair. Algunos macrófagos dentro de los granulomas expresan MHC-II (puntas de flecha). Sin embargo, la mayoría de las células epitelioides fueron negativas. (B) Vacuna contra el Silirum. Las células inmunomarcadas positivamente muestran diferentes intensidades de tinción: los linfocitos y los macrófagos no epitelioides muestran un fuerte inmunomarcado, mientras que los macrófagos epitelioides y las células gigantes de Langhans (puntas de flecha) muestran una tinción más débil. (C) Vacuna Gudair. El patrón de tinción de las células MHC-II+ era a menudo granular. D) Vacuna contra el Silirum. Fuerte inmunotinción de células con una morfología de células dendríticas que rodean una gota de vacuna.®®®®
Figura 5. Granulomas inducidos por vacunas, inmunomarcaje de clase II (MHC-II) con complejos de histocompatibilidad mayor. (A) Vacuna Gudair. Algunos macrófagos dentro de los granulomas expresan MHC-II (puntas de flecha). Sin embargo, la mayoría de las células epitelioides fueron negativas. (B) Vacuna contra el Silirum. Las células inmunomarcadas positivamente muestran diferentes intensidades de tinción: los linfocitos y los macrófagos no epitelioides muestran un fuerte inmunomarcado, mientras que los macrófagos epitelioides y las células gigantes de Langhans (puntas de flecha) muestran una tinción más débil. (C) Vacuna Gudair. El patrón de tinción de las células MHC-II+ era a menudo granular. D) Vacuna contra el Silirum. Fuerte inmunotinción de células con una morfología de células dendríticas que rodean una gota de vacuna.®®®®
La distribución de los linfocitos fue muy similar en todas las muestras, y los patrones de inmunomarcaje de CD3 y CD20 fueron citoplasmáticos. Las células CD20+ (linfocitos B) se distribuyeron uniformemente, en pequeñas cantidades, a lo largo del infiltrado inflamatorio, pero se agruparon particularmente en una capa bien delimitada de espesor variable que rodea a los macrófagos (Figuras 6A, B). Este manguito de células B formaba la parte más externa del granuloma, y como resultado de la fusión de varias de estas capas externas, se podían observar grandes agregados de células positivas en la confluencia de varios granulomas (Figura 6A). La mayoría de las células CD3+ (linfocitos T) estaban dispersas por todo el infiltrado granulomatoso (Figura 6C), pero ocasionalmente también se acumularon en cantidades muy variables alrededor de las gotas de la vacuna (Figura 6D). Las células WC1+ (células T γδ) eran muy escasas y no mostraban un patrón específico de distribución, excepto por el hallazgo de algunas células positivas en la periferia de un pequeño granuloma de un animal vacunado con Silirum (Figura 7).®
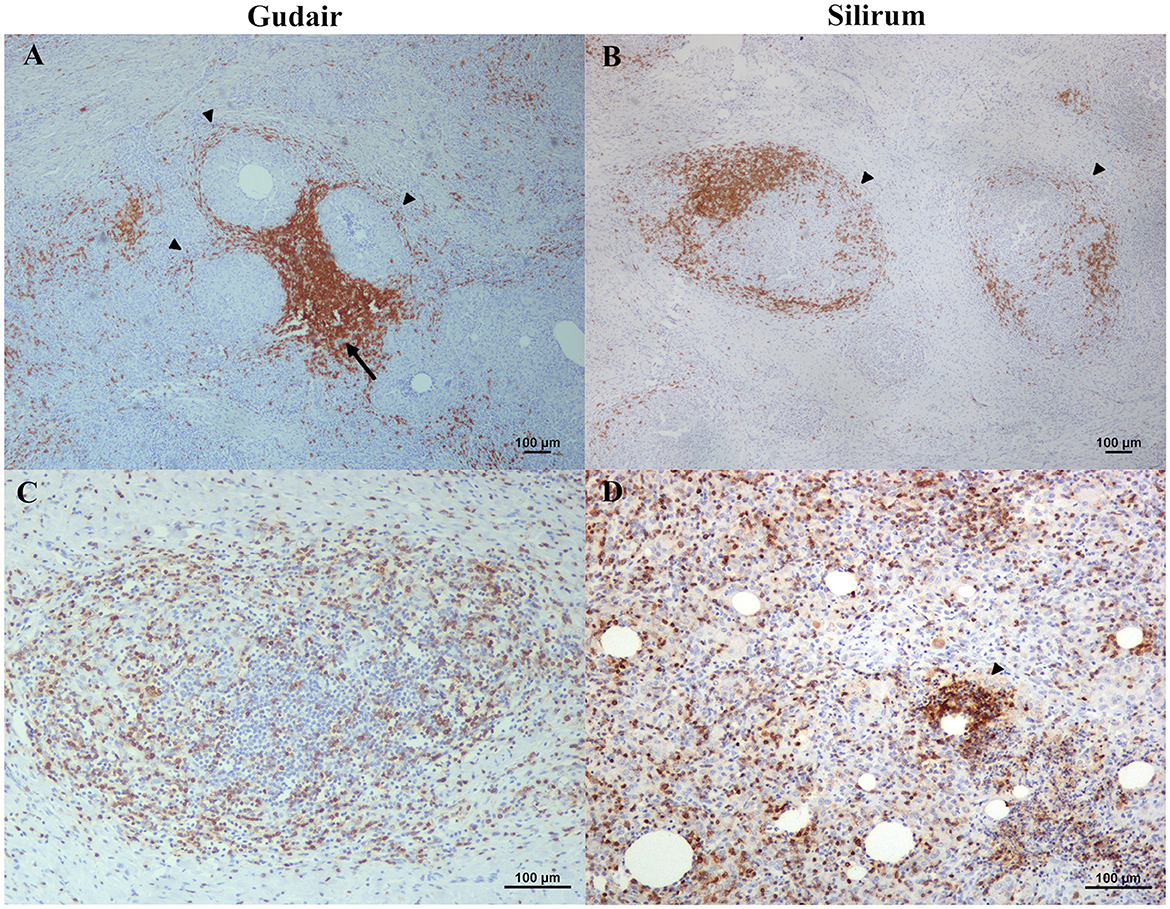 Figura 6. Distribución de linfocitos B y T a lo largo de los granulomas inducidos por la vacuna. (A) Vacunas Gudair y (B) Silirum. Las células inmunomarcadas positivamente con CD20 forman vainas que rodean los granulomas (puntas de flecha); A veces, estas vainas formaban agregados (flecha) en la confluencia de varios granulomas. (C) Vacuna Gudair. Las células inmunoteñidas con CD3+ positivo se dispersan uniformemente por todos los granulomas, (D) vacuna Silirum. Las células CD3+ se acumulan alrededor de algunas de las gotitas de la vacuna (punta de flecha).®®®®
Figura 6. Distribución de linfocitos B y T a lo largo de los granulomas inducidos por la vacuna. (A) Vacunas Gudair y (B) Silirum. Las células inmunomarcadas positivamente con CD20 forman vainas que rodean los granulomas (puntas de flecha); A veces, estas vainas formaban agregados (flecha) en la confluencia de varios granulomas. (C) Vacuna Gudair. Las células inmunoteñidas con CD3+ positivo se dispersan uniformemente por todos los granulomas, (D) vacuna Silirum. Las células CD3+ se acumulan alrededor de algunas de las gotitas de la vacuna (punta de flecha).®®®®
 Figura 7. Células T γδ en un granuloma inducido por vacuna. Las células inmunomarcadas positivamente con WC1 rodean un granuloma inducido por Silirum.®
Figura 7. Células T γδ en un granuloma inducido por vacuna. Las células inmunomarcadas positivamente con WC1 rodean un granuloma inducido por Silirum.®
Los linfocitos y neutrófilos que expresaban IL-4 se distribuyeron uniformemente a lo largo de los granulomas y mostraron un patrón de tinción citoplasmática (Figuras 8A, B). Los linfocitos inmunoteñidos positivamente con IFN-γ estaban presentes en todas las muestras, pero en cantidades bajas, y mostraron un patrón de tinción y distribución similar (Figuras 8C, D). Por último, la expresión inmunohistoquímica de IL-10 fue muy baja en todos los grupos, con la presencia ocasional de muy pocos linfocitos positivos.
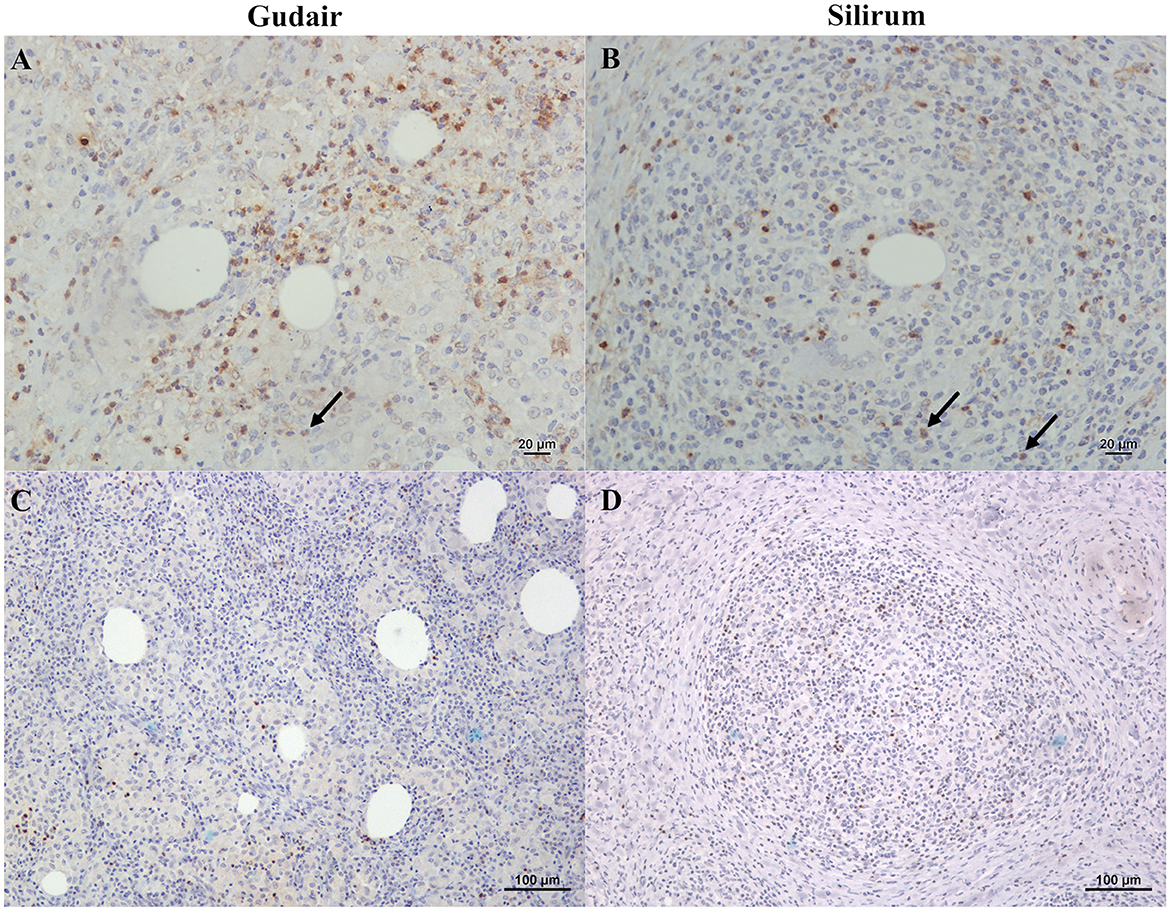 Figura 8. Expresión inmunohistoquímica de IL-4 e IFN-γ en los granulomas inducidos por vacunas. (A) Vacunas Gudair y (B) Silirum. Los linfocitos y neutrófilos (flechas) teñidos positivamente con IL-4 se distribuyeron uniformemente a lo largo de la inflamación granulomatosa en los granulomas inducidos por ambas vacunas. (C) Vacunas Gudair y (D) Silirum. Los linfocitos inmunomarcados positivamente con IFN-γ infiltran el tejido granulomatoso en menor número.®®®®
Figura 8. Expresión inmunohistoquímica de IL-4 e IFN-γ en los granulomas inducidos por vacunas. (A) Vacunas Gudair y (B) Silirum. Los linfocitos y neutrófilos (flechas) teñidos positivamente con IL-4 se distribuyeron uniformemente a lo largo de la inflamación granulomatosa en los granulomas inducidos por ambas vacunas. (C) Vacunas Gudair y (D) Silirum. Los linfocitos inmunomarcados positivamente con IFN-γ infiltran el tejido granulomatoso en menor número.®®®®
3.3.2.2 Recuentos celulares
En general, las diferentes subpoblaciones celulares inmunomarcadas positivamente se identificaron por la presencia, en mayor o menor medida, de tinciones marcadamente marrones en su citoplasma y, en ocasiones, en las membranas celulares. Se observó variabilidad en el número de las diferentes poblaciones celulares presentes en los granulomas locales según la vacuna empleada. En general, los macrófagos, marcados de forma variable para los marcadores Iba1, CD204, NRAMP1, TNF, iNOS y MHC-II, constituyeron la mayoría de la población celular presente en el infiltrado inflamatorio, mientras que los linfocitos T y B también estuvieron presentes, aunque en menor número. Los resultados de los recuentos celulares medios para cada anticuerpo se pueden ver en la Figura 9 y se representan como medias y desviación estándar. Se observó un aumento significativo en el número de células MHC-II (p < 0,001), TNF (p < 0,001), Iba1 (p < 0,01) e IL-4 (p < 0,05) en los animales vacunados con Silirum en comparación con la vacuna Gudair. Se observó un mayor número de linfocitos T γδ CD204+, iNOS+, WC1+, NRAMP1+ e IFN-γ+ en los granulomas de los animales vacunados con Gudair, sin embargo, este aumento solo fue significativo para el marcador CD204 (p < 0,05). Finalmente, no se encontraron diferencias significativas (p > 0,05) entre los grupos en el número de linfocitos CD3+ y CD20+. En este último caso, no se encontraron diferencias ni en el número de células que forman una vaina ni en las que se encuentran dispersas por todo el granuloma.®®®
 Figura 9. La inmunohistoquímica en las vacunas de Gudair y Silirum indujo granulomas. Los datos muestran el número medio de células inmunomarcadas por campo de 400x para (A) Iba1, (B) CD204, (C) NRAMP1, (D) TNF, (E) iNOS, (F) MHC-II, (G) CD3, (H) CD20, (I) WC1, (J) IL-4 y (K ) IFN-γ. Los resultados se expresan como media. Las barras de error representan la desviación estándar de los recuentos medios entre animales. *p < 0,05, **p < 0,01, ***p < 0,001.®®
Figura 9. La inmunohistoquímica en las vacunas de Gudair y Silirum indujo granulomas. Los datos muestran el número medio de células inmunomarcadas por campo de 400x para (A) Iba1, (B) CD204, (C) NRAMP1, (D) TNF, (E) iNOS, (F) MHC-II, (G) CD3, (H) CD20, (I) WC1, (J) IL-4 y (K ) IFN-γ. Los resultados se expresan como media. Las barras de error representan la desviación estándar de los recuentos medios entre animales. *p < 0,05, **p < 0,01, ***p < 0,001.®®
4 Discusión
En el presente estudio, realizamos un extenso estudio histopatológico e inmunohistoquímico para caracterizar las poblaciones de células inflamatorias presentes en los granulomas inducidos por dos vacunas comerciales diferentes contra el PTB: Gudair y Silirum. Además, se recopiló información sobre la respuesta inmune periférica desarrollada durante los primeros 75 dpv. Es bien sabido que la vacunación contra el PTB desencadena respuestas inmunitarias humorales y celulares específicas (4, 40). También se sabe que la intensidad y el tipo de respuesta inmune inducida por el mismo antígeno pueden verse influenciados por el adyuvante empleado (16, 41, 42). En consecuencia, en ausencia de otros factores de variabilidad como la influencia ambiental, la edad, el antígeno utilizado o la sensibilización previa a otras micobacterias, las diferencias observadas en la respuesta inmune pueden relacionarse fundamentalmente con las características del adyuvante empleado, dado que ambas vacunas estudiadas comparten la misma cepa y cantidad de Map.®®
En todos los animales vacunados, se observó la formación de un nódulo subcutáneo, similar al ya descrito en especies ovinas y bovinas (8, 14, 43, 44), en el lugar de la inyección. En ambos grupos vacunados, los nódulos alcanzaron su tamaño máximo a los 21 dpv y seguían siendo de tamaño considerable al final del experimento, una cuestión que debe tenerse en cuenta a la hora de vacunar contra el PTB. Sin embargo, se observaron diferencias en el tamaño, la forma, la textura de la superficie, la movilidad y la consistencia entre las dos vacunas. En general, los nódulos inducidos por Silirum mostraron una mejor conformación, menor tamaño, un centro necrótico más pequeño y menor tendencia a formar fístulas en comparación con los nódulos inducidos por Gudair.®®
Se ha reportado que el desarrollo de una fuerte respuesta humoral después de la vacunación es crucial para prevenir la infección por Map en ovejas (45); Por lo tanto, aunque no es tan importante en el control de la infección como la respuesta inmune mediada por células (46-48), podría ser un indicador de la efectividad de la vacunación. En este sentido, independientemente del adyuvante empleado, la vacunación indujo una respuesta inmune humoral detectable, ya a 15 dpv en algunos animales, y el principal aumento del título de anticuerpos se produjo entre 30 dpv y 75 dpv, similar a los resultados encontrados por Pooley et al. (45) y Arteche-Villasol et al. (49) con los animales vacunados con Gudair alcanzando los títulos más altos.®
A pesar de que la respuesta inmune humoral constituye un posible indicador de la efectividad de la vacunación, tiene poco valor protector frente a las micobacterias y no es suficiente para controlar las infecciones por micobacterias (50), siendo la respuesta inmune mediada por células la más efectiva. Por lo tanto, el objetivo principal de la vacunación es inducir la actividad de ciertas poblaciones celulares, lo que garantiza la destrucción y el procesamiento de bacilos en el sitio de infección, ya sea de manera directa o indirecta (a través de la producción de citoquinas). Por lo tanto, en el presente estudio, las respuestas inmunes periféricas fueron evaluadas a través de las pruebas cutáneas IGRA y PPDa. Como era de esperar, a través del experimento se produjo un aumento progresivo en la producción de IFN-γ por la sangre estimulada por PPDa en ambos grupos vacunados, como se había observado previamente para ambas vacunas (49, 51). En general, los resultados de los dos ensayos fueron coincidentes, ya que los animales vacunados con Silirum mostraron una respuesta específica mediada por células más fuerte en ambas técnicas empleadas. Sin embargo, debe tenerse en cuenta que, aunque las vacunas inactivadas parenterales, como Silirum, pueden influir significativamente en las respuestas inmunitarias de la mucosa frente a Map (52), las respuestas periféricas inducidas por las vacunas parenterales no se alinean perfectamente con la respuesta de la mucosa (53, 54).®®
Histológicamente, en el sitio de inoculación, ambas vacunas indujeron inflamación granulomatosa. Sin embargo, en los granulomas inducidos por Silirum, se pudo observar una distribución homogénea del antígeno en gotas adyuvantes más pequeñas. Por lo tanto, es tentador plantear la hipótesis de que este hecho, junto con la inducción de un menor daño tisular por Silirum, podría ser responsable del desarrollo de una respuesta inmune local más específica. El aumento de la necrosis inducida por Gudair está probablemente determinado por los efectos citotóxicos sobre las membranas celulares de los ácidos grasos de cadena corta que constituyen el aceite mineral y la descomposición enzimática de las cadenas lipídicas nativas en ácidos grasos tóxicos causada por los emulsionantes (48, 55). Este efecto fue quizás limitado en Silirum, ya que su coadyuvante está constituido por aceites minerales orgánicos y más refinados y biocompatibles.®®®®
En los animales vacunados con Silirum, se pudo observar una menor cantidad de antígeno dentro de las gotas de la vacuna en el lugar de la inyección. Esto probablemente fue causado por la fagocitosis progresiva y el procesamiento y destrucción del antígeno, ya que generalmente se asoció con una mayor cantidad de antígeno detectado dentro del epitelioide y las células gigantes que rodean las gotas de la vacuna y las áreas necróticas. Un hallazgo interesante es que la tinción inmunohistoquímica para los antígenos Map fue notablemente superior al método de Ziehl-Neelsen al revelar la presencia del antígeno, ya que este método depende de la integridad de la pared celular, que se ve afectada durante el proceso de inactivación y se altera aún más bajo la exposición al microambiente inflamatorio. Por estas razones, la inmunohistoquímica podría ser útil en futuros estudios que evalúen la presencia local de antígenos y su persistencia durante largos períodos de tiempo.®
Existe escasa información sobre las células presentes en el granuloma inducido por vacunas contra micobacterias; por ejemplo, muy recientemente, se evaluaron células que expresan CD4, CD8, cadena δ, CD79α, CD68 y MHC-II en granulomas subcutáneos inducidos por M. bovis BCG y derivados recombinantes en cabras (18). Con respecto a la TBP, algunos estudios han utilizado la inmunohistoquímica para evaluar las células inmunitarias presentes en los granulomas subcutáneos inducidos por vacunas inactivadas o Map vivo (6, 56). La mayor parte de esta investigación se centró en el efecto del antígeno (bacterias vivas, inactivadas o modificadas) y evaluó un pequeño número de poblaciones celulares (2-3 marcadores). Por lo tanto, la respuesta inmunitaria establecida en el lugar de inyección de la vacuna, y en particular el efecto del adyuvante, son casi inexplorados.
Uno de los hallazgos más interesantes observados en nuestro estudio ha sido la expresión significativamente mayor de células inmunomarcadas positivamente por MHC-II inducidas por Silirum en el nódulo de vacunación, lo que podría estar influenciado por la naturaleza de su adyuvante que rodea a los antígenos con un liposoma que los protege de la degradación y desnaturalización de la proteasa, preservando su estructura tridimensional (57). Además, las diferencias podrían ser el resultado de un grado variable de activación de APC, ya que induce la generación de complejos péptido antígeno-MHC-II y aumenta notablemente su expresión en la membrana plasmática (58). Por lo tanto, la menor expresión de MHC-II en el sitio de inyección de Gudair podría deberse a la distribución irregular del antígeno y a la persistencia de grandes gotas adyuvantes, que indujeron un daño tisular excesivo, polarizando a los macrófagos a un fenotipo epitelioide. Los macrófagos epitelioides podrían ser altamente fagocíticos, pero no juegan un papel importante en la presentación de antígenos (35). Además, en el infiltrado inflamatorio de ambos grupos, la mayoría de los macrófagos epitelioides tenían un fenotipo M2 (CD204+). Los macrófagos M2 expresan niveles más bajos de MHC-II que sus homólogos M1 (59) y fueron más abundantes en Gudair que en las muestras de Silirum (71,2 frente a 58 células medias por HPF), aunque había significativamente más macrófagos (Iba1+) en las muestras de Silirum (101,925 frente a 188,6 células medias por HPF). El patrón granular citoplasmático de marcaje MHC-II observado en algunos macrófagos podría atribuirse a los endosomas y a los compartimentos de procesamiento de antígenos (58). Además de los macrófagos, en algunos campos, en las proximidades de las gotitas de la vacuna, se pudieron observar células ramificadas fuertemente marcadas con MHC-II, principalmente en muestras de Silirum. Fueron morfológicamente consistentes con las células dendríticas, que son potentes APC que estimulan la proliferación de células T ingenuas (60). Las células dendríticas estudian el entorno con un conjunto de receptores de reconocimiento de patrones (PRR), similares a los receptores tipo Toll (TLR), y, tras el reconocimiento, maduran y se diferencian en fenotipos que pueden estimular una respuesta inmunitaria adaptativa. Uno de esos cambios es el aumento dramático en la expresión superficial de MHC-II (60, 61). Se necesitan más investigaciones sobre este tema, con una caracterización más precisa del papel de las poblaciones de células dendríticas en los granulomas.®®®®®®
Profundizando en los marcadores de macrófagos, la tinción más marcada del patrón de membrana observada en la proximidad de las gotas de la vacuna al marcar Iba1 podría deberse al aumento de la fagocitosis inducida por la presencia del antígeno, ya que Iba1 es una proteína involucrada en la alteración de la membrana y la fagocitosis (62, 63). No se encontraron diferencias en el número de células inmunomarcadas con NRAMP1+, pero la variabilidad observada en la intensidad podría deberse a las diferencias en la distribución del antígeno. Los macrófagos mostraron una tinción débil con el marcador NRAMP1 en ambos grupos. En los granulomas inducidos por Gudair, la expresión fue muy irregular, con macrófagos rodeando algunas de las gotitas de la vacuna que expresaban altos niveles de NRAMP1. Esos focos de macrófagos podrían estar relacionados con las manchas altamente concentradas del antígeno Map, ya que NRAMP1 se asocia con los fagosomas tras la fagocitosis del antígeno (30).®
Curiosamente, no se observaron diferencias en la expresión de macrófagos iNOS+ en los granulomas entre ambos grupos. Esta enzima se expresa fuertemente en granulomas de diferentes etiologías (64) y se asocia con una respuesta Th1. Sin embargo, se encontraron diferencias significativas en la expresión de TNF, un marcador funcional M1, que se expresó en niveles más altos en los granulomas inducidos por Silirum. La producción de TNF por parte de los macrófagos es inducida por la estimulación de TLR. En este sentido, el aumento de la expresión observado en los animales vacunados con Silirum puede ser inducido por la mejora sugerida en la preservación, distribución y activación de APC del antígeno. Este TNF autocrino participa en la activación de los macrófagos y estimula la fagocitosis, mientras que el TNF exógeno también puede activar los macrófagos previamente cebados por IFN-γ (65). Se ha descrito un aumento en la expresión de TNF en el sitio de inyección en respuesta a varios adyuvantes como MF59, hidróxido de aluminio, trehalosa-6, 6′-dibehenato-TDB, ligandos TLR y adyuvante completo de Freund. Curiosamente, esta última, que contiene micobacterias (M. tuberculosis muerta por calor), indujo la mayor expresión de esta citoquina (17).®®
No hubo diferencias significativas en el número y patrón de distribución de linfocitos B (CD20+) y T (CD3+) entre los grupos. Un estudio previo encontró que a las 3 semanas después de la vacunación con Mycopar, las células B estaban en números moderados y las células T eran escasas, mientras que a los 6 meses después de la vacunación, ambas eran abundantes en la periferia de los granulomas (66). Por lo tanto, parece factible que el reclutamiento de linfocitos tenga lugar principalmente después del primer mes de formación del granuloma, y persistan durante un largo período a partir de entonces. Curiosamente, las células T no se describieron entre los macrófagos epitelioides del granuloma en ese estudio, lo que podría ser una diferencia dependiente de la vacuna. En nuestro estudio, a diferencia de los linfocitos B, los linfocitos T fueron menos abundantes como parte del manguito linfocitario, una característica típica de los granulomas micobacterianos maduros (20), pero mostraron una distribución similar a la observada en macacos cynomolgus (Macaca fascicularis) infectados con M. tuberculosis (67). En este sentido, las células inmunomarcadas con IFN-γ+ también se distribuyeron por las áreas de inflamación granulomatosa, pero no se observaron diferencias entre los grupos. Estas células productoras de IFN-γ eran probablemente células T, que se sabe que infiltran lesiones granulomatosas y producen grandes cantidades de citocinas de tipo Th1, incluido el IFN-γ, lo que contribuye a la formación de granulomas (64, 68, 69). Además, el patrón de distribución de los linfocitos T γδ observado en una de las muestras (Figura 7) fue muy similar al observado previamente en las lesiones paratuberculosas focales intestinales (70). El pequeño tamaño de los granulomas observados en este tipo de lesiones podría indicar, tal y como se concluyó en aquel estudio previo, que su distribución en la periferia de los granulomas podría participar en la contención de los granulomas, favoreciendo su latencia y evitando su progresión.®
En cuanto a la expresión de interleucinas, se sabe que los neutrófilos y los linfocitos expresan IL-4 en respuesta a M. tuberculosis viva e inactivada, pero la IL-10 se produce solo en presencia de bacterias viables (71). Esta expresión es impulsada por la señalización de TLR y, por lo tanto, el aumento de la expresión de IL-4 observado en las muestras de Silirum podría deberse a la mejora en la distribución y preservación del antígeno mencionada anteriormente, mientras que la ausencia de bacterias vivas podría explicar la expresión limitada de IL-10 en ambos grupos. Además, el entorno inflamatorio local inducido por la vacunación no promueve la expresión de una IL-10 antiinflamatoria clásica similar a las citoquinas, lo que perjudicaría las funciones de las células dendríticas como la migración y su capacidad para inducir una respuesta inmune de tipo Th1 (72-74).®
Estudios previos han demostrado la inducción de distintas composiciones celulares en el granuloma en el lugar de la inyección inducido por Map vivo y una vacuna Map inactivada (6, 56). En general, los resultados obtenidos en el presente estudio muestran que los adyuvantes de la vacuna también pueden inducir cambios significativos en la respuesta inmune establecida en el lugar de la inyección. Sin embargo, estudiar la composición celular presente en los granulomas inducidos por los adyuvantes o el antígeno por separado ayudaría a comprender los mecanismos y las posibles sinergias detrás de las diferencias en la respuesta. De hecho, se ha investigado el efecto inespecífico de los adyuvantes en la respuesta inmune periférica y la patogénesis de la paratuberculosis en rumiantes (49). También sería de gran valor estudiar la interacción dinámica entre la respuesta inmunitaria establecida en el lugar de la inyección y su ganglio linfático aferente y establecer correlaciones sólidas entre este sitio de respuesta y las respuestas periféricas y mucosas frente a Map. En el presente estudio, los granulomas se muestrearon solo a 75 dpv. Sería interesante estudiar la cinética de la respuesta en momentos más tempranos en los que se producen eventos importantes en el establecimiento de la respuesta inmunitaria adaptativa. Sería igualmente interesante estudiar los puntos temporales posteriores dada la cronicidad de la enfermedad PTB, ya que se sabe que estos granulomas en el lugar de la inyección persisten durante meses o incluso años después de la vacunación (7).
En conclusión, no se observaron reacciones adversas sistémicas en ninguno de los grupos. Silirum indujo la formación de un nódulo granulomatoso comparable en tamaño al inducido por Gudair pero causando un menor grado de daño tisular, con antígeno distribuido en gotas de vacuna más pequeñas. Además, ambas vacunas indujeron una intensa respuesta inmune humoral y celular, pero Silirum indujo una respuesta celular significativamente mayor que Gudair. Independientemente del tipo de vacuna, los infiltrados inflamatorios en el lugar de la inyección están compuestos por macrófagos y linfocitos, sin un predominio claro de ningún subtipo, lo que sugiere que en este punto se establece una respuesta inmune celular y humoral simultánea, con un componente proinflamatorio y antiinflamatorio. Sin embargo, un mayor número de células que expresan MHC-II estaban presentes en los granulomas inducidos por Silirum, lo que podría sugerir que la distribución mejorada del antígeno mejora la absorción y el procesamiento del antígeno por parte de las células presentadoras de antígeno. Como conclusión adicional, encontramos que la tinción inmunohistoquímica frente a Map es muy superior al método de Ziehl-Neelsen a la hora de evaluar la distribución histológica del antígeno en estudios vacunales. Finalmente, podemos concluir que Silirum podría constituir una buena alternativa a Gudair para una vacuna Map, logrando parámetros de respuesta inmune similares o mejores a la vez que reduce ligeramente el daño tisular en el lugar de la inyección.®®®®®®®
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Subcomité de Experimentación y Bienestar Animal (OEBA) del Comité de Ética de la Universidad de León, Campus de Vegazana, Calle Profesor s/n 24071, León, España. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
MC: Curación de datos, Análisis formal, Investigación, Redacción, borrador original. LR: Investigación, redacción, revisión y edición. JM: Investigación, escritura, revisión y edición. DZ: Redacción, revisión y edición, investigación. DG-E: Redacción, revisión y edición. JE: Curación de datos, Análisis formal, Redacción, revisión y edición. VP: Conceptualización, Obtención de Fondos, Administración de Proyectos, Supervisión, Redacción, Revisión y Edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo ha sido financiado por los proyectos nacionales RTI2018-099496-B-I00 y PID2021-125807OB-C21, de la Agencia Estatal de Investigación del Ministerio de Ciencia e Innovación. MC acusa recibo de una beca predoctoral (PRE2019-087309) del MCIN/AEI/ 10.13039/501100011033 y FSE «El FSE invierte en tu futuro» y DZ de un contrato predoctoral de la Universidad de León. Zendal (Porriño, España), suministró las vacunas Gudair y Silirum.®®
Reconocimientos
Se agradece el apoyo técnico y humano brindado por Marta Silva.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Harris NB, Barletta RG. Mycobacterium avium subsp. paratuberculosis en medicina veterinaria. Clin Microbiol Rev. (2001) 14:489–512. doi: 10.1128/CMR.14.3.489-512.2001
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Wells SJ, Collins MT, Faaberg KS, Wees C, Tavornpanich S, Petrini KR, et al. Evaluación de una prueba rápida de PCR fecal para la detección de Mycobacterium avium subsp. paratuberculosis en bovinos lecheros. Clin Vacuna Immunol. (2006) 13:1125–30. doi: 10.1128/CVI.00236-06
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Bastida F, Juste RA. Control de la paratuberculosis: una revisión centrada en la vacunación. J Vacunas basadas en el sistema inmunitario. (2011) 9:8. doi: 10.1186/1476-8518-9-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Bannantine JP, Talaat AM. Control de la enfermedad de Johne: La vacunación es el camino a seguir. Las células frontales infectan el microbiol. (2015) 5:2. doi: 10.3389/fcimb.2015.00002
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Matthews C, Cotter PD, O’ Mahony J. MAP, La enfermedad de Johne y el microbioma; Conocimiento actual y consideraciones futuras. Anim Microbioma. (2021) 3:1–18. doi: 10.1186/s42523-021-00089-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Lei L, Plattner BL, Hostetter JM. La paratuberculosis y una vacuna contra la bacteria muerta inducen granulomas subcutáneos distintos, con perfiles celulares y citocinas únicos. Clin Vacuna Immunol. (2008) 15:783–93. doi: 10.1128/CVI.00480-07
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Eppleston J, Windsor P. Lesiones atribuidas a la vacunación de ovejas con GudairTM Para el control de la paratuberculosis ovina: impactos económicos posteriores a la explotación en el matadero. Aust Vet J. (2007) 85:129–33. doi: 10.1111/j.0005-0423.2007.00135.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Kohler H, Gyra H, Zimmer K, Drager KG, Burkert B, Lemser B, et al. Reacciones inmunitarias en bovinos después de la inmunización con una vacuna contra Mycobacterium paratuberculosis e implicaciones para el diagnóstico de M. paratuberculosis y M. bovis. Infecciones J Vet Med Ser B. (2001) 48:185–95. doi: 10.1046/j.1439-0450.2001.00443.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Garrido JM, Vázquez P, Molina E, Plazaola JM, Sevilla IA, Geijo M V, et al. La vacunación contra la paratuberculosis solo provoca una reactividad cruzada limitada en la prueba cutánea para el diagnóstico de la tuberculosis bovina. PLoS UNO. (2013) 8:e80985. doi: 10.1371/journal.pone.0080985
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Groenendaal H, Zagmutt FJ, Patton EA, Wells SJ. Análisis costo-beneficio de la vacunación contra Mycobacterium avium ssp. paratuberculosis en bovinos lecheros, dada su reactividad cruzada con las pruebas de tuberculosis. J Lácteos Sci. (2015) 98:6070–84. doi: 10.3168/jds.2014-8914
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Stringer LA, Wilson PR, Heuer C, MacKintosh CG. Ensayo controlado aleatorizado de la vacuna Silirum para el control de la paratuberculosis en ciervos de granja. Rec. Veterinario (2013) 173:551. doi: 10.1136/vr.101799
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Windsor P, Eppleston J, Dhand N, Whittington R. Efectividad de GudairTM vacuna para el control de la enfermedad de Johne ovina en rebaños vacunados durante al menos 5 años. Aust Vet J. (2014) 92:263–8. doi: 10.1111/avj.12194
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Tizard IR. Coadyuvantes y adyuvancia. Vacunas Vet. (2021) 75:1–17. doi: 10.1016/B978-0-323-68299-2.00016-2
14. Musk G, Kershaw H, Tano K, Niklasson A, von Unge M, Dilley R. Reacciones a la vacunación de Gudair identificadas en ovejas utilizadas para investigación biomédica. Aust Vet J. (2019) 97:56–60. doi: 10.1111/avj.12788®
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Herbert WJ. El modo de acción de los adyuvantes de emulsión de aceite mineral en la producción de anticuerpos en ratones. Inmunología. (1968) 14:301.
16. Awate S, Babiuk LA, Mutwiri G. Mecanismos de acción de los adyuvantes. Frente Immunol. (2013) 4:50795. doi: 10.3389/fimmu.2013.00114
17. van Aalst S, Ludwig IS, van Kooten PJS, van der Zee R, van Eden W, Broere F. Dinámica del reclutamiento de APC en el lugar de inyección después de la inyección de adyuvantes de vacunas. Vacuna. (2017) 35:1622–9. doi: 10.1016/j.vaccine.2017.02.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Liebler-Tenorio EM, Heyl J, Wedlich N, Figl J, Köhler H, Krishnamoorthy G, et al. Los granulomas subcutáneos inducidos por la vacuna en cabras reflejan diferencias en las interacciones huésped-micobacteria entre las vacunas BCG y las vacunas recombinantes derivadas de BCG. Int J Mol Sci. (2022) 23:10992. doi: 10.3390/ijms231910992
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Meneveau MO, Kumar P, Lynch KT, Patel SP, Slingluff CL. El microambiente del sitio de la vacuna: impactos de la vacunación con antígenos, adyuvantes y en el mismo sitio sobre la presentación de antígenos y la señalización inmunitaria. J Immunother Cáncer. (2022) 10:3533. doi: 10.1136/jitc-2021-003533
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. McClean CM, Tobin DM. Forma, función y fenotipo de macrófagos en la infección por micobacterias: lecciones de la tuberculosis y otras enfermedades. Pathog Dis. (2016) 74:68. doi: 10.1093/femspd/ftw068
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Unanue ER. Función presentadora de antígenos del macrófago. Annu Rev Immunol. (1984) 2:395–428. doi: 10.1146/annurev.iy.02.040184.002143
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Kashem SW, Haniffa M, Kaplan DH. Células presentadoras de antígenos en la piel. Annu Rev Immunol. (2017) 35:469–99. doi: 10.1146/annurev-immunol-051116-052215
23. Benoit M, Desnues B, Mege J-L. Polarización de macrófagos en infecciones bacterianas. J Immunol. (2008) 181:3733–9. doi: 10.4049/jimmunol.181.6.3733
24. Mills CD, Kincaid K, Alt JM, Heilman MJ, Hill AM. Los macrófagos M-1/M-2 y el paradigma Th1/Th2. J Immunol. (2000) 164:6166–73. doi: 10.4049/jimmunol.164.12.6166
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Orecchioni M, Ghosheh Y, Pramod AB, Ley K. Polarización de macrófagos: diferentes firmas génicas en M1 (LPS+) frente a macrófagos clásicamente y M2 (LPS-) frente a macrófagos activados alternativamente. Frente Immunol. (2019) 10:1084. doi: 10.3389/fimmu.2019.01084
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Martínez FO, Gordon S. El paradigma M1 y M2 de la activación de macrófagos: tiempo para la reevaluación. F1000Prime Rep. (2014) 6:13. doi: 10.12703/P6-13
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Roszer T. Comprensión del misterioso macrófago M2 a través de marcadores de activación y mecanismos efectores. Mediadores Inflamm. (2015) 2015:460. doi: 10.1155/2015/816460
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Angel CE, George E, Ostrovsky LL, Dunbar PR. Análisis exhaustivo de la expresión de MHC-II en piel humana sana. Immunol Cell Biol. (2007) 85:363–9. doi: 10.1038/sj.icb.7100047
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Xaus J, Comalada M, Barrachina M, Herrero C, Goñalons E, Soler C, et al. La expresión de los genes MHC de clase II en los macrófagos depende del ciclo celular. J Immunol. (2000) 165:6364–71. doi: 10.4049/jimmunol.165.11.6364
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Govoni G, Gros P. Macrófagos NRAMP1 y su papel en la resistencia a las infecciones microbianas. Inflamm Res. (1998) 47:277–84. doi: 10.1007/s000110050330
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Delgado F, Estrada-Chávez C, Romano M, Paolicchi F, Blanco-Viera F, Capellino F, et al. Expresión de NRAMP1 e iNOS en bovinos infectados naturalmente por Mycobacterium avium subsp. paratuberculosis. Comp Immunol Microbiol Infect Dis. (2010) 33:389–400. doi: 10.1016/j.cimid.2009.03.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Hilhorst M, Shirai T, Berry G, Goronzy JJ, Weyand CM. Interacciones entre células T y macrófagos y formación de granulomas en la vasculitis. Frente Immunol. (2014) 5:432. doi: 10.3389/fimmu.2014.00432
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Lee SM, Kim P, You J, Kim EH. Papel de las vías de muerte celular y patrones moleculares asociados al daño en la inmunidad inducida por vacunas. Virus. (2021) 13:2340. doi: 10.3390/v13122340
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Wang ZB, Xu J. Mejores adyuvantes para mejores vacunas: avances en los sistemas de administración de adyuvantes, modificaciones y coadministración de adyuvantes-antígenos. Vacunas. (2020) 8:128. doi: 10.3390/vaccines8010128
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Ramakrishnan L. Revisión del papel del granuloma en la tuberculosis. Nat Rev Immunol. (2012) 12:352–66. doi: 10.1038/NRI3211
36. Arteche-Villasol N, Gutiérrez-Expósito D, Criado M, Benavides J, Pérez V. Evaluación del efecto de la vacunación contra la paratuberculosis en la formación in vitro de trampas extracelulares de neutrófilos en un modelo de oveja. Vacunas. (2022) 10:1403. doi: 10.3390/vaccines10091403
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Delgado L, Juste RA, Muñoz M, Morales S, Benavides J, Ferreras MC, et al. Diferencias en la respuesta inmune periférica entre corderos y ovejas adultas infectadas experimentalmente con Mycobacterium avium subespecie paratuberculosis. Veterinario Inmunol Inmunopatíaco. (2012) 145:23–31. doi: 10.1016/j.vetimm.2011.10.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Pérez V, Tellechea J, Corpa JM, Gutiérrez M, Marín JFG. Relación entre los hallazgos patológicos y las respuestas inmunes celulares en ovinos con paratuberculosis adquirida de forma natural. Am J Vet Res. (1999) 60:123–7.
39. Equipo central de R (2022). R: Un lenguaje y un entorno para la computación estadística. Viena: R Foundation for Statistical Computing. Disponible en línea en: https://www.R-project.org
40. Rosseels V, Huygen K. Vacunación contra la paratuberculosis. Expert Rev Vaccines. (2008) 7:817–32. doi: 10.1586/14760584.7.6.817
41. Coffman RL, Sher A, Seder RA. Adyuvantes de vacunas: poner a trabajar la inmunidad innata. Inmunidad. (2010) 33:492–503. doi: 10.1016/j.immuni.2010.10.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Bastola R, Noh G, Keum T, Bashyal S, Seo JE, Choi J, et al. Adyuvantes de vacunas: componentes inteligentes para reforzar el sistema inmunitario. Arch Pharm Res. (2017) 40:1238–48. DOI: 10.1007/S12272-017-0969-Z
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Griffin JFT, Hughes AD, Liggett S, Farquhar PA, Mackintosh CG, Bakker D. Eficacia de nuevas vacunas de células bacterianas enteras formuladas con lípidos contra Mycobacterium avium subsp. paratuberculosis en ovejas. Vacuna. (2009) 27:911–8. doi: 10.1016/j.vaccine.2008.11.053
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Begg DJ, Dhungyel O, Naddi A, Dhand NK, Plain KM, de Silva K. La inmunogenicidad y la reactividad tisular de la vacuna de células enteras inactivadas contra Mycobacterium avium subsp paratuberculosis dependen del adyuvante utilizado. Heliyon. (2019) 5:E01911. doi: 10.1016/j.heliyon.2019.e01911
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Pooley HB, Begg DJ, Plain KM, Whittington RJ, Purdie AC, De Silva K. La respuesta inmune humoral es esencial para el éxito de la protección de la vacuna contra la paratuberculosis en ovejas. BMC Vet Res. (2019) 15:1–12. doi: 10.1186/s12917-019-1972-z
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Koets A, Rutten V, Hoek A, van Mil F, Müller K, Bakker D, Gruys E, van Eden W. La paratuberculosis bovina progresiva se asocia con la pérdida local de células T CD4(+), el aumento de la frecuencia de las células T gamma delta y los cambios relacionados en la función de las células T. Infectar a Immun. (2002) 70:3856–64. doi: 10.1128/IAI.70.7.3856-3864.2002
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Flynn JAL, Chan J, Triebold KJ, Dalton DK, Stewart TA, Bloom BR. Un papel esencial del interferón γ en la resistencia a la infección por Mycobacterium tuberculosis. J Exp Med. (1993) 178:2249–54. doi: 10.1084/jem.178.6.2249
48. Chiodini RJ. Inmunología: resistencia a la paratuberculosis. Vet Clin North Am Food Anim Pract. (1996) 12:313–43. doi: 10.1016/S0749-0720(15)30409-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Arteche-Villasol N, Gutiérrez-Expósito D, Elguezabal N, Sevilla IA, Vallejo R, Espinosa J, et al. Influencia de las vacunas heterólogas y homólogas, y sus componentes, en la respuesta inmune del huésped y la protección frente a la paratuberculosis caprina experimental. Front Vet Sci. (2022) 8:1568. doi: 10.3389/fvets.2021.744568
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Coussens PM. Mycobacterium paratuberculosis y el sistema inmunitario bovino. Anim Heal Res Rev. (2001) 2:141–62. doi: 10.1079/AHRR200134
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Fernández M, Royo M, Fuertes M, Arteche-Villasol N, Ferreras MC, Benavides J. Efectos de la vacunación contra la paratuberculosis a diferentes edades en un rebaño de cabras lecheras: un seguimiento de 2 años. Animal. (2022) 12:3135. doi: 10.3390/ani12223135
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Facciuolo A, Lee AH, Trimble MJ, Rawlyk N, Townsend HGG, Bains M, et al. Un modelo de infección por micobacterias entéricas bovinas para analizar la inmunidad de la mucosa inducida por la vacuna parenteral y acelerar el descubrimiento de vacunas. Frente Immunol. (2020) 11:1. doi: 10.3389/fimmu.2020.586659
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Purdie AC, Plain KM, Pooley H, Begg DJ, de Silva K, Whittington RJ. Correlatos de la protección de la vacuna contra la infección por paratuberculosis de la subespecie Mycobacterium avium revelados en un estudio transcriptómico de las respuestas en ovejas vacunadas con Gudair. Front Vet Sci. (2022) 9:1004237. doi: 10.3389/fvets.2022.1004237®
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Kaul D, Ogra PL. Respuestas de las mucosas a las vacunas parenterales y mucosas. Stand de Dev Biol. (1998) 95:141–6.
55. Gupta RK, Relyveld EH, Lindblad EB, Bizzini B, Ben-Efraim S, Gupta CK. Adyuvantes: un equilibrio entre toxicidad y adyuvancia. Vacuna. (1993) 11:293–306. doi: 10.1016/0264-410X(93)90190-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Simutis FJ, Cheville NF, Jones DE. Investigación de las respuestas de células T específicas de antígeno y el desarrollo de granulomas subcutáneos durante la sensibilización experimental de terneros con Mycobacterium avium subsp. paratuberculosis. Am J Vet Res. (2005) 66:474–82. doi: 10.2460/ajvr.2005.66.474
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Savoji MA, Haghighat S, Mirzaee M, Golkaran B, Mirzaee R, Esfandiari B, et al. La formulación del antígeno HBs en Montanide ISA266 muestra superioridad a la vacuna comercial HBsAg en la inducción de respuestas inmunes humorales. Gastroenterol Hepatol. (2019) 12:292–300.
58. Roche PA, Furuta K. Los entresijos del procesamiento y la presentación del antígeno mediado por MHC de clase II. Nat Rev Immunol. (2015) 15:203–16. doi: 10.1038/nri3818
Resumen de PubMed | Texto completo de Crossref | Google Académico
59. Veremeyko T, Yung AWY, Anthony DC, Strekalova T, Ponomarev ED. El gen 2 de respuesta temprana al crecimiento es esencial para la activación y plasticidad de los macrófagos M1 y M2 mediante la modulación del factor de transcripción CEBPβ. Frente Immunol. (2018) 9:2515. doi: 10.3389/fimmu.2018.02515
Resumen de PubMed | Texto completo de Crossref | Google Académico
60. Villadangos JA, Schnorrer P, Wilson NS. Control de la presentación del antígeno MHC clase II en células dendríticas: un equilibrio entre las fuerzas creativas y destructivas. Immunol Rev. (2005) 207:191–205. doi: 10.1111/j.0105-2896.2005.00317.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
61. diez Broeke T, Wubbolts R, Stoorvogel W. Presentación del antígeno MHC de clase II por células dendríticas reguladas mediante clasificación endosomal. Cold Spring Harb Perspect Biol. (2013) 5:873. doi: 10.1101/cshperspect.a016873
Resumen de PubMed | Texto completo de Crossref | Google Académico
62. Kanazawa H, Ohsawa K, Sasaki Y, Kohsaka S, Imai Y. La proteína iba1 específica de macrófagos/microglía mejora el alteración de la membrana y la activación de Rac a través de la vía dependiente de la fosfolipasa C-γ. J Biol Chem. (2002) 277:20026–32. doi: 10.1074/jbc. M109218200
Resumen de PubMed | Texto completo de Crossref | Google Académico
63. Ohsawa K, Imai Y, Kanazawa H, Sasaki Y, Kohsaka S. Participación de Iba1 en la agitación de la membrana y la fagocitosis de macrófagos/microglía. J Cell Sci. (2000) 113:3073–84. doi: 10.1242/jcs.113.17.3073
Resumen de PubMed | Texto completo de Crossref | Google Académico
64. Facchetti F, Vermi W, Fiorentini S, Chilosi M, Caruso A, Duse M, et al. Expresión de óxido nítrico sintasa inducible en granulomas humanos y reacciones histiocíticas. Am J Pathol. (1999) 154:145–52. doi: 10.1016/S0002-9440(10)65261-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
65. Parameswaran N, Patial S. Señalización del factor de necrosis tumoral A en macrófagos. Crit Rev Eukaryot Gene Expr. (2010) 20:87–103. doi: 10.1615/CritRevEukarGeneExpr.v20.i2.10
66. Hanafy M, Hansen C, Phanse Y, Wu C, Nelson K, Aschenbroich SA, et al. Caracterización de las respuestas inmunitarias tempranas provocadas por vacunas vivas e inactivadas contra la enfermedad de Johne en cabras. Front Vet Sci. (2023) 9:2073. doi: 10.3389/fvets.2022.1046704
Resumen de PubMed | Texto completo de Crossref | Google Académico
67. Phuah JY, Mattila JT, Lin PL, Flynn JL. Células B activadas en los granulomas de primates no humanos infectados con Mycobacterium tuberculosis. Am J Pathol. (2012) 181:508–14. doi: 10.1016/j.ajpath.2012.05.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
68. Cavalcanti YVN, Brelaz MCA, Neves JKDAL, Ferraz JC, Pereira VRA. Papel del TNF-alfa, IFN-gamma e IL-10 en el desarrollo de la tuberculosis pulmonar. Pulm Med. (2012) 2012:745483. doi: 10.1155/2012/745483
Resumen de PubMed | Texto completo de Crossref | Google Académico
69. Sacco RE, Jensen RJ, Thoen C, Sandor M, Weinstock J, Lynch RG, Dailey M 0. Expresión de moléculas de secreción y adhesión de citoquinas por linfocitos T granulomas en la infección por Mycobacterium avium. Am J Pathol. (1996) 148:
70. Criado M, Benavides J, Vallejo R, Arteche N, Gutiérrez D, Ferreras MC. Evaluación local del subconjunto de linfocitos T γδ WC1+ en los diferentes tipos de lesiones asociadas a la paratuberculosis bovina. Comp Immunol Microbiol Infect Dis. (2020) 69:101422. doi: 10.1016/j.cimid.2020.101422
Resumen de PubMed | Texto completo de Crossref | Google Académico
71. Gideon HP, Phuah J, Junecko BA, Mattila JT. Los neutrófilos expresan citoquinas proinflamatorias y antiinflamatorias en granulomas de macacos cynomolgus infectados con Mycobacterium tuberculosis. Inmunol. Mucosa. (2019) 12:1370–81. doi: 10.1038/s41385-019-0195-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
72. Iyer SS, Cheng G. Papel de la regulación transcripcional de la interleucina 10 en la inflamación y la enfermedad autoinmune. Crit Rev Immunol. (2012) 32:23–63. doi: 10.1615/CritRevImmunol.v32.i1.30
Resumen de PubMed | Texto completo de Crossref | Google Académico
73. De Smedt T, Van Mechelen M, De Becker G, Urbain J, Leo O, Moser M. Efecto de la interleucina-10 en la maduración y función de las células dendríticas. Eur J Immunol. (1997) 27:1229–35. doi: 10.1002/eji.1830270526
Resumen de PubMed | Texto completo de Crossref | Google Académico
74. Xu X, Liu X, Long J, Hu Z, Zheng Q, Zhang C, et al. La interleucina-10 reorganiza el citoesqueleto de las células dendríticas maduras, lo que conduce a un deterioro de sus propiedades biofísicas y motilidades. PLoS UNO. (2017) 12:e0172523. doi: 10.1371/journal.pone.0172523
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: adyuvantes, paratuberculosis, sitio de inyección de la vacuna, granuloma, Gudair, Silirum
Cita: Criado M, Reyes LE, Marín JFG, Gutiérrez-Expósito D, Zapico D, Espinosa J y Pérez V (2024) Los adyuvantes influyen en las poblaciones de células inmunitarias presentes en el granuloma del lugar de la inyección inducido por vacunas de paratuberculosis inactivadas de células enteras en ovejas. Frente. Vet. Sci. 11:1284902. doi: 10.3389/fvets.2024.1284902
Recibido: 29 de agosto de 2023; Aceptado: 04 de enero de 2024;
Publicado: 30 enero 2024.
Editado por:
Paul M. Coussens, Universidad Estatal de Michigan, Estados Unidos
Revisado por:
Jayne Hope, Universidad de Edimburgo, Reino Unido
Antonio Facciuolo, Organización de Vacunas y Enfermedades Infecciosas, Centro Internacional de Vacunas (VIDO-InterVac), Canadá
Copyright © 2024 Criado, Reyes, Marín, Gutiérrez-Expósito, Zapico, Espinosa y Pérez. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Miguel Criado, mcrib@unileon.es
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


