Los betaglucanos inducen el entrenamiento inmunológico celular y cambios en la morfología intestinal en las aves de corral
 Los betaglucanos inducen el entrenamiento inmunológico celular y cambios en la morfología intestinal en las aves de corral
Los betaglucanos inducen el entrenamiento inmunológico celular y cambios en la morfología intestinal en las aves de corral
 Hadar Bar-Dgan1
Hadar Bar-Dgan1  Ofer Gover1
Ofer Gover1  Natalie Avital Cohen2
Natalie Avital Cohen2  Vaclav Vetvicka3
Vaclav Vetvicka3  Israel Rozenboim2
Israel Rozenboim2  Betty Schwartz1*
Betty Schwartz1*- 1Instituto de Bioquímica, Ciencia de los Alimentos y Nutrición, Robert H. Smith, Facultad de Agricultura, Alimentación y Medio Ambiente, Universidad Hebrea de Jerusalén, Rehovot, Israel
- 2Departamento de Ciencias Animales, Robert H. Smith, Facultad de Agricultura, Alimentación y Medio Ambiente, Universidad Hebrea de Jerusalén, Rehovot, Israel
- 3Facultad de Medicina, Departamento de Patología, Universidad de Louisville, Louisville, KY, Estados Unidos
Introducción: Los betaglucanos son conocidos como modificadores de la respuesta biológica debido a su capacidad para activar el sistema inmunitario. Esta investigación tuvo como objetivo determinar la eficacia y seguridad de la alimentación con betaglucanos de diversas fuentes sobre el estado inmunológico y la morfología intestinal de los pollos.
Métodos: Para ello utilizamos montajes in vitro e in vivo. En la configuración in vitro, se utilizó la línea celular HD-11 de macrófagos de pollo para medir la respuesta de las células inmunitarias de pollo a los betaglucanos extraídos de algas y hongos sobre la expresión génica relacionada con el sistema inmunitario y las actividades asociadas. Además, realizamos dos experimentos in vivo utilizando betaglucanos extraídos de levadura o una mezcla de betaglucanos de levadura y hongos como parte de la alimentación de los pollitos para probar sus efectos en la morfología intestinal de los pollitos.
Resultados: En la configuración in vitro, la exposición de las células HD-11 a una concentración de 1 mg/ml de betaglucanos de algas y hongos dio lugar a una expresión significativamente mayor de 6 genes (TNFα, IL4, IL6, IL8, IL10 e iNOS2) en comparación con el control. La liberación de óxido de nitrito (NO) al medio después de la exposición de las células HD-11 a hongos o betaglucanos de algas aumentó significativamente en comparación con el control. Además, se encontró un aumento significativo de la actividad de la fagocitosis después de la exposición de las células a las algas y los betaglucanos de los hongos. En la configuración in vivo observamos que la longitud de las vellosidades y el número de células caliciformes en el íleon y el yeyuno en los pollitos alimentados con beta-glucano aumentaron significativamente en comparación con el control, cuando los pollitos fueron alimentados con levadura o mezcla de beta-glucanos de levadura y hongos.
Discusión: En conclusión, la suplementación dietética de las aves de corral con beta-glucano ejerce efectos significativos y positivos sobre la actividad inmune y la morfología intestinal en las aves.
1. Introducción
Las infecciones bacterianas en las aves de corral representan un problema esencial de la ganadería que afecta el bienestar, la salud y la productividad de los animales. Las infecciones debidas a bacterias en las aves de corral son una preocupación importante para la salud y la producción eficiente de las aves. Hasta ahora, los granjeros han utilizado antibióticos para controlar enfermedades que involucran infecciones bacterianas en las aves de corral. Los pollos también han sido alimentados con bajas concentraciones de antibióticos para mejorar la ganancia diaria de peso y la eficiencia alimenticia a través de alteraciones en la supresión de enfermedades (1). Debido al uso masivo de antibióticos, el aumento en el desarrollo y la propagación de bacterias resistentes a los antibióticos se ha convertido en una causa importante de preocupación. La resistencia a los antimicrobianos es un evento natural que tiene lugar cuando las bacterias ya no responden a los antibióticos a los que antes eran susceptibles y que antes estaban activas en el tratamiento de infecciones causadas por estos microorganismos (2). En las últimas décadas, no se han producido nuevos tipos importantes de antibióticos. Casi todos los antibióticos conocidos están perdiendo cada vez más su eficacia contra los microorganismos patógenos, especialmente los utilizados en la avicultura (3). Dado que la incidencia de la resistencia a los antibióticos se ha convertido en un problema grave, aumenta la presión sobre los productores para que reduzcan el uso de antibióticos en la industria avícola (2).
Con la disponibilidad reducida de antibióticos, los productores avícolas trabajan para reducir el uso de antibióticos y buscan aditivos alimentarios para estimular el sistema inmunológico de los pollos para resistir la infección microbiana (4). Además, ha aumentado el interés en los aditivos alimentarios «naturales» que pueden estimular el sistema inmunológico de las aves de corral. Además, un impulso significativo para producir aves de corral libres de antibióticos está ganando popularidad entre el público en general (5).
Varios estudios demuestran que los betaglucanos pueden desempeñar un papel en la sustitución de los antibióticos y estimular el sistema inmunitario (6). Los glucanos son carbohidratos hechos de polímeros complejos de glucosa que proporcionan la estructura primaria que se encuentra en la pared celular de levaduras, hongos, algas y granos de cereales como la avena y la cebada (7). Las estructuras de los glucanos varían en función de su fuente y del tipo de enlaces en los polímeros de glucosa (8). La naturaleza de estos enlaces afectará a la funcionalidad de las moléculas.
Los betaglucanos se transportan al intestino delgado, luego pasan a través de los parches de Peyer en el tejido linfoide asociado al intestino (GALT) y, posteriormente, se transportan por todo el cuerpo (9). El efecto de los betaglucanos está mediado por su unión a receptores específicos. Estimula los macrófagos, la secreción de anticuerpos y aumenta la actividad de las células asesinas naturales. Al igual que los mamíferos, los macrófagos aviares sintetizan citocinas y quimiocinas como el factor de necrosis tumoral alfa (TNFα), la interleucina 4 (IL4), la interleucina 6 (IL6), la interleucina 8 (IL8), la interleucina 10 (IL10) y el interferón gamma (IFN-γ) (10, 11). Además de la estimulación directa de la inmunidad específica e inespecífica, los glucanos también pueden influir en la expresión de genes y proteínas relacionados con el sistema inmunitario. La estimulación en el funcionamiento inmunológico sirve para combatir los efectos adversos de la infección entérica o la inmunosupresión debido a condiciones de crianza de alto estrés (9).
Se informó que los betaglucanos son efectivos para promover el crecimiento de pollos de engorde y mejorar la calidad de su carne (12). Se ha demostrado que los betaglucanos mejoran la salud intestinal de las aves de corral sometidas a un desafío bacteriano y aumentan el flujo de nuevos inmunocitos hacia los distintos órganos linfoides (13). Los betaglucanos pueden aumentar la funcionalidad de los macrófagos (14), afectar la morfología intestinal y funcionar como inmunomoduladores antiinflamatorios (7). El extracto de levadura dietético de manano-oligosacárido (MOS) que contiene MOS y la suplementación con betaglucanos a pavitos de pavo puede aumentar el número de células caliciformes y regular la producción de mucina-2 de las células caliciformes (15), mejora la altura de las vellosidades y la profundidad de las criptas y su proporción en el duodeno y el íleon (16). Además, los consumidores pueden aceptar más fácilmente los piensos enriquecidos con betaglucanos con más confidencialidad que las aves de corral tratadas con antibióticos (5). Proponemos que cuando se utiliza una declaración, «los glucanos introducidos en la alimentación de las aves de corral» siempre se asociarán con «aves de corral libres de antibióticos», y esta información puede transferirse fácilmente a la conciencia del consumidor. Las mezclas de betaglucano pueden implementarse para obtener un rendimiento antiinflamatorio, inmunomodulador y de crecimiento óptimo y una morfología intestinal e histología optimizadas en aves de corral (17, 18).
Se desconoce la actividad específica de cada subtipo de betaglucanos, y no se ha realizado una comparación directa de los betaglucanos derivados de diferentes fuentes en aves de corral. A pesar de los numerosos glucanos aislados de diversas fuentes, no se ha llegado a la decisión sobre los glucanos más activos en aves o en cualquier otro modelo animal, lo que a veces conduce a resultados contradictorios. Debido a que existe una amplia variación en la estructura de los betaglucanos en función de su origen, su eficacia en la modulación del sistema inmunitario puede variar (8). No obstante, generalmente se acepta que los 1,3 y 1,6-betaglucanos, derivados de la levadura y los hongos, se consideran la forma más efectiva disponible debido a su compleja red de ramificación de carbohidratos (19, 20). Por lo tanto, nos centramos en el uso de betaglucanos, procedentes de levaduras, hongos y algas, como supuestos inmunomoduladores en aves de corral. Nuestro objetivo fue encontrar el tipo y la concentración óptima de beta-glucano para ejercer el entrenamiento inmunológico óptimo y las adaptaciones sobre las actividades morfológicas intestinales en aves de corral utilizando configuraciones in vitro e in vivo. Los resultados de nuestro estudio pueden contribuir al objetivo general de reducir o incluso eliminar los antibióticos, lo que puede ser excepcionalmente beneficioso para los ganaderos para evitar pérdidas económicas y para los consumidores de pollo que buscan carne libre de antibióticos (21). Los resultados pueden aportar conocimientos comercialmente necesarios sobre este campo agrícola críticamente no explorado adecuadamente.
2. Materiales y métodos
2.1. Betaglucanos
(1) Un extracto de glucano de algas, utilizado en ensayos in vitro, fue amablemente proporcionado por Quegen Biotech (Corea del Sur). (2) Los glucanos de levadura (Saccharomyces cerevisiae) (Glucan #300) utilizados en ensayos in vivo fueron amablemente proporcionados por Transfer Point (Columbia, SC, EE. UU.). Para los ensayos in vitro se utilizaron betaglucanos de algas, ya que estos betaglucanos son fácilmente solubles en agua. Los glucanos de levadura (Saccharomyces cerevisiae) son completamente insolubles en agua o en cualquier otro disolvente, por lo que no pudimos utilizarlos en los ensayos in vitro. Además, el costo de los betaglucanos de algas es extremadamente alto, por lo que no es factible su uso con fines de alimentación, por lo que elegimos para los experimentos de alimentación el uso de glucanos de levadura (la proporción de alfa a beta glucanos en ambas preparaciones es similar) y beta glucanos de algas para los ensayos in vitro. Para los ensayos in vitro, los glucanos se disolvieron en agua bidestilada (DDW) hasta una concentración final de 50 mg/ml del extracto en un baño de agua durante 1 h a 80 °C. La solución se esterilizó en autoclave calentándola a 121 °C durante 30 min. A continuación, la solución se diluyó en el medio de águila modificado de Dulbecco (DMEM) hasta una concentración final de 5, 1, 0,5 y 0,05 mg/ml. (3) Los glucanos de hongos se extrajeron de los hongos ostra rey (amablemente proporcionados por Tekoa farms, Israel). Los hongos se molían hasta convertirlos en polvo fino en hielo seco. El polvo de hongos se disolvió en agua destilada, en una concentración de 1 g de polvo de hongos en 10 ml y se esterilizó en autoclave a 121 °C durante 30 min. A continuación, la solución se peletizó a una velocidad de 13.000×g a 10 °C durante 15 min; La fase líquida se transfirió a etanol a una concentración final de 1:2. A continuación, la solución se almacenó a una temperatura de -20 °C durante la noche. Después de aproximadamente 24 h, se forma un flotador. El flotador se secó en una campana extractora durante 24 h. El flotador seco se congeló a -80 °C durante la noche y se liofilizó para obtener un polvo uniforme (22). Para los experimentos in vitro, los glucanos extraídos de los hongos se disolvieron en el disolvente dimetilsulfóxido (DMSO) hasta una concentración final de 5 mg/ml del extracto de beta glucano en un baño de agua durante 1 h a 90 °C y se diluyeron en DMEM a la concentración final de 5, 1, 0,5 y 0,05 mg/ml. α y β glucanos se cuantificaron utilizando el kit de ensayo de beta-glucano Megazyme (Megazyme, Irlanda) de acuerdo con el protocolo del fabricante.
2.2. Cultivo celular
Las células de macrófagos HD11 de pollo fueron amablemente proporcionadas por la Dra. Elisabeth Kowenz-Leutz (Centro Max Delbrueck, Berlín, Alemania) y cultivadas en 75 mm2 matraces con 18 ml de medio de crecimiento DMEM suplementado con suero fetal bovino (FBS) al 8%, suero de pollo al 2%, penicilina al 1% y estreptomicina. A continuación, las células se incubaron a 37 °C y 5% de CO2 hasta alcanzar el 95% de confluencia. Para el análisis de expresión génica y óxido nítrico, las células se cultivaron en placas de 6 pocillos (1 × 106 células/ml). Después de 48 h, se retiró el medio y se retiró el medio DMEM fresco con lipopolisacárido (LPS) (de E. Coli, O111:B4; Se añadió Sigma L4130 (utilizado en concentraciones especificadas como se indica a continuación) o glucanos y se utilizaron como estimulante proinflamatorio. Las células se recolectaron para el ARN y los sobrenadantes se recolectaron y almacenaron a -80 °C.
2.2.1. Expresión génica
El ARN se extrajo de las células HD11 utilizando NucleoSpin RNA, Mini kit (MN, Alemania), de acuerdo con las instrucciones del fabricante. El ARN se cuantificó utilizando Nanodrop 2000 (ThermoFisher USA). Se utilizaron 2 μg de ARN para sintetizar ADNc utilizando el kit de síntesis de ADNc qScript (Quanta bio, EE. UU.).
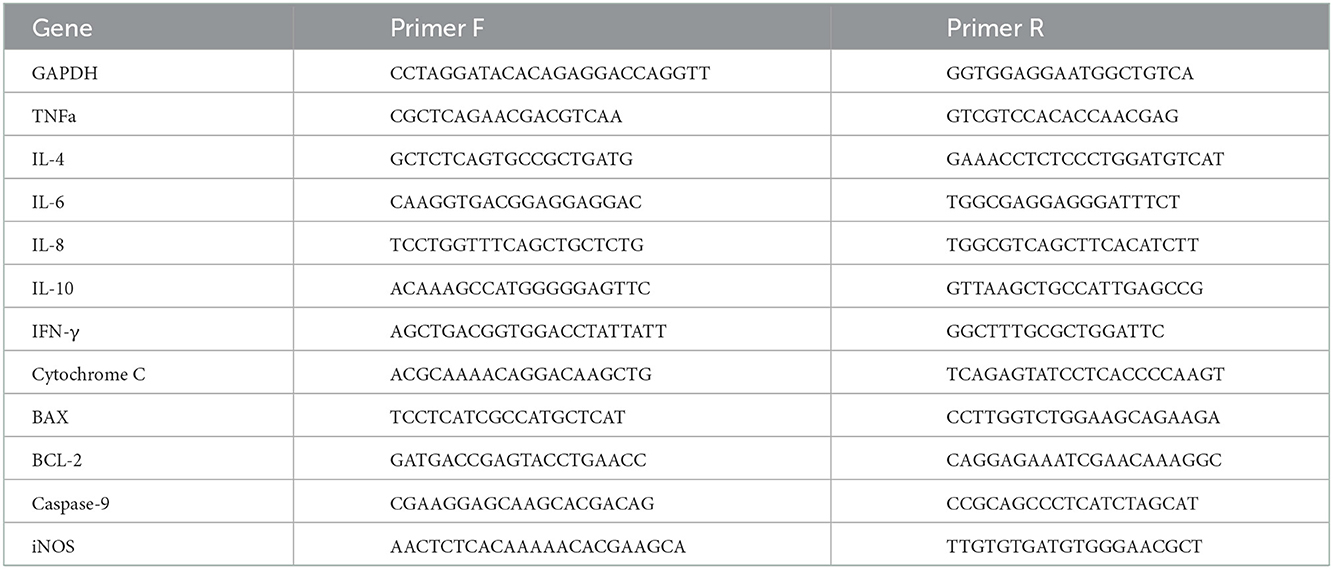
La qPCR en tiempo real se realizó utilizando una mezcla maestra verde SYBR rápida (ABI, EE. UU.) en la máquina Quant studio 1 (ABI, EE. UU.). Para la normalización de la expresión génica en todas las reacciones, se utilizó el gen GAPDH. En la Tabla 1 se presentan los cebadores para la expresión génica relativa. La normalización y cuantificación se realizó utilizando la curva std de diluciones seriadas 1:5 o el método ddCt (23).
Tabla 1. Lista de cebadores probados para la expresión génica relativa.
2.2.2. Ensayo colorimétrico de óxido nítrico
Se utilizó un kit de ensayo colorimétrico de nitrato/nitrito (Cayman Chemical, EE. UU.) para cuantificar la cantidad de óxido nítrico liberado al medio. El proceso se realizó de acuerdo con el protocolo del fabricante. Brevemente, se añadieron 200 μL de tampón de ensayo a 96 pocillos vacíos, seguidos de 80 μL del medio de muestra. Se añadieron 10 μL de cofactor enzimático a cada pocillo, seguido de 10 μL de mezcla de nitrato reductasa durante 1 h a temperatura ambiente. Los pocillos se suplementaron con reactivo Griess durante 10 min de incubación y se transfirieron a un lector de placas para leer la absorbancia a 540 nm (BioTek synergy H1, Agilent technologies CA, EE. UU.).
2.2.3. Ensayo de fagocitosis
La actividad de la fagocitosis de los macrófagos se evaluó utilizando el kit pHrodo™ Red Zymosan BioParticles («Zymosan», Life Technologies, EE. UU.) de acuerdo con el protocolo del fabricante. Brevemente, las células HD11 se cultivaron en placas de 96 pocillos (1 × 106 células/ml) para todos los experimentos. Después de 48 h, se retiró el medio y se añadió un medio DMEM fresco con betaglucanos de algas (1 mg/ml), betaglucanos de hongos (1 mg/ml) o LPS (100 ng/ml, preparado en DDW esterilizado) y se utilizó como activador estimulante durante 1 h. Las BioPartículas proporcionadas por el kit se sometieron a vórtice y se resuspendieron homogéneamente en DMEM transparente (pH = 7,4) y luego se sonicaron durante 10 min (Bioruptor; Diagenode, Denville, NJ) con el fin de dispersar homogéneamente las partículas. A continuación, se retiró el medio de los cultivos, se sustituyó por las «partículas de Zymosan» dispersas a 100 μL/pocillo y se incubó a 37 °C con 5% de CO2 durante otras 1-1,5 h. La actividad de fagocitosis en las células adheridas se midió utilizando un lector de placas utilizando una excitación de 560 nm y una emisión de 590 nm (BioTek synergy H1, Agilent technologies CA, EE. UU.).
2.3. Experimentos in vivo
Todos los procedimientos experimentales se llevaron a cabo bajo la aprobación del comité de ética de la Universidad Hebrea de Jerusalén. Se llevaron a cabo dos experimentos en la unidad avícola y en los laboratorios de investigación de la Facultad de Agricultura, Alimentación y Ciencias Ambientales de Israel. Todos los experimentos con animales se realizaron bajo el cuidado y la supervisión del Prof. Israel Rozenboim. Uno de los experimentos in vivo probó los efectos del tratamiento con betaglucanos extraídos de levaduras en varias concentraciones; sobre el crecimiento y desarrollo de los pollos de engorde. El segundo experimento in vivo probó los efectos del tratamiento con dos tipos de betaglucanos aislados de levaduras y hongos, a diferentes concentraciones. Los experimentos probaron el crecimiento y desarrollo de los pollos de engorde y su salud intestinal. Brevemente, los pollos de engorde Fertile Ross 1 de 308 día de edad se asignaron aleatoriamente por sexo (macho y hembra) en un experimento completo de diseño de bloques aleatorios en un diseño factorial de 3 × 2 para un ensayo de alimentación de 5 semanas. Los pollos de engorde se sometieron a una dieta comercial estándar suplementada con diferentes niveles de betaglucanos: sin betaglucanos (control), betaglucanos en una proporción de 250 mg/kg y 1 g/kg de alimento se mezclaron con un alimento comercial estándar (alimento básico). El primer experimento in vivo fue en febrero de 2021 en el gallinero experimental de la Facultad de Agricultura en Rehovot, Israel. Se dividieron 150 pollos según el sexo (75 machos y 75 hembras) y se subdividieron en tres grupos de tratamiento. Control, 250 mg/kg de betaglucanos (Glucan #300, 89% betaglucanos), 1 g/kg de glucanos alimento. El segundo experimento in vivo se llevó a cabo en abril de 2022. Se dividieron 60 pollos según el sexo (30 machos y 30 hembras) y se subdividieron en tres grupos de tratamiento. (1) Controlar (2) 250 mg/kg de betaglucanos de levadura y hongos cultivados, en una proporción de 3:1 de levadura a hongo en el alimento; (3) 1 g/kg de betaglucanos de levadura y setas cultivadas en una proporción de 3:1 entre levaduras y setas en el pienso. Este régimen de alimentación se eligió en base a los resultados preliminares en un pequeño número de aves (no mostradas) que demostraron efectos positivos en los parámetros medidos para los betaglucanos de levadura. A la edad de 35 días se sacrificaron aves y se crearon portaobjetos de parafina como se describe a continuación. Durante todo el período del experimento, todas las aves tuvieron libre acceso a alimento y agua. Las aves se criaron en dos salas de cría en el suelo divididas en 15 corrales, cada uno con una densidad de 10 aves por corral para cada sexo. La temperatura ambiente se regulaba y ventilaba de forma centralizada. Todos los pollos de engorde fueron expuestos a un fotoperiodo de 23 L:1D. A los 35 días de edad, las aves fueron sacrificadas por CO2 asfixia, y se le practicó la autopsia. Se obtuvieron segmentos del intestino delgado y se fijaron en una solución de formalina tamponada al 4%. Se cortaron secciones transversales seriadas de 4 μm del íleon y el yeyuno y se tiñeron para su evaluación morfológica (tinción H&E). La longitud de las vellosidades y el número de células caliciformes se midieron y contaron con el software ImageJ (National Institutes of Health, Bethesda, versión 1.53s).
2.3.1. Ácido peryódico azul alcián: tinción de Schiff (AB-PAS)
La tinción con AB-PAS de las secciones incluidas en parafina y de los portaobjetos fijados en formol se realizó de acuerdo con las instrucciones del fabricante [Kit de tinción de ácido peryódico-Schiff (PAS) (Laboratorios Scytek)]. Brevemente, se añadió una solución de ácido acético al 3% gota a gota sobre las secciones de tejido, seguida de 5-10 gotas de solución de azul alcián (pH 2,5). Los portaobjetos se tiñeron durante 25-30 minutos y luego se añadieron 5-10 gotas de la solución de ácido peryódico durante 5 minutos. Los portaobjetos se enjuagaron y se añadieron con la solución de Schiff durante 20 min, seguido de la tinción con hematoxilina. Las secciones se montaron y visualizaron bajo el microscopio y las células caliciformes se contaron manualmente.
3. Estadísticas
Todas las estadísticas se realizaron en JMP pro 14 (SAS Institute Inc., Cary, Carolina del Norte, 1989-2019); Los datos se expresan como media ± EE. La comparación entre medias de más de dos grupos se analizó mediante ANOVA de medias y HSD de Tukey.
4. Resultados
4.1. Incubación de macrófagos HD11 con algas β-glucanos
De los 11 genes analizados, 6 mostraron expresión diferencial en respuesta a la exposición a LPS. La expresión se probó en diferentes momentos. TNFα, IL4, IL6, INFγ, Citocromo C y BAX expresaron su máxima expresión después de 4 h de incubación con 100 ng/ml de LPS (Figura suplementaria 1). La IL8 mostró una expresión máxima a las 8 h con 100 ng/ml de LPS (Figura suplementaria 1D), la citocina antiinflamatoria IL10 alcanzó su punto máximo después de 2 h con 200 ng/ml de LPS (Figura suplementaria 2A), BCL-2 alcanzó su punto máximo después de 24 con 200 ng/ml de LPS y la caspasa 9 después de 4 h con 200 ng/ml también (Figuras suplementarias 3A, B). iNOS2 aumentó significativamente después de 8 h y 50 ng/ml de LPS (Figura suplementaria 3C).
Los betaglucanos de algas estimularon la expresión génica dependiente de la dosis de TNFα e IL4. La expresión máxima obtenida para TNF-α (Figura 1A) se detectó a 5 mg/ml después de 8 h de incubación y a 1 y 5 mg/ml durante 24 h de incubación. Para IL4, la expresión más alta se alcanzó a 5 mg/ml durante 8 h, seguida de 1 y 5 mg/ml durante 24 h (Figura 1B).
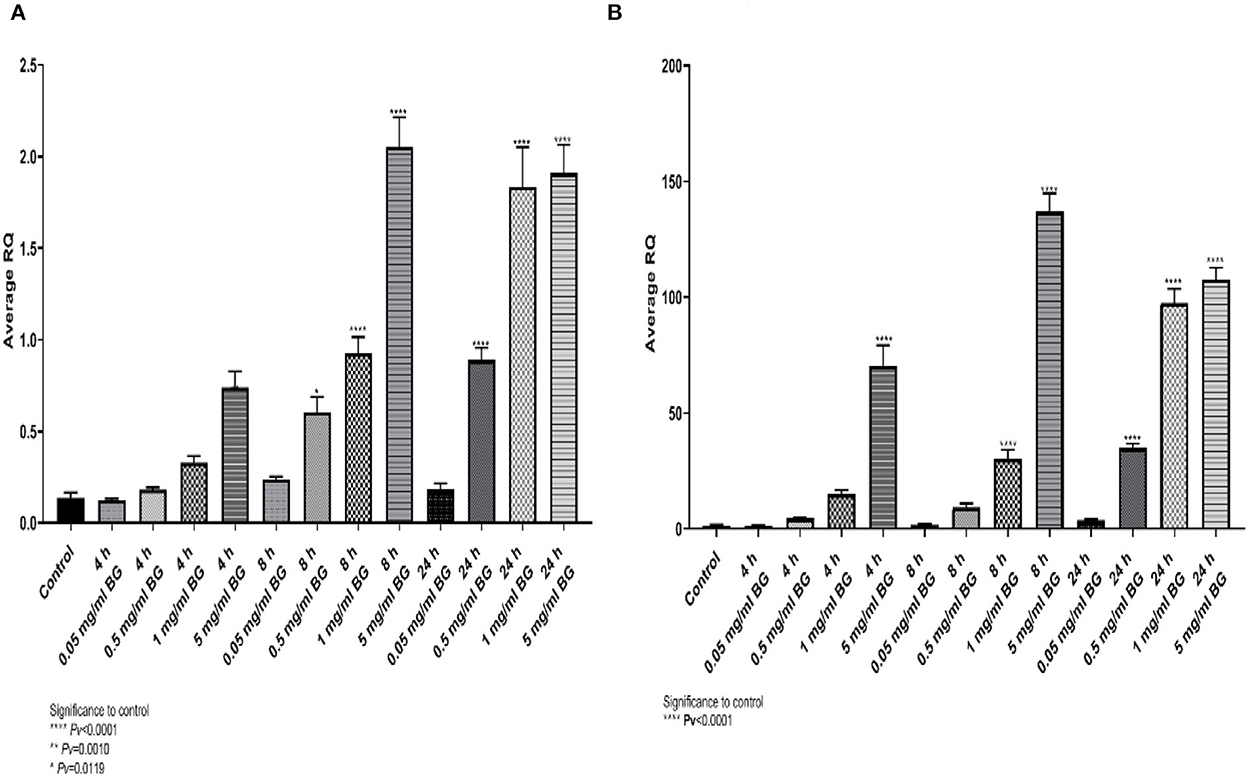 Figura 1. (A) Expresión relativa media para el gen TNFα, (B) la expresión génica de pliegue relativo (DDCT) para el gen IL4, después de la exposición a betaglucanos de algas en 3 puntos de tiempo y 4 concentraciones (n = 6). Pv < 0,000,1, **Pv = 0,0010, *Pv = 0,0119, en comparación con el control.
Figura 1. (A) Expresión relativa media para el gen TNFα, (B) la expresión génica de pliegue relativo (DDCT) para el gen IL4, después de la exposición a betaglucanos de algas en 3 puntos de tiempo y 4 concentraciones (n = 6). Pv < 0,000,1, **Pv = 0,0010, *Pv = 0,0119, en comparación con el control.
Se mostró un patrón de expresión similar para IL6 e IL10 (Figuras 2A, B), donde la expresión alcanzó su punto máximo a las 8 h y 5 mg/ml, mientras que para IL8 e iNOS2 los niveles más altos se detectaron a las 24 h (Figuras 2C, D). Los resultados indican una regulación positiva de la expresión génica de citoquinas resultante de la incubación con betaglucanos de algas.
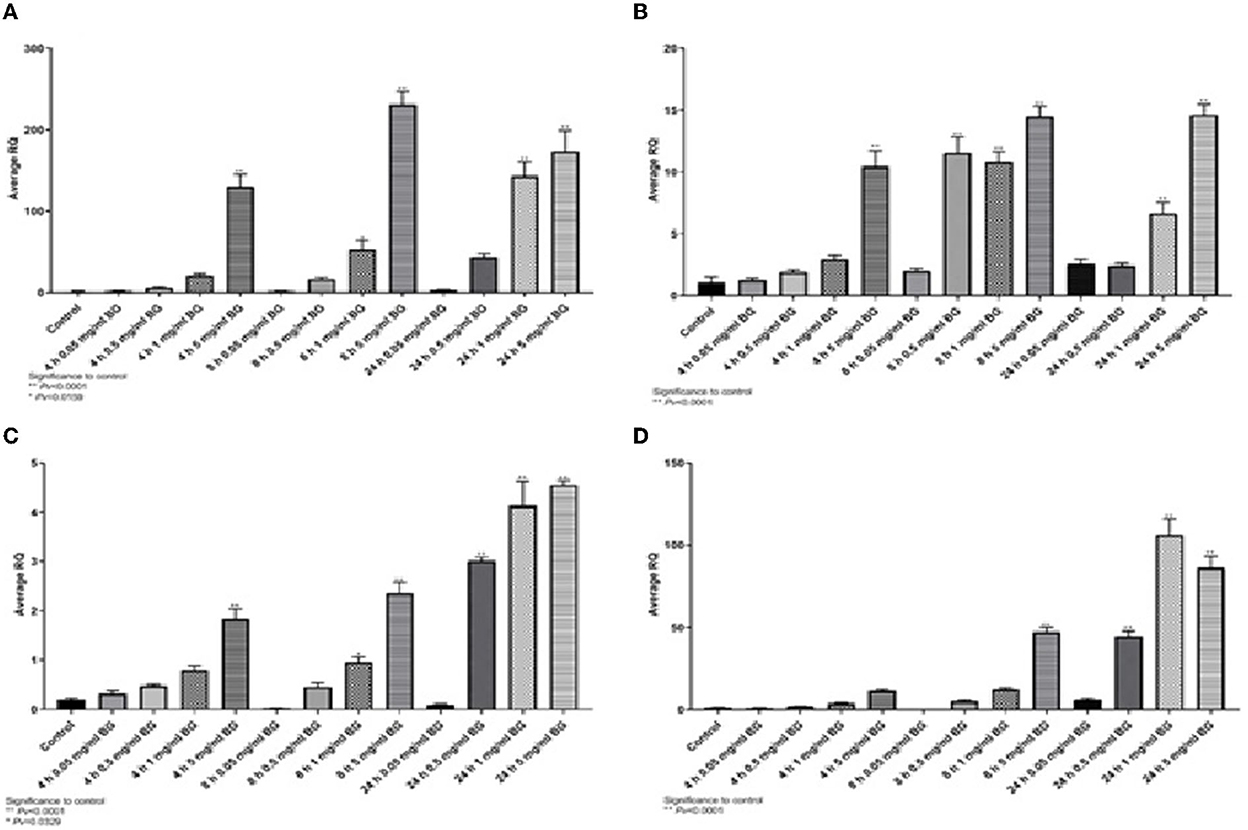 Figura 2. Expresión de genes de citoquinas a diferentes concentraciones de β-glucano de algas y tiempos de incubación. (A) IL6, (B) IL10, (C) IL8 y (D) iNOS 2.
Figura 2. Expresión de genes de citoquinas a diferentes concentraciones de β-glucano de algas y tiempos de incubación. (A) IL6, (B) IL10, (C) IL8 y (D) iNOS 2.
4.1.1. Liberación de óxido nítrico
El óxido nítrico es una molécula importante relacionada con los efectos antimicrobianos de los macrófagos y es un indicador químico de la respuesta inflamatoria. La liberación de NO fue significativamente diferente de los niveles de control después de la exposición a 1 mg/ml de betaglucanos de algas durante 24 h. La liberación de NO después del estímulo con LPS a una concentración de 100 ng/ml durante 4 h de estimulación no mostró diferencias significativas con respecto al control; sin embargo, después de 8 h fue significativamente diferente del control. La liberación de NO al medio después de la exposición a betaglucanos de algas a una concentración de 1 mg/ml durante 24 h fue significativamente mayor que incluso después de la exposición a LPS durante 4 h y durante 8 h (Figura 3).
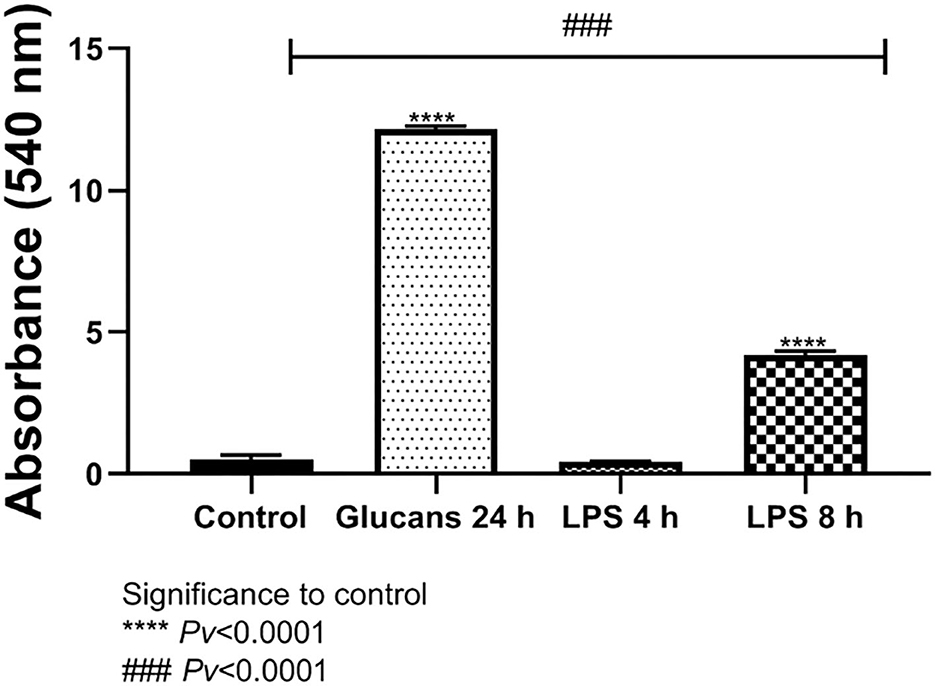 Figura 3. Liberación de NO al medio después de la exposición a algas betaglucanos glucanos glucanos durante 24 h, o LPS. Pv < 0,0001 en comparación con el grupo control. Pv < 0,0001 comparó la exposición a betaglucanos en contraste con LPS durante 4 y 8 h (n = 5).###
Figura 3. Liberación de NO al medio después de la exposición a algas betaglucanos glucanos glucanos durante 24 h, o LPS. Pv < 0,0001 en comparación con el grupo control. Pv < 0,0001 comparó la exposición a betaglucanos en contraste con LPS durante 4 y 8 h (n = 5).###
4.2. Comparación de los betaglucanos extraídos de algas y setas
El análisis del contenido de glucanos reveló que los extractos de algas consistían en un 59,4% de betaglucanos, mientras que los extractos de hongos contenían un 8,5% de betaglucanos. Los macrófagos HD11 se incubaron con 1 mg/mL de cada extracto durante 24 h.
4.2.1. Expresión génica
La expresión de TNFα fue significativamente mayor que la del control después de la exposición a betaglucanos de algas, pero no se midió la expresión significativa cuando se expuso a betaglucanos extraídos de hongos (Figura 4A). La expresión de IL4, IL6 e IL8 fue significativamente diferente de la del control después de 24 h de exposición a betaglucanos de algas y betaglucanos de hongos (Figuras 4B-D). La expresión de IL10 fue significativamente diferente de la del control después de la exposición a los betaglucanos de los hongos, pero no se midió la expresión significativa cuando se expuso a los betaglucanos de las algas (Figura 4E). Las iNOS, de manera similar a IL4, IL6 e IL8, se expresaron significativamente en el control después de 24 h de exposición a betaglucanos de algas y hongos (Figura 4F).
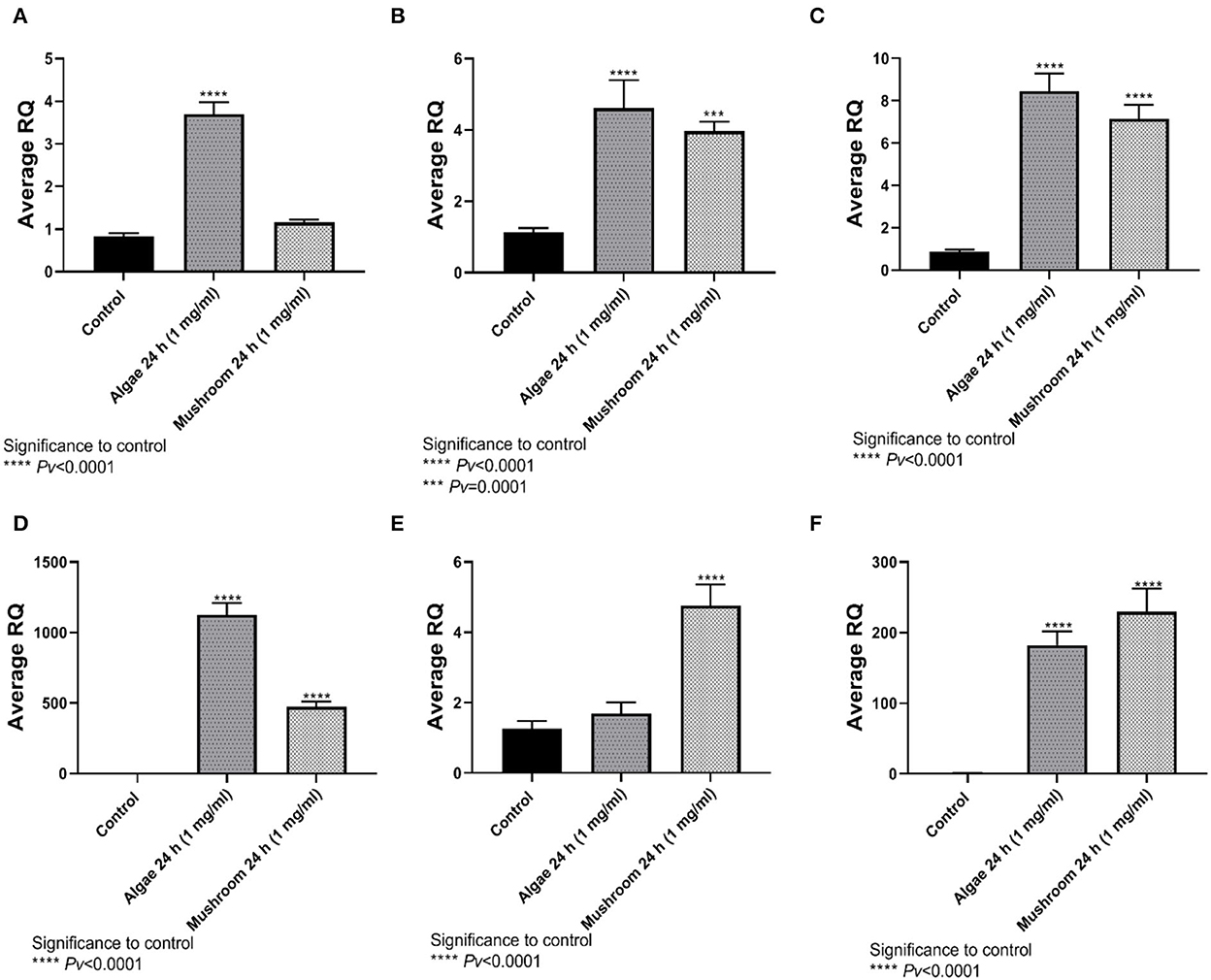 Figura 4. Expresión génica después de 24 h de incubación con glucanos de Algea o Champiñón. (A) Tnfα, (B) IL4, (C) IL6, (D) IL8, (E) IL10, (F ) iNOS 2 en comparación con el grupo de control que utiliza la expresión génica de pliegue relativo (DDCT) (n = 5).
Figura 4. Expresión génica después de 24 h de incubación con glucanos de Algea o Champiñón. (A) Tnfα, (B) IL4, (C) IL6, (D) IL8, (E) IL10, (F ) iNOS 2 en comparación con el grupo de control que utiliza la expresión génica de pliegue relativo (DDCT) (n = 5).
4.2.2. Creación con óxido nítrico
La liberación de NO al medio después de la exposición a betaglucanos de hongos o algas durante 24 h, y 1 mg/ml de betaglucanos, fue significativamente mayor en comparación con el grupo control. Los betaglucanos de algas indujeron una liberación de más NO que los grupos expuestos a LPS durante 4 u 8 h. Estos resultados son consistentes con nuestros resultados previos relacionados con la expresión génica del NO. Por el contrario, la cantidad de NO liberada después de la exposición a los betaglucanos de hongos fue significativamente diferente del grupo expuesto a 4 h de LPS, pero no del expuesto a 8 h de LPS (Figura 5).
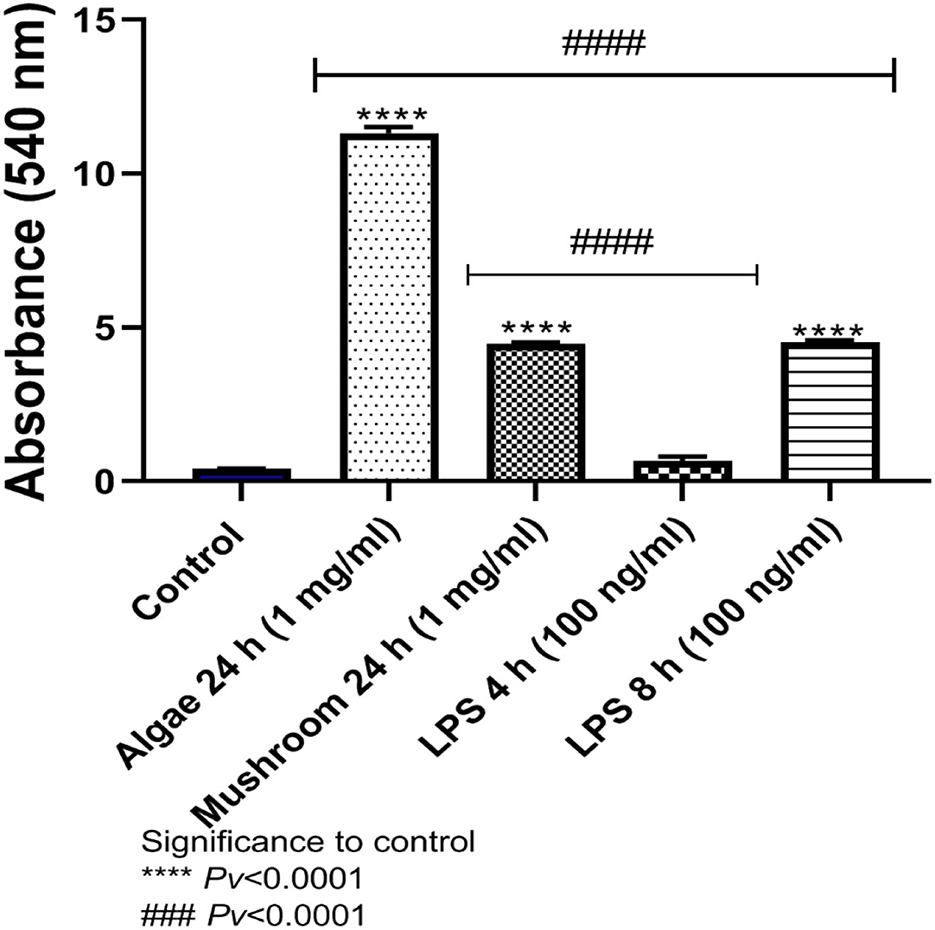 Figura 5. Liberación de NO al medio después de la exposición a algas o hongos, betaglucanos, glucanos glucanos durante 24 h, o LPS. Pv < 0,0001 significación para el grupo control. Pv < 0,0001 de significancia entre betaglucanos a LPS durante 4 y 8 h (n = 5).###
Figura 5. Liberación de NO al medio después de la exposición a algas o hongos, betaglucanos, glucanos glucanos durante 24 h, o LPS. Pv < 0,0001 significación para el grupo control. Pv < 0,0001 de significancia entre betaglucanos a LPS durante 4 y 8 h (n = 5).###
4.2.3. Fagocitosis
Para examinar la actividad de la fagocitosis, las células HD11 se incubaron durante 1 h con 1 mg/ml de betaglucanos de hongos o algas o 100 ng/ml de LPS. La fagocitosis se midió utilizando pHrodo™ Red Zymosan BioParticles («Zymosan», Life Technologies, EE. UU.) después de 60 minutos (Figura 6). Los betaglucanos de algas y hongos aumentaron significativamente la actividad de fagocitosis en comparación con el control en ambos momentos. El LPS aumentó significativamente la actividad de fagocitosis del control solo después de 60 min (Figura 6).
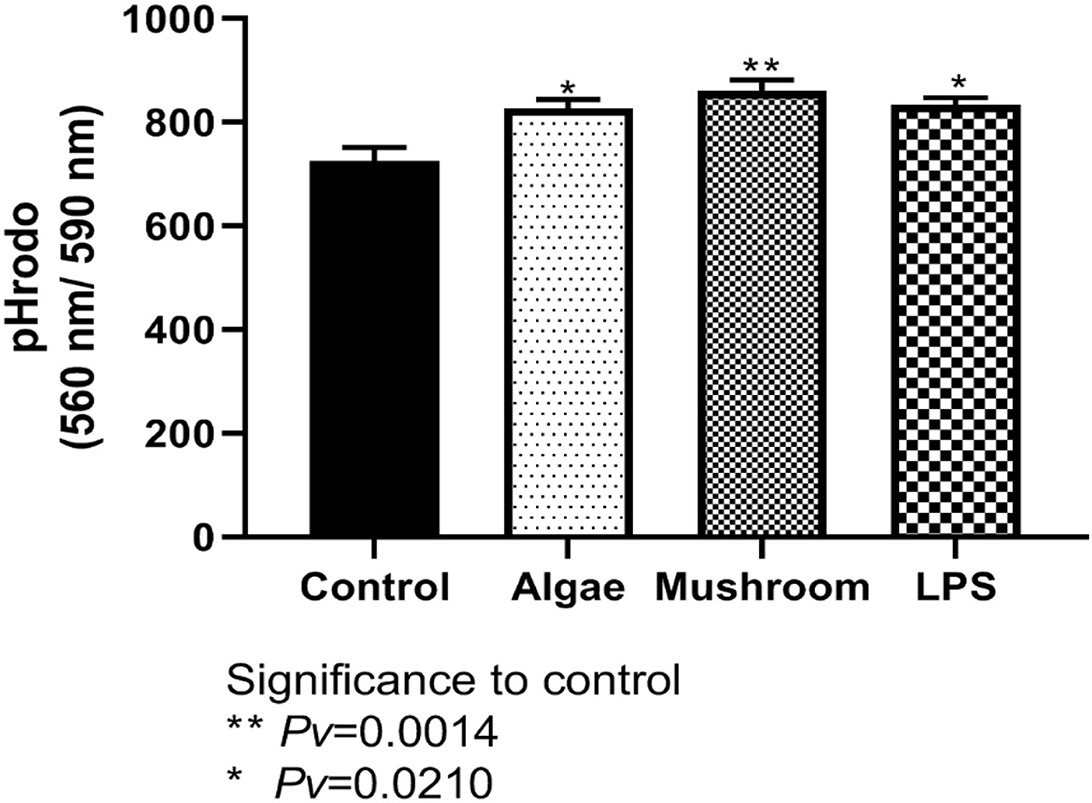 Figura 6. La actividad de fagocitosis medida después de 60 min. de la línea celular HD11 se incubó durante 1 h con 1 mg/ml de betaglucanos de hongos o algas (n = 6), o 100 ng/ml de LPS (n = 3) y se comparó con el control (n = 3).
Figura 6. La actividad de fagocitosis medida después de 60 min. de la línea celular HD11 se incubó durante 1 h con 1 mg/ml de betaglucanos de hongos o algas (n = 6), o 100 ng/ml de LPS (n = 3) y se comparó con el control (n = 3).
4.2.4. Tamaño de Vili
El aumento de la altura de las vellosidades afecta directamente a la capacidad de absorción de nutrientes en el intestino, ya que aumentaría la absorción y la superficie (24). La altura de las vellosidades se definió como la distancia desde la punta de las vellosidades hasta la unión de la cripta. Las mediciones de las vellosidades tomadas del íleon femenino no mostraron diferencias entre el tratamiento con glucano #300 betaglucanos para el control (Figura 7A, Figura suplementaria 4). La longitud de las vellosidades masculinas del íleon fue significativamente mayor en ambos grupos de tratamiento en comparación con el control (Figura 7B). Las mediciones de las vellosidades femeninas y masculinas del yeyuno mostraron diferencias significativas entre el tratamiento con glucano #300 betaglucanos al control (Figuras 7C, D).
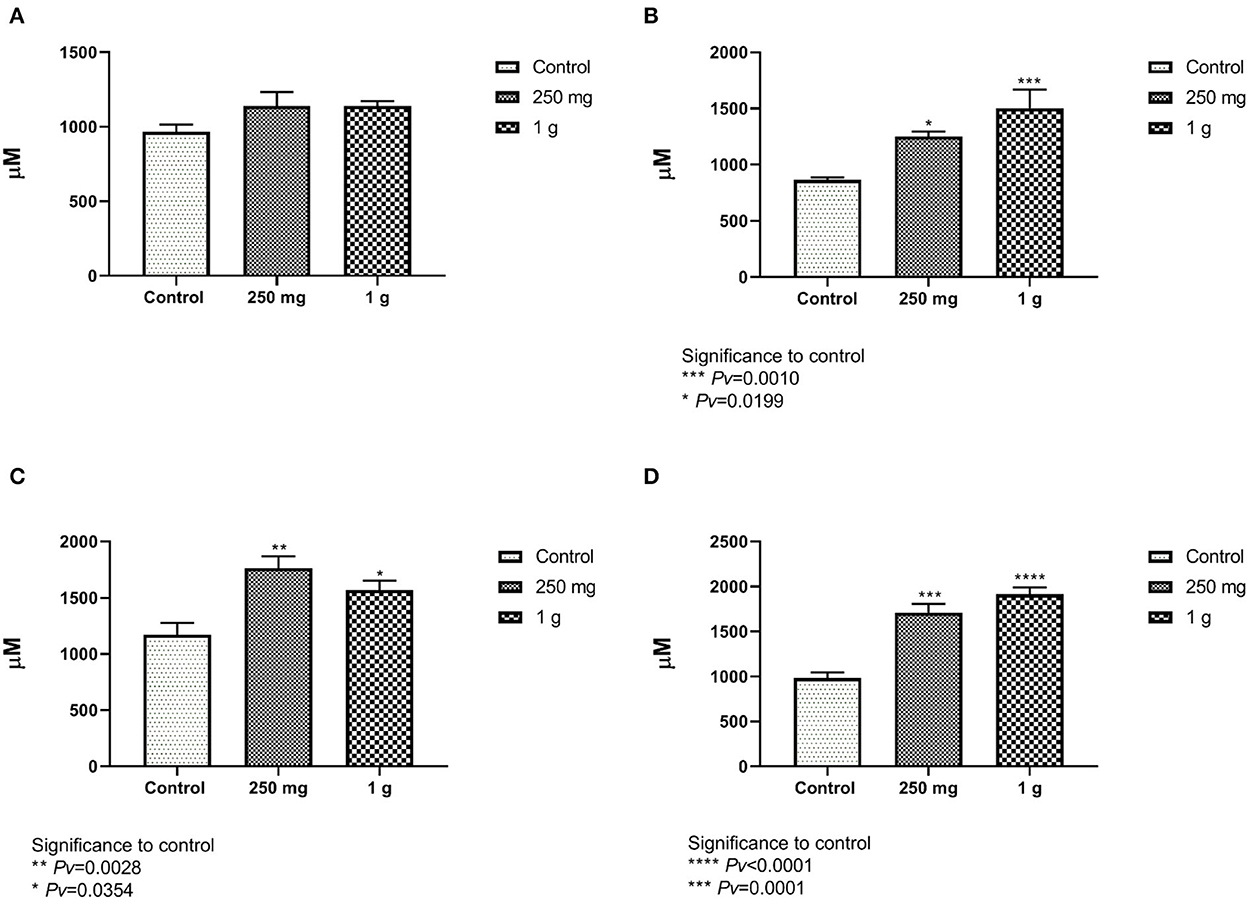 Figura 7. (A, B) La longitud de las vellosidades desde el íleon en comparación con los grupos de tratamiento con betaglucanos hasta el control. (A) Las hembras y la figura. (B) Los machos (n = 5 por grupo). (C, D) La longitud de las vellosidades desde el yeyuno en comparación con los grupos de tratamiento con betaglucanos hasta el control. (C) Representar a las hembras, y (D) a los machos (n = 5 por grupo).
Figura 7. (A, B) La longitud de las vellosidades desde el íleon en comparación con los grupos de tratamiento con betaglucanos hasta el control. (A) Las hembras y la figura. (B) Los machos (n = 5 por grupo). (C, D) La longitud de las vellosidades desde el yeyuno en comparación con los grupos de tratamiento con betaglucanos hasta el control. (C) Representar a las hembras, y (D) a los machos (n = 5 por grupo).
4.2.5. Recuento de células caliciformes
El número de células caliciformes del íleon y el yeyuno de las hembras mostró diferencias significativas entre ambos tratamientos, 1 g/kg y 250 mg/kg, con betaglucanos a control (Figuras 8A, C, Figura suplementaria 5). Estos resultados también fueron evidentes en el grupo masculino (Figuras 8B, D).
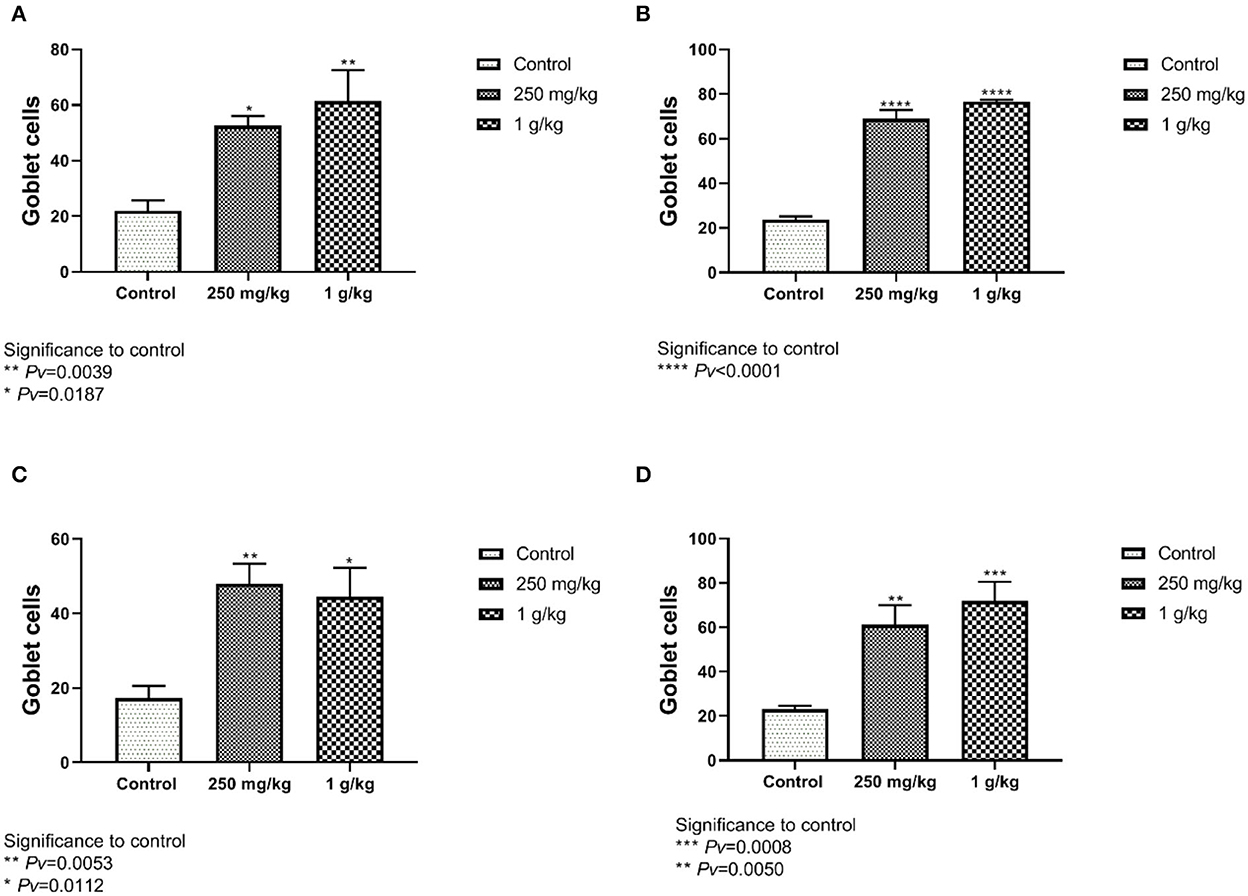 Figura 8. El número de células caliciformes contadas de las secciones de yeyuno e íleon. Grupos de tratamiento con betaglucanos en comparación con el control. (A) Íleon femenino, (B) íleon masculino, (C) yeyuno femenino, (D) yeyuno masculino (n = 5 por grupo). Pv se compara con el control.
Figura 8. El número de células caliciformes contadas de las secciones de yeyuno e íleon. Grupos de tratamiento con betaglucanos en comparación con el control. (A) Íleon femenino, (B) íleon masculino, (C) yeyuno femenino, (D) yeyuno masculino (n = 5 por grupo). Pv se compara con el control.
4.3. Efecto de una combinación de glucanos de levadura y mushroon
Las mediciones de las vellosidades tomadas del yeyuno femenino mostraron diferencias significativas entre el tratamiento con betaglucanos y el control. La longitud de las vellosidades femeninas y masculinas del yeyuno fue significativamente mayor en ambos grupos de tratamiento en comparación con el control (Figuras 9A, B). El número de células caliciformes encontradas en el yeyuno de las hembras mostró diferencias significativas entre ambos tratamientos, 1 g/kg y 250 mg/kg de betaglucanos en comparación con el control (Figura 9C). Estos resultados también se observaron en el grupo masculino (Figura 9D). Se obtuvieron resultados similares para las mediciones de la longitud del íleon y el número de células caliciformes (no se muestran).
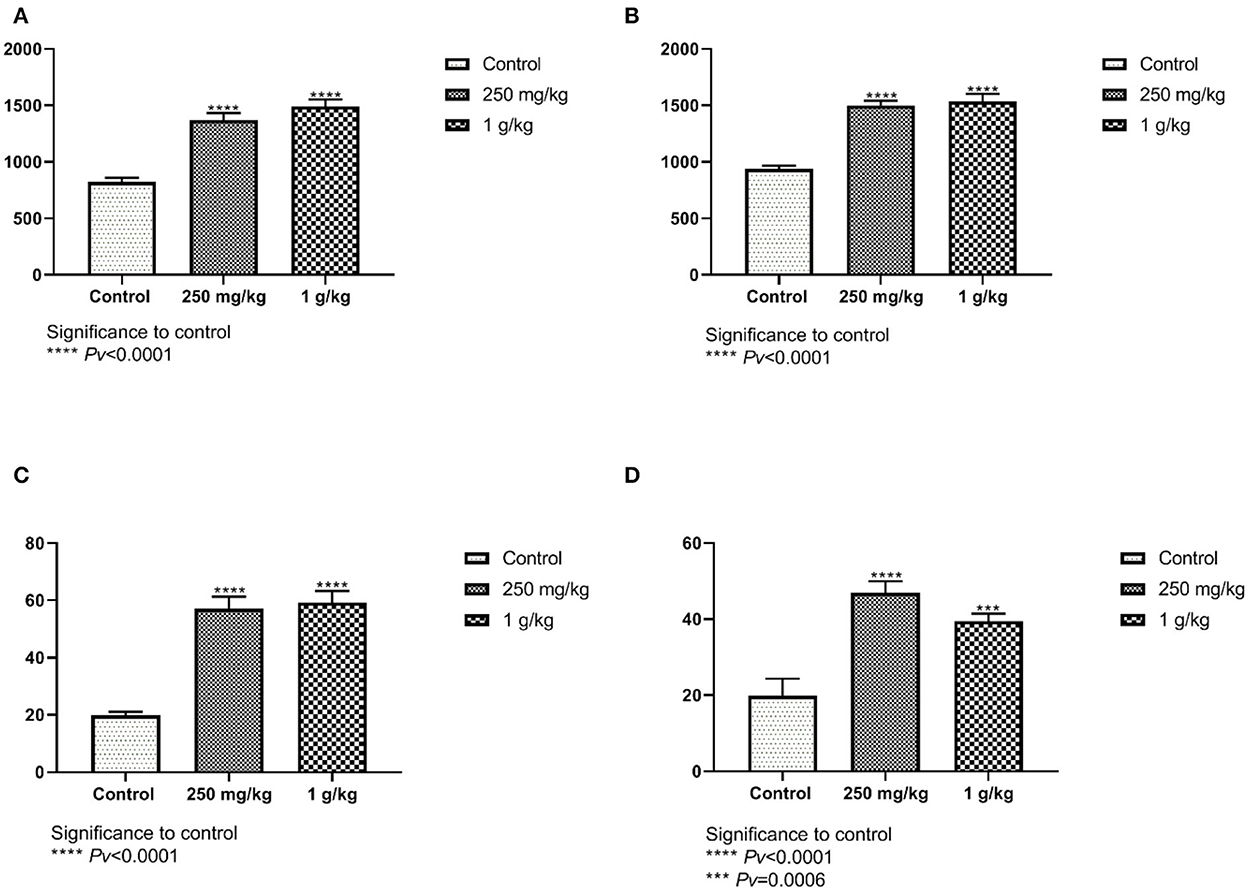 Figura 9. (A, B) La longitud de las vellosidades desde el yeyuno en comparación con los grupos de tratamiento con betaglucanos hasta el control. (A) mujeres, y (B) hombres (n = 10 por grupo). (C, D) El número de células caliciformes en el yeyuno. Grupos de tratamiento con betaglucanos en comparación con el control. (C) mujeres, y (D) hombres (n = 10 por grupo). Pv se comparan con el control.
Figura 9. (A, B) La longitud de las vellosidades desde el yeyuno en comparación con los grupos de tratamiento con betaglucanos hasta el control. (A) mujeres, y (B) hombres (n = 10 por grupo). (C, D) El número de células caliciformes en el yeyuno. Grupos de tratamiento con betaglucanos en comparación con el control. (C) mujeres, y (D) hombres (n = 10 por grupo). Pv se comparan con el control.
5. Discusión
Las infecciones bacterianas en las aves de corral son una preocupación esencial tanto para la salud animal como para la productividad. El tratamiento actual en la avicultura depende en gran medida de los antibióticos para prevenir los brotes de enfermedades (2). Se sabe que más del 60% de todos los antibióticos producidos en todo el mundo se utilizan en la producción animal con fines terapéuticos y no terapéuticos (25). El uso masivo de antibióticos condujo a un mayor riesgo de resistencia a patógenos. El resultado ha sido la retirada de varios antibióticos de la caja de herramientas disponible para los productores avícolas (9). El riesgo potencial de resistencia a los antibióticos dio lugar a la prohibición de algunos antibióticos como aditivos alimentarios por parte de la Unión Europea a partir del 1 de enero de 2006. Desgraciadamente, esta prohibición ha dado lugar a un deterioro de la sanidad animal y a una mayor variabilidad de las enfermedades (26).
Los betaglucanos son polímeros de glucosa que pueden derivarse de las paredes celulares de levaduras, bacterias, hongos y cereales (27). Existe una variación considerable en la estructura de los betaglucanos de estas diferentes fuentes, lo que en última instancia da lugar a diferencias en sus funciones fisiológicas (28). Los efectos de los betaglucanos como inmunomoduladores biológicamente activos han sido bien observados en especies de mamíferos; Si bien los sistemas inmunológicos de los mamíferos y las aves son similares, son lo suficientemente diferentes como para que sea difícil extrapolar la investigación en mamíferos a las aves de corral. Investigaciones recientes muestran que los betaglucanos pueden desempeñar un papel en la sustitución de los antibióticos y en la estimulación del sistema inmunitario en la industria avícola (16).
La suplementación dietética de betaglucanos de la pared celular de la levadura indujo un aumento de peso moderado en el bazo y la bolsa de Fabricio (12). Por el contrario, Cox et al. (16) no encontraron diferencias significativas en el peso corporal total y en la ganancia de peso corporal entre los grupos de tratamiento con betaglucanos. Estos resultados inconsistentes podrían atribuirse a varias razones, como las diferencias en la fuente del betaglucano, la presencia y el tipo de desafío utilizado, o ambos. Como tal, enfatiza la importancia de una mayor investigación para determinar la dosis óptima de suplementación con beta-glucano para obtener resultados consistentemente favorables en las aves de corral.
Los resultados del presente estudio sugieren que la incorporación de betaglucanos en la dieta de los pollos mejora significativamente la salud intestinal al preparar la función de los macrófagos intestinales y, por lo tanto, afectar la morfología y función intestinal, lo que resulta en inmunomoduladores antiinflamatorios efectivos. La suplementación con betaglucano beneficia el número de células caliciformes y la altura de las vellosidades tanto en el yeyuno como en el íleon. Además, la suplementación con betaglucanos aumentó la función fagocítica de los macrófagos y mejoró la respuesta inmunitaria al alterar los perfiles de citoquinas de los pollos. Como se ha mencionado anteriormente, durante la ingestión los betaglucanos llegan al intestino y de su paso a través de los parches de Peyer al GALT, y posteriormente, son transportados por todo el cuerpo (9). De esta manera, los betaglucanos de los alimentos pueden estimular directamente a los macrófagos y afectar su secreción de moléculas relacionadas con el sistema inmunológico.
Los macrófagos de pollo son las células presentadoras de antígenos más potentes capaces de resistir a microorganismos patógenos exógenos (14). Se ha demostrado que la suplementación dietética con betaglucanos a las aves de corral estimula la fagocitosis, lo que finalmente suprime la invasión del patógeno en los órganos (29). Además, la suplementación con betaglucano aumentó la función fagocítica de los macrófagos, como mostramos aquí y como se ha publicado anteriormente (30).
Los macrófagos han sido ampliamente estudiados en varias especies de mamíferos, pero se ha prestado poca atención al estudio de los macrófagos aviares. Nuestro experimento in vitro se llevó a cabo utilizando macrófagos originados a partir de una línea celular de macrófagos de pollo transformada, HD-11. Hasta donde sabemos, no se realizó ninguna investigación previa utilizando la línea celular de macrófagos HD-11 para probar el efecto de los betaglucanos. Se analizaron otras líneas celulares para determinar el efecto de los betaglucanos, principalmente células de macrófagos MQ-NCSU de pollo (30).
Para comprender el efecto inmunomodulador de los betaglucanos se utilizó la línea celular de macrófagos de pollo HD-11. Medimos la expresión de 6 genes en diferentes momentos y concentraciones. Se midió la expresión significativa del control con los 6 genes (TNFα, IL4, IL6, IL8, IL10 e iNOS2). Para estimular la respuesta máxima de secreción, se opta por utilizar una concentración de 1 g/ml de betaglucanos durante 24 h de incubación (Figuras 1, 2). Al comparar los betaglucanos de levadura con los β-glucanos de hongos, la expresión de IL4, IL6, IL8 e iNOS fue significativamente mayor que la del control después de 24 h de exposición a betaglucanos de algas y hongos (Figura 4). La expresión de IL10 fue significativamente diferente de la del control después de la exposición a los betaglucanos de los hongos, pero no se midió la expresión significativa cuando se expuso a los betaglucanos de las algas (Figura 4F). Zhang et al. (31) observaron un aumento cuadrático en los niveles de citoquinas de TNFα e IFN-γ en el suero sanguíneo de los pollos después de ser alimentados con 50 o 75 mg/kg/alimento de betaglucanos. La suplementación con betaglucano durante 7 días después de la eclosión reguló la expresión de IL4 en el duodeno, el yeyuno y el íleon. Para el día 14, la expresión de IL4 estaba regulada al alza en el duodeno y el íleon (16). Queiroz et al. (32) informaron que una concentración de 50 mg/kg/beta-glucano alimentado de hongos aumentó el nivel de IL10 concomitantemente con una reducción de IFN-γ, en pollos de aves de corral.
Por el contrario, en comparación con los controles no suplementados, se demostró que los pollos de engorde que recibieron betaglucano de levadura regulaban a la baja la IL8. La regulación a la baja del gen IL8 con la suplementación con beta-glucano sugiere que el beta-glucano funciona como un inmunomodulador antiinflamatorio (16). Qureshi et al. (30) informaron que no se observó bioactividad detectable de IL6 en sobrenadantes de cultivo de macrófagos con o sin exposición a beta-glucano. Este resultado puede explicarse porque su experimento se llevó a cabo utilizando la línea celular de macrófagos MQ-NCSU, que se deriva del bazo y puede no expresar IL6, en contraste con HD11, que se deriva de la médula ósea de pollo y expresa IL6. Sugerimos que se tenga cuidado con los diferentes datos publicados con respecto a los diversos efectos causados por los betaglucanos. Dado que muchos productos pueden denominarse betaglucanos, es probable que la composición y la conformación analítica difieran de una fuente a otra, lo que puede influir en la gran variedad de respuestas observadas.
El NO es una molécula importante en los efectos antiinflamatorios y antimicrobianos de los macrófagos y es un indicador químico de inflamación y enfermedades inflamatorias. La iNOS se induce en los tejidos inflamados y genera cantidades relativamente grandes de NO (33).
Cuando se exponen a antígenos o agentes quimiotácticos, los macrófagos comenzarán a expresar iNOS. Esta enzima conduce a la producción de NO, que posteriormente reaccionará con aniones superóxido para generar derivados tóxicos, lo que permite a los macrófagos matar de manera competente varios tipos de patógenos (34). La regulación positiva en iNOS implica una mayor capacidad de los macrófagos para matar patógenos invasores, lo que permite al huésped eliminar las amenazas infecciosas de manera más eficiente (16). La exposición a beta-glucanos aumentó la liberación de NO en la fracción sobrenadante del cultivo de macrófagos de pollos de engorde, lo que sugiere que los beta-glucanos pueden inducir una actividad de óxido nítrico sintasa similar a la de otros activadores de macrófagos conocidos, como el LPS (35). Se midió la liberación de NO al medio después de la exposición a 1 mg/ml de betaglucanos de hongos o algas durante 24 h o 100 ng/ml de LPS durante 4 y 8 h. Los resultados mostraron una liberación de NO significativamente mayor para todos los grupos de tratamiento que la cantidad liberada del grupo de control no tratado. La exposición a betaglucanos de algas indujo la liberación de más NO que los grupos expuestos a LPS durante 4 u 8 h (Figura 3). Estos resultados fueron consistentes cuando se comparó la liberación de beta-glucano NO de algas y hongos (Figura 5) y la expresión significativa del gen de la óxido nítrico sintasa (iNOS) después de la exposición a beta-glucanos durante 24 h (Figuras 2D, 4F).
Los macrófagos son una de las células inmunitarias innatas de primera respuesta ante una nueva infección, como se ve en los modelos de infección que muestran que la infección causa un rápido aumento en el número de macrófagos (36). Pueden fagocitar bacterias y, posteriormente, producir compuestos multifuncionales, incluidas especies reactivas de oxígeno (ROS), óxido nítrico (NO) y citoquinas, para matar los microorganismos infecciosos y enviar señales a otras células inmunitarias para establecer una respuesta adecuada a la infección (37). Además, los macrófagos activados pueden producir NO, que desempeña un papel importante en la defensa del huésped contra la infección microbiana, y actuar como moléculas efectoras para matar patógenos invasores (38). La liberación de NO al medio después de la exposición a los betaglucanos se observó en nuestra investigación y puede explicarse por el aumento de la actividad de la fagocitosis. Se han descrito muchos estudios sobre la actividad fagocítica de los macrófagos de los mamíferos, pero los datos disponibles para los macrófagos de los pollos son limitados.
Además de la eliminación intracelular de patógenos, los fagocitos profesionales desempeñan un papel importante en la modulación de la respuesta inmunitaria mediante la expresión de citoquinas y quimiocinas. Por ejemplo, indujo citoquinas proinflamatorias IL8 así como citoquinas inflamatorias IL6 (38), que también se observó en nuestra investigación. La fagocitosis es un proceso complejo que involucra un conjunto diverso de receptores que pueden estimular la fagocitosis. Las células se incubaron durante 1 h con 1 mg/ml de betaglucanos de hongos o algas o 100 ng/ml de LPS. Los betaglucanos de algas y hongos aumentaron significativamente la actividad de fagocitosis del control (Figura 6). A partir de los siguientes datos, se puede concluir que los β-glucanos tanto de algas como de hongos pueden provocar una respuesta proinflamatoria en macrófagos aviares HD-11. Esta leve respuesta proinflamatoria puede preparar a los macrófagos para que sean activos para infecciones putativas posteriores.
Las vellosidades intestinales más largas indican una mejor capacidad para absorber nutrientes en el intestino y pueden explicar el aumento del peso corporal (39). Las criptas de las vellosidades contienen varias células especializadas, incluidas las células absorbentes, las células caliciformes y las células regenerativas, que son responsables de la producción de moco y el reemplazo de las células viejas (15). La evaluación de la morfología de las vellosidades intestinales es importante ya que el intestino delgado es el sitio principal para la asimilación de nutrientes y, por lo tanto, es sensible a los cambios en la dieta (40). Las mediciones de las vellosidades tomadas del íleon femenino no mostraron diferencias entre el tratamiento con betaglucanos y el control (Figura 7A). La longitud de las vellosidades masculinas del íleon fue significativamente mayor en comparación con el control (Figura 7B). Las mediciones de las vellosidades femeninas y masculinas del yeyuno mostraron diferencias significativas entre los grupos de tratamiento a control (Figuras 7C, D, 9A, B). En correlación con nuestros hallazgos, varios estudios también han observado que la administración de beta-glucano de levadura en la dieta a los pollos resultó en una mayor altura de las vellosidades en el yeyuno en comparación con los pollos alimentados sin beta-glucano (40-42). Confirmando nuestros estudios, Solís de Los Santos et al. (15) encontraron que la altura de las vellosidades del íleon, el área superficial, el grosor de la lámina propia, la profundidad de la cripta y la densidad de las células caliciformes se vieron aumentados debido al consumo de betaglucanos de extracto de levadura como suplemento dietético.
El revestimiento intestinal proporciona la barrera de defensa innata contra la mayoría de los patógenos intestinales. Las células caliciformes de la mucosa intestinal secretan moco que proporciona la primera línea de defensa contra las lesiones intestinales (9). La capa de moco protege la superficie intestinal de la invasión de bacterias entéricas, toxinas bacterianas y ambientales, y algunos componentes de la dieta que pueden dañar la mucosa (15, 42, 43). Cuando se altera la capa de moco, la adhesión de los microbios a la superficie epitelial intestinal puede aumentar la permeabilidad epitelial y reducir la absorción de nutrientes (44, 45). En este trabajo se midió si el número de células caliciformes se vio afectado por el tratamiento con betaglucano. El número de células caliciformes del íleon y el yeyuno de los machos y hembras mostró diferencias significativas entre los tratamientos con betaglucanos para el control (Figuras 8A-D, 9C, D). La administración de betaglucano en la dieta aumentó significativamente el número de células caliciformes en el yeyuno y el íleon. Las células caliciformes son un tipo de células epiteliales de la mucosa intestinal cuya función principal es sintetizar y secretar moco. La producción y secreción de mucina son importantes para mantener la barrera mucosa. Se ha demostrado que una amplia gama de factores, como la alimentación, los microbios, los productos microbianos, las toxinas y las citocinas, regulan estos procesos, afectando así a la barrera mucosa (44-46). En correlación con nuestros hallazgos, estudios anteriores también encontraron que la suplementación con beta-glucano aumentó significativamente el número de células caliciformes en el yeyuno de los pollos (15, 41). Esto sugiere que la suplementación con betaglucano de los piensos para aves de corral desempeña un papel importante en la mejora de su salud intestinal durante un desafío bacteriano.
6. Conclusiones
Acumulativamente, nuestros resultados indican que los betaglucanos pueden influir en los perfiles de expresión de citoquinas, lo que indica que los macrófagos aviares pueden expresar receptores de beta-glucanos. Concluimos que los betaglucanos de algas y hongos modulan de manera diferente la expresión de citoquinas asociadas con la respuesta inmune, lo que sugiere que el uso de los dos tipos de betaglucanos puede resultar en una respuesta inmune más amplia.
Nuestros hallazgos son importantes ya que un intestino más sano indica una mejor digestión y absorción de nutrientes y, por lo tanto, un sistema inmunológico que funciona de manera saludable. De manera similar, extrapolando nuestros hallazgos a configuraciones humanas, la justificación del uso de adyuvantes en las formulaciones de vacunas para mejorar la eficacia de la inmunidad adaptativa es ampliamente aceptada, sin embargo, se ha prestado poca atención a los efectos directos de los adyuvantes sobre la inmunidad innata y la protección temprana contra la infección (15, 44). Como tales, los betaglucanos pueden mejorar la resistencia a las infecciones humanas agudas o crónicas y reducir el uso generalizado de antibióticos.
Declaración de la Junta de Revisión Institucional: «El estudio se llevó a cabo de acuerdo con la Declaración de Helsinki y fue aprobado por el comité de ética de la Universidad Hebrea de Jerusalén. El experimento se llevó a cabo en la unidad avícola y en los laboratorios de investigación de la Facultad de Agricultura, Alimentación y Ciencias Ambientales de Israel. Todos los experimentos con animales se realizaron bajo el cuidado y la supervisión del Prof. Israel Rozenboim. Código de protocolo AG-20-16348-4, número de aprobación de los NIH OPRR-A01-5011, fecha de aprobación, 28/10/2020.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Ética de la Universidad Hebrea de Jerusalén. El experimento se llevó a cabo en la unidad avícola y en los laboratorios de investigación de la Facultad de Agricultura, Alimentación y Ciencias Ambientales de Israel. Todos los experimentos con animales se realizaron bajo el cuidado y la supervisión del Prof. Israel Rozenboim. Código de protocolo AG-20-16348-4, número de aprobación de los NIH OPRR-A01-5011, fecha de aprobación, 28/10/2020.
Contribuciones de los autores
Conceptualización: BS, IR y VV. Metodología: HB-D, OG y NC. Redacción y preparación del borrador original: OG, HB-D y BS. Redacción-revisión y edición, supervisión y obtención de fondos: BS e IR. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Financiación
Este estudio contó con el apoyo de una beca del BARD (FONDO BINACIONAL DE INVESTIGACIÓN Y DESARROLLO AGROPECUARIO) No. IS-5241-20 a BS, IR y VV.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2022.1092812/full#supplementary-material
Referencias
1. Landers TF, Cohen B, Wittum TE, Larson EL. Una revisión del uso de antibióticos en animales destinados a la alimentación: perspectiva, política y potencial. Rep. de Salud Pública (2012) 127:4–22. doi: 10.1177/003335491212700103
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Aarestrup FM, Wegener HC, Collignon P. Resistencia en bacterias de la cadena alimentaria: epidemiología y estrategias de control. Exp rev anti infect ther. (2008) 6:733–50. doi: 10.1586/14787210.6.5.733
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Fair RJ, Tor Y. Antibióticos y resistencia bacteriana en el siglo XXI. Perspect Med Chem. (21) 2014:6–25. doi: 64.10/PMC. S4137
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Selaledi LA, Hassan ZM, Manyelo TG, Mabelebele M. El estado actual del uso alternativo a los antibióticos en la producción avícola: una perspectiva africana. Antibióticos. (2020) 9:1–18. doi: 10.3390/antibióticos9090594
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Manyi-Loh C, Mamphweli S, Meyer E, Okoh A. Uso de antibióticos en la agricultura y su consiguiente resistencia en fuentes ambientales: posibles implicaciones para la salud pública. Moléculas. (2018) 23:795. doi: 10.3390/moléculas23040795
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Chae BJ, Lohakare JD, Moon WK, Lee SL, Park YH, Hahn TW. Efectos de la suplementación con β-glucano sobre el rendimiento del crecimiento y la inmunidad en pollos de engorde. Res Vet Sci. (2006) 80:291–8. doi: 10.1016/j.rvsc.2005.07.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Vetvicka V, Vetvickova J. Inmunomoduladores naturales y su estimulación de la reacción inmunitaria: ¿verdadero o falso? Res. Anticancerígeno (2014) 34:2275–82.
8. Synytsya A, Novak M. Structural analysis of glucans. Ann Transl Med. (2014) 2:1–14. doi: 10.3978/j.issn.2305-5839.2014.02.07
9. Jacob J, Pescatore A. Glucans and the poultry immune system. Am J Immunol. (2017) 13:45–9. doi: 10.3844/ajisp.2017.45.49
10. Cox CM, Sumners LH, Kim S, Mcelroy AP, Bedford MR, Dalloul RA. Immune responses to dietary β-glucan in broiler cicks during an Eimeria challenge. Poult Sci. (2010) 89:2597–607. doi: 10.3382/ps.2010-00987
11. Han D, Lee HT, Lee JB, Kim Y, Lee SJ, Yoon JW, et al. bioprocessed polysaccharide from Lentinus edodes mycelia cultures with turmeric protects chicks from a lethal challenge of Salmonella gallinarum. J Food Prot. (2017) 80:245–50. doi: 10.4315/0362-028X.JFP-16-306
12. Cho JH, Zhang ZF, Kim IH. Effects of single or combined dietary supplementation of β-glucan and kefir on growth performance, blood characteristics and meat quality in broilers. Br Poult Sci. (2013) 54:216–21. doi: 10.1080/00071668.2013.777691
13. Stier H, Ebbeskotte V, Gruenwald J. Immune-modulatory effects of dietary Yeast Beta-1,3/1,6-D-glucan. Nutr J. (2014) 13:1–9. doi: 10.1186/1475-2891-13-38
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Jin X, Zhang X, Li J, Yu W, Chen F. Activación de macrófagos de pollo durante la estimulación in vitro y la expresión de genes inmunes. Am J Vet Res. (2018) 79:1306–12. doi: 10.2460/ajvr.79.12.1306
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Solís De Los Santos F, Donoghue AM, Farnel MB, Huff GR, Huff WF, Donoghue DJ. La maduración gastrointestinal se acelera en pavitos de pavo suplementados con un extracto de levadura de manano-oligosacárido (Alphamune). Poult Sci. (2007) 86:921–30. doi: 10.1093/ps/86.5.921
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Cox CM, Stuard LH, Kim S, McElroy AP, Bedford MR, Dalloul RA. Rendimiento y respuestas inmunitarias al β-glucano dietético en pollos de engorde. Poult Sci. (2010) 89:1924–33. doi: 10.3382/ps.2010-00865
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Zhao J, Cheung PCK. Fermentación de β-glucanos derivados de diferentes fuentes por bifidobacterias: evaluación de su efecto bifidogénico. J Agric Food Chem. (2011) 59:5986–92. doi: 10.1021/jf200621y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Rajapakse JR, Buddhika MD, Nagataki M, Nomura H, Watanabe Y, Ikeue Y, et al. Efecto del β-glucano Sophy sobre la inmunidad y el rendimiento del crecimiento en pollos de engorde. J Vet Med Sci. (2010) 72:1629–32. doi: 10.1292/jvms.10-0029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Bohn JA, BeMiller JN. (1 → 3)-β-d-glucanos como modificadores de la respuesta biológica: una revisión de las relaciones estructura-actividad funcional. Carbohydr Polym. (1995) 8:3–14. doi: 10.1016/0144-8617(95)00076-3
20. Rathgeber BM, Budgell KL, MacIsaac JL, Mirza MA, Doncaster KL. Rendimiento de crecimiento y peso del bazo y la bursa de pollos de engorde alimentados con betaglucano de levadura. Can J Anim Sci. (2008) 88:469–73. doi: 10.4141/CJAS07101
21. de Jesus RB, Petit J, Pilarski F, Wiegertjes GF, Koch JF, de Oliveira CA, et al. Un baño temprano de β-glucano durante el desarrollo embrionario aumenta el tamaño de las larvas de tilapia del Nilo. Aquac Res. (2019) 50:2012–4. doi: 10.1111/are.14047
22. Lavi I, Levinson D, Peri I, Nimri L, Hadar Y, Schwartz B. Los glucanos administrados por vía oral del hongo comestible Pleurotus pulmonarius reducen la inflamación aguda en la colitis experimental inducida por sulfato de dextrano sódico. Hno. J Nutr. (2010) 103:393–402. doi: 10.1017/S0007114509991760
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Nolan T, Hands RE, Bustin SA. Cuantificación de ARNm mediante RT-PCR en tiempo real. Nat Protoc. (2006) 1:1559–82. doi: 10.1038/nprot.2006.236
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Pauls SD, Rodway LA, Winter T, Taylor CG, Zahradka P, Aukema HM. El ácido alfa-linolénico mejora las funciones fagocíticas y secretoras de los macrófagos activados alternativamente en parte a través de cambios en el perfil de oxilipina. Int J Biochem Cell Biol. (2020) 119:105662. doi: 10.1016/j.biocel.2019.105662
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Aidara-Kane A, Angulo FJ, Conly JM, Minato Y, Silbergeld EK, McEwen SA, et al. Directrices de la Organización Mundial de la Salud (OMS) sobre el uso de antimicrobianos de importancia médica en animales destinados a la producción de alimentos. Resistencia a los antimicrobianos para el control de infecciones. (2018) 7:1–8. doi: 10.1186/s13756-017-0294-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Castañón JIR. Historia del uso de antibióticos como promotores del crecimiento en los piensos avícolas europeos. Poult Sci. (2007) 86:2466–71. doi: 10.3382/ps.2007-00249
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Sadeghi AA, Mohammadi A, Shawrang P, Aminafshar M. Respuestas inmunitarias a la inclusión dietética de manano-oligosacárido y β-glucano a base de prebióticos en pollos de engorde desafiados con Salmonella enteritidis. Turk J Vet Anim Sci. (2013) 37:206–13. doi: 10.3906/vet-1203-9
28. Volman JJ, Ramakers JD, Plat J. Modulación dietética de la función inmune por β-glucanos. Physiol Behave. (2008) 94:276–84. doi: 10.1016/j.physbeh.2007.11.045
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Lowry VK, Farnell MB, Ferro PJ, Swaggerty CL, Bahl A, Kogut MH. El β-glucano purificado como aditivo alimentario abiótico regula al alza la respuesta inmunitaria innata en pollos inmaduros contra Salmonella enterica serovar Enteritidis. Int J Microbiol Alimentario. (2005) 98:309–18. doi: 10.1016/j.ijfoodmicro.2004.06.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Guo Y, Ali RA, Qureshi MA. Influencia del β-glucano en las respuestas inmunitarias en pollos de engorde. Immunopharmacol Inmunotoxicol. (2003) 25:461–72. doi: 10.1081/IPH-120024513
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Zhang B, Guo Y, Wang Z. El efecto modulador de la suplementación con β-1, 3/1, 6-glucano en la dieta sobre el rendimiento y las respuestas inmunológicas de pollos de engorde. Asian-Aust J Anim Sci. (2008) 21:237–44. doi: 10.5713/ajas.2008.70207
32. Queiroz LS, Nascimento MS, Cruz AK, Castro AJ, Maria de Fátima VM, Baseia IG, et al. Los glucanos del hongo Caripia montagnei presentan actividad antiinflamatoria. Int Immunopharmacol. (2010) 10:34–42. doi: 10.1016/j.intimp.2009.09.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Du B, Lin C, Bian Z, Xu B. Una visión de los efectos antiinflamatorios de los betaglucanos fúngicos. Tendencias Food Sci Technol. (2015) 41:49–59. doi: 10.1016/j.tifs.2014.09.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Tizard IR. Inmunología Veterinaria: Una Introducción. 8ª Edn. San Luis: Saunders Elsevier (2009).
35. Hussain I, Qureshi MA. Actividad de la óxido nítrico sintasa y expresión de ARNm en macrófagos de pollo. Poult Sci. (1997) 76:1524–30. doi: 10.1093/ps/76.11.1524
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Ariaans MP, Matthijs MG, van Haarlem D, van de Haar P, van Eck JH, Hensen EJ, et al. El papel de las células fagocíticas en la mayor susceptibilidad de los pollos de engorde a la colibacilosis después de la infección por el virus de la bronquitis infecciosa. Veterinario Inmunol Inmunopatíaco. (2008) 123:240–50. doi: 10.1016/j.vetimm.2008.02.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Li D-Y, Xue M-Y, Geng Z-R, Chen P. Los efectos supresores de la bursopentina (BP5) sobre el estrés oxidativo y la activación de NF-κB en macrófagos peritoneales murinos activados por lipopolisacáridos. Bioquímica Celular Physiol. (2012) 29:9–20. doi: 10.1159/000337581
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Peng L, Matthijs MGR, Haagsman HG, Veldhuizen EJA. Activación patógena aviar de células HD11 de macrófagos de pollo. Dev Comp Immunol. (2018) 87:75–83. doi: 10.1016/j.dci.2018.05.019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Prakatur M, Miskulin I, Pavic M, Marjanovic M, Blazicevic K, Miskulin V, et al. Morfología intestinal en pollos de engorde. Animales. (2019) 9:301–12. doi: 10.3390/ani9060301
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Fasina YO, Olowo YL. Efecto de un producto comercial a base de levadura (Maxigen) sobre la morfología de las vellosidades intestinales y el rendimiento del crecimiento de pollos de engorde. Int J Poultry Sci. (2013) 12:9–14. doi: 10.3923/ijps.2013.9.14 ®
41. Shao Y, Guo Y, Wang Z. β-1,3/1,6-glucano alivió el deterioro de la barrera de la mucosa intestinal de pollos de engorde desafiados con Salmonella enterica serovar Typhimurium. Poult Sci. (2013) 92:1764–73. doi: 10.3382/ps.2013-03029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Pelaseyed T, Bergström JH, Gustafsson JK, Ermund A, Birchenough GM, Schütte A, et al. El moco y las mucinas de las células caliciformes y los enterocitos proporcionan la primera línea de defensa del tracto gastrointestinal e interactúan con el sistema inmunitario. Immunol Rev. (2014) 260:8–20. doi: 10.1111/imr.12182
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Johansson MEV, Hansson GC. Aspectos inmunológicos de la mucosa intestinal y las mucinas. Nat Rev Immunol. (2016) 16:639–49. doi: 10.1038/nri.2016.88
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Divangahi M, Aaby P, Khader SA, Barreiro LB, Bekkering S, Chavakis T, et al. Inmunidad entrenada, tolerancia, priming y diferenciación: procesos inmunológicos distintos. Nat Immunol. (2021) 22:928. doi: 10.1038/s41590-021-00960-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Young SH, Ye J, Frazer DG, Shi X, Castranova V. Mecanismo molecular de la producción de factor de necrosis tumoral α en macrófagos activados por 1 → 3-β-glucano (Zymosan). J Biol Chem. (2001) 276:20781–7. doi: 10.1074/jbc. M101111200
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: betaglucanos, células HD-11, entrenamiento inmune, modificadores de la respuesta biológica, células caliciformes.
Cita: Bar-Dagan H, Gover O, Cohen NA, Vetvicka V, Rozenboim I y Schwartz B (2023) Los betaglucanos inducen el entrenamiento inmunológico celular y los cambios en la morfología intestinal en las aves de corral. Frente. Vet. Sci. 9:1092812. doi: 10.3389/fvets.2022.1092812
Recibido: 08 de noviembre de 2022; Aceptado: 15 de diciembre de 2022;
Publicado: 09 Enero 2023.
Editado por:
Ilaria Biasato, Universidad de Turín, Italia
Revisado por:
Daniel Hernández-Patlán, Facultad de Estudios Superiores Cuautitlán, Universidad Nacional Autónoma de México, México
Guillermo Téllez-Isaías, Universidad de Arkansas, Estados Unidos
Derechos de autor © 2023 Bar-Dagan, Gover, Cohen, Vetvicka, Rozenboim y Schwartz. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Betty Schwartz,  betty.schwartz@mail.huji.ac.il
betty.schwartz@mail.huji.ac.il
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.