Los efectos de diferentes fuentes de aceite en pollos
Los efectos de diferentes fuentes de aceite en el rendimiento, las enzimas digestivas, las características de la canal, las respuestas bioquímicas, inmunológicas, antioxidantes y morfométricas de los pollos de engorde
 Youssef A. Attia1*
Youssef A. Attia1*  Mohammed A. Al-Harthi1
Mohammed A. Al-Harthi1  Hayam M. Abo El-Maaty2*
Hayam M. Abo El-Maaty2*- 1Departamento de Agricultura de Tierras Áridas, Facultad de Meteorología, Medio Ambiente y Agricultura de Tierras Áridas, Universidad Rey Abdulaziz, Jeddah, Arabia Saudita
- 2Departamento de Producción Avícola, Facultad de Agricultura, Universidad de Mansoura, Mansoura, Egipto
Esta investigación evalúa la influencia de diferentes fuentes de aceite, a saber, aceite de pescado (FO), aceite de coco (CocO), aceite de canola (CanO) o una mezcla de los tres aceites (MTO), incluidos al 1,5% en las dietas de pollos de engorde, en comparación con una dieta sin suplementos de aceite. Por lo tanto, se pesaron 250 pollitos Cobb de 1 día de edad sin sexo y se asignaron aleatoriamente en cinco grupos de tratamiento dietético de 50 pollitos cada uno y cinco réplicas por grupo. Las dietas suplementadas con aceite aumentaron significativamente el crecimiento, mejoraron el índice de conversión alimenticia (FCR) y disminuyeron el porcentaje de grasa abdominal en comparación con la dieta control. La amilasa se elevó significativamente debido a la alimentación con la dieta suplementada con FO o CocO en comparación con la dieta de control, mientras que la lipasa aumentó debido a la oferta de una dieta enriquecida con CocO y CanO; La quimotripsina aumentó debido a las diferentes fuentes de aceite. El colesterol de lipoproteínas de alta densidad (HDL-C) aumentó notablemente debido a la oferta de una dieta suplementada con aceite, pero el colesterol de lipoproteínas de baja densidad (LDL-C), la relación LDL-C:HDL-C y el malondialdehído (MDA) disminuyeron. Las inmunoglobulinas (Ig) G e IgM del plasma sanguíneo aumentaron significativamente debido a la alimentación con CocO, CanO o MTO en comparación con el grupo de control, mientras que FO aumentó solo la IgG. Las dietas que contienen FO y CanO dieron lugar al mayor aumento de α2-globulina y γ-globulina. El título de anticuerpos contra la influenza aviar (HIAI) y la enfermedad de Newcastle (HIND) se elevó significativamente debido a la suplementación con CocO en comparación con el grupo de control. La longitud y anchura del folículo de la bursa y la profundidad de la corteza del timo aumentaron considerablemente debido a la dieta suplementada con FO en comparación con el control, pero la relación longitud:anchura del folículo disminuyó. La relación altura:profundidad de las vellosidades se elevó significativamente debido a las dietas CanO y MTO. El estado antioxidante mejoró considerablemente debido a la adición de CocO y CanO. Tanto el CanO como el MTO aumentaron de manera similar la relación T3, T4 y T3:T4 plasmática. En conclusión, los suplementos de aceite al 1,5% mejoraron el rendimiento del crecimiento y el estado inmunológico, mejoraron el perfil de lípidos en sangre y el estado antioxidante, y el efecto de las fuentes de aceite depende de los criterios de respuesta.
Introducción
La avicultura es una industria muy importante. De hecho, se estima que en 2020, el pollo será la proteína animal más consumida en el mundo. La grasa y el aceite se utilizan generalmente en las dietas de las aves de corral para aumentar la concentración de energía. Los piensos enriquecidos con grasa aumentan la eficiencia de la energía y la productividad del alimento en las aves de corral (1, 2). Además, el aceite mejora la absorción de vitaminas liposolubles, la palatabilidad de las dietas, disminuye el polvo de los alimentos y reduce la tasa de paso del alimento en el intestino, lo que proporciona más tiempo para la absorción suficiente de nutrientes (3-5). Además, el perfil de ácidos grasos del tejido muscular refleja el perfil lipídico de la dieta y puede alterar los niveles sanguíneos de lipoproteínas y triglicéridos (6-8). Como regla general, la utilización de ácidos grasos insaturados (UFA) en las dietas de las aves de corral mejora la calidad del producto (por ejemplo, ω3 y ω6). Esta mejora es concordante con el interés de los consumidores (9, 10) y la respuesta inmune (3, 4, 11-13).
El aceite de pescado (FO) tiene altos porcentajes de ácidos grasos poliinsaturados de cadena larga (PUFA), particularmente ácidos grasos ω3 que aumentan el daño oxidativo y afectan negativamente el sabor de los productos animales. El FO es bajo en ácidos grasos ω6 y ácido linoleico (14, 15). En la harina de pescado se encuentran dos tipos de ácidos grasos ω3: el ácido eicosapentaenoico (EPA) y el ácido docosahexaenoico (DHA) (15). El ácido alfa-linolénico (ALA) se encuentra en las semillas de las plantas y puede transformarse en EPA y DHA en el cuerpo (16). El aceite de maíz, la grasa animal, las mezclas de grasas animales y vegetales y el FO no afectan el consumo de alimento, pero mejoran la tasa de crecimiento y la tasa de conversión alimenticia (FCR) en pollos de engorde expuestos a estrés por calor en comparación con las dietas no suplementadas con estrés por calor (17).
Las fuentes de AGPI ω3 en la dieta, como el FO o el aceite de linaza, tienen un impacto significativo positivo en la inmunidad humoral, es decir, los títulos de anticuerpos contra el virus de la enfermedad de Newcastle (VN), en comparación con la dieta de control (18). El FO no tiene efectos negativos sobre la función inmunitaria de los pollos de engorde (19). Además, la FO aumenta significativamente los títulos de anticuerpos y los porcentajes de peso relativo de la bursa y el bazo en comparación con una dieta de control (20). Las aves alimentadas con una dieta con una relación ω6:ω3 que excede los niveles recomendados muestran daños en las células epiteliales intestinales (21). Además, una relación baja ω6:ω3 aumenta el malondialdehído (MDA) en los tejidos, incluido el músculo, y, por lo tanto, perjudica la calidad de la carne.
Menos del 2% del ácido erúcico (ácido docosenoico, C22:1, ω-9) de la variedad de colza se denomina aceite de canola (CanO) (22). Los altos niveles de ácido erúcico en la dieta dañan el crecimiento, la ingesta de alimento y la digestibilidad de los lípidos (23). Además, los pollitos alimentados con dietas que contienen ácido erúcico depositan menos grasa y utilizan la energía lipídica de manera menos eficiente (23). La alimentación con dos variedades de CanO a los pollos de engorde hembras aumenta la tasa de crecimiento en comparación con la alimentación con sebo y jabón de aceite de soja acidulado. Estos datos confirman las ventajas del uso del CanO como fuente de energía para las aves (24). Las mejores tasas de crecimiento son el resultado del mayor porcentaje de ácidos grasos de cadena larga (LCFA) y el alto contenido de triglicéridos (24). Los pollos de engorde alimentados con una dieta con grasa de ave, CanO, aceite de girasol, aceite de maíz, aceite de soja o manteca de cerdo exhiben un rendimiento de crecimiento similar, así como cortes y rendimientos de canal a los 49 días de edad (25). Los pollos de engorde alimentados con aceite de maíz y manteca de cerdo muestran una carne de color rojo más alta en comparación con los alimentados con CanO, aceite de soja y aceite de girasol, pero la diferencia con la grasa de ave no es significativa (26).
El aceite de coco (CO) es una rica fuente de ácidos grasos saturados (AGS); Comprenden ~90% del contenido total de ácidos grasos. Los ácidos grasos de cadena media (AGCM, C6-C12) representan ~60% de todo el contenido de ácidos grasos (27). Estos ácidos grasos se absorben directamente en la circulación portal sin reesterificación en las células intestinales (28). Los AGCM se queman exclusiva y rápidamente para la producción de energía (29). Por el contrario, los AGLC (28) se depositan en el tejido adiposo (30). Según se informa, los AGCM disminuyen la deposición de grasa en la carne (31-33) y mejoran los perfiles de lípidos en sangre en humanos (34) y ratas (31). Sin embargo, los experimentos con pollos de engorde indicaron que los AGCM reducen la tasa de crecimiento (35). Curiosamente, el CocO mejora la digestión de las grasas y el rendimiento del crecimiento de los pollos de engorde durante una infección por coccidiosis (36).
En la actualidad, existe un gran interés en la producción de alimentos funcionales y/o productos de valor añadido como huevos, carne y leche (8). Las fuentes de ácidos grasos ω3 se encuentran entre las aplicaciones potenciales más interesantes en productos de origen animal debido a sus beneficios para la salud (37, 38). La calidad de la carne y los ácidos grasos se ven fuertemente afectados por las fuentes de grasa/aceite de la dieta (8, 10, 39-41) y podrían reducir significativamente los efectos aterogénicos, trombogénicos y de colesterol de los productos animales (37, 38). Aunque se dispone de cierta información sobre el efecto del uso de aceites individuales sobre el rendimiento de los pollos de engorde, el perfil lipídico en sangre y la inmunidad (8, 42), los resultados sobre el impacto de la combinación de diferentes fuentes de aceite en la producción, las enzimas pancreáticas, la calidad de la carne, los perfiles metabólicos y el estado inmunológico en los pollos de engorde son limitados. Por lo tanto, este estudio evaluó el efecto de la alimentación con una dieta que contenía 1.5% de FO, CocO, CanO o una mezcla de los tres aceites (MTO) sobre el rendimiento, las enzimas digestivas, las características de la canal, las respuestas bioquímicas, inmunológicas, antioxidantes y morfométricas de los pollos de engorde.
Materiales y métodos
El protocolo experimental fue aprobado por el comité científico del Departamento de Producción Avícola de la Facultad de Agricultura de la Universidad de Mansoura. El cuidado y la manipulación de los animales se realizaron para mantener sus derechos, garantizar su bienestar y causar un estrés mínimo, de acuerdo con las Directrices internacionales para la investigación con animales (Directiva 2010/63/UE).
Diseño Experimental, Animales, Dietas y Manejo
Se pesaron un total de 200 pollitos Cobb de 1 día de edad sin sexar y se dividieron en partes iguales entre cuatro grupos experimentales (50 polluelos cada uno). Los polluelos de cada grupo se subdividieron en cinco réplicas iguales (10 polluelos por réplica), y cada réplica se alojó en corrales de piso de 1 × 1 m en una casa abierta amueblada con virutas de madera para la cama. Cada corral estaba equipado con un alimentador de tubo y un bebedero de 5 litros. El primer, segundo, tercer y cuarto grupo fueron alimentados con una dieta con 1,5% FO, CocO, CanO o MTO (FO + CocO + CanO de 0,5% cada uno), respectivamente. Los aceites se añadieron a la dieta basal a los piensos isocalóricos e isonitrogenados para minimizar la interacción entre las grasas de la dieta y las suplementadas.
Las dietas basales experimentales de inicio y crecimiento se compusieron principalmente de maíz, harina de soja y harina de gluten de maíz y se formularon utilizando la composición de alimentos recomendada por el Consejo Nacional de Investigación (43). Las dietas experimentales cumplieron con la guía de cría de Cobb. La composición de los ingredientes y el análisis calculado de las dietas basales se muestran en las Tablas 1 y 2. A los pollitos se les ofreció una dieta de inicio, que contenía un 23% de proteína bruta y ~13,2 MJ/kg de energía metabolizable (EM), hasta los 21 días de edad. Posteriormente, se cambiaron a las dietas de crecimiento, que contenían ~20% de PC y 13,2 MJ/kg EM, de 21 a 42 días de edad.
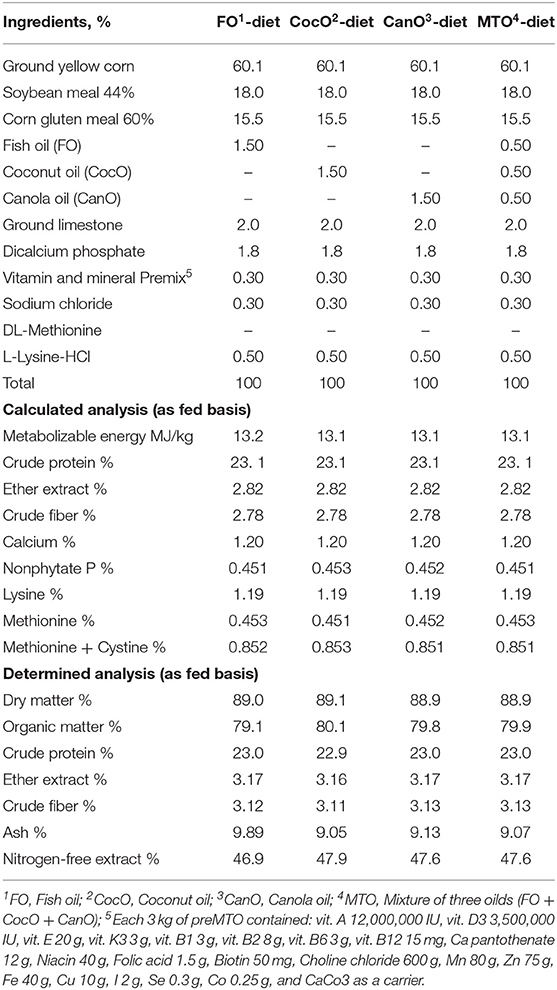 TABLA 1. La composición calculada y los análisis químicos de las dietas experimentales alimentadas a pollos de engorde de 0 a 21 semanas de edad.
TABLA 1. La composición calculada y los análisis químicos de las dietas experimentales alimentadas a pollos de engorde de 0 a 21 semanas de edad.
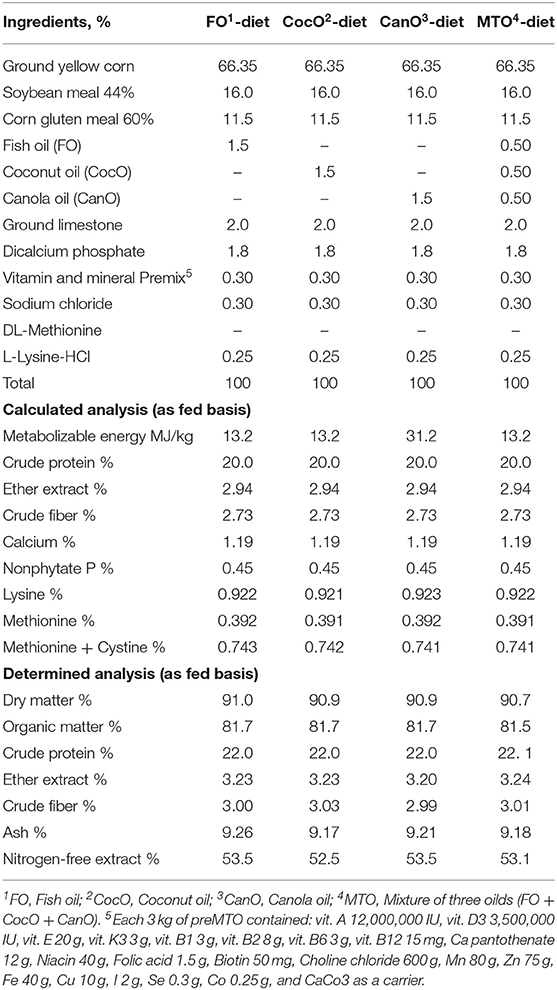 TABLA 2. La composición calculada y los análisis químicos de las dietas experimentales alimentadas a pollos de engorde de 21 a 42 semanas de edad.
TABLA 2. La composición calculada y los análisis químicos de las dietas experimentales alimentadas a pollos de engorde de 21 a 42 semanas de edad.
Todos los pollitos fueron mantenidos bajo similares condiciones de manejo, higiene y medio ambiente. El programa de vacunación y atención médica se llevó a cabo bajo la supervisión de un médico veterinario. En resumen, las aves fueron vacunadas contra IB+ NDV (cepa Hitchner B1) en el día 8, Gumboro en el día 15 y la cepa NDV LaSota en el día 21. Se ofrecía alimento y agua ad libitum. A los pollos de engorde se les proporcionó un fotoperiodo de 23 h de luz: 1 h de oscuridad. La temperatura interior y la humedad relativa (HR) durante el período experimental fueron de 34°C y 43%, 32°C y 45%, y 30°C y 51% durante las semanas 1, 2 y 3 de edad, respectivamente. La temperatura ambiente y la HR durante las semanas 4, 5 y 6 fueron de 29,7 °C y 55 %, 30,2 °C y 56 %, y 30,8 °C y 55 %, respectivamente.
Criterios de respuesta
El peso corporal y la ingesta de alimento de cada réplica se registraron a los 1, 21 y 42 días de edad. Para el cálculo de la FCR se utilizaron los registros de peso corporal vivo (BPN) y de consumo de alimento (IF) y (44) para el índice de producción europeo.
A los 42 días de edad, se seleccionaron aleatoriamente cinco aves de cada tratamiento para representar todas las réplicas del tratamiento; Cada ave seleccionada estaba alrededor del peso corporal promedio del grupo. Estos especímenes fueron pesados, ayunados durante la noche y luego sacrificados de acuerdo con un método islámico previamente reportado (45). Después de la hemorragia completa, se arrancaron las plumas, se evisceraron los cadáveres y se pesaron los cadáveres calientes. Se registró el peso de la grasa abdominal, el hígado, la molleja, el corazón, las menudencias (hígado + molleja + corazón) y el total de partes comestibles (canal caliente + menudencias) y se expresó como una relación con el peso vivo corporal.
Se recogieron cinco muestras de sangre por tratamiento, representativas de todas las réplicas, de la vena braquial con un tubo vacutainer utilizando tubos heparinizados y no heparinizados en el día 29 para determinar el título de anticuerpos séricos y en el día 42 para determinar los componentes bioquímicos de la sangre. El suero y el plasma se separaron por centrifugación a 1.500 g durante 15 min. Las muestras de sangre utilizadas para los análisis se recogieron antes del inicio de todas las vacunaciones (día 0) y después del final de la última vacunación (día 29). La producción total de anticuerpos específicos para la vacuna contra el VEN se determinó en suero utilizando kits comerciales de ensayo inmunoenzimático (ELISA) (46). La respuesta de anticuerpos se midió mediante la prueba de inhibición de la hemaglutinación (IH) (47). El ensayo está diseñado para medir los anticuerpos contra la EII unidos a placas recubiertas de antígeno de influenza (48). Se utilizó el método de Takatsy (49) para determinar el IH frente al VEN, la influenza aviar (IA) y la bronquitis infecciosa (IBB).
Los marcadores bioquímicos se analizaron utilizando kits de diagnóstico comerciales (Spectrum Diagnostics, Obour City, Egipto) a menos que se indique lo contrario. Se midieron los niveles de proteínas totales, albúmina, triglicéridos, colesterol total y colesterol de lipoproteínas de alta densidad (HDL-C) en el plasma sanguíneo a los 42 días de edad. El nivel de colesterol de lipoproteínas de baja densidad (LDL-C) en plasma sanguíneo se estimó de la siguiente manera: LDL-C = Colesterol Total–(HDL-C + VLDL); donde la lipoproteína de muy baja densidad (VLDL) se estimó como la concentración de triglicéridos plasmáticos dividida por cinco. Además, se determinaron las actividades de la superóxido dismutasa plasmática (SOD), la catalasa (CAT), el malondialdehído (MDA), la alanina aminotransferasa (ALT) y la aspartato aminotransferasa (AST), así como la capacidad antioxidante total (TAC). También se determinó la fosfatasa alcalina (AlkP), la inmunoglobulina (Ig)G, IgM e IgA, y las hormonas tiroideas (T3 y T4). Además, se midieron α, β y γ globulina de acuerdo con un método publicado anteriormente (51).
El contenido del duodeno, el yeyuno y el íleon se recolectó cualitativamente y luego se mantuvo en cantidades iguales de tampón salino. A continuación, la mezcla de cada contenido se centrifugó a 1.792 g durante 15 min, y se utilizó el sobrenadante para determinar los niveles de algunas enzimas digestivas. La actividad de la amilasa se determinó mediante el método descrito por Pinchasov et al. (51), la actividad de la lipasa según Sklan y Halevy (52) y las actividades de tripsina y quimotripsina según Sklan et al. (53).
Muestras representativas de íleo, hígado, timo y bursa (n = 5 por tratamiento) a los 42 días de edad se diseccionaron meticulosamente y se colocaron en un volumen suficiente de solución salina formal tamponada (BFS) al 10% durante al menos 24 h. Las muestras se prepararon y midieron como se informó anteriormente (54).
Los análisis proximales de las dietas experimentales se realizaron de acuerdo con los siguientes métodos oficiales de análisis (55): materia seca, método número 934.01; proteína bruta, método número 954.01; extracto de éter, número de método 920.39; fibra bruta, número de método 954.18; y ASH, método número 942.05.
Análisis estadístico
Los datos se analizaron con el software Statistical Analysis System (SAS) (56) utilizando el análisis de varianza de una vía (ANOVA) y el procedimiento de modelo lineal generalizado (GLM). Se utilizó la prueba de Student-Newman-Keuls (56) para predecir diferencias entre los criterios; los efectos se consideraron significativos si P ≤ 0,05. Todos los porcentajes se transformaron en base logarítmica 10 antes del ANOVA y luego se convirtieron nuevamente a los cocientes de riesgo para la presentación de resultados.
Resultados y discusión
Rendimiento del crecimiento
La Tabla 3 presenta el efecto de diferentes fuentes de aceite en el rendimiento de los pollos de engorde durante 1 a 42 días de edad. Las aves en este experimento muestran signos de estrés térmico, como lo demuestra el jadeo, acostarse en el piso y enderezar el ala, incluso el grupo más frío estaba ausente, pero el comportamiento de estrés por calor fue evidente. Las fuentes de aceite promovieron efectos positivos en el crecimiento de los pollos de engorde durante los días 1 a 21 y 1 a 42 de edad. Los resultados también revelaron que la fuente de CocO aumentó significativamente el crecimiento de los pollitos durante el período de 1 a 21 días (9,9%) en comparación con la dieta FO. Sin embargo, Wang et al. (57) informaron que una dieta suplementada con CocO no tiene ningún efecto sobre el aumento de peso. Además, los AGCM disminuyen la tasa de crecimiento (35) y el CocO mejora la digestión de las grasas y el índice de rendimiento durante la infección por coccidiosis (36).
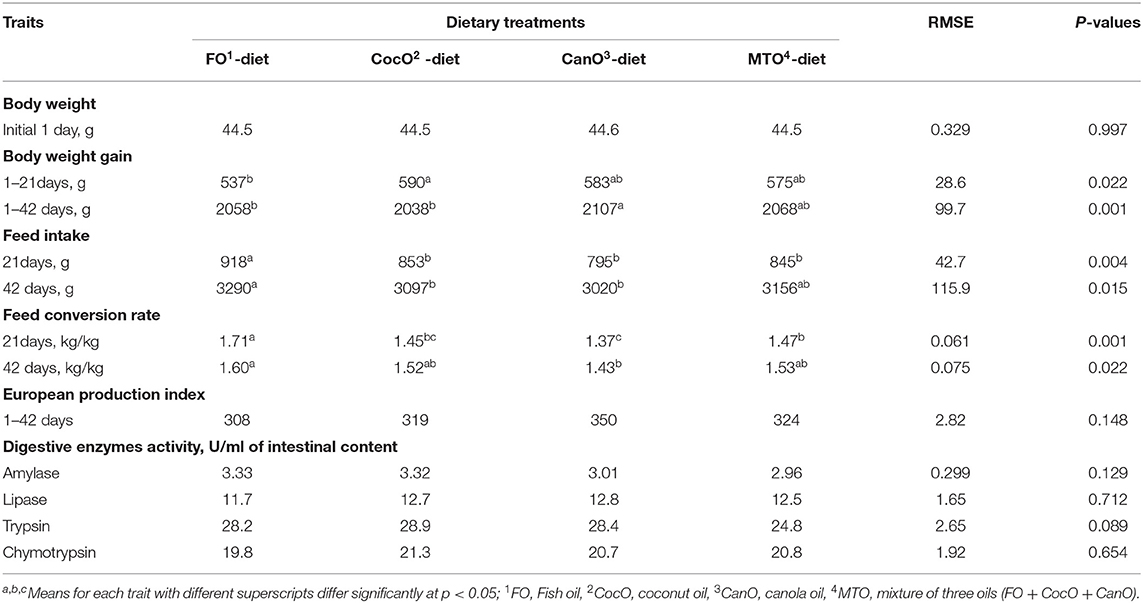 TABLA 3. Efecto de diferentes fuentes de aceite dietético en el rendimiento del crecimiento de los pollos de engorde.
TABLA 3. Efecto de diferentes fuentes de aceite dietético en el rendimiento del crecimiento de los pollos de engorde.
Durante todo el período, el CanO elevó significativamente el crecimiento durante los días 1 a 42 en comparación con las dietas FO y CocO. La mejora del rendimiento del crecimiento de los pollos de engorde en CanO podría deberse a un mayor contenido de UFA y ácidos grasos monoinsaturados (AGMI), y a la mayor capacidad energética de los AGPI (23). La tasa de crecimiento de los pollos de engorde hembras alimentados con dos variedades de CanO es mayor en comparación con los pollos de engorde alimentados con sebo y jabón de aceite de soja acidulado. El aumento del crecimiento se debe a los altos AGLC y a un alto porcentaje de triglicéridos (24).
En estudios previos, los alimentos mejorados con grasa elevan la eficiencia de la energía consumida y la productividad en aves de corral en condiciones de clima normal y cálido, pero el impacto depende de la fuente de grasa/aceite (2, 44, 45). Además, el aceite mejora la absorción de vitaminas liposolubles, la palatabilidad de las dietas, disminuye el polvo de los alimentos y reduce la tasa de paso del alimento en el intestino, lo que permite más tiempo para la absorción suficiente de nutrientes, especialmente a altas temperaturas debido a la mala digestión de los alimentos (1-5, 44). Por ejemplo, Zollitsch et al. (39) y Khatun et al. (8) informaron que los pollos de engorde alimentados con un 6% de aceite de soja (en su mayoría un 84% de aceite insaturado) o una combinación de aceite de soja y aceite de palma (en su mayoría un 50% de aceite saturado) exhiben un crecimiento significativamente mayor durante los días 1 a 21 de edad en comparación con una dieta de control con un 6% de aceite de palma. Nobakht concluyó que la tasa de crecimiento de los pollos de engorde disminuye con la inclusión de FO en la dieta (14). La contradicción entre los estudios mencionados anteriormente indica que el impacto del tipo de grasa en el rendimiento del crecimiento depende del perfil y los niveles de los ácidos grasos utilizados, así como de la edad de los pollos y el tipo de estrés (58). Los pollos alimentados con una dieta enriquecida con ácido erúcico exhiben una tasa de crecimiento, IF, digestibilidad de lípidos y ácidos grasos significativamente más bajos (23) y almacenan menos grasa y utilizan menos eficiencia energética (23).
Hubo un efecto significativo sobre la IF durante los días 1-21 y 1-42 (Tabla 3). FO aumentó significativamente la FI en comparación con otros grupos de aceites durante los días 1 a 21 de edad. Además, la dieta FO aumentó la FI en un 8,9% en comparación con la dieta CanO de los días 1 a 42. El IF más bajo fue para el grupo CanO de 1 a 21 días y de 1 a 42 días de edad. La suplementación con MTO presentó un efecto intermedio sobre la IF. El aumento de la IF mediada por FO en comparación con el CocO, y el CanO está en general de acuerdo con Dawood y Mohammed (59). Además, el 3% de aceite de palma aumenta significativamente la ingesta de alimento en comparación con el aceite de soja de los 17 a los 38 años de edad, pero no afecta a la IF de los días 1 a 16 de edad (40). Sin embargo, el 6% de aceite de palma o aceite de soja o diferentes combinaciones de los dos no afecta la ingesta de alimento de los pollos de engorde durante los días 1 a 21 días y 22 a 42 años (8). De acuerdo con los presentes hallazgos, la adición de SFA aumentó el IF en comparación con el UFA; Este cambio dependía del nivel y la fuente de grasas y la edad de los pollos. En la literatura, los ácidos linolénico PUFA (18:3) y linoleico (18:2) disminuyen el consumo de alimento en comparación con los AGS, es decir, los ácidos palmítico y esteárico (60). La disminución de la IF observada en este documento de pollos de engorde alimentados con CocO y CanO podría deberse a los AGPI y a su alta capacidad de producción de energía. Además, la baja digestibilidad de los AGS en comparación con los AGU fue citada por Zollitsch et al. (39) y Ayed et al. (40), particularmente durante las primeras semanas de vida (3). Sin embargo, Wang et al. (57) informaron que los pollos de engorde alimentados con una dieta suplementada con CocO no mostraron diferencias en la IF en comparación con una dieta suplementada o de control con FO (14).
Los pollos de engorde alimentados con la dieta suplementada con CanO de los días 1 a 21 y 1 a 42 mostraron el mejor cambio en la FCR en comparación con la otra dieta de aceite: 6,80-19,9% y 7,0-10,6%, respectivamente (Tabla 3). La peor FCR fue de los alimentos suplementados con FO de los días 1 a 21 y de 1 a 42 años de edad. Los pollos de engorde alimentados con la dieta enriquecida con CocO o MTO mostraron una FCR similar y mejor que la FO durante los días 1 a 21 (15,2%). Los presentes resultados indican que el CanO, que es rico en ácidos linolénico y linoleico, mejora el crecimiento de los pollos de engorde y la FCR debido a su alta capacidad de producción energética en comparación con las dietas ricas en AGS. Estas mejoras se asociaron con un mayor crecimiento. Los resultados también demuestran que el CanO utilizado en este documento tenía un bajo contenido de ácido erúcico y, por lo tanto, no tenía ningún efecto nocivo en los pollos de engorde (23, 25). Del mismo modo, las suplementaciones con aceite mejoraron el FCR de los pollos de engorde a temperatura ambiente normal y alta (2, 44, 45). En la literatura, existen diferencias en el FCR debido a diversas fuentes de petróleo, por ejemplo, Wignjosoesastro et al. (61) revelaron que un 10% de CocO aumenta la tasa de producción y la eficiencia. Además, Zollitsch et al. (39) y Ayed et al. (40) observaron que los pollos de engorde alimentados con aceite de soja presentan una FCR significativamente mejor en comparación con las dietas de aceite de palma. Además, Khatun et al. (8) revelaron que una dieta suplementada con un 6% de AGPI y una combinación de aceites de soja y palma mejoran significativamente la FCR en comparación con la dieta con un 6% de aceite de palma. Sin embargo, los pollos de engorde alimentados con aceite de girasol tienen un mejor FCR en comparación con los alimentados con sebo de res (61). Por otro lado, Wang et al. (57) informaron que los pollos de engorde alimentados con una dieta enriquecida con CocO no muestran diferencias en la FCR en comparación con el control. Nobakht (14) llegó a la conclusión de que el nivel de FO en la dieta no afecta a la FCR de los pollos de engorde.
No hubo diferencias significativas en el índice de producción europea y la mortalidad en las condiciones actuales del experimento.
Actividad de las enzimas digestivas
La actividad de las enzimas digestivas en el intestino (proventrículo, duodeno, yeyuno e íleon) influenciada por diferentes fuentes de aceite dietético se muestra en la Tabla 3. Las mediciones estimadas a los 42 días de edad después de la exposición de los pollos de engorde a alta temperatura ambiente durante las 4-6 semanas de edad indican que no hubo diferencias significativas debido a las diferentes fuentes de aceite en las activaciones de enzimas digestivas. La inclusión de FO y CocO aumentó numéricamente la amilasa intestinal (10,5-12,5%) en comparación con el CanO y la combinación de los tres aceites. Además, las dietas enriquecidas con CocO, CanO y MTO elevaron numéricamente la lipasa intestinal entre un 6,8 y un 9,4 % en comparación con la dieta suplementada con FO. Sin embargo, hubo una tendencia (P < 0,089) a que la tripsina fuera numéricamente mayor (16,1%) en los grupos que recibieron las fuentes de grasa individuales en comparación con el grupo MTO. Las actividades numéricas de quimotripsina también aumentaron (2,5%) debido a CocO en comparación con FO. Un estudio previo indicó una mayor actividad de tripsina pancreática, α-amilasa y maltasa intestinal debido a la suplementación con aceite (62). En general, la mejora de las actividades enzimáticas digestivas encontradas en este documento es consistente con el aumento del crecimiento y el uso de alimento para el crecimiento en condiciones de calor (Tabla 3). En la misma línea, el CocO mejora la digestión de las grasas y los valores de rendimiento durante la infección por coccidiosis (36).
Características de la canal
En la Tabla 4 se muestra el aderezo, el hígado, la molleja, el corazón, las menudencias, la parte comestible total y la grasa abdominal después de la suplementación con las diferentes fuentes de aceite. Los parámetros medidos a los 42 días de edad indican que los pollos de engorde alimentados con las dietas enriquecidas con CocO, CanO y MTO tuvieron un porcentaje de aderezo similar, y dieron como resultado un aumento del 2,8-4,5% en el total de partes comestibles en comparación con los alimentos suplementados con FO. Además, la suplementación con MTO no tuvo efectos aditivos sobre los parámetros de la canal y las características de los órganos en comparación con las fuentes de aceite induvial. Esto indica que la suplementación individual de la fuente de aceite fue adecuada, y que las suplementaciones con aceite durante las condiciones de clima cálido son beneficiosas (2, 44, 45). Los pollos de engorde alimentados con las dietas enriquecidas con CocO, CanO y MTO tuvieron un porcentaje de grasa abdominal más bajo (32%) en comparación con las dietas FO, pero el porcentaje de hígado fue significativamente mayor (22,9%) con la dieta enriquecida con CanO en comparación con el CocO. El aumento del aderezo y del total de partes comestibles de los pollos de engorde alimentados con una dieta enriquecida con AGPI (CocO, CanO o MTO) indica que estos animales tenían una mayor disponibilidad de energía para el crecimiento muscular, mientras que la disminución de la grasa abdominal en estos grupos muestra un cambio en el uso de energía para el crecimiento muscular en lugar de la deposición en la cavidad abdominal (14, 15). Además, Baião y Lara (3) y Nobakht et al. (14); demostró que la inclusión de diferentes fuentes y niveles de AGPI en las dietas de los pollos de engorde influyó significativamente en las características de la canal. Además, la inclusión de un 5% de CanO en las dietas de los pollos de engorde aumenta el peso de la pechuga en comparación con los otros grupos (63). Se reportaron rendimientos similares en canal y corte para pollos de engorde alimentados con diferentes fuentes de grasas (2, 25, 44, 45). La mejora del rendimiento de la canal y la disminución de la grasa abdominal y el porcentaje de hígado de los pollos de engorde alimentados con la dieta enriquecida con CocO indican que el aceite se quema para obtener energía en lugar de almacenarse en el cuerpo (27). El consumo de un alimento rico en AGCM aumenta la adiposidad de la parte superior del cuerpo en hombres con sobrepeso; por lo tanto, los AGCM pueden considerarse como una herramienta potencial en la prevención del aumento de peso y la obesidad (27, 32). De acuerdo con la reducción en el aderezo y el total de partes comestibles de los pollos de engorde, la dieta suplementada con FO afectó negativamente los criterios de canal (4, 64).
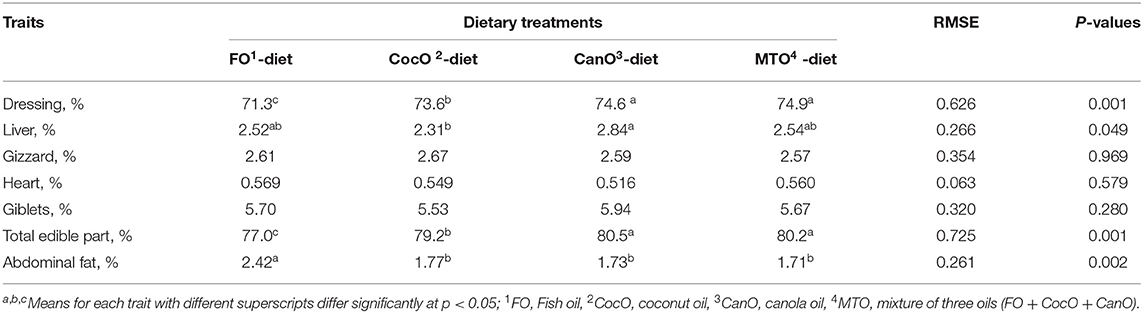 TABLA 4. Efecto de la alimentación con diferentes fuentes de aceite sobre las características de la canal a los 42 días (%).
TABLA 4. Efecto de la alimentación con diferentes fuentes de aceite sobre las características de la canal a los 42 días (%).
El aumento observado en el porcentaje de hígado de los pollos de engorde alimentados con la dieta enriquecida con CanO se debió a la deposición adicional de grasa en este órgano en lugar de a la grasa abdominal. Es probable que este fenómeno se deba al mayor contenido de UFA en el CanO (64,8%), del cual el oleico es dominante. La EM de los aceites y grasas depende del número de dobles enlaces, la longitud de la cadena de carbono, la presencia o ausencia de enlaces éster (ácidos grasos libres o triglicéridos), la composición de la dieta (3). Además, la configuración específica de los UFA y SFA en la columna vertebral de glicerol, la disposición de los ácidos grasos libres, la cantidad y el tipo de contenido nutricional de triglicéridos, la microflora intestinal y la edad y el sexo del pollo (3, 39).
Perfil lipídico plasmático
En la Tabla 5 se presenta la influencia de diferentes fuentes de aceite en el perfil lipídico plasmático de pollos de engorde de 42 días de edad. Los triglicéridos plasmáticos, el colesterol total, el LDL-C, HDL-C y la relación LDL-C:HDL-C y el vLDL de los pollos de engorde alimentados con dietas con diferentes fuentes de aceites fueron similares. Los lípidos plasmáticos totales fueron significativamente mayores en los grupos FO y CanO en comparación con el grupo MOT, que mostró la mayor disminución (15,5%) en los lípidos totales plasmáticos. Los grupos CocO presentaron valores intermedios. Las concentraciones plasmáticas de triglicéridos/HDL mostraron una tendencia hacia (P < 0,093) valores aumentados (10,5-12,6%) de los grupos CanO y MTO en comparación con los grupos FO y Cocoo. En general, el cambio en los perfiles lipídicos plasmáticos, que refleja la composición de ácidos grasos de la dieta y se correlaciona con el aumento del contenido de PUFA en la dieta, así como con la elevada actividad de la lipasa intestinal. El efecto positivo de la suplementación con CocO que se encuentra en este documento sobre los lípidos totales plasmáticos, triglicéridos/HDL indica que el aceite se quema para obtener energía y se usa para disipar el estrés térmico (27, 32, 44, 45). Del mismo modo, los AGCM mejoran los perfiles lipídicos séricos en humanos y ratas (31, 34). Los investigadores demostraron que los UFA y los PUFA beneficiosos tienen influencias positivas y saludables en los lípidos plasmáticos debido a su impacto en el aumento del HDL-C mientras disminuyen el LDL-C, el segmento de lipoproteínas peligrosas (61, 65-67).
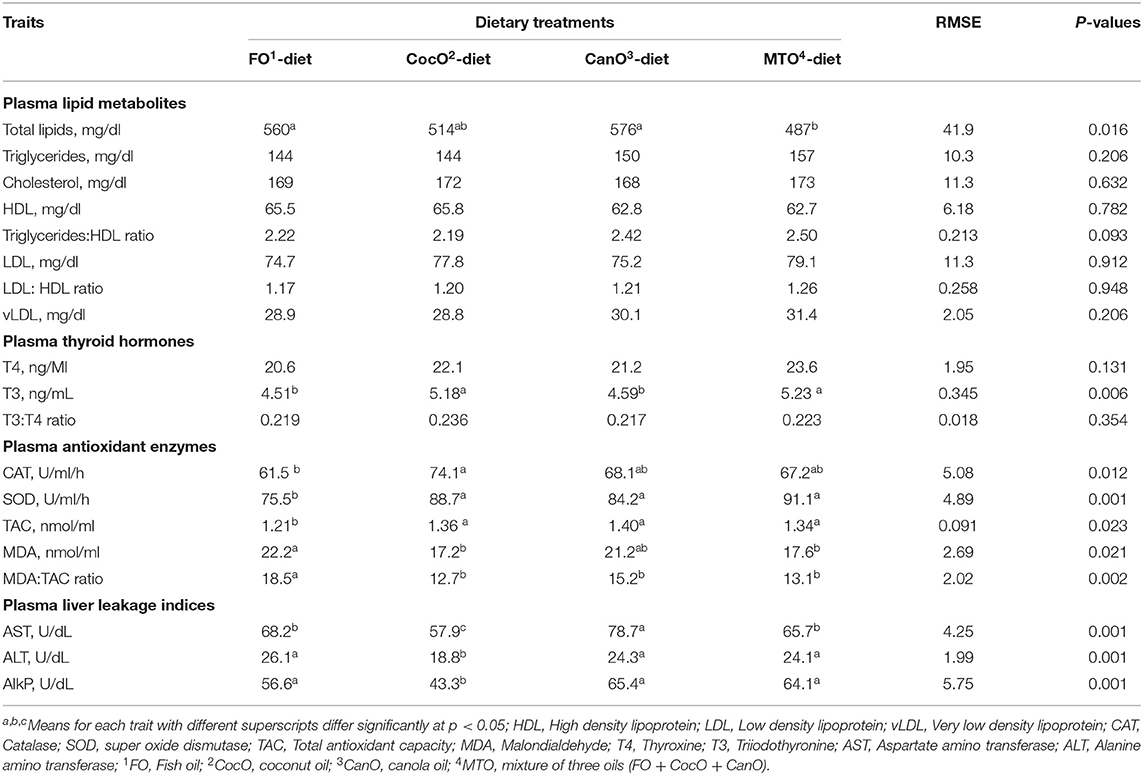 TABLA 5. Efecto de la alimentación con diferentes fuentes de aceite sobre algunos constituyentes bioquímicos lipídicos del plasma sanguíneo; índices de antioxidantes; hormonas tiroideas e índices de fugas hepáticas.
TABLA 5. Efecto de la alimentación con diferentes fuentes de aceite sobre algunos constituyentes bioquímicos lipídicos del plasma sanguíneo; índices de antioxidantes; hormonas tiroideas e índices de fugas hepáticas.
Hormonas tiroideas plasmáticas
Las hormonas tiroideas afectadas por los diferentes tipos de aceites se muestran en la Tabla 6. Los resultados muestran que la suplementación con CocO y MTO promovió los mayores aumentos de T3 en comparación con las dietas FO y CanO. Por otro lado, T4 y T3:T4 no se vieron afectados por las fuentes de grasa de la dieta. Las hormonas tiroideas disminuyen durante el clima cálido y están involucradas en la regulación de las vías anabólicas y catabólicas del metabolismo de proteínas, lípidos y carbohidratos (68, 69). Un estudio anterior informó que una interacción significativa entre el tipo y el nivel de grasas podría tener efectos adversos sobre la T3 y T4 (68, 69). El perfil de ácidos grasos de la dieta afecta a la actividad hepática de la desiodinasa tipo I (68, 69) y a la unión de T3 a los receptores nucleares (70). Este hallazgo contradice parcialmente los resultados de investigaciones que mostraron una reducción de la T3 nivel de animales alimentados con dietas ricas en grasas (71, 72). Sin embargo, es difícil explicar la falta de efecto del nivel de grasa sobre la T3 Concentración en ratas alimentadas con aceites de palma y colza.
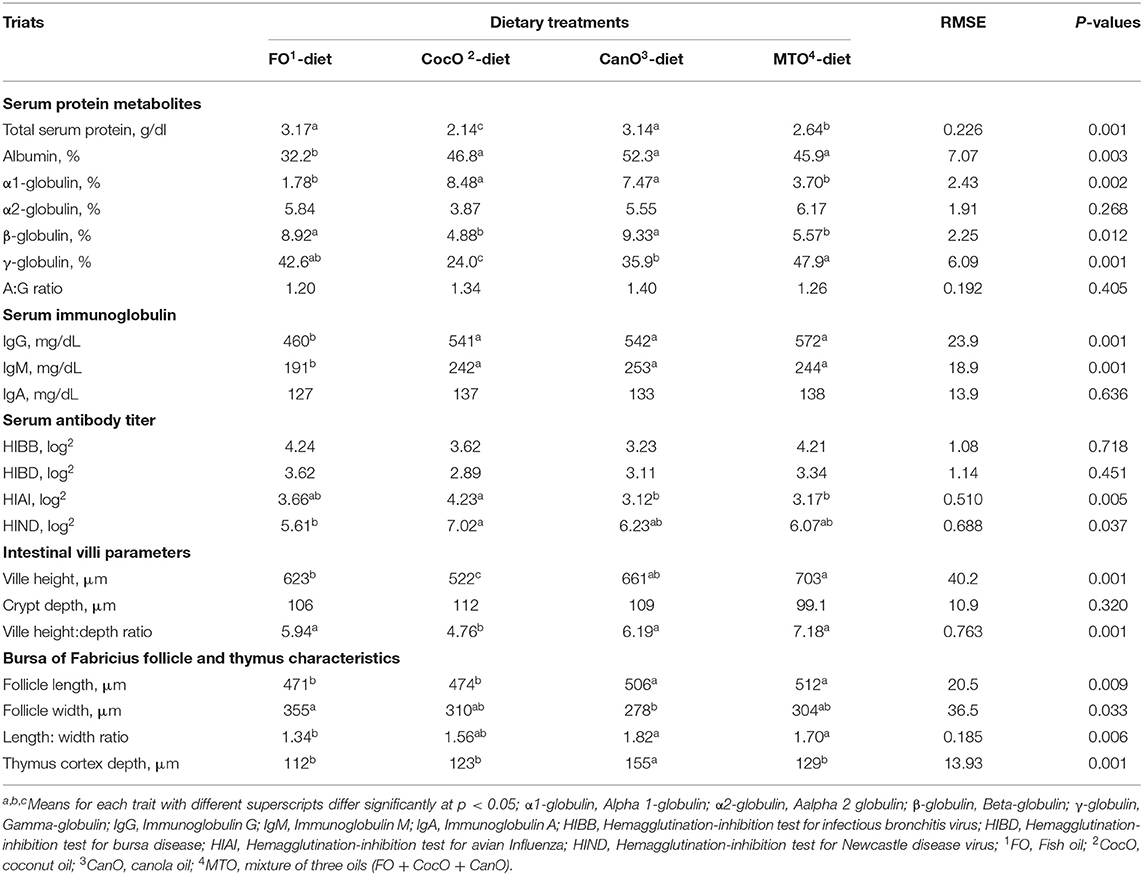 TABLA 6. Efecto de la alimentación con diferentes fuentes de aceite sobre los índices inmunológicos séricos sanguíneos y las características morfométricas de las vellosidades intestinales, la bolsa de Fabricio y la corteza del timo.
TABLA 6. Efecto de la alimentación con diferentes fuentes de aceite sobre los índices inmunológicos séricos sanguíneos y las características morfométricas de las vellosidades intestinales, la bolsa de Fabricio y la corteza del timo.
El aumento de la T3 de pollos de engorde suplementados con dietas de CocO en condiciones de clima cálido puede deberse a la elevada disponibilidad de energía y al uso de procesos anabólicos para el crecimiento muscular. Se evidencia por el aumento en la tasa de crecimiento y FCR durante 1-21 días y la disminución en la deposición de hígado y grasa en la cavidad abdominal de pollos de engorde alimentados con una dieta suplementada con Coco (Tabla 4). El CocO es una rica fuente de SFA y AGCM (6-12 átomos de carbono) (3, 27), que pueden ser absorbidos directamente en el sistema portal sin reesterificación en las células intestinales (28). Los AGCM se queman exclusiva y rápidamente para producir energía (29). Por el contrario, los AGLC se encuentran comúnmente en la mayoría de las dietas y se incorporan a los quilomicrones después de ser absorbidos en el intestino, donde se someten a una reesterificación, y luego llegan al torrente sanguíneo a través del sistema linfático (28). La mayoría de los AGC se almacenan en el tejido adiposo (30). En un estudio, la T total4 los niveles son más altos en ratas Wistar alimentadas con un 5 o 10% de aceite de palma en comparación con una dieta enriquecida con aceite de colza (68).
Estado antioxidante del plasma
La suplementación con CocO, CanO o MTO aumentó significativamente, y de manera similar, las actividades de SOD y TAC en comparación con el grupo FO (Tabla 6). Además, el CocO aumentó significativamente el CAT en comparación con el FO. Además, las dietas suplementadas con CocO y MOT disminuyeron significativamente la MDA plasmática y la relación MDA:TAC en comparación con la dieta FO. Además, el CanO redujo sustancialmente la relación MDA:TAC en comparación con el grupo FO y MAD hasta cierto punto. En general, la suplementación con CocO indujo el efecto más sustancial sobre los perfiles antioxidantes, mientras que el enriquecimiento con FO promovió la menor influencia. Es bien sabido que el MDA aumentó debido a la alimentación de AGPI y particularmente durante condiciones de clima cálido debido al proceso de peroxidación (44). Este efecto beneficioso de los aceites sobre el perfil antioxidante muestra la esencia de la suplementación con aceite durante las condiciones de clima cálido, particularmente cuando se combina con la suplementación antioxidante (45, 65). En particular, Bhatnagar et al. (27) informaron que la suplementación dietética con CocO aumenta los tocoferoles totales. Los tocoferoles son antioxidantes esenciales que protegen la membrana celular de los radicales libres (73). Además, el CocO es muy estable frente a la oxidación y, en consecuencia, no es propenso a la formación de peróxidos. Por lo tanto, la incorporación de CocO mejora la constancia de los piensos (27). Además, el CocO tiene efectos antibacterianos, antiprotozoarios y antivirales únicos, todos los cuales controlan la rancidez microbiana (74, 75).
Enzimas de fuga de plasma hepático
La Tabla 6 también muestra el efecto de diferentes fuentes de aceite sobre las enzimas de fuga hepática plasmática de pollos de engorde de 42 días de edad. AST, ALT y AlkP fueron significativamente más bajos en los pollos alimentados con la dieta enriquecida con CocO en comparación con los de los otros grupos de aceites. Además, los pollos de engorde alimentados con FO y MTO presentaron una disminución considerable de la actividad plasmática de AST en comparación con los grupos CanO y aumentaron AlkP en comparación con el grupo CocoO. Estos resultados indican un efecto beneficioso de los AGPI sobre la integridad de la membrana celular hepática que podría deberse a los fosfolípidos enriquecidos como parte esencial de la integridad de la membrana celular que contienen dos AGLC hidrofóbicos (4, 5, 65). Los efectos beneficiosos del CocO sobre las enzimas de fuga hepática, como se dijo anteriormente, podrían deberse a sus efectos antioxidantes (27) y antimicrobianos (74, 75). En la literatura, la suplementación con aceite mejoró la función hepática (44, 45). Sin embargo, Yildirim et al. (66) encontraron que las fuentes de grasa de la dieta, incluida la manteca de cacao, no afectaban a la AST, ALT y AlkP plasmáticas en ratas. Las diferencias entre los estudios podrían deberse al tipo de dietas, los niveles y el tipo de lípidos, la cepa, la edad y el sexo, y las especies de animales (73).
Estado inmunitario
Perfil de proteínas séricas
La Tabla 6 también muestra la influencia de diferentes fuentes de aceite en los índices inmunes séricos de los pollos de engorde. Las diferentes fuentes de aceite no tuvieron ningún efecto sobre la α2-globulina o la relación albúmina-globulina medida a los 42 días de edad. Las dietas suplementadas con FO y CanO aumentaron de manera similar la proteína sérica total en comparación con el grupo de CocO y MTO. En general, la mejora en el uso de proteínas con la suplementación con FO y CanO que se encuentra en este documento puede mejorar la respuesta inmunitaria, y los anticuerpos son de naturaleza proteica. El aumento de la proteína sérica de los pollos de engorde alimentados con la dieta enriquecida con FO o CanO está en general de acuerdo con el efecto de los aceites en la mejora de la absorción de nutrientes (incluida la proteína) en condiciones de calor (3, 4, 45). Los resultados actuales confirmaron este efecto debido a que las diferentes fuentes de aceite FO y CanO aumentaron la actividad de la quimotripsina. El aumento de la actividad enzimática se asocia con el aumento de la digestibilidad de los nutrientes y, por lo tanto, con la absorción de nutrientes (1, 44, 65).
La dieta suplementada con FO disminuyó significativamente el porcentaje de albúmina (una proteína inmune no específica) en comparación con los otros grupos de aceites. Del mismo modo, la suplementación con FO disminuyó la proliferación de células T y B y retrasó la hipersensibilidad de tipo como medidas de inmunidad mediada por células (76, 77).
Inmunoglobulina sérica
Las dietas enriquecidas con Coco y CanO aumentaron significativamente la α1-globulina en comparación con los grupos FO y MTO. La diferencia en la β-globulina debida a las diferentes fuentes de aceite mostró que FO y CanO indujeron un aumento subesteral en comparación con CocO y MTO. La γ-globulina se elevó considerablemente con la dieta enriquecida con MTO en comparación con los grupos enriquecidos con Coco y CanO. Las inmunoglobulinas (γ-globulina) desempeñan un papel vital en la inmunidad natural y adquirida a las infecciones (78). Las globulinas, una familia importante de proteínas, son una fuente esencial de la proteína presente en los fluidos animales, incluidas las enzimas, los anticuerpos y las proteínas fibrosas y contráctiles que generalmente se encuentran en el plasma sanguíneo (73). α y β-globulinas son proteínas transportadoras, sirven como sustratos sobre los que se forman otras sustancias y realizan otras funciones diversas (78).
Las diferentes fuentes de aceite no afectaron significativamente a la IgA, pero la IgG y la IgM disminuyeron considerablemente debido a la suplementación con FO en comparación con los otros grupos de aceites. Sin embargo, Yildirim et al. (66) no revelaron cambios marcados en la IgG entre sus grupos experimentales. Además, los niveles de IgM se redujeron significativamente en el grupo de manteca de cacao sola y manteca de cacao + aceite de girasol en comparación con la dieta enriquecida con aceite de girasol y el grupo control.
Título sérico de anticuerpos
Ninguna de las fuentes de aceite afectó la prueba de IH para el virus de la bronquitis infecciosa (HIBB) o la enfermedad de la bursa (HIBD) (Tabla 6). Por otro lado, los pollos de engorde alimentados con una dieta suplementada con 50 g/kg de FO muestran una mayor producción de anticuerpos (IgM e IgG) y globulinas en el suero y mantienen la función inmune después de la vacunación en comparación con el grupo control (79). En el presente estudio, la adición de CocO resultó en un aumento considerable del HIAI en comparación con los grupos CanO y MTO. Además, el grupo suplementado con CocO mostró un aumento significativo de la HIND en comparación con el grupo FO. En general, el CocO indujo los títulos de anticuerpos más altos contra HIAI y HIND. Los AGCM pueden ser absorbidos a través de la circulación portal después de la ingestión. Posteriormente, son metabolizados por los hepatocitos en cetonas y utilizados como fuente de energía. Este proceso mantiene el nivel sérico de leptina y promueve la cetogénesis durante el ayuno a corto plazo y la restricción energética (80). La leptina puede mejorar las funciones inmunitarias, incluida la producción de citoquinas inflamatorias en los macrófagos, la quimiotaxis de granulocitos y el aumento de la proliferación de Th17 (81). La dieta cetogénica activa un subconjunto de células T en los pulmones que no se habían asociado previamente con la respuesta del sistema inmunitario a la gripe; Esta acción mejora la producción de moco por parte de las células de las vías respiratorias que pueden atrapar eficazmente el virus (82). No obstante, el nivel y la fuente de grasa en la dieta no influyeron significativamente en el título de anticuerpos contra el VEN a los 42 y 70 días de edad (80, 83), pero tuvieron un efecto positivo sobre los anticuerpos en otros experimentos (44, 45). En los seres humanos, el CocO dietético normaliza los lípidos corporales, protege el hígado del daño causado por el alcohol y mejora la respuesta antiinflamatoria del sistema inmunológico (27, 74, 75). Del mismo modo, Yaqoob (12) sugirió que los impactos de MUFA en las moléculas de adhesión son potencialmente cruciales, concretamente a través de su papel en la patología de varias enfermedades que involucran al sistema inmunológico. Existe cierta evidencia de que los efectos del aceite de oliva sobre la función inmune en estudios con animales se deben al ácido oleico en lugar de a oligoelementos o antioxidantes. Kelley y Daudu (84) informaron que en los animales las grasas podrían inhibir y estimular procesos, dependiendo de la especie, los ácidos grasos utilizados y el índice que se esté examinando. Estos hallazgos sugieren que las cantidades absolutas o las proporciones entre ácidos grasos individuales o clases de ácidos grasos son fundamentales para determinar sus efectos sobre la respuesta inmune y deben investigarse (12, 83).
Vale la pena señalar que, la suplementación con FO resultó en un aumento numérico del HIAI y se correlacionó con un aumento de la γ-globina y una disminución de la albúmina sérica. Los AGPI ω3 dietéticos (FO o aceite de linaza) tienen un impacto significativo positivo en la inmunidad humoral, es decir, en los títulos de anticuerpos contra el VEN en comparación con la dieta de control (18). Además, la suplementación con FO aumenta significativamente los títulos de anticuerpos y los porcentajes de peso relativo de la bursa y el bazo en comparación con el control en condiciones de clima normal y cálido (20, 44, 45). El FO no tiene efectos adversos sobre la función inmunitaria de los pollos de engorde (19). Por otro lado, las aves alimentadas con una dieta con una relación ω6:ω3 que excede los niveles recomendados exhiben daño a las células epiteliales intestinales (21). Además, una relación baja de ω6: ω3 en la dieta aumenta la MDA en los tejidos, incluida la carne, y por lo tanto perjudica la calidad de la carne.
Medidas morfométricas de la Villi, Bursa de Fabricio y Timo
La altura de las vellosidades y la relación altura/profundidad de las vellosidades se vieron significativamente afectadas por la suplementación con aceites dietéticos (Tabla 6). El MTO aumentó significativamente la altura de las vellosidades en comparación con los grupos FO y CocoO, y aumentó la relación altura-profundidad de las vellosidades en comparación con el grupo CocoO. Estos resultados indican que FO, CanO y MTO aumentan la capacidad de absorción del intestino y, por lo tanto, podrían ser responsables de mejorar el crecimiento y la inmunidad de los pollos de engorde alimentados con estas dietas. Esta es una influencia esencial durante las condiciones de clima cálido debido a la alteración de la digestión y la absorción de nutrientes (44, 45, 65, 73).
Los parámetros del folículo y la profundidad de la corteza del timo se vieron afectados significativamente por la fuente de aceites. La adición de CanO y MTO causó el mayor aumento en la longitud del folículo en comparación con las otras fuentes de aceite, pero FO aumentó significativamente el ancho del folículo en comparación con el grupo de CanO. La relación longitud/anchura del folículo disminuyó significativamente en los pollos de engorde alimentados con la dieta enriquecida con FO en comparación con los grupos CanO y MTO.
La profundidad de la corteza del timo aumentó significativamente para las dietas suplementadas con CocO en comparación con los otros grupos de aceites. Del mismo modo, la fuente de grasa tuvo efectos significativos sobre el peso y el porcentaje de timo y la relación entre la bolsa de Fabricius y el peso corporal (4, 5). Sin embargo, el peso de la bolsa de Fabricius y el peso y porcentaje del bazo, la respuesta inmune humoral a las inyecciones de SRBC o a las vacunas contra el VND, el IBDV o el IBV no se vieron afectados por los tratamientos con aceite (4, 5). La adición de 2,5 o 5% de aceite de soja a la dieta aumenta el porcentaje de bazo y bursa, respectivamente, en comparación con otros grupos (83). En conjunto, el perfil de ácidos grasos en lugar del lípido específico de la dieta es esencial para optimizar la inmunidad celular y humoral en pollos de engorde (84).
En conclusión, los suplementos de aceite al 1,5% mejoraron el rendimiento del crecimiento y el estado inmunológico, mejoraron el perfil de lípidos en sangre y el estado antioxidante, y el efecto de las fuentes de aceite depende de los criterios de respuesta.
Declaración de disponibilidad de datos
Los conjuntos de datos generados para este estudio están disponibles previa solicitud al autor correspondiente.
Declaración de Ética
Los procedimientos experimentales fueron aprobados por el Decanato de Investigación Científica de la Universidad Rey Abdulaziz, Jeddah, Arabia Saudita bajo el número de protocolo (DF-312-155-1441 H) que recomienda los derechos de los animales, el bienestar y el estrés mínimo y no causaron ningún daño o sufrimiento a los animales de acuerdo con el Real Decreto número M59 en 14/9/1431H.
Contribuciones de los autores
Todos los autores enumerados han hecho una contribución sustancial, directa e intelectual al trabajo, y lo han aprobado para su publicación.
Financiación
Este proyecto fue financiado por el Decanato de Investigación Científica (DSR) de la Universidad Rey Abdulaziz, Jeddah, en virtud de la subvención No. (DF-312-155-1441 H). Por lo tanto, los autores agradecen el apoyo técnico y financiero de DSR.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Referencias
1. Chwen LT, Foo HL, Thanh NT, Choe D. Rendimiento del crecimiento, ácidos grasos plasmáticos, altura de las vellosidades y profundidad de la cripta de lechones antes del destete alimentados con triacilglicerol de cadena media. Asiático Aust J Anim Sci. (2013) 26:700–4. doi: 10.5713/ajas.2012.12561
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Attia YA, Abd El-Hamid EAH, Nagadi SA, de Oliveira MC, Bovera F, Habiba HI. Los ácidos grasos destilados de la dieta y los antioxidantes mejoran el uso de nutrientes y el rendimiento de las codornices macho japonesas. Anim Sci Pap Rep. (2019) 37:65–74. doi: 10.13140/RG.2.2.23000.03846
3. Baião NC, Lara LJC. Aceite y grasa en la nutrición de pollos de engorde. Braz J Poult Sci. (2005) 7:129–41. doi: 10.1590/S1516-635X2005000300001
4. Poorghasemi M, Seidavi A, Qotbi AAA, Chambers JR, Laudadio V, Tufarelli V. Influencia de la fuente de grasa de la dieta en las respuestas de rendimiento del crecimiento y las características de la canal de los pollos de engorde. Asiático Aust J Anim Sci. (2013) 26:705–10. doi: 10.5713/ajas.2012.12633
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Poorghasemi M, Seidavi A, Qotbi AAA, Chambers JR, Laudadio V, Tufarelli V. Efecto de la fuente de grasa de la dieta en la respuesta de inmunidad humoral de pollos de engorde. Eur Poult Sci. (2015) 79. doi: 10.1399/eps.2015.92
6. Abdulla NR, Loh TC, Akit H., Sazili A., Foo HL, Mohamad R., et al. Perfil de ácidos grasos, colesterol y estado oxidativo en pechuga de pollo de engorde alimentado con diferentes fuentes de aceite dietético y niveles de calcio. S Afr J Anim Sci. (2015) 45:153–63. doi: 10.4314/sajas.v45i2.6
7. Alzawqari MH, Al-Baddany AA, Al-Baadani HH, Alhidary IA, Khan RU, Aqil GM, et al. Efecto de la alimentación con cáscara seca de naranja dulce (Citrus sinensis) y hojas de hierba limón (Cymbopogon citratus) sobre el rendimiento del crecimiento, las características de la canal, los metabolitos séricos y el estado antioxidante en pollos de engorde durante la fase de engorde. Environ Sci Pollut Res. (2016) 23:17077–82. doi: 10.1007/s11356-016-6879-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Khatun J, Loh TC, Akit H, Foo HL, Mohamad R. Influencia de diferentes fuentes de aceite en el rendimiento, la calidad de la carne, la morfología intestinal, la digestibilidad ileal y el perfil lipídico sérico en pollos de engorde. J Appl Anim Res. (2017) 46:479–85. doi: 10.1080/09712119.2017.1337580
9. Raza T, Chand N, Khan RU, Shahid MS, Abudabos AM. Mejorar el perfil de ácidos grasos en la yema de huevo mediante el uso de semillas de cáñamo (Cannabis sativa), jengibre (Zingiber officinale) y cúrcuma (Curcuma longa) en la dieta de Hy-Line White Leghorns. Raza Arch Anim. (2016) 68:183–90. doi: 10.5194/aab-59-183-2016
10. Zaki EF, El Faham A, Nematallah GM. Perfil de ácidos grasos y características de calidad de la carne de pollo de engorde alimentada con diferentes fuentes de aceite dietético con algunos aditivos. Int J Salud Anim Sci Food Saf. (2018) 5:40-50. doi: 10.13130/2283-3927/9581
11. Galli C, Calder PC. Efectos de la ingesta de grasas y ácidos grasos sobre las respuestas inflamatorias e inmunitarias: una revisión crítica. Ann Nutr Metab. (2009) 55:123–39. doi: 10.1159/000228999
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Yaqoob P. Grasas monoinsaturadas y función inmunitaria. Braz J Med BiolRes. (1998) 31:453–65. doi: 10.1590/S0100-879X1998000400001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Swiatkiewicz S, Arczewska-Włosek A, Józefiak D. La relación entre las fuentes de grasa de la dieta y la respuesta inmunitaria en aves de corral y cerdos: una revisión actualizada. Livest Sci. (2015) 180:237–46 doi: 10.1016/j.livsci.2015.07.017
14. Nobakht A, Tabatbaei S, Khodaei S. Efectos de diferentes fuentes y niveles de aceites vegetales sobre el rendimiento, las características de la canal y la acumulación de vitamina E en la carne de pechuga de pollos de engorde. Cur Res J Biol Sci. (2011) 3:601–5.
15. Alagawany M, Elnesr SS, Farag MR, Abd El-Hack ME, Khafaga AF, Taha AE, et al. Ácidos grasos omega-3 y omega-6 en la nutrición avícola: efecto sobre el rendimiento productivo y la salud. Animales. (2019) 9:573. doi: 10.3390/ani9080573
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Shiels MI. Ácidos grasos y desarrollo humano temprano. Se desarrollan zumbidos tempranos. (2007) 83:761–6. doi: 10.1016/j.earlhumdev.2007.09.004
17. Smith M, Soisuvan K, Miller L. Evaluación del nivel de calcio en la dieta y la fuente de grasa sobre el rendimiento del crecimiento y la utilización de minerales de pollos de engorde angustiados por el calor. Poult Sci. (2003) 2:32–7. doi: 10.3923/ijps.2003.32.37
18. Ebeid T, Eid Y, Saleh A, Abd El-Hamid H. Desarrollo folicular ovárico, peroxidación lipídica, estado antioxidante y respuesta inmune en gallinas ponedoras alimentadas con dietas suplementadas con aceite de pescado para producir huevos enriquecidos con n-3. Animal. (2008) 2:84–91. doi: 10.1017/S1751731107000882
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Al-Khalifa HS, Givens D, Rymer C, Yaqoob P. Efecto de los ácidos grasos n-3 sobre la función inmune en pollos de engorde. Poult Sci. (2012) 91:74–88. doi: 10.3382/ps.2011-01693
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Jameel YJ, Sahib AM, Husain MA. Efecto de los ácidos grasos omega-3 en la dieta sobre la producción de anticuerpos contra la enfermedad de Newcastle en pollos de engorde. Int J Sci Nat. (2015) 6:23–7.
21. Konieczka P, Czauderna M, Smulikowska S. El enriquecimiento de la carne de pollo con ácidos grasos omega-3 mediante aceite de pescado dietético o su mezcla con colza o linaza efecto de la duración de la alimentación con aceite de pescado dietético, linaza y colza y carne de pollo de engorde enriquecida con n-3. Anim Feed Sci Technol. (2017) 223:42–52. doi: 10.1016/j.anifeedsci.2016.10.023
22. López-Ferrer S, Baucells MD, Barroeta AC, Grashorn MA. N-3 Enriquecimiento de carne de pollo. 1. Uso de ácidos grasos de cadena muy larga en las dietas de pollo y su influencia en la calidad de la carne: aceite de pescado. Poult Sci. (2001) 80:741–52. doi: 10.1093/ps/80.6.741
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Lección S, Summers JD. Nutrición de los pollos. 4ª Edn. Guelph, ON: Libros Universitarios (2001).
24. Thacker; PA, Petri D. Evaluación nutricional del concentrado de proteína de canola para pollos de engorde. Asiático Aust J Anim Sci. (2011) 24:1607–14. doi: 10.5713/ajas.2011.11161
25. Andreotti MO, Junqueira OM, Cancherini LC, Rodrigues EA, Sakomura NK. Valor nutricional de algumas fontes de gordura para frangos de corte. En: Anais da 38° Reunião Anual da Sociedade Brasileira de Zootecnia. Piracicaba: SBZ (2001).
26. Souza PA, Souza HBA, Oba A, Leonel FR, Pelicano ERL, Norkus EA, et al. Características físicas e químicas da carne da coxa de frangos de corte produzidos com diferentes fontes de óleo. En: 38° Reunião Anual da Sociedade Brasileira de Zootecnia. Piracicaba: FEALQ (2001).
27. Piracicaba SP, Piracicaba, SBZ; Bhatnagar AS, Kumar P, Hemavathy J, Krishna G. Composición de ácidos grasos; estabilidad oxidativa; y la actividad de eliminación de radicales de las mezclas de aceites vegetales con aceite de coco. J Am Oil Chem Soc. (2009) 86:991–9. doi: 10.1007/s11746-009-1435-y
28. Ferreira WM. Digestão e Metabolismo dos Lipídios. Belo Horizonte: Escola de Veterinária da UFMG (1999). págs. 1-34.
29. Rubin M, Moser A, Vaserberg N, Greig F, Levy Y, Spivak H, et al. Ácidos grasos de cadena larga; En Nutrición parenteral domiciliaria a largo plazo: un estudio cruzado aleatorizado doble ciego. Nutrición. (2000) 16:95–100. doi: 10.1016/S0899-9007(99)00249-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Rego Costa AC, Rosado EL, Soares-Mota M. Influencia de la ingesta dietética de triglicéridos de cadena media en la composición corporal; gasto energético y saciedad; una revisión sistemática. Nutr Hosp. (2012) 27:103–8. doi: 10.1590/S0212-16112012000100011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Han J, Hamilton JA, Kirkland JL, Corkey BE, Guo W. El aceite de cadena media reduce la masa grasa y regula a la baja la expresión de genes adipogénicos en ratas. Obes Res. (2003) 11:734–44. doi: 10.1038/oby.2003.103
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. St-Onge MP, Ross R, Parsons WD, Jones PJ. Los triglicéridos de cadena media + des aumentan el gasto energético y disminuyen la adiposidad en hombres con sobrepeso. Obes Res. (2003) 11:395–402 doi: 10.1038/oby.2003.53
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Takeuchi H, Noguchi O, Sekine S, Kobayashi A, Aoyama T. Menor aumento de peso y mayor expresión y niveles sanguíneos de adiponectina en ratas alimentadas con TAG de cadena media+ en comparación con TAG de cadena larga. Lípidos. (2006) 41:207–12. doi: 10.1007/s11745-006-5089-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Xie P, Wang Y, Wang C, Yuan C, Zou X. Efecto de diferentes fuentes de grasa en las dietas parentales sobre el rendimiento del crecimiento; morfología de las vellosidades; Enzimas digestivas y microbiota colorrectal en palomas. Arch Anim Nutr. (2013) 6:147–60. doi: 10.1080/1745039X.2013.776329
35. Santos F, Donoghue AM, Venkitanarayanan K, Dirain ML, Reyes-Herrera I, Blore PJ, et al. El ácido caprílico suplementado en los piensos reduce la colonización entérica de Campylobacter jejuni en pollos de engorde de diez días de edad. Poult Sci. (2008) 87:800–4. doi: 10.3382/ps.2007-00280
36. Adams BYC, Vahl HA, Veldman A. Interacción entre la nutrición y la infección por Eimeria acervulina en pollos de engorde: composiciones de la dieta que mejoran la digestión de las grasas durante la infección por Eimeria acervulina. Hno. J Nutr. (1996) 75:875–80. doi: 10.1079/BJN19960193
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Attia YA, Al-Harthi MA, Korish MM, Shiboob MM. Perfiles de ácidos grasos y colesterol e hipocolesterolémico; Aterogénico; e índices trombogénicos de huevos de mesa en el mercado minorista. Lípidos Salud Dis. (2015) 14:136. doi: 10.1186/s12944-015-0133-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Attia YA, Al-Harthi MA, Korish MM, Shiboob MM. Perfiles de ácidos grasos y colesterol; hipocolesterolémica; Aterogénico; e índices trombogénicos de carne de pollo de engorde en el mercado minorista. Lípidos Salud Dis. (2017) 16:40. doi: 10.1186/s12944-017-0423-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Zollitsch W, Knaus W, Aichinger F, Lettner F. Efectos de diferentes fuentes de grasa dietética sobre el rendimiento y las características de la canal de los pollos de engorde. Anim Feed Sci Technol. (1997) 66:63–73. doi: 10.1016/S0377-8401(96)01126-1
40. Ayed H. B, Attia H y Ennouri M. Efecto de la dieta suplementada con aceite sobre el rendimiento del crecimiento y la calidad de la carne de los pollos de engorde. Adv Tech Biol Med. (2015) 4:156. doi: 10.4172/2379-1764.1000156
41. Wood JD, Richardson RI, Nute GR, Fisher AV, Campo MM, Kasapidou E, et al. Efectos de los ácidos grasos en la calidad de la carne: una revisión. Ciencia de la carne. (2003) 66:21–32. doi: 10.1016/S0309-1740(03)00022-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Velasco S, Ortiz LT, Alzueta C, Rebole A, Treviño J, Rodríguez ML. Efecto de la suplementación con inulina y la fuente de grasa de la dieta sobre el rendimiento; metabolitos séricos sanguíneos; lípidos hepáticos; depósito de grasa abdominal; y la composición de ácidos grasos en tejidos de pollos de engorde. Poult Sci. (2010) 89:1651–62. doi: 10.3382/ps.2010-00687
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. NRC. Requerimiento de nutrientes de las aves de corral. Academia Nacional de Ciencias. 9ª ed. Washington, DC: Consejo Nacional de Investigación (1994).
44. Attia YA, Al-Harthi MA, Elnaggar ASh. Respuestas productivas, fisiológicas e inmunológicas de dos cepas de pollos de engorde alimentadas con diferentes regímenes dietéticos y expuestas a estrés por calor. Ital J Anim Sci. (2018) 17:686–97. doi: 10.1080/1828051X.2017.1416961
45. Attia YA Hassan SSh. Tolerancia de los pollos de engorde al estrés por calor en varios niveles de proteína/energía en la dieta. Europ Poult Sci. (2017) 81:2017. doi: 10.1399/eps.2017.171
46. Grasse M, Rosenkrands I, Olsen A, Follmann F, Dietrich J. Ensayo basado en citometría de flujo para determinar la actividad fagocítica de muestras de anticuerpos clínicos y no clínicos contra Chlamydia trachomatis. Citometría A. (2018) 93:525–32. doi: 10.1002/cyto.a.23353
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. King DJ, Seal BS. Caracterización biológica y molecular de aislados de campo del virus de la enfermedad de Newcastle (NDV) con comparaciones con cepas de NDV de referencia. Avian Dis. (1998) 42:507–16. doi: 10.2307/1592677
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Cosgrove A. Una enfermedad aparentemente nueva de los pollos: la nefrosis aviar. Avian Dis. (1962) 6:385–9. doi: 10.2307/1587909
49. Takatsy G. El uso de bucles espirales en micrométodos serológicos y virológicos. Acta Microbiol Acad Sci Hung. (1956) 3:197.
50. Friedewald WT, Levy RI, Fredrickson DS. Estimación de la concentración de colesterol de lipoproteínas de baja densidad en plasma; sin el uso de la ultracentrífuga preparativa. Clin Chem. (1972) 18:499–502. doi: 10.1093/clinchem/18.6.499
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Pinchasov Y, Nir I, Nitsan Z. Adaptaciones metabólicas y anatómicas de pollitos de cuerpos pesados a la alimentación intermitente. 2. Enzimas digestivas pancreáticas. Hno. Poult Sci. (1990) 31:769–77. doi: 10.1080/00071669008417307
52. Sklan; D., Halevy O. Digestión y absorción de proteínas a lo largo del tracto gastrointestinal ovino. J Lácteos Sci. (1985) 68:1676–81. doi: 10.3168/jds. S0022-0302(85)81013-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Sklan D, Hurwitz S, Budowski P, Ascarelli A. Digestión y absorción de grasas en pollitos alimentados con harina de soja cruda o calentada. J Nutr. (1975) 105:57–63. doi: 10.1093/jn/105.1.57
54. Attia YA, Al-Khalaifah HS, Abd El-Hamid HE, Al-Harthi MA, El-shafey AA. Efecto de diferentes niveles de multienzimas sobre la respuesta inmune; hematología y bioquímica sanguínea; Estado antioxidante e histología de los órganos de los pollos de engorde alimentados con dietas estándar y de baja densidad. Front Vet Sci. (2020) 6:510. doi: 10.3389/fvets.2019.00510
55. AOAC. Métodos oficiales de análisis. Washington, DC: Asociación de Químicos Analíticos Oficiales (2004).
56. SAS, Instituto. Guía del usuario de SAS para computadoras personales®. Cary, Carolina del Norte: SAS Institute Inc. (2004).
57. Wang J, Wang X, Li J, Chen Y, Yang W, Zhang L. Efectos del aceite de coco dietético como fuente de ácidos grasos de cadena media en el rendimiento; Composición de la canal y lípidos séricos en pollos de engorde machos. Asiático Aust J Anim Sci. (2015) 28:223–30. doi: 10.5713/ajas.14.0328
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Htin NN, Zulkifli I, Alimon AR, Loh TC, Hair-Bejo M. Efectos de las fuentes de grasa dietética en pollos de engorde expuestos a estrés transitorio por altas temperaturas. Arch Geflügelk. (2007) 71:74–80.
59. Dawood HY, Mohammed OE. Efecto de las fuentes y niveles de grasa de la dieta sobre el rendimiento de los pollos de engorde y los lípidos séricos de la canal. Am J Innov Res Appl Sci. (2015) 1:318–31.
60. Atteh JO, Leeson S. Efectos de los ácidos grasos saturados o insaturados de la dieta y los niveles de calcio en el rendimiento y el metabolismo mineral de los pollos de engorde. Poult Sci. (1984) 63:2252–60. doi: 10.3382/ps.0632252
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Wignjosoesastro N, Brooks CC, Herrick RB. El efecto de la harina de coco y el aceite de coco en las raciones de aves de corral sobre el rendimiento de las gallinas ponedoras. Poult Sci. (1972) 51:1126–1132. doi: 10.3382/ps.0511126
62. Jang IS, Ko YH, Kang SY, Lee CY. Efecto de un aceite esencial comercial en el rendimiento del crecimiento; Actividad enzimática digestiva y población de microflora intestinal en pollos de engorde. Anim Feed Sci Technol. (2007) 134:304–15. doi: 10.1016/j.anifeedsci.2006.06.009
63. Nash DM, Hamilton RMG, Hulan HW. El efecto de la harina de arenque dietética sobre el contenido de ácidos grasos omega-3 de los lípidos plasmáticos y de yema de huevo de gallinas ponedoras. Can J Anim Sci. (1995) 75:247–53. doi: 10.4141/CJAs95-036
64. Kiani A, Sharifi SD, Ghazanfari S. Influencia de las dietas de suplementación con aceite de canola y lisina en el rendimiento del crecimiento y la composición de ácidos grasos de la carne en pollos de engorde. Int J Anim Vet Sci. (2017) 11:134-40.
65. Aggoor FAM, Attia YA, Qota EMA. Un estudio sobre la eficiencia energética de diferentes fuentes y niveles de grasa en dietas vegetales de pollos de engorde. Mansoura Univ J Agric Sci. (2000) 25:801–20.
66. Yildirim E, Çinar M, Yalçinkaya I, Ekici H, Atmaca N, Güncüm E. Efecto de la suplementación con manteca de cacao y aceite de girasol sobre el rendimiento, la inmunoglobulina y el estado de las vitaminas antioxidantes de las ratas. BioMed Res Int. (2014) 2014:606575. doi: 10.1155/2014/606575
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Özdogan M, Akşit M. Efectos de los piensos que contienen diferentes grasas en la canal y los parámetros sanguíneos de los pollos de engorde. J Appl Poult Res. (2003) 12:251–6. doi: 10.1093/japr/12.3.251
68. Lachowicz K, Koszela-Piotrowska I, Rosołowska-Huszcz D. El metabolismo de la hormona tiroidea puede depender de la grasa de la dieta. J Anim Feed Sci. (2008) 17:110–9. doi: 10.22358/jafs/66475/2008
69. Lachowicz K, Koszela-Piotrowsk I, Rosołowska-Huszcza D. El tipo y el nivel de grasa de la dieta afectan las concentraciones plasmáticas de hormona tiroidea en ratas. J Anim Feed Sci. (2009) 18:541–50. doi: 10.22358/jafs/66430/2009
70. Yamamoto N, Li QL, Mita S, Morisawa S, Inoue A. Inhibición de la unión de la hormona tiroidea a la movilización del receptor nuclear de ácidos grasos libres. Hormona Metab Res. (2001) 33:131–7. doi: 10.1055/s-2001-14939
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Otten MH, Hennemann G, Docter R, Visser TJ. El papel de la grasa dietética en el metabolismo de la hormona tiroidea periférica. Metabolismo. (1980) 29:930–5. doi: 10.1016/0026-0495(80)90035-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Vermaak WJ, Kalk WJ, Kuyl JM, Smit AM. Cambios inducidos por ácidos grasos en las hormonas tiroideas totales y libres circulantes: efectos in vitro y artefactos metodológicos. J Endocrinol Invest. (1986) 9:121–6. doi: 10.1007/BF03348081
73. Attia YA, Böhmer Barbara M, Roth-Maier Dora A. Respuestas de pollos de engorde criados a una temperatura ambiente relativamente alta y constante a enzimas, suplementos de aminoácidos o una dieta rica en nutrientes. Archiv für Geflügelkunde. (2006) 70:80–91.
74. Enig MG. Dieta; colesterol sérico, enfermedad coronaria. En: Mann GV, editor. Enfermedad coronaria: el sinsentido del sentido dietético. Londres: Janus Publishing (1993). págs. 36-60.
75. Enig MG. Aceites láuricos como agentes antimicrobianos: teoría del efecto; fundamentación científica; aplicaciones dietéticas como apoyo nutricional complementario para las personas infectadas por el VIH. En: Watson RR, editor. Nutrientes Alimentos en SIDA. Boca Ratón, FL: CRC Press (1998). págs. 81-97.
76. Meydani SN, Ribaya-Mercado JD, Russell RM, Sahyoun N, Morrow FD, Gershoff SN. La deficiencia de vitamina B-6 afecta la producción de interleucina 2 y la proliferación de linfocitos en adultos mayores. Am J Clin Nutr. (1991) 53:1275–80. doi: 10.1093/ajcn/53.5.1275
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Kramer IM, Koornneef I, de Laat SW, Adriana JM, Raaij AJM. El TGF-f1 induce la fosforilación de la proteína de unión al elemento sensible al AMP cíclico en las células ML-CC164. EMBO J. (1991) 10:1083–9. doi: 10.1002/j.1460-2075.1991.tb08048.x
78. Attia YA, Al-Khalifa H, Ibrahim MS, Abd Al-Hamid AE, Al-Harthi MA, El-Naggar ASh. Componentes hematológicos y bioquímicos de la sangre; enzimas antioxidantes; inmunidad y órganos linfoides de pollos de engorde suplementados con propóleo; polen de abeja y manano, oligosacáridos de forma continua o intermitente. Poult Sci. (2017) 96:4182–92. doi: 10.3382/ps/pex173
79. Al-Mayah AAS. Efecto del aceite de pescado sobre la inmunidad humoral de los pollos de engorde. Basora J Vet Res. (2009) 8:23–32. doi: 10.33762/bvetr.2009.56864
80. Leung YB, Cave NJ, Heiser A, Edwards PJB, Godfrey AJR, Wester T. Efectos metabólicos e inmunológicos del ayuno intermitente en una dieta cetogénica que contiene triglicéridos de cadena media en perros sanos. Front Vet Sci. (2020) 6:480. doi: 10.3389/fvets.2019.00480
Resumen de PubMed | Texto completo de CrossRef | Google Académico
81. Naylor C, Petri WA Jr. Regulación de las respuestas inmunitarias por leptina. Tendencias Mol Med. (2016) 22:88–98. doi: 10.1016/j.molmed.2015.12.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
82. Goldberg EL, Molony RD, Kudo E, Sidorov S, Kong Y, Dixit VD, et al. La dieta cetogénica activa las respuestas protectoras de las células Tδ γ contra la infección por el virus de la influenza. Sci Immunol. (2019) 4:EAAV2026. doi: 10.1126/sciimmunol.aav2026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
83. Kelley DS, Daudu, Pensilvania. Ingesta de grasas y respuesta inmunitaria. Prog Food Nutr Sci. (1993) 17:41-63.
Palabras clave: aceite de pescado, aceite de coco, aceite de canola, rendimiento de pollos de engorde, respuesta inmunológica
Cita: Attia YA, Al-Harthi MA y Abo El-Maaty HM (2020) Los efectos de diferentes fuentes de aceite en el rendimiento, las enzimas digestivas, los rasgos de la canal, las respuestas bioquímicas, inmunológicas, antioxidantes y morfométricas de los pollos de engorde. Frente. Vet. Sci. 7:181. doi: 10.3389/fvets.2020.00181
Recibido: 24 de enero de 2020; Aceptado: 20 de marzo de 2020;
Publicado: 28 Abril 2020.
Editado por:
Kyung-Woo Lee, Universidad de Konkuk, Corea del Sur
Revisado por:
Mahmoud M. Alagawany, Universidad de Zagazig, Egipto
John Carragher, Universidad de Adelaida, Australia
Derechos de autor © 2020 Attia, Al-Harthi y Abo El-Maaty. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Youssef A. Attia, yaattia@kau.edu.sa; Hayam M. Abo El-Maaty, hayam151@yahoo.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


