Los efectos de la alimentación diferencial y el estado de salud de los terneros recién nacidos
Los efectos de la alimentación diferencial en el desarrollo del íleon, la capacidad digestiva y el estado de salud de los terneros recién nacidos
 Jie Wang†
Jie Wang†  Yang Chen†
Yang Chen†  Mianying Li
Mianying Li  Siqi Xia
Siqi Xia  Kaisen Zhao
Kaisen Zhao  Huimei Fan
Huimei Fan  Jiale Ni
Jiale Ni  Wenqiang Sun
Wenqiang Sun  Xianbo Jia
Xianbo Jia  Songjia Lai*
Songjia Lai*- Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de Sichuan, Chengdu, China
El predestete es el período más importante para el crecimiento y desarrollo de los terneros. La morfología intestinal, la comunidad microbiana y la inmunidad se construyen inicialmente en esta etapa, e incluso tienen un impacto de por vida en los terneros. Los patrones de alimentación temprana tienen un impacto significativo en el desarrollo gastrointestinal y las comunidades microbianas. Este estudio analizó principalmente los efectos de tres métodos de alimentación en el desarrollo gastrointestinal de los terneros y proporcionó una base teórica para mejorar aún más el modo de alimentación de los terneros. Es muy importante desarrollar un modo de alimentación adecuado. En este estudio, seleccionamos nueve terneros Holstein sanos recién nacidos que fueron seleccionados al azar y divididos en tres grupos (n = 3), que fueron alimentados con entrante + heno + leche (grupo SH), iniciador + leche (grupo SF), ración mixta total + leche (grupo TMR). Después de 80 días de alimentación hasta los 80 días de edad, se recogieron el contenido de íleon y muestras de sangre, y las diferencias se compararon y analizaron mediante análisis metagenómico y análisis metabolómico sérico. Los resultados muestran que, en comparación con los otros dos grupos, el epitelio intestinal del grupo SH fue más completo y las células caliciformes se desarrollaron mejor. El método de alimentación del grupo SH fue más propicio para el desarrollo de los terneros, con mayor ganancia diaria y sin reacción inflamatoria patológica. La comunidad microbiana intestinal era más propicia para la digestión y la absorción, y la inmunidad era más fuerte. Estos hallazgos son útiles para explorar mejores patrones de alimentación de terneros. En el siguiente paso, estableceremos más réplicas biológicas para estudiar las razones profundas de las diferencias en el desarrollo de los terneros antes del destete. Al mismo tiempo, los nuevos descubrimientos de la neuromicrobiología amplían nuestros horizontes y son el foco de nuestra atención futura.
1. Introducción
El predestete es el período más importante para el crecimiento y desarrollo de los terneros. La morfología intestinal, la comunidad microbiana y la inmunidad se construyen inicialmente en esta etapa, e incluso tienen un impacto de por vida en los terneros (1, 2). El entorno de vida del ternero cambió de un útero estéril al mundo exterior, y las condiciones nutricionales cambiaron de la provisión materna a la propia alimentación del ternero de alimento y leche. Debido al desarrollo incompleto de la capacidad inmune y el sistema digestivo de los terneros, los terneros recién nacidos son muy sensibles a los estímulos externos, y cualquier interferencia externa afectará seriamente el crecimiento de los terneros (3, 4). Si no se adopta el modo de alimentación apropiado en este momento, conducirá a un bajo aumento de peso diario, diarrea (5). Se informa que el 30% de las muertes de vacas antes del destete son causadas por diarrea, lo que destaca la importancia de la salud intestinal (6). El desarrollo del tracto digestivo de los terneros es un proceso único. Con el desarrollo del tracto gastrointestinal y el asentamiento de la comunidad microbiana, los terneros cambian gradualmente de animales pseudo-rumiantes a rumiantes funcionales en fisiología. La morfología de las vellosidades epiteliales intestinales, el desarrollo del músculo liso intestinal y el volumen ruminal se completan básicamente en esta etapa, que fue acompañada por el desarrollo de los órganos salivales y el desarrollo del comportamiento de rumia. Estos factores afectan directamente la ingesta de alimento, la tasa de absorción de nutrientes y la capacidad digestiva de los terneros después del destete (7).
Los estudios han demostrado que los patrones de alimentación temprana tienen un impacto significativo en el desarrollo gastrointestinal y las comunidades microbianas. Las diferencias en la composición de la dieta y la morfología física del alimento estimularán el desarrollo de la estructura intestinal y la composición de la comunidad microbiana (8-10). Por ejemplo, el heno de alfalfa puede promover el desarrollo de vellosidades epiteliales intestinales; la alimentación con alto contenido de carbohidratos y baja en fibra será perjudicial para el desarrollo ruminal de los terneros; Los aditivos pueden aumentar directa o indirectamente la proporción de probióticos (11-13). La investigación muestra que la comunidad microbiana intestinal puede dirigirse al cambio, ajustar los patrones de alimentación puede ayudar a los animales a formar comunidades microbianas beneficiosas antes del destete (14). Esto no solo puede promover el desarrollo de la capacidad digestiva de la pantorrilla, sino que también es indispensable para el desarrollo de la función inmune intestinal. La investigación de Deng sobre pandas gigantes ha demostrado que Streptococcus alactolyticus puede promover la adaptación dietética de los pandas gigantes al participar en el metabolismo de las proteínas (15). Estudios recientes también han encontrado que las comunidades microbianas también comunican información biológica con el sistema nervioso, apunta a un nuevo campo: la neuromicrobiología, esto ilustra aún más el enorme impacto de los microbios intestinales en el huésped (16).
No hay un modo de alimentación fijo para los terneros recién nacidos. El modo de alimentación apropiado debe formularse de manera integral de acuerdo con sus necesidades nutricionales, características de la raza, plan de alimentación y otros factores (17). Para los terneros en esta etapa, el crecimiento es importante, pero lo más importante, el desarrollo saludable del sistema digestivo basado en el tracto gastrointestinal. Esto tendrá un impacto a largo plazo en el crecimiento y la producción posteriores de terneros (18, 19). Por lo tanto, es muy importante desarrollar un modo de alimentación adecuado. En este estudio, se utilizaron tres modos de alimentación diferentes para explorar los efectos de diferentes modos de alimentación en el crecimiento y desarrollo del íleon y el metabolismo sanguíneo de los terneros desde la perspectiva de la metagenómica y la metabolómica. Se exploró la relación entre el desarrollo intestinal, la función digestiva y la composición de la comunidad microbiana para proporcionar una base teórica para mejorar aún más el patrón de alimentación de los terneros. Al mismo tiempo, nos inspiró a explorar la relación entre los microorganismos intestinales y el sistema nervioso desde una nueva perspectiva de la neurobiología.
2. Materiales y métodos
2.1. Declaración ética
Este estudio fue aprobado y realizado de acuerdo con los estándares éticos del Comité Institucional de Cuidado y Uso de Animales de la Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de Sichuan, Sichuan, 611130, China.
2.2. Animales y gestión de la alimentación
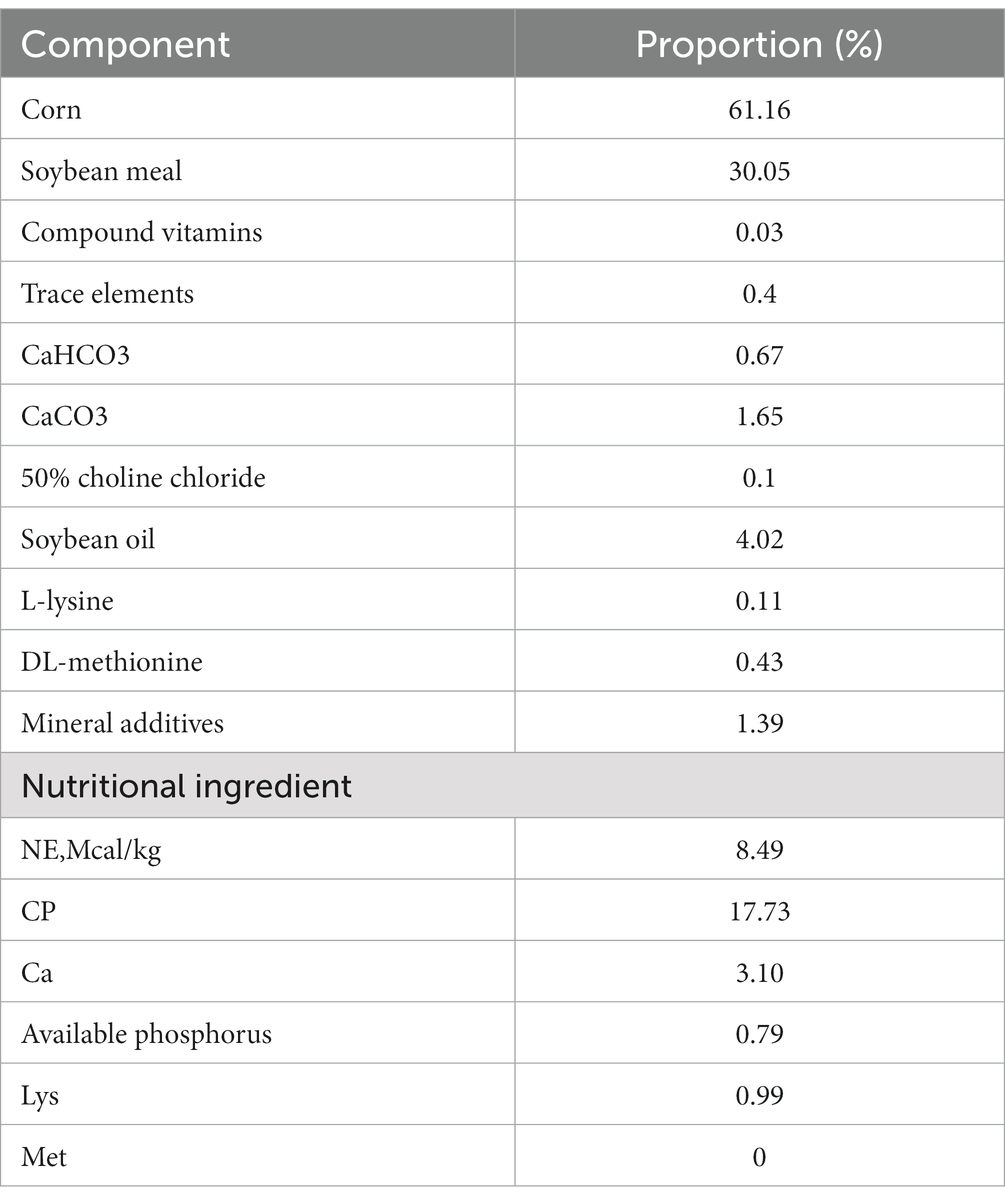
Se seleccionaron nueve terneros Holstein machos sanos de 7 días de edad con un peso corporal de aproximadamente 41,6 kg (desviación estándar = 0,563) y una condición física similar. Criado en Sichuan Xuebao Dairy Group HonSFeng granja ganadera. Nueve terneros se dividieron aleatoriamente en tres grupos, grupo SH: alimento inicial + heno + leche, grupo SF: alimento inicial + leche, grupo TMR: ración mixta total + leche. La composición del alimento y la composición de nutrientes del alimento de inicio se muestran en la Tabla 1. El heno en el grupo SH estaba compuesto de alfalfa y avena en una proporción de 3: 2, cortado en 1,5 cm de largo, mezclado con iniciador y alimentado. Alimento TMR (iniciador: alfalfa: pasto de avena: agua = 0.30: 0.12: 0.08: 0.50), el iniciador se trituró en polvo, el heno se cortó a aproximadamente 1 cm y se mezcló con agua para pegar. Otros métodos de alimentación y manejo se llevaron a cabo de acuerdo con los métodos existentes de las granjas ganaderas, y los terneros fueron libres de alimentar y beber agua durante el período experimental. Alimentación continua hasta los 80 días de edad, utilizando el método de sangría de descarga eléctrica para sacrificar y registrar el peso del sacrificio.
2.3. Recogida de muestras séricas y detección parcial del índice fisiológico
Después de que los terneros ayunaron durante 24 h, se adoptó el método de recolección de sangre de la vena yugular externa (10 de junio de 2022) y se usaron vasos de recolección de sangre de 5 ml (EDTAK2, Jiangsu Kangjian Medical Device Co., Ltd., Nanjing, China) para recolectar algo de sangre de ternera, y se usó heparina sódica para la anticoagulación. Se tomaron algunas muestras de sangre para determinar los índices de rutina de sangre, como el recuento de glóbulos rojos y el recuento de glóbulos blancos (Chengdu Li Lai Biotechnology Co., Ltd., Chengdu). Las muestras de sangre se centrifugaron a 4°C, 3000 r/min durante 5 min para obtener el suero superior. Algunas muestras de suero se enviaron a Novogene Bioinformatics Technology Co., Ltd. (Beijing, China) para el análisis metabolómico, y luego se seleccionaron algunas muestras de suero para determinar los índices digestivos e inmunes como la α-amilasa (C016-1-1), la lisozima (A050-1-1) y la tripsina (A080-2; los kits fueron proporcionados por el Instituto de Bioingeniería Nanjing Jiancheng).
2.4. Análisis de la sección morfológica del íleon y recogida de muestras
Sacrificio de terneros por sangría eléctrica. Los terneros se levantan por la mañana, usan anestesia de descarga eléctrica después de la recolección de sangre en ayunas y luego sacrifican mediante sangría de la arteria carótida. Después del sacrificio, el contenido del íleon del ternero se colocó rápidamente en un tubo congelado de 2 ml y se almacenó en nitrógeno líquido a -80 ° C. El tejido de íleon no sellado se recogió y se fijó con una solución de formaldehído neutro al 10%. Después de la deshidratación, la poda, la incrustación, el corte, la tinción con hematoxilina y eosina (HE), el sellado y otros pasos, se utilizó el escáner digital Pannoramic 250 producido por la empresa húngara 3DHISTECH para recopilar imágenes de las rodajas.
2.5. Secuenciación metagenómica microbiana y análisis de anotaciones funcionales
De acuerdo con las instrucciones del kit de cuentas magnéticas de Tiangen (Tiangen Biotech, Beijing, China), el ADN microbiano se extrajo de muestras de contenido de íleon, y la pureza e integridad del ADN se detectaron mediante electroforesis en gel de agarosa. Las muestras de ADN calificadas se rompieron en fragmentos de aproximadamente 350 pb mediante un instrumento de trituración ultrasónica. Después de la reparación, purificación, amplificación por PCR y otros pasos, se completó la base de datos preliminar. Qubit2.0 se utilizó para la cuantificación, y luego NEBNext ® Ultra DNA Library Prep Kit para Illumina (NEB, EUA) se utilizó para construir una biblioteca metagenómica y secuenciarla en la plataforma Illumina HiSeq Xten. Novogene Bioinformatics Technology Co., Ltd. (Beijing, China) completó el trabajo de construcción y secuenciación de la biblioteca. La fecha limpia se obtuvo filtrando la fecha bruta obtenida por secuenciación, y la fecha limpia de cada muestra fue ensamblada y analizada por el software MEGAHIT (20, 21) (v1.0.4-beta 1). A continuación, el software MetaGeneMark (22) (V2.102) se utilizó para la predicción de genes, y los genes predichos por cada muestra se juntaron para construir el catálogo de genes. A partir del catálogo de genes, se sintetizaron los datos limpios de cada muestra para obtener unigenes para su posterior análisis (23).
Los unigenes obtenidos se compararon con la base de datos NR del NCBI (24) (Versión 2018-01-023) para determinar la información de anotación de especies de cada unigenes. Combinado con la tabla de abundancia de genes, se obtuvo la información de abundancia de cada muestra en filo, género y especie. Se utilizaron análisis PCA (25) (paquete RADE4, versión 2.15.3) y LEfSe (26) (puntuación LDA predeterminada a 3) para comparar las diferentes especies entre grupos. Finalmente, los unigenes se compararon con la base de datos KEGG (27, 28) (versión 2018-01-014), base de datos CAZy (29) (versión 201,8015) y la base de datos eggNOG (30) (versión 4.56) para obtener la abundancia relativa y las diferencias de anotación funcional entre los grupos (31).
2.6. Análisis metabolómico sérico
Los metabolitos en el íleon se estudiaron con base en la tecnología LC-MS. Después del tratamiento preliminar, el sobrenadante se inyectó en el sistema de cromatografía líquida de ultra rendimiento-espectrometría de masas en tándem (UHPLC-MS / MS) para su análisis (32). En primer lugar, los datos brutos de la espectrometría de masas se importaron al software Compound discoverer 3.1 para el procesamiento espectral y la recuperación de bases de datos, y se obtuvieron los resultados cualitativos y cuantitativos de los metabolitos. Luego, se controló la calidad de los datos para garantizar la precisión y confiabilidad de los datos. Usando la tecnología de espectrometría de masas de alta resolución (HRMS), podemos hacer que el grupo metabólico no objetivo detecte los picos característicos moleculares en la muestra. Los datos sin procesar después de fuera de línea son preprocesados por el software de procesamiento de datos CD3.1. Para que la identificación sea precisa, extraemos los picos de acuerdo con el conjunto de ppm, relación señal-ruido (S / N), iones aditivos y otra información y cuantificamos el área del pico. Luego se compararon las bases de datos mzCloud, mzVault y MassList para identificar metabolitos. Finalmente, los metabolitos con un coeficiente de variación de menos del 30% en muestras de control de calidad se retuvieron como resultado final. Los metabolitos se compararon con KEGG, HMDB y otras bases de datos para obtener los resultados de la anotación. Luego, se realizó un análisis estadístico multivariante de metabolitos, incluyendo análisis de componentes principales (PCA), análisis discriminante de mínimos cuadrados parciales (PLS-DA) para establecer la relación entre la expresión de metabolitos y muestras (33). De acuerdo con los resultados de Q2 y R2, se juzgó que el modelo revelaba las diferencias en los patrones metabólicos entre los diferentes grupos. Se realizó un análisis de la vía de enriquecimiento KEGG en los metabolitos diferenciales para obtener resultados de análisis diferencial más claros y detallados.
3. Resultados
3.1. Sección de tinción de HE del tejido de íleon
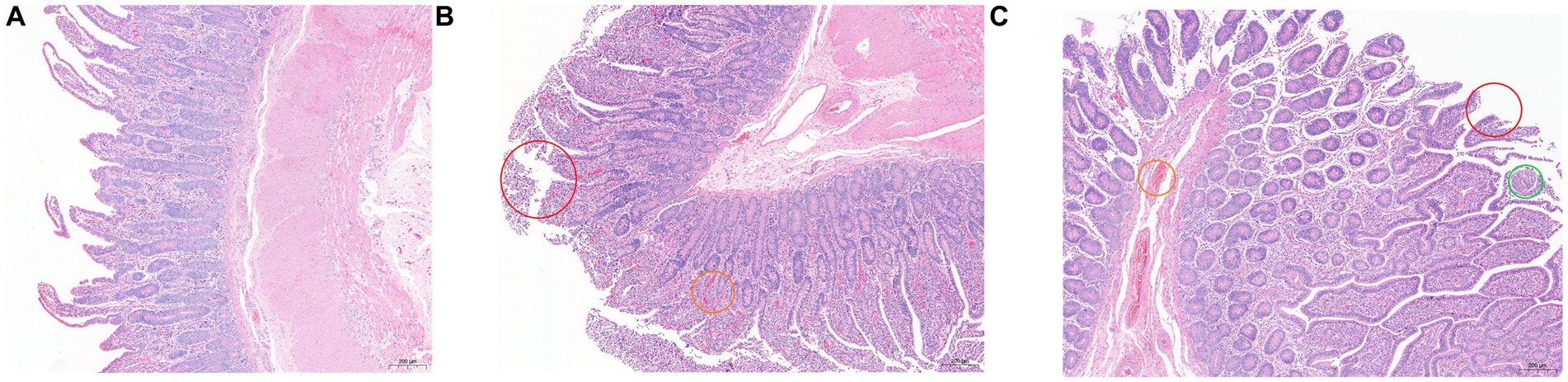
Los resultados de la tinción de HE se muestran en la Figura 1. En comparación con los otros dos grupos, las vellosidades epiteliales en el grupo SH estaban relativamente completas, las vellosidades epiteliales intestinales eran altas y estaban bien desarrolladas, las células caliciformes estaban estrechamente dispuestas y se observaron algunas células inflamatorias en la lámina propia. Hubo un gran número de desprendimiento de la mucosa epitelial en el grupo SF, y las células inflamatorias en la lámina propia también fueron más que las del grupo DAI, acompañadas de congestión; la integridad mucosa del grupo TMR fue la peor, acompañada de células inflamatorias y congestión, e incluso se observó una infección parasitaria obvia en algunas secciones.
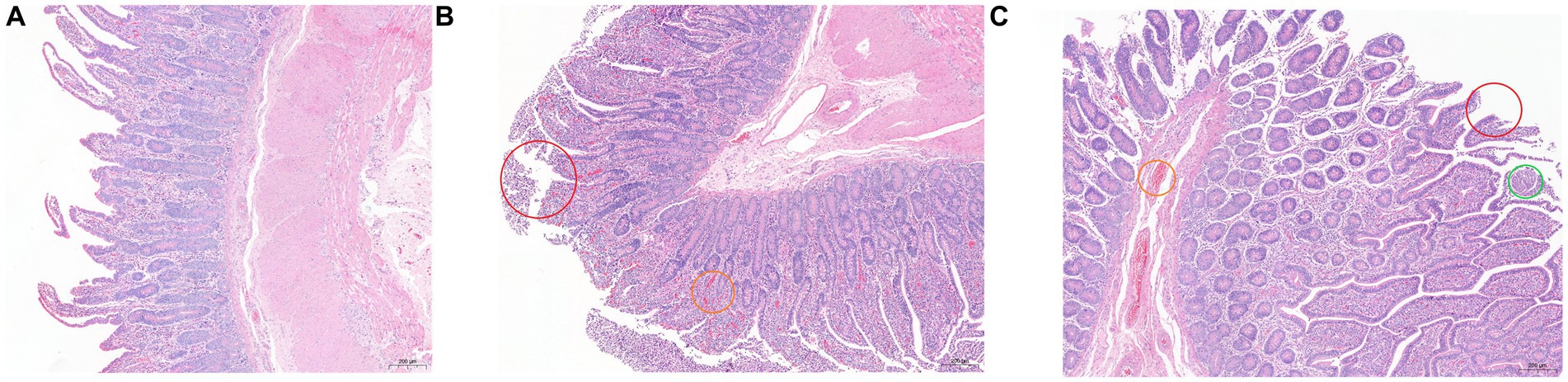 Figura 1. Hematoxilina y eosina (100×) – muestras de tejido ileal teñidas de terneros Holstein alimentados con diferentes dietas. (A) grupo SH; B) Grupo SF; (C) Grupo TMR. Círculo rojo marcado desprendimiento epitelial de la mucosa; el círculo naranja marcaba la congestión; círculo verde marcado como lesiones parasitarias.
Figura 1. Hematoxilina y eosina (100×) – muestras de tejido ileal teñidas de terneros Holstein alimentados con diferentes dietas. (A) grupo SH; B) Grupo SF; (C) Grupo TMR. Círculo rojo marcado desprendimiento epitelial de la mucosa; el círculo naranja marcaba la congestión; círculo verde marcado como lesiones parasitarias.
3.2. Aumento de peso diario y resultados de algunas pruebas de índices fisiológicos
En este experimento, se seleccionaron 9 terneros machos recién nacidos, sanos y sanos sin diferencias significativas en el peso al nacer. El peso al nacer fue de unos 41 kg. Cuando los terneros fueron sacrificados a los 80 días de edad, hubo diferencias significativas de peso entre los tres grupos (p = 0,002). El peso promedio del grupo SH y del grupo SF TMR fue de 100,62 ± 1,94, 100,07 ± 1,92 y 90,77 ± 2,42. Y el aumento de peso diario fue de 0,745 kg / día, 0,740 kg / día y 0,604 kg / día, respectivamente.
En la Figura 2, algunos datos de rutina de sangre. Los resultados mostraron que el número de células blancas de SH fue significativamente menor que el del grupo SF y el grupo TMR, lo que puede deberse a la respuesta inflamatoria más grave en el grupo SF y el grupo TMR. El número de glóbulos rojos en el grupo TMR fue el más alto. El contenido de hemoglobina en el grupo TMR también fue el más alto en los tres grupos. Los resultados de las enzimas digestivas y la inmunidad mostraron que los contenidos de amilasa, tripsina y lisozima en SH fueron los más altos en los tres grupos. El contenido de IgG del grupo SH también fue el más alto en los tres grupos. Estos indicadores muestran que la capacidad digestiva y la capacidad inmune del grupo SH son más altas que los otros dos grupos.
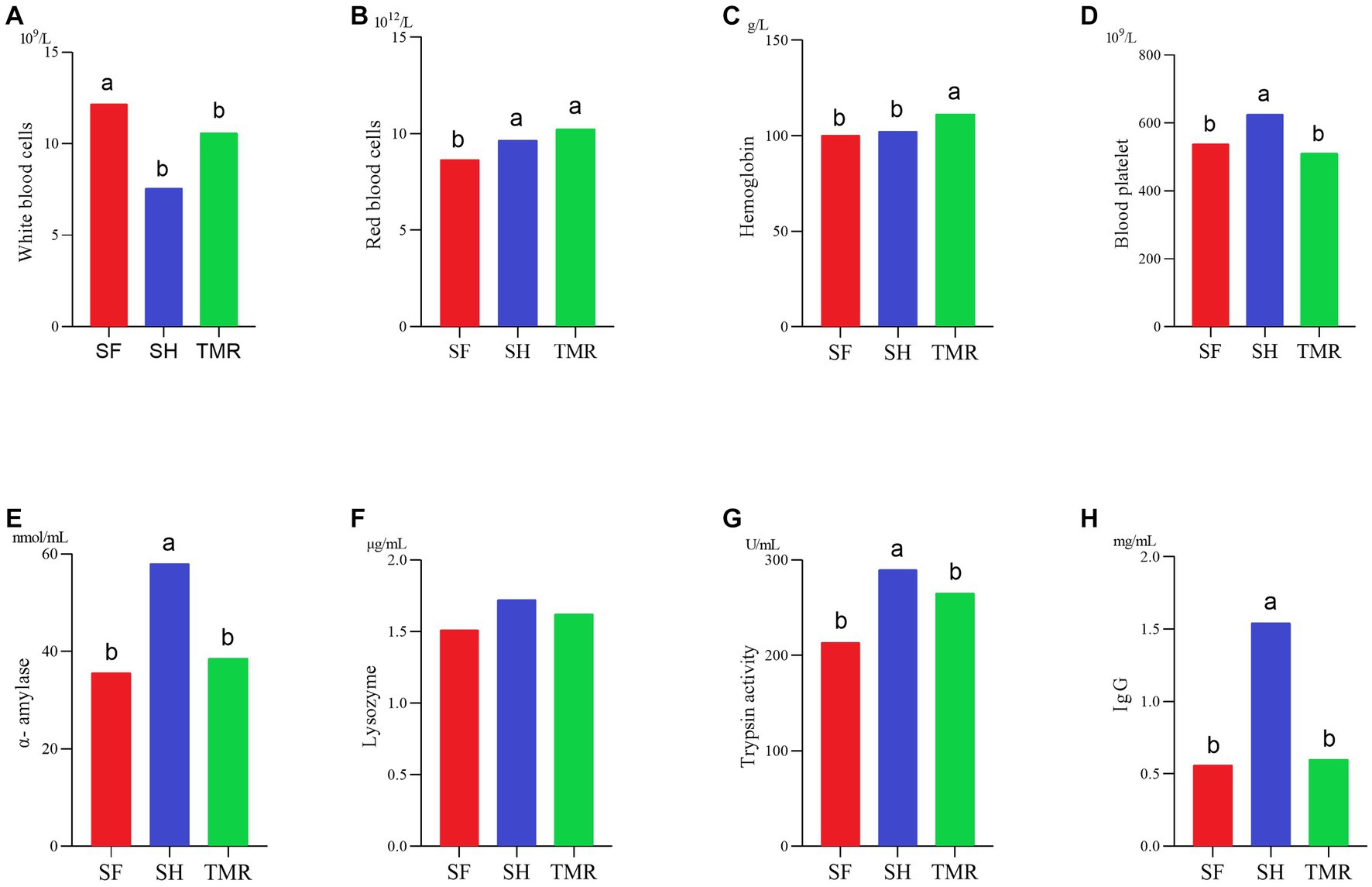 Figura 2. Algunos índices fisiológicos dan resultados a las pruebas. (A-D) Son los resultados de la determinación de la rutina de sangre. (E-H) Son los resultados de enzimas digestivas e inmunoensayos.
Figura 2. Algunos índices fisiológicos dan resultados a las pruebas. (A-D) Son los resultados de la determinación de la rutina de sangre. (E-H) Son los resultados de enzimas digestivas e inmunoensayos.
3.3. Tratamiento de datos metagenómicos microbianos del íleon
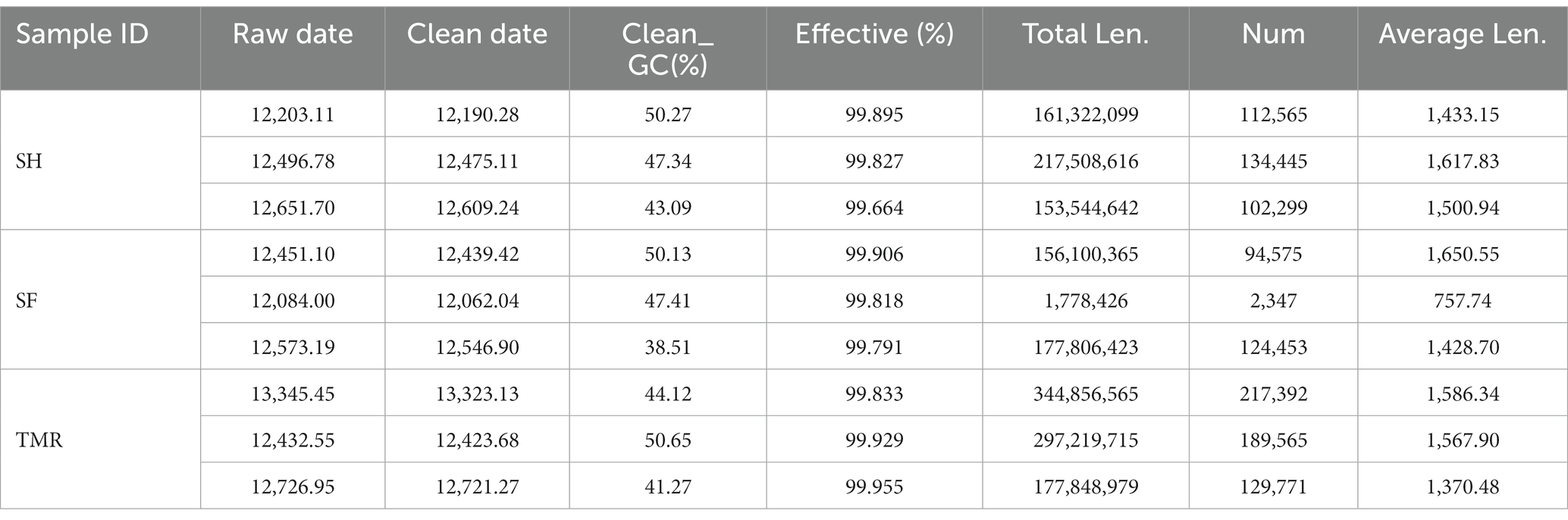
Como se muestra en la Tabla 2, se midieron un total de 112,964.83 datos brutos en 9 muestras, y se obtuvieron 112,791.07 datos limpios después del pretratamiento y filtrado de Illumina, con un contenido promedio de CG de 45.87% y un valor efectivo de más del 99.85%. La longitud promedio de los andamios de 9 muestras fue de 1434.85.
3.4. Análisis de correlación entre grupos y diferencias en la comunidad microbiana
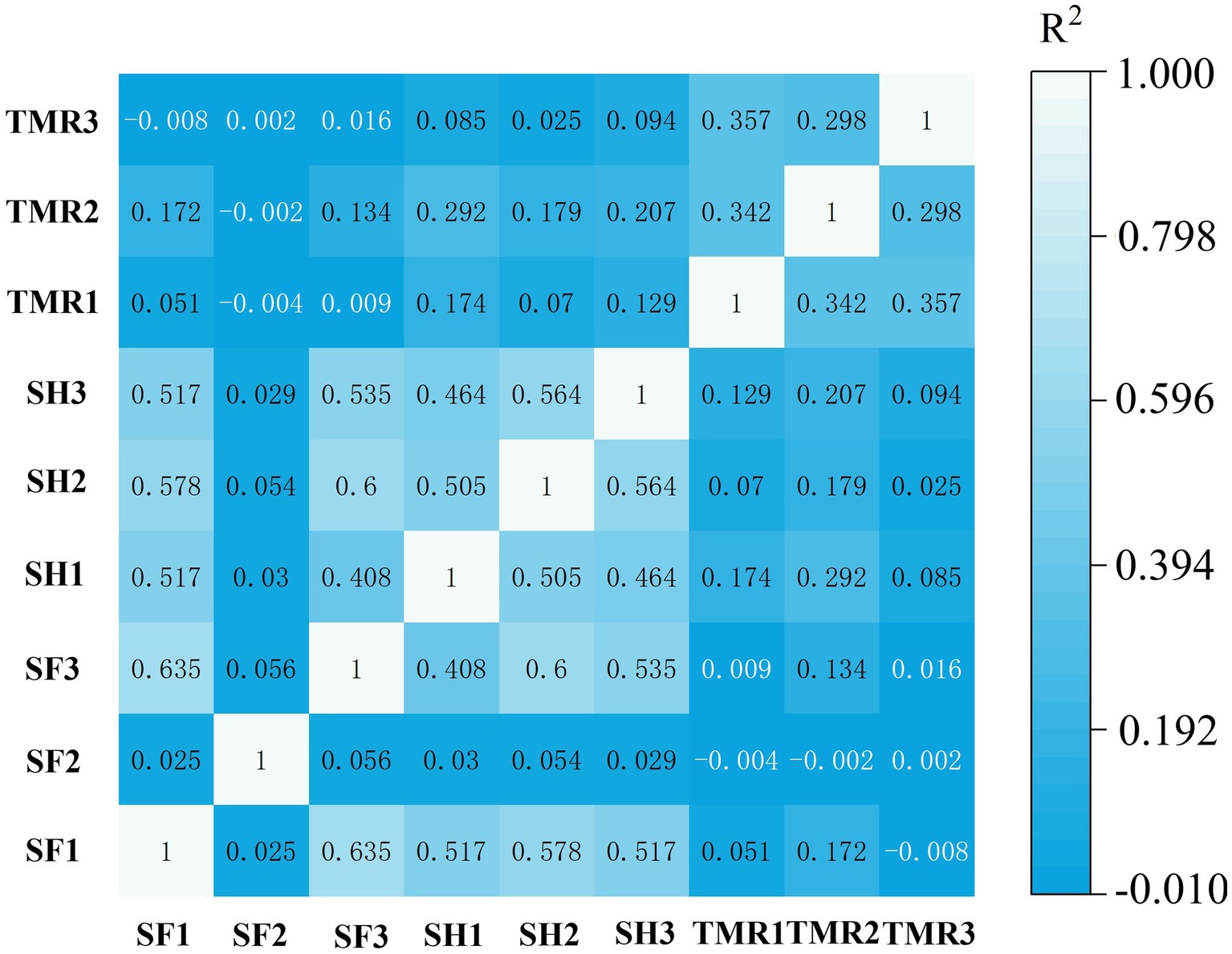
Sobre la base del número de genes, se realizó un análisis de correlación en 8 muestras. Los resultados se muestran en la Figura 3. La correlación entre el grupo SF y el grupo SH fue alta, pero la correlación entre el grupo TMR y el grupo SF y el grupo SH fue baja.
Los genes procesados se compararon con la base de datos para obtener la información de anotación de especies de cada secuencia y se compararon después de la clasificación en cada nivel. Los resultados se muestran en la Figura 4. Las bacterias dominantes en los tres grupos fueron Firmicutes bajo la clasificación de nivel de filo. Las bacterias subdominantes en el grupo SF fueron Proteobacteria y Chlamydiae. La flora subdominante en el grupo SH fue Actinobacteria, más que los otros dos grupos. La flora subdominante en el grupo TMR fue Proteobacteria. Bajo la clasificación a nivel de género, la flora dominante del grupo SF fue Clostridium y Chlamydia; la flora dominante en el grupo SH fue Olsenella, que fue mayor que la del grupo TMR y el grupo SF, y la flora dominante secundaria fue Clostridium. La flora dominante en el grupo TMR fue la flora dominante secundaria de Clostridium Sarcina y más que eso en los grupos SF y SH.
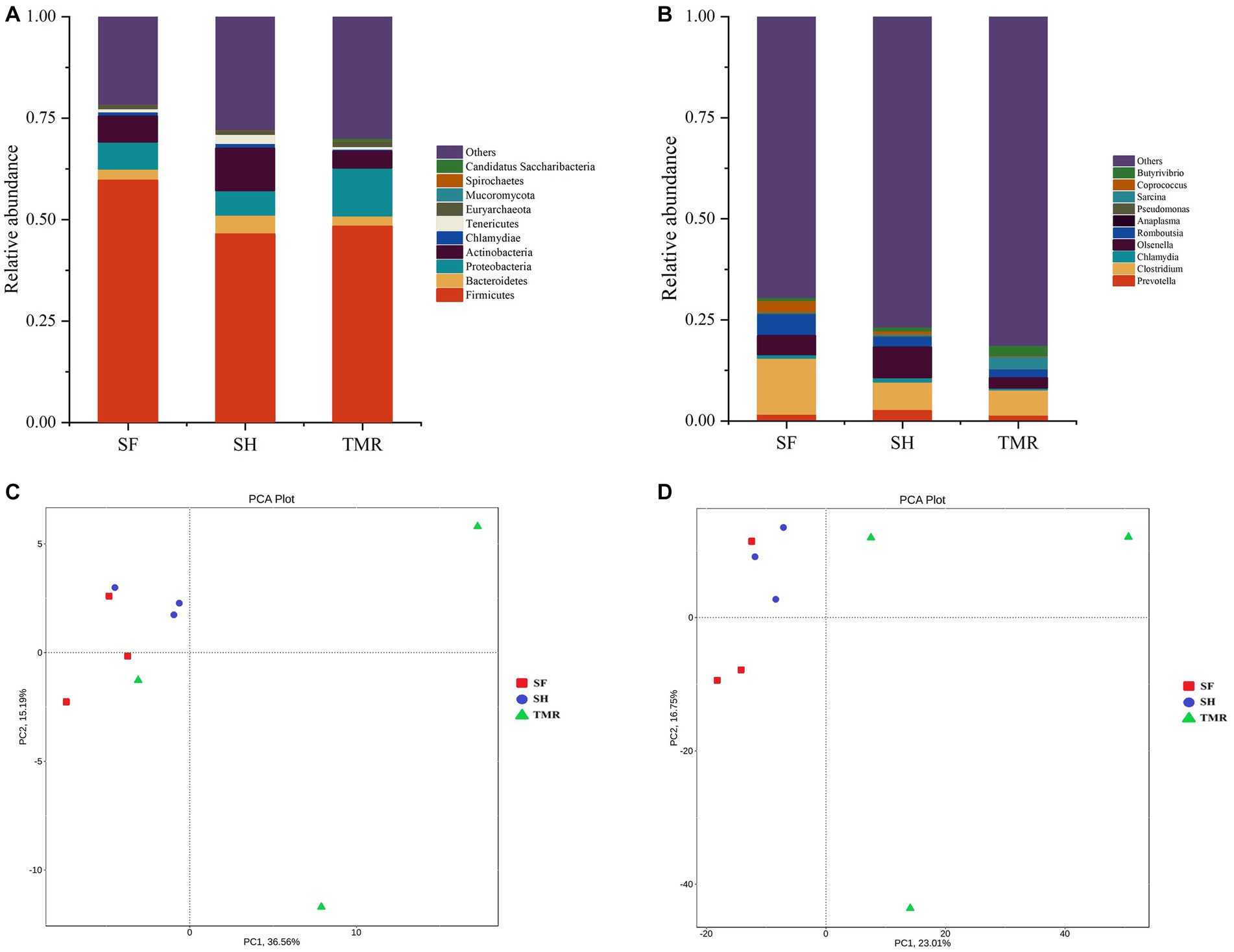 Figura 4. Análisis de las diferencias de la comunidad microbiana entre grupos. (A) Abundancia relativa de especies a nivel de filo TOP10. (B) Abundancia relativa de especies a nivel de género TOP10. (C) Análisis de PCA de especies a nivel de filo. (D) Análisis PCA de especies a nivel de género.
Figura 4. Análisis de las diferencias de la comunidad microbiana entre grupos. (A) Abundancia relativa de especies a nivel de filo TOP10. (B) Abundancia relativa de especies a nivel de género TOP10. (C) Análisis de PCA de especies a nivel de filo. (D) Análisis PCA de especies a nivel de género.
Los resultados del análisis de PCA mostraron que bajo la clasificación de nivel de filo y nivel de género, la diferencia intragrupal del grupo SH fue la más pequeña, la diferencia intragrupal del grupo SF fue ligeramente mayor que la del grupo SH y la diferencia intragrupal del grupo TMR fue la mayor. Hubo diferencias significativas entre los tres grupos, y la diferencia intragrupal de TMR fue mayor que la diferencia intergrupal, lo que indica que después de alimentar la mezcla total, los microbios de íleon de los terneros fueron muy diferentes. Con el fin de cribar especies con diferencias significativas entre los grupos, los resultados del análisis LDA (Figura 5) mostraron que las principales diferencias entre el grupo SH y el grupo TMR fueron p_Firmicutes y o_ Mycoplasmatales en el grupo SH y p_Sarcina en el grupo TMR. La principal flora diferencial entre el grupo SF y el grupo TMR fueron o_Veillonellaceae, g_Prevotella en el grupo SF y p_Sarcina en el grupo TMR.
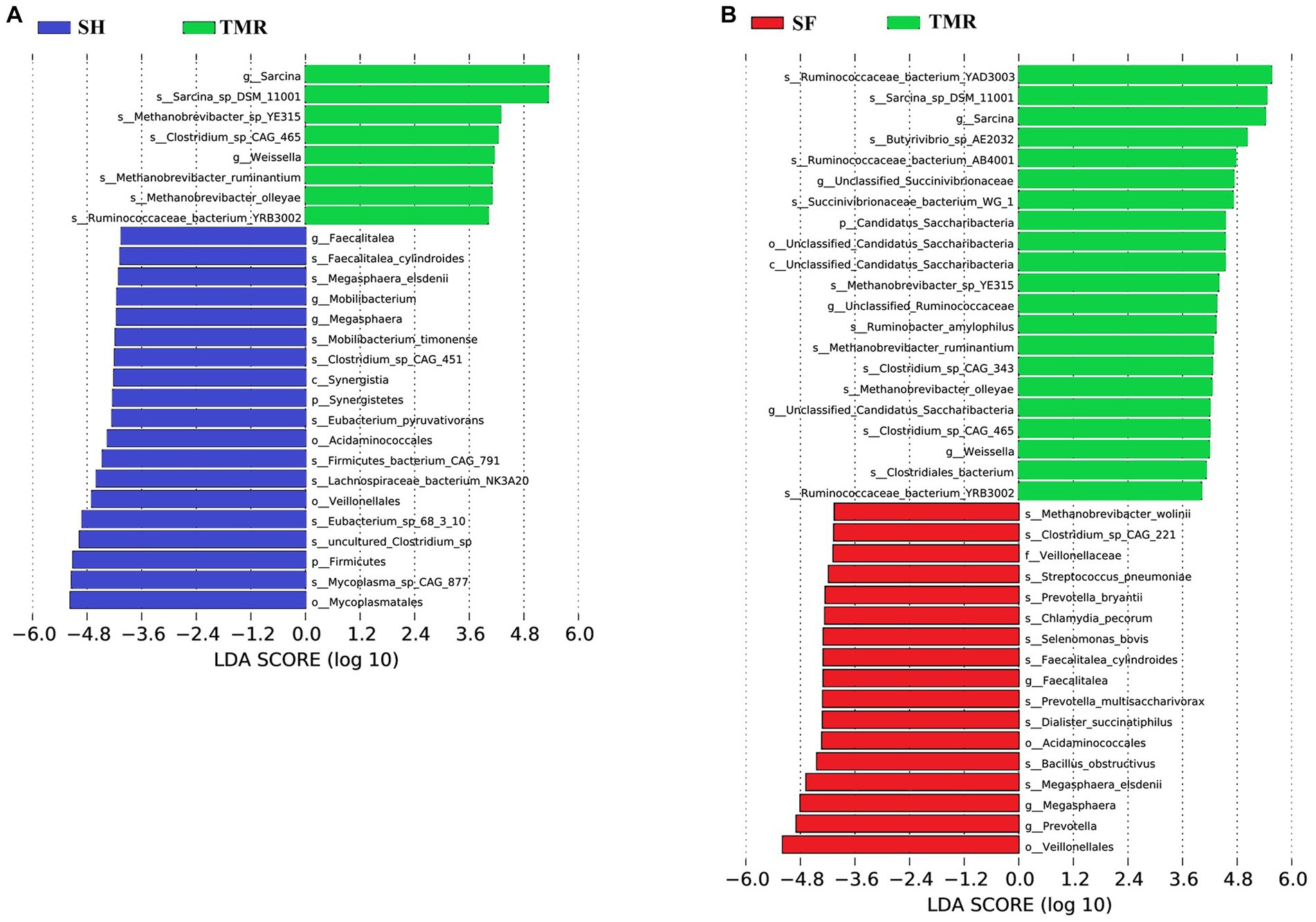 Figura 5. Puntuación LDA de LEfSe-PICRUSt. (A) Diagrama de análisis de puntuación LDA de diferentes especies entre el grupo SH y el grupo TMR. (B) Diagrama de análisis de puntuación LDA de diferentes especies entre el grupo SF y el grupo TMR.
Figura 5. Puntuación LDA de LEfSe-PICRUSt. (A) Diagrama de análisis de puntuación LDA de diferentes especies entre el grupo SH y el grupo TMR. (B) Diagrama de análisis de puntuación LDA de diferentes especies entre el grupo SF y el grupo TMR.
3.5. Análisis funcional de especies diferenciales
Se analizó la abundancia relativa de enriquecimiento de la vía KEGG en los tres grupos (Figura 6). Se encontró que entre las 45 vías bajo la clasificación de segundo nivel, el grupo SH estaba enriquecido principalmente en el metabolismo de los carbohidratos, seguido por el metabolismo de los aminoácidos, la traducción y el transporte de membranas; las vías dominantes en el grupo TMR fueron el metabolismo de los carbohidratos y el metabolismo de los aminoácidos. Vale la pena señalar que el grupo TMR se enriqueció en el crecimiento celular y la muerte y la resistencia a los medicamentos: la vía antimicrobiana es mayor que el grupo SH y el grupo SF. Estos genes se compararon aún más en las vías metabólicas del tercer nivel, y se enriquecieron en 302 vías. Los tres grupos enriquecieron más genes en transportadores ABC (vía ID: ko 02010), ribosoma (vía ID: ko03010), metabolismo de purina (vía ID: ko 00230) y metabolismo de pirimidina (vía ID: ko00240), pero el grupo SF fue más y el grupo TMR fue el menor. Curiosamente, el número de genes enriquecidos en Cell cycle-Caulobacter (vía ID: ko04112), necroptosis (vía ID: ko04217) y otras vías bajo la clasificación de crecimiento celular y vía de muerte fue menor en el grupo SH, y más en el grupo TMR y el grupo SF. La resistencia al péptido antimicrobiano catiónico (CAMP) (vía ID: ko01503) bajo la clasificación Resistencia a medicamentos: Antimicrobiano fue similar.
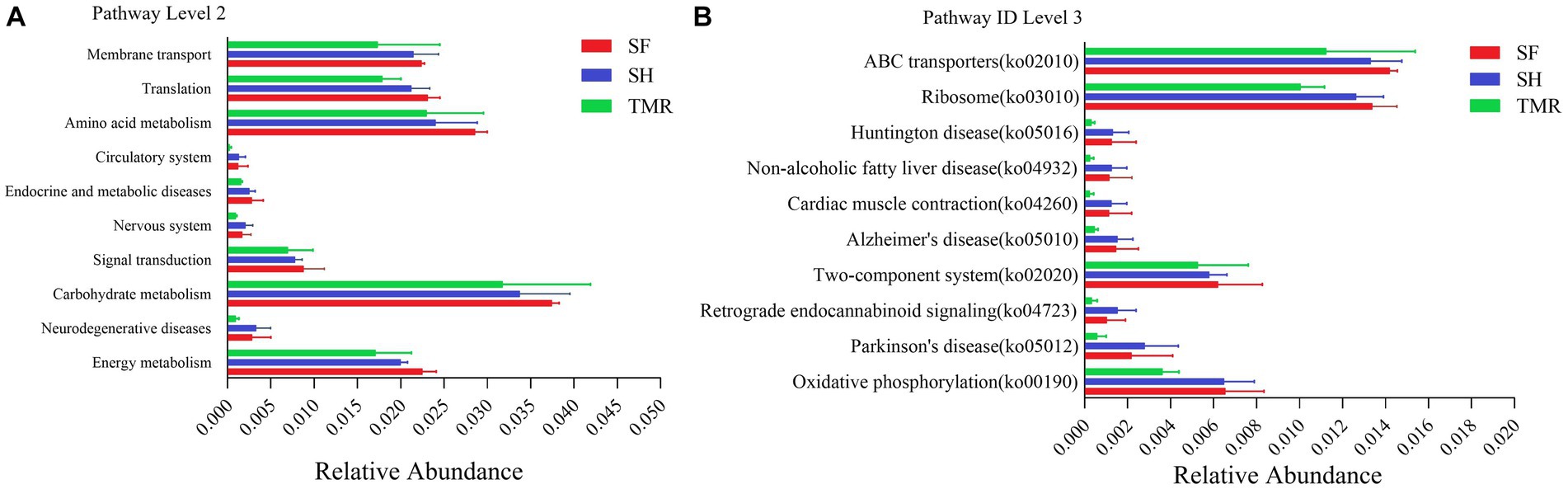 Figura 6. Análisis de enriquecimiento de la vía KEGG. (A) Análisis de enriquecimiento de nivel 2 de KEGG top 10 entre grupos. (B) Análisis de enriquecimiento de nivel 3 de KEGG top 10 entre grupos.
Figura 6. Análisis de enriquecimiento de la vía KEGG. (A) Análisis de enriquecimiento de nivel 2 de KEGG top 10 entre grupos. (B) Análisis de enriquecimiento de nivel 3 de KEGG top 10 entre grupos.
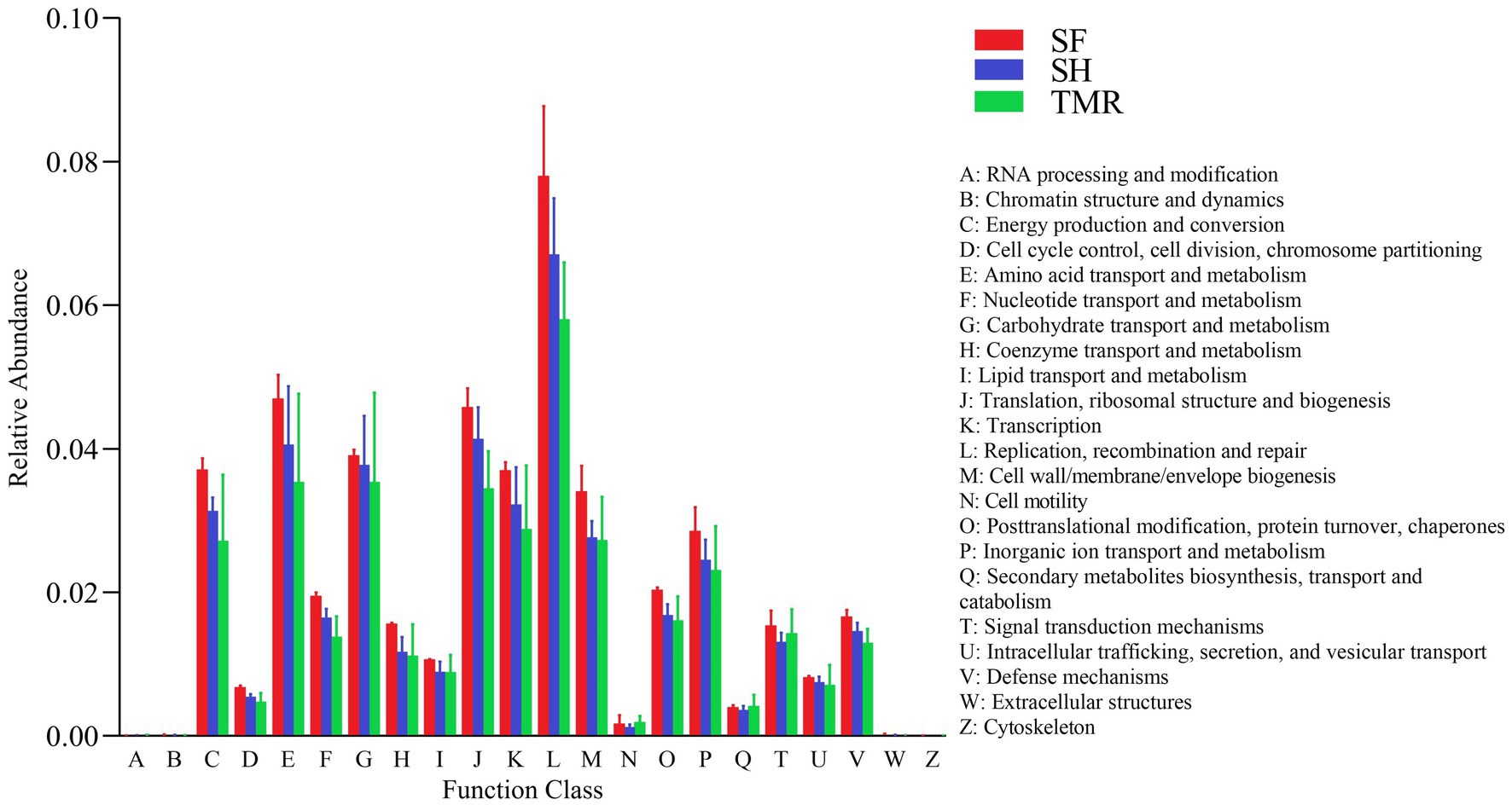
Los resultados del análisis de EggNOG (Figura 7) mostraron que los genes más abundantes se enriquecieron en Replicación, recombinación y reparación, seguidos por Transporte de aminoácidos y metabolismo y Traducción, estructura ribosómica y biogénesis. Después de comparar la abundancia relativa de genes anotados en eggNOG en los tres grupos, se encontró que las principales vías de enriquecimiento de los tres grupos eran similares, con la mayoría en el grupo SF y la menor en el grupo TMR. La abundancia relativa de metabolitos secundarios biosíntesis, transporte y catabolismo, motilidad celular y procesamiento y modificación de ARN en el grupo TMR fue mayor que en los otros dos grupos.
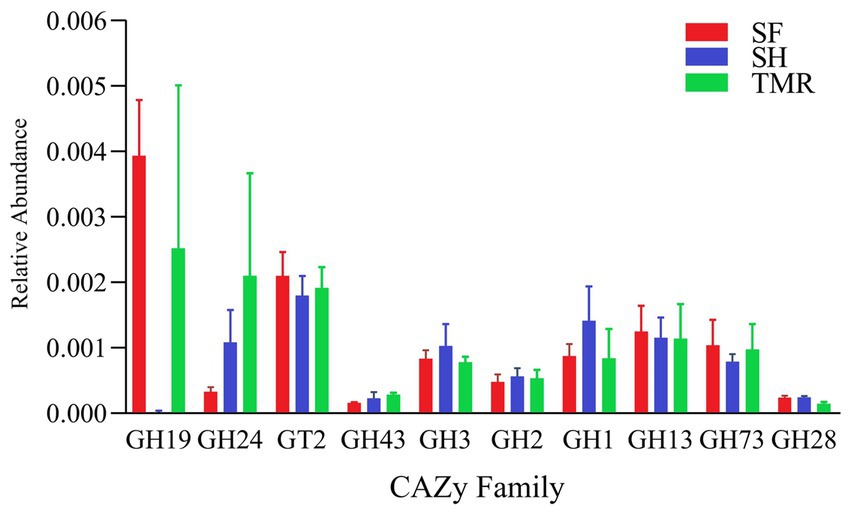
Después de comparar la abundancia relativa de genes CAZy en los tres grupos (Figura 8), se encontró que las glucósidas hidrolasas (GH) fueron las principales, y hubo diferencias en la familia CAZy bajo la clasificación de segundo nivel. La familia CAZy del grupo SH se distribuyó de manera más uniforme, y las familias más enriquecidas fueron la familia GT2 y la familia GH1, entre las cuales la familia GH1, GH3 y GH25 fueron más altas que los otros dos grupos. Las familias GH19, GT2 y GH13 estaban más enriquecidas en el grupo SF que en los otros dos grupos. Hubo más familias GH19, GH24 y GT2 en el grupo TMR, y GH24 fue más que los otros dos grupos. Las familias CAZy que llaman nuestra atención son GH1 y GH19. Las diferencias entre los tres grupos también se reflejan principalmente en estas dos familias. El enriquecimiento de GH1 en el grupo SH fue mayor que en el grupo SF y el grupo TMR, principalmente debido a la β-glucosidasa (EC 3.2.1.21) de la familia GH1 bajo la clasificación de nivel 3. GH19 estaba más enriquecida en el grupo SF y el grupo TMR que en el grupo SH, principalmente quitinasa (EC 3.2.1.14) de la familia GH19 bajo clasificación de nivel 3.
3.6. Análisis de los metabolitos diferenciales séricos
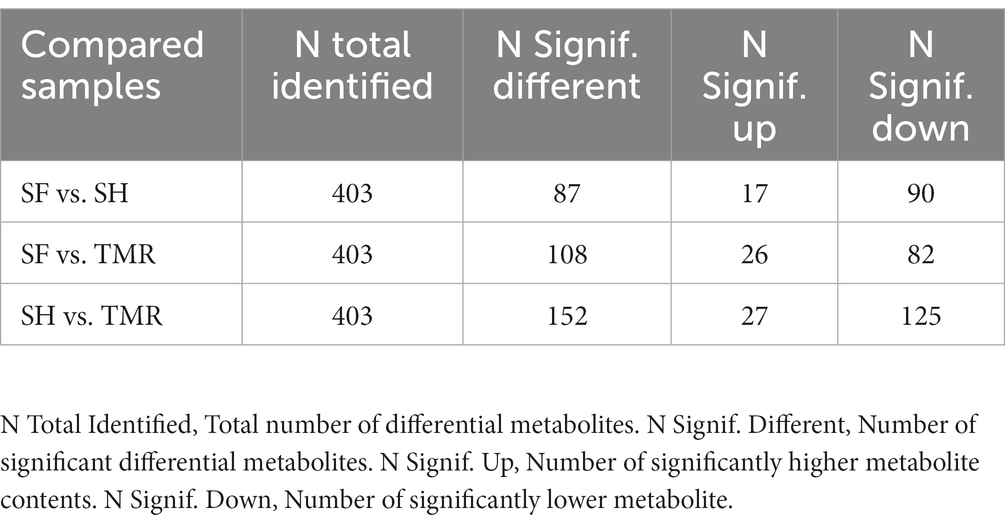
Después de analizar los metabolitos sanguíneos de los tres grupos, se encontraron un total de 403 metabolitos catódicos. El análisis PLS-DA (Figura 9) de estos metabolitos entre grupos mostró que la separación entre grupos era obvia, el grado de polimerización en el grupo era alto y los parámetros del modelo de cada grupo también cumplían con el estándar, lo que indica que los resultados fueron estables y confiables. El análisis y la selección adicionales de los metabolitos diferenciales (Tabla 3) mostraron que había 87 metabolitos diferenciales en el cátodo del grupo SF y el grupo SH, 17 estaban significativamente regulados al alza y 70 estaban significativamente regulados a la baja. Hubo 152 metabolitos diferenciales en el cátodo del grupo SF y el grupo TMR, 27 fueron significativamente regulados al alza y 125 fueron significativamente regulados a la baja. Hubo 108 metabolitos diferenciales en el cátodo del grupo SH y el grupo TMR, 26 fueron significativamente regulados al alza y 82 fueron significativamente regulados a la baja.
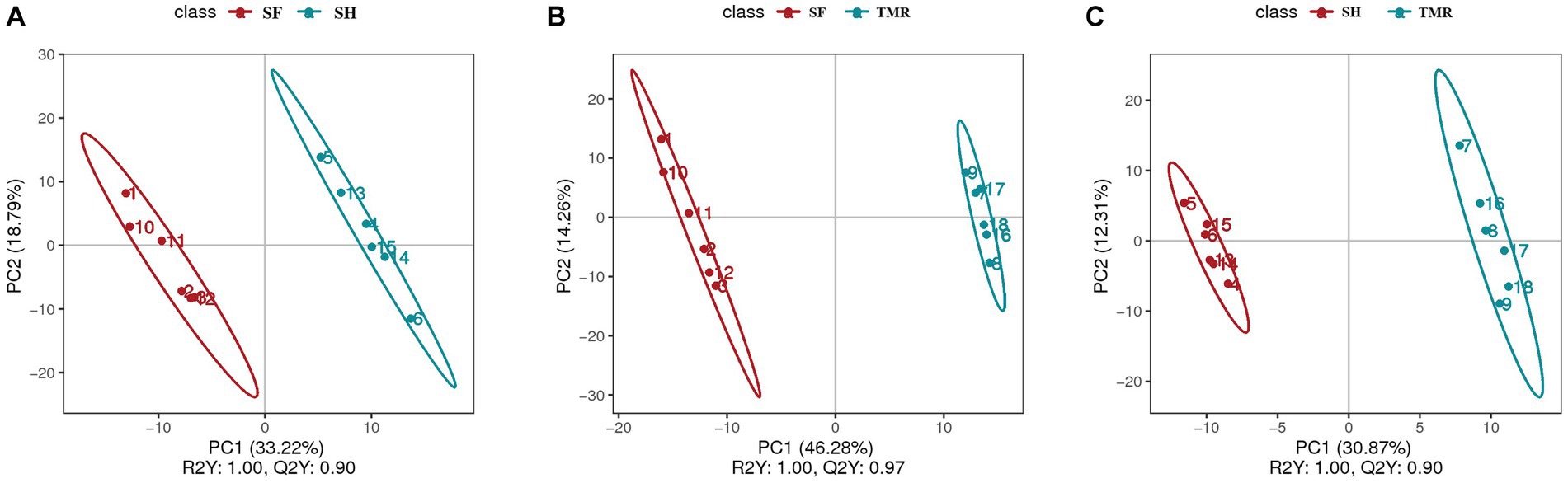 Figura 9. Análisis PLS-DA de metabolitos séricos entre grupos. (A) análisis PLS-DA del grupo SF y del grupo SH; (B) análisis PLS-DA del grupo SF y del grupo TMR; (C) Análisis PLS-DA del grupo SH y del grupo TMR.
Figura 9. Análisis PLS-DA de metabolitos séricos entre grupos. (A) análisis PLS-DA del grupo SF y del grupo SH; (B) análisis PLS-DA del grupo SF y del grupo TMR; (C) Análisis PLS-DA del grupo SH y del grupo TMR.
3.7. Análisis de enriquecimiento KEGG de metabolitos diferenciales
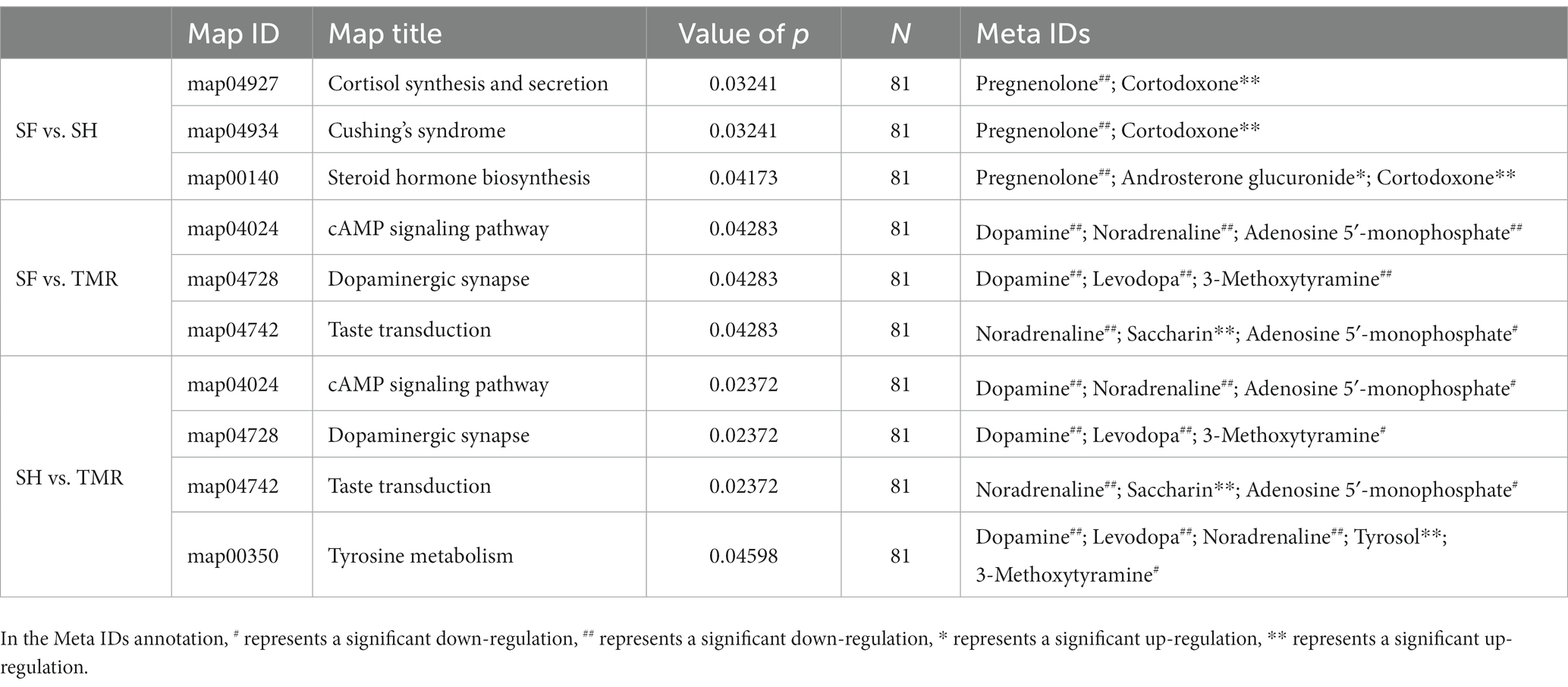
Los metabolitos diferenciales seleccionados se sometieron a un análisis de enriquecimiento de KEGG para determinar los efectos de los metabolitos diferenciales en las vías metabólicas sanguíneas clave. Los resultados mostraron que los metabolitos diferenciales entre el grupo SF y el grupo SH estaban enriquecidos principalmente en la síntesis y secreción de cortisol (valor de p = 0,032). Los metabolitos diferenciales entre el grupo SF y el grupo TMR se enriquecieron principalmente en la vía de señalización de AMPc (valor de p = 0,043), sinapsis dopaminérgica (valor de p = 0,043), transducción del gusto (valor de p = 0,043). Los metabolitos diferenciales entre el grupo SH y el grupo TMR se enriquecieron principalmente en la vía de señalización de AMPc (valor de p = 0,024), sinapsis dopaminérgica (valor de p = 0,024), transducción del gusto (valor de p = 0,024), metabolismo de la tirosina (valor de p = 0,046). La información específica de la vía y los metabolitos diferenciales enriquecidos en la vía se muestran en la Tabla 4.
4. Discusión
El íleon se encuentra en la parte posterior del intestino delgado y es el lugar principal para la digestión y absorción de nutrientes. Por lo tanto, el desarrollo de la función ileal es esencial para la salud y el crecimiento de los terneros. Observamos en las secciones posteriores a la tinción HE que las vellosidades epiteliales intestinales en los grupos SF y SH estaban mejor desarrolladas, la altura de las vellosidades era mayor y las células caliciformes en las vellosidades estaban más reorganizadas. Las células caliciformes pueden secretar moco y formar una barrera física en la superficie de la mucosa intestinal, que es el componente principal de la barrera intestinal (34). Estas características significan que el íleon del grupo SF y el grupo SH tienen un área de absorción y digestión más grande, y la morfología intestinal es más propicia para la absorción de nutrientes y tiene una función de barrera más fuerte, que es la característica del desarrollo saludable del intestino de la pantorrilla, que es propicia para el desarrollo de la capacidad digestiva y la salud gastrointestinal de los terneros (35, 36). La investigación de Ma mostró que el tracto intestinal de los terneros debe sufrir cambios de desarrollo, físicos y fisiológicos, antes de que puedan adaptarse mejor a la transición de la leche al alimento sólido (37). Los estudios han demostrado que el desarrollo saludable del ambiente epitelial intestinal es propicio para el desarrollo de probióticos intestinales y la estabilidad de las comunidades microbianas (38). Observamos una respuesta inflamatoria más obvia en el grupo de TMR, y la pared intestinal en el grupo de SH estaba relativamente completa. Tras un análisis posterior, creemos que puede deberse a la capacidad digestiva de los terneros y a la madurez, que no pueden adaptarse a la respuesta inflamatoria provocada por la alimentación TMR. El fenómeno del parásito puede ser causado por la invasión de patógenos. Si está relacionado con el total de alimentos mixtos necesita más estudio.
El análisis metagenómico comparó las diferencias de la comunidad microbiana entre los tres grupos. Los resultados mostraron que el grupo SH estaba enriquecido en Actinobacteria y más que los otros dos grupos. En estudios previos, a excepción de un pequeño número de bacterias patógenas, Actinobacteria suele ser un probiótico que conduce a la digestión y absorción de materia orgánica. En algunas granjas, los probióticos se utilizan para estimular selectivamente el crecimiento de Actinobacteria (39). Además, las actinobacterias también pueden producir metabolitos secundarios como fármacos naturales, enzimas y factores activos, y se consideran un probiótico potencial (40). Bifidobacterium bajo la clasificación de Actinobacteria juega un papel importante en la regulación del sistema inmunológico y la prevención de enfermedades intestinales. Puede reducir la respuesta inflamatoria mediante la producción de ácidos grasos de cadena corta y la regulación de los factores inflamatorios. La proliferación de Actinobacteria puede ser la clave para regular la inmunidad y reducir la respuesta inflamatoria en el grupo DAI. Algunos estudios han demostrado que Actinobacteria también desempeña un papel en la reducción de patógenos como Escherichia-Shigella, lo que indica que también puede tener un efecto positivo en la prevención de la diarrea (41). Olsenella tiene ventajas obvias en el enriquecimiento de SH. Olsenella pertenece a los probióticos bajo la clasificación de bacterias del ácido láctico. Los estudios han demostrado que Olsenella se correlaciona positivamente con el butirato. El butirato es uno de los principales ácidos grasos volátiles producidos por la fermentación ruminal, y el íleon es también la parte principal de la absorción de butirato. El butirato puede proporcionar energía para Olsenella y puede fortalecer la función de barrera intestinal, que es propicia para la salud intestinal (42). El estudio de Zhang también mostró que los individuos con mayor abundancia relativa de Olsenella tienen una mayor capacidad para producir ácidos grasos de cadena corta, que pueden afectar eficazmente la estructura de la capa de moco epitelial intestinal, estimular el desarrollo del tejido epitelial intestinal, nutrir el desarrollo de células epiteliales intestinales como las células caliciformes y reducir el riesgo de enfermedad inflamatoria intestinal en individuos (43).
Las bacterias dominantes en el grupo SF fueron Chlamydiae y Proteobacteria. Chlamydiae es un patógeno que puede causar enteritis (44, 45), pero no se encontraron síntomas de diarrea en este individuo, y puede haber un caso de infección invisible de Chlamydiae (46). Al mismo tiempo, no se encontraron otros patógenos con alta correlación con Chlamydiae, como Campylobacter. Las clamidias, como patógeno potencial, pueden estar relacionadas con la inflamación local observada en el grupo SF, que puede conducir a una absorción intestinal deficiente e inducir otras enfermedades (47). Se necesita un tratamiento oportuno. El estudio de Xia en lechones destetados mostró que la adición de aceites esenciales vegetales que contienen sustancias como la tributirina al alimento puede resistir la clamidia, regular la morfología microbiana y mejorar la morfología de las vellosidades intestinales (48).
Las proteobacterias tanto en el grupo TMR como en el grupo SF tienen una gran abundancia. Estudios previos han demostrado que muchas bacterias patógenas intestinales pertenecen a Proteobacteria, y la abundancia relativa de Proteobacteria es demasiado alta, lo que puede causar inflamación y causar diarrea en la pantorrilla (49, 50). Shin utilizó el enriquecimiento de Proteobacteria como uno de los marcadores importantes del desequilibrio de la microflora intestinal en individuos sanos. En general, las proteobacterias no se enriquecerán significativamente en individuos sanos (51). El estudio de Han en lechones destetados mostró que las proteobacterias podrían activar citoquinas relacionadas con la inflamación y causar daño a la inflamación intestinal. Al mismo tiempo, el aumento de peso diario de los lechones con enriquecimiento de Proteobacteria se redujo significativamente, lo que indicó que la función de absorción de la nutrición intestinal también se vio afectada (52). El estudio de Varada en búfalos recién nacidos encontró que la alimentación de probióticos puede regular la composición de las comunidades microbianas intestinales al reducir la abundancia de Proteobacteria (53). Numerosos estudios han demostrado que el enriquecimiento de Proteobacteria puede conducir a una respuesta inflamatoria y causar disfunción de las células epiteliales intestinales (54, 55). Esta puede ser una de las razones por las que el grupo TMR tuvo una gran cantidad de infiltración de células inflamatorias, desprendimiento de células epiteliales intestinales e incluso síntomas de diarrea. La sarcina enriquecida en TMR es un patógeno que se ha reportado muchas veces. Katharine descubrió que Sarcina estaba asociada con úlcera gástrica e infección por hongos en terneros y cabras, lo que puede ser la causa de gastritis y enteritis (56). El estudio de Simpson también encontró que Sarcina puede causar necrosis de la superficie epitelial intestinal y puede estar relacionada con una infección parasitaria (57). Muchos estudios han señalado que la sarcina se asocia con diarrea, inflamación y otros síntomas. Sarcina está significativamente enriquecida en el tracto intestinal de caballos parasitados por ascaris, y Sarcina se encuentra a menudo en cabras, conejos y otros animales con síntomas de diarrea o infección por hongos (58, 59). El estudio de Zhuo en lechones señaló directamente que el enriquecimiento de Sarcina no es propicio para el desarrollo saludable del tracto intestinal, afecta el rendimiento de producción y la tasa de absorción de alimento, y aumenta la probabilidad de infección por patógenos intestinales. También señalaron que la Sarcina tiene una gran relación con la reducción de microorganismos que producen ácidos grasos de cadena corta y patrones de alimentación (60). Esto es similar a nuestros hallazgos. Por lo tanto, creemos que la respuesta inflamatoria, la infección parasitaria y los síntomas de diarrea en el grupo TMR están estrechamente relacionados con Sarcina.
Después de comparar el enriquecimiento de la vía de señalización KEGG, encontramos que en las vías de señalización Cell cycle-Caulobacter (vía ID: ko04112) y Necroptosis (vía ID: ko04217), el grupo SH fue menor, el grupo SF y el grupo TMR fueron más. El ciclo celular-Caulobacter es una vía clave que puede regular la replicación del ADN, el ciclo celular y la topología celular. El regulador de respuesta del ciclo celular es el núcleo de su red. El ciclo celular-Caulobacter regula la división asimétrica de las células bacterianas, lo que resulta en células acechadas y células más enjambres con diferentes destinos (61). El tipo de célula de progenie acechada entrará en la fase S, mientras que el tipo de enjambre permanecerá en la fase G1 (62). Comparamos los metabolitos anotados en los tres grupos, y encontramos que los metabolitos únicos en el grupo SF y el grupo TMR finalmente apuntaron a morfogénesis polar y biogénesis pili, mientras que los metabolitos únicos en el grupo SH apuntaron a biogénesis de eyección flagelar, formación de tallos, es decir, las células en el grupo SF, grupo TMR y grupo SH fueron a diferentes divisiones, y diferentes células hijas tenían diferentes estructuras de membrana celular y morfología celular. Esto conduce a diferencias en las funciones posteriores (63, 64). Los estudios han demostrado que los fagos con estructuras pili y flagelos son más susceptibles al huésped a través de la regulación CtrA (65). Esta regulación de la red molecular tiene una relación directa con la infección bacteriana. El estudio de McAdams señaló que la función dentro de la red Cell cycle-Caulobacter se conserva, pero después de la división asimétrica, debido a las diferencias en la función celular y la proteína, las especies de acoplamiento específicas aguas abajo serán muy diferentes (66). Por lo tanto, especulamos audazmente que la vía del ciclo celular-Caulobacter en el grupo SH no es tan activa como los otros dos grupos, y los resultados finales de la división celular son diferentes, lo que puede ser una de las razones importantes de las diferencias en la infección bacteriana y la respuesta inflamatoria entre el grupo SH y el grupo TMR y el grupo SF. La diferencia en la necroptosis es más clara. SH no tiene metabolitos únicos, mientras que los metabolitos únicos del grupo SH y el grupo TMR son los mismos, que son H2AX, VDAC, Drp1, ESCRT-III. Estos metabolitos apuntan directa o indirectamente a una respuesta inflamatoria, daño mitocondrial, etc., y su actividad puede conducir a daño celular y, en última instancia, necroptosis (67). El estudio de Yi encontró que los patógenos plasmáticos como Staphylococcus aureus pueden conducir a la necroptosis celular al afectar el potencial de la membrana mitocondrial y la permeabilidad de la membrana. Esta necroptosis está regulada por la proteína quinasa II dependiente de calmodulina (CaMKII) y la quinasa de linaje mixto similar a un dominio (MLKL) (68). Los metabolitos únicos que encontramos en el grupo TMR y el grupo SF estuvieron involucrados en el proceso de reacción anterior. El estudio de Huang también señaló que la activación de MLKL y CaMKII puede conducir a la disfunción mitocondrial y la respuesta proinflamatoria (69). También encontramos que los metabolitos únicos del grupo TMR y el grupo SF se concentraron en la citocromo c oxidasa \ reductasa después de comparar la fosforilación oxidativa (vía ID: ko00190) de los tres grupos. Creemos que esto puede deberse a una infección bacteriana que activa vías como MLKL, que conduce a la necroptosis causada por la disfunción mitocondrial y promueve la respuesta inflamatoria, y finalmente conduce a daños en la estructura epitelial intestinal (70). Además, la flora intestinal también puede interactuar con intermediarios metabólicos en la fosforilación oxidativa. Los estudios existentes han encontrado que NAD (nicotinamida adenina dinucleótido) puede promover la secreción de mucina intestinal 2 (MUC2), mejorar la capacidad de la infección antibacteriana y aliviar la inflamación intestinal al inhibir NF-kB. Es probable que las anomalías de la fosforilación oxidativa y el daño mitocondrial afecten los niveles de metabolitos como el NAD, aumentando el riesgo de inflamación intestinal e infección bacteriana (71).
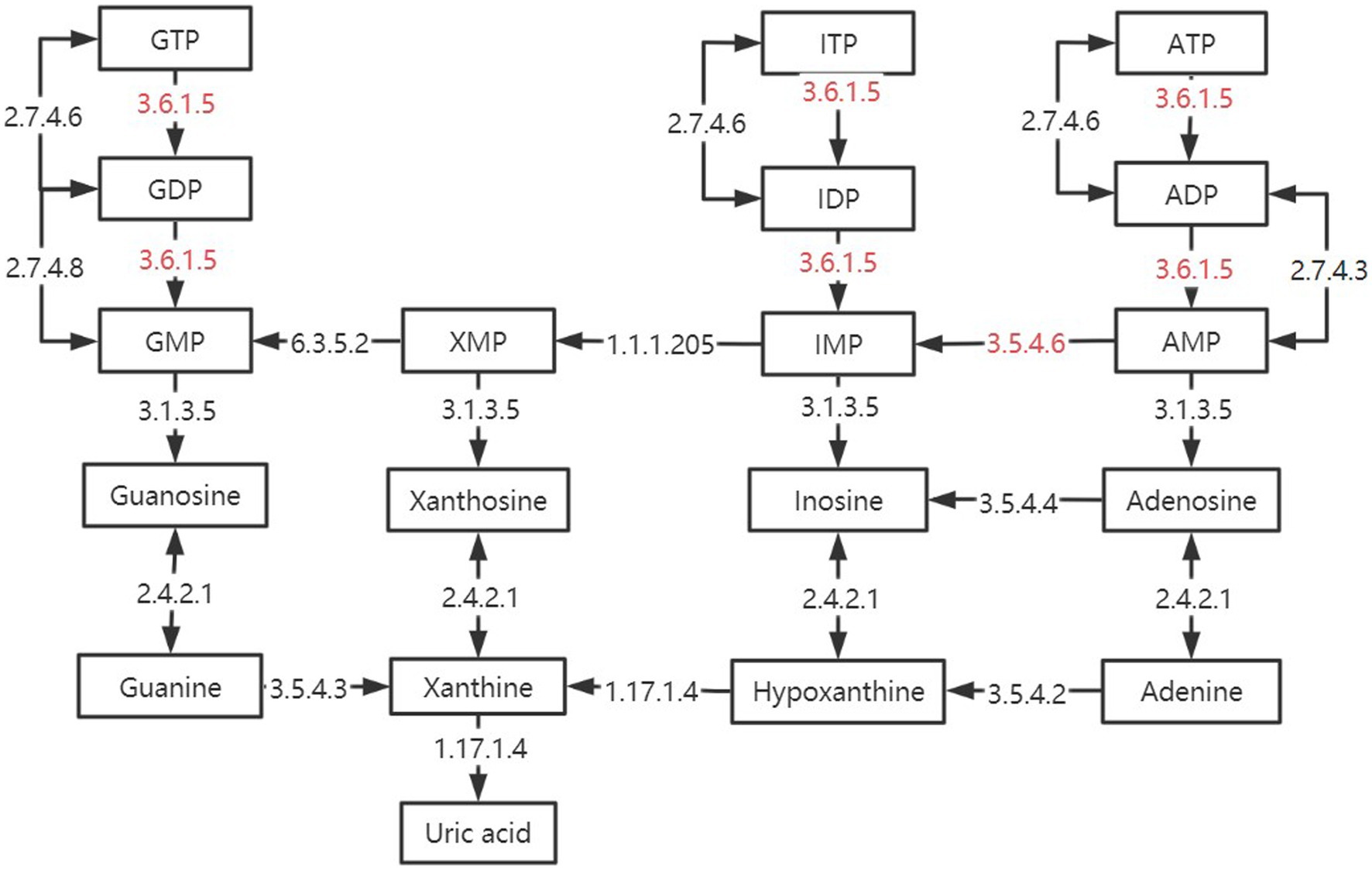 Figure 10. Differences in purine metabolic pathways between groups. The black box is marked as the intermediate product in the purine metabolic pathway. The black arrow is marked with enzymes annotated in the kegg enzyme database. The red-labeled enzyme is unique in SF and TMR.
Figure 10. Differences in purine metabolic pathways between groups. The black box is marked as the intermediate product in the purine metabolic pathway. The black arrow is marked with enzymes annotated in the kegg enzyme database. The red-labeled enzyme is unique in SF and TMR.
Comparando los resultados del análisis de los tres grupos de bases de datos CAZy. Las diferencias se reflejan principalmente en la familia GH1 y la familia GH19. Bajo la clasificación de nivel 3, el enriquecimiento de β-glucosidasa (EC 3.2.1.21) perteneciente a la familia GH1 en el grupo SH fue mayor que en los otros dos grupos. β-glucosidasa desempeña principalmente un papel en el metabolismo de los glicolípidos y es una enzima clave que cataliza la celulosa para producir glucosa. Creemos que la mayor actividad de β-glucosidasa en el grupo SH está estrechamente relacionada con su comunidad microbiana. Los estudios han demostrado que agregar β-glucosidasa para alimentar o activar la β-glucosidasa a través de la dieta puede mejorar la capacidad digestiva del tracto gastrointestinal y beneficiar el crecimiento animal (79). β-glucosidasa también puede aumentar la actividad de la amilasa intestinal (80). Esto también es consistente con nuestro hallazgo, el contenido de amilasa del grupo SH fue el más alto. El estudio de Zhang encontró que la castración cambió el entorno de digestión cecal de las vacas lecheras, redujo significativamente la actividad de la β-glucosidasa, redujo la abundancia relativa de Ruminococcaceae y otras bacterias relacionadas con la β-glucosidasa y redujo la ganancia diaria de vacas lecheras (81). Por lo tanto, el enriquecimiento de β-glucosidasa tiene un efecto positivo en los terneros. La quitinasa (EC 3.2.1.14) en la familia GH19 mostró diferencias más obvias. El enriquecimiento de quitinasa en el grupo SH fue mucho menor que en el grupo SF y el grupo TMR. La quitinasa tiene una fuerte especificidad y puede romper los enlaces glucosídicos de quitina. La quitina es un componente de invertebrados, artrópodos, hongos, etc., pero los mamíferos difícilmente pueden sintetizar quitina por sí mismos. Por lo tanto, se debe prestar atención cuando la quitinasa excesiva se enriquece en mamíferos, y puede ser que los alimentos que contienen quitina o patógenos microbianos invadan el cuerpo (82). Estudios recientes han demostrado que la proteína quitina está relacionada con enfermedades gastrointestinales. La quitinasa puede desempeñar un papel importante en la digestión gastrointestinal y las enfermedades debido a su especificidad, y es probable que se convierta en una nueva idea para el tratamiento de enfermedades gastrointestinales (83, 84). El estudio de Beier encontró que los microorganismos también pueden producir quitinasa, incluyendo Firmicutes, Actinobacteria, etc. La quitinasa puede hidrolizar específicamente la quitina y hacer que pierda patogenicidad, lo cual es particularmente crítico para los mamíferos (85). Observamos reacciones inflamatorias locales tanto en el grupo SF como en el grupo TMR. Los parásitos también aparecieron en el grupo TMR. Lo más probable es que patógenos extraños produzcan quitina, que estimula algunas de las bacterias en el intestino que pueden liberar quitinasa para responder, causando diferencias en la flora intestinal.
Además de esto, hay un fenómeno más crítico, encontramos que en el grupo TMR, un enriquecimiento único de muchos neurotransmisores y sus precursores: dopamina, noradrenalina, levodopa, etc., que puede apuntar a un nuevo campo de investigación: la neuromicrobiología. En los últimos años, cada vez más estudios han demostrado que los microorganismos no solo tienen las funciones de ayudar a la digestión y mantener las barreras, sino que también participan en la regulación del sistema nervioso entérico y el sistema nervioso central mediante la producción de neurotransmisores o precursores de neurotransmisores (86). Se informa que los microorganismos intestinales pueden sintetizar neurotransmisores como la dopamina, la norepinefrina, la 5-hidroxitriptamina y compuestos involucrados en el metabolismo de los neurotransmisores en el cuerpo, que pueden actuar sobre el sistema nervioso intestinal local y regular el ambiente intestinal (87, 88). Tomando como ejemplo el mecanismo de síntesis de la dopamina (fenilalanina-tirosina-L-dopa-dopamina), la fenilalanina hidroxilasa convierte la L-fenilalanina en L-tirosina, que puede cruzar la barrera hematoencefálica y entrar en el cerebro. En el cerebro, se convierte en (s)-3,4-dihidroxifenilalanina (L-DOPA) por la tirosina hidroxilasa, y luego la L-DOPA se convierte en dopamina por la dopa descarboxilasa (89, 90). Aunque la vía por la cual estos neurotransmisores son sintetizados por el microbioma intestinal no está clara, es probable que el microbioma intestinal también tenga la capacidad de convertir la dopamina local en norepinefrina, como la dopamina-beta oxidasa (91). Los microorganismos intestinales también pueden sintetizar precursores de neurotransmisores como la L-tirosina. Debido a la falta de transportadores relevantes, algunos neurotransmisores que circulan en la sangre, como la dopamina y la norepinefrina, no pueden cruzar la barrera hematoencefálica. Sin embargo, los precursores de estos neurotransmisores pueden cruzar la barrera hematoencefálica, sintetizar sustancias relacionadas en el cerebro y luego regular, que puede ser la forma en que los microorganismos conectan el sistema nervioso central.
La flora intestinal se comunica con el sistema nervioso central, el nervio simpático y el nervio vago a través de neurotransmisores, regula el nivel de neurotransmisores como la auxina y afecta el crecimiento y desarrollo, la digestión gastrointestinal y la función inmune de los animales (92). Por ejemplo, pequeños cambios en el nervio vago conducirán a cambios dramáticos en la liberación de neurotransmisores aguas abajo, que afectarán el nivel digestivo, la permeabilidad intestinal, la motilidad intestinal y la respuesta inmune (93, 94). El sistema nervioso central recibe señales de estos neurotransmisores y regula el ambiente digestivo y la composición de la comunidad microbiana en el tracto gastrointestinal mediante la producción de neuroquímicos como la 5-hidroxitriptamina, la colecistoquinina y la dopamina. Los microorganismos también estimulan las células endocrinas intestinales para producir hormonas y completar la retroalimentación al sistema nervioso central a través de fibras aferentes neurales. Por ejemplo, en presencia de dopamina y norepinefrina, Escherichia coli proliferará más rápido y también puede aumentar su motilidad y toxicidad (95). El estudio de Liu encontró que la síntesis anormal de caseína agravó la enteritis, alteró la flora microbiana y su función metabólica, y condujo a una respuesta inmune anormal (96). El compuesto intermedio de los neurotransmisores: los ácidos grasos de cadena corta, también participan en la regulación de microorganismos y neurotransmisores. Los estudios han demostrado que los ácidos grasos de cadena corta pueden regular el metabolismo de muchos neurotransmisores al actuar sobre las proteínas de unión al elemento de respuesta en la vía de señalización de cAMP (97, 98). Tomando la dopamina como ejemplo, los ácidos grasos de cadena corta pueden regular la producción de dopamina y la conversión de dopamina y norepinefrina al regular la expresión de tirosina carboxilasa y dopamina-β-carboxilasa (99). Estas vías metabólicas se reflejan en las vías metabólicas diferenciales en el grupo TMR. Especialmente para los mamíferos rumiantes como los terneros, los ácidos grasos de cadena corta en el cuerpo serán más abundantes y el mecanismo de regulación de los ácidos grasos de cadena corta será más complicado. En algunos experimentos con modelos animales, también se ha encontrado que las anomalías metabólicas causadas por trastornos de la comunidad microbiana intestinal y la liberación de sustancias monoaminas pueden conducir a la depresión (100). Esto demuestra la profunda relación entre los cambios microbianos intestinales y los trastornos mentales del huésped. En la cría de animales, si afectará la ingesta de alimento animal y el ciclo del estro necesita más estudio.
En los últimos años, muchos estudios han demostrado que los microorganismos intestinales pueden comunicarse y regular con el tracto gastrointestinal y el cerebro a través de neurotransmisores, e interactuar para mantener el equilibrio dinámico del entorno intestinal. Una de las dificultades en el campo de la neurobiología es identificar si la fuente de varios compuestos neuroactivos es huésped o microorganismo. En segundo lugar, la influencia entre los microorganismos intestinales y los neurotransmisores, y la compleja comunicación entre los microorganismos intestinales y el cerebro son difíciles. La combinación de los resultados del análisis de la metabolómica y la metagenómica nos ayudará a comprender la relación de operación entre el eje microbiano-intestinal-cerebral desde la perspectiva de la neuromicrobiología. En el futuro, se pueden realizar intervenciones microbianas específicas dirigidas en el huésped desde la perspectiva de la neuromicrobiología, que se pueden utilizar para ajustar la flora intestinal y mejorar la digestión. Incluso es posible regular comunidades microbianas específicas mediante la comprensión de la relación entre los microbios intestinales y la salud del cerebro, y tratar enfermedades neurológicas a través de la regulación microbiana del sistema nervioso central.
5. Conclusión
En resumen, nuestro estudio encontró que el modo de alimentación de ‘iniciador + heno + leche’ era más propicio para el desarrollo de los terneros. Los terneros en el grupo SH tenían un mejor desarrollo intestinal, la comunidad microbiana intestinal era más propicia para la digestión y la absorción, y la inmunidad era más fuerte. El modo de alimentación del grupo SH fue propicio para el desarrollo saludable de los terneros. Por lo tanto, los terneros en el grupo SH tuvieron un mayor aumento de peso diario, una capacidad digestiva más fuerte y no se encontró una reacción inflamatoria patológica. Para los terneros, el aumento de peso diario es importante y, lo que es más importante, puede haber un sistema digestivo y un sistema inmunológico más fuertes para garantizar que los terneros puedan tener un mejor crecimiento y desarrollo después del destete, que es la ventaja del grupo SH en comparación con el grupo SF. El enriquecimiento de neurotransmisores encontrado en el grupo TMR también nos inspiró a estudiar los microorganismos intestinales desde una nueva perspectiva. Las ideas de investigación de la neuromicrobiología serán uno de nuestros enfoques futuros. Por lo tanto, los resultados de este estudio proporcionan una base para mejorar el modo de alimentación de los terneros, y nos inspiran a explorar la relación entre microorganismos y huéspedes desde la perspectiva de los metabolitos neuronales.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Facultad de Ciencia y Tecnología Animal. El estudio se realizó de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones del autor
JW: Curación de datos, Redacción – revisión y edición, Redacción – borrador original. YC: Curación de datos, Redacción – borrador original, Redacción – revisión y edición. ML: Curación de datos, investigación, administración de proyectos, redacción, revisión y edición. SX: Investigación, Software, Escritura – revisión y edición. KZ: Investigación, Software, Escritura – revisión y edición. HF: Investigación, Software, Escritura – revisión y edición. JN: Investigación, Software, Escritura – revisión y edición. WS: Conceptualización, Investigación, Software, Escritura – revisión y edición. XJ: Conceptualización, Investigación, Software, Escritura – revisión y edición. SL: Metodología, Administración de proyectos, Supervisión, Redacción – revisión y edición.
Financiación
Este estudio fue apoyado por el proyecto clave de investigación y desarrollo del sistema de tecnología de selección del genoma del ganado de carne de Sichuan (2022YFYZ0006).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Notas
1. ^https://github.com/voutcn/megahit
2. ^http://topaz.gatech.edu/GeneMark/
3. ^https://www.ncbi.nlm.nih.gov/
4. ^http://www.kegg.jp/kegg/
5. ^http://www.cazy.org/
6. ^http://www.plob.org/tag/eggnog/
Referencias
1. Qi-yu, D, Rong, Z, y Yan, T. La investigación actual progresa en la cría y nutrición de terneros en China. J Integr Agric. (2017) 16:2805–14. doi: 10.1016/S2095-3119(17)61767-2
2. Soberon, F, Raffrenato, E, Everett, RW, and Amburgh, M. Preweaning milk replacer intake and effects on long-term productivity of dairy terneros. J Dairy Sci. (2012) 95:783–93. DOI: 10.3168/JDS.2011-4391
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Alawneh, JI, Barreto, M, Moore, R, Soust, M, Al-Harbi, H, James, A, et al. Revisión sistemática de una intervención: el uso de probióticos para mejorar la salud y la productividad de los terneros. Prev Vet Med. (2020) 183:105147. doi: 10.1016/j.prevetmed.2020.105147
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Osorio, J. Salud intestinal, estrés e inmunidad en terneros lecheros neonatales: el lado del huésped de las interacciones huésped-patógeno. J Anim Sci Biotechnol. (2020) 11:105. DOI: 10.1186/S40104-020-00509-3
5. Malmuthuge, N, Griebel, PJ, y Guan, LL. El microbioma intestinal y su papel potencial en el desarrollo y la función del tracto gastrointestinal de la pantorrilla recién nacida. Front Vet Sci. (2015) 2:36. DOI: 10.3389/FVETS.2015.00036
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Urie, NJ, Lombard, JE, Shivley, CB, Kopral, CA, Adams, AE, Earleywine, TJ, et al. Manejo de novillas predestetadas en operaciones lecheras en los Estados Unidos: parte V. Factores asociados con la morbilidad y mortalidad en terneros lecheros predestetados. J Dairy Sci. (2018) 101:9229–44. DOI: 10.3168/JDS.2017-14019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Soberon, F, y Amburgh, MV. Simposio de biología de la lactancia: el efecto de la ingesta de nutrientes de la leche o el sustituto de la leche de terneros lecheros predestetados en el rendimiento de leche de lactancia como adultos: un metanálisis de datos actuales. J Anim Sci. (2013) 91:706–12. doi: 10.2527/jas.2012-5834
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. García-Mazcorro, JF, Ishaq, SL, Rodríguez-Herrera, MV, García-Hernández, CA, Kawas, JR, y Nagaraja, TG. Revisión: ¿hay Saccharomyces indígenas en el tracto digestivo de las especies animales de ganado? Implicaciones para la salud, la nutrición y los rasgos de productividad. Animal. (2020) 14:22–30. doi: 10.1017/s1751731119001599
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Guzmán, CE, Bereza-Malcolm, LT, De Groef, B, y Franks, AE. Captación de leche con y sin alimento sólido durante la fase monogástrica: efecto sobre microorganismos fibrolíticos y metanogénicos en el tracto gastrointestinal de terneros. Anim Sci J. (2016) 87:378–88. doi: 10.1111/asj.12429
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Suárez-Mena, FX, Heinrichs, AJ, Jones, CM, Hill, TM y Quigley, JD. Tamaño de partícula de paja en entrantes de terneros: efectos sobre el desarrollo del sistema digestivo y la fermentación ruminal. J Dairy Sci. (2016) 99:341–53. DOI: 10.3168/JDS.2015-9884
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Khan, MA, Bach, A, Weary, DM, y Keyserlingk, MAGV. Revisión invitada: transición de la leche a la alimentación sólida en novillas lecheras. J Dairy Sci. (2016) 99:885–902. DOI: 10.3168/JDS.2015-9975
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. O’Hara, E, Kelly, A, McCabe, MS, Kenny, DA, Guan, LL, and Waters, SM. Effect of a butyrate-fortified milk replace on gastrointestinal microbiota and products of fermentation in artificially breeded dairy terneros at weaning. Sci Rep. (2018) 8:14901. DOI: 10.1038/S41598-018-33122-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Wang, H, Yu, Z, Gao, Z, Li, Q, Qiu, X, Wu, F, et al. Efectos de los probióticos compuestos sobre el rendimiento del crecimiento, la fermentación ruminal, los parámetros sanguíneos y el estado de salud de los terneros Holstein neonatales. J Dairy Sci. (2022) 105:2190–200. DOI: 10.3168/JDS.2021-20721
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. O’Hara, E, Neves, ALA, Song, Y, y Guan, LL. El papel del microbioma intestinal en la producción y la salud del ganado: ¿conductor o pasajero? Annu Rev Anim Biosci. (2020) 8:199–220. doi: 10.1146/annurev-animal-021419-083952
15. Deng, F, Wang, C, Li, D, Peng, Y, Deng, L, Zhao, Y, et al. El microbioma intestinal único de los pandas gigantes involucrados en el metabolismo de las proteínas contribuye a la adaptación dietética del huésped al bambú. Microbioma. (2023) 11:180. DOI: 10.1186/S40168-023-01603-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Agirman, G, y Hsiao, EY. SnapShot: el eje microbiota-intestino-cerebro. Células. (2021) 184:2524–2524.e1. doi: 10.1016/j.cell.2021.03.022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Diao, Q, Zhang, R, and Fu, T. Review of strategies to promote rumen development in terneros. Animales. (2019) 9:490. DOI: 10.3390/ANI9080490
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Dill-McFarland, KA, Breaker, JD, and Suen, G. Microbial succession in the gastrointestinal tract of dairy cows from 2 weeks to first lactation. Sci Rep. (2017) 7:40864. doi: 10.1038/srep40864
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Wu, ZH, Azarfar, A, Simayi, A, Li, SL, Jonker, A, y Cao, ZJ. Efectos del tipo de forraje y la edad en la que se inicia la provisión de forraje sobre el rendimiento de crecimiento, la fermentación ruminal, los metabolitos sanguíneos y las enzimas intestinales en terneros Holstein. Anim Prod Sci. (2018) 58:2288–99. DOI: 10.1071/AN16576
20. Nielsen, H, Almeida, M, Juncker, A, Rasmussen, S, Li, J, Sunagawa, S, et al. Identificación y ensamblaje de genomas y elementos genéticos en muestras metagenómicas complejas sin utilizar genomas de referencia. Nat Biotechnol. (2014) 32:822–8. DOI: 10.1038/NBT.2939
21. Scher, JU, Andrew, S, Longman, RS, Nicola, S, Carles, U, Craig, B, et al. La expansión de Prevotella copri intestinal se correlaciona con una mayor susceptibilidad a la artritis. eLife. (2013) 2:E01202. doi: 10.7554/eLife.01202
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Karlsson, FH, Fåk, F, Nookaew, I, Tremaroli, V, Fagerberg, B, Petranovic, D, et al. La aterosclerosis sintomática se asocia con un metagenoma intestinal alterado. Nat Commun. (2012) 3:1245. DOI: 10.1038/NCOMMS2266
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Villar, E, Farrant, GK, Follows, M, Garczarek, L, Speich, S, Audic, S, et al. Ocean plancton. Las características ambientales de los anillos Agulhas afectan el transporte de plancton interoceánico. Ciencia. (2015) 348:1261447. doi: 10.1126/science.1261447
24. Karlsson, FH, Tremaroli, V, Nookaew, I, Bergström, G, Behre, CJ, Fagerberg, B, et al. Metagenoma intestinal en mujeres europeas con control de glucosa normal, deteriorado y diabético. Naturaleza. (2013) 498:99–103. doi: 10.1038/nature12198
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Avershina, E, Frisli, T, and Rudi, K. De novo semi-alignment of 16S rRNA gene sequences for deep phylogenetic characterization of next generation sequencing data. Microbios Ambiente. (2013) 28:211–6. doi: 10.1264/jsme2.me12157
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Segata, N, Izard, J, Waldron, L, Gevers, D, Miropolsky, L, Garrett, WS, et al. Descubrimiento y explicación de biomarcadores metagenómicos. Genoma Biol. (2011) 12:R60. DOI: 10.1186/GB-2011-12-6-R60
27. Kanehisa, M, Furumichi, M, Tanabe, M, Sato, Y, y Morishima, K. KEGG: new perspectives on genomes, pathways, diseases and drugs. Ácidos nucleicos res. (2017) 45:D353–d361. doi: 10.1093/nar/gkw1092
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Kanehisa, M, Goto, S, Hattori, M, Aoki-Kinoshita, KF, Itoh, M, Kawashima, S, et al. De la genómica a la genómica química: nuevos desarrollos en KEGG. Ácidos nucleicos res. (2006) 34:D354–7. doi: 10.1093/nar/gkj102
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Cantarel, BL, Coutinho, PM, Rancurel, C, Bernard, T, Lombard, V, y Henrissat, B. La base de datos de enzimas activas en carbohidratos (CAZy): un recurso experto para la glucogenómica. Ácidos nucleicos res. (2009) 37:D233–8. doi: 10.1093/nar/gkn663
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Huerta-Cepas, J, Szklarczyk, D, Forslund, K, Cook, H, Heller, D, Walter, MC, et al. eggNOG 4.5: a hierarchical orthology framework with improved functional annotations for eukaryotic, prokaryotic and viral sequences. Ácidos nucleicos res. (2016) 44:D286–93. doi: 10.1093/nar/gkv1248
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Kanehisa, M, Goto, S, Sato, Y, Kawashima, M, Furumichi, M, y Tanabe, M. Data, information, knowledge and principle: back to metabolism in KEGG. Ácidos nucleicos res. (2014) 42:D199–205. doi: 10.1093/nar/gkt1076
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Wilson, ID, Gika, H, Theodoridis, G, Plumb, RS, Shockcor, J, Holmes, E, et al. Procedimientos de perfil metabólico global para orina utilizando UPLC-MS. Nat Protoc. (2010) 5:1005–18. doi: 10.1038/nprot.2010.50
33. Boulesteix, AL, y Strimmer, K. Partial least squares: a versatile tool for the analysis of high-dimensional genomic data. Breve Bioinform. (2007) 8:32–44. doi: 10.1093/bib/bbl016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Van Soest, B, Weber Nielsen, M, Moeser, A, Abuelo, A, y VandeHaar, M. La leche de transición estimula el desarrollo intestinal de los terneros Holstein neonatales. J Dairy Sci. (2022) 105:7011–22. DOI: 10.3168/JDS.2021-21723
35. van Keulen, P, Khan, M, Dijkstra, J, Knol, F, and McCoard, S. Effect of arginine or glutamine supplementation and milk feeding allowance on small intestinal development in terneros. J Dairy Sci. (2020) 103:4754–64. DOI: 10.3168/JDS.2019-17529
36. Welboren, A, Hatew, B, Renaud, J, Leal, L, Martín-, J y Steele, M. Adaptaciones intestinales a la fuente de energía de sustituto de leche en terneros lecheros neonatales. J Dairy Sci. (2021) 104:12079–93. DOI: 10.3168/JDS.2021-20516
37. Ma, J, Shah, A, Shao, Y, Wang, Z, Zou, H, and Kang, K. La suplementación dietética de la pared celular de levadura mejora el desarrollo gastrointestinal de los terneros destetados. Anim Nutr. (2020) 6:507–12. doi: 10.1016/j.aninu.2020.06.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Ma, T, O’Hara, E, Song, Y, Fischer, AJ, He, Z, Steele, MA, et al. Microbiota asociada a la mucosa alterada en el íleon y el colon de terneros neonatos en respuesta al retraso en la primera alimentación con calostro. J Dairy Sci. (2019) 102:7073–86. DOI: 10.3168/JDS.2018-16130
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Bai, Y, Zhou, Y, Zhang, R, Chen, Y, Wang, F, y Zhang, M. La fermentación microbiana intestinal promueve la actividad antiinflamatoria intestinal de los polisacáridos del ñame chino. Química de alimentos. (2023) 402:134003. doi: 10.1016/j.foodchem.2022.134003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Barczynska, R, Slizewska, K, Litwin, M, Szalecki, M, and Kapusniak, J. Effects of dietary fiber preparation made from maize starch on the growth and activity of selected bacteria from the Firmicutes, Bacteroidetes, and Actinobacteria phyla in fecal samples from obesos children. Acta Biochim Pol. (2016) 63:261–6. doi: 10.18388/abp.2015_1068
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Barczynska, R, Jurgoński, A, Slizewska, K, Juśkiewicz, J, y Kapusniak, J. Effects of potato dextrin on the composition and metabolism of the gut microbiota in rats fed standard and high-fat diets. J Funct Foods. (2017) 34:398–407. doi: 10.1016/j.jff.2017.05.023
42. Yi, S, Lee, H, So, K, Kim, E, Jung, Y, Kim, M, et al. Efecto de la alimentación con almidón de patata cruda en la dinámica de composición del microbioma intestinal del lechón. Anim Biosci. (2022) 35:1698–710. DOI: 10.5713/AB.22.0045
43. Zhu, Y, Mu, C, Liu, S, and Zhu, W. Dietary citrus pectin drives more ileal microbial protein metabolism and stronger fecal carbohydrate fermentation over fructooligosaccharide in growing pigs. Anim Nutr. (2022) 11:252–64. doi: 10.1016/j.aninu.2022.08.005
44. Heijne, M, van der Goot, J, Buys, H, Dinkla, A, Roest, H, van Keulen, L, et al. Patogenicidad de Chlamydia gallinacea en pollos después de la inoculación oral. Veterinario Microbiol. (2021) 259:109166. doi: 10.1016/j.vetmic.2021.109166
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Reinhold, P, Sachse, K, y Kaltenboeck, B. Chlamydiaceae en el ganado: ¿comensales, organismos desencadenantes o patógenos? Veterinario J. (2011) 189:257–67. doi: 10.1016/j.tvjl.2010.09.003
46. Müller, U, Sachse, K, Kemmerling, K, Rietz, C, and Sauerwein, H. Identification of certain management practices and health data associated with Chlamydia infection status in German dairy herds. Veterinario J. (2013) 197:905–7. doi: 10.1016/j.tvjl.2013.06.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Anstey, SI, Quigley, BL, Polkinghorne, A, and Jelocnik, M. Chlamydial infection and on-farm risk factors in dairy cattle herds in south East Queensland. Aust Vet J. (2019) 97:505–8. DOI: 10.1111/AVJ.12879
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Xia, B, Wu, W, Fang, W, Wen, X, Xie, J y Zhang, H. La disfunción de la barrera mucosa inducida por el estrés por calor está potencialmente asociada con la disbiosis de la microbiota intestinal en cerdos. Anim Nutr. (2022) 8:289–99. doi: 10.1016/j.aninu.2021.05.012
49. Dorbek-Kolin, E, Husso, A, Niku, M, Loch, M, Pessa-Morikawa, T, Niine, T, et al. Microbiota fecal en terneras lecheras hembras de dos semanas de edad durante un brote agudo de criptosporidiosis: asociación con respuesta inflamatoria sistémica. Res Vet Sci. (2022) 151:116–27. doi: 10.1016/j.rvsc.2022.07.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Zaman, S, Gohar, M, Kanwal, H, Chaudhary, A, and Imran, M. Impact of probiotic Geotrichum candidum QAUGC01 on health, productivity, and gut microbial diversity of dairy cattle. Curr Microbiol. (2022) 79:376. DOI: 10.1007/S00284-022-03074-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Shin, N, Whon, T, and Bae, J. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Tendencias Biotechnol. (2015) 33:496–503. doi: 10.1016/j.tibtech.2015.06.011
52. Han, Y, Tang, C, Zhao, Q, Fan, S, Yang, P, y Zhang, J. Butyrate mitiga los cambios morfológicos intestinales inducidos por lipopolisacáridos en lechones destetados mediante la regulación de la microbiota y el metabolismo energético, y el alivio de la inflamación y la apoptosis. Microorganismos. (2022) 10:2001. doi: 10.3390/microorganismos10102001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Varada, V, Kumar, S, Chhotaray, S, and Tyagi, A. Host-specific probiotics feeding influence growth, gut microbiota, and fecal biomarkers in buffalo terneros. AMB Express. (2022) 12:118. DOI: 10.1186/S13568-022-01460-4
54. Lu, C, Liu, Y, Ma, Y, Wang, S, Cai, C, Yang, Y, et al. Evaluación comparativa de la composición de la microbiota del íleon en lechones en diferentes etapas de crecimiento. Microbiol frontal. (2021) 12:765691. DOI: 10.3389/fmicb.2021.765691
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Piccolo, B, Mercer, K, Bhattacharyya, S, Bowlin, A, Saraf, M, Pack, L, et al. Las dietas postnatales tempranas afectan el microbioma bioregional del intestino delgado y el metaboloma ileal en cerdos neonatos. J Nutr. (2017) 147:1499–509. DOI: 10.3945/JN.117.252767
56. Marchesi, J, Adams, D, Fava, F, Hermes, G, Hirschfield, G, Hold, G, et al. La microbiota intestinal y la salud del huésped: una nueva frontera clínica. Intestino. (2016) 65:330–9. DOI: 10.1136/GuTJNL-2015-309990
57. Simpson, K, Callan, R, and Van Metre, D. Clostridial Abomasitis and enteritis in rumiants. Veterinario Clin North Am Food Anim Pract. (2018) 34:155–84. doi: 10.1016/j.cvfa.2017.10.010
58. Cain, J, Norris, J, Ripley, N, Suri, P, Finnerty, C, Gravatte, H, et al. La comunidad microbiana asociada con Parascaris spp. infectando caballos juveniles. Vectores parásitos. (2022) 15:408. DOI: 10.1186/S13071-022-05533-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Yuan, X, Liu, J, Hu, X, Yang, S, Zhong, S, Yang, T, et al. Alteraciones en la microbiota yeyunal y en los perfiles de metabolitos fecales de conejos infectados por Eimeria intestinalis. Vectores parásitos. (2022) 15:231. DOI: 10.1186/S13071-022-05340-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Zhuo, Y, Huang, Y, He, J, Hua, L, Xu, S, Li, J, et al. Efectos de la extrusión de maíz y arroz roto en la ingesta de alimento, la digestibilidad de nutrientes y la microbiota intestinal de lechones destetados. Animales. (2022) 12:818. DOI: 10.3390/ANI12070818
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Fatima, N, Fazili, K, and Bhat, N. Proteolysis dependent cell cycle regulation in Caulobacter crescentus. Celda Div. (2022) 17:3. DOI: 10.1186/S13008-022-00078-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Beroual, W, Prévost, K, Lalaouna, D, Ben Zaina, N, Valette, O, Denis, Y, et al. El ARN no codificante CcnA modula los reguladores del ciclo celular maestro CtrA y GcrA en Caulobacter crescentus. PLoS Biol. (2022) 20:E3001528. doi: 10.1371/journal.pbio.3001528
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Aldridge, P, Paul, R, Goymer, P, Rainey, P, and Jenal, U. Role of the GGDEF regulator PleD in polar development of Caulobacter crescentus. Mol Microbiol. (2003) 47:1695–708. doi: 10.1046/j.1365-2958.2003.03401.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Paul, R, Jaeger, T, Abel, S, Wiederkehr, I, Folcher, M, Biondi, E, et al. La regulación alostérica de las histidina quinasas por su regulador de respuesta afín determina el destino celular. Células. (2008) 133:452–61. doi: 10.1016/j.cell.2008.02.045
65. Mascolo, E, Adhikari, S, Caruso, SM, deCarvalho, T, Folch Salvador, A, Serra-Sagristà, J, et al. El regulador transcripcional CtrA controla la expresión génica en fagos de Alphaproteobacteria: evidencia de una vía de aplazamiento lítico. Microbiol frontal. (2022) 13:918015. DOI: 10.3389/FMICB.2022.918015
66. McAdams, H, y Shapiro, L. La arquitectura y el patrón de conservación de los circuitos de control de células completas. J Mol Biol. (2011) 409:28–35. doi: 10.1016/j.jmb.2011.02.041
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Liu, L, Liu, Y, Cheng, X, y Qiao, X. Los efectos paliativos de la quercetina en la necroptosis inducida por cadmio a través de la vía de inhibición ROS / iNOS / NF-κB en el cerebro del pollo. Biol Trace Elem Res. (2021) 199:1584–94. DOI: 10.1007/S12011-020-02563-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Yi, Y, Gao, K, Lin, P, Chen, H, Zhou, D, Tang, K, et al. La necroptosis inducida por Staphylococcus aureus promueve el daño mitocondrial en células epiteliales endometriales de cabra. Animales. (2022) 12:2218–8. doi: 10.3390/ani12172218
69. Huang, Y, Liang, Q, Zhang, H, Chen, S, Xu, L, Zeng, B, et al. Baicalin inhibe la necroptosis al disminuir la oligomerización de MLKL fosforilada y mitiga la pancreatitis aguda inducida por caeruleína en ratones. Int Immunopharmacol. (2022) 108:108885. doi: 10.1016/j.intimp.2022.108885
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Li, S, Liu, R, Xia, S, Wei, G, Ishfaq, M, Zhang, Y, et al. Papel protector de la curcumina en la necroptosis mediada por la vía TLR1/RIPK inducida por la aflatoxina B4 y la inflamación en el hígado de pollo. Ecotoxicol Environ Saf. (2022) 233:113319. doi: 10.1016/j.ecoenv.2022.113319
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Zhou, Y, Jin, H, Wu, Y, Chen, L, Bao, X y Lu, C. El ácido gálico protege contra la necroptosis de hepatocitos inducida por etanol a través de un mecanismo dependiente de NRF2. Toxicol In Vitro. (2019) 57:226–32. doi: 10.1016/j.tiv.2019.03.008
72. Fitzsimmons Liam, F, Liu, L, Kim, J-S, Jones-Carson, J, and Vázquez-Torres, A. Salmonella reprograms nucleotide metabolism in its adaptation to Nitrosative stress. MBio. (2018) 9:E00211–8. doi: 10.1128/mBio.00211-18
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Lane, A, and Fan, T. Regulation of mammalian nucleotide metabolism and biosynthesis. Ácidos nucleicos res. (2015) 43:2466–85. doi: 10.1093/nar/gkv047
Resumen de PubMed | Texto completo de CrossRef | Google Académico
74. Shi, C, Zhou, Z, Chi, X, Xiu, S, Yi, C, Jiang, Z, et al. Avances recientes en medicamentos para la gota. Eur J Med Chem. (2023) 245:114890. doi: 10.1016/j.ejmech.2022.114890
75. Tong, S, Zhang, P, Cheng, Q, Chen, M, Chen, X, Wang, Z, et al. El papel de la microbiota intestinal en la gota: ¿es la microbiota intestinal un objetivo potencial para el tratamiento de la gota? Las células frontales infectan microbiol. (2022) 12:1051682. DOI: 10.3389/fcimb.2022.1051682
76. Zhang, L, Wang, Y, Jia, H, Liu, X, Zhang, R, and Guan, J. Transcriptome and metabolome analysis reveal the regulatory effects of compound probiotics on cecal metabolism in heat-stress broilers. Poult Sci. (2023) 102:102323. doi: 10.1016/j.psj.2022.102323
77. Zhao, R, Li, Z, Sun, Y, Ge, W, Wang, M, Liu, H, et al. Escherichia colidiseñó Nissle 1917 con urato oxidasa y un sistema de reciclaje de oxígeno para el tratamiento de la hiperuricemia. Microbios intestinales. (2022) 14:2070391. doi: 10.1080/19490976.2022.2070391
Resumen de PubMed | Texto completo de CrossRef | Google Académico
78. Wu, Z, Zhang, H, Li, Z, Li, H, Miao, X, Pan, H, et al. Efecto mutuo de la homocisteína y el ácido úrico sobre la rigidez arterial y el riesgo cardiovascular en el contexto de la medicina predictiva, preventiva y personalizada. EPMA J. (2022) 13:581–95. DOI: 10.1007/S13167-022-00298-X
79. Qian, LC, y Sun, JY. Efecto de la β-glucosidasa como alimento complementario sobre el rendimiento de crecimiento, las enzimas digestivas y la fisiología de los pollos de engorde. Asiático-australas J Anim Sci. (2009) 22:260–6. doi: 10.5713/ajas.2009.80416
80. Long, C, Qi, X, and Venema, K. Chemical and nutritional characteristics, and microbial degradation of rapeseed meal recalcitrant carbohydrates: a review. Nutr delantero. (2022) 9:948302. doi: 10.3389/fnut.2022.948302
Resumen de PubMed | Texto completo de CrossRef | Google Académico
81. Li, Z, Shi, J, Lei, Y, Wu, J, Zhang, R, Zhang, X, et al. La castración altera la microbiota cecal e inhibe el crecimiento en el ganado Holstein. J Anim Sci. (2022) 100:SKAC367. doi: 10.1093/jas/skac367
Resumen de PubMed | Texto completo de CrossRef | Google Académico
82. Chang, D, Sharma, L, y Dela Cruz, CS. Chitotriosidasa: un marcador y modulador de la enfermedad pulmonar. Eur Respir Rev. (2020) 29:190143. DOI: 10.1183/16000617.0143-2019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
83. Allonsius, C, Vandenheuvel, D, Oerlemans, E, Petrova, M, Donders, G, Cos, P, et al. Inhibición de la morfogénesis de Candida albicans por quitinasa de Lactobacillus rhamnosus GG. Sci Rep. (2019) 9:2900. DOI: 10.1038/S41598-019-39625-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
84. Marzena, M, Anna, Z, M, GM, Jacek, O, y Jakub, F. Chitinasas y proteínas similares a la quitinasa como dianas terapéuticas en enfermedades inflamatorias, con especial atención a las enfermedades inflamatorias intestinales. Int J Mol Sci. (2021) 22:6966. DOI: 10.3390/IJMS22136966
85. Beier, S, y Bertilsson, S. Bacterial chitin degradation-mechanisms and ecophysiological strategies. Microbiol frontal. (2013) 4:149. DOI: 10.3389/FMICB.2013.00149
Resumen de PubMed | Texto completo de CrossRef | Google Académico
86. Miri, S, Yeo, J, Abubaker, S, y Hammami, R. Neuromicrobiology, an emerging neurometabolic facet of the gut microbiome? Microbiol frontal. (2023) 14:1098412. DOI: 10.3389/fmicb.2023.1098412
Resumen de PubMed | Texto completo de CrossRef | Google Académico
87. Cox, LM y Weiner, HL. Vías de señalización de la microbiota que influyen en las enfermedades neurológicas. Neuroterapéutica. (2018) 15:135–45. DOI: 10.1007/S13311-017-0598-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
88. Cryan, J, O’Riordan, K, Sandhu, K, Peterson, V, y Dinan, T. El microbioma intestinal en los trastornos neurológicos. Lancet Neurol. (2020) 19:179–94. doi: 10.1016/s1474-4422(19)30356-4
89. Nagatsu, T, Nakashima, A, Ichinose, H, and Kobayashi, K. Human tyrosine hydroxylase in Parkinson’s disease and in related disorders. J Transm Neural. (2019) 126:397–409. DOI: 10.1007/S00702-018-1903-3
90. Zhou, C, Nutt, DJ, y Davies, SJ. Visualización de la clasificación de las drogas utilizadas en los trastornos psicóticos: un «mapa del metro» que representa mecanismos, clases establecidas y categorías informales. J Psicofarmacol. (2022) 36:1007–15. DOI: 10.1177/02698811221115758
91. Maini Rekdal, V, Bess, EN, Bisanz, JE, Turnbaugh, PJ, and Balskus, EP. Discovery and inhibition of an interspecies gut bacterial pathway for levodopa metabolism. Ciencia. (2019) 364:eaau6323. doi: 10.1126/science.aau6323
92. T, DLM. Bacterias intestinales y neurotransmisores. Microorganismos. (2022) 10:1838. doi: 10.3390/microorganismos10091838
93. Bonaz, B, Bazin, T, y Pellissier, S. El nervio vago en la interfaz del eje microbiota-intestino-cerebro. Neurosci frontal. (2018) 12:49. DOI: 10.3389/FNINS.2018.00049
Resumen de PubMed | Texto completo de CrossRef | Google Académico
94. Breit, S, Kupferberg, A, Rogler, G, y Hasler, G. El nervio vago como modulador del eje cerebro-intestino en trastornos psiquiátricos e inflamatorios. Psiquiatría frontal. (2018) 9:44. DOI: 10.3389/FPSYT.2018.00044
Resumen de PubMed | Texto completo de CrossRef | Google Académico
95. Hughes, DT, y Sperandio, V. Inter-kingdom signalling: communication between bacteria and their hosts. Nat Rev Microbiol. (2008) 6:111–20. DOI: 10.1038/NRMICRO1836
Resumen de PubMed | Texto completo de CrossRef | Google Académico
96. Liu, X, Liu, S, Tang, Y, Pu, Z, Xiao, H, Gao, J, et al. La administración intragástrica de caseína conduce a la enfermedad nigroestriatal progresada acompañada de inflamación gastrointestinal nigroestriatal persistente Trastornos metabólicos de la microbiota intestinal y activados inducidos en el modelo de ratón MPTP de la enfermedad de Parkinson. Neurochem Res. (2021) 46:1514–39. DOI: 10.1007/S11064-021-03293-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
97. Dalile, B, Van Oudenhove, L, Vervliet, B, y Verbeke, K. El papel de los ácidos grasos de cadena corta en la comunicación microbiota-intestino-cerebro. Nat Rev Gastroenterol Hepatol. (2019) 16:461–78. DOI: 10.1038/S41575-019-0157-3
98. van de Wouw, M, Boehme, M, Lyte, JM, Wiley, N, Strain, C, O’Sullivan, O, et al. Ácidos grasos de cadena corta: metabolitos microbianos que alivian las alteraciones del eje cerebro-intestino inducidas por el estrés. J Physiol. (2018) 596:4923–44. doi: 10.1113/jp276431
99. Fung, T, Vuong, H, Luna, C, Pronovost, G, Aleksandrova, A, Riley, N, et al. La exposición intestinal a la serotonina y la fluoxetina modulan la colonización bacteriana en el intestino. Nat Microbiol. (2019) 4:2064–73. DOI: 10.1038/S41564-019-0540-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
100. Kelly, JR, Kennedy, PJ, Cryan, JF, Dinan, TG, Clarke, G, y Hyland, NP. Rompiendo las barreras: el microbioma intestinal, la permeabilidad intestinal y los trastornos psiquiátricos relacionados con el estrés. Neurosci de células frontales. (2015) 9:392. doi: 10.3389/fncel.2015.00392
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: terneros, patrones de alimentación, metagenómica, metabolómica, neuromicrobiología
Cita: Wang J, Chen Y, Li M, Xia S, Zhao K, Fan H, Ni J, Sun W, Jia X y Lai S (2023) Los efectos de la alimentación diferencial en el desarrollo del íleon, la capacidad digestiva y el estado de salud de los terneros recién nacidos. Frente. Vet. Sci. 10:1255122. doi: 10.3389/fvets.2023.1255122
Recibido: 08 Julio 2023; Aprobado: 29 de agosto de 2023;
Publicado: 08 septiembre 2023.
Editado por:
Balamuralikrishnan Balasubramanian, Universidad de Sejong, República de Corea
Revisado por:
Tianliu Zhang, Universidad Agrícola de Henan, China Jianmin Chai, Universidad de Foshan, China
Derechos de autor © 2023 Wang, Chen, Li, Xia, Zhao, Fan, Ni, Sun, Jia y Lai. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Songjia Lai, laisj5794@163.com
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía