Los efectos de las hojas de Artemisia Sieberi, Achillea Fragrantissima y Olea Europaea
Los efectos de las hojas de Artemisia Sieberi, Achillea Fragrantissima y Olea Europaea sobre el rendimiento y los parámetros fisiológicos en pollos de engorde estresados por calor
 Zeinab M. H. Mahasneh1
Zeinab M. H. Mahasneh1  Mohannad Abuajamieh1*
Mohannad Abuajamieh1*  Anas Abdelqader1
Anas Abdelqader1  Mohmmad Al-Qaisi1
Mohmmad Al-Qaisi1  Mohamed A. Abedal-Majed1
Mohamed A. Abedal-Majed1  Hosam Al-Tamimi2
Hosam Al-Tamimi2  Hana Zakaria1
Hana Zakaria1  Abdur-Rahman A. Al-Fataftah1
Abdur-Rahman A. Al-Fataftah1- 1Departamento de Producción Animal, Facultad de Agricultura, Universidad de Jordania, Ammán (Jordania)
- 2Departamento de Producción Animal, Facultad de Agricultura, Universidad de Ciencia y Tecnología de Jordania, Irbid, Jordania
Las altas temperaturas tienen efectos perjudiciales en el rendimiento y la fisiología de los pollos de engorde. Las plantas medicinales tienen diversas actividades biológicas y pueden mejorar la resistencia al calor de los pollos durante las olas de calor. Por lo tanto, este estudio tuvo como objetivo explorar el papel potencial del uso de plantas medicinales locales específicas para aliviar los impactos negativos del estrés por calor (HS) en pollos de engorde. En este estudio, se utilizaron 180 pollitos de un día de edad para investigar los efectos de la HS y las plantas medicinales autóctonas dietéticas sobre el rendimiento del crecimiento, los biomarcadores antioxidantes y la salud intestinal. Los polluelos fueron asignados a seis grupos (18 corrales con 10 pollitos por corral) con tres repeticiones cada uno. En el primer grupo, los pollitos se mantuvieron en condiciones termoneutras (CON) y se alimentaron con una dieta basal. Los otros cinco grupos fueron expuestos a estrés térmico recurrente y alimentados con una dieta basal (T1, grupo HS) o suplementados con Artemisia Sieberi (1,25 g/kg de alimento; T2), Achillea Fragrantissima (15 g/kg de alimento; T3), Olea europaea (10 g/kg de alimento; T4), y todos los aditivos anteriores (todo en uno) combinados a los mismos niveles de dosis mencionados anteriormente (T5). A los 21 días de edad, los pollitos de cada grupo fueron expuestos a dos fases de estrés térmico: fase 1 de los días 21 a 34 (34 ± 1 °C) seguida de la fase 2 de los días 35 a 39 (37 ± 1 °C). Los resultados indican que la HS aumentó significativamente la temperatura rectal y la frecuencia respiratoria en pollos de engorde. La ingesta de alimento y la ganancia de peso corporal mejoraron en todos los grupos suplementados, mientras que la tasa de conversión alimenticia disminuyó en respuesta a la inclusión dietética de plantas medicinales. Además, los niveles de glutatión peroxidasa e inmunoglobulina G aumentaron en los grupos T3, T4 y T5 en comparación con los otros grupos. La HS indujo una regulación positiva significativa en los niveles de ARNm de la proteína de choque térmico 70 y la interleucina-8, mientras que el ARNm de la ocludina disminuyó. Los genes T3, T4 y T5 mostraron una disminución significativa de la expresión de los genes HSP70 e IL-8 hepáticos e íleon y un aumento de los niveles de ocludina del ARNm del íleon en relación con los grupos CON y T1. En conclusión, la suplementación con estas plantas mejora el rendimiento del crecimiento y mantiene la salud intestinal, manteniendo la productividad de los pollos de engorde en condiciones de HS.
1 Introducción
El cambio climático es un desafío mundial acuciante con consecuencias de gran alcance para los ecosistemas, y tiene profundas implicaciones para diversos sectores, incluida la agricultura (1). El impacto del cambio climático en los animales de granja es una preocupación creciente, ya que los cambios de temperatura y clima pueden afectar su bienestar, productividad y rendimiento (2). A medida que cambia el clima de la Tierra, la ganadería se ve cada vez más afectada por el aumento de las temperaturas, la alteración de los patrones de precipitación y la mayor frecuencia de los fenómenos meteorológicos extremos. Estos cambios ambientales tienen impactos directos e indirectos en los animales de granja (3, 4). Entre los abundantes desafíos planteados por el cambio climático, el estrés por calor (HS) es un factor crítico en la cría de pollos de engorde (5, 6). Desde la HS hasta los cambios en la disponibilidad y calidad del forraje, los animales de granja están expuestos a una variedad de factores estresantes ambientales que pueden afectar su rendimiento y salud (5, 7). Entre los animales de granja, los pollos de engorde son especialmente vulnerables a las condiciones ambientales. Las condiciones de HS afectan notablemente el rendimiento y la salud de los pollos de engorde (8, 9), lo que lleva a una reducción de las tasas de crecimiento, un deterioro de la eficiencia alimenticia (6, 7) y una disminución de la productividad y los rendimientos económicos para los avicultores (10). Las temperaturas elevadas pueden aumentar la susceptibilidad a las enfermedades al comprometer el sistema inmunológico de los pollos de engorde (11). Además, la HS interrumpe el proceso digestivo en los pollos de engorde, afectando la absorción de nutrientes y la digestibilidad del alimento al alterar la salud intestinal. Esto se realiza promoviendo la inflamación y dañando las barreras intestinales (12, 13). La HS puede alterar los procesos metabólicos, lo que lleva a una mala utilización de nutrientes en los pollos de engorde, lo que resulta en un crecimiento y rendimiento debilitados. La microbiota intestinal es crucial para la salud de los pollos, y la HS puede causar desequilibrios, aumentando el riesgo de problemas gastrointestinales (14). Para mitigar estos efectos adversos, se pueden emplear diversas estrategias, como modificaciones ambientales, cría de razas tolerantes al calor e intervenciones nutricionales (13, 15). El manejo nutricional es particularmente importante para aliviar los efectos de la HS en las aves de corral (15, 16).
Las plantas medicinales son sustancias importantes en productos farmacéuticos y suplementos dietéticos porque contienen altos niveles de sustancias bioactivas como polifenoles, flavonoides y aceites esenciales (17-20). Estas características indican sus notables propiedades antioxidantes y antiinflamatorias. Jordania tiene una rica flora que se expresa en una variedad de especies de plantas, incluidas las plantas medicinales. Muchas de estas plantas medicinales se han utilizado como automedicación para el tratamiento de la dislipidemia, la diabetes, la hipertensión, el cáncer y la infertilidad (21). A pesar de que algunas plantas medicinales jordanas se han utilizado para diversos fines farmacéuticos, no se ha explorado su papel potencial en la mitigación de los efectos negativos de la HS en los pollos de engorde. Los pollos de engorde suplementados con plantas medicinales han mostrado mayores tasas de crecimiento, una mejor tasa de conversión alimenticia y una mejor utilización de nutrientes (22). Además, estas plantas pueden estimular la función inmunológica, reduciendo el riesgo de infecciones inducidas por estrés por calor (4, 23). Las propiedades antiinflamatorias de las plantas medicinales también favorecen la salud intestinal al mantener el equilibrio de la microbiota intestinal (16).
Artemisia Sieberi, conocida localmente como Shieh, es una hierba anual perteneciente al grupo Asteraceae. Por lo general, crece hasta una altura de 20 a 40 cm y es originaria de Jordania (21). Esta planta es conocida por sus altas concentraciones de componentes bioactivos, incluidos fenólicos, flavonoides y esteroides (21). Añadiendo Artemisia annua L. a las dietas de pollos de engorde criados bajo HS mejoró significativamente el peso corporal, redujo los biomarcadores de estrés oxidativo y mejoró las funciones hepáticas (24). Además, los pollos de engorde estresados (expuestos a 34 ± 1 °C durante 8 h) provistos con 1 g de Artemisia annua mostraron una disminución en los niveles plasmáticos de diamino oxidasa, expresión de ARNm de la proteína de choque térmico 70 (HSP70) e interleucinas en las células intestinales (25).
La Achillea Fragrantissima (AFR), conocida localmente como Qaysoom, es una hierba medicinal muy utilizada y valorada en la medicina tradicional árabe para prevenir diversas enfermedades. Las sustancias bioactivas que se encuentran en Achillea son los ácidos fenólicos y los flavonoides (26). En un estudio realizado por Eidrisha et al. (27), se encontró que la inclusión dietética de AFR (5 g/kg) mejoró significativamente el peso corporal (PC), la función hepática y el índice de conversión alimenticia (FCR) de las codornices en condiciones normales. Sin embargo, no se observaron efectos significativos sobre los rasgos de la canal. Se necesita más investigación para investigar el uso de AFR en la alimentación de las aves de corral, especialmente en condiciones de HS. El olivo (Olea europaea) es una hierba medicinal rica en polifenoles como el pinoresinol, el hidroxitirosol, la oleuropeína y el tirosol (28), que tienen poderosos efectos antibacterianos, antioxidantes y antiinflamatorios. Agah et al. (29) no encontraron efectos significativos de las hojas de olivo en los parámetros de rendimiento de pollos de engorde sometidos a estrés térmico (33 °C). Se ha descubierto que las hojas de olivo reducen los perfiles lipídicos, mejoran las funciones hepáticas y aumentan las enzimas antioxidantes como la glutatión peroxidasa. Estos hallazgos han llevado a los investigadores a investigar el potencial de estas plantas medicinales de Jordania para aliviar los efectos adversos del estrés térmico en las aves de corral, debido a sus propiedades antioxidantes. Por lo tanto, el estudio fue diseñado para evaluar las propiedades antioxidantes de las plantas medicinales autóctonas (hojas de Artemisia Sieberi, Achillea Fragrantissima y Olea Europaea) sobre el rendimiento del crecimiento, la morfología intestinal y la salud de pollos de engorde estresados por calor.
2 Materiales y métodos
2.1 Aprobación ética
El Comité de Ética Animal del Decanato de Investigación Científica de la Universidad de Jordania (Ammán, Jordania) aprobó los procedimientos experimentales utilizados en este estudio.
2.2 Recolección de plantas y análisis fitoquímico
Se recolectaron plantas medicinales, incluidas Artemisia sieberi y Achillea fragrantissima, en la región de Badia, en Al Safawi, y hojas de Olea europaea en la ciudad de Jerash, en Kufr Khall. Las especies de plantas fueron identificadas taxonómicamente por el Prof. Mahfouz Abu-Zanat del Departamento de Producción Animal de la Escuela de Agricultura de la Universidad de Jordania. Los especímenes de comprobante (#22/11/88, #16/7/88 y #23/1/21, respectivamente) se depositaron en el herbario del Departamento de Biología de la Facultad de Ciencias de la Universidad de Jordania. De acuerdo con la referencia (30), se determinó el contenido total de fenólicos y flavonoides, la actividad eliminatoria de radicales de 2,2-difenil-1-picrilhidrazilo (DPPH) y el potencial antioxidante reductor de iones férricos (FRAP) de las plantas experimentales (ver Tabla 1). Los constituyentes químicos del aceite obtenido por hidrodestilación se analizaron mediante cromatografía de gases-espectrometría de masas (ver Tabla 2).
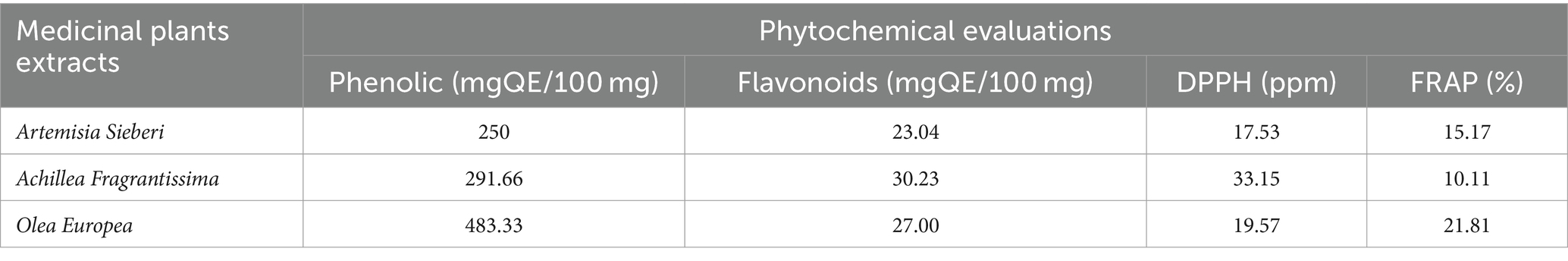 Tabla 1. En esta investigación se utilizaron evaluaciones fitoquímicas de extractos acuosos de Artemisia Sieberi, Achillea Fragrantissima y Olea Europea.
Tabla 1. En esta investigación se utilizaron evaluaciones fitoquímicas de extractos acuosos de Artemisia Sieberi, Achillea Fragrantissima y Olea Europea.
2.3 Animales y diseño experimental
Un total de 180 pollos de engorde Ross 308 de 1 día de edad se obtuvieron de una planta de incubación comercial local y se colocaron en incubadoras con dimensiones de 188 cm × 82 cm × 68 cm, con un piso de malla de alambre. Las aves fueron criadas en condiciones óptimas de temperatura ambiente y se les proporcionó acceso ad libitum al alimento (Tabla 3) y al agua. Al 1 día de edad, los pollitos se asignaron aleatoriamente a seis tratamientos dietéticos, cada uno con tres réplicas (que consisten en 10 aves por réplica), y se suplementaron con aditivos alimentarios.
A los 21 días de edad, los tratamientos 2 a 6 fueron sometidos a estrés térmico intermitente (fase 1) en cámaras ambientalmente controladas. La temperatura durante la fase 1 se mantuvo entre 34 ± 1°C con una humedad relativa de 49 ± 1% durante 15 días consecutivos (del 21 al 34) durante 4 h al día de 11:00 a 15:00. A esto le siguió la fase 2, donde se aumentó la temperatura a 37 ± 1°C con una humedad relativa de 52 ± 1% durante 5 días consecutivos (de los días 35 a 39) durante 4 h al día de 11:00 a 15:00.
Los tratamientos se distribuyeron de la siguiente manera:
1. CONTRA: Grupo control termoneutral alimentado con una dieta basal.
2. T1: Grupo control sometido a estrés térmico alimentado con una dieta basal.
3. T2: Grupo sometido a estrés térmico suplementado con Artemisia Sieberi a razón de 1,25 g/kg de alimento.
4. T3: Grupo sometido a estrés térmico suplementado con Achillea Fragrantissima a razón de 15 g/kg de alimento.
5. T4: Grupo sometido a estrés térmico suplementado con Olea europaea a razón de 10 g/kg de alimento.
6. T5: Grupo sometido a estrés térmico suplementado con todos los aditivos anteriores combinados a los mismos niveles de dosis mencionados anteriormente.
2.4 Parámetros ambientales
La temperatura ambiente (Ta) y la humedad relativa (HR%) se registraron a intervalos horarios a lo largo de todo el estudio utilizando termoregistradores ubicados dentro del laboratorio a nivel de las aves. A partir de estos registros se calculó la media de Ta (temperatura) y el % de humedad relativa (humedad relativa) para cada día (Ta = 28 ± 1°C; % HR = 46% ± 1), fase 1: (Ta = 34 ± 1°C; % HR = 49 ± 1) y fase 2: (Ta = 37 ± 1°C, % HR = 52 ± 1).
Los pollos de engorde (180) se dividieron en seis grupos. El grupo control fue alimentado con una dieta basal y se mantuvo en condiciones ambientales (28 ± 1°C; HR% = 46% ± 1), mientras que el segundo grupo (T1, grupo HS) fue alimentado con una dieta basal y a los 21 días de edad fue expuesto a HS cíclica (temperatura = 34 ± 1°C con una humedad relativa de 49 ± 1%) durante 4 h/día (de los días 21 a 34) de 11:00 a 15:00. A esto le siguió la fase 2, donde se aumentó la temperatura a 37 ± 1°C con una humedad relativa de 52 ± 1% durante 5 días consecutivos (de los días 35 a 39) durante 4 h al día de 11:00 a 15:00. Los grupos tratados (T2, T3, T4 y T5) fueron alimentados con dieta basal suplementada con Artemisia Sieberi, Achillea Fragrantissima, Olea europaea y sus combinaciones a razón de 1,25, 15, 10, 26,25 g/kg respectivamente.
2.5 Parámetros de calidad de funcionamiento
Se midió la ingesta semanal de alimento (IF) y el peso corporal (PC) en los días 0, 7, 14, 21, 28, 35 y 39 (el último día del experimento). La ganancia de peso corporal (BWG) se determinó restando el peso inicial de cada ave de su peso al final del estudio. El índice de conversión alimenticia (FCR) se calculó semanalmente durante el experimento utilizando la fórmula: FCR = (alimento promedio consumido en gramos por intervalo/BWG promedio en gramos durante el mismo intervalo). Se anotaron las mortalidades diarias para cada repetición en el tratamiento, y la FCR se ajustó en consecuencia.
2.6 Parámetros de la canal
En total, se seleccionaron al azar nueve aves por tratamiento, se pesaron y ayunaron durante la noche. Las aves fueron sacrificadas e inmediatamente procesadas para recolectar muestras intestinales y órganos necesarios para su análisis. El peso de la canal (g), el porcentaje de aderezo (%), el hígado, el corazón y el bazo se pesaron y ajustaron como porcentajes del peso corporal vivo.
2.7 Respuestas fisiológicas
La temperatura rectal se registró dos veces al día para nueve aves por tratamiento durante el período de exposición al calor (21-39 días de edad) utilizando termómetros digitales portátiles (GLM700) conectados a una sonda muy fina. La sonda se insertó a un máximo de 4-5 cm dentro de la cloaca de cada ave. La frecuencia respiratoria se midió contando las respiraciones jadeantes de las aves durante 15 s, y este valor se multiplicó por 4 para determinar el número de respiraciones respiratorias por minuto. Se utilizaron nueve aves por tratamiento para medir la frecuencia respiratoria (Ver Figura 1).
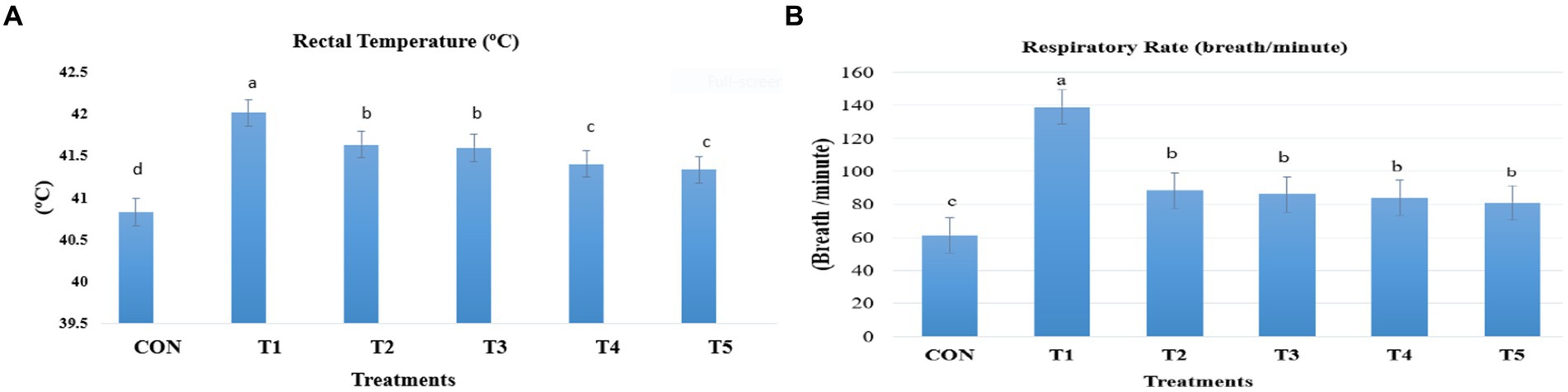 Figura 1. Cambio en las temperaturas rectales (A) y las tasas respiratorias (B) de los pollos de engorde como respuesta a la suplementación con aditivos alimentarios dietéticos. Los pollos de engorde (Ross308) fueron alimentados con una dieta basal (CON; Ta = 28 ± 1°C; % de HR = 46% ± 1), mientras que los otros grupos de pollos fueron expuestos a estrés térmico intermitente en la fase 1 (Ta = 34 ± 1 °C, % de humedad relativa = 49 ± 1) y en la fase 2 (Ta = 37 ± 1 °C, % de humedad relativa = 52 ± 1) tras lo cual se reanudó la termoneutralidad (Ta = 28 ± 1 °C; HR% = 46% ± 1), y alimentados con dietas sin suplementación (T1, grupo de estrés térmico), o alimentados con 1,25 g de Artemisia Sieberi/kg (T2), 15 g de Achillea Fragrantissima/kg de dieta (T3), 10 g de Olea europaea/kg de dieta (T4) y finalmente T5 suplementados con todos los aditivos previos combinados a los mismos niveles de dosis mencionados anteriormente. 2Error estándar de la media. A–C Las medias con diferentes superíndices dentro de una misma fila difieren significativamente (p < 0,05), según la prueba de Tukey.
Figura 1. Cambio en las temperaturas rectales (A) y las tasas respiratorias (B) de los pollos de engorde como respuesta a la suplementación con aditivos alimentarios dietéticos. Los pollos de engorde (Ross308) fueron alimentados con una dieta basal (CON; Ta = 28 ± 1°C; % de HR = 46% ± 1), mientras que los otros grupos de pollos fueron expuestos a estrés térmico intermitente en la fase 1 (Ta = 34 ± 1 °C, % de humedad relativa = 49 ± 1) y en la fase 2 (Ta = 37 ± 1 °C, % de humedad relativa = 52 ± 1) tras lo cual se reanudó la termoneutralidad (Ta = 28 ± 1 °C; HR% = 46% ± 1), y alimentados con dietas sin suplementación (T1, grupo de estrés térmico), o alimentados con 1,25 g de Artemisia Sieberi/kg (T2), 15 g de Achillea Fragrantissima/kg de dieta (T3), 10 g de Olea europaea/kg de dieta (T4) y finalmente T5 suplementados con todos los aditivos previos combinados a los mismos niveles de dosis mencionados anteriormente. 2Error estándar de la media. A–C Las medias con diferentes superíndices dentro de una misma fila difieren significativamente (p < 0,05), según la prueba de Tukey.
2.8 Parámetros sanguíneos
Se seleccionaron aleatoriamente un total de cinco aves/tratamientos para muestras de sangre para medir el cortisol, la glutatión peroxidasa (GSH-Px) y la inmunoglobulina G (IgG). La sangre se extrajo de la vena yugular de cada ave en tubos heparinizados e inmediatamente se centrifugó a 3500 rpm durante 15 min para obtener plasma. Las muestras de sangre se almacenaron congeladas a -20 °C para su posterior análisis. Los kits de sangre se obtuvieron de Biotechnology Co., Ltd., en la ciudad de Wuhan, China. Las concentraciones plasmáticas de cortisol se evaluaron utilizando kits comerciales (Cortisol ELISA Kit, ELK Biotechnology, Wuhan, China). Los niveles de GSH-Px se evaluaron mediante kits disponibles en el mercado de acuerdo con las instrucciones del fabricante. Los niveles plasmáticos de inmunoglobulinas (IgG) se midieron en placas de fondo plano de 96 pocillos utilizando kits de cuantificación de inmunoadsorción enzimática (ELISA) de IgG de pollo (Biotechnology, Wuhan, China) de acuerdo con las instrucciones del fabricante.
2.9 Parámetros intestinales
Se recolectaron muestras de duodeno, yeyuno e íleon de un total de 54 aves (9 aves/tratamiento) a los 39 días de edad y se fijaron en formol tamponado al 10% para el análisis histológico como se describe en la referencia (31).
2.10 Expresión génica (muestras hepáticas e íleon)
La abundancia de ARN y ARNm se extrajo siguiendo el método descrito anteriormente (32). Se recolectó una sección de tejidos hepáticos e ileales (40 mg cada uno) de cada una de las 36 aves (6 aves por tratamiento a los 39 días de edad) y se almacenó en un escudo de ADN/ARN (Zymo, Irvine, CA, Estados Unidos) para preservar la integridad del ARN. El ARN total se extrajo de las muestras y luego se convirtió en ADN complementario (ADNc) para el análisis cuantitativo de PCR. Se utilizó la RT-PCR CUANTITATIVA (QRT-PCR) (Qiagen, Hilden, Alemania) para determinar los niveles de ARNm en muestras hepáticas e íleon. La abundancia relativa de ARNm para cada gen se normalizó a la expresión de GAPDH como un gen de limpieza. Se diseñaron cebadores para los ARNm expresados constitutivamente (Tabla 4). Los niveles de expresión génica se analizaron mediante los 2−ΔΔCT método (33). Los datos se normalizaron a la abundancia media de ARNm en las muestras de control (establecida como un valor de referencia de 1) y se expresaron como cambio de pliegue en relación con el control.
2.11 Análisis estadístico
Los pollitos fueron asignados aleatoriamente a seis tratamientos en un diseño completamente aleatorizado con tres corrales replicados por tratamiento. Cada tratamiento contó con 30 aves, con 10 aves en cada corral replicado. El corral replicado fue considerado la unidad experimental para las variables de rendimiento. Las aves individuales se consideraron la unidad experimental para el análisis de muestras de sangre, tejidos intestinales y expresión génica. El efecto del tratamiento sobre las variables se analizó mediante PROC MIXED en SAS 9.4. Los resultados se presentaron como medias de mínimos cuadrados y la significancia se determinó con un valor de p de <0,05, con una tendencia de la diferencia con un valor de p de <0,10. Las medias se separaron mediante la prueba de rangos múltiples de Tukey.
3 Resultado
3.1 Índices de crecimiento e ingesta de alimento
Durante las semanas 3, 5 y 6, no hubo diferencia significativa en el IF entre el tratamiento con CON y el tratamiento con T1 (p > 0,05; Tabla 5). El IF disminuyó durante las semanas 1 y 2 (11 y 14%, respectivamente, p ≤ 0,05; Tabla 5) en los tratamientos T5 y T2 en comparación con el tratamiento T1. Del mismo modo, la IF fue menor en el tratamiento T5 que en el tratamiento CON (28%, p = 0,02; Tabla 5) durante la semana 4. Durante las semanas 1, 2, 3 y 5, el BWG no difirió entre el tratamiento con CON y el tratamiento con T1 (p > 0,05; Tabla 5). Sin embargo, el peso corporal de los pollos de engorde se incrementó durante la semana 4 (29%, p = 0,04; Tabla 6) en el tratamiento T2 en relación con el pollo de engorde en grupos estresados sin suplementación. El BWG (de los días 35 a 39) disminuyó en los tratamientos con HS en comparación con el tratamiento con CON (p = 0,01; Tabla 5). En cuanto a la FCR, no difirió entre el tratamiento con CON y los tratamientos con HS durante las semanas 1 y 3 del período del experimento (p > 0,05; Tabla 5). Sin embargo, durante la semana 2, el FCR disminuyó en el tratamiento T1 (estrés térmico) en comparación con el tratamiento con CON. La FCR aumentó significativamente durante las semanas 3-6 (29%, p < 0,05; Tabla 5) en el tratamiento con HS (T1) en comparación con el tratamiento con CON. Además, el FCR del pollo de engorde tratado con la planta medicinal (T2, T3, T4 y T5) mejoró en comparación con el tratamiento HS (T1) (p < 0,05; Tabla 5).
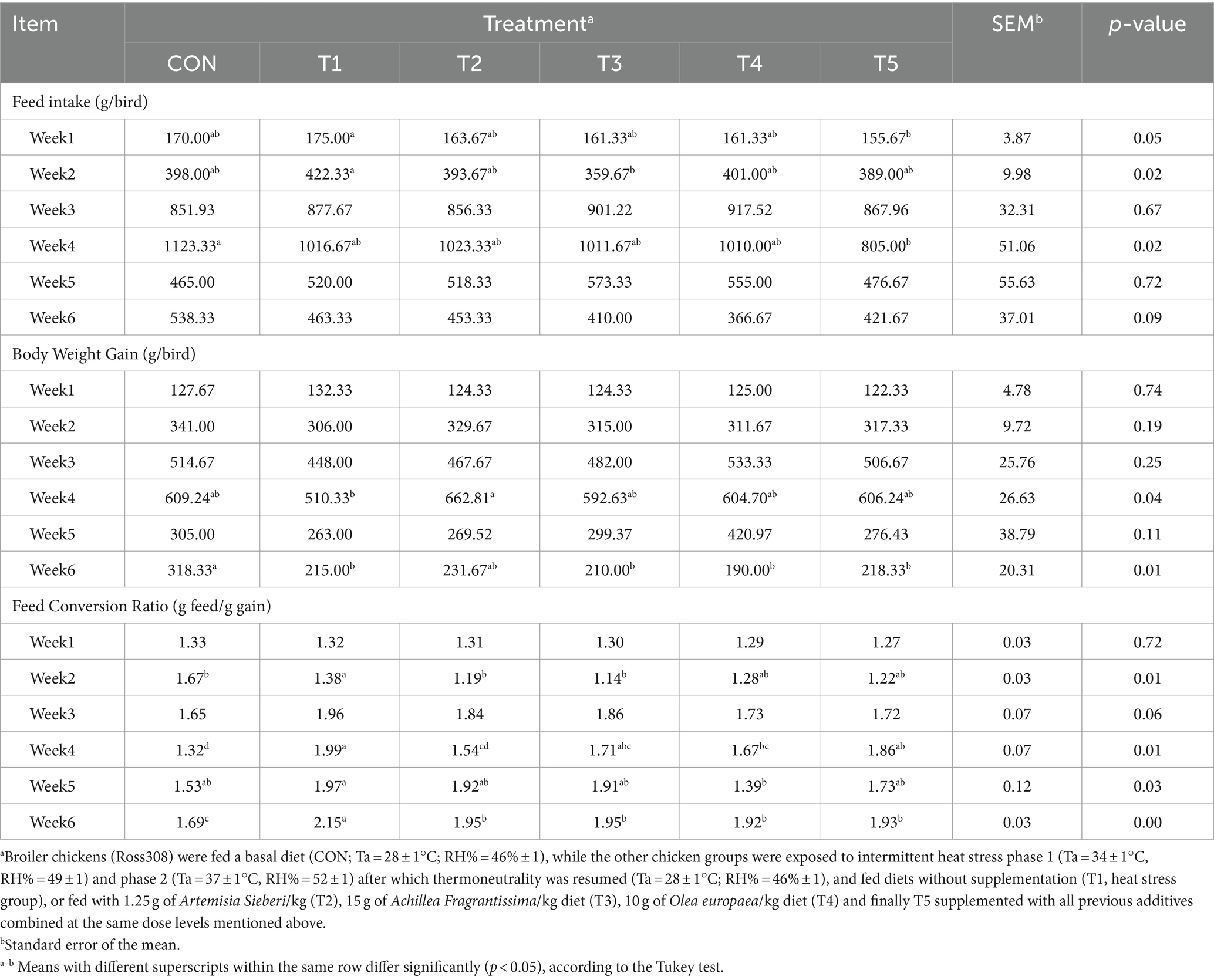 Tabla 5. Consumo medio de alimento, ganancia de peso corporal (BWG) y índice de conversión alimenticia (FCR) de pollos de engorde tratados con diferentes tipos de plantas medicinales en condiciones de estrés térmico.
Tabla 5. Consumo medio de alimento, ganancia de peso corporal (BWG) y índice de conversión alimenticia (FCR) de pollos de engorde tratados con diferentes tipos de plantas medicinales en condiciones de estrés térmico.
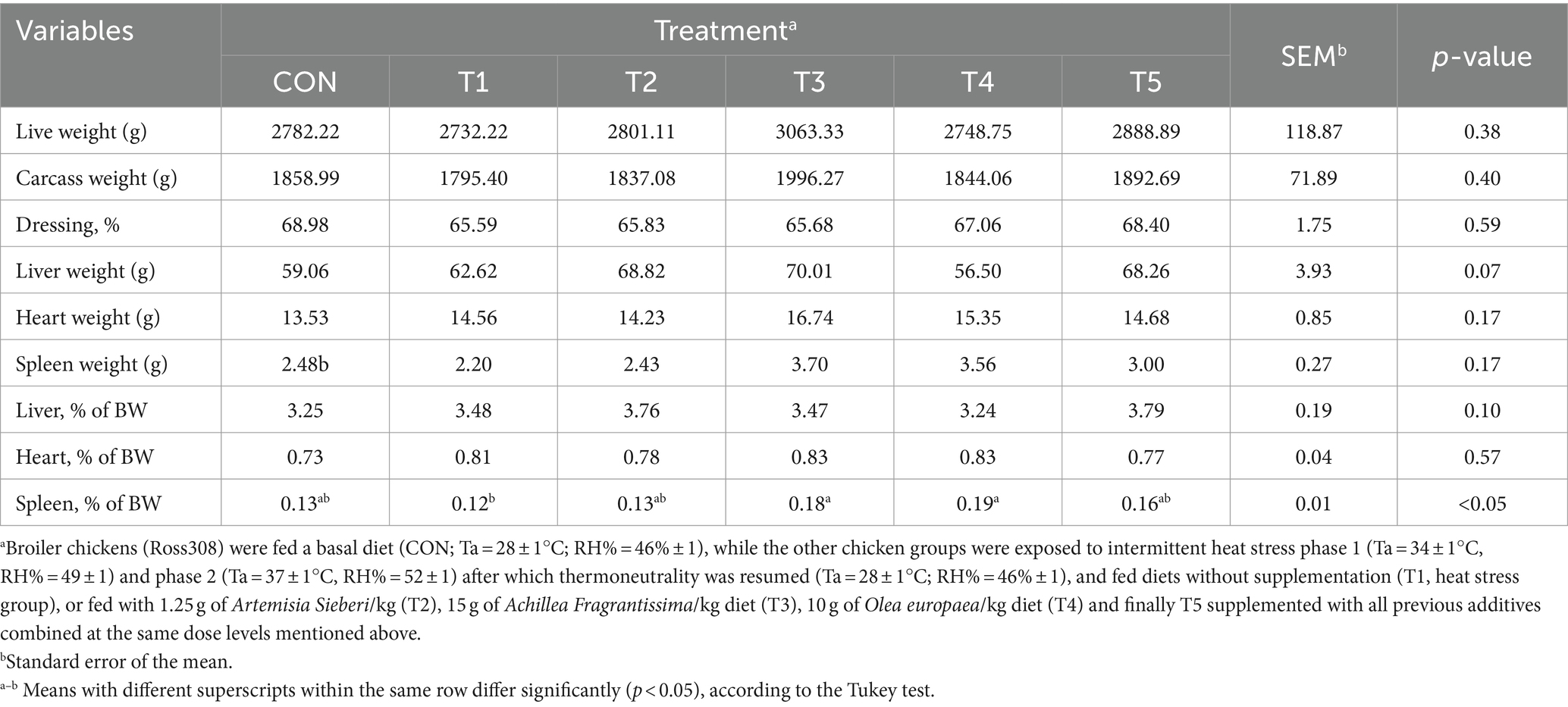 Tabla 6. Cambios en las características de la canal de pollos de engorde en respuesta a la suplementación dietética de varios tipos de plantas medicinales durante condiciones de estrés por calor.
Tabla 6. Cambios en las características de la canal de pollos de engorde en respuesta a la suplementación dietética de varios tipos de plantas medicinales durante condiciones de estrés por calor.
3.2 Características de la canal
En el día 39, las características de la canal como el peso de la canal (g), el porcentaje de aderezo, el peso cardíaco (g), el peso hepático (g), el peso del bazo (g), el porcentaje cardíaco y el porcentaje hepático no mostraron diferencias significativas entre el tratamiento con CON y los tratamientos con HS (T1) (p > 0,05; Tabla 6). El porcentaje de bazo fue mayor en los tratamientos T3 y T4 (50 y 58%, respectivamente, p < 0,05; Tabla 6) que el grupo de estrés térmico no tratado (T2).
3.3 Respuestas fisiológicas
Durante la HS intermitente (Ta = 34,50 ± 0,05°C, HR% = 49,23 ± 0,21), tanto la temperatura rectal como la frecuencia respiratoria se incrementaron significativamente en el tratamiento HS (T1) en comparación con los otros grupos (p < 0,05; Figura 1A). Por el contrario, todas las plantas medicinales suplementadas disminuyeron significativamente la temperatura rectal y las tasas respiratorias (Figura 1B) del pollo de engorde. La temperatura rectal fue menor en los pollos de engorde que recibieron los tratamientos T4 y T5 que en los tratamientos T2 y T3 (p < 0,05). Todos los aditivos alimentarios suplementados redujeron las tasas de respiración, pero estos valores siguen estando por encima de los valores del grupo CON (p < 0,05).
3.4 Parámetros sanguíneos
En el día 39, los niveles séricos de cortisol no difirieron entre los tratamientos CON y T1 (p > 0,05; Tabla 7). Sin embargo, los niveles de inmunoglobulina G se incrementaron en un 0,55% (p < 0,05; Tabla 7) en el tratamiento T4 en comparación con el tratamiento T1 (grupo con estrés térmico). Los niveles de glutatión peroxidasa circulante aumentaron significativamente (p < 0,05; Tabla 7) en los grupos T5 y T3 en comparación con el grupo de pollos de engorde estresados.
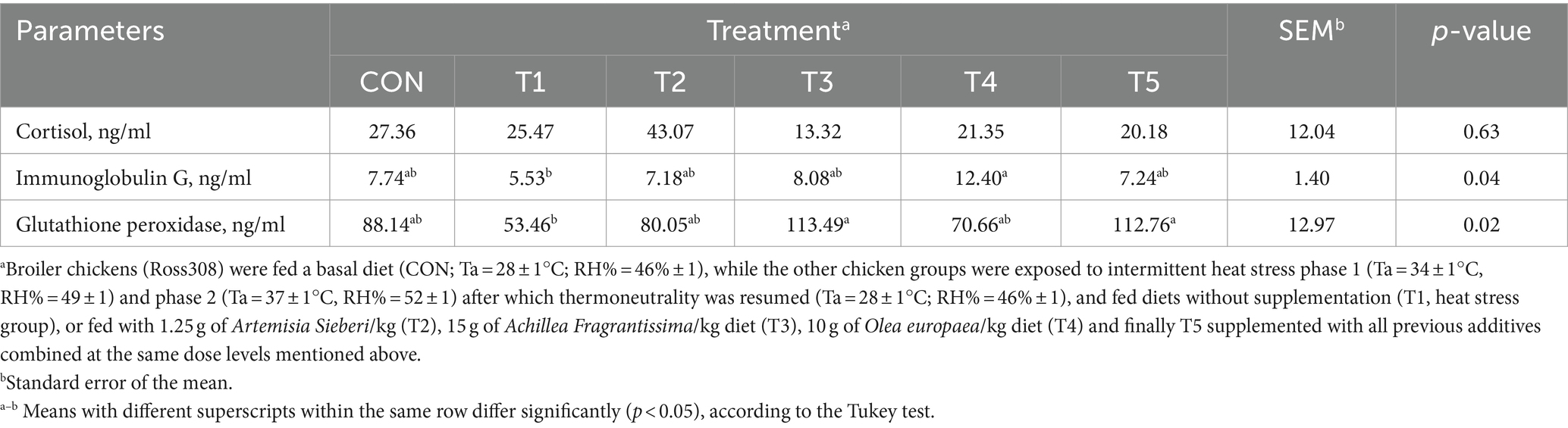 Tabla 7. Cambios en el cortisol sérico, las inmunoglobulinas G y la glutatión peroxidasa de pollos de engorde en respuesta a la suplementación dietética de varios tipos de plantas medicinales durante condiciones de estrés por calor.
Tabla 7. Cambios en el cortisol sérico, las inmunoglobulinas G y la glutatión peroxidasa de pollos de engorde en respuesta a la suplementación dietética de varios tipos de plantas medicinales durante condiciones de estrés por calor.
3.5 Parámetros intestinales
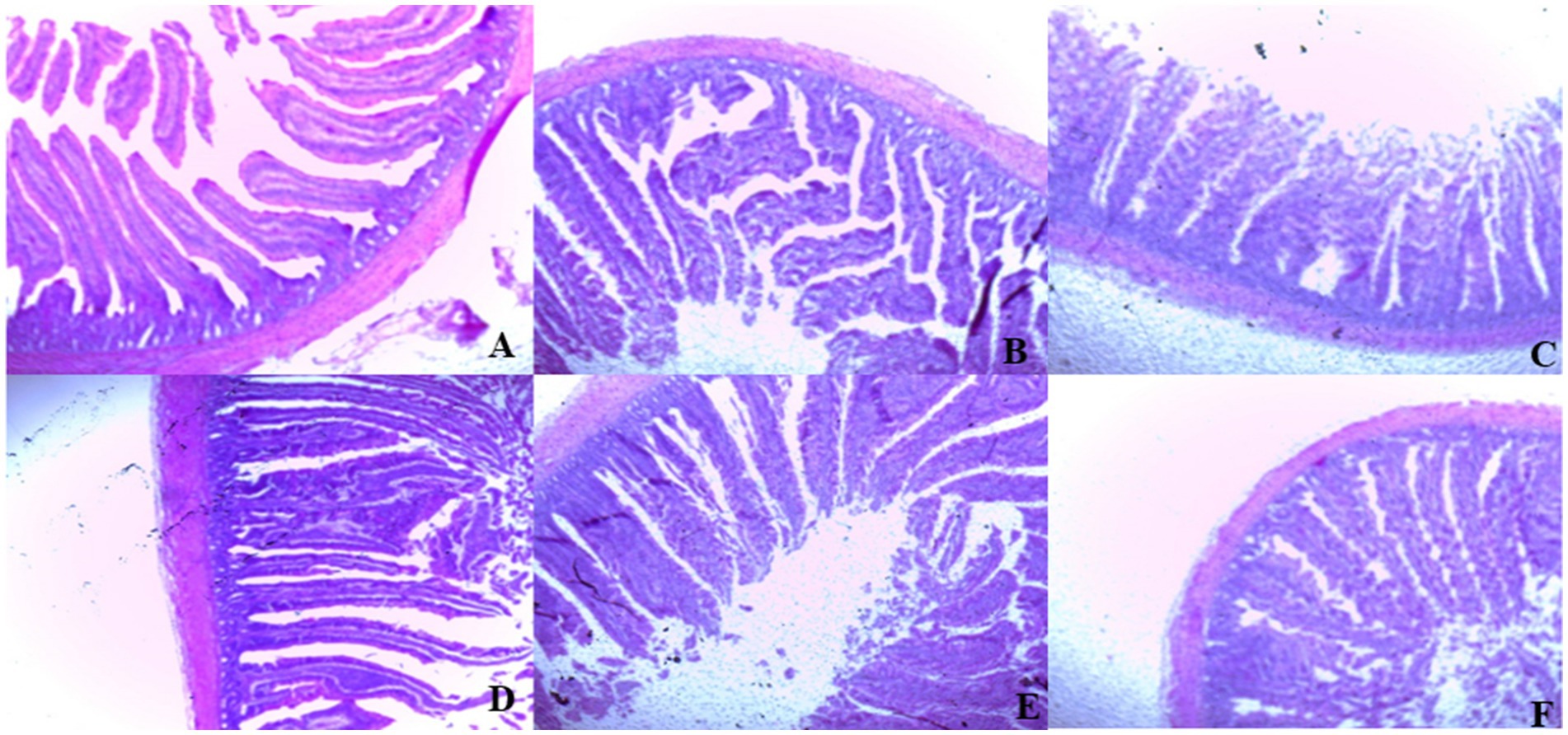
En el día 39, el tratamiento con T3 aumentó significativamente la altura de las vellosidades en el duodeno en comparación con el tratamiento con T1 (p < 0,01; Tabla 8). En el yeyuno, tanto el tratamiento T4 como el T3 condujeron a una mayor altura de las vellosidades que el grupo estresado (T1; p < 0,01). Sin embargo, en el íleon, la altura de las vellosidades disminuyó en los tratamientos T4 y T5 en comparación con el tratamiento T1 (p < 0,01; Tabla 8). Además, el tratamiento con T2 aumentó la profundidad de las vellosidades en el duodeno en comparación con el tratamiento con T1 (p < 0,01). En el yeyuno, la altura de las vellosidades disminuyó en el tratamiento T4 y T1 (p < 0,01), mientras que en el íleon, la profundidad de las vellosidades disminuyó en el tratamiento T4 en comparación con CON (p < 0,01). Además, los tratamientos T3 y T4 aumentaron la superficie de vellosidades en el duodeno en comparación con el tratamiento T1 (p < 0,01; Tabla 8). En el íleon, el tratamiento con T4 resultó en un aumento de la superficie de las vellosidades en comparación con el tratamiento con T1 (p < 0,01). Las figuras 2 a 4 ilustran los efectos perjudiciales de la HS sobre la estructura de las vellosidades en T1 en comparación con el duodeno, el yeyuno y el íleon de la CON. Sin embargo, los tratamientos con plantas medicinales mostraron un daño mínimo en las puntas de las vellosidades en comparación con el tratamiento con T1.
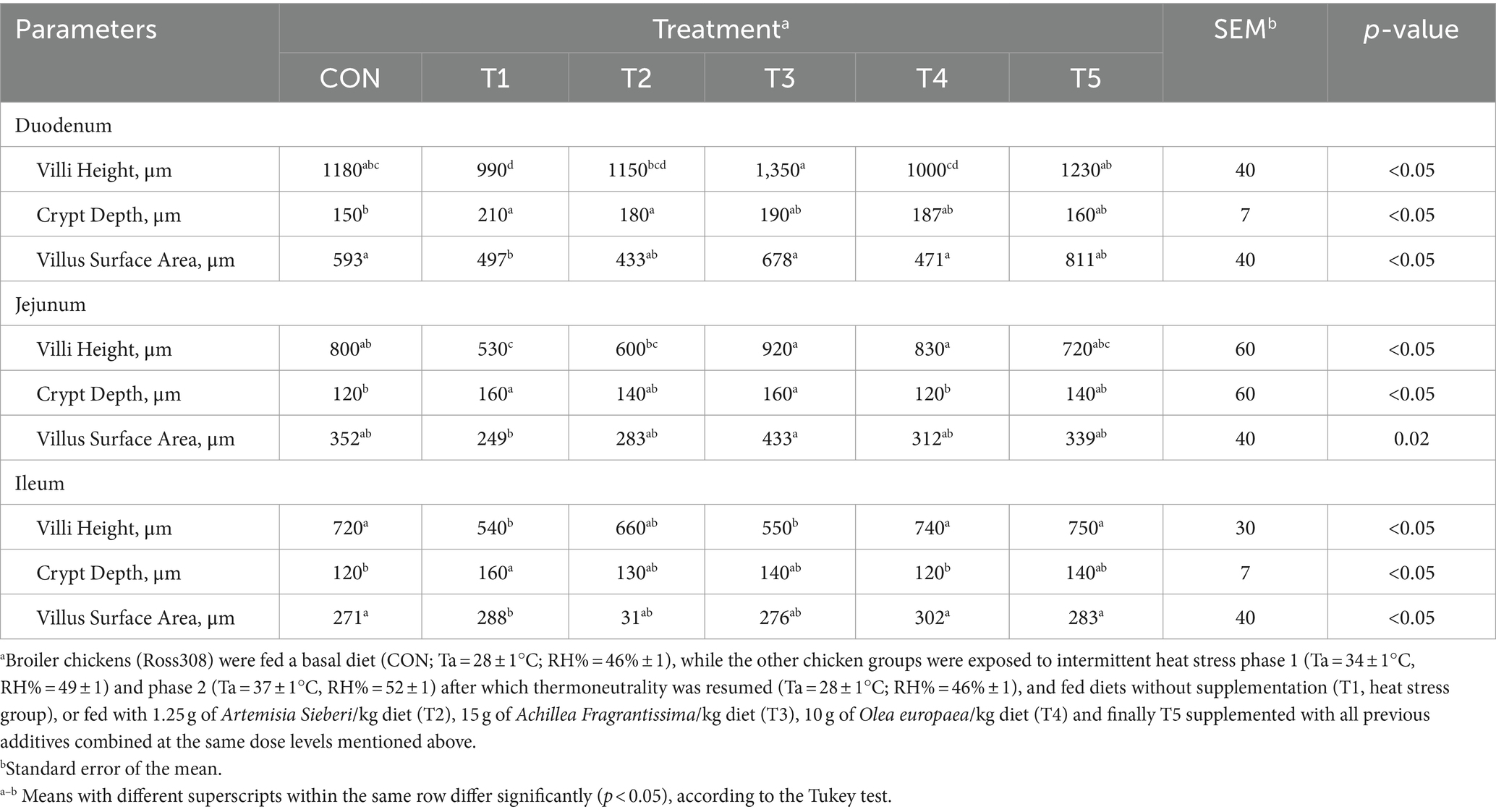 Tabla 8. Cambios en la morfología intestinal de pollos de engorde en respuesta a la suplementación dietética de varios tipos de plantas medicinales durante condiciones de estrés por calor.
Tabla 8. Cambios en la morfología intestinal de pollos de engorde en respuesta a la suplementación dietética de varios tipos de plantas medicinales durante condiciones de estrés por calor.
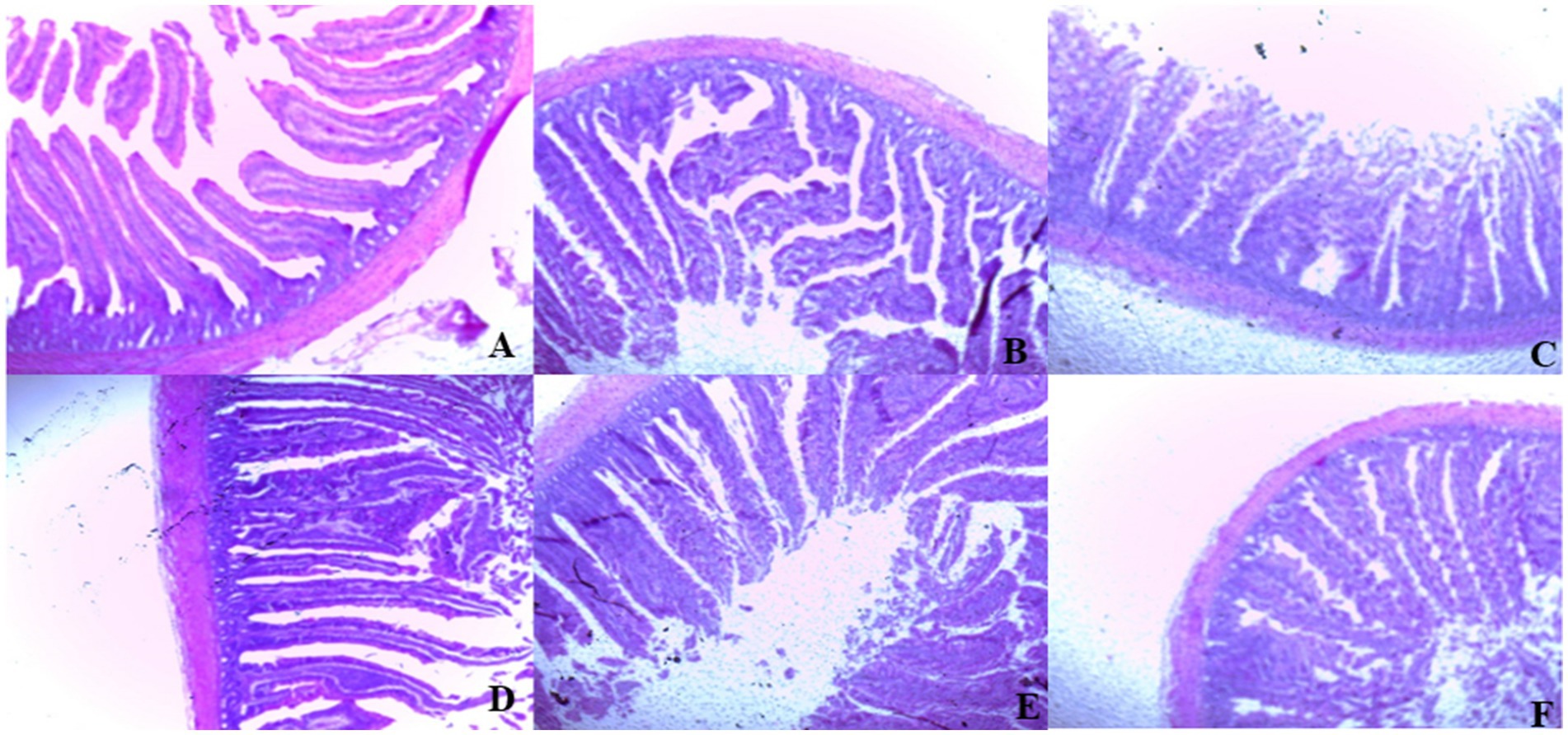 Figura 2. (De la A a la F) Cambios en la morfología del duodeno en todos los grupos experimentales. Los pollos de engorde fueron alimentados con una dieta basal (A; CONTRA; Ta = 28 ± 1°C; % de HR = 46% ± 1), mientras que los otros grupos de pollos fueron expuestos a estrés térmico intermitente en la fase 1 (Ta = 34 ± 1 °C, % de humedad relativa = 49 ± 1) y en la fase 2 (Ta = 37 ± 1 °C, % de humedad relativa = 52 ± 1) tras lo cual se reanudó la termoneutralidad (Ta = 28 ± 1 °C; HR% = 46% ± 1), y alimentados con dietas sin suplementación (B; T1, grupo de estrés térmico), o alimentado con 1,25 g de Artemisia Sieberi/kg de dieta (T2; C), 15 g de Achillea Fragrantissima/kg de dieta (T3; D), 10 g de Olea europaea/kg de dieta (T4; E) y, por último, T5 (F) suplementado con todos los aditivos anteriores combinados a los mismos niveles de dosis mencionados anteriormente. 2Error estándar de la media. A–B Las medias con diferentes superíndices dentro de una misma fila difieren significativamente (p < 0,05), según la prueba de Tukey.
Figura 2. (De la A a la F) Cambios en la morfología del duodeno en todos los grupos experimentales. Los pollos de engorde fueron alimentados con una dieta basal (A; CONTRA; Ta = 28 ± 1°C; % de HR = 46% ± 1), mientras que los otros grupos de pollos fueron expuestos a estrés térmico intermitente en la fase 1 (Ta = 34 ± 1 °C, % de humedad relativa = 49 ± 1) y en la fase 2 (Ta = 37 ± 1 °C, % de humedad relativa = 52 ± 1) tras lo cual se reanudó la termoneutralidad (Ta = 28 ± 1 °C; HR% = 46% ± 1), y alimentados con dietas sin suplementación (B; T1, grupo de estrés térmico), o alimentado con 1,25 g de Artemisia Sieberi/kg de dieta (T2; C), 15 g de Achillea Fragrantissima/kg de dieta (T3; D), 10 g de Olea europaea/kg de dieta (T4; E) y, por último, T5 (F) suplementado con todos los aditivos anteriores combinados a los mismos niveles de dosis mencionados anteriormente. 2Error estándar de la media. A–B Las medias con diferentes superíndices dentro de una misma fila difieren significativamente (p < 0,05), según la prueba de Tukey.
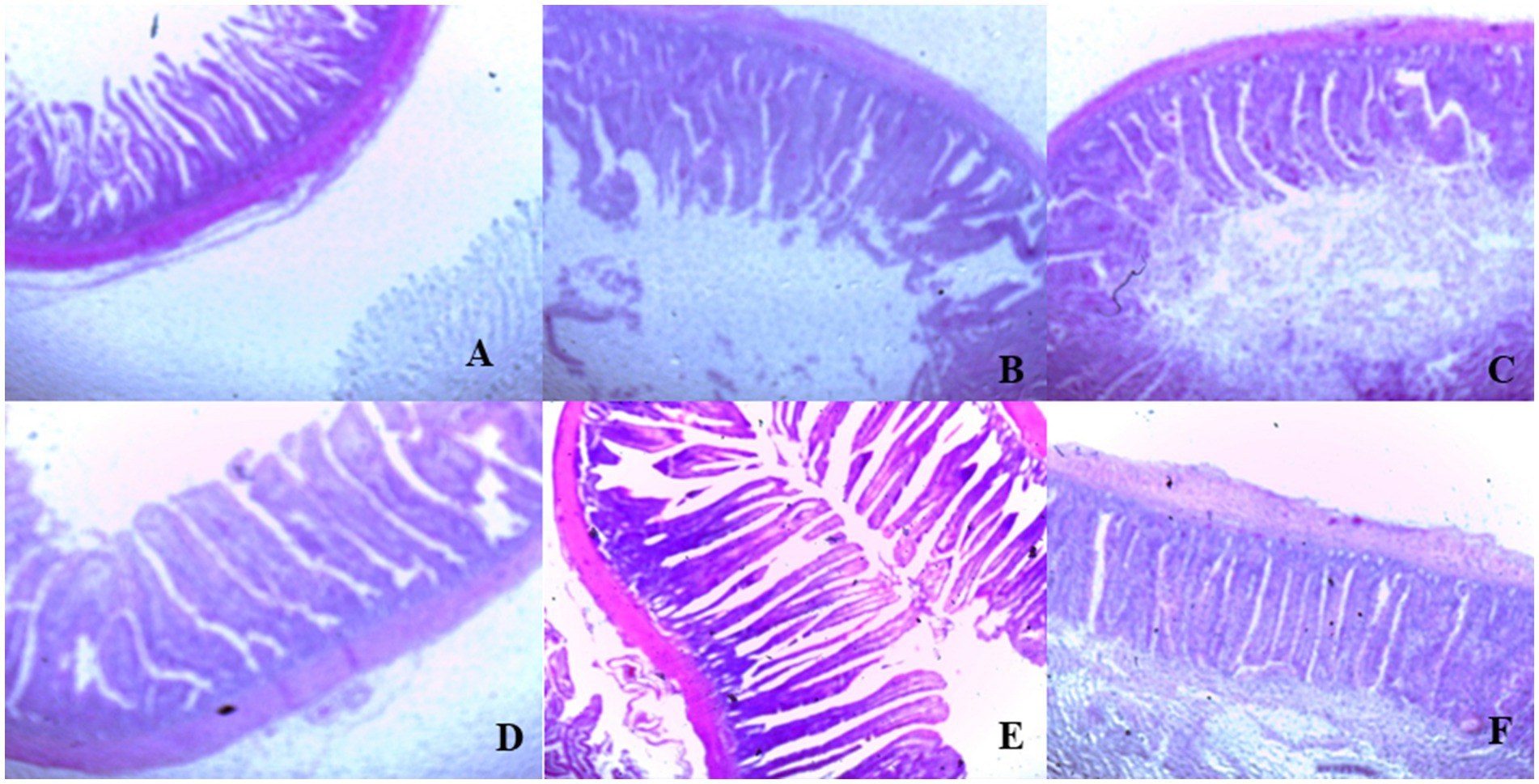 Figura 3. (De la A a la F) Cambios en la morfología del yeyuno en todos los grupos experimentales. Los pollos de engorde fueron alimentados con una dieta basal (A; CONTRA; Ta = 28 ± 1°C; % de HR = 46% ± 1), mientras que los otros grupos de pollos fueron expuestos a estrés térmico intermitente en la fase 1 (Ta = 34 ± 1 °C, % de humedad relativa = 49 ± 1) y en la fase 2 (Ta = 37 ± 1 °C, % de humedad relativa = 52 ± 1) tras lo cual se reanudó la termoneutralidad (Ta = 28 ± 1 °C; HR% = 46% ± 1), y alimentados con dietas sin suplementación (B; T1, grupo de estrés térmico), o alimentado con 1,25 g de Artemisia Sieberi/kg de dieta (T2; C), 15 g de Achillea Fragrantissima/kg de dieta (T3; D), 10 g de Olea europaea/kg de dieta (T4; E) y, por último, T5 (F) suplementado con todos los aditivos anteriores combinados a los mismos niveles de dosis mencionados anteriormente.
Figura 3. (De la A a la F) Cambios en la morfología del yeyuno en todos los grupos experimentales. Los pollos de engorde fueron alimentados con una dieta basal (A; CONTRA; Ta = 28 ± 1°C; % de HR = 46% ± 1), mientras que los otros grupos de pollos fueron expuestos a estrés térmico intermitente en la fase 1 (Ta = 34 ± 1 °C, % de humedad relativa = 49 ± 1) y en la fase 2 (Ta = 37 ± 1 °C, % de humedad relativa = 52 ± 1) tras lo cual se reanudó la termoneutralidad (Ta = 28 ± 1 °C; HR% = 46% ± 1), y alimentados con dietas sin suplementación (B; T1, grupo de estrés térmico), o alimentado con 1,25 g de Artemisia Sieberi/kg de dieta (T2; C), 15 g de Achillea Fragrantissima/kg de dieta (T3; D), 10 g de Olea europaea/kg de dieta (T4; E) y, por último, T5 (F) suplementado con todos los aditivos anteriores combinados a los mismos niveles de dosis mencionados anteriormente.
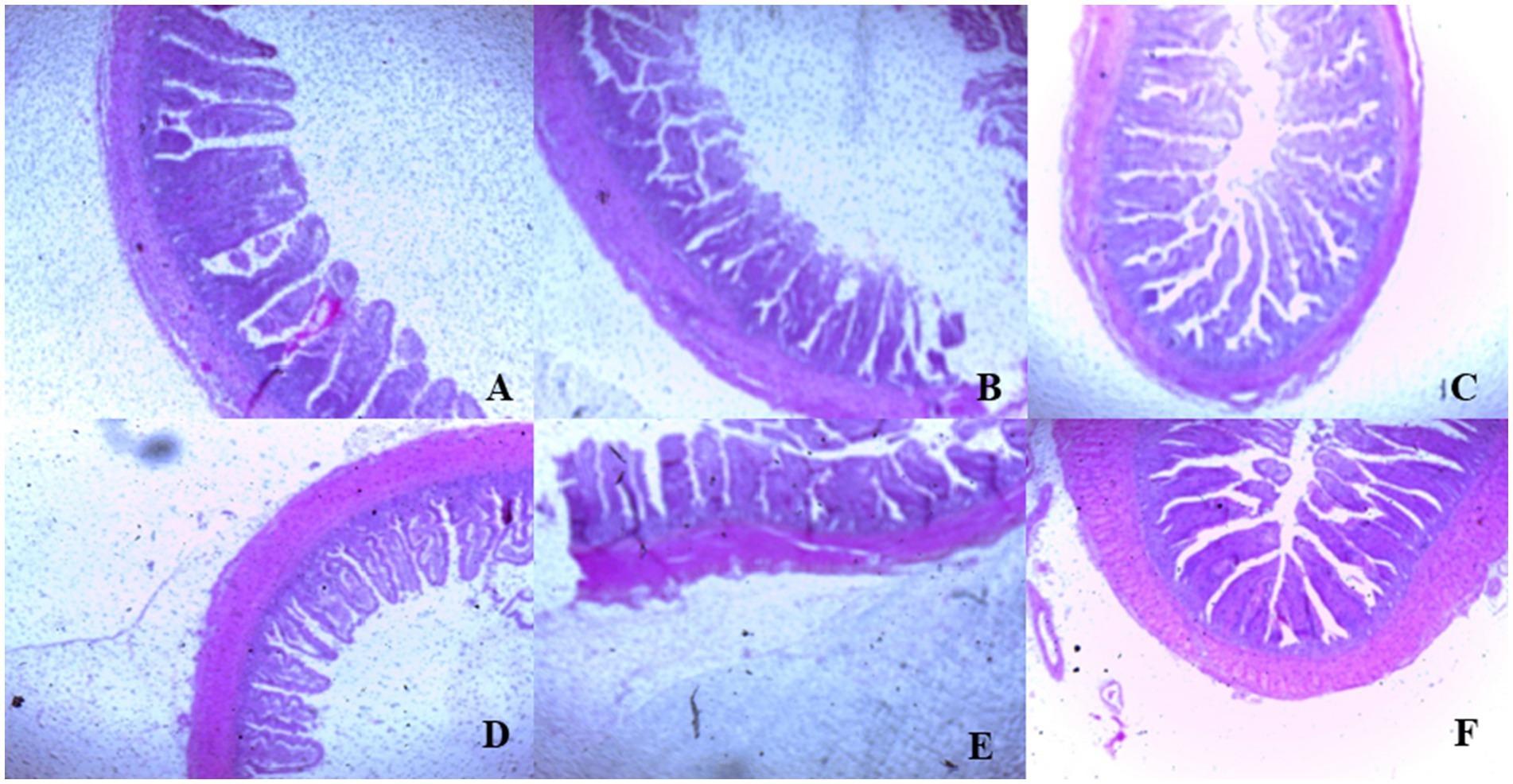 Figura 4. (De la A a la F) Cambios en la morfología del íleon en todos los grupos experimentales. Los pollos de engorde fueron alimentados con una dieta basal (A; CONTRA; Ta = 28 ± 1°C; % de HR = 46% ± 1), mientras que los otros grupos de pollos fueron expuestos a estrés térmico intermitente en la fase 1 (Ta = 34 ± 1 °C, % de humedad relativa = 49 ± 1) y en la fase 2 (Ta = 37 ± 1 °C, % de humedad relativa = 52 ± 1) tras lo cual se reanudó la termoneutralidad (Ta = 28 ± 1 °C; HR% = 46% ± 1), y alimentados con dietas sin suplementación (B; T1, grupo de estrés térmico), o alimentado con 1,25 g de Artemisia Sieberi/kg de dieta (T2; C), 15 g de Achillea Fragrantissima/kg de dieta (T3; D), 10 g de Olea europaea/kg de dieta (T4; E) y, por último, T5 (F) suplementado con todos los aditivos anteriores combinados a los mismos niveles de dosis mencionados anteriormente.
Figura 4. (De la A a la F) Cambios en la morfología del íleon en todos los grupos experimentales. Los pollos de engorde fueron alimentados con una dieta basal (A; CONTRA; Ta = 28 ± 1°C; % de HR = 46% ± 1), mientras que los otros grupos de pollos fueron expuestos a estrés térmico intermitente en la fase 1 (Ta = 34 ± 1 °C, % de humedad relativa = 49 ± 1) y en la fase 2 (Ta = 37 ± 1 °C, % de humedad relativa = 52 ± 1) tras lo cual se reanudó la termoneutralidad (Ta = 28 ± 1 °C; HR% = 46% ± 1), y alimentados con dietas sin suplementación (B; T1, grupo de estrés térmico), o alimentado con 1,25 g de Artemisia Sieberi/kg de dieta (T2; C), 15 g de Achillea Fragrantissima/kg de dieta (T3; D), 10 g de Olea europaea/kg de dieta (T4; E) y, por último, T5 (F) suplementado con todos los aditivos anteriores combinados a los mismos niveles de dosis mencionados anteriormente.
3.6 Expresión génica
La abundancia de ARNm para IL-8 se incrementó en el tejido del íleon del pollo de engorde estresado (grupo T1) en comparación con otros tratamientos (p < 0,05; Figura 5A). No hubo diferencias significativas en los niveles de ARNm de IL-8 en los tratamientos T2, T3, T4 y T5 en relación con el tratamiento con CON (p > 0,05). La abundancia de ARNm para el gen OCLN tendió a ser significativa en el tejido del íleon del tratamiento estresado (grupo T1) en comparación con el tratamiento CON (p > 0,05; Figura 5B). La abundancia de ARNm para OCLN en el tejido del íleon de los tratamientos T5 y T4 fue similar a la del tratamiento con CON (p < 0,05; Figura 5B). La abundancia de ARNm para HSP70 tendió a aumentar en el tejido hepático del grupo T1 en comparación con el tratamiento con CON (p < 0,05; Figura 5C). La abundancia de ARNm para HSP70 tendió a disminuir en el tejido hepático de los tratamientos T2 y T4 en comparación con el tratamiento T1 (p < 0,05; Figura 5C). No hubo diferencias significativas en el ARNm en el tejido hepático de los tratamientos T3 y T4 en relación con el tratamiento T1 (p > 0,05; Figura 5C).
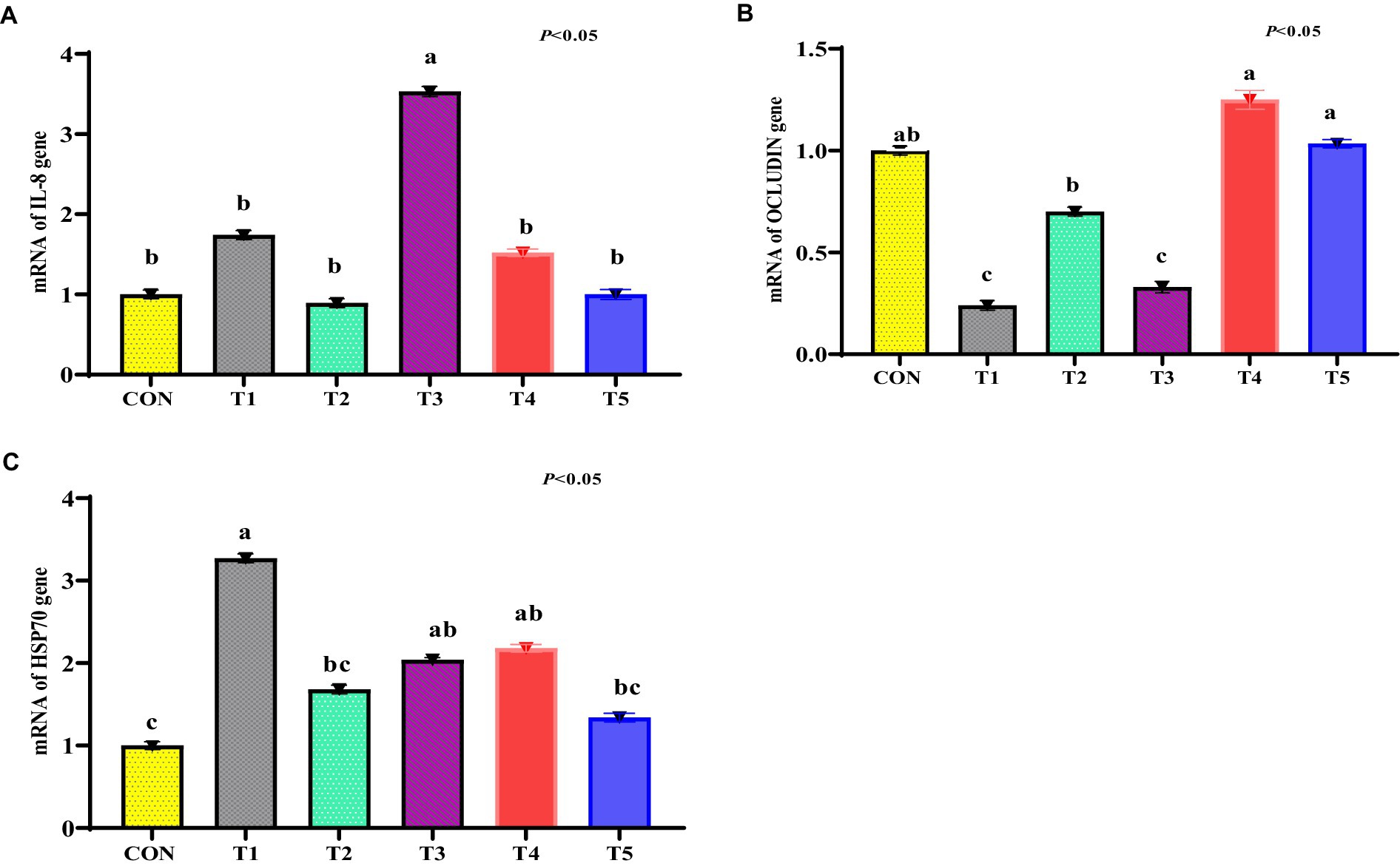 Figura 5. (De la A a la C) Expresión de interleucina-8 (IL-8; A), ocludina (OCLN; B) y los genes HSP70 (C) en el tejido del íleon de pollos de engorde desafiados por calor tratados con diversas plantas medicinales dietéticas. Los pollos de engorde (Ross308) fueron alimentados con una dieta basal (CON; Ta = 28 ± 1°C; % de HR = 46% ± 1), mientras que los otros grupos de pollos fueron expuestos a estrés térmico intermitente en la fase 1 (Ta = 34 ± 1 °C, % de humedad relativa = 49 ± 1) y en la fase 2 (Ta = 37 ± 1 °C, % de humedad relativa = 52 ± 1) tras lo cual se reanudó la termoneutralidad (Ta = 28 ± 1 °C; HR% = 46% ± 1), y alimentado con dietas sin suplementación (T1, grupo de estrés térmico), o alimentado con 1,25 g de Artemisia Sieberi/kg de dieta (T2), 15 g de Achillea Fragrantissima/kg de dieta (T3), 10 g de Olea europaea/kg de dieta (T4) y finalmente T5 suplementado con todos los aditivos anteriores combinados a los mismos niveles de dosis mencionados anteriormente. 2Error estándar de la media. A–B Las medias con diferentes superíndices dentro de una misma fila difieren significativamente (p < 0,05), según la prueba de Tukey.
Figura 5. (De la A a la C) Expresión de interleucina-8 (IL-8; A), ocludina (OCLN; B) y los genes HSP70 (C) en el tejido del íleon de pollos de engorde desafiados por calor tratados con diversas plantas medicinales dietéticas. Los pollos de engorde (Ross308) fueron alimentados con una dieta basal (CON; Ta = 28 ± 1°C; % de HR = 46% ± 1), mientras que los otros grupos de pollos fueron expuestos a estrés térmico intermitente en la fase 1 (Ta = 34 ± 1 °C, % de humedad relativa = 49 ± 1) y en la fase 2 (Ta = 37 ± 1 °C, % de humedad relativa = 52 ± 1) tras lo cual se reanudó la termoneutralidad (Ta = 28 ± 1 °C; HR% = 46% ± 1), y alimentado con dietas sin suplementación (T1, grupo de estrés térmico), o alimentado con 1,25 g de Artemisia Sieberi/kg de dieta (T2), 15 g de Achillea Fragrantissima/kg de dieta (T3), 10 g de Olea europaea/kg de dieta (T4) y finalmente T5 suplementado con todos los aditivos anteriores combinados a los mismos niveles de dosis mencionados anteriormente. 2Error estándar de la media. A–B Las medias con diferentes superíndices dentro de una misma fila difieren significativamente (p < 0,05), según la prueba de Tukey.
4 Discusión
Este estudio tuvo como objetivo evaluar los efectos de la suplementación dietética con plantas medicinales en pollos de engorde durante la HS intermitente. Se evaluaron parámetros de rendimiento como BWG, FI, FCR, características de la canal, temperatura rectal, frecuencia respiratoria, parámetros sanguíneos (cortisol, inmunoglobulinas y glutatión peroxidasa), expresión de los genes HSP70, IL-8 y OCLN, e histología intestinal. Varios experimentos han investigado el impacto de las altas temperaturas ambientales en el rendimiento y la salud de los pollos de engorde. En este experimento, los pollos de engorde tratados con plantas medicinales mostraron un ligero aumento de la FI (excepto por la mezcla de grupos de hierbas; T5) en comparación con el tratamiento estresado. También mostraron un aumento de BWG cuando se trataron con Artemisia Sieberi y una mejora de la FCR en todos los tratamientos con plantas medicinales en comparación con el tratamiento con CON/HS. Estos resultados de rendimiento son consistentes con otros estudios (4, 15, 27, 34–36) que han reportado mejoras en FI, BWG y FCR de pollos de engorde suplementados con plantas medicinales en sus dietas en condiciones de HS. Una explicación plausible para el aumento en el rendimiento del crecimiento en pollos de engorde alimentados con plantas medicinales podría atribuirse a los compuestos biológicos presentes en las plantas medicinales que mejoran el estado antioxidante y el metabolismo de proteínas y grasas (37). Este experimento también informa que no se observaron diferencias en los rasgos de la canal entre los tratamientos, excepto por un aumento en el porcentaje de bazo en Olea Europaea y una mezcla de grupos de hierbas en relación con el grupo de pollos de engorde estresados. De acuerdo con nuestro estudio, Shaker et al. (37) encontraron que la alimentación de pollos de engorde con polvo de hoja de Artemisia absinthium (1,5%) no resultó en cambios significativos en las características de la canal. Chen et al. informaron que el estrés por calor podría reducir la función hepática y otros índices inmunológicos. Ciertos aditivos fitogénicos actúan indirectamente desactivando los radicales libres, lo que ayuda a reducir los efectos negativos y a mantener un sistema inmunológico saludable en los pollos de engorde durante las condiciones de estrés por calor (38, 39). En contraste con nuestros resultados, Vasilopoulou et al. (40) informaron que la adición de un 1% de extracto de hoja de olivo mejoró significativamente la calidad de la carne en pollos de engorde.
Se sabe que los pollos de engorde carecen de glándulas sudoríparas, lo que dificulta la disipación del calor a través de la evaporación (41). Además, sus cuerpos cubiertos de plumas restringen la transferencia de calor a través de la conducción, la radiación y la convección (42, 43). Por lo tanto, el mecanismo principal para la pérdida de calor es el aumento de la frecuencia respiratoria (taquipnea) y la respiración superficial (polipnea), lo que resulta en jadeo, que elimina eficientemente el calor a través de la evaporación del agua del tracto respiratorio (44). La HS intermitente se implementó con éxito como lo indica el aumento de la temperatura rectal y la temperatura rectal en los tratamientos experimentales (45, 46). Curiosamente, los pollos tratados con plantas medicinales mostraron una ligera disminución de Tr y RR en relación con los pollos de engorde mantenidos en condiciones de HS, lo que está en línea con los hallazgos de referencia (47). Los mecanismos responsables de los efectos antioxidantes de las plantas medicinales no están bien definidos. Nuestros resultados son consistentes con la evidencia de la referencia (4) que mencionó que hierbas como la equinácea, el olivo, el ajo, el tomillo y el jengibre tienen acción termorreguladora y beneficios potenciales para reducir la frecuencia respiratoria en las aves de corral debido a sus robustas capacidades antioxidantes. En general, estos hallazgos concuerdan con los reportados por varios autores (48-51). Las modificaciones de las reacciones fenotípicas de las plantas medicinales durante el estrés térmico pueden deberse a diferentes dosis experimentales de suplementación, compuestos bioactivos, cantidades de compuestos fenólicos y flavonoides, y acciones antioxidantes.
El cortisol es una hormona del estrés que desempeña un papel crucial en la respuesta fisiológica a la HS en pollos de engorde. Cuando los pollos de engorde se exponen a altas temperaturas, sus cuerpos inician una respuesta de estrés, que incluye la liberación de cortisol (52). Se ha aceptado que la HS aumenta significativamente los niveles séricos de cortisol en pollos de engorde en comparación con el grupo de control. Curiosamente, los niveles de cortisol en pollos de engorde estresados por calor no fueron significativamente diferentes en comparación con el grupo CON, lo cual es consistente con estudios previos (50, 53). Se ha informado que la exposición de pollos de engorde a 10 h de HS (32 ° C) durante 7 días no afectó sus niveles plasmáticos de cortisol (54). Durante las fases iniciales de la HS, se observó que los niveles plasmáticos de cortisol en pollos de engorde aumentaban, pero volvieron a los niveles normales en 4 días (55). En nuestro estudio, los pollos de engorde expuestos al calor parecían haberse adaptado a las temperaturas elevadas y mantuvieron una concentración regular de corticosterona plasmática incluso después de 19 días de exposición al calor.
GSH-Px es una enzima antioxidante que normalmente se secreta en el cuerpo. Un estudio de referencia (56) encontró que los niveles de GSH-Px en el grupo HS eran más bajos que los del grupo control. Los datos respaldan la idea de que la inclusión de aditivos fitogénicos para piensos con propiedades antioxidantes en las dietas puede ayudar a reducir el daño oxidativo causado por la HS en pollos de engorde (4, 21, 27, 53). Las diferencias en la tolerancia al calor entre estas plantas medicinales durante el estrés térmico pueden deberse a diferentes metabolitos secundarios y sus mecanismos de acción (15, 52).
Un aspecto afectado por el estrés térmico es el sistema inmunitario, incluida la síntesis y función de la inmunoglobulina G (IgG). La IgG es una clase de anticuerpos que desempeña un papel crucial en la respuesta inmunitaria humoral, proporcionando inmunidad pasiva a los pollos de engorde a través de la transferencia materna e inmunidad activa a través de su propia síntesis. Nuestros resultados sugieren que la suplementación de plantas medicinales podría mejorar la liberación de IgG, especialmente en dietas alimentadas con pollos de engorde con Olea europaea (51%), en relación con pollos de engorde del grupo CON. De acuerdo con nuestros datos, un estudio (57) encontró una mejora en el contenido de IgG cuando los pollos de engorde fueron suplementados con Artemisia annua en HS. Otro estudio realizado por El-Kholy et al. (51) reportó que la adición de extractos herbales mejoró la síntesis de IgG. Además, un estudio realizado por Cheng et al. (50) indicó que las hierbas chinas mejoraron la inmunidad en pollos de engorde al promover la síntesis de IgG en el suero. Además, un estudio de referencia (58) informó de que la adición de extracto de hoja de olivo al 1% mejoró significativamente la IgG en pollos de engorde. Una posible explicación de los efectos positivos de las plantas medicinales sobre la IgG puede estar asociada con su papel en la reducción del exceso de citocinas proinflamatorias (IL-8) para mantener un entorno equilibrado de citoquinas mediante la restauración de la integridad del epitelio intestinal después de la HS.
HSP70, un miembro de la familia de las proteínas de choque térmico (HSP), es reconocida como la familia más ampliamente distribuida y conservada evolutivamente entre varios organismos (59). Un aumento en el ARNm de HSP70 se usa comúnmente como un indicador de diversas respuestas de estrés ambiental, incluidas las altas temperaturas como lo indica la referencia (60). Cada vez hay más pruebas que sugieren que la modulación de la HSP70 inducida por el estrés desempeña un papel fundamental en el mantenimiento de un equilibrio entre las citoquinas proinflamatorias y antiinflamatorias, ofreciendo protección contra la inflamación intestinal (61). HS aumentó el nivel de ARNm hepático de HSP70 en un 2,7% en pollos de engorde estresados en relación con el grupo de pollos de engorde termoneutrales (CON). Los pollos de engorde sometidos a estrés térmico tratados con plantas medicinales (Artemisia sieberi, Achillea fragrantissima, Olea europaea y su mezcla) mostraron una disminución en los niveles hepáticos de ARNm de HSP70 en 0,48, 0,37, 0,33 y 0,6%, respectivamente, en comparación con los pollos de engorde estresados.
De manera similar, la curcumina, un polifenol natural, inhibió el aumento en la expresión de HSP70 en pollos de engorde y codornices estresados por calor (56, 62). Además, un estudio de referencia (63) encontró que la suplementación oral a largo plazo de flavangenol, derivado del extracto de corteza de pino, conocido por su abundante contenido de polifenoles y fuertes propiedades antioxidantes, condujo a una reducción en la expresión de ARNm de HSP70 en los hígados de pollos de engorde que experimentaron HS. Las plantas medicinales exhiben múltiples mecanismos para sus efectos oxidativos, incluyendo la capacidad de eliminación de radicales y la sinergia con otros antioxidantes, como se discutió en investigaciones previas (64).
La ocludina, una proteína integral dentro de las uniones estrechas de las células intestinales, desempeña un papel crucial en la creación de barreras selectivas que regulan el transporte paracelular (57). El deterioro de las uniones estrechas da lugar a un aumento de la permeabilidad paracelular del contenido intestinal, lo que se reconoce como un sello distintivo de diversas condiciones patológicas (65).
HS disminuyó la abundancia de ARNm de OCLN en el íleon en grupos de pollos de engorde estresados (T1) en relación con los pollos de engorde CON. Un estudio previo (57) observó una disminución en la expresión génica de las proteínas ocludinas en la mucosa yeyunal de pollos de engorde estresados por calor. De manera similar, los pollos de engorde expuestos a HS cíclico mostraron una disminución en la abundancia de ARNm de OCLN en la mucosa yeyunal a los 21 días y una disminución en la abundancia de ARNm de OCLN tanto en la mucosa yeyunal como en la ileal a los 42 días. Estos hallazgos, junto con una morfología intestinal comprometida, sugieren que la HS cíclica puede alterar la integridad de la barrera intestinal (64, 65). Por el contrario, los pollos de engorde sometidos a estrés térmico tratados con las plantas medicinales utilizadas en este estudio, especialmente Olea europaea, y su mezcla de plantas medicinales investigadas mostraron un aumento en la abundancia de ARNm de íleon de OCLN en comparación con los pollos de engorde estresados.
Una posible explicación para este fenómeno podría ser que el aumento de esta proteína indica un efecto de mejora de la barrera durante la HS (52) como mecanismo compensatorio para el aumento de la permeabilidad. Esta idea está respaldada por datos que muestran que la expresión de HSPs inducida por calor es necesaria para la expresión de OCLN (57, 66). Autores anteriores encontraron que HS redujo los niveles de proteína de OCLN en el yeyuno en comparación con la zona termoneutral (57, 66). Además, la suplementación con Artemisia aumentó significativamente los niveles de expresión de ARNm de OCLN ileal en respuesta a HS, lo que sugiere que Artemisia podría mejorar la función de barrera intestinal (57). Un estudio de referencia (67) demostró que la exposición al calor aumentaba significativamente la expresión de ARNm de citoquinas proinflamatorias como la IL-8 en el íleon del pollo, como se indica en la investigación actual. La HS aumentó la abundancia de ARNm de IL-8 en pollos de engorde estresados en comparación con los pollos de engorde control. Como era de esperar, los pollos de engorde tratados con plantas medicinales (Artemisia sieberi y una mezcla de hierbas) mostraron una disminución de la abundancia de ARNm de IL-8 en comparación con los pollos de engorde estresados. Estos resultados pueden indicar los efectos antiinflamatorios de las hierbas utilizadas para aliviar los efectos negativos de la HS en varios animales, según lo informado por varios autores (7, 68, 69). Numerosos estudios han proporcionado evidencia de que la HS puede conducir a la disfunción intestinal (70, 71). Se ha observado que la HS causa una disminución en la calidad de la morfología intestinal, caracterizada por un deterioro de la arquitectura de las vellosidades, una altura reducida de las vellosidades y una disminución de la superficie de las vellosidades (71). Estas alteraciones en la estructura intestinal, como vellosidades más cortas y criptas más profundas, se han asociado con una absorción de nutrientes comprometida, un aumento de la secreción de electrolitos y agua en el tracto gastrointestinal y, posteriormente, una reducción del rendimiento (57). La suplementación con plantas o hierbas medicinales ha mostrado mejoría en ciertos aspectos morfológicos de los tejidos intestinales. Específicamente, el tratamiento con plantas medicinales se ha asociado con un aumento de la altura de las vellosidades, la profundidad de las criptas y el área de la superficie de las vellosidades (72, 73). La mejora de la integridad intestinal observada con la suplementación con plantas medicinales puede atribuirse a su papel en la promoción de la proliferación de células intestinales (74).
5 Conclusión
La suplementación de pollos de engorde con plantas medicinales dietéticas durante los desafíos de HS puede mejorar su estado antioxidante y sus respuestas antiinflamatorias. La mejora de la tolerancia al calor en los pollos de engorde tratados con plantas medicinales conduce a un aumento del potencial antioxidante en los pollos de engorde estresados por el calor. Observamos mejoras en los niveles de GSH-Px e IgG, una disminución en los niveles hepáticos de ARNm de HSP70, un aumento en los niveles de OCLN de ARNm de íleon y una disminución en los niveles de ARNm de IL-8. Estas respuestas contribuyen a mejorar el tracto gastrointestinal al aumentar la altura y la superficie de las vellosidades al tiempo que disminuyen la profundidad de las criptas.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética Animal del decanato de investigación científica de la Universidad de Jordania (Ammán, Jordania). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
ZM: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Software, Supervisión, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. MA: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Software, Supervisión, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. AA: Escritura – borrador original, Escritura – revisión y edición. MA-Q: Escritura – borrador original, Escritura – revisión y edición. MA-M: Escritura – borrador original, Escritura – revisión y edición. HA-T: Escritura – borrador original, Escritura – revisión y edición. HZ: Redacción – borrador original, Redacción – revisión y edición. AA-F: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Software, Supervisión, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Los autores desean expresar su más profundo agradecimiento al Decanato de Investigación Científica de la Universidad de Jordania (subvención n.º 146/2022/2023) y al Centro Nacional de Investigación y Desarrollo/Consejo Superior de Ciencia y Tecnología (subvención n.º 4/4/3/401) por su apoyo financiero para llevar a cabo esta investigación.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Li, J, Wang, X, Sun, A, Li, H, Luo, Y, He, F, et al. Análisis transcriptómico comparativo de espermatozoides de toros Xiangxi y Simmental bajo estrés térmico: implicaciones para la predicción de la fertilidad. Pak Vet J. (2023) 43:184–8. doi: 10.29261/pakvetj/2022.083
2. Chang, Q, Zhou, H, Khan, N y Ma, J. ¿Puede el cambio climático aumentar la propagación de enfermedades animales? Evidencia de 278 aldeas en China. Atmos. (2023) 14:1581. doi: 10.3390/atmos14101581
3. Hussain, K, Abbas, A, Alanazi, HAH, Alharbi, AMA, Alaiiri, AA, Rehman, A, et al. Efectos inmunomoduladores del extracto de Artemisia brevifolia contra la coccidiosis inducida experimentalmente en pollos de engorde. Pak Vet J. (2023) 43:333–8. doi: 10.29261/pakvetj/2023.026
4. Abd El-Hack, ME, Abdelnour, SA, Taha, AE, Khafaga, AF, Arif, M, Ayasan, T, et al. Hierbas como agentes termorreguladores en aves de corral: una visión general. Sci Total Environ. (2020) 703:134399. doi: 10.1016/j.scitotenv.2019.134399
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Yue, S, Qian, J, Du, J, Liu, X, Xu, H, Liu, H, et al. El estrés por calor influye negativamente en el flujo sanguíneo mamario, la absorción mamaria de aminoácidos y el perfil de aminoácidos de la leche de las vacas lecheras Holstein lactantes. Pak Vet J. (2023) 43:73–8. doi: 10.29261/pakvetj/2023.002
6. Bin-Jumah, M, Abd El-Hack, ME, Abdelnour, SA, Hendy, YA, Ghanem, HA, Alsafy, SA, et al. Uso potencial del cromo para combatir el estrés térmico en animales: una revisión. Sci Total Environ. (2020) 707:135996. doi: 10.1016/j.scitotenv.2019.135996
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Abdelnour, SA, Abd El-Hack, ME, Khafaga, AF, Arif, M, Taha, AE, y Noreldin, AE. Biomarcadores de estrés y alteración proteómica del estrés térmico en rumiantes: una revisión. J Therm Biol. (2019) 79:120–34. doi: 10.1016/j.jtherbio.2018.12.013
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Quintana-Ospina, GA, Alfaro-Wisaquillo, MC, Oviedo-Rondón, EO, Ruiz-Ramírez, JR, Bernal-Arango, LC, y Martínez-Bernal, GD. Efecto de los factores ambientales y asociados a la granja sobre los parámetros de rendimiento vivo de pollos de engorde criados en condiciones tropicales comerciales. Animales. (2023) 13:3312. doi: 10.3390/ani13213312
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Mahasneh, ZMH, Abdelnour, S, Ebrahim, A, Almasodi, AGS, Moustafa, M, Alshaharni, MO, et al. Aceite de oliva y sus derivados para promover el rendimiento, la salud y combatir los efectos del estrés térmico en los pollos de engorde. Poult Sci. (2024) 103:103348. doi: 10.1016/j.psj.2023.103348
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Jorge, AS, y Jorge, AH. Optimización de la producción avícola a través de sistemas avanzados de monitoreo y control. Socios Universal Inter Innov J. (2023) 1:77–97.
11. Khani, M, Fattah, A, Ebrahimi-mahmoudabad, S, y Joezy-Shekalgorabi, S. Impacto de la diferencia entre cationes y aniones en la dieta en la fermentación, digestibilidad y parámetros sanguíneos del rumen en corderos Zandi bajo estrés térmico. Agrobiol Rec. (2023) 12:34–45. doi: 10.47278/journal.abr/2023.015
12. Teyssier, J, Cozannet, P, Greene, E, Dridi, S y Rochell, S. Influencia de diferentes modelos de estrés térmico en la digestibilidad de los nutrientes y marcadores de estrés, inflamación, metabolismo de lípidos y proteínas en pollos de engorde. Poult Sci. (2023) 102:103048. doi: 10.1016/j.psj.2023.103048
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Elbaz, AM, Zaki, EF, Salama, AA, Badri, FB y Thabet, HA. Evaluar la eficacia de diferentes fuentes de aceite para reducir los efectos del estrés térmico ambiental a través de la mejora del rendimiento, las enzimas digestivas, el estado antioxidante y la calidad de la carne. Sci Rep. (2023) 13:20179. doi: 10.1038/s41598-023-47356-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Elnesr, S, y Abdel-Azim, A. El impacto del estrés por calor en la integridad del tracto gastrointestinal de las aves de corral. Laberinto: Fayoum J Sci e Interd Stud. (2023) 2:82–90. doi: 10.21608/IFJSIS.2023.220540.1031
15. Abdel-Moneim, AME, Shehata, AM, Alzahrani, SO, Shafi, ME, Mesalam, NM, Taha, AE, et al. El papel de los polifenoles en la nutrición de las aves. J Anim Physiol Anim Nutr. (2020) 104:1851–66. doi: 10.1111/jpn.13455
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Ebeid, TA, Aljabeili, HS, Al-Homidan, IH, Volek, Z y Barakat, H. Ramificaciones del estrés por calor en la producción de conejos y el papel de los nutracéuticos en el alivio de sus impactos negativos: una revisión actualizada. Antioxidantes. (2023) 12:1407. doi: 10.3390/antiox12071407
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Al-Saeed, FA, Bamarni, SSI, Iqbal, KJ, Rehman, TU, Faruk, AZ, Mahmood, S, et al. Eficacia antihelmíntica in vitro del extracto de hojas de Haloxylon salicornicum utilizando gusanos adultos de Heamonchus contortus. Pak Vet J. (2023) 4:91–6. doi: 10.29261/pakvetj/2022.091
18. Prakoso, YA, Babazadeh, D, y Wijayanti, AD. Potencia de la rosa del desierto (Adenium obesum (Forssk.) Roem. y Schult.) Extracto de flor contra la furunculosis inducida artificialmente en peces dorados de Oranda (Carassius auratus auratus). Pak Vet J. (2023) 43:339–44. doi: 10.29261/pakvetj/2023.024
19. Farooq, U, Mustafa, R, Khalid, MF, Auon, M, Mahmood, U, Wahaab, A, et al. Suplementación de semillas de hierbas para mejorar el rendimiento del crecimiento y la digestión en codorniz japonesa (Coturnix coturnix Japonica). Agrobiol Rec. (2022) 10:19–25. doi: 10.47278/journal.abr/2022.021
20. Akhtar, T, Shahid, S, Asghar, A, Naeem, MI, Aziz, S y Ameer, T. Utilización de balas herbales contra la enfermedad de Newcastle en el sector avícola de Asia y África (2012-2022). Int J Agric Sci. (2023) 12:56–65. doi: 10.47278/journal.ijab/2023.044
21. Fino, L, Al-Absi, G, Alnatour, D, Al-Darraji, M, Shehadeh, M, y Suaifan, G. Plantas medicinales de Jordania: revisión exploratoria. Heliyon. (2023) 9:E17081. doi: 10.1016/j.heliyon.2023.e17081
22. Onagbesan, OM, Uyanga, VA, Oso, O, Tona, K y Oke, OE. Alivio de los efectos del estrés térmico en aves de corral: actualizaciones sobre métodos y mecanismos de acción. Front Vet Sci. (2023) 10:10. doi: 10.3389/fvets.2023.1255520
23. Oluwafemi, R, Olawale, I, y Alagbe, J. Tendencias recientes en la utilización de plantas medicinales como promotores del crecimiento en la nutrición avícola: una revisión. Agric Veterinary Sci. (2020) 4:5–11.
24. Wan, X, Jiang, L, Zhong, H, Lu, Y, Zhang, L, y Wang, T. Efectos de Artemisia annua L. tratada enzimáticamente sobre el rendimiento del crecimiento y algunos parámetros sanguíneos de pollos de engorde expuestos a estrés térmico. Anim Sci J. (2017) 88:1239–46. doi: 10.1111/asj.12766
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Song, Z, Cheng, K, Zhang, L y Wang, T. La suplementación dietética de Artemisia annua tratada enzimáticamente podría aliviar la respuesta inflamatoria intestinal en pollos de engorde estresados por calor. J Therm Biol. (2017) 69:184–90. doi: 10.1016/j.jtherbio.2017.07.015
26. Patocka, J y Navratilova, Z. Achillea Fragrantissima: revisión farmacológica. Clin Oncol. (2019) 4:1601.
27. Eidrisha, AA, Roshdy, AR, AbdEl-Ghaffar, MA, y Ali, AM. Impacto del tomillo dietético (Thymus vulgaris l.) y Achillea fragrantissima en el rendimiento del crecimiento de aves de codorniz en crecimiento. Sinaí J Ciencia Aplicada. (2022) 11:487–500. doi: 10.21608/sinjas.2022.138603.1102
28. de Bock, M, Thorstensen, EB, Derraik, JG, Henderson, HV, Hofman, PL, y Cutfield, WS. Absorción humana y metabolismo de la oleuropeína y el hidroxitirosol ingeridos como extracto de hoja de olivo (olea europaea l.). Mol Nutr Food Res. (2013) 57:2079–85. doi: 10.1002/mnfr.201200795
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Agah, M, Mirakzehi, M y Saleh, H. Efectos del extracto de hoja de olivo (olea europea l.) sobre el rendimiento del crecimiento, los metabolitos sanguíneos y las actividades antioxidantes en pollos de engorde bajo estrés térmico. J Anim Plant Sci. (2019, 2019) 29:657–666.
30. Wan, X, Niu, Y, Zheng, X, Huang, Q, Su, W, Zhang, J, et al. Capacidades antioxidantes de hojas de artemisia annua l. y artemisia annua L. tratadas enzimáticamente in vitro y en pollos de engorde. Anim Feed Sci Technol. (2016) 221:27–34. doi: 10.1016/j.anifeedsci.2016.08.017
31. Lv, H, Huang, Y, Hou, Z y Chen, S. Composición microbiana en el duodeno y el íleon de pollos de engorde amarillos con alta y baja eficiencia alimenticia. Microbiol frontal. (2021) 12:689653. doi: 10.3389/fmicb.2021.689653
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Humam, AM, Loh, TC, Foo, HL, Izuddin, WI, Zulkifli, I, Samsudin, AA, et al. La suplementación con ri11 postbiótico mejora la actividad de las enzimas antioxidantes, regula al alza los genes de la barrera intestinal y reduce los niveles de expresión génica de citoquinas, proteínas de fase aguda y proteínas de choque térmico 70 en pollos de engorde estresados por calor. Poult Sci. (2021) 100:100908. doi: 10.1016/j.psj.2020.12.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Winer, J, Jung, CK, Shackel, I y Williams, PM. Desarrollo y validación de la reacción cuantitativa en cadena de la polimerasa con transcriptasa inversa en tiempo real para monitorear la expresión génica en miocitos cardíacos in vitro. Bioquímica anal. (1999) 270:41–9. doi: 10.1006/abio.1999.4085
34. Mahmoud, R, Ibrahim, D y Badawi, M. Efecto de la suplementación de dietas de pollos de engorde con hojas de guayaba y/o aceite de oliva sobre el crecimiento, la composición de la carne, los metabolitos sanguíneos y la respuesta inmunitaria. Benha Vet Med J. (2013) 25:23–32.
35. Saracila, M, Criste, R, Panaite, T, Vlaicu, P, Tabuc, C, Turcu, R, et al. Artemisia Annua como aditivo fitogénico para piensos en la dieta de pollos de engorde (14-35 días) criados bajo estrés térmico (32 °C). Braz J Poultry Sci. (2018) 20:825–32. doi: 10.1590/1806-9061-2018-0772
36. Mullenix, GJ, Greene, ES, Ramser, A, Maynard, C y Dridi, S. Efecto de una suplementación con mezcla fito/ficogénica microencapsulada sobre el rendimiento del crecimiento, los parámetros de procesamiento, la calidad de la carne y el perfil sensorial en pollos de engorde machos. Front Vet Sci. (2024) 11:1382535. doi: 10.3389/fvets.2024.1382535
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Sadeghi, A, y Moghaddam, M. Los efectos de la nutrición de cúrcuma, canela, jengibre y ajo en polvo sobre el estado de las enzimas antioxidantes y las hormonas involucradas en el metabolismo energético de los pollos de engorde durante el estrés por calor. Irán J Appl Anim Sci. (2018) 8:125–30.
38. Nissa, SS, Banday, M, Khan, A, Sofi, AH, Sheikh, G, Mir, M, et al. Efecto de las dietas alimenticias suplementadas con polvo de hoja de artemisia absinthium con o sin tratamiento enzimático sobre las diferentes carcasas, atributos físico-químicos, sensoriales y estabilidad oxidativa de la carne de pollo de engorde. J Pharm Innov. (2022) 11:554–7.
39. Cruvinel, JM, Groff Urayama, PM, Oura, CY, de Lima Krenchinski, FK, Dos Santos, TS, de Souza, BA, et al. El aceite de pequi (caryocar brasiliense camb.) atenúa los efectos adversos del estrés térmico cíclico y modula los genes relacionados con el estrés oxidativo en pollos de engorde. Animales. (2023) 13:1896. doi: 10.3390/ani13121896
40. Vasilopoulou, K, Papadopoulos, GA, Lioliopoulou, S, Pyrka, I, Nenadis, N, Savvidou, S, et al. Efectos de la suplementación dietética de un extracto acuoso de hoja de olivo isopropanol purificado con resina sobre los parámetros antioxidantes de la carne y el hígado en pollos de engorde. Antioxidantes. (2023) 12:1723. doi: 10.3390/antiox12091723
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Raza, SHA, Abdelnour, SA, Dhshan, AIM, Hassanin, AA, Noreldin, AE, Albadrani, GM, et al. Papel potencial de microARN específicos en la regulación de la respuesta al estrés térmico en el ganado. J Therm Biol. (2021) 96:102859. doi: 10.1016/j.jtherbio.2021.102859
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Ruzic, Z, Kanacki, Z, Stojanovic, S, Kovacevic, Z, Knezevic, S, Todorovic, S, et al. Temperatura rectal y frecuencia respiratoria como indicadores de estrés térmico en pollos de engorde sometidos a acondicionamiento térmico a temprana edad y suplementación con vitamina C. Turk J Vet Anim Sci. (2023) 47:160–6. doi: 10.55730/1300-0128.4281
43. Abdelnour, S.A., Abd El-Hack, ME, y Ragni, M. La eficacia de los forrajes tropicales ricos en proteínas como fuentes alternativas de proteínas para los pollos: una revisión. Agricultura. (2018) 8:86. doi: 10.3390/agriculture8060086
44. Rinttilä, T y Apajalahti, J. Microbiota intestinal y metabolitos: implicaciones para la salud y el rendimiento de los pollos de engorde. J Appl Poult Res. (2013) 22:647–58. doi: 10.3382/japr.2013-00742
45. Abdelnour, S.A., El-Ratel, IT, Peris, SI, El-Raghi, A.A., y Fouda, San Francisco. Efectos del aceite esencial de tomillo en la dieta sobre las variables hematobioquímicas hematobioquímicas, redox, inmunológicas y reproductivas de conejos expuestos a altas temperaturas ambientales. Ital J Anim Sci. (2022) 21:51–61. doi: 10.1080/1828051X.2021.2006807
46. Bashar, AM, Abdelnour, SA, El-Darawany, AA, y Sheiha, AM. La suplementación dietética con microalgas y/o nanominerales mitiga los efectos negativos del estrés térmico en conejos en crecimiento. Bioll Trace Elem Res. (2023) 23:3953. doi: 10.1007/s12011-023-03953-0
47. Algothmi, KM, Mahasneh, ZMH, Abdelnour, SA, Khalaf, QAW, Noreldin, AE, Barkat, RA, et al. Impactos protectores de los potenciadores de mitocondrias contra el estrés térmico en aves de corral. Poult Sci. (2024) 103:103218. doi: 10.1016/j.psj.2023.103218
48. de Souza, LFA, Espinha, LP, de Almeida, EA, Lunedo, R, Furlan, RL, y Macari, M. Cómo el estrés térmico (continuo o cíclico) interfiere con la digestibilidad de los nutrientes, los balances de energía y nitrógeno y el rendimiento en pollos de engorde. Livest Sci. (2016) 192:39–43. doi: 10.1016/j.livsci.2016.08.014
49. Shakeri, M, Cottrell, JJ, Wilkinson, S, Le, HH, Suleria, HA, Warner, RD, et al. Rendimiento de crecimiento y caracterización de la calidad de la carne de pollos de engorde suplementados con betaína y antioxidantes bajo estrés térmico cíclico. Antioxidantes. (2019) 8:336. DOI: 10.3390/antiox8090336
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Cheng, Y, Chen, Y, Chen, R, Su, Y, Zhang, R, He, Q, et al. El manano-oligosacárido dietético mejora los daños inducidos por el estrés térmico cíclico en el estado oxidativo intestinal y la integridad de la barrera de los pollos de engorde. Poult Sci. (2019) 98:4767–76. doi: 10.3382/ps/pez192
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. El-Kholy, K, Sarhan, DM y El-Said, EA. Efecto de la inyección in-Ovo de extractos de hierbas sobre el rendimiento posterior a la eclosión, las respuestas inmunológicas y fisiológicas de los pollos de engorde. J Mundo’s Poult Res. (2021) 11:183–92. doi: 10.36380/jwpr.2021.22
52. Madkour, M, Salman, FM, El-Wardany, I, Abdel-Fattah, SA, Alagawany, M, Hashem, NM, et al. Mitigar los efectos perjudiciales del estrés térmico en las aves de corral mediante el acondicionamiento térmico y la manipulación nutricional. J Therm Biol. (2022) 103:103169. doi: 10.1016/j.jtherbio.2021.103169
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Oke, O, Emeshili, U, Iyasere, O, Abioja, M, Daramola, J, Ladokun, A, et al. Las respuestas fisiológicas y el rendimiento de los pollos de engorde ofrecieron extracto de hoja de olivo en un clima tropical cálido y húmedo. J Appl Poult Res. (2017) 26:376–82. doi: 10.3382/japr/pfx0005
54. Sun, X, Zhang, H, Sheikhahmadi, A, Wang, Y, Jiao, H, Lin, H, et al. Efectos del estrés térmico en la expresión génica de transportadores de nutrientes en el yeyuno de pollos de engorde (Gallus Gallus Domesticus). Int J Biometeorol. (2015) 59:127–35. doi: 10.1007/s00484-014-0829-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Wolfenson, D, Bachrach, D, Maman, M, Graber, Y y Rozenboim, I. Enfriamiento por evaporación de las regiones ventrales de la piel en gallinas ponedoras estresadas por calor. Poult Sci. (2001) 80:958–64. doi: 10.1093/ps/80.7.958
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Zhang, Z, Jia, G, Zuo, J, Zhang, Y, Lei, J, Ren, L, et al. Efectos del estrés térmico constante y cíclico sobre el metabolismo muscular y la calidad de la carne del filete de pechuga de pollo de engorde y la carne de muslo. Poult Sci. (2012) 91:2931–7. doi: 10.3382/ps.2012-02255
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Guo, S, Ma, J, Xing, Y, Shi, L, Zhang, L, Xu, Y, et al. El extracto acuoso de Artemisia annua L. promueve la inmunidad intestinal y la función antioxidante en pollos de engorde. Front Vet Sci. (2022) 9:934021. doi: 10.3389/fvets.2022.934021
Resumen de PubMed | Texto completo de Crossref | Google Académico
58. Williams, GA, Babatunde, AV, Bello, FD, Alausa, BS, y Adewale, AO. Suplementación dietética con aceite de extracto de oliva y ajo: influencia en el rendimiento y los índices hematológicos de los pollos de engorde. Agric Trop Subtrop. (2024) 57:1–11. doi: 10.2478/ats-2024-0001
59. Madkour, M, Alaqaly, AM, Soliman, SS, Ali, SI y Aboelazab, O. Rendimiento del crecimiento, bioquímica sanguínea y expresión de ARNm de proteínas de choque térmico hepático de pollos de engorde estresados por calor en respuesta a extractos de romero y orégano. J Therm Biol. (2024) 119:103791. doi: 10.1016/j.jtherbio.2024.103791
Resumen de PubMed | Texto completo de Crossref | Google Académico
60. Yue, Y, Guo, Y y Yang, Y. Efectos de la suplementación con l-triptófano en la dieta sobre la respuesta intestinal al estrés crónico impredecible en pollos de engorde. Aminoácidos. (2017) 49:1227–36. doi: 10.1007/s00726-017-2424-3
61. Alem, WT . Efecto de los extractos herbales en la nutrición animal como aditivos alimentarios. Heliyon. (2024) 10:e24973. doi: 10.1016/j.heliyon.2024.e24973
Resumen de PubMed | Texto completo de Crossref | Google Académico
62. Sahin, K, Orhan, C, Smith, M y Sahin, N. Objetivos moleculares de los fitoquímicos dietéticos para el alivio del estrés térmico en aves de corral. Worlds Poult Sci J. (2013) 69:113–24. doi: 10.1017/S004393391300010X
63. Yang, Y, Bazhin, AV, Werner, J y Karakhanova, S. Especies reactivas de oxígeno en el sistema inmunológico. Int Rev Immunol. (2013) 32:249–70. doi: 10.3109/08830185.2012.755176
64. Yap, VL, Tan, LF, Rajagopal, M, Wiart, C, Selvaraja, M, Leong, MY, et al. Evaluación del potencial fitoquímico y antioxidante de una nueva formulación poliherbal Tc-16: ¿aditiva, sinérgica o antagónica? BMC Complem Med Therap. (2023) 23:93. doi: 10.1186/s12906-023-03921-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
65. Luissint, A-C, Parkos, CA y Nusrat, A. Inflamación y barrera intestinal: interacciones entre leucocitos y células epiteliales, remodelación de la unión celular y reparación de la mucosa. Gastroenterología. (2016) 151:616–32. doi: 10.1053/j.gastro.2016.07.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
66. Dokladny, K, Moseley, PL, y Ma, TY. El aumento fisiológicamente relevante de la temperatura provoca un aumento de la permeabilidad de la unión estrecha del epitelio intestinal. Am J Physiol Gastrointest Liver Physiol. (2006) 290:G204-12. doi: 10.1152/ajpgi.00401.2005
67. Varasteh, S, Braber, S, Akbari, P, Garssen, J y Fink-Gremmels, J. Diferencias en la susceptibilidad al estrés por calor a lo largo del intestino de pollo y los efectos protectores de los galactooligosacáridos. PLoS Uno. (2015) 10:e0138975. doi: 10.1371/journal.pone.0138975
Resumen de PubMed | Texto completo de Crossref | Google Académico
68. Basiouni, S, Téllez-Isaías, G, Latorre, JD, Graham, BD, Petrone-García, VM, El-Seedi, HR, et al. Sustancias fitogénicas antiinflamatorias y antioxidantes contra los asesinos secretos en aves de corral: estado actual y perspectivas. Veterinaria Sci. (2023) 10:55. doi: 10.3390/vetsci10010055
Resumen de PubMed | Texto completo de Crossref | Google Académico
69. Shan, C-H, Guo, J, Sun, X, Li, N, Yang, X, Gao, Y, et al. Efectos de las hierbas medicinales chinas fermentadas sobre el rendimiento de la leche y la función inmune en vacas al final de la lactancia en condiciones de estrés térmico. J Anim Sci. (2018) 96:4444–57. doi: 10.1093/jas/sky270
Resumen de PubMed | Texto completo de Crossref | Google Académico
70. Song, J, Jiao, L, Xiao, K, Luan, Z, Hu, C, Shi, B, et al. El celonoligosacárido mejora el deterioro inducido por el estrés térmico de la microflora, la morfología y la integridad de la barrera intestinal en pollos de engorde. Anim Feed Sci Technol. (2013) 185:175–81. doi: 10.1016/j.anifeedsci.2013.08.001
71. Abdelqader, A, y Al-Fataftah, A-R. Aclimatación térmica de pollos de engorde mediante exposición intermitente al calor. J Therm Biol. (2014) 39:1–5. doi: 10.1016/j.jtherbio.2013.11.001
72. Giannenas, I, Bonos, E, Skoufos, I, Tzora, A, Stylianaki, I, Lazari, D, et al. Efecto de los aditivos herbales para piensos sobre los parámetros de rendimiento, la microbiota intestinal, la morfología intestinal y la oxidación de los lípidos cárnicos de pollos de engorde. Bri Poult Sci. (2018) 59:545–53. doi: 10.1080/00071668.2018.1483577
73. Gāliņa, D, Ansonska, L, y Valdovska, A. Efecto de los probióticos y productos herbales en el desarrollo histomorfológico e inmunológico intestinal en lechones. Vet Med Inter. (2020) 2020:1–14. doi: 10.1155/2020/3461768
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: antioxidante, pollos de engorde, salud, estrés térmico, plantas medicinales
Cita: Mahasneh ZMH, Abuajamieh M, Abdelqader A, Al-Qaisi M, Abedal-Majed MA, Al-Tamimi H, Zakaria H y Al-Fataftah A-RA (2024) Los efectos de las hojas de Artemisia Sieberi, Achillea Fragrantissima y Olea Europaea en el rendimiento y los parámetros fisiológicos en pollos de engorde estresados por calor. Frente. Vet. Sci. 11:1410580. doi: 10.3389/fvets.2024.1410580
Recibido: 01 de abril de 2024; Aceptado: 24 de mayo de 2024;
Publicado: 17 Junio 2024.
Editado por:
Ramesh Chandra Gupta, Universidad Estatal de Murray, Estados Unidos
Revisado por:
Mohamed T. El-Saadony, Universidad de Zagazig, Egipto
Aisha Khatoon, Universidad de Agricultura, Pakistán
Derechos de autor © 2024 Mahasneh, Abuajamieh, Abdelqader, Al-Qaisi, Abedal-Majed, Al-Tamimi, Zakaria y Al-Fataftah. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Mohannad Abuajamieh, m.abuajamieh@ju.edu.jo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía