Los fitobióticos y sus modos de acción propuestos en cerdos
Conocimiento de vanguardia sobre el papel de los fitobióticos y sus modos de acción propuestos en cerdos
 Sriniwas Pandey1†
Sriniwas Pandey1†  Eun Sol Kim1†
Eun Sol Kim1†  Jin Ho Cho2†
Jin Ho Cho2†  Canción de Minho3†
Canción de Minho3†  Hyunok Doo1
Hyunok Doo1  Sheena Kim1
Sheena Kim1  Gi Beom Keum1
Gi Beom Keum1  Jinok Kwak1
Jinok Kwak1  Sumin Ryu1
Sumin Ryu1  Yejin Choi1
Yejin Choi1  Juyoun Kang1
Juyoun Kang1  Jeehwan Choe4
Jeehwan Choe4  Hyeun Bum Kim1*
Hyeun Bum Kim1*- 1Departamento de Ciencias de los Recursos Animales, Universidad Dankook, Cheonan, República de Corea
- 2División de Ciencias de los Alimentos y los Animales, Universidad Nacional de Chungbuk, Cheongju, República de Corea
- 3División de Ciencias Animales y Lácteas, Universidad Nacional de Chungnam, Daejeon, República de Corea
- 4Especialización en Ciencias de la Carne de Vacuno, Departamento de Ganadería, Universidad Nacional de Agricultura y Pesca de Corea, Jeonju, República de Corea
Con la prohibición de los antibióticos en la industria porcina, la exploración de opciones alternativas ha destacado a los fitobióticos como un sustituto prometedor de los antibióticos promotores del crecimiento, con el objetivo de fomentar una industria porcina más sostenible. Los fitobióticos son componentes bioactivos naturales no nutritivos derivados de plantas que ofrecen numerosos beneficios para la salud. Exhiben efectos antioxidantes, antimicrobianos y antiinflamatorios. Los fitobióticos se pueden utilizar en varias formas, incluyendo sólido, seco, molido o como extractos, ya sea en forma cruda o concentrada. Se caracterizan por bajos niveles residuales, falta de desarrollo de resistencia y efectos adversos mínimos. Estas cualidades hacen que los fitobióticos sean una opción atractiva para mejorar la salud y la productividad en los cerdos, presentándolos como una alternativa viable a los antibióticos. Si bien existe una comprensión general de los efectos de los fitobióticos, todavía se necesita información detallada sobre su efectividad y mecanismos de acción en entornos prácticos. Por lo tanto, el propósito de esta mini revisión fue resumir el conocimiento actual que apoya el papel de los fitobióticos y sus modos de acción propuestos, con un enfoque específico en los cerdos.
Introducción
Las crecientes preocupaciones sobre el uso de antibióticos como promotores del crecimiento en la alimentación del ganado han llevado a la búsqueda de mejores alternativas que puedan proporcionar efectos y rendimiento similares sin causar graves impactos negativos. En respuesta a esto, se han estudiado numerosas sustancias y se ha encontrado que poseen buenas cualidades que ayudan y mejoran la salud y el crecimiento general del ganado. Estas sustancias desempeñan un papel importante en el mantenimiento de las funciones fisiológicas normales y la salud animal, así como en la protección de los animales contra las enfermedades infecciosas. Una de esas sustancias que se ha identificado se denomina «nutracéutica» (1). Los nutracéuticos se refieren a sustancias que se producen en forma purificada o extraída y se administran a los animales con el propósito de mejorar su salud y bienestar (2). Este grupo incluye varios tipos de sustancias como enzimas, simbióticos, ácidos orgánicos, ácidos grasos poliinsaturados y fitobióticos (3, 4).
Los fitobióticos, un tipo específico de nutracéuticos, son componentes bioactivos naturales no nutritivos derivados de plantas que pueden usarse como aditivos para piensos (5-8). Estos fitobióticos han sido ampliamente estudiados por su capacidad para mejorar el rendimiento general del crecimiento y la salud de los animales. En particular, los fitobióticos poseen varios atributos deseables, incluidos bajos niveles de residuos, ausencia de desarrollo de resistencia y efectos secundarios mínimos (9-11). Estas cualidades los convierten en una opción prometedora para promover la salud y la productividad animal de manera sostenible y responsable (7, 12-14). Hasta la fecha, se han descubierto más de 5,000 fitobióticos dietéticos diferentes de una variedad de fuentes que incluyen frutas, verduras, legumbres, granos enteros, hierbas y aceites esenciales. Es ampliamente aceptado que los fitobióticos se pueden usar en diversas formas, como sólido, seco y molido o como extractos, ya sea en forma cruda o concentrada, en la que la acumulación de sustancias biológicamente activas es mayor (15, 16). En general, los fitobióticos contienen nutrientes esenciales, como carbohidratos, junto con otros componentes secundarios, incluidos aceites esenciales y compuestos fenólicos. Debido a que los fitobióticos no contribuyen significativamente a la ingesta de nutrientes primarios en los animales, el enfoque principal está en los componentes secundarios de la planta como los principales ingredientes de interés en los fitobióticos, aunque ciertos polisacáridos también pueden actuar como fitobióticos (6, 17, 18). Aunque no hay criterios de clasificación definitivos, los fitobióticos se pueden clasificar en 4 categorías diferentes según su origen y características de procesamiento: (1) hierbas (plantas florecientes, no leñosas y no persistentes); (2) especias (plantas con un fuerte olor o sabor); (3) aceites esenciales (componentes lipofílicos volátiles); y (4) oleorresinas (extractos derivados de soluciones no acuosas) (Tabla 1) (13, 25).
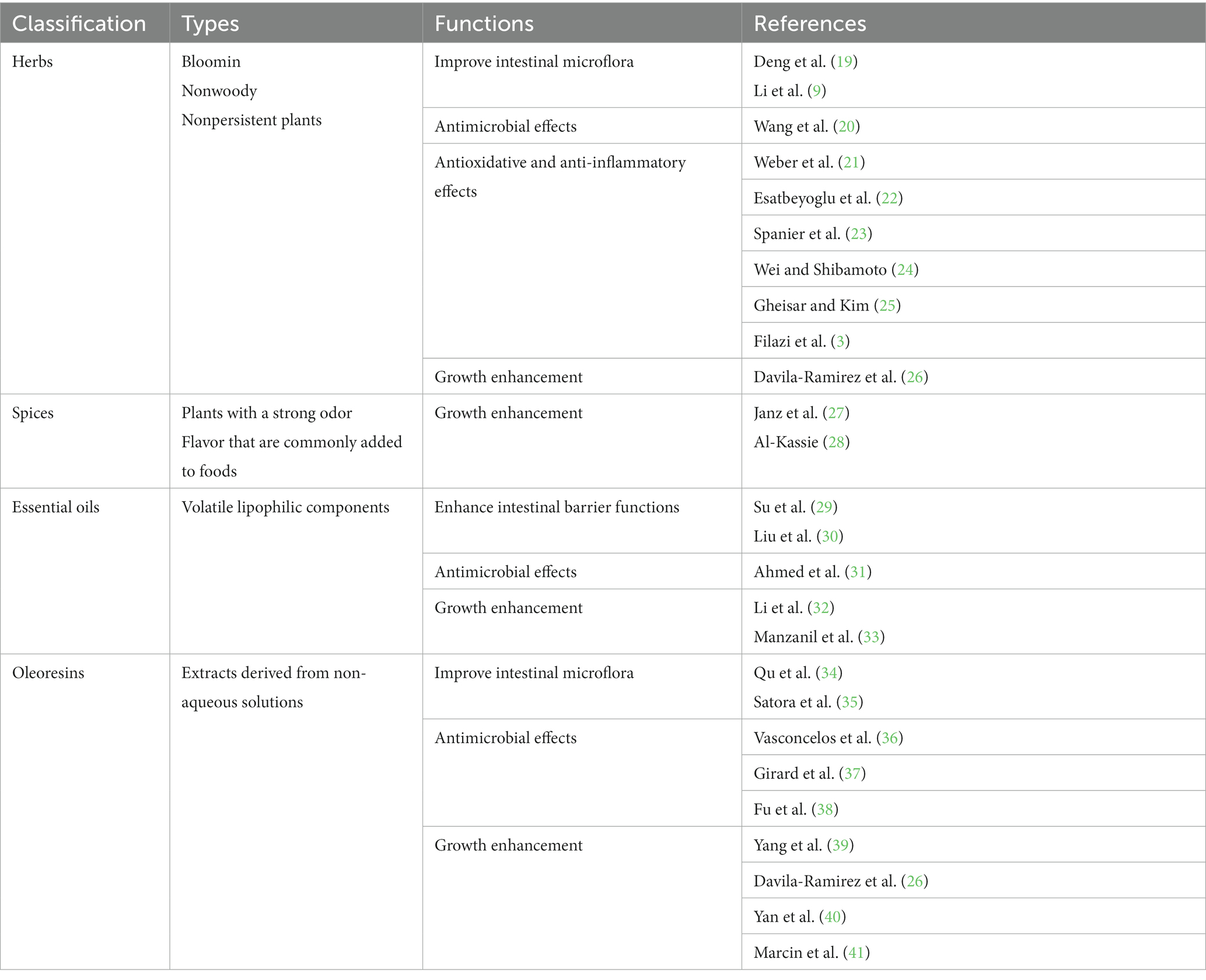 Tabla 1. La clasificación de los fitobióticos y sus ejemplos funcionales abordados en esta mini revisión.
Tabla 1. La clasificación de los fitobióticos y sus ejemplos funcionales abordados en esta mini revisión.
Una variedad de literatura ha demostrado los efectos positivos de los fitobióticos, que incluyen varios resultados beneficiosos. Estos efectos abarcan un mayor crecimiento de microbios beneficiosos en el intestino, así como propiedades antioxidantes, antimicrobianas y antiinflamatorias (3, 42). Estas actividades funcionales de los fitobióticos se han atribuido a diversos compuestos bioactivos presentes en ellos. Estos compuestos bioactivos incluyen terpenoides (mono y sesquiterpenos, esteroides), flavonoides, alcaloides (en forma de alcoholes, aldehídos, cetonas, ésteres y lactonas), fenoles (taninos), glucósidos y glucosinolatos (17, 43, 44). Sin embargo, el mecanismo de acción de los fitobióticos no se ha dilucidado claramente debido a la gran variedad de sustancias bioactivas presentes en estos productos derivados de plantas. El contenido y la composición química de las sustancias activas en los fitobióticos pueden variar en función de factores como la parte de la planta utilizada (semillas, hojas, etc.), la ubicación geográfica y la temporada de cosecha. Estas variaciones contribuyen a la complejidad de comprender los mecanismos precisos por los cuales los fitobióticos ejercen sus efectos (13, 25, 45).
Por lo tanto, el propósito de esta mini revisión fue proporcionar un resumen del conocimiento actual sobre los roles de los fitobióticos y sus modos de acción propuestos, particularmente en cerdos. A pesar de la complejidad de comprender los mecanismos precisos de acción debido a las diversas sustancias bioactivas y las variaciones en el contenido y la composición, la revisión tuvo como objetivo consolidar la literatura existente y arrojar luz sobre los beneficios potenciales de los fitobióticos en la producción porcina.
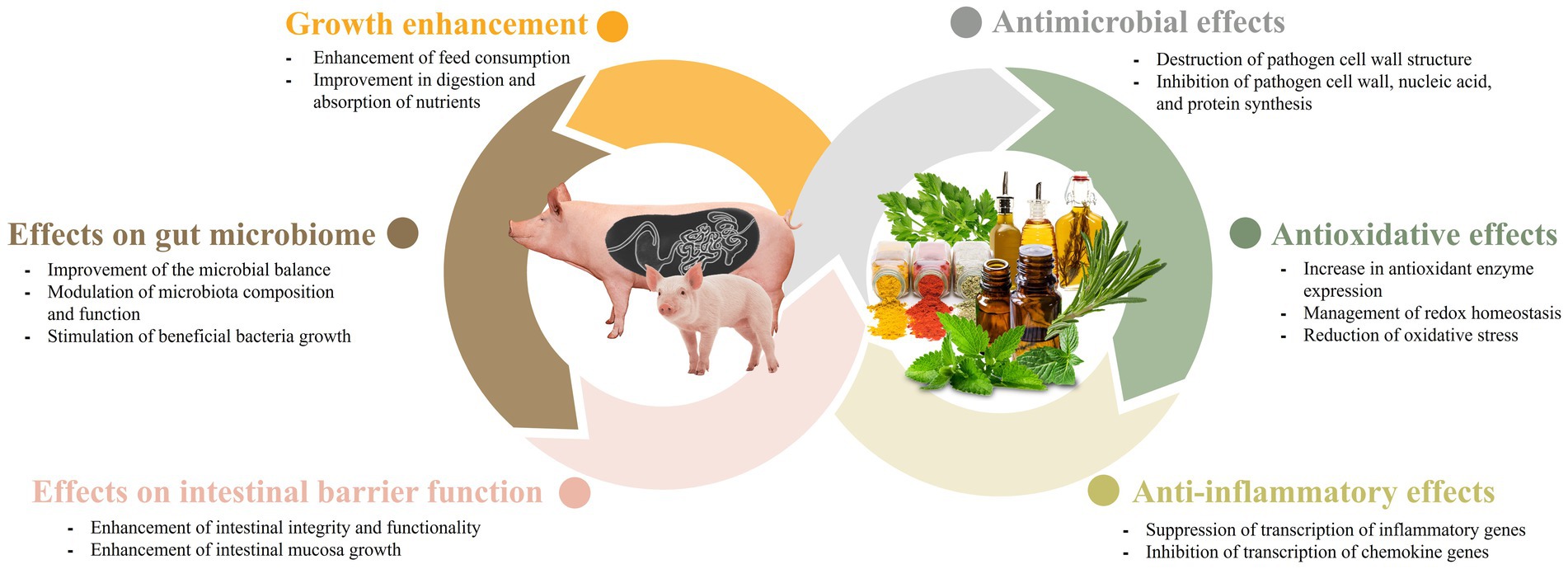
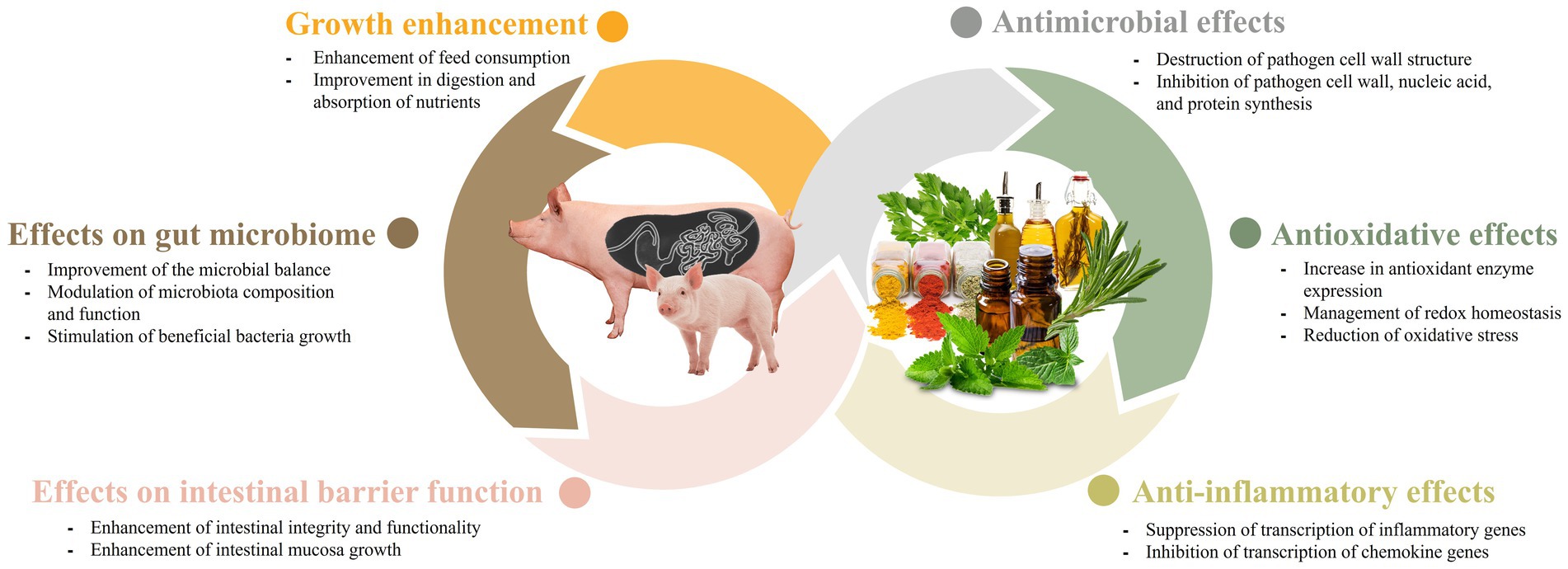
Efectos de los fitobióticos en el microbioma intestinal porcino
La salud intestinal de los animales es crucial para su salud y bienestar general, y está asociada con varios aspectos, incluido el microbioma intestinal y la barrera mucosa. Las perturbaciones en estos elementos pueden afectar la salud animal. Los fitobióticos tienden a promover la salud intestinal en los animales al mejorar las funciones de estos elementos (46).
El impacto de los fitobióticos en el microbioma intestinal ha sido ampliamente estudiado debido a su importante papel en la salud y la productividad del ganado. Se ha descubierto que los fitobióticos no solo alteran la proliferación bacteriana, sino que también influyen en la composición y función de la microbiota (47). Los cerdos destetados experimentan factores estresantes asociados con cambios en su alimentación y entorno cuando son trasladados de la sala de parto a las instalaciones del vivero. Estos cambios pueden dificultar el establecimiento de un ambiente intestinal estable. Los fitobióticos tienen el potencial de mejorar el equilibrio microbiano en cerdos jóvenes, lo que resulta en una mejor salud y eficiencia alimenticia. La presencia de bacterias intestinales beneficiosas durante el período de destete es crucial, y los productos de origen vegetal pueden servir como medios efectivos para modularla (9, 19, 35, 45). En un estudio de Deng et al. (19), se ha encontrado que los polisacáridos derivados de semillas de casiae mejoran la microflora intestinal de los lechones. En otro estudio de Li et al. (48), cuando los cerdos destetados fueron alimentados con una dieta suplementada con semillas de coix, hubo un aumento significativo en las poblaciones de Lactobacillus y Bacteroides en el tracto gastrointestinal. Además, hubo una reducción en la abundancia de Prevotellaceae. Estos hallazgos sugieren que la inclusión de semillas de coix en el alimento puede influir positivamente en la composición de la microbiota intestinal en cerdos destetados, promoviendo un equilibrio microbiano más saludable. La semilla de coix contiene un 60% de almidón, similar a los cereales, pero el contenido de aceite, polisacáridos y proteínas es mayor que el de los cereales, lo que la convierte en un medio enriquecido para la microbiota intestinal. Además, las proteínas y los polisacáridos ayudan a regular el transporte de agua, proporcionando a la microbiota intestinal un entorno adecuado para crecer (48). Además, varios estudios han sugerido que los microbios intestinales desempeñan un papel en el metabolismo de los fitobióticos ingeridos en metabolitos más simples. Este metabolismo microbiano aumenta la biodisponibilidad de los fitobióticos, lo que lleva a efectos mejorados que promueven la salud en el intestino. La capacidad de la microbiota intestinal para metabolizar los fitobióticos en compuestos bioactivos destaca la intrincada relación entre el huésped, la microbiota y los componentes dietéticos y subraya la importancia de considerar el metabolismo microbiano para comprender los efectos beneficiosos de los fitobióticos en la salud intestinal (49). En un estudio realizado por Fresno Rueda et al. (45), se investigaron los efectos de los fitobióticos que contienen polifenoles en cerdos destetados. El estudio encontró un aumento en la abundancia de productores de lactato y usuarios de lactato en el intestino de los cerdos. El lactato es un metabolito importante en el intestino, ya que puede suprimir el crecimiento de patógenos y también puede ser utilizado por el huésped en forma de propionato. Además, más allá del período de destete, los fitobióticos siguen desempeñando un papel en la modulación de la microbiota intestinal en cerdos en crecimiento y acabado. Por ejemplo, se encontró que la suplementación con 1,5% de vinagre de bambú en polvo aumenta la abundancia de Firmicutes y Bacteroidetes, dos filos bacterianos dominantes en el intestino. Esta suplementación también promovió la riqueza de Lactobacillus, un género beneficioso, y Thalassospira (34). Estos hallazgos resaltan el potencial de los fitobióticos para dar forma a la composición de la microbiota intestinal y promover lafila de bacterias beneficiosas en cerdos destetados y en crecimiento-acabado. Para las cerdas con suplementos de ajo, un estudio de Satora et al. (35) observó que la diversidad y riqueza de la comunidad microbiana cambió a través de los diferentes niveles taxonómicos de identificación. El estudio encontró un aumento en la diversidad y riqueza a nivel de especie, mientras que la tendencia fue opuesta a nivel de familia y género. Estos hallazgos apoyan la idea de que los fitobióticos pueden desempeñar un papel en la configuración del microbioma intestinal (Figura 1).
Efectos de los fitobióticos en la función de barrera intestinal porcina
Los fitobióticos también desempeñan un papel en el mantenimiento de la función de barrera intestinal (Figura 1). La integridad de la barrera intestinal depende de la interacción entre varios componentes, incluida la capa adhesiva de gel mucoso, la inmunoglobulina A, los péptidos antibacterianos y las uniones estrechas intercelulares. Entre estos componentes, las uniones estrechas son los principales factores que influyen en la integridad de la barrera intestinal. Las uniones estrechas consisten en proteínas transmembrana, como claudina, ocludina, tricelulina, molécula de adhesión de unión-A (JAM-A), así como proteínas de placa intracelular como zonula occludens (ZO) (50). Se ha documentado que la adición de resveratrol restaura eficazmente la expresión de ZO-2, ocludina, JAM-A y claudina, al tiempo que alivia la elevación de los niveles plasmáticos de proteínas de unión a lipopolisacáridos (LPS). Los niveles elevados de proteína de unión a LPS sirven como un indicador de la función de barrera intestinal comprometida en el animal (51). Además, se ha demostrado que la naringenina, una flavanona que se encuentra en los cítricos, aumenta la expresión de ocludina, JAM-A y claudina-3 (52). Además, se sabe que el aceite de extracción vegetal (PEO) mejora el crecimiento de la mucosa intestinal en cerdos destetados, atribuyendo a la mediación una mejor integridad y funciones intestinales (29). En otro estudio realizado por Liu et al. (30), se encontró que la administración de oleorresina de pimiento (CAP) y ajo botánico (GAR) aumenta la expresión de genes relacionados con la integridad de la membrana en cerdos destetados infectados. Esta administración también promovió la salud de la mucosa intestinal, lo que llevó a mejoras en la diarrea y las respuestas inmunes clínicas en cerdos infectados que recibieron el extracto de la planta. En conjunto, se ha demostrado que los fitobióticos tienden a promover la salud intestinal del animal al mantener la función de barrera intestinal.
Efectos antimicrobianos de los fitobióticos en cerdos
Los efectos antimicrobianos de los fitobióticos han sido objeto de numerosos estudios y, en consecuencia, han sido ampliamente investigados (53-55). La mayoría de estos estudios han demostrado que los componentes fenólicos, como el timol, el carvacrol, el limoneno, el geraniol, el fenilpropano y el citronelal, se encuentran entre los antimicrobianos más potentes (3). Cuando se trata de los mecanismos de acción, se ha encontrado que la variación en la composición de los componentes fitobióticos tiene un impacto significativo en la forma en que actúan (56, 57). Sin embargo, los efectos antimicrobianos de los aditivos fitoquímicos para piensos, en general, pueden atribuirse a cuatro modos de acción diferentes que son: (1) destrucción de la estructura de la pared celular; (2) inhibición de la síntesis de la pared celular; (3) inhibición de la síntesis de ácido nucleico, y (4) interferencia con la síntesis de proteínas (58). Según Wang et al. (20), una visión general de los mecanismos antimicrobianos del ginseng reveló varios modos de acción. Estos incluyen interrumpir la formación de biopelículas, destruir biopelículas maduras, alterar bicapas lipídicas y crear poros en la membrana de la pared celular bacteriana. Además de los mecanismos antimicrobianos mencionados del ginseng, también se ha encontrado que inhibe el flujo de salida de antibióticos, lo que reduce la probabilidad de desarrollo de resistencia a los medicamentos en los microbios. Además, se ha documentado que los extractos de canela exhiben actividad antimicrobiana a través de diversos mecanismos, incluida la interrupción de la membrana celular, la inhibición de las ATPasas, la interferencia con la división celular y la inhibición de la formación de biopelículas (36). Varios estudios también han informado que el timol posee la capacidad de integrarse en la región del grupo de cabeza polar de la bicapa lipídica. Esta integración conduce a la modificación de la integridad estructural y la fluidez de la membrana a través del enlace de hidrógeno y las interacciones hidrofóbicas (59, 60).
Cuando se utilizan fitobióticos en cerdos, se ha demostrado que sus efectos antimicrobianos producen resultados positivos. Los aceites esenciales han demostrado actividades antimicrobianas efectivas cuando se utilizan junto con ácidos orgánicos (61). Zhou et al. (61) informaron que la combinación de aceites esenciales (como carvacrol o timol) con ácido acético o ácido cítrico mostró una mejor eficacia contra Salmonella typhimurium en comparación con el uso de aceites esenciales individuales o ácidos orgánicos solos. Otro estudio realizado por Ahmed et al. (31) informó una disminución en el recuento de Salmonella fecal y Escherichia coli (E. coli), así como una reducción en las puntuaciones de diarrea, cuando el ácido benzoico y el timol fueron alimentados a los cerdos. El mecanismo detrás de esta sinergia aún no está claro. Sin embargo, está bien documentado que los fenoles presentes en el aceite esencial pueden alterar la estructura y las funciones de la membrana celular bacteriana. Esta alteración conduce a la hinchazón, lo que resulta en una mayor permeabilidad de la membrana y, en consecuencia, una mayor susceptibilidad de las bacterias a los ácidos orgánicos (62). La E. coli enterotoxigénica se considera una de las principales causas de diarrea en lechones destetados. Un estudio realizado por Girard et al. (37) mostró resultados prometedores en la suplementación de extracto de castaño al 2% (CE) inmediatamente después del destete en lugar de antibióticos, mejorando el rendimiento del crecimiento y reduciendo la aparición de diarrea post-destete (PWD) causada por E. coli enterotoxigénica (ETEC F4). En otro estudio, Chang et al. (63) realizaron un estudio para explorar los efectos de diferentes combinaciones de aditivos fitogénicos para piensos (PFA) en cerdos infectados por E. coli. Entre las numerosas combinaciones estudiadas, la mezcla de extracto de cítricos amargos, timol y carvacrol demostró los resultados más efectivos en términos de mejorar la respuesta inmune, la morfología intestinal y la expresión de la unión estrecha. En un estudio de Fu et al. (38), la administración del complejo baicalin-aluminio (BBA) alteró la composición del microbioma intestinal, lo que llevó a una reducción significativa en la frecuencia de diarrea en lechones. Además, se ha demostrado que la suplementación con extractos de Scutellaria baicalenis (SBE) reduce eficazmente la incidencia de diarrea en lechones destetados y disminuye la expresión de citoquinas inflamatorias al inhibir las vías de señalización NF-kB y P38 (64). En general, estos estudios demuestran que los fitobióticos pueden utilizarse como alternativas potenciales a los agentes antimicrobianos en cerdos (Figura 1).
Efectos antioxidantes y antiinflamatorios de los fitobióticos en cerdos
Las propiedades antioxidantes y antiinflamatorias de los fitobióticos son realmente notables y han despertado un gran interés (Figura 1). La industria porcina experimenta pérdidas económicas sustanciales cada año debido a varios tipos de estrés oxidativo. Los fitobióticos pueden ayudar a mitigar estas pérdidas al proporcionar apoyo antioxidante y reducir la inflamación en los cerdos (65). El estrés oxidativo se refiere a un aumento significativo en la producción de radicales libres, como las especies reactivas de oxígeno (ROS) y los radicales reactivos de nitrógeno (RNS), dentro de los cuerpos de los animales. También puede ocurrir cuando se reduce la capacidad de eliminar eficazmente los radicales libres, alterando el equilibrio entre los procesos de antioxidación y oxidación en el cuerpo (66). Los estudios han identificado cinco factores principales que pueden desencadenar el estrés oxidativo en los cerdos. Estos factores incluyen el nacimiento, el estrés al destete, el entorno de alimentación, la presencia de micotoxinas en la alimentación y los factores sociales (66). Dados los efectos perjudiciales del estrés oxidativo, es crucial para la industria porcina combatir esta condición. La producción no regulada de radicales libres, como ROS y RNS, asociada con el estrés oxidativo, puede incluso desencadenar inflamación (67, 68).
Los mecanismos antioxidantes y antiinflamatorios exhibidos por los fitobióticos se atribuyen en gran medida a su regulación de las vías de señalización, como lo destacan Li et al. (9). La vía de señalización del elemento sensible al antioxidante (Nrf2-ARE) desempeña un papel vital en la respuesta celular al estrés oxidativo (69). El factor de transcripción Nrf-2 se une con el elemento de respuesta antioxidante (ARE) e inicia la activación de una amplia gama de genes, incluidas las enzimas antioxidantes y las proteínas, que proporcionan protección celular contra el estrés oxidativo (70). Los fitobióticos, por lo tanto, ayudan a activar la vía Nrf-2, regulando al alza las enzimas antioxidantes y varias proteínas protectoras. Varios experimentos in vitro e in vivo han indicado que el estrés oxidativo también puede desencadenar la activación de la vía del factor nuclear Kappa B (NF-κB). El aumento del nivel de expresión de NF-κB puede facilitar la transcripción de multitud de genes inflamatorios (71). Esta vía de señalización sirve como un regulador principal de la inflamación (72). NF-κB es un factor transcripcional que desempeña un papel importante en muchas respuestas fisiológicas críticas, incluida la respuesta inflamatoria (73). Esta vía es responsable de la expresión de genes que codifican muchas citoquinas y quimiocinas proinflamatorias (74). La activación de NF-κB conduce a alteraciones tisulares indicativas de inflamación (9). En relación con la información antes mencionada, los hallazgos de Wang et al. (72) mostraron que la medicina tradicional china (MTC) I y II, compuesta por varios tipos de derivados vegetales, puede mejorar las capacidades antioxidantes y antiinflamatorias en el hígado de los lechones a través de la activación de la vía Nrf2. Además, se ha demostrado que la curcumina, un compuesto presentado en la cúrcuma, tiene actividades antiinflamatorias y antioxidantes, capaces de eliminar los radicales libres y facilitar las funciones antioxidantes a través de la vía de señalización Nrf2 (21, 22). Otro compuesto, el resveratrol, obtenido de las uvas y el vino, también se encontró que disminuye la inflamación y regula la homeostasis redox (23). En las células, la homeostasis redox es el equilibrio entre la generación y la eliminación de ROS/RNS (75). Un estudio realizado por Cao et al. (76) mostró que el resveratrol fue eficaz para mejorar el estado redox, disminuir el daño mitocondrial y promover la mitofagia en lechones inyectados con diquat. Las especies de plantas como el cilantro, el jengibre, la cúrcuma, así como las ricas en flavonoides (en el té verde) y antocianinas (en varias frutas) tienen actividades antioxidantes (24, 25). Los estudios demostraron que la pimienta negra, la pimienta roja y el chile también poseen propiedades antioxidantes, sin embargo, la mayoría de estas plantas están restringidas de ser añadidas especialmente en la alimentación porcina debido al olor acre y el sabor de las sustancias activas de estas plantas (3).
Mejora del crecimiento por fitobióticos en cerdos
Con la prohibición de los antibióticos promotores del crecimiento (AGP), los fitobióticos han surgido como aditivos alternativos prometedores para piensos, como señalaron Valenzuela-Grijalva et al. (58). Varios estudios han demostrado los posibles efectos promotores del crecimiento de los fitobióticos, aunque los mecanismos precisos que subyacen a su papel como potenciadores del crecimiento no se han dilucidado completamente (Figura 1). Sin embargo, Valenzuela-Grijalva et al. (58) han sugerido que los fitobióticos pueden promover el crecimiento de varias maneras diferentes. Estos incluyen: (1) a través de la mejora del estado del alimento y el consumo de alimento mediante el aumento del sabor y la palatabilidad; (2) mejora en la digestión y absorción de la nutrición; y (3) promueve la actividad anabólica comparable a la de las sustancias anabólicas.
Se ha demostrado que algunos fitobióticos, cuando se agregan a los alimentos, mejoran el sabor y la palatabilidad, lo que aumenta la ingesta de alimento en cerdos. Esta mejora en la ingesta de alimento puede, en última instancia, conducir a un mejor rendimiento de la producción (28, 77). Janz et al. (27) descubrieron que los cerdos demostraron una preferencia por el alimento suplementado con ajo o romero en comparación con el alimento suplementado con orégano o jengibre. Sin embargo, otros estudios han indicado que la palatabilidad del alimento se vio afectada negativamente cuando los cerdos fueron alimentados con aceites esenciales extraídos de hinojo y alcaravea, o de tomillo u orégano (78-80).
Los fitobióticos mejoran la digestión y absorción de nutrientes al estimular la secreción de varias secreciones digestivas, incluyendo saliva, moco, enzimas digestivas y bilis. Estas secreciones mejoradas contribuyen a la descomposición y asimilación de los nutrientes de la dieta. Además, se ha demostrado que los fitobióticos exhiben actividad prebiótica, promoviendo el crecimiento y la actividad de las bacterias intestinales beneficiosas, lo que apoya aún más la digestión y absorción eficiente de nutrientes (7, 81, 82). Janz et al. (27) y Manzanil et al. (33) realizaron estudios en los que observaron un efecto estimulante sobre las enzimas pancreáticas, específicamente la actividad de la amilasa y la tripsina, en cerdos después de la administración de cinamaldehído y una mezcla de aceites esenciales. Estos hallazgos sugieren que estos fitobióticos pueden mejorar la actividad de las enzimas pancreáticas involucradas en la digestión de nutrientes, contribuyendo a una mejor utilización de nutrientes en cerdos (25, 33, 83, 84). El aumento de la actividad de las enzimas digestivas facilita un incremento en el tiempo de retención gástrica del alimento ingerido. Este tiempo de retención prolongado permite una mejor digestibilidad y disponibilidad de nutrientes. Como resultado, la actividad enzimática mejorada inducida por los fitobióticos contribuye a una digestión y utilización más eficiente de los nutrientes en los animales (81). Li et al. (32) realizaron un estudio sobre cerdos alimentados con dietas suplementadas con aceites esenciales y observaron mejoras significativas en el aumento de peso, así como en la digestibilidad de la materia seca y la proteína cruda. Propusieron que la mejora de la morfología intestinal resultante de la suplementación con aceites esenciales contribuyó a mejorar la digestibilidad nutricional, lo que en última instancia condujo a un mejor rendimiento en cerdos. Del mismo modo, en un estudio realizado por Yang et al. (39), los lechones suplementados con extracto de romero (RE) exhibieron una mayor altura de las vellosidades y una relación entre la altura de las vellosidades y la profundidad de la cripta tanto en el yeyuno como en el íleon. Estos cambios en la morfología intestinal tienen el potencial de impactar positivamente el rendimiento del crecimiento, la digestibilidad de los nutrientes y la salud intestinal general en lechones destetados (32, 39).
En un estudio realizado por Dávila-Ramírez et al. (26), la adición de extractos de plantas (alcachofa, remolacha, apio, ajo, aguacate, espinacas, avena y perejil) a la dieta de los cerdos resultó en una mejora de la ganancia diaria promedio (ADG), la ingesta diaria promedio de alimento (ADFI) y el peso vivo final (LW) en condiciones de estrés por calor durante el período de crecimiento hasta el final. Del mismo modo, en un estudio realizado por Yan et al. (40), la suplementación con una mezcla de extracto de hierbas (HEM) que contiene trigo sarraceno, tomillo, cúrcuma, pimienta negra y jengibre resultó en un mejor rendimiento de crecimiento, específicamente un aumento de ADG y ADFI, en cerdos en crecimiento en comparación con un tratamiento de control no suplementado (NC). Sin embargo, no se observaron cambios significativos en la tasa de conversión alimenticia (FCR). Marcin et al. (41) observaron una mejora significativa en ADG en lechones a los que se les administró una dieta suplementada con extractos de salvia y orégano. Por otro lado, Ahmed et al. (85) no encontraron cambios significativos en el peso corporal vivo y ADG en cerdos en crecimiento y engorde alimentados con una dieta suplementada con plantas medicinales como granada, ginkgo biloba y regaliz, en comparación con un grupo control. Estos estudios destacan los efectos variables de diferentes extractos de plantas y suplementos herbales sobre el rendimiento del crecimiento en cerdos, subrayando la importancia de considerar varios factores al evaluar la eficacia de los fitobióticos en la nutrición porcina. Estos factores incluyen: variación de especies (diferentes especies de plantas tienen composiciones variables de compuestos bioactivos, lo que puede resultar en diferentes efectos sobre el rendimiento del crecimiento), partes de la planta y características heredadas (las partes específicas de la planta utilizadas, como hojas, tallos y raíces), sus características inherentes (composición química y contenido de nutrientes), edad de las plantas (la edad de las plantas en el momento de la cosecha puede afectar la concentración y composición de compuestos bioactivos, y potencialmente influir en su impacto en el rendimiento del crecimiento), el momento de la cosecha (el momento de la cosecha en relación con la etapa de crecimiento de la planta puede influir en la concentración y potencia de los compuestos bioactivos, lo que puede afectar su eficacia para promover el crecimiento) y las variaciones de dosis (diferentes dosis de hierbas o sus extractos pueden tener efectos variables en el rendimiento del crecimiento). Tener en cuenta estos factores es importante para comprender los diversos resultados observados en los estudios que investigan los efectos de las hierbas en el rendimiento del crecimiento animal (86-88).
Conclusión
En los últimos tiempos, el uso de fitobióticos como promotores naturales del crecimiento en la industria porcina ha ganado cada vez más popularidad. Varios estudios han demostrado el potencial de los fitobióticos para ejercer efectos antioxidantes, antimicrobianos y antiinflamatorios. Estos hallazgos sugieren que los fitoquímicos podrían servir como una alternativa prometedora a los antibióticos en la producción porcina, mejorando el rendimiento del crecimiento y la salud. Si bien existe una comprensión general de los efectos de los fitobióticos, todavía hay una falta de información detallada sobre sus mecanismos de acción específicos y la efectividad de su implementación en entornos prácticos. Por lo tanto, se necesitan más estudios para investigar los modos de acción de cada tipo y dosis de compuesto activo en fitobióticos, así como sus posibles interacciones con otros componentes del alimento. También es importante evaluar los efectos de los fitobióticos en todas las fases de la producción porcina para sacar conclusiones concretas sobre su uso. Al realizar una investigación más exhaustiva, podemos obtener una comprensión más profunda de los fitobióticos y sus beneficios potenciales, lo que permite su utilización óptima en la nutrición y producción porcina. En última instancia, esto contribuirá a mejorar la salud y el rendimiento de los animales, así como a prácticas de cría porcina más sostenibles y eficientes
Contribuciones del autor
SP: Redacción – revisión y edición, Redacción – borrador original, Recursos. EK: Visualización, Redacción – borrador original, Redacción – revisión y edición, Recursos. JiC: Conceptualización, Escritura – revisión y edición. MS: Conceptualización, Escritura – revisión y edición. HD: Escritura – borrador original, Recursos. SK: Conceptualización, Escritura – revisión y edición, Recursos. GK: Recursos, Redacción – borrador original. JiK: Recursos, Escritura – borrador original. SR: Recursos, Redacción – borrador original. YC: Recursos, Redacción – borrador original. JuK: Recursos, Escritura – borrador original. JeC: Escritura – revisión y edición, Conceptualización. HK: Conceptualización, Supervisión, Validación, Redacción – revisión y edición, Redacción – borrador original
Financiación
El(los) autor(es) declara(n) apoyado(s) financiero(s) fue recibido para la investigación, autoría y/o publicación de este artículo. Este trabajo fue apoyado por la Fundación Nacional de Investigación de Corea (NRF) financiada por el Ministerio de Educación: (NRF-2021R1I1A3059910 y NRF-2019M3A9F3065227)
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Das, L, Bhaumik, E, Raychaudhuri, U, y Chakraborty, R. Papel de los nutracéuticos en la salud humana. J Food Sci Technol. (2012) 49:173–83. DOI: 10.1007/S13197-011-0269-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Gupta, RC, Srivastava, A, y Lall, R. Nutracéuticos en medicina veterinaria. Cham: Springer (2019).
3. Filazi, A, y Yurdakok-Dikmen, B. Nutraceuticals in poultry health and disease In: R Gupta, A Srivastava, and R Lall, editors. Nutracéuticos en medicina veterinaria. Cham: Springer (2019). 661–72.
4. Alagawany, M, Elnesr, SS, Farag, MR, Abd El-Hack, ME, Barkat, RA, Gabr, AA, et al. Papel potencial de importantes nutracéuticos en el rendimiento y la salud de las aves de corral: una revisión exhaustiva. Res Vet Sci. (2021) 137:9–29. doi: 10.1016/j.rvsc.2021.04.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Kim, S, Fan, M, and Applegate, T. Nonruminant nutrition symposium on natural Phytobiotics for health of young animals and poultry: mechanisms and application. J Anim Sci. (2008) 86:E138–9. DOI: 10.2527/JAS.2007-0769
6. Grashorn, M. Uso de fitobióticos en la nutrición de pollos de engorde: una alternativa a los antibióticos de alimentación. J Anim Feed Sci. (2010) 19:338–47. doi: 10.22358/JAFS/66297/2010
7. Kikusato, M. Fitobióticos para mejorar la salud y la producción de pollos de engorde: funciones más allá de la actividad antioxidante. Anim Biosci. (2021) 34:345. DOI: 10.5713/AB.20.0842
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Serge Cyrille Houketchang, N, y Herve, KM. El uso de plantas como fitobióticos: un nuevo desafío En: S-H Marcos, A-H Eva, y P-T Mariana, editores. Fitoquímicos en agricultura y alimentación. Rijeka: IntechOpen (2023). Cap. 9.
9. Li, L, Sun, X, Zhao, D, and Dai, H. Pharmacological applications and action mechanisms of phytochemicals as alternatives to antibiotics in pig production. Frente Immunol. (2021) 12:798553. DOI: 10.3389/FIMMU.2021.798553
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Mandey, JS, and Sompie, FN. Phytogenic feed additives as an alternative to antibiotic growth promoters in poultry nutrition In: L Babinszky, J Oliveira, and E Mauro Santos, editors. Estudios avanzados en nutrición animal del siglo 21. Londres: IntechOpen Limited (2021). 19.
11. Dialoke, N, Onimisi, P, and Afolayan, M. Performance, blood parameters and economic indices of broiler chickens fed graded levels of chestnut (Castenea sativa) phytobiotics as replacement for antibiotics growth promoters. Níger J Anim Prod. (2020) 47:161–70. doi: 10.51791/njap.v47i2.123
12. Suryanarayana, M, y Durga, S. Role of phytogenic feed additives in swine production-a review. Int. J. Environ. Agric. Biotech. (2018) 3:264375. doi: 10.22161/ijeab/3.3.46
13. Windisch, W, Schedle, K, Plitzner, C, y Kroismayr, A. Use of phytogenic products as feed additives for swine and poultry. J Anim Sci. (2008) 86:E140–8. DOI: 10.2527/JAS.2007-0459
14. Lin, ZN, Ye, L, Li, ZW, Huang, XS, Lu, Z, Yang, YQ, et al. Los aditivos para piensos de hierbas chinas mejoraron el rendimiento de crecimiento, la calidad de la carne y los parámetros de digestibilidad de nutrientes de los cerdos. Anim Model Exp Med. (2020) 3:47–54. DOI: 10.1002/ame2.12104
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Krauze, M. Phytobiotics, a natural growth promoter for poultry En: L Babinszky, J Oliveira, and E Mauro Santos, editors. Estudios avanzados en nutrición animal del siglo 21. Londres: IntechOpen Limited (2021)
16. Lillehoj, H, Liu, Y, Calsamiglia, S, Fernandez-Miyakawa, ME, Chi, F, Cravens, RL, et al. Fitoquímicos como alternativas antibióticas para promover el crecimiento y mejorar la salud del huésped. Vet Res. (2018) 49:76. DOI: 10.1186/S13567-018-0562-6
17. Pashtetsky, V, Ostapchuk, P, Kuevda, T, Zubochenko, D, Yemelianov, S, and Uppe, V, editors. Use of phytobiotics in animal husbandry and poultry. E3S Web of Conferences; (2020). EDP Sciences.
18. Vidanarachchi, JK, Mikkelsen, L, Sims, I, Iji, P, and Choct, M. Phytobiotics: alternatives to antibiotic growth promoters in monogastric animal feeds. Recent Advances in Animal Nutrition in Australia, Vol. 15, pp. 131–144 (2005). Available at: https://hdl.handle.net/1959.11/4186
19. Deng, Z-Y, Zhang, J-W, Li, J, Fan, Y-W, Cao, S-W, Huang, R-l, et al. Effect of polysaccharides of cassiae seeds on the intestinal microflora of piglets. Asia Pac J Clin Nutr. (2007) 16:143–7.
20. Wang, L, Huang, Y, Yin, G, Wang, J, Wang, P, Chen, ZY, et al. Antimicrobial activities of Asian ginseng, American ginseng, and notoginseng. Phytother Res. (2020) 34:1226–36. doi: 10.1002/ptr.6605
21. Weber, WM, Hunsaker, LA, Abcouwer, SF, Deck, LM, and Vander Jagt, DL. Anti-oxidant activities of curcumin and related enones. Bioorg Med Chem. (2005) 13:3811–20. doi: 10.1016/j.bmc.2005.03.035
22. Esatbeyoglu, T, Huebbe, P, Ernst, IM, Chin, D, Wagner, AE, and Rimbach, G. Curcumin—from molecule to biological function. Angew Chem Int Ed. (2012) 51:5308–32. doi: 10.1002/anie.201107724
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Spanier, G, Xu, H, Xia, N, Tobias, S, Deng, S, Wojnowski, L, et al. El resveratrol reduce el estrés oxidativo endotelial mediante la modulación de la expresión génica de la superóxido dismutasa 1 (Sod1), la glutatión peroxidasa 1 (Gpx1) y la subunidad Nadph oxidasa (Nox4). J Physiol Pharmacol. (2009) 60:111–6.
24. Wei, A, y Shibamoto, T. Actividades antioxidantes y componentes volátiles de varios aceites esenciales. J Agric Food Chem. (2007) 55:1737–42. DOI: 10.1021/JF062959X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Mohammadi Gheisar, M, y Kim, IH. Fitobióticos en la nutrición de aves y cerdos: una revisión. Ital J Anim Sci. (2018) 17:92–9. doi: 10.1080/1828051X.2017.1350120
26. Dávila-Ramírez, JL, Munguía-Acosta, LL, Morales-Coronado, JG, García-Salinas, AD, González-Ríos, H, Celaya-Michel, H, et al. Adición de una mezcla de extractos de plantas a las dietas para cerdos en crecimiento-acabado en el rendimiento de crecimiento, metabolitos sanguíneos, rasgos de la canal, peso de los órganos como porcentaje del peso vivo, calidad y análisis sensorial de la carne. Animales. (2020) 10:1229. DOI: 10.3390/ANI10071229
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Janz, J, Morel, P, Wilkinson, B, and Purchas, R. Preliminary investigation of the effects of low-level dietary inclusion of fragant essential oils and oleoresins on pig performance and pork quality. Carne Sci. (2007) 75:350–5. doi: 10.1016/j.meatsci.2006.06.027
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Al-Kassie, GA. Influencia de dos extractos de plantas derivadas del tomillo y la canela en el rendimiento de los pollos de engorde. Pak Vet J. (2009) 29:169–73.
29. Su, G, Zhou, X, Wang, Y, Chen, D, Chen, G, Li, Y, et al. La suplementación dietética de aceite esencial de plantas mejora el rendimiento del crecimiento, la morfología intestinal y la salud en cerdos destetados. J Anim Physiol Anim Nutr. (2020) 104:579–89. DOI: 10.1111/JPN.13271
30. Liu, Y, Song, M, Che, T, Lee, J, Bravo, D, Maddox, C, et al. Los extractos de plantas dietéticas modulan los perfiles de expresión génica en la mucosa ileal de cerdos destetados después de una infección por Escherichia Coli. J Anim Sci. (2014) 92:2050–62. doi: 10.2527/jas.2013-6422
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Ahmed, S, Hossain, M, Kim, G, Hwang, J, Ji, H, and Yang, C. Effects of resveratrol and essential oils on growth performance, immunity, digestibility and fecal microbial shedding in challenged piglets. Australas asiáticas J Anim Sci. (2013) 26:683. doi: 10.5713/ajas.2012.12683
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Li, P, Piao, X, Ru, Y, Han, X, Xue, L, and Zhang, H. Effects of adding essential oil to the diet of weaned pigs on performance, nutrient utilization, immune response and intestinal health. Australas asiáticas J Anim Sci. (2012) 25:1617. doi: 10.5713/ajas.2012.12292
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Manzanilla, E, Perez, J, Martin, M, Kamel, C, Baucells, F, and Gasa, J. Effect of plant extracts and formic acid on the intestinal equilibrium of early-weaned pigs. J Anim Sci. (2004) 82:3210–8. doi: 10.2527/2004.82113210x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Qu, H, Huang, Y, Shi, Y, Liu, Y, Wu, S, and Bao, W. Effect of bamboo vinegar powder as an antibiotic alternative on the digesta bacteria communities of finishing pigs. Can J Microbiol. (2018) 64:732–43. DOI: 10.1139/CJM-2018-0058
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Satora, M, Magdziarz, M, Rząsa, A, Rypuła, K, and Płoneczka-Janeczko, K. Insight into the intestinal microbiome of funging sows following the administration of ajo (Allium Sativum) extract and probiotic bacteria cultures under farming conditions. BMC Vet Res. (2020) 16:442. DOI: 10.1186/S12917-020-02659-Y
36. Vasconcelos, N, Croda, J, y Simionatto, S. Antibacterial mechanisms of cinnamon and its constituents: a review. Microb Pathog. (2018) 120:198–203. doi: 10.1016/j.micpath.2018.04.036
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Girard, M, Hu, D, Pradervand, N, Neuenschwander, S, and Bee, G. El extracto de castaño pero no el salicilato de sodio disminuye la gravedad de la diarrea y el desprendimiento enterotoxigénico de Escherichia Coli F4 en lechones infectados artificialmente. PLoS One. (2020) 15:E0214267. doi: 10.1371/journal.pone.0214267
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Fu, S, Zhuang, F, Guo, L, Qiu, Y, Xiong, J, Ye, C, et al. Efecto de los complejos Baicalin-aluminio sobre el microbioma fecal en lechones. Int J Mol Sci. (2019) 20:2390. DOI: 10.3390/IJMS20102390
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Yang, M, Yin, Y, Wang, F, Bao, X, Long, L, Tan, B, et al. Efectos de la suplementación dietética con extracto de romero sobre el rendimiento del crecimiento, la digestibilidad de los nutrientes, la capacidad antioxidante, la morfología intestinal y la microbiota de los cerdos destetados. J Anim Sci. (2021) 99:skab237. doi: 10.1093/jas/skab237
40. Yan, L, Meng, Q, y Kim, I. El efecto de una mezcla de extracto de hierbas sobre el rendimiento del crecimiento, la digestibilidad de los nutrientes, las características de la sangre y el contenido de gases nocivos fecales en cerdos en crecimiento. Livest Sci. (2011) 141:143–7. doi: 10.1016/j.livsci.2011.05.011
41. Marcin, A, Lauková, A, y Mati, R. Comparación de los efectos de enterococcus faecium y aceites aromáticos de salvia y orégano sobre el rendimiento del crecimiento y las enfermedades diarreicas de cerdos destetados. Biografía. (2006) 61:789–95. DOI: 10.2478/S11756-006-0159-9
42. Dundar, E, Olgun, EG, Isiksoy, S, Kurkcuoglu, M, Baser, KHC y Bal, C. Los efectos de la aplicación intra-rectal e intra-peritoneal de Origanum Onites L. aceite esencial en la colitis inducida por ácido 2, 4, 6-trinitrobencenosulfónico en la rata. Exp Toxicol Pathol. (2008) 59:399–408. doi: 10.1016/j.etp.2007.11.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Ulrikh, EV, Khaliullin, RS, Ganieva, IA, Izhmulkina, E, y Arzjutov, M. El contenido de sustancias biológicamente activas en fitobióticos utilizados para animales agrícolas y aves de corral. Int J Eng Technol (EAU). (2018) 7:445–9. doi: 10.14419/ijet.v7i3.14.17040
44. Huyghebaert, G, Ducatelle, R, y Van Immerseel, F. Una actualización sobre alternativas a los promotores del crecimiento antimicrobianos para pollos de engorde. Veterinario J. (2011) 187:182–8. doi: 10.1016/j.tvjl.2010.03.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Fresno Rueda, A, Samuel, R, and St-Pierre, B. Investigating the effects of a phytobiotics-based product on the fecal bacterial microbiome of weaned pigs. Animales. (2021) 11:1950. DOI: 10.3390/ANI11071950
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Ducatelle, R, Goossens, E, De Meyer, F, Eeckhaut, V, Antonissen, G, Haesebrouck, F, et al. Biomarcadores para el seguimiento de la salud intestinal en aves de corral: estado actual y perspectivas futuras. Vet Res. (2018) 49:43. doi: 10.1186/s13567-018-0538-6
47. Castillo, M, Martín-Orúe, S, Roca, M, Manzanilla, E, Badiola, I, Perez, J, et al. La respuesta de la microbiota gastrointestinal a la avilamicina, el butirato y los extractos de plantas en cerdos de destete temprano. J Anim Sci. (2006) 84:2725–34. DOI: 10.2527/JAS.2004-556
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Li, Z, Lin, Z, Lu, Z, Feng, Z, Chen, Q, Deng, S, et al. Coix seed improves growth performance and productivity in post-weaning pigs by reducing gut Ph and modulating gut microbiota. AMB Express. (2019) 9:115. doi: 10.1186/s13568-019-0828-z
49. Iqbal, Y, Cottrell, JJ, Suleria, HA, and Dunshea, FR. Gut microbiota-polyphenol interactions in chicken: a review. Animals. (2020) 10:1391. doi: 10.3390/ani10081391
50. Suzuki, T. Regulation of the intestinal barrier by nutrients: the role of tight junctions. Anim Sci J. (2020) 91:e13357. doi: 10.1111/asj.13357
51. Mayangsari, Y, and Suzuki, T. Resveratrol ameliorates intestinal barrier defects and inflammation in colitic mice and intestinal cells. J Agric Food Chem. (2018) 66:12666–74. doi: 10.1021/acs.jafc.8b04138
52. Azuma, T, Shigeshiro, M, Kodama, M, Tanabe, S, and Suzuki, T. Supplemental naringenin prevents intestinal barrier defects and inflammation in colitic mice. J Nutr. (2013) 143:827–34. doi: 10.3945/jn.113.174508
53. Burt, S. Essential oils: their antibacterial properties and potential applications in foods—a review. Int J Food Microbiol. (2004) 94:223–53. doi: 10.1016/j.ijfoodmicro.2004.03.022
54. Panghal, M, Kaushal, V, and Yadav, JP. In vitro antimicrobial activity of ten medicinal plants against clinical isolates of oral cancer cases. Ann Clin Microbiol Antimicrob. (2011) 10:21. doi: 10.1186/1476-0711-10-21
55. Si, W, Gong, J, Tsao, R, Zhou, T, Yu, H, Poppe, C, et al. Antimicrobial activity of essential oils and structurally related synthetic food additives towards selected pathogenic and beneficial gut bacteria. J Appl Microbiol. (2006) 100:296–305. doi: 10.1111/j.1365-2672.2005.02789.x
56. Yang, C, Chowdhury, MK, Hou, Y, and Gong, J. Phytogenic compounds as alternatives to in-feed antibiotics: potentials and challenges in application. Pathogens. (2015) 4:137–56. doi: 10.3390/pathogens4010137
57. Salehi, B, Mishra, AP, Shukla, I, Sharifi-Rad, M, Contreras, MM, Segura-Carretero, A, et al. Thymol, thyme, and other plant sources: health and potential uses. Phytother Res. (2018) 32:1688–706. doi: 10.1002/ptr.6109
58. Valenzuela-Grijalva, NV, Pinelli-Saavedra, A, Muhlia-Almazan, A, Domínguez-Díaz, D, and González-Ríos, H. Dietary inclusion effects of phytochemicals as growth promoters in animal production. J Anim Sci Technol. (2017) 59:8. doi: 10.1186/s40781-017-0133-9
59. Di Pasqua, R, Betts, G, Hoskins, N, Edwards, M, Ercolini, D, and Mauriello, G. Membrane toxicity of antimicrobial compounds from essential oils. J Agric Food Chem. (2007) 55:4863–70. doi: 10.1021/jf0636465
60. Gill, A, and Holley, R. Inhibition of membrane bound atpases of Escherichia Coli and Listeria Monocytogenes by plant oil aromatics. Int J Food Microbiol. (2006) 111:170–4. doi: 10.1016/j.ijfoodmicro.2006.04.046
61. Zhou, F, Ji, B, Zhang, H, Jiang, H, Yang, Z, Li, J, et al. Synergistic effect of thymol and carvacrol combined with chelators and organic acids against Salmonella Typhimurium. J Food Prot. (2007) 70:1704–9. doi: 10.4315/0362-028X-70.7.1704
62. Omonijo, FA, Ni, L, Gong, J, Wang, Q, Lahaye, L, and Yang, C. Essential oils as alternatives to antibiotics in swine production. Anim Nutr. (2018) 4:126–36. doi: 10.1016/j.aninu.2017.09.001
63. Chang, SY, Song, MH, Lee, JH, Oh, HJ, Kim, YJ, An, JW, et al. Los aditivos fitogénicos para piensos alivian el daño intestinal patógeno inducido por Escherichia Coli al mejorar la integridad de la barrera e inhibir la inflamación en cerdos destetados. J Anim Sci Biotechnol. (2022) 13:107. DOI: 10.1186/S40104-022-00750-Y
64. Huang, C, Wang, Y, He, X, Jiao, N, Zhang, X, Qiu, K, et al. La implicación de las vías Nf-Κb/P38 en extractos de Scutellaria baicalensis atenuando la lesión intestinal aguda inducida por Escherichia Coli K88 en lechones destetados. H. J Nutr. (2019) 122:152–61. doi: 10.1017/S0007114519000928
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Cruzen, S, Baumgard, L, Gabler, N, Pearce, S, and Lonergan, S. Respuesta proteómica temporal al estrés por calor agudo en el sarcoplasma del músculo porcino. J Anim Sci. (2017) 95:3961–71. doi: 10.2527/jas2017.1375
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Hao, Y, Xing, M, and Gu, X. Research progress on oxidative stress and its nutritional regulation strategies in pigs. Animales. (2021) 11:1384. doi: 10.3390/ani11051384
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Tsai, W-H, Yang, C-C, Li, P-C, Chen, W-C, y Chien, C-T. Potencial terapéutico de la medicina tradicional china sobre enfermedades inflamatorias. J Tradit Complemento Med. (2013) 3:142–51. doi: 10.4103/2225-4110.114898
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Shingnaisui, K, Dey, T, Manna, P, y Kalita, J. Therapeutic potentials of Houttuynia Cordata Thunb. Contra la inflamación y el estrés oxidativo: una revisión. J Etnofarmacol. (2018) 220:35–43. doi: 10.1016/j.jep.2018.03.038
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Shaw, P, y Chattopadhyay, A. Nrf2–are signaling in cellular protection: mechanism of action and the regulatory mechanisms. J Cell Physiol. (2020) 235:3119–30. doi: 10.1002/jcp.29219
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Niture, SK, Kaspar, JW, Shen, J y Jaiswal, AK. Señalización Nrf2 y supervivencia celular. Toxicol Appl Pharmacol. (2010) 244:37–42. doi: 10.1016/j.taap.2009.06.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Kaltschmidt, C, Greiner, JF y Kaltschmidt, B. El factor de transcripción Nf-Κb en células madre y desarrollo. Células. (2021) 10:2042. doi: 10.3390/cells10082042
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Wang, X, Wang, Y, Mao, Y, Hu, A, Xu, T, Yang, Y, et al. Los efectos beneficiosos de la medicina tradicional china sobre el estado antioxidante y la expresión de citoquinas inflamatorias en el hígado de los lechones. Front Vet Sci. (2022) 9:937745. doi: 10.3389/fvets.2022.1063573
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Park, MH, y Hong, JT. Roles de Nf-Κb en el cáncer y las enfermedades inflamatorias y sus enfoques terapéuticos. Células. (2016) 5:15. doi: 10.3390/cells5020015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
74. Liu, T, Zhang, L, Joo, D, y Sun, S-C. Señalización de Nf-Κb en inflamación. Objetivo de transducción de señal ther. (2017) 2:1–9. doi: 10.1038/sigtrans.2017.23
75. Trachootham, D, Lu, W, Ogasawara, MA, Valle, NR-D, y Huang, P. Redox regulation of cell survival. Señal redox antioxidante. (2008) 10:1343–74. DOI: 10.1089/ARS.2007.1957
Resumen de PubMed | Texto completo de CrossRef | Google Académico
76. Cao, S, Shen, Z, Wang, C, Zhang, Q, Hong, Q, He, Y, et al. El resveratrol mejora la función de barrera intestinal, alivia la disfunción mitocondrial e induce mitofagia en lechones con problemas diquat 1. Función de alimentos. (2019) 10:344–54. DOI: 10.1039/C8FO02091D
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Bartoš, P, Dolan, A, Smutný, L, Šístková, M, Celjak, I, Šoch, M, et al. Efectos de los aditivos fitogénicos para piensos en el rendimiento del crecimiento y en las emisiones de amoníaco y gases de efecto invernadero en cerdos en crecimiento-acabado. Anim Feed Sci Technol. (2016) 212:143–8. doi: 10.1016/j.anifeedsci.2015.11.003
78. Jugl-Chizzola, M, Ungerhofer, E, Gabler, C, Hagmüller, W, Chizzola, R, Zitterl-Eglseer, K, et al. Ensayo de la palatabilidad de Thymus Vulgaris L. y Origanum Vulgare L. como aditivo aromatizante para piensos para cerdos destetados sobre la base de un experimento de elección. Berl Munch Tierarztl Wochenschr. (2006) 119:238–43.
79. Schöne, F, Vetter, A, Hartung, H, Bergmann, H, Biertümpfel, A, Richter, G, et al. Efectos de los aceites esenciales de hinojo (Foeniculi Aetheroleum) y alcaravea (Carvi Aetheroleum) en cerdos. J Anim Physiol Anim Nutr. (2006) 90:500–10. doi: 10.1111/j.1439-0396.2006.00632.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
80. Zhai, H, Liu, H, Wang, S, Wu, J y Kluenter, A-M. Potencial de los aceites esenciales para aves y cerdos. Anim Nutr. (2018) 4:179–86. doi: 10.1016/j.aninu.2018.01.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
81. Costa, L, Luciano, F, Miyada, VS, and Gois, F. Herbal extracts and organic acids as natural feed additives in pig diets. South Afr J Anim Sci. (2013) 43:181–93.
82. Jamroz, D, Wiliczkiewicz, A, Wertelecki, T, Orda, J, y Skorupińska, J. Use of active substances of plant origin in chicken diets based on maize and local growing cereals. Br Poult Sci. (2005) 46:485–93. DOI: 10.1080/00071660500191056
83. Jang, I, Ko, Y, Kang, S, and Lee, C. Effect of a commercial essential oil on growth performance, digestive enzyme activity and intestinal microflora population in burler chickens. Anim Feed Sci Technol. (2007) 134:304–15. doi: 10.1016/j.anifeedsci.2006.06.009
84. Diaz-Sanchez, S, D’Souza, D, Biswas, D, and Hanning, I. Botanical alternatives to antibiotics for use in organic poultry production. Poult Sci. (2015) 94:1419–30. DOI: 10.3382/ps/pev014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
85. Ahmed, ST, Mun, H-S, Islam, MM, Ko, S-Y, y Yang, C-J. Efectos de la combinación de hierbas dietéticas naturales y fermentadas sobre el rendimiento del crecimiento, los rasgos de la canal y la calidad de la carne en cerdos de crecimiento-acabado. Carne Sci. (2016) 122:7–15. doi: 10.1016/j.meatsci.2016.07.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
86. Hashemi, S, y Davoodi, H. Phytogenics as new class of feed additive in poultry industry. J Anim Vet Adv. (2010) 9:2295–304. doi: 10.3923/javaa.2010.2295.2304
87. Zhang, G, Lee, Y, Wang, Z-Y, and Wang, Y. Synthesis and bioactivities of plant-derived biomolecules. Planta Frontal Sci. (2022) 13:949057. DOI: 10.3389/FPLS.2022.1077403
Resumen de PubMed | Texto completo de CrossRef | Google Académico
88. Wenk, C. Herbs and botanicals as feed additives in Monogastric animals. Australas asiáticas J Anim Sci. (2003) 16:282–9. DOI: 10.5713/AJAS.2003.282
Glosario
Palabras clave: fitobióticos, porcinos, salud, rendimiento de crecimiento, modos de acción
Cita: Pandey S, Kim ES, Cho JH, Song M, Doo H, Kim S, Keum GB, Kwak J, Ryu S, Choi Y, Kang J, Choe J y Kim HB (2023) Conocimiento de vanguardia sobre los roles de los fitobióticos y sus modos de acción propuestos en cerdos. Frente. Vet. Sci. 10:1265689. doi: 10.3389/fvets.2023.1265689
Recibido: 23 de julio de 2023; Aprobado: 06 Septiembre 2023;
Publicado: 20 septiembre 2023.
Editado por:
HongGu Lee, Universidad de Konkuk, República de Corea
Revisado por:
Jingui Li, Universidad de Yangzhou, China
Derechos de autor © 2023 Pandey, Kim, Cho, Song, Doo, Kim, Keum, Kwak, Ryu, Choi, Kang, Choe y Kim. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Hyeun Bum Kim, hbkim@dankook.ac.kr
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía