Los niveles de expresión sérica y tisular de la leptina y el receptor de leptina son marcadores putativos de subtipos específicos de carcinoma mamario felino
Los niveles de expresión sérica y tisular de la leptina y el receptor de leptina son marcadores putativos de subtipos específicos de carcinoma mamario felino
 Andreia Gameiro,
Andreia Gameiro,  Catarina Nascimento,
Catarina Nascimento,  Ana Catarina Urbano,
Ana Catarina Urbano,  Jorge Correia y
Jorge Correia y  Fernando Ferreira*
Fernando Ferreira*- CIISA – Centro de Investigação Interdisciplinar em Sanidade Animal, Faculdade de Medicina Veterinária da Universidade de Lisboa, Lisbon, Portugal
La obesidad es un factor de riesgo establecido para el cáncer de mama en mujeres posmenopáusicas, que se asocia con niveles séricos elevados de leptina. Aunque el sobrepeso es una condición común en el gato, el papel de la leptina y su receptor en el carcinoma mamario felino sigue sin resolverse. En este estudio, se investigaron los niveles séricos de leptina y receptores de leptina (ObR) en 58 gatos con carcinoma mamario y se compararon con los de animales sanos, al igual que los niveles de expresión de leptina y ObR en tejidos tumorales. Los resultados mostraron que el Índice de Leptina Libre está significativamente disminuido en gatos con carcinoma mamario (p = 0,0006), particularmente en aquellos con tumores luminales B y HER2 positivos, y que estos animales también presentan niveles de leptina sérica significativamente más bajos (p < 0,0001 y p < 0,005, respectivamente). Curiosamente, los tumores ulcerantes (p = 0,0005) y la supervivencia libre de enfermedad más corta (p = 0,0217) se asociaron a niveles séricos de leptina superiores a 4,17 pg/ml. En contraste, se encontraron niveles séricos elevados de ObR en todos los gatos con carcinoma mamario (p < 0.0001), con niveles superiores a 16.89 ng / ml asociados con tumores más pequeños (p = 0.0118), estado negativo del receptor de estrógeno (p = 0.0291) y niveles séricos aumentados de CTLA-4 (p = 0.0056), TNF-α (p = 0.0025), PD-1 (p = 0.0023) y PD-L1 (p = 0,0002). En muestras tumorales, la leptina se sobreexpresa en carcinomas luminales B y triple negativos (p = 0,0046), mientras que ObR se encuentra sobreexpresada en tumores luminales B (p = 0,0425). En conjunto, nuestros resultados apoyan la hipótesis de que los niveles séricos de leptina y ObR pueden usarse como biomarcadores de subtipos específicos de carcinoma mamario felino, y sugieren el uso de antagonistas de la leptina como herramienta terapéutica, reforzando la utilidad del gato como modelo de cáncer.
Introducción
El carcinoma mamario felino (CMF) es una enfermedad de alta prevalencia (12-40% de todos los tumores en el gato) que muestra características clínicas y genéticas similares (1), en comparación con el cáncer de mama humano (2), apoyando su uso en estudios oncológicos comparativos (3, 4), y permitiendo mejorar los protocolos terapéuticos para mujeres y gatos (5). A pesar de que el gato se considera un modelo de cáncer adecuado, especialmente para los subtipos de carcinomas mamarios más agresivos, HER2-posiitve (2, 6) y triple negativo (6-8), se necesitan más esfuerzos para rastrear la progresión de la enfermedad (9). Algunos biomarcadores comunes ya están identificados, como por ejemplo, el receptor de andrógenos (1), el PD-1 (10) y el CTLA-4 (11), que representan posibles dianas terapéuticas moleculares. Asimismo, la obesidad es un trastorno nutricional común en el gato, con mayor prevalencia en animales de interior y esterilizados mayores de 3 años de edad (12). En humanos, la obesidad induce un estado inflamatorio crónico, siendo un factor de riesgo para el cáncer de mama (13-15).
La leptina es una adipocitocina de 16 kDa, codificada por el gen obeso e involucrada en la regulación central de la ingesta de alimentos, la homeostasis energética, la modulación de la función reproductiva y los procesos metabólicos periféricos, como el desarrollo de la glándula mamaria, la proliferación celular y la angiogénesis (16-18). En los tejidos y el suero, la expresión de leptina está modulada por la masa grasa, con gatos sanos que muestran niveles séricos de leptina más bajos que los animales obesos (12), como se informó en humanos (13, 14). Curiosamente, aunque esta proteína es secretada principalmente por los adipocitos, también puede ser expresada por células alteradas patológicamente, como las células cancerosas (19, 20). Por lo tanto, las células malignas pueden regular sus actividades metabólicas (21), promoviendo el crecimiento celular incontrolado a través de Wnt / β-catenina (22), migración, invasión y angiogénesis (15, 23) y regulando negativamente la apoptosis a través de un mecanismo dependiente de Bcl-2 (21, 24). En consecuencia, la sobreexpresión de leptina se detecta en células de cáncer de mama y adipocitos vecinos, en contraste con las células epiteliales glandulares de mama normales (15, 25), promoviendo la expresión de varios factores tisulares (26), lo que sugiere un papel oncogénico para esta adipocitocina (14). Además, los estudios en pacientes con cáncer de mama humano mostraron que la sobreexpresión de leptina tiene efectos paracrinos, no siempre reflejados en los niveles séricos, pero asociados con tumores más agresivos y resistencia a la terapia (25). Además, en pacientes humanos con sobrepeso se encontró una correlación positiva entre la sobreexpresión de leptina en el microambiente tumoral y el cáncer de mama positivo para el receptor de estrógeno (ER), y con un estado positivo para el receptor 2 del factor de crecimiento epidérmico humano (HER 2) frecuentemente relacionado con un fenotipo tumoral más invasivo (27).
Paralelamente, se encontró que el receptor de leptina (ObR, 150-190 kDa) estaba involucrado en la inmunidad innata y adaptativa (28), expresándose en varios órganos, incluidos los tejidos mamarios y periféricos, así como en los adipocitos (29, 30) y las células inmunes. ObR tiene un dominio N-terminal extracelular, un dominio transmembrana y un dominio C-terminal citoplasmático. Tras la ligadura de leptina, ObR homodimeriza y el monómero JAK asociado se autofosforila para activar las vías de señalización aguas abajo (19); en el caso de las formas ObR con falta de capacidades de autofosforilación, las quinasas auxiliares son importantes (29). La forma ObR soluble es una proteína de 146 kDa (31) que puede generarse por apoptosis celular o por la escisión proteolítica del dominio proteico anclado extracelular, siendo este desprendimiento más frecuente en isoformas intracelulares más cortas. En suero, ObR modula la biodisponibilidad de leptina, disminuida en humanos obesos (19). En pacientes con cáncer de mama, la obr se sobreexpresa independientemente del estado de ER (14), correlacionada con una baja supervivencia general (SG) (20). Además, la relación entre los niveles séricos de leptina/ObR (Índice de leptina libre, FLI) se considera un predictor útil de la actividad de la leptina, que refleja el estado metabólico individual (32) y cuando aumenta es un factor de riesgo importante para el desarrollo del cáncer de mama (33). Paralelamente, estudios en pacientes con cáncer de mama encontraron una asociación entre la sobreexpresión de leptina y ObR con un estado inflamatorio crónico, condicionando las respuestas inmunes de las células T (aumentar las respuestas Th1 y disminuir las respuestas Th2) (34) y la activación de inhibidores del punto de control inmunitario (29). De hecho, algunos estudios en humanos han demostrado una correlación positiva entre la sobreexpresión de leptina y ObR con varias moléculas inmunomoduladoras (por ejemplo, la proteína 4-CTLA-4 asociada a linfocitos T citotóxicos; Factor de necrosis tumoral α-TNF-α; Muerte celular programada-1-PD-1 y ligando de muerte celular programada 1-PD-L1) (35, 36). Mientras que CTLA-4 es una proteína relacionada con la respuesta inflamatoria que se incrementa en pacientes con cáncer de mama, contribuyendo a la regulación inmune a la baja (37), el TNF-α es una citoquina proinflamatoria que induce la apoptosis promovida por la ausencia de leptina (38). Además, la sobreexpresión de PD-1 en las células T se asocia con la sobreexpresión de ObR en humanos con distintos tipos de tumores (39), inducida a través de la activación de la vía AKT por estrógenos (40) y es responsable de la disfunción de las células T mediada por PD-1 (41).
Como se mencionó anteriormente, la obesidad se asocia con un aumento de los niveles de leptina, lo que induce resistencia a la quimioterapia (42, 43). Por lo tanto, el eje leptina/ObR ha sido ampliamente estudiado (44) como diana para una terapia adyuvante, no solo en el estado tumoral ER-positivo (42), sino también en tumores triple negativos (45), en los que la falta de receptores hormonales reduce las opciones terapéuticas. Hoy en día, se están utilizando diferentes estrategias terapéuticas dirigidas al eje leptina/ObR, a saber, antagonistas de la leptina, que regulan a la baja las vías descendentes de leptina (por ejemplo, Wnt y STAT3) (42, 44-46), anticuerpos monoclonales específicos de leptina y ObR o nanopartículas, que impiden la unión leptina/ObR y, finalmente, moléculas solubles de ObR que encierran la leptina plasmática, regulando su disponibilidad (46).
Hasta donde sabemos, este estudio es el primero en evaluar los niveles séricos de leptina y ObR, así como la expresión tisular tumoral de leptina y ObR en gatos con carcinoma mamario. Por lo tanto, los principales objetivos de este estudio fueron: (1) comparar los niveles séricos de leptina y ObR de gatos con carcinoma mamario estratificado por subtipo molecular con los de animales sanos; (2) investigar la expresión de leptina y ObR en tejidos tumorales y compararla con tejidos mamarios normales; (3) buscar asociaciones estadísticas entre los niveles séricos de leptina/ObR y las puntuaciones IHC de leptina/ObR en tejidos mamarios tumorales; y (4) probar las asociaciones estadísticas entre los niveles séricos de leptina/ObR y las características clínico-patológicas, con el fin de evaluar la utilidad de la leptina y el ObR como biomarcadores diagnósticos y/o pronósticos o dianas farmacológicas prometedoras en gatos con carcinoma mamario.
Materiales y métodos
Población animal
Se recolectaron muestras pareadas de tumores y suero de 58 gatas, con antecedentes completamente documentados de FMC, que exhibían una edad media en el momento del diagnóstico de 11,5 años (rango 6,5-18 años), y la mayoría mostraba una raza indiferenciada y presentaba una puntuación promedio de condición corporal (1-9) de 3,73 (que oscilaba entre 1 y 7). Además, se recolectaron 24 muestras de suero de gatos sanos presentadas para ovariohisterectomía electiva que muestran una edad media de 1,37 años (rango 0,5-5,5 años) y una puntuación promedio de condición corporal (1-9) de 5,0 (que oscila entre 4 y 6), en el Hospital Universitario de la Facultad de Medicina Veterinaria de la Universidad de Lisboa. Todos los procedimientos que implican la manipulación de animales fueron consentidos por los propietarios. Para cada animal inscrito en el estudio, se registraron los datos clínico-patológicos, incluyendo: edad; raza; peso corporal; reproductivo; y el estado de administración de anticonceptivos; estado del tratamiento (ninguno, mastectomía o mastectomía más quimioterapia); número, ubicación, tamaño y clasificación histopatológica; estado ER, estado PR, estado HER2 (47) e índice Ki-67 (48) de lesiones tumorales; grado de malignidad, calificado utilizando el sistema de Elston y Ellis (49); presencia de necrosis tumoral, invasión linfática, infiltración linfocítica y/o ulceración cutánea; afectación de los ganglios linfáticos regionales; y estadio clínico (sistema TNM) (Tabla 1). En cuanto al subtipificación molecular de los carcinomas mamarios felinos (2, 50), los animales se estratificaron en grupos luminal A (n = 10), luminal B (n = 17), HER2 positivo (n = 15) y triple negativo (n = 16). Los animales fueron anestesiados antes de los procedimientos quirúrgicos y se recogieron muestras de sangre sin interferir con el bienestar de los animales. Brevemente, todas las muestras de tejido se incrustaron en parafina después de la fijación en formalina neutralizada tamponada al 10% (pH 7.2), durante 24-48 h, mientras que las muestras de suero se separaron de la sangre coagulada por centrifugación (1,500 g, 10 min, 4 ° C) y se almacenaron a -80 ° C hasta su uso posterior. Todas las muestras que mostraban hemólisis fueron descartadas, como se recomienda (2, 51).
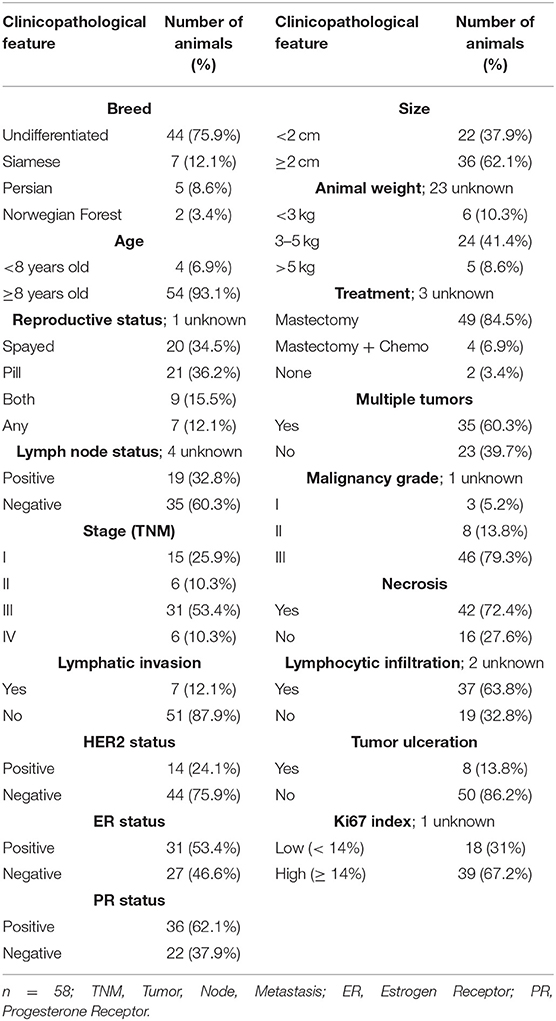 TABLA 1. Características clinicopatológicas de las gatas con carcinomas mamarios inscritas en este estudio.
TABLA 1. Características clinicopatológicas de las gatas con carcinomas mamarios inscritas en este estudio.
Medición de los niveles séricos de leptina y ObR
Los niveles séricos de leptina y ObR, CTLA-4, TNF-α (11), PD-1 y PD-L1 (10) se cuantificaron mediante el uso de kits comerciales basados en ELISA (R&D Systems, Minneapolis, EUA; DY398-05, DY389, DY476, DY2586, DY1086 y DY156, respectivamente). Para cada ensayo, se trazó una curva estándar utilizando diluciones seriadas de 10 veces de las proteínas recombinantes proporcionadas por el fabricante, y el r2 Los valores se calcularon mediante una regresión cuadrática [r2 = 0,9976 para la leptina, r2 = 0,9632 para ObR, r2 = 0,99 para PD-1, y r2 = 0,96 para PD-L1 (10)], mientras que las concentraciones séricas de CTLA-4 y TNF-α se determinaron mediante una ecuación de ajuste de curva (r2 > 0,99), como se informó anteriormente (11). Brevemente, se preparó una placa de 96 pocillos agregando el anticuerpo de captura a cada pocillo e incubando durante la noche. Las placas se trataron con albúmina sérica bovina (BSA) al 1% en solución salina tamponada con fosfato (PBS) durante 1 h, para evitar la unión inespecífica. Se añadieron muestras estándar y de suero diluido a los pocillos de muestra y se incubaron durante 2 h a temperatura ambiente (RT), seguidas de incubación con el anticuerpo de detección durante 2 h a RT. Posteriormente, la estreptavidina conjugada a peroxidasa de rábano picante (HRP) se añadió a cada pocillo y se incubó a RT durante 20 min antes de la adición de la solución de sustrato en 1:1 H2O2 y tetrametilbencidina a cada pocillo (20 min a RT en la oscuridad). La reacción fue interrumpida añadiendo una solución de parada (2NH2Así que4) y la absorbancia se midió mediante un espectrofotómetro (FLUOStar OPTIMA, Microplate Reader, BMG, Ortenberg, Alemania), utilizando 450 nm como longitud de onda primaria y 570 nm como longitud de onda de referencia. Después de la medición sérica de leptina y ObR, el FLI se calculó en función de la relación entre los niveles séricos de leptina / ObR (32).
Evaluación del estado de leptina y ObR por inmunohistoquímica (IHC)
Inicialmente, las muestras de carcinoma mamario felino con paraffin fijo incrustado en parafina (FFPE) se tiñeron con hematoxilina-eosina para seleccionar un área tumoral representativa (n = 58) y un área de tejido normal para ser utilizada como control (n = 20). Las muestras de FFPE se seccionaron en rodajas de 3 μm de espesor (Microtomo Leica RM135, Newcastle, Reino Unido) y se montaron en un portaobjetos de vidrio (SuperFrost Plus, Thermo Fisher Scientific, Massachusetts, EE. UU.). En el módulo PT-Link (DAKO, Agilent, Santa Clara, USA), las muestras se desparafinaron, se hidrataron y se realizó la recuperación de antígenos durante 20 min a 96°C utilizando Tris-EDTA tampón pH 9.0 (EnVision™ Flex Target Retrieval Solution High pH, DAKO). Luego, los toboganes se enfriaron durante 30 minutos en RT y se sumergieron dos veces durante 5 minutos en agua destilada. La técnica IHC se realizó con soluciones comerciales del Novolink™ Max Polymer Detection System Kit (Leica Biosystems, Newcastle, Reino Unido). Antes de la incubación de anticuerpos, las muestras de tejido se trataron con Peroxidase Block Novocastra Solution (Leica Biosystems) durante 15 min y el reconocimiento antigénico inespecífico se inhibió mediante incubación con Protein Block Novocastra Solution (Leica Biosystems) durante 10 min. Finalmente, las muestras de tejido se incubaron en RT durante 1 h, en una cámara humidificada, con los siguientes anticuerpos primarios: anticuerpo antileptina (ab3583, Abcam, Cambridge, Reino Unido) y anticuerpo anti-ObR (ab104403, Abcam), ambos diluidos a 1:200. Los portaobjetos se lavaron dos veces, durante 5 minutos, entre todos los pasos de incubación, utilizando una solución de PBS a pH 7,4. Luego, el polímero de detección se incubó durante 30 min en RT, y la detección se realizó utilizando diaminobencidina (tampón de sustrato DAB y cromogen DAB, Leica Biosystems) durante 5 min. Posteriormente, las muestras se tensaron con hematoxilina Gills (Merck, Nueva Jersey, EE.UU.) durante 5 min, se deshidrataron en un gradiente de etanol y xileno, y se montaron utilizando el medio de montaje Entellan (Merck). Se predijo que los anticuerpos reaccionarían con las proteínas felinas, que ocurren en la membrana celular y el citoplasma (52, 53). El tejido mamario humano y el hígado felino se utilizaron como controles positivos para la tinción de leptina, mostrando una tinción positiva en células glandulares (25, 52), hepatocitos (54, 55) y una tinción débil en colangiocitos (56), respectivamente. Para la ObR, el riñón humano y felino se utilizaron como controles positivos, mostrando una inmunotinción en células tubulares y algunas glomerulares, como se informó anteriormente (55, 57). Las secciones de los tejidos mamarios felinos analizados se utilizaron como controles negativos.
La leptina y el ObR se evaluaron en el epitelio glandular del tumor, el tejido estromal y las células inflamatorias infiltrantes del tumor. Para acceder a la inmunorreactividad de las proteínas utilizamos un sistema de puntuación previamente reportado (14, 25, 52) y el H-Score publicado por la Sociedad Americana de Oncología Clínica (ASCO). La puntuación final de IHQ se obtuvo multiplicando las células positivas (0 = ausencia de tinción; 1 = todas las células teñidas), por la intensidad de tinción más alta (Tabla 2), variando de 0 a 3, con muestras de tejido calificadas como 0 consideradas negativas, y muestras calificadas como 3 como altamente reactivas. Todas las diapositivas fueron sometidas a puntuación ciega, por dos patólogos independientes y experimentados.
Análisis estadístico
El análisis estadístico se realizó utilizando el software GraphPad Prism, versión 5.04 (California, EUA), con p de dos colas < 0,05 consideradas estadísticamente significativas para un nivel de confianza del 95% (p < 0,05, p < 0,01 y p < 0,001) y los valores promedio se representaron con la desviación estándar.******
La prueba no paramétrica de Kruskal-Wallis se realizó para comparar los resultados de leptina y ObR entre gatos sanos y gatos con carcinomas mamarios estratificados por subtipo tumoral. Se realizaron curvas de características operativas del receptor (ROC) para elegir el valor de corte óptimo para los niveles séricos de leptina y ObR, y para determinar la especificidad y sensibilidad de la técnica para diagnosticar la enfermedad. Se utilizó la prueba no paramétrica de Mann-Whitney para comparar los niveles séricos de ambas proteínas con varias características clínico-patológicas. El análisis de supervivencia se realizó mediante la prueba de Kaplan-Meier para evaluar la supervivencia libre de enfermedad (SSE) en gatos con carcinomas mamarios. Las correlaciones entre los niveles séricos de ObR y las concentraciones séricas de CTLA-4, TNF-α, PD-1 y PD-L1 previamente informadas (10, 11) se investigaron utilizando el coeficiente de correlación de rango de Spearman.
Resultados
Los gatos con carcinoma mamario mostraron un índice de leptina libre más bajo
El índice de leptina libre (FLI) se determinó en las muestras de suero de gatos con carcinomas mamarios y se comparó con animales sanos. Los resultados obtenidos mostraron que los gatos con enfermedad tenían un FLI significativamente menor que el grupo control (0,44 vs. 0,86, p = 0,0006, Figura 1). Además, se obtuvieron los mismos resultados si los valores atípicos se eliminaron del análisis (p = 0,0005).
 FIGURA 1. Diagrama de diagrama de puntos que muestra que el índice de leptina libre (FLI) fue significativamente elevado en animales sanos que en gatos con carcinoma mamario (***p = 0,0006).
FIGURA 1. Diagrama de diagrama de puntos que muestra que el índice de leptina libre (FLI) fue significativamente elevado en animales sanos que en gatos con carcinoma mamario (***p = 0,0006).
Además, los resultados revelaron que el peso corporal no influyó en los niveles séricos de leptina y ObR, tanto en el grupo control (p = 0,0760 y p = 0,8432, respectivamente, Figuras 2A, B) como en el grupo de cáncer (p = 0,3294 y p = 0,9722, respectivamente, Figuras 2C, D).
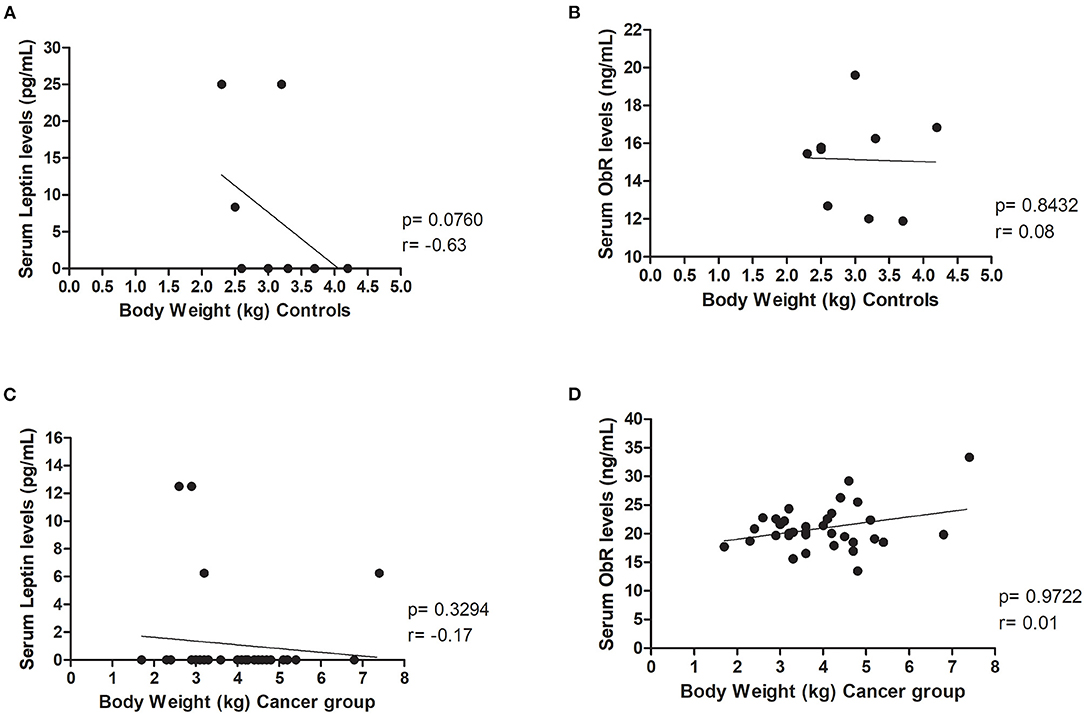 FIGURA 2. El peso corporal no influyó en la leptina, ni en los niveles séricos de ObR en animales sanos y enfermos. No se encontraron correlaciones entre (A) los niveles séricos de leptina (p = 0,0760) o (B) ObR (p = 0,8432) y el peso corporal en el grupo control. Además, al evaluar el grupo de cáncer, no se detectaron correlaciones entre (C) los niveles séricos de leptina (p = 0,3294) o (D) ObR (p = 0,9722) y el peso corporal felino.
FIGURA 2. El peso corporal no influyó en la leptina, ni en los niveles séricos de ObR en animales sanos y enfermos. No se encontraron correlaciones entre (A) los niveles séricos de leptina (p = 0,0760) o (B) ObR (p = 0,8432) y el peso corporal en el grupo control. Además, al evaluar el grupo de cáncer, no se detectaron correlaciones entre (C) los niveles séricos de leptina (p = 0,3294) o (D) ObR (p = 0,9722) y el peso corporal felino.
Los gatos con carcinomas mamarios luminal B o HER2 positivos mostraron disminución de los niveles séricos de leptina
En cuanto a los niveles séricos de leptina, los resultados obtenidos mostraron que los gatos con carcinomas mamarios luminal B o HER2 positivos tenían niveles séricos de leptina más bajos que los animales sanos (0,00 vs. 13,89 pg/ml, p < 0,01; 0,83 vs. 13,89 pg/mL , p < 0,05, respectivamente, Figura 3A), y considerando el análisis sin valores atípicos, se pudieron reportar los mismos resultados (p = 0,0021). El valor de corte óptimo para predecir el carcinoma mamario fue de 4,17 pg/ml con un área bajo la curva ROC (AUC) de 0,7045 ± 0,0757 (IC 95 %: 0,5561–0,8528, p = 0,0103; sensibilidad = 96,9%; especificidad = 43,5%; Figura 3B). Considerando este análisis sin valores atípicos, se obtuvo un AUC = 0,6732 ± 0,0731 (IC 95%: 0,5299–0,8164, p = 0,0158; sensibilidad = 92,9%; especificidad = 43,4%), lo que llevó a los mismos resultados. Un análisis estadístico adicional reveló que los niveles séricos de leptina por encima del valor de corte se asociaron con ulceración tumoral (p = 0,0005, Figura 3C; o p = 0,0009, si no se consideraron valores atípicos) y una SSE más corta (117 vs . 314 días, p = 0,0217, Figura 3D; o p = 0,0245, si se eliminaron los valores atípicos).
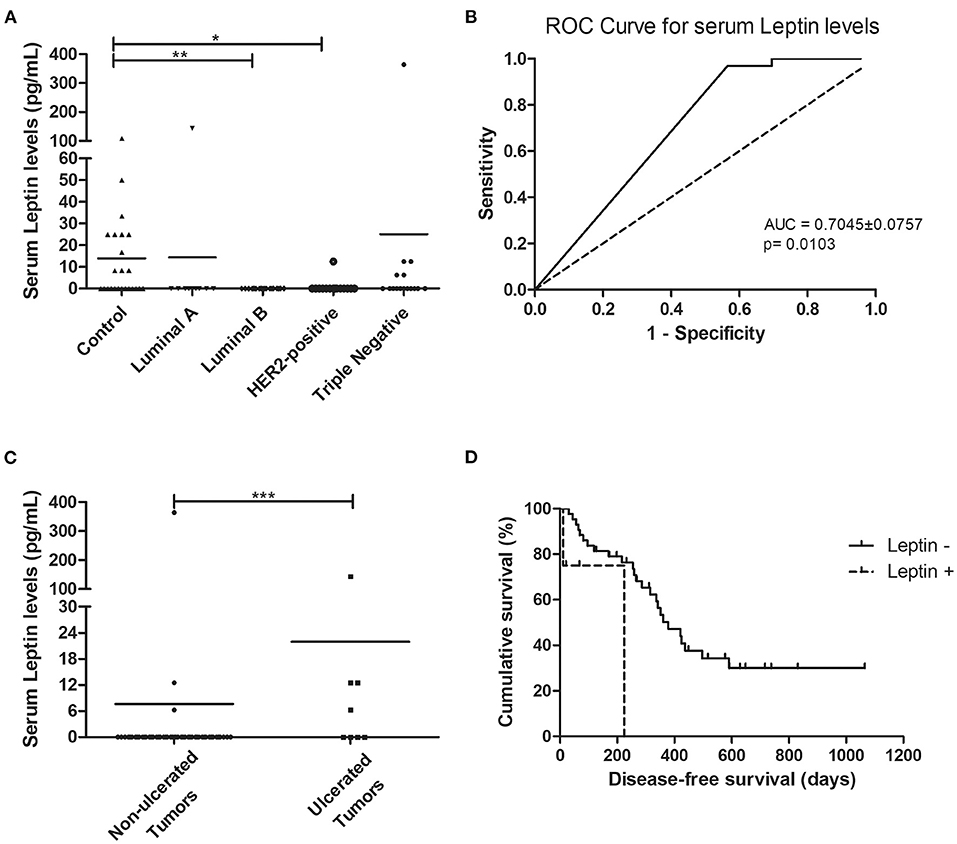 FIGURA 3. Los gatos con carcinomas mamarios luminal B y HER2 positivos mostraron niveles séricos de leptina disminuidos, aunque los gatos con tumores ulcerados exhibieron niveles séricos de leptina por encima del valor de corte de 4,17 pg/ml, lo que se asoció con una supervivencia libre de enfermedad más corta. (A) Diagrama de diagrama de puntos que muestra la distribución de los niveles séricos de leptina (pg/mL) entre animales sanos (control) y gatos estratificados por el subtipo de carcinoma mamario. Se encontró una disminución significativa de los niveles séricos de leptina en gatos que presentaban subtipos luminal B o HER2 positivos en comparación con animales sanos (p = 0,0025). (B) Se determinó que el punto de corte óptimo de los niveles séricos de leptina para predecir el carcinoma mamario maximizó la suma de la sensibilidad y la especificidad (4,17 pg/ml; AUC = 0,7045 ± 0,0757, IC 95%: 0,5561–0,8528, p = 0,0103; sensibilidad = 96,9%; especificidad = 43,5%). (C) Diagrama de diagrama de puntos que muestra que los niveles séricos de leptina fueron significativamente más altos en gatos con tumores ulcerados (p = 0,0005). (D) Los gatos con carcinoma mamario y niveles séricos de leptina superiores a 4,17 pg/ml tuvieron una SSE menor (p = 0,0217). *p < 0,05; **p < 0,01; p < 0,001.
FIGURA 3. Los gatos con carcinomas mamarios luminal B y HER2 positivos mostraron niveles séricos de leptina disminuidos, aunque los gatos con tumores ulcerados exhibieron niveles séricos de leptina por encima del valor de corte de 4,17 pg/ml, lo que se asoció con una supervivencia libre de enfermedad más corta. (A) Diagrama de diagrama de puntos que muestra la distribución de los niveles séricos de leptina (pg/mL) entre animales sanos (control) y gatos estratificados por el subtipo de carcinoma mamario. Se encontró una disminución significativa de los niveles séricos de leptina en gatos que presentaban subtipos luminal B o HER2 positivos en comparación con animales sanos (p = 0,0025). (B) Se determinó que el punto de corte óptimo de los niveles séricos de leptina para predecir el carcinoma mamario maximizó la suma de la sensibilidad y la especificidad (4,17 pg/ml; AUC = 0,7045 ± 0,0757, IC 95%: 0,5561–0,8528, p = 0,0103; sensibilidad = 96,9%; especificidad = 43,5%). (C) Diagrama de diagrama de puntos que muestra que los niveles séricos de leptina fueron significativamente más altos en gatos con tumores ulcerados (p = 0,0005). (D) Los gatos con carcinoma mamario y niveles séricos de leptina superiores a 4,17 pg/ml tuvieron una SSE menor (p = 0,0217). *p < 0,05; **p < 0,01; p < 0,001.
Los gatos con carcinoma mamario mostraron niveles séricos elevados de obR y de mediadores de inflamación
Teniendo en cuenta los resultados anteriores, también se evaluaron los niveles séricos de ObR. Cuando los animales fueron agrupados según el subtipo tumoral, se encontró una diferencia significativa entre los rangos medios de al menos un par de grupos (p < 0,0001, con o sin valores atípicos). Los resultados revelaron que los niveles séricos de ObR fueron significativamente más altos en animales con carcinoma mamario que en controles, independientemente del subtipo molecular (grupo control 15,67 ng/ml; luminal A 23,04 ng/ml, p < 0,0001; luminal B 20,18 ng/ml , p < 0,001; HER2 positivo 28,99 ng/ml, p < 0,0001; triple negativo 21,70 ng/ml, p < 0,0001; Figura 4A). Además, el valor de corte óptimo calculado para gatos con carcinoma mamario fue de 16,89 ng/ml, con un AUC de 0,9408 ± 0,0288 (IC 95%: 0,8842–0,9973, p < 0,0001; sensibilidad = 94,8%; especificidad = 87,0%; Figura 4B). Si se eliminaron los valores atípicos del análisis, se obtuvieron los mismos resultados, con un AUC = 0,9397 ± 0,0293 (IC 95%: 0,8823–0,9972, p < 0,0001; sensibilidad = 94,7%; especificidad = 87,0%).
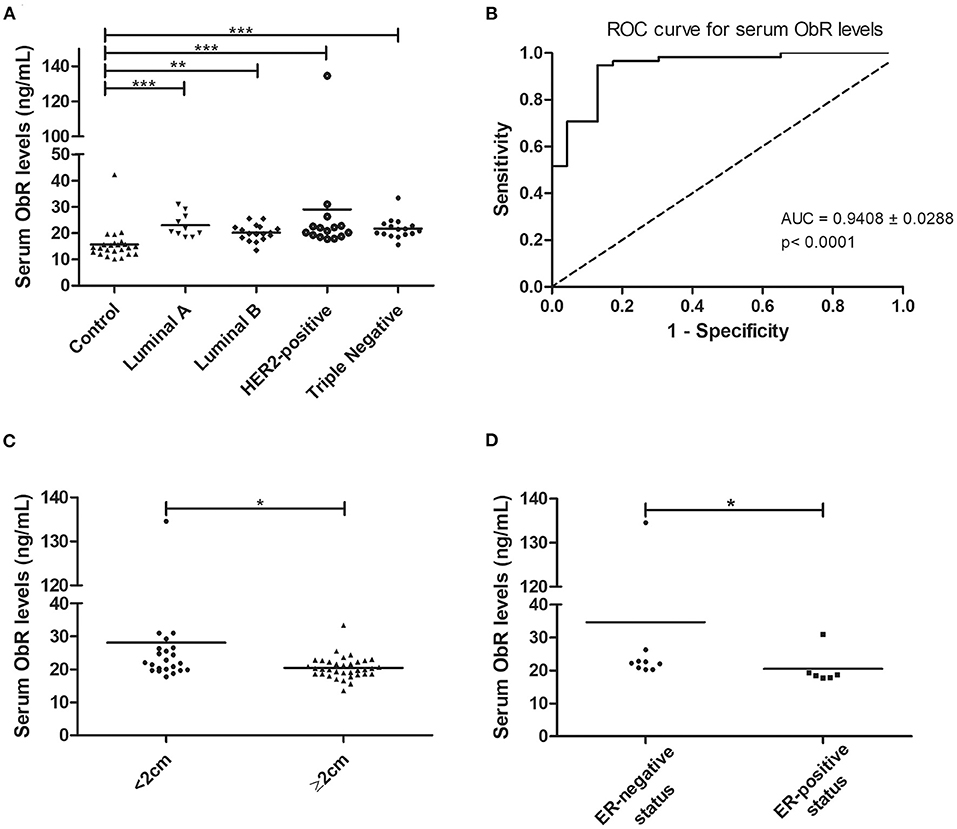 FIGURA 4. Los gatos con carcinoma mamario mostraron niveles séricos elevados de ObR, con concentraciones séricas superiores a 16,89 ng/ml asociadas con tumores más pequeños y un estado ER-negativo. (A) Diagrama de diagrama de puntos que muestra la distribución de los niveles séricos de ObR (ng / ml) en animales sanos (control) y en gatos con carcinoma mamario estratificado por el subtipo molecular. Se encontraron niveles séricos significativamente más altos de ObR en todos los subtipos tumorales en comparación con animales sanos (p < 0,0001). (B) El valor de corte óptimo de los niveles séricos de ObR para predecir gatos con carcinoma mamario fue de 16,89 ng/ml con un AUC de 0,9408 ± 0,0288 (IC 95 %: 0,8842–0,9973, p < 0,0001; sensibilidad = 94,8%; especificidad = 87,0%). (C) Diagrama de diagrama de puntos que muestra que las concentraciones séricas de ObR fueron significativamente bajas en tumores mayores de 2 cm (p = 0,0118). (D) Diagrama de diagrama de puntos que muestra una asociación positiva entre los niveles séricos más altos de ObR y el estado ER-negativo (p = 0,0291). *p < 0,05; **p < 0,01; p < 0,001.
FIGURA 4. Los gatos con carcinoma mamario mostraron niveles séricos elevados de ObR, con concentraciones séricas superiores a 16,89 ng/ml asociadas con tumores más pequeños y un estado ER-negativo. (A) Diagrama de diagrama de puntos que muestra la distribución de los niveles séricos de ObR (ng / ml) en animales sanos (control) y en gatos con carcinoma mamario estratificado por el subtipo molecular. Se encontraron niveles séricos significativamente más altos de ObR en todos los subtipos tumorales en comparación con animales sanos (p < 0,0001). (B) El valor de corte óptimo de los niveles séricos de ObR para predecir gatos con carcinoma mamario fue de 16,89 ng/ml con un AUC de 0,9408 ± 0,0288 (IC 95 %: 0,8842–0,9973, p < 0,0001; sensibilidad = 94,8%; especificidad = 87,0%). (C) Diagrama de diagrama de puntos que muestra que las concentraciones séricas de ObR fueron significativamente bajas en tumores mayores de 2 cm (p = 0,0118). (D) Diagrama de diagrama de puntos que muestra una asociación positiva entre los niveles séricos más altos de ObR y el estado ER-negativo (p = 0,0291). *p < 0,05; **p < 0,01; p < 0,001.
Además, los niveles séricos elevados de ObR se asociaron con tumores más pequeños (p = 0,0118, Figura 4C; p = 0,0248, si no se consideraron valores atípicos) y con gatos tuvieron un estado ER-negativo (p = 0,0291, Figura 4D; p = 0,0452, si no se consideraron valores atípicos). Finalmente, se encontró una correlación positiva entre los niveles séricos de ObR y los niveles séricos de CTLA-4 (r = 0,38, p = 0,0056, Figura 5A), TNF-α (r = 0,40, p = 0,0025, Figura 5B), PD-1 (r = 0,42, p = 0,0023, Figura 5C) y PD-L1 (r = 0,50, p = 0,0002 , Figura 5D). Eliminando los valores atípicos de nuestros datos, se podrían informar los mismos resultados (CTLA-4: r = 0,34, p = 0,0153; TNF-α; r = 0,37, p = 0,0064; PD-1: r = 0,39, p = 0,0002; y PD-L1: r = 0,47, p = 0,0007).
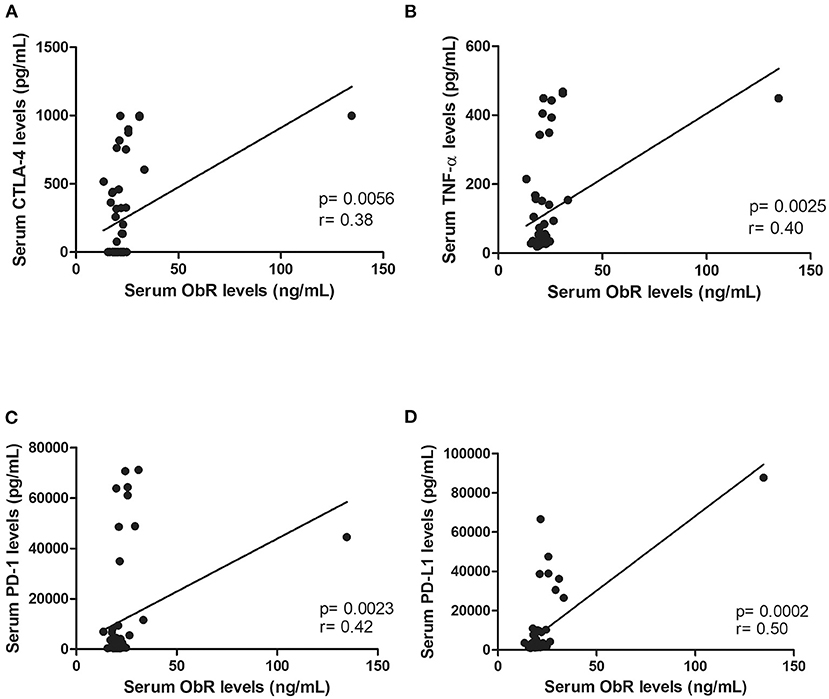 FIGURA 5. Los niveles séricos de ObR mostraron una correlación positiva con mediadores inflamatorios, a saber, (A) niveles séricos de CTLA-4 (p = 0,0056), (B) niveles séricos de TNF-α (p = 0,0025), (C) niveles séricos de PD-1 (p = 0,0023) y (D) niveles séricos de PD-L1 (p = 0,0002).
FIGURA 5. Los niveles séricos de ObR mostraron una correlación positiva con mediadores inflamatorios, a saber, (A) niveles séricos de CTLA-4 (p = 0,0056), (B) niveles séricos de TNF-α (p = 0,0025), (C) niveles séricos de PD-1 (p = 0,0023) y (D) niveles séricos de PD-L1 (p = 0,0002).
La leptina y la obR se sobreexpresan en carcinomas mamarios luminales B y triple negativos
Los resultados obtenidos revelaron que los gatos con carcinoma mamario luminal B o triple negativo mostraron una mayor puntuación IHQ de leptina en las células glandulares tumorales, en comparación con las muestras de control sanas (1,93 vs. 1,34, p < 0,05; 2,00 vs. 1,34 , p < 0,05, respectivamente; Figuras 6A, 7A, B). Con respecto al receptor de leptina, la puntuación IHQ también fue significativamente mayor en animales con un subtipo de tumor luminal B que en animales sanos (2,50 vs. 1,75; p = 0,0425; Figuras 6B, 7C, D).
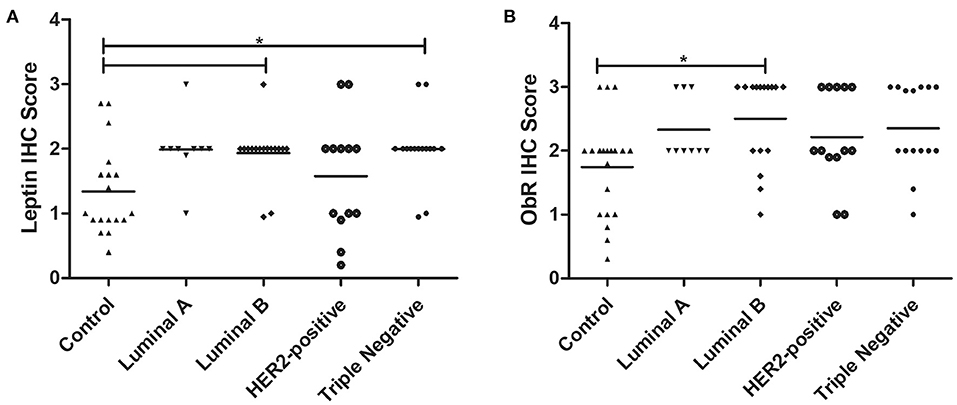 FIGURA 6. Puntuaciones finales de IHQ para leptina (A) y ObR (B) en gatos con carcinoma mamario estratificado por el subtipo tumoral y comparado con controles. (A) La expresión de leptina fue significativamente mayor en los subtipos luminal B y triple negativo (p = 0,0046). (B) La expresión de ObR fue estadísticamente mayor en el subtipo tumoral luminal B (p = 0,0425).
FIGURA 6. Puntuaciones finales de IHQ para leptina (A) y ObR (B) en gatos con carcinoma mamario estratificado por el subtipo tumoral y comparado con controles. (A) La expresión de leptina fue significativamente mayor en los subtipos luminal B y triple negativo (p = 0,0046). (B) La expresión de ObR fue estadísticamente mayor en el subtipo tumoral luminal B (p = 0,0425).
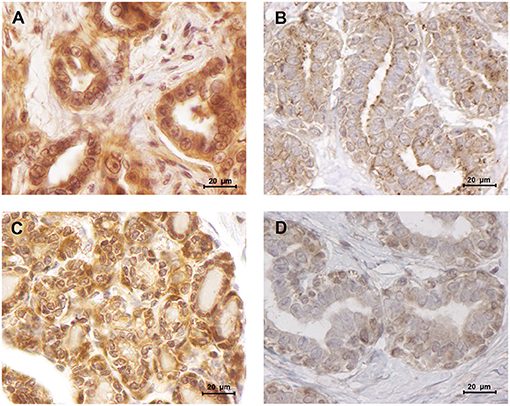 FIGURA 7. La leptina y la obr se sobreexpresaron en carcinomas mamarios luminales B. (A) Sobreexpresión de leptina en un carcinoma mamario luminal B (puntuación IHQ de 1,93) contrastando con (B) una baja intensidad de tinción detectada en tejidos mamarios normales (puntuación IHC de 1,34). (C) Los tumores mamarios luminales B mostraron una mayor intensidad de tinción para ObR (puntuación IHC de 2,50), (D) que los tejidos mamarios normales (puntuación IHC de 1,75) (400× aumento).
FIGURA 7. La leptina y la obr se sobreexpresaron en carcinomas mamarios luminales B. (A) Sobreexpresión de leptina en un carcinoma mamario luminal B (puntuación IHQ de 1,93) contrastando con (B) una baja intensidad de tinción detectada en tejidos mamarios normales (puntuación IHC de 1,34). (C) Los tumores mamarios luminales B mostraron una mayor intensidad de tinción para ObR (puntuación IHC de 2,50), (D) que los tejidos mamarios normales (puntuación IHC de 1,75) (400× aumento).
Además, la inmunotinción revela ser positiva en las células del estroma, en el 72,2 y 18,2% de los tumores, para leptina (puntuación IHC de 0,79) y ObR (puntuación IHC de 1,1), respectivamente. Además, se observó que, independientemente del subtipo tumoral, una media de 81 ± 2,5% de las células mononucleares inflamatorias tumorales presentaron ser positivas para la tinción de leptina (puntuación media IHQ de 2,0 para los macrófagos y puntuación media de IHQ de 1,6 para las células linfoides, Figura 8A). El mismo análisis, considerando el ObR reveló una tinción positiva para una media de 87,6 ± 2,5% de las células mononucleares inflamatorias tumorales (puntuación IHC media de 2,62 para los macrófagos y puntuación IHC media de 1,33 para las células linfoides, Figura 8B).
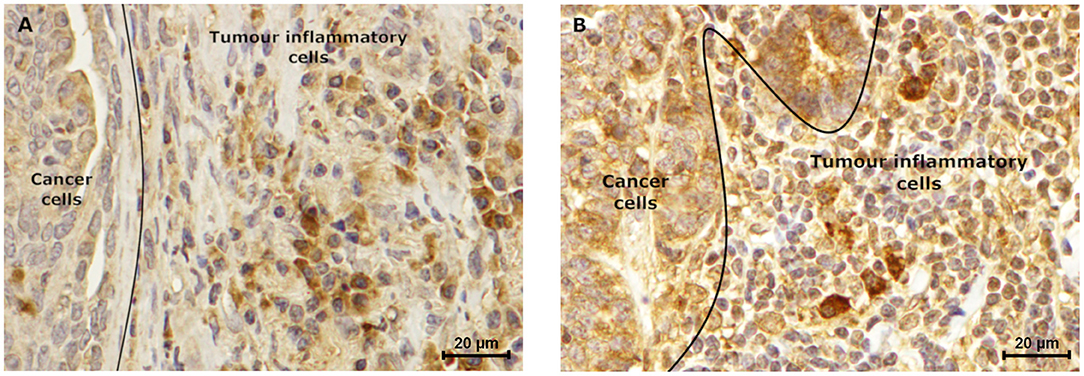 FIGURA 8. Las células inflamatorias tumorales expresan leptina y ObR. El subtipo de carcinoma luminal B mostró una tinción de leptina (A) positiva (puntuación IHC de 1,5), que es menor en comparación con la inmunotinción (B) ObR (puntuación IHC de 2,5) DE las células inflamatorias tumorales. Además, en ambas muestras se observó una mayor intensidad de tinción en macrófagos, en comparación con las células linfoides (puntuación IHC de 2,0 vs. 1,2, respectivamente para leptina, y puntuación IHQ de 3,0 vs. 2,0, respectivamente para ObR) (400× aumento).
FIGURA 8. Las células inflamatorias tumorales expresan leptina y ObR. El subtipo de carcinoma luminal B mostró una tinción de leptina (A) positiva (puntuación IHC de 1,5), que es menor en comparación con la inmunotinción (B) ObR (puntuación IHC de 2,5) DE las células inflamatorias tumorales. Además, en ambas muestras se observó una mayor intensidad de tinción en macrófagos, en comparación con las células linfoides (puntuación IHC de 2,0 vs. 1,2, respectivamente para leptina, y puntuación IHQ de 3,0 vs. 2,0, respectivamente para ObR) (400× aumento).
Además, nuestros hallazgos revelaron que los niveles séricos de ObR se correlacionan negativamente con la puntuación ObR IHC, con gatos que presentan niveles séricos más altos de ObR que muestran tumores mamarios con puntuaciones más bajas de ObR IHC (p = 0.0103, Figura 9; p = 0,0244 si los valores atípicos se eliminaron del análisis).
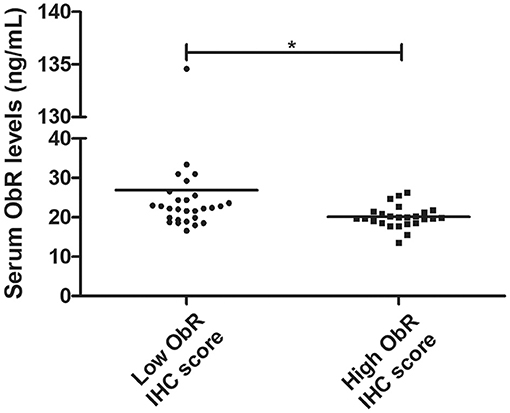 FIGURA 9. Diagrama de diagrama de puntos que muestra una correlación negativa entre los niveles séricos de ObR y la puntuación de IHC de ObR tumoral (*p = 0,0103).
FIGURA 9. Diagrama de diagrama de puntos que muestra una correlación negativa entre los niveles séricos de ObR y la puntuación de IHC de ObR tumoral (*p = 0,0103).
Discusión
Aunque la FMC espontánea se ha propuesto como un modelo adecuado para los estudios de cáncer de mama humano, el papel del eje leptina/ObR nunca se ha evaluado en gatos. En humanos, estudios previos mostraron que la sobreexpresión de leptina y ObR se asocia con efectos proinflamatorios y protumorigénicos, particularmente en mujeres con sobrepeso (13, 15). Además, algunos estudios informaron un aumento de los niveles séricos de leptina con el envejecimiento (58, 59). En este estudio, el grupo sano presentó una edad media menor que el grupo tumoral, y a pesar de lo reportado en humanos y ratas (58, 59), los resultados obtenidos demostraron que los gatos con carcinoma mamario tienen un Índice de Leptina Libre (FLI) reducido en comparación con el grupo sano (p = 0,0006), no solo debido al aumento de los niveles séricos de ObR (60), pero también sugiere que los animales enfermos pueden haber disminuido los niveles de leptina soluble, como se informó en mujeres premenopáusicas con cáncer de mama (61) y pacientes con cáncer de colon (62). Estos resultados indican que la leptina sérica puede ser reclutada por las células de cáncer de mama para promover el crecimiento tumoral y la migración celular (23). De hecho, los gatos con carcinoma mamario luminal B o HER2 positivo mostraron niveles séricos de leptina significativamente más bajos en comparación con los controles (p < 0,001 y p < 0,05, respectivamente), revelando que los niveles séricos de leptina están regulados a la baja en tumores con estado PR positivo (14) y/o HER2 positivo (27). En contraste, los gatos con luminal A mostraron niveles elevados de leptina sérica, lo que indica que la sobreexpresión de RE en el tumor puede promover la expresión de leptina (14). Con respecto a los niveles elevados de leptina sérica encontrados en gatos con carcinomas mamarios triple negativos, los estudios demostraron que la leptina induce la capacidad proliferativa celular (por ejemplo, a través de la vía Wnt/β-catenina) (22, 43) y promueve la supervivencia celular al interactuar con las proteínas Bcl-2, asociándose con tumores más agresivos (63). De hecho, nuestros resultados revelaron que los niveles elevados de leptina sérica ocurren en una etapa avanzada de la enfermedad, estando significativamente asociados con ulceración tumoral (p = 0.0005) y SSE más corta (p = 0.0217), como se informó para mujeres con cáncer de mama (14, 15).
Paralelamente, como se documentó en pacientes con cáncer de mama (14, 64), todos los gatos con carcinoma mamario mostraron niveles séricos de ObR más altos que los controles sanos (p < 0,0001). También los niveles séricos más altos de ObR se correlacionaron con un tamaño tumoral más pequeño (p = 0.0118), lo que sugiere que la diseminación de ObR ocurre en tumores pequeños, modulando los niveles séricos de leptina libre (28). Además, nuestros resultados apoyan aún más la hipótesis de que las células malignas en tumores más grandes mantienen la expresión de ObR en su superficie para aumentar su supervivencia y crecimiento (19). Curiosamente, los niveles séricos más altos de ObR se encontraron en gatos con carcinomas mamarios que presentaban un estado HER2 positivo / ER negativo (p = 0.0291), como se informó para pacientes con cáncer de mama humano (14), lo que confirma la diafonía entre el eje leptina / ObR y la vía de señalización posterior EGFR (65).
Además, este estudio revela la utilidad de la leptina y el ObR como biomarcadores diagnósticos prometedores para diferenciar animales con FMC de gatos sanos (valor de corte de 4.17 pg / ml para leptina y 16.89 ng / ml para ObR).
También encontramos que los niveles séricos de ObR se correlacionaron positivamente con los niveles séricos de CTLA-4 (p = 0.0056), TNF-α (p = 0.0025), PD-1 (p = 0.0023) según lo informado en pacientes con cáncer de mama (39) y con los niveles séricos de PD-L1 (p = 0.0002). De hecho, estudios previos mostraron que la activación del eje leptina/ObR puede dar lugar a un estado inflamatorio crónico (35, 66), un factor de riesgo bien conocido para el cáncer de mama, con leptina implicada en la diferenciación de las células T reguladoras CD4+ debido a la sobreexpresión de ObR en la membrana plasmática de los linfocitos (67). Estas células CD4+ reguladoras CD4+ activadas expresan CTLA-35(1) y PD-37, dos moléculas de punto de control inmunoinhibidoras que regulan a la baja las respuestas inmunitarias de las células T (68), lo que lleva al desarrollo tumoral (69) y contribuye al crecimiento celular (4). Por otro lado, en un intento por controlar el proceso de tumorigénesis, las células CD38+ T reguladoras secretan TNF-α (70), una molécula que muestra un doble papel en la inmunomodulación, siendo expresada también por las células cancerosas (71), actuando como un factor de crecimiento autocrino (10). En conjunto, estos hallazgos proporcionan apoyo para la diafonía entre el eje leptina / ObR y los mecanismos de inmunoedición tumoral, contribuyendo a un estado inmunosupresor en gatos con carcinoma mamario (11, <>).
El análisis de inmunotinción de las muestras tumorales y de tejido normal reveló que los subtipos de carcinoma mamario luminal B y triple negativo (p < 0,05) mostraron sobreexpresión de leptina. Aunque solo se detectó una fuerte expresión de ObR en carcinomas mamarios luminales B (p = 0,0425), como se describe en el cáncer de mama humano (25). Además, varios estudios sugieren que la leptina y el ObR están sobreexpresados en los tejidos tumorales, debido a la hipoxia y/o como respuesta a la insulina, IgF-1 y/o al estradiol (64, 72). Además, las puntuaciones más altas de IHC para la leptina encontradas en los carcinomas luminales B también apoyan la asociación previamente reportada entre la expresión de esta adipocitoquina y la expresión de aromatasa, una enzima que cataliza la conversión de andrógenos en estrógeno para promover el desarrollo tumoral a través de un mecanismo dependiente de ER (14). La sobreexpresión de leptina detectada en carcinomas mamarios triple negativos también está en concordancia con los resultados previos en el cáncer de mama triple negativo, donde la señalización de la leptina es crucial para el crecimiento tumoral (29, 63), estando asociada con las vías ERK y Akt, ambas involucradas en la proliferación de células de cáncer de mama (23). Además, las células mononucleares inflamatorias tumorales revelaron ser positivas para la inmunotinción de leptina y ObR, con una mayor expresión de proteínas en macrófagos. De hecho, se informa que el eje leptina / ObR activa la respuesta inflamatoria (66, 73). Finalmente, nuestros resultados demostraron que los gatos con tumores mamarios bajos que expresan ObR tenían niveles séricos de ObR más altos, lo que indica una retroalimentación negativa entre el microambiente tumoral y el suero, probablemente debido a un mecanismo de desprendimiento que conduce a una reducción de los niveles séricos de leptina (23, 60). Además, los datos obtenidos enfatizan la posibilidad de bloquear el eje leptina/receptor de leptina, como terapia adyuvante en gatos con subtipos de carcinoma mamario luminal B y triple negativo, según lo informado para pacientes con cáncer de mama (42, 44-46).
En conclusión, nuestros datos proporcionan un uso racional para la leptina/ObR como biomarcadores diagnósticos y pronósticos. De hecho, los gatos con carcinoma mamario mostraron una disminución de la LF, junto con una disminución de los niveles séricos de leptina en animales con subtipos de carcinoma mamario luminal B o triple negativo. Se detectó un aumento significativo en los niveles séricos de ObR, en todas las muestras, independientemente del subtipo tumoral, estando asociado a un estado inmunosupresor. En conjunto, nuestros datos indican que los gatos que presentan tumores luminales B y triple negativos podrían beneficiarse de las terapias adyuvantes dirigidas a la leptina y apoyar la utilidad de la FMC espontánea como modelo para la oncología comparativa.
Declaración de disponibilidad de datos
Los datos brutos que apoyan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue revisado y aprobado por CIISA – Faculdade de Medicina Veterinária. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
AG y FF: diseñaron la investigación. AG, CN, ACU, JC y FF: realizaron la investigación. AG, CN y FF: analizaron los datos. AG y FF: escribieron el artículo. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Financiación
Esta investigación fue financiada por la Fundação para a Ciência e a Tecnologia (Portugal) a través de los proyectos PTDC/CVT-EPI/3638/2014 y UIDB/00276/2020. AG recibió una beca de doctorado de la Fundação para a Ciência e a Tecnologia (SFRH / BD / 132260 / 2017) y CN recibió una beca de doctorado de la Universidad de Lisboa (C00191r).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Reconocimientos
Los autores desean agradecer a la Dra. Maria Soares para las muestras clínicas y la base de datos.
Referencias
1. Dagher E, Royer V, Buchet P, Abadie J, Loussouarn D, Campone M, et al. El receptor de andrógenos y la coexpresión de FOXA1 definen un subtipo «luminal-AR» de carcinomas mamarios felinos, modelos espontáneos de cáncer de mama. BMC Cáncer. (2019) 19:1267. DOI: 10.1186/S12885-019-6483-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Soares M, Ribeiro R, Najmudin S, Gameiro A, Rodrigues R, Cardoso F, et al. Los niveles séricos de HER2 aumentan en gatos con carcinomas mamarios y predicen el estado de HER2 tisular. Oncotarget. (2016) 7:17314–26. doi: 10.18632/oncotarget.7551
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Porrello A, Cardelli P, Spugnini EP. Oncología de animales de compañía como modelo para humanos. Una visión general de los histotipos tumorales. J Exp Clin Cancer Res. (2006) 25:97–105.
4. Vail DM, Macewen EG. Tumores que ocurren espontáneamente de animales de compañía como modelos para el cáncer humano. cáncer invertir. (2000) 18:781–92. DOI: 10.3109/07357900009012210
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Ferreira D, Martins B, Soares M, Correia J, Adega F, Ferreira F, et al. Estudio de asociación de expresión génica en carcinomas mamarios felinos. PLoS ONE. (2019) 14:E0221776. doi: 10.1371/journal.pone.0221776
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. De Maria R, Olivero M, Iussich S, Nakaichi M, Murata T, Biolatti B, et al. El carcinoma mamario felino espontáneo es un modelo de cáncer de mama humano de sobreexpresión de HER2 que sobreexpresa mal pronóstico. Cáncer Res. (2005) 65:907–12.
7. Wiese DA, Thaiwong T, Yuzbasiyan-Gurkan V, Kiupel M. Adenocarcinomas basales mamarios felinos: un modelo potencial para el cáncer de mama triple negativo humano (TNBC) con subtipo basal-like. BMC Cáncer. (2013) 13:403. doi: 10.1186/1471-2407-13-403
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Caliari D, Zappulli V, Rasotto R, Cardazzo B, Frassineti F, Goldschmidt MH, et al. Carcinomas mamarios felinos heterogéneos triple negativos positivos para vimentina como un posible modelo comparativo para el cáncer de mama. BMC Vet Res. (2014) 10:185. doi: 10.1186/s12917-014-0185-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Zappulli V, Rasotto R, Caliari D, Mainenti M, Peña L, Goldschmidt MH, et al. Evaluación pronóstica de carcinomas mamarios felinos: una revisión de la literatura. Veterinario Pathol. (2015) 52:46–60. doi: 10.1177/0300985814528221
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Nascimento C, Urbano AC, Gameiro A, Correia J, Ferreira F. Niveles séricos de PD-1/PD-L1, expresión tumoral y mutaciones somáticas de PD-L1 en subtipos de carcinoma felino similar normal HER2 positivo y triple negativo. Cánceres. (2020) 12:1–16. doi: 10.3390/cánceres12061386
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Urbano AC, Nascimento C, Soares M, Correia J, Ferreira F. Clinical relevance of the serum CTLA-4 in cats with mammary carcinoma. (2020) 10:3822. DOI: 10.1038/S41598-020-60860-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Shibata H, Sasaki N, Honjoh T, Ohishi I, Takiguchi M, Ishioka K, et al. Leptina felina: actividades inmunogénicas y biológicas de la proteína recombinante, y su medición por ELISA. J Vet Med Sci. (2003) 65:1207–11. DOI: 10.1292/JVMS.65.1207
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Pan H, Deng LL, Cui JQ, Shi L, Yang YC, Luo JH, et al. Asociación entre los niveles séricos de leptina y el riesgo de cáncer de mama: una revisión sistemática actualizada y metanálisis. Medicina. (2018) 97:E11345. doi: 10.1097/MD.0000000000011345
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Hosney M, Sabet S, Shinawi MEL. La leptina se sobreexpresa en el microambiente tumoral de pacientes obesas con cáncer de mama con receptor de estrógeno positivo. Exp Ther Med. (2017) 13:2235–46. doi: 10.3892/etm.2017.4291
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Modzelewska P, Chludzińska S, Lewko J, Reszeć J. La influencia de la leptina en el proceso de carcinogénesis. Wspolczesna Onkol. (2019) 23:63–8. doi: 10.5114/wo.2019.85877
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Jéquier E. Leptin signaling, adiposity, and energy balance ERIC. Ann NY Acad Sci. (2002) 967:379–88. doi: 10.1111/j.1749-6632.2002.tb04293.x
17. Andò S Catalano S. El papel multifactorial de la leptina en la conducción del microambiente del cáncer de mama. Nat Rev Endocrinol. (2012) 8:263–75. doi: 10.1038/nrendo.2011.184
18. Cao R, Brakenhielm E, Wahlestedt C, Thyberg J, Cao Y. La leptina induce permeabilidad vascular y estimula sinérgicamente la angiogénesis con FGF-2 y VEGF. Proc Natl Acad Sci USA. (2001) 98:6390–5. DOI: 10.1073/PNAS.101564798
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Artac M, Altundag K. Leptin and breast cancer: an overview. Med Oncol. (2012) 29:1510–4. DOI: 10.1007/S12032-011-0056-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Bonofiglio D, Barone I, Catalano S. Obesidad, leptina y cáncer de mama: evidencia epidemiológica y mecanismos propuestos. Cánceres. (2019) 11:1–27. doi: 10.3390/cánceres11010062
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Kang YJ, Moon A. Roles de la leptina en la progresión del cáncer. Biomol Ther. (2010) 18:363–74. doi: 10.4062/biomolther.2010.18.4.363
22. Liang X, Wang S, Wang X, Zhang L, Zhao H, Zhang L. La leptina promueve el crecimiento del cáncer de mama mediante la regulación positiva de la vía wnt/β-catenina. Exp Ther Med. (2018) 16:767–71. doi: 10.3892/etm.2018.6212
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Kim HS. Leptina y expresión del receptor de leptina en el cáncer de mama. Cancer Res Treat. (2009) 41:155–63. DOI: 10.4143/CRT.2009.41.3.155
24. Artwohl M, Roden M, Hölzenbein T, Freudenthaler A, Waldhäusl W, Baumgartner-Parzer SM. Modulación por leptina de proliferación y apoptosis en células endoteliales vasculares. Int J Obes. (2002) 26:577–80. doi: 10.1038/sj.ijo.0801947
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Khabaz MN, Abdelrahman A, Butt N, Damnhory L, Elshal M, Aldahlawi AM, et al. La tinción inmunohistoquímica de la leptina se asocia con el grado, el estadio, la afectación de los ganglios linfáticos, la recurrencia y los fenotipos de los receptores hormonales en el cáncer de mama. BMC Salud de la Mujer. (2017) 17:105. DOI: 10.1186/S12905-017-0459-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Mahbouli S, Der Vartanian A, Ortega S, Rougé S, Vasson MP, Rossary A. La leptina induce ROS a través de NOX5 en células epiteliales mamarias sanas y neoplásicas. (2017) 38:3254–64. doi: 10.3892/o.2017.6009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Cha Y, Kang Y, Moon A. HER2 induce la expresión de leptina en células epiteliales de mama humanas. BMB Rep. (2012) 45:719–23. doi: 10.5483/BMBRep.2012.45.12.164
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Gorska E, Popko K, Stelmaszczyk-Emmel A, Ciepiela O, Kucharska A. Leptin receptors. Eur J Med Res. (2010) 209:50–4. doi: 10.1007/978-3-642-24716-3_1
29. Sánchez-Jiménez F, Pérez-Pérez A, de la Cruz-Merino L, Sánchez-Margalet V. Obesity and breast cancer: role of leptin. Frente Oncol. (2019) 9:596. DOI: 10.3389/FONC.2019.00596
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Appelton DJ, Rand JS, Sunvold GD. Concentraciones plasmáticas de leptina en gatos: rango de referencia, efecto del aumento de peso y relación con. J Felino Med Surg. (2000) 2:191–9. DOI: 10.1053/JFMS.2000.0103
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Lahlou N, Clement K, Carel JC, Vaisse C, Lotton C, Le Bihan Y, et al. Receptor de leptina soluble en suero de sujetos con resistencia completa a la leptina: relación con la masa grasa. Diabetes. (2000) 49:1347–52. doi: 10.2337/diabetes.49.8.1347
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Owecki M, Nikisch E, Miczke A, Pupek-Musialik D, Sowiński J. Free leptin index as a marker for leptin action in diabetes and obesity: leptin and soluble leptin receptors relationship with HbA1c. Lett neuroendocrino. (2010) 31:679–84.
33. Rodrigo C, Tennekoon KH, Karunanayake EH, De Silva K, Amarasinghe I, Wijayasiri A. Circulating leptin, soluble leptin receptor, free leptin index, visfatin and selected leptin and leptin receptor gene polymorphisms in sporadic breast cancer. Endocrino J. (2017) 64:393–401. DOI: 10.1507/endocrj. EJ16-0448
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Zhang Y, Wilsey JT, Frase CD, Matheny MM, Bender BS, Zolotukhin S, et al. La leptina periférica pero no central previene la inmunosupresión asociada con la hipoleptinemia en ratas. J Endocrinol. (2002) 174:455–61. doi: 10.1677/joe.0.1740455
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Wei R, Hu Y, Dong F, Xu X, Hu A, Gao G. La leptina derivada de células de hepatoma regula a la baja la función inmunosupresora de las células T reguladoras para mejorar la actividad antitumoral de las células T CD8 +. Immunol Cell Biol. (2016) 94:388–99. doi: 10.1038/icb.2015.110
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Dayakar A, Chandrasekaran S, Veronica J, Bharadwaja V, Maurya R. La leptina regula la expresión de Granzyme-A, PD-1 y CTLA-4 en células T para controlar la leishmaniasis visceral en ratones BALB/c. (2017) 7:14664. DOI: 10.1038/S41598-017-15288-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Erfani N, Razmkhah M, Ghaderi A. CTLA4 soluble circulante (sCTLA4) está elevado en pacientes con cáncer de mama. cáncer invertir. (2010) 28:828–32. doi: 10.3109/07357901003630934
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Singh S, Mayengbam SS, Chouhan S, Deshmukh B, Ramteke P, Athavale D, et al. Papel de la señalización de TNFα y leptina en la incidencia de cáncer de colon y el crecimiento tumoral bajo fenotipo obeso. Biochim Biophys Acta Mol Base Dis. (2020) 1866:165660. doi: 10.1016/j.bbadis.2019.165660
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Rivadeneira DB, DePeaux K, Wang Y, Kulkarni A, Tabib T, Menk A V, et al. Oncolytic viruses engineered to enforce leptin expression reprogram tumor-infiltrating T cell metabolism and promote tumor clearance. Immunity. (2019) 51:548–60.e4. doi: 10.1016/j.immuni.2019.07.003
40. El Andaloussi A, Al-Hendy A. Regulation of PD-1 and leptin receptor expression by estrogen through AKT3 in human uterine fibroids. Fertil Steril. (2017) 108:e65. doi: 10.1016/j.fertnstert.2017.07.205
41. Wang Z, Aguilar EG, Luna JI, Dunai C, Khuat LT, Le CT, et al. Paradoxical effects of obesity on T cell function during tumor progression and PD-1 checkpoint blockade. Nat Med. (2019) 25:141–51. doi: 10.1038/s41591-018-0221-5
42. Surmacz E. Leptin and adiponectin: emerging therapeutic targets in breast cancer. J Mammary Gland Biol Neoplasia. (2013) 18:321–32. doi: 10.1007/s10911-013-9302-8
43. Linares RL, Benítez JGS, Reynoso MO, Romero CG, Sandoval-Cabrera A. Modulation of the leptin receptors expression in breast cancer cell lines exposed to leptin and tamoxifen. Sci Rep. (2019) 9:19189. doi: 10.1038/s41598-019-55674-x
44. Guo S, Liu M, Wang G, Torroella-Kouri M, Gonzalez-Perez RR. Oncogenic role and therapeutic target of leptin signaling in breast cancer and cancer stem cells. Biochim Biophys Acta Rev Cancer. (2012) 1825:207–22. doi: 10.1016/j.bbcan.2012.01.002
45. Otvos L, Kovalszky I, Riolfi M, Ferla R, Olah J, Sztodola A, et al. Efficacy of a leptin receptor antagonist peptide in a mouse model of triple-negative breast cancer. Eur J Cancer. (2011) 47:1578–84. doi: 10.1016/j.ejca.2011.01.018
46. Zabeau L, Peelman F, Tavernier J. Antagonizing leptin: current status and future directions. Biol Chem. (2014) 395:499–514. doi: 10.1515/hsz-2013-0283
47. Soares M, Madeira S, Correia J, Peleteiro M, Cardoso F, Ferreira F. Molecular based subtyping of feline mammary carcinomas and clinicopathological characterization. Breast. (2016) 27:44–51. doi: 10.1016/j.breast.2016.02.016
48. Soares M, Ribeiro R, Carvalho S, Peleteiro M, Correia J, Ferreira F. Ki-67 as a prognostic factor in feline mammary carcinoma. Vet Pathol. (2015) 53:37–43. doi: 10.1177/0300985815588606
49. Elston CW, Ellis IO. Assessment of Histological Grade. 3rd Edition. London: Churchill Livingstone (1998). 365–384p.
50. Goldhirsch A, Winer EP, Coates AS, Gelber RD, Piccart-Gebhart M, et al. Personalizing the treatment of women with early breast cancer: highlights of the st gallen international expert consensus on the primary therapy of early breast cancer 2013. Ann Oncol. (2013) 24:2206–23. doi: 10.1093/annonc/mdt303
51. Lippi G, Avanzini P, Zobbi V, Ippolito L. Influence of mechanical hemolysis of blood on two D-dimer immunoassays. Blood Coagul Fibrinolysis. (2012) 23:461–3. doi: 10.1097/MBC.0b013e3283549696
52. Ishikawa M, Kitayama J, Nagawa H. Enhanced expression of leptin and leptin receptor (OB-R) in human breast cancer. Clin Cancer Res. (2004) 10:4325–31. doi: 10.1158/1078-0432.CCR-03-0749
53. Dall’Aglio C, Polisca A, Boiti C, Ceccarelli P. Immunolocalization of leptin and its receptor in the placenta of cats. Acta Histochem. (2012) 114:719–22. doi: 10.1016/j.acthis.2011.12.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Otte C, Otte JM, Strodthoff D, Bornstein SR, Fölsch UR, Mönig H, et al. Expresión de leptina y receptor de leptina durante el desarrollo de fibrosis hepática y cirrosis. Exp Clin Endocrinol Diabetes. (2004) 112:10–17. DOI: 10.1055/S-2004-815720
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Perumal K, Mun KS, Yap NY, Razack AHA, Gobe GC, Ong TA, et al. Un estudio sobre las expresiones inmunohistoquímicas de leptina y receptor de leptina en carcinoma de células renales de células claras. Biomed Res Int. (2020) 2020:3682086. DOI: 10.1155/2020/3682086
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Fava G, Alpini G, Rychlicki C, Saccomanno S, DeMorrow S, Trozzi L, et al. La leptina mejora el crecimiento celular del colangiocarcinoma. Cáncer Res. (2008) 68:6752–61. doi: 10.1158/0008-5472.CAN-07-6682
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Hardwick JCH, Van Den Brink GR, Offerhaus GJ, Van Deventer SJH, Peppelenbosch MP. La leptina es un factor de crecimiento para las células epiteliales del colon. Gastroenterología. (2001) 121:79–90. DOI: 10.1053/GAST.2001.25490
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Gabriely I, Xiao Hui M, Yang XM, Rossetti L, Barzilai N. La resistencia a la leptina durante el envejecimiento es independiente de la masa grasa. Diabetes. (2002) 51:1016–21. doi: 10.2337/diabetes.51.4.1016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Li H, Matheny M, Nicolson M, Tümer N, Scarpace PJ. La expresión génica de la leptina aumenta con la edad, independientemente del aumento de la adiposidad en ratas. Diabetes. (1997) 46:2035–39. doi: 10.2337/diab.46.12.2035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Chan JL, Blüher S, Yiannakouris N, Suchard MA, Kratzsch J, Mantzoros CS. Regulation of circulating soluble leptin receptor levels by gender, adiposity, sex steroids, and leptin observational and interventional studies in humans. Diabetes. (2002) 51:2105–12. doi: 10.2337/diabetes.51.7.2105
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Georgiou GP, Provatopoulou X, Kalogera E, Siasos G, Menenakos E, Zografos GC, et al. La resistina sérica está inversamente relacionada con el riesgo de cáncer de mama en mujeres premenopáusicas. Seno. (2016) 29:163–9. doi: 10.1016/j.breast.2016.07.025
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Arpaci F, Yilmaz MI, Ozet A, Ayta H, Ozturk B, Komurcu S, et al. Bajo nivel sérico de leptina en pacientes con cáncer de colon sin pérdida de peso significativa. Tumores. (2002) 88:147–9. DOI: 10.1177/030089160208800213
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Crean-Tate KK, Reizes O. Leptin regulation of cancer stem cells in breast and gynecologic cancer. Endocrinología. (2018) 159:3069–80. doi: 10.1210/es.2018-00379
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Garofalo C, Koda M, Cascio S, Sulkowska M, Kanczuga-Koda L, Golaszewska J. Aumento de la expresión de leptina y el receptor de leptina como marcador de progresión del cáncer de mama: posible papel de los estímulos relacionados con la obesidad. Clin Cancer Res. (2006) 12:1447–53. doi: 10.1158/1078-0432.CCR-05-1913
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Wauman J, Zabeau L, Tavernier J. El complejo receptor de leptina: ¿más pesado de lo esperado? Frente Endocrinol. (2017) 8:30. DOI: 10.3389/FENDO.2017.00030
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Paz-Filho G, Mastronardi C, Franco CB, Wang KB, Wong M-L, Licinio J. Leptin: molecular mechanisms, systemic pro-inflammatory effects, and clinical implications. Arq Bras Endocrinol Metabol. (2012) 56:597–607. DOI: 10.1590/S0004-27302012000900001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Kim SY, Lim JH, Choi SW, Kim M, Kim ST, Kim MS, et al. Los efectos preferenciales de la leptina sobre las células T CD4 en el sistema inmune central y periférico están críticamente relacionados con la expresión del receptor de leptina. Biochem Biophys Res Commun. (2010) 394:562–8. doi: 10.1016/j.bbrc.2010.03.019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Chen MI L. Role of B7-H1 and B7-H4 molecules in down-regulation effector phase of T-cell immunity: novel cancer escaping mechanisms. Biosci frontal. (2005) 10:2856–60. DOI: 10.2741/1742
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Wang X, Teng F, Kong L, Yu J. PD-L1 expression in human cancers and its association with clinical outcomes. Onco apunta a Ther. (2016) 9:5023–39. doi: 10.2147/OTT. S105862
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Montesano R, Soulié P, Eble JA, Carrozzino F. Tumor necrosis factor α confiere un fenotipo invasivo y transformado a las células epiteliales mamarias. J Cell Sci. (2005) 118:3487–500. DOI: 10.1242/JCS.02467
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Gautam Sethi, Bokyung Sung BBA. TNF: un interruptor maestro para la inflamación al cáncer. Biosci frontal. (2008) 13:5094–107. DOI: 10.2741/3066
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Cascio S, Bartella V, Auriemma A, Johannes GJ, Russo A, Giordano A, et al. Mecanismo de expresión de leptina en células de cáncer de mama: papel del factor 1α inducible por hipoxia. Oncogén. (2008) 27:540–47. doi: 10.1038/sj.onc.1210660
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Sánchez-Margalet V, Fernández-Riejos P, Najib S, Santos-Alvarez J, Martín-Romero C, Pérez-Pérez A, et al. Papel de la leptina en la activación de las células inmunes. Mediadores inflamm. (2010) 2010:568343: doi: 10.1155/2010/568343
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cita: Gameiro A, Nascimento C, Urbano AC, Correia J y Ferreira F (2021) Los niveles de expresión sérica y tisular de leptina y el receptor de leptina son marcadores putativos de subtipos específicos de carcinoma mamario felino. Frente. Vet. Sci. 8:625147. doi: 10.3389/fvets.2021.625147
Recibido: 02 Noviembre 2020; Aprobado: 20 de enero de 2021;
Publicado: 10 febrero 2021.
Editado por:
Hiroyuki Mochizuki, Universidad Estatal de Carolina del Norte, Estados Unidos
Revisado por:
Elena De Felice, Universidad de Camerino, Italia Giuseppe Sarli, Universidad de Bolonia, Italia
Copyright © 2021 Gameiro, Nascimento, Urbano, Correia y Ferreira. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Fernando Ferreira, fernandof@fmv.ulisboa.pt
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía