Los perros como modelo animal natural de la epilepsia
Los perros como modelo animal natural de la epilepsia
 Wolfgang Löscher1,2*
Wolfgang Löscher1,2*- ¹Departamento de Farmacología, Toxicología y Farmacia, Universidad de Medicina Veterinaria, Hannover, Alemania
- ²Centro de Neurociencia de Sistemas, Hannover, Alemania
La epilepsia es una enfermedad neurológica común tanto en humanos como en perros domésticos, lo que convierte a los perros en un modelo de traducción ideal de la epilepsia. En ambas especies, la epilepsia es una enfermedad cerebral compleja que se caracteriza por una predisposición duradera a generar convulsiones epilépticas espontáneas recurrentes. Además, al igual que en los seres humanos, el estado epiléptico es una de las emergencias neurológicas más comunes en perros con epilepsia. En ambas especies, la epilepsia no es una sola enfermedad, sino un grupo de trastornos que se caracterizan por una amplia gama de signos clínicos, edad de inicio y causas subyacentes. Las imágenes cerebrales sugieren que el sistema límbico, incluido el hipocampo y el girocíngulo, a menudo se ve afectado en la epilepsia canina, lo que podría explicar la alta incidencia de problemas de comportamiento comórbidos, como la ansiedad y las alteraciones cognitivas. La resistencia a los medicamentos antiseconvulsivos es un problema importante tanto en la epilepsia canina como en la humana, por lo que los perros se pueden utilizar para estudiar los mecanismos de resistencia a los medicamentos y desarrollar nuevas estrategias terapéuticas para beneficiar a ambas especies. Es importante destacar que los perros son lo suficientemente grandes como para acomodar el EEG intracraneal y los dispositivos de neuroestimulación sensibles diseñados para los seres humanos. Los estudios en perros epilépticos con tales dispositivos han informado de eventos ictal e interictal que son notablemente similares a los que ocurren en la epilepsia humana. Los registros continuos de EEG (24/7) en un grupo selecto de perros epilépticos durante más de 1 año han proporcionado un rico conjunto de datos de una longitud sin precedentes para estudiar las periodicidades de las convulsiones y desarrollar nuevos métodos para el pronóstico de las convulsiones. Los datos presentados en esta revisión corroboran que la epilepsia canina es un excelente modelo de traducción para varias facetas de la investigación de la epilepsia. Además, se discuten varias técnicas de inducción de convulsiones en perros de laboratorio relacionadas con los avances terapéuticos. Es importante destacar que el desarrollo de la estimulación del nervio vago como una nueva terapia para la epilepsia resistente a los medicamentos en las personas se basó en una serie de estudios en perros con convulsiones inducidas. Los perros con convulsiones naturales o inducidas proporcionan excelentes modelos de animales grandes para cerrar la brecha traslacional entre los roedores y los humanos en el desarrollo de nuevas terapias. Además, debido a que el perro no solo es una especie preclínica para la medicina humana, sino también un posible paciente y mascota, la investigación sobre esta especie sirve tanto a la medicina veterinaria como a la humana.
Introducción
Los perros domésticos (Canis lupus familiaris) proporcionan un modelo ideal para la medicina traslacional, ya que tienen la mayor diversidad fenotípica y las enfermedades naturales conocidas de todos los mamíferos terrestres que no sean humanos (1). Los perros comparten una historia evolutiva y una gran cantidad de secuencia genética ancestral con los humanos, así como las características de nuestro entorno (2). El nivel de sofisticación del sistema de salud para perros en Europa y los Estados Unidos es solo superado por el de los humanos. Por lo tanto, los datos relacionados con la salud de los perros presentan muchas oportunidades para descubrir información sobre la salud y los resultados de las enfermedades tanto en las poblaciones de perros como de humanos. De hecho, las enfermedades naturales en los animales de compañía a menudo son similares, y a veces idénticas, a las enfermedades humanas relacionadas con la etiología de la enfermedad, la progresión y cómo esa enfermedad responde a la intervención o el tratamiento médico (1, 3, 4). Además, los perros son las principales especies no de no predadores en el desarrollo de medicamentos preclínicos, particularmente en la evaluación de la seguridad farmacéutica, la farmacocinética y la eficacia (5-7). En cuanto a la neurociencia traslacional, es importante tener en cuenta que, a diferencia de los cerebros lissencéfalos de ratones y ratas, los cerebros tanto de los perros como de los humanos son giroencefálicos (2).
La epilepsia es la enfermedad neurológica médica más común en los perros (8). Si bien la referencia al uso de perros con epilepsia natural como un modelo comparativo potencial de la base subyacente y la terapia de la epilepsia se hizo en la década de 1970 (9, 10), fuimos los primeros en realizar estudios farmacocinéticos comparativos sobre medicamentos anticonvulsivos (ASM; anteriormente denominados medicamentos antiepilépticos) en perros (11-24). Propusimos perros epilépticos como un modelo natural de epilepsia humana en la investigación y el desarrollo de medicamentos hace unos 40 años (24-26), seguidos de numerosos estudios en esta especie, incluido el primer ensayo clínico controlado de medicamentos en perros epilépticos (27). Esta revisión destacará la utilidad de los perros con convulsiones naturales o inducidas como un modelo animal grande de epilepsia con un enfoque en la farmacología y el desarrollo de medicamentos. A este respecto, es importante tener en cuenta que la investigación sobre esta especie sirve tanto para la medicina veterinaria como para la humana, ya que el perro epiléptico no solo es una especie preclínica para avanzar en el conocimiento y el tratamiento de los seres humanos, sino también un paciente potencial como mascota. Para enfatizar la importancia biomédica y social de este aspecto, utilizaremos como ejemplo el desarrollo de la imepitoína ASM para la epilepsia canina.
Epilepsia en perros
Epidemiología de la epilepsia en perros
Tanto en perros como en humanos, la epilepsia es una enfermedad cerebral compleja que se caracteriza por una predisposición duradera a generar convulsiones epilépticas recurrentes. La epilepsia no es una sola enfermedad, sino un grupo de trastornos caracterizados por una amplia gama de signos clínicos, edad de inicio y causas subyacentes (28). Se desconoce la verdadera prevalencia de la epilepsia en perros y se ha estimado entre el 0,6 y el 0,75 % en la población general de perros (29, 30), que es similar a la prevalencia de la epilepsia en los seres humanos (28). En ciertas razas de perros predispuestas a la epilepsia idiopática, se reportan tasas de prevalencia considerables más altas que las estimadas para la población general de perros, que es una de las razones por las que se sospecha un componente genético en ciertas razas caninas (31).
El Grupo de Trabajo Internacional de Epilepsia Veterinaria (IVETF) divide la epilepsia en las categorías de epilepsia estructural (debido a alteraciones estructurales adquiridas o heredadas del cerebro) y epilepsia idiopática (32). La epilepsia idiopática se define como una enfermedad por derecho propio en la que no se sospecha (o se observa) ninguna patología cerebral estructural y, en muchos casos, puede estar involucrado un componente genético (32). En este sentido, la terminología de la IVETF difiere de la terminología de la Liga Internacional contra la Epilepsia (ILAE) para la epilepsia humana, en la que «idiopática» ha sido reemplazada por «genética» y «etiología desconocida» (33). Según los tipos de convulsiones, las epilepsias se clasifican en focales, generalizadas, generalizadas y focales, y desconocidas (33). En el siguiente nivel, el ILAE diferencia numerosos síndromes de epilepsia por un patrón clínico distintivo y características electroencefalográficas (EEG) (34), lo que aún no es posible en la epilepsia canina debido a las limitaciones de los análisis de EEG en perros (ver más abajo). Los ejemplos bien reconocidos de síndromes de epilepsia en humanos incluyen la epilepsia de ausencia infantil, la epilepsia mioclónica juvenil (JME) y la epilepsia benigna con picos centrotemporales (33). Un nivel final de diagnóstico del esquema de clasificación de la ILAE establece que se ha determinado la etiología primaria y el diagnóstico de epilepsia (33). Este nivel de diagnóstico abre la puerta a un enfoque de medicina de precisión que refleja los esfuerzos científicos actuales (35). En medicina, la capacidad de hacer un diagnóstico etiológico está aumentando rápidamente con la revolución en la genética y otros campos como la neuroimagen. Están surgiendo numerosos diagnósticos etiológicos nuevos, en particular encefalopatías epilépticas pediátricas (36, 37). Uno de los ejemplos más conocidos es el síndrome de Dravet, que es causado por una mutación conocida del gen del canal de sodio SCN1A (35). Debido a la limitada disponibilidad de datos de vídeo EEG, genéticos y de imágenes cerebrales, la clasificación canina de la epilepsia se basa principalmente en la presunta etiología.
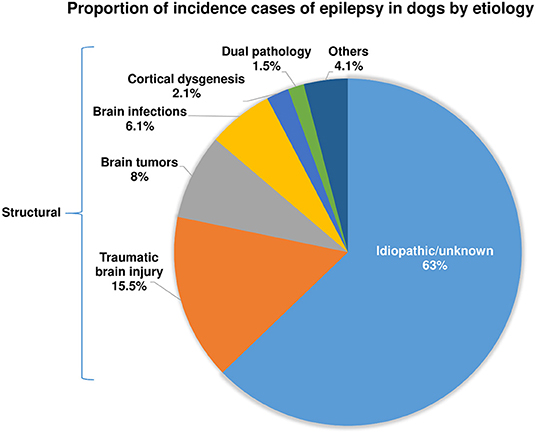
En 2013, publicamos el resultado de un gran estudio retrospectivo en 1.000 perros referidos al Departamento de Medicina y Cirugía de Animales Pequeños de nuestra Universidad de Hannover durante 11,5 años (38). Como se muestra en la Figura 1, el 63 % de los perros se clasificaron como teniendo una etiología idiopática o desconocida, y el 37 % tenía una etiología estructural. Dentro del grupo de epilepsia estructural o adquirida, los perros con lesión cerebral traumática (TBI) formaban el subgrupo más grande. Más recientemente, Hall et al. informaron datos similares. (39). Sobre la base de un estudio retrospectivo en 900 perros sometidos a imágenes por resonancia magnética (IRM) para convulsiones, se identificaron lesiones estructurales como causa de convulsiones en el 45,1 % de los casos, y no se identificaron lesiones estructurales en el 54,9 % de los casos. En el grupo de epilepsia estructural, el TBI se identificó con menos frecuencia como una causa de epilepsia adquirida que en nuestro estudio, lo que puede deberse a las diferencias en el diseño del estudio o en la población de casos (39). Se obtuvo una cifra similar del 46 % de perros epilépticos que tienen causas estructurales en un estudio prospectivo de Podell et al. (40).
Es importante destacar que los datos epidemiológicos sobre las causas predisponentes de la epilepsia en perros que se muestran en la Figura 1 (38) son muy similares a los estudios respectivos en humanos con epilepsia (41–43). Según la proporción relativa de etiologías identificadas en un gran estudio poblacional de Rochester, Minnesota, EE. UU., durante 50 años (44), el 65 % de los pacientes se clasificaron como «idiopáticos/criptogénicos» y el 35 % como sintomáticos. En este último grupo, se identificó el traumatismo craneoencefálico como causa de epilepsia en el 6% de la población, accidente cerebrovascular en el 10%, tumores cerebrales en el 6%, infecciones en el 3%, causas degenerativas en el 4% y alteraciones cerebrales congénitas en el 8%. , respectivamente. Esta notable similitud con las causas predisponentes de la epilepsia en perros que se muestran en la Figura 1 es un fuerte argumento a favor de la idoneidad de los perros epilépticos como modelo traslacional de la epilepsia. Sin embargo, es importante señalar que en la medicina humana el porcentaje de epilepsias «criptogénicas» (ahora denominadas epilepsias de etiología desconocida) está disminuyendo progresivamente en los últimos años debido al uso frecuente de resonancias magnéticas de alta resolución y al advenimiento de tecnologías modernas para identificar causas genéticas, como la secuenciación de próxima generación (42, 45, 46). Es de esperar que se produzcan avances similares con respecto a la epilepsia en perros en el futuro. El reciente estudio basado en resonancia magnética de Hall et al. (39) es un buen ejemplo porque el porcentaje de perros sin lesiones estructurales evidentes fue solo del 54,9 % de los casos, que es ~8 % más bajo que en el estudio de 2013 de Steinmetz et al. (38).
Las razas de perros, que se han identificado como predispuestas a la epilepsia idiopática, incluyen el pastor australiano, el tervueren belga, el pastor belga, el border collie, el perro lobo irlandés, el labrador retriever, el pequeño basset griffon vendeen, el perro spitz finlandés y el spinone italiano (31, 47). ). Aunque el análisis genealógico ha sugerido fuertemente la influencia genética en estas razas, la identificación de los genes afectados ha sido bastante difícil (47–49). Hasta la fecha, solo se han identificado unas pocas epilepsias monogénicas en perros que son paralelas a las epilepsias en humanos con respecto al inicio de la epilepsia y los tipos de convulsiones (47). Por lo tanto, en contraste con la genética de las epilepsias humanas hereditarias, donde las técnicas modernas como la secuenciación de alto rendimiento han llevado a la identificación de un número cada vez mayor de síndromes de epilepsia, incluidas las encefalopatías epilépticas, con base genética conocida (36, 42, 45, 50–52), esta área de investigación está en sus inicios en la epilepsia canina.
Tipos de convulsiones en perros con epilepsia
De acuerdo con el ILAE, las convulsiones epilépticas se dividen en inicio focal, inicio generalizado e inicio desconocido (53). Las convulsiones de inicio generalizada se subdividen en convulsiones motoras (por ejemplo, tónico-clónicas generalizadas) y no motoras (por ejemplo, ausencia). Las convulsiones de inicio focal pueden generalizarse secundariamente a convulsiones tónico-clónicas generalizadas. En principio, estos tipos de convulsiones también se observan en perros epilépticos. En el pasado, las convulsiones tónico-clónicas generalizadas a menudo se consideraban el tipo más frecuente de convulsiones en la epilepsia canina, pero la acumulación de evidencia sugiere que las convulsiones de inicio focal son la principal forma de inicio de convulsiones en la epilepsia canina (32, 54, 55). Al igual que en los seres humanos, las convulsiones tónico-clónicas generalizadas pueden tener un inicio generalizado o surgir por generalización secundaria después de las convulsiones de inicio focal. En los perros, el tipo de convulsión (por ejemplo, focal vs. generalizada) no debe usarse como una variable aislada para predecir la presencia de epilepsia estructural, aunque las convulsiones focales (parciales) a menudo sugieren una etiología estructural (40, 56). En general, el tipo de epilepsia y convulsiones es un factor importante para el pronóstico de la terapia (56). Las epilepsias estructurales con convulsiones de inicio focal tienen un pronóstico peor que las epilepsias idiopáticas con convulsiones de inicio generalizado (57). Las convulsiones de inicio focal pueden ser muy sutiles y pueden ser fácilmente perdidas por el dueño del perro, especialmente cuando ocurren por la noche. Las convulsiones focales más complejas pueden manifestarse como un comportamiento extraño, como una agresión no provocar, una carrera incontrolablemente o un ladrido rítmico (32). Además, la epilepsia estructural con convulsiones de inicio focal puede estar asociada con una fase pre-ictal, es decir, es un período de comportamiento alterado en el que el perro puede esconderse, parecer nervioso o buscar al dueño. Aunque la literatura sobre la semiología ictal de las convulsiones focales en perros es limitada, se han encontrado similitudes con respecto a la distribución y la semiología de las convulsiones focales entre perros y humanos (58). Al igual que en los seres humanos (28), las convulsiones focales con o sin generalización secundaria parecen ser el tipo más frecuente de convulsiones en perros con epilepsia, asociadas con un mal pronóstico del tratamiento (55).
Estudios de EEG en perros con epilepsia
En un entorno clínico, el registro no invasivo del EEG del cuero cabelludo mediante una disposición de electrodos estandarizados es un método clave en la evaluación de la epilepsia en humanos, que guía el diagnóstico primario, la clasificación de la epilepsia y el tratamiento (59, 60). Por el contrario, el EEG nunca se ha establecido como una prueba de laboratorio de rutina para el diagnóstico de epilepsia canina, al menos en parte porque el registro no invasivo del EEG del cuero cabelludo se ve comprometido por los artefactos debido a los músculos gruesos del cráneo del perro (61). Para superar este problema, se han utilizado electrodos de cuero cabelludo de aguja subdérmica en hospitales de referencia neurológica específicos, pero esto requiere la inmovilización del perro por sedación profunda o anestesia, lo que es probable que afecte a los registros de EEG interictal e ictal (62). Para reducir este problema, cuando se utilizó sedación o anestesia general para la colocación de electrodos de EEG, el registro ambulatorio de EEG puede extenderse más allá de la recuperación a un estado de meditación normal (63). El IVETF (32, 56) ha reconocido y descrito la importancia del EEG en perros epilépticos y señaló que el desarrollo de un protocolo estandarizado de EEG es una prioridad urgente para la neurología veterinaria, no menos importante para promover la cirugía de epilepsia resectiva en el futuro. De hecho, la extirpación quirúrgica del foco epiléptico es la única cura disponible para la epilepsia (64), pero aún no se utiliza en perros con epilepsia resistente a los medicamentos (DRE) porque es difícil localizar con precisión el origen de las convulsiones en el cerebro de esta especie (65, 66).
Hay varios informes de registros de EEG en perros epilépticos, pero lo más probable es que debido a la sedación o anestesia utilizada, las tasas de detección de alteraciones de EEG en la mayoría de los informes fueron bajas (66). Es poco probable que los registros de EEG en perros epilépticos se puedan utilizar para caracterizar las convulsiones a menos que se disponga de nuevos dispositivos de EEG implantables y un monitoreo continuo de EEG. El grupo de Brian Litt de la Universidad de Pensilvania y sus colaboradores han desarrollado un nuevo dispositivo implantado para registrar y analizar de forma inalámbrica el EEG canino intracraneal continuo (67). Al utilizar este dispositivo para el monitoreo continuo de EEG intracraneal (iEEG) en seis perros conscientes (no anestesiados) con epilepsia natural durante 5 meses, Davis et al. (67) demostraron patrones de inicio de convulsiones intracraneales previamente no caracterizados en estos animales que son sorprendentemente similares en apariencia a la epilepsia de inicio focal En un estudio posterior de un año de duración con este dispositivo en cuatro perros epilépticos, Ung et al. (68) encontraron una variabilidad temporal significativa en las convulsiones y las ráfagas intéricas después de la implantación de electrodos que requirieron varias semanas para alcanzar un estado estacionario. Estos hallazgos, comparables a los reportados en humanos implantados con el dispositivo NeuroPace Responsive NeuroPace Responsive Neurostimulator System (RNS) (ver más abajo), sugieren que los cambios transitorios de la red después de la implantación del electrodo pueden tenerse en cuenta al interpretar o analizar el iEEG durante la evaluación de la cirugía de epilepsia. Una vez que se alcanzó un estado estacionario, se observaron múltiples tipos de convulsiones en cada perro, con una variación temporal significativa entre los tipos (68). Las convulsiones solían ocurrir en grupos, y las convulsiones aisladas eran raras (ver a continuación para una discusión más detallada de este dispositivo iEEG).
Morita et al. (69) utilizaron el registro continuo de EEG con electrodos subcutáneos cada 1-3 meses bajo sedación con xilazina en Sheedogs epilépticos de Shetland y encontraron que inicialmente se detectó un foco epiléptico en el lóbulo frontal, particularmente en el área interna, y que los focos paroxesmales se Estos ejemplos ilustran la utilidad de los registros continuos de EEG en la epilepsia canina para localizar el inicio de las convulsiones y caracterizar su evolución.
Estado epiléptico en perros con epilepsia
El estado epiléptico (SE), la condición de las convulsiones en curso o la actividad convulsiva repetitiva sin recuperar el conocimiento entre convulsiones, es una de las emergencias neurológicas más comunes con un riesgo de alta mortalidad o morbilidad en las personas (70). Con mayor frecuencia, la SE se caracteriza por convulsiones tonico-clónicas convulsivas generalizadas, mientras que la SE no convulsiva es menos frecuente. La SE puede ocurrir en pacientes con epilepsia previa o trastornos agudos del SNC (71). Las causas comunes de SE en pacientes humanos con epilepsia incluyen niveles bajos de ASM o la interrupción abrupta del tratamiento con ASM. La SE requiere un tratamiento i.v. inmediato con un ASM para reducir la mortalidad (72). Sin embargo, no todos los pacientes responderán al tratamiento inicial. Las dos variables más importantes que influyen en la respuesta al fármaco de SE son la etiología subyacente y la duración de SE (73). En cuanto a la duración de la SE, cuanto más tiempo persista la SE (típicamente ~0,5-1 h), más probable es que la SE no responda a la terapia farmacológica, mayor será la mortalidad y peores serán las consecuencias a largo plazo en los sobrevivientes. Sobre la base de la respuesta al tratamiento, la SE se divide en cuatro etapas: temprana, establecida, refractaria y superrefractoria (74). El tratamiento inicial de i.v. con benzodiacepinas (BDZ) se ha convertido en el estándar de atención para la SE temprana. Cuando el tratamiento falla («SE establecida»), se inyecta un ASM de segunda línea. Si este tratamiento también falla, la SE se define como refractaria, lo que potencialmente requiere agentes anestésicos para terminar la SE (75). La SE refractaria se produce en el 23-43% de los pacientes con SE y se asocia con tasas de mortalidad a corto plazo entre el 16 y el 39 % (75). La SE superrresistente se define como actividad convulsiva >24 h a pesar del tratamiento con agentes anestésicos. Esto incluye casos en los que las convulsiones se repiten con un intento de retirada de los anestésicos (76). El tratamiento eficaz de la SE es fundamental, ya que la morbilidad y la mortalidad aumentan drásticamente a medida que persiste la SE convulsiva más larga.
Se ha estimado que casi el 60 % de los perros epilépticos pueden, en algún momento de su vida, experimentar uno o más eventos de SE (77). SE puede ser la primera manifestación de un trastorno convulsivo en perros (78). Es el resultado del fracaso de la terminación endógena de una convulsión aislada. El pronóstico para los perros con SE es bastante pobre: hasta el 25 % de los perros afectados no sobrevivirán al alta hospitalaria (78, 79). La SE puede provocar daño cerebral permanente (por ejemplo, necrosis celular neuronal, reorganización de la red, gliosis) y complicaciones sistémicas graves (por ejemplo, colapso cardiorrespiratorio, shock, acidosis y desequilibrios electrolíticos) (80). Las incautaciones en racimos pueden ser un precursor de SE y se definen como dos o más incautaciones en un plazo de 24 horas. Sin embargo, difieren de la SE porque, durante las convulsiones por racimo, los pacientes recuperan la conciencia, o vuelven a la función basal del SNC, entre las convulsiones (81). Al igual que en los seres humanos, los principales objetivos del tratamiento de las convulsiones SE o de racimo en los perros son detener la actividad convulsiva, prevenir más convulsiones, identificar la causa de las convulsiones y controlar cualquier complicación (79). Los ASM efectivos en SE canino son los mismos que se utilizan en humanos con SE, lo que hace que el SE canino sea una plataforma de traducción para ensayos terapéuticos en humanos (77).
La SE se trata típicamente mediante la administración i.v. de ASM en un entorno hospitalario. Al igual que en los humanos, i.v. Los BDZ son el tratamiento de primera línea de SE en perros. Sin embargo, cuando el acceso i.v. no está disponible para el tratamiento de emergencia, la administración intramuscular, rectal, intranasal, bucal o sublingual puede ser útil. Charalambous et al. (82) realizaron un ensayo clínico aleatorizado de grupos paralelos sobre el midazolam intranasal frente al diazepam rectal para el manejo de la SE canina y encontraron que el midazolam intranasal es un medicamento de primera línea rápido, seguro y eficaz para controlar la SE en perros y parece superior al diazepam rectal. Sin embargo, en el 30 % de los perros, el midazolam intranasal no terminó la SE. A este respecto, es importante tener en cuenta que los subtipos de SE [SE temprano (sensible a BDZ), SE establecido, SE refractario, SE superrrefractario] descritos anteriormente para las personas se han aplicado a los perros (80). Además, al igual que en los seres humanos, cuanto más tiempo persista el SE antes del inicio del tratamiento, mayor es la probabilidad de resistencia a los medicamentos (83). Las terapias combinatorias pueden ser más efectivas para interrumpir la SE que el tratamiento farmacológico individual (84).
Muerte súbita inesperada en epilepsia (SUDEP) en perros con epilepsia
La muerte súbita inesperada en la epilepsia (SUDEP) se ha definido en personas con epilepsia como «la muerte repentina, inesperada, presenciada o no presenciada, no traumática y no ahogándose de un paciente con epilepsia con o sin evidencia de una convulsión, excluyendo el estado documentado epiléptico, y en la que el examen post morte El SUDEP suele ocurrir en pacientes con epilepsia mal controlada. Aunque el SUDEP es relativamente raro, contribuye a la reducción de la esperanza de vida de los pacientes con epilepsias resistentes a los medicamentos (86, 87). Cada año, aproximadamente 1 de cada 1.000 adultos y 1 de cada 4.500 niños con epilepsia morirá de SUDEP. Se desconoce la causa subyacente de SUDEP. La afección puede deberse a una anomalía de la respiración, disfunción cardiovascular, déficits de excitación o una combinación de estos (87). En los perros, se cree que el SUDEP es poco común, pero puede estar infrarreconocida (78). El probable SUDEP se ha documentado en una gran cohorte de perros con epilepsia idiopática (88).
Comorbilidades en perros con epilepsia
Las comorbilidades como el estado de ánimo y los trastornos psiquiátricos o los déficits en el aprendizaje y la memoria pueden estar presentes antes del inicio de la epilepsia, pueden constituir un aspecto del síndrome de epilepsia o ocurrir como consecuencia de la epilepsia en las personas (89). De hecho, algunos mecanismos comunes, como las alteraciones estructurales y funcionales en el sistema límbico, podrían ser la base tanto de la epilepsia como de las comorbilidades (89). En los seres humanos, los trastornos psiquiátricos, como la ansiedad, la depresión, la psicosis, el trastorno por déficit de atención/hiperactividad (TDAH) y el deterioro cognitivo son comorbilidades comunes de la epilepsia (28, 90). La prevalencia de trastornos psiquiátricos en personas con epilepsia es mayor que en la población general o en los pacientes con otras enfermedades médicas crónicas (91).
En los perros epilépticos, se han reportado una variedad de cambios de comportamiento comórbidos, incluyendo ansiedad y agresión defensiva, síntomas similares a la psicosis (por ejemplo, ladridos sin causa aparente, persiguiendo sombras o puntos de luz, ritmo sin objetivo y mirando al espacio), síntomas similares al TDAH y alteraciones cognitivas (92, 93). Sin embargo, los comportamientos anormales como la ansiedad, la inquietud, la irritación y la búsqueda de atención también pueden constituir signos prodrómicos que preceden al inicio de una convulsión o signos post-ictal, lo que indica una afectación del sistema límbico. Además, las convulsiones focales con un componente sensorial o psíquico a menudo se manifiestan como cambios de comportamiento, incluidos los comportamientos ansiosos, la inquietud, el ritmo y la búsqueda de su dueño (58).
Tratamiento de la epilepsia en perros
Los ASM, anteriormente conocidos como medicamentos anticonvulsivos o antiepilépticos, son el pilar del tratamiento de la epilepsia sintomática en humanos y perros (72, 94). El objetivo de la terapia de la epilepsia es la eliminación completa de las convulsiones, que, sin embargo, no siempre es alcanzable, con un objetivo secundario de reducir la gravedad y la frecuencia de los eventos convulsiones (ver más abajo). Actualmente, alrededor de 30 ASM están disponibles para la terapia de la epilepsia en humanos; sin embargo, no todos son adecuados para la terapia en perros. La razón principal de esto son las diferencias farmacocinéticas entre especies. Como se muestra en la Tabla 1, la mayoría de los ASM se eliminan mucho más rápidamente en los perros que en los humanos, lo que hace que el mantenimiento de los niveles de medicamentos terapéuticos en los perros sea difícil, si no imposible. Solo tres ASM, fenobarbital, imepitoína y bromuro de potasio, han sido aprobados para el tratamiento de la epilepsia en perros en Europa, y solo uno (primidono) en los EE. UU. El bromuro de potasio solo está aprobado en Europa como terapia complementaria en perros en los que el tratamiento con fenobarbital o imepitoína fracasó. Al igual que en los seres humanos, los perros epilépticos tienen que ser tratados diariamente y de por vida con un ASM, porque el tratamiento solo suprime sintomáticamente las convulsiones. El tratamiento con dosis demasiado bajas o la interrupción abrupta del tratamiento puede conducir a una SE potencialmente mortal (ver más arriba).
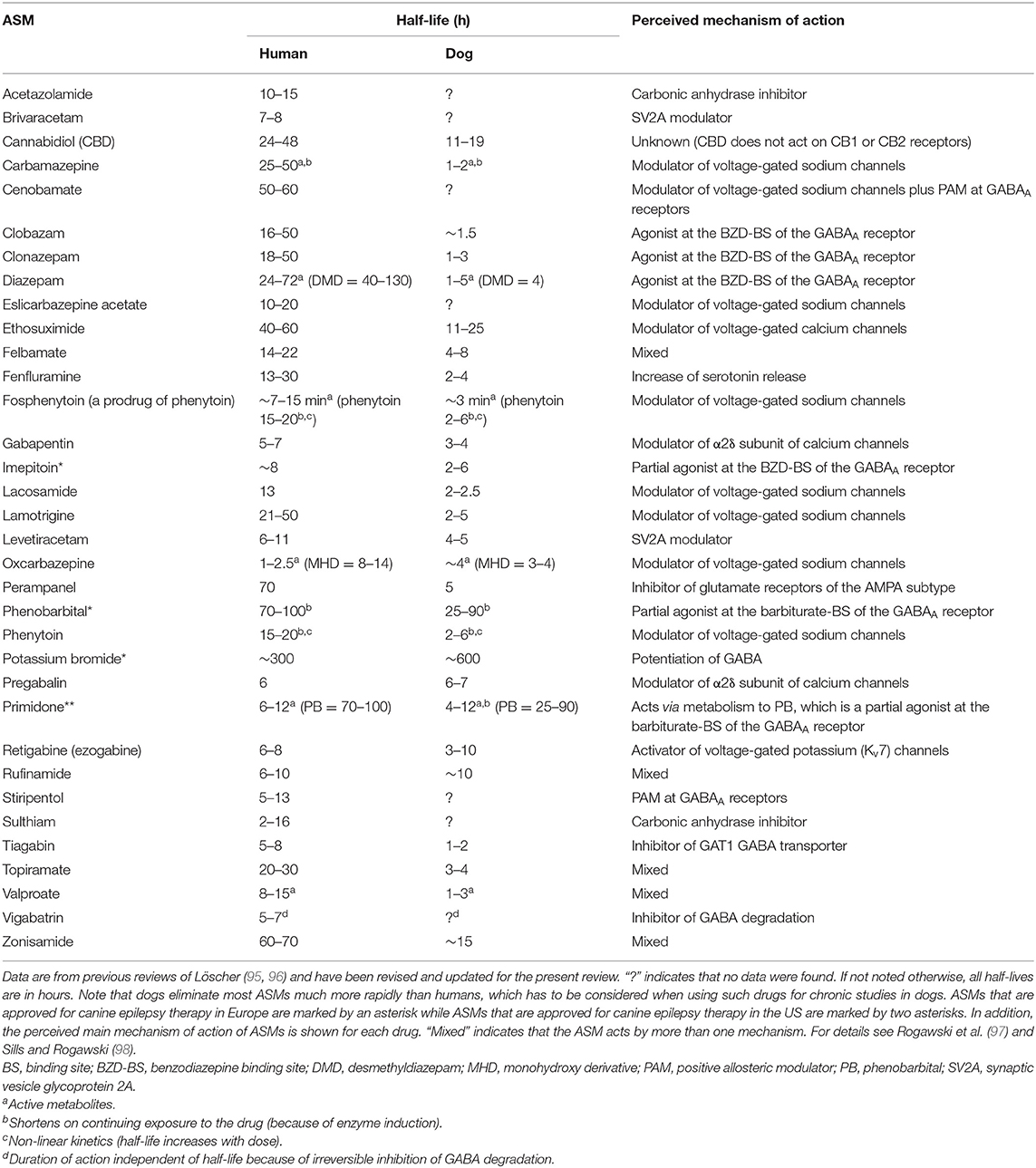 TABLA 1. Una comparación de las vidas medias de eliminación de los medicamentos anticonvulsivos (ASM) en humanos y perros.
TABLA 1. Una comparación de las vidas medias de eliminación de los medicamentos anticonvulsivos (ASM) en humanos y perros.
En los perros que son resistentes a los medicamentos aprobados, los ASM que están aprobados para el tratamiento de la epilepsia humana se pueden probar como medicamento adicional, siempre que la vida media sea lo suficientemente larga como para permitir el mantenimiento de los niveles efectivos de los medicamentos (véase, Tabla 1). Una variedad de tales ASM se han probado como terapia adicional (o monoterapia) en perros epilépticos, en su mayoría con un éxito limitado (24, 57, 94). Sin embargo, el levetiracetam se ha utilizado con éxito para el tratamiento de «pulsos» para las convulsiones en racimos y poco antes de las convulsiones convulsivas generalizadas que se predicen mediante alteraciones del comportamiento (93,99).
El fenobarbital, la primidona y los BDZ (por ejemplo, clobazam, clonazepam y diazepam) conducen a la tolerancia (pérdida de eficacia) y a la dependencia física del tratamiento crónico de los perros; por lo que la dosis de medicamento debe aumentarse durante la primera semana de tratamiento (100). Esta tolerancia se debe principalmente a la adaptación del receptor GABAA a la presencia continua de estos medicamentos (toolerancia funcional); en el caso del fenobarbital y la primidona, la tolerancia metabólica (por inducción de enzimas hepáticas) contribuye a la pérdida general de eficacia. Con tales medicamentos, la interrupción abrupta del tratamiento puede conducir a una SE potencialmente mortal. Por el contrario, la imepitoína, que difiere del fenobarbital y los BDZ, actúa solo como un agonista parcial de baja afinidad en el receptor GABAA y no tiene tolerancia ni responsabilidad de dependencia (101). Otra ventaja del tratamiento con imepitoína es que, a diferencia del fenobarbital y el bromuro de potasio, no se necesita un seguimiento terapéutico del fármaco (mediante la determinación de los niveles plasmáticos del fármaco) durante la terapia (101). A este respecto, es interesante observar que los niveles plasmáticos terapéuticos de fenobarbital en perros epilépticos están en el mismo rango (10-40 μg/ml) que en personas con epilepsia (102).
Si los ASM no suprimen o, al menos, mejoran las convulsiones, hay varias opciones adicionales para tratar el DRE, incluida la dieta cetogénica y la estimulación nerviosa vaga (VNS) (65). Sin embargo, que yo sepa, solo hay pruebas limitadas de evidencia disponibles para tales tratamientos en perros (ver más abajo). En medicina humana, la medicina de precisión se está desarrollando para tipos específicos de epilepsias genéticas con etiología conocida (35), pero este tipo de terapia aún no está disponible para perros.
En medicina, muchos pacientes libres de convulsiones consideran la retirada de los ASM, tanto cuando el control de las convulsiones se logra solo con la medicación, como una vez que se convirtieron en libres de convulsiones después de la cirugía de epilepsia. Sin embargo, alrededor del 30-50 % de los pacientes libres de convulsiones que se retiran de los ASM experimentarán una recurrencia convulsiva (103). Hasta donde sabemos, fuimos los primeros en examinar la frecuencia con la que la reinstitución de la terapia en las personas controlará rápidamente la epilepsia como antes (104). Aunque el control de las convulsiones se recuperó en ~1 año en la mitad de los casos, algunos pacientes tardaron entre 5 y 12 años. Además, en el 19 % la reanudación de la medicación no controló la epilepsia como antes, y se observó DRE crónica con muchas convulsiones en hasta el 23 % de los pacientes con recurrencia (104). Después de nuestro informe inicial, se han reportado cifras similares en numerosos estudios clínicos (103). Más recientemente, examinamos el mismo problema en la epilepsia canina (105). Después de la retirada de ASM, el 36 % de los perros epilépticos permanecieron libres de convulsiones, pero el 64 % sufría de recurrencia de convulsiones, de los cuales solo el 43 % pudo recuperar la libertad de convulsiones después de reanudar la terapia con ASM. Por lo tanto, este estudio sobre perros reflejó hallazgos similares en pacientes humanos y cuestionó si el riesgo de recurrencia de las convulsiones vale la pena el beneficio de suspender el tratamiento.
Ensayos controlados aleatorios en perros epilépticos
La aprobación de nuevos ASM para la epilepsia en humanos depende de varios ensayos controlados aleatorios (ECA), generalmente realizados como terapia complementaria en pacientes con epilepsia focal que es refractaria a los tratamientos estándar (106). Por el contrario, en los perros los ECA también son posibles en animales con epilepsia recién diagnosticada. Además, una ventaja adicional de los ECA en perros es que el acuerdo de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) no es necesario para los estudios caninos a menos que el medicamento se esté desarrollando para su aprobación en perros (8). La prueba de eficacia mediante ECA diseñados adecuadamente está disponible para fenobarbital, bromuro de potasio e imepitoína (57). Para este último medicamento, se han realizado varios ECA tanto en perros con epilepsia recién diagnosticada como en perros resistentes a ASM (57, 101). Hasta donde sabemos, fuimos los primeros en comparar la primidona y el fenobarbital en un ensayo controlado en perros epilépticos, lo que mostró que el fenobarbital es superior a la primidona (27), lo que llevó a abandonar la primidona como un medicamento de primera elección en la epilepsia canina. Además, demostramos que los principales ASM utilizados en humanos, como la carbamazepina, la fenitoína y el valproato, no son efectivos en perros epilépticos porque sus corta vida media en esta especie (Tabla 1) no permiten mantener concentraciones plasmáticas efectivas durante el tratamiento crónico (24).
Por el contrario, solo se han realizado unos pocos ECA en perros para ASM que solo están aprobados para pacientes humanos (57). Como ejemplo, Munana et al. (107) llevaron a cabo un ensayo cruzado aleatorizado, controlado con placebo y ciego sobre el levetiracetam en perros resistentes al fenobarbital y al bromuro de potasio. Se informó repetidamente que el levetiracetam era eficaz en pequeños ensayos no controlados, pero en el ECA el levetiracetam no fue más eficaz que el placebo (107). Sin embargo, como se describió anteriormente, el levetiracetam se utiliza como tratamiento de pulso para la prevención de convulsiones en perros epilépticos que son resistentes al tratamiento crónico con ASM. Para esta indicación, el levetiracetam tiene la ventaja de que es mucho menos sedante que los BDZ que se utilizan de otro modo para un tratamiento de pulsos cortos y transitorios. Además, el tratamiento intermitente o de pulso con levetiracetam evita el desarrollo de tolerancia (pérdida de eficacia) que se ha observado durante el tratamiento crónico con este medicamento en perros (108) y, inicialmente, en ratas enmadas (109).
Munana et al. (110) realizaron pequeños ECA similares en perros epilépticos resistentes a los medicamentos con modificación de la dieta e implantes quirúrgicos, de nuevo sin ninguna diferencia significativa con el placebo. Curiosamente, al igual que en los seres humanos, se observó una respuesta positiva a la administración de placebo, que se manifestó como una disminución en la frecuencia de las convulsiones, en perros epilépticos (107, 110). Esto debe tenerse en cuenta al evaluar los estudios abiertos en perros que tienen como objetivo evaluar la eficacia de los ASM, ya que los resultados reportados podrían estar sobreestimados (110). Hay varias explicaciones para los efectos del placebo en la frecuencia de convulsiones en humanos o perros con epilepsia, incluida la «regresión a la media», la anticipación, el condicionamiento clásico y la historia natural de la enfermedad (110, 111). La regresión a la media es un término estadístico utilizado para describir las fluctuaciones naturales de las convulsiones que se producen a lo largo del tiempo en un ensayo de medicamentos que normalmente tiene una duración de unos pocos meses. La epilepsia es un trastorno de depilación y disminución, y las fluctuaciones en la frecuencia de las convulsiones son comunes a lo largo de la enfermedad (112). Es más probable que los dueños de perros busquen un cambio en la terapia para su mascota (o la inclusión del perro en un ensayo de drogas) cuando las convulsiones están bajo un mal control. A corto plazo, es probable que mejore la frecuencia de las convulsiones, independientemente del tratamiento administrado. Por lo tanto, los ensayos con medicamentos sin control de placebo pueden atribuir erróneamente una mejora en la frecuencia de las convulsiones al tratamiento con medicamentos, mientras que, de hecho, se debe al efecto del tiempo. Una alternativa a un grupo de placebo es el uso de un grupo de pseudo-placebo que se trata con un ASM a una dosis subterapéutica baja (113). Además, la superioridad de un medicamento se puede demostrar utilizando un diseño comparativo frente a un ASM estándar.
El último diseño se utilizó en un ECA más reciente que comparó la eficacia de la monoterapia con levetiracetam frente a fenobarbital en perros con epilepsia recién diagnosticada; el fenobarbital fue efectivo, pero el levetiracetam no lo fue, incluso cuando se administró tres veces al día para tener en cuenta la corta vida media de este medicamento en perros (114). En un ECA para evaluar el efecto de la administración oral de cannabidiol, además del tratamiento convencional de ASM sobre la frecuencia de las convulsiones en perros con epilepsia intratable, la proporción de respondedores fue similar entre los grupos de cannabidiol y placebo (115). Por el contrario, un ECA multicéntrico en una dieta enriquecida con triglicéridos de cadena media cetogénicos (MCT) administrada como suplemento dietético adicional tuvo un efecto positivo en el control de las convulsiones y el comportamiento en perros con epilepsia resistente al ASM (116). Además, un ECA en la estimulación magnética transcraneal repetitiva (rTMS) produjo efectos positivos en la frecuencia de las convulsiones en perros con DRE (117). Del mismo modo, un ECA sobre la eficacia del fenobarbital o el bromuro de potasio como ASM adicionales para controlar a los perros refractarios a una dosis máxima de imepitoína resultó en una mejora en el manejo de las convulsiones en la mayoría de los perros (118).
Resistencia a los medicamentos en perros epilépticos
El DRE ocurre cuando una persona no se ha vuelto (y permanece) libre de convulsiones con ensayos adecuados de dos ASM (119). Numerosos estudios sugieren que la epilepsia no se controla con ASM en aproximadamente un tercio de los adultos y entre el 20 y el 25 % de los niños (28). Esta condición también se conoce como epilepsia intratable, médicamente refractaria o resistente a los medicamentos. Los pacientes con tal DRE tienen un mayor riesgo de muerte prematura, lesiones, disfunción psicosocial y reducción de la calidad de vida, por lo que el desarrollo de terapias más efectivas es una necesidad clínica urgente (120). En los perros epilépticos, el porcentaje de resistencia a los medicamentos puede ser incluso mayor (≥50%) que en los humanos (121). Esto puede deberse a que los medicamentos [fenobarbital, primidona (a través de su principal metabolito activo fenobarbital), imepipina, bromuro de potasio] que están aprobados para el tratamiento de la epilepsia canina actúan como moduladores alostéricos positivos (PAM) en el mismo objetivo (el receptor GABAA), mientras que los muchos másPor lo tanto, un paciente resistente a una categoría mecanicista de ASM (por ejemplo, los PAM receptores GABAA) se puede cambiar a otra categoría mecanicista (por ejemplo, moduladores de canales iónicos), mejorando así el armamento terapéutico, mientras que esto no es posible en perros epilépticos. Al igual que en los seres humanos, la resistencia a los medicamentos sigue siendo un problema clínico importante en el manejo terapéutico de las epilepsias caninas con implicaciones sustanciales para la calidad de vida y los tiempos de supervivencia (121).
Los mecanismos subyacentes a la resistencia a los medicamentos en la epilepsia canina son poco conocidos. La densidad de convulsiones y la aparición de convulsiones en racimos se han relacionado con una mala respuesta a los ASM (121). Además, existe evidencia de que los antecedentes genéticos y las alteraciones en los mecanismos epigenéticos podrían influir en la eficacia de los ASM en perros con epilepsia (121, 122). Solo hay datos insuficientes disponibles en perros epilépticos para apoyar las hipótesis prominentes de resistencia a los medicamentos en la epilepsia humana, por ejemplo, las hipótesis del transportador, el objetivo y la red (120), que se discutirán con más detalle a continuación.
Es importante destacar que antes de definir una epilepsia como resistente a los medicamentos, se debe excluir la pseudoresistencia. La razón principal de la pseudoresistencia en los perros epilépticos es el mal cumplimiento del propietario en el tratamiento médico de sus mascotas (123, 124). Otra razón puede ser que el perro no es epiléptico, sino que tiene un trastorno de discinesia paroxística (125), que, sin EEG y conocimiento sobre las diferencias clínicas, puede diagnosticarse falsamente como epilepsia (126).
Patogénesis de la epilepsia en perros
Como se muestra en la Figura 1, una variedad de insultos cerebrales pueden inducir la epiléptica génesis, es decir, el proceso subyacente al desarrollo de la epilepsia (Figura 2). Además, las mutaciones genéticas subyacentes a las epilepsias hereditarias inducen este proceso. Basada principalmente en datos de modelos de roedores de epilepsia, la epileptogénesis se caracteriza por una variedad de cambios estructurales, moleculares y funcionales en el cerebro, incluidos los procesos inflamatorios, la interrupción de la barrera hematoencefálica (BBB), la neurodegeneración, el brote sináptico, los cambios plásticos en los canales y receptores i Sin embargo, no todos los pacientes con los insultos cerebrales que se muestran en las Figuras 1, 2 desarrollarán epilepsia; por lo que se necesitan con urgencia biomarcadores para predecir la epilepsia en pacientes en riesgo (127). Además, actualmente no hay terapias disponibles que detengan o modifiquen estos procesos para prevenir la epilepsia en pacientes en riesgo (128). Si tales terapias estuvieran disponibles, también podrían usarse para prevenir la epileptógenesis secundaria, es decir, el proceso que conduce de la epilepsia recién diagnosticada a la epilepsia crónica, que a menudo es refractaria a los ASM (Figura 2).
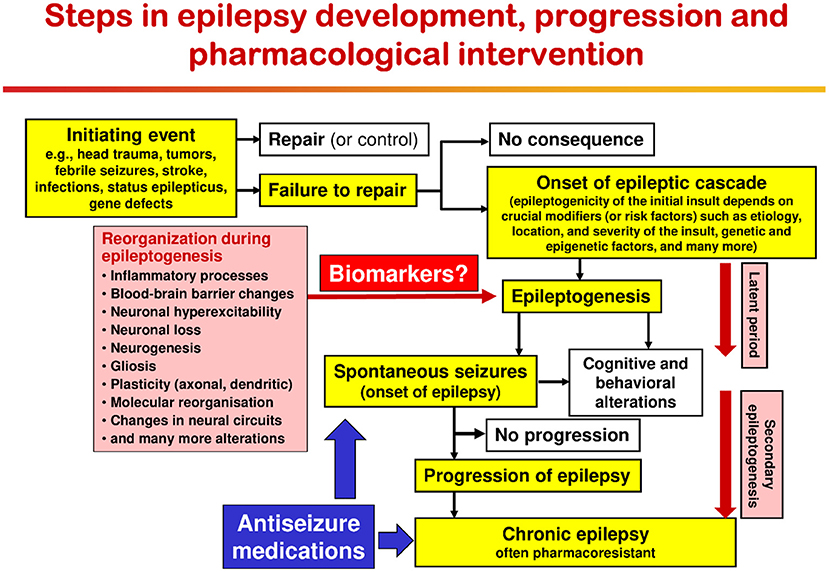 FIGURA 2. Procesos epiteptogénicos y factores de riesgo involucrados en el desarrollo de la epilepsia después de insultos cerebrales agudos. Posiblemente dependiendo de los modificadores cruciales o los factores de riesgo, la misma lesión cerebral puede ser epileptogénica o no. Inmediatamente después de la lesión cerebral, pueden ocurrir convulsiones tempranas (o provocadas); estas convulsiones sintomáticas agudas no indican epilepsia, pero pueden aumentar el riesgo de desarrollar epilepsia. En la mayoría de los pacientes, los insultos cerebrales no causan epilepsia. El término epileptogénesis incluye procesos que hacen que el cerebro sea susceptible a las convulsiones recurrentes espontáneas y procesos que intensifican las convulsiones y las hacen más refractarias a la terapia (progresión o «epileptogénesis secundaria»). Durante la epileptógenesis, se producen múltiples alteraciones cerebrales, incluida la excitabilidad alterada de las neuronas y/o los circuitos neuronales, la activación de la microglía, la disfunción de los astrocitos, las alteraciones en la expresión y la función de los receptores y los canales iónicos (en parte recapitulando la ontogénesis), la pérdida de Es importante tener en cuenta que algunas de estas alteraciones pueden estar relacionadas con la reparación o recuperación posterior a la lesión y no ser adecuadas como objetivos para detener el proceso epileptogénico. El «período latente» es el tiempo desde el inicio de la lesión cerebral epileptogénica hasta el primer inicio de convulsiones espontáneas clínicamente obvias. Este período latente, durante el cual tienen lugar los procesos epileptogénicos, puede durar de días a meses a años. La figura ha sido modificada con respecto a versiones anteriores (129–131).
FIGURA 2. Procesos epiteptogénicos y factores de riesgo involucrados en el desarrollo de la epilepsia después de insultos cerebrales agudos. Posiblemente dependiendo de los modificadores cruciales o los factores de riesgo, la misma lesión cerebral puede ser epileptogénica o no. Inmediatamente después de la lesión cerebral, pueden ocurrir convulsiones tempranas (o provocadas); estas convulsiones sintomáticas agudas no indican epilepsia, pero pueden aumentar el riesgo de desarrollar epilepsia. En la mayoría de los pacientes, los insultos cerebrales no causan epilepsia. El término epileptogénesis incluye procesos que hacen que el cerebro sea susceptible a las convulsiones recurrentes espontáneas y procesos que intensifican las convulsiones y las hacen más refractarias a la terapia (progresión o «epileptogénesis secundaria»). Durante la epileptógenesis, se producen múltiples alteraciones cerebrales, incluida la excitabilidad alterada de las neuronas y/o los circuitos neuronales, la activación de la microglía, la disfunción de los astrocitos, las alteraciones en la expresión y la función de los receptores y los canales iónicos (en parte recapitulando la ontogénesis), la pérdida de Es importante tener en cuenta que algunas de estas alteraciones pueden estar relacionadas con la reparación o recuperación posterior a la lesión y no ser adecuadas como objetivos para detener el proceso epileptogénico. El «período latente» es el tiempo desde el inicio de la lesión cerebral epileptogénica hasta el primer inicio de convulsiones espontáneas clínicamente obvias. Este período latente, durante el cual tienen lugar los procesos epileptogénicos, puede durar de días a meses a años. La figura ha sido modificada con respecto a versiones anteriores (129–131).
Estudios de neuroimagen
A excepción de algunas epilepsias genéticas, las causas de la epilepsia canina no se entienden bien. Aunque la introducción de la RMN como herramienta de diagnóstico de los perros epilépticos ha revelado una variedad de anomalías cerebrales estructurales y funcionales en tales animales (38, 39, 132-36), esto por sí solo no explica las causas moleculares exactas de las convulsiones recurrentes espontáneas como las observadas en la epilepsia. Además, los perros epilépticos, incluidos aquellos con epilepsia «idiopática», pueden tener patologías subyacentes heterogéneas, incluidos cambios estructurales sutiles que no se pueden identificar en la inspección visual convencional de la resonancia magnética del cerebro.
En un reciente estudio de resonancia magnética peri-ictal en 81 perros con sospecha de epilepsia idiopática, las áreas cerebrales más comunes afectadas fueron el hipocampo (39/81), el giro cingulado (33/81) y los lóbulos piriformes (32/81) (135). Esto puede sugerir que, al igual que los humanos, el sistema límbico (o lóbulo temporal mesial) se ve particularmente afectado en los perros epilépticos. Esta posibilidad está corroborada por varios otros estudios de resonancia magnética en un gran número de perros epilépticos (132–134, 136, 137). Sin embargo, a diferencia de los pacientes humanos, de los cuales se puede obtener tejido epiléptico para estudios electrofisiológicos y moleculares durante la cirugía de epilepsia por resección del tejido focal epileptogénico, dicha cirugía resectiva está en su infancia en medicina veterinaria (66, 138–140).
El uso de la resonancia magnética funcional y las imágenes espectroscópicas por resonancia magnética (MRSI) en perros se discutirá en secciones separadas a continuación.
Más recientemente, la tomografía por emisión de positrones (PET) se ha utilizado en perros epilépticos (141, 142). Las imágenes nucleares no invasivas por PET y la tomografía computarizada por emisión de fotón único (SPECT) han contribuido significativamente a la localización del foco epiléptico en la neurología humana durante varias décadas (143). Debido a que las imágenes de radiotraqueo molecular por PET o SPECT ofrecen una visión funcional de las alteraciones cerebrales, tales técnicas tienen el potencial de una mejor comprensión de la fisiopatología de la epilepsia. Las imágenes neuronucleares en perros también pueden servir para identificar un foco epiléptico en la epilepsia negativa por resonancia magnética. Los esfuerzos conjuntos en Finlandia han llevado a dos publicaciones recientes que apoyan que la PET F-18-fluoro-desoxiglucosa (F-18-FDG) para la identificación de la región de enfoque epiléptico ampliamente utilizada en la evaluación prequirúrgica en pacientes humanos es traducible a pacientes veterinarios. En perros juveniles Lagotto Romagnolo con epilepsia de inicio focal, Jokinen et al. (141) identificaron regiones con un metabolismo reducido de la glucosa en la corteza cerebral asociada con anomalías del EEG. Un segundo estudio realizado por el mismo grupo evaluó prospectivamente perros Spitz finlandeses adultos con epilepsia idiopática focal por EEG y F-18-FDG y encontró anomalías por análisis visual en perros del 11 de septiembre con hallazgos de corteza occipital más consistentes con el estado epiléptico (142).
Estudios de tejido cerebral
En un estudio post mortem en un Sheedogs epiléptico de Shetland, se encontraron pérdida neuronal y gliosis en el sistema límbico, incluido el giro cingulado, el núcleo amigdaloide, las partes dorsales y ventrales del hipocampo y el núcleo dorsodial del tálamo (144), que está en línea con los hallazgos post morte En un estudio posterior en un grupo más grande de Sheedogs de las Shetland epilépticos que murieron en SE, se encontró neurodegeneración y astrocitosis predominantemente en la corteza cingulada y el área interna de la corteza frontal (69). Además de la neurodegeneración, se ha informado de neurogénesis en el giro dentado de un perro epiléptico (146), que se asemeja a la neurogénesis aberrante en esta región reportada en humanos con epilepsia del lóbulo temporal (TLE) (147, 148). Sin embargo, en un grupo de seis perros epilépticos de diferentes razas, que fueron sacrificados debido a convulsiones frecuentes y graves resistentes a los medicamentos, no se determinó ninguna pérdida de neuronas en el hilus dentado ni brote axonal, lo que indica la ausencia de patología TLE (149). Esto no es sorprendente porque solo uno de los seis perros mostró convulsiones focales. La pérdida de neuronas en el hipocampo de perros con epilepsia se ha descrito anteriormente en informes de casos (144, 150, 151) y en una colonia de Beagles de investigación (152). Potschka et al. (153) describieron alteraciones patomorfológicas obvias en el tejido hipocampo canino de perros con epilepsia idiopática y sintomática, lo que sería consistente con los datos de los análisis de resonancia magnética descritos anteriormente. Sin embargo, si TLE existe en perros sigue siendo un tema de debate. La sospecha de esclerosis hipocampal a partir de las resonancias magnéticas y la volumetría (ver arriba) requiere ser corroborada por estudios de tejidos (154).
¿Existe epilepsia del lóbulo temporal mesial en perros?
En los seres humanos, el tipo más común de epilepsia en adultos es el TLE mesial (mTLE), un síndrome de epilepsia que se caracteriza por convulsiones focales (parciales complejas) que se originan en el lóbulo temporal mesial y lesiones patológicas, como la esclerosis del hipocampo y la neurodegeneración en otras regiones de Durante muchas décadas, se sabe que el sistema límbico en los lóbulos temporales, incluida la formación del hipocampo y las áreas parahipopocampales, como los cortes piriforme, perirhinal y entorinal, desempeña un papel crucial en el desarrollo de convulsiones y epilepsia (156–163). El hipocampo es considerado por muchos como el generador de mTLE. mTLE se asocia típicamente con la esclerosis del hipocampo, una condición neuropatológica con pérdida grave de células neuronales y gliosis en el hipocampo, específicamente en la región CA1 (área de Cornu Ammonis 1) y el subiculo del hipocampo propiamente dicho y en el hilus del giro Además de la pérdida de neuronas, se cree que la germinación aberrante de fibras musgosas de células de gránulos dentadas en TLE mesial es la base de la creación de circuitos aberrantes que promueven la generación o propagación de la actividad convulsiva espontánea (163, 165). La extirpación quirúrgica del hipocampo esclerótico en pacientes resistentes a los medicamentos a menudo mejora o incluso cura el TLE (120).
Los mecanismos por los cuales las lesiones del hipocampo y los cambios asociados de la red neuronal dentro y fuera del hipocampo pueden conducir a una mayor susceptibilidad a las convulsiones y al desarrollo de convulsiones recurrentes han sido objeto de intensa investigación, tanto en modelos de roedores de mTLE como mediante el uso de tejido resecado de pacientes con mTLE (145 De hecho, en la mayoría de los pacientes con mTLE las convulsiones se originan en esta región. Sin embargo, una pregunta de muy larga data y un tema de debate en curso es si la esclerosis del hipocampo juega un papel en el desarrollo del enfoque epiléptico o si es la consecuencia de convulsiones repetidas (166, 167).
Como se discutió anteriormente, la relevancia de la patología del lóbulo temporal sigue siendo un tema de debate en la epilepsia canina (54,56, 153, 154). Ha habido varios informes en la literatura veterinaria que sugieren que el mTLE también se produce en perros. Sin embargo, en ausencia de anomalías convincentes de EEG ictal o interictal para confirmar que la actividad convulsiva está en el lóbulo temporal, y con la ausencia de patología similar a la enfermedad humana (esclerosis hipocampal), no hay evidencia definitiva de que algunos tipos de epilepsia canina sean en realidad análogos a la TLE en los Sin embargo, varios de los datos de resonancia magnética y tejido cerebral descritos anteriormente indican claramente una participación del hipocampo y otras regiones del lóbulo temporal en la epilepsia canina. Además, muchos perros epilépticos tienen una presentación de convulsiones focal que es muy similar a la que se describe en humanos con mTLE, incluyendo salivación excesiva, mirar hacia fuera, pupilas dilatadas y espasmos faciales (32). En línea con esto, reflejando las características del mTLE humano, se ha descrito una asociación entre la presencia de descargas unilaterales de EEG epilépticos y una disminución en el volumen unilateral del hipocampo en la epilepsia canina (133).
Estudios de microdiálisis cerebral sobre GABA y Glutamato
La epilepsia se caracteriza en general por una excitabilidad neuronal aberrante. El glutamato es el neurotransmisor excitatorio predominante en el cerebro de los mamíferos adultos; por lo tanto, gran parte de la investigación anterior sobre la epilepsia ha intentado comprender el papel del glutamato en las convulsiones y la epilepsia (168). El glutamato ha estado implicado tanto en el inicio como en la propagación de las convulsiones como en el daño cerebral que puede ocurrir después de convulsiones prolongadas o repetidas. El ácido gamma-aminobutírico (GABA), el neurotransmisor inhibitorio más común en el cerebro, generalmente suprime la actividad convulsiva. Durante mucho tiempo se ha pensado que la epilepsia y su mayor propensión a las convulsiones espontáneas recurrentes se deben a un desequilibrio entre la excitación glutamatérgica y la inhibición GABAérgica en el cerebro (169, 170). Sin embargo, esta idea anticuada ignora la complejidad de los sistemas GABAérgico y glutamatérgico en el cerebro (171). De hecho, la experiencia con GABA indica que ciertos neurotransmisores pueden tener efectos anticonvulsivos o proconvulsivos dependiendo de las redes neuronales, la edad y la patología involucrada (172-124).
A pesar de esta complejidad del funcionamiento de los neurotransmisores cerebrales, numerosos estudios que utilizan microdiálisis intracerebral de aminoácidos extracelulares en el foco epiléptico de pacientes humanos sometidos a cirugía de epilepsia han mostrado aumentos marcados en la liberación de glutamato intéricamente y, más marcadamente, durante las convulsiones (175-180 Los niveles extracelulares de GABA no cambiaron o aumentaron durante las convulsiones. Sin embargo, cuando la liberación de GABA en el hipocampo humano fue estimulada por el glutamato, disminuyó notablemente en los hipocampos epileptogénicos, en contraste con los hipocampos contralaterales y no epileptogénicos (181). La microdiálisis intracerebral también se ha utilizado en perros epilépticos (129). En los Sheedogs epilépticos de las Shetland, se detectaron altos valores de niveles de glutamato extracelular en los lóbulos frontal y parietal en asociación con un mayor número de picos y ondas agudas durante la hiperventilación. En el cerebro de los Shetland Sheedogs que murieron de SE, la inmunohistoquímica que utiliza anticuerpos contra los transportadores de glutamato y glutamato (GLT-1 y GLAST) reveló una disminución de GLT-1 en la corteza cerebral y el núcleo lateral del tálamo (129). Estos datos indican que la absorción astrocítica de glutamato por GLT-1 está alterada en estos perros epilépticos, lo que explicaría el aumento de los niveles de glutamato extracelular. Los hallazgos de GLT-1 son de interés porque este transportador de glutamato astrocítico regula la homeostasis del glutamato extracelular en el cerebro y se cree que la desregulación de GLT-1 contribuye al desarrollo de la epilepsia (182).
Estudios de imágenes espectroscópicas de resonancia magnética sobre los niveles de GABA en el cerebro
Un problema inherente a la medición de los aminoácidos extracelulares durante la cirugía de epilepsia es la falta de controles no epilépticos adecuados. Las imágenes espectroscópicas por resonancia magnética (MRSI) se pueden utilizar para determinar el GABA en el cerebro de los pacientes con epilepsia frente a los controles (183). De hecho, al usar MRSI, Petroff et al. (184) informaron que las personas con mTLE tenían niveles más bajos de GABA en el lóbulo occipital que los sujetos sin epilepsia. El MRSI también se ha utilizado para estudiar el efecto de los ASM que actúan potenciando la transmisión GABAérgica en los niveles de GABA, mostrando que la vigabatrina, inhibidor de la GABA aminotransferasa (GABA-T) aumenta los niveles de GABA en pacientes con epilepsia (185). En aparente contraste, el valproato no aumentó significativamente las concentraciones de GABA en el lóbulo occipital de pacientes adultos con convulsiones focales complejas (186). No se dispone de estudios comparables de MRSI sobre los niveles cerebrales de GABA en perros epilépticos, pero la técnica se ha evaluado en perros no epilépticos para medir las perturbaciones postictales del metabolismo cerebral después de la inducción de convulsiones por el pentilentetrazol (PTZ) (187). Una desventaja de medir los niveles cerebrales de GABA o glutamato mediante MRSI es la baja resolución espacial de la técnica y el hecho de que solo se pueden evaluar regiones como el lóbulo occipital.
Estudios sobre los niveles de GABA y Glutamato de LCR
Otra técnica para evaluar los niveles extracelulares de aminoácidos en el cerebro es determinarlos en el líquido cefalorraquídeo (LCR). Se han reportado estrechas correlaciones dependientes de la dosis entre los niveles de GABA de LCR ventricular o cisternal y las concentraciones de GABA en el cerebro después de la administración de medicamentos que elevan el contenido de GABA en el cerebro (188-190), lo que indica que los niveles de GABA de LCR pueden reflejar el metabolismo de GABA en el cerebro y la Un ejemplo en perros se muestra en la Figura 3A, en la que comparamos los niveles de GABA en la corteza cerebral, el LCR y el plasma de un perro anestesiado después de la administración de valproato, lo que demuestra un impresionante paralelismo de las alteraciones de GABA. Además, utilizando un modelo de umbral de convulsiones en perros no tratados, encontramos una correlación positiva altamente significativa entre el GABA del LCR y el umbral de convulsiones (Figura 3B), lo que indica que la concentración de GABA en el LCR está relacionada con la actividad GABAérgica en los compartimentos cerebrales involucrados en la regulación de la excitabilidad Además, cuando enciendamos a los perros mediante la administración repetida del antagonista del receptor GABAA PTZ, el aumento progresivo en la gravedad de las convulsiones se asoció con una disminución en los niveles de GABA de LCR, que fue prevenido por el fenobarbital ASM (195). Por lo tanto, estos datos sugirieron la utilidad de las mediciones de GABA del LCR en las investigaciones clínicas de la función GABAérgica del cerebro. En línea con esta sugerencia, Wood et al. (193) informaron que la concentración media de GABA lumbar de LCR entre 21 pacientes humanos con epilepsia medicada con convulsiones intratables fue significativamente menor que la de 20 voluntarios normales no medicados (Figura 3C). Esto nos llevó a realizar un estudio similar en perros epilépticos (194). Como se muestra en la Figura 3D, los perros epilépticos mostraron una disminución similar en el GABA del LCR que la observada anteriormente en humanos con epilepsia. También determinamos CSF GABA en perros epilépticos no medicados y no encontramos ninguna diferencia con los perros medicados con epilepsia (Figura 3D). El tratamiento consistió en primidona o fenobarbital, que no se sabe que afecten a los niveles de GABA en el cerebro. El resultado similar de los estudios de GABA de LCR en perros epilépticos y humanos fue la primera evidencia directa de que los perros epilépticos pueden servir como modelo de traducción para la enfermedad humana.
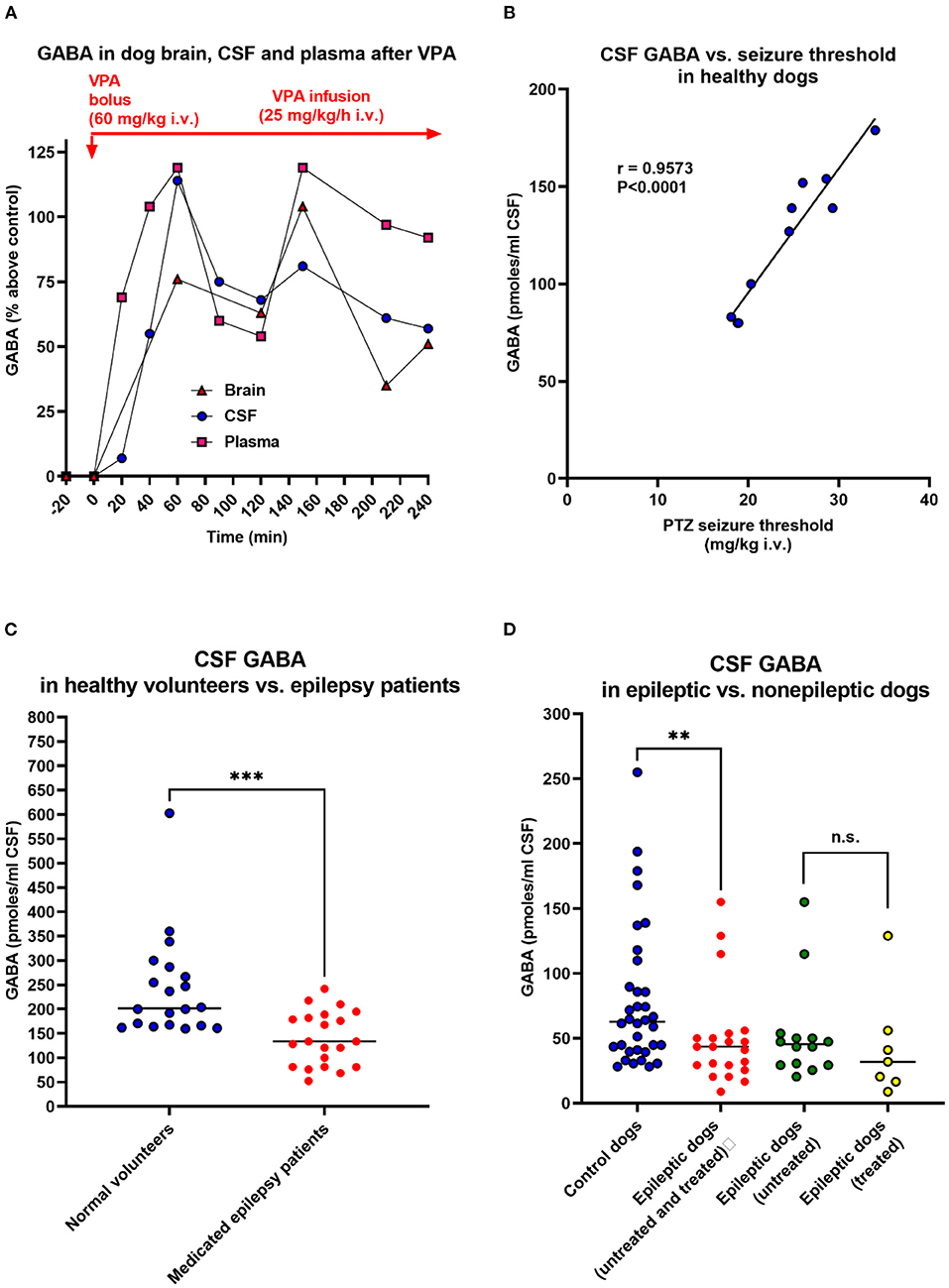 FIGURA 3. Relación entre las concentraciones de GABA de LCR y la excitabilidad neuronal. En los estudios con perros que se muestran en (A,B,D), el LCR se retiró del espacio subaracnoideo mediante una punción suboccipital durante la anestesia. (A) Niveles de GABA en la corteza cerebral, el LCR y el plasma durante la administración del medicamento anticonvulsivo valproato (VPA) en un perro anestesiado. Se realizaron experimentos similares con vigabatrina y otros inhibidores de GABA-T para investigar la relación entre los niveles de GABA en el parénquima cerebral y los del LCR y el plasma. Inesperadamente, estos experimentos mostraron que las alteraciones del GABA en plasma reflejan las respectivas alteraciones en el cerebro y el LCR. Además, tenga en cuenta la correlación entre las alteraciones del GABA del cerebro y el LCR. Se cree que el VPA aumenta la síntesis de GABA (191), lo que explica el aumento del GABA en perros y otras especies, incluidos los humanos (ver texto). Los datos son de Löscher (190). (B) Correlación entre los niveles de GABA de LCR y el umbral de convulsión de pentilenetilenotetrazol en 10 perros sanos. Los datos son de Löscher (192).( C) Niveles de GABA de LCR en 20 voluntarios adultos sanos no medicados y 21 pacientes adultos con epilepsia. Todos los pacientes tuvieron más de tres convulsiones al día a pesar del tratamiento crónico con ASM (fenitoína, fenobarbital o primidona). Los datos se muestran como niveles individuales de GABA de LCR lumbar y mediana; la diferencia significativa entre grupos se indica con asteriscos (P = 0,0003). Los datos son de Wood et al. (193). (D) Niveles de GABA de LCR en 34 perros adultos de control sanos y 21 adultos con epilepsia. Los niveles de GABA de LCR en los perros epilépticos también se muestran por separado para los perros no tratados (n = 14) y tratados (n = 7), respectivamente. Los datos se muestran como niveles individuales de GABA de líquido cefalorraquídeo y mediana; la diferencia significativa entre grupos se indica con asteriscos (P = 0,0075). Los niveles de GABA de LCR en perros tratados (fenobarbital o primidona) y no tratados no difirieron significativamente. Solo uno de los siete perros tratados estaba libre de convulsiones en el momento de la muestra de LCR. Los datos son de Löscher y Schwartz-Porsche (194).
FIGURA 3. Relación entre las concentraciones de GABA de LCR y la excitabilidad neuronal. En los estudios con perros que se muestran en (A,B,D), el LCR se retiró del espacio subaracnoideo mediante una punción suboccipital durante la anestesia. (A) Niveles de GABA en la corteza cerebral, el LCR y el plasma durante la administración del medicamento anticonvulsivo valproato (VPA) en un perro anestesiado. Se realizaron experimentos similares con vigabatrina y otros inhibidores de GABA-T para investigar la relación entre los niveles de GABA en el parénquima cerebral y los del LCR y el plasma. Inesperadamente, estos experimentos mostraron que las alteraciones del GABA en plasma reflejan las respectivas alteraciones en el cerebro y el LCR. Además, tenga en cuenta la correlación entre las alteraciones del GABA del cerebro y el LCR. Se cree que el VPA aumenta la síntesis de GABA (191), lo que explica el aumento del GABA en perros y otras especies, incluidos los humanos (ver texto). Los datos son de Löscher (190). (B) Correlación entre los niveles de GABA de LCR y el umbral de convulsión de pentilenetilenotetrazol en 10 perros sanos. Los datos son de Löscher (192).( C) Niveles de GABA de LCR en 20 voluntarios adultos sanos no medicados y 21 pacientes adultos con epilepsia. Todos los pacientes tuvieron más de tres convulsiones al día a pesar del tratamiento crónico con ASM (fenitoína, fenobarbital o primidona). Los datos se muestran como niveles individuales de GABA de LCR lumbar y mediana; la diferencia significativa entre grupos se indica con asteriscos (P = 0,0003). Los datos son de Wood et al. (193). (D) Niveles de GABA de LCR en 34 perros adultos de control sanos y 21 adultos con epilepsia. Los niveles de GABA de LCR en los perros epilépticos también se muestran por separado para los perros no tratados (n = 14) y tratados (n = 7), respectivamente. Los datos se muestran como niveles individuales de GABA de líquido cefalorraquídeo y mediana; la diferencia significativa entre grupos se indica con asteriscos (P = 0,0075). Los niveles de GABA de LCR en perros tratados (fenobarbital o primidona) y no tratados no difirieron significativamente. Solo uno de los siete perros tratados estaba libre de convulsiones en el momento de la muestra de LCR. Los datos son de Löscher y Schwartz-Porsche (194).
En otro estudio en cooperación con neurólogos pediátricos, determinamos los niveles de GABA de LCR en niños con epilepsia (196-198). Los niños no tratados tenían niveles de GABA de LCR significativamente más bajos que los controles [120 (rango 91-159) pmol/ml frente a 174 (rango 95-316) pmoles/ml; P < 0,02]. Lo mismo fue cierto para los niños con epilepsia tratados con ASM cuando se excluyó el valproato de ASM, que se ha informado que aumenta el metabolismo del GABA (191), (198). De hecho, se encontró que el valproato aumenta los niveles de GABA de LCR en niños con epilepsia en aproximadamente un 100 % (197), lo que es similar al aumento de GABA del LCR (y el cerebro) con valproato observado en perros (Figura 3A). También se encontró una disminución significativa en el GABA de LCR en niños con convulsiones febriles (199).
Sin embargo, algunos estudios no informaron de disminuciones significativas en el GABA de LCR en personas con epilepsia (200-204). Al menos en parte, esto podría deberse a los métodos utilizados para determinar los bajos niveles de GABA de LCR, que se sabe que son sensibles a los aumentos artificiales durante el muestreo, el almacenamiento y la descongelación de las muestras de LCR y el análisis de GABA (205). Estudios más recientes con métodos analíticos modernos, como la espectrometría de masas en tándem por electrospray (ESI-MS/MS) confirmaron los hallazgos iniciales de GABA de LCR en niños y adultos con epilepsia (206, 207). Del mismo modo, nuestros hallazgos sobre el GABA bajo nivel de LCR en perros epilépticos fueron confirmados por estudios posteriores (208, 209). Curiosamente, Podell y Hadjiconstantinou (210) informaron que las bajas concentraciones de GABA de LCR se correlacionan con una respuesta reducida a la terapia con fenobarbital en perros epilépticos, lo que indica que el GABA inicial bajo en el LCR es un biomarcador de la respuesta posterior al tratamiento. En humanos con epilepsia, se encontró que el inhibidor de GABA-T vigabatrina aumenta los niveles de GABA de LCR (211–214), lo que fue predicho por nuestros estudios en perros (189, 190). Los no respondedores de vibeatrina tuvieron un aumento menos marcado de CSF GABA que los respondedores (215). Del mismo modo, se encontró que el tratamiento de las convulsiones con una dieta cetogénica aumenta el GABA de LCR en pacientes humanos epilépticos, con niveles más altos de GABA en los respondedores que en los no respondedores durante la dieta (216).
Además de GABA, se midieron los niveles de glutamato en el LCR tanto de perros como de humanos con epilepsia. En ambas especies, se informaron aumentos en las concentraciones de glutamato de LCR (69, 204, 208, 217–220), aunque algunos estudios no confirmaron estos hallazgos (201–203). Tales diferencias entre estudios en el resultado de los niveles de aminoácidos del LCR en la epilepsia pueden deberse a la variación del diseño experimental, las poblaciones de pacientes y los ASM, o a la falta de controles adecuados.
GABA de plasma como biomarcador de los efectos de los medicamentos
La punción lumbar para el muestreo de LCR es un método invasivo con limitaciones éticas. Por lo tanto, examinamos si las alteraciones inducidas por los medicamentos en el cerebro y los niveles de GABA de LCR se reflejan en el plasma. Como se muestra en la Figura 3A, sorprendentemente, el aumento en los niveles plasmáticos corticales y de LCR tras el tratamiento de perros con medicamentos de elevación de GABA como el valproato se reflejó en los niveles plasmáticos de GABA. Informamos de hallazgos similares para la vigabatrina (189, 190). Esto nos llevó a evaluar el GABA de plasma como una herramienta de diagnóstico para el tratamiento de pacientes con epilepsia humana con valproato y vigabatrina. Tanto en voluntarios sanos como en pacientes con epilepsia, el tratamiento subcrónico con valproato aumentó los niveles plasmáticos de GABA de forma dependiente de la dosis (221, 222).
Curiosamente, un estudio transversal de pacientes con epilepsia con tratamiento adicional con vigabatrina mostró que los respondedores de vigabatrina tenían un nivel de GABA en plasma significativamente más alto que los no respondedores y controles (223, 224). La posibilidad de utilizar el aumento de GABA en plasma causado por la vigabatrina como biomarcador para la respuesta anticonvulsivo a este medicamento en pacientes con epilepsia focal resistente a los medicamentos nos llevó a realizar un estudio clínico prospectivo para evaluar los cambios en la concentración de GABA en plasma en relación con la respuesta clínica durante el tratamiento de la vigabatrinaLos respondedores de vivigabatrina tuvieron un aumento significativo en el GABA plasmático medio tanto después del tratamiento a corto como a largo plazo, mientras que los no respondedores no tuvieron cambios significativos en los niveles de GABA.
Sin embargo, si bien los niveles plasmáticos de GABA son paralelos a los aumentos inducidos por medicamentos en el cerebro y el líquido cefalorraquídeo GABA, no reflejan alteraciones asociadas a la enfermedad en las concentraciones de GABA en el cerebro (226), aunque estudios recientes informaron una asociación entre los niveles plasmámicos de GABA y los síntomas del trastorno de estrés post Además, Saleem et al. (229) informaron que los niveles plasmáticos de GABA y glutamato eran significativamente más altos en pacientes con DRE en comparación con los controles sanos, pero, al menos en parte, esto podría ser una consecuencia del tratamiento de los pacientes con epilepsia con ASM como el valproato.
Hasta donde sabemos, el plasma GABA aún no ha sido evaluado como un biomarcador potencial en perros con epilepsia. En nuestros experimentos con perros con PTZ, los niveles de GABA en plasma no reflejaron las alteraciones en el GABA de LCR en ausencia de tratamiento con ASM (190, 195). Sin embargo, como se muestra en la Figura 3A, los aumentos inducidos por medicamentos en los niveles de GABA de LCR de los perros por ASM como el valproato o la vigabatrina se reflejaron en los niveles plasmáticos de GABA (189, 190, 195). Esto se puede explicar por el hecho de que la enzima degradante GABA GABA-T también está presente en los tejidos periféricos y las plaquetas sanguíneas (230). Además, la enzima sintetizador de GABA glutamato descarboxilasa (GAD) está presente en algunos tejidos periféricos (230). Por lo tanto, medicamentos como el valproato y la vigabatrina que afectan a GABA-T y/o GAD aumentarán el GABA tanto en la periferia como en el SNC.
GABA-T plaquetaria como biomarcador
Al igual que nuestros estudios en perros y humanos, los estudios experimentales en roedores han demostrado que el aumento en el cerebro o la concentración de GABA del LCR inducido por la vigabatrina u otros inhibidores de GABA-T, es paralelo a un aumento en la concentración plasmática de GABA (188, 231, 232). Curiosamente, en niños con epilepsia no tratada, se informó que la actividad de GABA-T en las plaquetas era significativamente menor que en los controles sanos (233). Sorprendentemente, los pacientes que recibieron valproato en monoterapia tuvieron una actividad GABA-T significativamente más alta que tanto el grupo de control como los niños no tratados con epilepsia (233). Como era de esperar, el tratamiento con vigabatrina redujo la actividad de GABA-T en las plaquetas (234). En ratas, se demostró que la GABA-T plaquetaria reflejaba la inhibición de la GABA-T y el aumento de los niveles de GABA en el cerebro después del tratamiento con vigabatrina (235).
Otro estudio en pacientes adultos con epilepsia focal informó que la actividad de GABA-T en las plaquetas aumentó, pero todos los pacientes recibieron ASM como valproato (236). En aparente contraste con el aumento de las plaquetas GABA-T, esta enzima no se incrementó en el tejido del hipocampo resecado durante la cirugía de epilepsia. En un estudio en pacientes medicados con Epilepsia JME y epilepsia focal refractaria, la actividad media de la GABA-T plaquetaria en pacientes con JME fue significativamente mayor que en los sujetos de control, mientras que los pacientes con epilepsia focal no diferían significativamente de los controles (237). En este último estudio, también se midió la absorción de GABA en las plaquetas, lo que mostró una disminución significativa en la absorción de GABA en ambos grupos de pacientes con epilepsia. Basándose en el resultado de un estudio que evaluó el GABA y su metabolismo y función en las plaquetas en comparación con las neuronas, Kaneez y Saeed (238) propusieron que las plaquetas podrían desarrollarse aún más para ser utilizadas como un modelo periférico para estudiar la función GABAérgica neuronal y su anormalidad en enfermedades como la epilepsia.
El papel de la neuroinflamación
Un campo emergente en la investigación de la epilepsia es la evaluación de la neuroinflamación como un proceso crítico durante la epileptogénesis, así como en la epilepsia crónica (143). Los radioligandos PET de la proteína transmembrana mitocondrial TSPO (también conocida como receptor BDZ periférico) se pueden utilizar para visualizar la microglía residente del cerebro activado y los macrófagos invasores del cerebro (239). Además de los pacientes, las imágenes de TSPO se utilizan ampliamente en modelos animales de enfermedades cerebrales (240), pero, hasta donde sabemos, aún no en perros con epilepsia. Sin embargo, la neuroinflamación se está investigando de forma rutinaria en la epilepsia canina mediante otros métodos de diagnóstico (241). De hecho, las enfermedades inflamatorias del SNC son causas importantes de convulsiones en los perros (242) y, al igual que en los seres humanos, la neuroinflamación puede estar involucrada en la epiléptica y la ictogénesis, es decir, los procesos que conducen a la epilepsia y las convulsiones, respectivamente. Por ejemplo, la caja 1 del grupo de alta movilidad (HMGB1), un mediador clave de la neuroinflamación con niveles aumentados en pacientes con epilepsia, aumenta significativamente en el suero sanguíneo de los perros epilépticos (243). Del mismo modo, los perros con epilepsia aumentaron los niveles de interleucina (IL)-1β en el suero, independientemente de la causa subyacente de la enfermedad (244). En el LCR de perros epilépticos, se encontraron concentraciones significativamente más altas de factor de necrosis tumoral (TNF)-α e IL-6 (245).
El papel de la barrera cerebral de la sangre
Los métodos de obtención de imágenes cerebrales no invasivas también son útiles para detectar alteraciones en la barrera hematoencefálica (BBB), que son un sello distintivo de la epilepsia (246). El aumento de la permeabilidad de la BBB que conduce a la extravasación de compuestos sanguíneos como la albúmina y las alteraciones posteriores inducidas por la albúmina en el parénquima cerebral se considera un factor crucial para el desarrollo de la epilepsia (246, 247). Los enfoques de imágenes in vivo para visualizar un BBB con fugas se basan en la detección de agentes de contraste o radiodetracers que no cruzan el BBB intacto (143). La resonancia magnética con contraste mejorado es una técnica establecida para diagnosticar fugas de BBB después de insultos epiptogénicos (248). Esta última técnica se utilizó recientemente en 46 perros epilépticos y 6 controles sanos (249). La disfunción BBB (BBBD) se encontró en el 37 % de los perros epilépticos. La puntuación media de gravedad de la BBBD del lóbulo piriforme en perros con epilepsia fue significativamente mayor en comparación con el control. Además, se encontró una proporción significativamente mayor de LCR a albúmina sérica en perros con BBBD en comparación con perros con BBB intacta. La inmunohistoquímica cerebral en perros que fueron sacrificados a petición del propietario debido a convulsiones no controladas sugirió la señalización del factor de crecimiento transformador activo (TGF)-β y la neuroinflamación en la corteza piriforme, mostrando un aumento de los niveles de albúmina sérica colocalizada con proteína fibrilar ácida glial (GFAP) y Los autores de este estudio histórico concluyeron que la participación del lóbulo piriforme visto por su protocolo de resonancia magnética enfatiza la posibilidad de usar perros como modelo de traducción para la enfermedad humana (249). Una limitación en el uso de métodos de imagen como MRSI, PET o SPECT en perros es que la anestesia es necesaria para lograr la inmovilidad del sujeto para la neuroimagen, lo que puede influir considerablemente en los resultados de los resultados de las imágenes cerebrales funcionales (143).
Causas genéticas de la epilepsia
En comparación con las alteraciones estructurales, bioquímicas e inmunológicas en perros con epilepsia, se sabe mucho menos sobre las causas genéticas de la epilepsia en perros. En los seres humanos, las innovaciones centradas en nuevas tecnologías, análisis y colaboración han llevado a un notable progreso en el descubrimiento de genes (45, 250), lo que ha aumentado nuestra comprensión de las causas de la epilepsia (Figura 4A). Una diferencia clave entre el paradigma de la década de 1990 y la comprensión actual de la epilepsia es que ahora tenemos la confianza de dejar atrás el término «idiopático» para la epilepsia humana (42, 250). Más de 80 genes se consideran genes de la epilepsia, es decir, genes que causan epilepsias o síndromes con epilepsia como el síntoma central (36). Otros 800 genes están relacionados con la epilepsia o están supuestamente asociados con la epilepsia. Las funciones de los genes de la epilepsia se muestran en la Figura 4B. La mayoría de los genes de la epilepsia conducen a cambios funcionales en los canales iónicos y causan canalopatías epilépticas (37). Sin embargo, como se muestra en la Figura 4B, varios otros cambios funcionales, incluidas las alteraciones en los receptores de GABA y glutamato, pueden ser causados por los genes de la epilepsia (36). Esto ha dado lugar a una variedad de síndromes de epilepsia para los que se conoce la base genética (50). La nueva era genómica ahora afecta directamente a la atención clínica hacia la medicina de precisión (250). Sin embargo, las epilepsias monogenéticas son raras; para la mayoría de los pacientes, la epilepsia se considera un trastorno complejo asociado con múltiples genes y factores ambientales externos.
 FIGURA 4. Avances en la comprensión de las causas de la epilepsia humana. (A) Gráfico de la izquierda: Hasta la década de 1990, la mayoría de las epilepsias se caracterizaban como «idiopáticas». Gráfico de la derecha: Hoy en día, la epilepsia de causa desconocida comprende una proporción mucho menor, debido al descubrimiento de epilepsias autoinmunes, epilepsias con lesiones que solo son detectables por resonancia magnética y, lo que es más importante, la reclasificación de muchas epilepsias que anteriormente se consideraban idiopáticas como que tienen una Las proporciones exactas de epilepsias monogénicas y complejas o poligénicas siguen siendo inciertas. Basado en Thomas y Berkovic (42) y modificado recientemente por Jeff Noebels. (B) Mutaciones identificadas en los genes de la epilepsia humana por función génica. Modificado de Simkin y Kiskinis (37).
FIGURA 4. Avances en la comprensión de las causas de la epilepsia humana. (A) Gráfico de la izquierda: Hasta la década de 1990, la mayoría de las epilepsias se caracterizaban como «idiopáticas». Gráfico de la derecha: Hoy en día, la epilepsia de causa desconocida comprende una proporción mucho menor, debido al descubrimiento de epilepsias autoinmunes, epilepsias con lesiones que solo son detectables por resonancia magnética y, lo que es más importante, la reclasificación de muchas epilepsias que anteriormente se consideraban idiopáticas como que tienen una Las proporciones exactas de epilepsias monogénicas y complejas o poligénicas siguen siendo inciertas. Basado en Thomas y Berkovic (42) y modificado recientemente por Jeff Noebels. (B) Mutaciones identificadas en los genes de la epilepsia humana por función génica. Modificado de Simkin y Kiskinis (37).
En los perros, muchos estudios de razas con «epilepsia idiopática» no han logrado identificar genes o lugares de interés (47, 49.251). El descubrimiento de genes en perros con epilepsias mioclónicas progresivas (PME) ha sido más exitoso, con ocho genes conocidos; seis de estos son ortólogos a los trastornos humanos correspondientes (48, 49). En 2016, Hayward et al. (252) llevaron a cabo el mayor estudio de asociación de todo el genoma canino (GWAS) hasta la fecha, con un panel de más de 4.200 perros genotipados en 180.000 marcadores, para acelerar los esfuerzos de mapeo. Entre estos resultados, los autores encontraron genes candidatos adicionales relacionados con la epilepsia en sabuesos irlandeses utilizando 34 casos y 168 controles. En un estudio más reciente que exploró la patogénesis de la epilepsia canina utilizando un método de genética de sistemas con los datos de Hayward et al. (252), combinando tanto GWASs como interacciones genéticas, Cui et al. (253) informaron de 26 subredes significativas correlacionadas con la epilepsia canina. Combinado con el análisis de enriquecimiento de la ontología génica (GO), Cui et al. (253) identificaron tres genes adicionales que fueron omitidos por el análisis GWAS. Por lo tanto, al igual que en la medicina, es probable que los avances en las tecnologías de secuenciación genética y la bioinformática aumenten la identificación de genes y trastornos genéticos que están asociados con la epilepsia en los perros. Un ejemplo reciente en este sentido es un estudio sobre la epilepsia grave de inicio temprano en varias camadas de Parson Russel terriers (254). El mapeo combinado de la homocigosidad y la secuenciación del genoma revelaron una deleción en el marco de 6 pb en la pitrilysina metalopeptidasa 1 (PITRM1) codificada en la energía nuclear para una proteasa mitocondrial involucrada en el procesamiento y la degradación de la secuencia de orientación mitocondrial. Las consecuencias funcionales de la mutación se modelaron en la levadura y mostraron un crecimiento deteriorado en condiciones permisivas y una capacidad respiratoria deteriorada. El examen post mortem reveló una aguda difusa difusa preemb ¡predominante de la polioencefalocefalopatía poliomie polio necrotizante que afecta principalmente a las capas celulares piramidales del hipocampo propio y la corteza entorinina (254), lo que sugiere una implicación del sistema límbico como se sugirió anteriormente para otros tipos de epile
Otra epilepsia genética interesante descubierta recientemente en perros fue descrita por Wielaender et al. (255, 256). Descubrieron una nueva epilepsia mioclónica genética en perros jóvenes de Rhodesian Ridgeback, caracterizada por convulsiones mioclónicas vigorosas que se producen principalmente durante los períodos de relajación. Más de un tercio de los perros afectados desarrollan convulsiones tónico-clónicas generalizadas en el curso de la enfermedad y se informa que el 35 % es fotosensible.
Al combinar un GWAS y análisis de secuenciación de próxima generación utilizando la resecuenciación de todo el exoma y todo el genoma, Wielaender et al. (255) identificaron una deleción recesiva de 4 pb totalmente penetrante en el gen de la familia DIRAS GTPasa 1 (DIRAS1) con un patrón de expresión alterado de la proteína DIRAS Sin embargo, al igual que en los seres humanos, las epilepsias monogenéticas en los perros son raras, y la mayoría de las epilepsias idiopáticas en los perros son trastornos complejos asociados con múltiples genes o se deben a alteraciones estructurales que aún se han pasado por alto, como sugieren los datos de numerosos estudios de resonancia magnética discutidos anteriormente.
Incautaciones espontáneas recurrentes en grandes colonias endogámicas de Beagle
Koestner y Rehfeld (257) informaron de la aparición de convulsiones generalizadas espontáneas en una gran colonia de Beagle consanguínea. Redman y Weir (258) encontraron que la incidencia de perros epilépticos en una colonia similar era del 6 %. A través de la reproducción selectiva, esta incidencia podría aumentar al 66 % (259). Un análisis detallado de EEG de 10 Beagles epilépticos realizado por Wiederholt (260) reveló la hiperactividad límbica en el hipocampo y la amígdala, que se asoció con episodios similares a los psicomotores de volteo excesivo, golpes, masticación y babeo, lo que indica convulsiones de inicio focal. Los niveles de glutamato en el cerebro y el LCR no diferían entre los Beagles epilépticos y sus hermanos no epilépticos (261). En los análisis post mortem, se determinó la neurodegeneración particularmente en el hipocampo y la corteza cingulada (262).
Además de la epilepsia idiopática en perros Beagle, Hegreberg y Padgett (263) describieron una forma de epilepsia familiar y su relación con una condición similar en el hombre, es decir, PME (o enfermedad de Lafora), una rara enfermedad de almacenamiento neurológico de inicio tardío caracterizada por depósitos de poliglucos (cuerposanos de Lafora) en Además de los Beagles, PME se ha descrito en varias otras razas, incluyendo el Basset hound, Chihuahua, French Bulldog, Pointer, Miniature Poodle, Miniature Dachshund y Welsh Corgi (49, 265). Más recientemente, PME en perros Beagle se ha caracterizado con más detalle (266).
En una gran serie de análisis en 68 perros Beagle epilépticos en una colonia propensa a la epilepsia, las áreas más comunes de daño neuronal fueron el hipocampo, la amígdala, la corteza piriforme, la corteza cerebral, los núcleos basales, el claustro, los núcleos septales y los núcleos talámicos dorsales (152). Además, se detectaron inclusiones intraneuronales idénticas a los cuerpos de Lafora en núcleos talámicos de solo seis perros (152). Usando la resonancia magnética con morfometría basada en voxel, comparamos las diferencias locales en el volumen de la materia gris entre 5 Beagles sanos y 10 Beagles con epilepsia idiopática o estructural (267). Los Beagles epilépticos mostraron una reducción estadísticamente significativa del volumen de materia gris en el bulbo olfativo, el giro cingulado, el hipocampo y la corteza, especialmente en los lóbulos temporales y occipitales.
Los perros Beagle epilépticos rara vez se han utilizado para las pruebas de drogas porque las convulsiones recurrentes espontáneas requieren un monitoreo continuo de video-EEG las 24 horas del día, los 7 días de la semana. En cambio, como se describe a continuación, las convulsiones se han inducido experimentalmente en perros Beagle epilépticos y no epilépticos y otras razas de perros.
Convulsiones inducidas experimentalmente en perros no epilépticos
Aparte de la epilepsia que eventualmente ocurre en grandes colonias de perros Beagle usados experimentalmente (ver arriba), los perros con epilepsia suelen ser mascotas de propiedad privada, lo que restringe su uso como modelo traslacional, porque los propietarios a menudo no están dispuestos a permitir experimentos invasivos o a regalar a sus animales con fines de investigación (95). En teoría, este problema podría resolverse mediante el uso de perros epilépticos de grandes colonias de Beagle endogámicos (ver más arriba); sin embargo, los altos costos de primera y mantenimiento de los perros en los números necesarios para la selección y la cría de sublíneas epilépticas limitan la utilidad de esta especie para estudios experimentales (95). Además, las convulsiones naturales en los perros no pueden ser provocadas a voluntad por un investigador, lo que hace que cualquier estudio científico consuma mucho tiempo, especialmente cuando la frecuencia de convulsiones es baja. Sin embargo, las convulsiones o SE pueden inducirse experimentalmente en perros no epilépticos con muchas similitudes con las convulsiones espontáneas en perros epilépticos. En este sentido, hemos utilizado las convulsiones inducidas por PTZ en perros como modelo para las pruebas de drogas, pero las convulsiones pueden ser inducidas a voluntad por muchos otros agentes convulsivos en perros.
Como lo ilustra el desarrollo de la imepitoína y también de la VNS, los perros en los que las convulsiones se inducen química o eléctricamente son una herramienta valiosa tanto para desarrollar nuevos tratamientos para la epilepsia canina como para los seres humanos con epilepsia. Para la epilepsia canina, las pruebas de drogas en perros no epilépticos sirven para demostrar el efecto anticonvulsivo de una nueva terapia y para la búsqueda de dosis para los primeros ensayos clínicos en perros epilépticos, lo que está bien demostrado por la imepitoína (268). Como se describe con más detalle a continuación, tras la demostración del efecto anticonvulsivo de la imepitoína en modelos de convulsiones de roedores, demostramos su eficacia anticonvulsiva en perros que utilizan el umbral de convulsivo de PTZ, seguido de los primeros ensayos clínicos en perros con epilepsia (268). El efecto sobre las convulsiones de PTZ en perros no epilépticos predijo correctamente su eficacia anticonvulsiva en perros epilépticos y simplificó el hallazgo de dosis en los primeros ensayos clínicos. Esta es una gran ventaja en comparación con el hallazgo de dosis cuando se trata de traducir los datos preclínicos a los primeros ensayos clínicos en personas.
Convulsiones inducidas por el pentilenotetrazol en perros
La PTZ, también conocida como pentetrazol y metrazol, es un estimulante del SNC que se utiliza ampliamente experimentalmente para estudiar los fenómenos de convulsiones y para identificar productos farmacéuticos que pueden alterar la susceptibilidad a las convulsiones (269). La PTZ actúa predominantemente antagónicando la inhibición GABAérgica a través de un efecto en el sitio de unión a la picrotoxina del ionóforo de cloruro del receptor GABAA (270). Debido a sus efectos estimulantes en el tronco encefálico, el PTZ se ha utilizado clínicamente como estimulante circulatorio y respiratorio y, antes de la invención de la terapia electroconvulsiva, para la terapia convulsiva en personas con depresión mayor (269).
La i.v. cronometrada La prueba de umbral de convulsión de infusión de PTZ en perros conscientes ilustrada en la Figura 5 se ha desarrollado para probar la pérdida de eficacia (tolerancia) que se desarrolla durante el tratamiento prolongado de BDZ como el diazepam (271). En esta prueba, la PTZ se infunde a una velocidad de 10 mg/kg por minuto en 3 ml/min mediante una bomba de infusión. El umbral convulsivo se define como la cantidad de PTZ (en mg/kg de peso corporal) que induce la primera contracción mioclónica generalizada, en la que se detiene la infusión para evitar el desarrollo de convulsiones más graves. En los perros Beagle, el umbral de PTZ suele ser de ~15 mg/kg i.v. A esta dosis, la PTZ induce descargas paroxísticas características en el EEG de los perros (275, 276). Se indica un efecto anticonvulsivo si el umbral de convulsión de la PTZ aumenta después del tratamiento previo con un ASM o un medicamento experimental, mientras que un efecto proconvulsivo se indica por una disminución en el umbral de convulsión de la PTZ en comparación con el umbral de control. Hemos utilizado esta prueba en diferentes razas de perros, incluidos los Beagles, ampliamente para determinar el desarrollo de la tolerancia a los BZD y los medicamentos relacionados y para probar nuevos compuestos antiseconvulsivos (ver a continuación). Además, se utiliza una infusión lenta de PTZ como compuesto de referencia proconvulsivo cuando se emplea el EEG de perro en farmacología de seguridad para evaluar el riesgo proconvulsivo de los compuestos de prueba (276, 277). La ventaja de usar PTZ para la inducción de convulsiones es su rápido inicio de acción, lo que permite determinar el umbral de convulsiones durante la infusión intravenosa cronometrada, lo que no es posible con varios otros agentes convulsivos estudiados a este respecto (269, 275).
 FIGURA 5. Ilustración esquemática de la prueba de umbral de convulsión i.v. cronometrada de pentylenetetrazol (PTZ) en un perro sin restricciones. Antes de comenzar los experimentos, es importante acostumbrar a los perros a las personas involucradas en los experimentos, así como a las habitaciones y al manejo. Para la determinación del umbral de convulsión, una solución al 3% de PTZ (en 0,9% de NaCl) se inyecta continuamente a una velocidad de 3 ml/min mediante una bomba de infusión a través de un catéter de plástico delgado y flexible de aproximadamente 1 m de longitud, conectado por un extremo de corte afilado de una aguja de inyección a la vena cef La infusión se termina inmediatamente después de la aparición de la primera contracción generalizada (mioclono inicial), que generalmente toma un promedio de 120 s después del inicio de la infusión de PTZ. Antes de la contracción mioclónica, los perros suelen mostrar temblores como un signo de aumento de la excitabilidad neuronal. Durante la infusión de PTZ, el animal solo está ligeramente restringido (o, en perros entrenados, no está restringido en absoluto). La dosis umbral de PTZ (en mg/kg de peso corporal) se calcula a partir de la velocidad de infusión, el peso corporal del animal y el tiempo necesario para producir la primera contracción mioclónica (que se produce junto con la primera actividad de EEG paroxística). Los umbrales típicos de convulsión de PTZ están en el rango de ~15 mg/kg de PTZ, pero pueden variar con la raza, el sexo y la edad de los perros. La potencia de los medicamentos para aumentar el umbral de convulsiones se puede determinar (y comparar) calculando las dosis necesarias para aumentar el umbral en un 20 % (TID20) o un 50 % (TID50), probando un rango de dosis en grupos de perros (ver Figura 7). Los mismos perros se pueden usar repetidamente a intervalos de al menos 1 semana para evitar el encohón (ver texto). Los perros se adaptan rápidamente al método y no muestran ningún signo de incomodidad o ansiedad antes o después de la determinación del umbral. Antes de cualquier experimento con medicamentos, el umbral de convulsiones de PTZ se determina una vez por semana hasta que se obtienen umbrales reproducibles y estables en todos los perros. La cifra fue modificada de Löscher (269). Para más detalles, consulte Löscher et al. (274).
FIGURA 5. Ilustración esquemática de la prueba de umbral de convulsión i.v. cronometrada de pentylenetetrazol (PTZ) en un perro sin restricciones. Antes de comenzar los experimentos, es importante acostumbrar a los perros a las personas involucradas en los experimentos, así como a las habitaciones y al manejo. Para la determinación del umbral de convulsión, una solución al 3% de PTZ (en 0,9% de NaCl) se inyecta continuamente a una velocidad de 3 ml/min mediante una bomba de infusión a través de un catéter de plástico delgado y flexible de aproximadamente 1 m de longitud, conectado por un extremo de corte afilado de una aguja de inyección a la vena cef La infusión se termina inmediatamente después de la aparición de la primera contracción generalizada (mioclono inicial), que generalmente toma un promedio de 120 s después del inicio de la infusión de PTZ. Antes de la contracción mioclónica, los perros suelen mostrar temblores como un signo de aumento de la excitabilidad neuronal. Durante la infusión de PTZ, el animal solo está ligeramente restringido (o, en perros entrenados, no está restringido en absoluto). La dosis umbral de PTZ (en mg/kg de peso corporal) se calcula a partir de la velocidad de infusión, el peso corporal del animal y el tiempo necesario para producir la primera contracción mioclónica (que se produce junto con la primera actividad de EEG paroxística). Los umbrales típicos de convulsión de PTZ están en el rango de ~15 mg/kg de PTZ, pero pueden variar con la raza, el sexo y la edad de los perros. La potencia de los medicamentos para aumentar el umbral de convulsiones se puede determinar (y comparar) calculando las dosis necesarias para aumentar el umbral en un 20 % (TID20) o un 50 % (TID50), probando un rango de dosis en grupos de perros (ver Figura 7). Los mismos perros se pueden usar repetidamente a intervalos de al menos 1 semana para evitar el encohón (ver texto). Los perros se adaptan rápidamente al método y no muestran ningún signo de incomodidad o ansiedad antes o después de la determinación del umbral. Antes de cualquier experimento con medicamentos, el umbral de convulsiones de PTZ se determina una vez por semana hasta que se obtienen umbrales reproducibles y estables en todos los perros. La cifra fue modificada de Löscher (269). Para más detalles, consulte Löscher et al. (274).
Cuando el i.v. cronometrado La prueba de umbral de convulsión de infusión de PTZ se utiliza repetidamente a intervalos semanales en los mismos perros, no se observa un aumento similar al encendido en la respuesta convulsiva. Sin embargo, un uso más frecuente conduce a un efecto similar al de la leña en el sentido de que los perros responden con convulsiones cada vez más graves a la misma dosis de PTZ (195).
Además de la PTZ, se han utilizado otros antagonistas de los receptores GABAA como la picrotoxina, la bicucullina y la penicilina para inducir convulsiones en perros (275, 278, 279). Durante la infusión intravenosa de PTZ o bicucullina en perros, el sitio más frecuente de los primeros cambios observados en el EEG ictal fue el cuerpo geniculado lateral, mientras que el neocórtex y el hipocampo se involucraron más tarde (279). Además, el antagonista del receptor de glicina, la estricnina, se ha utilizado para la inducción de convulsiones en perros, por ejemplo, durante el desarrollo de VNS (280).
Convulsiones inducidas eléctricamente en perros
Durante varias décadas, la inducción eléctrica de las convulsiones en perros sanos se ha utilizado para diferentes propósitos, incluidos los estudios neuropatológicos (281), los estudios sobre la terapia electroconvulsiva y la depresión (282), las respuestas cardiovasculares y neuroquímicas (283) y la evaluación farmacológica de los medicamentos experimentales (259.284). Para este último propósito, la prueba de convulsión de electrochoque máximo (MES, por sus siglas en inglés), que se desarrolló para la detección de ASM en ratones y ratas, se adaptó al perro y se caracterizó farmacológicamente por fenobarbital (285). Además, la versión de umbral de la prueba MES se ha utilizado en perros y se ha comparado con el umbral de convulsivos de PTZ (259). Sin embargo, en comparación con la i.v. Prueba de umbral de convulsiones por infusión de PTZ, la prueba MES se usa con mucha menos frecuencia como prueba de convulsiones en perros, al menos en parte porque las convulsiones tónicas inducidas por la estimulación eléctrica de alta corriente son mucho más graves y potencialmente letales en comparación con las convulsiones mioclónicas cortas y Se cree que una disminución del umbral de convulsiones está involucrado en los mecanismos que conducen a convulsiones recurrentes espontáneas en la epilepsia (130).
Convulsiones focales inducidas por la penicilina actual aplicada a la corteza cerebral en perros
En 1945, Walker et al. (286) demostraron que cuando la penicilina entró en contacto directo con el cerebro, produjo manifestaciones electroencefalográficas y epileformes clínicas, tanto en animales como en hombres. La acción convulsiva de la penicilina se ha confirmado desde entonces en numerosos estudios experimentales y clínicos (278, 287–289). La penicilina óptica aplicada a la corteza cerebral produce un foco epiléptico en varias especies, incluidos los perros. El tipo de convulsiones focales depende de la ubicación exacta del foco. Los efectos convulsivos y epileptogénicos de la penicilina son el resultado del bloqueo de los receptores GABAA (289). El modelo de penicilina ha sido uno de los modelos más importantes para responder preguntas sobre la base neuronal de la epilepsia, incluido el descubrimiento del cambio de despolarización paroxística y el análisis de la propagación de la actividad convulsiva a partir de un enfoque epileptogénico (288).
En los perros, el modelo de penicilina se utilizó para estudiar los efectos anticonvulsivos del magnesio; los efectos observados en los perros se tradujeron luego a primates no humanos (290). Además, el modelo de penicilina para perros se ha utilizado para estudiar los efectos de la estimulación eléctrica del noveno nervio craneal (el nervio glosofaríngeo) para el control de las convulsiones en comparación con VNS (291), que se discutirá con más detalle a continuación.
Convulsiones focales inducidas por kainato en perros
Hasegawa et al. (292) inyectaron el antagonista del receptor de glutamato, kainate, en la amígdala de los perros Beagle (292). La inyección intraamigdala o intrahippocampal de kainato es un modelo ampliamente utilizado de TLE en roedores que se caracteriza por una SE límbica, seguida, después de un período latente, por frecuentes convulsiones recurrentes espontáneas que son convulsivas focales o generalizadas (293). Los perros tratados con Kainate mostraron convulsiones límbicas que comenzaron a partir de la amígdala ipsilateral y se con desarrollaron en una SE focal compleja, que duró de 1 a 3 días (292). Sin embargo, a diferencia de los roedores, los perros no mostraron convulsiones espontáneas durante el período de observación de 2 meses. Tras la necropsia, se observó una pérdida neuronal grave en la amígdala y el hipocampo.
En un estudio posterior sobre este modelo de perro, se utilizó una resonancia magnética ponderada por difusión para caracterizar el desarrollo temporal de las lesiones (294). Además, el glutamato y el GABA se determinaron repetidamente en el LCR (295). Durante la fase aguda (3, 6, 12 y 48 horas después del inicio de SE), el Glúmato de LCR aumentó significativamente, mientras que el GABA de LCR disminuyó, aunque no significativamente. En la fase crónica, tanto el CSF-glutamato como el CSF-GABA fueron significativamente más bajos de lo normal a las 72 horas después del inicio de la SE, y sus niveles volvieron a la normalidad a los 2 meses (295).
El modelo de encende , enceniño, de epilepsia de lóbulo temporal en perros
El enmíngepio es un modelo animal de TLE producido por estimulación eléctrica focal de áreas del cerebro límbico como la amígdala, el hipocampo o la corteza piriforme (296). Además, como se discutió para PTZ anteriormente, el enmado se puede inducir químicamente. El término «enciendo» se refiere al fenómeno por el cual la estimulación eléctrica repetida de una región del cerebro límbico a través de un electrodo de profundidad implantado inicialmente solo induce actividad focal de EEG paroxística (los llamados «después de las descargas») sin una actividad convulsiva clínica (296). Las estimulaciones posteriores inducen el desarrollo progresivo de convulsiones convulsivas generalizadas focales y secundarias posteriores hasta que el animal está «completamente enctado» y responde con la misma gravedad máxima de la convulsión y duración tras la estimulación (297). Una vez desarrollada, la sensibilidad mejorada al estímulo eléctrico subconvulsivo inicial es permanente, que es la consecuencia de alteraciones cerebrales moleculares y funcionales persistentes (296, 298). Desde su introducción en 1969 por Goddard et al. (299), el encembible se ha convertido en uno de los modelos animales más utilizados de la epilepsia, sobre todo porque se cree que los mecanismos involucrados en el encteo son relevantes para la epileptogénesis (300). Además, el modelo de encerillo de la amígdala de TLE en ratas ha sido fundamental en el desarrollo preclínico de varios ASM (301, 302). Se ha demostrado la leña eléctrica en numerosas especies, incluidos los primates no humanos y los humanos, pero generalmente se realiza en ratas (296).
En 1979, Wauquier et al. (303) adaptaron el modelo de encedora de la amígdala a los perros Beagle. La leña en los perros ocurrió rápidamente y no mostró las cinco etapas de Racine que se observaron en ratas. Después de una estimulación diaria con corrientes de 50 a 700 μA, la masticación se evocó en las primeras sesiones, pero las convulsiones tónico-clónicas generalizadas se desarrollaron rápidamente en todos los perros con una etapa intermedia de clonus facial, asintiendo con la cabeza y salivación profusa. Las convulsiones completamente enccionadas comenzaron con clonus facial, asentir con la cabeza y salivación, y fueron seguidas por opisthotonos, levantamiento de la pata delantera contralateral, caída hacia atrás, clonicidad de las patas traseras, extensión tónica de las patas delanteras y traseras, quiescencia, sacudidas mioclónicas o Después de encender, se observaron convulsiones espontáneas ocasionalmente en todos los animales, lo que es una diferencia importante con los roedores, que desarrollan convulsiones espontáneas solo después de varias 100 estimulaciones de la amígdala (304). Cuatro de los ocho perros ennados murieron después de desarrollar SE. Las convulsiones enc enenció por completo por fenobarbital y diazepam, mientras que el clonazepam solo fue parcialmente efectivo, y la fenitoína fue ineficaz (303).
Thompson y Galosy (305) han descrito las alteraciones del EEG durante el ence de la amígdala en perros. Además, el enceño se ha inducido en perros por estimulación eléctrica repetida de la corteza olfativa o la corteza piriforme anterior (306, 307), que es particularmente sensible al enceniza eléctrico (161, 308).
El perro como modelo de asfixia de nacimiento y convulsiones neonatales
La asfixia del nacimiento, o alteración del intercambio de gases durante el período perinatal, que conduce a la hipoxia progresiva, la hipercarbia y la acidosis, es un problema de salud mundial importante, responsable de más de 1 millón de muertes neonatales cada año en todo el mundo (309, 310). Aquellos que sobreviven a menudo sufren de una serie de problemas de salud, incluyendo convulsiones neonatales y encefalopatía hipóxico-isquémica (HIE). La asfixia del HIE después del nacimiento es la causa más común de lesión cerebral perinatal adquirida y puede conducir a secuelas neurológicas como la epilepsia más adelante en la vida (311). Se cree que las convulsiones neonatales, que suelen ocurrir durante las primeras 48 horas después del nacimiento, contribuyen a la mortalidad y la morbilidad después de la asfixia del nacimiento (312). Actualmente, la hipotermia terapéutica es el único tratamiento estándar para los bebés con HIE de moderada a grave y se ha demostrado que reduce tanto la mortalidad como la morbilidad (313). Sin embargo, la hipotermia terapéutica tiene varias limitaciones, por lo que se necesitan urgentemente nuevas terapias para HIE (311). Del mismo modo, las terapias utilizadas actualmente (por ejemplo, fenobarbital) para las convulsiones neonatales tienen una eficacia limitada (312). Los modelos animales de asfixia de nacimiento, HIE y convulsiones neonatales son importantes para explorar los mecanismos celulares y moleculares, evaluar el potencial de las nuevas estrategias terapéuticas y caracterizar los correlatos funcionales y conductuales de la lesión (314, 315).
El perro se ha utilizado como modelo de «animal grande» para la asfixia del nacimiento y las convulsiones neonatales (316–318). Por ejemplo, en una serie de estudios de referencia, Duffy et al. han utilizado perros recién nacidos para estudiar los efectos de la asfixia en el flujo sanguíneo cerebral y el metabolismo (319–321). Del mismo modo, se investigó el metabolismo cerebral después de las convulsiones inducidas en perros recién neonatales (316, 322). El «modelo de cachorro de Beagle de asfixia perinatal» se ha utilizado para estudiar nuevos enfoques terapéuticos, incluidos los bloqueadores de los canales de calcio, los antagonistas de los receptores de glutamato, los medicamentos antiinflamatorios no esteroideos y los inhibidores de la síntesis de tromboxano (317, 323–327). Más recientemente, la encefalopatía neonatal con convulsiones se describió como una enfermedad autosómica recesiva de los cachorros de caniche estándar (328). Sin embargo, esta condición no se asoció con la asfixia del nacimiento.
Uso de perros como modelo traslacional en la investigación de la epilepsia y el desarrollo de medicamentos antiseconvulsivos
Como se muestra en la revisión anterior sobre la epilepsia canina, la epilepsia en perros es similar a la epilepsia humana en su epidemiología y espontaneidad, y en su respuesta y resistencia a la terapia. Las similitudes hacen del modelo canino un modelo animal prometedor para probar nuevas terapias, incluidos los neurodispositivos. Las ventajas del modelo canino natural incluyen que (1) la vigilancia de la enfermedad en los perros es superada por la de las personas; (2) la endogamia en razas de perros de raza pura hace que la genética sea más fácil de determinar; (3) los estudios de medicamentos se pueden hacer a un costo más bajo que en personas sin la necesidad de aprobación regulatoria; (4) se pueden usar prototipo Los resultados de los estudios comparativos de epilepsia canina no solo son de un beneficio traslacional potencial para las personas, sino que a menudo también ayudan directamente a mejorar el resultado y la calidad de vida de las mascotas afectadas por la epilepsia. La imepitina ASM, que se desarrolló inicialmente para la epilepsia humana pero, basada en estudios en perros, fue aprobada para el tratamiento de la epilepsia canina, es un buen ejemplo a este respecto (ver más abajo).
Sin embargo, hasta ahora, la epilepsia canina es un modelo infrautilizado, que tiene varias razones, incluida la falta de conciencia pública sobre este modelo en el desarrollo de la investigación y la terapia, las marcadas diferencias entre perros y los seres humanos en la eliminación de medicamentos, la clasificación menos exhaustiva de la epilepsia canina y las convulsiones epilépticas, Sin embargo, como se discutió anteriormente, hay un aumento relativo de estudios de prueba de concepto y ECA de terapias en la epilepsia natural en el perro en los últimos ~15 años. Estos estudios caninos en las áreas de genética, terapia farmacológica, terapia dietética, dispositivos de EEG implantables y dispositivos terapéuticos muestran una prueba de concepto de que la epilepsia canina puede ser un muy buen modelo para la investigación comparativa para muchas, pero no todas, las facetas de la epilepsia, que se discutirán a continuación.
Además de los perros con convulsiones epilépticas naturales, las convulsiones pueden ser inducidas por estimulación química o eléctrica en perros sanos, lo que aumenta la aplicabilidad del modelo de perro para la evaluación de nuevos tratamientos. Un ejemplo importante en este sentido es el desarrollo de VNS, que se basó en una serie de estudios en perros con convulsiones inducidas (280), que se describirán con más detalle a continuación.
A continuación, destacaré algunas de las áreas en las que el uso de perros, ya sea con convulsiones naturales o inducidas, ha demostrado ser útil en la investigación traslacional.
Perros epilépticos como modelo para la evaluación de nuevos medicamentos anticonvulsivos
Patterson (8) sugirió que el modelo traslacional canino de la epilepsia bien puede resultar ser un excelente paso intermedio para confirmar los datos preclínicos en modelos de roedores justo antes de iniciar los estudios en humanos. Probablemente el mejor ejemplo a este respecto es la imepitoína, el primer agonista parcial del «receptor BDZ» desarrollado para el tratamiento de la epilepsia (101). Como se ilustra en la Figura 6, el receptor GABAA exhibe varios sitios de unión, incluido el sitio de reconocimiento GABA y diferentes sitios de reconocimiento para BDZ y barbitúricos (330). A través de estos sitios, los BDZ y el fenobarbital potencian la acción inhibitoria del GABA, actuando así como PAM. La Imepitoína, que no es un BDZ, también actúa como un PAM a través del sitio BDZ (anteriormente denominado «receptor BDZ»), pero con una afinidad y eficacia intrínseca mucho menores que los BD Debido a que el efecto anticonvulsivo de los medicamentos que actúan a través del sitio BDZ se produce a una baja ocupación de receptores, la imepitoína ejerce potentes efectos anticonvulsivo en varios modelos animales, pero, a diferencia de los BDZ, no induce sedación, ataxia o hipnosis en dosis altas y carece de tolerancia y responsabilidad de dependencia.
 FIGURA 6. Esquemas simplificados de la sinapsis GABAérgica inhibitoria y la estructura del receptor GABAA que ilustran el sitio de acción de las benzodiacepinas (BZD) y otros medicamentos que actúan a través de este sitio. La parte izquierda de la figura ilustra una sinapsis GABAérgica que muestra la síntesis, el empaque vesicular, la liberación, la absorción y la degradación de GABA en las terminales nerviosas GABAérgicas; la captación en los astrocitos; y la estructura de la subunidad pentamérica de un complejo receptor GABAA típico en la membrana postsiná Los componentes de la sinapsis GABAérgica que se muestran incluyen la descarboxilasa de ácido glutámico (GAD), la enzima que cataliza la descarboxilación del glutamato a GABA; vesículas sinápticas que contienen GABA (círculos que contienen moléculas de GABA); el transportador GAT-1 GABA ( La parte derecha de la figura ilustra esquemáticamente la estructura pentamérica del receptor GABAA dentro del plano de la membrana neuronal que muestra las posiciones relativas de los dominios transmembrana. Las interfaces de subunidad están formadas por M3 y M1. Se muestran las ubicaciones interfaciales de los dos sitios de reconocimiento GABA y BZD. Al unirse al sitio BZD, los BZD (por ejemplo, diazepam, midazolam y otros), las β-carbolines (por ejemplo, abecarnil) y los derivados de imidazolona (por ejemplo, imepitoína) actúan como moduladores alostéricos positivos de GABA, lo que conduce a un aumento de Los barbitúricos como el fenobarbital también se unen al receptor GABAA para potenciar el GABA, pero el sitio de unión exacto está menos establecido. Los iones de bromuro (como se producen mediante la administración de bromuro de potasio) mejoran la inhibición GABAérgica, pero el mecanismo es distinto del de los BDZ y los barbitúricos en que los iones Br compiten con los iones Cl- por los canales Cl-gated-GA y, a altas concentraciones, entran en la neurona Una vez que los iones Br- han entrado en una neurona, solo se pueden eliminar muy lentamente de la neurona, lo que explica la mala relación terapéutica y el riesgo de intoxicación con bromuro de potasio. La figura fue modificada de Rundfeldt y Löscher (101). A modo de comparación, también se muestran las estructuras químicas de GABA, fenobarbital, un BDZ (diazepam), imepitoína y abecarnil.
FIGURA 6. Esquemas simplificados de la sinapsis GABAérgica inhibitoria y la estructura del receptor GABAA que ilustran el sitio de acción de las benzodiacepinas (BZD) y otros medicamentos que actúan a través de este sitio. La parte izquierda de la figura ilustra una sinapsis GABAérgica que muestra la síntesis, el empaque vesicular, la liberación, la absorción y la degradación de GABA en las terminales nerviosas GABAérgicas; la captación en los astrocitos; y la estructura de la subunidad pentamérica de un complejo receptor GABAA típico en la membrana postsiná Los componentes de la sinapsis GABAérgica que se muestran incluyen la descarboxilasa de ácido glutámico (GAD), la enzima que cataliza la descarboxilación del glutamato a GABA; vesículas sinápticas que contienen GABA (círculos que contienen moléculas de GABA); el transportador GAT-1 GABA ( La parte derecha de la figura ilustra esquemáticamente la estructura pentamérica del receptor GABAA dentro del plano de la membrana neuronal que muestra las posiciones relativas de los dominios transmembrana. Las interfaces de subunidad están formadas por M3 y M1. Se muestran las ubicaciones interfaciales de los dos sitios de reconocimiento GABA y BZD. Al unirse al sitio BZD, los BZD (por ejemplo, diazepam, midazolam y otros), las β-carbolines (por ejemplo, abecarnil) y los derivados de imidazolona (por ejemplo, imepitoína) actúan como moduladores alostéricos positivos de GABA, lo que conduce a un aumento de Los barbitúricos como el fenobarbital también se unen al receptor GABAA para potenciar el GABA, pero el sitio de unión exacto está menos establecido. Los iones de bromuro (como se producen mediante la administración de bromuro de potasio) mejoran la inhibición GABAérgica, pero el mecanismo es distinto del de los BDZ y los barbitúricos en que los iones Br compiten con los iones Cl- por los canales Cl-gated-GA y, a altas concentraciones, entran en la neurona Una vez que los iones Br- han entrado en una neurona, solo se pueden eliminar muy lentamente de la neurona, lo que explica la mala relación terapéutica y el riesgo de intoxicación con bromuro de potasio. La figura fue modificada de Rundfeldt y Löscher (101). A modo de comparación, también se muestran las estructuras químicas de GABA, fenobarbital, un BDZ (diazepam), imepitoína y abecarnil.
Mostramos en el i.v. cronometrado Prueba de umbral de convulsión de infusión de PTZ en perros que la imepitoína aumenta de forma independiente de la dosis el umbral de convulsión de PTZ en aproximadamente el mismo rango de dosis que el fenobarbital (Figuras 7A,B), mientras que el abecarnil, que actúa como agonista selectivo de subtipo de alta afinidad/ Basándonos en el perfil farmacológico único de la imepitoína, también realizamos estudios crónicos en perros y determinamos repetidamente el efecto anticonvulsivo durante el tratamiento (268). La administración oral prolongada con dos dosis de imepitoína dos veces al día con 5 o 40 mg/kg durante 5 semanas no se asoció con la pérdida de eficacia anticonvulsivo en el modelo de perro PTZ (Figura 7D). Por el contrario, como se muestra en la Figura 7D, tanto el diazepam como el clonazepam perdieron eficacia durante el tratamiento prolongado en perros.
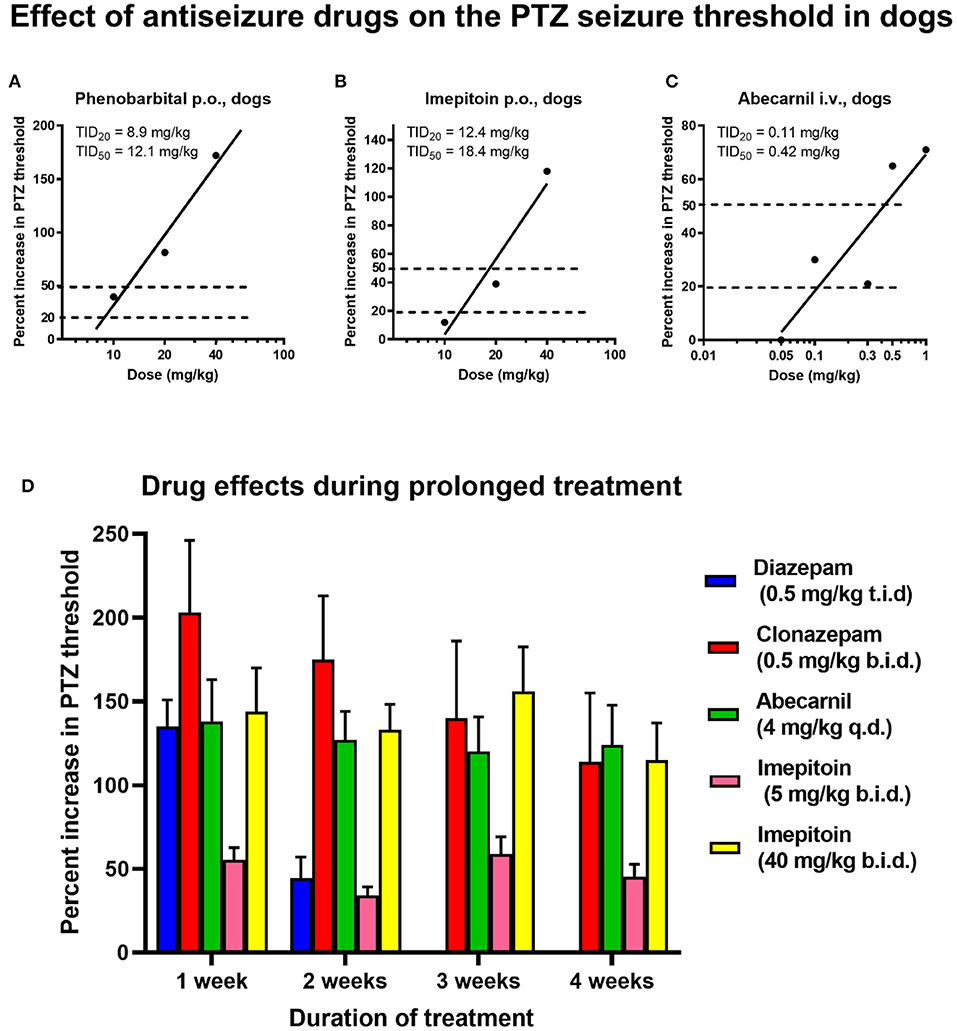 FIGURA 7. Efecto de los medicamentos anticonvulsivos en la prueba de umbral de convulsión por pentylenetetrazol (PTZ) cronometrada por inov. (A) Efecto de diferentes dosis de fenobarbital en el umbral de convulsión de PTZ, mostrado como un aumento porcentual por encima del umbral de control. Cada símbolo presenta el porcentaje de aumento en el umbral de convulsiones en un grupo de 6-7 perros. Mediante el análisis de regresión no lineal, se calcularon las dosis que aumentaron el umbral de convulsión en un 20 % (TID20) y un 50 % (TID50). (B) Efecto de diferentes dosis de imepitoína en el umbral de convulsión de la PTZ. Otros detalles como en (A). (C) Efecto de diferentes dosis de abecarnil en el umbral de convulsión de la PTZ. Otros detalles como en (A). (D) Alteraciones en la eficacia anticonvulsivo durante el tratamiento prolongado en perros. Se compararon cuatro medicamentos en grupos de 4-7 perros: diazepam, clonazepam, abecarnil e imepitoína. Estos medicamentos se administraron diariamente durante 4 semanas. El primer umbral de convulsión de PTZ se determinó después de 1 semana de tratamiento. Los umbrales de control se determinaron repetidamente en cada perro antes del inicio del tratamiento. Los datos se muestran como el porcentaje de aumento medio inducido por medicamentos (± SEM) por encima de los umbrales de control. Tenga en cuenta la rápida disminución de la eficacia antisecutiva del diazepam, lo que indica el desarrollo de tolerancia. La tolerancia, aunque menos marcada, también se observó con clonazepam, pero no con imepitoína o abecarnil. Los datos provienen de Frey et al. (271), Scherkl et al. (272), Löscher et al. (273), y Löscher et al. (171, 274).
FIGURA 7. Efecto de los medicamentos anticonvulsivos en la prueba de umbral de convulsión por pentylenetetrazol (PTZ) cronometrada por inov. (A) Efecto de diferentes dosis de fenobarbital en el umbral de convulsión de PTZ, mostrado como un aumento porcentual por encima del umbral de control. Cada símbolo presenta el porcentaje de aumento en el umbral de convulsiones en un grupo de 6-7 perros. Mediante el análisis de regresión no lineal, se calcularon las dosis que aumentaron el umbral de convulsión en un 20 % (TID20) y un 50 % (TID50). (B) Efecto de diferentes dosis de imepitoína en el umbral de convulsión de la PTZ. Otros detalles como en (A). (C) Efecto de diferentes dosis de abecarnil en el umbral de convulsión de la PTZ. Otros detalles como en (A). (D) Alteraciones en la eficacia anticonvulsivo durante el tratamiento prolongado en perros. Se compararon cuatro medicamentos en grupos de 4-7 perros: diazepam, clonazepam, abecarnil e imepitoína. Estos medicamentos se administraron diariamente durante 4 semanas. El primer umbral de convulsión de PTZ se determinó después de 1 semana de tratamiento. Los umbrales de control se determinaron repetidamente en cada perro antes del inicio del tratamiento. Los datos se muestran como el porcentaje de aumento medio inducido por medicamentos (± SEM) por encima de los umbrales de control. Tenga en cuenta la rápida disminución de la eficacia antisecutiva del diazepam, lo que indica el desarrollo de tolerancia. La tolerancia, aunque menos marcada, también se observó con clonazepam, pero no con imepitoína o abecarnil. Los datos provienen de Frey et al. (271), Scherkl et al. (272), Löscher et al. (273), y Löscher et al. (171, 274).
Las propiedades únicas de la imepitoína en perros nos llevaron a realizar un ensayo prospectivo abierto en perros con epilepsia recién diagnosticada (268). Los datos de los experimentos agudos y crónicos con imepitoína en el modelo PTZ (Figura 7) se utilizaron para elegir dosis de imepitoína para el tratamiento de perros epilépticos. La imepitoína redujo notablemente la frecuencia y la gravedad de las convulsiones sin una diferencia significativa con respecto a los tratamientos estándar (fenobarbital o primidona), pero fue mucho mejor tolerada que los medicamentos estándar. En perros con DRE crónica, la mayoría de los perros mostraron una reducción en la frecuencia y gravedad de las convulsiones durante el tratamiento adicional con imepitoína (268). La eficacia anticonvulsivo y la tolerabilidad favorable de la imepitina en perros epilépticos se confirmaron posteriormente en varios ECA (57.101) y el medicamento fue aprobado en Europa para el tratamiento de la epilepsia canina en 2013.
Inicialmente se pensó que nuestros estudios canina sobre imepitoína complementaban los datos preclínicos antes de iniciar ensayos clínicos en humanos. Como predijo en los experimentos con perros, la imepitoína demostró ser altamente tolerable en los estudios farmacocinéticos y de tolerabilidad de fase 1 en voluntarios humanos. Sin embargo, el desarrollo posterior para los seres humanos se desperó debido a las diferencias farmacocinéticas entre fumadores y no fumadores (101). En cambio, se decidió desarrollar este compuesto como un ASM para perros con epilepsia, porque dos de los científicos (Chris Rundfeldt y Wolfgang Löscher) involucrados en el desarrollo de la imepitoína son veterinarios y argumentaron con éxito que hay una necesidad urgente de nuevos ASM en medicina veterinaria.
La β-carbolina abecarnil, que como imepitoína no perdió eficacia durante el tratamiento prolongado en perros (Figura 7D), se desarrolló inicialmente como un medicamento ansiolítico no sedativo («anxioselectivo») para humanos (331, 332). Sin embargo, el abecarnil también ejerce amplias antisevulsivos en una amplia variedad de modelos de convulsiones, incluidas las convulsiones de PTZ en perros y las convulsiones inducidas fóficamente en babuinos epilépticos (273, 274, 333). Abecarnil parece ser un agonista completo en los receptores GABAA que contienen subunidades α1 y α3, pero es un agonista parcial en otras isoformas de receptores. No se observó que el abecarnil causara alteraciones significativas en la actividad motora, con las actividades ansiolíticas y anticonvulsivantes del abecarnil que normalmente se manifestaban a dosis de 3 a 1.000 veces menos que las que inducen sedación/ataxia y miorrelaxación (332). Más recientemente, evaluamos su potencial anticonvulsivo en un estudio piloto controlado con placebo en personas con epilepsia y encontramos una eficacia marcada (334), que había sido predicha correctamente por el modelo PTZ del perro (Figuras 7C,D).
Perros epilépticos como modelo para el manejo dietético de las convulsiones
Las dietas cetogénicas, que son altas en grasas y bajas en carbohidratos, se han utilizado para tratar el DRE desde la década de 1920 (65.335). El mecanismo anticonvulsivo exacto de esta dieta no está claro, pero la dieta cetogénica conduce a aumentos en las cetonas circulantes, lo que puede contribuir a la eficacia en el tratamiento de las convulsiones farmacorresistentes (97). A pesar de un efecto positivo en la frecuencia de las convulsiones cuando se utiliza como tratamiento adjunto, la mayoría de los pacientes interrumpen la dieta debido a sus características desagradables y restrictivas. En los últimos 20 años, han surgido nuevas variantes de la dieta cetogénica clásica (335). Además, el eje microbiota-intestino-cerebro ha evolucionado como un objetivo potencial para la dieta cetogénica (336). Los perros epilépticos se han utilizado tanto para evaluar nuevas variantes de la dieta cetogénica como para estudiar el papel potencial de la microbiota intestinal (116, 337–340).
Perros epilépticos como modelo para nuevos dispositivos terapéuticos
En cuanto a los dispositivos, la ventaja de los perros frente a los modelos de epilepsia de roedores es que los prototipos de dispositivos de epilepsia de tamaño completo se pueden evaluar en perros. Como se describió anteriormente, la base experimental para la terapia con VNS fue una serie de estudios en la década de 1980 sobre los efectos de la estimulación vagal cervical en las convulsiones inducidas en perros (280). En estos experimentos en perros de raza mixta, las convulsiones o temblores, respectivamente, se indujeron por inyección i.v. de bolos de estricnina o PTZ a intervalos de 1 a 4 minutos hasta que se observó actividad muscular sostenida electromiográficamente. La estimulación vagal terminó con las convulsiones en 0,5-5 s. Zabara (280) sugirió que estos resultados pueden formar la base de un nuevo enfoque terapéutico para la epilepsia. De acuerdo con esta sugerencia, los resultados de VNS en perros se confirmaron en un modelo de mono y poco después en el primer implante de VNS en un paciente adulto con DRE (341). Después de los datos positivos de dos ECA, el sistema VNS Therapy® recibió la aprobación de la FDA en 1997 para su uso como terapia complementaria para reducir la frecuencia de las convulsiones de inicio focal que son refractarias a los ASM (341). El primer ensayo clínico que utilizó este dispositivo en perros con DRE se publicó en 2002 (342), reportando una reducción de hasta el 50 % en la frecuencia de convulsiones en cuatro de los nueve perros. Para explorar los efectos neuroquímicos del VNS en perros, el sistema VNS Therapy® se implantó en 8 perros Beagle y los niveles de serotonina (5HT), norepinefrina y dopamina se cuantificaron en el LCR después de 1 hora de VNS falso, estándar y microexplosión (343). El estándar de ciclo rápido y el microexplosión VNS causaron un aumento significativo de los niveles de norepinefrina en el LCR, mientras que no se detectaron cambios significativos en los niveles de 5HT o dopamina. Estos datos apoyan hallazgos anteriores que indican que el VNS influye en el sistema locus coeruleus-norepinefrina (344).
En la primera evaluación a largo plazo de la terapia VNS en un perro con epilepsia resistente a los medicamentos, un macho Shetland Sheepdog de 5 años fue tratado con VNS durante 1 año (345). Durante este período, los parámetros de estimulación se ajustaron repetidamente para optimizar la intensidad de la estimulación y evitar los efectos adversos. La frecuencia de las convulsiones tónico-clónicas generalizadas se redujo en un 87 % durante todo el período de VNS. El dueño informó de que el perro recuperó su personalidad y calidad de vida.
Más recientemente, Robinson et al. (346) examinaron la viabilidad y eficacia del VNS no invasivo (nVNS) como tratamiento adjunto para la DRE en perros. Se encontró que el nVNS es seguro y fácil de administrar con eventos adversos leves. De los 14 perros epilépticos, nueve lograron una reducción en la frecuencia de las convulsiones y cuatro se consideraron respondedores con una reducción del 50 % o más en las convulsiones desde el inicio hasta el período final de tratamiento (346).
Además de VNS, hay varios otros tipos de neuroestimulación invasiva o no invasiva disponibles para la terapia complementaria para personas con DRE (65). Una de las técnicas más utilizadas es la RNS, que fue aprobada por la FDA en 2013 (65). Mientras que el volumen total de cirugías de resección disminuyó en los últimos años, los implantes de RNS han aumentado en más del 100 % en personas con DRE (347). Los ECA en pacientes adultos con DRE han demostrado que el RNS de bucle cerrado al foco de convulsiones a través de electrodos hipocampales bilaterales reduce la frecuencia de las convulsiones incapacitantes, es bien tolerada y es aceptablemente segura (348, 349). El sistema NeuroPace RNS®, que registra continuamente el iEEG, reconoce y responde a los patrones cerebrales únicos de cada paciente, proporcionando estimulación personalizada y previniendo las convulsiones antes de que comiencen. RNS u otros tipos de estimulación cerebral profunda aún no están disponibles de forma rutinaria para el tratamiento de DRE en perros, pero los perros desempeñaron un papel decisivo en el desarrollo de los dispositivos iEEG y los algoritmos de aprendizaje automático necesarios para desarrollar RNS de circuito cerrado para pacientes humanos. Recientemente, se informó de un nuevo dispositivo de estimulación y registro neuronal implantable para prevenir eventos SE en un perro con DRE grave (350).
Los datos generados por el monitoreo continuo de iEEG en los pacientes demostraron que, sin dicho monitoreo, los pacientes o sus familiares y cuidadores pasan por alto muchas convulsiones (351). Esto es ciertamente similar a la documentación de convulsiones, como los diarios de convulsiones utilizados por los propietarios de perros epilépticos, que pueden formar un sesgo significativo en los ensayos de nuevas terapias. De hecho, los recuentos de convulsiones basados en los diarios de convulsiones a menudo son inexactos y subestimados (351.352). Al igual que en la situación de la epilepsia humana, la imprevisibilidad de las convulsiones juega un papel importante en el manejo de la epilepsia canina, y los dueños de perros tienen un fuerte deseo de saber cuándo se produce una convulsión (353). La detección automatizada de convulsiones mediante dispositivos fiables de detección de convulsiones sería importante para guiar las decisiones de tratamiento o controlar los resultados en los ensayos clínicos tanto en pacientes humanos como caninos.
Perros epilépticos como modelo para nuevos dispositivos de EEG implantables
En 2011, Davis et al. (67) describieron un nuevo dispositivo implantado para registrar y analizar de forma inalámbrica el iEEG continuo (24/7) y probaron este dispositivo en seis perros epilépticos sin sed durante 5 meses (ver más arriba). Para el monitoreo de iEEG, se colocaron dos matrices de electrodos con 16 sensores intracraneales paralelas a la dura en el espacio subdural para registrar el iEEG de ambos hemisferios (Figura 8). Los sensores intracraneales se acoplaron a una unidad de adquisición y transmisión subclavicular implantada, recargable y recargable, que telemetro continuamente los datos de iEEG a una unidad de procesamiento externa para el almacenamiento de datos en tiempo real, el análisis y la comunicación de los resultados del análisis a los cuidadores. Se implementó un algoritmo de detección de convulsiones, entrenado en datos humanos de iEEG, en iEEG canino en tiempo real (67).
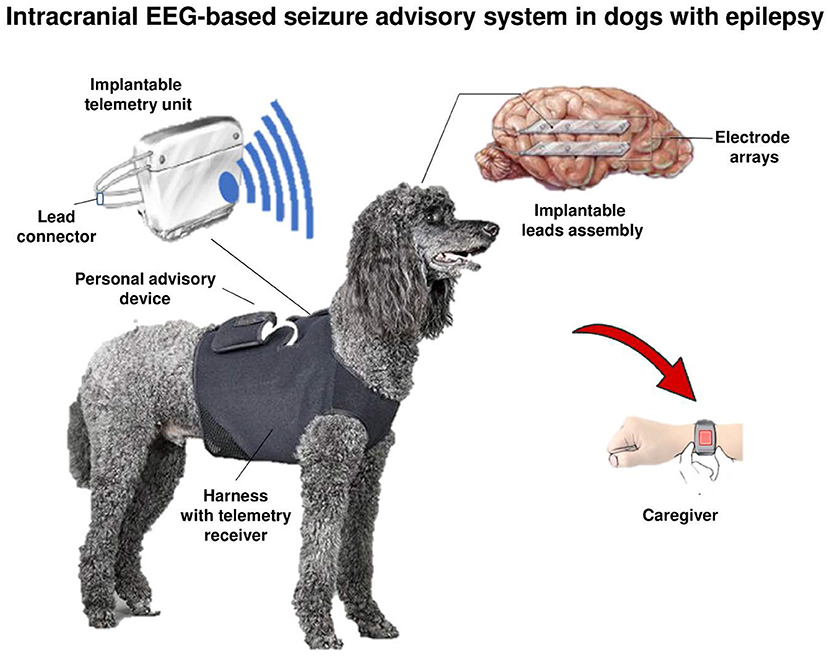 FIGURA 8. Esquema de un perro con un sistema de asesoramiento de convulsiones NeuroVista (SAS) ambulatorio implantado. El dispositivo implantable para registrar y almacenar iEEG continuo incluye: un conjunto de plomo implantable (ILA) colocado en el espacio subdural, una unidad de telemetría implantable (ITU) y un dispositivo de asesoramiento personal (PAD). La ILA, que adquiere 16 canales de iEEG, detecta y transmite la actividad eléctrica en el cerebro a la UIT. La UIT recibe datos de los cables implantables, predice la actividad convulsiva utilizando un algoritmo y envía una alerta inalámbrica al PAD. El PAD envía una alerta inalámbrica al cuidador, lo que puede conducir a una intervención acelerada y la administración de medicamentos para detener las convulsiones (ver texto). Todos los datos de iEEG se almacenan en una unidad flash y se cargan semanalmente a través de Internet en un sitio central de almacenamiento de datos. Modificado de Coles et al. (354).
FIGURA 8. Esquema de un perro con un sistema de asesoramiento de convulsiones NeuroVista (SAS) ambulatorio implantado. El dispositivo implantable para registrar y almacenar iEEG continuo incluye: un conjunto de plomo implantable (ILA) colocado en el espacio subdural, una unidad de telemetría implantable (ITU) y un dispositivo de asesoramiento personal (PAD). La ILA, que adquiere 16 canales de iEEG, detecta y transmite la actividad eléctrica en el cerebro a la UIT. La UIT recibe datos de los cables implantables, predice la actividad convulsiva utilizando un algoritmo y envía una alerta inalámbrica al PAD. El PAD envía una alerta inalámbrica al cuidador, lo que puede conducir a una intervención acelerada y la administración de medicamentos para detener las convulsiones (ver texto). Todos los datos de iEEG se almacenan en una unidad flash y se cargan semanalmente a través de Internet en un sitio central de almacenamiento de datos. Modificado de Coles et al. (354).
Este dispositivo se utilizó en estudios posteriores para la minería de iEEG continuo en la epilepsia canina focal (68, 355). Uno de los objetivos de estos estudios era investigar las ráfagas interictales y su relación electrográfica con las convulsiones. Otro objetivo era centrarse en los desafíos que presentan los nuevos dispositivos que monitorean y procesan continuamente los datos humanos del EEG durante largos períodos. Este trabajo ha evolucionado y mejorado constantemente en los últimos años, incorporado en dispositivos para detectar, predecir y responder a las convulsiones en varios nuevos dispositivos implantables (348, 349). El gran archivo de datos continuos analizados para este proyecto (hasta 14 meses de registro continuo de EEG en perros epilépticos) requería métodos rigurosos y automatizados, incluido el aprendizaje automático, para detectar y procesar la actividad del EEG. Los datos obtenidos validaron aún más la epilepsia canina como un modelo prometedor de epilepsia humana y generaron un conjunto de datos continuos de iEEG de una duración sin precedentes para su análisis (68, 355).
Además de la grabación de iEEG, se están desarrollando nuevos e interesantes dispositivos móviles (ambulatorios) para el monitoreo continuo del cuero cabelludo o el EEG del subcalmo en pacientes humanos con epilepsia (356, 357). Uno de estos dispositivos utiliza un electrodo de aguja subcutáneo ( también conocido como subcáscal o subdérmico) (el UNEEG SubQ™; UNEEG Medical A/S, Lynge, Dinamarca), que se coloca a través de un procedimiento quirúrgico mínimamente invasivo debajo del cuero cabelludo y contiene una bobina inductiva para la transferencia de energía y datos En relación con un registrador externo (el 24/7 EEGTM SubQ) combinado con una completa infraestructura de datos y un software de análisis, el electrodo implantado proporciona detección de convulsiones electrográficas continuas 24/7 y automatizada durante un máximo de 15 meses (358–360). Se han desarrollado y probado varios sistemas de subcárpón similares en humanos, incluido el uso de dichos sistemas para el pronóstico de convulsiones (359, 361). El tamaño del electrodo de aguja subcutánea o el dispositivo de subcoron del sistema UNEEG sería ideal para los registros continuos de EEG en perros epilépticos, que planeamos explorar pronto. Las grabaciones de video-EEG inalámbricas a corto plazo de perros epilépticos no seados a través de electrodos de alambre subdérmicos corroboraron la viabilidad de dicho enfoque (362).
Perros epilépticos como modelo para la previsión de convulsiones
La predicción de la aparición de convulsiones epilépticas utilizando algoritmos de aprendizaje automático que operan con iEEG o datos de EEG del cuero cabelludo tiene el potencial de mejorar la vida de los pacientes que viven con convulsiones (363, 364). Sin embargo, el progreso hacia un pronóstico confiable de las convulsiones se ha visto obstaculizado por la falta de acceso abierto a las grabaciones de EEG de larga duración con un número adecuado de convulsiones para que los investigadores comparen rigurosamente los algoritmos y los resultados. En 2014, se ejecutó una competencia internacional de predicción de convulsiones a gran escala en un portal de concurso de ciencia de datos estándar, que involucró una combinación de datos de iEEG humanos a corto plazo (con 942 convulsiones registradas durante más de 500 días) y datos de iEEG a largo plazo en perros (348 convulsiones registradas durante 1.500 Los datos de estos estudios demostraron la viabilidad de la previsión de convulsiones en la epilepsia canina y humana. Desde entonces, las grabaciones de iEEG de larga duración de perros epilépticos se han utilizado para mejorar aún más los algoritmos de aprendizaje profundo desarrollados para el pronóstico de convulsiones (367–370). Es importante destacar que la evidencia más sólida de que la predicción de convulsiones es posible proviene de los registros a largo plazo en perros epilépticos, lo que corrobora aún más la epilepsia canina como modelo traslacional. Estos estudios han demostrado que la predicción de convulsiones funciona mejor que el azar en todos los perros estudiados.
Perros epilépticos como modelo de convulsiones resistentes a los medicamentos
Como se describió anteriormente, al igual que en los seres humanos, la resistencia a los medicamentos es el principal problema clínico en el manejo terapéutico de las epilepsias caninas. Varios ECA con ASM en perros con epilepsia recién diagnosticada han demostrado que al menos el 50 % de los animales no logran el control de las convulsiones (121). Por lo tanto, los perros epilépticos son un modelo ideal para estudiar los mecanismos de la epilepsia (95, 121, 153, 371). Hasta donde sabemos, los perros epilépticos son el único modelo no ingrante de epilepsia que permite la selección de animales que responden y no responden al tratamiento farmacológico y, por lo tanto, parecería representar una herramienta definitiva para estudiar por qué y cómo la epilepsia se vuelve intratable. Los perros con convulsiones resistentes al ASM a menudo son sacrificados, lo que hace posibles los estudios cerebrales post mortem. En este sentido, un biobanco para el tejido cerebral canino sería útil porque esto puede proporcionar a los neurólogos una nueva visión de la morfología cerebral epiléptica e identificar causas subyacentes como la displasia cortical, que podría pasarse por alto en la medicina veterinaria y ser factores vitales para el desarrollo de la resistencia a los medicamentos (47).
Un examen detallado de perros con convulsiones tónico-clónicas intractables generalizadas indicó varias diferencias entre los animales resistentes y los no resistentes (95, 121, 372). Los perros con epilepsia intratable tienen una mayor frecuencia de convulsiones y convulsiones más graves (incluidos SE y grupos de convulsiones) que los perros epilépticos que responden a los ASM, lo que es consistente con los datos de la evaluación pronóstica en humanos (121) y en línea con la hipótesis de gravedad intrínseca de
Además, se observaron diferencias en la distribución de la raza en los respondedores de ASM y los no respondedores, lo que indica que la genética está involucrada en la capacidad detratabilidad médica de la epilepsia canina (372). La duración del tiempo durante el cual la epilepsia había estado presente antes del tratamiento no parecía ser de gran importancia para la eficacia de la terapia con ASM en perros epilépticos.
Más recientemente, el papel de la «hipótesis del transportador» de DRE se ha abordado en perros epilépticos (121).Para varios ASM importantes, la absorción, distribución y eliminación de medicamentos se ven afectados por los transportadores de eflujo de medicamentos como la glicoproteína P (Pgp), que están regulados por receptores nucleares promiscuos sensibles a los medicamentos y pueden estar sobreexpresados en pacientes con epilepsia (120). Las bombas de eflujo como la Pgp también se expresan en el BBB, lo que reduce críticamente los niveles de fármaco funcionalmente relevantes en los sitios objetivo en el tejido epileptogénico, lo que puede contribuir a la resistencia al ASM. Tanto los estudios preclínicos como los clínicos han encontrado un aumento de la expresión de la Pgp y otros transportadores de eflujo en el área del foco epiléptico de individuos resistentes al ASM (120, 374). Tal aumento de la expresión del transportador puede ser el resultado de convulsiones frecuentes o factores genéticos, o ambos. Por ejemplo, se ha informado de que SE en perros aumenta la Pgp en el cerebro canino (375) y los polimorfismos en el gen ABCB1 que codifica Pgp se han asociado con resultados de las convulsiones en Collies con epilepsia (122, 376). Por lo tanto, el aumento de la expresión de BBB de Pgp puede estar involucrado en la resistencia al ASM en los perros, aunque varios otros mecanismos ciertamente contribuyen a este fenómeno (120). El tratamiento adicional con el inhibidor de Pgp verapamilo en perros con epilepsia resistente al fenobarbital no logró mejorar el control de las convulsiones (377). Sin embargo, el verapamilo no es un bloqueador selectivo de la Pgp, sino que actúa principalmente como un bloqueador de los canales de calcio dependientes del voltaje, lo que complica la interpretación de los estudios con este medicamento. Por lo tanto, se necesitan estudios clínicos con inhibidores más selectivos de la Pgp (121). La sobreexpresión de Pgp en el cerebro y su inhibición se puede visualizar mediante imágenes PET (378).
Otra hipótesis popular de resistencia a ASM, la «hipótesis objetivo», sugiere que los objetivos ASM en el cerebro se alteran en DRE (120). Aunque es atractiva, la evidencia clínica de este mecanismo es muy limitada. Además, el hecho de que la mayoría de los pacientes resistentes a ASM sean resistentes a varios ASM que actúan sobre diferentes objetivos terapéuticos socava la utilidad general de la hipótesis del objetivo (374). Recientemente, se ha sugerido que los mecanismos epigenéticos y las interacciones proteína-proteína pueden resultar en alteraciones de diversas dianas de medicamentos en las regiones del cerebro epileptogénico, lo que explica por qué la mayoría de los pacientes resistentes al ASM son resistentes a varios ASM que actúan sobre diferentes dianas terapéuticas (121, 379). Las convulsiones y la epilepsia inducen cambios epigenéticos en el transcriptoma de las proteínas (incluidas las dianas de los medicamentos) por metilación del ADN, lo que puede ser la base de la resistencia de varios ASM. Sin embargo, esta interesante hipótesis necesita una mayor exploración tanto en los modelos animales como en la epilepsia humana y canina.
Estado epiléptico en perros como modelo para nuevos tratamientos
En 2011, Leppik et al. (77) sugirieron que la SE canina de origen natural puede convertirse en una plataforma de traducción para evaluar la seguridad y eficacia de compuestos interesantes con actividad anti-SE en estudios de roedores antes de su eventual uso en ensayos en humanos. Esta propuesta se basó en un estudio aleatorizado, controlado con placebo y de doble máscara sobre levetiracetam i.v. en perros que se presentó con SE convulsiva al Centro Médico Veterinario de la Universidad de Minnesota. Los perros que no se liberaron de convulsiones con diazepam fueron inscritos y tratados con levetiracetam o placebo, lo que resultó en una tasa de respuesta del 56 % para el levetiracetam en comparación con el 10 % para el placebo (77). Los detalles del ensayo completo, que también incluyó perros con convulsiones repetitivas agudas (convulsiones en racimo), se publicaron en 2012 (380). Las etiologías de convulsiones identificadas fueron epilepsia idiopática (n = 10), enfermedad inflamatoria del SNC (n = 4), neoplasia intracraneal (n = 2), encefalopatía hepática (n = 1), y dos perros no tenían causa determinada. Leppik et al. (77) concluyeron que, a diferencia de los modelos de roedores de SE inducida eléctrica o químicamente, una especie de prueba que tuviera SE natural similar a la de los seres humanos y más cercana en términos de características farmacocinéticas y tamaño corporal sería muy útil. Otra ventaja es que, a diferencia de los humanos, los estudios controlados con placebo en perros son posibles porque los tratamientos aprobados por la FDA para el SE canino no están disponibles. La prometedora eficacia del levetiracetam en el SE canino refractario al diazepam (establecido) se tradujo en eficacia en el SE humano establecido (381).
En 2015, se publicó un ECA multicéntrico de prueba de principio sobre SE canino establecido tratado con fosfenitoína i.v., un profármaco de la fenitoína (382). La fosfenitoína fue significativamente más eficaz que el placebo en los niveles plasmáticos de fenitoína dentro del rango de concentración terapéutica para las personas. En un estudio posterior, el mismo grupo evaluó la farmacocinética del topiramato i.v. en perros con epilepsia natural (383). El topiramato aún no está aprobado para la administración i.v., pero, según los datos de la administración de la sonda nasogástrica, puede ser una opción interesante para el tratamiento de la SE establecida (384). En este sentido, es interesante observar que evaluamos la seguridad y la farmacocinética de una nueva formulación i.v. de carbamazepina basada en ciclodextrina en perros (385) y demostramos su eficacia en un modelo de ratón de SE convulsivo (386). En 2016, la FDA aprobó una formulación i.v. basada en ciclodextrina de carbamazepina para su uso en humanos.
Recientemente, Vuu et al. (387) informaron sobre la farmacocinética, la farmacodinámica y la seguridad de una nueva formulación i.v. basada en ciclodextrina de alopregnanolona en perros sanos y epilépticos para desarrollar esta formulación para el tratamiento temprano de la SE. La aloprégnanolona, un neuroesteroide que modula los receptores GABAA sinápticos y extrasinápticos, demostró ser eficaz en un modelo de ratón de SE establecido (388). En el estudio en perros, el rápido inicio del efecto de la alopergnanolona después de la infusión intravenosa sugirió que este medicamento puede ser útil en el tratamiento temprano de la SE (387). En general, estos diversos estudios establecen al perro como un modelo clínico viable de SE humano.
Convulsiones inducidas en perros como modelo para nuevos tratamientos
Como se describió anteriormente, las convulsiones inducidas en perros sanos se han utilizado ampliamente para evaluar nuevos ASM y dispositivos terapéuticos. El modelo más utilizado ha sido el i.v. cronometrado. Prueba de umbral de convulsión de infusión de PTZ, que fue fundamental en el desarrollo preclínico de nuevos ASM como la imepitoína. Sin embargo, el modelo de PTZ no es susceptible a todas las terapias anticonvulsivos, como lo ilustra la falta de VNS para aumentar el umbral de convulsivo de PTZ en perros (343). A este respecto, es importante tener en cuenta que la PTZ actúa como un antagonista del receptor GABAA y, como tal, es particularmente sensible a los ASM (como los BDZ, la imepitoína y el fenobarbital) que actúan como PAM en este receptor. Por lo tanto, la PTZ no puede reemplazar las pruebas de convulsión, como el modelo MES, que son sensibles a los ASM que actúan por varios otros mecanismos. Al igual que la prueba MES en roedores (389), Territo et al. (285) han demostrado que las convulsiones clónicos en la prueba MES en perros pueden suprimirse de forma dependiente de la dosis por el fenobarbital. Los autores sugirieron que el MES es un modelo útil para evaluar las convulsiones generalizadas en caninos y puede proporcionar una herramienta para la selección de dosis de nuevos compuestos farmacéuticos antes de los primeros ensayos clínicos en humanos. En un estudio posterior, Territo et al. (284) utilizaron el modelo de perro MES para evaluar más a fondo la eficacia antiseconvulsiva de la ameltolida, que actúa modulando los canales de sodio dependientes del voltaje de las neuronas presinápticas.
Además de usar el i.v. cronometrado Prueba de umbral de convulsión de infusión de PTZ para determinar la eficacia de ASM en perros, esta prueba se puede utilizar para determinar si la pérdida de eficacia (tolerancia) se desarrolla tras la administración crónica. Los ejemplos se ilustran en la Figura 7D. Además, esta prueba se puede utilizar para determinar si la hiperexcitabilidad de la abstinencia se produce después de la rápida interrupción del tratamiento. Los síntomas de abstinencia, incluida una disminución del umbral de convulsiones, convulsiones espontáneas o, eventualmente, SE, son típicos de las drogas (como los BDZ, los barbitúricos y los opioides) que inducen dependencia física durante el tratamiento crónico. Para tales medicamentos, los síntomas de abstinencia, por supuesto, también ocurren cuando no se inducen convulsiones durante el tratamiento prolongado, pero la inducción de convulsiones permite determinar la tolerancia y la dependencia en el mismo experimento (100). Para los medicamentos que actúan a través del sitio de unión BDZ del receptor GABAA, como alternativa a la terminación abrupta del tratamiento, la inyección de medicamentos (como el flumazenil) que actúan como antagonistas en este sitio se ha utilizado para precipitar los síntomas de abstinencia (390). El modelo de perro ha sido útil para demostrar que la tolerancia y la dependencia pueden ser abolidas mediante el desarrollo de compuestos, como la imepitoína o el abecarnil, que actúan solo como agonistas parciales o selectivos de subtipo en el receptor GABAA (101).
El perro como modelo para los estudios farmacocinéticos
Como se muestra en la Tabla 1, la mayoría de los ASMS son eliminados más rápidamente por los perros que por los humanos, lo que restringe el uso de ASM en la epilepsia canina. A pesar de las diferencias entre perros y humanos en la cinética de eliminación de muchos ASM (Tabla 1), tanto los perros sanos como los epilépticos se utilizan para estudiar ciertos aspectos farmacocinéticos de los ASM. Por ejemplo, hemos utilizado perros para estudiar la cinética de la entrada del SNC de varios ASM (16, 18, 23). Del mismo modo, incluimos a los perros al evaluar las diferencias de especies en el metabolismo y la unión a proteínas plasmáticas de los ASM (13-15, 391) y caracterizamos la farmacología de los metabolitos activos, como el principal metabolito activo del valproato, en perros (392). Además, como se describió anteriormente y se muestra en la Tabla 1, hemos determinado la farmacocinética de varios ASM en perros como base para la selección de la dosis y el intervalo de dosificación para el tratamiento crónico en perros epilépticos (11, 13-17,19-24, 393). Más recientemente, estudiamos en perros si el cambio de la marca a las formulaciones genéricas de fenobarbital está asociado con diferencias en los niveles de medicamentos efectivos (394).
Muchos otros grupos han utilizado perros sanos o epilépticos para estudios farmacocinéticos, incluidos estudios recientes sobre fosfenitoína i.v. (382, 395), topiramato (383) y alopregnanolona (387). Tales estudios son importantes para caracterizar aún más las diferencias de especies en la farmacocinética de los medicamentos y proporcionar una base para la terapia racional de la epilepsia canina o SE. Además, los datos de los estudios invasivos sobre la penetración de la droga BBB en perros se pueden traducir a los seres humanos, porque las características de la BBB son similares entre las especies de mamíferos, como los perros y los humanos (396).
Conclusión
Como se muestra en esta revisión, debido a las impresionantes similitudes epidemiológicas, clínicas y farmacológicas, la epilepsia canina natural es un excelente modelo para la epilepsia humana. Lo mismo es cierto para el SE canino. A pesar de que los perros metabolizan la mayoría de los ASM más rápidamente que los humanos (Tabla 1), los niveles plasmáticos efectivos durante la terapia de la epilepsia crónica son notablemente similares, por ejemplo, como se muestra para el fenobarbital. La resistencia a los medicamentos es un problema importante tanto en la epilepsia canina como en la humana. Se producen comorbilidades similares en ambas especies. Además, el tamaño del cuerpo de los perros está más cerca de los humanos que el tamaño del cuerpo de los roedores, lo que hace que la conversión de dosis entre perros y humanos sea más precisa. Los factores de escala para las dosis equivalentes en humanos son ~1.8 para los perros, pero ~12 y ~6 para ratones y ratas, respectivamente (397). Es importante destacar que los perros son lo suficientemente grandes como para acomodar dispositivos terapéuticos o iEEG diseñados para humanos. Los estudios en perros epilépticos con tales dispositivos han reportado eventos ictales que mostraron una notable similitud con las convulsiones humanas (68, 355). El EEG de fondo y las ráfagas interictales de descargas epilépticas en estos animales también eran indistinguibles de las grabaciones de iEEG humanas. Este trabajo proporcionó un rico conjunto de datos de una longitud sin precedentes para estudiar las periodicidades de las incautaciones y desarrollar nuevos métodos para el pronóstico de las incautaciones (363).
Sin embargo, también hay limitaciones del perro epiléptico como modelo traslacional (329). A pesar de los esfuerzos de la IVETF para estandarizar el diagnóstico de la epilepsia y la evaluación de las respuestas terapéuticas, la clasificación de las convulsiones y la epilepsia en los perros es controvertida. Al menos en parte, esto se debe a que el EEG no es un procedimiento estándar en el manejo de diagnóstico de pacientes caninos con sospecha de epilepsia. Además, el uso de técnicas de imagen modernas pero costosas, como la resonancia magnética, no es un procedimiento rutinario en medicina veterinaria, aunque su uso está aumentando constantemente. En cuanto a los estudios sobre medicamentos o dispositivos en perros epilépticos, dichos estudios se ven muy afectados por la motivación y fiabilidad del propietario de los perros. Los ensayos clínicos en medicamentos epilépticos son tan elaborados y lentos como los ensayos en pacientes humanos, pero mucho menos costosos y menos limitados que los estudios en humanos. Por lo tanto, en el desarrollo de medicamentos o dispositivos, los perros epilépticos solo deben usarse con fines de traducción si el valor adicional es importante para la decisión de iniciar o continuar las pruebas en humanos. Ejemplos relevantes a este respecto son los estudios sobre nuevos tratamientos de SE o nuevos dispositivos iEEG y algoritmos de pronóstico de convulsiones. Los perros de laboratorio, como los Beagles, con epilepsia natural, son una alternativa a las mascotas, pero el costo y el esfuerzo para mantener a dichos perros, junto con consideraciones éticas, plantean limitaciones para la investigación experimental de la epilepsia en dichos animales (329).
En resumen, los perros con convulsiones naturales o inducidas proporcionan excelentes modelos de animales grandes para cerrar la brecha traslacional entre los roedores y los humanos en el desarrollo de nuevas terapias. Además, debido a que el perro no solo es una especie preclínica para la medicina humana, sino también un posible paciente y mascota, la investigación sobre esta especie sirve tanto a la medicina veterinaria como a la humana.
devoción
Esta revisión está dedicada a mis difuntos colegas y amigos, los doctores. Hans-Hasso Frey y Dieter Schmidt, que iniciaron mi interés en los perros epilépticos como modelo traslacional en la década de 1970 y realizaron varios estudios conmigo en esta especie.
Contribuciones del autor
WL escribió esta reseña y acepta ser responsable de todos los aspectos del trabajo.
Financiación
Los propios estudios del autor en perros han sido financiados en parte por la Deutsche Forschungsmeinschaft (Bonn, Alemania, números de subvención LO 274/xx). Esta publicación de acceso abierto fue financiada por la Deutsche Forschungsgemeinschaft dentro del programa LE 824/10-1 Open Access Publication Costs y la Fundación de la Universidad de Medicina Veterinaria de Hannover.
Conflicto de intereses
El autor declara que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Agradecimientos
Agradezco a Michael Podell (MedVet, Columbus, Ohio), Edward E. Patterson (Departamento de Ciencias Clínicas Veterinarias, Facultad de Medicina Veterinaria de la Universidad de Minnesota, St. Paul, Minnesota) e Ilo E. Leppik (MINCEP Epilepsy Care, University of Minnesota Physicians, Minneapolis, Minnesota) por revisar críticamente una versión anterior de este manuscrito. Agradezco a los muchos colegas que han trabajado conmigo durante los últimos ~45 años en la evaluación del perro como un modelo traslacional para la investigación de la epilepsia.
Referencias
1. Paynter AN, Dunbar MD, Creevy KE, Ruple A. Big data veterinarios: cuando los datos van a los perros. Animales. (2021) 11:1872. doi: 10.3390/ani11071872
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
2. Bunford N, Andics A, Kis A, Miklósi Ã, Gácsi M. Canis familiaris como modelo para la neurociencia comparada no invasiva.Tendencias Neurociencia. (2017) 40:438–52. doi: 10.1016/j.tins.2017.05.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. Momozowa Y. El potencial de la investigación traslacional en perros en medicina humana. Translat Regulat Sci. (2019) 1:31–6. doi: 10.33611/trs.1_31
4. Giuliano A. Modelo de animal de compañía en oncología traslacional; carcinoma de células escamosas oral felino y melanoma oral canino. Biología. (2021) 11:54. doi: 10.3390/biología11010054
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
5. Bailey J, Thew M, Balls M. Un análisis del uso de perros en la predicción de la toxicología humana y la seguridad de los medicamentos. Altern Lab Anim. (2013) 41:335-50. doi: 10.1177/026119291304100504
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
6. Pellegatti M. Perros y monos en el desarrollo de medicamentos preclínicos: el desafío de reducir y reemplazar. Experto en drogas Opin Metab Toxicol. (2013) 9:1171–80. doi: 10.1517/17425255.2013.804061
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
7. Ferreira GS, Veening-Griffioen DH, Boon WPC, Moors EHM, Gispen-de Wied CC, Schellekens H, et al. Un marco estandarizado para identificar los modelos animales óptimos para la evaluación de la eficacia en el desarrollo de medicamentos. PLoS ONE. (2019) 14:e0218014. doi: 10.1371/journal.pone.0220325
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Patterson EE. Epilepsia canina: un modelo infrautilizado. ILAR J. (2014) 55:182–6. doi: 10.1093/ilar/ilu021
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
9. Holliday TA, Cunningham JG, Gutnick MJ. Estudios clínicos y electroencefalográficos comparativos de la epilepsia canina. Epilepsia. (1970) 11:281–92. doi: 10.1111/j.1528-1157.1970.tb03892.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Löscher W, Esenwein H. Farmacocinética del valproato de sodio en perros y ratones. Arzneimittel-Forsch. (1978) 28:782–7.
12. El Sayed MA, Löscher W, Frey HH. Farmacocinética de ethosuximide en el perro. Arch Int Pharmacodyn Ther. (1978) 234:180–92.
13. Löscher W. GABA en plasma y líquido cefalorraquídeo de diferentes especies. Efectos del GABA y-acetilénico, el GABA de y-vinilo y el valproato de sodio. J Neurochem. (1979) 32:1587–91. doi: 10.1111/j.1471-4159.1979.tb11104.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. Frey HH, Göbel W, Löscher W. Farmacocinética de la primidona y sus metabolitos activos en el perro. Arch Int Pharmacodyn Ther. (1979) 242:14-30.
15. Löscher W. Niveles plasmáticos de ácido valproico y sus metabolitos durante el tratamiento continuado en perros. J Vet Pharmacol Ther. (1981) 4:111–9. doi: 10.1111/j.1365-2885.1981.tb00719.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Löscher W, Nau H. Distribución del ácido valproico y sus metabolitos en varias regiones cerebrales de perros y ratas después de un tratamiento agudo y prolongado. J Pharmacol Exp Ther. (1983) 226:845–54.
17. Al-Tahan FJ. O., Löscher W, Frey HH. Farmacocinética del clonazepam en el perro. Arch Int Pharmacodyn Ther. (1984) 268:180–93.
18. Frey HH, Löscher W. Distribución del valproato a través de la interfaz entre la sangre y el líquido cefalorraquídeo. Neurofarmacología. (1978) 17:637–42. doi: 10.1016/0028-3908(78)90160-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Frey HH, Löscher W. farmacocinética clínica de la fenitoína en el perro: una reevaluación. Am J Vet Res. (1980) 41:1635–8.
20. Frey HH, Löscher W. Farmacocinética de la carbamazepina en el perro. Arch Int Pharmacodyn Ther. (1980) 243:180–91.
21. Frey HH, Löscher W. Farmacocinética de los medicamentos antiepilépticos en el perro: una revisión. J Vet Pharmacol Ther.(1985) 8:219-133. doi: 10.1111/j.1365-2885.1985.tb00951.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Löscher W, Frey HH. Farmacocinética del diazepam en el perro. Arch Int Pharmacodyn Ther. (1981) 254:180–95.
23. Löscher W, Frey H-H. Cinética de la penetración de medicamentos antiepilépticos comunes en el líquido cefalorraquídeo.Epilepsia. (1984) 25:346-52.
24. Löscher W, Schwartz-Porsche D, Frey H-H, Schmidt D. Evaluación de perros epilépticos como modelo animal de epilepsia humana.Arzneim.-Forsch. (Reso de drogas). (1985) 35:82-7.
25. Löscher W. Modelos animales genéticos de epilepsia como un recurso único para la evaluación de medicamentos anticonvulsivos. Un experimento de hallazgos de métodos de revisión. Clin Pharmacol. (1984) 6:531–47.
26. Löscher W, Meldrum BS. Evaluación de medicamentos anticonvulsivos en modelos animales genéticos de epilepsia. Fed Proc.(1984) 43:276–84.
27. Schwartz-Porsche D, Löscher W, Frey HH. Eficacia terapéutica del fenobarbital y la primidona en la epilepsia canina: una comparación. J Vet Pharmacol Ther. (1985) 8:113–9. doi: 10.1111/j.1365-2885.1985.tb00934.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
28. Devinsky O, Vezzani A, O’Brien TJ, Jette N, Scheffer IE, De Curtis M, et al. Epilepsia. Nat Rev Dis Primers. (2018) 4:18024. doi: 10.1038/nrdp.2018.24
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
29. Kearsley-Fleet L, O’Neill DG, Volk HA, Church DB, Brodbelt DC. Prevalencia y factores de riesgo para la epilepsia canina de origen desconocido en el Reino Unido. Veterinario Rec. (2013) 172:338. doi: 10.1136/vr.101133
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
30. Heske L, Nödtvedt A, Jäderlund KH, Berendt M, Egenvall A. Un estudio de cohorte de epilepsia entre 665.000 perros asegurados: incidencia, mortalidad y supervivencia después del diagnóstico. Veterinario J. (2014) 202:471–6. doi: 10.1016/j.tvjl.2014.09.023
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
31. Hülsmeyer VI, Fischer A, Mandigers PJ, DeRisio L, Berendt M, Rusbridge C, et al. La comprensión actual del Grupo de Trabajo Internacional de Epilepsia Veterinaria de la epilepsia idiopática de origen genético o sospechoso en perros de raza pura. BMC Vet Res. (2015) 11:175. doi: 10.1186/s12917-015-0463-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
32. Berendt M, Farquhar RG, Mandigers PJ, Pakozdy A, Bhatti SF, de Risio L, et al. Informe de consenso del grupo de trabajo internacional sobre epilepsia veterinaria sobre la definición, clasificación y terminología de la epilepsia en animales de compañía. BMC Vet Res. (2015) 11:182. doi: 10.1186/s12917-015-0461-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
33. Scheffer IE, Berkovic S, Capovilla G, Connolly MB, French J, Guilhoto L. Clasificación ILAE de las epilepsias: Documento de posición de la Comisión de Clasificación y Terminología de la ILAE. Epilepsia. (2017) 58:512-21. doi: 10.1111/epi.13709
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Wirrell EC, Nabbout R, Scheffer IE, Alsaadi T, Bogacz A, French JA. Metodología para la clasificación y definición de los síndromes de epilepsia con lista de síndromes: informe del Grupo de Trabajo de la ILAE sobre Nosología y Definiciones.Epilepsia. (2022) 2022:epi.17237. doi: 10.1111/epi.17237
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
35. Sisodiya SM. Medicina de precisión y terapias del futuro. Epilepsia. (2021) 62(Suplemento 2):S90–105. doi: 10.1111/epi.16539
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
36. Wang J, Lin ZJ, Liu L, Xu HQ, Shi YW, Yi YH. Genes asociados a la epilepsia. Incautación. (2017) 44:11–20. doi: 10.1016/j.seictura.2016.11.030
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Simkin D, Kiskinis E. Modelado de la epilepsia pediátrica a través de tecnologías basadas en iPSC. Epilepsia Curr. (2018) 18:240–5. doi: 10.5698/1535-7597.18.4.240
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Steinmetz S, Tipold A, Löscher W. Epilepsia después de una lesión en la cabeza en perros: un modelo natural de epilepsia postraumática. Epilepsia. (2013) 54:580–8. doi: 10.1111/epi.12071
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
39. Hall R, Labruyere J, Volk H, Cardy TJ. Estimación de la prevalencia de epilepsia idiopática y epilepsia estructural en una población general de 900 perros sometidos a resonancia magnética para convulsiones epilépticas. Vet Rec. (2020) 187:e89. doi: 10.1136/vr.105647
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Podell M, Fenner WR, Powers JD. Clasificación de convulsiones en perros de una población no basada en la referencia. J Am Vet Med Assoc. (1995) 206:1721–8.
41. Annegers JF, Rocca WA, Hauser WA. Causas de la epilepsia: contribuciones del proyecto de epidemiología de Rochester.Mayo Clin Proc. (1996) 71:570–5. doi: 10.4065/71.6.570
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
42. Thomas RH, Berkovic SF. La genética oculta de la epilepsia, un nuevo paradigma clínicamente importante. Nat Rev Neurol.(2014) 10:283–92. doi: 10.1038/nrneurol.2014.62
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
43. Lowenstein DH. Epilepsia después de una lesión en la cabeza: una visión general. Epilepsia. (2009) 50:4–9. doi: 10.1111/j.1528-1167.2008.02004.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
44. Hauser WA, Annegers JF, Kurland LT. Incidencia de epilepsia y convulsiones no provocadas en Rochester, Minnesota: 1935-1984. Epilepsia. (1993) 34:453–68. doi: 10.1111/j.1528-1157.1993.tb02586.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
45. Noebels J. Descubrimiento impulsado por la trayectoria de los genes de la epilepsia. Nat Neurosci. (2015) 18:344-50. doi: 10.1038/nn.3933
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
46. Carvill GL, Dulla CG, Lowenstein DH, Brooks-Kayal AR. El camino desde el descubrimiento científico hasta las curas para la epilepsia. Neurofarmacología. (2020) 167:107702. doi: 10.1016/j.neuropharm.2019.107702
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
47. Charalambous M, Fischer A, Potschka H, Walker M, Raedt R, Vonck K. Epilepsia veterinaria traslacional: ¿una situación en la que todos ganan entre la neurología humana y la veterinaria? Veterinario, Rec. (en imprenta).
48. Ekenstedt KJ, Patterson EE, Mickelson JR. Genética de la epilepsia canina. Genoma de Mamm. (2012) 23:28–39. doi: 10.1007/s00335-011-9362-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
49. Ekenstedt KJ, Oberbauer AM. Epilepsia herediza en perros. Top Companion Anim Med. (2013) 28:51–8. doi: 10.1053/j.tcam.2013.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
50. Guerri G, Castori M, D’Agruma L, Petracca A, Kurti D, Bertelli M. Análisis genético de genes asociados con la epilepsia. Acta Biomed. (2020) 91:e2020005. doi: 10.23750/abm.v91i13-S.10596
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
51. Happ HC, Carvill GLA. 2020 visión de la genética de las encefalopatías epilépticas del desarrollo. Epilepsia Curr. (2020) 20:90–6. doi: 10.1177/1535759720906118
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
52. Shlobin NA, Singh G, Newton CR, Sander JW. Clasificar la epilepsia de forma pragmática: pasado, presente y futuro. J Neurol Sci. (2021) 427:117515. doi: 10.1016/j.jns.2021.117515
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
53. Fisher RS, Cross JH, French JA, Higurashi N, Hirsch E, Jansen FE. Clasificación operativa de los tipos de convulsiones por la Liga Internacional contra la Epilepsia: documento de posición de la Comisión de Clasificación y Terminología de la ILAE.Epilepsia. (2017) 58:522–30. doi: 10.1111/epi.13670
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
54. Chandler K. Epilepsia canina: ¿qué podemos aprender de los trastornos convulsivos humanos? Veterinario J. (2006) 172:207-17. doi: 10.1016/j.tvjl.2005.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
55. Berendt M, Gram L. Clasificación de la epilepsia y las convulsiones en 63 perros: una reevaluación de la terminología veterinaria de la epilepsia. J Vet Intern Med. (1999) 13:14-20.
56. De Risio L, Bhatti S, Munana K, Penderis J, Stein V, Tipold A, et al. Propuesta de consenso del grupo de trabajo internacional sobre epilepsia veterinaria: enfoque diagnóstico de la epilepsia en perros. BMC Vet Res. (2015) 11:148. doi: 10.1186/s12917-015-0462-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
57. Podell M, Volk HA, Berendt M, Löscher W, Munana K, Patterson EE. Declaración de consenso de animales pequeños de ACVIM 2015 sobre el manejo de las convulsiones en perros. J Vet Intern Med. (2016) 30:477–90. doi: 10.1111/jvim.13841
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
58. Berendt M, GREdal H, Alving J. Características y fenomenología de las convulsiones parciales epilépticas en perros: similitudes con la semiología de las convulsiones humanas. Res. de epilepsia (2004) 61:167-73. doi: 10.1016/j.eplepsyres.2004.07.009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
59. Ramantani G, Maillard L, Koessler L. Correlación del EEG invasivo y el EEG del cuero cabelludo. Convulsión. (2016) 41:196–200. doi: 10.1016/j.seizure.2016.05.018
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
60. Baumgartner C, Koren JP. Detección de convulsiones utilizando el cuero cabelludo-EEG. Epilepsia. (2018) 59:14-22. doi: 10.1111/epi.14052
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
61. Uriarte A, Maestro SI. Epilepsia canina frente a epilepsia humana: ¿estamos al día? J Pequeña Práctica De Anim. (2016) 57:115-21. doi: 10.1111/jsap.12437
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
62. Berendt M, Hogenhaven H, Flagstad A, Dam M. Electroencefalografía en perros con epilepsia: similitudes entre los hallazgos humanos y caninos. Acta Neurol Scand. (1999) 99:276–83. doi: 10.1111/j.1600-0404.1999.tb00676.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
63. Ukai M, Parmentier T, Cortez MA, Fischer A, Gaitero L, Lohi H. Discrepancia de frecuencia de convulsiones entre los datos subjetivos y objetivos de electroencefalografía ictal en perros. J Vet Intern Med. (2021) 35:1819-25. doi: 10.1111/jvim.16158
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
64. Vakharia VN, Duncan JS, Witt JA, Elger CE, Staba R, Engel J. Obtener los mejores resultados de la cirugía de epilepsia. Ann Neurol. (2018) 83:676–90. doi: 10.1002/ana.25205
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
65. Martlé V, Van Ham L, Raedt R, Vonck K, Boon P, Bhatti S. Opciones de tratamiento no farmacológico para la epilepsia refractaria: una visión general de las modalidades de tratamiento humano y su posible utilidad en los perros. Veterinario J.(2014) 199:332–9. doi: 10.1016/j.tvjl.2013.09.055
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
66. Hasegawa D. Técnicas de diagnóstico para detectar la zona epiléptica: análisis fisiopatológico y prequirúrgico de la epilepsia en perros y gatos. Veterinario J. (2016) 215:64–75. doi: 10.1016/j.tvjl.2016.03.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
67. Davis KA, Sturges BK, Vite CH, Ruedebusch V, Worrell G, Gardner AB. Un nuevo dispositivo implantado para registrar y analizar de forma inalámbrica el EEG canino intracraneal continuo. Epilepsia Res. (2011) 96:116-22. doi: 10.1016/j.eplepsyres.2011.05.011
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
68. Ung H, Davis KA, Wulsin D, Wagenaar J, Fox E, McDonnell JJ, et al. Comportamiento temporal de convulsiones y ráfagas intéricas en registros intracraneales prolongados de caninos epilépticos. Epilepsia. (2016) 57:1949–57. doi: 10.1111/epi.13591
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
69. Morita T, Shimada A, Takeuchi T, Hikasa Y, Sawada M, Ohiwa S. Hallazgos clínico y neuropatológicos de la epilepsia familiar del lóbulo frontal en perros pastores de Shetland. Can J Vet Res. (2002) 66:35–41.
70. Lowenstein DH. El manejo del estado refractario epiléptico: una actualización. Epilepsia. (2006) 47:35-40. doi: 10.1111/j.1528-1167.2006.00658.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
71. Trinka E, Höfler J, Zerbs A. Causas del estado epiléptico. Epilepsia. (2012) 53:127–38. doi: 10.1111/j.1528-1167.2012.03622.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
72. Löscher W, Klein P. La farmacología y la eficacia clínica de los medicamentos antiseconvulsivos: desde las sales de bromuro hasta el cenobamato y más. Medicamentos para el SNC. (2021) 35:935–63. doi: 10.1007/s40263-021-00827-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
73. Löscher W. Mecanismos de resistencia a los medicamentos en el estado epiléptico. Epilepsia. (2007) 48(Suppl.8):74–7. doi: 10.1111/j.1528-1167.2007.01357.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
74. Trinka E, Höfler J, Leitinger M, Brigo F. Farmacoterapia para el estado epiléptico. Drogas. (2015) 75:1499–521. doi: 10.1007/s40265-015-0454-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
75. Rossetti AO, Lowenstein DH. Manejo del estado refractario epiléptico en adultos: aún más preguntas que respuestas. Lancet Neurol. (2011) 10:922–30. doi: 10.1016/S1474-4422(11)70187-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
76. Ochoa JG, Dougherty M, Papanastassiou A, Gidal B, Mohamed I, Vossler DG. Tratamiento del estado epiléptico superrrefractario: una revisión. Epilepsia Curr. (2021) 21:1535759721999670. doi: 10.1177/1535759721999670
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
77. Leppik IE, Patterson EN, Coles LD, Craft EM, Cloyd JC. Estado canino epiléptico: una plataforma traslacional para ensayos terapéuticos en humanos. Epilepsia. (2011) 52:31-4. doi: 10.1111/j.1528-1167.2011.03231.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
78. Golubovic SB, Rossmeisl JH. Estado epiléptico en perros y gatos, parte 1: etiopatogénesis, epidemiología y diagnóstico. J Vet Emerg Crit Care. (2017) 27:278–87. doi: 10.1111/vec.12605
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
79. Golubovic BS, Rossmeisl JH. Estado epiléptico en perros y gatos, parte 2: tratamiento, seguimiento y pronóstico. J Vet Emerg Crit Care. (2017) 27:288–300. doi: 10.1111/vec.12604
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
80. Charalambous M, Volk HA, Van Ham L, Bhatti SFM. Manejo de primera línea del estado canino epiléptico en el hogar y en las oportunidades hospitalarias y limitaciones de las diversas vías de administración de benzodiacepinas. BMC Vet Res. (2021) 17:103. doi: 10.1186/s12917-021-02805-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
81. Jafarpour S, Hirsch LJ, Gainza-Lein M, Kellinghaus C, Detyniecki K. Grupo de convulsiones: definición, prevalencia, consecuencias y manejo. Incautación. (2019) 68:9–15. doi: 10.1016/j.seizure.2018.05.013
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
82. Charalambous M, Bhatti SFM, Van Ham L, Platt S, Jeffery ND, Tipold A. Midazolam intranasal frente a diazepam rectal para el tratamiento del estado canino epilepticus: un ensayo clínico multicéntrico aleatorizado de grupos paralelos. J Vet Intern Med.(2017) 31:1149–58. doi: 10.1111/jvim.14734
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
83. Charalambous M, Bhatti SFM, Volk HA, Platt S. Definir y superar los obstáculos terapéuticos en el estado refractario canino epiléptico. Veterinario J. (2022) 2022:105828. doi: 10.1016/j.tvjl.2022.105828
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
84. Löscher W. Terapias individuales frente a terapias combinatorias en estado epiléptico: nuevos datos de modelos preclínicos.Comportamiento de la epilepsia. (2015) 49:20-5. doi: 10.1016/j.yebeh.2015.02.027
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
85. Nashef L. Muerte repentina e inesperada en la epilepsia: terminología y definiciones. Epilepsia. (1997) 38(11Suppl.):S6–8. doi: 10.1111/j.1528-1157.1997.tb06130.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
86. Shankar R, Donner EJ, McLean B, Nashef L, Tomson T. Muerte súbita e inesperada en epilepsia (SUDEP): lo que todo neurólogo debería saber. Disord de epilepsia. (2017) 19:1–9. doi: 10.1684/epd.2017.0891
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
87. Pensel MC, Nass RD, Tauböll E, Aurlien D, Surges R. Prevención de la muerte súbita inesperada en la epilepsia: estado actual y perspectivas futuras. Experto Rev Neurother. (2020) 20:497–508. doi: 10.1080/14737175.2020.1754195
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
88. Huenerfauth E, Nessler J, Erath J, Tipold A. Probable muerte súbita inesperada en perros con epilepsia (SUDED). Ciencia Veterinaria Frontal. (2021) 8:600307. doi: 10.3389/fvets.2021.600307
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
89. Löscher W, Stafstrom CE. Las comorbilidades como factores pronósticos de la epilepintogénesis. En: Engel JJ, Moshé SL, editores, Epilepsia: un libro de texto completo. 3a ed. Filadelfia, PA: Wolters Kluwer (2022).
90. Kanner AM. Manejo de comorbilidades psiquiátricas y neurológicas en la epilepsia. Nat Rev Neurol. (2016) 12:106-16. doi: 10.1038/nrneurol.2015.243
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
91. Lu E, Pyatka N, Burant CJ, Sajatovic M. Revisión sistemática de la literatura sobre las comorbilidades psiquiátricas en adultos con epilepsia. J Clin Neurol. (2021) 17:176–86. doi: 10.3988/jcn.2021.17.2.176
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
92. Packer RM, Volk HA. Epilepsia más allá de las convulsiones: una revisión del impacto de la epilepsia y sus comorbilidades en la calidad de vida relacionada con la salud de los perros. Veterinario Rec. (2015) 177:306-15. doi: 10.1136/vr.103360
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
93. Watson F, Packer RMA, Rusbridge C, Volk HA. Cambios de comportamiento en perros con epilepsia idiopática. Veterinario Rec. (2020) 186:93. doi: 10.1136/vr.105222
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
94. Bhatti SF, De Risio L, Munana K, Penderis J, Stein V, Tipold MA, et al. Propuesta de consenso del Grupo de Trabajo Internacional de Epilepsia Veterinaria: tratamiento médico de la epilepsia canina en Europa. BMC Vet Res. (2015) 11:176. doi: 10.1186/s12917-015-0464-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
95. Löscher W. Modelos animales de epilepsia intratable. Neurobiol Prog. (1997) 53:239-58. doi: 10.1016/S0301-0082(97)00035-X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
96. Löscher W. La farmacocinética de los medicamentos antiepilépticos en ratas: consecuencias para mantener niveles efectivos de medicamentos durante la administración prolongada de medicamentos en modelos de epilepsia de ratas. Epilepsia. (2007) 48:1245–58. doi: 10.1111/j.1528-1167.2007.01093.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
97. Rogawski MA, Löscher W, Rho JM. Mecanismos de acción de los medicamentos anticonvulsivos y la dieta cetogénica. Cold Spring Harb Perspect Med. (2016) 6:a022780. doi: 10.1101/cshperspect.a022780
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
98. Sills GJ, Rogawski MA. Mecanismos de acción de los medicamentos anticonvulsivos utilizados actualmente.Neurofarmacología. (2020) 168:107966. doi: 10.1016/j.neuropharm.2020.107966
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
99. Packer RM, Nye G, Porter SE, Volk HA. Evaluación del uso de levetiracetam en una clínica de epilepsia canina. BMC Vet Res.(2015) 11:25. doi: 10.1186/s12917-015-0340-x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
100. Löscher W, Schmidt D. Evidencia experimental y clínica de pérdida de efecto (tolerancia) durante el tratamiento prolongado con medicamentos antiepilépticos. Epilepsia. (2006) 47:1253–84. doi: 10.1111/j.1528-1167.2006.00607.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
101. Rundfeldt C, Löscher W. La farmacología de la imepitoína: el primer agonista parcial del receptor de benzodiacepinas desarrollado para el tratamiento de la epilepsia. Medicamentos para el SNC. (2014) 28:29–43. doi: 10.1007/s40263-013-0129-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
102. Patsalos PN, Berry DJ, Bourgeois BF, Cloyd JC, Glauser TA, Johannessen SI. Medicamentos antiepilépticos: directrices de mejores prácticas para el monitoreo de medicamentos terapéuticos: un documento de posición de la subcomisión de monitoreo de medicamentos terapéuticos, Comisión de Estrategias Terapéuticas de la ILAE. Epilepsia. (2008) 49:1239–76. doi: 10.1111/j.1528-1167.2008.01561.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
103. Laue-Gizzi H. Interrupción de los medicamentos antiepilépticos en adultos con epilepsia. Aust Prescr. (2021) 44:53–6. doi: 10.18773/austprescr.2021.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
104. Schmidt D, Löscher W. Epilepsia no controlada tras la interrupción de los medicamentos antiepilépticos en pacientes sin convulsiones: una revisión de la experiencia clínica actual. Acta Neurol Scand. (2005) 111:291–300. doi: 10.1111/j.1600-0404.2005.00408.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
105. Gesell FK, Hoppe S, Löscher W, Tipold A. Retirada de medicamentos antiepilépticos en perros con epilepsia. Ciencia Veterinaria Frontal. (2015) 2:23. doi: 10.3389/fvets.2015.00023
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
106. Franco V, francés JA, Peruca E. Desafíos en el desarrollo clínico de nuevos medicamentos antiepilépticos. Pharmacol Res.(2016) 103:95–104. doi: 10.1016/j.phrs.2015.11.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
107. Munana KR, Thomas WB, Inzana KD, Nettifee-Osborne JA, McLucas KJ, Olby NJ, et al. Evaluación del levetiracetam como tratamiento complementario para la epilepsia canina refractaria: un ensayo cruzado aleatorizado, controlado con placebo. J Vet Intern Med. (2012) 26:341–8. doi: 10.1111/j.1939-1676.2011.00866.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
108. Volk HA, Matiasek LA, Lujã¡n Feliu-Pascual A, Platt SR, Chandler KE. La eficacia y tolerabilidad del levetiracetam en perros epilépticos farmacorresistentes. Veterinario J. (2008) 176:310–9. doi: 10.1016/j.tvjl.2007.03.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
109. Löscher W, Hönack D. Desarrollo de la tolerancia durante el tratamiento crónico de ratas encendeñadas con el nuevo medicamento antiepilépticos levetiracetam. Epilepsia. (2000) 41:1499–506. doi: 10.1111/j.1499-1654.2000.001499.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
110. Munana KR, Zhang D, Patterson EE. Efecto placebo en ensayos de epilepsia canina. J Vet Intern Med. (2010) 24:166–70. doi: 10.1111/j.1939-1676.2009.0407.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
111. Goldenholz DM, Goldenholz SR. Respuesta al placebo en ensayos clínicos de epilepsia: viejas ideas y nuevas ideas. Res. de epilepsia (2016) 122:15-25. doi: 10.1016/j.eplepsyres.2016.02.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
112. Schmidt D, Löscher W. Resistencia a los medicamentos en la epilepsia: supuestos mecanismos neurobiológicos y clínicos.Epilepsia. (2005) 46:858–77. doi: 10.1111/j.1528-1167.2005.54904.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
113. Schwabe S. Ensayos comparativos de monoterapia: placebos y comparadores subóptimos. Res. de epilepsia (2001) 45:93–6. doi: 10.1016/S0920-1211(01)00226-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
114. Fredso N, Sabers A, Toft N, Möller A, Berendt M. Un ensayo controlado con fenobarbital de un solo ciego de levetiracetam como monoterapia en perros con epilepsia recién diagnosticada. Veterinario J. (2016) 208:44–9. doi: 10.1016/j.tvjl.2015.10.018
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
115. McGrath S, Bartner LR, Rao S, Packer RA, Gustafson DL. Ensayo clínico controlado ciego aleatorizado para evaluar el efecto de la administración oral de cannabidiol, además del tratamiento antiepilépticos convencional, sobre la frecuencia de convulsiones en perros con epilepsia idiopática intratable. J Am Vet Med Assoc. (2019) 254:1301–8. doi: 10.2460/javma.254.11.1301
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
116. Berk BA, Law TH, Packer RMA, Wessmann A, Bathen-NÃthen A, Jokinen TS, et al. Un ensayo controlado aleatorizado multicéntrico de suplementos dietéticos de triglicéridos de cadena media para la epilepsia en perros. J Vet Intern Med. (2020) 34:1248–59. doi: 10.1111/jvim.15756
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
117. Charalambous M, Van Ham L, Broeckx BJG, Roggeman T, Carrette S, Vonck K. Estimulación magnética transcraneal repetitiva en la epilepsia idiopática resistente a los medicamentos de perros: una técnica de neuroestimulación no invasiva. J Vet Intern Med. (2020) 34:2555–61. doi: 10.1111/jvim.15919
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
118. Royaux E, Van Ham L, Broeckx BJ, Van S, Gielen I, Deforce ID, et al. Fenobarbital o bromuro de potasio como medicamento antiepiléptico adicional para el tratamiento de la epilepsia idiopática canina refractaria a la imepitoína. Veterinario J. (2017) 220:51–4. doi: 10.1016/j.tvjl.2017.01.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
119. Kwan P, Arzimanoglou A, Berg AT, Brodie MJ, Allen HW, Mathern G. Definición de epilepsia resistente a los medicamentos: propuesta de consenso del Grupo de Trabajo ad hoc de la Comisión de Estrategias Terapéuticas de la ILAE. Epilepsia. (2010) 51:1069–77. doi: 10.1111/j.1528-1167.2009.02397.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
120. Löscher W, Potschka H, Sisodiya SM, Vezzani A. Resistencia a los medicamentos en la epilepsia: impacto clínico, mecanismos potenciales y nuevas opciones de tratamiento innovadoras. Pharmacol Rev. (2020) 72:606–38. doi: 10.1124/pr.120.019539
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
121. Potschka H, Fischer A, Löscher W, Volk HA. Fisiopatología de la epilepsia canina resistente a los medicamentos. Vet J. (en imprenta).
122. Munana KR, Nettifee-Osborne JA, Bergman RL, Mealey KL. Asociación entre el genotipo ABCB1 y el resultado de las convulsiones en Collies con epilepsia. J Vet Intern Med. (2012) 26:1358–64. doi: 10.1111/j.1939-1676.2012.01006.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
123. Potschka H, Fischer A, Löscher W, Patterson N, Bhatti S, Berendt M. Propuesta de consenso del grupo de trabajo internacional sobre epilepsia veterinaria: resultado de las intervenciones terapéuticas en la epilepsia canina y felina. BMC Vet Res. (2015) 11:177. doi: 10.1186/s12917-015-0465-y
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
124. Booth S, Meller S, Packer RM, Farquhar R, Maddison JE, Volk HA. Cumplimiento del propietario en la epilepsia canina. Vet Rec. (2021) 188:e16. doi: 10.1002/vetr.16
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
125. Cerda-Gonzalez S, Packer RA, Garosi L, Lowrie M, Mandigers PJJ, O’Brien DP. Declaración de consenso del grupo de trabajo internacional de discinesia canina veterinaria internacional de ECVN: Terminología y clasificación. J Vet Intern Med. (2021) 35:1218–30. doi: 10.1111/jvim.16108
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
127. Simonato M, Agoston DV, Brooks-Kayal A, Dulla C, Fureman B, Henshall DC. Identificación de biomarcadores clínicamente relevantes de la epileptogénesis: una hoja de ruta estratégica. Nat Rev Neurol. (2021) 17:231–42. doi: 10.1038/s41582-021-00461-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
128. Löscher W. El santo grial de la prevención de la epilepsia: enfoques preclínicos de los tratamientos antiepiptogénicos. Neurofarmacología. (2020) 167:107605. doi: 10.1016/j.neuropharm.2019.04.011
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
129. Morita T, Takahashi M, Takeuchi T, Hikasa Y, Ikeda S, Sawada M. Cambios en los neurotransmisores extracelulares en el cerebro de los perros pastores epilépticos idiopáticos familiares utilizando una técnica de microdiálisis intracerebral y un estudio inmunohistoquímico para el metabolismo del glutamato. J Vet Med Sci. (2005) 67:1119-26. doi: 10.1292/jvms.67.1119
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
130. Löscher W, Hirsch LJ, Schmidt D. El enigma del período latente en el desarrollo de la epilepsia adquirida sintomática: visión tradicional frente a nuevos conceptos. Comportamiento de la epilepsia. (2015) 52:78–92. doi: 10.1016/j.yebeh.2015.08.037
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
131. Löscher W, Gernert M, Heinemann U. ¿Tercitaciones celulares y genéticas en avenidas prometedoras para la epilepsia o callejones sin salida? Tendencias Neurociencia. (2008) 31:62–73. doi: 10.1016/j.tins.2007.11.012
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
132. Estey CM, Dewey CW, Rishniw M, Lin DM, Bouma J, Sackman J. Un subconjunto de perros con presunta epilepsia idiopática muestra asimetría hipocampal: una comparación volumétrica con perros no epilépticos que utilizan RMN. Ciencia Veterinaria Frontal. (2017) 4:183. doi: 10.3389/fvets.2017.00183
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
133. Czerwik A, Plonek M, Podgórski P, Wrzosek M. Comparación de los hallazgos electroencefalográficos con la volugrafía por resonancia magnética del hipocampo en perros con epilepsia idiopática. J Vet Intern Med. (2018) 32:2037–44. doi: 10.1111/jvim.15323
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
134. Huaijantug S, Yatmark P, Chinnabrut P, Rueangsawat N, Wongkumlue A, Teerapan W. histograma cerebral cuantitativo de la epilepsia canina mediante resonancia magnética. Acta Radiol. (2021) 62:93–101. doi: 10.1177/0284185120914031
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
135. Nagendran A, McConnell JF, De Risio L, José-López R, Quintana RG, Robinson K, et al. Características de las imágenes de resonancia magnética peri-ictal en perros con sospecha de epilepsia idiopática. J Vet Intern Med. (2021) 35:1008–17. doi: 10.1111/jvim.16058
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
136. Maeso C, Sánchez-Masian D, Ródenas S, Font C, Morales C, Domínguez E. Prevalencia, distribución y asociaciones clínicas de presuntos cambios postictales en las imágenes por resonancia magnética cerebral en perros epilépticos. J Am Vet Med Assoc. (2021) 260:71–81. doi: 10.2460/javma.21.02.0088
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
137. Kuwabara T, Hasegawa D, Kobayashi M, Fujita M, Orima H. Volumen de resonancia magnética clínica del hipocampo en 58 perros epilépticos. Ecografía veterinaria. (2010) 51:485–90. doi: 10.1111/j.1740-8261.2010.01700.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
138. Asada R, Mizuno S, Yu Y, Hamamoto Y, Anazawa T, Ito D, et al. Callosotomía de cuerpo en 3 perros cavalier king charles spaniel con epilepsia resistente a los medicamentos. Brain Sci. (2021) 11:1462. doi: 10.3390/brainsci11111462
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
139. Asada R, Hamamoto Y, Yu Y, Mizuno S, Chambers J, Uchida KK, et al. Lobectomía temporal venentrolateral en perros normales como contraparte de la lobectomía temporal anterior humana: un estudio preliminar sobre el procedimiento quirúrgico y las complicaciones. J Vet Med Sci. (2021) 83:1513–20. doi: 10.1292/jvms.21-0127
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
140. Jones GMC, Volk HA, Packer RMA. Prioridades de investigación para la epilepsia idiopática en perros: puntos de vista de los propietarios, veterinarios de práctica general y especialistas en neurología. J Vet Intern Med. (2021) 35:1466–79. doi: 10.1111/jvim.16144
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
141. Jokinen TS, Haaparanta-Solin M, Viitmaa R, Grönroos TJ, Johansson J, Bergamasco L. FDG-PET en perros Lagotto Romagnolo sanos y epilépticos y cambios en la captación de glucosa en el cerebro con la edad. Ecografía veterinaria. (2014) 55:331–41. doi: 10.1111/vru.12129
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
142. Viitmaa R, Haaparanta-Solin M, Snellman M, Cizinauskas S, Orro T, Kuusela E. Utilización de glucosa cerebral medida con tomografía por emisión de positrones de alta resolución en perros Spitz finlandeses epilépticos y perros sanos. Ecografía veterinaria. (2014) 55:453–61. doi: 10.1111/vru.12147
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
143. Bankstahl M, Bankstahl JP. Los avances recientes en las imágenes de radiotraqueadores tienen potencial para una futura evaluación refinada de la epilepsia en neurología veterinaria. Ciencia Veterinaria Frontal. (2017) 3:218. doi: 10.3389/fvets.2017.00218
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
144. Yamasaki H, Furuoka H, Takechi M, Itakura C. Pérdida neuronal y gliosis en el sistema límbico en un perro epiléptico. Vet Pathol. (1991) 28:540–2. doi: 10.1177/030098589102800614
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
145. Klein P, Dingledine R, Aronica E, Bernard C, Blümcke I, Boison D. Puntos en común en los procesos epileptogénicos de diferentes insultos cerebrales agudos: ¿se traducen? Epilepsia. (2018) 59:37–66. doi: 10.1111/epi.13965
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
146. Borschensky CM, Woolley JS, Kipar A, Herden C. Neurogénesis en un perro joven con convulsiones epilépticas. Vet Pathol.(2012) 49:766–70. doi: 10.1177/0300985811429308
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
147. Zhong Q, Ren BX, Tang FR. Neurogénesis en el hipocampo de pacientes con epilepsia del lóbulo temporal. Curr Neurol Neurosci Rep. (2016) 16:20. doi: 10.1007/s11910-015-0616-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
148. Chen HH, Shiao HT, Cherkassky V. Predicción en línea de incautaciones de plomo a partir de datos de iEEG. Brain Sci. (2021) 11:1554. doi: 10.3390/brainsci11121554
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
149. Buckmaster PS, Smith MO, Buckmaster CL, LeCouteur RA, Dudek FE. Ausencia de patología de epilepsia del lóbulo temporal en perros con epilepsia médicamente intratable. J Vet Intern Med. (2002) 16:95–9. doi: 10.1111/j.1939-1676.2002.tb01612.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
150. Palmer AC. Cambios patológicos en el cerebro asociados con ataques en perros. Veterinario Rec. (1972) 90:167-73. doi: 10.1136/vr.90.7.167
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
151. Andersson B, Olsson SE. Epilepsia en un perro con extensos daños bilaterales en el hipocampo. Acta Vet Scand. (1959) 1:98–104. doi: 10.1186/BF03548532
152. Montgomery DL, Lee AC. Daño cerebral en el perro beagle epiléptico. Vet Pathol. (1983) 20:160–9. doi: 10.1177/030098588302000203
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
153. Potschka H, Fischer A, von Rüden EL, Hülsmeyer V, Baumgärtner W. ¿La epilepsia canina como modelo traslacional? Epilepsia.(2013) 54:571–9. doi: 10.1111/epi.12138
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
154. Matiasek K, Pumarola IB, Rosati M, Fernández-Flores F, Fischer A, Wagner E. Recomendaciones del grupo de trabajo internacional sobre epilepsia veterinaria para el muestreo y procesamiento sistemáticos de cerebros de perros y gatos epilépticos. BMC Vet Res. (2015) 11:216. doi: 10.1186/s12917-015-0467-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
155. Engel JJ. Epilepsia del lóbulo temporal mesial: ¿qué hemos aprendido? Neurocientífico. (2001) 7:340–52. doi: 10.1177/107385840100700410
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
156. Walter RD. Aspectos clínicos de la epilepsia del lóbulo temporal: una revisión. Med de California. (1969) 110:325–9.
157. Meldrum BS. Presente puntos de vista sobre la esclerosis del hipocampo y la epilepsia. Mod Trends Neurol. (1975) 6:223–39.
158. Ribak CE, Gall CM, Mody I. El giro dentado y su papel en las convulsiones. Ámsterdam: Elsevier (1992).
159. Engel J. Introducción a la epilepsia del lóbulo temporal. Res. de epilepsia (1996) 26:141-50. doi: 10.1016/S0920-1211(96)00043-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
160. Löscher W, Ebert U. El papel de la corteza piriforme en el kindling. Neurobiol Prog. (1996) 50:427–81. doi: 10.1016/S0301-0082(96)00036-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
161. Löscher W, Ebert U. Mecanismos básicos de propagación de convulsiones: objetivos para el diseño racional de medicamentos y la polifarmacia racional. Epilepsia Res. (1996) 11:17-44.
162. Chatzikonstantinou A. La epilepsia y el hipocampo. Neurociencia Neurol Frontal. (2014) 34:121–42. doi: 10.1159/000356435
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
163. Scharfman HE. El giro dentado y la epilepsia del lóbulo temporal: una era «emocionante». Epilepsia Curr. (2019) 19:249–55. doi: 10.1177/1535759719855952
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
164. Blümcke I, Thom M, Wiestler OD. Esclerosis del cuerno de Ammon: un trastorno del mal desarrollo asociado con la epilepsia del lóbulo temporal. Cerebro cerebral. (2002) 12:199–211. doi: 10.1111/j.1750-3639.2002.tb00436.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
165. Sutula TP, Dudek FE. Desenmascarar la excitación recurrente generada por la germinación de fibra musgosa en el giro dentado epiléptica: una propiedad emergente de un sistema complejo. Prog Brain Res. (2007) 163:541–63. doi: 10.1016/S0079-6123(07)63029-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
166. Jefferys JG. Esclerosis hipocampal y epilepsia del lóbulo temporal: ¿causa o consecuencia? Cerebro. (1999) 122, 1007–1008. doi: 10.1093/brain/122.6.1007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
167. Walker MC. Esclerosis hipocampo: causas y prevención. Semin Neurol. (2015) 35:193–200. doi: 10.1055/s-0035-1552618
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
168. Barker-Haliski M, White HS. Mecanismos glutamatérgicos asociados con las convulsiones y la epilepsia. Cold Spring Harb Perspect Med. (2015) 5:a022863. doi: 10.1101/cshperspect.a022863
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
169. Bradford HF. GABA y epilepsia. Progr Neurobiol. (1995) 47:477–511. doi: 10.1016/0301-0082(95)00030-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
170. Fritschy JM. Epilepsia, equilibrio E/I y plasticidad del receptor GABA(A). Front Mol Neurosci. (2008) 1:5. doi: 10.3389/neuro.02.005.2008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
171. Löscher W, Hoffmann K, Twele F, Potschka H, Töllner K. El nuevo medicamento antiepiléptico imepitoína se compara favorablemente con otros medicamentos miméticos GABA en un modelo de umbral de convulsiones en ratones y perros.Pharmacol Res. (2013) 77:39-46. doi: 10.1016/j.phrs.2013.09.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
172. Holmes GL. Papel del glutamato y el GABA en la fisiopatología de la epilepsia. Ment Retard Developm Disab Res Rev. (1995) 1:208-19. doi: 10.1002/mrdd.1410010309
173. Löscher W, Kaila K. Farmacología del SNC de los inhibidores de la NKCC1. Neurofarmacología. (2022) 205:108910. doi: 10.1016/j.neuropharm.2021.108910
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
174. Greenfield LJ Jr. Mecanismos moleculares de la actividad del fármaco antiseconvulsivo en los receptores GABAA. Incautación. (2013) 22:589–600. doi: 10.1016/j.seizure.2013.04.015
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
175. Durante MJ, Spencer DD. Glutamato hipocampal extracelular y convulsiones espontáneas en el cerebro humano consciente.Lancet. (1993) 341:1607-10. doi: 10.1016/0140-6736(93)90754-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
176. Wilson CL, Maidment NT, Shomer MH, Behnke EJ, Ackerson L, Fried I. Comparación de la liberación de aminoácidos relacionada con las convulsiones en el hipocampo epiléptico humano con un modelo crónico de epilepsia hipocampal de rata kainata. Res. de epilepsia (1996) 26:245–54. doi: 10.1016/S0920-1211(96)00057-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
177. Thomas PM, Phillips JP, Delanty N, O’Connor WT. Niveles extracelulares elevados de glutamato, aspartato y ácido gamma-aminobutírico dentro del hipocampo humano intraoperatorio, espontáneamente epiléptica. Res. de epilepsia (2003) 54:73–9. doi: 10.1016/S0920-1211(03)00035-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
178. Cavus I, Pan JW, Hetherington HP, Abi-Saab W, Zaveri HP, Vives KP. La disminución del volumen del hipocampo en la resonancia magnética se asocia con un aumento del glutamato extracelular en pacientes con epilepsia. Epilepsia. (2008) 49:1358–66. doi: 10.1111/j.1528-1167.2008.01603.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
179. Cavus I, Romanyshyn JC, Kennard JT, Farooque P, Williamson A, Eid T. Glutamato basal elevado y glutamina y GABA inalteradas en la epilepsia refractaria: estudio de microdiálisis de 79 pacientes en el programa de cirugía de epilepsia yale. Ann Neurol. (2016) 80:35-45. doi: 10.1002/ana.24673
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
180. Ronne-Engström E, Hillered L, Flink R, Spännare B, Ungerstedt U, Carlson H. Microdiálisis intracerebral de aminoácidos extracelulares en el foco epiléptico humano. J Cereb Blood Flow Metab. (1992) 12:873–6. doi: 10.1038/jcbfm.1992.119
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
181. Durante MJ, Ryder KM, Spencer DD. Función del transportador GABA del hipocampo en la epilepsia del lóbulo temporal.Naturaleza. (1995) 376:174–7. doi: 10.1038/376174a0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
182. Peterson AR, Binder DK. Absorción y señalización de glutamato de astrocitos como nuevos objetivos para la terapia antiepiptogénica. Neurol frontal. (2020) 11:1006. doi: 10.3389/fneur.2020.01006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
183. Ranjeva JP, Confort-Gouny S, Le Fur Y, Cozzone PJ. Espectroscopia de resonancia magnética del cerebro en la epilepsia.Sistema Nervioso Infantil. (2000) 16:235-41. doi: 10.1007/s003810050504
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
184. Petroff OAC, Rothman DL, Behar KL, Mattson RH. El bajo nivel de GABA cerebral se asocia con un mal control de las convulsiones. Ann Neurol. (1996) 40:908-11. doi: 10.1002/ana.410400613
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
185. Petroff OAC, Rothman DL. Medición de los efectos de la GABA en el cerebro humano in vivo de la inhibición de la GABA-transaminasa con vigabatrina.Mol Neurobiol. (1998) 16:97–121. doi: 10.1007/BF02740605
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
186. Petroff OA, Rothman DL, Behar KL, Hyder F, Mattson RH. Efectos del valproato y otros medicamentos antiepilépticos sobre el glutamato cerebral, la glutamina y el GABA en pacientes con convulsiones parciales del complejo refractario. Incautación.(1999) 8:120–7. doi: 10.1053/seiz.1999.0267
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
187. Neppl R, Nguyen CM, Bowen W, Al Saadi T, Pallagi J, Morris G. Detección in vivo de perturbaciones postictales del metabolismo cerebral mediante el uso de espectroscopia de RM de protones: resultados preliminares en un modelo canino de convulsiones generalizadas prolongadas. Soy J Neuroradiol. (2001) 22:1933–43.
188. Böhlen P, Huot S, Palfreyman MG. La relación entre las concentraciones de GABA en el cerebro y el líquido cefalorraquídeo.Cerebro Res. (1979) 167:297–305. doi: 10.1016/0006-8993(79)90824-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
189. Löscher W. Un estudio comparativo de la unión a proteínas de los medicamentos anticonvulsivos en el suero de perros y hombres. J Pharmacol Exp Ther. (1979) 208:429–35.
190. Löscher W. Relación entre las concentraciones de GABA en el líquido cefalorraquídeo y la excitabilidad por convulsiones. J Neurochem. (1982) 38:293–5. doi: 10.1111/j.1471-4159.1982.tb10886.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
191. Löscher W. Farmacología básica del valproato: una revisión después de 35 años de uso clínico para el tratamiento de la epilepsia. Medicamentos para el SNC. (2002) 16:669–94. doi: 10.2165/00023210-200216100-00003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
192. Löscher W. GABA en plasma, LCR y cerebro de perros durante el tratamiento agudo y crónico con GABA y-acetilénico y ácido valproico. En: Okada Y, Roberts E, editores, Problemas en la investigación GABA – Del cerebro a las bacterias. Amsterdam: Exerpta Medica (1982). p. 101-9.
193. Wood JH, Hare TA, Glaeser BS, Ballenger JC, Post RM. Bajo contenido de ácido gamma-aminobutírico del líquido cefalorraquídeo en pacientes con convulsiones. Neurología. (1979) 29:1203–8. doi: 10.1212/WNL.29.9_Part_1.1203
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
194. Löscher W, Schwartz-Porsche D. Bajos niveles de ácido y-aminobutírico en el líquido cefalorraquídeo de perros con epilepsia.J Neurochem. (1986) 46:1322–5. doi: 10.1111/j.1471-4159.1986.tb00658.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
195. Löscher W. Alteraciones en los niveles de GABA de LCR y susceptibilidad a las convulsiones durante la administración repetida de pentetrazol en perros. Efectos del GABA y-acetilénico, el ácido valproico y el fenobarbital. Neurochem Int. (1983) 5:405–12. doi: 10.1016/0197-0186(83)90069-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
196. Clasificación D, Siemes H, Löscher WL. concentración en niños con convulsiones febriles, epilepsia no tratada y meningitis. J Neurol. (1983) 230:217-25. doi: 10.1007/BF00313697
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
197. Löscher W, Siemes H. El ácido valproico aumenta el ácido y-aminobutírico en el LCR de los niños epilépticos. Lancet. (1984). II:225. doi: 10.1016/S0140-6736(84)90509-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
198. Löscher W, Siemes H. Niveles de ácido y-aminobutírico del líquido cefalorraquídeo en niños con diferentes tipos de epilepsia: efecto del tratamiento anticonvulsivo. Epilepsia. (1985) 26:314–9. doi: 10.1111/j.1528-1157.1985.tb05656.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
199. Löscher W, Clasificación D, Siemes H. GABA en el líquido cefalorraquídeo de niños con convulsiones febriles. Epilepsia. (1981) 22:697–702. doi: 10.1111/j.1528-1157.1981.tb04143.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
200. Crawford PM, Chadwick DW. Concentraciones de GABA y aminoácidos en el LCR lumbar en pacientes con epilepsia tratada y no tratada. Res. de epilepsia (1987) 1:328–38. doi: 10.1016/0920-1211(87)90057-X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
201. Araki K, Harada M, Ueda Y, Takino T, Kuriyama K. Alteración del contenido de aminoácidos del líquido cefalorraquídeo de pacientes con epilepsia. Acta Neurol Scand. (1988) 78:473–9. doi: 10.1111/j.1600-0404.1988.tb03690.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
202. Pitkänen A, Matilainen R, Halonen T, Kutvonen R, Hartikainen P, Riekkinen P. Aminoácidos hibidores y excitatorios en el líquido cefalorraquídeo de pacientes epilépticos crónicos. J Neural Transm. (1989) 76:221-30. doi: 10.1007/BF01260507
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
203. Devinsky O, Emoto S, Nadi NS, Theodore WH. Niveles de líquido cefalorraquídeo de neuropéptidos, cortisol y aminoácidos en pacientes con epilepsia. Epilepsia. (1993) 34:255–61. doi: 10.1111/j.1528-1157.1993.tb02407.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
204. Creevy KE, Gagnepain JF, Platt SR, Edwards GL, Kent M. Comparación de las concentraciones de ácido Î3-aminobutírico y glutamato en el líquido cefalorraquídeo de perros con epilepsia idiopática con y sin resonancia magnética relacionadas convulsiones en áreas hiperintensas en el sistema límbico. Am J Vet Res. (2013) 74:1118–25. doi: 10.2460/ajvr.74.8.1118
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
205. Löscher W, Schmidt D. Monitoreo del ácido y-aminobutírico en el líquido cefalorraquídeo humano: revisión a la baja de los valores de control anteriores. Su Droga Monit. (1984) 6:227–31. doi: 10.1097/00007691-198406000-00017
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
206. Mahmoud AT, Abdel-Tawab AM. Niveles de ácido gamma aminobutírico (GABA) y glutamato en el LCR de los niños epilépticos. Alexandria J Pediatr. (1999) 13:423–7.
207. Nkinin SW, Tang PH, Hallinan B, Setchell KDR. Líquido cefalorraquídeo (LCR) de la población pediátrica medido por LC/MS. En: Póster en la Asociación de Espectrometría de Masas: Aplicaciones al laboratorio clínico (MSACL), del 9 al 13 de febrero de 2013. San Diego, CA (2013).
208. Podell M, Hadjiconstantinou M. Valores de ácido gamma-aminobutírico y glutamato del líquido cefalorraquídeo en perros con epilepsia. Am J Vet Res. (1997) 58:451-6.
209. Ellenberger C, Mevissen M, Doherr M, Scholtysik G, Jaggy A. Neurotransmisores inhibitorios y excitatorios en el líquido cefalorraquídeo de perros epilépticos. Am J Vet Res. (2004) 65:1108–13. doi: 10.2460/ajvr.2004.65.1108
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
210. Podell M, Hadjiconstantinou M. Las bajas concentraciones de GABA de líquido cefalorraquídeo se correlacionan con una respuesta reducida a la terapia con fenobarbital en la epilepsia canina primaria. J Vet Intern Med. (1999) 13:89–94. doi: 10.1111/j.1939-1676.1999.tb01135.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
211. Halonen T, Lehtinen M, Pitkänen A, Ylinen A, Riekkinen PJ. Aminoácidos inhibitorios y excitatorios en el LCR de pacientes que sufren convulsiones parciales complejas durante el tratamiento crónico con gamma-vinilo GABA (vigabatrina). Res. de epilepsia (1988) 2:246–52. doi: 10.1016/0920-1211(88)90015-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
212. Pitkänen A, Matilainen R, Ruutiainen T, Lehtinen M, Riekkinen P. Efecto de la vigabatrina (Gamma-vinil GABA) sobre los niveles de aminoácidos en el LCR de los pacientes epilépticos. J Neurol Neurosurg Psychiatry. (1988) 51:1395–400. doi: 10.1136/jnnp.51.11.1395
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
213. Eriksson AS, O’Connor WT. Análisis de los aminoácidos del LCR en pacientes jóvenes con epilepsia refractaria generalizada durante un estudio adicional con lamotrigina. Res. de epilepsia (1999) 34:75–83. doi: 10.1016/S0920-1211(98)00102-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
214. Ben Menachem E, Persson LI, Schechter PJ, Haegele KD, Huebert N, Hardenberg J. El efecto de los diferentes regímenes de tratamiento con vigabatrina sobre la bioquímica del LCR y el control de las convulsiones en pacientes epilépticos. Br J Clin Pharmacol. (1989) 27(Suppl.1):79S−85S. doi: 10.1111/j.1365-2125.1989.tb03466.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
215. Riekkinen PJ, Ylinen A, Halonen T, Sivenius J, Pitkanen A. GABA del líquido cefalorraquídeo y control de convulsiones con vigabatrina. Br J Clin Pharmacol. (1989) 27(Suppl.1):87S−94S. doi: 10.1111/j.1365-2125.1989.tb03467.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
216. Dahlin M, Elfving A, Ungerstedt U, Amark P. La dieta cetogénica influye en los niveles de aminoácidos excitatorios e inhibitorios en el LCR en niños con epilepsia refractaria. Res. de epilepsia (2005) 64:115-25. doi: 10.1016/j.eplepsyres.2005.03.008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
217. Cuela CM. Niveles de aminoácidos libres en el líquido cefalorraquídeo de los seres humanos normales y su variación en casos de epilepsia y enfermedad de Spielmeyer-Vogt-Batten. J Neurochem. (1974) 23:595–600. doi: 10.1111/j.1471-4159.1974.tb06064.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
218. Kälviäinen R, Halonen T, Pitkänen A, Riekkinen PJ. Niveles de aminoácidos en el líquido cefalorraquídeo de pacientes epilépticos recién diagnosticados: efecto de las monoterapias con vigabatrina y carbamazepina. J Neurochem. (1993) 60:1244-50. doi: 10.1111/j.1471-4159.1993.tb03283.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
219. Rainesalo S, Keränen T, Palmio J, Peltola J, Oja SS, Saransaari P. Aminoácidos plasmáticos y del líquido cefalorraquídeo en pacientes epilépticos. Neurochem Res. (2004) 29:319–24. doi: 10.1023/B:NERE.0000010461.34920.0c
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
220. Hasegawa T, Sumita M, Horitani Y, Tamai R, Tanaka K, Komori M. Perfil metabólico basado en cromatografía de gases y espectrometría de masas del líquido cefalorraquídeo de perros epilépticos. J Vet Med Sci. (2014) 76:517-22. doi: 10.1292/jvms.13-0520
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
221. Löscher W, Schmidt D. Aumento del GABA de plasma humano por valproato de sodio. Epilepsia. (1980) 21:611–5. doi: 10.1111/j.1528-1157.1980.tb04314.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
222. Löscher W, Schmidt D. Niveles plasmáticos de GABA en pacientes neurológicos en tratamiento con ácido valproico. Ciencia de la vida. (1981) 28:2383–8. doi: 10.1016/0024-3205(81)90504-X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
223. Löscher W, Gram L, Stefan H. Plasma GABA y control de convulsiones con vigabatrina. Lancet. (1993) 341:117. doi: 10.1016/0140-6736(93)92596-L
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
224. Löscher W, Fassbender CP, Gram L, Gramer M, Hörstermann D, Zahner B. Determinación de GABA y vigabatrina en plasma humano mediante un método de HPLC rápido y simple: correlación entre la respuesta clínica a la vigabatrina y el aumento del plasma GABA.Epilepsia Res. (1993) 14:245–55. doi: 10.1016/0920-1211(93)90049-D
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
225. Erdal J, Gram L, Alving J, Löscher W. Cambios en la concentración plasmática de GABA durante el tratamiento con vigabatrina de la epilepsia: un estudio prospectivo. Res. de epilepsia (1999) 34:145–50. doi: 10.1016/S0920-1211(98)00112-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
226. Schmidt D, Löscher W. Ácido y aminobutírico del líquido cefalorraquídeo y cefalorraquídeo en trastornos neurológicos. J Neurol Neurosurg Psychiatry. (1982) 45:931–5. doi: 10.1136/jnnp.45.10.931
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
227. Schür RR, Boks MP, Geuze E, Prinsen HC, Verhoeven-Duif NM, Joels M. Desarrollo de psicopatología en las fuerzas armadas desplegadas en relación con los niveles de GABA en plasma. Psiconeuroendocrinología. (2016) 73:263–70. doi: 10.1016/j.psyneuen.2016.08.014
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
228. Arditte Hall KA, DeLane SE, Anderson GM, Lago TR, Shor R, Wang W, et al. Niveles de ácido gamma-aminobutírico plasmático (GABA) y síntomas del trastorno de estrés postraumático en mujeres expuestas al trauma: un informe preliminar.Psicofarmacología. (2021) 238:1541–52. doi: 10.1007/s00213-021-05785-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
229. Saleem TH, Nassar AY, El-Tallawy HN, Dahpy MA. Papel del perfil de los aminoácidos plasmáticos en la patogénesis y predicción de la gravedad en pacientes con epilepsia resistente a los medicamentos. Egyp J Hosp Med. (2019) 77:4681–7. doi: 10.21608/ejhm.2019.45934
230. Tillakaratne NJ, Medina-Kauwe L, Gibson KM. Metabolismo del ácido gamma-aminobutírico (GABA) en los tejidos neurales y no neuronales de mamíferos. Comp Biochem Physiol A Physiol. (1995) 112:247–63. doi: 10.1016/0300-9629(95)00099-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
231. Ferkany JW, Smith LA, Seifert WE, Caprioli RM, Enna SJ. Medición del ácido gamma-aminobutírico (GABA) en la sangre.Ciencia de la vida. (1978) 22:21-21–8. doi: 10.1016/0024-3205(78)90456-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
232. Ferkany JW, Butler IJ, Enna SJ. Efecto de los medicamentos en el cerebro de la rata, el líquido cefalorraquídeo y el contenido de GABA en sangre. J Neurochem. (1979) 33:29–33. doi: 10.1111/j.1471-4159.1979.tb11702.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
233. Arteaga R, Herranz JL, Armijo JA. GABA-transaminasa plaquetaria en niños epilépticos: influencia de la epilepsia y los anticonvulsivos. Epilepsia Res. (1993) 14:73-85. doi: 10.1016/0920-1211(93)90076-J
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
234. Arteaga R, Herranz JL, Valdizán EM, Armijo JA. Gamma-vinil GABA (vigabatrina): relación entre la dosis, las concentraciones plasmáticas, la inhibición de la GABA-transaminasa plaquetaria y la reducción de las convulsiones en niños epilépticos.Epilepsia. (1992) 33:923–31. doi: 10.1111/j.1528-1157.1992.tb02202.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
235. Valdizan EM, Garcia AP, Armijo JA. Curso temporal de los efectos GABAérgicos de la vigabatrina: ¿el curso temporal del GABA cerebral está relacionado con la inhibición de la GABA-transaminasa de plaquetas? Epilepsia. (1999) 40:1062–9. doi: 10.1111/j.1528-1157.1999.tb00820.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
236. Kumlien E, Sherif F, Ge L, Oreland L. Actividades plaquetarias y cerebrales GABA-transaminasa y monoaminooxidasa en pacientes con convulsiones parciales complejas. Res. de epilepsia (1995) 20:161–70. doi: 10.1016/0920-1211(94)00069-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
237. Rainesalo S, Saransaari P, Peltola J, Keränen T. Absorción de GABA y actividad de la GABA-transaminasa en plaquetas de pacientes epilépticos. Res. de epilepsia (2003) 53:233–9. doi: 10.1016/S0920-1211(03)00030-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
238. Kaneez FS, Saeed SA. Investigando el GABA y su función en las plaquetas en comparación con las neuronas. Plaquetas.(2009) 20:328-33. doi: 10.1080/09537100903047752
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
239. Crawshaw AA, Robertson NP. El papel de TSPO PET en la evaluación de la neuroinflamación. J Neurol. (2017) 264:1825–7. doi: 10.1007/s00415-017-8565-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
240. Van Camp N, Lavisse S, Roost P, Gubinelli F, Hillmer A, Boutin H. TSPO imagina modelos animales de enfermedades cerebrales. Eur J Nucl Med Mol Imaging. (2021) 49:77–109. doi: 10.1007/s00259-021-05379-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
241. Lach P, Klus W, Zajdel K, Szeleszczuk A, Komorowska E, Burda K. Neuroinflamación en la epilepsia: perspectivas diagnósticas y terapéuticas. Curr Pharmacol Rep. (2022) 8:31-5. doi: 10.1007/s40495-021-00270-9
242. Thomas WB. Enfermedades inflamatorias del sistema nervioso central en perros. Clin Tech Small Anim Pract. (1998) 13:167–78. doi: 10.1016/S1096-2867(98)80038-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
243. Koo Y, Kim H, Yun T, Jung DI, Kang JH, Chang D. Evaluación de la concentración del grupo sérico de alta movilidad box 1 en perros con epilepsia: un estudio de casos y controles. J Vet Intern Med. (2020) 34:2545–54. doi: 10.1111/jvim.15940
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
244. Kostic D, Carlson R, Henke D, Rohn K, Tipold A. Evaluación de los niveles de IL-1Î2 en epilepsia y lesión cerebral traumática en perros. BMC Neurosci. (2019) 20:29. doi: 10.1186/s12868-019-0509-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
245. Merbl Y, Sommer A, Chai O, Aroch I, Zimmerman G, Friedman A. Concentraciones de factor de necrosis tumoral-α e interleucina-6 en el líquido cefalorraquídeo de los perros después de las convulsiones. J Vet Intern Med. (2014) 28:1775–81. doi: 10.1111/jvim.12462
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
246. Löscher W, Friedman A. Alteraciones estructurales, moleculares y funcionales de la barrera hematoencefálica durante la epileptogénesis y la epilepsia: ¿causa, consecuencia o ambas? Int J Mol Sci. (2020) 21:591. doi: 10.3390/ijms21020591
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
247. Heinemann U, Kaufer D, Friedman A. Disfunción de la barrera hematoencefálica, señalización de TGFbeta y disfunción de los astrocitos en la epilepsia. Glia. (2012) 60: 121-51-7. doi: 10.1002/glia.22311
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
248. Veksler R, Shelef I, Friedman A. Imágenes de la barrera hematoencefálica en neuropatologías humanas. ARCH MED RES.(2014) 45:646–52. doi: 10.1016/j.arcmed.2014.11.016
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
249. Hanael E, Veksler R, Friedman A, Bar-Klein G, Senatorov VV, Kaufer D, et al. Disfunción de la barrera hematoencefálica en las convulsiones epilépticas caninas detectadas por resonancia magnética dinámica con contraste. Epilepsia. (2019) 60:1005–16. doi: 10.1111/epi.14739
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
250. Ellis CA, Petrovski S, Berkovic SF. Genética de la epilepsia: impactos clínicos y conocimientos biológicos. Lancet Neurol.(2020) 19:93–100. doi: 10.1016/S1474-4422(19)30269-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
251. O’Brien DP, Leeb T. Pruebas de ADN en enfermedades neurológicas. J Vet Intern Med. (2014) 28:1186–98. doi: 10.1111/jvim.12383
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
252. Hayward JJ, Castelhano MG, Oliveira KC, Corey E, Balkman C, Baxter TL. Mapeo de enfermedades complejas y fenotipos en el perro doméstico. Nat Commun. (2016) 7:10460. doi: 10.1038/ncomms10460
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
253. Cui ZJ, Liu YM, Zhu Q, Xia J, Zhang HY. Explorando la patogénesis de la epilepsia canina utilizando un método de genética de sistemas e implicaciones para el descubrimiento de medicamentos contra la epilepsia. Oncotarget. (2018) 9:13181–92. doi: 10.18632/oncotarget.23719
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
254. Hytönen MK, Sarviaho R, Jackson CB, Syrjä P, Jokinen T, Matiasek K. La deleción en el marco en PITRM1 canino se asocia con una epilepsia de inicio temprano grave, disfunción mitocondrial y neurodegeneración. Hum Genet. (2021) 140:1593–609. doi: 10.1007/s00439-021-02279-y
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
255. Wielaender F, Sarviaho R, James F, Hytönen MK, Cortez MA, Kluger G. Epilepsia mioclónica generalizada con fotosibilidad en perros jóvenes causada por una familia DIRAS defectuosa GTPase 1. Proc Natl Acad Sci USA. (2017) 114:2669–74. doi: 10.1073/pnas.1614478114
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
256. Wielaender F, James FMK, Cortez MA, Kluger G, Neßler JN, Tipold A. Las convulsiones de ausencia como una característica de la epilepsia mioclónica juvenil en perros rodianos. J Vet Intern Med. (2018) 32:428-32. doi: 10.1111/jvim.14892
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
257. Koestner A, Rehfeld CE. Epilepsia idiopática en una colonia de beagle. ANL-7535 ANL Rep 1968. (1968) 178-9.
258. Redman HC, Weir JE. Detección de trastornos neurológicos naturales de perros beagle mediante electroencefalografía. Am J Vet Res. (1969) 30:2075–82.
259. Edmonds HL, Bellin SI, Chen FC, Hegreberg GA. Propiedades anticonvulsivas de la ropizina en perros beagle epilépticos y no epilépticos. Epilepsia. (1978) 19:139–46. doi: 10.1111/j.1528-1157.1978.tb05024.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
260. WC Wiederholt. Análisis electrofisiológico de beagles epilépticos. Neurología. (1974) 24:149–55. doi: 10.1212/WNL.24.2.149
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
261. van Gelder NM, Edmonds HL, Hegreberg GA, Chatburn CC, Clemmons RM, Sylvester DM. Cambios en los aminoácidos en una cepa genética de perros beagle epilépticos. J Neurochem. (1980) 35:1087–91. doi: 10.1111/j.1471-4159.1980.tb07862.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
262. Morita T, Shimada A, Ohama E, Umemura T, Fukuda S. Degeneración vacuolar oligodendroglial en las cortezas motoras bilaterales y astrocitosis en perros beagle epilépticos. J Vet Med Sci. (1999) 61:107–11. doi: 10.1292/jvms.61.107
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
263. Hegreberg GA, Padgett GA. Herencia de la epilepsia progresiva del perro con comparaciones con la enfermedad del hombre de Lafora. Fed Proc. (1976) 35:122-05.
264. Nitschke F, Ahonen SJ, Nitschke S, Mitra S, Minassian BA. Enfermedad de Lafora: desde la patogénesis hasta las estrategias de tratamiento. Nat Rev Neurol. (2018) 14:606-17. doi: 10.1038/s41582-018-0057-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
265. von Klopmann T, Ahonen S, Espadas-Santiuste I, Matiasek K, Sanchez-Masian D, Rupp S. Enfermedad de la lafora canina: un trastorno de expansión repetida inestable. La vida. (2021) 11:689. doi: 10.3390/life11070689
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
266. Flegel T, Kornberg M, Mühlhause F, Neumann S, Fischer A, Wielaender F. Una serie retrospectiva de casos de signos clínicos en 28 Beagles con enfermedad de Lafora. J Vet Intern Med. (2021) 35:2359–65. doi: 10.1111/jvim.16255
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
267. Frank L, Lupke M, Kostic D, Löscher W, Tipold A. Volumen de materia gris en águilas sanas y epilépticas utilizando morfometría basada en voxel, un estudio piloto. BMC Vet Res. (2018) 14:50. doi: 10.1186/s12917-018-1373-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
268. Löscher W, Potschka H, Rieck S, Tipold A, Rundfeldt C. Eficacia anticonvulsiva del agonista del receptor parcial de benzodiazepinas de baja afinidad ELB 138 en un modelo de convulsiones canina y en perros epilépticos con convulsiones espontáneamente recurrentes. Epilepsia. (2004) 45:1228–39. doi: 10.1111/j.0013-9580.2004.21204.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
269. Löscher W. Evaluación preclínfica de la actividad de los fármacos proconvulsivos y su relevancia para predecir eventos adversos en humanos. Eur J Pharmacol. (2009) 610:1-11. doi: 10.1016/j.ejphar.2009.03.025
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
270. Ramanjaneyulu R, Ticku MK. Interacciones de los análogos del pentametilenotetrazol y el tetrazol con el sitio de picrotoxina del complejo receptor-ionóforo benzodiazepina-GABA. Eur J Pharmacol. (1984) 98:337-45. doi: 10.1016/0014-2999(84)90282-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
271. Frey HH, Philippin HP, Scheuler W. Desarrollo de tolerancia al efecto anticonvulsivo del diazepam en perros. Eur J Pharmacol.(1984) 104:27–38. doi: 10.1016/0014-2999(84)90365-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
272. Scherkl R, Scheuler W, Frey HH. Efecto anticonvulsivo del clonazepam en el perro: desarrollo de tolerancia y dependencia física. Arch Int Pharmacodyn Ther. (1985) 278:249-60.
273. Löscher W, Hönack D, Scherkl R, Hashem A, Frey HH. Farmacocinética, eficacia anticonvulsiva y efectos adversos del b-carbolina abecarnil, un nuevo ligando para los receptores de benzodiacepinas, después de la administración aguda y crónica en perros. J Pharmacol Exp Ther. (1990) 255:541–8.
274. Löscher W, Klitgaard H, Twyman RE, Schmidt D. Nuevas vías para el descubrimiento y desarrollo de medicamentos antiepilépticos. Nat Rev Drug Discov. (2013) 12:757–76. doi: 10.1038/nrd4126
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
275. Bircher RP, Kanai T, Wang SC. Relación dosis-efecto intravenosa, cortical e intraventricular de pentilentetrazol, picrotoxina y deslanosido en perros. Electroencephalogr Clin Neurophysiol. (1962) 14:256–67. doi: 10.1016/0013-4694(62)90035-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
276. Dürmüller N, Guillaume P, Lacroix P, Porsolt RD, Moser P. El uso del electroencefalograma (EEG) para perros en farmacología de seguridad para evaluar el riesgo de proconvulsivo. J Métodos de Pharmacol Toxicol. (2007) 56:234–8. doi: 10.1016/j.vascn.2007.03.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
277. Bassett L, Troncy E, Pouliot M, Paquette D, Ascah A, Authier S. Videoelectroencefalografía de telemetría (EEG) en ratas, perros y primates no humanos: métodos en las evaluaciones de responsabilidad por convulsiones de farmacología de seguridad de seguimiento. J Métodos de Pharmacol Toxicol. (2014) 70:230-40. doi: 10.1016/j.vascn.2014.07.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
278. Gloor P. Acción epiptogénica de la penicilina. Ann N Y Acad Sci. (1969) 166:350–60. doi: 10.1111/j.1749-6632.1969.tb46405.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
279. Binnie CD, van Emde BW, Wauquier A. Picos geniculados durante las convulsiones epilépticas inducidas en perros por pentilentetrazol y biculina. Electroencephalogr Clin Neurophysiol. (1985) 61:40–9. doi: 10.1016/0013-4694(85)91071-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
280. Zabara J. Inhibición de las convulsiones experimentales en caninos mediante la estimulación vagal repetitiva. Epilepsia. (1992) 33:1005–12. doi: 10.1111/j.1528-1157.1992.tb01751.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
281. Devanand DP, Dwork AJ, Hutchinson ER, Bolwig TG, Sackeim HA. ¿La ECT altera la estructura cerebral? Soy Psiquiatría. (1994) 151:957–70. doi: 10.1176/ajp.151.7.957
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
282. McKinney WT. Terapia electroconvulsiva y modelos animales de depresión. Ann N Y Acad Sci. (1986) 462:65–9. doi: 10.1111/j.1749-6632.1986.tb51240.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
283. Anton AH, Uy DS, Redderson CL. Bloqueo automático y la respuesta cardiovascular y de catecolaminas al electrochoque.Anesth Analg. (1977) 56:46–54. doi: 10.1213/00000539-197701000-00013
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
284. Territo PR, Shannon HE, Newhall K, Barnhart SD, Peters SC, Engleking DR. Análisis farmacocinético/farmacodinámico de efectos mixtos no lineales del ameltolida anticonvulsivo (LY201116) en un modelo de convulsiones canina. J Vet Pharmacol Ther. (2008) 31:562–70. doi: 10.1111/j.1365-2885.2008.00995.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
285. Territo PR, Freise KJ, Newhall K, Barnhart SD, Peters SC, Engleking DR. Desarrollo y validación del modelo máximo de convulsiones de electrochoque en perros. J Vet Pharmacol Ther. (2007) 30:508-15. doi: 10.1111/j.1365-2885.2007.00906.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
286. Walker AE, Johnson HC, Kollros JJ. Convulsiones de penicilina; los efectos convulsivos de la penicilina aplicada a la corteza cerebral del mono y el hombre. Surg Gynecol Obstet. (1945) 81:692–701.
287. Príncipe DA. Medicamentos convulsivos ínicos y antagonistas metabólicos. En: Purpura DP, Penry JK, Tower D, Woodbury DM, Walter R, editores, Experimental Models of Epilepsy—A Manual for the Laboratory Worker. Nueva York, NY: Raven Press (1972). p. 51-84.
288. Fisher RS. Modelos animales de las epilepsias. Brain Res Rev. (1989) 14:245–78. doi: 10.1016/0165-0173(89)90003-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
289. Velisek L. Modelos de convulsiones agudas inducidas químicamente. En: Pitkänen A, Schwartzkroin PA, Moshé SL, editores, Modelos de convulsiones y epilepsia. Ámsterdam: Elsevier (1996). p. 127-52. doi: 10.1016/B978-012088554-1/50013-X
290. Borges LF, Gücer G. Efecto del magnesio en los focos epilépticos. Epilepsia. (1978) 19:81–91. doi: 10.1111/j.1528-1157.1978.tb05015.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
291. Patwardhan RV, Tubbs RS, Killingsworth CR, Rollins DL, Smith WM, Ideker RE. Noveno estímulo del nervio craneal para el control de la epilepsia. Parte 1: eficacia en un modelo animal. Pediatr Neurosurg. (2002) 36:236–43. doi: 10.1159/000058426
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
292. Hasegawa D, Orima H, Fujita M, Hashizume K, Tanaka T. Epilepticus de estado parcial complejo inducido por una microinyección de ácido kaínico en la amígdala unilateral en perros y su daño cerebral. Cerebro Res. (2002) 955:174–82. doi: 10.1016/S0006-8993(02)03430-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
293. Henshall DC. Modelos epilépticos post-estado: ácido kaínico focal. En: Pitkänen A, Buckmaster PS, Galanopoulou AS, Moshé SL, editores. Modelos de convulsiones y epilepsia. 2a ed. Londres: Academic Press (2017). p. 611–24. doi: 10.1016/B978-0-12-804066-9.00042-0
294. Hasegawa D, Orima H, Fujita M, Nakamura S, Takahashi K, Ohkubo S. Imágenes ponderadas por difusión en el estado parcial del complejo epilepticus inducido por ácido caínico en perros. Cerebro Res. (2003) 983:115–27. doi: 10.1016/S0006-8993(03)03041-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
295. Hasegawa D, Matsuki N, Fujita M, Ono K, Orima H. Cinética del glutamato y el ácido gamma-aminobutírico en el líquido cefalorraquídeo en un modelo canino de estado complejo epileptico parcial inducido por el ácido kaínico. J Vet Med Sci.(2004) 66:1555–9. doi: 10.1292/jvms.66.1555
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
296. Sato M, Racine RJ. McIntyre DC. Encanilla: mecanismos básicos y validez clínica. Electroenceph Clin Neurophysiol. (1990) 76:459-72. doi: 10.1016/0013-4694(90)90099-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
297. Racine RJ. Modificación de la actividad convulsiva mediante estimulación eléctrica: II. Convulsión motora. Electroenceph Clin Neurophysiol. (1972) 32:281–94. doi: 10.1016/0013-4694(72)90177-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
298. Coulter DA, McIntyre DC, Löscher W. Modelos animales de epilepsias límbicas: ¿qué pueden decirnos? Cerebro cerebral.(2002) 12:240–56. doi: 10.1111/j.1750-3639.2002.tb00439.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
299. Goddard GV, McIntyre DC, Leech CK. Un cambio permanente en la función cerebral como resultado de la estimulación eléctrica diaria. Exp Neurol. (1969) 25:295–330. doi: 10.1016/0014-4886(69)90128-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
300. Löscher W. Modelos animales de convulsiones y epilepsia: papel pasado, presente y futuro para el descubrimiento de medicamentos anticonvulsivos.Neurochem Res. (2017) 42:1873–88. doi: 10.1007/s11064-017-2222-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
301. Löscher W. Apto para la aplicación de los modelos animales existentes actualmente en el descubrimiento de nuevas terapias para la epilepsia. Epilepsy Res. (2016) 126:157–84. doi: 10.1016/j.eplepsyres.2016.05.016
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
302. Löscher W. Estado actual y direcciones futuras en la farmacoterapia de la epilepsia. Tendencias Pharmacol Sci. (2002) 23:113–8. doi: 10.1016/S0165-6147(00)01974-X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
303. Wauquier A, Ashton D, Melis W. Análisis conductual de la leña amigdaloide en perros Beagle y los efectos del clonazepam, el diazepam, el fenobarbital, la difenilhidantoína y la flunarizina en las manifestaciones convulsas. Exp Neurol. (1979) 64:579–86. doi: 10.1016/0014-4886(79)90233-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
304. Brandt C, Ebert U, Löscher W. Epilepsia inducida por el encandecimiento prolongado de la amígdala en ratas: falta de una asociación clara entre el desarrollo de convulsiones espontáneas y el daño neuronal. Res. de epilepsia (2004) 62:135-56. doi: 10.1016/j.eplepsyres.2004.08.008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
305. Thompson ME, Galosy RA. Actividad eléctrica cerebral y función cardiovascular durante el ence de la amigdaloide en el perro.Exp Neurol. (1983) 82:505–20. doi: 10.1016/0014-4886(83)90076-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
306. Lopes Da Silva FH, Wadman WJ, Leung LS, Van Hulten K. Aspectos comunes del desarrollo de un foco epileptogénico de leña en la corteza prepiriforme del perro y en el hipocampo de la rata: transitorios interictales espontáneos con polaridades cambiantes. Electroencephalogr Clin Neurophysiol Suppl. (1982) 36:274–87.
307. Mars NJ, Lopes Da Silva FH. Propagación de la actividad convulsiva en perros enmómados. Electroencephalogr Clin Neurophysiol. (1983) 56:194–209. doi: 10.1016/0013-4694(83)90074-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
308. Löscher W, Ebert U, Wahnschaffe U, Rundfeldt C. Susceptibilidad de diferentes capas celulares de la parte anterior y posterior de la corteza piriforme a la estimulación eléctrica y al encteo: comparación con la amígdala basolateral y las «tormentas de área». Neurociencia. (1995) 66:265–76. doi: 10.1016/0306-4522(94)00614-B
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
309. LaRosa DA, Ellery SJ, Walker DW, Dickinson H. Comprender el espectro completo de lesiones orgánicas después de la asfixia intraparto. Pediatr delantero. (2017) 5:16. doi: 10.3389/fped.2017.00016
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
310. Rainaldi MA, Perlman JM. Fisiopatología de la asfixia del nacimiento. Clin Perinatol. (2016) 43:409-22. doi: 10.1016/j.clp.2016.04.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
311. Disdier C, Stonestreet BS. Cambios cerebrovasculares relacionados con la hipóxica-isquémica y posibles estrategias terapéuticas en el cerebro neonatal. J Neurosci Res. (2020) 98:1468–84. doi: 10.1002/jnr.24590
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
312. Pressler RM, Lagae L. Por qué necesitamos urgentemente mejores terapias para las convulsiones y la epilepsia para niños y recién nacidos. Neurofarmacología. (2020) 170:107854. doi: 10.1016/j.neuropharm.2019.107854
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
313. Cotten CM, Shankaran S. Hipotermia por encefalopatía hipóxico-isquémica. Experto Rev Obstet Gynecol. (2010) 5:227–39.
314. Millar LJ, Shi L, Hoerder-Suabedissen A, Molnár Z. Ismia de hipoxia neonatal: mecanismos, modelos y desafíos terapéuticos.Neurociencia de células frontales. (2017) 11:78. doi: 10.3389/fncel.2017.00078
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
315. Hamdy N, Eide S, Sun HS, Feng ZP. Modelos animales para lesiones cerebrales neonatales inducidas por condiciones isquémicas hipóxicas en roedores. Exp Neurol. (2020) 334:113457. doi: 10.1016/j.expneurol.2020.113457
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
316. Young RS, Yagel SK, Gonya-Magee T. Alteraciones fisiológicas y metabólicas asociadas con convulsiones en perros normoxicos y neonatales asfixiados. Epilepsia. (1984) 25:569–73. doi: 10.1111/j.1528-1157.1984.tb03463.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
317. Ment LR, Stewart WB, Petroff OA, Duncan CC, Montoya D. Modelo de cachorro de Beagle de asfixia perinatal: bloqueo de neurotransmisores excitatorios. Pediatr Neurol. (1989) 5:281–6. doi: 10.1016/0887-8994(89)90018-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
318. Pintor MJ. Modelos animales de asfixia perinatal: contribuciones, contradicciones, relevancia clínica. Semin Pediatr Neurol.(1995) 2:37-56. doi: 10.1016/S1071-9091(05)80004-X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
319. Vannucci RC, Duffy TE. Metabolismo cerebral en perros recién nacidos durante la asfixia reversible. Ann Neurol. (1977) 1:528–34. doi: 10.1002/ana.410010604
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
320. Duffy TE, Cavazzuti M, Cruz NF, Sokoloff L. Metabolismo de la glucosa cerebral local en perros recién nacidos: efectos de la hipoxia y la anestesia con halotano. Ann Neurol. (1982) 11:233–46. doi: 10.1002/ana.410110303
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
321. Cavazzuti M, Duffy TE. Regulación del flujo sanguíneo cerebral local en perros recién nacidos normales e hipóxico. Ann Neurol. (1982) 11:247–57. doi: 10.1002/ana.410110304
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
322. Young RS, Cowan B, Briggs RW. Metabolismo cerebral después de una convulsión de electrochoque en el perro neonatal: un estudio de RMN [31P]. Brain Res Bull. (1987) 18:261–3. doi: 10.1016/0361-9230(87)90199-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
323. Ment LR, Stewart WB, Duncan CC, Scott DT, Lambrecht R. Modelo de cachorro de Beagle de hemorragia intraventricular. Efecto de la indometacina en el flujo sanguíneo cerebral. J Neurosurg. (1983) 58:857–62. doi: 10.3171/jns.1983.58.6.0857
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
324. Ment LR, Stewart WB, Duncan CC, Scott DT, Lambrecht R. Modelo de cachorro de Beagle de hemorragia intraventricular. Efecto de la indometacina en la utilización local de la glucosa cerebral. J Neurosurg. (1984) 60:737–42. doi: 10.3171/jns.1984.60.4.0737
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
325. Ment LR, Stewart WB, Duncan CC. Modelo de cachorro de Beagle de hemorragia intraventricular: estudios de ethamsilato.Prostaglandinas. (1984) 27:245–56. doi: 10.1016/0090-6980(84)90077-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
326. Ment LR, Stewart WB, Duncan CC, Pitt BR. Modelo de cachorro de Beagle de asfixia perinatal: estudios de nimodipina.Accidente cerebrovascular. (1987) 18:599–605. doi: 10.1161/01. STR.18.3.599
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
327. Ment LR, Stewart WB, Petroff OA, Duncan CC. Inhibidor de la síntesis de tromboxano en un modelo de cachorro de beagle de asfixia perinatal. (1989) 20:809-14. doi: 10.1161/01. STR.20.6.809
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
328. Chen X, Johnson GS, Schnabel RD, Taylor JF, Johnson GC, Parker HG. Una encefalopatía neonatal con convulsiones en perros caniche estándar con una mutación misense en el ortólogo canino de ATF2. Neurogenética. (2008) 9:41–9. doi: 10.1007/s10048-007-0112-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
329. Potschka H Patterson EN y Leppik IE. (2017). Epilepsia natural y estado epiléptico en perros. En: Pitkänen A, Buckmaster PS, Galanopoulou AS, Moshé SL, editores. Modelos de convulsiones y epilepsia. Segunda edición. Londres: Academic Press 387-398. doi: 10.1016/B978-0-12-804066-9.00028-6
330. Sieghart W, Ramerstorfer J, Sarto-Jackson I, Varagic Z, Ernst M. Una nueva farmacología del receptor GABA(A): fármacos que interactúan con la interfaz alfa(+) beta(-). Br J Pharmacol. (2012) 166:476–85. doi: 10.1111/j.1476-5381.2011.01779.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
331. Stephens DN, Turski L, Jones GH, Steppuhn KG, Schneider HH. Abecarnil: un nuevo ansiolítico con propiedades mixtas de agonista completo/agonista parcial en modelos animales de ansiedad y sedación. En: Stephens DN, editor, Anxiolytic b-Carbolines. Berlín: Springer-Verlag (1993). p. 79–95. doi: 10.1007/978-3-642-78451-4_7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
332. Basile AS, Lippa AS, Skolnick P. Anxiolíticos ansioselectives: ¿puede menos ser más? Eur J Pharmacol. (2004) 500:441–51. doi: 10.1016/j.ejphar.2004.07.043
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
333. Turski L, Stephens DN, Jensen LH, Petersen EN, Meldrum BS, Patel S. Acción anticonvulsiva del abecarnilo de b-carbolina: estudios en roedores y babuinos, Papio papio. J Pharmacol Exp Ther. (1990) 253:344–52.
334. Kasteleijn-Nolst Trenite DG, Groenwold RH, Schmidt B, Löscher W. Evaluación de la eficacia de una dosis única de dos agonistas parciales de los receptores de benzodiacepinas en pacientes con epilepsia fotosensibles: un estudio piloto controlado con placebo. Res. de epilepsia (2016) 122:30–6. doi: 10.1016/j.eplepsyres.2016.02.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
335. D’Andrea M, Romao I, Pires TT, do Prado HJ, Krüger LT, Pires MEP, et al. Dieta cetogénica y epilepsia: lo que sabemos hasta ahora. Neurosci frontal. (2019) 13:5. doi: 10.3389/fnins.2019.00005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
336. Tang Y, Wang Q, Liu J. Eje microbiota-intestino-cerebro: un nuevo objetivo potencial de la dieta cetogénica para la epilepsia.Curr Opin Pharmacol. (2021) 61:36–41. doi: 10.1016/j.coph.2021.08.018
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
337. Law TH, Davies ES, Pan Y, Zanghi B, Want E, Volk HA. Un ensayo aleatorizado de una dieta TAG de cadena media como tratamiento para perros con epilepsia idiopática. Br J Nutr. (2015) 114:1438–47. doi: 10.1017/S000711451500313X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
338. Munana KR, Jacob ME, Callahan BJ. Evaluación de las poblaciones de Lactobacillus fecal en perros con epilepsia idiopática: un estudio piloto. Anim Microbioma. (2020) 2:6. doi: 10.1186/s42523-020-00036-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
339. Pilla R, Law TH, Pan Y, Zanghi BM, Want Li Q. Los efectos de una dieta cetogénica de triglicéridos de cadena media en las heces en perros con epilepsia idiopática. Ciencia Veterinaria Frontal. (2020) 7:541547. doi: 10.3389/fvets.2020.541547
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
340. Garcia-Belenguer S, Grasa L, Valero O, Palacio J, Luno I, Rosado B. Microbicóta intestinal en la epilepsia idiopática canina: efectos de la enfermedad y el tratamiento. Animales. (2021) 11:3121. doi: 10.3390/ani11113121
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
341. Afra P, Adamolekun B, Aydemir S, Watson GDR. Evolución de la tecnología del sistema de terapia de estimulación nerviosa vaga (VNS) para la epilepsia resistente a los medicamentos. Tecnología médica frontal. (2021) 3:696543. doi: 10.3389/fmedt.2021.696543
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
342. Munana KR, Vitek SM, Tarver WB, Saito M, Skeen TM, Sharp NJ. Uso de la estimulación del nervio vagal como tratamiento para la epilepsia refractaria en perros. J Am Vet Med Assoc. 221 (2002):977–83. doi: 10.2460/javma.2002.221.977
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
343. Martlé V, Raedt R, Waelbers T, Smolders I, Vonck K, Boon P. El efecto de la estimulación del nervio vago en las monoaminas del LCR y el umbral de convulsiones de PTZ en perros. Estimulante cerebral. (2015) 8:1–6. doi: 10.1016/j.brs.2014.07.032
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
344. Kohlberg GD, Samy RN. Efectos centrales de la estimulación del nervio craneal. Otolaryngol Clin North Am. (2020) 53:45–55. doi: 10.1016/j.otc.2019.09.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
345. Hirashima J, Saito M, Igarashi H, Takagi S, Hasegawa D. Informe de caso: seguimiento de 1 año de estimulación del nervio vago en un perro con epilepsia resistente a los medicamentos. Ciencia Veterinaria Frontal. (2021) 8:708407. doi: 10.3389/fvets.2021.708407
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
346. Robinson K, Platt S, Stewart G, Reno L, Barber R, Boozer L. Viabilidad de la estimulación no invasiva del nervio vago (gammaCore VETâ?) para el tratamiento de la actividad convulsiva refractaria en perros. Ciencia Veterinaria Frontal. (2020) 7:569739. doi: 10.3389/fvets.2020.569739
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
347. Ostendorf AP, Ahrens SM, Lado FA, Arnold ST, Bai S, Bensalem Owen MK. Características del centro de epilepsia de los Estados Unidos: un análisis de datos de la asociación nacional de centros de epilepsia. Neurología. (2022) 98:e449–58. doi: 10.1212/WNL.0000000000013130
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
348. Skarpaas TL, Jarosiewicz B, Morrell MJ. Neuroestimulación sensible al cerebro para la epilepsia (sistema RNS®). Res. de epilepsia (2019) 153:68–70. doi: 10.1016/j.eplepsyres.2019.02.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
349. Rao VR. Electroencefalografía crónica en la epilepsia con un dispositivo de neuroestimulación sensible: estado actual y perspectivas futuras. Dispositivos médicos de revisión experto. (2021) 18:1093–105. doi: 10.1080/17434440.2021.1994388
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
350. Zamora M, Meller S, Kajin F, Sermon JJ, Toth R, Benjaber M. Informe de caso: incorporación de «cronoterapia digital» en dispositivos médicos, una validación canina para controlar el estado epiléptico a través de la estimulación cerebral rítmica multiescala. Neurociencia frontal. (2021) 15:734265. doi: 10.3389/fnins.2021.734265
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
351. Quigg M, Skarpaas TL, Spencer DC, Fountain NB, Jarosiewicz B, Morrell MJ. Los eventos electrocorticográficos de los registros cerebrales ambulatorios a largo plazo pueden complementar potencialmente los diarios de convulsiones. Res. de epilepsia (2020) 161:106302. doi: 10.1016/j.eplepsyres.2020.106302
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
352. Fisher RS, Blum DE, DiVentura B, Vannest J, Hixson JD, Moss R, et al. Diarios de incautaciones para la investigación clínica y la práctica: limitaciones y perspectivas futuras. Comportamiento de la epilepsia. (2012) 24:304-10. doi: 10.1016/j.yebeh.2012.04.128
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
353. Bongers J, Gutiérrez-Quintana R, Stalin CE. La percepción del propietario de los dispositivos de detección de convulsiones en perros epilépticos idiopáticos. Front Vet Sci. (2021) 8:792647. doi: 10.3389/fvets.2021.792647
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
354. Coles LD, Patterson EE, Sheffield WD, Mavoori J, Higgins J, Michael B, et al. Estudio de viabilidad de un sistema de alerta de convulsiones del cuidador en la epilepsia canina. Res. de epilepsia (2013) 106:456–60. doi: 10.1016/j.eplepsyres.2013.06.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
355. Davis KA, Ung H, Wulsin D, Wagenaar J, Fox E, Patterson N. Extracción de EEG intracraneal continuo en la epilepsia canina focal: relacionar las ráfagas intéricas con los inicios de las convulsiones. Epilepsia. (2016) 57:89–98. doi: 10.1111/epi.13249
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
356. Hubbard I, Beniczky S, Ryvlin P. El difícil camino para desarrollar un dispositivo de salud móvil para la epilepsia: el panorama actual y hacia dónde vamos a partir de aquí. Neurol frontal. (2021) 12:740743. doi: 10.3389/fneur.2021.740743
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
357. Tatum WO, Desai N, Feyissa AA. Cruzando la brecha durante una pandemia. Epilepsy Behav Rep. (2021) 16:100500. doi: 10.1016/j.ebr.2021.100500
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
358. Weisdorf S, Duun-Henriksen J, Kjeldsen MJ, Poulsen FR, Gangstad SW, Kjaer TW. Monitoreo subcutáneo en el hogar a corto plazo de la epilepsia: 490 días de EEG de nueve pacientes. Epilepsia. (2019) 60:2204-14. doi: 10.1111/epi.16360
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
359. Duun-Henriksen J, Baud M, Richardson MP, Cook M, Kouvas G, Heasman JM. ¿Una nueva era en la monitorización electroencefalográfica? Dispositivos Subscalp para grabaciones a muy largo plazo. Epilepsia. (2020) 61:1805–17. doi: 10.1111/epi.16630
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
360. Viana PF, Duun-Henriksen J, Glasstãter M, Dãmpelmann M, Nurse ES, Martins IP, et al. 230 días de EEG subcutáneo ultra largo plazo: análisis del ciclo convulsivo y comparación con el diario del paciente. Ann Clin Transl Neurol. (2021) 8:288–93. doi: 10.1002/acn3.51261
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
361. Stirling RE, Maturana MI, Karoly PJ, Nurse ES, McCutcheon K, Grayden DB, et al. Pronóstico de incautaciones utilizando un novedoso sistema de monitoreo de EEG a muy largo plazo. Neurol frontal. (2021) 12:713794. doi: 10.3389/fneur.2021.713794
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
362. James FMK, Cortez MA, Monteith G, Jokinen TS, Sanders S, Wielaender F. Utilidad de diagnóstico de la videoelectroencefalografía inalámbrica en perros sin sed. J Vet Intern Med. (2017) 31:1469–76. doi: 10.1111/jvim.14789
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
363. Kuhlmann L, Lehnertz K, Richardson MP, Schelter B, Zaveri HP. Predicción de incautación – lista para una nueva era. Nat Rev Neurol. (2018) 14:618–30. doi: 10.1038/s41582-018-0055-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
364. Meisel C, Loddenkemper T. Predicción e intervención de convulsiones. Neurofarmacología. (2020) 172:107898. doi: 10.1016/j.neuropharm.2019.107898
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
365. Howbert JJ, Patterson EE, Stead SM, Brinkmann B, Vasoli V, Crepeau D. Previsión de convulsiones en perros con epilepsia natural. PLoS ONE. (2014) 9:e81920. doi: 10.1371/journal.pone.0081920
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
366. Brinkmann BH, Wagenaar J, Abbot D, Adkins P, Bosshard SC, Chen M. Crowdsourcing, pronóstico reproducible de convulsiones en epilepsia humana y canina. Cerebro. (2016) 139:1713-22. doi: 10.1093/brain/aww045
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
367. Varatharajah Y, Iyer RK, Berry BM, Worrell GA, Brinkmann BH. Pronóstico de convulsiones y el estado precario en la epilepsia canina. Sistema neuronal Int J. (2017) 27:1650046. doi: 10.1142/S0129065716500465
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
368. Nejedly P, Kremen V, Sladky V, Nasseri M, Guragain H, Klimes P. Aprendizaje profundo para el pronóstico de convulsiones en caninos con epilepsia.J Neural Eng. (2019) 16:036031. doi: 10.1088/1741-2552/ab172d
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
369. Nasseri M, Kremen V, Nejedly P, Kim I, Chang SY, Joon JH. La selección de datos de entrenamiento semisupervisado mejora el pronóstico de convulsiones en caninos con epilepsia. Control del proceso de señal Biomed. (2020) 57:101743. doi: 10.1016/j.bspc.2019.101743
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
370. Chen P, Chen F, Wu Y, Zhou B. Nuevos conocimientos sobre el papel de la neurogénesis aberrante del hipocampo en la epilepsia. Neurol frontal. (2021) 12:727065. doi: 10.3389/fneur.2021.727065
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
371. Baraban SC, Löscher W. ¿Qué nuevos enfoques de modelado nos ayudarán a identificar tratamientos farmacológicos prometedores? Adv Exp Med Biol. (2014) 813:283–94. doi: 10.1007/978-94-017-8914-1_23
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
372. Löscher W. Modelos experimentales para la epilepsia intratable en especies animales no primatientes. En: Schmidt D, Morselli PL, editores, Epilepsia intratable: Aspectos experimentales y clínicos. Nueva York, NY: Raven Press (1986). p. 25-37.
373. Rogawski MA, Johnson MR. Severidad intrínseca como determinante de la refractiación de los medicamentos antiepilépticos.Corrientes de epilepsia. (2008) 8:127–30. doi: 10.1111/j.1535-7511.2008.00272.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
374. Tang F, Hartz AMS, Bauer B. Epilepsia resistente a los medicamentos: múltiples hipótesis, pocas respuestas. Neurol frontal.(2017) 8:301. doi: 10.3389/fneur.2017.00301
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
375. Pekcec A, Unkruer B, Stein V, Bankstahl JP, Soerensen J, Tipold A. Exceso de expresión de la glicoproteína P en el cerebro canino después del estado espontáneo epiléptico. Res. de epilepsia (2009) 83:144–51. doi: 10.1016/j.eplepsyres.2008.10.010
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
376. Alves L, Hulsmeyer V, Jaggy A, Fischer A, Leeb T, Drogemuller M. Polimorfismos en el gen ABCB1 en Border Collies epilépticos idiopáticos fenobarbitales sensibles y resistentes. J Vet Intern Med. (2011) 25:484–9. doi: 10.1111/j.1939-1676.2011.0718.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
377. Jambroszyk M, Tipold A, Potschka H. Tratamiento adicional con verapamilo en la epilepsia canina farmacorresistente.Epilepsia. (2011) 52:284–91. doi: 10.1111/j.1528-1167.2010.02886.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
378. Löscher W, Langer O. Imágenes de la función y expresión de la glicoproteína P para dilucidar los mecanismos de farmacorresistencia en la epilepsia. Curr Top Med Chem. (2010) 10:1785–91. doi: 10.2174/156802610792928095
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
379. Fonseca-Barriendos D, Frías-Soria CL, Pérez-Pérez D, Gómez-López R, Borroto Escuela DO, Rocha L. Epilepsia resistente a los medicamentos: hipótesis de la diana del fármaco y más allá de los receptores. Epilepsia abierta. (2021) 2021:epi4.12539. doi: 10.1002/epi4.12539
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
380. Hardy BT, Patterson EE, Cloyd JM, Hardy RM, Leppik IE. Estudio doble enmascarado y controlado con placebo de levetiracetam intravenoso para el tratamiento del estado epiléptico y las convulsiones agudas repetitivas en perros. J Vet Intern Med. (2012) 26:334–40. doi: 10.1111/j.1939-1676.2011.00868.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
381. Yang L, Dong XZ, Cui XH, Liu JM, Liu WN, Zhang L. Comparación de la eficacia y la seguridad del levetiracetam y la fenitoína en el tratamiento del estado epileptico establecido: una revisión sistemática y un metanálisis. J Clin Neurosci. (2021) 89:422–9. doi: 10.1016/j.jocn.2021.05.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
382. Patterson EE, Leppik IE, Coles LD, Podell M, Vite CH, Bush W. Estado canino epiléptico tratado con fosfenitoína: una prueba de estudio de principios. Epilepsia. (2015) 56:882–7. doi: 10.1111/epi.12994
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
383. Vuu I, Coles LD, Maglalang P, Leppik IE, Worrell G, Crepeau D. Topiramato intravenoso: farmacocinética en perros con epilepsia natural. Ciencia Veterinaria Frontal. (2016) 3:107. doi: 10.3389/fvets.2016.00107
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
384. Fechner A, Hubert K, Jahnke K, Knake S, Konczalla J, Menzler K. Tratamiento del estado refractario y superrefrárectífero epiléptico con topiramato: un estudio de cohorte de 106 pacientes y una revisión de la literatura. Epilepsia. (2019) 60:2448–58. doi: 10.1111/epi.16382
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
385. Löscher W, Hönack D, Richter A, Schulz HU, Schürer M, et al. Nueva solución acuosa inyectable de carbamazepina a través de la complejación con 2-hidroxipropil-b-ciclodextrina: Tolerabilidad y farmacocinética después de la inyección intravenosa en comparación con una formulación a base de glicofurol. Epilepsia. (1995) 36:255–61. doi: 10.1111/j.1528-1157.1995.tb00993.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
386. Löscher W, Hönack D. carbamazepina intravenosa: comparación de diferentes formulaciones parenterales en un modelo de ratón de estado convulsivo epiléptico. Epilepsia. (1997) 38:106-13. doi: 10.1111/j.1528-1157.1997.tb01084.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
387. Vuu I, Patterson EE, Wu CY, Zolkowska D, Leppik IE, Rogawski MA. Alopregnanolona intravenosa e intramuscular para el tratamiento temprano del estado epiléptico: farmacocinética, farmacodinámica y seguridad en perros. J Pharmacol Exp Ther.(2022) 380:104–13. doi: 10.1124/jpet.121.000736
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
388. Zolkowska D, Wu CY, Rogawski MA. Allopregnanolona intramuscular y ganaxolona en un modelo de ratón de estado epileptico resistente al tratamiento. Epilepsia. (2018) 59:220–7. doi: 10.1111/epi.13999
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
389. Löscher W. Revisión crítica de los modelos animales actuales de convulsiones y epilepsia utilizados en el descubrimiento y desarrollo de nuevos medicamentos antiepilépticos. Incautación. (2011) 20:359–68. doi: 10.1016/j.seizure.2011.01.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
390. Löscher W, Hönack D. Precipitación de retirada por antagonistas de los receptores de benzodiazepinas en perros tratados crónicamente con diazepam o el nuevo anxiolítico y anticonvulsivo b-carboline abecarnil. Arch Pharmacol de Naunyn-Schmiedeberg. (1992) 345:452–60. doi: 10.1007/BF00176624
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
391. Jakobs C, Löscher W. Identificación de metabolitos del ácido valproico en suero de humanos, perros, ratas y ratones.Epilepsia. (1978) 19:591–602. doi: 10.1111/j.1528-1157.1978.tb05039.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
392. Löscher W, Hönack D, Nolting B, Fa bbender CP. Trans-2-en-valproato: reevaluación de su eficacia anticonvulsiva en modelos de convulsiones estandarizadas en ratones, ratas y perros. Res. de epilepsia (1991) 9:195–210. doi: 10.1016/0920-1211(91)90053-I
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
393. Löscher W. Unión a proteínas séricas y farmacocinética de valproato en hombres, perros, ratas y ratones. J Pharmacol Exp Ther. (1978) 204:255–61.
394. Bankstahl M, Bankstahl JP, Löscher W. ¿El cambio de la marca a las formulaciones genéricas de fenobarbital se asocia con la pérdida de eficacia antiepiléptica?: un estudio farmacocinético con dos formulaciones orales (luminal((R)) vet. Fenoleptil(R)) en perros. BMC Vet Res. (2013) 9:202. doi: 10.1186/1746-6148-9-202
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
395. Coles LD, Leppik IE, Patterson EE, Rivers Z, Mishra U, Cloyd JC. Uso de la farmacocinética de fosfenitoína IV para determinar la dosis de carga para un ensayo clínico de estado canino epiléptico. Epilepsia. (2015) 56:888–94. doi: 10.1111/epi.12961
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
396. O’Brown NM, Pfau SJ, Gu C. Puente de barreras: una mirada comparativa a la barrera hematoencefálica a través de los organismos. Genes Dev. (2018) 32:466–78. doi: 10.1101/gad.309823.117
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
397. Nair AB, Jacob S. Una guía de práctica sencilla para la conversión de dosis entre animales y humanos. J Basic Clin Pharm.(2016) 7:27-31. doi: 10.4103/0976-0105.177703
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: convulsiones, medicamentos anticonvulsivos, farmacocinética, EEG intracraneal, neuroestimulación receptiva, estado epileptico, epilepsia canina
Cita: Löscher W (2022) Perros como modelo animal natural de epilepsia. Frente. Veterinario. Sci. 9:928009. doi: 10.3389/fvets.2022.928009
Recibido: 25 de abril de 2022; Aceptado: 18 de mayo de 2022;
Publicado: 22 de junio de 2022.
Editado por:
Alberto Muñoz-Prieto, Universidad de Zagreb, Croacia
Revisado por:
Ahmed Abdelhameed, Centro de Ciencias de la Salud de la Universidad de Texas en Houston, Estados Unidos
Charles Akos Szabo, Centro de Ciencias de la Salud de la Universidad de Texas en San Antonio, Estados Unidos
Yoshihiko Yu, Universidad de Veterinaria y Ciencias de la Vida de Nippon, Japón
Copyright © 2022 Löscher. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución de Creative Commons (CC BY). Se permite el uso, distribución o reproducción en otros foros, siempre que se acredite el(los) autor(es) original(es) y el(los) propietario(es) de los derechos de autor y que se cite la publicación original en esta revista, de acuerdo con la práctica académica aceptada. No se permite el uso, distribución o reproducción que no cumpla con estos términos.
*Correspondencia: Wolfgang Löscher, wolfgang.loescher@tiho-hannover.de
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía