Los polisacáridos de Pueraria lobata alivian la diarrea neonatal de terneros
Los polisacáridos de Pueraria lobata alivian la diarrea neonatal de terneros mediante la modulación de la microbiota intestinal y sus metabolitos
 Liuhong Shen1†
Liuhong Shen1†  Yu Shen1†
Yu Shen1†  Liuchao Tú1
Liuchao Tú1  Yue Zhang1
Yue Zhang1  Zhetong Su2
Zhetong Su2  Guangneng Peng1
Guangneng Peng1  Junliang Dng1
Junliang Dng1  Zhicai Zuo1
Zhicai Zuo1  Zhijun Zhong1
Zhijun Zhong1  Zhihua Ren1
Zhihua Ren1  Shumin Yu1
Shumin Yu1  Xiaolan Zong1
Xiaolan Zong1  Yingkun Zhu3*
Yingkun Zhu3*  Suizhong Cao1*
Suizhong Cao1*- 1El Laboratorio Clave de Enfermedades Animales y Salud Humana de la Provincia de Sichuan, El Centro de Investigación Médica para la Enfermedad de las Vacas, Facultad de Medicina Veterinaria, Universidad Agrícola de Sichuan, Chengdu, Sichuan, China
- 2Guangxi Innova Medical Technology Co., Ltd., Lipu, Guangxi, China
- 3Escuela de Agricultura y Ciencias de los Alimentos, University College Dublin, Belfield, Irlanda
Introducción: La diarrea neonatal de terneros (NCD) sigue siendo una de las enfermedades más críticas en la crianza de terneros. Los estudios han demostrado que los polisacáridos de Pueraria lobata (PLP) tienen una intensa actividad antioxidante e inmunomoduladora y modulan la microbiota intestinal. Este ensayo clínico aleatorizado tuvo como objetivo determinar el efecto de la PLP en el ternero neonatal con diarrea.
Métodos: En este estudio, registramos la puntuación fecal de terneros experimentales, y los terneros con puntuaciones fecales ≥ 2 se determinaron como diarrea y evaluaron sus concentraciones séricas de citoquinas inflamatorias e índices relacionados con el daño oxidativo. La microbiota fecal y la metabolómica de terneros diarreicos se investigaron más a fondo.
Resultados: Los resultados mostraron que el tratamiento con PLP disminuyó la puntuación fecal de los terneros diarreicos, las concentraciones séricas de IL-1β, TNF-γ y malondialdehído, y también elevó el nivel de superóxido dismutasa. Además, el tratamiento con PLP alteró la microbiota intestinal, aumentó significativamente la abundancia relativa de bacterias beneficiosas, incluidos los filos Bacteroidetes y Actinobacteria, el género Collinsella, Megamonas y Bifidobacterium; disminuyó la abundancia relativa de bacterias patogenéticas o relacionadas con la diarrea, como Proteobacteria, Fusobacteria, Clostridium_sensu_stricto_1 y Escherichia_Shigella. Además, PLP puede aumentar las concentraciones fecales de ácido isobutírico, ácido propiónico y pantotenato; reducir los niveles de PC [18:0/18:1(9Z)], ácido araquidónico y ácido docosahexaenoico.
Discusión: Por lo tanto, los resultados sugirieron que el PLP puede realizar la actividad terapéutica aliviando la inflamación intestinal y regulando la microbiota intestinal, evitando una mayor disbiosis para restaurar el metabolismo de la microbiota intestinal y, finalmente, promoviendo la recuperación de la diarrea. El cambio mitigó aún más la inflamación intestinal y el daño oxidativo en terneros diarreicos. Esto indicó que la PLP podría ser un tratamiento prometedor para atenuar la diarrea en terneros neonatales.
1. Introducción
La diarrea neonatal de terneros (ENT) ha sido durante mucho tiempo un problema en la industria láctea y ha causado graves pérdidas económicas, que incluso afectan la morbilidad y la mortalidad dentro del primer mes de vida, y el rendimiento productivo y reproductivo posterior de los terneros (1, 2). Dado que el desarrollo intestinal en animales jóvenes es inmaduro, su microbiota intestinal es altamente vulnerable a las infecciones e interfiere con su crecimiento (3). Cada vez hay más pruebas de que la salud de los animales está estrechamente relacionada con su microbiota intestinal en los primeros años de vida (4). Sin embargo, una asociación complicada entre factores infecciosos y no infecciosos está relacionada con un mayor riesgo de enfermedades intestinales neonatales (5). Los antibióticos se usan a menudo para tratar o prevenir la diarrea en rumiantes que se sabe que causan bacterias resistentes a los antibióticos (6) y, lo que es más importante, la terapia con antibióticos de terneros diarreicos conduce a la recurrencia de diarrea severa y agrava la disbiosis intestinal (7, 8). En general, la ENT es una enfermedad multifactorial y desafiante. Por lo tanto, los tratamientos alternativos para la diarrea, con menos efectos secundarios, residuos minimizados y resistencia se han convertido en un punto crítico para la industria láctea sostenible.
Pueraria lobata es una de las hierbas medicinales tradicionales chinas que ha sido ampliamente utilizada (9) y contiene sustancias biológicamente activas, incluyendo isoflavonas, polisacáridos, aminoácidos y terpenoides (10). Los polisacáridos han sido reportados como un prebiótico con funciones de promover el crecimiento de bacterias intestinales beneficiosas, reducir los patógenos intestinales a través de la inhibición competitiva y mantener la homeostasis del ambiente intestinal y la salud del huésped (11, 12). Los estudios han demostrado que el polisacárido Pueraria lobata (PLP) tiene una fuerte actividad antioxidante e inmunomoduladora in vitro (13) y modula la microbiota intestinal (14). Sin embargo, pocos investigadores se han centrado en los efectos de la PLP en el crecimiento neonatal de la pantorrilla. Además, el impacto de los polisacáridos en la diarrea neonatal de terneros podría estar estrechamente relacionado con la microbiota intestinal. Se ha demostrado que el desarrollo inicial de la microbiota intestinal tiene un efecto fisiológico a largo plazo en el huésped (12). Sin embargo, la microecología intestinal del ternero es inmadura, y varias bacterias patógenas y sus metabolitos podrían iniciar la fase temprana de la infección por diarrea (15). Aunque el enfoque tradicional en la diarrea de terneros ha sido en patógenos directos como Escherichia coli, Salmonella y C. perfrigens (16), cada vez más estudios sugieren que la microbiota intestinal está significativamente asociada con el estado de salud de los animales (17, 18). Investigaciones anteriores han encontrado que la reducción de Bacteroidetes y la elevación de Proteobacteria se observaron en terneros con diarrea neonatal en comparación con terneros sanos (19). Una microbiota intestinal sana apoyaría a su huésped al inhibir las bacterias patógenas potenciales y la maduración del sistema inmunitario intestinal al proporcionar metabolitos beneficiosos (20), como los ácidos grasos de cadena corta (AGCC), que son esenciales para la salud intestinal (21). Por lo tanto, los cambios en la microbiota intestinal y sus metabolitos durante el tratamiento deben enfatizarse al desarrollar nuevas terapias para las ENT.
Por lo tanto, este estudio investigó el impacto de la administración oral de PLP en la microbiota fecal, los perfiles de metabolitos y los índices inflamatorios séricos en terneros con ENT para investigar más a fondo la terapia no antibiótica para las ENT.
2. Materiales y métodos
2.1. Preparación del PLP
PLP fue proporcionado por Guangxi Innovate Medical Technology Co., Ltd. e identificado por el Centro Nacional de Investigación de Ingeniería de Medicina Tradicional China Tecnología de Fabricación de Preparación de Sólidos de la Universidad de Medicina Tradicional China de Jiangxi. El Mw promedio de PLP, con 50.00% de pureza, fue de 1.09 × 105 Da, y el monosacárido residual fue glucosa (22).
2.2. Animales
El estudio se realizó en una granja lechera gestionada intensivamente en Sichuan, China. A los terneros lecheros se les ofreció calostro de 4 L dentro de las 2 h posteriores al nacimiento, luego se alojaron individualmente con material de cama para evitar el contacto físico entre ellos. Después del primer día de vida, los terneros fueron alimentados con leche de un cubo dos veces al día a las 8:00 y 16:00, con acceso gratuito a concentrado y agua durante los próximos 7 días.
Los terneros sin ningún tratamiento antibiótico previo y con una puntuación fecal de 2 (secreción, se propaga fácilmente) o 3 (líquido, desprovisto de material sólido) se definieron como terneros con ENT y se inscribieron en este estudio (23); se consideró que la ENT terminaba cuando su puntaje fecal era ≤ 1 durante dos días consecutivos (24). Investigue la puntuación fecal de los terneros inscritos durante siete días consecutivos. El día de inscripción se definió como 0 día.
De acuerdo con el criterio, doce terneros con ENT (edades de 7-8 días y 45-55 kg de peso) fueron seleccionados entre cincuenta terneros neonatos y se administró PLP (400 mg / kg PC) QD administrada por vía oral durante cinco días consecutivos. Cada ternero se administró utilizando un dispensador oral para garantizar una dosis constante. La dosificación de PLP se realizó haciendo referencia a un estudio similar con algunas modificaciones (22). Mientras tanto, doce terneros sanos de la misma edad con una puntuación fecal de 0 (consistencia normal a las heces) o 1 (heces semiformadas o pastosas) fueron seleccionados como el grupo de control (23).
Se recolectaron muestras fecales y muestras de sangre del recto y la cola de terneros con ENT (DS) y terneros en el grupo control (HS) en el día 0; luego se recolectaron muestras fecales y muestras de sangre de terneros con ENT tratados con PLP (TS) en los 7 días del ensayo. Las muestras de sangre se recogieron a través de la vena caudal utilizando el tubo no anticoagulante, se centrifugaron a 1.500 × g durante 10 minutos a temperatura ambiente, y luego se recogió suero. Congelar inmediatamente todas las muestras a -80°C hasta el final del ensayo. Después de la recolección de la muestra, las muestras de heces se enviaron a Shanghai Applied Protein Technology Co., Ltd. (Shanghai, China) para su análisis.
2.3. Análisis sérico
La IL-1β, el TNF-α, el malondialdehído (MDA) y la superóxido dismutasa (SOD) séricos se midieron utilizando kits de prueba disponibles comercialmente de Shanghai Enzyme-linked Biotechnology Co., Ltd., China. Todos los procedimientos de prueba seguían estrictamente las instrucciones del fabricante.
2.4. Secuenciación del gen 16S rDNA para el análisis de la microbiota intestinal
El ADN genómico microbiano se extrajo utilizando el kit de ADN y se detectó mediante electroforesis en gel de agarosa. El ADN extraído de cada muestra se amplificó en la región bacteriana 16S rDNA V3-V4 utilizando cebadores específicos: 341F (5′-CCTACGGGRBGCASCAG-3′) y 806R (5′-GGACTACNNGGGTATCTAAT-3′). Los productos de PCR fueron purificados por AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, USA). Generé las bibliotecas de secuenciación utilizando el kit de preparación de bibliotecas de ADN NEB NextUltra™para Illumina (NEB, EE. UU.) y agregué códigos de índice. Las bibliotecas de ADN se cargaron y secuenciaron en una plataforma Illumina NovaSeq 6000. Las lecturas se ensamblaron usando FLASH y se analizaron usando QIIME. Las secuencias con más del 97% de similitud fueron asignadas a las mismas unidades taxonómicas operacionales. Generó las curvas del índice de Shannon y calculó los índices Chao1 y Shannon usando Qiime, luego exploró la diversidad β de las comunidades microbianas a través de la escala multidimensional no métrica (NMDS) basada en distancias uniFrac ponderadas. El método de análisis discriminante lineal (LDA) tamaño del efecto (LEfSe) analizó los biomarcadores. Los datos se completaron utilizando Wekemo Bioincloud (https://www.bioincloud.tech/task-meta).®
2.5. Análisis metabolómico de muestras fecales
Metanol/acetonitrilo/H2Se añadieron O (2:2:1, v/v/v) a la muestra fecal para la extracción de metabolitos. El análisis se realizó utilizando un sistema de cromatografía líquida de ultra alta presión (1290 Infinity LC, Agilent Technologies) acoplado a un espectrómetro de tiempo de vuelo cuadrupolo (AB Sciex Triple TOF 6600) (UHPLC-Q-TOF/MS). La identificación compuesta de metabolitos se realizó comparando el valor m/z de precisión (< 25 ppm) y los espectros MS/MS con una base de datos interna establecida con estándares auténticos disponibles. Los datos procesados fueron sometidos a análisis de datos multivariados por el paquete R. Los metabolitos con importancia variable para los valores de proyección (VIP) superiores a 1 se aplicaron además a la prueba t de Student a nivel univariado para medir la importancia de cada metabolito. El valor de p < 0,05 fue considerado estadísticamente significativo. Metabolitos con log2 (cambio de pliegue) (registro2FC) superior a 1 o inferior a 0 se determinaron como reguladas al alza o a la baja, respectivamente.
2.6. Análisis de correlación
El análisis de correlación se realizó utilizando las herramientas de OmicStudio (https://www.omicstudio.cn/tool). El análisis de correlación de Spearman se realizó para las áreas pico de los metabolitos seleccionados, bacterias e índices bioquímicos. Se construyó una red de coexpresión utilizando el software Cytoscape 3.9.1. Los valores de p ≤ 0,05 significaron una correlación significativa. El rango del coeficiente de correlación (r) fue de −1 a 1, y r > 0 o < 0 representó una correlación positiva o negativa.
2.7. Análisis estadístico
Los resultados de los datos biológicos y la puntuación fecal se expresaron como media ± SEM y se analizaron mediante el software SPSS 26.0. La prueba t del estudiante analizó las diferencias entre los dos grupos. Se analizaron comparaciones de grupos múltiples mediante ANOVA unidireccional. La significación estadística se determina si P < 0,05. El método LEfSe y la prueba de suma de rangos de Kruskal-Wallis (KW) se realizaron para identificar características que caracterizan diferencias significativas entre dos clases asignadas. Un valor de LDA >3,0 se consideró estadísticamente significativo. El análisis de la expresión diferencial de los metabolitos se realizó utilizando valores de p y valores VIP realizados mediante el análisis ortogonal de discriminación de mínimos cuadrados parciales (OPLS-DA).
3. Resultados
3.1. Eficacia de la PLP en el alivio de la diarrea
La eficacia antidiarreica de la PLP se realizó por las condiciones de las heces (Figura complementaria 1). La Figura 1 y la Tabla Suplementaria 1 muestran que la puntuación fecal disminuyó gradualmente con el tiempo de tratamiento. Para el día 5, no hubo diferencias significativas entre los grupos HS y ST (P = 0,082), lo que sugirió que el tratamiento con PLP alivió los síntomas diarreicos.
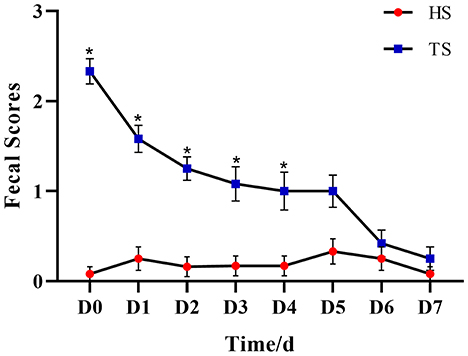 Figura 1. El efecto del polisacárido de Pueraria lobata (PLP) en las puntuaciones fecales de terneros. *P < 0.05 HS vs. TS, D0 significa ternero diarreico sin PLP tratado (DS). HS: muestra fecal de ternero sano; TS, PLP tratamiento diarrea ternera muestra fecal.
Figura 1. El efecto del polisacárido de Pueraria lobata (PLP) en las puntuaciones fecales de terneros. *P < 0.05 HS vs. TS, D0 significa ternero diarreico sin PLP tratado (DS). HS: muestra fecal de ternero sano; TS, PLP tratamiento diarrea ternera muestra fecal.
3.2. Efecto de PLP sobre el estrés oxidativo, los índices inmunes e inflamatorios
Los terneros con ENT mostraron concentraciones séricas significativamente más altas de IL-1β y TNF-α en comparación con los terneros sanos (P < 0,01, HS vs. DS), mientras que la terapia PLP alivió significativamente el aumento de IL-1β y TNF-α (P < 0,01, TS vs. DS). La concentración sérica de MDA aumentó significativamente en los terneros diarreicos en comparación con los terneros sanos (P < 0,01), mientras que después de ser tratados con PLP en terneros con diarrea, que mostraron una actividad reducida de MDA en comparación con los terneros diarreicos (P < 0,01). Además, los niveles de expresión de SOD disminuyeron en los terneros diarreicos (P = 0,028), que tendieron a aumentar después de la administración de PLP (P = 0,263) (Figura 2).
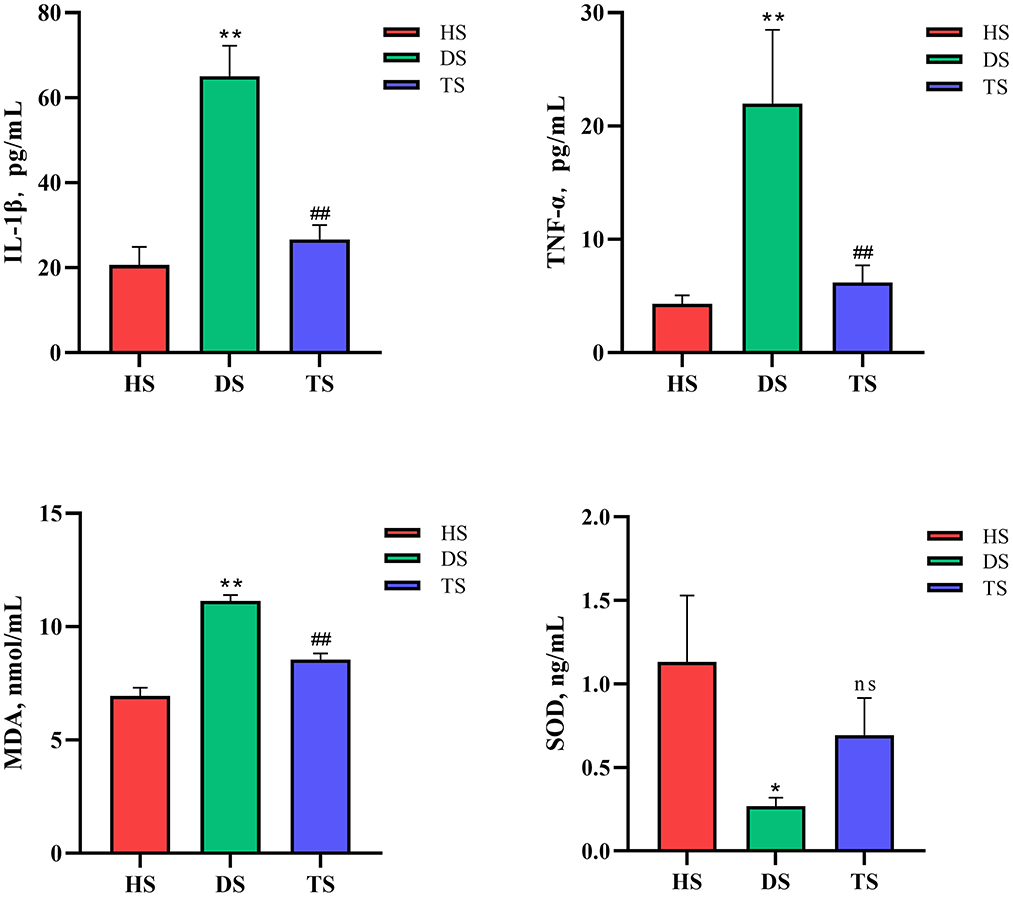 Figura 2. Efecto del polisacárido de Pueraria lobata (PLP) sobre el nivel de estrés oxidativo y citoquinas inmunoinflamatorias. Expresión de IL-1β, TNF-α, malondialdehído (MDA) y superóxido dismutasa (SOD). Cada columna representa una muestra. Los datos se expresan como media ± SEM, SEM significa error estándar de la media, *P < 0,05, **P < 0,01 DS vs. HS; P < 0.01 TS vs. DS. ns, no significativo. HS: muestra fecal de ternero sano; DS: muestra fecal de ternero diarreico; TS, PLP tratamiento diarrea ternera muestra fecal.##
Figura 2. Efecto del polisacárido de Pueraria lobata (PLP) sobre el nivel de estrés oxidativo y citoquinas inmunoinflamatorias. Expresión de IL-1β, TNF-α, malondialdehído (MDA) y superóxido dismutasa (SOD). Cada columna representa una muestra. Los datos se expresan como media ± SEM, SEM significa error estándar de la media, *P < 0,05, **P < 0,01 DS vs. HS; P < 0.01 TS vs. DS. ns, no significativo. HS: muestra fecal de ternero sano; DS: muestra fecal de ternero diarreico; TS, PLP tratamiento diarrea ternera muestra fecal.##
En conclusión, el PLP redujo efectivamente los niveles de estrés oxidativo y la inflamación inmune en terneros diarreicos.
3.3. PLP alteró la estructura de la microbiota intestinal y revirtió la disbiosis microbiana intestinal inducida por diarrea
Se realizó un análisis de secuenciación de ADNr 16S para investigar los cambios estructurales de la microbiota intestinal. La curva del índice de Shannon de cada muestra tendió a ser plana con el aumento en el número de secuencias, lo que demuestra que se capturó la mayor diversidad (Figura suplementaria S2). Para el análisis de α diversidad, los índices Chao1 y Shannon reflejaron la riqueza de la comunidad y la diversidad de la microbiota, respectivamente. No hubo diferencias significativas en los índices Chao1 y Shannon entre los grupos HS, DS y TS (Figura complementaria S2). Sobre la base de las distancias ponderadas de UniFrac, el NMDS reveló que las estructuras de la microbiota en el grupo DS estaban separadas del grupo HS (Figura 3A). Sin embargo, las estructuras de la microbiota en el grupo ST estaban cerca del grupo HS después de la administración de PLP. Esto significa que el PLP podría influir en las estructuras de la microbiota en terneros diarreicos.
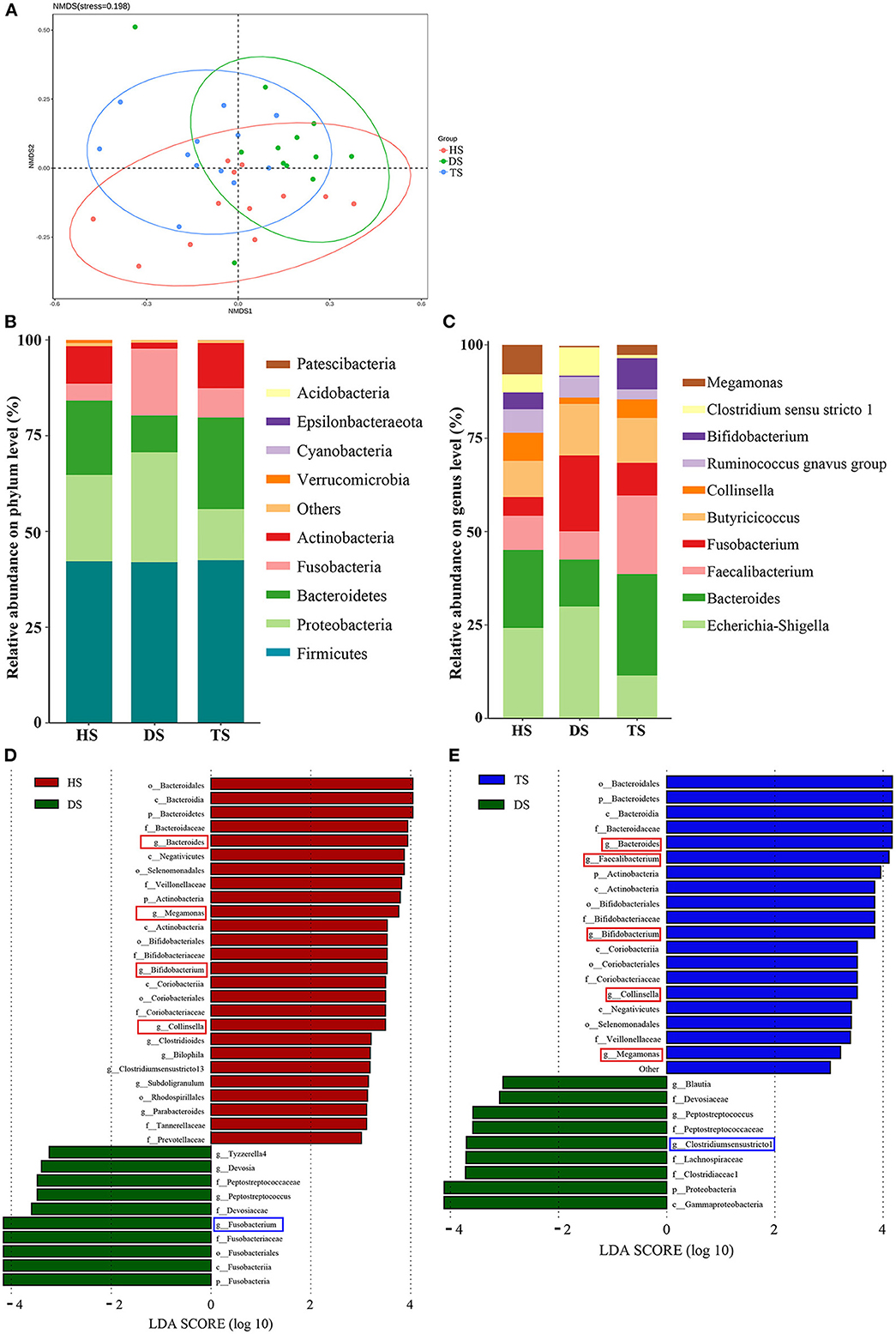 Figura 3. Comparación de las estructuras y distribuciones de la microbiota fecal en diferentes grupos. (A) Gráficos de escala multidimensional no métrica (NMDS) de 3 grupos; (B, C) Abundancia relativa de la microbiota fecal a nivel de filo y género; (D, E) Análisis discriminante lineal (LDA) entre diferentes grupos del análisis discriminante lineal. El método del tamaño del efecto del análisis discriminante lineal identifica los taxones bacterianos más diferencialmente abundantes, pero solo se muestran los taxones que cumplen un umbral de significación LDA de >3.0. HS: muestra fecal de ternero sano; DS: muestra fecal de ternero diarreico; TS, tratamiento PLP muestra fecal de ternero diarreico; PLP: polisacárido de Pueraria lobata.
Figura 3. Comparación de las estructuras y distribuciones de la microbiota fecal en diferentes grupos. (A) Gráficos de escala multidimensional no métrica (NMDS) de 3 grupos; (B, C) Abundancia relativa de la microbiota fecal a nivel de filo y género; (D, E) Análisis discriminante lineal (LDA) entre diferentes grupos del análisis discriminante lineal. El método del tamaño del efecto del análisis discriminante lineal identifica los taxones bacterianos más diferencialmente abundantes, pero solo se muestran los taxones que cumplen un umbral de significación LDA de >3.0. HS: muestra fecal de ternero sano; DS: muestra fecal de ternero diarreico; TS, tratamiento PLP muestra fecal de ternero diarreico; PLP: polisacárido de Pueraria lobata.
En el análisis adicional de la microbiota intestinal a nivel de filo, los resultados indicaron que las bacterias dominantes en cada grupo estaban compuestas por Firmicutes, Bacteroidetes, Proteobacteria, Fusobacteria y Actinobacteria (Figura 3B). Dentro de los terneros sanos, Firmicutes (42,21%), Bacteroidetes (19,44%), Proteobacteria (22,51%), Fusobacteria (4,40%) y Actinobacteria (9,78%) fueron los más abundantes. En comparación con los terneros sanos, la diarrea se asoció con Proteobacteria y Fusobacteria proliferadas y redujo Bacteroidetes y Actinobacteria, y la administración de PLP de ST revirtió los filos alterantes en DS, inhibió Proteobacteria (28.71-13.35%) y Fusobacteria (17.42-7.63%); promovió Bacteroidetes (9,61–23,88%) y Actinobacteria (1,58–11,83%). Finalmente, entre las comparaciones cruzadas de diferentes grupos (HS vs. DS y DS vs. TS), los resultados mostraron que PLP alteró especialmente cuatro filos microbianos en terneros diarreicos: Bacteroidetes, Proteobacteria, Fusobacteria y Actinobacteria.
A nivel de género, el mapa de calor mostró los 10 géneros principales entre todos los grupos (Figura 3C). En comparación con los terneros sanos, los terneros diarreicos mostraron una disminución significativa de la abundancia relativa de Bacteroides y Megamonas (P < 0,05) y un aumento significativo de Fusobacterium (P < 0,05). La PLP alteró la reducción de Bacteroides (P < 0,01), Bifidobacterium (P < 0,01) y Faecalibacterium (P < 0,05) en terneros diarreicos e indujo una disminución significativa de la abundancia de Clostridium_sensu_stricto_1 (P < 0,05) y Escherichia_Shigella (P < 0,05) (Tabla 1).
Para encontrar los biomarcadores de microflora rectal entre varios grupos, se aplicó el método LEfSe (LDA > 3) (Figuras 3D, E). Los resultados del HS vs. DS y DS vs. TS se superponían. El análisis detallado a nivel de género encontró que los patógenos potenciales, Fusobacterium y Clostridium_sensu_stricto_1, se alteraron significativamente en terneros diarreicos, mientras que los probióticos potenciales, Collinsella, Megamonas y Bifidobacterium aumentaron considerablemente después del tratamiento con PLP. Estos resultados sugieren que el PLP restauró parcialmente las comunidades microbianas rectales, lo que podría beneficiar al huésped.
3.4. Metabolitos intestinales regulados por PLP en las ENT y detección de posibles biomarcadores en las ENT
Las complejas interacciones entre el huésped y la microbiota intestinal están intensamente asociadas con los ejes metabólicos huésped-microbio. Por lo tanto, el análisis metabolómico no dirigido en muestras fecales por UHPLC Q-TOF / MS. La agrupación distinta de metabolitos fue evidente entre los grupos HS, DS y TS en el OPLS-DA (Figura Suplementaria S3). La R2Y y Q2 se utilizaron para evaluar la capacidad de modelado y predicción del modelo OPLS-DA, respectivamente (Figura Suplementaria S3). Hubo 34 metabolitos diferentes entre el grupo DS vs. HS y 35 entre el grupo DS vs. TS (Figuras 4A, B; Cuadros suplementarios S2, S3). Un diagrama de Veen mostró que se identificaron 11 metabolitos comunes y se correlacionaron parcialmente mediante el tratamiento con PLP (Figura 4C). La microbiota intestinal de los mamíferos interactúa ampliamente con el huésped a través del cometabolismo de sustratos en el contenido intestinal. Los metabolitos se analizaron más a fondo para determinar su papel utilizando el MetOrigin (http://metorigin.met-bioinformatics.cn/). Los resultados mostraron que había 5 metabolitos comunes entre el huésped y la microbiota, 1 metabolito único de la microbiota y otros 5 metabolitos (Figura 4D). En detalle, los metabolitos significativos fueron ácido isobutírico, ácido propiónico, PC [18:0/18:1(9Z)], ácido araquidónico (ARA), ácido docosahexaenoico (DHA) y pantotenato (Figura 4E). Las vías metabólicas KEGG recuperaron además estos metabolitos alterados por MetaboAnalyst (Figura 4F), que están involucrados en la biosíntesis de ácidos grasos insaturados, metabolismo del ácido araquidónico, metabolismo del ácido linoleico, metabolismo del ácido α-linolénico, biosíntesis de pantotenato y CoA, metabolismo del propanoato y metabolismo de glicerofosfolípidos.
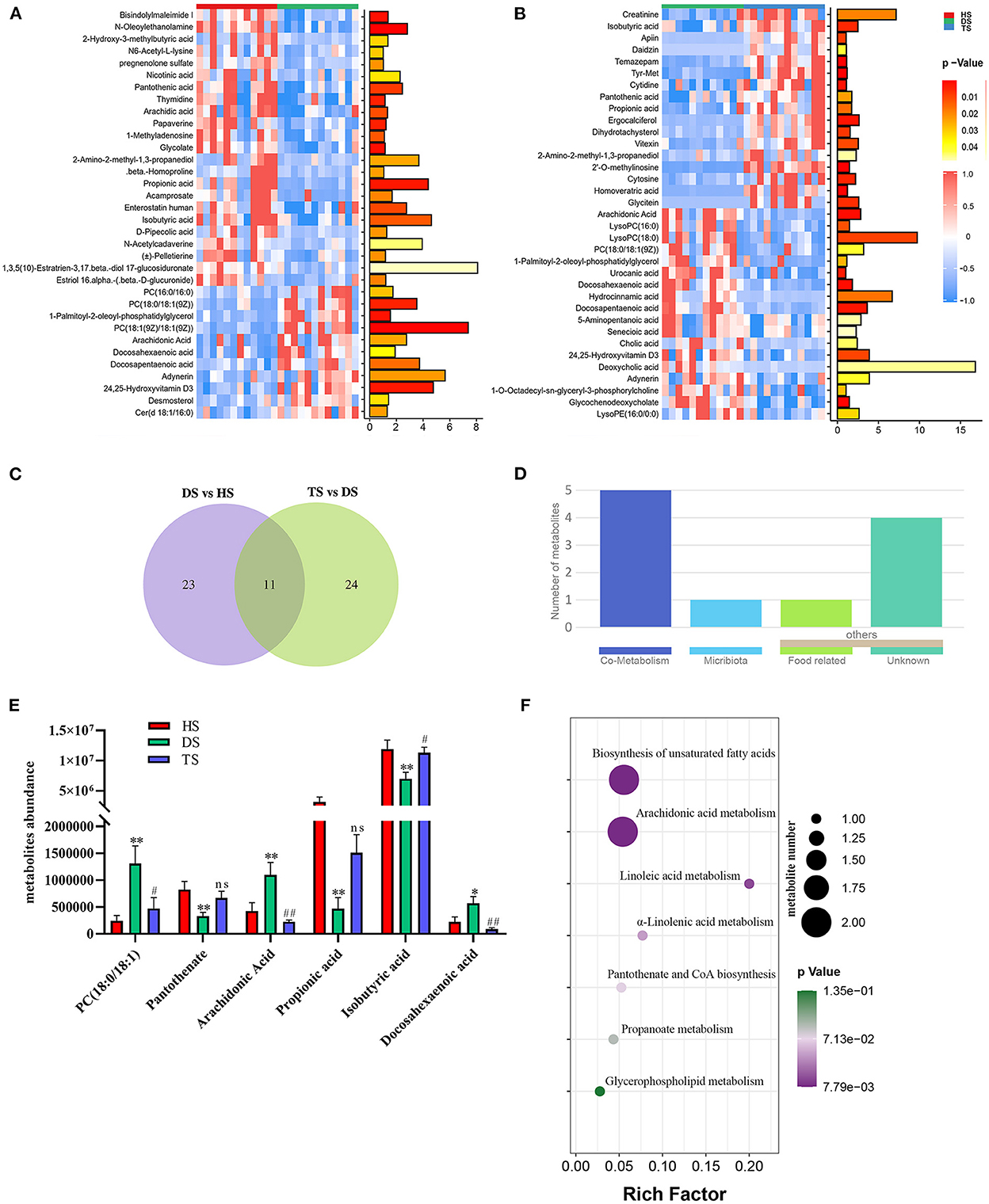 Figura 4. El efecto del polisacárido de Pueraria lobata (PLP) sobre los metabolitos diarreicos de terneros. (A) Mapa de calor de los 34 metabolitos notablemente diferentes entre DS vs. HS; (B) Mapa de calor de los 35 metabolitos notablemente alterados entre DS vs. TS; (C) El diagrama de Veen mostró que 11 de los mismos metabolitos se identificaron en diferentes grupos; (D) Se analizaron más a fondo las funciones de los mismos metabolitos; (E) 6 concentraciones de metabolitos clave del contenido intestinal en diferentes grupos; (F) Los diagramas de burbujas de las vías metabólicas. HS: muestra fecal de ternero sano; DS: muestra fecal de ternero diarreico; TS, PLP tratamiento diarrea ternera muestra fecal. *P < 0.05, **P < 0.01 DS vs. HS; P < 0,05, P < 0,01 TS vs. DS; ns, no significativo.###
Figura 4. El efecto del polisacárido de Pueraria lobata (PLP) sobre los metabolitos diarreicos de terneros. (A) Mapa de calor de los 34 metabolitos notablemente diferentes entre DS vs. HS; (B) Mapa de calor de los 35 metabolitos notablemente alterados entre DS vs. TS; (C) El diagrama de Veen mostró que 11 de los mismos metabolitos se identificaron en diferentes grupos; (D) Se analizaron más a fondo las funciones de los mismos metabolitos; (E) 6 concentraciones de metabolitos clave del contenido intestinal en diferentes grupos; (F) Los diagramas de burbujas de las vías metabólicas. HS: muestra fecal de ternero sano; DS: muestra fecal de ternero diarreico; TS, PLP tratamiento diarrea ternera muestra fecal. *P < 0.05, **P < 0.01 DS vs. HS; P < 0,05, P < 0,01 TS vs. DS; ns, no significativo.###
3.5. Análisis de correlación entre microbios y metabolitos
La secuenciación del ADNr 16S y el análisis metabolómico revelaron el efecto del tratamiento con PLP en terneros diarreicos. El análisis de correlación mostró que había una correlación global significativa entre los metabolitos y la microbiota (r = 0,741, P < 0,001) (Figura 5A). El análisis de correlación por pares adicional mostró que había 4 microbios destacados vinculados con los metabolitos significativos, Megamonas, Clostridium_sensu_stricto_1, Collinsella y Bifidobacterium (Figura 5B).
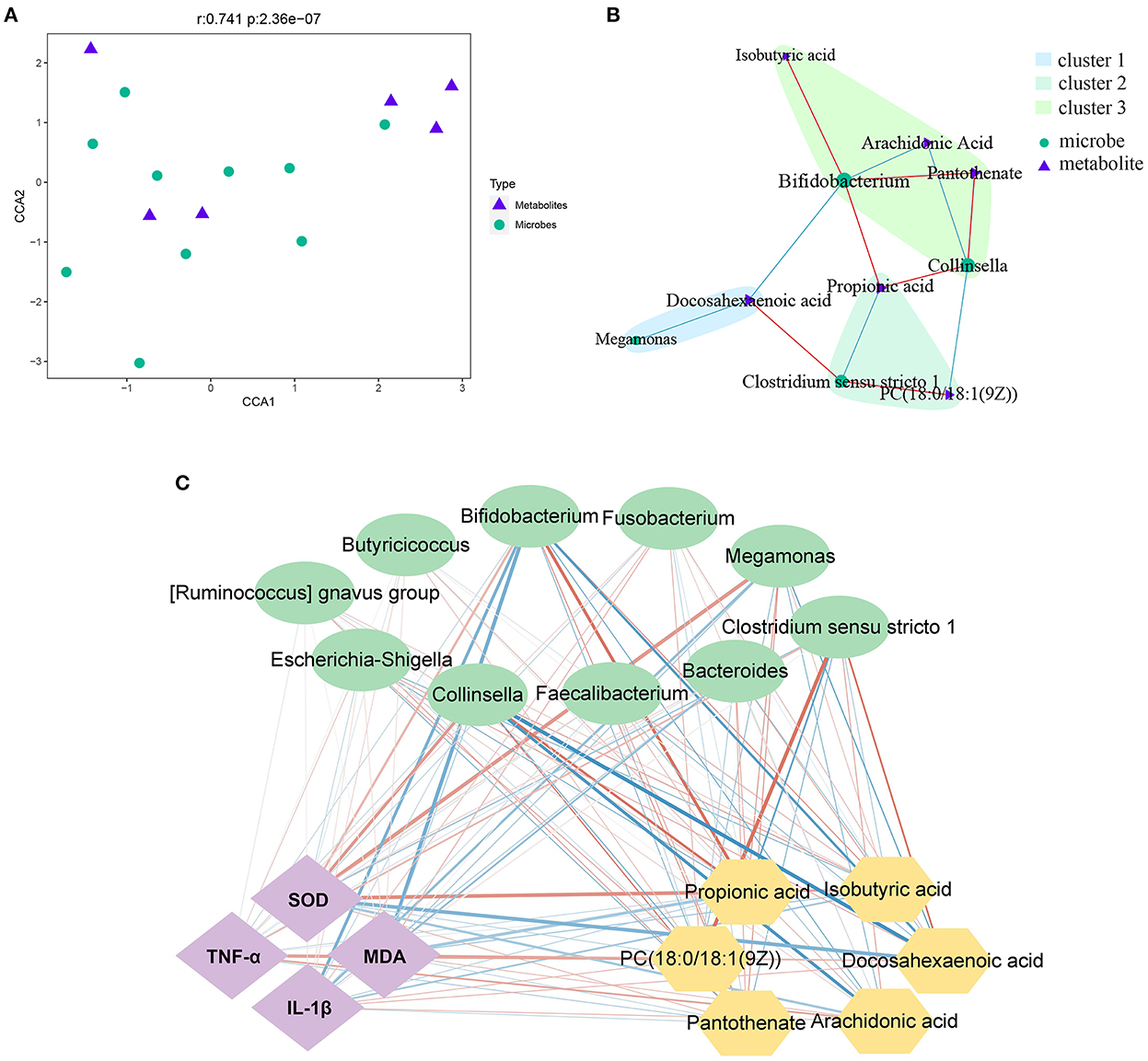 Figura 5. Análisis de correlación entre microbios y metabolitos. (A, B) El análisis de correlación canónica (CCA) y el análisis de correlación de pares entre metabolitos y microbiota. (C) La red de interacción entre el índice fenotípico, las bacterias y los metabolitos; La fuerza de la interacción está representada por el grosor y la profundidad de las líneas. Cuanto más fuerte es la interacción, más gruesa y oscura es una línea. La línea roja representa la relación positiva y la línea azul representa la relación negativa. MDA: malondialdehído; SOD: superóxido dismutasa.
Figura 5. Análisis de correlación entre microbios y metabolitos. (A, B) El análisis de correlación canónica (CCA) y el análisis de correlación de pares entre metabolitos y microbiota. (C) La red de interacción entre el índice fenotípico, las bacterias y los metabolitos; La fuerza de la interacción está representada por el grosor y la profundidad de las líneas. Cuanto más fuerte es la interacción, más gruesa y oscura es una línea. La línea roja representa la relación positiva y la línea azul representa la relación negativa. MDA: malondialdehído; SOD: superóxido dismutasa.
Por otro lado, basándose en el fenotipo, la microbiota fecal a nivel de género y los metabolitos más diferenciales, el análisis de correlación de Spearman identificó la relación con el tratamiento con PLP (Figura 5C). Los metabolitos como el ácido docosahexaenoico, disminuyeron significativamente después del tratamiento con PLP y mostraron una fuerte correlación positiva con Clostridium_sensu_stricto_1 (r = 0,611, P < 0,01), mientras que la correlación negativa con Bifidobacterium (r = −0,625, P < 0,01). PC [18:0/18:1(9Z)] tuvo correlación positiva con Clostridium_sensu_stricto_1 (r = 0,628, P < 0,01), pero correlación negativa con Collinsella. El ácido araquidónico se correlacionó negativamente con Bifidobacterium (r = −0,552, P < 0,01) y Collinsella (r = −0,673, P < 0,01). Bifidobacterium tuvo correlación positiva con ácido isobutírico, ácido propiónico y pantotenato (r > 0,5, P < 0,01). Collinsella también tuvo correlación positiva con ácido propiónico y pantotenato (r > 0,5, P < 0,01). Específicamente, el ácido propiónico se correlacionó negativamente con Clostridium_sensu_stricto_1 (r = −0.576, P < 0.01). Sobre la base de estos resultados, análisis adicionales para explorar la relación con el fenotipo. El resultado mostró que Bifidobacterium y Collinsella se correlacionaron negativamente con MDA (P < 0.05), mientras que los metabolitos de PC [18: 0 / 18: 1 (9Z)] se correlacionaron positivamente con MDA (P < 0.05). Bifidobacterium se correlacionó negativamente con IL-1β (P < 0,01), y DHA se correlacionó positivamente con IL-1β (P < 0,05). De manera similar, el ácido propiónico y el ácido isobutírico se correlacionaron positivamente con SOD (P < 0.05), mientras que Clostridium_sensu_stricto_1 se correlacionó negativamente con SOD (P < 0.05). Los metabolitos de PC [18:0/18:1(9Z)], ácido araquidónico y DHA se correlacionaron positivamente con TNF-α (P < 0,05).
El análisis reveló fuertes correlaciones entre varias bacterias intestinales específicas, metabolitos y fenotipos. Estos datos indicaron que la PLP afectó la microbiota y los metabolitos de las heces rectales para mejorar la inflamación y el estado oxidativo, aliviando aún más la diarrea de la pantorrilla.
4. Discusión
La diarrea es una enfermedad de alto riesgo en los terneros recién nacidos, que induce disbiosis de la microbiota intestinal, trastornos metabólicos e incluso la muerte (25). Por lo tanto, mejorar la microbiota intestinal puede contribuir a prevenir y aliviar la diarrea (26). Un estudio con modelos de roedores mostró que el PLP podría aliviar la inflamación y el estrés oxidativo al restaurar la disbiosis de la microbiota intestinal (22). Además, la PLP podría aliviar los cambios patológicos del colon y la disbiosis de la microbiota intestinal causada por la diarrea asociada a antibióticos (24). Estos hallazgos sugieren que la PLP puede ser un agente de tratamiento prometedor para la disbacteriosis intestinal inducida por diarrea y los trastornos de metabolitos. Los principales resultados del presente estudio fueron: (a) la administración de PLP en terneros alivió la inflamación y mejoró la capacidad antioxidante de los terneros diarreicos. b) La administración de PLP inhibió las bacterias dañinas y moduló la composición de la microbiota de manera probiótica. c) Los metabolitos específicos relacionados con la microflora intestinal se asociaron con perturbaciones en los microbios intestinales.
Las citoquinas juegan un papel importante en las respuestas inflamatorias y regulan la integridad de la barrera intestinal (27). Además, los cambios en IL-1β y TNF-α están estrechamente relacionados con el desarrollo de diarrea (28). Una vez que la barrera intestinal se ve comprometida, muchas bacterias patógenas pueden colonizar el tracto intestinal y causar inflamación (29). La sinergia de la infección bacteriana patógena, el estrés oxidativo y la inflamación agravan el proceso patológico (30). Cuando el nivel de estrés oxidativo aumenta, SOD desempeña el papel de eliminar los radicales libres para bloquear la peroxidación lipídica y la producción de MDA (31). Investigaciones anteriores encontraron que PLP podría promover la integridad de la barrera intestinal y reducir la inflamación a través de la vía de señalización NF-κB (22). En este ensayo, los terneros tratados con PLP tuvieron puntuaciones fecales más bajas, y la IL-1β y el TNF-α disminuyeron en los terneros de curación clínica en comparación con los diarreicos. Además, los terneros diarreicos tratados con PLP podrían recuperar la capacidad antioxidante, es decir, el menor nivel de MDA y un mayor nivel de SOD en terneros de curación clínica. Sugirió que el PLP tuvo un efecto beneficioso sobre la inhibición de la respuesta inflamatoria y la mejora del estado redox en terneros diarreicos.
La microbiota intestinal de los animales lactantes no estaba madura, lo que era más probable que ocurriera diarrea y disfunción intestinal exacerbada (3, 32). La detección de la microbiota intestinal es necesaria para determinar la eficacia de la PLP para la diarrea de terneros. De acuerdo con la investigación previa (16, 33), nuestro estudio encontró que el filo Proteobacteria es la bacteria más dominante en terneros sanos. Sin embargo, una adición generalizada del filo Proteobacteria es un marcador de disbiosis de la comunidad microbiana y un criterio diagnóstico potencial para la enfermedad (34) al desencadenar respuestas inflamatorias intensivas al producir lipopolisacáridos (35), alterar la microbiota intestinal, dañar la barrera intestinal e inducir la respuesta inflamatoria (36). La abundancia relativa de proteobacterias en los terneros curados (13,35%) fue menor que en los terneros diarreicos (28,71%), lo que implica que la PLP puede inhibir la reproducción de proteobacterias, una bacteria dañina.
Además, las Fusobacterias proliferadas en terneros diarreicos podrían invadir la barrera epitelial intestinal, induciendo síntomas de diarrea (37, 38). La pérdida de riqueza microbiana se asoció más con la sobreproliferación de Fusobacterium (39). En este estudio, la abundancia relativa de Fusobacteria disminuyó en los terneros curados (7,63%) en comparación con los terneros diarreicos (17,42%) después del tratamiento con PLP. Bacteroidetes y Actinobacteria fueron filos de bacterias beneficiosas que pueden contribuir positivamente a mantener la homeostasis intestinal (40, 41). Además, las especies de Bacteroidetes generalmente producen butirato, un producto de fermentación colónica que ayuda a mantener un intestino sano (42). El tratamiento con PLP promovió el crecimiento de Bacteroidetes y Actinobacteria en terneros diarreicos, lo que indica que el PLP podría proteger el tracto intestinal al reducir las bacterias patógenas y aumentar los microbios beneficiosos. A nivel de género, el análisis mostró que el tratamiento con PLP disminuyó los niveles de patógenos, Clostridium_sensu_stricto_1 y Escherichia_Shigella, en terneros diarreicos. Estudios previos indicaron que Clostridium_sensu_stricto_1 juega un papel vital en el desarrollo de colitis ulcerosa y promueve la respuesta inflamatoria (43, 44). En el presente estudio, encontramos que la abundancia relativa de Clostridium_sensu_stricto_1 correlacionó negativamente con el nivel de SOD.
Por otro lado, Escherichia_Shigella fue ampliamente aceptado como el principal patógeno para causar diarrea bovina (45). Especulamos que el PLP restauró el equilibrio ecológico de la microbiota intestinal al inhibir la proliferación de Clostridium_sensu_stricto_1 y Escherichia_Shigella en terneros diarreicos. Además, el análisis LEfSe identificó el enriquecimiento de Bifidobacterium en los terneros curados en comparación con los terneros diarreicos. Bifidobacterium produce AGCC y estimula el crecimiento de bacterias productoras de butirato (46, 47). Bifidobacterium también previene infecciones gastrointestinales por la colonización elevada de células epiteliales (47). En otras investigaciones, los fructanos de tipo inulina mejoraron la microbiota intestinal de ratones, aumentaron la abundancia de Bifidobacterium y redujeron los niveles de Clostridium y Escherichia_Shigella (48). Collinsella puede metabolizar carbohidratos, y la cooperación con Bifidobacterium modifica los ácidos biliares del huésped, lo que modula la virulencia y patogenicidad de los patógenos entéricos (49). Por lo tanto, la reducción de las bacterias patógenas y el aumento de la colonización de bacterias beneficiosas en el intestino pueden considerarse una de las ventajas de los terneros diarreicos tratados con PLP.
Como fuente de carbono para la microbiota intestinal, los polisacáridos pueden promover el crecimiento de la microbiota intestinal, que, a su vez, fermenta polisacáridos en AGCC (50), que desempeñan un papel esencial en la integridad de la mucosa y la respuesta inmune (51). El ácido propiónico ejerce propiedades inmunomoduladoras al inducir la expresión reguladora de células T (52). Además, la concentración de ácido isobutírico fecal fue significativamente menor en terneros diarreicos (53). A través del análisis de correlación de las bacterias y metabolitos, encontramos que el ácido propiónico y el ácido isobutírico se correlacionaron significativamente positivamente con Collinsella y Bifidobacterium. Además, encontramos que el PLP alteró significativamente la reducción del contenido de ácido isobutírico y ácido propiónico en terneros diarreicos. Podríamos demostrar además que el PLP afecta a la microbiota intestinal, en particular al aumentar los AGCC y producir abundancia de bacterias. La presente investigación mostró que los niveles de CP [18:0/18:1(9Z)] y ARA fueron menores después del tratamiento con PLP en terneros con diarrea. El presente estudio encontró que los PC pertenecen al grupo glicerofosfato, principalmente involucrados en el metabolismo de los glicerofosfolípidos. El aumento del contenido de PC sugiere que se evocó la respuesta al estrés oxidativo (54). Las membranas dañadas pueden liberar ARA para promover ROS, agravando así el estrés oxidativo (55). Por lo tanto, el PLP inhibió el estrés oxidativo e inmunoinflamatorio en terneros diarreicos, relacionado con el metabolismo restaurado de glicerofosfolípidos, ácido araquidónico y ácido linoleico. El DHA, un miembro de los AGPI omega-3, mejoró la inflamación y mejoró la cicatrización de heridas (56). Sin embargo, se encontró que el nivel de DHA disminuyó en los terneros curados en comparación con los terneros diarreicos. Especulamos que la respuesta inflamatoria se desvanece gradualmente en los terneros curados, lo que está estrechamente relacionado con la disminución del DHA. Pero necesitamos más estudios para ser concluyentes. El pantotenato es el precursor de la síntesis de CoA, un cofactor esencial para una amplia gama de funciones dentro de todas las células, como el ciclo del ácido tricarboxílico y la síntesis de ácidos grasos (57). El tratamiento con PLP aumentó el nivel de pantotenato, que también se correlacionó positivamente con el crecimiento de probióticos intestinales. Estos resultados se compararon bien con la alteración de los microbios intestinales, lo que apoyó aún más que el PLP mejora la diarrea mediante la modulación de metabolitos específicos relacionados con la microflora intestinal. En general, la suplementación con PLP atenuó la diarrea que puede estar asociada con la capacidad de mejora de los probióticos, la producción de ácido orgánico y la actividad inmunomoduladora causada por la fermentación de PLP y la utilización selectiva de bacterias en el intestino.
5. Conclusiones
El estudio reveló que la microbiota intestinal en terneros diarreicos sufre cambios sorprendentes, caracterizados por una mayor abundancia de bacterias patógenas y trastornos metabólicos en terneros diarreicos. Por el contrario, el tratamiento con PLP redujo las puntuaciones fecales, inhibió la respuesta inflamatoria y mejoró el estado redox para atenuar el síntoma de diarrea de los terneros. Estos impactos se realizaron principalmente alterando el microbioma intestinal y promoviendo la producción de AGCC. Además, la administración de PLP también restauró el metabolismo del huésped al reducir los niveles séricos de mediadores proinflamatorios, PC [18: 0 / 18: 1 (9Z)] y ARA. La PLP podría convertirse en un tratamiento prometedor sin antibióticos para la diarrea neonatal de terneros. Cómo esas comunidades microbianas moduladas por PLP afectan la salud y la productividad de los terneros en su vida posterior merece más investigación.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio / repositorios y el número (s) de acceso se pueden encontrar en el artículo / material complementario.
Declaración ética
La recolección de muestras se realizó en estricta conformidad con las directrices del Cuidado y uso de animales de laboratorio de China y todos los procedimientos fueron aprobados por el Comité de Cuidado y Uso de Animales de la Universidad Agrícola de Sichuan (No. 2013-028).
Contribuciones del autor
LS, YS, YZha y LY diseñaron el estudio. ZS, GP, ZZu, ZZh y JD realizaron el experimento. SY y LS realizaron análisis de laboratorio y escribieron el manuscrito. ZR, SY y XZ realizaron estadísticas y analizaron los datos. YZhu y SC revisaron el artículo. Todos los autores leyeron cuidadosamente y aprobaron la revisión final del manuscrito.
Financiación
Este trabajo fue financiado por el Proyecto de Apoyo al Departamento de Ciencia y Tecnología de Sichuan (2019YJ0650) y el Proyecto de Doble Apoyo para la Construcción de Disciplina de la Universidad Agrícola de Sichuan (No. 03572174).
Reconocimientos
Agradecemos a Shanghai Applied Protein Technology Co. Ltd., (Shanghai, China) por el análisis UHPLCTOF / MS.
Conflicto de intereses
ZS es empleado de Guangxi Innovates Medical Technology Co., Ltd.
Los autores restantes declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2022.1024392/full#supplementary-material
Referencias
1. Schild CO, Caffarena RD, Gil A, Sanchez J, Riet-Correa F, Giannitti F, et al. survey of management practices that influence ternf welfare and an estimation of the annual ternf mortality risk in pastured dairy hatured har hats in Uruguay. J Dairy Sci. (2020) 103:9418–29. DOI: 10.3168/JDS.2020-18177
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Aghakeshmiri F, Azizzadeh M, Farzaneh N, Gorjidooz M. Efectos de la diarrea neonatal y otras condiciones en el rendimiento productivo y reproductivo posterior de terneros. Vet Res Commun. (2017) 41:107–12. DOI: 10.1007/S11259-017-9678-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Uetake K. Newborn ternf welfare: a review focusing on mortality rates. Anim Sci J. (2013) 84:101–5. doi: 10.1111/asj.12019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Kerr CA, Grice DM, Tran CD, Bauer DC Li D, Hendry P, et al. Los eventos de la vida temprana influyen en la salud metabólica de toda la vida a través de la microflora intestinal y la permeabilidad intestinal. Crit Rev Microbiol. (2015) 41:326–40. doi: 10.3109/1040841X.2013.837863
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Cho YI, Yoon KJ. Una visión general de la diarrea de ternera: etiología infecciosa, diagnóstico e intervención. J Vet Sci. (2014) 15:1–17. doi: 10.4142/jvs.2014.15.1.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Santos FH, De Paula MR, Lezier D, Silva JT, Santos G, Bittar CM. Aceites esenciales para terneros lecheros: efectos sobre el rendimiento, los exfoliantes, la fermentación ruminal y la fauna intestinal. Animal. (2015) 9:958–65. doi: 10.1017/S175173111500018X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Kim HS, Whon TW, Sung H, Jeong YS, Jung ES, Shin NR, et al. Evaluación longitudinal del trasplante de microbiota fecal para mejorar la diarrea de terneros y mejorar el rendimiento del crecimiento. Nat Commun. (2021) 12:161. DOI: 10.1038/S41467-020-20389-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Afema JA, Davis MA, Sischo WM. Antimicrobial use policy change in pre-weaned dairy terners and its impact on antimicrobial resistance in commensal E. coli: a crosssectional and ecological study. BMC Microbiol. (2019) 19:217. DOI: 10.1186/S12866-019-1576-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Liu J, Shi YC, Lee DY. Aplicaciones de P. lobata en el tratamiento de diabéticos y la reducción del consumo de alcohol. Chin Herb Med. (2019) 11:141–9. doi: 10.1016/j.chmed.2019.04.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Luo D, Dong X, Huang J, Huang C, Fang G, Huang Y. El polisacárido de la raíz de Pueraria lobata alivia la disfunción metabólica de la glucosa y los lípidos en ratones diabéticos db / db. Pharm Biol. (2021) 59:382–90. doi: 10.1080/13880209.2021.1898648
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Bie N, Duan S, Meng M, Guo M, Wang C. Efecto regulador de polisacáridos sin almidón de batata púrpura en la microbiota intestinal de ratones con diarrea asociada a antibióticos. Función de alimentos. (2021) 12:5563–75. doi: 10.1039/D0FO03465G
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Wang M, Xie Z, Li L, Chen Y, Li Y, Wang Y, et al. La suplementación con polisacáridos compuestos contribuye al desarrollo y la actividad metabólica de la microbiota intestinal de rata joven. Función de alimentos. (2019) 10:2658–75. doi: 10.1039/C8FO02565G
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Dong Z, Zhang M, Li H, Zhan Q, Lai F, Wu H. Caracterización estructural y actividad inmunomoduladora de un nuevo polisacárido de la raíz de P. lobata (Willd) Ohwi. Int J Biol Macromol. (2020) 154:1556–64. doi: 10.1016/j.ijbiomac.2019.11.040
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Chen R, Liu B, Wang X, Chen K, Zhang K, Zhang L, et al. Efectos del polisacárido de P. lobata sobre la microbiota intestinal en ratones. Int J Biol Macromol. (2020) 158:740–9. doi: 10.1016/j.ijbiomac.2020.04.201
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Vogt SL, Finlay BB. Protección mediada por la microbiota intestinal contra infecciones diarreicas. J Travel Med. (2017) 24:C39–43. doi: 10.1093/jtm/taw086
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Gomez DE, Arroyo LG, Costa MC, Viel L, Weese JS. Caracterización de la microbiota bacteriana fecal de terneros lecheros sanos y diarreicos. J Vet Pasante Med. (2017) 31:928–39. DOI: 10.1111/JVIM.14695
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Esser D, Lange J, Marinos G, Sieber M, Best L, Prasse D, et al. Funciones de la microbiota para la fisiología de los metaorganismos animales. J Innata Inmune. (2019) 11:393–404. doi: 10.1159/000495115
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Lee WJ, Hase K. Gut microbiota-generated metabolites in animal health and disease. Nat Chem Biol. (2014) 10:416–24. DOI: 10.1038/NCHEMBIO.1535
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Kim ET, Lee SJ, Kim TY, Lee HG, Atikur RM, Gu BH, et al. Cambios dinámicos en las comunidades microbianas fecales de terneros lecheros neonatales por envejecimiento y diarrea. Animales. (2021) 11:1113. doi: 10.3390/ani11041113
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Na S, Na L, Xinwang D, Haitao N. Interacción entre el microbioma intestinal y el sistema inmune de la mucosa. Milit Med Res. (2017) 4:14. DOI: 10.1186/S40779-017-0122-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Liu C, Liang X, Wei X, Jin Z, Chen F, Tang Q, et al. La decocción Gegen qinlian trata la diarrea en lechones mediante la modulación de la microbiota intestinal y los ácidos grasos de cadena corta. Microbiol frontal. (2019) 10:825. doi: 10.3389/fmicb.2019.00825
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Li Q, Liu W, Feng Y, Hou H, Zhang Z, Yu Q, et al. Radix Puerariae thomsonii polysaccharide (RPP) mejora la inflamación y la peroxidación lipídica en ratones con dieta alta en alcohol y grasas mediante la regulación de la microbiota intestinal. Int J Biol Macromol. (2022) 209:858–70. doi: 10.1016/j.ijbiomac.2022.04.067
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Medrano-Galarza C, LeBlanc SJ, Jones-Bitton A, DeVries TJ, Rushen J, Marie DPA, et al. Asociaciones entre las prácticas de manejo y la prevalencia dentro de la jaula de diarrea de terneros y enfermedades respiratorias en granjas lecheras que utilizan alimentadores de leche automatizados. J Dairy Sci. (2018) 101:2293–308. DOI: 10.3168/JDS.2017-13733
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Renaud DL, Kelton DF, Weese JS, Noble C, Duffield TF. Evaluación de un probiótico multiespecie como tratamiento de apoyo para la diarrea en terneros lecheros: un ensayo clínico aleatorizado. J Dairy Sci. (2019) 102:4498–505. DOI: 10.3168/JDS.2018-15793
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Islam J, Tanimizu M, Shimizu Y, Goto Y, Ohtani N, Sugiyama K, et al. Desarrollo de un marco racional para la eficacia terapéutica del trasplante de microbiota fecal para el tratamiento de la diarrea de terneros. Microbioma. (2022) 10:31. doi: 10.1186/s40168-021-01217-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Yue SJ, Liu J, Wang WX, Wang AT, Yang XY, Guan HS, et al. Diarrea leve emergente del tratamiento con berberina asociada con disbiosis de la microbiota intestinal. Biomed Pharmacother. (2019) 116:109002. doi: 10.1016/j.biopha.2019.109002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Yang B, Huang Z, He Z, Yue Y, Zhou Y, Ross RP, et al. Efecto protector de Bifidobacterium bifidum FSDJN7O5 y Bifidobacterium breve FHNFQ23M3 sobre la diarrea causada por E. enterotoxigénica. Coli. Función de alimentos. (2021) 12:7271–82. doi: 10.1039/D1FO00504A
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Dong N, Xue C, Zhang L, Zhang T, Wang C, Bi C, et al. El ácido oleanólico mejora las uniones estrechas y mejora la inflamación en la diarrea inducida por Salmonella typhimurium en ratones a través de la vía TLR4 / NF-κB y MAPK. Función de alimentos. (2020) 11:1122–32. doi: 10.1039/C9FO01718F
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, et al. Un catálogo de genes microbianos intestinales humanos establecido por secuenciación metagenómica. Naturaleza. (2010) 464:59–65. doi: 10.1038/nature08821
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Huang C, Dong J, Jin X, Ma H, Zhang D, Wang F, et al. Los efectos antiinflamatorios intestinales del par de hierbas fuzi-ganjiang contra la colitis ulcerosa inducida por DSS en ratones. J Etnofarmacol. (2020) 261:112951. doi: 10.1016/j.jep.2020.112951
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Wu T, Wang X, Xiong H, Deng Z, Peng X, Xiao L, et al. Los bioactivos y sus metabolitos de Tetrastigma hemsleyanum mejoran la colitis inducida por DSS protegiendo la barrera intestinal, mitigando el estrés oxidativo y regulando la microbiota intestinal. Función de alimentos. (2021) 12:11760–76. doi: 10.1039/D1FO02588K
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Wang Y, Zhang H, Zhu L, Xu Y, Liu N, Sun X, et al. Distribución dinámica de la microbiota intestinal en cabras de diferentes edades y estados de salud. Microbiol frontal. (2018) 9:2509. DOI: 10.3389/fmicb.2018.02509
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. He L, Wang C, Simujide H, Aricha H, Zhang J, Liu B, et al. Efectos de la infección patógena por E. coli en la composición de la flora, función y contenido de ácidos grasos de cadena corta en heces de terneros. Animales. (2022) 12:959. doi: 10.3390/ani12080959
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Shin NR, Whon TW, Bae JW. Proteobacteria: firma microbiana de la disbiosis en la microbiota intestinal. Tendencias Biotechnol. (2015) 33:496–503. doi: 10.1016/j.tibtech.2015.06.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Lin TL, Shu CC, Chen YM, Lu JJ, Wu TS, Lai WF, et al. Como curas como: actividad farmacológica de lipopolisacáridos antiinflamatorios del microbioma intestinal. Frente Pharmacol. (2020) 11:554. DOI: 10.3389/FPHAR.2020.00554
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Li Q, Wu W, Fang X, Chen H, Han Y, Liu R, et al. Caracterización estructural de un polisacárido de brote de bambú (Phyllostachys edulis) y su efecto preventivo en ratones colitis. Química de alimentos. (2022) 387:132807. doi: 10.1016/j.foodchem.2022.132807
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Ohkusa T, Yoshida T, Sato N, Watanabe S, Tajiri H, Okayasu I. Las bacterias comensales pueden entrar en las células epiteliales del colon e inducir la secreción de citoquinas proinflamatorias: un posible mecanismo patogénico de la colitis ulcerosa. J Med Microbiol. (2009) 58:535–45. DOI: 10.1099/JMM.0.005801-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Hennessy M, Indugu N, Vecchiarelli B, Redding L, Bender J, Pappalardo C, et al. Comunicación corta: comparación de las comunidades bacterianas fecales en terneros lecheros diarreicos y no diarreicos de múltiples granjas en el sureste de Pensilvania. J Dairy Sci. (2021) 104:7225–32. DOI: 10.3168/JDS.2020-19108
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Fan P, Kim M, Liu G, Zhai Y, Liu T, Driver JD, et al. La microbiota intestinal de los terneros recién nacidos y la influencia de los probióticos potenciales en la reducción de la enfermedad diarreica mediante la inhibición de la colonización de patógenos. Microbiol frontal. (2021) 12:772863. DOI: 10.3389/fmicb.2021.772863
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Chang MN, Wei JY, Hao LY, Ma FT Li HY, Zhao SG, et al. Efectos de diferentes tipos de suplementos de zinc sobre el crecimiento, la incidencia de diarrea, la función inmune y la microbiota rectal de terneros lecheros recién nacidos. J Dairy Sci. (2020) 103:6100–13. DOI: 10.3168/JDS.2019-17610
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Becker AA, Hesta M, Hollants J, Janssens GP, Huys G. El análisis filogenético de la microbiota fecal de guepardos cautivos revela una representación insuficiente de Bacteroidetes y Bifidobacteriaceae. BMC Microbiol. (2014) 14:43. DOI: 10.1186/1471-2180-14-43
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Takahashi K, Nishida A, Fujimoto T, Fujii M, Shioya M, Imaeda H, et al. Reducción de la abundancia de especies de bacterias productoras de butirato en la comunidad microbiana fecal en la enfermedad de Crohn. Digestión. (2016) 93:59–65. doi: 10.1159/000441768
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Chen L, Wang W, Zhou R, Ng SC Li J, Huang M, et al. Características de la microbiota asociada a heces y mucosas en pacientes chinos con enfermedad inflamatoria intestinal. Medicina. (2014) 93:e51. doi: 10.1097/MD.0000000000000051
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Gu W, Zhang L, Han T, Huang H, Chen J. Dynamic changes in gut microbiome of ulcerative colitis: Initial study from animal model. J Inflamm Res. (2022) 15:2631–47. doi: 10.2147/JIR. S358807
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Bartels CJ, Holzhauer M, Jorritsma R, Swart WA, Lam TJ. Prevalencia, predicción y factores de riesgo de enteropatógenos en heces normales y no normales de terneros lecheros holandeses jóvenes. Prev Vet Med. (2010) 93:162–9. doi: 10.1016/j.prevetmed.2009.09.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Veiga P, Pons N, Agrawal A, Oozeer R, Guyonnet D, Brazeilles R, et al. Cambios en el microbioma intestinal humano inducidos por un producto lácteo fermentado. (2014) 4:6328. doi: 10.1038/srep06328
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Malmuthuge N, Chen Y, Liang G, Goonewardene LA, Guan LL. La alimentación con calostro tratada térmicamente promueve la colonización de bacterias beneficiosas en el intestino delgado de terneros neonatales. J Dairy Sci. (2015) 98:8044–53. DOI: 10.3168/JDS.2015-9607
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Healey GR, Tsai K, Schick A, Lisko DJ, Cook L, Vallance BA, et al. La nutrición enteral exclusiva enriquecida con prebióticos suprime la colitis a través de la modulación del microbioma intestinal y la expansión de las células T antiinflamatorias en un modelo de colitis de ratón. Célula Mol Gastroenterol Hepatol. (2021) 12:1251–66. doi: 10.1016/j.jcmgh.2021.06.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Bag S, Ghosh TS, Das B. Complete genome sequence of collinsella aerofaciens isolated from the gut of a healthy Indian subject. Genoma Announc. (2017) 5:E01361–17. doi: 10.1128/genomeA.01361-17
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Koropatkin NM, Cameron EA, Martens EC. Cómo el metabolismo de los glicanos da forma a la microbiota intestinal humana. Nat Rev Microbiol. (2012) 10:323–35. DOI: 10.1038/NRMICRO2746
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Wang JJ, Zhang QM Ni WW, Zhang X, Li Y, Li AL, et al. Efecto modulador de Lactobacillus acidophilus KLDS 1.0738 sobre el metabolismo intestinal de ácidos grasos de cadena corta y la expresión de GPR41/43 en ratones sensibilizados con β-lactoglobulina. Microbiol Immunol. (2019) 63:303–15. doi: 10.1111/1348-0421.12723
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Duscha A, Gisevius B, Hirschberg S, Yissachar N, Stangl GI, Eilers E, et al. El ácido propiónico da forma al curso de la enfermedad de esclerosis múltiple mediante un mecanismo inmunomodulador. Celda. (2020) 180:1067–80. doi: 10.1016/j.cell.2020.02.035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Li K, Zeng Z, Liu J, Pei L, Wang Y, Li A, et al. Efectos de la modulación de ácidos grasos de cadena corta en patógenos potencialmente causantes de diarrea en yaks a través de secuenciación metagenómica. Las células frontales infectan microbiol. (2022) 12:805481. DOI: 10.3389/fcimb.2022.805481
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Angelini R, Vortmeier G, Corcelli A, Fuchs B. Un método rápido para la determinación de la relación PC/LPC en suero intacto por MALDI-TOF MS: un biomarcador lipídico de inflamación fácil de seguir. Lípidos químicos físicos. (2014) 183:169–75. doi: 10.1016/j.chemphyslip.2014.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Sanchez B. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis: a role for bifidobacteria and lactobacilli? Nat Rev Gastroenterol Hepatol. (2018) 15:205. doi: 10.1038/nrgastro.2018.23
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Yum HW, Na HK, Surh YJ. Efectos antiinflamatorios del ácido docosahexaenoico: implicaciones para su potencial quimiopreventivo contra el cáncer. Semin Cancer Biol. (2016) 40–41: 141–59. doi: 10.1016/j.semcancer.2016.08.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Pietrocola F, Galluzzi L, Bravo-San PJ, Madeo F, Kroemer G. Acetyl coenzyme a: a central metabolite and second messenger. Celda Metab. (2015) 21:805–21. doi: 10.1016/j.cmet.2015.05.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: polisacáridos de Pueraria lobata, microbiota intestinal, metabolitos, ternero neonatal, diarrea
Cita: Shen L, Shen Y, You L, Zhang Y, Su Z, Peng G, Deng J, Zuo Z, Zhong Z, Ren Z, Yu S, Zong X, Zhu Y y Cao S (2023) Los polisacáridos de Pueraria lobata alivian la diarrea neonatal de la pantorrera mediante la modulación de la microbiota intestinal y sus metabolitos. Frente. Vet. Sci. 9:1024392. doi: 10.3389/fvets.2022.1024392
Recibido: 21 de agosto de 2022; Aprobado: 23 de noviembre de 2022;
Publicado: 04 enero 2023.
Editado por:
Bing Dong, Universidad Agrícola de China, China
Revisado por:
Aoyun Li, Universidad Agrícola de Huazhong, China Shu-Cheng Huang, Universidad Agrícola de Henan, China
Derechos de autor © 2023 Shen, Shen, You, Zhang, Su, Peng, Deng, Zuo, Zhong, Ren, Yu, Zong, Zhu y Cao. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Yingkun Zhu,  Yingkun_Zhu@outlook.com; Suizhong Cao,
Yingkun_Zhu@outlook.com; Suizhong Cao,  Suizhongcao@126.com
Suizhongcao@126.com
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía