Manifestaciones neurológicas en perros con leucemia aguda
 Filipa L. S. Lyseight1*
Filipa L. S. Lyseight1* Charles Pittaway1
Charles Pittaway1 Ruth Dennis2
Ruth Dennis2 Giunio B. Cherubini3,4
Giunio B. Cherubini3,4- 1Servicio de Oncología, Dick White Referrals, parte de Linnaeus Veterinary Limited, Cambridgeshire, Reino Unido
- número arábigoServicio de Diagnóstico por Imágenes, Dick White Referrals, parte de Linnaeus Veterinary Limited, Cambridgeshire, Reino Unido
- 3Servicio de Neurología y Neurocirugía, Dick White Referrals, parte de Linnaeus Veterinary Limited, Cambridgeshire, Reino Unido
- 4Departamento de Ciencias Veterinarias, Universidad de Pisa, Pisa, Italia
La leucemia aguda canina es una neoplasia hematopoyética poco frecuente. Se han reportado con frecuencia anomalías neurológicas en perros con leucemia aguda (AL). Sin embargo, la descripción de la presentación y los hallazgos son limitados. El objetivo de este estudio fue describir los hallazgos clínicos en perros con leucemia aguda que presentan signos neurológicos como queja principal. Se buscó en la base de datos de un hospital privado de referencia los casos que acudieron al servicio de neurología con déficits neurológicos y posteriormente fueron diagnosticados de leucemia aguda. Se incluyeron seis casos; Todos presentaban signos clínicos neurológicos y un examen neurológico anormal. Todos los casos tenían una localización neuroanatómica focal en el examen neurológico (cerebro n = 4; espinal = 2). De los cuatro perros con un estudio completo de resonancia magnética (RM), había un patrón infiltrativo mal definido con una intensidad de señal anormal en el sistema nervioso central (SNC) en tres perros y la pérdida de diferenciación de la materia gris y blanca en el cerebro (n = 2) y/o la médula espinal (n = 2). Otros hallazgos de la RM incluyeron realce meníngeo anormal (n = 3), cambios que afectan los nervios espinales y los músculos epaxiales (n = 2) y linfadenopatía en el campo de visión (n = 2). La evaluación de la médula ósea en la RM mostró evidencia de cambio de señal (n = 3), caracterizado por una pérdida de la opacidad normal de la grasa y un grado anormal de realce del contraste. El análisis del líquido cefalorraquídeo (LCR) de los cuatro perros mostró un aumento del nivel de proteínas con pleocitosis inespecífica y sin evidencia de células malignas. Se aplicó tratamiento con medicación citotóxica en dos perros. Los perros diagnosticados de leucemia aguda tenían localización neuroanatómica focal, un patrón infiltrativo del SNC y remodulación de la médula ósea en la RM con un aumento de la proteína del LCR y un análisis citológico negativo.
1 Introducción
Los tumores hematopoyéticos pueden originarse en las células del sistema inmunitario (por ejemplo, linfoma) o en la médula ósea (por ejemplo, leucemia). La leucemia aguda (AL) se define como la proliferación incontrolada de células linfoides o mieloides inmaduras (blásticas) en la médula ósea, que pueden clasificarse como leucemia linfoide aguda (LLA) o leucemia mieloide aguda (LMA), respectivamente (1-3). La AL ocurre cuando hay una rápida proliferación de blastocitos en la etapa temprana del desarrollo, reemplazando a las células hematopoyéticas normales, que pueden diseminarse en la sangre y/o infiltrarse en órganos como los ganglios linfáticos, el hígado y el bazo (4). . La Organización Mundial de la Salud (OMS) define la leucemia aguda como un aumento de la presencia de blastocitos en la médula ósea (>20% para la LMA y >25% para la LLA) o en la sangre periférica (> 20% para la LMA y la LLA) (5). En la leucemia crónica (LC), hay una acumulación de células maduras y maduras en la médula ósea. La leucemia crónica también tiene un inicio crónico de los síntomas, a diferencia de la leucemia aguda, que tiene un curso clínico rápido (4, 6).
Los perros con AL suelen presentar signos inespecíficos como letargo e inapetencia. Los hallazgos de la exploración física incluyen pirexia, linfadenopatía periférica leve, organomegalia abdominal, examen neurológico anormal, membranas mucosas pálidas y hemorragia (p. ej., epistaxis). El hallazgo hematológico más frecuente es un elevado número de blastocitos circulantes y bicitopenia (más del 50% de los perros), caracterizada por anemia y trombocitopenia. Un aumento moderado en el nivel de fosfatasa alcalina (ALP) es el hallazgo bioquímico más reportado (1, 7-10). Aproximadamente el 30% de los perros tienen una masa cráneo-torácica identificada en las radiografías torácicas. Los hallazgos más frecuentes en la ecografía de abdomen son esplenomegalia, hepatomegalia y adenopatías intraabdominales (9, 11). La leucemia se diagnostica en la clínica mediante análisis citológico (análisis morfológico y citoquímico) de sangre periférica, médula ósea y/o órganos infiltrados (1, 3, 12). En los últimos tiempos, la citometría de flujo ha mejorado el diagnóstico (CD34 positivo) y la subtipificación de la leucemia (3, 9, 12). Las tasas de supervivencia son bajas sin el uso de ningún medicamento citotóxico (menos de 5 días). Los perros tratados con protocolos de quimioterapia multifarmacológica también tienen un pronóstico precario, con tasas medias de supervivencia reportadas que varían de 9 a 120 días (9, 12).
Los signos clínicos neurológicos se han reportado con frecuencia en perros con leucemia aguda; sin embargo, la descripción de los hallazgos clínicos es limitada (8-10). Algunos informes de casos han documentado signos neurológicos como la queja principal (13-16). Se han notificado casos de ataxia, inclinación de la cabeza, presión de la cabeza, círculos, ceguera aguda, parálisis mandibular, fotofobia, convulsiones y atrofia difusa de los músculos esqueléticos craneales (10, 13-15). La infiltración de la médula espinal se ha asociado con tetraparesia, paraplejia flácida, ausencia de nocicepción y reflejos espinales, dolor e incontinencia de la neurona motora inferior (15-17). La descripción de los hallazgos de neuroimagen diagnóstica se limita a dos casos. El primer caso mostró compresión bilateral extradural de C2 a C5 en el mielograma; Esto se confirmó como un subtipo de leucemia aguda en la necropsia (15). El segundo caso mostró infartos y un patrón infiltrativo dentro de la región talámica derecha del cerebro en la resonancia magnética, sospechando que era AL (10). Se informó de citología y bioquímica del líquido cefalorraquídeo en dos perros, mostrando un alto número de células blásticas (>130 por μL) y un aumento de proteínas (12-15 mg/dL) (13, 17).
La resonancia magnética es la única modalidad de imagen que permite la visualización directa de la médula ósea (18). La médula ósea está compuesta por células grasas y células hematopoyéticas activas, que determinan la intensidad de su señal en la resonancia magnética. Una médula ósea madura parece hiperintensa para el músculo esquelético y el disco intervertebral, y similar a la grasa subcutánea con supresión de la señal en la recuperación de la inversión corta de tau (STIR) o con saturación espectral de grasa (19-21). Las neoplasias hematológicas malignas causan reemplazo de médula ósea que puede verse como hipointensidad en T1- e hiperintensidad en imágenes potenciadas en T2. Este hallazgo es inespecífico y también se asocia con trastornos inflamatorios o metabólicos. La resonancia magnética de la médula ósea es sensible para el diagnóstico de linfoma y leucemia en medicina humana y se utiliza para evaluar la respuesta al tratamiento (18, 19, 22, 23).
Este estudio tiene como objetivo describir los hallazgos clínicos en perros con leucemia aguda, que presentan signos neurológicos como queja principal. El objetivo secundario fue caracterizar los cambios en la médula ósea de la resonancia magnética en perros con leucemia aguda.
2 Materiales y métodos
Se revisaron retrospectivamente las historias clínicas de los perros que se presentaron entre enero de 2010 y diciembre de 2022 del Servicio de Neurología de un único centro privado de referencia. Los criterios de inclusión fueron los siguientes: (1) tener un examen neurológico realizado por un neurólogo o residente certificado por la junta y (2) ser diagnosticado de leucemia aguda con base en la citología de médula ósea o sangre periférica (> 20% de células blásticas) (1, 9) o citometría de flujo. Se excluyeron los casos si había sospecha clínica de linfoma multicéntrico en estadio V (por ejemplo, ganglios linfáticos periféricos >1 cm) o si se identificaron otras causas de molestias neurológicas. Todos los estudios de resonancia magnética (Hitachi Aperto Lucente 0.4 Tesla, Berkshire, Reino Unido) fueron revisados por un diplomado del Colegio Europeo de Diagnóstico por Imágenes Veterinarias (ECVDI). Los informes iniciales de análisis citológico e histopatológico fueron evaluados por un patólogo clínico veterinario certificado por la junta en la presentación inicial. Los datos recopilados incluyeron la señalización (edad, sexo, estado de castración, peso corporal y raza), la historia clínica, los signos clínicos, el examen clínico general, el examen neurológico, los hallazgos del procedimiento diagnóstico, los tratamientos y los resultados.
3 Resultados
Un total de ocho perros cumplieron con los criterios de inclusión; se excluyeron dos ya que un perro tenía una extrusión de disco intervertebral en la RM y el otro perro tenía linfoma en estadio V. Finalmente se incluyeron un total de seis perros. Había cinco machos y una hembra, todos castrados. La mediana de edad fue de 3,6 años (rango 2,5-4,3) y la mediana de peso corporal fue de 21,35 kg (rango 3,8-38 kg). Las razas representadas fueron el Springer Spaniel Inglés (n = 2), el Border Collie, el Chihuahua, el Golden Retriever y el Bulldog Francés. Todos los propietarios informaron antecedentes de signos clínicos agudos (n = 1) o progresivos con deterioro agudo (n = 5), incluida la deambulación anormal (cojera unilateral intermitente de las extremidades torácicas n = 2; ataxia n = 2; paraparesia n = 2) y dolor intermitente (n = 2), que comenzó entre 12 h y 3 semanas antes de la presentación. Un perro mostró signos clínicos inespecíficos adicionales, como letargo, jadeo intermitente, inapetencia e hipersalivación.
Durante el examen neurológico, todos los perros mostraron cambios que incluían estado mental deprimido (n = 3), paresia (paraparesia n = 3; hemiparesia n = 1), ataxia generalizada (propioceptivo n = 3; vestibular n = 1), ausencia de amenaza (con reflejo palpebral normal n = 1; con ausencia de reflejo palpebral n = 1), nistagmo rotatorio (n = 1), disminución de la sensibilidad facial y nasal (n = 1), disminución o ausencia de reacciones posturales (extremidades pélvicas bilaterales n = 2; lado derecho n = 1), disminución del tono muscular y de los reflejos espinales segmentarios (extremidades torácicas bilaterales n = 1; extremidades pélvicas bilaterales n = 2), porte de la cabeza bajo con postura plantígrada (n = 1) y dolor (dolor espinal difuso n = 2; dolor de columna cervical n = 1). La localización neuroanatómica fue consistente en cerebro (prosencéfalo n = 2; aparato vestibular n = 1; cerebro difuso n = 1) y columna vertebral (cervical n = 1; mielopatía difusa con predominio en L4-S3 n = 1). Sobre la base del examen clínico general, se detectaron tres perros con anomalías, incluida una linfadenopatía periférica leve caracterizada por ganglios linfáticos periféricos firmes <1 cm (n = 2), pirexia (n = 1) y atrofia muscular generalizada (n = 1).
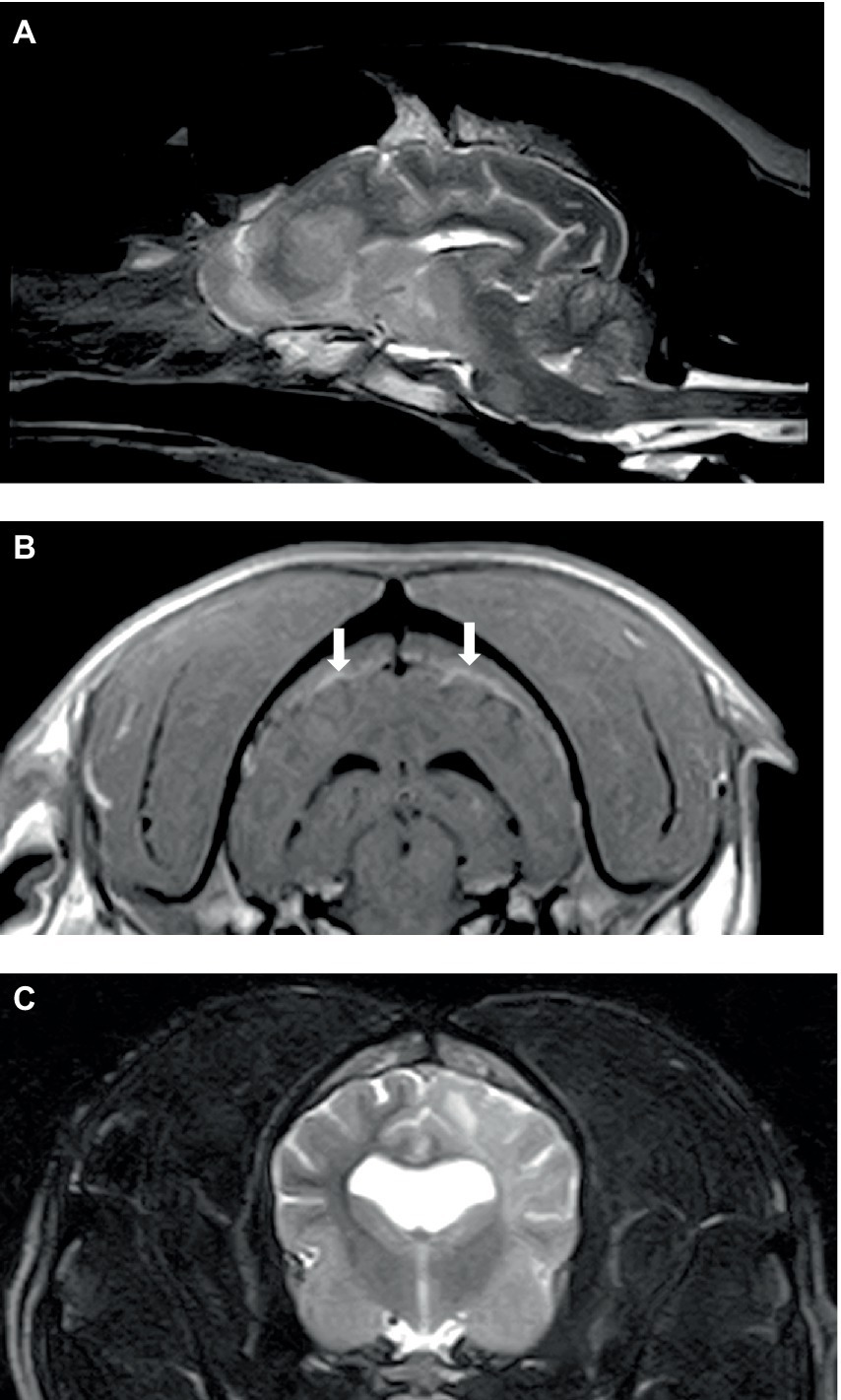
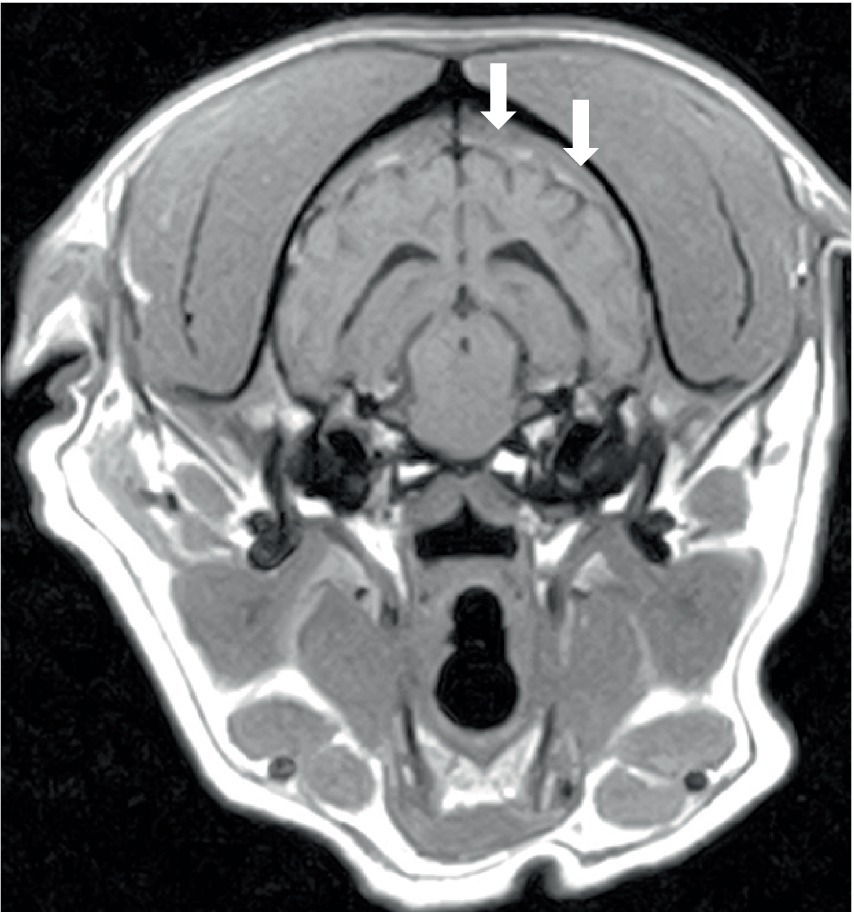
De los seis perros, tres perros se sometieron a un procedimiento de resonancia magnética del cerebro y dos perros se sometieron a un procedimiento de resonancia magnética de la columna vertebral. El estudio se interrumpió en un perro porque el diagnóstico de leucemia aguda se realizó mediante citología de sangre periférica. Las imágenes sagitales y transversales ponderadas en T2 (T2W) obtenidas del cerebro y los huesos circundantes parecían normales. Había linfadenomegalia (mandibular y retrofaríngea) y amígdala derecha. Los estudios cerebrales completos en los otros dos perros incluyeron T2W sagital, T2W transversal, FLAIR, T2*GE y T1W, y T1W post-contraste en tres planos; se obtuvo una imagen adicional de STIR oblicua dorsal y una imagen T1W post-contraste dorsal en un perro. Ambos estudios mostraron parches de hiperintensidad generalizados/multifocales mal definidos en T2W y STIR tanto en la materia gris como en la blanca del cerebro, que mostraron una mejora del contraste débil y mal definida que aumentaba con el tiempo. En un perro (Figuras 1A, B), estas lesiones se observaron en todas las áreas del cerebro, y estas lesiones se asociaron con un efecto de masa mínimo, mientras que el segundo perro tenía una patología difusa del lado izquierdo solo con efecto de masa leve a moderado (Figura 1C). Hubo un aumento del contraste meníngeo (paquimeninges n = 2; leptomeninges n = 1), y las meninges estaban engrosadas en un perro. La parte craneal de la médula espinal se incluyó en un estudio y mostró parches sutiles y mal definidos (como se describe para el cerebro) en C1-C2. Un perro tenía hiperintensidad de la musculatura adyacente.
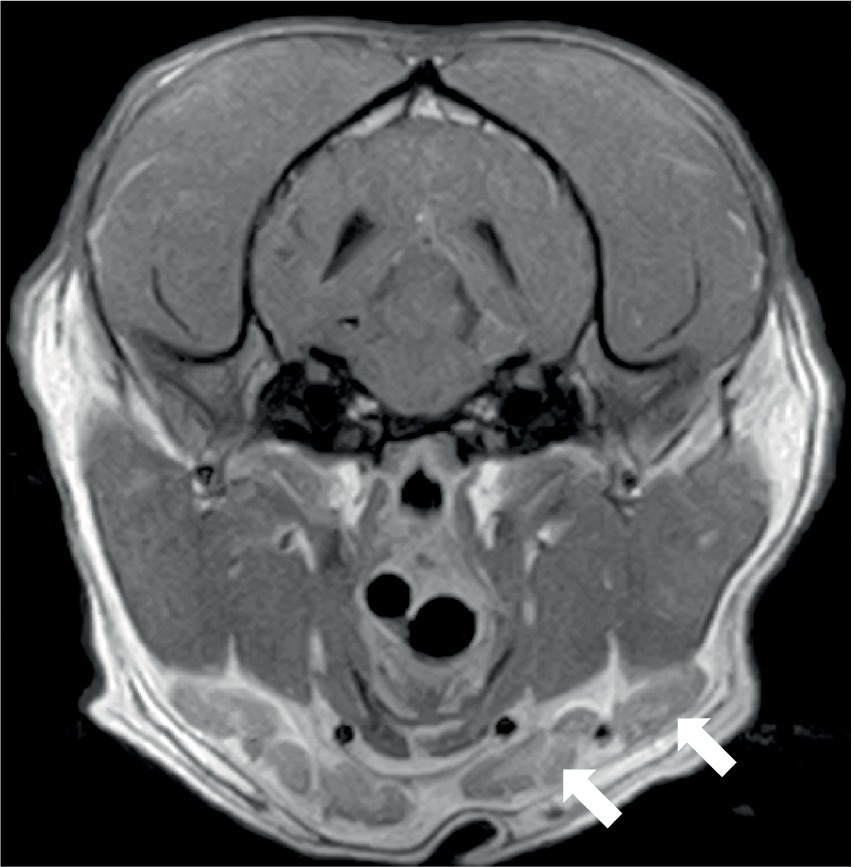
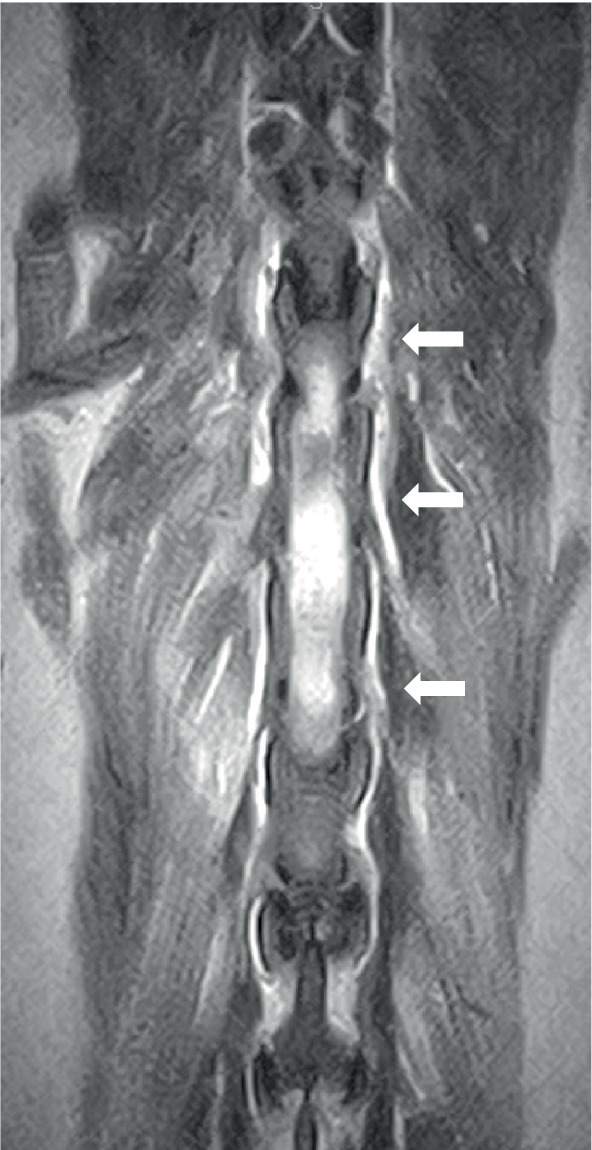
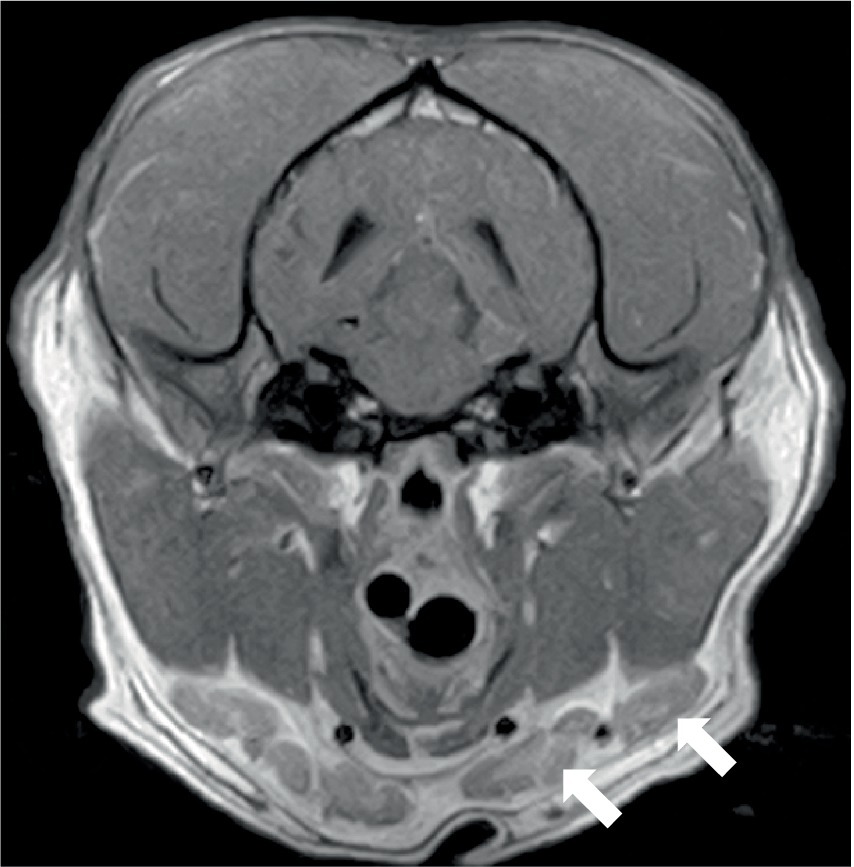
Dos perros se sometieron a resonancias magnéticas de la columna vertebral. El estudio de la columna cervicotorácica incluyó T2W sagital, STIR, T1W pre y post-contraste, y T2W transversal y imágenes STIR, que mostraron una inflamación moderada y difusa de la médula espinal de C3-C5 con hiperintensidad medular sutil y en parches como se observa en STIR. El estudio toracolumbar incluyó T2W sagital y dorsal e imágenes STIR sagitales y transversales, y en el mismo perro, un estudio lumbosacro incluyó T2W, STIR y T1W sagitales, y T2W transversal y dorsal. No se observaron anomalías en la médula espinal en ninguno de los sitios. Ambos perros tenían evidencia de inflamación del nervio espinal; en el primer perro, esta era bilateral y multifocal (Figura 2) y el otro perro tenía una raíz espinal engrosada en L1 dentro del canal vertebral. En ambos casos, la musculatura adyacente (epaxial o longus colli) mostró hiperintensidad severa, bilateral, bien definida y asimétrica (Figura 3). Se consideró que un perro tenía una ausencia inequívoca de meningitis y el otro tenía cambios epidurales dispersos sugestivos de meningitis o empiema. Un perro tenía esplenomegalia.
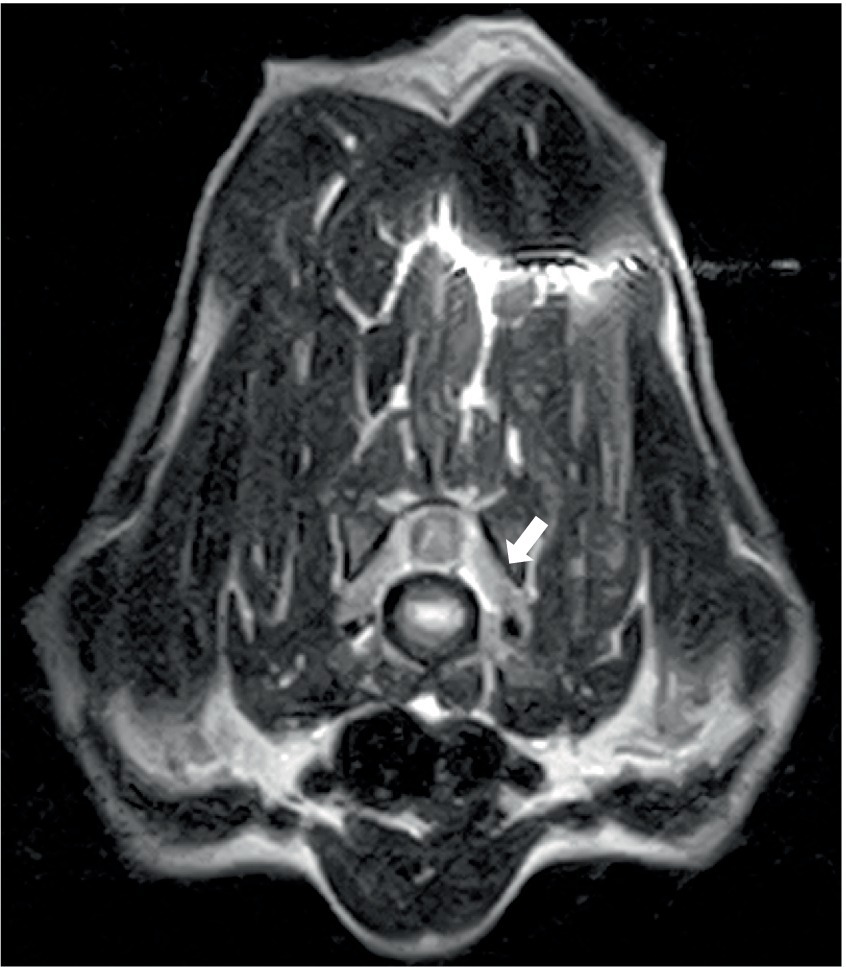
Tres perros mostraron remodelación de la médula ósea en la resonancia magnética. Esto se caracterizó por una pérdida heterogénea de la opacidad de la grasa de la médula ósea normal en T1 y una falta de supresión en STIR (Figura 4), y un perro mostró un aumento leve del contraste de la médula ósea. Estos cambios se observaron en los huesos adyacentes a la musculatura o meninges anormales, como se describió anteriormente (hueso del calvario n = 2; manubrio y escápulas n = 1). Todos los perros tenían linfadenopatía leve a moderada (Figura 5) de varios ganglios linfáticos dentro del campo de visión (FOV) (Figura 5).
Se obtuvo líquido cefalorraquídeo de la cisterna magna de cuatro perros para su análisis citológico y bioquímico. Ninguno de los perros tenía una población neoplásica en la citología (Tablas 1, 2). A un perro se le realizó una biopsia incisional del músculo longus colli (hiperintenso en la resonancia magnética) para histopatología y cultivo. El análisis histopatológico reveló tejido adiposo maduro e inflamación neutrofílica consistente en una acumulación de neutrófilos degenerados. Los cultivos de enriquecimiento aeróbico y anaeróbico fueron negativos. Se realizaron pruebas adicionales en el mismo perro, incluida una prueba de chasquido transmitida por vectores; serología para Leishmania, Toxoplasma spp. y Neospora spp.; y hemocultivo. Todos los resultados fueron negativos.
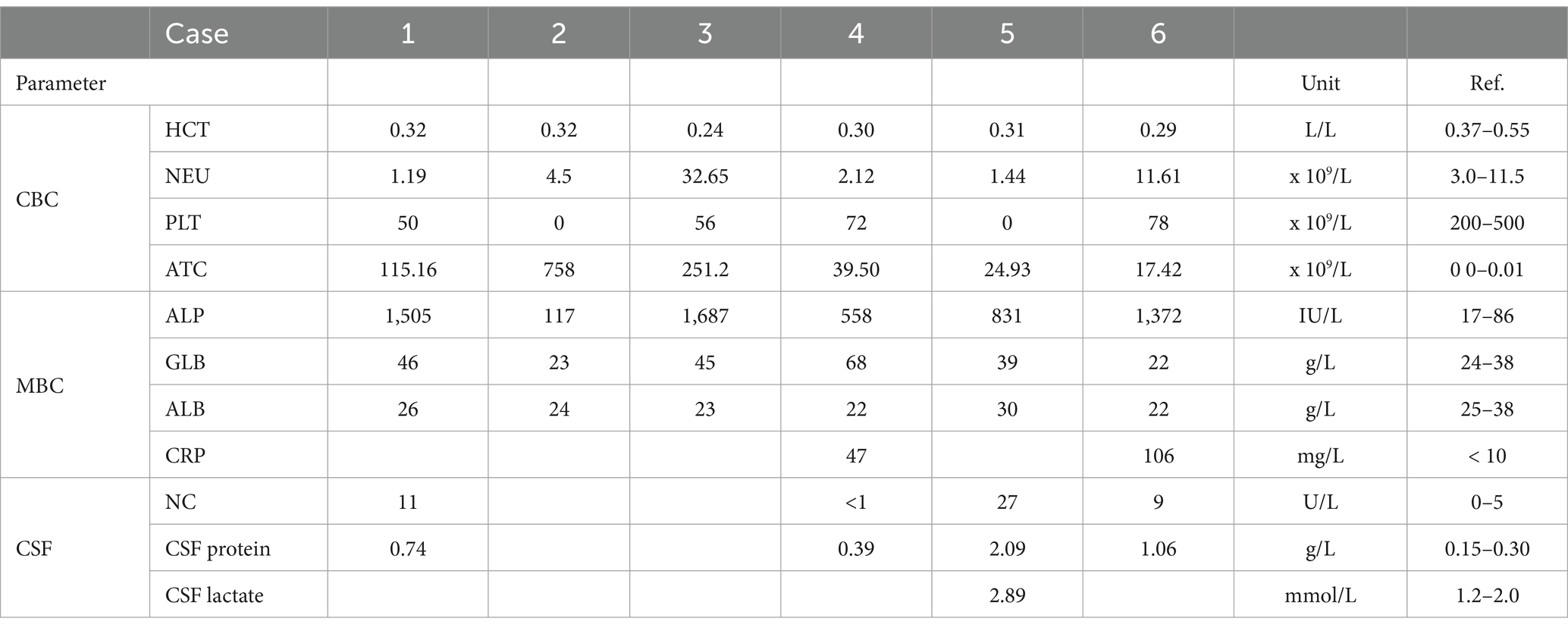
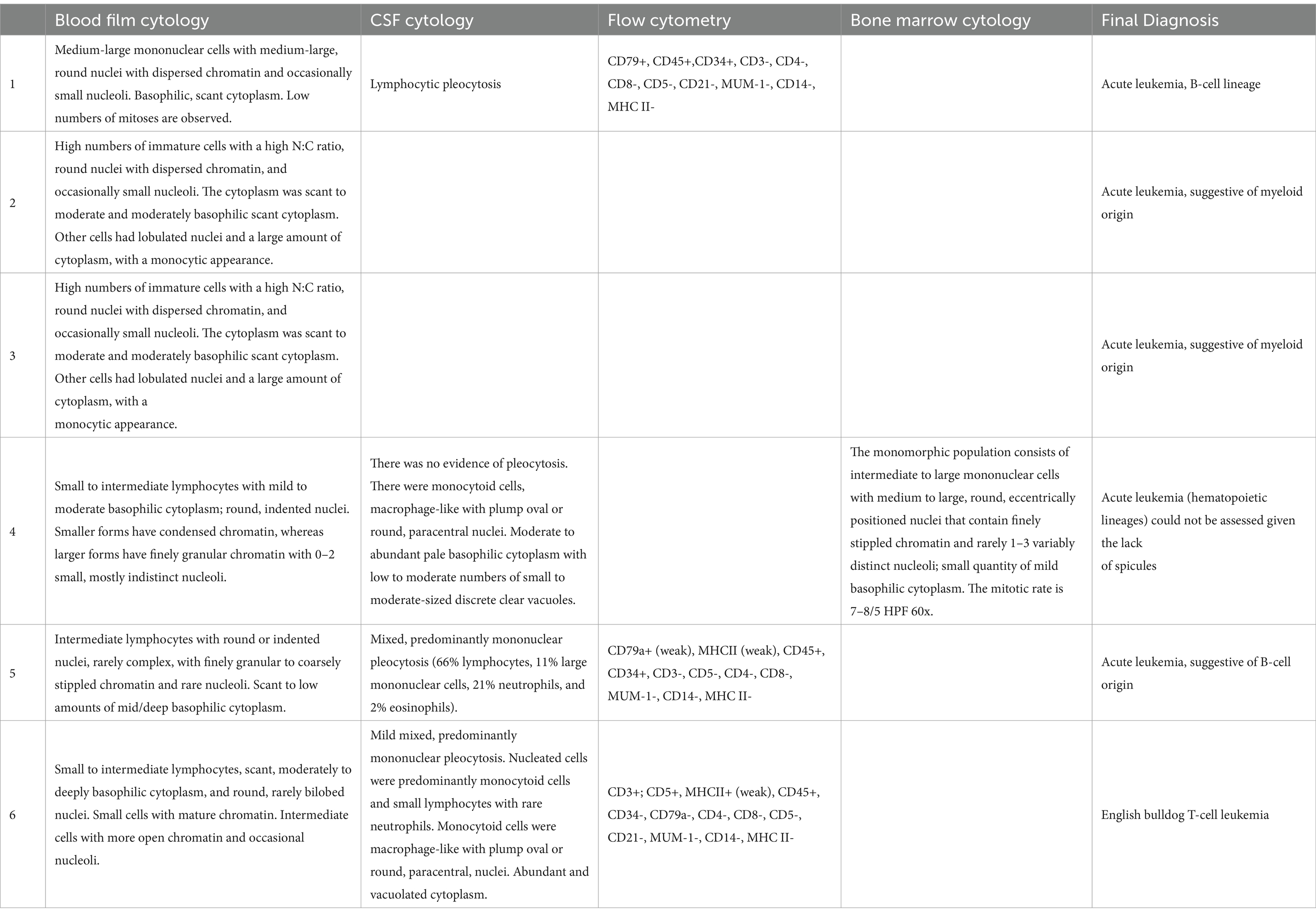
Los resultados de hematología y análisis de hematología en el momento de la presentación estaban disponibles para todos los perros. Todos los perros con leucocitosis y análisis citológico de sangre periférica se consideraron diagnósticos de leucemia en cuatro de los seis perros. Todos los perros tenían trombocitopenia grave y anemia leve no regenerativa, una mediana de recuento de plaquetas de 53 × 109/L (rango 0-78, R.I.: 200-500) y una mediana de hematocrito de 0,30 L/L (rango 24-32, R.I.: 0,37-0,55). Tres perros presentaban pancitopenia con neutropenia leve (Tabla 1). En la bioquímica de la sangre periférica, todos los perros tenían un aumento de la fosfatasa alcalina con una mediana de 1.102 U/L (rango 117-1.687, R.I.: 17-86). Se identificó hiperglobulinemia leve a moderada en cuatro perros, y la proteína C reactiva se incrementó en los dos perros en los que se midió (Tabla 1). Se realizaron pruebas adicionales en cuatro perros para el diagnóstico de leucemia aguda, incluyendo citometría de flujo (n = 3) y citología y biopsia de médula ósea (n = 1) (Tabla 2).
Cuatro perros fueron sacrificados humanitariamente tras el diagnóstico de leucemia aguda. Un perro recibió dexametasona (0,1 mg/kg VO cada 24 horas), lomustina (50 mg/m2 VO), levetiracetam (20 mg/kg cada 8 horas) y amoxicilina/ácido clavulánico profiláctico (20 mg/kg VO cada 12 horas) debido a neutropenia. El propietario informó de una mejoría transitoria, pero el paciente se deterioró y fue sacrificado después de 4 días. El segundo perro recibió dexametasona (0,1 mg/kg VO cada 24 horas) y arabinósido de citarabina (210 mg/m2 SC). Antes del alta, la propiocepción y la marcha habían vuelto a la normalidad. Después de 10 días, se informó que el paciente tenía una buena calidad de vida y el examen neurológico estaba dentro de los límites normales, excepto por cojera leve, persistente y unilateral de las extremidades torácicas. Sin embargo, hubo una progresión de células atípicas circulantes, pero el propietario rechazó un protocolo de quimioterapia multifarmacológica. Se administró una segunda dosis de arabinósido de citarabina y se mantuvo el tratamiento con glucocorticoides (dexametasona) como se indicó anteriormente. La paciente fue sacrificada humanamente a las 4 semanas después del diagnóstico (7 días después del segundo tratamiento con citarabina) con antecedentes de anorexia, vómitos e hinchazón de las extremidades pélvicas.
4 Discusión
El objetivo de este estudio fue describir la presentación neurológica y los hallazgos clínicos de perros con leucemia aguda. Seis perros adultos jóvenes presentaron signos neurológicos asociados a neurolocalización focal. La deambulación y la postura anormales fueron los hallazgos más comunes. Todos presentaron trombocitopenia, anemia leve y aumento de la fosfatasa alcalina. Sin embargo, según el análisis de la película de sangre periférica, solo cuatro perros fueron diagnosticados con leucemia aguda. En la resonancia magnética, cinco perros tenían linfadenopatía y tres tenían parches hiperintensos (T2W y STIR) en la médula espinal y/o el cerebro asociados con el realce meníngeo y la remodelación de la médula ósea. Se observó un aumento de proteínas en los análisis de todo el líquido cefalorraquídeo y se observó pleocitosis inespecífica en tres perros. Los dos perros que recibieron quimioterapia fueron sacrificados dentro de 1 mes después del alta. Teniendo en cuenta que el diagnóstico de leucemia aguda rara vez es incidental y, en ausencia de otros diagnósticos, la afectación de la AL en el SNC se consideró altamente probable en los casos descritos. Sin embargo, no se realizó la histopatología para su confirmación.
Se ha planteado la hipótesis de que los signos neurológicos asociados con la AL del SNC se deben a la infiltración leptomeníngea, la infiltración de la médula espinal, los eventos vasculares (eventos hemorrágicos o tromboembólicos) o la presencia de una masa compresiva (24-26). En perros, se han reportado signos neurológicos en el 17-19% de los perros con AL, particularmente en la leucemia mieloide aguda, la leucemia linfoblástica aguda y la leucemia de células T del bulldog inglés (8, 10, 27). A pesar de la prevalencia de signos neurológicos, solo cuatro informes de casos han confirmado la afectación del SNC, según la citología del LCR o la histopatología del SNC. Dos de estos casos fueron confirmados durante la autopsia (13-16). Se encontraron células neoplásicas infiltradas en los nervios craneales, el cerebro, las meninges cerebrales y/o de la médula espinal, la sustancia gris de la médula espinal, el tejido adiposo epidural, las raíces nerviosas, el espacio extradural y el sistema nervioso extracentral (los ganglios linfáticos, el timo, la tiroides, el miocardio, el pericardio, los pulmones, el hígado, el bazo, los intestinos, las glándulas suprarrenales, el riñón, la próstata, la médula ósea y el músculo esquelético focal o difuso) (13–16). Se sospechaba que la afectación leptomeníngea del cerebro, también llamada meningitis leucémica, se producía a través de la vena aracnoidea y, posteriormente, del LCR (28). En medicina humana, la afectación del SNC es poco frecuente y principalmente asintomática, y se presenta en menos del 3 % de los niños y en el 5-10 % de los adultos con leucemia aguda (28-30). Sin embargo, un tercio de los casos recaen en el sistema nervioso central (24, 30).
Debido a la ausencia de blastocitos circulantes o a la ambigüedad de la citomorfología (reportada en el 15% de los perros), la citología de sangre periférica no siempre es diagnóstica para AL, como se observó en los casos descritos (8). Las alteraciones hematológicas y bioquímicas de laboratorio más frecuentes observadas fueron la bicitopenia (trombocitopenia y/o anemia) y una elevación moderada de la FA, como se ha descrito previamente (7, 12, 31). La mieloftisis, la regulación negativa de la eritropoyesis y la destrucción secundaria mediada por el sistema inmunitario son las posibles causas de la anemia y la trombocitopenia observadas en la leucemia canina (1). El aumento de la fosfatasa alcalina puede deberse a la fuga de la muerte de las células blásticas o a la producción de isoenzimas, a la remodulación de la médula ósea o a la infiltración hepática secundaria. Sin embargo, a diferencia de otros tipos de cáncer, no se ha identificado como una herramienta de monitorización o factor pronóstico (32).
El diagnóstico de AL del SNC en medicina humana requiere una combinación de signos clínicos, citocentrifugación del LCR, citometría de flujo +/−, resonancia magnética +/− y casos específicos de biopsia meníngea/tisular (24, 27, 29, 30, 32). Un realce leptomeníngeo nodular focal o difuso y un agrandamiento de los nervios craneales en la RM se consideran indicativos de afectación del SNC y justifican tratamiento local (33, 34). El realce paquimeníngeo en dos o más sitios del cerebro es un factor de pronóstico negativo (28). Los hallazgos de diagnóstico por imagen en el presente estudio se asemejan a la literatura humana y a la resonancia magnética de AL única informada. El diagnóstico diferencial tentativo de los hallazgos de la RM incluyó meningitis de etiología desconocida o linfoma. Se sospechó miositis en tres perros según los hallazgos de la resonancia magnética. Solo uno de los tres perros con cambios musculares se sometió a una biopsia, y esto fue consistente con inflamación neutrofílica estéril. La afectación musculoesquelética ocurre en el 8-38% de los pacientes humanos con leucemia aguda y se ha asociado con inflamación neutrofílica estéril, polimiositis, dermatomiositis o infecciones secundarias (35-38). La infiltración difusa del músculo esquelético de células neoplásicas ha sido un hallazgo en perros durante la necropsia (13, 15, 16).
La resonancia magnética es de especial relevancia en pacientes con análisis de LA y LCR normal, pero con una alta sospecha clínica de afectación del SNC (33). Históricamente, el diagnóstico de la leucemia del SNC se basaba principalmente en el citogiro del LCR. Sin embargo, debido a la baja sensibilidad asociada con el diagnóstico de leucemia (sensibilidad <50%; especificidad >95%), se recomienda la adición de citometría de flujo en LCR (sensibilidad 78%) (24, 27, 30). Los resultados de la citología pueden no ser representativos si solo hay un pequeño número de células neoplásicas presentes en un gran volumen de LCR, particularmente en casos con una afectación leptomeníngea mínima (29, 30). El aumento del nivel de proteína del LCR es un hallazgo común en los seres humanos con AL a pesar de los análisis citológicos normales. En el estudio que se presenta aquí, la citología del LCR no fue diagnóstica de leucemia. El predominio de células monocitoideas y pleocitosis mixta observada en este estudio es inespecífico y puede observarse con cualquier causa de necrosis o mielomalacia del SNC y se ha asociado con diversos procesos patológicos como meningoencefalitis granulomatosa, agentes infecciosos (p. ej., hongos, protozoos o Ehrlichia) y meningitis sensible a esteroides; sin embargo, con menor frecuencia con el meningioma (39, 40). La citometría de flujo solo se realizó en sangre periférica.
Los cambios en la médula ósea en la resonancia magnética en personas con leucemia aguda están bien documentados y pueden preceder a los cambios en las pruebas de laboratorio y el análisis de tejidos (21). Los patrones más comunes en la RM son señales T1W hipointensas difusas, irregulares y focales anormales (20). En los niños, la evidencia de remodulación de la médula ósea larga en la RM (patrón de reemplazo difuso) se ha asociado consistentemente con la leucemia en comparación con el linfoma (20, 21). No existen estudios en medicina veterinaria que evalúen la médula ósea en casos de neoplasia hematopoyética en perros. Sin embargo, en este estudio, tres de los cuatro perros con estudios completos de resonancia magnética presentaron cambios en la médula ósea como los observados en los huesos del esternón, el manubrio y la pantorrilla. El perro sin cambios en la médula ósea fue diagnosticado de AL mediante citología de médula ósea. Este sujeto solo tenía los huesos vertebrales incluidos en el estudio de resonancia magnética, y se ha demostrado que los huesos vertebrales tienen menos médula ósea (41).
Este estudio tiene varias limitaciones, entre ellas la pequeña población, la naturaleza retrospectiva del estudio, la falta de un protocolo de RM consistente, la ausencia de una necropsia para un diagnóstico definitivo de leucemia en el SNC y la necesidad de determinar la causa de los hallazgos de la RM. La meningoencefalomielitis, el principal diagnóstico diferencial, no se pudo diferenciar en función de la presentación clínica, la resonancia magnética o el análisis del LCR. Sin embargo, se consideró menos probable debido a la citopenia observada en los informes de hematología y a la linfadenopatía en la resonancia magnética. Los cambios en la resonancia magnética en perros con leucemia solo se han descrito en un perro, y no fue posible realizar comparaciones con otros estudios veterinarios. Una limitación adicional es que los estudios de resonancia magnética se limitaron a áreas determinadas por cambios en el examen neurológico, y una resonancia magnética de cuerpo entero podría haber proporcionado más información. Es posible que el método de búsqueda de datos haya disminuido el número de casos. Los casos diagnosticados por los veterinarios remitentes con signos neurológicos pueden haber sido remitidos a otros servicios y no fueron incluidos en el estudio. Sin embargo, como la AL es un diagnóstico poco frecuente, es posible que esto no haya obstaculizado los casos.
El diagnóstico de leucemia en el SNC en medicina veterinaria es difícil debido a la baja sensibilidad de la citología del LCR, el uso poco frecuente o la validez de la citometría de flujo del LCR en medicina veterinaria y la práctica poco común de la biopsia del sistema nervioso central. Los hallazgos de la RM están bien descritos en humanos con LA del SNC y se consideran diagnósticos; sin embargo, no hay evidencia similar en perros. En la mayoría de los casos notificados se confirmó el diagnóstico durante la autopsia. Por lo tanto, el diagnóstico clínico de leucemia en el SNC puede depender de una combinación de hallazgos clínicos y, posiblemente, de la adición de citometría de flujo. Dappiano et al. (16) sugirieron que la leucemia aguda debería incluirse como diagnóstico diferencial en perros con signos neurológicos por compresión medular con otros hallazgos (pirexia, linfadenopatía, hepatomegalia, leucocitosis marcada, anemia y trombocitopenia). En el estudio actual, los perros tenían signos leves o ausencia de enfermedad sistémica en el momento de la presentación. Como se ha comentado anteriormente, la citología de sangre periférica no siempre es un diagnóstico de AL. Además, algunos perros se presentan sin citopenia periférica (5-10%) (8, 9, 12). Esto puede llevar a una neoplasia del SNC infradiagnosticada según las pruebas de rutina. Dentro de otros diferenciales, los perros con lesiones hiperintensas difusas T2W en el cerebro o la médula espinal, realce meníngeo y remodelación de la médula ósea en la RM pueden sugerir neoplasia hematopoyética del SNC. Se requieren estudios adicionales para evaluar el papel de la citometría de flujo en la neoplasia del LCR canino, la compatibilidad de los hallazgos de la RM descritos y la histopatología. El reconocimiento de la participación del SNC en la medicina humana ha llevado a una mejora significativa en los resultados (30, 42) principalmente debido al uso de la terapia dirigida al SNC (quimioterapia intratecal y radioterapia) tanto en entornos profilácticos como terapéuticos (24, 30, 33, 41).
5 Conclusión
El diagnóstico de afectación del SNC en la LA no se confirmó a pesar de las investigaciones avanzadas en la mayoría de los casos. Se necesitan más estudios para evaluar si, al igual que en la medicina humana, una combinación de hallazgos clínicos es suficiente para lograr un diagnóstico e implementar un tratamiento local. Además, se necesitan estudios adicionales para evaluar el papel de la RM en la detección de la enfermedad hematopoyética en medicina veterinaria.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
La aprobación ética fue aprobada por el profesor David Morton, CBE, presidente del Panel de Revisión de Ética de RCVS. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. No se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio debido a su carácter retrospectivo. Hubo consentimiento para el uso de datos. No se requirió aprobación ética para el estudio con humanos.
Contribuciones de los autores
FL: Escritura – borrador original. CP: Escritura – revisión y edición. RD: Escritura – revisión y edición. GC: Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio recibió financiación de Linnaeus Veterinary Limited. El financiador no participó en el diseño del estudio, la recopilación, el análisis, la interpretación de los datos, la redacción de este artículo ni la decisión de enviarlo para su publicación.
Conflicto de intereses
FL, CP, RD y GC fueron empleados por Linnaeus Veterinary Limited.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Adam, F, Villiers, E, Watson, S, Coyne, K, y Blackwood, L. Evaluación clínico-patológica y epidemiológica de la leucemia canina morfológica e inmunológicamente confirmada. Veterinario Comp Oncol. (2009) 7:181–95. doi: 10.1111/j.1476-5829.2009.00189.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Avery, AC . Las bases genéticas y moleculares de los modelos caninos de leucemia y linfoma humanos. Frente Oncol. (2020) 10:23. doi: 10.3389/fonc.2020.00023
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Harris, RA, Rout, ED, Yoshimoto, JA, Avery, PR y Avery, AC. Uso del recuento digital de ARN para establecer criterios diagnósticos de citometría de flujo para subtipos de leucemia aguda canina CD34+. Veterinario Comp Oncol. (2022) 20:710–9. doi: 10.1111/vco.12825
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Chennamadhavuni, A, Lyengar, V, Mukkamalla, SKR, et al. Leucemia en: StatPearls. Treasure Island, FL: StatPearls Publishing (2023)
5. Alaggio, R, Amador, C, Anagnostopoulos, I, Attygalle, AD, Araujo, IBO, Berti, E, et al. 5ª edición de la clasificación de la Organización Mundial de la Salud de los tumores hematolinfoides : neoplasias linfoides. Leucemia. (2022) 36:1720–48. doi: 10.1038/s41375-022-01620-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Hallek, M . Leucemia linfocítica crónica: actualización de 2020 sobre el diagnóstico, la estratificación del riesgo y el tratamiento. Am J Hematol. (2019) 94:1266–87. doi: 10.1002/ajh.25595
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Comazzi, S, Gelain, ME, Bonfanti, U y Roccabianca, P. Leucemia megacarioblástica aguda en perros: informe de tres casos y revisión de la literatura. J Am Anim Hosp Assoc. (2010) 46:327–35. doi: 10.5326/0460327
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Davis, LL, Hume, KR, y Stokol, T. Una revisión retrospectiva de la leucemia mieloide aguda en 35 perros diagnosticada por una combinación de hallazgos morfológicos, inmunofenotipado citométrico de flujo y resultados de tinción citoquímica (2007-2015). Veterinario Comp Oncol. (2018) 16:268–75. doi: 10.1111/vco.12377
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Bennett, AL, Williams, LE, Ferguson, MW, Hauck, ML, Suter, SE, Lanier, CB, et al. Leucemia aguda canina: 50 casos (1989-2014). Veterinario Comp Oncol. (2017) 15:1101–14. doi: 10.1111/vco.12251
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Frankhouse, KA, Rout, ED, Hughes, KL, Labadie, JD, Yoshimoto, JA, Lana, SE, et al. Una neoplasia agresiva de células T CD4-CD8- en bulldogs ingleses jóvenes. Veterinario Comp Oncol. (2022) 20:416–26. doi: 10.1111/vco.12787
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Epperly, E, Hume, KR, Moirano, S, Stokol, T, Intile, J, Erb, HN, et al. Los perros con leucemia mieloide aguda o neoplasias linfoides (linfoma de células grandes o leucemia linfoblástica aguda) pueden tener masas mediastínicas indistinguibles en las radiografías. Ecografía Radiol Veterinaria. (2018) 59:507–15. doi: 10.1111/vru.12622
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Novacco, M, Comazzi, S, Marconato, L, Cozzi, M, Stefanello, D, Aresu, L, et al. Factores pronósticos en leucemias agudas caninas: estudio retrospectivo. Veterinario Comp Oncol. (2016) 14:409–16. doi: 10.1111/vco.12136
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Christopher, MM, Metz, AL, Klausner, J, Polzin, D, y Hayden, DW. Leucemia mielomonocítica aguda con manifestaciones neurológicas en el perro. Veterinario Pathol. (1986) 23:140–7. doi: 10.1177/030098588602300206
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Carpenter, JL, King, NW Jr y Abrams, KL. Parálisis bilateral del nervio trigémino y síndrome de Horner asociados con neoplasia mielomonocítica en un perro. J Am Vet Med Assoc. (1987) 191:1594–6.
15. Hayashi, A, Tanaka, H, Kitamura, M, Nishida, H, Shimoda, T, Ohashi, F, et al. Leucemia mielomonocítica aguda (LMA-M4) en un perro con lesión extradural. J Vet Med Sci. (2011) 73:419–22. doi: 10.1292/jvms.10-0324
16. Dappiano, E, Cagnotti, G, Corona, C, Riondato, F, Iulini, B, Pintore, D, et al. Leucemia mielomonocítica aguda con manifestación multifocal e infiltración medular en un perro. Schweiz Arch Tierheilkd. (2022) 164:350–6. doi: 10.17236/sat00353
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Conway, EA, Waugh, EM, y Knottenbelt, C. Un caso de leucemia linfocítica crónica de células T que progresa a síndrome de Richter con compromiso del sistema nervioso central en un perro. Veterinario Clin Pathol. (2020) 49:147–52. doi: 10.1111/vcp.12839
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Hynes, JP, Hughes, N, Cunningham, P, Kavanagh, EC, y Eustace, SJ. Resonancia magnética de cuerpo entero de médula ósea: una revisión. J Magn Reson Imaging. (2019) 50:1687–701. doi: 10.1002/jmri.26759
19. Silva, JR Jr, Hayashi, D, Yonenaga, T, Fukuda, K, Genant, HK, Lin, C, et al. Resonancia magnética de anomalías de la médula ósea en neoplasias malignas hematológicas. Diagn Interv Radiol. (2013) 19:393–9. doi: 10.5152/dir.2013.067
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Kan, JH, Hernanz-Schulman, M, Frangoul, HA, y Connolly, SA. Diagnóstico por resonancia magnética de la recaída de la médula ósea en niños con LLA. Pediatr Radiol. (2008) 38:76–81. doi: 10.1007/s00247-007-0653-4
21. Nguyen, JC, Davis, KW, Arkader, A, Guariento, A, Sze, A, Hong, S, et al. Resonancia magnética previa al tratamiento de leucemia y linfoma en niños: ¿existen diferencias en los patrones de reemplazo de médula ósea en las imágenes ponderadas en T1? Eur Radiol. (2021) 31:7992–8000. DOI: 10.1007/S00330-021-07814-Z
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Hwang, S, y Panicek, DM. Resonancia magnética de la médula ósea en oncología, parte 2. Radiol esquelético. (2007) 36:1017–27. doi: 10.1007/s00256-007-0308-4
23. Oyake, M, Hirakuni, Y, Hirano, N, Suenobu, S e Ihara, K. Imágenes de resonancia magnética anormales ponderadas en T1 de médula ósea en un paciente pediátrico con leucemia linfoblástica aguda sin blastocitos periféricos. Int J Hematol. (2024) 119:107–8. doi: 10.1007/s12185-023-03697-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Lenk, L, Alsadeq, A, y Schewe, DM. Implicación del sistema nervioso central en la leucemia linfoblástica aguda: opiniones sobre mecanismos moleculares e implicaciones clínicas basadas en datos recientes. Metástasis del cáncer Rev. (2020) 39:173–87. DOI: 10.1007/S10555-020-09848-Z
25. Arshad, U, Jabbar, N, Mansoor, N, Haider, M, Butt, Z y Nadeem, K. Afectación del sistema nervioso central en la leucemia linfoblástica aguda infantil: un análisis de las punciones lumbares del primer día frente al octavo día en la terapia de inducción de la remisión. Cureus. (2021) 13:e12464. doi: 10.7759/cureus.12464
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. de Souza, GS, Pinto, GOPA, de Oliveira, WJ y Locatelli-Dittrich, R. Infiltración del sistema nervioso central en la leucemia linfoblástica aguda en un perro. Acta Sci Vet. (2021) 49. doi: 10.22456/1679-9216.112658
27. Paul, S, y Short, NJ. Afectación del sistema nervioso central en adultos con leucemia aguda: diagnóstico, prevención y tratamiento. Curr Oncol Rep. (2022) 24:427–36. doi: 10.1007/s11912-022-01220-4
28. Guenette, JP, Tirumani, SH, Keraliya, AR, Shinagare, AB, Ramaiya, NH, y Jagannathan, JP. Hallazgos de resonancia magnética en pacientes con leucemia y citología positiva en LCR: una experiencia de 5 años en una sola institución. AJR Am J Roentgenol. (2016) 207:1278–82. doi: 10.2214/AJR.16.16221
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Larson, RA . Manejo de la enfermedad del SNC en adultos con leucemia linfoblástica aguda. Linfoma leuk. (2018) 59:3–13. doi: 10.1080/10428194.2017.1326597
30. Wu, SY, Short, NJ, Nasr, L, Dabaja, BS y Fang, PQ. Profilaxis y tratamiento del sistema nervioso central en leucemias agudas. Opciones de curr treat en Oncol. (2022) 23:1829–44. doi: 10.1007/s11864-022-01032-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Patel, PS, Adhvaryu, SG, y Balar, DB. Importancia clínica de la fosfatasa alcalina sérica total y termoestable en pacientes con leucemia. Tumores. (1993) 79:352–6. doi: 10.1177/030089169307900514
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Tang, YM, Jeavons, S, Stuckey, S, Middleton, H y Gill, D. Características de la necrosis de la médula ósea por resonancia magnética. AJR Am J Roentgenol. (2007) 188:509–14. doi: 10.2214/AJR.05.0656
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Lauer, M, Kernen, E, Schwabe, D, Lehrnbecher, T, y Porto, L. Papel de la resonancia magnética en el diagnóstico de la afectación del sistema nervioso central en niños con leucemia linfoblástica aguda. Pediatr Cáncer de la Sangre. (2020) 67:e28294. doi: 10.1002/pbc.28294
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Liu, J, Wang, Y, Sun, X, Liu, S, Yu, Z, Ji, N, et al. Lesiones del sistema nervioso central en la leucemia: características patológicas y de resonancia magnética en el momento de la presentación en 14 pacientes. Oncol Lett. (2017) 14:8162–70. doi: 10.3892/ol.2017.7192
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Marie, I, Guillevin, L, Menard, JF, Hatron, PY, Cherin, P, Amoura, Z, et al. Neoplasia hematológica maligna asociada a polimiositis y dermatomiositis. Autoimmun Rev. (2012) 11:615–20. doi: 10.1016/j.autrev.2011.10.024
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Shen, JK, Ding, YM, Zhou, WJ y Jin, J. Polimiositis/dermatomiositis asociada con leucemia mielocítica aguda. Rheumatol Int. (2008) 28:1265–7. doi: 10.1007/s00296-008-0600-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Kim, MK, Park, JW, Park, SH, Bang, SM, Chung, JG, Ahn, JY, et al. Miositis neutrofílica sin afectación cutánea como primera manifestación de la leucemia mieloide aguda. Coreano J Interno Med. (2005) 20:346–8. doi: 10.3904/kjim.2005.20.4.346
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Damián, L, Login, CC, Salomón, C, Belizna, C, Encica, S, Urián, L, et al. Miositis y neoplasia por cuerpos de inclusión: una revisión narrativa. Int J Mol Sci. (2022) 23:7358. doi: 10.3390/ijms23137358
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Hugo, TB, Heading, KL, y Labuc, RH. El líquido cefalorraquídeo canino, los recuentos de células nucleadas totales y las asociaciones citológicas con la prevalencia de anomalías en la resonancia magnética. Vet Med (Auckl). (2014) 5:75–84. doi: 10.2147/VMRR. S63805
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Cherubini, GB, Platt, SR, Anderson, TJ, Rusbridge, C, Lorenzo, V, Mantis, P, et al. Características de las imágenes de resonancia magnética de meningoencefalomielitis granulomatosa en 11 perros. Rec. Veterinario (2006) 159:110–5. doi: 10.1136/vr.159.4.110
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Tang, J, Yu, J, Cai, J, Zhang, L, Hu, S, Gao, J, et al. Factores pronósticos para el control del SNC en niños con leucemia linfoblástica aguda tratados sin irradiación craneal. Sangre. (2021) 138:331–43. doi: 10.1182/blood.2020010438
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Marwaha, RK, Kulkarni, KP, Bansal, D y Trehan, A. Afectación del sistema nervioso central en la presentación de la leucemia linfoblástica aguda infantil: experiencia de manejo y lecciones. Linfoma leuk. (2010) 51:261–8. doi: 10.3109/10428190903470323
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: resonancia magnética de médula ósea, resonancia magnética de leucemia aguda, neurooncología veterinaria, perros con leucemia aguda, leucemia del sistema nervioso central
Cita: Lyseight FLS, Pittaway C, Dennis R y Cherubini GB (2024) Manifestaciones neurológicas en perros con leucemia aguda. Frente. Vet. Sci. 11:1385093. doi: 10.3389/fvets.2024.1385093
Recibido: 11 de febrero de 2024; Aceptado: 12 de junio de 2024;
Publicado: 18 de julio de 2024.
Editado por:
Stanislaw Dzimira, Universidad de Ciencias Ambientales y de la Vida de Wrocław, Polonia
Revisado por:
Kristian Schafernak, Phoenix Children’s Hospital, Estados
Unidos Valeria Martini, Universidad de Milán, Italia
Derechos de autor © 2024 Lyseight, Pittaway, Dennis y Cherubini. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Filipa L. S. Lyseight, Filipa.lyseight@dwr.co.uk
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía