Medidas de bioseguridad para el control del virus de la hepatitis E en granjas porcinas europeas
Medidas de bioseguridad para el control del virus de la hepatitis E en granjas porcinas europeas
 Tamino Dubbert1*
Tamino Dubbert1*  Marina Meester2
Marina Meester2  Richard Piers Smith3
Richard Piers Smith3  Tijs J. Tobías2
Tijs J. Tobías2  Ilaria Di Bartolo4
Ilaria Di Bartolo4  Reimar Johne1
Reimar Johne1  Enrico Pavoni5
Enrico Pavoni5  Gergana Krumova-Valcheva6
Gergana Krumova-Valcheva6  Elena Lucia Sassu7
Elena Lucia Sassu7  Giuseppe Aprea8
Giuseppe Aprea8  Hannah May3
Hannah May3  Nadine Althof1
Nadine Althof1  Giovanni Ianiro4
Giovanni Ianiro4  Jacek Żmudzki9
Jacek Żmudzki9  Albena Dimitrova6
Albena Dimitrova6  Giovanni Loris Alborali5
Giovanni Loris Alborali5  Daniela D’Angelantonio8
Daniela D’Angelantonio8  Silvia Scattolini8
Silvia Scattolini8  Noemí Battistelli8
Noemí Battistelli8  Elke Burow1,10
Elke Burow1,10- 1Departamento de Seguridad Biológica, Instituto Federal Alemán para la Evaluación de Riesgos (BfR), Berlín, Alemania
- 2Departamento de Ciencias de la Salud de la Población, Facultad de Medicina Veterinaria, Universidad de Utrecht (UU), Utrecht, Países Bajos
- 3Departamento de Ciencias Epidemiológicas, Agencia de Sanidad Animal y Vegetal (APHA) – Weybridge, Surrey, Reino Unido
- 4Departamento de Seguridad Alimentaria, Nutrición y Salud Pública Veterinaria, Istituto Superiore di Sanità (ISS), Roma, Italia
- 5Departamento de Seguridad Alimentaria, Instituto Zooprofiláctico Experimental de Lombardía y Emilia Romagna (IZSLER), Brescia, Italia
- 6Centro Nacional de Seguridad Alimentaria, Instituto Nacional de Medicina Veterinaria de Diagnóstico e Investigación (NDRVMI), Sofía, Bulgaria
- 7Instituto de Control de Enfermedades Veterinarias, Agencia Austriaca de Salud y Seguridad Alimentaria (AGES), Mödling, Austria
- 8Departamento de Seguridad Alimentaria, Instituto Zooprofiláctico Experimental de Abruzzo y Molise ‘G. Caporale’ (IZS), Teramo, Italia
- 9Departamento de Enfermedades Porcinas, Instituto Nacional de Investigación Veterinaria (PIWet), Puławy, Polonia
- 10Departamento de Desarrollo Rural y Agricultura, Ministerio de Agricultura, Medio Ambiente y Protección del Clima del Estado de Brandeburgo (MLUK), Potsdam, Alemania
El genotipo 3 del virus de la hepatitis E (VHE) es un patógeno zoonótico prevalente en las granjas porcinas europeas, que supone un importante riesgo para la salud pública, principalmente a través de la vía alimentaria. El estudio tuvo como objetivo identificar medidas de bioseguridad efectivas para controlar la transmisión del VHE en las granjas porcinas, abordando una brecha crítica en el conocimiento actual. Utilizando un diseño transversal, se recogieron muestras fecales de cerdas jóvenes, cerdas secas y cerdos de engorde en 231 granjas porcinas de todos los tipos de granjas en nueve países europeos. Se empleó RT-PCR en tiempo real para analizar estas muestras en busca de VHE. Al mismo tiempo, se realizó un cuestionario exhaustivo de bioseguridad en el que se recogieron datos sobre diversas medidas potenciales para controlar el VHE. La variable dependiente fue el riesgo de VHE, categorizado como menor o mayor en función del porcentaje de muestras fecales positivas agrupadas en cada granja (punto de corte del 25%). Los datos se analizaron utilizando modelos lineales generalizados (uno para las muestras de engorde y otro para todas las muestras) con una función de enlace logit con el país y el tipo de finca como factores fijos a priori. Los resultados de los modelos multivariables finales identificaron medidas clave de bioseguridad asociadas a un menor riesgo de VHE, que fueron el uso de un higiengrama en la cría (OR: 0,06, p = 0,001) y/o área de engorde después de la limpieza (OR: 0,21, p = 0,019), la presencia de un área de cuarentena (OR: 0,29, p = 0,025), la prueba y/o el tratamiento de los piensos comprados contra Salmonella (OR: 0,35, p = 0,021), la presencia de otras especies ganaderas en la granja, y tener cinco o menos personas a cargo de los cerdos. Contrariamente a lo esperado, algunas medidas de bioseguridad se asociaron con un mayor riesgo de VHE, por ejemplo, un tiempo de inactividad de 3 días o más después de la limpieza en el área de engorde (OR: 3,49, p = 0,005) o el lavado de manos obligatorio para el personal de la granja al cambiar las secciones del establo (OR: 3,4, p = 0,026). Este novedoso estudio revela información crítica sobre las medidas de bioseguridad efectivas para controlar el VHE en las granjas porcinas europeas. La identificación de medidas de protección y asociadas al riesgo contribuye a mejorar las estrategias de gestión del VHE y subraya la complejidad de la bioseguridad en la cría de cerdos.
1 Introducción
El virus de la hepatitis E (VHE) es el agente causal de la hepatitis aguda y crónica en humanos (1). En todo el mundo, las infecciones por VHE representan aproximadamente 3,3 millones de casos sintomáticos y 44.000 muertes al año (2). Dependiendo del genotipo del VHE afectado, los síntomas graves de la enfermedad y las muertes se observan principalmente en mujeres embarazadas, receptores de trasplantes de órganos, pacientes con enfermedad hepática preexistente y pacientes inmunodeprimidos (1). Sin embargo, los estudios poblacionales serológicos indican que las infecciones leves y subclínicas por VHE son más comunes (3, 4).
Los genotipos 1 y 2 del VHE (HEV-1 y HEV-2) solo infectan a los seres humanos y se transmiten por el agua, causando grandes brotes en países africanos y asiáticos con malas condiciones sanitarias (5, 6). Por el contrario, los genotipos HEV-3 y HEV-4 son zoonóticos, siendo el HEV-3 común en América del Norte y Europa (5) y el HEV-4 confinado principalmente a Asia (6). Para un contexto europeo, HEV-3 es de gran interés. Los principales reservorios del VHE-3 son los cerdos y los jabalíes, aunque el virus se ha detectado en otros animales como ciervos y conejos (7, 8). Aunque asintomática en cerdos y jabalíes, la enfermedad puede ser esporádicamente aguda y letal en humanos (8, 9). Se considera que la transmisión del VHE-3 a los seres humanos se transmite a través de los alimentos o por contacto directo con animales infectados y, a menudo, se remonta al consumo de carne de cerdo y jabalí contaminada cruda o poco cocida, especialmente hígado (5, 7, 10, 11).
Aunque se estima que el VHE está presente en muchas granjas porcinas en Europa, existen diferencias en la seroprevalencia del VHE entre granjas y países, que oscilan entre el 65 y el 100 % a nivel de granja y entre el 20 % y el 93 % a nivel animal (7, 12, 13). La seroprevalencia aumenta con la edad de los animales hasta un 100% en cerdos adultos, lo que demuestra una exposición frecuente al virus (14, 15). Después de la introducción, se ha demostrado que el VHE persiste en las granjas durante varios años (16, 17). Para reducir la carga para la salud pública, la mitigación del riesgo de infección por el VHE no solo debe producirse en el matadero, sino también en la producción primaria, es decir, a nivel de explotación. Las medidas de bioseguridad se definen comúnmente como medidas para evitar la introducción de patógenos y su propagación dentro de una granja. Sin embargo, los conocimientos publicados sobre estrategias eficaces de control del VHE en las granjas porcinas son muy limitados (18).
Varios estudios investigaron las asociaciones de los factores de riesgo con diferentes resultados del VHE (19). El riesgo de hígados positivos para el VHE en cerdos en edad de sacrificio se incrementó debido a una gran variación en la edad de los cerdos enviados al matadero, una alta tasa de acogida cruzada en el parto, el uso de botas que no eran específicas para la producción porcina, el suministro de agua potable de un manantial o un pozo perforado a <50 m de profundidad y los antecedentes genéticos maternos de los cerdos (20). El riesgo de una mayor seroprevalencia del VHE en los cerdos en edad de sacrificio se incrementó por un período de inactividad de <4 días en el vivete, una distancia más corta entre el estiércol de pozo y el suelo de rejillas en las instalaciones de engorde, la mezcla de cerdos de diferentes instalaciones entre las etapas de parto y destete, y el tamaño de los corrales de 16 o más cerdos/corral en las salas de destete. mientras que la aclimatación de las primerizas a través de la distribución de placenta y heces de las cerdas disminuyó el riesgo de una mayor seroprevalencia de VHE (20). Los factores de riesgo asociados a una mayor prevalencia de VHE en cerdos son la cría extensiva, la ausencia de un vado sanitario, la ausencia de período de cuarentena y el contacto con otras especies domésticas (21). Los factores de riesgo asociados a una mayor presencia de anticuerpos anti-VHE en la granja fueron no realizar la desinfección después de la limpieza y mezclar los sistemas de agua potable, es decir, con agua estancada y corriente (22). En un estudio previo de tres granjas japonesas, la que no mezcló cerdos durante el destete tuvo la menor seroprevalencia de VHE (23). Un estudio canadiense observó infecciones generalizadas por VHE en lechones destetados procedentes de múltiples proveedores (24). Este estudio investigó el curso natural de la infección durante el período de engorde en un entorno de granja simulado, y encontró que casi todos los cerdos excretaron el VHE en al menos una ocasión. Sin embargo, se necesita más investigación para fortalecer la evidencia y priorizar las medidas para el control del VHE.
Este estudio epidemiológico de factores de riesgo investigó, en una población de diferentes granjas porcinas europeas, las asociaciones del VHE con un gran número de medidas de bioseguridad basadas en la literatura publicada previamente y en la opinión de expertos. El riesgo de VHE en las granjas se estimó en función del número de muestras fecales positivas para el VHE utilizando un nuevo protocolo de detección. Los resultados deberían ayudar a mejorar la bioseguridad de las explotaciones basadas en la evidencia y a controlar el VHE en la cría de cerdos.
2 Materiales y métodos
2.1 Diseño del estudio y descripción de la muestra
El diseño del estudio se describe en detalle en el artículo centrado en los resultados de Salmonella del mismo grupo de estudio (25). Brevemente, este estudio transversal tuvo como objetivo incluir 30 granjas de todos los principales tipos de producción de cada uno de los nueve países europeos participantes: Austria (AT), Bulgaria (BG), República Checa (CZ), Alemania (DE), Estonia (EE), Italia (IT), Países Bajos (NL), Polonia (PL) y Reino Unido (UK, Figura 1). Aunque la selección de las granjas se realizó por conveniencia, se buscó incluir una población de granjas representativa de cada país en términos de tamaño y tipos de granjas porcinas. Se excluyeron las granjas que eran pequeñas explotaciones, mantenían algunos cerdos de un tipo específico en el interior y otros del mismo tipo en el exterior, así como rebaños núcleo/multiplicadores o rebaños libres de patógenos específicos (SPF). Se excluyeron los rebaños núcleo/multiplicador y SPF, ya que son pocos en número y de difícil acceso para los visitantes, lo que puede dar lugar a sesgos de selección.
 Figura 1. Mapa de los nueve países europeos Austria, Bulgaria, República Checa, Alemania, Estonia, Italia, Países Bajos, Polonia y Reino Unido que participan en el proyecto OHEJP BIOPIGEE (creado con mapchart.net y compartido bajo CC BY-SA 4.0).
Figura 1. Mapa de los nueve países europeos Austria, Bulgaria, República Checa, Alemania, Estonia, Italia, Países Bajos, Polonia y Reino Unido que participan en el proyecto OHEJP BIOPIGEE (creado con mapchart.net y compartido bajo CC BY-SA 4.0).
2.2 Recopilación de datos
Los datos se recopilaron de las granjas reclutadas entre julio de 2020 y octubre de 2021.
2.2.1 Cuestionario
El cuestionario aplicado en este estudio se describe en detalle en otro lugar (26). En resumen, incluyó 10 preguntas sobre las características de las granjas y 56 preguntas centradas en las prácticas de bioseguridad relacionadas con la producción porcina en interiores. Las preguntas pueden responderse eligiendo una de las opciones de respuesta (categórica) o proporcionando un número. La base para la selección de las preguntas y las medidas de bioseguridad relacionadas fue su relevancia para reducir la presencia de VHE y Salmonella en la producción porcina (según lo establecido por el proyecto OHEJP BIOPIGEE) según artículos revisados por pares y la opinión de expertos (26-28). Un criterio adicional para incluir las medidas de bioseguridad en el cuestionario fue su practicidad, es decir, que el agricultor pudiera cambiar activamente las medidas en un período de tiempo razonable (por ejemplo, se excluyeron las preguntas sobre las granjas vecinas, las ubicaciones o las construcciones fundamentales de las granjas). El cuestionario se tradujo a las lenguas de los países europeos participantes y se instaló en una herramienta de encuesta electrónica (keyingress/mobilingress, Ingress Health GmbH, Alemania).
El cuestionario fue completado en la granja por el agricultor en colaboración con el personal de los institutos asociados a BIOPIGEE durante la visita para recoger muestras fecales. Parte de las entrevistas y la cumplimentación de los cuestionarios tuvieron que realizarse a través de llamadas telefónicas, separadas del muestreo, debido a las restricciones por la pandemia de SARS-CoV-2. Los entrevistadores y entrevistados no tenían conocimiento del estado de HEV de las granjas.
2.2.2 Detección de HEV
2.2.2.1 Recogida de muestras
La prevalencia del VHE en las explotaciones se había estimado solo en un pequeño número de países participantes antes del inicio del estudio (12) y, por lo tanto, no pudo utilizarse para calcular el tamaño de la muestra. En cambio, el tamaño de la muestra se basó en la capacidad de detectar tanto el VHE como la Salmonella (25), incluso si estaban presentes con una prevalencia relativamente baja. Para ello, se utilizaron muestras agrupadas. Además, se tomaron muestras de tres categorías diferentes de cerdos (cerdas jóvenes, cerdas secas y cerdos de engorde), para maximizar las posibilidades de detectar tanto el VHE como la Salmonella en las granjas, basándose en estudios previos y en la opinión de expertos dentro del consorcio BIOPIGEE (29, 30).
El número óptimo de muestras fecales para estratificar entre las granjas con mayor y menor riesgo de VHE se determinó después de discusiones dentro del equipo del proyecto, que incluyó expertos en VHE. Se determinaron veinte muestras fecales agrupadas por granja (10 muestras individuales por muestra agrupada) como el número óptimo. Esto proporcionó suficiente sensibilidad para detectar al menos una muestra positiva, incluso si la prevalencia dentro del rebaño era tan baja como el 2% y estimaría una prevalencia esperada en la granja del 10% (31, 32) con una varianza del 5,5% y un 95% de confianza (33).
Cada muestra contenía 10 g de heces frescas, preferiblemente recogidas inmediatamente después de la defecación. Además, cuando había más corrales presentes en la granja, se muestrearon tantos corrales como fue posible cubriendo una distribución espacial uniforme. La proporción de muestras recogidas para tres tipos de cerdos (cerdos de engorde/cerdas jóvenes/cerdas secas) fue según el tipo de granja: 50%/40%/10% en granjas de parto a engorde, 0%/80%/20% en granjas de cría y 100%/0%/0% en granjas de engorde. Por ejemplo, en las granjas de cría se debían recoger 16 muestras de cerdas jóvenes y cuatro de cerdas secas. Se recogieron muestras fecales de cerdos de engorde antes de la edad de sacrificio (~4-6 meses de edad).
Las granjas de NL en este estudio (n = 20) fueron muestreadas originalmente para un estudio diferente. Se tomaron muestras de un promedio de ocho lotes de cerdos de engorde entregados al matadero para cada granja mediante la recolección de sangre de cinco a 12 cerdos al azar por lote. El suero se analizó individualmente para detectar anticuerpos contra el VHE y se analizó agrupado por lote para detectar la viremia [para el diseño del estudio, véase Meester et al. (15)]. Las muestras de NL se recolectaron de enero a agosto de 2019. Se muestrearon entre 12 y 173 cerdos por granja (mediana 51, media 64,8). Cada granja tuvo entre 4 y 21 lotes (mediana 8,5, media 10,2). Las muestras se agruparon a nivel de lote y se analizaron para detectar el ARN del VHE mediante RT-PCR en tiempo real.
2.2.2.2 Ensayo de muestras
Las muestras se transportaron a los laboratorios de pruebas en cajas de refrigeración que no debían superar los 8 °C y finalmente se almacenaron a -20 °C hasta la prueba de HEV. Después de la descongelación, las heces se diluyeron 1:10 (p/v) en agua estéril libre de ARNasa o solución salina tamponada con fosfato y se clarificaron mediante centrifugación a baja velocidad al 10% (p/v). Antes de la extracción del ARN, los sobrenadantes fecales se enriquecieron artificialmente con un virus de control de procesos, que consistía en mengovirus (34), norovirus murino (35), calicivirus felino (36) o bacteriófago MS2 (37). El ARN viral se extrajo de 100 μl de sobrenadante mediante kits comerciales a base de sílice diferentes para cada país (Qiamp Viral mini kit, Qiagen; Kit MiniMag, Biomerieux; kit EMAG, Biomerieux; BioExtract SuperBall, BioSellal; Kit de aislamiento de ácidos nucleicos virales/patógenos MagMAX, Thermofisher) y eluido en un volumen total de tampón de elución de 100 μl. El ARN se almacenó a -80 °C o se analizó inmediatamente.®®
El ARN del virus de control de procesos utilizado para la introducción de muestras fecales se analizó mediante una RT-PCR en tiempo real diferente (34, 38, 39). La tasa de recuperación resultante se estimó mediante el método del umbral de ciclo comparativo (40). Una tasa de recuperación >1% se consideró adecuada para los análisis de amplificación posteriores del virus diana del VHE (34).
Para la detección del ARN del VHE, se realizó una RT-PCR en tiempo real de amplio rango como se describió anteriormente (41). Todos los laboratorios participantes utilizaron 5 μl de ARN para preparar una mezcla de reacción con un volumen total de 25 μl utilizando diferentes kits de RT-PCR en tiempo real (QuantiTect Probe RT-PCR Kit, Qiagen; Sistema de qRT-PCR de un solo paso UltraSense™ de ARN, Thermofisher Scientific) (42, 43). Cada RT-PCR en tiempo real incluyó ARN de muestras fecales, controles de extracción negativos, control de agua (NTC) y control de ARN diana positivo para cada ejecución.
Para permitir la comparabilidad de los resultados generados por los diferentes protocolos de extracción y amplificación, el límite de detección (LOD) del método utilizado fue determinado por cada laboratorio antes de participar en el estudio. Esto se llevó a cabo mediante el análisis de dos series de dilución de HEV (1st WHO International Standard for Hepatitis Virus RNA, código PEI 6329/10, Instituto Paul-Ehrlich, Alemania) (44) en una muestra de heces de cerdo HEV negativa. De esta manera, los laboratorios participantes determinaron los LOD entre 87,2 × 103 y 10,9 × 103 Copias del genoma del VHE/g de heces.
2.2.3 Análisis estadístico
2.2.3.1 Categorización del riesgo de VHE
El objetivo de este estudio fue encontrar evidencia de medidas de bioseguridad efectivas para el control del VHE comparando las medidas de bioseguridad presentes en aquellas granjas con un menor porcentaje de muestras positivas para el VHE frente a aquellas granjas con un porcentaje más alto, utilizando un análisis de factores de riesgo multivariable. La hipótesis era que las granjas que realizaban medidas de bioseguridad efectivas tenían un menor riesgo de tener un mayor porcentaje de muestras positivas para el VHE en comparación con las granjas que no realizaban medidas de bioseguridad efectivas. El punto de corte para esta categorización binaria de riesgo de VHE de las granjas se eligió para ser del 25 %, lo que significa que las granjas con muestras positivas para el VHE iguales o superiores al 25 % se clasificaron como de mayor riesgo. La elección de este valor de corte fue realizada por el equipo del estudio solo después de la inspección de la distribución de las muestras positivas para el VHE de todas las explotaciones (ver sección 3.3).
2.2.3.2 Datos del cuestionario
Se limpiaron los datos del cuestionario y se verificó la información potencialmente incorrecta con los agricultores o el equipo local del proyecto. Las respuestas faltantes se codificaron como «faltantes» o «no aplicables» cuando tenía sentido permitir que esta información se conservara en el modelo. Además, para mejorar el ajuste del modelo, se exploró la fusión de niveles con 10 o menos observaciones con otros niveles de la misma variable cuando era significativa. Se graficaron variables continuas para evaluar posibles tendencias o agrupaciones y posteriormente se categorizaron.
2.2.3.3 Análisis de datos
Se realizaron análisis descriptivos y se presentaron los resultados. La distribución de muestras fecales positivas se investigó a nivel de muestra como base para determinar un valor de corte significativo para la categorización de riesgo de las granjas. Los datos de los países relativos al estado o al riesgo de infección por el virus del VIH solo se muestran de forma anónima (país A-I).
La variable de resultado fue el riesgo de VHE de las granjas basado en los resultados de RT-PCR en tiempo real del análisis de muestras fecales. Para el análisis estadístico multivariante, el resultado fue dicotomizado (0 = porcentaje de muestras fecales positivas para el VHE por debajo del punto de corte definido, 1 = porcentaje de muestras fecales positivas para el VHE por encima del punto de corte definido). Todas las asociaciones entre las variables resultado e independientes se investigaron en modelos lineales generalizados con una función de enlace logit (función glm) y el país y el tipo de granja como factores fijos a priori. Se seleccionaron las variables que se asociaron en los análisis univariados preliminares con el riesgo de VHE (p < 0,25) para la modelización de factores de riesgo. Las variables se excluyeron de la selección cuando el fracaso o el éxito se predijeron perfectamente (p. ej., 0 observaciones en una celda), o cuando las granjas confirmaron o negaron casi unánimemente la variable/medida (p. ej., ≤ 10 granjas afirmando o negando). Se elaboró una matriz de correlación V de Cramer (función char_cor_vars) para identificar correlaciones fuertes entre las variables. Si se observó una correlación de ≥0,8 entre dos variables independientes, se mantuvo la que tenía la correlación más fuerte con el resultado para el modelado de factores de riesgo. Si las variables estaban igualmente correlacionadas con el resultado, el equipo del estudio eligió una.
La modelación de factores de riesgo se realizó mediante regresión logística escalonada hacia adelante. En los pasos posteriores, se incluyeron aquellas variables que más mejoraron el ajuste del modelo [criterio de información de Akaike (AIC) más bajo] hasta que se alcanzó un paso en el que no hubo más variables significativas que pudieran mejorar el ajuste del modelo. Los análisis de sensibilidad se realizaron excluyendo las granjas NL del modelo. La limpieza y recodificación de los datos se realizó con SAS (versión 15, Sistema de Análisis Estadístico, RRID:SCR_008567) y R (versión 4.1.2, Proyecto R para Computación Estadística, RRID:SCR_001905). Todos los análisis estadísticos se realizaron con R.
3 Resultados
3.1 Población agrícola
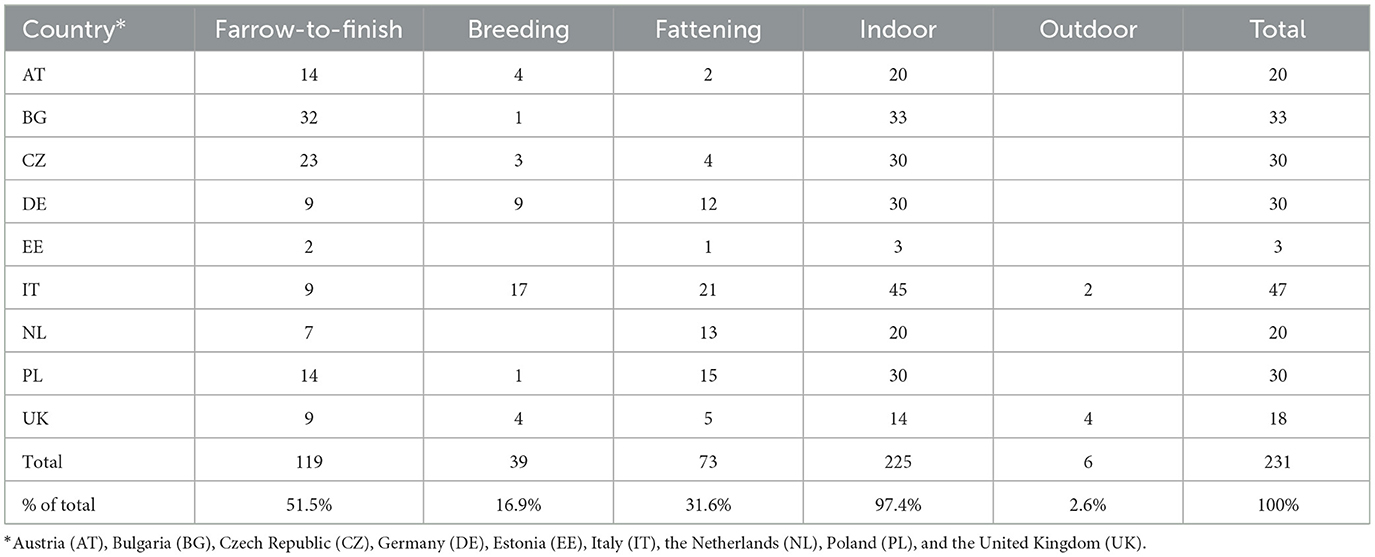
Se dispuso de datos de cuestionarios y muestras de VHE para 231 explotaciones. De estas, 119 (51,5%) eran granjas de parto a engorde, 39 (16,9%) eran granjas de cría y 73 (31,6%) eran granjas de engorde. Solo seis (2,6%) fincas eran al aire libre. Se disponía de datos de los países incluidos en la muestra para entre tres (EE) y 47 (IT) explotaciones agrícolas (Cuadro 1).
3.2 Resultados de HEV por explotación
De las 4.389 muestras de cerdos de todas las etapas de producción, 718 (16,4%) fueron positivas para el VHE. De las 231 granjas, 127 (55%) tuvieron al menos una muestra positiva (Figuras 2, 3A). Las granjas de engorde presentaron el mayor porcentaje medio de muestras positivas (29,2%), seguidas de las granjas de parto a engorde (13,0%) y las de cría (4,5%). En consecuencia, las granjas de engorde tuvieron el mayor porcentaje de granjas positivas para VHE (69,9%), seguidas de las granjas de parto a engorde (55,5%) y las granjas de cría (25,6%, Figura 3C). Dos de las seis granjas al aire libre fueron positivas (33,3%), con un promedio promedio de 5,9% de muestras positivas entre todas y 17,9% solo entre las granjas positivas al aire libre (Tablas suplementarias 1-4).
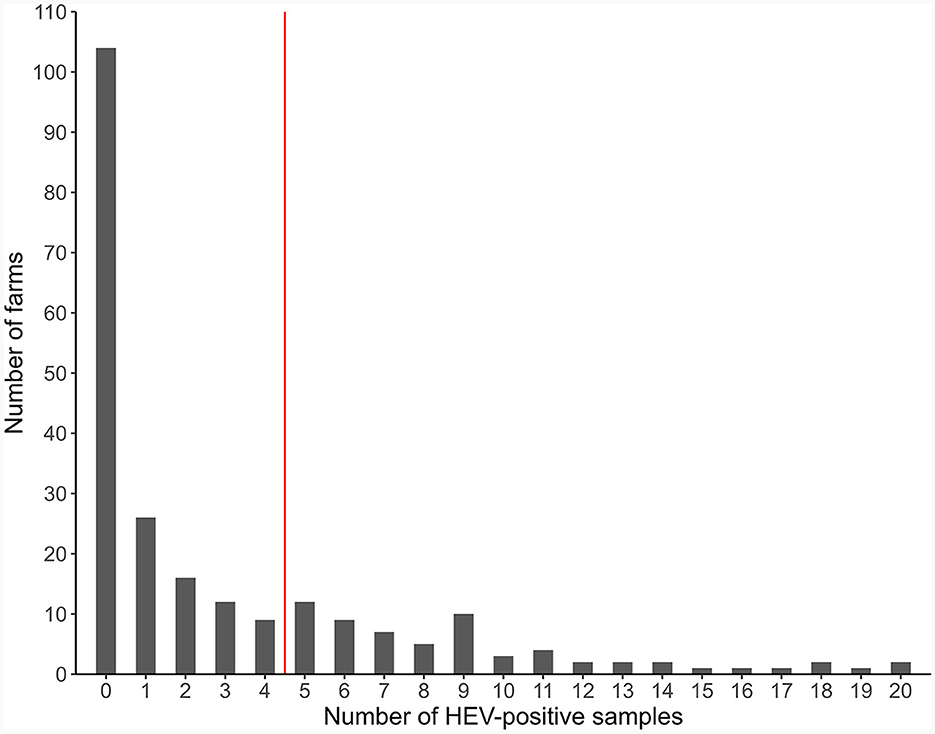 Figura 2. Distribución de las granjas según el número de muestras agrupadas positivas para el VHE (231 granjas porcinas, Europa, 2020).
Figura 2. Distribución de las granjas según el número de muestras agrupadas positivas para el VHE (231 granjas porcinas, Europa, 2020).
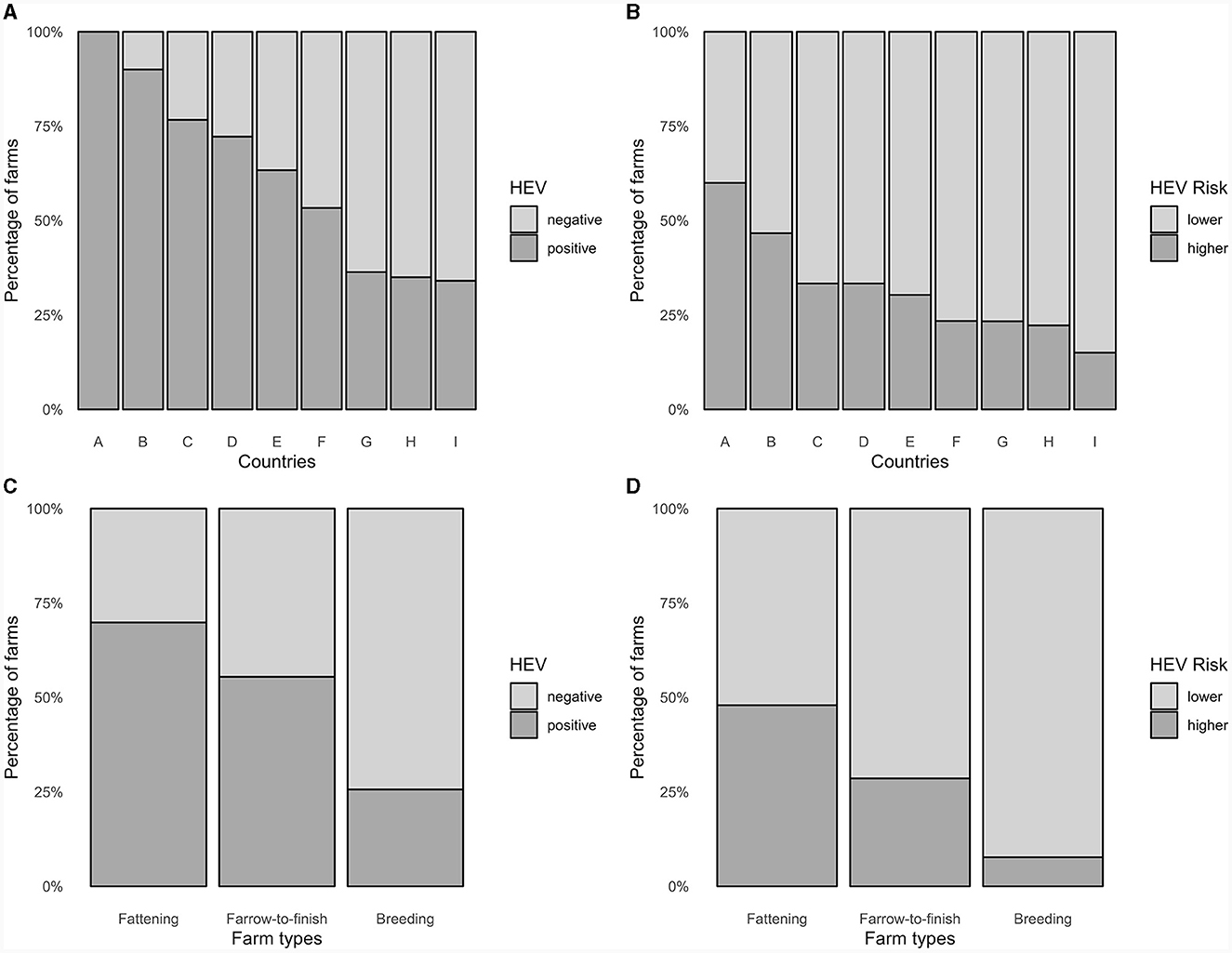 Figura 3. Distribución en porcentajes de (A) granjas con VHE positivo y (B) granjas con VHE de mayor riesgo según país, y (C) granjas con VHE positivo y (D) granjas con mayor riesgo de VHE según tipo de granja (231 granjas porcinas, Europa, 2020).
Figura 3. Distribución en porcentajes de (A) granjas con VHE positivo y (B) granjas con VHE de mayor riesgo según país, y (C) granjas con VHE positivo y (D) granjas con mayor riesgo de VHE según tipo de granja (231 granjas porcinas, Europa, 2020).
Las muestras positivas para el VHE de las granjas de engorde de los Países Bajos fueron comparables a las muestras positivas de engorde de las granjas de engorde de los otros países (29,6 vs. 29,2%). Sin embargo, las muestras de engorde de las granjas de engorde de las granjas de engorde de los Países Bajos de parto a engorde de los otros países (39,7 vs. 22,0%).
3.3 Riesgo de VHE
El límite para la categorización del riesgo de VHE se fijó en el 25%, es decir, las granjas con un 25% o más de muestras positivas estarían en la categoría de mayor riesgo de VHE. Esta evaluación se basó en la distribución de muestras positivas de todas las fincas y con el fin de producir poblaciones útiles para el análisis (Figura 2). De las 231 granjas, 72 (31,2%) se clasificaron como de mayor riesgo de VHE, según todas las muestras. Las granjas de mayor riesgo fueron las más comunes entre las granjas de engorde, seguidas de las granjas de parto a engorde y las granjas de reproducción, con 35 (47,9%), 34 (28,6%) y 4 (7,7%) granjas de cada tipo clasificadas como de mayor riesgo (Figuras 3B, D, Tabla Suplementaria 5).
Las muestras de cerdos de engorde fueron significativamente más propensas a ser positivas para el VHE que las muestras de cerdas jóvenes o cerdas secas (OR: 10,2, IC del 95%: 7,87-13,34, p < 0,001, Figura 4). Por lo tanto, el equipo del estudio decidió realizar un segundo procedimiento de modelo de factores de riesgo solo con aquellas granjas que proporcionaron muestras de engorde y solo utilizando las muestras de engorde para la categorización del riesgo. En este caso, se utilizó el mismo punto de corte del 25%. De las 188 granjas con muestras de engorde, 77 (41%) se clasificaron como de mayor riesgo de VHE. Cuatro granjas de parto a engorde no tenían engordadores en el momento del muestreo. Una prueba de chi cuadrado mostró que las granjas con 10 o menos muestras de engorde recolectadas, como las granjas de parto a engorde y algunas granjas de NL, no tenían significativamente más o menos probabilidades de estar en la categoría de menor riesgo que las granjas con más de 10 muestras de engorde (OR: 1,32, IC 95%: 0,69-2,5, p = 0,373).
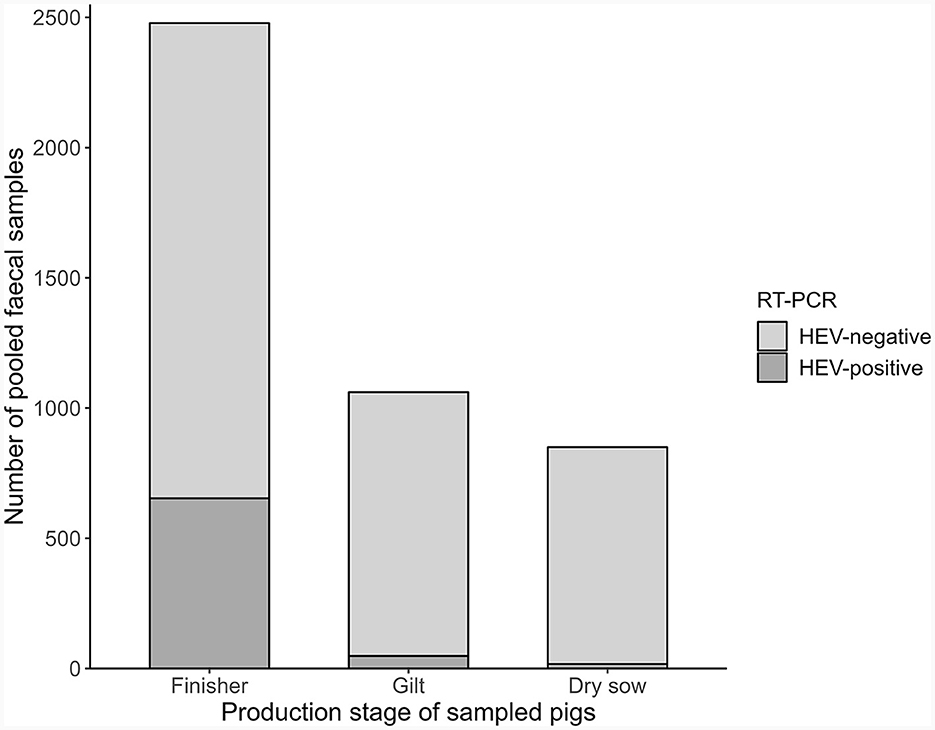 Figura 4. Distribución de muestras positivas para el VHE analizadas mediante RT-PCR en tiempo real según cerdos muestreados (Europa, 2020).
Figura 4. Distribución de muestras positivas para el VHE analizadas mediante RT-PCR en tiempo real según cerdos muestreados (Europa, 2020).
3.4 Resultados univariables
En los análisis de regresión univariable ajustados por país y tipo de explotación, nueve variables se asociaron significativamente con el riesgo de VHE en función de todas las muestras y 10 variables se asociaron significativamente con el riesgo de VHE en función de las muestras de engorde solamente (Tablas suplementarias 6 y 7).
3.5 Modelo de factores de riesgo: muestras positivas para el VHE de todos los cerdos
Para el modelo de factores de riesgo basado en todas las muestras de cerdos, 65 variables permanecieron después de la etapa de regresión univariable, 15 de ellas fueron posteriormente excluidas debido a la alta correlación. El procedimiento escalonado dio como resultado un modelo final con nueve variables retenidas, incluyendo el país y el tipo de finca. Las probabilidades más bajas de tener un mayor riesgo de contraer el VHE, según todas las muestras, se asociaron con menos personas trabajando con los cerdos, el uso de un higienografía como parte del procedimiento de limpieza en el área de cría y la presencia de un área de cuarentena. Las mayores probabilidades de tener un mayor riesgo de contraer el VHE, según todas las muestras, se asociaron con el tiempo de inactividad de al menos 3 días en el área de engorde, las personas internas (es decir, el personal) que se lavan las manos entre las diferentes secciones del establo, el uso de guantes desechables y/o el lavado y desinfectado de manos al manipular los cadáveres, y el acceso de las aves silvestres a los establos (Tabla 2). Se estimó que el modelo explicaba el 27,2% de la variación en el resultado (pseudo-R de McFadden2 = 0,272).
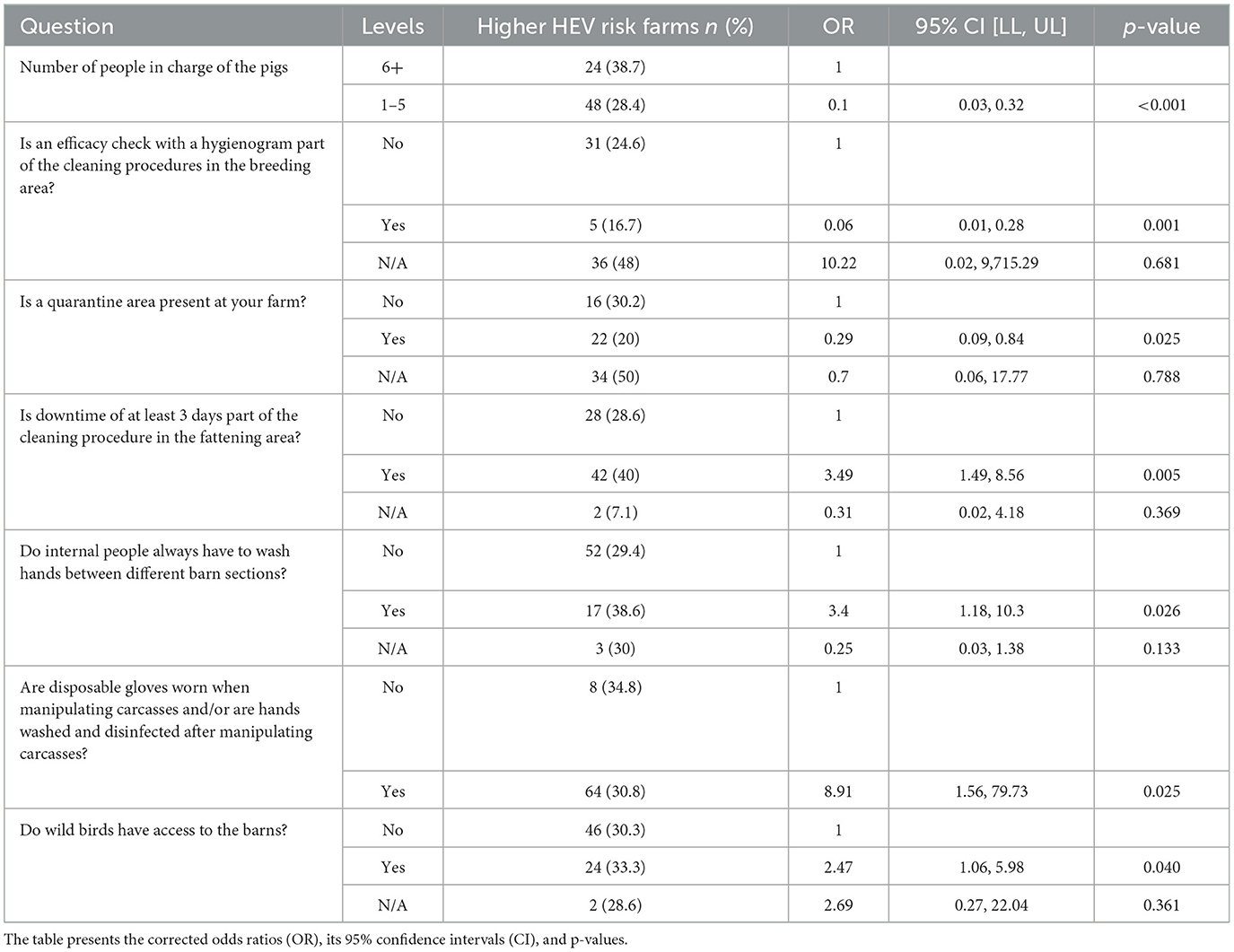 Tabla 2. Modelo de regresión logística multivariable con riesgo de VHE basado en todas las muestras de cerdos ajustadas por país y tipo de granja.
Tabla 2. Modelo de regresión logística multivariable con riesgo de VHE basado en todas las muestras de cerdos ajustadas por país y tipo de granja.
3.6 Modelo de factores de riesgo: muestras de engordador positivas para VHE
Para el modelo de factores de riesgo basado únicamente en muestras de gordo, 54 variables permanecieron después de la etapa de regresión univariada, 10 de ellas fueron posteriormente excluidas debido a la alta correlación. El procedimiento escalonado dio como resultado un modelo final con siete variables retenidas, incluyendo el país y el tipo de finca. Las probabilidades más bajas de tener un mayor riesgo de contraer el VHE, basadas únicamente en muestras de engorde, se asociaron con un menor número de personas que trabajan con los cerdos, que realizan pruebas y/o tratan los piensos comprados para cerdos contra la contaminación por Salmonella, el uso de un higiengrama como parte del procedimiento de limpieza en la zona de engorde, la presencia de una zona bajo cuarentena y la presencia de otras especies ganaderas en la explotación. Las mayores probabilidades de tener un mayor riesgo de contraer el VHE, basadas únicamente en muestras de engorde, se asociaron con la compra de cerdos y aves silvestres que tenían acceso a los establos (Tabla 3). Se estimó que el modelo explicaba el 20,5% de la variación en el resultado (pseudo-R de McFadden2 = 0,205).
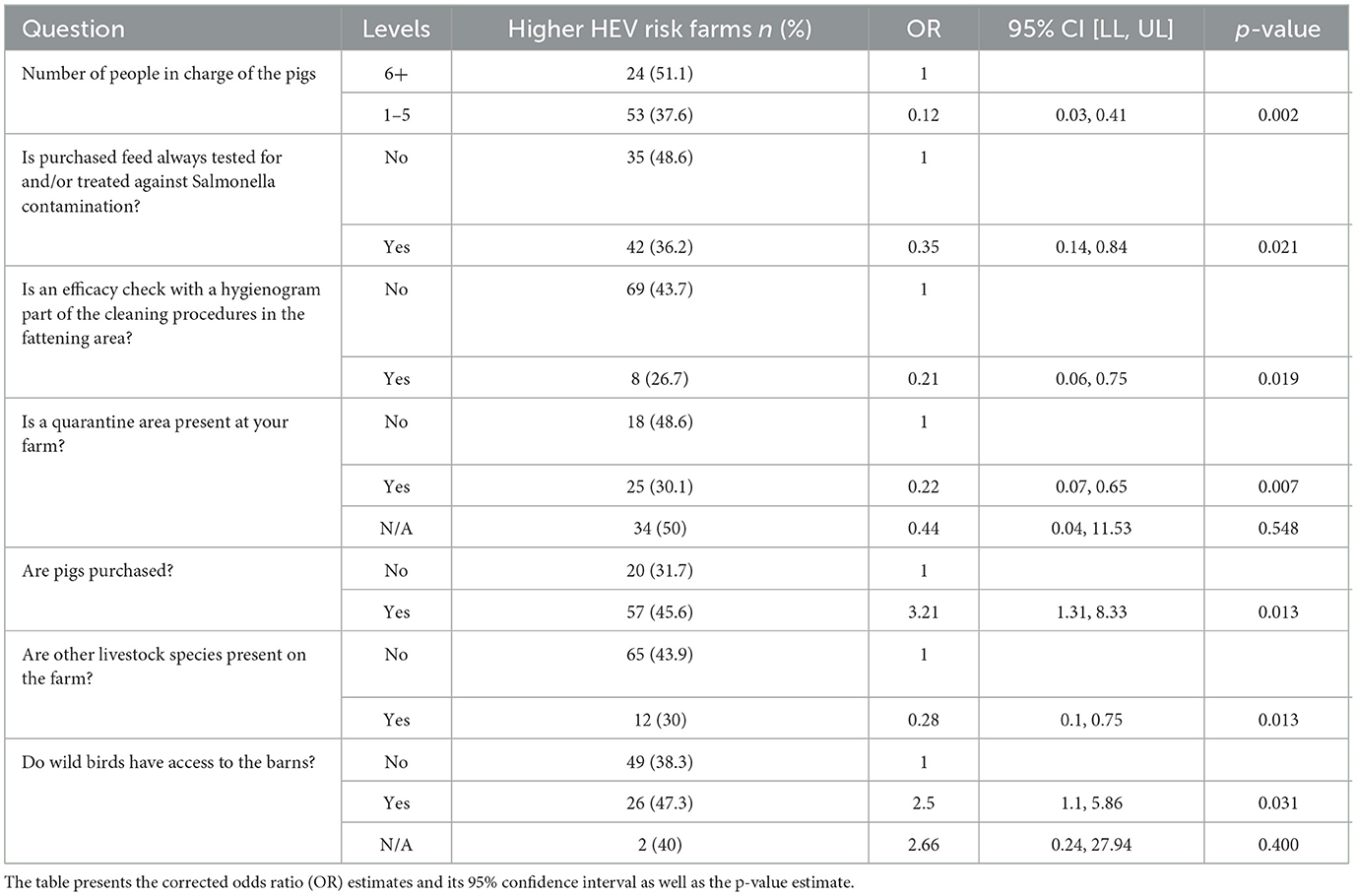 Tabla 3. Modelo de factores de riesgo con riesgo de VHE basado únicamente en muestras de engorde y ajustado por país y tipo de explotación.
Tabla 3. Modelo de factores de riesgo con riesgo de VHE basado únicamente en muestras de engorde y ajustado por país y tipo de explotación.
3.7 Análisis de sensibilidad
Dado que las explotaciones de NL se muestrearon de manera diferente a las de los otros países, los análisis de sensibilidad se realizaron excluyendo las granjas de NL de los modelos multivariados (Tablas suplementarias 8 y 9). En el modelo basado en todas las muestras, la exclusión de las granjas NL llevó a que la variable de manipulación de la canal perdiera su significación, pero no condujo a la inestabilidad del modelo en general ni a fuertes cambios en las estimaciones. En el modelo basado únicamente en muestras de engorde, la exclusión de las granjas NL no tuvo ningún efecto sobre la estabilidad del modelo y las estimaciones se mantuvieron en el mismo rango.
4 Discusión
Los análisis multivariados revelaron varias medidas de bioseguridad significativamente asociadas con el riesgo de VHE en las granjas porcinas europeas. Si bien se han realizado estudios que investigan la dinámica de la infección del VHE en granjas porcinas, solo unos pocos estudios han investigado las medidas de bioseguridad en relación con el VHE (20, 21, 45, 46). En los modelos de factores de riesgo, los pasos del procedimiento de limpieza, la presencia de un área bajo cuarentena, las medidas higiénicas del personal de la granja y el número de personas a cargo de los cerdos se asociaron significativamente con el riesgo de VHE. Algunas de las medidas encontradas fueron contrarias a las expectativas.
Este estudio representa la primera investigación en toda Europa sobre la presencia de VHE en granjas porcinas. Revela una prevalencia media de ARN-VHE comparable a estudios previos realizados en países como Suiza (58,8%) (47), con algunas diferencias entre países, que oscilan entre el 35 y el 100% (42, 43) (Figura 3A). La matriz de muestreo y el esquema de muestreo fueron determinados por el equipo del estudio BIOPIGEE como el método más apropiado y rentable para detectar y distinguir granjas de menor y mayor riesgo para el VHE, así como para Salmonella (25). Los dos resultados del VHE explicaron las diferencias en las muestras positivas para el VHE de cerdos en diferentes etapas de producción y la posible modificación del efecto por el bajo número de granjas reproductoras positivas para el VHE en el primer modelo de factores de riesgo. Las medidas de bioseguridad investigadas se eligieron en función de su viabilidad, la opinión de expertos y la evidencia en la literatura publicada de su efectividad para reducir el riesgo de VHE (y también de Salmonella) en granjas porcinas (28). Por lo tanto, la lista completa de medidas de bioseguridad para el VHE investigadas en este estudio es única y la primera de su tipo.
La utilización de higienografías en las áreas de cría y engorde se asoció con un menor riesgo de VHE en el modelo de todas las muestras y en el modelo de muestras de engorde, respectivamente. Las higienografías, pruebas de crecimiento bacteriano, se pueden utilizar para comprobar la eficacia de los procedimientos de limpieza. En este estudio, las granjas que utilizaron higienografías fueron casi exclusivamente granjas de bajo riesgo desde el parto hasta el engorde y aplicaron higienografías en todas las etapas de producción. Esas granjas realizaron significativamente más pasos de limpieza en cada etapa de producción, en comparación con las granjas que no utilizan higiengrama y, además, era más probable que aplicaran pasos de limpieza particulares en la mayoría o en todas las etapas de producción, como la limpieza en seco, la limpieza en húmedo o el tiempo de inactividad. Sin embargo, el número de pasos realizados en los procedimientos de limpieza por sí solos no se asoció con el riesgo de VHE (no se muestra el análisis). En resumen, esto podría significar que el uso de higienografías, aunque detecta bacterias, ayuda a identificar y mejorar la limpieza subóptima, lo que posteriormente reduce la carga ambiental del VHE (48).
En ambos modelos, la existencia de un área de cuarentena definida se asoció con un menor riesgo de VHE. Esto está en línea con el estudio de López-López et al. (21), que encontró una asociación entre la falta de un período de cuarentena y un mayor riesgo de VHE. Por lo general, las áreas de cuarentena están situadas lejos de otros edificios agrícolas. Aquí, el estado de salud de los cerdos que llegan a la granja, principalmente primerizas, se controla y analiza antes de que entren en otros edificios de la granja o se mezclen con el rebaño. Además, aquí se pueden aislar los cerdos enfermos de la granja. Las primerizas compradas suelen tener entre 4 y 6 meses de edad, momento en el que el VHE es más prevalente (7, 49). Por lo tanto, un período de cuarentena puede ser particularmente efectivo para que las primerizas se recuperen de la infección y entren en la piara porcina con VHE negativo.
La mejora de la bioseguridad externa a partir de la zona de cuarentena es muy importante, ya que el movimiento frecuente de cerdos entre granjas es un factor de riesgo y se considera uno de los principales impulsores de la propagación de enfermedades en la ganadería porcina especializada moderna (50). Y, de hecho, la compra de cerdos se asoció de forma independiente con un mayor riesgo de VHE según las muestras de engorde. En este estudio, las granjas que compraban cerdos tenían más probabilidades de tener un área de cuarentena en comparación con las granjas que no compraban cerdos (excluyendo las granjas que no tenían un área de cuarentena debido al sistema de producción, es decir, las granjas de engorde). Esto y el hecho de que ambas variables, el área de cuarentena y la compra de cerdos, estuvieran en el mismo modelo, indica que tener un área de cuarentena es protector contra el VHE, incluso cuando estas granjas no están comprando cerdos, y del mismo modo, que la compra de cerdos es un verdadero factor de riesgo para el VHE incluso cuando estas granjas tienen un área de cuarentena.
La prueba o el tratamiento de los piensos para cerdos comprados contra Salmonella se asoció con un menor riesgo de VHE en el modelo de todas las muestras. Sin embargo, el riesgo de transmisión del VHE a los cerdos a través de piensos contaminados se considera bajo (18, 19). Una explicación podría ser que la prueba y/o el tratamiento de los alimentos comprados (una medida de bioseguridad externa) refleja un sentido generalmente mayor de bioseguridad y esfuerzos más diligentes para prevenir la introducción y propagación de patógenos dentro de la granja.
El hecho de que las aves silvestres tuvieran acceso a los establos se asoció con un mayor riesgo de VHE en ambos modelos. Aunque este es un ejemplo de bioseguridad deficiente y un factor de riesgo conocido para Salmonella (51), no se han destacado riesgos específicos con respecto a las aves silvestres y el VHE en estudios anteriores. Sin embargo, un estudio informó de una infección natural de aves silvestres con VHE de mamíferos (genotipo 4) en un centro de vida silvestre en China (52), lo que indica la posibilidad de que las aves silvestres puedan (re)introducir el VHE en las piaras de cerdos.
La presencia de otras especies de ganado en la granja se asoció con un menor riesgo de VHE basado solo en muestras de engorde. Este pequeño grupo de granjas que tenían (una o varias) otras especies de ganado presentes también cuidaba con mucha más frecuencia cerdos con menos personas. Esto podría indicar que estas granjas eran más pequeñas, menos comerciales y posiblemente tenían una presión infecciosa de patógenos más baja que las granjas más grandes y especializadas. Además, no hubo asociación entre el riesgo de VHE basado solo en muestras de engorde y cualquier tipo específico de otras especies de ganado presentes.
Los hallazgos contradictorios pueden deberse a que las granjas de mayor riesgo han implementado (recientemente) medidas cuyo efecto protector aún no es medible o a que se han contrarrestado con prácticas de bioseguridad insuficientes en otros puntos de la granja. Las estimaciones de las medidas de protección reales estarían sesgadas y aparecerían como no significativas o incluso como factores de riesgo, lo que podría explicar que el tiempo de inactividad del área de engorde y las rutinas de higiene de las secciones transversales del establo se asociaron con un mayor riesgo de VHE en el modelo de todas las muestras. Del mismo modo, las precauciones higiénicas en la manipulación de las canales, una medida confirmada por la gran mayoría de las explotaciones, también se asociaron con un mayor riesgo de VHE en el mismo modelo. En particular, este efecto de riesgo particular desapareció después de excluir las granjas de NL y, por lo tanto, puede haber sido causado por el hecho de que las granjas de NL se clasificaron con mayor frecuencia y posiblemente injustamente como de mayor riesgo.
Un mayor riesgo de VHE se asoció con las granjas de engorde y las variables de área de engorde, mientras que lo contrario fue cierto para las granjas de cría (es decir, las granjas de cría y las variables del área de reproducción se asociaron con un menor riesgo de VHE). Esta diferencia en el riesgo de infección por VHE entre los tipos de explotación y las medidas relacionadas es un reflejo de la dinámica de infección por VHE, ya que el pico de infección suele producirse durante el engorde (19, 53). Aunque los diferentes esfuerzos en materia de bioseguridad pueden desempeñar un papel, las granjas de engorde no difirieron significativamente de las granjas de cría en la implementación de varios pasos del procedimiento de limpieza (el análisis no se muestra). Si bien las granjas de engorde deben priorizar el control de la propagación en la granja y la carga ambiental de VHE, dependen de la salud de los cerdos que reciben de las granjas en una etapa anterior de la cadena de producción.
Este estudio tiene varias limitaciones. Las granjas fueron una muestra de conveniencia, pero se hicieron esfuerzos para seleccionar granjas que fueran representativas de la cría de cerdos dentro de cada país participante. Además, se desconocía el estado de HEV de las granjas antes del muestreo, lo que puede tener un sesgo de selección limitado.
El método de detección del VHE en heces aún no está estandarizado y siguen siendo posibles diferencias en la detección a nivel nacional. Sin embargo, se hicieron esfuerzos para armonizar los protocolos de límite de detección (LOD) y los resultados de un análisis previo al estudio mostraron LOD comparables entre los laboratorios participantes. Todos menos uno demostraron una detección exitosa incluso con la dilución más alta de ARN-HEV. Por lo tanto, los resultados obtenidos del LOD confirmaron que los métodos empleados por los laboratorios eran adecuados para el estudio.
La traducción del cuestionario del inglés a los idiomas de los países participantes puede haber dado lugar a errores o malentendidos. A pesar de lo necesario, el ajuste de los modelos según el tipo de explotación y el país puede haber explicado parte de la variación en el riesgo de VHE entre las explotaciones y posiblemente haber reducido el poder estadístico para detectar nuevas medidas de bioseguridad. Por último, la falta de información sobre la capacitación o educación de los trabajadores agrícolas, las rutinas de trabajo específicas o si se aplicaba algún tipo de protocolo de bioseguridad en la granja también puede haber afectado los resultados del modelo.
En conclusión, la prevalencia del VHE en las explotaciones porcinas europeas representa un reto importante, pero el establecimiento de una estrategia de control universalmente fiable sigue siendo difícil de alcanzar. Los resultados del estudio indican que las medidas de bioseguridad externas, como la implementación de áreas de cuarentena y la evaluación periódica de los procedimientos de limpieza a través de pruebas de crecimiento bacteriano, podrían constituir las piedras angulares de un protocolo de bioseguridad eficaz. Sin embargo, se necesita más investigación para validar los hallazgos y comprender mejor la dinámica de infección del VHE. Por último, los resultados deben difundirse y ser aceptados por la comunidad agrícola para mejorar las normas de bioseguridad a nivel nacional y mitigar el impacto del VHE en la salud animal y humana.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
No se requirió aprobación ética para los estudios con animales de acuerdo con la legislación local y los requisitos institucionales porque no se realizaron procedimientos que entraran dentro de la definición de experimentación animal y, por lo tanto, el estudio estaba exento de evaluación ética para el uso de animales en investigación. El muestreo de depósitos fecales en el suelo se consideró fuera de la Ley de Procedimientos Científicos Animales de 1986. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
TD: Curación de datos, Análisis formal, Visualización, Redacción – borrador original, Redacción – revisión y edición. MM: Conceptualización, Investigación, Metodología, Escritura – Revisión y Edición. RS: Conceptualización, Curación de datos, Adquisición de fondos, Investigación, Metodología, Administración de proyectos, Supervisión, Redacción, revisión y edición. TT: Conceptualización, Investigación, Metodología, Supervisión, Redacción – revisión y edición. ID: Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición. RJ: Conceptualización, Metodología, Supervisión, Redacción – Revisión y Edición. EP: Investigación, Metodología, Redacción – revisión y edición. GK-V: Metodología, Redacción – revisión y edición, Curación de datos, Investigación. ES: Conceptualización, Investigación, Metodología, Recursos, Redacción – revisión y edición. GA: Metodología, Administración de proyectos, Redacción, revisión y edición. HM: Conceptualización, Investigación, Recursos, Escritura – Revisión y Edición. NA: Investigación, Escritura – Revisión y Edición. GI: Curación de datos, Investigación, Metodología, Visualización, Redacción – revisión y edición. JŻ: Investigación, Escritura – Revisión y Edición. AD: Investigación, Redacción – revisión y edición, Metodología. GLA: Investigación, Redacción – revisión y edición. DD’A: Análisis formal, Investigación, Redacción – revisión y edición. SS: Investigación, Escritura – Revisión y Edición. NB: Redacción – revisión y edición, Investigación. EB: Conceptualización, Obtención de Fondos, Investigación, Administración de Proyectos, Software, Supervisión, Redacción, Revisión y Edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo contó con el apoyo de la financiación del programa de Investigación e Innovación Horizonte 2020 de la Unión Europea en virtud del acuerdo de subvención n.º 773830: Programa Conjunto Europeo One Health y de los institutos asociados a BIOPIGEE. La recopilación de datos para los Países Bajos se realizó como parte del proyecto «HEVentie: intervención del virus de la hepatitis E en la producción primaria de cerdos». HEVentie recibe apoyo financiero de Topsector AgriFood (TKI AF 18119).
Reconocimientos
Los autores desean agradecer a los agricultores por participar en este estudio y compartir su información. También nos gustaría agradecer a los equipos de recolección de muestras y laboratorio de cada país que produjeron resultados de VHE, así como al consorcio BIOPIGEE. También nos gustaría expresar nuestro agradecimiento a los servicios alemanes de sanidad porcina en Baviera y Renania del Norte-Westfalia por su apoyo en la recopilación de datos sobre las granjas. En Alemania, el análisis de la muestra fue llevado a cabo por Vaxxinova, a quienes se agradece su ayuda.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1328284/full#supplementary-material
Referencias
1. Velavan TP, Pallerla SR, Johne R, Todt D, Steinmann E, Schemmerer M, et al. Hepatitis E: una actualización sobre One Health y la medicina clínica. Hígado Int. (2021) 41:1462–73. doi: 10.1111/liv.14912
2. QUIÉN. Hoja informativa sobre la hepatitis E. (2023) [actualizado el 20 de julio de 2023]. Disponible en línea en: https://www.who.int/news-room/fact-sheets/detail/hepatitis-e (consultado el 20 de septiembre de 2023).
3. Faber M, Wenzel J, Jilg W, Thamm M, Höhle M, Stark K. Seroprevalencia del virus de la hepatitis E en adultos, Alemania. Emerg Infect Dis. (2012) 18:1654–7. doi: 10.3201/eid1810.111756
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Faber M, Willrich N, Schemmerer M, Rauh C, Kuhnert R, Stark K, et al. Seroprevalencia, seroincidencia y serorreversión del virus de la hepatitis E en la población adulta alemana. J Hepatía viral. (2018) 25:752–8. doi: 10.1111/jvh.12868
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. ECDC. Datos sobre la hepatitis E. (2017) [actualizado el 26 de junio de 2017]. Disponible en línea en: https://www.ecdc.europa.eu/en/hepatitis-e/facts (consultado el 20 de septiembre de 2023).
6. Pallerla SR, Harms D, Johne R, Todt D, Steinmann E, Schemmerer M, et al. Infección por el virus de la hepatitis E: circulación, epidemiología molecular e impacto en la salud global. Patógenos. (2020) 9:856. doi: 10.3390/pathogens9100856
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Pavio N, Doceul V, Bagdassarian E, Johne R. Conocimiento reciente sobre el virus de la hepatitis E en reservorios de Suidae y vías de transmisión a humanos. Res. Veterinaria. (2017) 48:78. doi: 10.1186/s13567-017-0483-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Spahr C, Knauf-Witzens T, Vahlenkamp T, Ulrich RG, Johne R. Virus de la hepatitis E y virus relacionados en animales salvajes, domésticos y de zoológico: una revisión. Zoonosis Salud Pública. (2018) 65:11–29. doi: 10.1111/zph.12405
9. RKI. Hepatitis E. (2015) [actualizado el 2 de noviembre de 2015]. Disponible en línea en: https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_HepatitisE.html (consultado el 20 de septiembre de 2023).
10. Ricci A, Allende A, Bolton D, Chemaly M, Davies R, Fernandez Escamez PS, et al. Panel de la EFSA sobre peligros biológicos: opinión científica sobre los riesgos para la salud pública asociados con el virus de la hepatitis E (VHE) como patógeno transmitido por los alimentos. EFSA J. (2017) 15:4886–89. doi: 10.2903/j.efsa.2017.4886
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Johne R, Althof N, Nöckler K, Falkenhagen A. Das hepatitis-E-virus – ein zoonotisches virus: verbreitung, übertragungswege und bedeutung für die lebensmittelsicherheit. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. (2022) 65:202–8. DOI: 10.1007/S00103-021-03476-W
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Salines M, Andraud M, Rose N. De la epidemiología del virus de la hepatitis E (VHE) en el reservorio porcino a las estrategias de mitigación de riesgos para la salud pública: una revisión exhaustiva. Res. Veterinaria. (2017) 48:31. doi: 10.1186/s13567-017-0436-3
13. Treagus S, Wright C, Baker-Austin C, Longdon B, Lowther J. La transmisión del virus de la hepatitis E a través de los alimentos a los seres humanos. Ambiente alimentario Virol. (2021) 13:127–45. doi: 10.1007/s12560-021-09461-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Chelli E, Suffredini E, De Santis P, De Medici D, Di Bella S, D’Amato S, et al. Aparición del virus de la hepatitis E en cerdos sacrificados en Italia. Animales. (2021) 11:277. doi: 10.3390/ani11020277
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Meester M, Bouwknegt M, Hakze-van der Honing R, Vernooij H, Houben M, van Oort S, et al. El muestreo transversal repetido de cerdos en el momento del sacrificio indica una edad variable de la infección por el virus de la hepatitis E dentro de las granjas porcinas y entre ellas. Res. Veterinaria. (2022) 53:50. doi: 10.1186/s13567-022-01068-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Ianiro G, Chelli E, De Sabato L, Monini M, Ostanello F, Di Bartolo I. Vigilancia a largo plazo del virus de la hepatitis E en una granja porcina italiana de dos sitios desde el parto hasta el final. Zoonosis Salud Pública. (2021) 68:474–82. doi: 10.1111/zph.12837
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Wang H, Karlsson M, Lindberg M, Nystrom K, Norder H. Las cepas del virus de la hepatitis E que infectan a los cerdos domésticos suecos son únicas para cada granja porcina y permanecen en la granja durante al menos 2 años. Transbound Emerg Dis. (2019) 66:1314–23. doi: 10.1111/tbed.13153
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Pujols J, Rodríguez C, Navarro N, Pina-Pedrero S, Campbell JM, Crenshaw J, et al. No hay transmisión del virus de la hepatitis E en cerdos alimentados con dietas que contienen plasma porcino comercial secado por aspersión: un estudio retrospectivo de muestras de varios ensayos porcinos. Virol J. (2014) 11 232. doi: 10.1186/s12985-014-0232-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Meester M, Tobias TJ, Bouwknegt M, Kusters NE, Stegeman JA, van der Poel WHM. Dinámica de la infección y persistencia del virus de la hepatitis E en granjas porcinas: una revisión. Manejo de la salud de Porc. (2021) 7:16. doi: 10.1186/s40813-021-00189-z
20. Walachowski S, Dorenlor V, Lefevre J, Lunazzi A, Eono F, Merbah T, et al. Factores de riesgo asociados a la presencia del virus de la hepatitis E en hígados y seroprevalencia en cerdos en edad de sacrificio: estudio retrospectivo de 90 granjas porcinas en Francia. Epidemiol Infect. (2014) 142:1934–44. doi: 10.1017/S0950268813003063
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. López-López P, Risalde MLA, Frías M, García-Bocanegra I, Brieva T, Caballero-Gómez J, et al. Factores de riesgo asociados al virus de la hepatitis E en cerdos de diferentes sistemas de producción. Microbiol veterinario. (2018) 224:88–92. doi: 10.1016/j.vetmic.2018.08.020
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. de Oliveira-Filho EF, Lopes KGS, Cunha DS, Silva VS, Barbosa CN, Brandespim DF, et al. Análisis de riesgo y ocurrencia del virus de la hepatitis E (VHE) en cerdos domésticos en el nordeste de Brasil. Ambiente alimentario Virol. (2017) 9:256–9. doi: 10.1007/s12560-017-9292-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Nakai I, Kato K, Miyazaki A, Yoshii M, Li T-C, Takeda N, et al. Diferentes patrones de excreción fecal de dos cepas comunes del virus de la hepatitis E en tres granjas porcinas japonesas. Am J Trop Med Hyg. (2006) 75:1171–7. doi: 10.4269/ajtmh.2006.75.1171
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Leblanc D, Ward P, Gagné M-J, Poitras E, Müller P, Trottier Y-L, et al. Presencia del virus de la hepatitis E en una piara porcina infectada de forma natural desde el destete hasta el sacrificio. Int J Microbiol Alimentario. (2007) 117:160–6. doi: 10.1016/j.ijfoodmicro.2007.03.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Smith RP, May HE, Burow E, Meester M, Tobias TJ, Sassu EL, et al. Evaluación de las medidas de bioseguridad de las granjas porcinas para el control de Salmonella en granjas europeas. Epidemiol Infect. (2023) 151:1–10. doi: 10.1017/S0950268823001115
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Burow E, Prigge C, Smith R, Meester M, C. K. OHEJP BIOPIGEE entregable: D-JRP21-WP2.1 «Desarrollo de un protocolo de bioseguridad». Zenodo. (2021). doi: 10.5281/zenodo.5336900
27. Burow E, Prigge C, Smith R, Meester M, Santucci G, Young B, et al. Selección de un protocolo de bioseguridad para identificar las mejores prácticas para limitar la presencia de Salmonella y el virus de la hepatitis E en las granjas porcinas europeas. Zenodo. (2020). doi: 10.5281/zenodo.4944520
28. Galipó E, Zoche-Golob V, Sassu EL, Prigge C, Sjölund M, Tobias T, et al. Priorización de la bioseguridad de las granjas porcinas para el control de las infecciones por Salmonella y el virus de la hepatitis E; resultados de la obtención de un dictamen pericial europeo. Manejo de la salud de Porc. (2022) 9:8. doi: 10.21203/rs.3.rs-1946242/v1
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Smith RP, Andrés V, Cheney TE, Martelli F, Gosling R, Marier E, et al. ¿Cómo mantienen las granjas porcinas una baja prevalencia de Salmonella?: un estudio de casos y controles. Epidemiol Infect. (2018) 146:1909–15. doi: 10.1017/S0950268818002248
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Withenshaw SM, Grierson SS, Smith RP. Estudio de la mezcla de animales y la dinámica de la infección por el virus de la hepatitis E en una granja porcina desde el parto hasta el engorde. Animales. (2022) 12:272. doi: 10.3390/ani12030272
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Autoridad Europea de Seguridad Alimentaria. Análisis de la encuesta de referencia sobre la prevalencia de Salmonella en explotaciones con cerdos reproductores en la UE, 2008 – Parte A: Estimaciones de la prevalencia de Salmonella. EFSA J. (2009) 7:1377. doi: 10.2903/j.efsa.2009.1377
32. Powell LF, Cheney TE, Williamson S, Guy E, Smith RP, Davies RH. Un estudio de prevalencia de Salmonella spp., Yersinia spp., Toxoplasma gondii y el virus del síndrome respiratorio y reproductivo porcino en cerdos del Reino Unido en el momento del sacrificio. Epidemiol Infect. (2016) 144:1538–49. doi: 10.1017/S0950268815002794
33. Sargento ESG. Calculadoras epidemiológicas de Epitools. Ausvet (2018). Disponible en línea en: http://epitools.ausvet.com.au (consultado el 20 de septiembre de 2023).
34. Organización Internacional de Normalización (ISO). Microbiología de la cadena alimentaria – Método horizontal para la determinación del virus de la hepatitis A y el norovirus mediante RT-PCR en tiempo real – Parte 2: Método de detección (ISO 15216-2:2019). Vernier (2019).
35. De Sabato L, Ostanello F, De Grossi L, Marcario A, Franzetti B, Monini M, et al. Estudio molecular de la infección por VHE en la población de jabalíes en Italia. Transbound Emerg Dis. (2018) 65:1749–56. doi: 10.1111/tbed.12948
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Ward P, Poitras E, Leblanc D, Letellier A, Brassard J, Plante D, et al. Análisis comparativo de diferentes ensayos de RT-PCR en tiempo real de TaqMan para la detección del virus de la hepatitis E porcina e integración del calicivirus felino como control interno. J Appl Microbiol. (2009) 106:1360–9. doi: 10.1111/j.1365-2672.2008.04104.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Wang S, Liu Y, Li D, Zhou T, Gao S, Zha E, et al. Preparación y evaluación de partículas similares a bacteriófagos MS2 que empaquetan el ARN del virus de la hepatitis E. FEMS Microbiol Lett. (2016) 363:FNW221. doi: 10.1093/femsle/fnw221
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Baert L, Uyttendaele M, Debevere J. Evaluación de métodos de extracción viral en una amplia gama de alimentos listos para comer con RT-PCR convencional y en tiempo real para la detección de Norovirus GII. Int J Microbiol Alimentario. (2008) 123:101–8. doi: 10.1016/j.ijfoodmicro.2007.12.020
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Pinto F, Pacheco CP, Ferreira D, Moradas-Ferreira P, Tamagnini P. Selección de genes de referencia adecuados para análisis de RT-qPCR en cianobacterias. PLoS UNO. (2012) 7:e34983. doi: 10.1371/journal.pone.0034983
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Schmittgen TD, Livak KJ. Análisis de datos de PCR en tiempo real mediante el método comparativo C(T). Nat Protoc. (2008) 3:1101–8. doi: 10.1038/nprot.2008.73
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Jothikumar N, Cromeans TL, Robertson BH, Meng XJ, Hill VR. Un ensayo de RT-PCR en tiempo real de un solo paso ampliamente reactivo para la detección rápida y sensible del virus de la hepatitis E. Métodos J Virol. (2006) 131:65–71. doi: 10.1016/j.jviromet.2005.07.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Krumova-Valcheva GL, Di Bartolo I, Smith RP, Gyurova E, Mateva G, Milanov M, et al. Detección de ARN del VHE mediante RT-PCR en tiempo real en un solo paso en granjas porcinas de parto a engorde en Bulgaria. 673 patógenos. (2023) 12:673. doi: 10.3390/pathogens12050673
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Ianiro G, Pavoni E, Aprea G, Romantini R, Alborali GL, D’Angelantonio D, et al. Estudio transversal de la circulación del virus de la hepatitis E (VHE) en granjas porcinas italianas. Front Vet Sci. (2023) 10:1136225. doi: 10.3389/fvets.2023.1136225
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Baylis SA, Blumel J, Mizusawa S, Matsubayashi K, Sakata H, Okada Y, et al. Norma internacional de la Organización Mundial de la Salud para armonizar los ensayos para la detección del ARN del virus de la hepatitis E. Emerg Infect Dis. (2013) 19:729–35. doi: 10.3201/eid1905.121845
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Caruso C, Peletto S, Rosamilia A, Modesto P, Chiavacci L, Sona B, et al. Virus de la hepatitis E: un estudio serológico y virológico transversal en cerdos y humanos en riesgo zoonótico dentro de un área de cría porcina de alta densidad. Transbound Emerg Dis. (2017) 64:1443–53. doi: 10.1111/tbed.12533
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Meester M, Tobias TJ, van den Broek J, Meulenbroek CB, Bouwknegt M, van der Poel WHM, et al. Medidas de bioseguridad de las granjas para prevenir la infección por el virus de la hepatitis E en cerdos de engorde en granjas porcinas infectadas endémicamente. Una sola salud. (2023) 16:100570. doi: 10.1016/j.onehlt.2023.100570
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Lienhard J, Vonlanthen-Specker I, Sidler X, Bachofen C. Cribado de piaras de cerdos suizos para detectar el virus de la hepatitis E: un estudio piloto. Animales. (2021) 11:3050. doi: 10.3390/ani11113050
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Wolff A, Gunther T, Johne R. Estabilidad del virus de la hepatitis E después del secado en diferentes superficies. Ambiente alimentario Virol. (2022) 14:138–48. doi: 10.1007/s12560-022-09510-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Ianiro G, Monini M, De Sabato L, Chelli E, Cerini N, Ostanello F, et al. Dinámica de la excreción del virus de la hepatitis E (VHE) en cerdos. Animales. (2022) 12:1063. doi: 10.3390/ani12091063
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Stärk KDC, Wingstrand A, Dahl J, Møgelmose V, Lo Fo Wong DMA. Diferencias y similitudes entre las opiniones de los expertos sobre la dinámica de Salmonella enterica en la precosecha porcina. Prev Vet Med. (2002) 53:7–20. doi: 10.1016/S0167-5877(01)00278-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Tizard I. Salmonelosis en aves silvestres. Semin Avian Exot Pet Med. (2004) 13:50–66. doi: 10.1053/j.saep.2004.01.008
52. Zhang W, Shen Q, Yang ZB, Yuan CL, Cui L, Zhu JG, et al. Infección entre especies del virus de la hepatitis E en un lugar similar a un zoológico, incluidas las aves. Epidemiol Infect. (2008) 136:1020–6. doi: 10.1017/S095026880700965X
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Ianiro G, Monini M, Ammendolia MG, De Sabato L, Ostanello F, Vaccari G, et al. Replicación in vitro del virus de la hepatitis E porcina (VHE): producción de cepas adaptadas a las células. Animales. (2023) 13:276. doi: 10.3390/ani13020276
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: hepatitis-E-virus, VHE, medidas de bioseguridad, producción porcina, BIOPIGEE, One Health, OH
Cita: Dubbert T, Meester M, Smith RP, Tobias TJ, Di Bartolo I, Johne R, Pavoni E, Krumova-Valcheva G, Sassu EL, Aprea G, May H, Althof N, Ianiro G, Żmudzki J, Dimitrova A, Alborali GL, D’Angelantonio D, Scattolini S, Battistelli N y Burow E (2024) Medidas de bioseguridad para controlar el virus de la hepatitis E en granjas porcinas europeas. Frente. Vet. Sci. 11:1328284. doi: 10.3389/fvets.2024.1328284
Recibido: 26 de octubre de 2023; Aceptado: 29 de enero de 2024;
Publicado: 14 febrero 2024.
Editado por:
Amjad Islam Aqib, Universidad de Ciencias Veterinarias y Animales de Cholistán, Pakistán
Revisado por:
Iqra Zaheer, Instituto de Investigación de la Producción Ganadera, Pakistán
S. Rehan Ahmad, Universidad Estatal de Bengala Occidental, India
Derechos de autor © 2024 Dubbert, Meester, Smith, Tobias, Di Bartolo, Johne, Pavoni, Krumova-Valcheva, Sassu, Aprea, May, Althof, Ianiro, Żmudzki, Dimitrova, Alborali, D’Angelantonio, Scattolini, Battistelli y Burow. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Tamino Dubbert, tamino.dubbert@bfr.bund.de
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía