Mito-Tempo mejora la integridad acrosómica de los espermatozoides en gatos

Mito-Tempo mejora la integridad acrosómica de los espermatozoides del epidídimo congelados-descongelados en gatos
 Hiba Ali Hassan1*
Hiba Ali Hassan1*  Penélope Banchi1,2
Penélope Banchi1,2  Dominio Guillaume1
Dominio Guillaume1  Leen Vanderheyden1
Leen Vanderheyden1  Sylwia Prochowska3
Sylwia Prochowska3  Wojciech Nizański3
Wojciech Nizański3  Ana Van Soom1
Ana Van Soom1- 1Unidad de Biología Reproductiva, Facultad de Medicina Veterinaria, Departamento de Medicina Interna, Reproducción y Medicina de la Población, Universidad de Gante, Gante, Merelbeke, Bélgica
- 2Departamento de Ciencias Veterinarias, Facultad de Medicina Veterinaria, Universidad de Turín, Grugliasco, Italia
- 3Departamento de Reproducción y Clínica de Animales de Granja, Facultad de Medicina Veterinaria, Universidad de Wrocław de Ciencias Ambientales y de la Vida, Wrocław, Polonia
Introducción: En los gatos tomcat, los espermatozoides del epidídimo proporcionan una fuente adicional de gametos masculinos disponibles para la criopreservación. Si bien este procedimiento es factible, la tasa de supervivencia y la motilidad de los espermatozoides de gato epididimario son bajas después de la descongelación. Se sabe que la criopreservación induce estrés oxidativo en los espermatozoides, siendo las mitocondrias y la membrana plasmática los dos principales sitios de generación, y una presencia desequilibrada de radicales libres es una posible causa de esta baja tasa de supervivencia. Diferentes antioxidantes han sido probados antes por su efecto sobre la calidad criopreservada de los espermatozoides de gato, con resultados variables. Aquí, utilizamos Mito-Tempo, que es un antioxidante sintético dirigido a las mitocondrias y un eliminador específico del sistema superóxido mitocondrial. Al complementar Mito-Tempo con el extensor de congelación, nuestro objetivo era mejorar la calidad del esperma de los espermatozoides del epidídimo de gato congelados y descongelados.
Métodos: Se evaluó la motilidad y la concentración de los espermatozoides del epidídimo obtenidos de doce gatos tomcat. Antes de la congelación, las muestras se diluyeron en un extensor tamponado TRIS con yema de huevo y glicerol y se dividieron en cinco alícuotas suplementadas con 0 (control), 0.5, 5, 50 y 1005M de Mito-Tempo. Después de la descongelación, se evaluaron la motilidad de los espermatozoides, la concentración, la morfología, la integridad de la membrana plasmática, la integridad del acrosoma y el potencial de la membrana mitocondrial. Se utilizó una prueba de suma de rangos de Friedman con una prueba post-hoc de Bonferroni para determinar las diferencias estadísticas entre los grupos en los parámetros del semen posteriores al deshielo.
Resultados y discusión: Los resultados indicaron una ligera mejoría en la integridad del acrosoma en todos los grupos que fueron suplementados con Mito-Tempo, con el grupo que recibió 55M de Mito-Tempo mostrando la mayor mejoría [(mediana de 67.99%, IQR de 5.55) en comparación con el grupo de control (mediana de 65.33%, IQR de 7.75; P = 0,05)]. Para todos los demás parámetros de los espermatozoides, no se detectaron diferencias significativas (P > 0,05) entre las diferentes concentraciones de Mito-Tempo. Estos hallazgos resaltan el efecto protector de Mito-Tempo sobre la integridad del acrosoma y sugieren que 55M es la concentración más efectiva para mantener la integridad del acrosoma. Dado que Mito-Tempo ha mostrado un efecto positivo en múltiples parámetros de esperma en otras especies, como hombres, jabalíes, gallos, carneros y toros, debemos concluir que la especificidad de la especie puede desempeñar un papel aquí.
1. Introducción
Más del 60% de los Felidae están clasificados como en peligro y vulnerables o casi amenazados por la Unión Internacional para la Conservación de la Naturaleza (1). La fragmentación de las poblaciones de Felidae en grupos más pequeños y aislados está, entre otros factores, llevando a un mayor riesgo de extinción (2-4). Esta fragmentación está reduciendo el flujo de genes, lo que lleva a una reducción en la diversidad genética que resulta en una disminución de la fertilidad (2, 5). Los estudios han demostrado que la variabilidad genética limitada se asocia con una mayor producción de espermatozoides malformados (5). Por esta razón, es extremadamente importante fomentar la variabilidad genética preservando los gametos de un mayor número de animales. Con este objetivo, los animales fallecidos pueden representar una fuente conveniente para la recolección de gametos para enriquecer los bancos genéticos. La optimización de los protocolos de recolección y preservación es la clave para apoyar la preservación de especies en peligro de extinción y el gato doméstico (Felis catus) representa un excelente modelo, proporcionando una fuente accesible y más abundante de gametos.
La criopreservación se usa ampliamente para preservar gametos animales y humanos (6), pero el proceso puede provocar daños significativos en varios aspectos de los parámetros de los espermatozoides, como la integridad de la membrana plasmática, la integridad de los acrosomas, la motilidad de los espermatozoides y la integridad del ADN (7). Esta degradación es causada principalmente por la formación de radicales libres. Los radicales libres se pueden clasificar en especies reactivas de oxígeno (ROS), especies reactivas de nitrógeno y otras especies reactivas no radicales (6). Entre estos, los radicales libres más comúnmente encontrados son los que pertenecen a la familia ROS. Un desequilibrio en el sistema oxidante-antioxidante causado por una sobreproducción de oxidantes resulta en estrés oxidativo. El estrés oxidativo resultante puede conducir a la peroxidación lipídica, donde los ácidos grasos poliinsaturados en la membrana plasmática son atacados por ROS, lo que resulta en la formación de moléculas de peróxido lipídico que causan alteraciones físicas y funcionales en la membrana plasmática, como aumento de la permeabilidad, disminución de la fluidez y cambios en la función de la proteína de la membrana (6). Las especies reactivas de oxígeno que entran en los espermatozoides representan una amenaza significativa para el material genético. Causan la destrucción del ADN mitocondrial, lo que lleva a una reducción en la producción de ATP intracelular (8, 9). Esta reducción está afectando tanto a la función como a la motilidad de los espermatozoides (10).
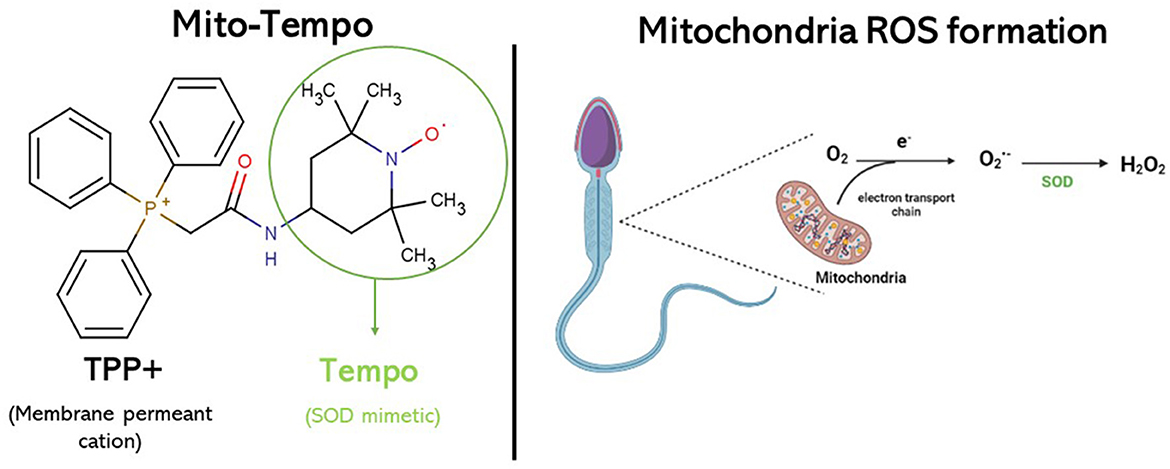
Los antioxidantes empleados en los extensores de criopreservación pueden servir como una protección contra la formación de ROS y la aparición de estrés oxidativo. Estos antioxidantes se pueden clasificar en antioxidantes de actividad enzimática (como glutatión peroxidasa, superóxido dismutasa (SOD) y catalasa) o antioxidantes de actividad no enzimática (como vitamina C, vitamina E, vitamina B12, melatonina, resveratrol y glutatión) (11). Por esta razón, varios antioxidantes han sido probados como aditivos para el diluyente de congelación en diferentes especies para mejorar la criosupervivencia de los espermatozoides (12, 13). Mito-Tempo (MT) es un antioxidante sintetizado dirigido a las mitocondrias derivado del nitroóxido de piperidina, TEMPO, conjugado con un catión trifenilfosfonio lipofílico (TPP +) y funciona como un eliminador específico de superóxido mitocondrial. TEMPO funciona como una mimética de superóxido dismutasa en el ciclo catalítico del superóxido (Figura 1). TPP es un catión perverso de membrana que, impulsado por el potencial de membrana, pasa rápidamente la membrana lipídica y se acumula masivamente en las mitocondrias energizadas. La combinación de TEMPO y TPP crea una sustancia química con propiedades de eliminación de superóxido que se dirige específicamente a las mitocondrias (8, 9, 14).++
Figura 1. Fórmula molecular Mito-Tempo. Actuando como mimético SOD, puede disminuir la generación de ROS en la membrana mitocondrial interna.
El efecto de la suplementación con MT al extensor de semen se ha investigado en varias especies, como humanos (15, 16), jabalíes (17), gallos (18, 19), carneros (20) y toros (21, 22). En estos estudios, la calidad del esperma se renovó con la suplementación de MT en comparación con el grupo de control. Hasta donde sabemos, el efecto de la suplementación con MT al extensor de semen nunca se ha investigado en felinos. Por lo tanto, la presente investigación tuvo como objetivo evaluar el impacto de este antioxidante específico en la calidad posterior al deshielo de los espermatozoides del epidídimo felino.
2. Materiales y métodos
Todos los productos fueron comprados a Sigma (Sigma, St. Louis, USA) excepto si se indica lo contrario.
2.1. Muestras de animales
Se recolectaron testículos y epidídimos de doce gatos de múltiples clínicas veterinarias de primera línea en Wroclaw, Polonia, entre abril y mayo de 2022. Todos los gatos tomcats eran gatos callejeros clínicamente sanos y se sometieron a orquiectomía electiva en un programa de trampa, castración y liberación. Después de la recolección, las muestras se colocaron inmediatamente en tubos de halcón de 50 ml que contenían 0,9% de NaCl y se transportaron dentro de un refrigerador portátil (4 ° C con sistema de temperatura controlada) al laboratorio de la Facultad de Medicina Veterinaria de la Universidad de Wroclaw de Ciencias Ambientales y de la Vida. Las muestras se procesaron dentro de 1-4 h después de la orquiectomía. Brevemente, después de ser retiradas de la solución salina fisiológica, las muestras se lavaron con solución salina tampón fosfato (PBS; P4474) y cada epidídimo fue cuidadosamente diseccionado lejos del testículo. Se realizó picado del epidídimo para la recolección de espermatozoides. Específicamente, la cauda de ambos epidídimos, junto con el conducto deferente, se colocaron en una placa de Petri que contenía 5 ml de medio de recolección de semen [medio F-10 de Ham (N6013) suplementado con 2 mM de L-glutamina (G7513) y 5% de suero fetal bovino (F9665)]. Se utilizó una hoja de bisturí estéril para realizar múltiples cortes, evitando los vasos sanguíneos, tanto en la cauda como en el conducto deferente, permitiendo que los espermatozoides nadaran hacia el medio de recolección de semen. Después de 10 minutos de incubación a 37°C, se recogió el medio de recolección de semen que contenía los espermatozoides, se filtró (CellTrics 30 mm, Partec) y se colocó en un tubo de halcón de 15 ml precalentado.
2.2. Evaluación previa a la congelación de los espermatozoides
2.2.1. Motilidad de los espermatozoides
La motilidad de los espermatozoides se evaluó inmediatamente después de la recolección de los espermatozoides. Brevemente, 10 μL de la suspensión de esperma se colocaron en un portaobjetos microscópico precalentado, cubierto con un cubreobjetos de vidrio precalentado, y evaluado subjetivamente por dos operadores igualmente experimentados bajo un microscopio de contraste de fase equipado con una etapa de calentamiento (37 ° C) (Nikon Eclipse E200). La motilidad total de los espermatozoides fue evaluada bajo cinco campos diferentes por ambos operadores y la media fue calculada y registrada.
2.2.2. Concentración de espermatozoides
La concentración de espermatozoides se midió utilizando una cámara de conteo Thoma. Para este procedimiento, 10 μL de la suspensión de esperma se diluyeron en 190 μL de agua. Después de mezclar delicadamente la suspensión, ambas rejillas de la cámara Thoma se llenaron con 10 μL de la suspensión. Los espermatozoides se contaron utilizando un microscopio de contraste de fase (aumento x40) (Nikon Eclipse E200) y se calculó la concentración.
2.3. Criopreservación y descongelación
Cada muestra de esperma se centrifugó a 620 × g durante 5 minutos a 22 °C (23). Se extrajo el sobrenadante y el pellet se resuspendió en un extensor de semen I, que contenía 3% de glicerol y 20% de yema de huevo en tampón Tris [3,025 g de Tris(hidroximetil)aminometano (T6066), 1,7 g de ácido cítrico (C7129), 1,25 g de fructosa (F3510) y 0,1 g de estreptomicina (S9137) en 100 ml de agua destilada] para alcanzar una concentración de 16 × 106 espermatozoides/ml (24). La muestra extendida se dividió en cuatro volúmenes iguales y se colocó en tubos Eppendorf de 2 ml (Eppendorf, Alemania).
Cada alícuota se complementó con una concentración específica de Mito-Tempo (MT; SML0737) (Control del grupo A: sin MT; Grupo B: 5 μM MT; Grupo C: 50 μM MT; y Grupo D: 100 μM MT). Se calculó el volumen de MT para alcanzar la concentración deseada en cada alícuota y la mitad se añadió inmediatamente a cada tubo de Eppendorf. Posteriormente, las muestras se colocaron en un baño de agua tibia (37 ° C) y se enfriaron a 4 ° C. Después de 90 minutos, el segundo extensor de semen (extensor II que contiene 7% de glicerol, 1% de pasta Equex y 20% de yema de huevo en tampón Tris) se agregó junto con la otra mitad de la cantidad calculada de MT para alcanzar una concentración final de 8 × 106 espermatozoides/ml (24). Luego, las muestras se cargaron directamente en pajitas de 0,25 ml preenfriadas, colocadas a 5 cm por encima de la superficie de nitrógeno líquido durante 10 minutos antes de sumergirse en nitrógeno líquido (23). Las pajillas se almacenaron a –196 ° C durante al menos 3 días antes de realizar análisis adicionales (23).
La descongelación se obtuvo sumergiendo las pajillas en un baño de agua tibia a 37 ° C durante 30 segundos y se evaluaron inmediatamente los parámetros de los espermatozoides posteriores a la descongelación (23).
2.4. Evaluación de los espermatozoides después del deshielo
2.4.1. Motilidad y morfología de los espermatozoides
La motilidad de los espermatozoides se evaluó como se describió anteriormente para muestras frescas. La morfología de los espermatozoides se evaluó después de la tinción con eosina nigrosin. Brevemente, se agregaron 10 μL de solución de nigrosina de eosina (v: v) a 10 μL de suspensión de esperma descongelada y se untaron en un portaobjetos microscópico. Después de que el portaobjetos se secó al aire, se evaluaron doscientos espermatozoides bajo una microscopía de campo brillante (Olympus BX51TF, Tokio, Japón) con un aumento de 1.000x bajo inmersión en aceite. Luego se registraron los porcentajes de espermatozoides morfológicamente normales y espermatozoides con cabezas anormales, colas anormales, gotitas citoplasmáticas proximales y gotitas citoplasmáticas distales.
2.4.2. Análisis del citómetro de flujo
Las muestras de semen post-descongelación se diluyeron con tampón TRIS (3,02% (p/v) TRIS, 1,35% (p/v) ácido cítrico, 1,25% (p/v) fructosa, en agua destilada; pH 6,5, todos los reactivos comprados a Merck, Polonia) para obtener una concentración de 5 × 106 espermatozoides/ml. Cada muestra diluida se dividió en tres alícuotas de 300 μL cada una para evaluar la integridad de la membrana plasmática, la integridad del acrosoma y la actividad mitocondrial mediante citómetro de citometría de flujo Guava EasyCyte 5 (Merck KGaA, Darmstadt, Alemania). Las sondas fluorescentes fueron excitadas por un láser de iones de argón de 488 nm. La detección de fluorescencia verde se estableció con un filtro de paso de banda FL1 (525 nm / 30 nm), la fluorescencia naranja se midió con filtro FL2 (583/26 nm) y la fluorescencia roja se midió con un filtro FL3 (695/50 nm). Los eventos no espermatozoides se eliminaron en función de las propiedades de dispersión y se excluyeron del análisis. Se analizaron un total de 10.000 eventos por parámetro para cada muestra. Las adquisiciones de gametos se analizaron con el software GuavaSoft™ 3.1.1 (Merck KGaA, Darmstadt, Alemania).
2.4.2.1. Integridad de la membrana plasmática
La integridad de la membrana plasmática se evaluó mediante SYBR-14 y yoduro de propidio (PI) (Live/Dead Sperm Viability Kit; L7011, Life Technologies Ltd, Carlsbad, CA, EUA) según Prochowska et al. (23). SYBR-14 es un colorante fluorescente permeable a la membrana que se une al ADN en los espermatozoides vivos y emite fluorescencia verde. SYBR-14 se usa en combinación con yoduro de propidio (PI), una tinción específica de ADN que no puede ingresar a la membrana plasmática intacta, como una contratinción de marcadores muertos (25). Brevemente, se agregaron 5 μL de 0.02 mM de SYBR-14 a 300 μL de suspensión de esperma y se incubaron a temperatura ambiente en la oscuridad durante 10 minutos. Posteriormente, se añadieron 1,8 μL de 2,4 mM PI y la muestra se analizó inmediatamente mediante citometría de flujo. Se registró el porcentaje de espermatozoides con una membrana plasmática intacta.
2.4.2.2. Integridad del acrosoma
El estado del acrosoma se evaluó mediante lectina PNA (PNA de Arachis hypogaea, Alexa Fluor 488 conjugado; L21409, LifeTechnologies Ltd, Carlsbad, CA, EE.UU.) y PI según Prochowska et al. (23). PNA es una lectina conjugada con Alexa Fluor 488 (colorante verde-fluorescente) como una sonda fluorescente. Se une específicamente a la β-galactosa en la membrana acrosomal externa de los espermatozoides (26). Brevemente, se agregaron 6 μL de 0,1 mg/ml de PNA a 300 μL de suspensión de esperma y se incubaron a temperatura ambiente en la oscuridad durante 5 minutos. Posteriormente, la muestra se centrifugó a 620 × g durante 5 minutos y el pellet se resuspendió con 300 μL de TRIS. Finalmente, se añadieron 1,8 μL de 2,4 mM PI y la muestra se analizó inmediatamente mediante citometría de flujo. Se registró el porcentaje de espermatozoides con un acrosoma intacto.
2.4.2.3. Potencial de membrana mitocondrial de los espermatozoides
La evaluación del potencial de la membrana mitocondrial de los espermatozoides se realizó mediante tinción JC-1 (T3168, Life Technologies Ltd, Carlsbad, CA, EUA) según Prochowska et al. (23). JC-1 es un colorante fluorescente catiónico lipofílico que se dirige específicamente a las mitocondrias. Cuando el potencial mitocondrial es bajo, JC-1 emite fluorescencia verde en su forma de monómero, mientras que en su alto potencial mitocondrial, JC-1 emite fluorescencia naranja en su forma de agregado J (23). Brevemente, se agregaron 0,4 μL de solución JC-1 (2 mg/ml de JC-1 en DMSO) a 300 μL de la muestra de semen. Las muestras se incubaron a 37 ° C en la oscuridad durante 20 minutos. Posteriormente, se añadieron 1,8 μL de 2,4 mM PI y la muestra se analizó inmediatamente mediante citometría de flujo. Se registró el porcentaje de espermatozoides vivos con alta actividad mitocondrial.
2.5. Análisis estadístico
El análisis estadístico se realizó utilizando el software R versión 4.1.2 (R Foundation for Statistical Computing, Viena, Austria). La normalidad de los parámetros de semen fresco y post-deshielo se evaluó mediante la prueba de Shapiro-Wilk (P ≤ 0,05). Se utilizó la prueba de suma de rangos de Friedman con la prueba post-hoc de Bonferroni para determinar las diferencias estadísticas entre los grupos en los parámetros del semen posteriores al deshielo. Específicamente, se evaluaron las diferencias en las cantidades de espermatozoides móviles (%), espermatozoides morfológicamente normales (%), cabezas de espermatozoides anormales (%), colas de espermatozoides anormales (%), gotitas citoplasmáticas proximales (%) y distales (%), integridad de la membrana plasmática (%), integridad acrosómica (%) y potencial de membrana mitocondrial (%). La significancia fue considerada para los valores de p ≤ 0,05.
3. Resultados
La integridad del acrosoma mejoró significativamente en todas las muestras tratadas con MT en comparación con las muestras no tratadas. Específicamente, el grupo B (5 μM de MT) pareció ejercer el mayor efecto protector sobre la integridad del acrosoma en comparación con el grupo control (mediana 67,90%, IQR 5,55 y mediana 65,33%, IQR 7,75, respectivamente; P = 0,05), mientras que el grupo C y el grupo D solo mostraron una tendencia a mejorar la integridad del acrosoma en comparación con el grupo control (P = 0,07 para ambas concentraciones). No se encontraron diferencias significativas en los porcentajes de espermatozoides móviles, morfológicamente normales o espermatozoides morfológicamente anormales entre los diferentes grupos investigados. Tampoco se encontraron diferencias entre los grupos investigados en cuanto a la integridad de la membrana plasmática y el potencial de la membrana mitocondrial. Los resultados (mediana, IQR y valores p generales) se informan en la Tabla 1.
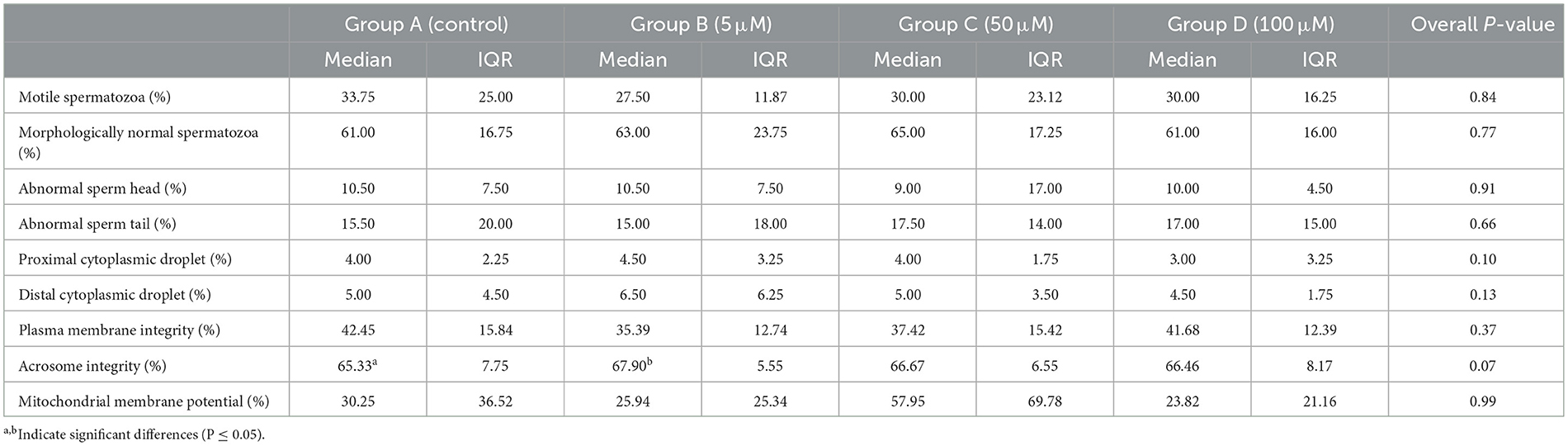 Tabla 1. Efecto de Mito-Tempo sobre los parámetros espermáticos post-descongelación en grupos de tratamiento.
Tabla 1. Efecto de Mito-Tempo sobre los parámetros espermáticos post-descongelación en grupos de tratamiento.
4. Discusión
En el presente estudio, encontramos un pequeño aumento en la integridad del acrosoma en el semen del epidídimo del gato congelado-descongelado suplementado con 5 μM de MT durante la congelación. Todos los demás parámetros investigados, como la motilidad de los espermatozoides, la morfología, la integridad de la membrana plasmática y el potencial de la membrana mitocondrial, no mejoraron significativamente. Este hallazgo contrastó con estudios previos realizados en otras especies, que demostraron una mejora en los parámetros de los espermatozoides como la motilidad, la funcionalidad de la membrana, el potencial activo mitocondrial, la integridad del acrosoma y la viabilidad, así como una disminución en la peroxidación lipídica y la fragmentación del ADN (18-21). Cabe señalar que la evaluación de la motilidad de los espermatozoides en este estudio se realizó subjetivamente. Aunque dos operadores con igual experiencia evaluaron la motilidad en cinco campos diferentes y calcularon la media después de contar los espermatozoides, una limitación significativa surge de la ausencia de técnicas más avanzadas como el análisis de espermatozoides asistido por computadora (CASA). La evaluación subjetiva de la motilidad puede no capturar adecuadamente las variaciones sutiles en los patrones de motilidad o los cambios menores a lo largo del tiempo, lo que puede restringir la detección de alteraciones más matizadas en la motilidad de los espermatozoides. Además, CASA ofrece la oportunidad de evaluar características adicionales de la cinemática de los espermatozoides que podrían verse influenciadas por la suplementación de Mito-Tempo. Por ejemplo, la mayor velocidad en línea recta y la amplitud del desplazamiento lateral de la cabeza se asocian frecuentemente con la capacitación. Teniendo en cuenta que Mito-Tempo exhibió una leve mejora en la integridad del acrosoma, sería beneficioso evaluar estos parámetros por CASA también para obtener una comprensión más completa de los efectos de la suplementación con Mito-Tempo.
Aunque la causa exacta de esta disparidad sigue sin estar clara, Len et al. (27) han sugerido antes que los antioxidantes podrían actuar de una manera específica de la especie. Por ejemplo, la suplementación de 200 UI/ml de catalasa (CAT), un antioxidante enzimático dirigido al peróxido de hidrógeno, al extensor de glicerol de yema de huevo (TEY) de Tris redujo la motilidad de los espermatozoides felinos (28), aunque la suplementación de CAT a la misma concentración aumentó el mismo parámetro en espermatozoides bovinos criopreservados (29). Inesperadamente, agregar el doble de la concentración de CAT (400 UI / ml) no mejoró la motilidad, la viabilidad o la integridad acrosomal de los espermatozoides de gato congelados y descongelados (30). Por lo tanto, una diferencia entre especies entre gatos y especies previamente estudiadas que fueron suplementadas con MT (15-22) puede ser una posible explicación. Se cree que los espermatozoides del epidídimo tienen niveles más bajos de enzimas antioxidantes debido a la falta de exposición al plasma seminal, lo que los hace más vulnerables al estrés oxidativo. Sin embargo, en el caso del semen de gato, existe evidencia contradictoria, ya que se cree que es más resistente a la peroxidación lipídica (23). Varios estudios han apoyado esta afirmación. En comparación, los espermatozoides de gato epididimario post-descongelado no experimentaron un aumento en la peroxidación lipídica después de 6 h de incubación a 37 ° C (31), mientras que los espermatozoides humanos congelados y descongelados mostraron un aumento de la peroxidación lipídica después de ser incubados durante 15 a 60 minutos a la misma temperatura (32). Además, el almacenamiento en frío de los espermatozoides equinos durante 48 h condujo a un aumento significativo de la peroxidación lipídica (33), mientras que los espermatozoides del epidídimo de gato almacenados a 5 ° C mantuvieron una alta calidad durante hasta 48 h de enfriamiento y no se expusieron al estrés oxidativo hasta después de 72 h de enfriamiento (34). Se puede plantear la hipótesis de que altos niveles de actividad antioxidante endógena pueden estar presentes en los espermatozoides de gato y / o líquido epididimario que puede neutralizar las concentraciones excesivas de ROS durante el procesamiento del semen y la criopreservación. La evidencia indirecta de tal actividad antioxidante endógena fue demostrada por Thuwanut et al. (31) quienes encontraron que la peroxidación lipídica solo se detectó después de 6 h de incubación posterior al deshielo con promotor de peroxidación lipídica [sulfato ferroso de 100 mM (FeSO4)] en espermatozoides de gato epididimario.
Nuestro estudio detectó un efecto protector leve de MT sobre la integridad del acrosoma en espermatozoides de gato epididimario después de la descongelación cuando se complementó con una concentración de 5 μM. La criocapacitación, un cambio similar a la capacitación, ocurre en los espermatozoides durante el proceso de congelación-descongelación, pero su mecanismo no se comprende bien (35). Mito-Tempo es un antioxidante que actúa como un mimético de SOD, una sustancia que ayuda a preservar la integridad normal del acrosoma y previene la hiperactivación prematura y la capacitación por radicales superóxido antes de la eyaculación (36). Aunque la mejora de la integridad del acrosoma en nuestro estudio no fue sustancial, es un factor importante que se correlaciona directamente con la tasa de fertilidad. En comparación con la motilidad y morfología de los espermatozoides, investigaciones anteriores han indicado que evaluar la integridad de la membrana plasmática y el acrosoma es un indicador más confiable para predecir la tasa de fertilidad in vitro (37, 38). Verstegen et al. (39) informaron que los altos niveles de espermatozoides con defectos acrosómicos están asociados con dificultades de fertilización. Además, Tanghe et al. (40) demostraron una correlación moderada entre la integridad del acrosoma y la formación de pronúcleos después de la fertilización in vitro en bovinos.
La vida es un equilibrio de fuerzas opuestas como oxidante y antioxidante. Un equilibrio adecuado entre estos dos elementos se mantiene a través de la igualación, con cualquier desequilibrio que conduce a daños potenciales. Por lo tanto, los antioxidantes solo deben usarse como suplemento cuando se espera una sobreproducción de oxidantes o / o cuando el sistema de defensa antioxidante se debilita. En consecuencia, cuando se usa antioxidante sin una justificación, la suplementación de estos aditivos al diluyente de semen podría incluso ser perjudicial (41). Un ejemplo de este fenómeno es el efecto de la suplementación con catalasa al extensor de semen de carnero refrigerado. Las concentraciones superiores a 200 U/ml disminuyeron la calidad del esperma, mientras que las concentraciones más bajas tienen un efecto positivo (42). La elección de las concentraciones de prueba que oscilaban entre 0 y 100 μM se basó en la investigación de otras especies. Se obtuvieron resultados significativos tras la suplementación de 5 μM y/o 50 μM de MT al extensor en varias especies (15, 17-22), mientras que otro estudio informó una mejora en los parámetros del semen humano y una mejora de la actividad de las enzimas antioxidantes tras la suplementación de 10 μM y 100 μM de MT (16). Sin embargo, ninguna de las concentraciones elegidas en el presente estudio sugirió que aumentar la concentración no sería beneficioso ni perjudicial para los espermatozoides felinos. Por lo tanto, la combinación de dos antioxidantes con diferentes propiedades funcionales, puede tener un efecto positivo aditivo, mitigando el crioestrés en lugar de aumentar la concentración de un antioxidante. Por ejemplo, cuando se agregaron catalasa y SOD a un extensor para semen de jabalí, se logró una mayor mejora en los parámetros de esperma posteriores al deshielo en comparación con la suplementación de cualquiera de ellos solo (43). Mito-tempo es un antioxidante mimético SOD que puede dirigirse a las mitocondrias para proteger contra el estrés oxidante mitocondrial selectivo, eliminando el anión superóxido (14). Por otro lado, la glutatión peroxidasa puede descomponer el peróxido de hidrógeno en oxígeno y agua. Dado que se ha demostrado el efecto positivo de la glutatión peroxidasa en los espermatozoides felinos (35), podría valer la pena investigar si la combinación de MT o SOD con glutatión peroxidasa podría mejorar aún más su rendimiento protector sobre los parámetros del esperma felino.
5. Conclusión
Nuestros resultados mostraron que la suplementación con Mito-Tempo mejoró la integridad del acrosoma sin ningún efecto positivo en todos los demás parámetros del semen investigados en este estudio. Estudios previos no han examinado el uso de Mito-Tempo como suplemento a los extensores de semen para los espermatozoides eyaculados y epididimarios en gatos, por lo que no es posible comparar nuestros hallazgos con otros estudios similares. Sin embargo, en los últimos años, el efecto de la suplementación de varios antioxidantes a los extensores de congelación en la calidad del esperma ha sido ampliamente estudiado en varias especies, con una mejora inconsistente de la calidad del esperma entre las especies, incluidos los felinos (13, 27, 28, 44). Se deben realizar más investigaciones para investigar otra población felina y/o más grande. Además de investigar el efecto de MT en la producción de ROS que puede revelar combinaciones potenciales de MT con antioxidantes.
Declaración de disponibilidad de datos
Los datos brutos que apoyan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
No se requirió revisión ética y aprobación para el estudio en animales porque el estudio analizó espermatozoides epididimarios de gatos que se habían sometido a castración, ya sea como parte de un programa de esterilización o según la solicitud del propietario. La castración no se realizó para el propósito del estudio, pero las muestras se utilizaron para evitar su desperdicio. Es importante tener en cuenta que ninguno de los espermatozoides criopreservados se utilizó para la inseminación o la fertilización in vitro. En cambio, todas las muestras posteriores al deshielo se descongelaron y analizaron para evaluar el efecto de la suplementación con Mito-Tempo en varios parámetros de esperma.
Contribuciones del autor
HA y AV: conceptualización. HA, SP y LV: metodología e investigación. PB: análisis estadístico. HA y SP: recursos. HA y PB: redacción: preparación y visualización del borrador original. SP, GD y AV: redacción, revisión y edición. SP, AV y WN: supervisión. AV y WN: adquisición de fondos. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Financiación
Este artículo ha sido apoyado por la Agencia Nacional Polaca para el Intercambio Académico bajo la Subvención No. PPI/APM/2019/1/00044/U/00001.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Lamberski N. Felidae. Fowler’s Zoo Wild Anim Med. (2015) 8:467–476. doi: 10.1016/B978-1-4557-7397-8.00047-5
2. Comizzoli P. Biotecnologías para la preservación de la fertilidad de la vida silvestre. Frente Anim. (2015) 5:73–8. DOI: 10.2527/AF.2015-0011
3. Praxedes ÉA, Borges AA, Santos MVO, Pereira AF. Uso de bancos de células somáticas en la conservación de felinos silvestres. Biología del zoológico. (2018) 37:258–63. doi: 10.1002/zoo.21416
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Andrews CJ, Thomas DG, Yapura J, Potter MA. Biología reproductiva de las 38 especies de félidos existentes: una revisión. (2019) 49:16–30. doi: 10.1111/mam.12145
5. Pukazhenthi BS, Neubauer K, Jewgenow K, Howard JG, Wildt DE. El impacto y la etiología potencial de la teratospermia en el gato doméstico y sus parientes salvajes. Teriogenología. (2006) 66:112–21. doi: 10.1016/j.theriogenology.2006.03.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Benko F, Dura?cka M, Ba?nas Š, Luká?c N, Tvrdá E. Relevancia biológica de los radicales libres en el proceso de capacitación fisiológica y criocapacitación. Oxígeno. (2022) 2:164–76. DOI: 10.3390/oxígeno2020014
7. Hezavehei M, Sharafi M, Kouchesfahani HM, Henkel R, Agarwal A, Esmaeili V, et al. Criopreservación de espermatozoides: una revisión sobre la criobiología molecular actual y los enfoques avanzados. Reproducto. BioMed. En línea. (2018) 37:327–39. doi: 10.1016/j.rbmo.2018.05.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Trnka J, Blaiki FH, Smith RAJ, Murphy MP. Un nitrógeno dirigido a las mitocondrias se reduce a su hidroxilamina por el ubiquinol en las mitocondrias. Libre Radic Biol Med. (2008) 44:1406–19. doi: 10.1016/j.freeradbiomed.2007.12.036
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Trnka J, Blaiki FH, Logan A, Smith RAJ, Murphy MP. Propiedades antioxidantes de MitoTEMPOL y su hidroxilamina. Libre Radic Res. (2009) 43:4–12. DOI: 10.1080/10715760802582183
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Agarwal A, Mulgund A, Alshahrani S. Especies reactivas de oxígeno y daño del ADN de los espermatozoides en hombres infértiles que presentan leucocitospermia de bajo nivel. Reprod Biol Endocrinol. (2014) 12:126. doi: 10.1186/1477-7827-12-126
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Sotler R, Poljšak B, Dahmane R, Jukić T, Pavan Jukić D, Rotim C, et al. Actividades prooxidantes de los antioxidantes y su impacto en la salud. Acta clinica Croatica. (2019) 58:726–36. doi: 10.20471/acc.2019.58.04.20
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Ahmadi S, Bashiri R, Ghadiri-Anari A, Nadjarzadeh A. Revisión basada en la evidencia suplementos antioxidantes y parámetros del semen: una revisión basada en la evidencia. Int J Reprod BioMed. (2016) 14:729–36. doi: 10.29252/ijrm.14.12.729
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Silvestre MA, Yániz J, Peña FJ, Santolaria P, Castelló-Ruiz M. Papel de los antioxidantes en el almacenamiento líquido refrigerado de espermatozoides de mamíferos. Antioxidantes. (2021) 10:1096. DOI: 10.3390/antiox10071096
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Du K, Farhood A, Jaeschke H. Mitochondria-targeted antioxidant Mito-Tempo protege contra la hepatotoxicidad del paracetamol. Arco Toxicol. (2017) 91:761–73. DOI: 10.1007/S00204-016-1692-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Lu X, Zhang Y, Bai H, Liu J, Li J, Wu B. El antioxidante dirigido a las mitocondrias MitoTEMPO mejora la calidad del esperma post-descongelación. Criobiología. (2018) 80:26–9. doi: 10.1016/j.cryobiol.2017.12.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Zhang X, Lu X, Li J, Xia Q, Gao J, Wu B. Mito-Tempo alivia el criodaño mediante la regulación del metabolismo oxidativo intracelular en espermatozoides de pacientes astenozoospérmicos. Criobiología. (2019) 91:18–22. doi: 10.1016/j.cryobiol.2019.11.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Cho ES, Kim JA, Jeong YD, Choi YH, Hong JK, Kim YS, et al. Efectos del antioxidante dirigido a las mitocondrias MitoTEMPO sobre las características cinéticas del esperma de jabalí congelado-descongelado. J Korea Academie-Industr cooperat Soc. (2020) 21:199–205. doi: 10.5762/KAIS.2020.21.3.199
18. Masoudi R, Asadzadeh N, Sharafi M. El antioxidante dirigido a las mitocondrias Mito-TEMPO conserva la calidad del semen enfriado del gallo y el potencial de fertilidad. Teriogenología. (2020) 156:236–41. doi: 10.1016/j.theriogenology.2020.07.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Masoudi R, Asadzadeh N, Sharafi M. Efectos de la suplementación con diluyentes de congelación con antioxidante dirigido a las mitocondrias Mito-TEMPO en la calidad del semen de gallo congelado-descongelado y el rendimiento reproductivo. Anim Reprod Sci. (2021) 21:225. doi: 10.1016/j.anireprosci.2020.106671
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Zarei F, Kia H.D, Masoudi R, Moghaddam G, Ebrahimi M. Suplementación del extensor de semen de carnero con Mito-TEMPO I: Mejora en los parámetros de calidad y rendimiento reproductivo del semen refrigerado-almacenado. Criobiología. (2020) 98:215–8. doi: 10.1016/j.cryobiol.2020.10.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Kumar A, Ghosh SK, Katiyar R, Rautela R, Bisla A, Ngou AA, et al. Efecto del extensor de semen incorporado mito-tempo sobre los atributos físicomorfológicos y la integridad funcional de la membrana de los espermatozoides de búfalo descongelados congelados. Cartas criogénicas. (2021) 42:111–9.
22. Kumar A, Ghosh SK, Katiyar R, Gemeda AE, Rautela R, Bisla A, et al. La suplementación de Mito TEMPO y acetovanillona en el extensor de semen mejora la congelabilidad de los espermatozoides de búfalo. Andrología. (2022) 10:775–88. DOI: 10.1111/Andr.13158
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Prochowska S, Nizanski W, Partyka A. Análisis comparativo de las características in vitro de espermatozoides uretrales y epididimarios frescos y congelados-descongelados de gatos (Felis domesticus). Teriogenología. (2016) 86:2063–72. doi: 10.1016/j.theriogenology.2016.07.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Kunkitti P, Bergqvist AS, Sjunnesson Y, Johannisson A, Axnér E. La tolerancia del cuerpo felino y los espermatozoides de cauda al crioestrés. Teriogenología. (2016) 85:502–8. doi: 10.1016/j.theriogenology.2015.09.032
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Nagy S, Jansen J, Topper KE, Gadella MB. Un método citométrico de flujo de triple tinción para evaluar la integridad de la membrana plasmática y acrosómica de espermatozoides bovinos criopreservados inmediatamente después de la descongelación en presencia de partículas de yema de huevo. Biol Reproduct. (2003) 68:1828–35. doi: 10.1095/biolreprod.102.011445
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Nizański W, Partyka A, Rijsselaere T. Uso de tinciones fluorescentes y citometría de flujo para la evaluación del semen canino. Reprod Domest Anim. (2012) 6:215–21. DOI: 10.1111/RDA.12048
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Len JS, Koh WSD, Tan S. El papel de las especies reactivas de oxígeno y antioxidantes en la criopreservación. Biosci Rep. (2019) 39:161. doi: 10.1042/BSR20191601
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Thuwanut P, Chatdarong K, Johannisson A, Bergqvist AS, Söderquist L, Axnér E. Criopreservación de espermatozoides de gato epididimario: efectos de la suplementación con enzimas antioxidantes in vitro e inducción de peroxidación lipídica. Teriogenología. (2010) 73:1076–87. doi: 10.1016/j.theriogenology.2010.01.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Paudel KP, Kumar S, Meur SK, Kumaresan A. El ácido ascórbico, la catalasa y la clorpromazina reducen los daños inducidos por la criopreservación a los espermatozoides de toro cruzados. Reprod Domest Anim. (2010) 45:256–62. doi: 10.1111/j.1439-0531.2008.01278.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Thiangtum K, Pinyopummin A, Hori T, Kawakami E, Tsutsui T. Effect of catalase and superoxide dismutase on motility, viability and acrosomal integrity of frozen-thaled cat spermatozoa. Reprod Domest Anim. (2009) 44:369–72. doi: 10.1111/j.1439-0531.2009.01420.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Thuwanut P, Axne r E, Johanisson A, Chatdarong K. Detection of lipid peroxidation reaction in frozen-thaired epididymal catspermatozoa using BODIPY581/591 C11. Reprod Dom Anim. (2009) 44:373–6. doi: 10.1111/j.1439-0531.2009.01453.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Engel S, Schreiner Th, Petzoldt R. Peroxidación lipídica en espermatozoides humanos y mantenimiento de la motilidad progresiva de los espermatozoides. Andrología. (1999) 31:17–22. doi: 10.1111/j.1439-0272.1999.tb02837.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Ball BA, Vo AT. Detección de peroxidación lipídica en espermatozoides equinos basada en el colorante fluorescente lipofílico C1l-BODIPY581/591. J Androl. (2002) 23:259–269. doi: 10.1002/J.1939-4640.2002.TB02623.X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Angrimani D, Nagai KK, Rui BR, Bicudo LC, Losano J, Brito MM, et al. Perfil espermático y oxidativo de espermatozoides del epidídimo doméstico (Felis catus) sometidos a diferentes tiempos de enfriamiento (24, 48 y 72 h). Reprod Domest Anim. (2018) 53:163–70. DOI: 10.1111/RDA.13086
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Talukdar DJ, Ahmed K, Sinha S, Deori S, Das GC, Talukdar P. La criopreservación induce cambios similares a la capacitación de los espermatozoides de búfalo del pantano. Toro búfalo. (2017) 36:221–30.
36. Perumal P, Vupru K, Rajkhowa C. Effect of added of taurine on the liquid storage (5°C) of Mithun (Bos frontalis) semen. Veterinario Med Int. (2013) 13:348. doi: 10.1155/2013/165348
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Oliveira BM, Arruda RP, Thomé HE, Maturana Filho M, Oliveira G, Guimarães C, et al. Fertilidad y hemodinámica uterina en vacas tras inseminación artificial con semen evaluado por sondas fluorescentes. Teriogenología. (2014) 82:767–72. doi: 10.1016/j.theriogenology.2014.06.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Tartaglione CM, Ritta MN. Valor pronóstico de los parámetros espermatológicos como predictores de la fertilidad in vitro del semen de toro congelado-descongelado. Teriogenología. (2004) 62:1245–52. doi: 10.1016/j.theriogenology.2004.01.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Verstegen J, Iguer-Ouada M, Onclin K. Computer assisted semen analyzers in andrology research and veterinary practice. Teriogenología. (2002) 57:149–79. doi: 10.1016/S0093-691X(01)00664-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Tanghe S, Van Soom A, Sterckx V, Maes D, de Kruif A. Evaluación de diferentes parámetros de calidad del esperma para predecir la fertilidad in vitro de toros. Reprod Domest Anim. (2002) 37: 127–32. doi: 10.1046/j.1439-0531.2002.00343.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Halliwell B. Especies reactivas y antioxidantes. La biología redox es un tema fundamental de la vida aeróbica. Planta Physiol. (2006) 141:312–22. doi: 10.1104/pp.106.077073
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Maxwell WM, Stojanov T. Almacenamiento líquido de semen de carnero en ausencia o presencia de algunos antioxidantes. Reprod Fertil Dev. (1996) 8:1013–1020. doi: 10.1071/RD9961013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Trzcinska M, Bryla M. Cambios apoptóticos de espermatozoides de jabalí en medios de congelación suplementados con diferentes antioxidantes. Pol J Vet Sci. (2015) 18:473–80. DOI: 10.1515/PJVS-2015-0062
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Thuwanut P, Chatdarong K, Bergqvist AS, Söderquist L, Thiangtum K, Tongthainan D, et al. Los efectos de los antioxidantes sobre los rasgos del semen y la capacidad de fertilización in vitro de los espermatozoides del gato de cabeza plana (Prionailurus planiceps). Teriogenología. (2011) 76:115–25. doi: 10.1016/j.theriogenology.2011.01.024
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: gato, espermatozoides epididimarios, antioxidante, Mito-Tempo, especies reactivas de oxígeno
Cita: Ali Hassan H, Banchi P, Domain G, Vanderheyden L, Prochowska S, Nizański W y Van Soom A (2023) Mito-Tempo mejora la integridad acrosómica de los espermatozoides epidídicos congelados-descongelados en gatos tomcats. Frente. Vet. Sci. 10:1170347. doi: 10.3389/fvets.2023.1170347
Recibido: 20 de febrero de 2023; Aprobado: 01 Junio 2023;
Publicado: 07 agosto 2023.
Editado por:
Federica Turri, Consejo Nacional de Investigación (CNR), Italia
Revisado por:
Maria Alejandra Stornelli, Universidad Nacional de La Plata, Argentina
Kampon Kaeoket, Universidad Mahidol, Tailandia
Copyright © 2023 Ali Hassan, Banchi, Domain, Vanderheyden, Prochowska, Nizański y Van Soom. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Hiba Ali Hassan, hiba_alihasan@hotmail.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía