Muestreo de heridas para cultura y citología
- La obtención de muestras de diagnóstico puede ser importante para el tratamiento de infecciones de heridas. Debido a que las heridas se comunican con el entorno externo y los sitios del cuerpo que albergan una microbiota comensal, se requiere una técnica adecuada para optimizar la sensibilidad y la especificidad. Una muestra de diagnóstico bien recolectada puede ayudar a confirmar la presencia de infección bacteriana, identificar el organismo causal y proporcionar datos críticos de susceptibilidad a los antimicrobianos. Una mala técnica de muestreo puede complicar el manejo del paciente al proporcionar resultados no diagnósticos o incluso engañosos.
Determinar si se debe recolectar una muestra y qué pruebas de diagnóstico son necesarias debería ser el primer paso. Aunque el cultivo es útil en la mayoría de las situaciones, el muestreo para el cultivo es menos importante (o debería evitarse) en los casos en que no es probable que se necesite una terapia antimicrobiana sistémica, no se puede recolectar una muestra representativa adecuada, es probable que se contamine o el muestreo puede comprometer los sitios no afectados .
El cultivo bacteriano es útil cuando el proceso de la enfermedad no está claro y / o cuando se usan antimicrobianos sistémicos. El cultivo es particularmente importante cuando existe una mayor probabilidad de que intervengan patógenos resistentes, como infecciones que han fallado en el tratamiento empírico o infecciones en pacientes con antecedentes de tratamiento antimicrobiano y / u hospitalización.
Aunque el cultivo es a menudo el foco del muestreo de heridas, la citología debe considerarse siempre que se recolecte una muestra para el cultivo. Siempre se debe enviar una muestra para citología, que puede ser útil para confirmar la presencia de infección bacteriana, descartar otras causas, corroborar los resultados del cultivo o identificar organismos exigentes. Más allá del cultivo y la citología aeróbica de rutina, pueden estar indicadas pruebas adicionales en algunas situaciones, particularmente infecciones crónicas, infecciones que no han respondido al tratamiento apropiado e infecciones que son clínicamente atípicas. Esto podría incluir la adición de manchas especiales (p. Ej., Ácido-rápido, ácido periódico-Schiff) o cultivo de hongos. El cultivo anaeróbico puede estar indicado en infecciones potencialmente asociadas con una herida penetrante o aquellas que tienen un aspecto clínico sugestivo de infección anaeróbica (p. Ej., Tejido enfisematoso).
Tipos de muestra
Cuando sea posible, se deben recolectar muestras de tejido para cultivo. Aunque son más invasivas que los aspirados con aguja fina o los hisopos, las muestras de tejido pueden tener una mayor sensibilidad y especificidad, particularmente con infecciones más profundas en humanos. 1,2
La aspiración con aguja fina se puede realizar en sitios más profundos y se prefieren a los hisopos superficiales de los tractos de drenaje. El pequeño volumen recogido y la pequeña área del sitio muestreado pueden limitar la sensibilidad. Idealmente, se deben recolectar ≥2 muestras, ya que los resultados positivos de> 1 muestra proporcionan información más convincente de la relevancia clínica de una especie bacteriana aislada.
Los hisopos son generalmente más fáciles de recolectar y pueden ser útiles en muchas situaciones clínicas. Cuando se realizan correctamente, los hisopos son más propensos al aislamiento de contaminantes pero producen resultados bastante similares en comparación con otros métodos. 3 Aunque la biopsia de tejido debe realizarse cuando sea posible, la siguiente discusión se centra en la recolección de hisopos, ya que este es el enfoque más común. Los conceptos importantes para el muestreo de heridas se presentan en Consideraciones importantes al recoger una muestra de una herida.

Se deben usar hisopos congregados cuando estén disponibles, ya que recuperan bacterias de sitios infectados, así como hisopos con punta de algodón o rayón, pero son más efectivos para liberar bacterias recuperadas en el medio de cultivo. 4
Un hisopo recolectado adecuadamente a menudo parece relativamente limpio, con solo un poco de líquido teñido de sangre (Figura 1).
Cabe destacar que el cultivo de hongos puede considerarse en cualquier caso, pero las infecciones por hongos son poco comunes. El cultivo de hongos es más importante en infecciones que no responden como se esperaba a los antimicrobianos, en infecciones con presentación o progresión clínica inusual, o cuando la citología sugiere afectación fúngica.
Consideraciones importantes al recoger una muestra de una herida 5
- No se recomienda tomar muestras de la superficie sin limpiar de una herida.
- Se debe recolectar una muestra (p. Ej., Un hisopo o una biopsia de tejido limpio pero infectado), en lugar de una muestra de una muestra (p. Ej., Pus).
- Se debe tomar una muestra de tejido sano (no tejido necrótico o pus) del área afectada.
- Cuando sea posible, las muestras deben recogerse antes de comenzar con los antibióticos.
- Las muestras de baja calidad (p. Ej., Tejido necrótico, hisopos superficiales de pus) no deben enviarse al laboratorio, ya que la información engañosa puede ser más dañina que ninguna información.
- Las muestras deben etiquetarse adecuadamente con el sitio del cuerpo del cual se recolectó la muestra. Solo indicar «herida» no es adecuado.
Manejo de muestra
La pérdida de viabilidad (es decir, falsos negativos) y la contaminación (es decir, falsos positivos) son motivo de preocupación. Los hisopos para cultivo deben colocarse en un medio de transporte apropiado. La mayoría de los juegos de hisopos de cultivo comerciales son efectivos para preservar la viabilidad de las bacterias aeróbicas durante el tiempo típicamente requerido para que una muestra llegue al laboratorio de diagnóstico. Los anaerobios son más propensos a la muerte durante el tránsito, y se deben usar medios de transporte anaeróbicos o medios de transporte aeróbicos / anaeróbicos combinados si se va a realizar un cultivo anaeróbico.
Los hisopos deben almacenarse a temperatura ambiente si el laboratorio los procesará dentro de las 2 horas. Sin embargo, esto será difícil en la mayoría de las situaciones clínicas; Cuando se encuentren retrasos, los hisopos deben almacenarse a temperatura de refrigeración (39 ° F [4 ° C]) hasta el envío y mantenerse frescos durante el envío. Los portaobjetos para citología deben prepararse inmediatamente después de la recolección. Idealmente, el mismo hisopo no debe usarse tanto para citología como para cultivo, ya que podría contaminarse mientras el hisopo se enrolla en un portaobjetos y la preparación del portaobjetos de citología eliminará parte de la biomasa bacteriana.
Interpretación de los resultados culturales
A pesar del uso de técnicas óptimas, el muestreo nunca será 100% sensible y específico, y puede ocurrir un error de laboratorio (error técnico y comportamiento anormal de las bacterias in vitro). Cualquier resultado del cultivo debe interpretarse cuidadosamente, teniendo en cuenta el sitio del cuerpo, los patógenos comunes, el tipo de muestra y los organismos que se aislaron. Pueden ocurrir infecciones mixtas, pero probablemente son poco frecuentes. El aislamiento de múltiples organismos debe abordarse con precaución, ya que uno (o todos) podría ser un contaminante. Aunque muchos comensales son patógenos oportunistas, el aislamiento de bacterias que son miembros comunes de la microbiota comensal y típicamente de virulencia limitada (p. Ej., Estafilococos coagulasa negativos, enterococos) generalmente no es clínicamente relevante.
Al determinar si una bacteria aislada es clínicamente importante, la resistencia a los antimicrobianos es irrelevante. La resistencia y la virulencia son diferentes, y una bacteria resistente a múltiples fármacos no tiene más probabilidades de ser clínicamente relevante que una contraparte susceptible. Por lo tanto, se deben considerar las especies bacterianas, el sitio de infección y el grado de crecimiento bacteriano, no el patrón de susceptibilidad.
PASO A PASO
COLECCIÓN DE SWABS DE CULTURA DE HERIDAS
- QUÉ NECESITARÁS
- Solución salina estéril
- Jeringa grande
- Gasa
- Guantes y, en algunos casos, una bata de barrera.
- Hisopos de cultivo, hisopos idealmente flocados
- Medio de transporte de cultivo
- Diapositivas de vidrio
- Pequeño paquete quirúrgico (opcional)
PASO 1
Reúna todos los suministros necesarios. Determine el grado de restricción física o química que es necesaria para la recolección adecuada de la muestra.
PASO 2
Riegue la herida con solución salina estéril (A). Desbride cualquier tejido necrótico existente. Luego, con una gasa, elimine el exceso de solución salina del sitio (B), dejando un lecho limpio de la herida sin pus, escombros o tejido necrótico para el muestreo (C). Si es posible, deje que el sitio se seque durante ≈1 minuto.
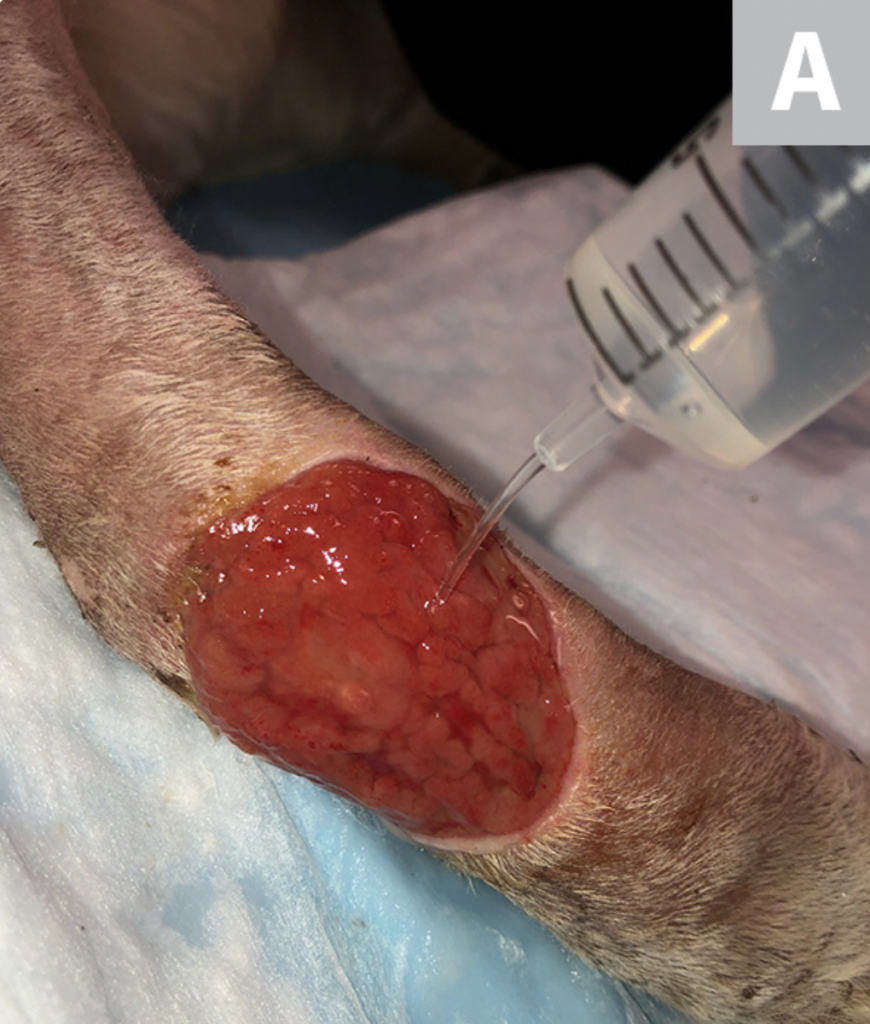
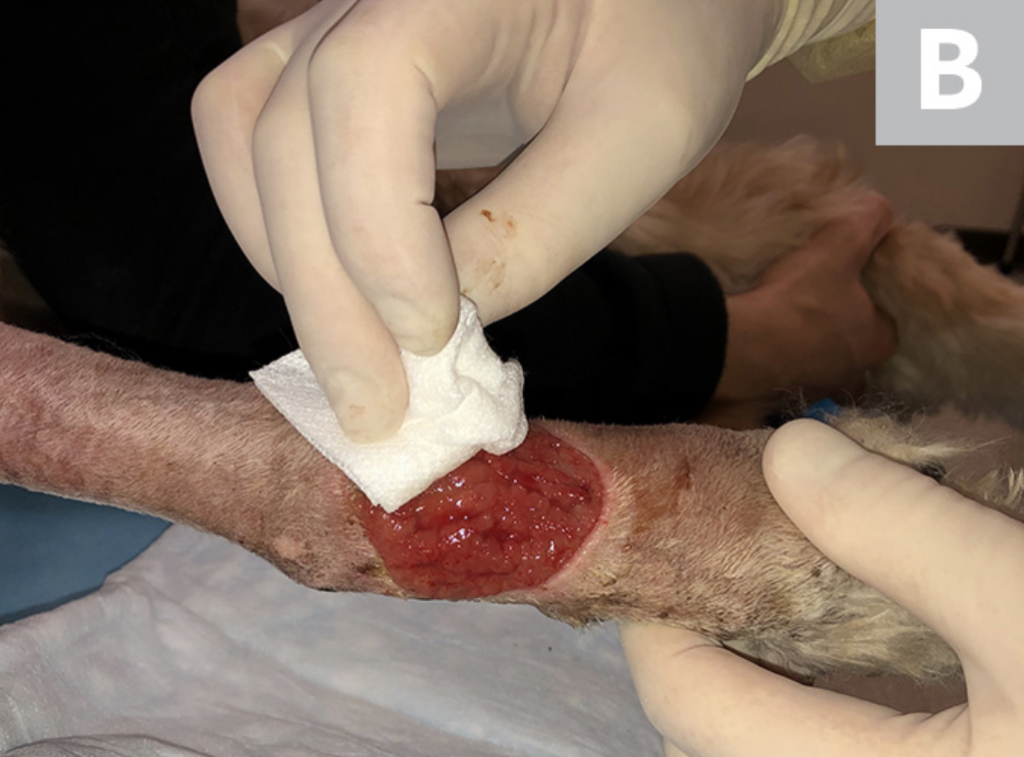
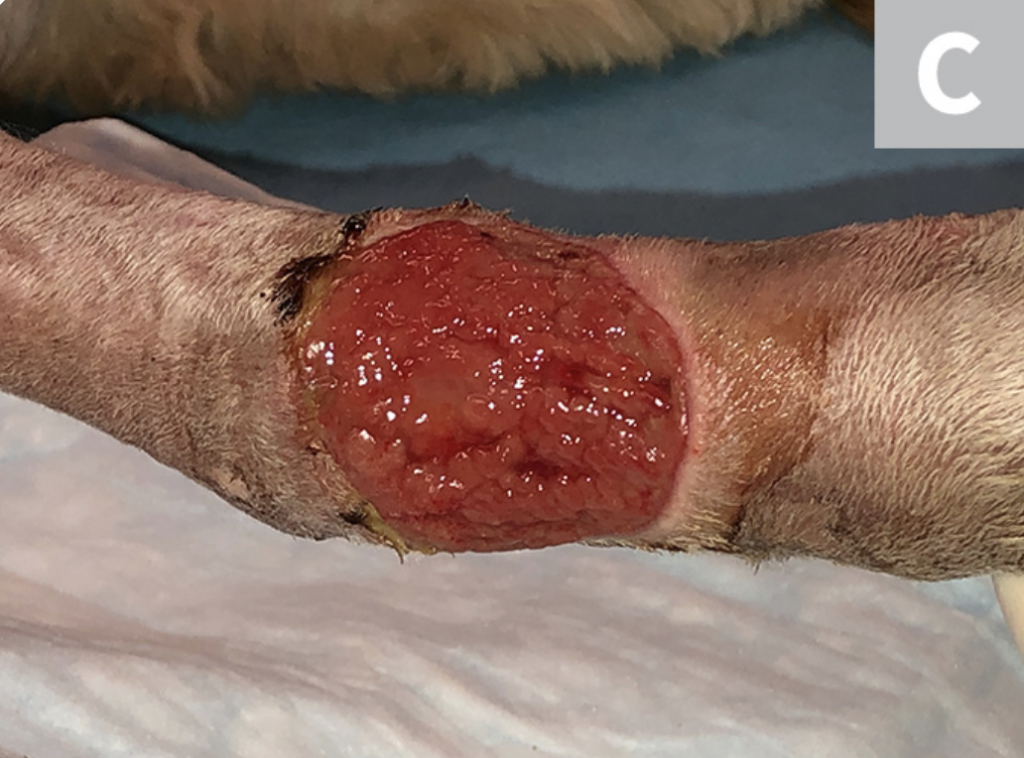 PASO 3
PASO 3
Reemplace los guantes si están contaminados y / o mojados. Retire un hisopo estéril de su embalaje, teniendo cuidado de no contaminarlo por contacto con otras superficies. Frote el hisopo de ida y vuelta sobre ≈1 cm3 de tejido viable en el área afectada durante ≈5 segundos, evitando el contacto del hisopo con sitios que tienen una microbiota comensal (p. Ej., Piel y membranas mucosas). Aplique presión al hisopo para ayudar a extraer el líquido del lecho de la herida.
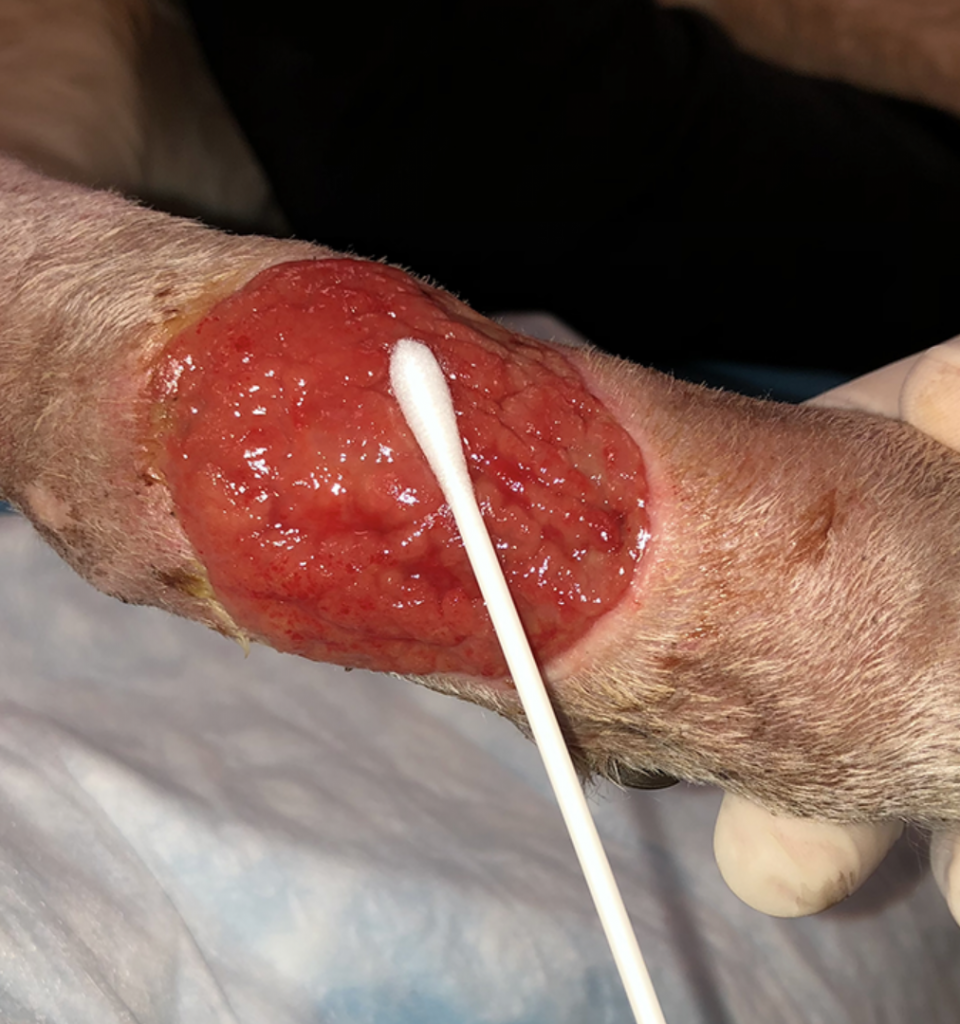 PASO 4
PASO 4
Para muestras de cultivo, coloque el hisopo en un medio de transporte y etiquete el tubo. Mantenga el hisopo a temperatura ambiente si se procesará dentro de 2 horas; de lo contrario, refrigere el hisopo. Complete el formulario de presentación de laboratorio; incluya la ubicación de muestra específica.
PASO 5
Para citología, enrolle un segundo hisopo en un portaobjetos de vidrio. Etiquete el portaobjetos y permita que se seque al aire.
 PASO 6
PASO 6
Indique el sitio del hisopo, el proceso de la enfermedad, las especies (junto con cualquier otra información relevante) y el historial del paciente de terapia antimicrobiana en el formulario de envío del laboratorio.
Referencias
- Huang Y, Cao Y, Zou M, et al. A comparison of tissue versus swab culturing of infected diabetic foot wounds. Int J Endocrinol. 2016;2016(2):1-6.
- Pellizzer G, Strazzabosco M, Presi S, et al. Deep tissue biopsy vs. superficial swab culture monitoring in the microbiological assessment of limb-threatening diabetic foot infection. Diabet Med. 2001;18(10):822-827.
- Esposito S, De Simone G, Gioia R, et al. Deep tissue biopsy vs. superficial swab culture, including microbial loading determination, in the microbiological assessment of Skin and Soft Tissue Infections (SSTIs). J Chemother. 2017;29(3):154-158.
- Daley P, Castriciano S, Chernesky M, Smieja M. Comparison of flocked and rayon swabs for collection of respiratory epithelial cells from uninfected volunteers and symptomatic patients. J Clin Microbiol. 2006;44:2265-2267.
- Miller JM, Binnicker MJ, Campbell S, et al. A guide to utilization of the microbiology laboratory for diagnosis of infectious diseases: 2018 update by the Infectious Diseases Society of America and the American Society for Microbiology. Clin Infect Dis. 2018;67(6):e1-e94.

