Nuevas tecnologías de vacunas en medicina veterinaria: un heraldo de las vacunas para la medicina humana
Nuevas tecnologías de vacunas en medicina veterinaria: un heraldo de las vacunas para la medicina humana
 Virginia Aida1,2
Virginia Aida1,2 Vasilis C. Pliasas1,2
Vasilis C. Pliasas1,2 Peter J. Neasham1,2
Peter J. Neasham1,2 J. Fletcher Norte1,2
J. Fletcher Norte1,2 Kirklin L. McWhorter1,3
Kirklin L. McWhorter1,3 Sheniqua R. Glover1,2
Sheniqua R. Glover1,2 Constantinos S. Kyriakis1,2,4*
Constantinos S. Kyriakis1,2,4*- 1Departamento de Patobiología, Facultad de Medicina Veterinaria, Universidad de Auburn, Auburn, AL, Estados Unidos
- 2Centro de Excelencia para la Investigación y Vigilancia de la Influenza (CEIRS) de la Universidad de Georgia (UGA), Auburn, AL, Estados Unidos
- 3Departamento de Química, Universidad de Emory, Atlanta, GA, Estados Unidos
- 4Centro de Vacunas e Inmunología, Universidad de Georgia, Athens, GA, Estados Unidos
El éxito de las vacunas inactivadas y vivas atenuadas ha mejorado la productividad ganadera, ha promovido la seguridad alimentaria y ha atenuado la morbilidad y mortalidad de varias enfermedades humanas, animales y zoonóticas. Sin embargo, estas tecnologías tradicionales de vacunas no están exentas de fallas. La eficacia de las vacunas inactivadas puede ser subóptima con patógenos particulares y surgen problemas de seguridad con las vacunas vivas atenuadas. Además, la tasa de enfermedades infecciosas emergentes sigue aumentando y, con ello, la necesidad de desplegar rápidamente nuevas vacunas. Desafortunadamente, las vacunas de primera generación no son propicias para tales urgencias. En las últimas tres décadas, la medicina veterinaria ha encabezado el avance en el desarrollo de nuevas vacunas para eludir varios de los defectos asociados con las vacunas clásicas. Estas vacunas de tercera generación, que incluyen vacunas de ADN, ARN y vectores virales recombinantes, inducen una respuesta inmunitaria tanto humoral como celular, se fabrican de forma económica, son seguras de usar y pueden utilizarse para diferenciar a los animales infectados de los vacunados. El presente artículo ofrece una revisión de las nuevas tecnologías de vacunas disponibles comercialmente que se utilizan actualmente en el control de enfermedades de animales de compañía, animales de consumo y fauna silvestre.
Introducción
Desde Edward Jenner y Louis Pasteur en los siglos XVIII y XIX, hasta la erradicación de la peste bovina en la bovina y la viruela en las poblaciones humanas en el siglo XX, las vacunas han desempeñado un papel fundamental en la supervivencia, la salud y el bienestar general de los seres humanos y los animales (1-3).
El objetivo final de la vacunación es generar inmunidad humoral y/o mediada por células, induciendo así la producción de memoria inmunológica que confiere protección contra infecciones naturales posteriores. La obtención de anticuerpos neutralizantes ha sido durante mucho tiempo el objetivo principal de las vacunas, sin embargo, además de los anticuerpos neutralizantes, se ha demostrado que las respuestas inmunitarias mediadas por células T son cruciales para una protección eficaz contra patógenos como el virus de la varicela, el VIH, la tuberculosis y la malaria (4-9).
La respuesta inmune adaptativa se activa principalmente a través de la presentación de antígenos unidos a un Complejo Mayor de Histocompatibilidad (MHC) I o II en la superficie de las células presentadoras de antígenos (APC) a las células T y las células B dentro de los órganos linfoides secundarios. Sin embargo, las células B pueden absorber partículas y antígenos sin la ayuda de APC, siempre que el antígeno sea lo suficientemente pequeño (10). El MHC-I se encuentra en todas las células nucleadas, mientras que el MHC-II se expresa exclusivamente en las células dendríticas, los macrófagos, los monocitos, las células B y las células epiteliales de la mucosa (11). Sin embargo, debido a que las células T no pueden interactuar directamente con el antígeno, el mecanismo de presentación del MHC junto con la señalización adecuada desempeña un papel fundamental en las células efectoras activadas y es particularmente importante en el desarrollo de vacunas en las que se desea una respuesta mediada por células T (12). La presentación del MHC depende de la localización intracelular del procesamiento del antígeno. Los antígenos derivados del citosol, como en el caso de las células somáticas infectadas por virus, se procesan en complejos MHC-I e interactúan con las células T CD8+, también conocidas como células T citotóxicas (CTL) que matan directamente a las células infectadas (13). Las APC también pueden presentar antígenos adquiridos exógenamente en complejos MHC-I, un proceso denominado presentación cruzada (14) y, al migrar a los ganglios linfáticos, activará CTL que migrarán fuera del ganglio linfático para eliminar las células infectadas.
Los antígenos exógenos adquiridos por endocitosis se presentan en moléculas MHC-II e interactúan con el ayudante CD4+T (TH) células. Las células T auxiliares tienen varios destinos y funciones efectoras que están influenciadas por el tipo de señal provocada durante el cebado y la activación. Pertinente a la producción de vacunas, T-helper 1 (TH1) Las células producen interferón-γ y factor de necrosis tumoral alfa, que potencian la función efectora de los fagocitos y aumentan la inflamación (15). Por lo tanto, la memoria T inducida por la vacunaH1 Las células son particularmente buscadas para patógenos intracelulares. Ayudante T 2 (TH2) las células facilitan la proliferación de células B mientras antagonizan a las TH1 y, por lo tanto, se asocian con un aumento de las respuestas humorales y son de particular interés para las vacunas dirigidas a parásitos o respuestas alérgicas (16, 17). Células auxiliares foliculares T (TFH) interactúan con linfocitos B que presentan antígeno en moléculas MHC-II (12, 18, 19). Solo los linfocitos B que reciben señales coestimuladoras de TFH Las células son capaces de generar anticuerpos IgG de alta afinidad o madurar hasta convertirse en células B de memoria (20). Como tal, las vacunas destinadas a generar una memoria robusta de las células B también deben estimular las respuestas de las células T.
Las vacunas clásicas inactivadas y las vacunas vivas modificadas (IV y MLV, respectivamente), también conocidas como vacunas de primera generación, han dado a humanos y animales ventajas tanto sobre el mundo patógeno que los rodea. Estas vacunas también han tenido un impacto económico debido al éxito que se ha visto en las industrias ganaderas (21). Las vías intravenosas son seguras y relativamente baratas de producir, presentan predominantemente antígenos a través de la vía MHC-II e inducen principalmente respuestas inmunitarias humorales. Debido a esta desventaja, los patógenos que requieren una fuerte respuesta mediada por células pueden escapar a la presión provocada por la vacuna (22). Los MLV eluden este problema, debido a su capacidad para replicarse con éxito dentro del huésped y provocar inmunidad protectora contra sus respectivos patógenos. Estos patógenos atenuados imitan la infección natural, provocando así las vías MHC-I y MHC-II. Se ha demostrado que algunos MLV provocan anticuerpos IgA en la mucosa, una característica única de solo un puñado de vacunas administradas por vía oral o nasal (23). Sin embargo, los MLV representan un riesgo leve para los animales, ya que hubo casos raros en los que las cepas atenuadas recuperaron la patogenicidad, causando la propagación de la enfermedad (21, 24-27). Además, los MLV están contraindicados en individuos gravemente inmunodeprimidos debido al riesgo de enfermedad (28). Estas vacunas clásicas han predominado en las inmunizaciones comerciales humanas y animales durante los últimos 100 años. Sin embargo, las desventajas antes mencionadas han llevado a las vacunas de segunda y tercera generación al centro de atención de la exploración.
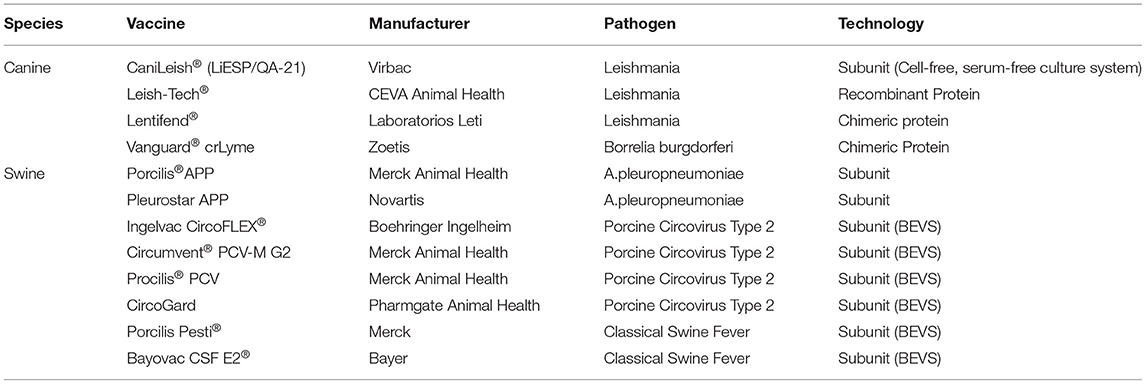
Estas vacunas de segunda y tercera generación han demostrado su éxito en la medicina veterinaria, allanando así el camino para el avance de la medicina humana (Figura 1). Las vacunas de segunda generación incluyen elementos de subunidades, antígenos conjugados/recombinantes o proteínas sintéticas (Tabla 1). Las vacunas de subunidades recombinantes no utilizan virus (inactivados o vivos), sino que utilizan la producción de antígenos a través de la sobreexpresión y purificación del antígeno. Esto se puede lograr a través de múltiples rutas, incluido el sistema de vectores de expresión de baculovirus (BEVS). Las vacunas de subunidades a menudo carecen de los patrones moleculares asociados a patógenos que el sistema inmunitario utiliza para reconocer patógenos a través de receptores de reconocimiento de patrones. Debido a esto, las vacunas de subunidades requieren adyuvantes con actividad coestimuladora que mejoren la magnitud y la calidad de la respuesta inmunitaria. Además, este tipo de vacunas son generalmente reconocidas por las células presentadoras de antígenos por vía intravesicular y, en consecuencia, se presentan en complejos MHC-II.
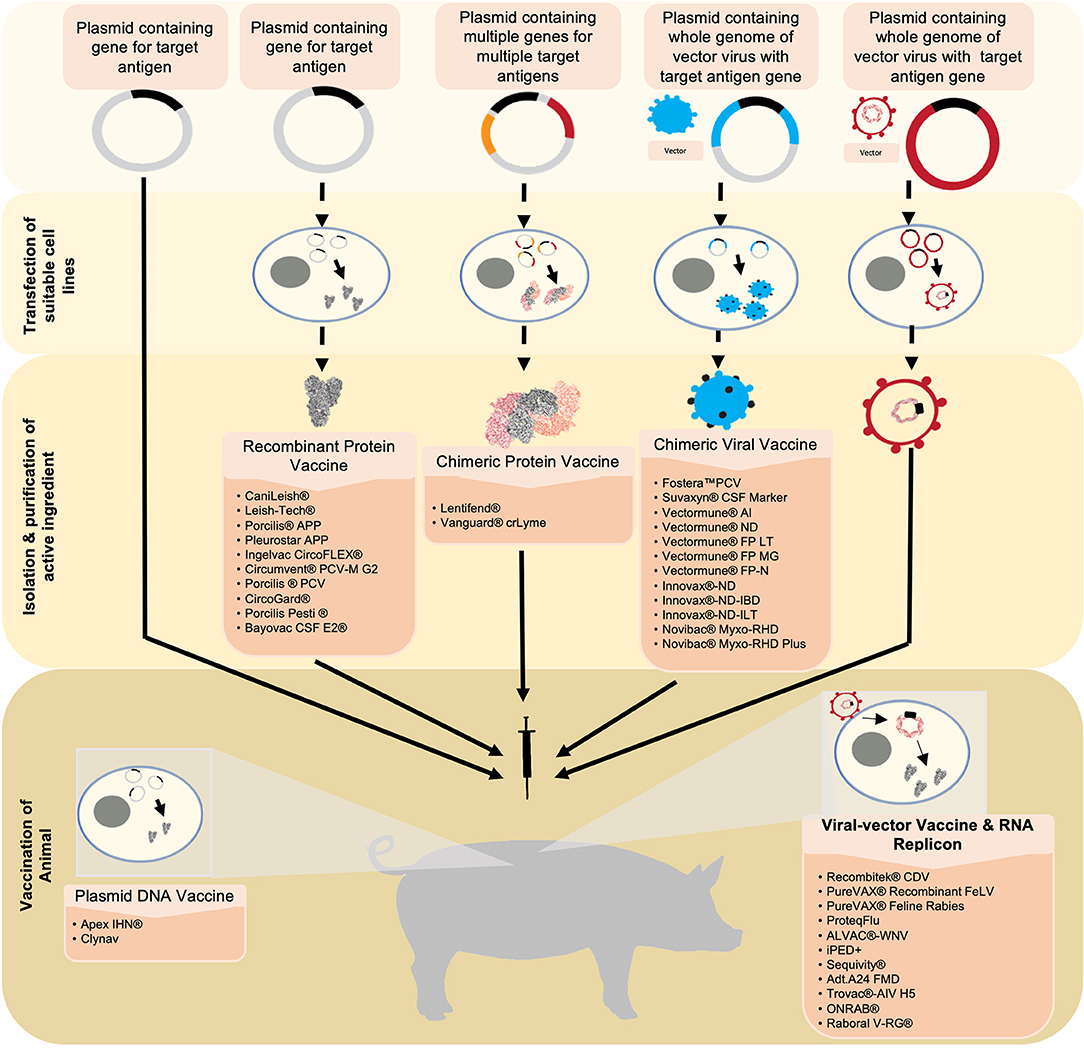
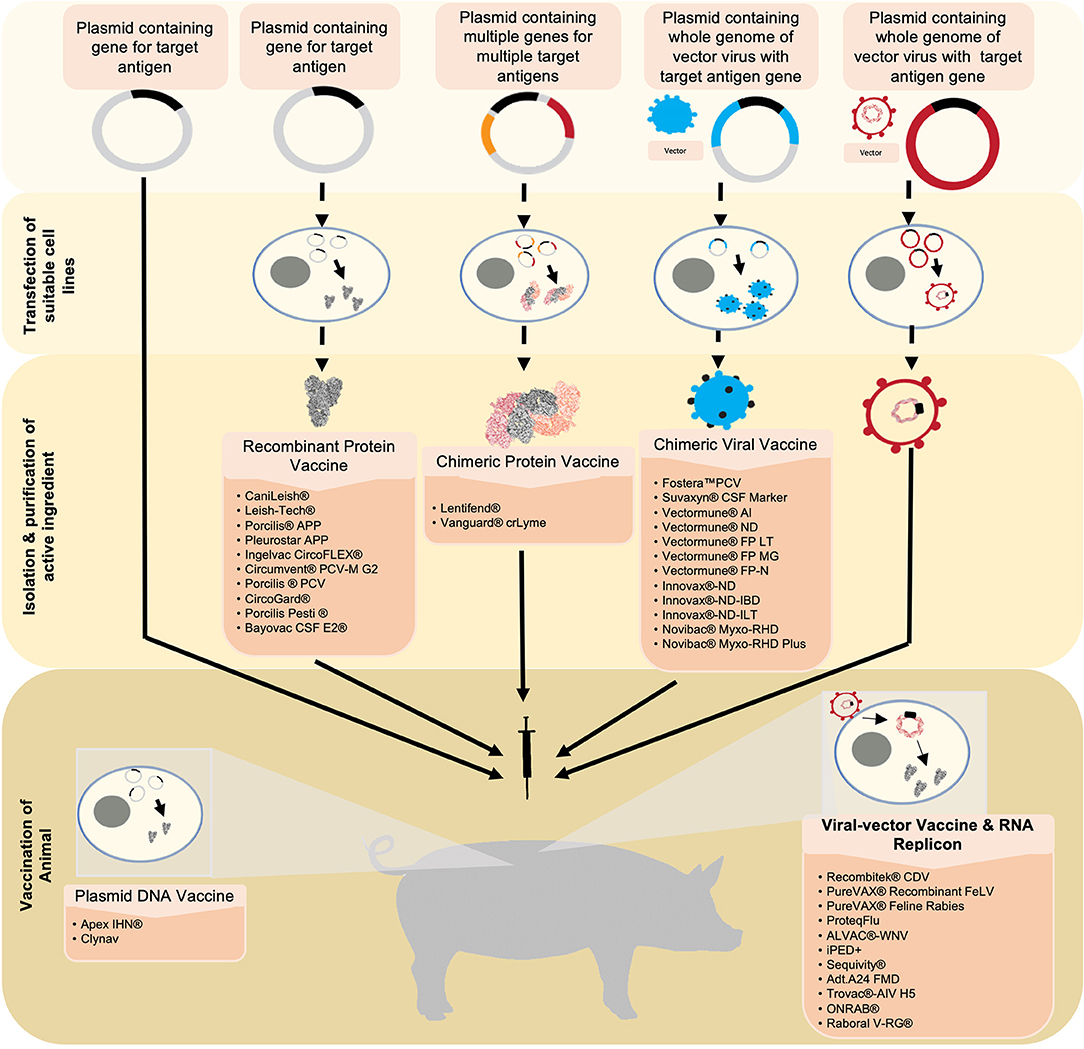 FIGURA 1. En esta revisión se simplifican y resumen seis nuevas tecnologías de vacunas analizadas en esta revisión, desde la generación y producción de antígenos hasta la vacunación. A partir de las vacunas de ADN plasmídico, el antígeno diana se inserta en un plásmido. Este sirve como ingrediente activo que se utilizará para vacunar al animal. Tras la vacunación, la vacuna de ADN plasmídico que lleva el ADN que codifica para el antígeno diana se traduce en la proteína deseada en las células del receptor de la vacuna. A continuación, el antígeno se expresa desde la célula, lo que provoca una respuesta inmunitaria. Las vacunas de proteínas recombinantes y las vacunas de proteínas quiméricas utilizan una tecnología similar. Sin embargo, las líneas celulares adecuadas se transfectan con el plásmido en el que se expresa el antígeno o antígenos. A continuación, se cosechan los antígenos, se purifican y se formulan en la vacuna. Las vacunas virales quiméricas utilizan un plásmido que contiene el genoma completo de un virus que se utilizará como vector además del gen objetivo para el antígeno deseado. Este plásmido se utiliza para transfectar una línea celular adecuada en la que se produce un virus completo que expresa el antígeno integrado. Este virus se cosecha y purifica, y se formula en una vacuna. Los vectores virales utilizan un virus que ha sido diseñado para expresar el gen de interés. El virus se formula en una vacuna y liberará los genes recombinantes en las células huésped. De forma similar a una vacuna de ADN plasmídico, los genes se transcribirán en el antígeno diana que luego se expresará y provocará una respuesta inmunitaria. Las vacunas de repliegue de ARN utilizan un segmento de ARN que codifica los antígenos deseados encapsulados en un portador de vesículas. Una vez en la célula del huésped, el ARN se traduce directamente, lo que da lugar a la expresión del antígeno diana.
FIGURA 1. En esta revisión se simplifican y resumen seis nuevas tecnologías de vacunas analizadas en esta revisión, desde la generación y producción de antígenos hasta la vacunación. A partir de las vacunas de ADN plasmídico, el antígeno diana se inserta en un plásmido. Este sirve como ingrediente activo que se utilizará para vacunar al animal. Tras la vacunación, la vacuna de ADN plasmídico que lleva el ADN que codifica para el antígeno diana se traduce en la proteína deseada en las células del receptor de la vacuna. A continuación, el antígeno se expresa desde la célula, lo que provoca una respuesta inmunitaria. Las vacunas de proteínas recombinantes y las vacunas de proteínas quiméricas utilizan una tecnología similar. Sin embargo, las líneas celulares adecuadas se transfectan con el plásmido en el que se expresa el antígeno o antígenos. A continuación, se cosechan los antígenos, se purifican y se formulan en la vacuna. Las vacunas virales quiméricas utilizan un plásmido que contiene el genoma completo de un virus que se utilizará como vector además del gen objetivo para el antígeno deseado. Este plásmido se utiliza para transfectar una línea celular adecuada en la que se produce un virus completo que expresa el antígeno integrado. Este virus se cosecha y purifica, y se formula en una vacuna. Los vectores virales utilizan un virus que ha sido diseñado para expresar el gen de interés. El virus se formula en una vacuna y liberará los genes recombinantes en las células huésped. De forma similar a una vacuna de ADN plasmídico, los genes se transcribirán en el antígeno diana que luego se expresará y provocará una respuesta inmunitaria. Las vacunas de repliegue de ARN utilizan un segmento de ARN que codifica los antígenos deseados encapsulados en un portador de vesículas. Una vez en la célula del huésped, el ARN se traduce directamente, lo que da lugar a la expresión del antígeno diana.
Las vacunas de tercera generación incluyen vacunas basadas en genes (ADN y ARN), plataformas de vectores virales y vacunas quiméricas vivas o inactivadas. Las vacunas basadas en ADN y ARN son un enfoque fundamentalmente nuevo para la vacunación, que implica el uso de ADN plasmídico administrado mediante inyección (Tabla 2). Los avances en las técnicas de biología molecular nos han permitido manipular estos polinucleótidos en nuestro beneficio, proporcionando rutas alternativas a las tecnologías clásicas de vacunas (29, 30). Las vacunas de ADN emplean el uso de un plásmido que contiene el ADN que codifica el antígeno o antígenos de interés. Una vez insertada en las células huésped, la maquinaria celular expresará los antígenos codificados por el ADN y se provocará una respuesta inmunitaria. Algunas ventajas de las vacunas de ADN incluyen la administración segura a individuos inmunodeprimidos en comparación con las MLV, el potencial de combinar múltiples plásmidos para una vacuna combinada de amplio espectro y la facilidad de ingeniería en comparación con las vacunas clásicas (31-33). Junto con estas ventajas, las vacunas de ADN inducen respuestas humorales y mediadas por células, y funcionan como patrones moleculares asociados a patógenos (PAMPS) que atenúan la necesidad de adyuvantes (32, 34, 35). Más específicamente, las vacunas de ADN plasmídico y ARN transfectan células y, por lo tanto, imitan la producción de proteínas patógenas intracelulares y, por lo general, inducen fuertes respuestas de células T CD8 + mediadas por MHC-I (36). Las células somáticas transfectadas presentarán antígeno en MHC-I, provocando así CTL cebadas por células dendríticas. Además, las APC engullen células transfectadas y presentan antígeno en complejos MHC-II para provocar una respuesta de células T CD4+ (37).
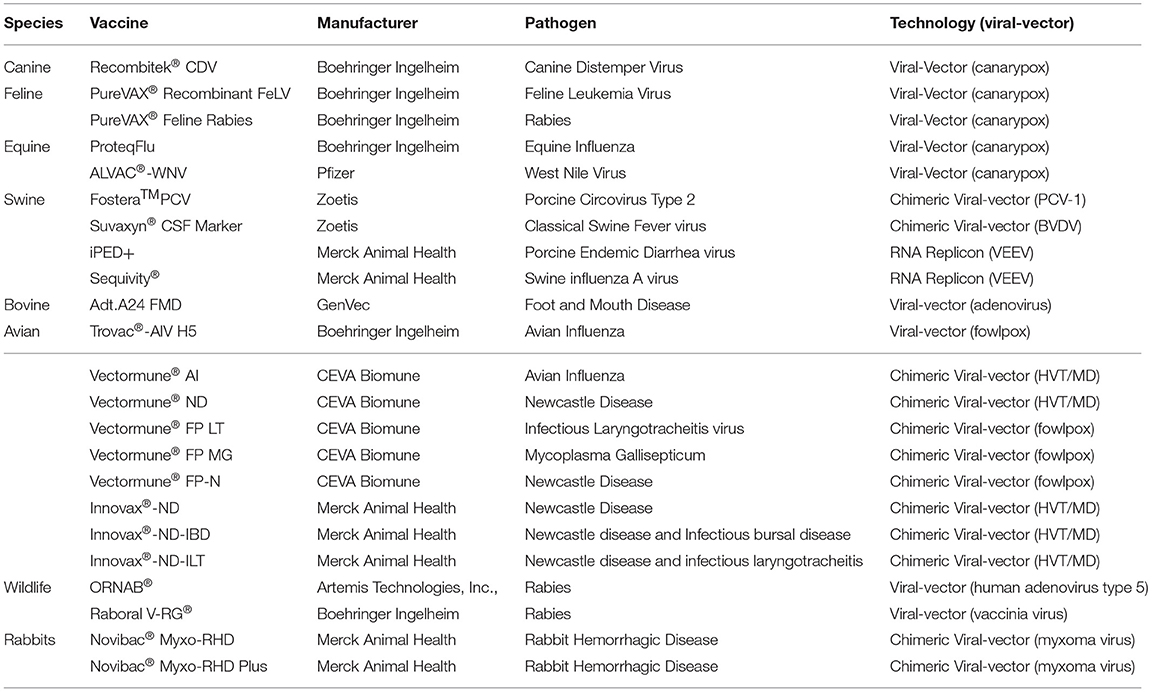
Las vacunas de vectores virales recombinantes son tecnologías novedosas en medicina veterinaria que utilizan virus como herramientas para la vacunología (Tabla 3). Estas vacunas están modificadas genéticamente e implican la inserción de ADN que codifica antígenos clave en un vector viral. El perfil de seguridad es similar al de las vacunas de subunidades inactivadas (muertas) y estimulan tanto las respuestas mediadas por células, específicamente las células T CD8+, como las respuestas inmunitarias humorales (9, 38). Los vectores virales de la viruela fueron los primeros en ser estudiados y establecidos en la década de 1980, con varias columnas vertebrales que se utilizaron para inducir respuestas a diversos patógenos animales, incluidas las columnas vertebrales de la viruela canaria y la viruela aviar (39-43). Los vectores de adenovirus han sido explorados como sistemas de tratamiento para numerosas infecciones, e incluso como vacunas contra antígenos asociados a tumores (44). Los alfavirus que contienen ARN de sentido positivo también se han utilizado como columna vertebral de vectores, y estas construcciones incluyen dos tipos: clones infecciosos de longitud completa y vectores replicones. Este último tipo es ventajoso debido a su falta de genes de proteínas estructurales, ya que solo contienen la región genómica no estructural y los genes que codifican los antígenos de interés (45). En el caso de los replicones de alfavirus, se pueden insertar genes extraños de interés en lugar de los genes estructurales que generan replicones de ARN autorreplicantes (RP) (46). Tras la inoculación, la RP es engullida por las células dendríticas y, en consecuencia, dirige la traducción de grandes cantidades de proteína en las células, lo que da lugar a la presentación del antígeno. Básicamente, esto las convierte en moléculas de ARN autorreplicantes. Estos conceptos pueden extenderse a las vacunas de vectores recombinantes quiméricos, donde los principios son los mismos, pero los genes, y por extensión los antígenos, de interés se toman de múltiples tipos del patógeno y se colocan dentro del mismo vector, con el objetivo de provocar una respuesta inmunitaria más amplia.
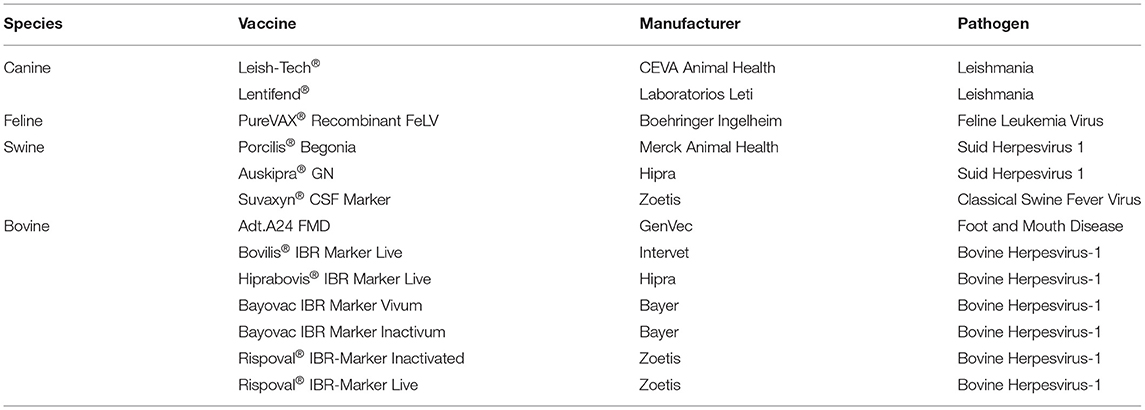
Otro componente que distingue a las vacunas veterinarias de las humanas es la tecnología que permite diferenciar a los animales infectados y vacunados (DIVA), lo que las convierte en una herramienta fundamental para el control y la erradicación de enfermedades (47). Esta tecnología también ha tenido un gran impacto en las importaciones y exportaciones, ya que proporciona un método sensible, rápido y económico para determinar las parvadas y los rebaños libres de patógenos (48). La mayoría de las vacunas DIVA, o vacunas marcadoras, se basan en mutantes de deleción recombinantes de patógenos de tipo salvaje, en los que se han eliminado segmentos de genes que expresan proteínas virales, como la glicoproteína de la envoltura (gE) del herpesvirus. Otras vacunas DIVA se basan en vacunas de subunidades y vacunas de virus enteros inactivados (Tabla 4). Debido a que las vacunas DIVA provocan una respuesta inmunitaria diferente a la provocada por las pruebas diagnósticas complementarias de infecciones naturales, normalmente se puede utilizar un ensayo de inmunoabsorción ligado a enzimas (ELISA) para discernir a los infectados y a los vacunados. Las vacunas DIVA se han utilizado en el control de la fiebre aftosa, la peste porcina clásica, la rinotraqueítis bovina y la erradicación de la pseudorrabia (enfermedad de Aujesky) en cerdos (49-51).
En general, la medicina veterinaria ha logrado grandes avances en el desarrollo de vacunas para una amplia gama de patógenos, y ha encabezado las metodologías y diseños de vacunología, estando años por delante en comparación con las tecnologías de vacunas humanas. En esta revisión, se presentan las tecnologías actuales disponibles comercialmente y autorizadas que se utilizan en vacunología veterinaria.
Animales de compañía
Vacunas caninas
Virus del moquillo canino: vacunas combinadas Recombitek (CDV)®
El virus del moquillo canino (CDV) pertenece a la familia Paramyxoviridae y está estrechamente relacionado con el virus del sarampión humano y el virus de la peste bovina. El CDV se encuentra en todo el mundo, afecta a todos los miembros de la familia Canidae y es responsable de enfermedades importantes, que a menudo resultan en una alta morbilidad y mortalidad en animales no protegidos. Las vacunas Recombitek, producidas por Merial Animal Health (ahora Boehringer Ingelheim Animal Health), utilizan un vector recombinante de la viruela canaria que expresa tanto la hemaglutinina antigénica como las glicoproteínas de fusión del CDV y están coformuladas con otros MLV (adenovirus tipo 2, coronavirus, parainfluenza o parvovirus) o antígenos bacterianos. Estas vacunas son las únicas vacunas contra el CDV transmitidas por virus autorizadas y disponibles comercialmente para caninos hasta la fecha. Uno de los principales beneficios de esta vacuna es que el vector de la viruela canaria no tiene el genoma completo del CDV ni los componentes infecciosos del CDV y, por lo tanto, se elimina el riesgo de encefalitis postvacunal por CDV (52). Los estudios han demostrado que la Recombitek CDV tiene un tiempo de inmunidad comparable al de las vacunas MLV-CDV, puede conferir una protección moderada contra el desafío del virus a las pocas horas de ser vacunado y protege completamente a los animales dentro de 1 semana de la vacunación (53). Además, a diferencia de las vacunas MLV-CDV, Recombitek CDV se puede utilizar en individuos inmunodeprimidos y con enfermedades antes del destete, ya que se ha demostrado que protege a los cachorros en presencia de anticuerpos maternos sin suprimir la capacidad de respuesta de los linfocitos (54, 55). Recombitek CDV tiene una respuesta anamnésica significativa y confiere un aumento 4 veces mayor en el título tras la vacunación de refuerzo (particularmente cuando los perros recibieron una vacuna MLV-CDV inicialmente) y una duración serológica de inmunidad de 36 meses (56-58). En comparación con las vacunas MLV-CDV, Recombitek CDV induce un título de neutralización sérica más bajo en comparación con las vacunas MLV-CDV en carnívoros no domésticos (59).®®®®®
Enfermedad de Lyme canina—VANGUARD crLyme®
La enfermedad de Lyme, causada por la espiroqueta Borrelia burgdorferi, es la enfermedad transmitida por vectores más común en América del Norte y Europa e infecta a una variedad de animales vertebrados, incluidos pequeños mamíferos, lagartos y aves (3, 60). Estudios anteriores han demostrado que el 63% de los perros expuestos a garrapatas infectadas, el vector transmisor de B. burgdorferi, desarrollan signos clínicos de la enfermedad de Lyme que consisten en cojera grave en la articulación del codo o del hombro de aparición repentina, hinchazón de las articulaciones del hombro, el codo y el carpo, y artritis aguda (61). Existen varias vacunas caninas disponibles comercialmente contra B. burgdorferi que inducen la producción de anticuerpos borreliacidales contra la proteína A de la superficie externa (OspA). Estos anticuerpos forman un complejo de ataque a la membrana dentro de la garrapata que transmite B. burgdorferi durante la alimentación de sangre en el huésped (62). Debido a que la OspA es genoespecífica, se ha identificado que dirigirse tanto a la OspA como a la proteína C de la superficie externa (OspC) es una táctica de vacunación más ventajosa porque la OspC se conserva entre varias de las genoespecies patógenas de Borrelia. No obstante, la combinación de ambos antígenos proporciona una protección completa contra la enfermedad de Lyme (63-66). VANGUARD crLyme, creada por Zoetis, es la única vacuna de Lyme recombinante quimérica disponible comercialmente basada en proteínas recombinantes basadas en epítopos quiméricos. Contiene antígenos para OspA y 14 epítopos lineales diferentes derivados de siete tipos de OspC y, por lo tanto, proporciona una protección de amplio espectro (67). Al investigar la eficacia y seguridad de VANGUARD crLyme, los investigadores encontraron que la vacuna mostró una reducción del 93,7% en la incidencia de la infección por B. burgdorferi y demostró respuestas humorales significativas tanto a OspA como a OspC después de la vacunación. Tras el desafío con garrapatas sospechosas de ser portadoras de B. burgdorferi, los animales vacunados no mostraron respuesta humoral al antígeno OspC, lo que sugiere que VANGUARD crLyme previno la transmisión de B. burgdorferi de garrapatas infectadas a perros vacunados (68). En contraste con estos hallazgos, la comparación de VANGUARD crLyme con Recombitek Lyme (la vacuna monovalente recombinante OspA disponible comercialmente) reveló que VANGUARD crLyme provocó una respuesta más lenta de anticuerpos anti-OspA, tuvo una actividad borreliacidal sérica más baja en todos los puntos de tiempo posteriores a la vacunación y tuvo una inmunogenicidad inferior (69). Grosenbaugh et al. (69), señalan que la variación en la eficacia podría deberse a las diferencias de lipidación de los antígenos, pero también a un desajuste entre los antígenos OspC utilizados en la vacuna y el ensayo de anticuerpos utilizado para evaluar la respuesta. En un estudio más reciente, se demostró que VANGUARD crLyme induce anticuerpos ampliamente reactivos cruzados a 25 variantes recombinantes de OspC examinadas contra sueros de animales vacunados, reduce significativamente los cambios histopatológicos en el sitio de la picadura de garrapata y previene la sinovitis y dermatitis inducidas por B. burgdorferi (68).®®®®®®®
Leishmaniasis visceral canina: CaniLeish, Leish-Tec, Letifend®®®
La leishmaniosis canina (CanL), causada por el protozoo Leishmania infantum, es una enfermedad grave y crónica transmitida por la picadura de un flebótomo. Actualmente, la leishmaniasis es endémica en la cuenca mediterránea, Oriente Medio, Asia Central y América Latina. Es importante destacar que los perros domésticos son reservorios de la leishmaniasis visceral humana en muchas áreas (70). Se estima que el 30% de los perros en áreas endémicas son seropositivos y algunos eventualmente se enfermarán clínicamente. Desafortunadamente, CanL no se puede curar fácilmente con las terapias actuales. En consecuencia, la alta prevalencia implora la creación de una vacuna eficaz que provoque una respuesta robusta y duradera mediada por Th1 para prevenir el desarrollo de la enfermedad después de la infección. A la fecha existen tres vacunas disponibles en el mercado: CaniLeish (Virbac S.A.), Leish-Tec (CEVA salud animal) y Lentifend (Laboratorios Leti). Leishmune (Zoetis) se retiró del mercado en 2018 y, por lo tanto, no se analizará en esta revisión.®®®®
CaniLeish (LiESP/QA-21) fue la primera vacuna contra la leishmaniasis en Europa y está indicada para la inmunización activa de la leishmania al proporcionar una reducción significativa en la progresión de la enfermedad (71). En general, CaniLeish es una vacuna bien tolerada formulada con antígenos de proteína secretada excretada (LiESP) de L. infantum y un adyuvante de extracto purificado de Quillaja saponaria (QA-21) (72). CaniLeish tiene un inicio de inmunidad de 4 semanas caracterizado predominantemente por una respuesta IgG-2 a la percepción extrasensorial y un perfil inmunitario significativamente fuerte mediado por células dominadas por Th1 que permanece persistente durante un año completo después del ciclo de vacunación primaria (71, 73, 74). En un importante ensayo clínico, CaniLeish proporcionó una protección del 68,4% en animales vacunados en comparación con los controles no vacunados (71). Además, los perros vacunados tuvieron cargas parasitarias medias más bajas debido a la facilitación de una reducción parasitaria intracelular inducida por macrófagos más fuerte junto con linfocitos autólogos (73, 75). Desafortunadamente, CaniLeish no previene la entrada inicial y la migración de los parásitos y no produce anticuerpos que puedan distinguirse de las pruebas diagnósticas convencionales de anticuerpos de inmunofluorescencia (IFAT) (71).®®®®®
Leish-Tec está autorizada como otra vacuna de segunda generación en Brasil. Esta vacuna contiene antígenos recombinantes de proteína A2 de varias especies de Leishmania y un adyuvante de saponina (76, 77). La vacuna se tolera de manera similar a CaniLeish, provoca un anticuerpo anti-A2 IgG1, un anticuerpo IgG2 y una respuesta inmune Th1 1 mes después de la vacunación (78, 79). Esta vacunación induce una reducción significativa en la transmisión de Leishmania spp. por flebótomos que se alimentan de perros vacunados seropositivos anti-A2 y reduce el riesgo de progresión de la enfermedad y mortalidad por todas las causas en perros infectados asintomáticos (80, 81). En un estudio de prueba de campo, el tiempo medio de seroconversión y la incidencia acumulada de infección entre los perros inmunizados fueron de ~18 meses y 27%, respectivamente, mientras que el tiempo medio de seroconversión no vacunado fue de ~9 meses y 42%, respectivamente (79). En ese mismo estudio, el 43% de los receptores de la vacuna finalmente desarrollaron signos clínicos que cuestionan la eficacia de Leish-Tec (79). Actualmente, el gobierno brasileño aconseja el sacrificio de todos los perros seropositivos. Afortunadamente, Leish-Tec se considera una vacuna DIVA, ya que la respuesta humoral inducida por Leish-Tec puede detectarse mediante A2-ELISA y no crea interferencias de reacción cruzada con las pruebas diagnósticas serológicas convencionales de leishmaniosis (79, 82).®®®®®
Lentifend contiene el antígeno recombinante Proteína Q, una proteína quimérica formada por la fusión de cinco determinantes antigénicos de cuatro proteínas de Leishmania y no tiene adyuvante (76). Lentifend provoca consistentemente una respuesta inmune celular y humoral caracterizada por un aumento significativo en las proteínas del sistema del complemento y un aumento temprano y estadísticamente significativo de los anticuerpos IgG2 contra la proteína Q 2 semanas después de la vacunación (76, 83, 84). Lentifend ha demostrado ser muy bien tolerado, reduce los inmunocomplejos circulantes, la carga parasitaria, la incidencia de signos clínicos y el número de casos confirmados, y tiene una eficacia global del 72% (76, 83). Al igual que Leish-Tec, Lentifend entra en la categoría DIVA (85, 86).®®®®®
Vacunas felinas
Virus de la leucemia felina – FeLV recombinante PureVAX®
El virus de la leucemia felina es un retrovirus inmunosupresor que infecta a los felinos domésticos y salvajes. Puede transmitirse por contacto directo o a través del virus que se disemina en la saliva o las secreciones nasales y afecta a múltiples sistemas de órganos. Se estima que entre el 2,3 y el 3,4% de todos los gatos de América del Norte se ven afectados (87). PureVAX Recombinant FeLV, producida por Boehringer Ingelheim Animal Health, es una vacuna no adyuvante vectorizada por el virus de la viruela canaria que contiene la proteína polimerasa mutada de la envoltura, gag y truncada de la cepa FeLV subtipo A/Glasgow-1 (88, 89). La respuesta inmunitaria provocada por el FeLV recombinante PureVAX se caracteriza por la activación de la inmunidad mediada por células mediante la inducción de una respuesta de células T específicas de FeLV (89-91). En comparación con otras vacunas disponibles comercialmente, la FeLV recombinante tiene grados similares de protección contra la viremia persistente y la integración del ADN proviral ante el desafío del virus y una fracción preventiva del 93% (92). No obstante, se ha demostrado que una duración de 3 años de la inmunidad después de un protocolo de vacunación de preparación y refuerzo confiere una protección completa contra la viremia persistente (93).®®
Rabia felina—PureVAX Rabia felina®
La rabia es una infección zoonótica, neurológica progresiva y mortal causada por el virus de la rabia. La infección por rabia está presente en todo el mundo, es responsable de más de 60.000 muertes humanas al año y afecta a todos los animales de sangre caliente (94). PUREVAX Rabia Felina contiene el virus recombinante de la viruela canaria (vCP65) que expresa el gen de la glicoproteína de la rabia. La inoculación de animales con vCP65 demostró un nivel apropiado de expresión de productos génicos extraños suficiente para inducir anticuerpos neutralizantes séricos específicos de la rabia y respuestas de células T para proteger contra el desafío letal del virus de la rabia hasta por 3 años (95). PUREVAX Rabia Felina proporciona una protección completa incluso cuando se administra conjuntamente con otras vacunas felinas, lo que ilustra la utilidad en las vacunaciones básicas anuales (96). Además, debido a que esta vacuna carece de un adyuvante, existe una excelente seguridad local y reacciones inflamatorias mínimas, ya que la inflamación crónica en el lugar de la inyección es un factor de riesgo para los fibrosarcomas inducidos por la vacuna en felinos (97).®®
Vacunas Equinas
Influenza equina—ProteqFlu
El virus de la influenza equina (EIV) es un ortomixovirus considerado una enfermedad respiratoria importante en los caballos. La influenza equina ha tenido importantes implicaciones económicas y de bienestar en la última década y es particularmente difícil de controlar debido a la tendencia del virus a sufrir fácilmente la deriva y el cambio antigénico. Desafortunadamente, el desajuste de la vacuna con la cepa circulante puede contribuir a una eficacia significativamente menor para provocar una respuesta inmunitaria adecuada del huésped.
ProtequFlu (comercializado por Boehringer Ingelheim, anteriormente Merial Animal Health) contiene dos recombinantes vivos modificados del virus de la viruela canaria que expresan el gen de la hemaglutinina (HA) EIV de dos cepas significativamente importantes de EIV circulantes. Se ha demostrado que ProtequFlu genera títulos de anticuerpos antigripales IgGa e IgGb significativamente altos antes del desafío, una respuesta protectora de IgGa e IgGb anamnésica a largo plazo de 6 meses después del desafío con varios linajes estadounidenses e induce un IFN-y específico y Expresión de ARNm de IL-2 (98, 99). En animales mayores de 8 meses, la vacunación ha demostrado proporcionar protección después de una sola dosis en comparación con las dos dosis requeridas de la vacuna inactivada y, por lo tanto, se ha utilizado como un medio para la respuesta de emergencia a los brotes de IEV (100, 101). Sin embargo, algunos estudios encontraron que los potros <8 meses no se seroconvirtieron hasta la tercera inmunización, lo que sugiere que la presencia de anticuerpos derivados de la madre contribuye a este patrón de inmunización y podría influir en los protocolos de vacunación (102). En cuanto a la inmunidad a largo plazo, ProteqFlu-Te no fue tan robusta como todas las vacunas inactivadas comerciales, Equilis Prequenza-Te y Duvaxyn IE-T Plus, o cuando ProteqFlu-Te se combinó en un protocolo de vacunación mixta, que es una práctica común en el campo (103).®®®®
Virus del Nilo Occidental: ALVAC-WNV y ADN innovador del Nilo Occidental®®
El Virus del Nilo Occidental (VNO) es un Flavivirus neurotrópico transmitido por mosquitos que causa enfermedades debilitantes y potencialmente mortales que se encuentran en todo el mundo en aves, humanos y caballos (las dos últimas especies son los huéspedes sin salida) (104, 105). El éxito de la vacunación requiere tanto la inducción de anticuerpos neutralizantes como la respuesta inmunitaria mediada por células, incluida la obtención de INF-α, INF-β y una participación significativa del sistema del complemento (104, 106, 107). La IgM es de vital importancia para el control de la infección aguda y temprana por el VNO, seguida de la presencia de anticuerpos IgG que confieren protección a largo plazo contra la reinfección por el VNO (108, 109).
Merial Animal Health (ahora Boehringer Ingelheim Animal Health) desarrolló ALVAC-WNV, una vacuna quimérica recombinante vectorizada por la viruela canaria que expresa los genes de la membrana precursora (prM) y la envoltura (E) del VNO derivados de los aislados de Nueva York de 1999 (110). ALVAC-WNV induce anticuerpos neutralizantes y células productoras de IFN-y+ específicas del inserto prM/E contra el WNV en caballos vacunados y, por lo tanto, desempeña un papel importante en la eliminación de antivirales (107, 111). Se demostró que la vacuna ALVAC-WNV es totalmente protectora contra el virulento desafío del WNV a través de la exposición a mosquitos, lo que la hace excepcionalmente aplicable en el campo (112). Además, ALVAC-WNV induce anticuerpos contra el VNO a los 7 días, desarrolla protección contra la viremia a partir de los 26 días después de una sola dosis, protege completamente contra la provocación y provoca una respuesta inmunitaria que podría recordarse 9 meses después de la vacunación primaria adecuada y la vacunación de refuerzo (107, 112, 113). West Nile-Innovator DNA, una vacuna basada en plásmidos de ADN del VNO, autorizada en 2005 por Fort Dodge Animal Health/Pfitzer, contenía un ADN plásmido no formulado que codifica las proteínas prM y E del VNO y un adyuvante MetaStim™ (110, 114). Esta vacuna resultó en una respuesta humoral y fuerte de Th1, sin embargo, la vacuna fue descontinuada por Pfizer (110, 115, 116).®®®®®
Animales destinados a la alimentación
Vacunas porcinas
Pleuroneumonía: APP Porcilis y APP PleuroStar®
Una segunda generación de vacunas de subunidades dirigidas a la bacteria Actinobacillus pleuropneumoniae (APP) fue desarrollada previamente por Merck Animal Health y Novartis. La APP es el agente activo que causa la enfermedad de pleuroneumonía contagiosa porcina en cerdos a través de las toxinas ApxI, ApxII, ApxII y ApxIV de la bacteria (117, 118). Actualmente se caracterizan quince serotipos conocidos de APP, cada uno de los cuales puede causar patogenicidad variable (119). La forma aguda de la pleuroneumonía contagiosa porcina es a menudo mortal al inducir daño pulmonar hemolítico y citotóxico que conduce a la pleuroneumonía (119). La enfermedad es más grave en lechones de 6 a 22 semanas de edad, generalmente antes de que salgan al mercado (119). En consecuencia, la APP es una enorme carga económica para la industria porcina. Porcilis APP y PleurostarAPP son vacunas de subunidades de segunda generación disponibles comercialmente que proporcionan cierta protección cruzada contra los 15 serotipos de A. pleuropneumonia (120-122). Las vacunas se basan en cuatro o cinco proteínas purificadas producidas por cepas c. Esto incluye las exotoxinas ApxI, ApxII, ApxIII y una proteína de membrana externa de 42 kilodalton para el desarrollo de PorcilisAPP, y las proteínas ApxII, TbpB, CysL, OmlA y OmlA para PleurostarAPP (119, 123).®
Se ha demostrado que Porcilis APP desarrolla una inmunidad protectora con un pico de 2 a 3 semanas después de la vacunación de refuerzo que se puede mantener hasta por siete semanas, confiere protección en términos de signos clínicos, reduce las lesiones pulmonares y reduce la mortalidad por serovar 1 (123). En un experimento realizado por Del Pozo Sacristán et al., se evaluó la APP de Porcilis en rebaños afectados crónicamente por pleuresía. Los animales vacunados tuvieron una prevalencia y un grado de pleuresía significativamente más bajos, 4,1 y 2,5%, respectivamente, frente a los animales no vacunados, 18,5 y 8,0%, respectivamente. Los animales vacunados aumentaron más de peso que los cerdos del grupo no vacunado. Además, el uso de antimicrobianos y la mortalidad se redujeron en los animales vacunados, lo que sugiere que, aunque la vacunación puede no prevenir la expresión clínica de la infección por APP, podría ser útil para reducir el impacto de la infección (121, 123).®®
Circovirus Porcino Tipo 2: CircoFLEX de Ingelvac, Circumvent PCV-M G2, PCV de Porcilis, PCV de CircoGard y Fostera™®®®
Se han identificado dos tipos de circovirus en cerdos, el circovirus porcino 1 (PCV1) y el circovirus porcino 2 (PCV2), donde solo este último se considera patógeno (124). La PCV2 es el agente causal de la enfermedad asociada al circovirus porcino, que incluye múltiples síndromes clínicos de los cerdos, como el síndrome de desgaste multisistémico posterior al destete, el síndrome de dermatitis y nefropatía porcina y los trastornos reproductivos inducidos por la PCV2 (125-127).
Ingelvac CircoFLEX (producida por Boehringer Ingelheim), Circumvent PCV-M G2 & y Porcilis PCV (ambas producidas por Merck) y CircoGard (producida por Pharmgate Biologics) son vacunas de subunidades autorizadas que se desarrollaron utilizando un sistema BEVS para expresar la proteína PCV-2 ORF-2 (128). Tanto para las vacunas Ingelvac CircoFLEX como para las vacunas Circumvent PCV-M G2, la proteína ORF-2 se utiliza como base para provocar una respuesta inmunitaria en cerdos contra PCV-2 (129). En general, la vacunación con estas tecnologías en lechones jóvenes resultó en una pérdida de peso atenuada, una viremia más corta y una carga viral más baja (130). La vacuna Fostera PCV producida por Zoetis es una™ vacuna de vector viral PCV1-2 quimérico inactivado de dosis única. Utiliza el genoma de la PCV1 no patógena como columna vertebral, clonada con el gen ORF2 de PCV2 que codifica la proteína inmunogénica de la cápside del virus (131). Los animales vacunados demostraron una mayor concentración de anticuerpos neutralizantes y títulos de anticuerpos IgG anti-PCV2 que se correlacionan con la reducción significativa de la viremia y la replicación de PCV2 en comparación con los animales de control negativos (132, 133). Además, esta vacuna quimérica indujo una fuerte respuesta inmune mediada por células (células CD3+ y CD4+) que puede explicar la disminución de las copias genómicas de PCV2 en la sangre de cerdos inmunizados (132).®®®®®®
Suid Herpesvirus-1 (pseudorrabia/enfermedad de Aujesky): Porcilis begonia (MSD Animal Health- Intervet), Auskipra GN (Hipra)®®
El herpesvirus Suid 1 (SuHV-1) es un alfaherpesvirus responsable de la enfermedad de Aujesky (también conocida como pseudorrabia). Este patógeno altamente contagioso infecta a una amplia gama de especies animales, siendo los cerdos el principal reservorio y huésped del virus. La enfermedad en los cerdos incluye una variedad de síntomas clínicos, signos neurológicos y una alta tasa de mortalidad de hasta el 100% en los lechones, mientras que los cerdos más viejos muestran principalmente signos respiratorios. Las cerdas infectadas muestran una variedad de trastornos reproductivos, como el retorno anormal al celo, abortos, mortinatos, lechones momificados o de una semana (50). Los síntomas clínicos predominantes en los huéspedes secundarios (bovinos, perros y gatos) son prurito severo y trastornos neurológicos (127). No obstante, este patógeno causa importantes pérdidas económicas en los centros de producción de granjas porcinas ingenuas y sigue siendo una enfermedad de declaración obligatoria en los EE. UU. (134). SuHV-1 es un virus de ADN compuesto por varios genes que contribuyen a la virulencia del patógeno, pero que no son esenciales para la replicación viral, mientras que los genes tk y gE han sido el objetivo principal de la deleción para lograr la inactivación del virus.
Porcilis Begonia (MSD Animal Health- Intervet) es una vacuna viva atenuada con mutantes de deleción de tk y gE. Se utiliza para la prevención de los síntomas clínicos y la mortalidad por la enfermedad de Aujesky. Esta vacuna ha sido desarrollada para inmunizar de forma protectora a los animales durante un período de 4 meses (135, 136). Auskipra GN (Hipra) es una vacuna viva atenuada de la cepa Bartha K61 negativa a gE y ha demostrado prevenir los síntomas clínicos y reducir la diseminación viral de las variantes chinas de SuHV-1 (cepa AH02) (137, 138). Ambas vacunas se pueden utilizar en programas de vacunación para controlar y erradicar la pseudorrabia (139, 140).®®
Pestivirus: marcador de líquido cefalorraquídeo de Suvaxyn, pesti de Porcilis y líquido cefalorraquídeo de Bayovac E2®®®
La peste porcina clásica (PPC) es causada por un pestivirus de la familia Flaviviridae (127). El virus de la peste porcina clásica (VCE) es un virus pequeño y envoltoso con un genoma de ARN de sentido positivo monocatenario que codifica una poliproteína, escindida postraduccionalmente en 12 productos finales, incluida la glicoproteína estructural E2 que tiene un papel fundamental en la replicación viral (141, 142). La erradicación del líquido cefalorraquídeo en varios países de Europa occidental, América del Norte y Australia se atribuye en gran medida a la vacuna lapinizada china (cepa C), una cepa atenuada de la peste porcina clásica, desarrollada por el Instituto de Control de Medicamentos Veterinarios de China y el Instituto de Investigación Veterinaria de Harbin en 1956 (143). Sin embargo, esta enfermedad viral altamente contagiosa sigue siendo de importancia mundial con una alta tasa de mortalidad. El virus de la peste porcina clásica sigue siendo endémico en muchas partes del mundo, incluida la mayor parte de Asia, América Central y del Sur y varios países de Europa del Este, lo que ha dado lugar a brotes esporádicos en poblaciones porcinas vírgenes altamente susceptibles en países vecinos libres de peste porcina clásica (127, 144).
Los cerdos suelen infectarse con el virus de la peste porcina clásica por vía oronasal, por contacto de cerdos susceptibles con cerdos salvajes o domésticos infectados, o por ingestión de desechos crudos, con la amígdala como sitio inicial de replicación viral. Los animales en la forma aguda de la enfermedad presentan fiebre alta, pérdida de apetito, depresión y conjuntivitis, frecuentemente seguidos de diarrea, vómitos, eritema cutáneo y signos clínicos del sistema nervioso central, días o semanas antes de que finalmente mueran. Además, el virus de la peste porcina clásica es capaz de atravesar la placenta y transmitirse a los fetos, lo que da lugar a momificaciones, abortos, mortinatos o deformidades fetales (127, 144, 145).
Una vacuna prometedora disponible comercialmente es Suvaxyn CSF Marker, la vacuna quimérica CP7_E2_alf que está autorizada por la Agencia Europea de Medicamentos. La vacuna utiliza una columna vertebral viva atenuada del virus de la diarrea viral bovina (BVDV) que expresa la glicoproteína E2 del virus de la peste porcina clásica (146). Esta es una estrategia efectiva ya que la glicoproteína E2 es el principal antígeno neutralizante del virus de la peste porcina clásica (147, 148). Además, el diseño de la vacuna CP7_E2_alf permite la diferenciación serológica entre cerdos infectados de tipo salvaje y vacunados en piaras (149, 150). Se ha demostrado que la vacunación intramuscular (IM) y oral confiere una protección completa contra la exposición con la cepa altamente virulenta del virus de la peste porcina clásica «Eystrup» 28 días después de la inmunización (146, 149). Desafiar a los animales vacunados dentro de los 2 días posteriores a la inmunización confirió protección parcial (151). Además, se ha demostrado que la duración de la inmunidad dura al menos 6 meses después de una dosis de vacunación (152).®
Porcilis Pesti (Merck) y Bayovac CSF E2 (Beyer AG) son vacunas de subunidades autorizadas desarrolladas utilizando el sistema BEVS para expresar la proteína E2 (153). Porcilis Pesti ha demostrado ser muy eficaz contra la cepa «Glentorf» de baja virulencia en cerdas gestantes, ya que no se detectó ningún virus después de un estudio de provocación vacunal y nueve de cada 10 camadas de cerdas vacunadas estaban protegidas de la infección por el virus de la peste porcina clásica cuando se desafiaron 126 días después de la vacunación y en el día 65 de gestación (154). En un ensayo de laboratorio a gran escala, se evaluaron tanto Porcilis Pesti como Bayovac CSF E2. Los datos revelaron que los animales vacunados con Bayovac CSF E2 estaban mejor protegidos contra el LCR clínico que los que recibieron Porcilis pesti, ya que la respuesta de anticuerpos fue más pronunciada y la probabilidad de transmisión se redujo significativamente después de la segunda dosis. Cuando las cerdas fueron desafiadas con LCR virulento 14 días después de la vacunación (día 60 de gestación) con Bayovac LCR E2 y Porcilis Pesti, el 75 y el 100% de las cerdas tenían lechones virémicos, respectivamente (155). Estos datos sugieren colectivamente que estas vacunas han reducido su eficacia durante una situación de brote de emergencia en el campo en la que los animales no habían sido vacunados al menos 3 semanas antes de la exposición.®®®®®®®®®
Virus de la diarrea endémica porcina – Vacuna iPED+
El virus de la diarrea epidémica porcina (PEDv) es un coronavirus porcino altamente contagioso que causa enteritis en todos los grupos de edad con una virulencia y mortalidad variables según la cepa (156, 157). El PEDv es un coronavirus enteropatógeno compuesto por un genoma de ARN detectado positivamente que codifica una glicoproteína de pico (S) ubicada en la envoltura de la superficie externa de la partícula del virus. La proteína de la espícula (S) del PEDv es crucial para la interacción del virus con los receptores de la célula huésped y se caracterizó por contener muchos epítopos reconocidos por el sistema inmunitario del huésped para incitar anticuerpos neutralizantes (158-160).
La vacuna iPED+ (actualizada a iPED RNA) fue la primera vacuna de partículas de ARN de replicón derivada de alfavirus autorizada para controlar el PEDv. La vacuna emplea un sistema de vectores replicones que utiliza una partícula defectuosa similar al virus de la encefalitis equina venezolana (VEEV) para administrar y propagar el antígeno de la glicoproteína PEDv S en cerdos (161, 162). Se demostró que la vacuna iPED RNA provoca anticuerpos neutralizantes de PEDv en las madres y anticuerpos neutralizantes de PEDv adquiridos pasivamente en lechones lactantes, induce inmunidad clínicamente protectora y reduce la excreción viral en cerdos desafiados, y reduce la mortalidad por partos en cerdas desafiadas (161, 163, 164).
Virus de la influenza porcina A – SEQUIVITY®
El virus de la influenza porcina A (swIAV, por sus siglas en inglés) es un patógeno respiratorio importante en los cerdos que provoca un retraso en el crecimiento, un tiempo de terminación prolongado y el consiguiente daño económico (165-168). Sequivity es una tecnología de vacuna de 3ª generación que emplea la tecnología de partículas de ARN de sequivity™, un sistema de vectores de replicón de alfavirus derivado de la cepa TC-83 atenuada de VEEV (45, 169, 170). No se ha demostrado que esta vacuna sea eficaz cuando se administra en presencia de anticuerpos maternos, pero induce una fuerte respuesta inmunitaria humoral y mediada por células en animales sin anticuerpos maternos (45, 171-173). Además, esta plataforma de vacunas permite la opción de «Prescripción Veterinaria» o vacunas personalizadas, similares a las vacunas autógenas, en las que se pueden producir formulaciones individualizadas, únicas o multivalentes caso por caso. En consecuencia, un ensayo de inmunogenicidad y eficacia que evaluó una vacuna H3 RP mostró que esta plataforma de vacuna provocó una respuesta serológica protectora dentro de las 3 semanas posteriores a la recepción de la vacuna de refuerzo, indujo una respuesta específica de IFN-γ, evitó la diseminación nasal detectable y el virus vivo dentro del líquido de lavado broncoalveolar y atenuó la enfermedad clínica (173).
Vacunas bovinas
Fiebre aftosa: vacuna Adt.A24 contra la fiebre aftosa
La fiebre aftosa es causada por un aftovirus altamente contagioso que se transmite entre ungulados de pezuña hendida. El virus es miembro de la familia Picornaviridae y puede transmitirse a través de gotitas de aerosol, contacto directo y/o por ingestión de animales susceptibles. En promedio, se pierden 11 mil millones de dólares (USD) por año en los países donde prevalece la fiebre aftosa (174). El devastador impacto económico mundial de la fiebre aftosa ha acelerado la investigación de vacunas contra la fiebre aftosa utilizando tecnologías novedosas. De interés, incluye la vacuna Adt.A24 contra la fiebre aftosa, a la que el Departamento de Agricultura de los Estados Unidos (USDA) concedió una licencia condicional para proteger al ganado en 2012 (175). La vacuna Adt.A24 de replicación deficiente utiliza una construcción de adenovirus humano como vector para administrar cápsidas vacías de la cepa A24 FMD para provocar una respuesta inmune (175). Estudios previos en bovinos y porcinos han demostrado que la vacuna Adt.A24 previene la fiebre aftosa, junto con la viremia de la fiebre aftosa 7 días después de la vacunación inicial, y es más eficaz cuando se combina con el adyuvante ENABL (176, 177). Esta vacuna no tiene reversión a la virulencia, no se excreta de las vacunas a animales naïve, no se excretan en la leche del ganado lechero lactante y confirió una eficacia del 64% contra la fiebre aftosa clínica (178, 179). Por último, la vacuna Adt.A24 permite el uso de una estrategia DIVA para evaluar los rebaños durante un brote.®
Herpesvirus bovino tipo 1 – Bovilis IBR Marker Live, Hiprabovis IBR Marker Live, Bayovac IBR Marker Vivum, Bayovac IBR Marker Inactivatum, Rispoval IBR-Marker Inactivado, Rispoval IBR-Marker Live®®®®
El ganado infectado con el virus del herpes bovino tipo 1 (BoHV-1) corre el riesgo de desarrollar rinotraqueítis infecciosa bovina (IBR), una enfermedad aguda y altamente contagiosa que afecta al tracto respiratorio superior (180). Además, la infección por BoHV-1 también puede afectar la fertilidad, la reproducción y la productividad. Bovilis IBR Marker Live, Hiprabovis IBR Marker Live, Bayovac IBR Marker Vivum, Bayovac IBR Marker Inactivatum, Rispoval IBR-Marker inactivado y Rispoval IBR-Marker live son vacunas autorizadas para su uso en bovinos contra BoHV-1. Todas estas vacunas IBR tienen la deleción gE-; el marcador IBR de Hipravovis en vivo también tiene la eliminación tk-. Una desventaja de la utilización de algunos de estos productos gE vivos modificados es el potencial de latencia en animales inmunizados y la consiguiente reactivación o excreción después de un estado inmunosupresor provocado (181, 182). Se ha demostrado que las vacunas inactivadas con deleción de gE redujeron la excreción viral de manera más eficiente que las vacunas vivas con deleción de gE en animales infectados latentemente inducidos a un estado inmunosupresor (183). No obstante, estas vacunas marcadoras administradas por vía intramuscular o por vía intramuscular inducen una respuesta inmunitaria humoral y celular robusta, lo que las hace versátiles y valiosas (184). Se ha demostrado que Bovilis IBR Marker Live prohíbe la secreción nasal, previene la viremia, provoca una respuesta inmune humoral en el ganado preñado hasta al menos 180 días después del parto y proporciona inmunidad pasiva a los terneros hasta al menos 180 días después del parto (185, 186).®®®®®
Vacunas para aves de corral
Influenza aviar: Trovac-AIV H5, VectormuneAI®®
Los virus de la influenza aviar (AIV) son patógenos importantes tanto para la producción avícola como para la salud humana. Los AIV son virus de ARN monocatenario de sentido negativo de la familia Orthomyxoviridae y se clasifican como altamente patógenos o de baja patogenicidad en las especies aviares. Trovac-AIV H5 (TROVAC-H5), producido por Boehringer-Ingelheim, contiene una columna vertebral viva recombinante vectorizada por viruela aviar que expresa un aislado de subtipo H5 de HA generado sintéticamente a partir de una proteína de AIV HA altamente patógena y alterada para imitar un virus de baja patogenicidad. Cuando se administró una dosis única a pollitos de 1 día de edad, la duración de la inmunidad duró al menos 20 semanas, proporcionando una protección significativa y rápida, especialmente en condiciones de campo (187, 188). Es importante destacar que esta vacuna no fue eficaz contra animales preinmunizados o infectados con viruela aviar, ya que la protección contra los niveles de AIV disminuyó (189).®
Vectormune AI de CEVA Animal Health, utiliza una proteína aviar HA IAV sintética similar insertada en la columna vertebral de un herpesvirus del pavo (HVT). La vacunación confirió una protección sólida y duradera en las parvadas comerciales, previno el desarrollo de enfermedades clínicas y suprimió la diseminación de la influenza aviar de alta patogenicidad (190, 191).®
Enfermedad de Newcastle: Innovax-ND, Vectormune FP-ND®®
La enfermedad de Newcastle (ND) es una enfermedad vírica de las aves de corral domésticas, incluidos pollos, pavos, palomas, faisanes, patos y gansos, de importancia mundial (192). El agente infeccioso, el virus de la enfermedad de Newcastle (VEN) o paramixovirus aviar serotipo 1, es un virus de ARN monocatenario altamente contagioso y de sentido negativo de la familia Paramyxoviridae. La transmisión del VEN puede ocurrir por inhalación o por ingestión de alimentos o agua contaminados, a través de las secreciones y excrementos de aves infectadas, y puede propagarse rápidamente a través de la parvada. Al igual que el virus de la influenza aviarina, el VEN se puede clasificar además en función de su virulencia, como velogénico (altamente patógeno), mesogénico (patogenicidad moderada) o lentegénico (subclínico o avirulento). Las cepas velogénicas causan enfermedad respiratoria aguda acompañada de signos nerviosos y alta mortalidad que en lotes susceptibles puede acercarse al 100% (193, 194).
ND ha visto avances en tecnologías de vacunas comerciales similares a AIV. Innovax-ND, de Merck, inserta la proteína Fusion (F), un gen fuertemente inmunogénico del VEN en un vector HVT. Al igual que con cualquier vector HVT, los animales vacunados desarrollaron una fuerte inmunidad contra la DM, pero lo más importante es que desarrollaron protección contra el desafío letal con el VEN (195). Un desarrollo más reciente y novedoso en las vacunas contra la ND es Vectormune FP-ND de Ceva, que también utiliza un vector viral, sin embargo, en este caso se trata de la viruela aviar.®
Enfermedad infecciosa de la bursa, Mareks, enfermedad y laringotraqueítis infecciosa: Innovax ND-IBD, Innovax ND-ILT®®
La bursitis infecciosa (EII) es causada por un virus de ADN bicatenario (IBDv) de la familia Birnaviridae. La EII es una enfermedad altamente infecciosa de pollos y pavos domésticos jóvenes, caracterizada por inmunosupresión y atrofia de la bolsa debido a la depleción de los linfocitos B. Si bien en la mayoría de los casos, la morbilidad relacionada con la EII es alta y la mortalidad es baja, ciertas cepas altamente virulentas pueden causar hasta un 60% de mortalidad (196, 197). Mientras que el IBDv se dirige a los linfocitos B, el virus de la enfermedad de Marek (MDV), también llamado alfaherpesvirus 2 o herpesvirus gallid 2, se alimenta principalmente de los linfocitos T CD4. El MDV es un virus linfotrópico altamente oncogénico de distribución mundial que causa enfermedad linfoproliferativa en pollos. La enfermedad de Marek se caracteriza por parálisis debido a la presencia generalizada de linfomas de células T localizados en los nervios periféricos y en los órganos viscerales (198). Otra enfermedad herpesviral importante de las aves de corral es la laringotraqueítis infecciosa (ILT), que es causada por el alfaherpesvirus aviar 1 o herpesvirus gallid 1. El virus ILT (ILTv) es un virus de ADN bicatenario que se transmite a las aves a través de aerosoles y fómites. La ILT es una enfermedad de las vías respiratorias superiores que causa pérdidas económicas significativas debido a la alta tasa de mortalidad (hasta el 70%) (199).+
El método tradicional de inmunización contra la distrofia muscular es a través de una vacuna viva vectorizada por el virus del herpes del pavo, ya que la HVT es subclínica en aves de corral y proporciona anticuerpos fuertemente reactivos cruzados contra la distrofia muscular. Este estilo de vacunas recombinantes multiprotectoras se ha popularizado, ya que Merck ha producido múltiples variantes basadas en esta tecnología. Innovax ND-IBD utiliza el vector HVT, modificado para incluir el gen F del NDV y el gen de glicorpteína de superficie VP2 del IBDv. Cuando se les desafió, los animales exhibieron protección contra el VEN, el IBDV y, por supuesto, el MDV hasta por 60 semanas (200). Otro ejemplo es Innovax ND-ILT, que proporciona protección contra NDV e ILTV. Este FPV recombinante se ha editado para incluir el gen F y el gen HN del VND, así como el gen gB de ILTV. La construcción HN del VEN codifica las proteínas hemaglutinina/neuraminidasa, mientras que el gen gB de ILTV codifica el antígeno primario de la glicoproteína de superficie. Los resultados de los ensayos de vacunas mostraron aproximadamente un 70% de protección contra la ILTV, comparable a la vacuna inactivada tradicional, además de neutralizar la inmunidad contra el VEN (201).®®
Acuicultura
Vacunas de salmónidos
Necrosis hematopoyética infecciosa: IHN ápice
En la industria de la acuicultura, las vacunas de ADN han tenido más éxito que otros campos y siguen siendo un campo importante de desarrollo (202). Como se indicó anteriormente, las vacunas de ADN en sí mismas son inmunogénicas y funcionan como PAMPS y, por lo tanto, eliminan la necesidad de adyuvantes (203). Una de las principales ventajas de esta tecnología en peces es evitar los adyuvantes que históricamente se ha demostrado que causan reacciones graves, como la peritonitis y la melanización del tejido muscular en los peces (204, 205). Apex IHN de Novartis (ahora Elanco Animal Health) fue desarrollado para vacunar contra el Virus de la Necrosis Hematopoyética Infecciosa (IHNV), un rabdovirus que causa una necrosis extensa del tejido hematopoyético en las primeras etapas de la vida y tiene una alta mortalidad entre los salmónidos (206). Esta enfermedad puede afectar tanto a los salmónidos silvestres como a los de piscifactoría, lo que resulta en grandes pérdidas económicas. Apex IHN es una vacuna de ADN que codifica la glicoproteína (G), un antígeno importante para los anticuerpos protectores. Dada la IM, esta vacuna induce respuestas inmunitarias tanto innatas como adaptativas en los peces y ha conferido una protección significativa en el salmón del Atlántico, el salmón del Pacífico y la trucha arco iris (207-213). La vacunación con Apex IHN confiere una tasa de mortalidad significativamente atenuada (<3% en animales vacunados y 99% en animales de control), reduce la propagación viral entre el salmón del Atlántico ingenuo que cohabita con el salmón del Atlántico infectado, suprime la transmisión de la enfermedad entre el salmón del Atlántico infectado que cohabita con salmón rojo ingenuo e induce un título de anticuerpos neutralizantes de larga duración (214).
Enfermedad del páncreas – Clynav
Clynav, producida por Elanco Animal Health, es otra vacuna de ADN recombinante que contiene el plásmido puK-SPDV-poly2#1 y codifica varias proteínas del alfavirus del salmónido subtipo 3. Esta vacuna ha sido aprobada en la UE y Noruega y está indicada para proteger contra la enfermedad del páncreas. Esta enfermedad tiene una carga económica significativa debido a la mortalidad, la reducción de las tasas de crecimiento y la reducción de la calidad de la carne en el momento del sacrificio (215). Afortunadamente, Clynav protege contra la pérdida de peso, reduce la prevalencia y la gravedad de las lesiones morfológicas del tejido en el cardias, el páncreas y el músculo esquelético, y reduce la mortalidad hasta 1 año después de la vacunación. Además, en comparación con una vacuna monovalente tradicional, Clynav proporcionó títulos de anticuerpos neutralizantes significativamente más altos, confirió una viremia más baja, redujo la transmisión a los peces naïve que cohabitaban y confirió un aumento de peso significativamente mayor después del desafío (216). La principal crítica a estas vacunas de ADN es la tasa de incorporación en los sujetos vacunados. Si bien la tasa de incorporación es insignificante, no se ha estimado con precisión de acuerdo con los fabricantes, sino que se ha modelado en escenarios que estiman la integración (217).
Animales exóticos
Vida silvestre
Rabia: ONRAB, RaboralV-RG®®
Durante los últimos 50 años ha habido un esfuerzo significativo para erradicar el virus de la rabia de los animales de compañía domésticos mediante el establecimiento de programas de vacunación obligatorios. Actualmente, la atención se ha centrado en las especies de vida silvestre que son críticas para la prevalencia de esta enfermedad mortal y su transmisión a los humanos. Según el informe anual de los Centros para el Control y la Prevención de Enfermedades (CDC, por sus siglas en inglés) sobre la vigilancia de la rabia en los Estados Unidos durante 2017, el 91% de los casos de rabia involucraron animales salvajes, principalmente murciélagos, mapaches, zorrillos y zorros (218). Esto pone de relieve la importancia del desarrollo de diferentes estructuras vacunales para controlar e incluso eliminar la transmisión de la rabia mediante la inmunización de las principales especies de fauna silvestre reservorio más susceptibles. Estados Unidos, Canadá y Europa han establecido un programa de vacunación oral contra la rabia (ORV, por sus siglas en inglés), para prevenir la propagación de la rabia a mapaches, zorros, coyotes, lobos y otras especies que pueden servir como reservorios de la rabia.
Se han utilizado dos tipos de vacunas recombinantes que expresan la glicoproteína de la rabia en cebos orales para prevenir esta enfermedad zoonótica. Onrab de Artemis Technologies Inc. (Guelph, Ontario, Canadá) emplea una vacuna vectorizada con adenovirus humano tipo 5 (Had5). Raboral V-RG utiliza un virus vaccinia como columna vertebral. Los cebos ORV son producidos por Merial Ltd (Atenas, GA) y consisten en un paquete comestible que contiene el Raboral V-RG. La administración de esta vacuna ha permitido la erradicación del rabdovirus zoonótico en 3 países europeos (219). Esto se debe a la mayor eficacia de la vacuna en zorros rojos, que son las principales especies reservorio del continente (220, 221). El objetivo principal de este programa de vacunación es conferir un título positivo neutralizante superior a 0,05 UI/ml a los animales objetivo. Todos los zorros vacunados, el 56% de los coyotes y el 62% de los zorros grises han mostrado títulos de suero protectores después de la administración de los cebos ORV (220-222). Sin embargo, otros animales mesocarnívoros como los mapaches y los zorrillos, que se consideran los principales portadores de la rabia en los EE. UU., han demostrado una eficacia variable en su inmunización utilizando cebos ORV (223-225). Se ha demostrado que la vacuna Onrab induce una mejor protección en los mapaches al inducir una respuesta humoral en el 74-77% de los animales, en lugar del 30% de seropositividad alcanzado después de la administración de los cebos ORV (226, 227).®®®®
Lagomorfos
Enfermedad hemorrágica del conejo – Novibac Myxo-RHD y Novibac Myxo-RHD Plus
El agente etiológico de la enfermedad hemorrágica del conejo (RHD) es un Calicivirus altamente virulento que es enzoótico en las poblaciones de conejos de todo el mundo, causando epidemias frecuentes con una tasa de mortalidad significativa de hasta el 90% en conejos mayores de 5 semanas (127, 228). Otro patógeno importante de esta especie animal es el virus Myxoma, que es un miembro del género Leporipoxvirus. La mixomatosis es una enfermedad aguda, sistémica y a menudo mortal de los conejos europeos caracterizada por blefaroconjuntivitis, hinchazón en los ojos, la piel y los genitales, apatía y anorexia (229).
Nobivac Myxo-RHD es una vacuna bivalente quimérica viva que utiliza un vector viral Myxoma que expresa la proteína de la cápside VP60 de la cepa viral clásica 009 RHD. Nobivac Myxo-RHD Plus contiene un segundo virus de Myxoma recombinante con la proteína VP60 de la variante emergente MK 1899 (230). Nobivac Myxo-RHD confiere una protección significativa contra ambos patógenos durante 12 meses después de la administración de una sola dosis. En un estudio de inmunización, todos los animales vacunados seroconvertidos mostraron una fuerte respuesta humoral contra el RHDV, que es esencial para la prevención de esta enfermedad viral en los animales desafiados (231).®®®
Discusión
Históricamente, las vacunas en medicina humana han seguido la estela de la medicina veterinaria, ya que hay muy pocas vacunas aprobadas de segunda y tercera generación en medicina humana. La vacuna contra la hepatitis B fue el primer ejemplo de vacuna sintética desarrollada utilizando tecnología de ADN recombinante y fue autorizada en 1986; Hemophilus influenza B (HIB), la primera vacuna conjugada, fue autorizada para uso médico en 1987; La vacuna tetravalente contra el dengue, cuyo nombre comercial es Dengvaxia, utiliza una vacuna tetravalente viva atenuada que consiste en proteínas quiméricas del dengue combinadas con los genes no estructurales de la cepa de la vacuna contra la fiebre amarilla 17D. La vacuna rVSV-ZEBOV contra el Ébola Zaire, aprobada en 2019, es una vacuna viva recombinante contra el ébola competente para la replicación viral que consiste en una columna vertebral del virus de la estomatitis vesicular con la glicoproteína envolvente del virus del Ébola Zaire en lugar de la glicoproteína envolvente del VSV. Se aprueba un esquema de vacunación heteróloga de 2 dosis con las vacunas Zabdeno (Ad26.ZEBOV) y Mvabea contra el Ébola (MVA-BN-Filo) para su uso en la UE. Zabdeno es la vacuna principal y es un vector de adenovirus tipo 26 que expresa la glicoproteína de la variante Mayinga del virus del Ébola. MBA-BN-Filo sirve como refuerzo de la inmunización y es una vacuna no replicante, recombinante y modificada basada en vectores vaccinia Ankara (MVA) que codifica glicoproteínas del virus del Ébola de Zaire, el virus de Sudán, el virus de Marburgo y la nucleoproteína del virus del bosque de Tai, respectivamente (232).
A finales de 2020, el Reino Unido se convirtió en el primer país soberano en aprobar Tozinameran INN, una vacuna de ARN mensajero (coproducida por Pfizer y BioNTech) indicada para la prevención de la infección por SARS-CoV-2, el agente responsable de la pandemia de COVID-19 (233). Este es el primer caso en el que una tecnología basada en genes ha sido autorizada y aprobada para un agente infeccioso. Desde entonces, y en medio de la pandemia, otras vacunas candidatas nuevas y de tercera generación han sido aprobadas para la Autorización de Uso de Emergencia (EUA) o se encuentran en las etapas finales para la solicitud de EUA. En el momento de escribir este artículo, estas candidatas incluyen la vacuna de ARNm de Moderna, mRNA-1273, y la vacuna vectorizada por adenovirus AZD1222 por AstraZeneca y la Universidad de Oxford (234, 235).
Continuando con la optimización de los sistemas de administración y para mejorar la inmunidad de las mucosas, los adyuvantes moleculares son cruciales para la sinergia del desarrollo de vacunas. Sin embargo, para mantenerse dentro del alcance de las nuevas tecnologías autorizadas en medicina veterinaria, los componentes antes mencionados solo se discutirán brevemente, ya que muchos aún se encuentran en etapas experimentales.
Una tecnología en la que la medicina humana ha precedido a la medicina veterinaria es el empleo de partículas similares a las virales (VLP). Las VLP no son infecciosas/carecen de material genético, complejos autoensamblables que contienen antígenos de interés e imitan la estructura general de un virus (236). La tecnología VLP ha tenido éxito, ya que activa la respuesta inmunitaria adaptativa a través de los complejos MHC-I y MHC-II y, en consecuencia, es capaz de estimular CTL robustos y células T auxiliares CD4+ (237). Las vacunas contra el virus del papiloma humano (Cervarix, Gardasil y Gardasil9) y el virus de la hepatitis B (Sci-B-Vac™) también utilizaron la tecnología recombinante ensamblada en una partícula similar al virus (VLP) (238).®®®
Las nanopartículas (NP), similares a las VLP, son una tecnología de administración revolucionaria ampliamente investigada para medicamentos terapéuticos y vacunas. Caracterizados por su tamaño (<100 nm), se ha demostrado que varios tipos de NP compuestos de oro, dendrímeros, polímeros de carbono y liposomas mejoran la eficacia de la vacuna, facilitan la absorción de antígenos e inducen las respuestas inmunológicas deseadas (239). Las NP ofrecen varias ventajas: pueden acceder directamente a los sistemas de drenaje linfático para el procesamiento inmunitario, pueden modificarse para dirigirse a subconjuntos específicos de células inmunitarias y pueden administrarse a compartimentos intracelulares específicos para perfeccionar vías inmunitarias específicas (240). Como tal, gran parte del éxito de la plataforma de vacunas de ARNm contra el SARS-CoV-2 fue el uso de NP lipídicas (241). No obstante, sigue existiendo una comprensión integral de cómo se pueden utilizar las NP para optimizar la administración de vacunas y actualmente se están explorando muchos candidatos experimentales de NP en ensayos clínicos para vacunas contra la influenza (NTC032293498, NCT3658629) y el virus respiratorio sincitial (NCT01960686, NCT02247726, NCT02624947) (240).
Algunas de las principales lagunas en el desarrollo de vacunas son la obtención de inmunidad de la mucosa mediante la inducción de IgA secretora y la estimulación inmunitaria adecuada del antígeno mediante adyuvantes. La gran mayoría de los patógenos ingresan a los huéspedes a través de los sitios mucosos, sin embargo, la mayoría de las vacunas actuales brindan protección parcial o nula en los sitios mucosos. En medicina veterinaria, las vacunas contra las mucosas han tenido más éxito, ya que las vacunas en aerosol y en el agua potable se utilizan de forma rutinaria, sin embargo, no existen vacunas humanas autorizadas para los patógenos transmitidos por la mucosa (242). La inmunidad de la mucosa inducida por la vacuna es particularmente difícil debido a la dificultad de proteger y preservar la integridad estructural del antígeno y aumentar la biodisponibilidad de las vacunas de la mucosa. Algunos experimentos han tenido éxito con el uso de formulaciones de nanopartículas mediante la incorporación de polietilenglicol (PEG) (243). El quitosano, un polímero no tóxico, también se ha utilizado en formaciones de vacunas contra Escherichia coli O157:H7 administradas por vía intranasal con un éxito similar (244). Los complejos inmunoestimulantes (ISCOM) son adyuvantes experimentales en forma de jaula esférica compuestos de fosfolípidos, colesterol, saponina y antígenos proteicos y han sido particularmente exitosos en inmunizaciones de mucosas que resultan en IgA secretora y respuestas inmunes sistémicas (245, 246). Esta tecnología se ha utilizado en la vacuna contra la influenza equina Equip ™ F (producida por Zoetis/Pfizer Animal Health), una vacuna de subunidad que ha demostrado estimular la inmunidad humoral y mediada por células (247, 248).
Una solución prometedora para combatir la inmunogenicidad deficiente, específicamente para las vacunas de ADN, son los adyuvantes moleculares. Estos generalmente comprenden moléculas de señalización codificadas por plásmidos, como citocinas, quimiocinas y moléculas coestimuladoras inmunes, pero los enfoques más nuevos incluyen la eliminación de genes y la biología de sistemas (249-251). Por ejemplo, la interleucina-2 (IL-2) promueve la diferenciación de las células T vírgenes en células efectoras y facilita la generación de células T de memoria (20). Por lo tanto, la IL-2 ha sido uno de los adyuvantes moleculares más estudiados y ha mostrado una mayor inmunogenicidad para vacunas previamente inmunogénicas bajas, como el VIH, la influenza y el SARS-CoV (252-255). Otras citocinas inmunomoduladoras que se están evaluando como adyuvantes moleculares son la IL-15, la IL-12 y la MG-CSF (250, 252).
La evolución de las tecnologías de las vacunas refleja el avance continuo y riguroso hacia vacunas seguras, eficaces, estables y rentables para patógenos infecciosos existentes y emergentes. La medicina veterinaria sigue abriendo caminos, como lo demuestran las numerosas tecnologías novedosas que ya se emplean.
Contribuciones de los autores
VA, VP, PN, JN y KM investigaron los datos para el artículo y contribuyeron sustancialmente a la discusión del contenido. VA, VP y SG redactaron y generaron cifras para el artículo. VA y CK escribieron, revisaron y editaron el manuscrito antes de su presentación. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Reconocimientos
El VA fue financiado a través del Programa Nacional de Capacitación de Científicos de Instalaciones Bio y Agro-δefense del Servicio de Inspección de Sanidad Animal y Vegetal (APHIS, por sus siglas en inglés) del Departamento de Agricultura de los Estados Unidos (USDA, por sus siglas en inglés). El trabajo en el laboratorio de los autores contó con el apoyo de los Centros de Excelencia para la Investigación y Vigilancia de la Influenza (CEIRS, por sus siglas en inglés) de los NIH/NIAID, por sus siglas en inglés), el contrato número HHSN272201400004C, y la Estación Experimental Agrícola de Alabama (AAES, por sus siglas en inglés) de la Universidad de Auburn.
Referencias
1. Riedel S. Edward Jenner and the history of smallpox and vaccination. Proc Bayl Univ Med Cent. (2005) 18:21–5. doi: 10.1080/08998280.2005.11928028
2. Lombard M, Pastoret PP, Moulin AM. A brief history of vaccines and vaccination. Rev Sci Tech. (2007) 26:29–48. doi: 10.20506/rst.26.1.1724
3. Tilly K, Rosa PA, Stewart PE. Biology of infection with Borrelia burgdorferi. Infect Dis Clin North Am. (2008) 22:217–34. doi: 10.1016/j.idc.2007.12.013
4. Pantaleo G, Koup RA. Correlates of immune protection in HIV-1 infection: what we know, what we don’t know, what we should know. Nat Med. (2004) 10:806–10. doi: 10.1038/nm0804-806
5. Arvin AM. Humoral and cellular immunity to varicella-zoster virus: an overview. J Infect Dis. (2008) 197(Suppl.2):S58–60. doi: 10.1086/522123
6. Hoft DF. Tuberculosis vaccine development: goals, immunological design, and evaluation. Lancet. (2008) 372:164–75. doi: 10.1016/S0140-6736(08)61036-3
7. Levin MJ, Oxman MN, Zhang JH, Johnson GR, Stanley H, Hayward AR, et al. Varicella-zoster virus-specific immune responses in elderly recipients of a herpes zoster vaccine. J Infect Dis. (2008) 197:825–35. doi: 10.1086/528696
8. Reyes-Sandoval A, Pearson FE, Todryk S, Ewer K. Potency assays for novel T-cell-inducing vaccines against malaria. Curr Opin Mol Ther. (2009) 11:72–80.
9. Pulendran B, Ahmed R. Immunological mechanisms of vaccination. Nat Immunol. (2011) 12:509–17. doi: 10.1038/ni.2039
10. Batista FD, Harwood NE. The who, how and where of antigen presentation to B cells. Nat Rev Immunol. (2009) 9:15–27. doi: 10.1038/nri2454
11. Lung P, Yang J, Li Q. Nanoparticle formulated vaccines: opportunities and challenges. Nanoscale. (2020) 12:5746–63. doi: 10.1039/C9NR08958F
12. Jiskoot W, Kersten GFA, Mastrobattista E, Slütter B. Vaccines. Pharmaceut Biotechnol Fundamental Appl. (2019) 14:281–304. doi: 10.1007/978-3-030-00710-2_14
13. Alberts BJA, Lewis J, Raff M, Roberts K, Walter P. Molecular Biology of the Cell. New York, NY: Garland Science (2002).
14. Belz GT, Carbone FR, Heath WR. Cross-presentation of antigens by dendritic cells. Crit Rev Immunol. (2002) 22:439–48. doi: 10.1615/CritRevImmunol.v22.i5-6.50
15. Szabo SJ, Sullivan BM, Peng SL, Glimcher LH. Molecular mechanisms regulating Th1 immune responses. Annu Rev Immunol. (2003) 21:713–58. doi: 10.1146/annurev.immunol.21.120601.140942
16. Kaiko GE, Horvat JC, Beagley KW, Hansbro PM. Immunological decision-making: how does the immune system decide to mount a helper T-cell response? Immunology. (2008) 123:326–38. doi: 10.1111/j.1365-2567.2007.02719.x
17. Bernink J, Mjösberg J, Spits H. Th1- and Th2-like subsets of innate lymphoid cells. Immunol Rev. (2013) 252:133–8. doi: 10.1111/imr.12034
18. Mesquita DJr, Cruvinel WM, Resende LS, Mesquita FV, Silva NP, Câmara NO, et al. Follicular helper T cell in immunity and autoimmunity. Braz J Med Biol Res. (2016) 49:e5209. doi: 10.1590/1414-431×20165209
19. Qin L, Waseem TC, Sahoo A, Bieerkehazhi S, Zhou H, Galkina EV, et al. Insights into the molecular mechanisms of T follicular helper-mediated immunity and pathology. Front Immunol. (2018) 9:1884. doi: 10.3389/fimmu.2018.01884
20. Janeway CAJPT, Mark W, Mark Shlomchik J. Immunobiology G.Science. 9th ed. Vol. 20 (2001). p. 445–86.
21. Meeusen EN, Walker J, Peters A, Pastoret PP, Jungersen G. Current status of veterinary vaccines. Clin Microbiol Rev. (2007) 20:489–510. doi: 10.1128/CMR.00005-07
22. Melnick JL. Advantages and disadvantages of killed and live poliomyelitis vaccines. Bull World Health Organ. (1978) 56:21–38.
23. Boyaka PN. Inducing mucosal IgA: a challenge for vaccine adjuvants and delivery systems. J Immunol. (2017) 199:9–16. doi: 10.4049/jimmunol.1601775
24. Blasco JM, Diaz R. Brucella melitensis Rev-1 vaccine as a cause of human brucellosis. Lancet. (1993) 342:805. doi: 10.1016/0140-6736(93)91571-3
25. Nielsen HS, Oleksiewicz MB, Forsberg R, Stadejek T, Botner A, Storgaard T. Reversion of a live porcine reproductive and respiratory syndrome virus vaccine investigated by parallel mutations. J Gen Virol. (2001) 82:1263–72. doi: 10.1099/0022-1317-82-6-1263
26. Brun A, Albina E, Barret T, Chapman DA, Czub M, Dixon LK, et al. Antigen delivery systems for veterinary vaccine development. Viral-vector based delivery systems. Vaccine. (2008) 26:6508–28. doi: 10.1016/j.vaccine.2008.09.044
27. Murti M, Krajden M, Petric M, Hiebert J, Hemming F, Hefford B, et al. Case of vaccine-associated measles five weeks post-immunisation, British Columbia, Canada, October 2013. Euro Surveill. (2013) 18:20649. doi: 10.2807/1560-7917.ES2013.18.49.20649
28. Arvas A. Vaccination in patients with immunosuppression. Turk pediatri arsivi. (2014) 49:181–5. doi: 10.5152/tpa.2014.2206
29. Ferraro B, Morrow MP, Hutnick NA, Shin TH, Lucke CE, Weiner DB. Clinical applications of DNA vaccines: current progress. Clin Infect Dis. (2011) 53:296–302. doi: 10.1093/cid/cir334
30. Small JC, Ertl HC. Viruses – from pathogens to vaccine carriers. Curr Opin Virol. (2011) 1:241–5. doi: 10.1016/j.coviro.2011.07.009
31. Doria-Rose NA, Haigwood NL. DNA vaccine strategies: candidates for immune modulation and immunization regimens. Methods. (2003) 31:207–16. doi: 10.1016/S1046-2023(03)00135-X
32. Li J, Chen H, Wu N, Fan D, Liang G, Gao N, et al. Characterization of immune responses induced by inactivated, live attenuated and DNA vaccines against Japanese encephalitis virus in mice. Vaccine. (2013) 31:4136–42. doi: 10.1016/j.vaccine.2013.06.099
33. Chapman R, Rybicki EP. Use of a novel enhanced DNA vaccine vector for preclinical virus vaccine investigation. Vaccines. (2019) 7:20050. doi: 10.3390/vaccines7020050
34. Mogensen TH. Pathogen recognition and inflammatory signaling in innate immune defenses. Clin Microbiol Rev. (2009) 22:240–73. doi: 10.1128/CMR.00046-08
35. Kyriakis CS. Tomorrow’s vector vaccines for small ruminants. Vet Microbiol. (2015) 181:47–52. doi: 10.1016/j.vetmic.2015.08.003
36. Sahin U, Karikó K, Türeci Ö. mRNA-based therapeutics — developing a new class of drugs. Nat Rev Drug Discov. (2014) 13:759–80. doi: 10.1038/nrd4278
37. Lee J, Arun S, Kumar Jhan YY, Bishop CJ. Engineering DNA vaccines against infectious diseases. Acta Biomater. (2018) 80:31–47. doi: 10.1016/j.actbio.2018.08.033
38. Eric R, Miller NL, Paul C. Miller – Fowler’s Zoo and Wild Animal Medicine Current Therapy Volume 9 E-Book. St. Lous, Missouri: Elsevier. (2019).
39. Smith GL, Murphy BR, Moss B. Construction and characterization of an infectious vaccinia virus recombinant that expresses the influenza hemagglutinin gene and induces resistance to influenza virus infection in hamsters. Proc Natl Acad Sci USA. (1983) 80:7155–9. doi: 10.1073/pnas.80.23.7155
40. Kieny MP, Lathe R, Drillien R, Spehner D, Skory S, Schmitt D, et al. Expression of rabies virus glycoprotein from a recombinant vaccinia virus. Nature. (1984) 312:163–6. doi: 10.1038/312163a0
41. Paoletti E. Applications of pox virus vectors to vaccination: an update. Proc Natl Acad Sci USA. (1996) 93:11349–53. doi: 10.1073/pnas.93.21.11349
42. Draper SJ, Cottingham MG, Gilbert SC. Utilizing poxviral vectored vaccines for antibody induction-progress and prospects. Vaccine. (2013) 31:4223–30. doi: 10.1016/j.vaccine.2013.05.091
43. Kreijtz JH, Gilbert SC, Sutter G. Poxvirus vectors. Vaccine. (2013) 31:4217–9. doi: 10.1016/j.vaccine.2013.06.073
44. Xiang ZQ, Yang Y, Wilson JM, Ertl HC. A replication-defective human adenovirus recombinant serves as a highly efficacious vaccine carrier. Virology. (1996) 219:220–7. doi: 10.1006/viro.1996.0239
45. Rayner JO, Dryga SA, Kamrud KI. Alphavirus vectors and vaccination. Rev Med Virol. (2002) 12:279–96. doi: 10.1002/rmv.360
46. Pushko P, Parker M, Ludwig GV, Davis NL, Johnston RE, Smith JF. Replicon-helper systems from attenuated Venezuelan equine encephalitis virus: expression of heterologous genes in vitro and immunization against heterologous pathogens in vivo. Virology. (1997) 239:389–401. doi: 10.1006/viro.1997.8878
47. Capua I, Cattoli G. Diagnosing avian influenza infection in vaccinated populations by systems for differentiating infected from vaccinated animals (DIVA). Dev Biol. (2007) 130:137−43.
48. Suarez D. DIVA vaccination strategies for avian influenza virus. Avian Dis. (2012) 56:836–44. doi: 10.1637/10207-041512-Review.1
49. Kinker DR, Swenson SL, Wu LL, Zimmerman JJ. Evaluation of serological tests for the detection of pseudorabies gE antibodies during early infection. Vet Microbiol. (1997) 55:99–106. doi: 10.1016/S0378-1135(96)01308-9
50. Sykes JESDC. Pseudorabies, an overview. In: Canine and Feline Infectious Diseases. St. Louis, MI: Elseveir Inc. (2014). p. 258–60. doi: 10.1016/B978-1-4377-0795-3.00025-9
51. Freuling CM, Muller TF, Mettenleiter TC. Vaccines against pseudorabies virus (PrV). Vet Microbiol. (2017) 206:3–9. doi: 10.1016/j.vetmic.2016.11.019
52. Pardo MC, Bauman JE, Mackowiak M. Protection of dogs against canine distemper by vaccination with a canarypox virus recombinant expressing canine distemper virus fusion and hemagglutinin glycoproteins. Am J Vet Res. (1997) 58:833–6.
53. Larson LJ, Schultz RD. Effect of vaccination with recombinant canine distemper virus vaccine immediately before exposure under shelter-like conditions. Vet Ther. (2006) 7:113–8.
54. Shultz RD. A comparison of immunosuppressive effects of canine vaccines on lymphocyte responses to mitogens. In: Proceedings. 85th Annual Meeting of the CRWAD. Chicago, IL (2004).
55. Pardo MC, Tanner P, Bauman J, Silver K, Fischer L. Immunization of puppies in the presence of maternally derived antibodies against canine distemper virus. J Comp Pathol. (2007) 137(Suppl.1):S72–5. doi: 10.1016/j.jcpa.2007.04.015
56. Larson LJ, Schultz RD. Effect of vaccination with recombinant canine distemper virus vaccine immediately before exposure under shelter-like conditions. Vet Ther. (2006) 7:113–8.
57. Larson LJ, Schultz RD. Three-year duration of immunity in dogs vaccinated with a canarypox-vectored recombinant canine distemper virus vaccine. Vet Ther. (2007) 8:101–6.
58. Larson LJ, Schultz RD. Three-year serologic immunity against canine parvovirus type 2 and canine adenovirus type 2 in dogs vaccinated with a canine combination vaccine. Vet Ther. (2007) 8:305-10.
59. Coke RL, Backues KA, Hoover JP, Saliki JT, Ritchey JW, West GD. Serologic responses after vaccination of fennec foxes (Vulpes zerda) and meerkats (Suricata suricatta) with a live, canarypox-vectored canine distemper virus vaccine. J Zoo Wildl Med. (2005) 36:326–30. doi: 10.1638/04-039.1
60. Mead PS. Epidemiology of Lyme disease. Infect Dis Clin North Am. (2015) 29:187–210. doi: 10.1016/j.idc.2015.02.010
61. Summers BAAFS, Jacobson RH, Chang Y-F, Appel MJG, Straubinger RK. Histopathological studies of experimental Lyme disease in the dog. J Comp Pathol. (2005) 133:1–13. doi: 10.1016/j.jcpa.2004.11.006
62. Nowling JM, Philipp MT. Killing of Borrelia burgdorferi by antibody elicited by OspA vaccine is inefficient in the abscence of complement. Infect Immun. (1999) 67:443–5. doi: 10.1128/IAI.67.1.443-445.1999
63. Wilske B, Busch U, Fingerle V, Jauris-Heipke S, Preac V, Mursic Rossler D, et al. Immunological and molecular variability of OspA and OspImplications, C. for Borrelia vaccine development. Infection. (1996) 24:208–12. doi: 10.1007/BF01713341
64. Lovrich SD, Jobe DA, Schell RF, Callister SM. Borreliacidal OspC antibodies specific for a highly conserved epitope are immunodominant in human lyme disease and do not occur in mice or hamsters. Clin Diagn Lab Immunol. (2005) 12:746–51. doi: 10.1128/CDLI.12.6.746-751.2005
65. LaFleur RL, Dant JC, Wasmoen TL, Callister SM, Jobe DA, Lovrich SD, et al. Bacterin that induces anti-OspA and anti-OspC borreliacidal antibodies provides a high level of protection against canine Lyme disease. Clin Vaccine Immunol. (2009) 16:253–9. doi: 10.1128/CVI.00373-08
66. LaFleur RL, Callister SM, Dant JC, Jobe DA, Lovrich SD, Warner TF, et al. One-year duration of immunity induced by vaccination with a canine Lyme disease bacterin. Clin Vaccine Immunol. (2010) 17:870–4. doi: 10.1128/CVI.00524-09
67. Ball EC. VANGUARD (R) crLyme: chimeric recombinant vaccine technology for broad-spectrum protection against canine Lyme disease. Zoetis Technical Bullet. (2015) 193:1-6.
68. Marconi RT, Honsberger N, Teresa M, Winkler Sobell N, King VL, Wappel S, et al. Field safety study of VANGUARD(R)crLyme: a vaccine for the prevention of Lyme disease in dogs. Vaccine X. (2020) 6:100080. doi: 10.1016/j.jvacx.2020.100080
69. Grosenbaugh DA, De Luca K, Durand PY, Feilmeier B, DeWitt K, Sigoillot-Claude C, et al. Characterization of recombinant OspA in two different Borrelia vaccines with respect to immunological response and its relationship to functional parameters. BMC Vet Res. (2018) 14:312. doi: 10.1186/s12917-018-1625-7
70. Dantas-Torres F, Miro G, Baneth G, Bourdeau P, Breitschwerdt E, Capelli G, et al. Canine leishmaniasis control in the context of one health. Emerg Infect Dis. (2019) 25:1–4. doi: 10.3201/eid2512.190164
71. Oliva G, Nieto J, Foglia Manzillo V, Cappiello S, Fiorentino E, Di Muccio T, et al. A randomised, double-blind, controlled efficacy trial of the LiESP/QA-21 vaccine in naive dogs exposed to two leishmania infantum transmission seasons. PLoS Negl Trop Dis. (2014) 8:e3213. doi: 10.1371/journal.pntd.0003213
72. Petitdidier E, Pagniez J, Papierok G, Vincendeau P, Lemesre JL, Bras-Goncalves R. Recombinant forms of leishmania amazonensis excreted/secreted promastigote surface antigen (PSA) induce protective immune responses in dogs. PLoS Negl Trop Dis. (2016) 10:e0004614. doi: 10.1371/journal.pntd.0004614
73. Moreno J, Vouldoukis I, Martin V, McGahie D, Cuisinier AM, Gueguen S. Use of a LiESP/QA-21 vaccine (CaniLeish) stimulates an appropriate Th1-dominated cell-mediated immune response in dogs. PLoS Negl Trop Dis. (2012) 6:e1683. doi: 10.1371/journal.pntd.0001683
74. Martin V, Vouldoukis I, Moreno J, McGahie D, Gueguen S, Cuisinier AM. The protective immune response produced in dogs after primary vaccination with the LiESP/QA-21 vaccine (CaniLeish(R)) remains effective against an experimental challenge one year later. Vet Res. (2014) 45:69. doi: 10.1186/1297-9716-45-69
75. Moreno J, Vouldoukis I, Schreiber P, Martin V, McGahie D, Gueguen S, et al. Primary vaccination with the LiESP/QA-21 vaccine (CaniLeish) produces a cell-mediated immune response which is still present 1 year later. Vet Immunol Immunopathol. (2014) 158:199–207. doi: 10.1016/j.vetimm.2014.01.011
76. Fernandez Cotrina J, Iniesta V, Monroy I, Baz V, Hugnet C, Maranon F, et al. A large-scale field randomized trial demonstrates safety and efficacy of the vaccine LetiFend(R) against canine leishmaniosis. Vaccine. (2018) 36:1972–82. doi: 10.1016/j.vaccine.2018.02.111
77. Moafi M, Rezvan H, Sherkat R, Taleban R. Leishmania vaccines entered in clinical trials: a review of literature. Int J Prev Med. (2019) 10:95. doi: 10.4103/ijpvm.IJPVM_116_18
78. Regina-Silva S, Feres AM, Franca-Silva JC, Dias ES, Michalsky EM, de Andrade HM, et al. Field randomized trial to evaluate the efficacy of the Leish-Tec(R) vaccine against canine visceral leishmaniasis in an endemic area of Brazil. Vaccine. (2016) 34:2233–9. doi: 10.1016/j.vaccine.2016.03.019
79. Grimaldi G Jr, Teva A, Dos-Santos CB, Santos FN, Pinto ID, Fux B, et al. Field trial of efficacy of the Leish-tec(R) vaccine against canine leishmaniasis caused by Leishmania infantum in an endemic area with high transmission rates. PLoS ONE. (2017) 12:e0185438. doi: 10.1371/journal.pone.0185438
80. Fernandes CB, Junior JT, de Jesus C, Souza BM, Larangeira DF, Fraga DB, et al. Comparison of two commercial vaccines against visceral leishmaniasis in dogs from endemic areas: IgG, and subclasses, parasitism, and parasite transmission by xenodiagnosis. Vaccine. (2014) 32:1287–95. doi: 10.1016/j.vaccine.2013.12.046
81. Toepp A, Larson M, Wilson G, Grinnage-Pulley T, Bennett CA, Leal-Lima B, et al. Randomized, controlled, double-blinded field trial to assess Leishmania vaccine effectiveness as immunotherapy for canine leishmaniosis. Vaccine. (2018) 36:6433–41. doi: 10.1016/j.vaccine.2018.08.087
82. Testasicca MC, dos Santos MS, Machado LM, Serufo AV, Doro D, Avelar D, et al. Antibody responses induced by Leish-Tec(R), an A2-based vaccine for visceral leishmaniasis, in a heterogeneous canine population. Vet Parasitol. (2014) 204:169–76. doi: 10.1016/j.vetpar.2014.04.025
83. Cacheiro-Llaguno C, Parody N, Renshaw-Calderon A, Osuna C, Alonso C, Carnes J. Vaccination with LetiFend(R) reduces circulating immune complexes in dogs experimentally infected with L. infantum. Vaccine. (2019) 38:890–6 doi: 10.1016/j.vaccine.2019.10.078
84. Molano I, Alonso MG, Miron C, Redondo E, Requena JM, Soto M, et al. A Leishmania infantum multi-component antigenic protein mixed with live BCG confers protection to dogs experimentally infected with L. infantum. Vet Immunol Immunopathol. (2003) 92:1–13. doi: 10.1016/S0165-2427(02)00315-X
85. Carcelén J, Iniesta V, Fernández-Cotrina J, Serrano F, Parejo JC, Corraliza I, et al. The Chimerical Multi-Component Q protein from Leishmania in the absence of adjuvant protects dogs against an experimental Leishmania infantum infection. Vaccine. (2009) 27:5964–73. doi: 10.1016/j.vaccine.2009.07.069
86. Gradoni L. Canine Leishmania vaccines: still a long way to go. Vet Parasitol. (2015) 208:94–100. doi: 10.1016/j.vetpar.2015.01.003
87. Chhetri BK, Berke O, Pearl DL, Bienzle D. Comparison of the geographical distribution of feline immunodeficiency virus and feline leukemia virus infections in the United States of America (2000-2011). BMC Vet Res. (2013) 9:2. doi: 10.1186/1746-6148-9-2
88. Poulet H, Brunet S, Boularand C, Guiot AL, Leroy V, Tartaglia J, et al. Efficacy of a canarypox virus-vectored vaccine against feline leukaemia. Vet Rec. (2003) 153:141–5. doi: 10.1136/vr.153.5.141
89. Schlecht-Louf G, Mangeney M, El-Garch H, Lacombe V, Poulet H, Heidmann T. A targeted mutation within the feline leukemia virus (FeLV) envelope protein immunosuppressive domain to improve a canarypox virus-vectored FeLV vaccine. J Virol. (2014) 88:992–1001. doi: 10.1128/JVI.02234-13
90. Tandon R, Cattori V, Gomes-Keller MA, Meli ML, Golder MC, Lutz H, et al. Quantitation of feline leukaemia virus viral and proviral loads by TaqMan real-time polymerase chain reaction. J Virol Methods. (2005) 130:124–32. doi: 10.1016/j.jviromet.2005.06.017
91. El garch H, Richard S, Piras F, Leard T, Poulet H, Andreoni C, et al. Feline leukemia virus (FeLV)- specific IFNγ+ T-cell responses are induced in cats following transdermal vaccination with a recombinant FeLV vaccine. J Appl Res Vet Med. (2006) 4:100–8.
92. Grosenbaugh DA, Frances-Duvert V, Abedi S, Feilmeier B, Ru H, Poulet H. Efficacy of a nonadjuvanted recombinant FeLV vaccine and two inactivated FeLV vaccines when subject to consistent virulent FeLV challenge conditions. Biologicals. (2017) 49:76–80. doi: 10.1016/j.biologicals.2016.10.004
93. Jas D, Frances-Duvert V, Vernes D, Guigal PM, Poulet H. Three-year duration of immunity for feline herpesvirus and calicivirus evaluated in a controlled vaccination-challenge laboratory trial. Vet Microbiol. (2015) 177:123–31. doi: 10.1016/j.vetmic.2015.03.009
94. Singh R, Singh KP, Cherian S, Saminathan M, Kapoor S, Manjunatha Reddy GB, et al. Rabies – epidemiology, pathogenesis, public health concerns and advances in diagnosis and control: a comprehensive review. Vet Q. (2017) 37:212–51. doi: 10.1080/01652176.2017.1343516
95. Taylor J, Meignier B, Tartaglia J, Languet B, VanderHoeven J, Franchini G, et al. Biological and immunogenic properties of a canarypox-rabies recombinant, ALVAC-RG (vCP65) in non-avian species. Vaccine. (1995) 13:539–49. doi: 10.1016/0264-410X(94)00028-L
96. Jas D, Coupier C, Toulemonde CE, Guigal PM, Poulet H. Three-year duration of immunity in cats vaccinated with a canarypox-vectored recombinant rabies virus vaccine. Vaccine. (2012) 30:6991–6. doi: 10.1016/j.vaccine.2012.09.068
97. Doddy FD, Glickman LT, Glickman NW, Janovitz EB. Feline fibrosarcomas at vaccination sites and non-vaccination sites. J Comparat Pathol. (1996) 114:165–74. doi: 10.1016/S0021-9975(96)80005-3
98. Soboll G, Hussey SB, Minke JM, Landolt GA, Hunter JS, Jagannatha S, et al. Onset and duration of immunity to equine influenza virus resulting from canarypox-vectored (ALVAC) vaccination. Vet Immunol Immunopathol. (2010) 135:100–7. doi: 10.1016/j.vetimm.2009.11.007
99. Gildea S, Arkins S, Walsh C, Cullinane A. A comparison of antibody responses to commercial equine influenza vaccines following primary vaccination of Thoroughbred weanlings–a randomised blind study. Vaccine. (2011) 29:9214–23. doi: 10.1016/j.vaccine.2011.09.101
100. Edlund Toulemonde C, Daly J, Sindle T, Guigal PM, Audonnet JC, Minke JM. Efficacy of a recombinant equine influenza vaccine against challenge with an American lineage H3N8 influenza virus responsible for the 2003 outbreak in the United Kingdom. Vet Rec. (2005) 156:367–71. doi: 10.1136/vr.156.12.367
101. Minke JM, El-Hage CM, Tazawa P, Homer D, Lemaitre L, Cozette V, et al. Evaluation of the response to an accelerated immunisation schedule using a canarypox-vectored equine influenza vaccine, shortened interdose intervals and vaccination of young foals. Aust Vet J. (2011) 89(Suppl.1):137–9. doi: 10.1111/j.1751-0813.2011.00767.x
102. Dilai M, Piro M, El Harrak M, Fougerolle S, Dehhaoui M, Dikrallah A, et al. Impact of mixed equine influenza vaccination on correlate of protection in horses. Vaccines. (2018) 6:40071. doi: 10.3390/vaccines6040071
103. Gildea S, Quinlivan M, Murphy BA, Cullinane A. Humoral response and antiviral cytokine expression following vaccination of thoroughbred weanlings–a blinded comparison of commercially available vaccines. Vaccine. (2013) 31:5216–22. doi: 10.1016/j.vaccine.2013.08.083
104. Johnston LJ, Halliday GM, King NJ. Langerhans cells migrate to local lymph nodes following cutaneous infection with an arbovirus. J Invest Dermatol. (2000) 114:560–8. doi: 10.1046/j.1523-1747.2000.00904.x
105. Mackenzie JS, Gubler DJ, Petersen LR. Emerging flaviviruses: the spread and resurgence of Japanese encephalitis, West Nile and dengue viruses. Nat Med. (2004) 10(12 Suppl.):S98–109. doi: 10.1038/nm1144
106. Mehlhop E, Whitby K, Oliphant T, Marri A, Engle M, Diamond MS. Complement activation is required for induction of a protective antibody response against West Nile virus infection. J Virol. (2005) 79:7466–77. doi: 10.1128/JVI.79.12.7466-7477.2005
107. El Garch H, Minke JM, Rehder J, Richard S, Edlund C, Toulemonde Dinic S, et al. A West Nile virus (WNV) recombinant canarypox virus vaccine elicits WNV-specific neutralizing antibodies and cell-mediated immune responses in the horse. Vet Immunol Immunopathol. (2008) 123:230–9. doi: 10.1016/j.vetimm.2008.02.002
108. Tardei G, Ruta S, Chitu V, Rossi C, Tsai TF, Cernescu C. Evaluation of immunoglobulin M (IgM) and IgG enzyme immunoassays in serologic diagnosis of West Nile Virus infection. J Clin Microbiol. (2000) 38:2232–9. doi: 10.1128/JCM.38.6.2232-2239.2000
109. Diamond MS, Sitati EM, Friend LD, Higgs S, Shrestha B, Engle M. A critical role for induced IgM in the protection against West Nile virus infection. J Exp Med. (2003) 198:1853–62. doi: 10.1084/jem.20031223
110. De Filette M, Ulbert S, Diamond MS, Sanders NN. Recent progress in West Nile virus diagnosis and vaccination. Vet Res. (2012) 43:16. doi: 10.1186/1297-9716-43-16
111. Shrestha B, Wang T, Samuel MA, Whitby K, Craft J, Fikrig E, et al. Gamma interferon plays a crucial early antiviral role in protection against West Nile virus infection. J Virol. (2006) 80:5338. doi: 10.1128/JVI.00274-06
112. Minke JM, Siger L, Karaca K, Austgen L, Gordy P, Bowen R, et al. Recombinant canarypoxvirus vaccine carrying the prM/E genes of West Nile virus protects horses against a West Nile virus-mosquito challenge. Arch Virol Suppl. (2004) 18:221–30. doi: 10.1007/978-3-7091-0572-6_20
113. Siger L, Bowen RA, Karaca K, Murray MJ, Gordy PW, Loosmore SM, et al. Assessment of the efficacy of a single dose of a recombinant vaccine against West Nile virus in response to natural challenge with West Nile virus-infected mosquitoes in horses. Am J Vet Res. (2004) 65:1459–62. doi: 10.2460/ajvr.2004.65.1459
114. Davis BS, Chang GJ, Cropp B, Roehrig JT, Martin DA, Mitchell CJ, et al. West Nile virus recombinant DNA vaccine protects mouse and horse from virus challenge and expresses in vitro a noninfectious recombinant antigen that can be used in enzyme-linked immunosorbent assays. J Virol. (2001) 75:4040–7. doi: 10.1128/JVI.75.9.4040-4047.2001
115. Dunn MD, Rossi SL, Carter DM, Vogt MR, Mehlhop E, Diamond MS, et al. Enhancement of anti-DIII antibodies by the C3d derivative P28 results in lower viral titers and augments protection in mice. Virol J. (2010) 7:95. doi: 10.1186/1743-422X-7-95
116. Amanna IJ, Slifka MK. Current trends in West Nile virus vaccine development. Expert Rev Vaccines. (2014) 13:589–608. doi: 10.1586/14760584.2014.906309
117. Frey J. Virulence in Actinobacillus pleuropneumoniae and RTX toxins. Trends Microbiol. (1995) 3:257–61. doi: 10.1016/S0966-842X(00)88939-8
118. Blackall PJ, Klaasen HL, van den Bosch H, Kuhnert P, Frey J. Proposal of a new serovar of Actinobacillus pleuropneumoniae: serovar 15. Vet Microbiol. (2002) 84:47–52. doi: 10.1016/S0378-1135(01)00428-X
119. Chiers K, van Overbeke I, De Laender P, Ducatelle R, Carel S, Haesebrouck F. Effects of endobronchial challenge with Actinobacillus pleuropneumoniae serotype 9 of pigs vaccinated with inactivated vaccines containing the Apx toxins. Vet Q. (1998) 20:65–9. doi: 10.1080/01652176.1998.9694841
120. Cruijsen T, van Leengoed LA, Kamp EM, Bartelse A, Korevaar A, Verheijden JH. Susceptibility to Actinobacillus pleuropneumoniae infection in pigs from an endemically infected herd is related to the presence of toxin-neutralizing antibodies. Vet Microbiol. (1995) 47:219–28. doi: 10.1016/0378-1135(95)00109-3
121. Sjolund M, Wallgren P. Field experience with two different vaccination strategies aiming to control infections with Actinobacillus pleuropneumoniae in a fattening pig herd. Acta Vet Scand. (2010) 52:23. doi: 10.1186/1751-0147-52-23
122. Del Pozo Sacristán R, Michiels A, Martens M, Haesebrouck F, Maes D. Efficacy of vaccination against Actinobacillus pleuropneumoniae in two Belgian farrow-to-finish pig herds with a history of chronic pleurisy. Vet Rec. (2014) 174:302. doi: 10.1136/vr.101961
123. Tumamao JQ, Bowles RE, van den Bosch H, Klaasen HL, Fenwick BW, Storie GJ, et al. Comparison of the efficacy of a subunit and a live streptomycin-dependent porcine pleuropneumonia vaccine. Aust Vet J. (2004) 82:370–4. doi: 10.1111/j.1751-0813.2004.tb11108.x
124. Van Overbeke I, Chiers K, Ducatelle R, Haesebrouck F. Effect of endobronchial challenge with Actinobacillus pleuropneumoniae serotype 9 of pigs vaccinated with a vaccine containing Apx toxins and transferrin-binding proteins. J Vet Med B Infect Dis Vet Public Health. (2001) 48:15–20. doi: 10.1046/j.1439-0450.2001.00419.x
125. Rosell C, Segales J, Plana-Duran J, Balasch M, Rodriguez-Arrioja GM, Kennedy S, et al. Pathological, immunohistochemical, and in-situ hybridization studies of natural cases of postweaning multisystemic wasting syndrome (PMWS) in pigs. J Comp Pathol. (1999) 120:59–78. doi: 10.1053/jcpa.1998.0258
126. Olvera A, Cortey M, Segales J. Molecular evolution of porcine circovirus type 2 genomes: phylogeny and clonality. Virology. (2007) 357:175–85. doi: 10.1016/j.virol.2006.07.047
127. Maclachlan James NaEJD. Fener’s Veterinary Virology. London: Academic Press; Elsevier Academic Press (2010).
128. Felberbaum RS. The baculovirus expression vector system: a commercial manufacturing platform for viral vaccines and gene therapy vectors. Biotechnol J. (2015) 10:702–14. doi: 10.1002/biot.201400438
129. Gillespie J, Opriessnig T, Meng XJ, Pelzer K, Buechner-Maxwell V. Porcine circovirus type 2 and porcine circovirus-associated disease. J Vet Intern Med. (2009) 23:1151–63. doi: 10.1111/j.1939-1676.2009.0389.x
130. Roof Michael B, Eichmeyer Marc Allan HPWU, Gregory Paul N, Merrill Lynn S. Use of a PCV2 immunogenic composition for lessening clinical symptoms in pigs. BIVI. US-9987349-B2. St. Joseph, MO (2018). Available online at: https://patentimages.storage.googleapis.com/16/19/b1/31636a686043fd/US9987349.pdf
131. Fenaux M, Opriessnig T, Halbur PG, Elvinger F, Meng XJ. A chimeric porcine circovirus (PCV) with the immunogenic capsid gene of the pathogenic PCV type 2 (PCV2) cloned into the genomic backbone of the nonpathogenic PCV1 induces protective immunity against PCV2 infection in pigs. J Virol. (2004) 78:6297–303. doi: 10.1128/JVI.78.12.6297-6303.2004
132. Seo HW, Oh Y, Han K, Park C, Chae C. Reduction of porcine circovirus type 2 (PCV2) viremia by a reformulated inactivated chimeric PCV1-2 vaccine-induced humoral and cellular immunity after experimental PCV2 challenge. BMC Vet Res. (2012) 8:194. doi: 10.1186/1746-6148-8-194
133. Hemann M, Beach NM, Meng XJ, Wang C, Halbur PG, Opriessnig T. A live-attenuated and an inactivated chimeric porcine circovirus (PCV)1-2 vaccine are both effective at inducing a humoral immune response and reducing PCV2 viremia and intrauterine infection in female swine of breeding age. Can J Vet Res. (2014) 78:8–16.
134. Hoblet KH, Miller GY, Bartter NG. Economic assessment of a pseudorabies epizootic, breeding herd removal/repopulation, and downtime in a commercial swine herd. J Am Vet Med Assoc. (1987) 190:405–9.
135. International I. Procilis Begonia Intervet International. Boxmeer (2002).
136. Pensaert M, Labarque G, Favoreel H, Nauwynck H. Aujeszky’s disease vaccination and differentiation of vaccinated from infected pigs. Dev Biol. (2004) 119:243–54.
137. Zeng T, Torrents WJ, Martinez D, Pedrazuela CR. Vaccination with PRV vaccine (AUSKIPRA (R) GN; Bartha k61 strain), reduced virus shedding when challenge against Chinese PRV variant (AH02 strain). In: APVS Congress, Manila. (2015).
138. Zeng T, Torrents WJ, Martinez D, Pedrazuela CR, Gale I. PRV vaccine AUSKIPRA GN (A3 solvent; Bartha k61 strain) provide quick and strong protection against Chinese PRV variant. In: APVS, Manila. (2015).®
139. Szweda Wea. The role of vaccinations using deleted vaccines in decreasing the spread of Aujeszky’s disease virus in pig farms covered within the» vaccination-eradication programme. Medycyna Weterynaryjna. (2000) 56.4:229–34.
140. Quilitis MTD, Torres I, Bautista C, Magcalas J, Maldonado J, Llopart D. Retrospective study on the prevalence of Aujeszky’s disease in major pig producing provinces in the Philippines (2006-2010). In: IPVS, Korea. (2012).
141. Risatti GR, Borca MV, Kutish GF, Lu Z, Holinka LG, French RA, et al. The E2 glycoprotein of classical swine fever virus is a virulence determinant in swine. J Virol. (2005) 79:3787–96. doi: 10.1128/JVI.79.6.3787-3796.2005
142. Borca MV, Holinka LG, Ramirez-Medina E, Risatti GR, Vuono EA, Berggren KA, et al. Identification of structural glycoprotein E2 domain critical to mediate replication of Classical Swine Fever Virus in SK6 cells. Virology. (2019) 526:38–44. doi: 10.1016/j.virol.2018.10.004
143. Luo Y, Li S, Sun Y, Qiu H-J. Classical swine fever in China: a minireview. Vet Microbiol. (2014) 172:1–6. doi: 10.1016/j.vetmic.2014.04.004
144. Blome S, Staubach C, Henke J, Carlson J, Beer M. Classical swine fever-an updated review. Viruses. (2017) 9:40086. doi: 10.3390/v9040086
145. Brown VR, Bevins SN. A Review of classical swine fever virus and routes of introduction into the United States and the potential for virus establishment. Front Vet Sci. (2018) 5:31. doi: 10.3389/fvets.2018.00031
146. Reimann I, Depner K, Trapp S, Beer M. An avirulent chimeric Pestivirus with altered cell tropism protects pigs against lethal infection with classical swine fever virus. Virology. (2004) 322:143–57. doi: 10.1016/j.virol.2004.01.028
147. Hulst MM, Moormann RJ. Inhibition of pestivirus infection in cell culture by envelope proteins E(rns) and E2 of classical swine fever virus: E(rns) and E2 interact with different receptors. J Gen Virol. (1997) 78:2779–87. doi: 10.1099/0022-1317-78-11-2779
148. Blome S, Wernike K, Reimann I, König P, Moß C, Beer M. A decade of research into classical swine fever marker vaccine CP7_E2alf (Suvaxyn CSF Marker): a review of vaccine properties. Vet Res. (2017) 48:51. doi: 10.1186/s13567-017-0457-y®
149. Koenig P, Lange E, Reimann I, Beer M. CP7_E2alf: A safe and efficient marker vaccine strain for oral immunisation of wild boar against Classical swine fever virus (CSFV). Vaccine. (2007) 25:3391–9. doi: 10.1016/j.vaccine.2006.12.052
150. Xia H, Harimoorthy R, Vijayaraghavan B, Blome S, Widen F, Beer M, et al. Differentiation of classical swine fever virus infection from CP7_E2alf marker vaccination by a multiplex microsphere immunoassay. Clin Vaccine Immunol. (2015) 22:65–71. doi: 10.1128/CVI.00271-14
151. Renson P, Le M, Dimna Keranflech A, Cariolet R, Koenen F, Le Potier MF. CP7_E2alf oral vaccination confers partial protection against early classical swine fever virus challenge and interferes with pathogeny-related cytokine responses. Vet Res. (2013) 44:9. doi: 10.1186/1297-9716-44-9
152. Gabriel C, Blome S, Urniza A, Juanola S, Koenen F, Beer M. Towards licensing of CP7_E2alf as marker vaccine against classical swine fever—duration of immunity. Vaccine. (2012) 30:2928–36. doi: 10.1016/j.vaccine.2012.02.065
153. Cox MMJ. Recombinant protein vaccines produced in insect cells. Vaccine. (2012) 30:1759–66. doi: 10.1016/j.vaccine.2012.01.016
154. Ahrens U, Kaden V, Drexler C, Visser N. Efficacy of the classical swine fever (CSF) marker vaccine Porcilis Pesti in pregnant sows. Vet Microbiol. (2000) 77:83–97. doi: 10.1016/S0378-1135(00)00265-0®
155. Depner KR, Bouma A, Koenen F, Klinkenberg D, Lange E, de H, et al. Classical swine fever (CSF) marker vaccine: Trial IChallenge, I. study in pregnant sows. Vet Microbiol. (2001) 83:107–20. doi: 10.1016/S0378-1135(01)00410-2
156. Vlasova AN, Marthaler D, Wang Q, Culhane MR, Rossow KD, Rovira A, et al. Distinct characteristics and complex evolution of PEDV strains, North America, May 2013-February 2014. Emerg Infect Dis. (2014) 20:1620–8. doi: 10.3201/eid2010.140491
157. Antas M, Wozniakowski G. Current status of porcine epidemic diarrhoea (PED) in European Pigs. J Vet Res. (2019) 63:465–70. doi: 10.2478/jvetres-2019-0064
158. Li S, Yang J, Zhu Z, Zheng H. Porcine epidemic diarrhea virus and the host innate immune response. Pathogens. (2020) 9:50367. doi: 10.3390/pathogens9050367
159. Chang SH, Bae JL, Kang TJ, Kim J, Chung GH, Lim CW, et al. Identification of the epitope region capable of inducing neutralizing antibodies against the porcine epidemic diarrhea virus. Mol Cells. (2002) 14:295–9.
160. Bosch BJ, van der Zee R, de Haan CA, Rottier PJ. The coronavirus spike protein is a class I virus fusion protein: structural and functional characterization of the fusion core complex. J Virol. (2003) 77:8801–11. doi: 10.1128/JVI.77.16.8801-8811.2003
161. Mogler MA, Gander JR, Ray DD, Harris DLH. Vaccination of PEDV-naive dams with a replicon RNA particle vaccine protects suckling piglets from challenge. In: PRSS PED Symposium Poster Presentation (Ames, IA). (2014).
162. Vander Veen RL, Harris DL, Kamrud KI. Alphavirus replicon vaccines. Anim Health Res Rev. (2012) 13:1–9. doi: 10.1017/S1466252312000011
163. Crawford K, Lager K, Kulshreshtha V, Miller L, Faaberg K. Status of vaccines for porcine epidemic diarrhea virus in the United States and Canada. Virus Res. (2016) 226:108–16. doi: 10.1016/j.virusres.2016.08.005
164. Greiner L, Connor J, Graham A, Mellor J, Lowe J. Evaluation of a PED vaccine on piglet mortality and sow immunity. In: 46th Proceedings of the 2015 Meeting of the American Association of Swine Veterinarians Orlando, Florida. (2015).
165. Ma W, Lager KM, Vincent AL, Janke BH, Gramer MR, Richt JA. The role of swine in the generation of novel influenza viruses. Zoonoses Public Health. (2009) 56:326–37. doi: 10.1111/j.1863-2378.2008.01217.x
166. Kyriakis CS, Brown IH, Foni E, Kuntz-Simon G, Maldonado J, Madec F, et al. Virological surveillance and preliminary antigenic characterization of influenza viruses in pigs in five European countries from 2006 to 2008. Zoonoses Public Health. (2011) 58:93–101. doi: 10.1111/j.1863-2378.2009.01301.x
167. Nelson MI, Viboud C, Vincent AL, Culhane MR, Detmer SE, Wentworth DE, et al. Global migration of influenza A viruses in swine. Nat Commun. (2015) 6:6696. doi: 10.1038/ncomms7696
168. Kyriakis CS, Zhang M, Wolf S, Jones LP, Shim BS, Chocallo AH, et al. Molecular epidemiology of swine influenza A viruses in the Southeastern United States, highlights regional differences in circulating strains. Vet Microbiol. (2017) 211:174–9. doi: 10.1016/j.vetmic.2017.10.016
169. Strauss JH, Strauss EG. The alphaviruses: gene expression, replication, and evolution. Microbiol Rev. (1994) 58:491–562. doi: 10.1128/MR.58.3.491-562.1994
170. Hooper JW, Ferro AM, Golden JW, Silvera P, Dudek J, Alterson K, et al. Molecular smallpox vaccine delivered by alphavirus replicons elicits protective immunity in mice and non-human primates. Vaccine. (2009) 28:494–511. doi: 10.1016/j.vaccine.2009.09.133
171. Bosworth B, Erdman MM, Stine DL, Harris I, Irwin C, Jens M, et al. Replicon particle vaccine protects swine against influenza. Comp Immunol Microbiol Infect Dis. (2010) 33:e99–103. doi: 10.1016/j.cimid.2010.05.002
172. Erdman MM, Kamrud KI, Harris DL, Smith J. Alphavirus replicon particle vaccines developed for use in humans induce high levels of antibodies to influenza virus hemagglutinin in swine: proof of concept. Vaccine. (2010) 28:594–6. doi: 10.1016/j.vaccine.2009.10.015
173. Vander Veen RL, Loynachan AT, Mogler MA, Russell BJ, Harris DL, Kamrud KI. Safety, immunogenicity, and efficacy of an alphavirus replicon-based swine influenza virus hemagglutinin vaccine. Vaccine. (2012) 30:1944–50. doi: 10.1016/j.vaccine.2012.01.030
174. Knight-Jones TJ, Rushton J. The economic impacts of foot and mouth disease – what are they, how big are they and where do they occur? Prev Vet Med. (2013) 112:161–73. doi: 10.1016/j.prevetmed.2013.07.013
175. Grubman MJea. Adenovirus serotype 5-vectored foot-and-mouth diseaes subunit vaccines: the first decade. Futur Virol. (2010) 5:51–64. doi: 10.2217/fvl.09.68
176. Shutta Cea. Mutliple efficacy studies of an adenovirus-vectored foot-and-mouth disease virus serotype A24 subunit vaccine in cattle using homologous challenge. Vaccine. (2016) 34:3214–20. doi: 10.1016/j.vaccine.2015.12.018
177. Change SHea. Use of ENABLE(R) Adjuvant to increase the potency of an adenovirus-vectored foot-and-mouth disease virus serotype A subunit. Vaccine. (2018) 36:1078–84. doi: 10.1016/j.vaccine.2018.01.026
178. Barrera J, Brake DA, Kamicker BJ, Purcell C, Kaptur R Jr, Schieber T, et al. Safety profile of a replication-deficient human adenovirus-vectored foot-and-mouth disease virus serotype A24 subunit vaccine in cattle. Transbound Emerg Dis. (2018) 65:447–55. doi: 10.1111/tbed.12724
179. Neilan JG, Schutta C, Barrera J, Pisano M, Zsak L, Hartwig E, et al. Efficacy of an adenovirus-vectored foot-and-mouth disease virus serotype A subunit vaccine in cattle using a direct contact transmission model. BMC Vet Res. (2018) 14:254. doi: 10.1186/s12917-018-1582-1
180. Engels M, Ackermann M. Pathogenesis of ruminant herpesvirus infections. Vet Microbiol. (1996) 53:3–15. doi: 10.1016/S0378-1135(96)01230-8
181. Castrucci G, Frigeri F, Salvatori D, Ferrari M, Dico ML, Rotola A, et al. A study on latency in calves by five vaccines against bovine herpesvirus-1 infection. Comp Immunol Microbiol Infect Dis. (2002) 25:205–15. doi: 10.1016/S0147-9571(02)00014-0
182. Petrini S, Iscaro C, Righi C. Antibody responses to bovine alphaherpesvirus 1 (BoHV-1) in passively immunized calves. Viruses. (2019) 11:10023. doi: 10.3390/v11010023
183. Bosch JC, Kaashoek MJ, van Oirschot JT. Inactivated bovine herpesvirus 1 marker vaccines are more efficacious in reducing virus excretion after reactivation than a live marker vaccine. Vaccine. (1997) 15:1512–7. doi: 10.1016/S0264-410X(97)00092-3
184. Kerkhofs P, Renjifo X, Toussaint JF, Letellier C, Vanopdenbosch E, Wellemans G. Enhancement of the immune response and virological protection of calves against bovine herpesvirus type 1 with an inactivated gE-deleted vaccine. Vet Rec. (2003) 152:681–6. doi: 10.1136/vr.152.22.681
185. Makoschey B, Beer M. A live bovine herpesvirus-1 marker vaccine is not shed after intramuscular vaccination. Berl Munch Tierarztl Wochenschr. (2007) 120:480–2.
186. Petrini S, Righi C, Iscaro C, Viola G, Gobbi P, Scoccia E, et al. Evaluation of passive immunity induced by immunisation using two inactivated gE-deleted marker vaccines against infectious bovine rhinotracheitis (IBR) in calves. Vaccines. (2020) 8:10014. doi: 10.3390/vaccines8010014
187. Webster RG, Taylor J, Pearson J, Rivera E, Paoletti E. Immunity to Mexican H5N2 avian influenza viruses induced by a fowl pox-H5 recombinant. Avian Dis. (1996) 40:461–5. doi: 10.2307/1592246
188. Swayne DE, Beck JR, Mickle TR. Efficacy of recombinant fowl poxvirus vaccine in protecting chickens against a highly pathogenic Mexican-origin H5N2 avian influenza virus. Avian Dis. (1997) 41:910–22. doi: 10.2307/1592346
189. Swayne DE, Beck JR, Kinney N. Failure of a recombinant fowl poxvirus vaccine containing an avian influenza hemagglutinin gene to provide consistent protection against influenza in chickens preimmunized with a fowl pox vaccine. Avian Dis. (2000) 44:132–7. doi: 10.2307/1592516
190. Kilany W, Dauphin G, Selim A, Tripodi A, Samy M, Sobhy H, et al. Protection conferred by recombinant turkey herpesvirus avian influenza (rHVT-H5) vaccine in the rearing period in two commercial layer chicken breeds in Egypt. Avian Pathol. (2014) 43:514–23. doi: 10.1080/03079457.2014.966302
191. Palya V, Tatar-Kis T, Walkone E, Kovacs Kiss I, Homonnay Z, Gardin Y, et al. Efficacy of a recombinant turkey herpesvirus AI (H5) vaccine in preventing transmission of heterologous highly pathogenic H5N8 Clade 2.3.4.4b challenge virus in commercial broilers and layer pullets. J Immunol Res. (2018) 2018:3143189. doi: 10.1155/2018/3143189
192. Rahman AU, Habib M, Shabbir MZ. Adaptation of Newcastle Disease Virus (NDV) in feral birds and their potential role in interspecies transmission. Open Virol J. (2018) 12:52–68. doi: 10.2174/1874357901812010052
193. Dortmans JC, Koch G, Rottier PJ, Peeters BP. Virulence of Newcastle disease virus: what is known so far? Vet Res. (2011) 42:122. doi: 10.1186/1297-9716-42-122
194. Abdisa T, Tagesu T. Review on Newcastle disease of poultry and its public health importance. J Vet Sci Technol. (2017) 8:441. doi: 10.4172/2157-7579.1000441
195. Morgan RW, Gelb JJr, Schreurs CS, Lutticken D, Rosenberger JK, Sondermeijer PJ, et al. Protection of chickens from Newcastle and Marek’s diseases with a recombinant herpesvirus of turkeys vaccine expressing the Newcastle disease virus fusion protein. Avian Dis. (1992) 36:858–70. doi: 10.2307/1591544
196. Jeon WJ, Lee EK, Joh SJ, Kwon JH, Yang CB, Yoon YS, et al. Very virulent infectious bursal disease virus isolated from wild birds in Korea: epidemiological implications. Virus Res. (2008) 137:153–6. doi: 10.1016/j.virusres.2008.06.013
197. Dey S, Pathak DC, Ramamurthy N, Maity HK, Chellappa MM. Infectious bursal disease virus in chickens: prevalence, impact, and management strategies. Vet Med. (2019) 10:85–97. doi: 10.2147/VMRR.S185159
198. Jarosinski KW, Tischer BK, Trapp S, Osterrieder N. Marek’s disease virus: lytic replication, oncogenesis and control. Expert Rev Vaccines. (2006) 5:761–72. doi: 10.1586/14760584.5.6.761
199. Gowthaman V, Kumar S, Koul M, Dave U, Murthy T, Munuswamy P, et al. Infectious laryngotracheitis: etiology, epidemiology, pathobiology, and advances in diagnosis and control – a comprehensive review. Vet Q. (2020) 40:140–61. doi: 10.1080/01652176.2020.1759845
200. van Hulten MCW, Cruz-Coy J, Gergen L, Pouwels H, ten Dam GB, Verstegen I, et al. Efficacy of a turkey herpesvirus double construct vaccine (HVT-ND-IBD) against challenge with different strains of Newcastle disease, infectious bursal disease and Marek’s disease viruses. Avian Pathol. (2021) 50:18–30. doi: 10.1080/03079457.2020.1828567
201. Sun HL, Wang YF, Tong GZ, Zhang PJ, Miao DY, Zhi HD, et al. Protection of chickens from Newcastle disease and infectious laryngotracheitis with a recombinant fowlpox virus co-expressing the F, HN genes of Newcastle disease virus and gB gene of infectious laryngotracheitis virus. Avian Dis. (2008) 52:111–7. doi: 10.1637/7998-041807-Reg
202. Chang C-J. Immune sensing of DNA and strategies for fish DNA vaccine development. Fish Shellfish Immunol. (2020) 101:252–60. doi: 10.1016/j.fsi.2020.03.064
203. Kobiyama K, Jounai N, Aoshi T, Tozuka M, Takeshita F, Coban C, et al. Innate immune signaling by, and genetic adjuvants for DNA vaccination. Vaccines. (2013) 1:278–92. doi: 10.3390/vaccines1030278
204. Skinner LA, Schulte PM, LaPatra SE, Balfry SK, McKinley RS. Growth and performance of Atlantic salmon, Salmo salar L., following administration of a rhabdovirus DNA vaccine alone or concurrently with an oil-adjuvanted, polyvalent vaccine. J Fish Dis. (2008) 31:687–97. doi: 10.1111/j.1365-2761.2008.00945.x
205. Thim HL, Villoing S, McLoughlin M, Christie KE, Grove S, Frost P, et al. Vaccine adjuvants in fish vaccines make a difference: comparing three adjuvants (montanide ISA763A Oil, CpG/Poly I:C Combo and VHSV Glycoprotein) alone or in combination formulated with an inactivated whole salmonid alphavirus antigen. Vaccines. (2014) 2:228–51. doi: 10.3390/vaccines2020228
206. Salonius K, Simard N, Harland R, Ulmer J. The road to licensure of a DNA vaccine. Curr Opin Investigat Drugs. (2007) 8:635-41.
207. Corbeil S, Lapatra SE, Anderson ED, Jones J, Vincent B, Hsu YL, et al. Evaluation of the protective immunogenicity of the N, P, M, NV and G proteins of infectious hematopoietic necrosis virus in rainbow trout oncorhynchus mykiss using DNA vaccines. Dis Aquat Organ. (1999) 39:29–36. doi: 10.3354/dao039029
208. Traxler GS, Anderson E, LaPatra SE, Richard J, Shewmaker B, Kurath G. Naked DNA vaccination of Atlantic salmon Salmo salar against IHNDis, V. Aquat Organ. (1999) 38:183–90. doi: 10.3354/dao038183
209. Corbeil S, LaPatra SE, Anderson ED, Kurath G. Nanogram quantities of a DNA vaccine protect rainbow trout fry against heterologous strains of infectious hematopoietic necrosis virus. Vaccine. (2000) 18:2817–24. doi: 10.1016/S0264-410X(00)00078-5
210. Lorenzen N, Lorenzen E, Einer-Jensen K, LaPatra SE. Immunity induced shortly after DNA vaccination of rainbow trout against rhabdoviruses protects against heterologous virus but not against bacterial pathogens. Dev Comp Immunol. (2002) 26:173–9. doi: 10.1016/S0145-305X(01)00059-3
211. Garver KA, LaPatra SE, Kurath G. Eficacia de una vacuna de ADN contra el virus de la necrosis hematopoyética infecciosa (IHN) en Chinook Oncorhynchus tshawytscha y sockeye nerka, O. salmon. Órgano Dis Aquat. (2005) 64:13–22. doi: 10.3354/dao064013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
212. Purcell MK, Nichols KM, Winton JR, Kurath G, Thorgaard GH, Wheeler P, et al. Perfil completo de expresión génica después de la vacunación por ADN de la trucha arco iris contra el virus de la necrosis hematopoyética infecciosa. Mol Immunol. (2006) 43:2089–106. doi: 10.1016/j.molimm.2005.12.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
213. Holvold LB, Myhr AI, Dalmo RA. Estrategias y obstáculos en el uso de vacunas de ADN para pescar. Res. Veterinaria. (2014) 45:21. doi: 10.1186/1297-9716-45-21
Resumen de PubMed | Texto completo de CrossRef | Google Académico
214. Long A, Richard J, Hawley L, LaPatra SE, Garver KA. Potencial de transmisión del virus de la necrosis hematopoyética infecciosa en salmón del Atlántico vacunado con APEX-IHN(R). Órgano Dis Aquat. (2017) 122:213–21. doi: 10.3354/dao03076
Resumen de PubMed | Texto completo de CrossRef | Google Académico
215. Jansen M, Bang B, Jensen McLoughlin M, Rodger H, Taksdal T, Sindre H, et al. La epidemiología de la enfermedad del páncreas en la acuicultura de salmónidos: un resumen del estado actual del conocimiento. J Fish Dis. (2016) 40:12478. doi: 10.1111/jfd.12478
Resumen de PubMed | Texto completo de CrossRef | Google Académico
216. Thorarinsson R, Wolf JC, Inami M, Phillips L, Jones G, Macdonald AM, et al. Efecto de una nueva vacuna de ADN contra la enfermedad del páncreas causada por el alfavirus del salmónido subtipo 3 en el salmón del Atlántico (Salmo salar). Pescados y mariscos Immunol. (2021) 108:116–26. doi: 10.1016/j.fsi.2020.12.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
217. Seguridad alimentaria europea A, Houston R, Moxon S, Nogué Papadopoulou F, Ramon N, Waigmann M, et al. Evaluación de la potencial integración de la vacuna de plásmidos de ADN CLYNAV en el genoma del salmón. EFSA J. (2017) 15:e04689. doi: 10.2903/j.efsa.2017.4689
Resumen de PubMed | Texto completo de CrossRef | Google Académico
218. Brett Petersen W, Ryan Wallace M, Jesse Blanton D. Vigilancia de la rabia en los Estados Unidos durante 2017. J Am Vet Medical Assoc. (2018) 253:1555–68. doi: 10.2460/javma.253.12.1555
Resumen de PubMed | Texto completo de CrossRef | Google Académico
219. Maki J, Guiot AL, Aubert M, Brochier B, Cliquet F, Hanlon CA, et al. Vacunación oral de fauna silvestre con una vacuna contra el virus recombinante vaccinia-rabia-glicoproteína (RABORAL V-RG((R))): una revisión global. Res. Veterinaria. (2017) 48:57. doi: 10.1186/s13567-017-0459-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
220. Blancou J, Kieny MP, Torno R, Lecocq JP, Pastoret PP, Soulebot JP, et al. Vacunación oral del zorro contra la rabia utilizando un virus vaccinia vivo recombinante. Naturaleza. (1986) 322:373–5. doi: 10.1038/322373a0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
221. Tolson ND, Charlton KM, Casey GA, Knowles MK, Rupprecht CE, Lawson KF, et al. Inmunización de zorros contra la rabia con un virus vaccinia recombinante que expresa la glicoproteína de la rabia. Arch Virol. (1988) 102:297–301. doi: 10.1007/BF01310835
222. Sidwa TJ, Wilson PJ, Moore GM, Oertli EH, Hicks BN, Rohde RE, et al. Evaluation of oral rabies vaccination programs for control of rabies epizootics in coyotes and gray foxes, 1995–2003. J Am Vet Med Assoc. (2005) 227:785–92. doi: 10.2460/javma.2005.227.785
223. Rupprecht CE, Wiktor TJ, Johnston DH, Hamir AN, Dietzschold B, Wunner WH, et al. Oral immunization and protection of raccoons (Procyon lotor) with a vaccinia-rabies glycoprotein recombinant virus vaccine. Proc Natl Acad Sci USA. (1986) 83:7947–50. doi: 10.1073/pnas.83.20.7947
224. Hanlon CA, Niezgoda M, Hamir AN, Schumacher C, Koprowski H, Rupprecht CE. First North American field release of a vaccinia-rabies glycoprotein recombinant virus. J Wildl Dis. (1998) 34:228–39. doi: 10.7589/0090-3558-34.2.228
225. Brown LJ, Rosatte RC, Fehlner-Gardiner C, Knowles MK, Bachmann P, Davies JC, et al. Immunogenicity and efficacy of two rabies vaccines in wild-caught, captive raccoons. J Wildl Dis. (2011) 47:182–94. doi: 10.7589/0090-3558-47.1.182
226. Brown LJ, Rosatte RC, Fehlner-Gardiner C, Taylor JS, Davies JC, Donovan D. Immune response and protection in raccoons (Procyon lotor) following consumption of baits containing ONRAB(R), a human adenovirus rabies glycoprotein recombinant vaccine. J Wildl Dis. (2012) 48:1010–20. doi: 10.7589/2012-01-023
227. Fehlner-Gardiner C, Rudd R, Donovan D, Slate D, Kempf L, Badcock J. Comparing ONRAB(R) AND RABORAL V-RG(R) oral rabies vaccine field performance in raccoons and striped skunks, New Brunswick, Canada, and Maine, USJ, A. Wildl Dis. (2012) 48:157–67. doi: 10.7589/0090-3558-48.1.157
228. Calvete C. Modeling the effect of population dynamics on the impact of rabbit hemorrhagic disease. Conserv Biol. (2006) 20:1232–41. doi: 10.1111/j.1523-1739.2006.00371.x
229. Best SM, Collins SV, Kerr PJ. Coevolution of host and virus: cellular localization of virus in myxoma virus infection of resistant and susceptible European rabbits. Virology. (2000) 277:76–91. doi: 10.1006/viro.2000.0505
230. Division VM. CVMP Assessment report for Nobivac Myxo-RHD plus (EMEA/V/C/004989/0000). Amsterdam: Committee for Medicinal Products for Veterinary Use E. M. Agency (2019).
231. Spibey N, McCabe VJ, Greenwood NM, Jack SC, Sutton D, van der Waart L. Novel bivalent vectored vaccine for control of myxomatosis and rabbit haemorrhagic disease. Vet Rec. (2012) 170:309. doi: 10.1136/vr.100366
232. Pollard AJ, Launay O, Lelievre JD, Lacabaratz C, Grande S, Goldstein N, et al. Safety and immunogenicity of a two-dose heterologous Ad26.ZEBOV and MVA-BN-Filo Ebola vaccine regimen in adults in Europe (EBOVAC2): a randomised, observer-blind, participant-blind, placebo-controlled, phase 2 trial. Lancet Infect Dis. (2020) 21:493–506. doi: 10.1016/S1473-3099(20)30476-X
233. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and efficacy of the BNT162b2 mRNA covid-19 vaccine. N Engl J Med. (2020) 383:2603–15. doi: 10.1056/NEJMoa2034577
234. Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med. (2020) 384:403–16. doi: 10.1056/NEJMoa2035389
235. Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. (2021) 397:99–111. doi: 10.1016/S0140-6736(20)32661-1
236. Noad R, Roy P. Virus-like particles as immunogens. Trends Microbiol. (2003) 11:438–44. doi: 10.1016/S0966-842X(03)00208-7
237. Brisse M, Vrba SM, Kirk N, Liang Y, Ly H. Emerging concepts and technologies in vaccine development. Front Immunol. (2020) 11:583077. doi: 10.3389/fimmu.2020.583077
238. Mohsen MO, Zha L, Cabral-Miranda G, Bachmann MF. Major findings and recent advances in virus-like particle (VLP)-based vaccines. Semin Immunol. (2017) 34:123–32. doi: 10.1016/j.smim.2017.08.014
239. Lugade AA, Bharali DJ, Pradhan V, Elkin G, Mousa SA, Thanavala Y. Single low-dose un-adjuvanted HBsAg nanoparticle vaccine elicits robust, durable immunity. Nanomedicine. (2013) 9:923–34. doi: 10.1016/j.nano.2013.03.008
240. Diaz-Arévalo D, Zeng M. Nanoparticle-based vaccines: opportunities and limitations. Nanopharmaceuticals. (2020) 135–50. doi: 10.1016/B978-0-12-817778-5.00007-5
241. Buschmann MD, Carrasco MJ, Alishetty S, Paige M, Alameh MG, Weissman D. Nanomaterial delivery systems for mRNA vaccines. Vaccines. (2021) 9:10065. doi: 10.3390/vaccines9010065
242. Miquel-Clopés A, Bentley EG, Stewart JP, Carding SR. Vacunas y tecnología de las mucosas. Clin Exp Immunol. (2019) 196:205–14. doi: 10.1111/cei.13285
243. Jain AK, Goyal AK, Mishra N, Vaidya B, Mangal S, Vyas SP. PEG-PLA-PEG bloquea nanopartículas copoliméricas para la inmunización oral contra la hepatitis B. Int J Pharm. (2010) 387: 253–62. doi: 10.1016/j.ijpharm.2009.12.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
244. Doavi T, Mousavi SL, Kamali M, Amani J, Fasihi Ramandi M. Vacuna intranasal a base de quitosan contra Escherichia coli O157:H7. Irán Biomed J. (2016) 20:97–108. doi: 10.7508/ibj.2016.02.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
245. Hu KF, Lövgren-Bengtsson K, Morein B. Complejos inmunoestimulantes (ISCOM) para la vacunación nasal. (2001) 51:149–59. doi: 10.1016/S0169-409X(01)00165-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
246. Sanina N, Chopenko N, Mazeika A, Kostetsky E. Complejos inmunoestimulantes tubulares nanopartículas: nueva formulación de adyuvantes eficaces y sistemas de administración de antígenos. BioMed Res Int. (2017) 2017:4389525. doi: 10.1155/2017/4389525
Resumen de PubMed | Texto completo de CrossRef | Google Académico
247. Paillot R. Una revisión sistemática de los avances recientes en la vacunación contra la influenza equina. Vacunas. (2014) 2:797–831. doi: 10.3390/vacunas2040797
Resumen de PubMed | Texto completo de CrossRef | Google Académico
248. Paillot R, Fraser S, Prowse-Davis L, Rash N, Montesso F, Slootmans N, et al. Vacuna contra la influenza equina basada en ISCOM: duración de la inmunidad y ensayos clínicos aleatorizados para evaluar un esquema acelerado de inmunización y eficacia. Ensayos Vaccinol. (2015) 4:61–70. doi: 10.1016/j.trivac.2015.07.002
249. Li L, Petrovsky N. Adyuvantes moleculares para vacunas de ADN. Curr emite Mol Biol. (2017) 22:17–40. doi: 10.21775/cimb.022.017
250. Suschak JJ, Williams JA, Schmaljohn CS. Avances en vectores de vacunas de ADN, métodos de administración no mecánicos y adyuvantes moleculares para aumentar la inmunogenicidad. Hum Vaccines Immunotherapeut. (2017) 13:2837–48. doi: 10.1080/21645515.2017.1330236
Resumen de PubMed | Texto completo de CrossRef | Google Académico
251. Sabbaghi A, Ghaemi A. Adyuvantes moleculares para vacunas de ADN: aplicación, diseño, preparación y formulación. Métodos Mol Biol. (2021) 2197:87–112. doi: 10.1007/978-1-0716-0872-2_5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
252. Somani J, Lonial S, Rosenthal H, Resnick S, Kakhniashvili I, Waller EK. Un ensayo aleatorizado controlado con placebo de la administración subcutánea de GM-CSF como adyuvante de la vacuna: efecto sobre las respuestas inmunitarias celulares y humorales. Vacuna. (2002) 21:221–30. doi: 10.1016/S0264-410X(02)00463-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
253. Ben-Yehuda A, Joseph A, Barenholz Y, Zeira E, Even-Chen S, Louria-Hayon I, et al. Inmunogenicidad y seguridad de una nueva vacuna contra la influenza liposomal suplementada con IL-2 (INFLUSOME-VAC) en residentes de hogares de ancianos. Vacuna. (2003) 21:3169–78. doi: 10.1016/S0264-410X(03)00251-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
254. Hu H, Tao L, Wang Y, Chen L, Yang J, Wang H. Mejora de las respuestas inmunitarias contra la vacuna de ADN de la nucleocápside del SARS-CoV mediante la coinoculación del vector que expresa la interleucina-2 en ratones. Biotechnol Lett. (2009) 31:1685–93. doi: 10.1007/s10529-009-0061-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
255. Chen Y, Wang S, Lu S. Inmunización por ADN para el desarrollo de vacunas contra el VIH. Vacunas. (2014) 2:138–59. doi: 10.3390/vacunas2010138
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: vacunas veterinarias, vacunas de nueva tecnología, animales destinados a la alimentación, animales de compañía, enfermedades infecciosas, control y prevención de enfermedades
Cita: Aida V, Pliasas VC, Neasham PJ, North JF, McWhorter KL, Glover SR y Kyriakis CS (2021) Nuevas tecnologías de vacunas en medicina veterinaria: un heraldo de las vacunas de medicina humana. Frente. Vet. Sci. 8:654289. doi: 10.3389/fvets.2021.654289
Recibido: 15 de enero de 2021; Aceptado: 17 de marzo de 2021;
Publicado: 15 Abril 2021.
Editado por:
Zhenhai Chen, Universidad de Yangzhou, China
Revisado por:
Sherry Layton, Vetanco S.A., Argentina
Uwe Fischer, Instituto Friedrich-Loeffler, Alemania
Derechos de autor © 2021 Aida, Pliasas, Neasham, North, McWhorter, Glover y Kyriakis. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Constantinos S. Kyriakis, csk@auburn.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía