Perfil proteico y evaluación de los niveles de beta amiloide en plasma en epilepsia canina refractaria
Perfil proteico y evaluación de los niveles de beta amiloide en plasma en epilepsia canina refractaria
 Sataporn Phochantachinda1
Sataporn Phochantachinda1  Boonrat Chantong2
Boonrat Chantong2  Onrapak Reamtong3
Onrapak Reamtong3  Duangthip Chatchaisak1*
Duangthip Chatchaisak1*- 1Departamento de Ciencias Clínicas y Salud Pública, Facultad de Ciencias Veterinarias, Universidad de Mahidol, Nakhon Pathom, Tailandia
- 2Departamento de Ciencias Preclínicas y Animales Aplicadas, Facultad de Ciencias Veterinarias, Universidad de Mahidol, Nakhon Pathom, Tailandia
- 3Departamento de Medicina Molecular Tropical y Genética, Facultad de Medicina Tropical, Universidad de Mahidol, Bangkok, Tailandia
Introducción: La relación entre la epilepsia y la disfunción cognitiva se ha investigado en caninos, y el deterioro de la memoria fue prevalente en perros con epilepsia. Además, los caninos con epilepsia tienen una mayor acumulación de β amiloide (Aβ) y degeneración neuronal que los controles sanos. En el presente estudio se investigó el plasma Aβ42 y realizó perfiles proteómicos en perros con epilepsia refractaria y perros sanos.
Métodos: En total, se incluyeron en el estudio ocho perros, incluidos cuatro perros sanos y cuatro perros con epilepsia. Se recogieron muestras de sangre para analizar Aβ42 y realizar perfiles proteómicos. Los cambios en los perfiles proteómicos plasmáticos de perros se determinaron mediante cromatografía nanolíquida y espectrometría de masas en tándem.
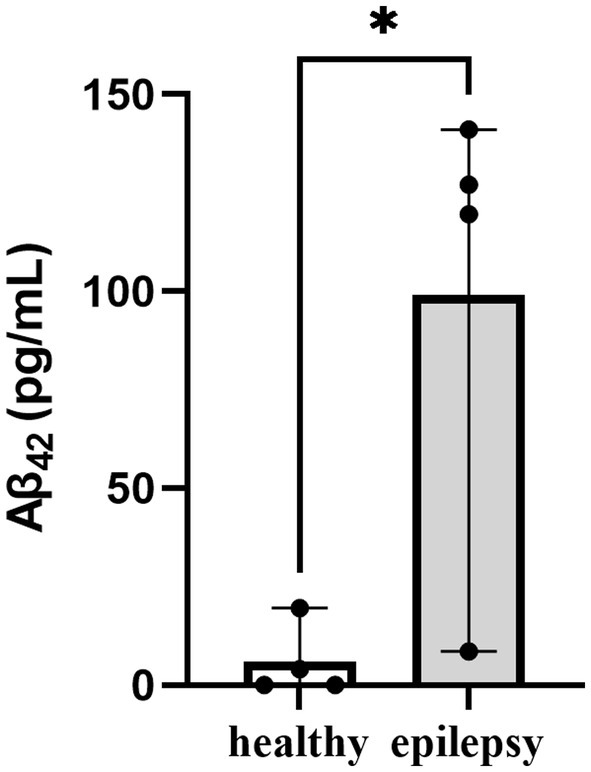
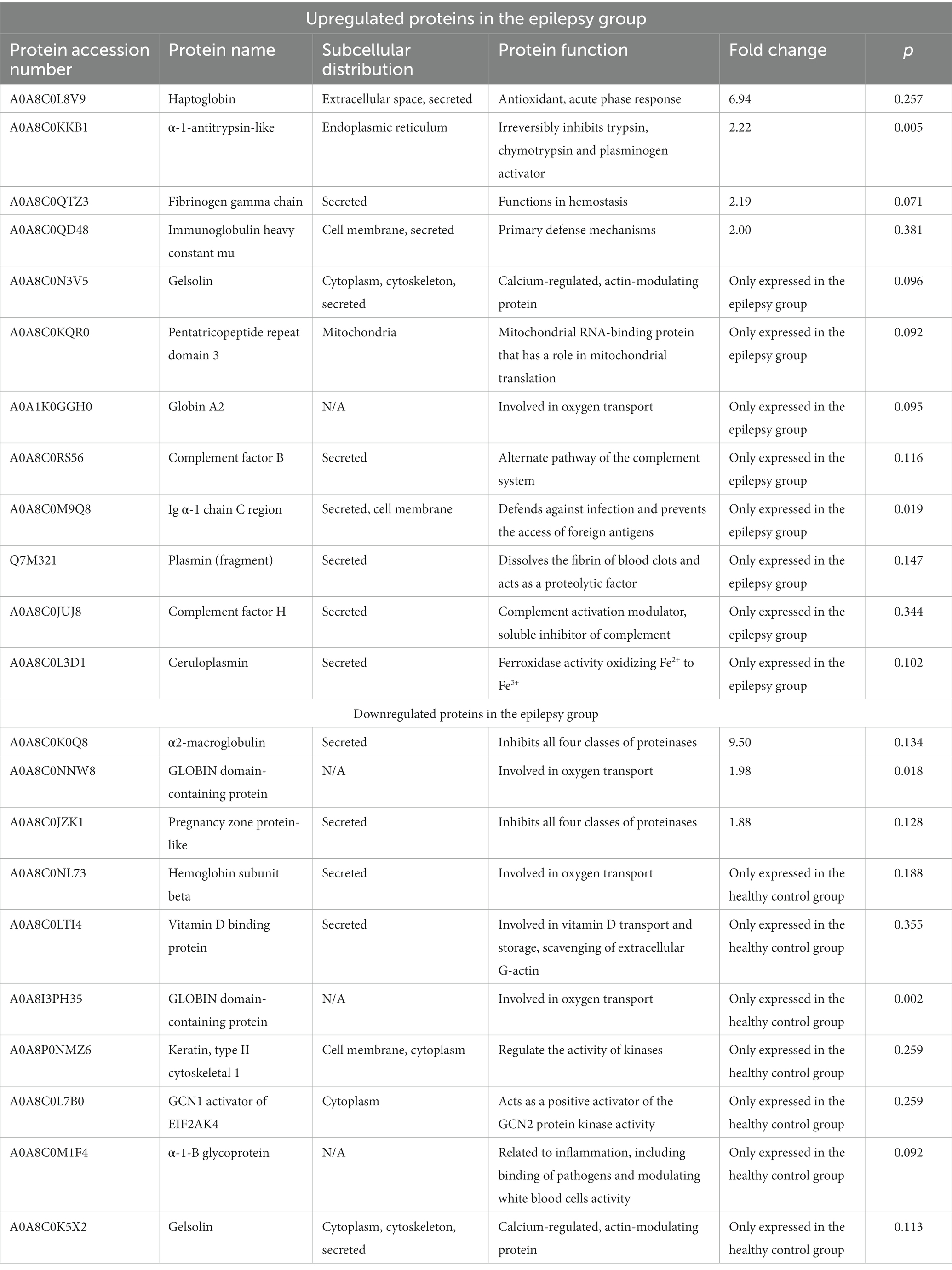
Resultados y discusión: El plasma Aβ42 fue significativamente mayor en perros con epilepsia (99 pg/mL) que en perros sanos (5,9 pg/mL). En total, se identificaron 155 proteínas, y de estas, la expresión de 40 proteínas estaba alterada en la epilepsia. Entre estas proteínas, que están relacionadas con enfermedades neurodegenerativas, 10 (25%) estaban reguladas a la baja en perros con epilepsia, mientras que 12 (30%) estaban reguladas al alza. La expresión de las proteínas de fase aguda haptoglobina y α2-macroglobulina difirió significativamente entre los grupos. El factor H del complemento y la ceruloplasmina solo se detectaron en perros con epilepsia, lo que sugiere que la neuroinflamación desempeña un papel en las crisis epilépticas. La gelsolina, que está involucrada en los procesos celulares y la organización del citoesqueleto, solo se detectó en perros sanos. La anotación de Gene Ontology reveló que la epilepsia puede interferir potencialmente con los procesos biológicos, incluidos los procesos celulares, la localización y las respuestas a los estímulos. Las convulsiones comprometieron funciones moleculares clave, incluida la actividad catalítica, la regulación de la función molecular y la unión. Las proteínas de defensa/inmunidad se modificaron de manera más significativa durante el desarrollo de la epilepsia. En el análisis de las vías de la Enciclopedia de Genes y Genomas de Kioto, las cascadas del complemento y de la coagulación fueron las vías de señalización más relevantes afectadas por las convulsiones. Los hallazgos sugirieron que la haptoglobina, la ceruloplasmina, la α2-macroglobulina, el factor H del complemento y la gelsolina desempeñan un papel en la epilepsia canina y en los niveles de Aβ según el perfil proteómico. Estas proteínas podrían representar biomarcadores de diagnóstico que, tras su validación clínica, podrían utilizarse en la práctica veterinaria, así como proteínas relevantes para las vías de respuesta a enfermedades. Para determinar los mecanismos precisos que subyacen a estas relaciones y sus implicaciones en la epilepsia canina, se requiere investigación adicional.
1 Introducción
Las convulsiones epilépticas son descritas por el Grupo de Trabajo Internacional de Epilepsia Veterinaria (IVETF, por sus siglas en inglés) como «una ocurrencia transitoria de signos debido a una actividad neuronal anormal, excesiva o sincrónica en el cerebro» (1). Se ha estimado que la prevalencia de la epilepsia canina es del 0,6 al 0,75% en la población canina general (2). Las convulsiones caninas afectan significativamente la salud y el bienestar de los perros, así como de sus dueños. Las convulsiones repetidas o prolongadas pueden causar daños en el cerebro y el sistema nervioso, lo que puede provocar problemas cognitivos y conductuales, así como un aumento de la frecuencia y gravedad de las convulsiones (3, 4). Los perros que experimentan convulsiones pueden lesionarse a sí mismos o a otros durante un episodio debido a la pérdida del conocimiento, la pérdida del control motor u otros factores (3, 4). Las convulsiones pueden ser emocionalmente estresantes tanto para los perros como para sus dueños, y pueden provocar ansiedad, depresión y disminución de la calidad de vida (5).
La fisiopatología de las convulsiones caninas es compleja y no se comprende completamente. Sin embargo, se cree que implica una alteración en el equilibrio de los neurotransmisores excitatorios e inhibidores en el cerebro, lo que conduce a la hiperexcitabilidad y al disparo sincronizado de las neuronas. Las mutaciones genéticas, las lesiones cerebrales u otros factores afectan los canales iónicos y los receptores de neurotransmisores en el cerebro. Estos cambios pueden aumentar la excitabilidad de las neuronas y hacerlas más propensas a dispararse de forma anormal (4, 6). Los cambios inflamatorios en el cerebro, como la activación de la microglía y la liberación de citoquinas, pueden contribuir al desarrollo y propagación de las convulsiones (7-9). Además, las especies reactivas de oxígeno y otros agentes oxidantes pueden dañar las neuronas y aumentar su excitabilidad, lo que puede provocar convulsiones (10, 11).
La posible relación entre las convulsiones caninas y el síndrome de disfunción cognitiva (SDC), una afección caracterizada por un deterioro cognitivo similar a la enfermedad de Alzheimer (EA) en humanos, ha recibido una amplia atención. Los perros con SDC tienen más probabilidades de experimentar convulsiones que los perros sanos. Un perro que experimentaba una convulsión mostraba síntomas típicos comúnmente relacionados con la demencia canina. Además, los perros con epilepsia mostraron una mayor prevalencia de síntomas de demencia canina en comparación con el grupo de control (12, 13). Las convulsiones y el deterioro cognitivo están interconectados y pueden interactuar en un círculo vicioso. En concreto, las convulsiones pueden causar daños en el sistema nervioso, incluyendo la muerte celular y alteraciones en los neurotransmisores, afectando así a la función cognitiva. Además, el SDC y la demencia pueden aumentar la incidencia de convulsiones al cambiar la estructura y la función del cerebro (14-18). Investigaciones anteriores revelaron que los perros que experimentaron convulsiones tenían un mayor riesgo de desarrollar deterioro cognitivo que sus contrapartes. Además, los perros con disfunción cognitiva eran más propensos a las convulsiones que los perros sin disfunción cognitiva (15). Del mismo modo, las personas con epilepsia tienen un mayor riesgo de desarrollar demencia que sus contrapartes, y el riesgo de demencia aumenta con la duración de la epilepsia (14, 16, 19). Existe una relación compleja entre las convulsiones, la EA y el β amiloide (Aβ) (20-22). Estudios recientes sugirieron que las convulsiones pueden contribuir a la formación de placas de Aβ en el cerebro y aumentar los niveles de Aβ en el líquido cefalorraquídeo (LCR), los cuales son características distintivas de la EA (21, 23, 24). Estudios anteriores ilustraron que Aβ puede mejorar la excitabilidad neuronal y contribuir a las convulsiones a través de una variedad de mecanismos, incluida la disfunción sináptica y la neuroinflamación (17, 18). Además, estudios recientes identificaron un posible vínculo entre Aβ y las comorbilidades asociadas a la epilepsia, como el deterioro cognitivo y la depresión (18, 25). Estos estudios sugirieron una relación bidireccional entre las convulsiones y la acumulación de Aβ en el cerebro. Específicamente, las convulsiones pueden contribuir a la formación de placas de Aβ, y la acumulación de Aβ puede aumentar el riesgo de convulsiones.
Actualmente, el diagnóstico de la epilepsia se basa en los signos clínicos, la historia clínica y la eliminación de otras posibles causas de convulsiones (1, 3). Las técnicas avanzadas de diagnóstico por imágenes, como la resonancia magnética y la tomografía computarizada, pueden proporcionar información valiosa sobre las causas subyacentes de las convulsiones. El análisis proteómico es una poderosa herramienta que se puede utilizar en el diagnóstico y seguimiento terapéutico de la epilepsia canina. En particular, el análisis proteómico se puede utilizar para identificar posibles biomarcadores de epilepsia en perros. Al comparar los perfiles proteicos de perros con y sin epilepsia, los investigadores pueden identificar las proteínas que se expresan diferencialmente en perros con epilepsia. Estas proteínas pueden validarse como biomarcadores potenciales para su uso en el diagnóstico y la evaluación de la respuesta al tratamiento y como dianas para nuevos fármacos (26, 27).
Los objetivos de esta investigación fueron determinar los niveles plasmáticos de Aβ e identificar proteínas potencialmente implicadas en la patogénesis de la epilepsia canina refractaria mediante análisis proteómico. Demostramos por primera vez que el aumento de Aβ plasmático42 Los niveles se acompañaron de alteraciones en la expresión de proteínas plasmáticas en perros con epilepsia refractaria. Estos hallazgos podrían proporcionar información adicional sobre los mecanismos subyacentes a la epilepsia. Además, los posibles biomarcadores plasmáticos obtenidos mediante análisis proteómicos pueden utilizarse para el tratamiento de tratamientos.
2 Materiales y métodos
2.1 Población de estudio
Se recogieron ocho muestras de plasma de perros en el Hospital Universitario de Pequeños Animales de la Facultad de Medicina Veterinaria de la Universidad de Mahidol (Nakhon Pathom, Tailandia). El tamaño muestral de cuatro animales de cada grupo se determinó utilizando la calculadora epidemiológica EpiTools,1 con un nivel de significancia del 5% y un nivel de confianza del 95%. La cohorte incluyó cuatro perros diagnosticados con epilepsia idiopática refractaria y cuatro perros sanos. La epilepsia idiopática se describió como una afección en la que los perros de 6 meses a 6 años de edad experimentaron su primera convulsión sin ninguna otra causa subyacente para las convulsiones sin anomalías significativas en los análisis de sangre de la base de datos mínima (de acuerdo con el diagnóstico IVETF Tier I) (28). Todos los perros con epilepsia idiopática recibieron dosis adecuadas de fenobarbital y bromuro de potasio, pero se volvieron refractarios a toda la medicación (29). Las características poblacionales de los perros en este estudio se han incluido en el material complementario. El protocolo de recolección de muestras fue aprobado por el Comité de Cuidado y Uso de Animales de la Universidad de Mahidol (AICUC: MUVS-2020-08-37). Se recogieron muestras de sangre y se centrifugaron a 3000 rpm durante 10 min. La primera porción de la muestra de plasma se almacenó a -80 °C para el análisis proteómico, mientras que la segunda porción se almacenó a -80 °C para evaluar Aβ42 mediante el ensayo de inmunoabsorción ligado a enzimas (ELISA).
2.2 Electroforesis en gel de dodecil sulfato de sodio-poliacrilamida (SDS-PAGE)
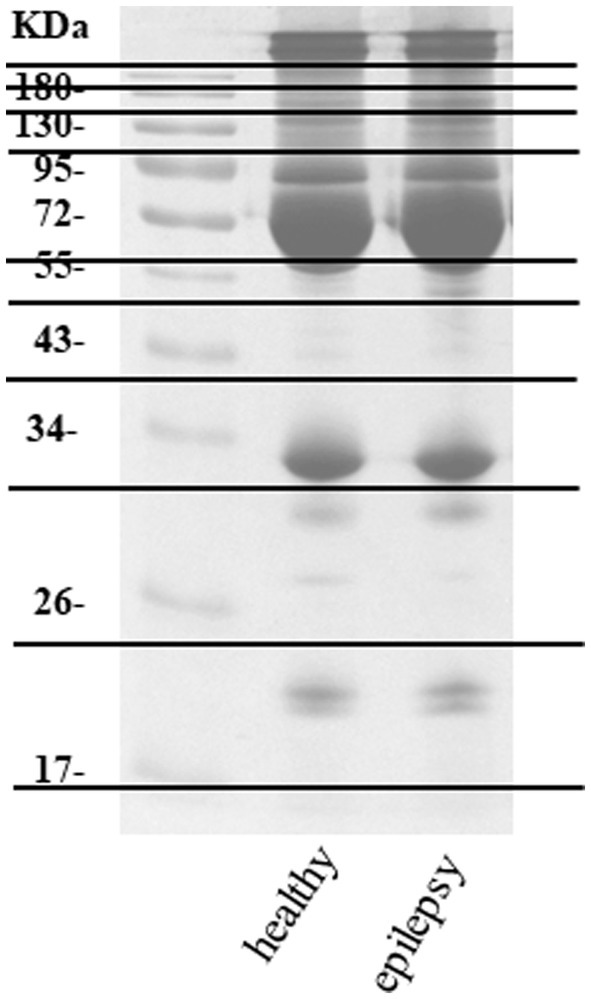
Las concentraciones de proteínas plasmáticas se midieron mediante el ensayo de Bradford. Se agruparon muestras de proteínas de cada grupo. Para la identificación de proteínas mediante espectrometría de masas en tándem de nanocromatografía líquida (nano-LC-MS/MS), se cargaron 30 μg de proteína combinada en un gel de poliacrilamida al 12%. Las bandas de proteínas en el gel se tiñeron con Coomassie Brilliant Blue R-250 (Bio-Rad, Hercules, CA, EE. UU.) y luego se desteñieron con una solución de etanol al 30% en ácido acético al 10%. El gel se escaneó con un escáner GS-710 (Bio-Rad, Hercules, CA, EE. UU.). Para un análisis más detallado, las bandas de proteínas se dividieron en 11 segmentos por carril y se cortaron en trozos. La técnica de escisión de bandas de gel se basó en la capacidad de separar físicamente diferentes tamaños de proteínas en el gel y no cortó en el medio de las bandas de proteínas. A continuación, cada pieza individual se sometió a una digestión tríptica.
2.3 Digestión en gel
Las piezas de gel se equilibraron utilizando acetonitrilo absoluto y 50 mM de NH4HCO3. Los enlaces disulfuro se redujeron utilizando 4 mM de ditiotreitol en 50 mM de NH4HCO3 durante 10 min a 60 °C y alquilado en 250 mM yodoacetamida en 50 mM NH4HCO3 durante 30 min a temperatura ambiente en la oscuridad. Las piezas de gel se deshidrataron dos veces en acetonitrilo absoluto durante 15 minutos cada una y se dejaron secar al aire. A continuación, las piezas de gel se sometieron a digestión con tripsina en 50 mM NH4HCO3 durante la noche a 37°C. Los péptidos trípticos resultantes se extrajeron del gel utilizando acetonitrilo absoluto. Finalmente, las mezclas peptídicas se secaron utilizando un vacío rápido y se almacenaron a -80 °C hasta su análisis mediante nano-LC-MS/MS.
2.4 Análisis de patrones peptídicos mediante nano LS-MS/MS
Los péptidos extraídos se disolvieron en ácido fórmico al 0,1% en agua de grado LC/MS. Cada muestra se inyectó en el sistema UltiMate 3.000 RSLCnano (Thermo Fisher Scientific, Waltham, MA, EE. UU.). La separación peptídica se realizó utilizando una columna C18 a un caudal de 300 nL/min. La fase móvil A consistió en un 0,1% de ácido fórmico en agua, mientras que la fase móvil B consistió en un 80% de acetonitrilo en ácido fórmico al 0,1%. A continuación, el eluyente se infundió en un espectrómetro de masas microTOF-Q (Bruker Daltonics, Billerica, MA, EE. UU.). Los espectros de masas de la espectrometría de masas (MS) y la MS en tándem cubrieron los rangos de masas de m/z 400-2000 y m/z 50-1.500, respectivamente.
2.5 Análisis bioinformático
Se generó un archivo genérico de mascota (.mgf) utilizando el software DataAnalysis versión 3.4. Se utilizó Mascot Daemon versión 2.3.2 (Matrix Science, Londres, Reino Unido) para identificar las proteínas. La identificación y cuantificación de las proteínas se realizó en una base de datos del NCBInr (02 de marzo de 2023) específica para perros. La abundancia de proteínas se determinó mediante el análisis del recuento de péptidos utilizando el valor del índice de abundancia de proteínas modificado exponencialmente (emPAI) (30). El emPAI es un enfoque sin etiquetas para la cuantificación de proteínas. Proporciona una relación de proporcionalidad directa entre el número de péptidos observados y esperados (30). Esta técnica podría informar la cuantificación relativa de cada proteína en la mezcla de proteínas, lo que es más informativo que el ensayo de concentración de proteína cruda. Se realizaron tres réplicas biológicas. Se utilizaron proteínas con expresión significativamente diferente en los dos grupos para realizar el análisis de agrupamiento. Se utilizó un diagrama de Venn para ilustrar las diferencias en la expresión de proteínas entre los grupos.
2.5.1 Anotación de ontología génica (GO)
Las proteínas se clasificaron mediante la anotación GO en función de tres categorías: procesos biológicos, componentes celulares y función molecular. Este análisis ayuda a comprender las funciones y procesos biológicos asociados con las proteínas expresadas diferencialmente.
2.5.2 Enriquecimiento del análisis de vías
Las interacciones proteína-proteína entre proteínas expresadas diferencialmente en un mapa de proteínas se evaluaron utilizando la base de datos Search Tool for the Retrieval of Interacting Genes (STRING).2 Esta base de datos proporciona información sobre las interacciones conocidas y predichas entre las proteínas, lo que ayuda en la exploración de las redes de proteínas y las posibles relaciones funcionales. A continuación, la base de datos de la Enciclopedia de Genes y Genomas de Kioto (KEGG)3 se utilizó para clasificar las proteínas expresadas diferencialmente en categorías jerárquicas. Las vías con tasas de falsos descubrimientos menores de 0,05 se consideraron estadísticamente significativas. La función de las proteínas se identificó utilizando la base de datos UniProt.4
2.6 Determinación de Aβ42 niveles por ELISA
Para cuantificar Aβ42 niveles en plasma, kits ELISA sándwich específicos diseñados para Aβ humano42 (Elabscience®, Wuhan, China) se utilizaron siguiendo las instrucciones del fabricante. Varias evidencias en estudios caninos han utilizado Aβ humano42 Kit ELISA en todas las especies (31, 32) debido a la secuencia idéntica de aminoácidos de Aβ42 entre humanos y perros (33). Brevemente, las placas ELISA se recubrieron con 100 μL de cada muestra de plasma. A continuación, se añadió un anticuerpo biotinilado a las placas, seguido de una incubación durante 1 h. Después de varios pasos de lavado, se agregó solución de trabajo conjugada HRP a cada pocillo. Se repitió el paso de lavado y se agregó solución de sustrato a cada pocillo. La reacción se detuvo mediante la adición de la solución de parada. La absorbancia de las muestras se midió a una longitud de onda de 450 nm.
2.7 Análisis estadístico
La significación estadística de las diferencias entre los grupos se determinó mediante una prueba t de Student no paramétrica pareada. Los cálculos estadísticos se realizaron con GraphPad Prism versión 5.0 y la significancia se indicó con p < 0.05.
3 Resultados
3.1 Niveles plasmáticos de Aβ42 en perros con epilepsia y perros sanos
La media plasmática Aβ42 nivel de epilepsia idiopática refractaria fue significativamente mayor en comparación con los perros normales (99 pg/mL vs. 5,9 pg/mL, p < 0,05, Figura 1). Del mismo modo, se observó que los perros con deterioro cognitivo presentaban un aumento de los niveles plasmáticos de Aβ42 (31, 32 y 34).
3.2 Proteómica plasmática
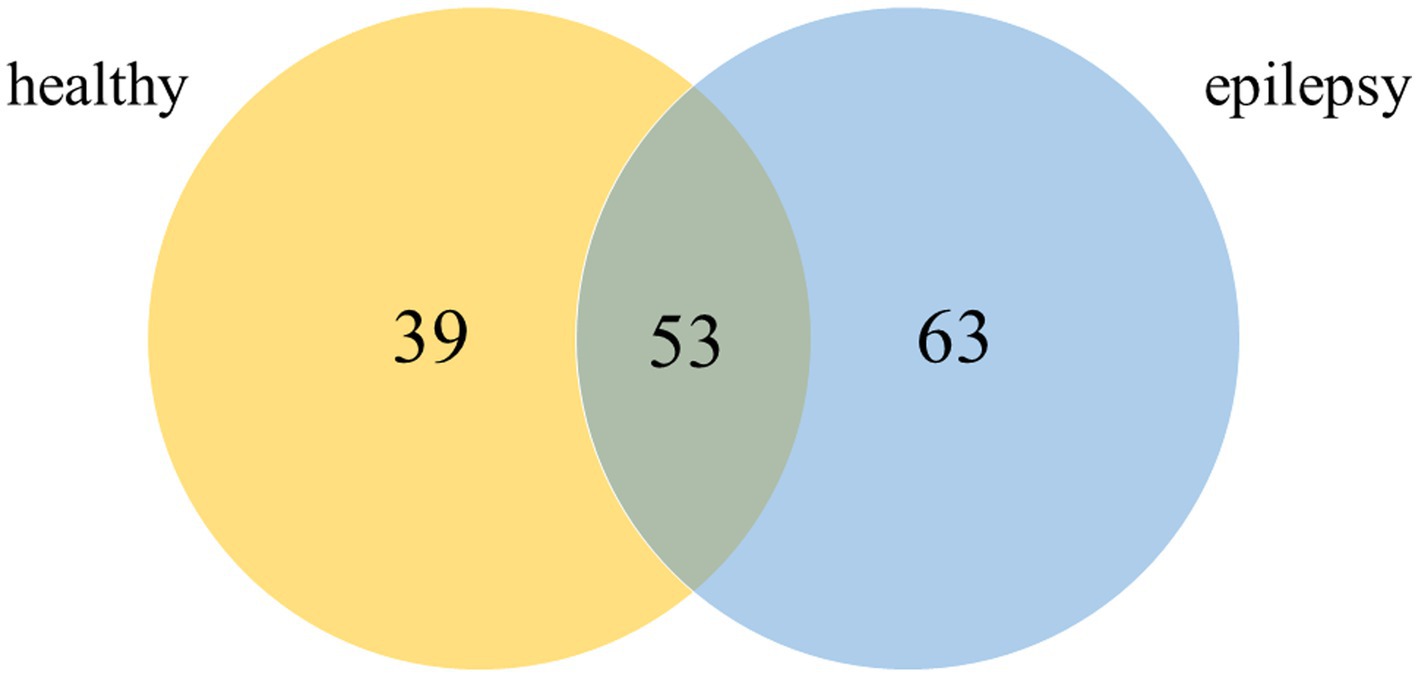
El plasma de perros de los grupos de control sano y epilepsia se combinó y preparó para medir la expresión diferencial de proteínas utilizando un enfoque proteómico. Las bandas de proteínas en la electroforesis en gel unidimensional de ambos grupos se separaron en 11 piezas antes de la digestión con tripsina en gel (Figura 2). De las 155 proteínas caninas examinadas, 53 (34,19%) se expresaron comúnmente en perros de ambos grupos (Figura 3).
Figura 3. Diagrama de Venn de las proteínas detectadas en los grupos control sano y epilepsia (Canis spp.).
3.3 Identificación de proteínas expresadas diferencialmente en plasma
Las proteínas reguladas a la baja y al alza en perros con epilepsia, en comparación con las de perros sanos, estaban específicamente involucradas en varios procesos biológicos. La expresión diferencial de proteínas se demostró mediante semicuantificación mediante la selección de las proteínas alteradas con al menos dos repeticiones (35, 36). De las 155 proteínas examinadas, 40 mostraron diferencias de al menos 1,5 veces en la expresión entre los grupos de control sano y epilepsia de acuerdo con los valores de emPAI.
3.4 Análisis de GO y enriquecimiento de vías de proteínas
Se realizó un análisis de enriquecimiento de vías para mapear las proteínas en las bases de datos de GO a través de PANTHER utilizando tres categorías principales: proceso biológico, clase de proteína y función molecular. En la categoría de función molecular GO, las proteínas expresadas diferencialmente entre los grupos control sano y epilepsia se dividieron en cuatro grupos: proceso biológico, regulador de la función molecular, clase de proteína y componente celular (Figura 4). Entre las proteínas expresadas diferencialmente en el grupo de epilepsia, seis, seis y cinco fueron mapeadas dentro de los procesos celulares, la respuesta a estímulos y la regulación biológica, respectivamente, en la categoría de proceso biológico (Figura 4A). Cinco proteínas se agruparon dentro de la actividad catalítica y cinco proteínas estuvieron involucradas en la unión, la regulación de la función molecular y la actividad del transductor molecular en la categoría de función molecular (Figura 4B). Once proteínas participaron en la proteína de defensa/inmunidad en la categoría de clase de proteína (Figura 4C), y ocho proteínas participaron en la entidad anatómica celular en la categoría de componente celular (Figura 4D).
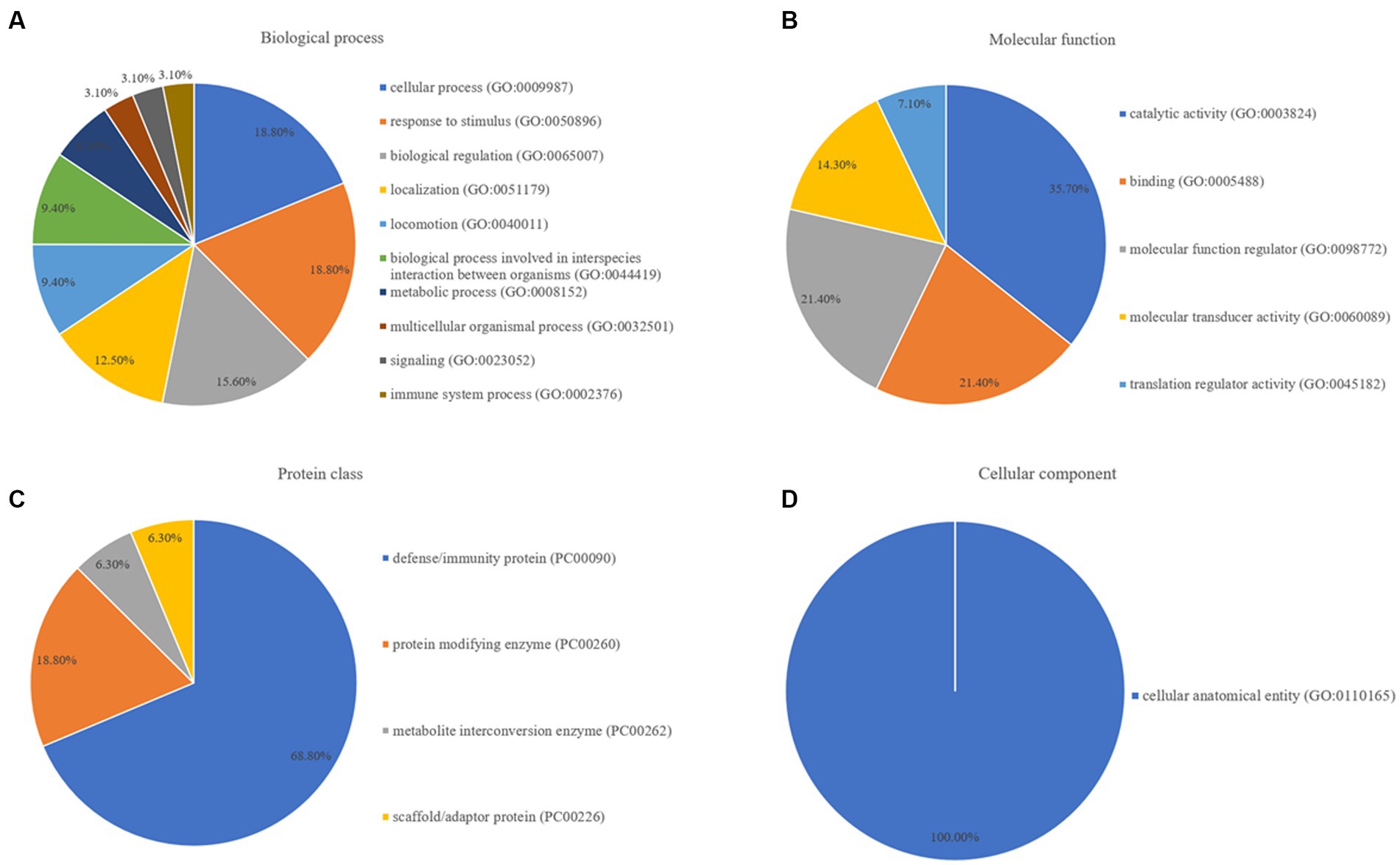 Figura 4. Anotación GO de; (A) proceso biológico, (B) función molecular, (C) clase de proteína, y (D) componente celular, para proteínas expresadas diferencialmente entre los grupos de control sano y epilepsia.
Figura 4. Anotación GO de; (A) proceso biológico, (B) función molecular, (C) clase de proteína, y (D) componente celular, para proteínas expresadas diferencialmente entre los grupos de control sano y epilepsia.
Estos resultados ilustran que, en comparación con los hallazgos en perros sanos, los procesos biológicos como las actividades celulares, la localización, la respuesta a los estímulos y las actividades moleculares críticas, como la actividad catalítica, la regulación de la función molecular y la unión, se interrumpieron en perros con epilepsia. Las proteínas de defensa/inmunidad fueron las proteínas más dramáticamente alteradas a lo largo del desarrollo de la epilepsia.
3.5 Proteínas de interés y distribución subcelular de proteínas expresadas diferencialmente
Doce proteínas fueron reguladas al alza en el grupo de epilepsia, mientras que 10 proteínas fueron reguladas a la baja (Tabla 1). Para predecir las funciones celulares de las proteínas expresadas diferencialmente, en este estudio se analizó su localización. Utilizando el análisis de localización subcelular con datos de la base de datos de anotaciones UniProt, la distribución de las proteínas fue la siguiente: secretadas, 14 (63,64); retículo endoplásmico, 1 (4,55%); membrana celular, 3 (13,64%); citoplasma, 4 (18,18%); mitocondrias, 1 (4,55%); citoesqueleto, 2 (9,09%); y espacio extracelular, 1 (4,55%, Tabla 1). Las proteínas de interés en perros, identificadas a partir de los datos de EM/EM reportados aquí, exhibieron un nivel de confianza superior al 95%, según lo determinado por la tasa de falsos descubrimientos.
Tabla 1. Proteínas de expresión diferencial en perros con epilepsia y controles sanos.
3.6 Análisis de la función KEGG de proteínas expresadas diferencialmente
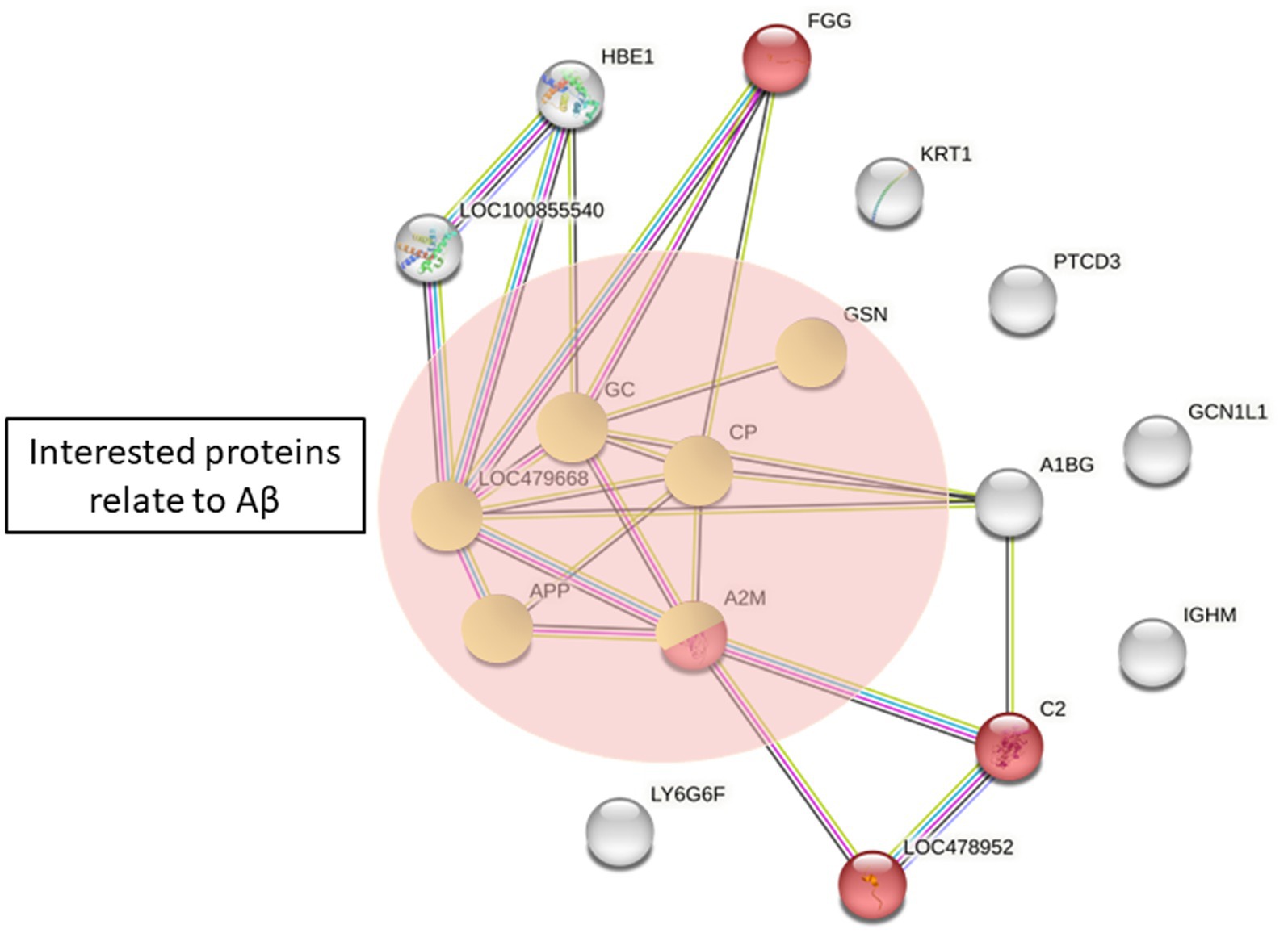
Explorar las proteínas potenciales implicadas en la patogénesis de la epilepsia canina y Aβ42 metabolismo, se realizó un análisis de la vía utilizando la versión 11.0 de STRING. Los cambios totales en las proteínas en el grupo de epilepsia en comparación con el grupo de control sano se ampliaron para ilustrar la evidencia de las interacciones, lo que resultó en la identificación de 17 proteínas. Comparamos este conjunto de proteínas con los de las bases de datos GO y KEGG. Las proteínas relacionadas con Aβ fueron haptoglobina (HP), α2-macroglobulina, ceruloplasmina, factor H del complemento (CFH) y gelsolina. Las proteínas potencialmente asociadas a la patogénesis de la epilepsia están implicadas en las cascadas del complemento y de la coagulación (Figura 5).
Figura 5. Diferencias proteicas entre el grupo control sano y el grupo de epilepsia por STRING. Rojo = complemento y cascadas de coagulación (vía KEGG). Las proteínas en círculos verdes son proteínas de interés relacionadas con Aβ42 (APP: proteína beta amiloide A4; A2M: α2-macroglobulina; PC: ceruloplasmina; GSN, gelsolina; GC: proteína de unión a la vitamina D; LOC479668, haptoglobina).
4 Discusión
Un creciente cuerpo de investigación ha sugerido una asociación entre la EA y la epilepsia (18). La epilepsia refractaria canina tiene un mayor riesgo de desarrollar CDS a una edad más temprana que los perros normales (12). Múltiples estudios en animales y humanos han revelado una asociación entre el Aβ y la epilepsia (37-39). En nuestro estudio, demostramos por primera vez niveles plasmáticos significativamente más altos de Aβ en perros con epilepsia refractaria. Plasma Aβ42 Los niveles en perros sanos en este estudio fueron comparables a los registrados en un estudio previo (10,99 ± 5,45 pg/mL) (31), y Aβ plasmático42 Los niveles estaban elevados en los perros de la misma edad con epilepsia. Se evaluó el patrón proteómico plasmático y se identificaron cinco proteínas principales potencialmente implicadas en la patogénesis de la epilepsia y niveles elevados de Aβ: haptoglobina (HP), α2-macroglobulina, ceruloplasmina, factor H del complemento (CFH) y gelsolina.
La interacción entre la epilepsia y la disfunción cognitiva se ha estudiado en perros. Sin embargo, la evidencia que demuestra que los niveles de Aβ son más altos en perros con que en controles sanos es limitada. Un estudio anterior encontró que los perros con epilepsia severa de inicio temprano tenían una mayor acumulación de Aβ y una mayor degeneración neuronal en el cerebro que los controles sanos (40). Además, la evidencia sustancial ha revelado una asociación entre Aβ y la epilepsia en animales y humanos. Por ejemplo, la presencia de placas Aβ se asoció con una mayor frecuencia y duración de los picos epilépticos en ratones APP/PS1 (37). Los niveles de proteína Aβ y su relación con la función cognitiva se han investigado en pacientes con epilepsia refractaria mediante el análisis de biopsias corticales de los lóbulos temporales. Los resultados revelaron una fuerte presencia de depósitos de Aβ en los tejidos biopsiados, lo que apoya la existencia de depósitos de Aβ en pacientes con epilepsia refractaria (39). En pacientes con convulsiones refractarias, se detectó un aumento de la proteína precursora Aβ en secciones del lóbulo temporal o del hipocampo (41). Un estudio en ratas ilustró que la epilepsia puede conducir a un aumento de la expresión de Aβ (42, 43). Las convulsiones contribuyen a los procesos neurodegenerativos al desencadenar corrientes eléctricas y promover la producción y liberación de Aβ (37, 44). La presencia de Aβ42 conduce a un aumento de la excitabilidad neuronal en la EA, lo que posteriormente inicia el desarrollo de una epilepsia progresiva (17). Nuestros hallazgos demuestran que el aumento de los niveles de Aβ42 En perros con convulsiones resistentes al tratamiento, las convulsiones pueden atribuirse a descargas epileptiformes prolongadas en el cerebro, lo que conduce al desarrollo de deterioro cognitivo. Se necesita más investigación para comprender completamente los mecanismos subyacentes a esta relación e identificar posibles dianas terapéuticas.
La HP plasmática, que es producida principalmente por los hepatocitos en el hígado, es una proteína de unión a la hemoglobina particularmente importante que elimina la hemoglobina de la circulación (45). Se han descubierto varias funciones adicionales de HP, que incluyen servir como una glicoproteína aguda de respuesta ácida de fase 2, un antioxidante de la apolipoproteína E (APOE), una proteína antiinflamatoria y un facilitador de la eliminación de Aβ (46, 47). En el estudio actual, la HP se reguló significativamente al alza en el grupo de epilepsia en comparación con el grupo de control sano. Se descubrió una posible asociación de la HP con trastornos neurológicos. La regulación positiva significativa de HP, interferón gamma e interleucina-1β se asoció con epilepsia refractaria, según lo determinado por el análisis proteómico del plasma aislado de niños con epilepsia refractaria (48). Los niveles séricos de HP fueron significativamente más altos en pacientes con convulsiones idiopáticas que en controles sanos (49). Del mismo modo, el análisis proteómico del LCR de perros con convulsiones epilépticas recurrentes reveló un aumento significativo en los niveles de HP, lo que sugiere que la HP participa en la interrupción de la barrera hematoencefálica, lo que podría estar relacionado con la respuesta inflamatoria desencadenada por las convulsiones dentro del cerebro (26). Los pacientes con EA tienen niveles de HP séricos significativamente más altos que los controles sanos. Además, se observó una correlación positiva significativa entre el nivel sérico de HP y la gravedad del deterioro cognitivo en pacientes con EA (47, 50). Se cree que esta asociación se produce a través de la modificación de los efectos de la APOE, otro factor genético implicado en la progresión de la EA (46). Aunque la investigación sobre la relación entre HP, epilepsia y Aβ es actualmente limitada, los presentes hallazgos sugieren posibles vínculos entre estos factores.
En el presente estudio, la ceruloplasmina solo se detectó en perros con epilepsia. La ceruloplasmina es una proteína circulante de unión al cobre que participa en la homeostasis del cobre, el estrés oxidativo y la neuroinflamación, y su expresión aumenta durante la respuesta de la fase aguda (51, 52). La evidencia sugiere que los niveles plasmáticos de ceruloplasmina reflejan sus niveles en el cerebro (53). Existe cierta evidencia de que la ceruloplasmina está involucrada en la actividad convulsiva, aunque la relación exacta no se comprende completamente (28, 54, 55). Las concentraciones plasmáticas de ceruloplasmina y la actividad oxidasa fueron sustancialmente más altas en adultos con epilepsia que en controles emparejados por edad y sexo (28). La expresión del ARNm de la ceruloplasmina en sangre periférica fue significativamente mayor en los pacientes con epilepsia refractaria que en los pacientes que respondieron a los fármacos y en los controles sanos. Además, los investigadores encontraron un vínculo entre el aumento de la expresión de ceruloplasmina y diferentes estrategias de tratamiento, lo que podría revelar un mecanismo de resistencia para los medicamentos combinados utilizados para tratar la epilepsia refractaria (28). Se estudió la relación entre la epilepsia y la duplicación parcial del gen de la ceruloplasmina en ratones con epilepsia, que se cohereda con las convulsiones, y la duplicación del gen se asoció con un aumento de la expresión del ARNm de la ceruloplasmina y de la actividad de la ceruloplasmina oxidasa (55). Además, se ha estudiado el papel de la ceruloplasmina en el metabolismo de Aβ. Existe evidencia de que los niveles altos de ceruloplasmina en LCR en pacientes con EA y patogénesis subyacente de Aβ se relacionaron con un deterioro cognitivo más rápido (51). Estos estudios sugieren la participación de la ceruloplasmina en la actividad convulsiva y el metabolismo de Aβ a través de su papel en el estrés oxidativo y la homeostasis del cobre.
En el presente estudio, la CFH solo se detectó en el plasma de perros con epilepsia. La proteína regula la actividad del sistema del complemento y modula la inflamación en el cerebro y la periferia. A pesar de ser sintetizado y secretado principalmente por el hígado, el CFH se ha encontrado en diferentes tejidos, incluido el cerebro (56). Estudios recientes han sugerido un posible vínculo entre las mutaciones o la desregulación de la CFH y la epilepsia. Se midieron diez analitos del complemento en pacientes con epilepsia focal o generalizada, y los niveles plasmáticos de CFH fueron significativamente más altos en estos pacientes que en los controles (56). Aunque los mecanismos exactos que subyacen a la relación entre la CFH y las convulsiones no se comprenden completamente, se cree que la desregulación del sistema del complemento contribuye a la neuroinflamación y al daño neuronal, lo que conduce a un mayor riesgo de convulsiones. Además, estudios recientes han intentado demostrar la posible relación entre CFH y Aβ en la EA (57, 58). Los niveles plasmáticos de CFH se redujeron en pacientes con EA de inicio tardío, y esta reducción se asoció con los niveles séricos de proteína C reactiva. Desafortunadamente, recientemente se ha sugerido que la CFH plasmática no es un biomarcador apropiado para la EA (57).
La α2-macroglobulina es un inhibidor de la proteinasa de amplio espectro y una proteína de fase aguda del sistema inmunitario innato que se encuentra ampliamente en el plasma de los animales y se distribuye en varios fluidos corporales, incluido el LCR (59-61). Los niveles plasmáticos de α2-macroglobulina y citoquinas están elevados en pacientes con enfermedades neurodegenerativas, como la EA y la enfermedad de Parkinson (61). Se ha propuesto que el aumento de la actividad de la α2-macroglobulina tiene un papel en la patogénesis de la EA que implica la acumulación de placa Aβ (62). La α2-macroglobulina plasmática funciona como una proteína transportadora y se une específicamente al Aβ soluble y facilita su degradación (63-65). Este proceso puede ayudar en la eliminación de Aβ de los tejidos, incluido el cerebro. El estudio actual mostró una expresión reducida de α2-macroglobulina en el grupo de convulsiones, lo que puede resultar en una disminución del aclaramiento de Aβ. Esto puede explicar por qué se identificaron niveles plasmáticos elevados de Aβ en el grupo de convulsiones.
En el presente estudio, la gelsolina plasmática solo se detectó en perros sanos. La gelsolina es una proteína regulada por calcio y fosfatidilinositol 4,5-bisfosfato con propiedades de unión a la actina que está involucrada en varios procesos celulares, incluida la señalización celular, la inflamación y la organización del citoesqueleto (66). Existe evidencia del potencial de la gelsolina como biomarcador de la epilepsia, ya que las personas con epilepsia tienen niveles de gelsolina en el LCR considerablemente más bajos que los controles sanos. Los niveles de proteína gelsolina se redujeron de manera similar en el lóbulo temporal en pacientes con epilepsia (67). El daño inducido por las convulsiones a las neuronas piramidales del hipocampo se exacerbó en ratones adultos deficientes en gelsolina, lo que sugiere que la gelsolina activa los receptores de N-metil-D-aspartato y los canales de calcio dependientes del voltaje, lo que conduce a eventos fisiopatológicos (68). Además, la expresión de gelsolina m fue menor en el hipocampo de ratones con epilepsia y convulsiones que en ratones sin convulsiones (69). También se considera que la gelsolina está implicada en la EA y en la regulación de los niveles de Aβ, de acuerdo con el hallazgo de que diversas alteraciones de la gelsolina están relacionadas con la progresión de la EA (70, 71). La administración o sobreexpresión de gelsolina indujo una reducción considerable de la carga amiloide y del nivel de Aβ en ratones transgénicos con EA (70, 72). Se detectaron mayores concentraciones plasmáticas y de gelsolina en LCR en los pacientes con EA que en los controles, y se encontró una asociación positiva entre la gelsolina y el Aβ42 niveles en LCR. Lo más probable es que el aumento de los niveles plasmáticos de gelsolina sea una reacción compensatoria en la EA (71).
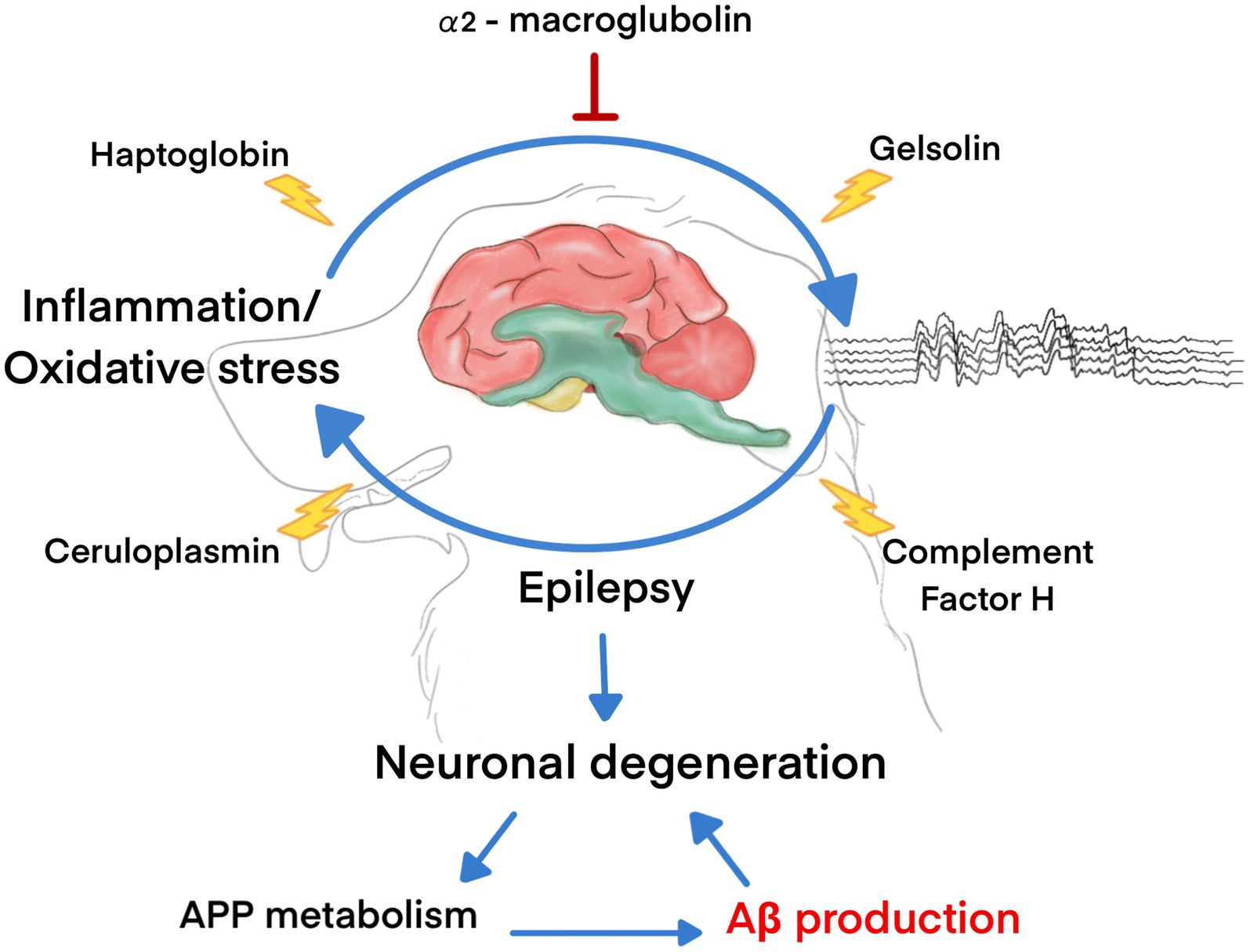
En conclusión, primero demostramos que el Aβ plasmático42 Los niveles fueron significativamente más altos en perros con epilepsia refractaria que en perros sanos. Se identificó el patrón proteómico plasmático y se identificaron cinco proteínas principales potencialmente implicadas en la patogénesis de la epilepsia y el control de los niveles de Aβ, incluyendo HP, α2-macroglobulina, ceruloplasmina, CFH y gelsolina. La HP y la α2-macroglobulina son proteínas implicadas en las respuestas de fase aguda, inmunológicas e inflamatorias. La expresión de HP fue sustancialmente elevada en el grupo de epilepsia, lo que indica relaciones con la lesión neuronal temprana y un mayor aclaramiento de Aβ. Por el contrario, la α2-macroglobulina se reguló significativamente al alza en el grupo de control sano, y el papel de la α2-macroglobulina en la etiología de las convulsiones sigue siendo desconocido. La CFH y la ceruloplasmina solo se detectaron en el plasma de perros con epilepsia, lo que sugiere un papel potencial en la neuroinflamación y las convulsiones. Por el contrario, la gelsolina, que está involucrada en los procesos celulares y la organización del citoesqueleto, solo se encontró en el plasma de perros sanos. Sin embargo, los mecanismos exactos que subyacen a estas relaciones y sus implicaciones en la epilepsia canina requieren más investigación (Figura 6). Aunque el tamaño de la muestra de los animales en el estudio es suficiente para examinar la diferencia en los niveles plasmáticos de β-amiloide42 Entre los perros sanos y los que padecen epilepsia refractaria, el análisis proteómico está limitado por el pequeño número de perros. El presente estudio demostró que el análisis proteómico tiene el potencial de identificar nuevos biomarcadores, mecanismos y dianas terapéuticas para los trastornos convulsivos. Sin embargo, se necesita más investigación para validar estos biomarcadores y superar los desafíos asociados con el análisis proteómico en trastornos neurológicos.
Figura 6. Las moléculas asociadas con la producción de Aβ en perros con epilepsia.
Información adicional
El estudio fue aprobado por el Comité de Cuidado y Uso de Animales de Laboratorio de la Facultad de Ciencias Veterinarias de la Universidad de Mahidol, Tailandia (número de aprobación: MUVS-2020-08-37). Los propietarios fueron informados y firmados en el formulario de consentimiento.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio y el número de acceso se pueden encontrar aquí: https://www.ebi.ac.uk/pride/, PXD043962.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Cuidado y Uso de Animales de Laboratorio de la Facultad de Ciencias Veterinarias de la Universidad de Mahidol, Tailandia (número de aprobación: MUVS-2020-08-37). Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
SP: Conceptualización, Curación de datos, Investigación, Validación, Visualización, Escritura – borrador original, Escritura – revisión y edición. BC: Conceptualización, Metodología, Recursos, Supervisión, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. O: Curación de datos, Recursos, Redacción – revisión y edición. DC: Conceptualización, Obtención de Financiamiento, Investigación, Metodología, Supervisión, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. El trabajo contó con el apoyo de la Agencia de Desarrollo de la Investigación Agrícola de Tailandia (subvención número CRP6305031600).
Reconocimientos
Los autores están profundamente agradecidos con el dueño del perro en el hospital Prasu-arthorn, Facultad de Ciencias Veterinarias, Universidad de Mahidol por su generosa respuesta. Los autores desean agradecer a la Sra. Tipparat Thiangtrongjit por su asistencia técnica con el procedimiento nano-LC-MS/MS.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1258244/full#supplementary-material
Notas
1. ^http://epitools.ausvet.com.au/content.php?page=home
2. ^https://string-db.org
3. ^https://www.genome.jp
4. ^www.uniprot.org
Referencias
1. De Risio, L, Bhatti, S, Muñana, K, Penderis, J, Stein, V, Tipold, A, et al. International veterinary epilepsy task force consensus proposal: diagnostic approach to epilepsy in dogs. BMC Vet Res. (2015) 11:148. doi: 10.1186/s12917-015-0462-1
2. Heske, L, Nødtvedt, A, Jäderlund, KH, Berendt, M, and Egenvall, A. A cohort study of epilepsy among 665, 000 insured dogs: incidence, mortality and survival after diagnosis. Vet J. (2014) 202:471–6. doi: 10.1016/j.tvjl.2014.09.023
3. Moore, S.A. Un abordaje clínico y diagnóstico para el paciente con convulsiones. El mejor compañero Anim Med. (2013) 28:46–50. doi: 10.1053/j.tcam.2013.07.002
4. Marzo, PA. Convulsiones: clasificación, etiologías y fisiopatología. Clin Tech Pequeña Animación Pract. (1998) 13:119–31. doi: 10.1016/S1096-2867(98)80033-9
5. Booth, S, Meller, S, Packer, RM, Farquhar, R, Maddison, JE, y Volk, HA. Cumplimiento del propietario en la epilepsia canina. Rec. Veterinario (2021) 188:E16. DOI: 10.1002/VTR.16
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Potschka, H, Fischer, A, Löscher, W, y Volk, HA. Fisiopatología de la epilepsia canina farmacorresistente. Veterinario J. (2023) 296-297:105990. doi: 10.1016/j.tvjl.2023.105990
7. Eyo, UB, Murugan, M, y Wu, LJ. Comunicación microglía-neurona en epilepsia. Glia. (2017) 65:5–18. doi: 10.1002/glia.23006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. López-Meraz, ML, y Álvarez-Croda, DM. Microglía y estado epiléptico en el cerebro inmaduro. Epilepsia abierta. (2023) 8:S73–s81. doi: 10.1002/epi4.12610
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Sol, Y, Ma, J, Li, D, Li, P, Zhou, X, Li, Y, et al. La interleucina-10 inhibe la producción de interleucina-1β y la activación inflamasoma de la microglía en las crisis epilépticas. J Neuroinflamación. (2019) 16:66. doi: 10.1186/s12974-019-1452-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Yuen, AWC, Keezer, MR, y Sander, JW. La epilepsia es un trastorno neurológico y sistémico. Comportamiento de la epilepsia. (2018) 78:57–61. doi: 10.1016/j.yebeh.2017.10.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Pearson-Smith, JN y Patel, M. Disfunción metabólica y estrés oxidativo en la epilepsia. Int J Mol Sci. (2017) 18:2365. doi: 10.3390/ijms18112365
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Packer, RMA, McGreevy, PD, Salvin, HE, Valenzuela, MJ, Chaplin, CM y Volk, HA. Disfunción cognitiva en la epilepsia idiopática canina natural. PLoS Uno. (2018) 13:e0192182. doi: 10.1371/journal.pone.0192182
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Winter, J, Packer, RMA y Volk, HA. Evaluación preliminar de los deterioros cognitivos en la epilepsia idiopática canina. Rec. Veterinario (2018) 182:633. doi: 10.1136/vr.104603
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Stefanidou, M, Beiser, AS, Himali, JJ, Peng, TJ, Devinsky, O, Seshadri, S, et al. Asociación bidireccional entre la epilepsia y la demencia: el estudio del corazón de Framingham. Neurología. (2020) 95:E3241–7. doi: 10.1212/WNL.000000000000011077
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Mac Quiddy, B, Moreno, JA, Kusick, B y McGrath, S. Evaluación de los factores de riesgo en perros con presunta disfunción cognitiva canina avanzada. Front Vet Sci. (2022) 9:958488. doi: 10.3389/fvets.2022.958488
16. Sen, A, Capelli, V y Husain, M. Cognición y demencia en pacientes mayores con epilepsia. Cerebro. (2018) 141:1592–608. doi: 10.1093/brain/awy022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Minkeviciene, R, Rheims, S, Dobszay, MB, Zilberter, M, Hartikainen, J, Fülöp, L, et al. La hiperexcitabilidad neuronal inducida por beta amiloide desencadena epilepsia progresiva. J Neurosci. (2009) 29:3453–62. doi: 10.1523/JNEUROSCI.5215-08.2009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Yang, F, Chen, L, Yu, Y, Xu, T, Chen, L, Yang, W, et al. Enfermedad de Alzheimer y epilepsia: una comorbilidad cada vez más reconocida. Neurosci de envejecimiento frontal. (2022) 14:940515. doi: 10.3389/fnagi.2022.940515
19. Dun, C, Zhang, Y, Yin, J, Su, B, Peng, X y Liu, L. Asociaciones bidireccionales de la epilepsia con la demencia y la enfermedad de Alzheimer: una revisión sistemática y metaanálisis de estudios longitudinales. Envejecimiento de la edad. (2022) 51:AFAC010. doi: 10.1093/ageing/afac010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Subota, A, Pham, T, Jetté, N, Sauro, K, Lorenzetti, D, y Holroyd-Leduc, J. La asociación entre demencia y epilepsia: una revisión sistemática y metaanálisis. Epilepsia. (2017) 58:962–72. doi: 10.1111/epi.13744
21. Costa, C, Romoli, M, Liguori, C, Farotti, L, Eusebi, P, Bedetti, C, et al. Alzheimer’s disease and late-onset epilepsy of unknown origin: two faces of beta amyloid pathology. Neurobiol Aging. (2019) 73:61–7. doi: 10.1016/j.neurobiolaging.2018.09.006
22. Romoli, M, Sen, A, Parnetti, L, Calabresi, P, and Costa, C. Amyloid-β: a potential link between epilepsy and cognitive decline. Nat Rev Neurol. (2021) 17:469–85. doi: 10.1038/s41582-021-00505-9
23. Costa, C, Parnetti, L, D’Amelio, M, Tozzi, A, Tantucci, M, Romigi, A, et al. Epilepsy, amyloid-β, and D1 dopamine receptors: a possible pathogenetic link? Neurobiol Aging. (2016) 48:161–71. doi: 10.1016/j.neurobiolaging.2016.08.025
24. Zhang, D, Chen, S, Xu, S, Wu, J, Zhuang, Y, Cao, W, et al. The clinical correlation between Alzheimer’s disease and epilepsy. Front Neurol. (2022) 13:922535. doi: 10.3389/fneur.2022.922535
25. Altuna, M, Olmedo-Saura, G, Carmona-Iragui, M, and Fortea, J. Mechanisms involved in Epileptogenesis in Alzheimer& rsquo; s disease and their therapeutic implications. Int J Mol Sci. (2022) 23:4307. doi: 10.3390/ijms23084307
26. Baka, R, Eckersall, D, Horvatic, A, Gelemanovic, A, Mrljak, V, McLaughlin, M, et al. Quantitative proteomics of cerebrospinal fluid using tandem mass tags in dogs with recurrent epileptic seizures. J Proteome. (2021) 231:103997. doi: 10.1016/j.jprot.2020.103997
27. Liu, X-Y, Yang, J-L, Chen, L-J, Zhang, Y, Yang, M-L, Wu, Y-Y, et al. Comparative proteomics and correlated signaling network of rat hippocampus in the pilocarpine model of temporal lobe epilepsy. Proteomics. (2008) 8:582–603. doi: 10.1002/pmic.200700514
28. Chen, H-Y, Pan, Y-X, Li, X-B, Yun, Y-F, Yang, G-X, Jiang, Y-M, et al. Expression of ceruloplasmin in the peripheral blood of patients with drug-resistant epilepsy. J Clin Pharmacol. (2023) 63:466–72. doi: 10.1002/jcph.2183
29. Muñana, KR. Management of refractory epilepsy. Top Companion Anim Med. (2013) 28:67–71. doi: 10.1053/j.tcam.2013.06.007
30. Ishihama, Y, Oda, Y, Tabata, T, Sato, T, Nagasu, T, Rappsilber, J, et al. Exponentially modified protein abundance index (em PAI) for estimation of absolute protein amount in proteomics by the number of sequenced peptides per protein * S. Mol Cell Proteomics. (2005) 4:1265–72. doi: 10.1074/mcp.M500061-MCP200
31. Panek, WK, Murdoch, DM, Gruen, ME, Mowat, FM, Marek, RD, and Olby, NJ. Plasma amyloid Beta concentrations in aged and cognitively impaired pet dogs. Mol Neurobiol. (2021) 58:483–9. doi: 10.1007/s12035-020-02140-9
32. Stylianaki, I, Polizopoulou, ZS, Theodoridis, A, Koutouzidou, G, Baka, R, and Papaioannou, NG. Amyloid-beta plasma and cerebrospinal fluid biomarkers in aged dogs with cognitive dysfunction syndrome. J Vet Intern Med. (2020) 34:1532–40. doi: 10.1111/jvim.15812
33. Youssef, SA, Capucchio, MT, Rofina, JE, Chambers, JK, Uchida, K, Nakayama, H, et al. Pathology of the aging brain in domestic and laboratory animals, and animal models of human neurodegenerative diseases. Vet Pathol. (2016) 53:327–48. doi: 10.1177/0300985815623997
34. González-Martínez, Á, Rosado, B, Pesini, P, Suárez, ML, Santamarina, G, García-Belenguer, S, et al. Plasma β-amyloid peptides in canine aging and cognitive dysfunction as a model of Alzheimer’s disease. Exp Gerontol. (2011) 46:590–6. doi: 10.1016/j.exger.2011.02.013
35. Reamtong, O, Srimuang, K, Saralamba, N, Sangvanich, P, Day, NPJ, White, NJ, et al. Protein profiling of mefloquine resistant plasmodium falciparum using mass spectrometry-based proteomics. Int J Mass Spectrom. (2015) 391:82–92. doi: 10.1016/j.ijms.2015.09.009
36. Pinto, PM, Klein, CS, Zaha, A, and Ferreira, HB. Comparative proteomic analysis of pathogenic and non-pathogenic strains from the swine pathogen Mycoplasma hyopneumoniae. Proteome Sci. (2009) 7:45. doi: 10.1186/1477-5956-7-45
37. Gureviciene, I, Ishchenko, I, Ziyatdinova, S, Jin, N, Lipponen, A, Gurevicius, K, et al. Characterization of epileptic spiking associated with brain amyloidosis in APP/PS1 mice. Front Neurol. (2019) 10:1151. doi: 10.3389/fneur.2019.01151
38. Joutsa, J, Rinne, JO, Hermann, B, Karrasch, M, Anttinen, A, Shinnar, S, et al. Association between childhood-onset epilepsy and amyloid burden 5 decades later. JAMA Neurol. (2017) 74:583–90. doi: 10.1001/jamaneurol.2016.6091
39. Aroor, A, Nguyen, P, Li, Y, Das, R, Lugo, JN, and Brewster, AL. Assessment of tau phosphorylation and β-amyloid pathology in human drug-resistant epilepsy. Epilepsia Open. (2023) 8:609–22. doi: 10.1002/epi4.12744
40. Hytönen, MK, Sarviaho, R, Jackson, CB, Syrjä, P, Jokinen, T, Matiasek, K, et al. In-frame deletion in canine PITRM1 is associated with a severe early-onset epilepsy, mitochondrial dysfunction and neurodegeneration. Hum Genet. (2021) 140:1593–609. doi: 10.1007/s00439-021-02279-y
41. Sima, X, Xu, J, Li, J, Zhong, W, and You, C. Expression of β-amyloid precursor protein in refractory epilepsy. Mol Med Rep. (2014) 9:1242–8. doi: 10.3892/mmr.2014.1977
42. Jang, SS, Royston, SE, Lee, G, Wang, S, and Chung, HJ. Seizure-induced regulations of amyloid-β, STEP61, and STEP61 substrates involved in hippocampal synaptic plasticity. Neural Plast. (2016) 2016:1–13. doi: 10.1155/2016/2123748
43. Dolev, I, Fogel, H, Milshtein, H, Berdichevsky, Y, Lipstein, N, Brose, N, et al. Spike bursts increase amyloid-β 40/42 ratio by inducing a presenilin-1 conformational change. Nat Neurosci. (2013) 16:587–95. doi: 10.1038/nn.3376
44. Gourmaud, S, Shou, H, Irwin, DJ, Sansalone, K, Jacobs, LM, Lucas, TH, et al. Alzheimer-like amyloid and tau alterations associated with cognitive deficit in temporal lobe epilepsy. Brain. (2020) 143:191–209. doi: 10.1093/brain/awz381
45. Wassell, J. Haptoglobin: function and polymorphism. Clin Lab. (2000) 46:547–52.
46. Bai, H, Naj, AC, Benchek, P, Dumitrescu, L, Hohman, T, Hamilton-Nelson, K, et al. A haptoglobin (HP) structural variant alters the effect of APOE alleles on Alzheimer’s disease. Alzheimers Dement. (2023) 19:4886–95. doi: 10.1002/alz.13050
47. Song, IU, Kim, YD, Chung, SW, and Cho, HJ. Association between serum haptoglobin and the pathogenesis of Alzheimer’s disease. Intern Med. (2015) 54:453–7. doi: 10.2169/internalmedicine.54.2876
48. Saengow, VE, Chiangjong, W, Khongkhatithum, C, Changtong, C, Chokchaichamnankit, D, Weeraphan, C, et al. Proteomic analysis reveals plasma haptoglobin, interferon-γ, and interleukin-1β as potential biomarkers of pediatric refractory epilepsy. Brain Dev. (2021) 43:431–9. doi: 10.1016/j.braindev.2020.11.001
49. Sadrzadeh, SM, Saffari, Y, and Bozorgmehr, J. Haptoglobin phenotypes in epilepsy. Clin Chem. (2004) 50:1095–7. doi: 10.1373/clinchem.2003.028001
50. Zhu, CJ, Jiang, GX, Chen, JM, Zhou, ZM, and Cheng, Q. Serum haptoglobin in Chinese patients with Alzheimer’s disease and mild cognitive impairment: a case-control study. Brain Res Bull. (2018) 137:301–5. doi: 10.1016/j.brainresbull.2018.01.005
51. Diouf, I, Bush, AI, and Ayton, S. Cerebrospinal fluid ceruloplasmin levels predict cognitive decline and brain atrophy in people with underlying β-amyloid pathology. Neurobiol Dis. (2020) 139:104810. doi: 10.1016/j.nbd.2020.104810
52. Brewer, GJ, Kanzer, SH, Zimmerman, EA, Celmins, DF, Heckman, SM, and Dick, R. Copper and ceruloplasmin abnormalities in Alzheimer’s disease. Am J Alzheimers Dis Other Dement. (2010) 25:490–7. doi: 10.1177/1533317510375083
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Wang, B, y Wang, XP. ¿La ceruloplasmina defiende contra las enfermedades neurodegenerativas? Curr Neuropharmacol. (2019) 17:539–49. doi: 10.2174/1570159X16666180508113025
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Tutor-Crespo, MJ, Hermida, J, y Tutor, JC. Evaluación del estado del cobre en pacientes epilépticos tratados con fármacos anticonvulsivos mediante la medición de la actividad oxidasa específica de la ceruloplasmina. Epilepsia Res. (2003) 56:147–53. doi: 10.1016/j.eplepsyres.2003.08.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Garey, CE, Schwarzman, AL, Rise, ML y Seyfried, TN. Defecto del gen de la ceruloplasmina asociado con la epilepsia en ratones EL. Nat Genet. (1994) 6:426–31. doi: 10.1038/ng0494-426
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Kopczynska, M, Zelek, WM, Vespa, S, Touchard, S, Wardle, M, Loveless, S, et al. Biomarcadores del sistema del complemento en la epilepsia. Convulsión. (2018) 60:1–7. doi: 10.1016/j.seizure.2018.05.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Williams, MA, Haughton, D, Stevenson, M, Craig, D, Passmore, AP y Silvestri, G. Factor H del complemento plasmático en la enfermedad de Alzheimer. J Alzheimers Dis. (2015) 45:369–72. doi: 10.3233/JAD-142742
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Lu, G, Liu, W, Huang, X y Zhao, Y. Los niveles del factor H del complemento disminuyen y se correlacionan con la proteína C reactiva sérica en la enfermedad de Alzheimer de inicio tardío. Arq Neuropsiquiatr. (2020) 78:76–80. doi: 10.1590/0004-282×20190151
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. García-Ferrer, I, Marrero, A, Gomis-Rüth, FX, y Goulas, T. α2-macroglobulinas: estructura y función En: JR Harris y J Marles-Wright, editores. Complejos proteicos macromoleculares: estructura y función. Cham: Springer International Publishing (2017). 149–83.
60. Garton, MJ, Keir, G, Lakshmi, MV, y Thompson, EJ. Cambios relacionados con la edad en las concentraciones de proteínas en el líquido cefalorraquídeo. J Neurol Sci. (1991) 104:74–80. doi: 10.1016/0022-510X(91)90218-V
61. Varma, VR, Varma, S, An, Y, Hohman, TJ, Seddighi, S, Casanova, R, et al. Alfa-2 macroglobulina en la enfermedad de Alzheimer: un marcador de lesión neuronal a través de la vía RCAN1. Mol Psiquiatría. (2017) 22:13–23. doi: 10.1038/mp.2016.206
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Wetterling, T, y Tegtmeyer, KF. Alfa 1-antitripsina y alfa 2-macroglobulina séricas en la enfermedad de Alzheimer y la enfermedad de Binswanger. Clin Investig. (1994) 72:196–9. doi: 10.1007/BF00189310
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Lauer, D, Reichenbach, A y Birkenmeier, G. Degradación mediada por α2-macroglobulina del amiloide β1-42: un mecanismo para mejorar el amiloide β el catabolismo. Exp Neurol. (2001) 167:385–92. doi: 10.1006/exnr.2000.7569
64. Cater, JH, Wilson, MR y Wyatt, AR. Alfa-2-macroglobulina, una chaperona regulada por hipoclorito y modulador del sistema inmunológico. Oxidativa Med Cell Longev. (2019) 2019:1–9. doi: 10.1155/2019/5410657
65. Kovacs, DM. α2-macroglobulina en la enfermedad de Alzheimer de inicio tardío. Exp Gerontol. (2000) 35:473–9. doi: 10.1016/S0531-5565(00)00113-3
66. Suprewicz, Ł, Tran, KA, Piktel, E, Fiedoruk, K, Janmey, PA, Galie, PA, et al. La gelsolina de plasma humano recombinante revierte el aumento de la permeabilidad de la barrera hematoencefálica inducida por la proteína de pico del virus SARS-CoV-2. J Neuroinflamación. (2022) 19:282. doi: 10.1186/s12974-022-02642-4
67. Peng, X, Zhang, X, Wang, L, Zhu, Q, Luo, J, Wang, W, et al. La gelsolina en el líquido cefalorraquídeo como posible biomarcador de epilepsia. Neurochem Res. (2011) 36:2250–8. doi: 10.1007/s11064-011-0549-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Furukawa, K, Fu, W, Li, Y, Witke, W, Kwiatkowski, DJ, y Mattson, MP. La proteína gelsolina, que corta la actina, modula las actividades de los canales de calcio y de los receptores NMDA y la vulnerabilidad a la excitotoxicidad en las neuronas del hipocampo. J Neurosci. (1997) 17:8178–86. doi: 10.1523/JNEUROSCI.17-21-08178.1997
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Lee, T-S, Li, AY, Rapuano, A, Mantis, J, Eid, T, Seyfried, TN, et al. Expresión génica en el hipocampo epiléptico (EL) del ratón. Neurobiol Dis. (2021) 147:105152. doi: 10.1016/j.nbd.2020.105152
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Ji, L, Zhao, X y Hua, Z. Posibles implicaciones terapéuticas de la gelsolina en la enfermedad de Alzheimer. J Alzheimers Dis. (2015) 44:13–25. doi: 10.3233/JAD-141548
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Jiang, Y, Wan, M, Xiao, X, Lin, Z, Liu, X, Zhou, Y, et al. Mutaciones de cambio de marco del gen GSN en la enfermedad de Alzheimer. J Neurol Neurosurg Psiquiatría. (2023) 94:436–47. doi: 10.1136/jnnp-2022-330465
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Antequera, D, Vargas, T, Ugalde, C, Spuch, C, Molina, JA, Ferrer, I, et al. La gelsolina citoplasmática aumenta la actividad mitocondrial y reduce la carga de Abeta en un modelo de ratón de la enfermedad de Alzheimer. Neurobiol Dis. (2009) 36:42–50. doi: 10.1016/j.nbd.2009.06.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: beta amiloide, epilepsia, proteómica, canino, vías de señalización
Cita: Phochantachinda S, Chantong B, Reamtong O y Chatchaisak D (2023) Perfil de proteínas y evaluación de los niveles de beta amiloide en plasma en la epilepsia refractaria canina. Frente. Vet. Sci. 10:1258244. doi: 10.3389/fvets.2023.1258244
Recibido: 13 de julio de 2023; Aceptado: 01 de diciembre de 2023;
Publicado: 21 diciembre 2023.
Editado por:
Elsayed Metwally, Universidad del Canal de Suez, Egipto
Revisado por:
Sam Long, Hospital de Referencia Veterinaria, Australia
Ahmed S. Mandour, Universidad del Canal de Suez, Egipto
Derechos de autor © 2023 Phochantachinda, Chantong, Reamtong y Chatchaisak. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Duangthip Chatchaisak, duangthip.cha@mahidol.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía