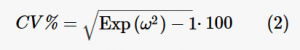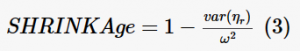Prednisolona en perros: exposición al plasma y respuesta de los glóbulos blancos
Prednisolona en perros: exposición al plasma y respuesta de los glóbulos blancos
 Carl Ekstrand1
Carl Ekstrand1  Helena Pettersson2,3
Helena Pettersson2,3  Ronette Gehring1,4*
Ronette Gehring1,4*  Mikael Hedeland5,6
Mikael Hedeland5,6  Sara Adolfsson1
Sara Adolfsson1  Inger Lilliehöök2,3
Inger Lilliehöök2,3- 1División de Farmacología y Toxicología, Departamento de Ciencias Biomédicas y Salud Pública Veterinaria, Universidad Sueca de Ciencias Agrícolas, Uppsala, Suecia
- 2División de Patología Clínica, Departamento de Ciencias Clínicas, Universidad Sueca de Ciencias Agrícolas, Uppsala, Suecia
- 3Laboratorio de Patología Clínica, Hospital Universitario de Animales, Universidad Sueca de Ciencias Agrícolas, Uppsala, Suecia
- 4División de Farmacología Veterinaria y Comparada, Departamento de Ciencias de la Salud de la Población, Universidad de Utrecht, Utrecht, Países Bajos
- 5Departamento de Química, Medio Ambiente e Higiene de los Piensos, Instituto Nacional de Veterinaria, Uppsala, Suecia
- 6Departamento de Química Médica, Universidad de Uppsala, Uppsala, Suecia
Los glucocorticoides como la prednisolona se utilizan comúnmente en perros, pero existe escasa información cuantitativa farmacocinética y farmacodinámica de este fármaco en esta especie. El objetivo de este estudio fue caracterizar cuantitativamente la relación concentración-efecto de la prednisolona en perros sobre el tráfico de neutrófilos y linfocitos y la supresión de cortisol. Nueve beagles, de 2 a 12 años de edad y parte de un grupo para la enseñanza/investigación, se utilizaron en un experimento cruzado de 4 vías que incluyó dos tratamientos, activo o placebo, administrados por vía oral (PO) o intravenosa (IV). El plasma se analizó para detectar prednisolona y cortisol mediante cromatografía líquida de ultra alta resolución – espectrometría de masas en tándem. Los recuentos de leucocitos se realizaron en sangre total. A continuación, los datos se analizaron mediante modelos no lineales de efectos mixtos para estimar los parámetros farmacocinéticos y farmacodinámicos. Después de la administración de succinato sódico de prednisolona IV, el valor típico (entre las variaciones de los sujetos) para el aclaramiento corporal total de prednisolona fue de 1.370 ml/h·kg (13,4%). Los volúmenes del compartimento central y periférico fueron de 2.300 ml/kg (10,7%) y 600 ml/kg (16,0%), respectivamente. La vida media del plasma terminal fue de 1,7 h. La concentración plasmática de prednisolona que produjo el 50% de la respuesta máxima fue de 10 ng/mL (90,3%), 22,5 ng/ml (52,3%) y 0,04 ng/mL (197,3%) para la respuesta de neutrófilos, linfocitos y cortisol, respectivamente. La dosis administrada (1 mg/kg) aumentó el número de neutrófilos y disminuyó el número de linfocitos, pero no durante todo el intervalo de dosificación de 24 h, debido a la corta vida media. Sin embargo, los glucocorticoides tienen una amplia gama de respuestas. Una respuesta antiinflamatoria debida a una transcripción génica alterada puede tener una duración más larga. Se necesitan estudios futuros sobre la potencia antiinflamatoria junto con los datos presentados para optimizar las futuras recomendaciones de dosis en perros.
Introducción
La prednisolona es un glucocorticoide comúnmente utilizado en perros por sus efectos antiinflamatorios e inmunosupresores. A pesar de su amplio uso, se dispone de escasa información sobre la farmacocinética (PK) y la farmacodinamia (DP) de la prednisolona en perros. Hace más de 35 años se publicaron algunos informes farmacocinéticos (1-4). Más recientemente, se han puesto a disposición datos sobre el tiempo de concentración de prednisolona, pero sin análisis exhaustivos de PK (5, 6). Los estudios de farmacocinética citados anteriormente se realizaron en pocos perros y, desde entonces, las mejoras técnicas han hecho que las técnicas analíticas para la cuantificación de fármacos en plasma sean más sensibles. Un límite inferior de cuantificación (LOQ) permite medir con precisión las concentraciones del fármaco durante un tiempo prolongado después de la administración. Esto permite una mayor comprensión de la disposición del fármaco durante la fase terminal de la curva concentración-tiempo, informando mejor el valor de los parámetros PK y la relación entre las concentraciones más bajas del fármaco y los efectos. Un ejemplo es la mejora de la comprensión de la disposición a la dexametasona en caballos después de las mejoras en el método analítico (7, 8). El aumento de la sensibilidad analítica utilizado por Soma et al. (8) reveló un tercer compartimento con una vida media terminal considerablemente más larga que la reportada por Toutain et al. (7), lo cual es importante para comprender la acumulación del fármaco y la duración de la supresión del cortisol. Además, los ordenadores personales y los programas informáticos modernos permiten realizar análisis PK/PD más sofisticados, los denominados modelos no lineales de efectos mixtos o análisis poblacionales que no sólo modelan los cursos temporales de concentración individuales, sino también la variabilidad de los datos (9). Estos modelos se utilizaron por primera vez en conjuntos de datos en los que se recogía un número limitado de muestras de un gran número de sujetos, pero también son útiles para analizar conjuntos de datos más ricos de menos individuos (10, 11). En humanos, existe información disponible sobre la potencia y eficacia de la prednisolona (12, 13). En medicina veterinaria, esta información falta. Se necesita información adicional sobre PK/PD para identificar las dosis iniciales adecuadas y diseñar mejores ensayos clínicos para futuros regímenes de dosificación optimizados. Por lo tanto, el objetivo de este estudio fue caracterizar las relaciones dosis-concentración-tiempo y concentración-efecto de la prednisolona en perros.
Materiales y métodos
Animales
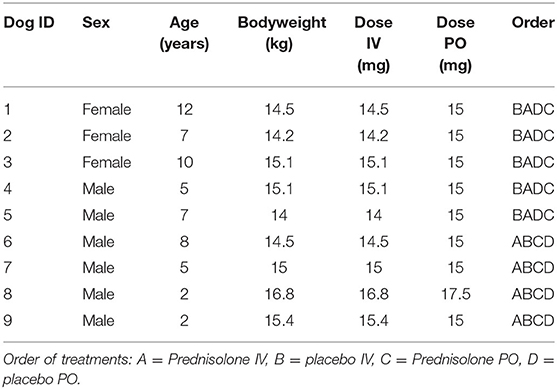
El estudio se realizó en nueve perros beagle que formaban parte de un grupo de docencia e investigación y estaban acostumbrados a la manipulación y muestreo (Tabla 1). Los perros se mantuvieron en su entorno familiar. Antes de cada tratamiento, se colocó un catéter intravenoso (IV) en la vena cefálica para la toma de muestras de sangre. Antes del tratamiento intravenoso, se colocó un catéter intravenoso adicional en la vena safena y se usó solo para administrar la prednisolona. Los perros se alojaron en grupos de dos a cuatro perros por razones sociales y de bienestar.
Alojamiento y alimentación
Las habitaciones eran de 20 m2 con plataformas elevadas, juguetes y espacios de descanso. Durante el día, los perros salían a un corral con una caseta para perros. Los perros tenían acceso a un gran corral de ejercicios con césped y túneles una vez a la semana. Los perros fueron alimentados con piensos comerciales nutricionalmente completos (Hills pet nutrition, Langeskog, Dinamarca) dos veces al día. El agua estaba disponible ad libitum.
Diseño Experimental
Los grupos de perros alojados juntos fueron asignados aleatoriamente a uno de cuatro tratamientos; activo (prednisolona) por vía oral (VO), activo por vía intravenosa (IV), placebo VO o placebo IV en un experimento cruzado de 4 vías. El orden de los tratamientos para cada perro se indica en la Tabla 1.
Tratamientos
Para los tratamientos activos, se administró prednisolona-succinato de sodio (Precortalon® aquosum, Biocodex AB, Kista, Suecia) a una concentración de 25 mg/ml una vez por vía intravenosa y comprimidos de prednisolona (Prednisolon Pfizer, Pfizer AB, Sollentuna, Suecia) una vez al día durante diez días consecutivos por vía oral en la comida matutina de los perros. Las dosis de prednisolona fueron de 0,97 a 1,07 mg/kg y la dosis precisa para cada perro se indica en la Tabla 1. Para los tratamientos con placebo se utilizó solución salina (Natriumklorid Fresenius Kabi 9 mg/ml, Fresenius Kabi AB, Uppsala, Suecia) por vía intravenosa y una comida matutina sin comprimidos de prednisolona por vía oral.
Recogida de muestras
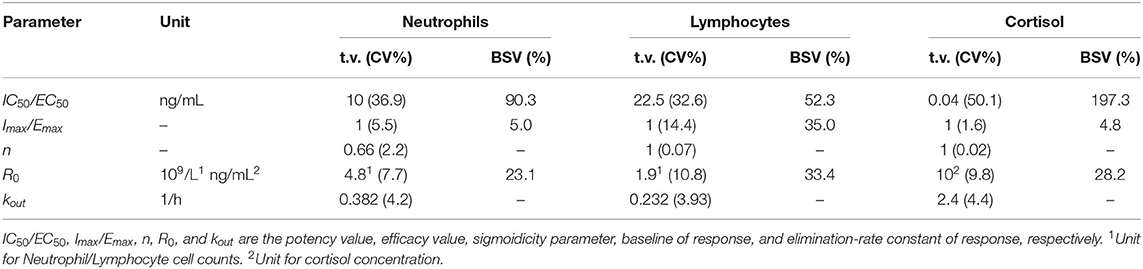
Durante el tratamiento intravenoso, se tomó muestra de sangre antes de la administración del fármaco (0 h) y 0,33, 0,67, 1, 2, 3, 4, 6, 9, 12, 24, 28, 32, 36, 48 y 60 h después de la administración del fármaco. Durante los tratamientos PO se tomó una muestra de sangre antes de la administración del fármaco a los días 1 (0 h), 7 (144 h) y 10 (216 h). Se tomó una muestra de sangre adicional 1, 2, 4, 7, 10, 22, 26, 30, 34 y 72 h después de la última administración del fármaco (217, 218, 220, 223, 226, 238, 242, 246, 250 y 288 h después de la primera dosis). En la Figura 1 se muestra una descripción general esquemática del protocolo de dosificación y muestreo. Se utilizaron tubos recubiertos de EDTA para todas las muestras de sangre. La sangre para el recuento diferencial de glóbulos blancos se transfirió a nuevos tubos antes de centrifugar el resto de la sangre a 2.100 g. El plasma se almacenó a -70 °C a la espera de los análisis de prednisolona y cortisol.
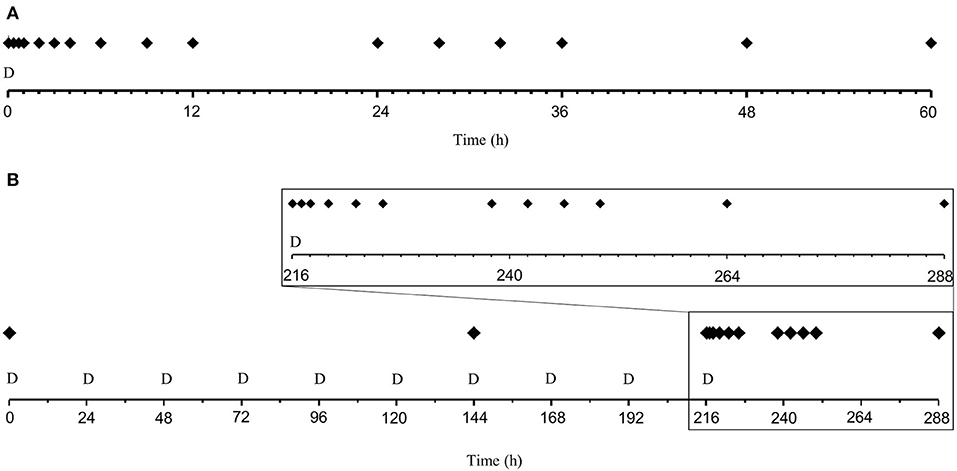 FIGURA 1. Resumen esquemático del régimen de dosis (D) y muestreo (diamantes rellenos) después de la administración de 1 mg/kg de succinato de prednisolona y placebo por vía intravenosa (IV, parcela superior «A«) o ~1 mg/kg de prednisolona o placebo una vez al día por vía oral (PO, parcela inferior «B«) durante 10 días a nueve perros beagle en un estudio cruzado. El aumento en el centro muestra los 3 días siguientes a la última dosis oral. (A) Dosis y régimen de muestreo para la administración intravenosa. (B) Dosis y régimen de muestreo para la administración de PO.
FIGURA 1. Resumen esquemático del régimen de dosis (D) y muestreo (diamantes rellenos) después de la administración de 1 mg/kg de succinato de prednisolona y placebo por vía intravenosa (IV, parcela superior «A«) o ~1 mg/kg de prednisolona o placebo una vez al día por vía oral (PO, parcela inferior «B«) durante 10 días a nueve perros beagle en un estudio cruzado. El aumento en el centro muestra los 3 días siguientes a la última dosis oral. (A) Dosis y régimen de muestreo para la administración intravenosa. (B) Dosis y régimen de muestreo para la administración de PO.
Recuento diferencial de glóbulos blancos
El recuento total y diferencial de glóbulos blancos se analizó con un instrumento ADVIA 2120 con Multi Species Software (Siemens Healthcare, Dublín Irlanda, L-00000062, 20 de diciembre de 2018), un método validado más preciso que los recuentos manuales (14).
Método analítico
Los análisis cuantitativos de prednisolona y cortisol se llevaron a cabo con cromatografía líquida de ultra alta resolución – espectrometría de masas en tándem (UHPLC-MS/MS) en el Instituto Nacional de Veterinaria (SVA), Uppsala, Suecia. Los compuestos de referencia para la prednisolona y el cortisol y los patrones internos [2H8]-prednisolon y [2H7]-hidrocortison se compraron a Toronto Research Chemicals (North York, ON, Canadá). La preparación de la muestra se realizó de la siguiente manera: se adicionaron 100 μL de plasma heparinado de litio canino (muestras de estudio, calibradores o muestras de control de calidad), 100 μL de solución patrón interna y 200 μL de ácido tricloroacético (20% v/v en agua) para la precipitación de proteínas. A continuación, las muestras se sometieron a vórtice durante 10 min y se centrifugaron a 10.000 g durante 10 min. Los sobrenadantes se transfirieron a placas de 96 pocillos y se inyectaron 10 μL en el sistema UHPLC-MS/MS que consiste en un UPLC Acquity acoplado a un espectrómetro de masas cuadrupolar microtándem Xevo TQ-S equipado con una interfaz de ionización por electrospray que funciona en modo positivo, todos de Waters Corp. (Milford, MA, EE. UU.). La columna analítica fue una Acquity UPLC BEH C18 (longitud 100 mm, diámetro interior 2,1 mm, tamaño de partícula 1,7 μm) mantenida a 65°C. La fase móvil consistió en (A) 10 mM de formiato de amonio en agua y (B) 0,1% de ácido fórmico en acetonitrilo. Se utilizó la elución en gradiente: inicialmente 23% B durante 3,0 min, aumento lineal a 80% B durante 0,5 min, constante al 80% B durante 1,0 min, disminución lineal al 23% B durante 0,1 min, constante al 23% B durante 0,9 min. El caudal se fijó en 400 μL/min. Los parámetros del electrospray fueron: tensión capilar 0,50 kV y tensión cónica 35 V. Las temperaturas de desolvatación y del bloque fuente fueron de 500 y 150 °C, respectivamente. El caudal de gas de desolvatación fue de 1.000 L/h. La cuantificación se llevó a cabo en el modo de Monitoreo de Reacción Seleccionada (SRM) con la celda de colisión llena de argón a 1,3 × 10−5 mBar. Las transiciones SRM utilizadas fueron m/z 361 → 147 para la prednisolona (energía de colisión 25 eV) y m/z 369 → 150 para [2H8]-prednisolona (energía de colisión 25 eV), m/z 363 → 121 para cortisol (energía de colisión 25 eV) y m/z 369 → 100 para [2H7]-hidrocortison. El tiempo de permanencia fue de 0,082 s. Las curvas de calibración se construyeron con la relación cromatográfica de área de pico (analito/patrón interno) en función de la concentración de analito. Las muestras de calibración y control de calidad para prednisolona se prepararon mediante la adición de un compuesto de referencia a plasma canino en blanco. Las muestras de calibración de cortisol se prepararon mediante la adición de un compuesto de referencia al agua, ya que este analito es endógeno al perro. Las muestras de control de calidad de cortisol se prepararon mediante la adición de un compuesto de referencia al agua y al plasma canino. Las funciones de calibración se calcularon mediante regresión lineal con un factor de ponderación de 1/x2 para ambos analitos.
Análisis farmacocinéticos y farmacodinámicos
Con el fin de obtener valores del área bajo la curva (AUC) para estimar la biodisponibilidad oral de prednisolona, los datos de concentración-tiempo plasmático se sometieron a análisis no compartimentales utilizando WinNonlin 4.0.1 (Certara, St. Louis, Missouri, U.S.A). A continuación, los datos de PK se analizaron mediante el ajuste de un modelo compartimental utilizando el enfoque de efectos mixtos no lineales (NLME) implementado en el software Monolix2018R2 (Antony, Francia: Lixoft SAS, 2018). La inspección visual de las parcelas diagnósticas, el Criterio de Información de Akaike (AIC) y el Criterio de Información Bayesiano (BIC) se utilizaron para juzgar el mejor ajuste. Las observaciones por debajo del LOQ se trataron como censuradas, es decir, cualquier valor positivo por debajo de 0,05 ng/mL. Los parámetros del modelo fueron los centrales (Vc) y periférica (VTI) volúmenes de distribución, aclaramiento plasmático (Cl) y aclaramiento de distribución intercompartimental (Cldi), donde i denota el número de compartimentos periféricos necesarios para describir mejor los datos. A continuación, se fijaron los valores de los parámetros obtenidos tras el análisis IV, de modo que la tasa de absorción oral constante (kun) y el tiempo de retardo en la absorción (tretraso) podría estimarse a partir de los datos de la orden de compra. Para el análisis de DP, se utilizaron los modelos IV y PO PK con valores de parámetros fijados a los valores estimados en el primer paso para simular el curso de la concentración de prednisolona en el tiempo que impulsa la respuesta a la DP. Se ajustó un modelo de recambio a los datos de DP (recuento de cortisol, linfocitos y neutrófilos) obtenidos después de la administración de prednisona y solución salina (placebo) por vía intravenosa y posolina. Para el cortisol se inhibió la producción, para los linfocitos se estimuló la pérdida y para los neutrófilos se inhibió la pérdida. Los parámetros del modelo fueron la respuesta máxima (Imáximo/Emáximo), la concentración al 50% de la respuesta máxima (CI50/EC50), el parámetro de sigmoicidad (n), la línea de base de la respuesta (R0) y la tasa de eliminación fraccionaria de la respuesta (kfuera).
El modelo estadístico de variabilidad entre sujetos (BSV) fue descrito mediante:
donde θYo es el valor de los parámetros farmacocinéticos en el iésimo perro, θtelevisión es el valor típico de población del parámetro y ηYo es la desviación del valor de población correspondiente asociado a la iésimo perro (15). El modelo exponencial asume una distribución logarítmica normal de los parámetros, es decir, que la distribución de las etas (ηYo) es normal en el dominio logarítmico, con una media de 0 y la desviación típica de los efectos aleatorios ω donde η≈N[0, ω2]. La desviación estándar de los efectos aleatorios reportados por Monolix® se transformó en un coeficiente de variación (CV%) utilizando la ecuación (2):
La reducción de los efectos aleatorios (eta) hacia las medias se describió como:
donde var(ηr) es la varianza de los efectos aleatorios. Cuando la contracción de eta fue >30%, el componente aleatorio no se consideró una estimación robusta. Se investigaron como covariables el sexo, el peso y la edad. En la evaluación de las covariables se utilizó el impacto en los valores de la función objetivo, el parámetro BSV y las funciones estadísticas internas de Monolix.
Resultados
Método analítico
Los rangos de calibración lineal fueron de 0,50 a 500 ng/ml para la prednisolona y de 0,27 a 543 ng/ml para el cortisol. La precisión (RSD%) fue para la prednisolona en el rango de 1,6-11% y para el cortisol de 1,3-10%. La precisión fue para la prednisolona en el rango de 87-108% y para el cortisol de 87-104%.
Evaluación del modelo
Se consideró que un modelo de dos compartimentos era el más adecuado para los datos de PK de prednisolona. La variabilidad entre sujetos pudo estimarse de forma robusta para todos los parámetros de PK y para la potencia (IC50), eficacia (Imáximo) y la línea de base de respuesta (R0) en el modelo de DP. Ninguna de las covariables mejoró el modelo y, por lo tanto, se descartaron. En la Figura 2 se muestra una descripción general esquemática del modelo PK/PD. Los gráficos de diagnóstico están disponibles en las Figuras Suplementarias 1 a 12.
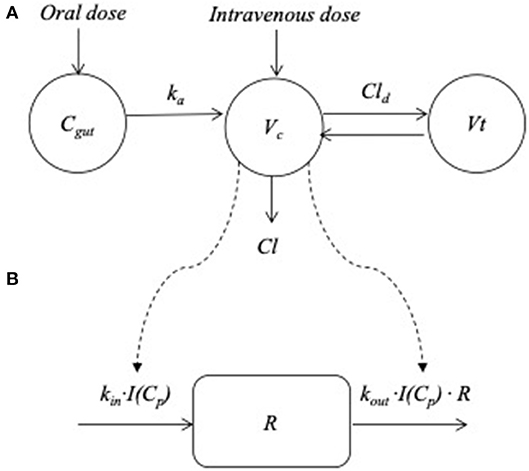 FIGURA 2. Visión general del modelo farmacocinético y farmacodinámico. (A) El modelo de absorción y disposición del plasma donde Ctripa , kun/ 5c, Vt , Cl y Cld representan el fármaco desechado en el intestino, la constante de la tasa de absorción desde el intestino hasta el compartimento central, el volumen de distribución central y periférico, el aclaramiento y el parámetro de distribución intercompartimental, respectivamente. (B) El modelo de recambio que describe los cambios inducidos por la prednisolona en la respuesta (R). La concentración plasmática (Cp) se utilizó para «impulsar» la función del mecanismo de la droga [I (Cp)] actuando sobre la tasa de rotación de respuesta cuando ken(t) , kfuera y R representan la tasa de rotación y la tasa de rotación fraccionaria. Para el cortisol se inhibió la producción de respuesta, para los linfocitos se estimuló la pérdida y para los neutrófilos se inhibió la pérdida de respuesta.
FIGURA 2. Visión general del modelo farmacocinético y farmacodinámico. (A) El modelo de absorción y disposición del plasma donde Ctripa , kun/ 5c, Vt , Cl y Cld representan el fármaco desechado en el intestino, la constante de la tasa de absorción desde el intestino hasta el compartimento central, el volumen de distribución central y periférico, el aclaramiento y el parámetro de distribución intercompartimental, respectivamente. (B) El modelo de recambio que describe los cambios inducidos por la prednisolona en la respuesta (R). La concentración plasmática (Cp) se utilizó para «impulsar» la función del mecanismo de la droga [I (Cp)] actuando sobre la tasa de rotación de respuesta cuando ken(t) , kfuera y R representan la tasa de rotación y la tasa de rotación fraccionaria. Para el cortisol se inhibió la producción de respuesta, para los linfocitos se estimuló la pérdida y para los neutrófilos se inhibió la pérdida de respuesta.
Concentraciones plasmáticas observadas de prednisolona
Después de la administración intravenosa de 1 mg/kg de prednisolona, las concentraciones plasmáticas de prednisolona disminuyeron rápidamente y las concentraciones observadas estaban por debajo de LOQ (0,5 ng/mL) después de 24 h en todos los perros. Doce horas después de la administración de prednisolona, la concentración plasmática de prednisolona osciló entre 0,78 y 4,1 ng/ml (Figura 3). Durante el tratamiento oral durante un período de 10 días, las concentraciones plasmáticas de prednisolona previas a la administración solo superaron el LOQ una vez (0,79 ng/ml, día 7) en un perro. Después de la última dosis, se observaron concentraciones plasmáticas máximas en ocho de los perros dentro de las 4 h posteriores a la administración y un perro que mostró una absorción más lenta y una concentración máxima 7 h después de la administración (Figura 3). Diez horas después de la última dosis, las concentraciones plasmáticas de prednisolona oscilaron entre 2,3 y 15,2 ng/ml en ocho perros. En un perro, la concentración plasmática de prednisolona fue de 42,6 ng/ml 10 h después de la última administración del fármaco. Este perro también mostró la absorción más lenta. A las 22 h después de la última administración de prednisolona, las concentraciones plasmáticas estaban por debajo del LOQ en todos los perros. En relación con la exposición plasmática a prednisolona después de la administración intravenosa, la biodisponibilidad de la PO fue mediana (rango) del 108% (87-118). La biodisponibilidad de la PO podría estar sesgada por hidrolizados lentos del éster de succinato y, por lo tanto, es una función de la biodisponibilidad después de la administración intravenosa (ver sección Discusión).
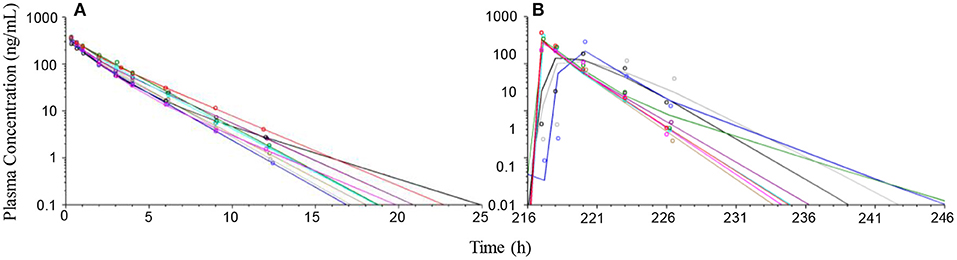 FIGURA 3. Observados (símbolos) y modelos predichos (líneas) de la concentración plasmática de prednisolona y la evolución del tiempo después de la administración de 1 mg/kg de succinato de prednisolona por vía intravenosa (gráfico A de la izquierda) y después de la última dosis (216 h después de la primera dosis) de aproximadamente 1 mg/kg durante 10 dosis orales diarias consecutivas (gráfico B de la derecha) a 9 perros beagle. Veinticuatro horas después de la administración intravenosa o 24 h después de la última dosis por vía oral (240 h después de la primera dosis), la concentración plasmática de prednisolona estaba por debajo del límite inferior de cuantificación (0,5 ng/ml) en todos los perros.
FIGURA 3. Observados (símbolos) y modelos predichos (líneas) de la concentración plasmática de prednisolona y la evolución del tiempo después de la administración de 1 mg/kg de succinato de prednisolona por vía intravenosa (gráfico A de la izquierda) y después de la última dosis (216 h después de la primera dosis) de aproximadamente 1 mg/kg durante 10 dosis orales diarias consecutivas (gráfico B de la derecha) a 9 perros beagle. Veinticuatro horas después de la administración intravenosa o 24 h después de la última dosis por vía oral (240 h después de la primera dosis), la concentración plasmática de prednisolona estaba por debajo del límite inferior de cuantificación (0,5 ng/ml) en todos los perros.
Un modelo farmacocinético de dos compartimentos se ajusta bien a los datos experimentales de prednisolona recogidos tras la administración intravenosa de succinato de prednisolona (Figura 3). Los parámetros se estimaron con buena precisión (CV 4-19%). A continuación, el modelo se ajustó a los datos experimentales de prednisolona recogidos después de la administración de la PO, pero los parámetros no pudieron estimarse de forma robusta, muy probablemente debido al enmascaramiento de la fase de distribución por la absorción. Por lo tanto, los parámetros de disposición se fijaron de modo que solo los parámetros de absorción necesitaban estimarse a partir de los datos de PO. Estos parámetros se estimaron con una precisión de aceptable a baja (CV 30-66%). En la Tabla 2 se muestran los parámetros farmacocinéticos y el BSV correspondiente.
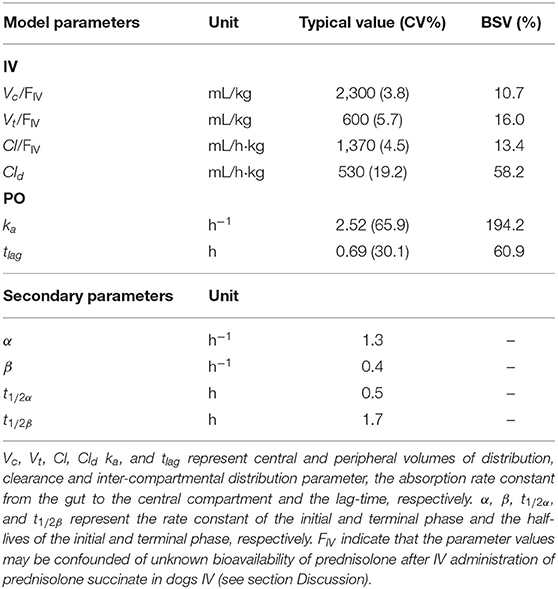 TABLA 2. El modelo estimó los valores farmacocinéticos típicos, su correspondiente desviación estándar relativa (CV%) y la diferencia entre la variación del sujeto (BSV) y los parámetros farmacocinéticos secundarios después de la administración intravenosa (IV) de 1 mg/kg de succinato de prednisolona y la administración de ~1 mg/kg de prednisolona por vía oral (PO).
TABLA 2. El modelo estimó los valores farmacocinéticos típicos, su correspondiente desviación estándar relativa (CV%) y la diferencia entre la variación del sujeto (BSV) y los parámetros farmacocinéticos secundarios después de la administración intravenosa (IV) de 1 mg/kg de succinato de prednisolona y la administración de ~1 mg/kg de prednisolona por vía oral (PO).
Respuesta de neutrófilos, linfocitos y cortisol
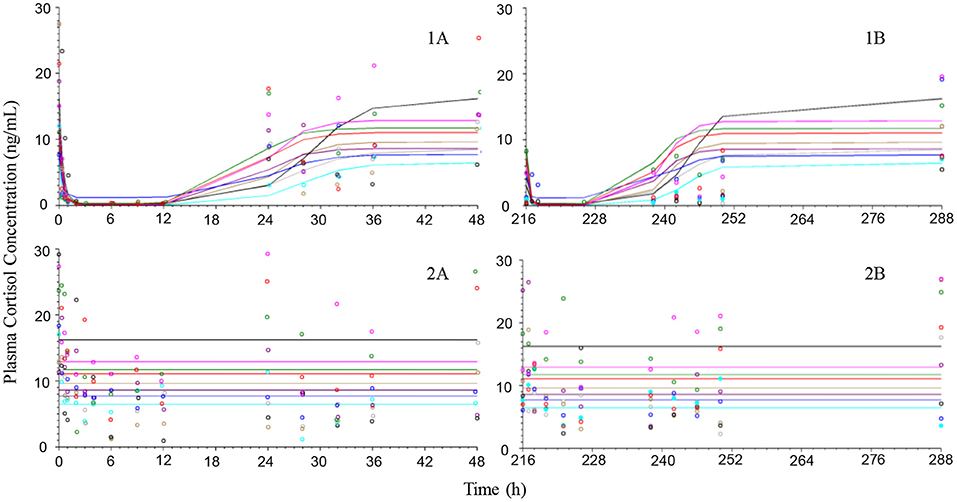
Las observaciones del tratamiento con placebo sugieren que los neutrófilos y los linfocitos tenían una variabilidad limitada en comparación con el cortisol, que era más variable tanto dentro de los animales como entre ellos (Figuras 4-6). La exposición a la prednisolona aumentó los recuentos de neutrófilos (Figura 4) y disminuyó tanto los recuentos de linfocitos (Figura 5) como las concentraciones plasmáticas de cortisol (Figura 6). Los tres ciclos de respuesta demostraron un inicio de respuesta dentro de las 3 h, una respuesta máxima dentro de las 10 h y se estimó que se volvió a la línea de base a las 24-36 h. El modelo de rotación describió bien los datos observados y generó los parámetros del modelo con una precisión de aceptable a buena. Los valores de los parámetros farmacodinámicos, su precisión y el BSV se muestran en la Tabla 3.
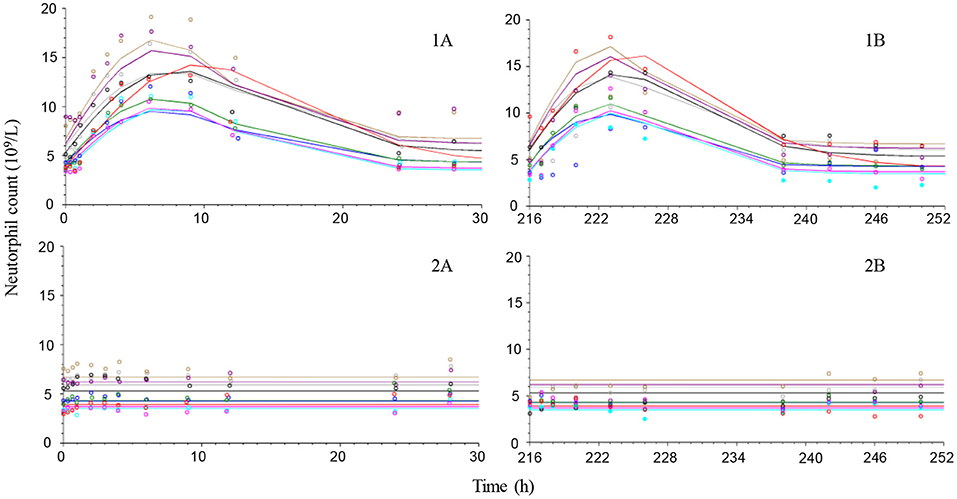 FIGURA 4. Observaron (símbolos) y predijeron el modelo (líneas) los cursos de tiempo de recuento de neutrófilos después de la administración intravenosa (gráficos de la izquierda) de 1 mg/kg de succinato de prednisolona (1A) o solución salina (2A) y después de la última dosis oral (gráficos de la derecha) (216 h después de la primera dosis) de ~1 mg/kg durante 10 dosis diarias consecutivas por vía oral (1B) o placebo (2B) a 9 perros beagle.
FIGURA 4. Observaron (símbolos) y predijeron el modelo (líneas) los cursos de tiempo de recuento de neutrófilos después de la administración intravenosa (gráficos de la izquierda) de 1 mg/kg de succinato de prednisolona (1A) o solución salina (2A) y después de la última dosis oral (gráficos de la derecha) (216 h después de la primera dosis) de ~1 mg/kg durante 10 dosis diarias consecutivas por vía oral (1B) o placebo (2B) a 9 perros beagle.
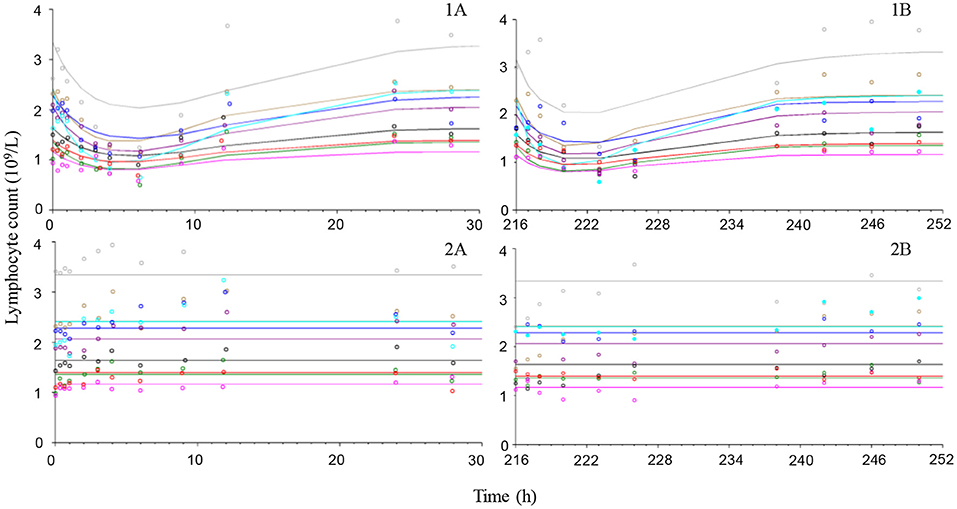 FIGURA 5. Observaron (símbolos) y predijeron el modelo (líneas) los ciclos de tiempo de recuento de linfocitos después de la administración intravenosa (gráficos de la izquierda) de 1 mg/kg de succinato de prednisolona (1A) o solución salina (2A) y después de la última dosis oral (gráficos de la derecha) (216 h después de la primera dosis) de ~1 mg/kg durante 10 dosis diarias consecutivas por vía oral (1B) o placebo (2B) a 9 perros beagle.
FIGURA 5. Observaron (símbolos) y predijeron el modelo (líneas) los ciclos de tiempo de recuento de linfocitos después de la administración intravenosa (gráficos de la izquierda) de 1 mg/kg de succinato de prednisolona (1A) o solución salina (2A) y después de la última dosis oral (gráficos de la derecha) (216 h después de la primera dosis) de ~1 mg/kg durante 10 dosis diarias consecutivas por vía oral (1B) o placebo (2B) a 9 perros beagle.
TABLA 3. El modelo estimó los valores típicos de farmacodinamia (t.v.), su correspondiente desviación estándar relativa (CV%) y entre la variación del sujeto (BSV) después de la administración intravenosa de 1 mg/kg de succinato de prednisolona y ~1 mg/kg de prednisolona por vía oral.
Faltaron dos valores en la respuesta de neutrófilos y linfocitos porque una muestra se había coagulado y otra se perdió debido a problemas técnicos. Los valores perdidos correspondían tanto al tratamiento intravenoso activo como a los de dos perros diferentes, 32 y 48 h después de la administración, respectivamente.
Discusión
El régimen posológico (dosis e intervalo de dosis) es una piedra angular en la terapia farmacológica. La PK (absorción, distribución y eliminación) de un fármaco combinada con los datos toxicológicos y el recambio de la respuesta a la EP deciden la ventana terapéutica y el régimen de dosificación. Este estudio describe la exposición plasmática, la PK y la PD de la prednisolona en perros utilizando recuentos de células de neutrófilos y linfocitos como respuesta a la exposición a la prednisolona, lo que proporciona evidencia adicional y aportes para futuros estudios que utilicen resultados clínicos o biomarcadores inflamatorios/inmunosupresores más relevantes para optimizar la farmacoterapia.
La exposición a prednisolona después de 1 mg/kg provocó un aumento del número de neutrófilos y una disminución del número de linfocitos que volvió al valor basal dentro de las 24 h posteriores a la administración de prednisolona. El retorno a la línea de base se debió a la corta vida media de la prednisolona en perros, lo que resultó en que las concentraciones plasmáticas cayeran por debajo de los valores de concentración efectiva en cuestión de horas, y a la renovación y migración relativamente rápidas de estos glóbulos blancos (16-18). La dosis de 1 mg/kg está dentro del rango de dosis clínicamente establecido (0,5-4 mg/kg) para la prednisolona. Sin embargo, si el tratamiento se va a continuar durante períodos de tiempo más largos, se debe utilizar la dosis efectiva más baja para minimizar los efectos adversos. Una dosis de 0,5 mg/kg cada dos días se considera clínicamente eficaz en algunos casos. Teniendo en cuenta la corta vida media terminal (1,7 h) y el alto CI50-valores (10-22,5 ng/mL), concentraciones superiores a los IC50-Los valores se mantuvieron <24 h en plasma tras la administración oral de 1 mg/kg de prednisolona a perros Beagle.
Se ha establecido que la eficacia clínica y la vida media de respuesta de los corticoides es mayor que la vida media farmacocinética de los glucocorticoides (19). Es probable que esto se deba a la modulación de la transcripción de genes que codifican para moduladores inflamatorios que tienen un recambio más lento que los biomarcadores medidos en este estudio. Las respuestas inmunosupresoras (y antiinflamatorias) a los glucocorticoides son numerosas (20). Por ejemplo, los glucocorticoides inducen la síntesis de la proteína antiinflamatoria anexina A1 (21). La anexina A1 se almacena en el citoplasma y debe degradarse antes de que desaparezca su efecto. Posiblemente la prednisolona afecte a algunos de estos biomarcadores con una mayor potencia, aumentando el tiempo en la ventana terapéutica. Ambos factores podrían explicar el efecto clínico que es más largo que la duración de la respuesta reportada aquí. Además, las dosis bajas de prednisolona se suelen utilizar contra los síntomas leves y crónicos. Posiblemente, la exposición corta inhibe los procesos estimulantes dentro del recambio de los procesos inflamatorios de bajo grado y, por lo tanto, dificulta el desarrollo de signos clínicos, lo que podría explicar por qué la dosis de 0,5 mg/kg cada dos días puede ser clínicamente eficiente. Sin embargo, esta hipótesis aún no se ha verificado en futuros estudios.
Las estimaciones de los parámetros farmacocinéticos presentados anteriormente para el aclaramiento y la biodisponibilidad son inferiores a sus valores típicos correspondientes en este estudio (1-3). La prednisolona es poco soluble en agua, por lo que los ésteres (p. ej., fosfato de prednisolona y succinato de prednisolona) se formulan y utilizan para la administración intravenosa. Tanto el fosfato de prednisona como el succinato de prednisolona son profármacos que deben ser bioconvertidos (es decir, hidrolizados) antes de que su compuesto activo, la prednisolona, esté disponible sistémicamente. El fosfato de prednisolona se convierte rápidamente en prednisolona en perros (22), lo que se interpretó como que la dosis completa de prednisolona estaba disponible sistémicamente. También se ha demostrado que el éster de succinato se hidroliza rápidamente in vivo en conejos, pero no in vitro en plasma o sangre total, lo que indica que el compuesto activo probablemente está disponible sistémicamente debido a la eliminación de órganos (23). En perros, sin embargo, la fracción de la dosis de metilprednisolona disponible sistémicamente fue del 43% después de la administración intravenosa de succinato de metilprednisolona (24). Toutain et al. (24) argumentan que esta diferencia de especies se debe a una predisposición genética a la sobreexpresión de carboxilasas en la cepa de conejo utilizada en (23). Si los resultados de (24) también son válidos para el succinato de prednisolona, los resultados de los análisis de farmacocinación presentados aquí deben interpretarse con gran precaución para otros tipos de ésteres de prednisolona. La parte farmacocinética del estudio asumió que la dosis administrada por vía intravenosa estaba disponible al 100% de forma sistémica y se utilizaba para estimar tanto la biodisponibilidad como el aclaramiento. El modelo PK se ajustó con éxito a los datos experimentales con una precisión de buena a aceptable y describió adecuadamente el curso de la concentración-tiempo. La disponibilidad sistémica potencialmente baja de prednisolona después de la administración intravenosa de prednisolona justifica una mayor atención en relación con los resultados del modelo PK. Si la biodisponibilidad de la prednisolona en perros es similar a la de la metilprednisolona en (24), podría explicar la diferencia en la biodisponibilidad y los valores medios de aclaramiento informados después de la administración intravenosa de fosfato de prednisolona (1-3). Cabe señalar que el rango de valores de aclaramiento dentro de las poblaciones previamente estudiadas en (1-3) se superpone al rango de parámetros individuales para el aclaramiento en este estudio. No se puede excluir que las diferencias en los resultados puedan deberse a la variabilidad entre los estudios. Sin embargo, la fracción de prednisolona disponible sistémicamente después de la administración intravenosa de fosfato de prednisolona y succinato de prednisolona merece atención futura. Hasta entonces, los valores de los parámetros del modelo farmacocinético informados en este estudio deben considerarse específicos para la formulación de succinato y solo extrapolarse a formulaciones que contengan otras sales con precaución. La vida media terminal, que es un parámetro clínico importante ya que se utiliza para estimar el intervalo de dosificación, depende de la velocidad de eliminación que, a su vez, determina la pendiente de la fase terminal del curso de tiempo de concentración. El modelo se ajustó adecuadamente a las observaciones experimentales, imitó la pendiente y, por lo tanto, la vida media debe considerarse confiable. Las vidas medias también se confirmaron mediante la inspección visual de los datos experimentales.
La razón principal para realizar un análisis de PK en los datos de prednisolona fue derivar un perfil de PK que luego se utilizó para «impulsar» el modelo de DP. Los cursos de tiempo predichos se ajustaron bien a los datos experimentales y los análisis farmacocinéticos fueron funcionales en este aspecto (datos no mostrados). En consecuencia, los parámetros de DP para el aumento del número de neutrófilos, la disminución del número de linfocitos y la supresión del cortisol merecen atención. Estas son respuestas conocidas de glucocorticoides (25-28). En otras especies, los recuentos de glóbulos blancos y la supresión del cortisol también se han utilizado para obtener datos cuantitativos de EP y estimar la magnitud y duración de la respuesta a los glucocorticoides (12, 29, 30). El modelo farmacodinámico se ajustó a los datos experimentales, los cursos de tiempo predichos imitaron bien los datos y los parámetros del modelo se estimaron con una precisión de buena a aceptable. Para mantener la concentración plasmática de prednisolona por encima del valor de potencia durante todo el intervalo de dosificación, es necesario un aumento de la dosis diaria de 1 mg/kg y una dosificación más frecuente. Si los cambios en los recuentos de glóbulos blancos son marcadores sustitutos adecuados para las respuestas inmunosupresoras a la prednisolona, estos resultados refuerzan la dosis diaria inicial empírica de prednisolona para la inmunosupresión (2-4 mg/kg). Sin embargo, se sabe que los pacientes individuales responden a dosis más bajas (31, 32). Por lo tanto, las dosis deben reducirse individualmente para lograr la dosis de prednisolona clínicamente más baja posible para un paciente específico. Por lo tanto, los resultados presentados en este estudio son más útiles como insumo en el diseño de estudios clínicos que para recomendaciones de dosis individuales. Por ejemplo, se pueden realizar simulaciones de Monte Carlo con el modelo para predecir la probabilidad de resultados clínicos favorables para un régimen de dosificación determinado en una población objetivo (33). Estas predicciones pueden compararse con los resultados experimentales como parte del ciclo de aprendizaje-confirmación del desarrollo de terapias veterinarias seguras y eficaces. También hay que tener en cuenta que en este estudio se utilizaron únicamente perros Beagle. Pueden ocurrir diferencias entre razas en PK y PD (34) y los resultados de este estudio deben interpretarse teniendo esto en cuenta. En el futuro, este modelo podrá ser validado y perfeccionado con datos de estudios en otras razas para cuantificar cualquier posible variabilidad en los valores de los parámetros PK y PD.
El BSV para los parámetros PK fue bajo para los parámetros estimados con buena precisión. Los parámetros kun y tretraso ambos tenían baja precisión y alto BSV, lo que probablemente se debió a datos experimentales limitados en la fase de absorción. Sin embargo, también el valor de potencia (IC50/EC50El BSV fue bastante sustancial en este estudio, con los valores más altos para la respuesta de cortisol. Se sabe que la EP suele mostrar una mayor variabilidad entre individuos que la PK (35). Hasta donde sabemos, no se han publicado valores de BSV para las respuestas de glucocorticoides en perros. En el caballo, el BSV para la supresión del cortisol después de la exposición a la dexametasona fue de hasta el 80% (36, 37), lo que es comparable con el BSV para la CI de neutrófilos y linfocitos50–pero inferiores a la variabilidad de la potencia de respuesta al cortisol en este estudio. La razón detrás de esta variación no se conoce completamente, pero se ha demostrado que el sexo y la edad son fuentes de variación en la concentración de cortisol en perros (38, 39). En el presente estudio, la edad y el sexo se evaluaron como covariables, pero no pudieron explicar el gran VSB. Posiblemente, una población de estudio más grande aumentaría las posibilidades de explicar la variación del VSB debido a la edad y el sexo. Las diferencias entre las especies, las sustancias y el diseño del estudio podrían proporcionar posibles explicaciones adicionales al BSV relativamente alto.
En conclusión: la prednisolona se elimina rápidamente, lo que da como resultado una vida media terminal corta. Después de la administración de PO, se observaron concentraciones máximas dentro de 1 h en la mayoría de los perros. La dosis administrada (1 mg/kg) provocó un aumento del número de neutrófilos y una disminución del número de linfocitos, pero no dio lugar a una concentración plasmática efectiva durante todo el intervalo de dosificación de 24 h. Sin embargo, los glucocorticoides tienen una amplia gama de respuestas y, por ejemplo, las respuestas antiinflamatorias debidas a la transcripción génica alterada pueden tener efectos de mayor duración. Los estudios futuros sobre la potencia antiinflamatoria de la prednisolona, junto con los datos presentados aquí, podrían optimizar las futuras recomendaciones de dosis en perros.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración de Ética
El estudio en animales fue revisado y aprobado por el Comité de Ética Animal, Uppsala, Suecia (5.8.18-07216/2017).
Contribuciones de los autores
CE, HP, SA e IL planificaron y ejecutaron el experimento. MH e IL analizaron prednisolona, cortisol y realizaron recuentos celulares. CE y RG realizaron análisis PK/PD. CE redactó el manuscrito con la ayuda de RG. Todos los autores revisaron y aprobaron la versión final del manuscrito.
Financiación
Este trabajo fue apoyado por el fondo de investigación Agria y SKK (subvención número N2016-0004). La fuente de financiación no participó en ninguna parte del estudio.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Reconocimientos
Los autores desean agradecer a Emma Hörnebro, Sofia Rylander, Jeanette Hansson y Anna Hillström de SLU por toda la ayuda durante la fase experimental del estudio.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2021.666219/full#supplementary-material
Referencias
1. Tse FL, Welling PG. Biodisponibilidad de la prednisolona en el perro. J Pharm Sci. (1977) 66:1751–4. doi: 10.1002/jps.2600661225
2. Frey FJ, Frey BM, Greither A, Benet LZ. Depuración de prednisolona en estado estacionario en perros. J Pharmacol Exp ther. (1980) 215:287–91.
3. Frey FJ, Frey BM. Desigualdad de los valores de aclaramiento obtenidos por bolo intravenoso y por infusión en estado estacionario. Estudios de prednisolona en perros. Farmacología. (1982) 24:346–54. doi: 10.1159/000137617
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Hankes GH, Lazenby LR, Ravis WR, Belmonte AA. Farmacocinética del succinato sódico de prednisolona y sus metabolitos en perros normovolémicos e hipovolémicos. Am J Vet Res. (1985) 46:476–8.
5. De Vries F, Leuschner J, Jilma B, Derhaschnig U. Establecimiento de un modelo de endotoxemia canina de dosis baja para probar medicamentos antiinflamatorios, efectos de la prednisolona. Int J Immunopathol Pharmacol. (2013) 26:861–9. doi: 10.1177/039463201302600404
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Nam A, Kim SM, Jeong JW, Song KH, Koo TS, Seo KW. Comparación del formato de dosificación basado en el área de superficie corporal y en el peso para la administración oral de prednisolona en perros de razas pequeñas y grandes. Pol J Vet Sci. (2017) 20:611–3. doi: 10.1515/pjvs-2017-0076
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Toutain PL, Brandon RA, de Pomyers H, Alvinerie M, Baggot JD. Dexametasona y prednisolona en el caballo: farmacocinética y acción sobre la glándula suprarrenal. Am J Vet Res. (1984) 45:1750–6.
8. Soma LR, Uboh CE, Luo Y, Guan F, Moate PJ, Boston RC. Farmacocinética de la dexametasona con modelo farmacocinético/farmacodinámico del efecto de la dexametasona sobre la hidrocortisona endógena y la cortisona en el caballo. J Vet Pharmacol Ther. (2005) 28:71–80. doi: 10.1111/j.1365-2885.2004.00632.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Bon C, Toutain PL, Concordet D, Gehring R, Martin-Jimenez T, Smith J, et al. Modelización y simulación matemática en sanidad animal. Parte III: Uso de efectos mixtos no lineales para caracterizar y cuantificar la variabilidad en la farmacocinética de fármacos. J Vet Pharmacol Ther. (2018) 41:171–83. doi: 10.1111/jvp.12473
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Sheiner LB, Rosenberg B, Melmon KL. Modelización de la farmacocinética individual para la dosificación de fármacos asistida por ordenador. Comput Biomed Res. (1972) 5:411–59. doi: 10.1016/0010-4809(72)90051-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Pelligand L, Soubret A, King JN, Elliott J, Mochel JP. Modelado de grandes datos farmacocinéticos utilizando efectos mixtos no lineales: un cambio de paradigma en farmacología veterinaria. Un estudio de caso con robenacoxib en gatos. CPT Pharmacometr Syst Pharmacol. (2016) 5:625–35. doi: 10.1002/psp4.12141
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Magee MH, Blum RA, Lates CD, Jusko WJ. Modelo farmacocinético/farmacodinámico para la inhibición de la proliferación de linfocitos en sangre total con prednisolona. Hno. J Clin Pharmacol. (2002) 53:474–84. doi: 10.1046/j.1365-2125.2002.01567.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Hong Y, Mager DE, Blum RA, Jusko WJ. Modelización farmacocinética/farmacodinámica poblacional de la inhibición sistémica de corticosteroides de linfocitos de sangre total: modelización de la variabilidad farmacodinámica interocasional. Pharm Res. (2007) 24:1088–97. DOI: 10.1007/S11095-006-9232-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Tvedten HW, Lilliehöök IE. Recuento diferencial de leucocitos caninos con los analizadores hematológicos CellaVision DM96Vision, Sysmex XT-2000iV y Advia 2120 y un método manual. Veterinario Clin Pathol. (2011) 40:324–39. doi: 10.1111/j.1939-165X.2011.00347.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Bonate P. Modelos no lineales de efectos mixtos: teoría. En: Modelación y Simulación Farmacocinético-Farmacodinámica. 2ª ed. Boston, MA: Springer (2011).
16. Raab SO, Athens JW, Haab OP, Boggs DR, Ashenbrucker H, Cartwright GE, et al. Granulucinética en perros normales. Am J Physiol. (1964) 206:83–8. doi: 10.1152/ajplegacy.1964.206.1.83
17. Deubelbeiss KA, Dancey JT, Harker LA, Finch CA. Cinética de neutrófilos en el perro. J Clin Invest. (1975) 55:833–9. doi: 10.1172/JCI107994
18. Ganusov VV, Auerbach J. El modelado matemático revela la cinética de la recirculación de linfocitos en todo el organismo. PLoS Comput Biol. (2014) 10:e1003586. doi: 10.1371/journal.pcbi.1003586
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Lees P, May SA, White D. Farmacocinética y regímenes de dosificación de medicamentos antiinflamatorios. Ann Rech Veterinaria. (1990) 21 (Supl. 1):73s–78s.
20. Caín DW, Cidlowski JA. Regulación inmune por glucocorticoides. Nat Rev Immunol. (2017) 17:233–247. doi: 10.1038/nri.2017.1
21. Perretti M, D’Acquisto F. Anexina A1 y glucocorticoides como efectores de la resolución de la inflamación. Nat Rev Immunol. (2009) 9:62–70. doi: 10.1038/nri2470
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Kitagawa H, Mori T, Kitagawa M. Estudios comparativos sobre el efecto antiinflamatorio y los destinos biológicos de los 21-fosfatos y sulfatos de dexametasona y prednisolona. Arzneimittelforschung. (1972) 22:402–10.
23. Ebling WF, Szefler SJ, Jusko WJ. Disposición de metilprednisolona en conejos. Análisis, conversión de profármacos, metabolismo reversible y comparación con el hombre. Drug Metab Dispos. (1985) 13:296-304.
24. Toutain PL, Koritz GD, Fayolle PM, Alvinerie M. Farmacocinética de la metilprednisolona, el succinato de sodio de metilprednisolona y el acetato de metilprednisolona en perros. J Pharm Sci. (1986) 75:251–5. doi: 10.1002/jps.2600750309
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Jasper DE, Jain NC. Influencia de la hormona adrenocorticotrópica y la prednisolona sobre la médula ósea y los leucocitos circulantes en el perro. Am J Vet Res. (1965) 26:844–50.
26. Braun JP, Guelfi JF, Thouvenot JP, Rico AG. Efectos hematológicos y bioquímicos de una dosis intramuscular única de acetato de 6-metilprednisolona en el perro. Res Vet Sci. (1981) 31:236–8. doi: 10.1016/S0034-5288(18)32500-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Moore GE, Mahaffey EA, Hoenig M. Efectos bioquímicos hematológicos y séricos de la administración a largo plazo de dosis antiinflamatorias de prednisona en perros. Am J Vet Res. (1992) 53:1033–7.
28. Melamies M, Vainio O, Spillmann T, Junnila J, Rajamäki MM. Efectos endocrinos de la budesonida inhalada en comparación con el propionato de fluticasona inhalado y la prednisolona oral en perros Beagle sanos. Veterinario J. (2012) 194:349–53. doi: 10.1016/j.tvjl.2012.04.029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Wald JA, Law RM, Ludwig EA, Sloan RR, Middleton E Jr, Jusko WJ. Evaluación de la farmacocinética y farmacodinamia relacionadas con la dosis de prednisolona en el hombre. J Pharmacokinet Biopharm. (1992) 20:567–89. doi: 10.1007/BF01064420
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Ekstrand C, Ingvast-Larsson C, Olsén L, Hedeland M, Bondesson U, Gabrielsson J. Un enfoque cuantitativo para analizar la respuesta de cortisol en el caballo. J Vet Pharmacol Ther. (2016) 39:255–63. doi: 10.1111/jvp.12276
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Saridomichelakis MN, Olivry T. Una actualización sobre el tratamiento de la dermatitis atópica canina. Veterinario J. (2016) 207:29–37. doi: 10.1016/j.tvjl.2015.09.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Cornelis I, van Ham L, Gielen I, de Decker S, Bhatti SFM. Presentación clínica, hallazgos diagnósticos, factores pronósticos, tratamiento y evolución en perros con meningoencefalomielitis de origen desconocido: una revisión. Veterinario J. (2019) 244:37–44. doi: 10.1016/j.tvjl.2018.12.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Sheiner LB. Aprendizaje versus confirmación en el desarrollo clínico de fármacos. Clin Pharmacol Ther. (1997) 61:275–91. doi: 10.1016/S0009-9236(97)90160-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Fleischer F, Sharkey M, Mealey K, Ostrander EA, Martinez M. Diferencias farmacogenéticas y metabólicas entre razas de perros: su impacto en la medicina canina y el uso del perro como modelo animal preclínico. AAPS J. (2008) 10:110–9. doi: 10.1208/s12248-008-9011-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Levy G. Predicción de concentraciones efectivas de fármacos para pacientes individuales. Determinantes de la variabilidad farmacodinámica. Clin Pharmacokinet. (1998) 34:323–33. doi: 10.2165/00003088-199834040-00005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Held F, Ekstrand C, Cvijovic M, Gabrielsson J, Jirstrand M. Modelización de la respuesta oscilatoria al cortisol en caballos utilizando un enfoque poblacional bayesiano para la evaluación de los protocolos de prueba de supresión de dexametasona. J Pharmacokinet Pharmacodyn. (2019) 46:75–87. doi: 10.1007/s10928-018-09617-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Knych HK, Weiner D, Arthur RM, Baden R, McKemie DS, Kass PH. Concentraciones séricas, modelado farmacocinético/farmacodinámico y efectos de la dexametasona en los mediadores inflamatorios después de la administración intravenosa y oral a caballos ejercitados. Prueba de drogas anal. (2020) 12:1087–101. doi: 10.1002/dta.2862
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Reul JM, Rothuizen J, de Kloet ER. Cambios relacionados con la edad en el sistema hipotálamo-hipófisis-adrenocortical del perro: actividad neuroendocrina y receptores de corticosteroides. J Esteroide Biochem Mol Biol. (1991) 40:63–9. doi: 10.1016/0960-0760(91)90168-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Mongillo P, Prana E, Gabai G, Bertotto G, Marinelli L. Efecto de la edad y el sexo sobre las concentraciones plasmáticas de cortisol y dehidroepiandrosterona en el perro (Canis familiaris). Res Vet Sci. (2014) 96:33–8. doi: 10.1016/j.rvsc.2013.10.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: canino, glucocorticoide, farmacocinética, farmacodinamia, inmunosupresión
Cita: Ekstrand C, Pettersson H, Gehring R, Hedeland M, Adolfsson S y Lilliehöök I (2021) Prednisolona en perros: exposición al plasma y respuesta de los glóbulos blancos. Frente. Vet. Sci. 8:666219. doi: 10.3389/fvets.2021.666219
Recibido: 09 de febrero de 2021; Aceptado: 14 de mayo de 2021;
Publicado: 09 Junio 2021.
Editado por:
Nora Mestorino, Universidad Nacional de La Plata, Argentina
Revisado por:
Pritam Kaur Sidhu, Universidad de Ciencias Veterinarias y Animales Guru Angad Dev, India
Parque Seung-Chun, Universidad Nacional de Kyungpook, Corea del Sur
Derechos de autor © 2021 Ekstrand, Pettersson, Gehring, Hedeland, Adolfsson y Lilliehöök. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY). S
*Correspondencia: Ronette Gehring, r.gehring@uu.nl
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía