Preparación preoperatoria de pacientes con animales pequeños
Preparación preoperatoria de pacientes con animales pequeños: una revisión de los antisépticos comunes, estudios comparativos y resistencia
 Alicia K. Nye
Alicia K. Nye  Kelley M. Thieman Mankin*
Kelley M. Thieman Mankin*- Departamento de Ciencias Clínicas de Pequeños Animales, Facultad de Medicina Veterinaria y Ciencias Biomédicas, Universidad de Texas A&M, College Station, TX, Estados Unidos
Esta revisión tiene como objetivo describir los antisépticos de uso común en medicina veterinaria, incluido su mecanismo de acción, espectro de actividad, posibles efectos adversos y técnicas de aplicación. Además, proporciona una revisión de la literatura veterinaria que compara los antisépticos, una discusión de la efectividad y los estudios de eficacia, y el potencial de una mayor resistencia a los biocidas y antimicrobianos. Esta revisión concluye que es necesaria una selección y un uso adecuados para prevenir la aparición de infecciones del sitio quirúrgico, los efectos adversos y la posibilidad de aumentar la resistencia a los antimicrobianos. Se necesita investigación continua para llenar los vacíos en el conocimiento actual, como los procedimientos de preparación óptimos para varios sitios quirúrgicos, la estandarización de las pruebas de eficacia y efectividad, y el impacto clínico de la disminución de la susceptibilidad a la clorhexidina y otros antisépticos.
1 Introducción
Las infecciones del sitio quirúrgico (ISQ) plantean un desafío importante en la medicina veterinaria con respecto a la selección del tratamiento con antibióticos, la prevención de infecciones adquiridas en el hospital y los riesgos zoonóticos. Los estudios de ISQ veterinarias realizados en las últimas dos décadas informan una incidencia de aproximadamente 3-6% para todos los procedimientos (1-5) con un rango de 1,7% para procedimientos mínimamente invasivos (6) a 15,8% para ciertos procedimientos ortopédicos (7). Además del aumento del costo, el uso de antibióticos y la morbilidad de los pacientes asociados con las ISQ, la proximidad de los animales de compañía a los humanos y el potencial de infecciones zoonóticas requieren la optimización de las estrategias para la prevención de la ISQ en los hospitales veterinarios.
La preparación aséptica de los pacientes implica el uso de antisépticos preoperatorios para evitar la contaminación de la herida que puede conducir al desarrollo de infecciones. La asepsia quirúrgica se define como la ausencia de microorganismos dentro de cualquier tipo de procedimiento invasivo. Sin embargo, hasta el 20% de la flora residente de la piel está fuera del alcance de los antisépticos, por lo que la preparación aséptica de los pacientes implica realmente una reducción de la flora residente y la eliminación, inhibición o destrucción de organismos transitorios y patógenos en el sitio operatorio propuesto (8).
El origen de la asepsia quirúrgica en el siglo XIX se produjo en respuesta a las altas tasas de mortalidad postoperatoria tras infecciones de heridas quirúrgicas. En 1865 Joseph Lister, un cirujano conocido como pionero en cirugía antiséptica, descubrió que la aplicación de apósitos empapados en ácido carbólico disminuía la aparición de infecciones. Más de una década después, el médico y microbiólogo Robert Koch pudo relacionar las bacterias con las infecciones de las heridas. Realizó una serie de experimentos para evaluar la eficacia de diferentes agentes antisépticos. A través de los esfuerzos de muchos cirujanos, médicos y científicos adicionales durante las décadas siguientes, la asepsia quirúrgica evolucionó para incluir estándares en la preparación del paciente, el cirujano, el instrumento y el entorno que definen las prácticas quirúrgicas modernas (9).
Hoy en día, los antisépticos se eligen en función de su eficacia para matar bacterias y otros microorganismos, la rapidez de acción, la seguridad, la facilidad de uso y la persistencia de la acción, entre otros criterios. Los antisépticos más utilizados para la preparación quirúrgica de los pacientes incluyen clorhexidina, compuestos de yodo y alcoholes (10).
2 Clorhexidina
La clorhexidina (CHX) es un bisbiguanida catiónico, desinfectante y antiséptico. Su mecanismo de acción se basa en su capacidad para unirse a la membrana celular bacteriana y alterarla. La capa más externa de la célula bacteriana tiene una carga negativa neta debido a los componentes de la pared celular, incluidos el ácido teicoico y los polisacáridos de las bacterias Gram-positivas, el lipopolisacárido de las bacterias Gram-negativas y la membrana celular más profunda. Las agrupaciones catiónicas de biguanida dentro de la molécula se unen fuertemente a sitios cargados negativamente, particularmente proteínas y los grupos principales de fosfolípidos ácidos en las membranas celulares, lo que provoca el desplazamiento de cationes divalentes que ayudan a estabilizar la pared y la membrana. La distancia entre los sitios de unión de fosfolípidos de CHX es aproximadamente equivalente a la distancia entre las cabezas de fosfolípidos en una monocapa compacta, lo que la hace capaz de formar un puente entre dos fosfolípidos de membrana adyacentes. A bajas concentraciones, CHX causa una reducción de la fluidez de la membrana y afecta la membrana celular y las enzimas asociadas osmorreguladoras y metabólicas. Esto conduce a la fuga celular de iones de potasio y protones, y a la inhibición de la respiración y el transporte de solutos dentro de las bacterias. A medida que aumentan las concentraciones, la membrana se transforma de un estado fluido a un estado líquido-cristalino, lo que lleva a una pérdida de integridad estructural, fuga de materiales celulares y muerte celular bacteriana. Las altas concentraciones provocan la coagulación de los constituyentes intracelulares y la congelación del citoplasma, lo que permite que CHX interrumpa y mate las células bacterianas sin lisis celular (11, 12).
El mecanismo de acción de CHX permite un amplio espectro de actividad antimicrobiana. CHX es más activo contra las bacterias Gram-positivas, pero también tiene actividad contra bacterias Gram-negativas, anaerobios, hongos y algunos virus con envoltura. Es ineficaz contra las esporas bacterianas y es micobacteristático (10, 11, 13). Es rápidamente absorbido por bacterias y levaduras, y el efecto máximo se produce en 20 s (10, 11). Su capacidad para unirse a proteínas en el estrato córneo de la epidermis permite la persistencia de la acción (8), que se ha demostrado que tiene un efecto acumulativo con el uso repetido (14). Se ha demostrado que la actividad residual de CHX dura al menos 24 h en la piel y se extiende a 48 h cuando se combina con alcohol en una tintura (una solución hecha con alcohol como disolvente) (15). Curiosamente, un estudio realizado por Rutter et al. evaluó la actividad residual de CHX mediante la aplicación de S. aureus a las manos de los participantes a través de la contaminación por contacto seco. La actividad residual solo se apreció cuando las manos de los participantes se volvieron a humedecer después de la contaminación, lo que indica que solo produce una muerte residual cuando está en solución. Sin embargo, los autores no evaluaron la actividad residual en áreas de humedad de facto (p. ej., manos enguantadas, regiones corporales húmedas) ni investigaron la supresión del crecimiento de la microflora residente (16). Se ha encontrado que los espesantes o emulsionantes aniónicos, como los que se encuentran en ciertos productos humectantes y desinfectantes para manos, inactivan la persistencia de la acción de CHX (17-19).
CHX está disponible en formulaciones de sal de gluconato o diacetato. Las preparaciones exfoliantes suelen contener detergentes y alcohol, mientras que las formulaciones acuosas están libres de estas sustancias. Los ingredientes inactivos varían según la fórmula patentada utilizada por el fabricante. El exfoliante de gluconato de CHX es el agente más común utilizado en la piel intacta para la preparación del paciente en clínicas veterinarias (20). Si bien el diacetato CHX (Nolvasan Solution, Fort Dodge Animal Health, Fort Dodge, IA) se ha utilizado en la piel de los perros (10), no está etiquetado para su uso en la piel, sino que está etiquetado como un limpiador para las instalaciones de los animales. En 2010, salió al mercado una solución acuosa de gluconato de CHX al 2% como Vet One (MWI Animal Health, Boise, ID), etiquetada para su uso en piel intacta o dañada de caballos y perros. Con respecto al almacenamiento de CHX, los recipientes abiertos de gluconato de CHX al 4% expuestos a contaminación bacteriana artificial y natural en el transcurso de 6 meses han demostrado resistir el crecimiento bacteriano (21), sin embargo, las preparaciones diluidas (<2%) son susceptibles a la contaminación bacteriana y no deben mezclarse ni almacenarse previamente (11, 22).
En la actualidad, no existe un estándar para la preparación del paciente veterinario antes de la cirugía. Varias formulaciones de CHX no están etiquetadas para este uso específico o para su uso en animales. Por lo tanto, los protocolos para la preparación de los pacientes varían entre las clínicas veterinarias y el personal responsable de este paso preoperatorio a veces desconoce la concentración que se está utilizando, así como los tiempos de contacto recomendados (20). Se desconoce la importancia clínica de esto, ya que se ha demostrado que concentraciones de exfoliante que oscilan entre el 1,0 y el 4,0% son efectivas para reducir adecuadamente la carga bacteriana después de 3 min de tiempo de contacto (20). En cuanto a la aplicación, no se ha encontrado ninguna diferencia entre la preparación aséptica mecánica (fregado continuo durante el tiempo de contacto predeterminado) y no mecánica (aplicación rápida de fregado seguida de la asignación del mismo tiempo de contacto) (23) o la técnica de aplicación mecánica (fregado lineal frente a círculos concéntricos) (24). Los protocolos de preparación a menudo incluyen alternar alcohol y CHX o usar alcohol para eliminar el exceso de exfoliación en la piel después de una preparación con CHX. Osuna et al. encontraron que un exfoliante de gluconato de CHX al 4% alternado con solución salina o alcohol isopropílico al 70% funcionó de manera similar en su reducción bacteriana media y porcentaje de muestras con cultivos negativos. Sin embargo, el estudio encontró que el gluconato de CHX eliminado con alcohol dio lugar a cultivos bacterianos más positivos en el postoperatorio, lo que sugiere que la adición de alcohol puede afectar la actividad residual de CHX. Los autores cuestionaron la importancia de este hallazgo y recomendaron que se realizara un estudio que evaluara la incidencia de infecciones del sitio quirúrgico después de estos métodos de preparación (25). Si bien este estudio en particular no se ha realizado en pacientes veterinarios hasta la fecha, es importante señalar que las recomendaciones actuales favorecen el uso de antisépticos combinados con alcohol para la preparación intraoperatoria de la piel, con base en estudios en la literatura humana (26).
Los estudios en humanos varían en cuanto a los beneficios del baño o la ducha preoperatoria con antisépticos cutáneos para prevenir la ISQ. Revisiones recientes de la literatura humana no muestran evidencia clara de que la ducha o el baño preoperatorio con clorhexidina reduzca las ISQ en comparación con otros productos de lavado (27). En 2017 se realizó una revisión sistemática con metaanálisis que evaluó el baño preoperatorio del sitio quirúrgico con CHX para la prevención de ISQ (28). El metanálisis recopiló datos de más de 10.000 pacientes y no se encontró una reducción significativa de la ISQ al comparar a los pacientes sometidos a baños preoperatorios con CHX con los pacientes del grupo placebo. Aun así, algunos estudios en humanos informan tasas más bajas de ISQ cuando se usa CHX para limpiar el sitio quirúrgico la noche anterior a la cirugía (29, 30). En 2017, los Centros para el Control y la Prevención de Enfermedades publicaron pautas para la prevención de la ISQ en cirugía humana e incluyeron la recomendación de realizar una ducha o baño de cuerpo completo con jabón o agente antiséptico al menos la noche anterior a la cirugía (26). En los seres humanos, la concentración de CHX en la superficie de la piel se maximiza con un protocolo estandarizado que incluye permitir que el CHX permanezca en la piel durante al menos 1 minuto antes del enjuague (31). Se ha realizado un estudio en perros para evaluar los recuentos bacterianos en las extremidades lavadas con gluconato de CHX la noche anterior a la toma de muestras en comparación con las extremidades que no se lavaron. En ese estudio, la extremidad tratada tenía un recuento de bacterias más bajo, sin embargo, no se detectaron diferencias en los recuentos de bacterias de la piel después de la exfoliación preoperatoria completa de CHX y la desinfección con alcohol (32).
Para heridas cutáneas abiertas, se recomienda una concentración de CHX acuoso al 0,05%. Esta es la concentración mínima que se ha demostrado que es bactericida contra S. aureus, sin importar si se utiliza solución salina fisiológica, solución electrolítica balanceada o agua estéril para la dilución (33, 34). Se ha demostrado que el diacetato de CHX en concentraciones superiores al 0,006% es citotóxico para los fibroblastos embrionarios caninos in vitro, sin embargo, una concentración del 0,05% no afecta a la cicatrización de la herida ni a la contracción de la herida in vivo (35). Se sabe que el diacetato de CHX precipita en algunas soluciones, como la solución de Ringer lactato, pero esto no afecta su eficacia (34). A bajas concentraciones (<0,16%), el efecto bactericida de CHX puede reducirse en presencia de materia orgánica, como el suero, posiblemente debido a la unión a proteínas (36). Por lo tanto, CHX puede no ser tan eficaz cuando se utilizan concentraciones bajas para limpiar heridas con grandes cantidades de contaminación orgánica. A concentraciones de CHX superiores al 1,6%, la materia orgánica no afecta a su capacidad de desinfección (37), pero sí conduce a un aumento de la citotoxicidad.
En general, CHX causa pocas reacciones adversas. Se sabe que el CHX es ototóxico en concentraciones iguales o superiores al 0,5%, aboliendo todos los potenciales vestibulares y auditivos (38, 39). Sin embargo, CHX no causa efectos ototóxicos a concentraciones del 0,2%, lo que hace que la concentración recomendada del 0,05% sea segura para enjuagar el canal auditivo externo de los perros sin un tímpano intacto (40, 41). Los gatos, sin embargo, pueden mostrar ototoxicidad transitoria y lesión de la mucosa del oído medio incluso a esta baja concentración (42). Para la preparación de la cavidad oral, se recomienda una solución de gluconato al 0,2% (43). Es importante destacar que se sabe que CHX causa queratitis grave y ulceración corneal con posible daño permanente en la córnea en altas concentraciones o cuando se combina con un detergente (44-46). A bajas concentraciones, el grado de toxicidad corneal difiere entre las formulaciones de gluconato y diacetato. Una concentración de gluconato de CHX al 0,05% no causa cambios macroscópicos o microscópicos en la córnea y se usa de forma rutinaria para la preparación de la conjuntiva antes de la cirugía oftálmica y como conservante de lentes de contacto (47, 48). Sin embargo, el diacetato de CHX a esta misma concentración causa toxicidad corneal a nivel macroscópico y microscópico (47). Debido a estas reacciones adversas oftalmológicas y otológicas bien conocidas, informes anteriores han concluido que CHX no debe usarse en la preparación de la piel de la cabeza (46). Durante la operación, el CHX no debe instilarse en el peritoneo, la vejiga o las articulaciones sinoviales debido a la posibilidad de peritonitis química, cistitis erosiva y sinovitis (49-51). No se ha notificado toxicidad sistémica con CHX; Su unión a la piel impide que se absorba fácilmente y también hay una absorción insignificante a través del tracto digestivo (8, 49, 52). Los informes de hipersensibilidad en humanos varían en grado de gravedad, desde urticaria hasta anafilaxia potencialmente mortal (53). La mayoría de los casos se asocian con la aplicación de CHX en las membranas mucosas y áreas de epidermis dañada. Sin embargo, la incidencia de hipersensibilidad puede estar subestimada debido al escaso reconocimiento de esta reacción adversa (54).
3 Compuestos de yodo
Los compuestos de yodo son desinfectantes y antisépticos que liberan halógenos. Penetran fácilmente en la pared celular del microorganismo, atacan y oxidan proteínas, nucleótidos y ácidos grasos en el citoplasma y la membrana celular, lo que provoca la muerte celular. El yodo libre o molecular (I2) tiene un amplio espectro de actividad antimicrobiana eficaz contra bacterias, hongos, virus y esporas (11, 55, 56). En más de 150 años de uso, no se ha reportado resistencia bacteriana a los yodóforos ni experimental ni anecdóticamente (57).
Las tinturas que contienen alcohol y soluciones acuosas inestables se usaron históricamente como antisépticos, pero cayeron en desgracia debido a la irritación, toxicidad y tinción excesiva (10, 11). Yodóforos, como la polivinilpirrolidona yodada (povidona yodada; PI) o poloxámero-yodo, contienen yodo complejado con un polímero. Aunque son menos activos contra las esporas y los hongos que las tinturas, menos yodo libre en estos complejos solubles en agua hace que sean menos irritantes y más estables, y por lo tanto estas preparaciones son las más utilizadas hoy en día (58). Además, estos complejos mejoran la eficiencia antimicrobiana del yodo debido a su afinidad por la membrana celular, mejoran sus propiedades humectantes y ayudan en su penetración en la materia orgánica (55).
Los yodóforos comprenden un equilibrio de yodo complejo y libre que actúa como un reservorio para la liberación del halógeno a medida que se agota (55). La cantidad de yodo libre, en comparación con el «yodo disponible», es responsable de la actividad microbiana de una solución. Por ejemplo, una solución de PI al 10% contiene un 1% de yodo disponible y 1 mg/L (1 ppm o 0,0001%) de yodo libre, cumpliendo con las recomendaciones de que los antisépticos contengan 1-2 mg/L de yodo libre (55, 59). La cantidad de yodo libre dentro de una solución se puede ilustrar con una curva en forma de campana. Una concentración de solución de aproximadamente el 0,7% contiene el mayor contenido de yodo libre, y este contenido se reduce a medida que la concentración de la solución se aleja de este valor en cualquier dirección (55). Si bien esta curva en forma de campana se aplica a las diversas formulaciones fabricadas, la cantidad exacta de yodo libre y actividad bactericida puede variar entre los productos (60).
La mayor actividad bactericida de las soluciones diluidas, en comparación con las soluciones completas al 10%, se ha demostrado in vitro en varias especies bacterianas (61). Se ha descubierto que varios materiales orgánicos neutralizan los efectos de los yodóforos, lo que se cree que se debe a que el yodo forma complejos y se somete a reacciones químicas, como la reducción a yoduro. La neutralización de los yodóforos se produce especialmente en presencia de sangre total, dada la capacidad de la hemoglobina para unirse a una gran cantidad de yodo (55), pero también se produce frente a material purulento y homogeneizado de grasa (62). Este hallazgo puede apoyar el uso de concentraciones más altas de PI cuando hay materia orgánica presente, ya que las soluciones diluidas tienen un reservorio disminuido de yodo y, por lo tanto, pueden neutralizarse más fácilmente (63). Los yodóforos muestran una persistencia moderada que se prolonga en gran medida hasta 48 h cuando se combinan con alcohol (25, 64, 65). Con respecto al almacenamiento, se ha producido contaminación de yodóforos disponibles comercialmente y los picos de las jarras de PI han dado positivo para S. aureus, lo que ilustra que estos recipientes de uso múltiple son una fuente potencial de contaminación (66, 67).
El PI es un yodóforo comúnmente utilizado en medicina veterinaria para la preparación del paciente (10). Las formulaciones pueden contener alcohol o detergentes y variar en concentraciones de hasta el 10%. Todas las formulaciones se recomiendan solo para membranas mucosas y uso externo, sin embargo, las pautas humanas recientes recomiendan la irrigación de las capas profundas y subcutáneas de las heridas incisionales con soluciones de yodóforo diluidas durante la operación para reducir la incidencia de infecciones del sitio quirúrgico (26, 68). Esta recomendación fue evaluada recientemente en artroplastia total de cadera en pacientes veterinarios. Las tasas de ISQ postoperatorias se evaluaron en artroplastias realizadas con o sin un lavado previo al cierre de una solución de PI al 0,035% y se encontró que eran eficaces para reducir las tasas de infección, seguros y rentables (69). Las formulaciones de exfoliantes quirúrgicos contienen detergentes para fregar (55). Para la preparación de la piel de la cabeza, actualmente se considera más segura una solución al 10% libre de alcohol y detergente, que podría alterar la película lagrimal de la córnea (46). Para la preparación de la córnea y la conjuntiva, se encontró que una solución de PI al 0,2% era igualmente bactericida que una solución al 1 o 5% (70). Sin embargo, se recomienda una concentración del 5% para la profilaxis con cirugía intraocular, ya que su uso es seguro y puede ser más eficaz en pacientes con alta carga bacteriana (71). Al igual que CHX, una tintura de povacrylex de yodo al 0,7 % en alcohol isopropílico al 74 % (DuraPrep) es más eficaz que el PI al 10 % para reducir los cultivos cutáneos positivos inmediatamente después de la aplicación en la piel humana (72). Ioban, un paño de incisión adhesivo impregnado de PI, es un producto utilizado para reducir el riesgo de contaminación de heridas y ofrecer una actividad antimicrobiana continua según el sitio web del fabricante. Para evaluar su efectividad en pacientes veterinarios que tienen un pelaje más denso y más residuos superficiales, Osuna et al. compararon una preparación de exfoliación IP y alcohol con la preparación con alcohol y la aplicación del paño antimicrobiano. Los autores encontraron que la preparación del paño era inferior al exfoliante PI en la reducción de la carga bacteriana en la piel (73). Además, se encontró un potencial para aumentar las tasas de infección mediante un metaanálisis de literatura humana que evaluó las cortinas adhesivas. Este hallazgo puede explicarse por un aumento de la humedad debajo de la cortina adhesiva que estimula a las bacterias que residen en los folículos pilosos (aquellos que están fuera del alcance de los antisépticos) a migrar a la superficie y multiplicarse (73-75). Por lo tanto, el valor de los paños incisos, con o sin impregnación antiséptica, es cuestionable en medicina veterinaria, dada la alta incidencia de falta de adherencia (67). La solución DuraPrep mejora la adhesión entre los paños quirúrgicos y la superficie de la piel preparada, pero esta aplicación no se ha evaluado en la piel de pacientes veterinarios (64).
Para determinar una concentración efectiva y segura para la irrigación de heridas, Sánchez et al. evaluaron la citotoxicidad de varias concentraciones de IP para S. aureus in vitro y fibroblastos embrionarios caninos, así como su efecto en la cicatrización de heridas. El grupo que realizó este experimento encontró que se requiere una concentración de al menos 1.0% de PI para la muerte completa de S. aureus in vitro, y aunque se encontró que esta concentración era citotóxica para los fibroblastos, no tuvo ningún efecto sobre la contracción de la herida y la cicatrización in vivo (33, 35). Por lo tanto, una concentración del 1,0% de la solución de PI es la recomendación actual para el tratamiento de heridas.
Los efectos adversos están relacionados con la irritación tópica y el aumento de los niveles sistémicos de yodo. La dermatitis aguda de contacto, el eritema, las ronchas, el edema, las pápulas y el supuración del suero pueden ocurrir en casi la mitad de los perros preparados con IP (25, 76). Las soluciones diluidas apropiadas para su aplicación en las membranas mucosas también tienen la capacidad de producir reacciones tisulares, como en la preparación de la cavidad prepucial canina (77). La IP administrada por cualquier vía puede dar lugar a una absorción sistémica. Esto parece aumentar cuando entra en contacto con la piel desnuda, las superficies mucosas o serosas, o grandes áreas de piel intacta (57). La absorción sistémica puede conducir a anomalías metabólicas y a una función tiroidea anormal. Debido a estos posibles trastornos y a la eliminación de yodo por los riñones, no se recomienda la preparación de heridas PI en casos de quemaduras, enfermedad tiroidea o enfermedad renal (55, 57, 78).
4 Alcoholes
Los alcoholes, como el alcohol etílico y el alcohol isopropílico, actúan como desinfectantes y antisépticos. Se desconoce su mecanismo de acción exacto, pero se cree que causan daño a la membrana y desnaturalización de proteínas, lo que resulta en interferencia con el metabolismo y la lisis celular (10, 11). Tienen un amplio espectro de actividad contra bacterias, virus y hongos Gram-positivos y Gram-negativos, pero no son esporicidas. El agua es necesaria para aumentar la eficiencia microbicida del alcohol, siendo las formulaciones de 60-90% de alcohol las más efectivas (59). Si bien la concentración del producto es más importante que el tipo de alcohol, el alcohol isopropílico tiene mayor acción bactericida que el etanol (10, 59).
El alcohol proporciona la reducción más rápida y mayor de bacterias en la piel, pero no tiene actividad residual y, por lo tanto, su eficacia se limita a su tiempo de contacto antes del secado (10, 11, 59). Una concentración del 70% de etanol puede eliminar el 90% de la flora cutánea con un tiempo de aplicación de 2 minutos. Sin embargo, debido a la naturaleza de secado rápido de este agente y su uso común como medio para eliminar el antiséptico residual durante la preparación, esta reducción bacteriana generalmente no se logra. Por ejemplo, una sola toallita con etanol solo reduce las bacterias cutáneas en un 75% (8). La eficacia mejora mediante la adición de emolientes que disminuyen el tiempo de evaporación del alcohol, como en los desinfectantes de manos sin agua, y la adición de otros antisépticos como CHX y yodóforos (8, 11). De hecho, el alcohol potencia la acción de estos antisépticos añadidos, lo que se traduce en una mayor actividad microbicida y aumenta su acción residual (59, 72, 79, 80). Los estudios que evalúan la eficacia del alcohol en presencia de materia orgánica son limitados, pero el alcohol parece ser eficaz en presencia de pequeñas cantidades de sangre; sin embargo, no es un buen agente limpiador y, por lo tanto, la suciedad debe eliminarse antes de la aplicación (59, 81).
El alcohol se puede usar como parte de un producto combinado con CHX o yodóforos o como parte de una preparación inicial para eliminar el exceso de antiséptico. Se debe dejar que el alcohol se seque por completo para una eficacia completa, así como para disminuir la irritación y la inflamabilidad, que es un riesgo cuando se utiliza la electrocirugía. La duración recomendada para que una solución a base de alcohol se seque es de un mínimo de 3 minutos después de la aplicación sobre la piel sin vello; Se debe evitar la aplicación o acumulación de la solución en la piel pilosa, ya que puede tardar hasta 1 h en secarse. En pacientes veterinarios pediátricos, un enjuague con alcohol utilizado durante la preparación no disminuye significativamente la temperatura rectal en comparación con un enjuague con agua (82). Los efectos adversos adicionales del alcohol aplicado a la piel son mínimos, pero se ha demostrado la absorción a través de la piel intacta y se asoció con toxicidades infantiles en la década de 1950 (59, 83). Sin embargo, incluso con una combinación de absorción dérmica e inhalación de vapores, la depresión del sistema nervioso central es poco probable sin una exposición prolongada (varias horas) al alcohol (84). En comparación con el etanol, el alcohol isopropílico es ligeramente más tóxico y causa más vasodilatación, lo que conduce a un aumento del sangrado en los sitios de punción e incisiones (8, 85). Debido a su citotoxicidad, el alcohol no está indicado para su aplicación en heridas o mucosas (10).
5 Comparación de antisépticos
CHX, IP y alcohol tienen diferentes mecanismos de acción, riesgos y beneficios que se resumen en la Tabla 1. Varias revisiones sistemáticas y metaanálisis han comparado CHX con IP en la literatura humana y han encontrado que CHX es superior a IP en ambos resultados de efectividad evaluados (86-89). Los estudios han informado que CHX es superior a IP en la reducción de las ISQ, especialmente en cirugías contaminadas limpias, y dos de las revisiones encontraron una calidad moderada de la evidencia para una reducción del 30 al 36% (86, 89). Dos revisiones diferentes no pudieron concluir qué antiséptico fue más efectivo (90, 91). Kamel et al. afirmaron que no se podían sacar conclusiones generales, especialmente en lo que respecta al ingrediente activo de los antisépticos utilizados, ya que pueden mezclarse con solución salina o alcohol (90). Dumville et al. concluyeron que, debido a la falta de pruebas claras, los profesionales deben basar sus decisiones en otras características, como el coste y los posibles efectos secundarios (91). El metaanálisis más reciente de Chen et al. no encontró diferencias en los eventos adversos al comparar el CHX y el IP (88). Múltiples revisiones citan varias limitaciones, incluida la variación en la concentración y formulación del antiséptico, la técnica de aplicación, la población de pacientes, el diseño del estudio y, en algunas, no tener en cuenta el papel del alcohol en sus resultados.
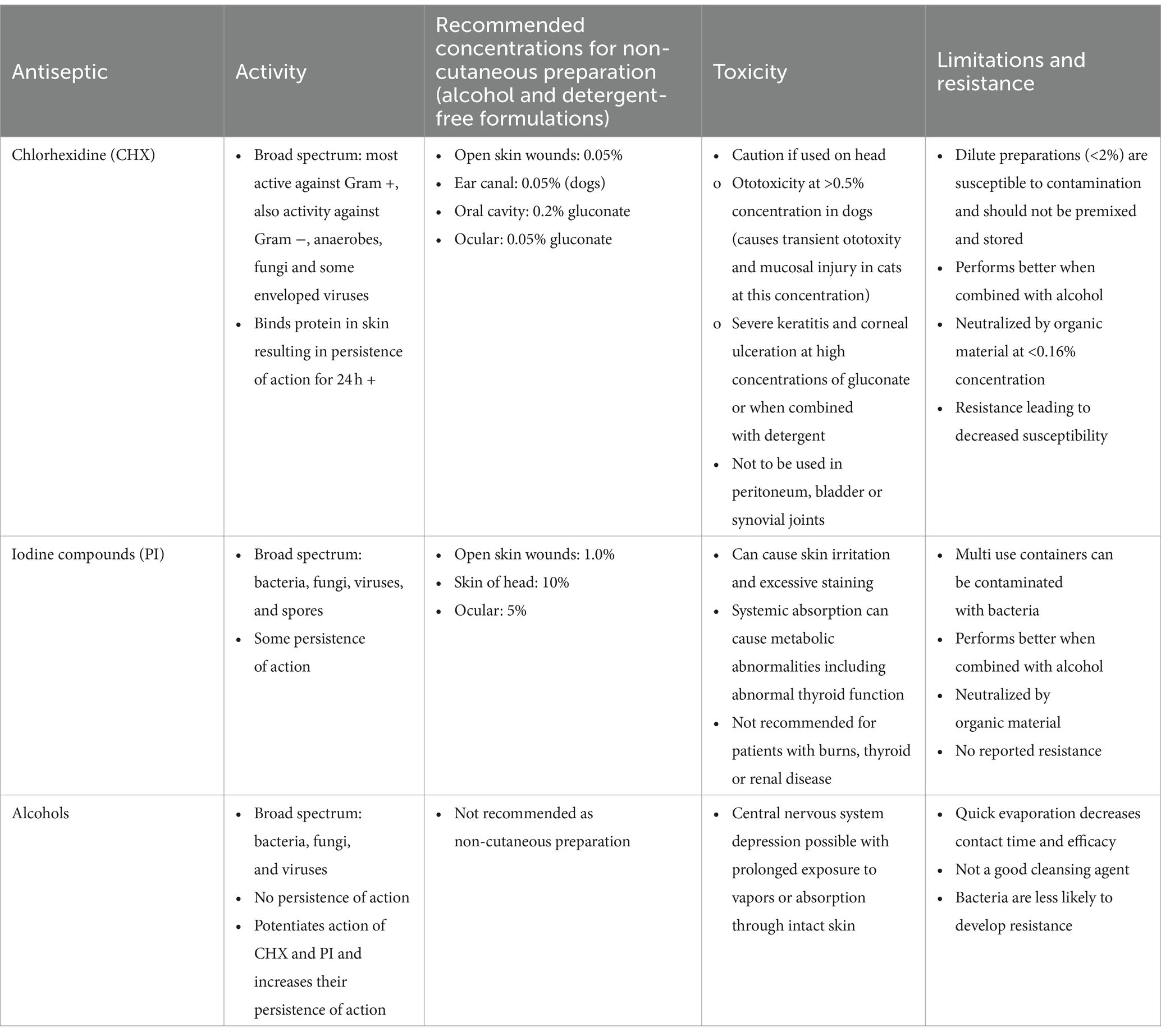 Tabla 1. Mecanismos de acción, concentraciones recomendadas, toxicidades y limitaciones de la clorhexidina, los compuestos de yodo y los alcoholes cuando se utilizan como preparación preoperatoria.
Tabla 1. Mecanismos de acción, concentraciones recomendadas, toxicidades y limitaciones de la clorhexidina, los compuestos de yodo y los alcoholes cuando se utilizan como preparación preoperatoria.
Debido a las diferencias entre la piel de los humanos y la de las especies veterinarias, es probable que los hallazgos específicos de la especie sean más apropiados, sin embargo, la literatura veterinaria sobre el tema es rara. Recientemente, se publicó una revisión sistemática y un metaanálisis de la literatura veterinaria en el que se comparan el CHX y el IP (92). Los autores no encontraron diferencias en la incidencia de ISQ postoperatorias o colonización bacteriana de la piel entre los protocolos que utilizaron los dos antisépticos. Sin embargo, el número limitado de estudios y el riesgo variable de sesgo dentro de los estudios explicaron una baja calidad general de la evidencia (92).
Muy pocos estudios prospectivos en la literatura veterinaria de pequeños animales comparan CHX con PI en sus concentraciones recomendadas utilizando protocolos similares para la preparación. Amber et al. investigaron la eficacia de las soluciones acuosas de CHX y PI a varias concentraciones diluidas para reducir la carga bacteriana en heridas abiertas contaminadas artificialmente. Los investigadores encontraron que las heridas tratadas con CHX tenían una carga bacteriana significativamente disminuida 48 h más tarde en comparación con las heridas tratadas con PI (93). La comparación de CHX y PI diluidos para la reducción de la carga bacteriana en el prepucio canino fue realizada por Neihaus et al.; se encontró que la preparación con CHX resultó en una disminución significativa en la proporción de cultivos positivos después del lavado en comparación con IP (77). Por el contrario, Nye et al. evaluaron preparaciones diluidas de CHX e IP en la preparación inicial del coche externo de los perros antes de la cirugía del canal auditivo y no encontraron una diferencia en la reducción de la carga bacteriana entre los dos antisépticos (94). Phillips et al. tampoco encontraron una diferencia entre los antisépticos cuando compararon la incidencia de SSI en sitios preparados con exfoliante CHX seguido de una solución acuosa, o lavado PI seguido de una solución acuosa (95). Sánchez et al., evaluaron la efectividad de la irrigación diaria con concentraciones diluidas de CHX e IP en la prevención de la contaminación de la herida; los autores encontraron que ninguno de los antisépticos fue completamente efectivo en la prevención de la contaminación, pero CHX resultó en significativamente menos heridas contaminadas a lo largo del experimento de 14 días (35).
Se han realizado varios estudios en animales para evaluar concentraciones y combinaciones de antisépticos inigualables. Belo et al. no encontraron diferencias entre la eficacia de una solución acuosa de PI al 7,5% y una solución alcohólica de CHX al 2% en la reducción de las bacterias de la piel en perros (96). Al comparar el IP al 0,7 % en alcohol isopropílico al 74 % (DuraPrep) con el exfoliante de gluconato CHX al 4 %, Gibson et al. no encontraron diferencias en la eficacia antiséptica ni en la incidencia de reacciones cutáneas (97). Osuna et al. no encontraron diferencias en la incidencia de cultivos negativos hasta 1 h después de la preparación antiséptica cuando compararon el gluconato de CHX al 4% alternado con alcohol y el exfoliante de PI al 10% alternado con alcohol y la aplicación de una solución de PI al 10%, pero los perros del grupo de IP mostraron significativamente más reacciones cutáneas (76). Swaim et al. investigaron la carga bacteriana de las patas caninas vendadas inmediatamente después de la preparación y 24 h después de la preparación con un 7,5% de PI y una solución de PI al 10% frente a un 2% de CHX y una solución. Los resultados indicaron una efectividad y actividad residual similares de los dos antisépticos, y ninguna disminución adicional de la carga bacteriana después de la aplicación inicial (98). Más recientemente, Asimus et al. no encontraron diferencias en la carga bacteriana después de que la piel del perro se preparó con un exfoliante CHX al 4% alternado con enjuague con solución salina o un champú suave enjuagado con solución salina seguido de un gel a base de alcohol. Se encontró que el protocolo de alcohol en gel era más rápido con el beneficio teórico adicional de prevenir la aparición de resistencia bacteriana a CHX (99). Estos resultados inconsistentes representan el cuerpo más amplio y conflictivo de la literatura humana y veterinaria, y aunque CHX parece ser favorecido en más de un meta-análisis, varias variables, incluida la contribución del alcohol, no están claras (100).
Tanto CHX como PI tienden a funcionar mejor cuando se combinan con alcohol, como se encontró en estudios in vivo y en humanos. In vivo, Adams et al. compararon la eficacia del gluconato de CHX al 2% en alcohol isopropílico al 70% (ChloraPrep) con una solución de CHX al 2% para reducir la carga bacteriana. ChloraPrep resultó en una mayor reducción de bacterias, especialmente cuando se realizó una prueba de portador de biopelícula con y sin la adición de suero humano al 10% (79). Al comparar ChloraPrep y Duraprep en cirugías colorrectales humanas, que son inherentemente de alto riesgo para desarrollar infecciones, Kaoutzanis et al. no encontraron diferencias en la incidencia de ISQ (101). Un metaanálisis realizado por Peel et al. que comparó la preparación de la piel del sitio quirúrgico a base de alcohol (ya sea productos combinados o la adición de un paso de alcohol) encontró una reducción en las ISQ con el uso de CHX y alcohol en comparación con yodóforo y alcohol. Sin embargo, debido al bajo número de estudios y al potencial de sesgo, no estaba claro si esta superioridad se aplicaba a todos los grupos de procedimientos quirúrgicos (102). Las preparaciones combinadas de antiséptico y alcohol son convenientes debido a su proceso de aplicación de un solo paso, pero vale la pena mencionar que el área aún debe descontaminarse con un jabón no medicado, seco y sin residuos antes de la aplicación para obtener la máxima efectividad de acuerdo con las instrucciones del fabricante.
6 Resistencia bacteriana a los antisépticos
No existen métodos estandarizados para evaluar la susceptibilidad y no existe consenso sobre la definición de resistencia a los antisépticos. Se utilizan varios términos para definir los grados de susceptibilidad bacteriana. Las bacterias descritas como insensibles se consideran intrínsecamente resistentes al antiséptico. La tolerancia fenotípica se define como la supervivencia bacteriana en presencia de un antiséptico después de un cambio fenotípico o una condición transitoria. La tolerancia antiséptica implica que la cepa bacteriana es inhibida, pero no eliminada, por el antiséptico. Finalmente, la resistencia puede definirse como una cepa bacteriana que puede sobrevivir a la exposición a un antiséptico a una concentración que mata al resto de la población bacteriana (13).
Al evaluar la resistencia, la susceptibilidad puede determinarse mediante varios métodos, incluidos los estudios de concentración mínima inhibitoria (CMI), concentración mínima bactericida (CMM) o tiempo de muerte. Los resultados dependen en gran medida del método de prueba y no hay valores de punto de corte acordados (13). Los métodos de CMI determinan la concentración más baja posible requerida para inhibir el crecimiento del organismo y, por lo tanto, evalúan concentraciones antisépticas muy por debajo de lo que se usa clínicamente. Debido a que los antisépticos están dirigidos a la eliminación bacteriana frente a la inhibición, y las pruebas de CMI por debajo de las concentraciones en uso, los estudios de MBC o de eliminación prolongada pueden ser más apropiados cuando se realiza una prueba de resistencia. Los métodos de MBC miden la concentración más baja posible requerida para matar el organismo y permiten la comparación de cepas resistentes y susceptibles. Sin embargo, al igual que la CIM, se relaciona con las concentraciones alcanzables por los fluidos corporales, lo que no es relevante para la administración tópica de antisépticos (13). Los estudios de muerte prolongada miden el crecimiento de bacterias expuestas a un antiséptico en caldo durante diferentes períodos de tiempo y la actividad antimicrobiana está determinada por la tasa de reducción en el número de microorganismos; bactericida se define típicamente como un logaritmo10 factor de reducción de 5 (13). Las pruebas de antisépticos se ven afectadas por numerosas variables y se ha sugerido que el método para probar la susceptibilidad debería imitar las condiciones «en uso» con respecto al medio de cultivo y las características del cultivo, sin embargo, la mayor parte de la evidencia de resistencia proviene de experimentos de laboratorio (103).
Los mecanismos de resistencia bacteriana a los antisépticos, como los antimicrobianos, son una propiedad natural de la bacteria (intrínseca) o adquirida. Las propiedades intrínsecas suelen consistir en una impermeabilidad de las capas externas del organismo al antiséptico y, con menos frecuencia, a la degradación del antiséptico por las enzimas sintetizadas constitutivamente. Las esporas bacterianas muestran una resistencia intrínseca a los antisépticos debido a su corteza y a las cubiertas de esporas internas y externas. La compleja pared celular de las micobacterias proporciona una resistencia intermedia a muchos antisépticos. En general, las bacterias Gram-negativas muestran más resistencia intrínseca que las Gram-positivas debido a la composición de su membrana celular externa, especialmente con Pseudomonas aeruginosa, Proteus spp., Burkholderia cepacia y Providencia stuartii. En las bacterias Gram-positivas, la resistencia intrínseca puede deberse a una difusión reducida a través del glicocálix extracelular y los mucopolisacáridos, como la capa de limo producida por las cepas mucoides de Staphylococcus aureus (11). La resistencia fenotípica se puede lograr a través de propiedades intrínsecas como la formación de biopelículas y hacer que una colonia sea resistente a varios antisépticos. Las biopelículas consisten en un conglomerado de organismos sésiles organizados dentro de un polímero de exopolisacáridos que muestran una sensibilidad reducida a los antisépticos y son de particular preocupación con las infecciones nosocomiales y asociadas a implantes. La resistencia mediada por biopelículas puede deberse a la disminución de la permeabilidad al antiséptico, a la interacción química entre el antiséptico y la biopelícula, a la modulación del microambiente, a la producción de enzimas degradativas o al intercambio genético entre las células dentro de la biopelícula. Las bacterias que exhiben formación de biopelículas incluyen Staphylococcus (S. aureus y S. pseudintermedius), Pseudomonas aeruginosa, Acinetobacter, Actinobacillus y Klebsiella (104).
La resistencia adquirida puede ocurrir a través de la adquisición de elementos genéticos móviles (plásmidos y transposones), mutación o inducción. Las bombas de eflujo pueden adquirirse a través de elementos genéticos móviles y ayudan a la resistencia al disminuir la concentración intracelular del antiséptico. Los plásmidos de Staphylococcus aureus contienen las familias de genes qacA-G que codifican proteínas de exportación dependientes de protones que imparten resistencia de bajo nivel a múltiples antisépticos. Las bombas de eflujo también son responsables de la reducción de la eficacia antiséptica en Pseudomonas aeruginosa y Escherichia coli (103, 105). La inducción o mutación causada por el estrés puede conducir a la adquisición de resistencia a los antisépticos. Esto puede ser responsable de cambios en la permeabilidad celular, la transcripción de genes de resistencia u otros mecanismos de resistencia. La mutación o selección puede ser responsable de la disminución de la susceptibilidad antiséptica de las bacterias Gram-negativas aisladas de ambientes hospitalarios (11).
Además de la posibilidad de una disminución de la susceptibilidad a los antisépticos de uso común, existe la preocupación de que la resistencia adquirida a los antisépticos pueda conferir mecanismos que den lugar a la resistencia a los antibióticos. La superposición de la resistencia entre los antimicrobianos se debe en parte a que estos organismos comparten mecanismos de resistencia comunes, como la formación de biopelículas, la inducción de genes de resistencia, los cambios en la envoltura celular y las bombas de eflujo inespecíficas. Sin embargo, los experimentos de laboratorio han identificado varios métodos que dan como resultado resistencia a los antibióticos después de la exposición a antisépticos. La resistencia cruzada implica la selección de genes que codifican la resistencia tanto a los antisépticos como a los antibióticos. Por ejemplo, las proteínas de exportación asociadas con la familia de genes qacAB en plásmidos de S. aureus muestran una homología significativa con otros transportadores dependientes de energía, como los exportadores de tetraciclina (11). La corresistencia es la selección de clones o elementos móviles que portan genes de resistencia vinculados genéticamente que afectan la susceptibilidad a los antisépticos y a los antibióticos, como los plásmidos de S. aureus que llevan genes de resistencia a diversos antibióticos, metales pesados y antisépticos. Por último, la exposición a biocidas puede conducir a la selección indirecta de una subpoblación bacteriana que muestra una susceptibilidad reducida a ambos agentes antimicrobianos (103).
La resistencia a CHX es de particular importancia dado su uso generalizado y los múltiples informes de disminución de la eficacia contra organismos problemáticos como S. aureus resistente a la meticilina (13). Las esporas bacterianas, las micobacterias y varias bacterias gramnegativas como Pseudomonas, Proteus y Providencia spp. muestran una resistencia variable a CHX debido a factores intrínsecos. Sin embargo, lo más importante son los mecanismos de resistencia adquirida que han dado lugar a múltiples informes de disminución de la susceptibilidad a CHX. En el S. aureus grampositivo, la bomba de eflujo codificada por el gen qacA se asocia comúnmente con una susceptibilidad reducida a CHX y se puede encontrar en múltiples plásmidos que también portan genes de resistencia a otros antimicrobianos. Este gen tiene una prevalencia significativamente mayor en los aislados de enfermeras en comparación con la población general, lo que sugiere que la exposición repetida a CHX puede resultar en la selección de estos genes (13). Es importante tener en cuenta que la presencia de los genes qac por sí sola no indica resistencia a CHX. Con respecto a la resistencia cruzada, el aumento de la resistencia a varias clases de antibióticos ha sido mostrado experimentalmente tanto por bacterias grampositivas (p. ej., Enterococcus faecium y Enterococcus faecalis) como gramnegativas (p. ej., Enterobacter cloacae o Escherichia coli) cuando se exponen a concentraciones subletales de CHX (106, 107). Si bien es difícil determinar el impacto clínico de estos resultados y llegar a una conclusión definitiva sobre la creciente prevalencia de la resistencia a CHX, estos hallazgos enfatizan la importancia de usar una concentración adecuada de antiséptico en casos apropiados y respaldan el argumento para usar antisépticos con una baja presión de selección para la resistencia, como el alcohol y el IP (106-108).
7 Conclusión
Los antisépticos son una parte integral de la preparación preoperatoria de los pacientes quirúrgicos. Es necesaria una selección y un uso adecuados para prevenir la aparición de infecciones en el sitio quirúrgico, los efectos adversos y la posibilidad de aumentar la resistencia a los antimicrobianos. En este momento, los autores reconocen que la investigación no respalda un único mejor antiséptico, sin embargo, los autores prefieren una preparación cutánea a base de alcohol que contenga CHX disponible comercialmente cuando no esté contraindicada. La elección futura de antisépticos tendría que tener en cuenta la resistencia, especialmente a CHX. Se necesita investigación continua para ayudar a llenar los vacíos en el conocimiento actual, como los procedimientos de preparación óptimos para los diversos sitios quirúrgicos y el impacto clínico de la disminución de la susceptibilidad al CHX y otros antisépticos.
Contribuciones de los autores
KT: Conceptualización, Supervisión, Redacción – borrador original, Redacción – revisión y edición. AN: Conceptualización, Curación de datos, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Stickney, DNG, y Mankin, KMT. El impacto de la vigilancia post-alta en el diagnóstico de infección del sitio quirúrgico. Cirugía veterinaria. (2018) 47:66–73. doi: 10.1111/vsu.12738
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Turk, R, Singh, A, y Weese, JS. Vigilancia prospectiva de la infección del sitio quirúrgico en perros. Cirugía veterinaria. (2015) 44:2–8. doi: 10.1111/j.1532-950x.2014.12267.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Eugster, S, Schawalder, P, Gaschen, F, y Boerlin, P. Un estudio prospectivo de infecciones postoperatorias del sitio quirúrgico en perros y gatos. Cirugía veterinaria. (2004) 33:542–50. doi: 10.1111/j.1532-950x.2004.04076.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Mankin, KMT, y Cohen, ND. Ensayo clínico aleatorizado y controlado para evaluar el efecto de la sutura impregnada de antimicrobianos en la incidencia de infecciones del sitio quirúrgico en perros y gatos. J Am Vet Med Assoc. (2020) 257:62–9. doi: 10.2460/javma.257.1.62
5. Mankin, KMT, Jeffery, ND, y Kerwin, SC. El impacto de una lista de verificación quirúrgica en los resultados quirúrgicos en una institución académica. Cirugía veterinaria. (2021) 50:848–57. doi: 10.1111/vsu.13629
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Mayhew, PD, Freeman, L, Kwan, T y Brown, DC. Comparación de las tasas de infección del sitio quirúrgico en heridas limpias y contaminadas en perros y gatos después de una cirugía mínimamente invasiva versus una cirugía abierta: 179 casos (2007-2008). J Am Vet Med Assoc. (2012) 240:193–8. doi: 10.2460/javma.240.2.193
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Corr, S.A., y Brown, C. Una comparación de los resultados después de la osteotomía de nivelación de la meseta tibial y los procedimientos de osteotomía en cuña tibial craneal. Veterinario Comp Ortopédico. (2007) 20:312–9. doi: 10.1160/vcot-07-02-0013
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Sebben, JE . Antisépticos quirúrgicos. J Am Acad Dermatol. (1983) 9:759–65. doi: 10.1016/S0190-9622(83)70192-1
9. Nakayama, Dinamarca . Antisepsia y asepsia y cómo dieron forma a la cirugía moderna. Am Surg. (2018) 84:766–71. doi: 10.1177/000313481808400616
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Boothe, HW . Antisépticos y desinfectantes. Vet Clin North Am Small Anim Pract. (1998) 28:233–48. doi: 10.1016/s0195-5616(98)82003-2
11. McDonnell, G, y Russell, AD. Antisépticos y desinfectantes: actividad, acción y resistencia. Clin Microbiol Rev. (1999) 12:147–79. doi: 10.1128/cmr.12.1.147
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Gilbert, P, y Moore, LE. Antisépticos catiónicos: diversidad de acción bajo un epíteto común. J Appl Microbiol. (2005) 99:703–15. doi: 10.1111/j.1365-2672.2005.02664.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Horner, C, Mawer, D, y Wilcox, M. Reducción de la susceptibilidad a la clorhexidina en estafilococos: ¿está aumentando y tiene importancia? J Chemoth antimicrobiano. (2012) 67:2547–59. doi: 10.1093/jac/dks284
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Bartzokas, CA, Corkill, JE, y Makin, T. Evaluación de la actividad desinfectante de la piel y el efecto acumulativo de las preparaciones de lavado de manos con clorhexidina y triclosán en manos contaminadas artificialmente con Serratia marcescens. Control de infecciones. (1987) 8:163–7. doi: 10.1017/s0195941700065838
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Hibbard, JS . Análisis comparativos de la actividad antimicrobiana y la seguridad de los agentes antisépticos actuales: una revisión. J Infus Nurs. (2005) 28:194–207. doi: 10.1097/00129804-200505000-00008
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Rutter, JD, Angiulo, K, y Macinga, DR. Medición de la actividad residual de los antimicrobianos tópicos: ¿es la actividad residual de la clorhexidina un artefacto de los métodos de laboratorio? J Hosp Infectar. (2014) 88:113–5. doi: 10.1016/j.jhin.2014.06.010
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Kaiser, N, Klein, D, Karanja, P, Greten, Z y Newman, J. Inactivación del gluconato de clorhexidina en la piel por geles desinfectantes de manos con alcohol incompatibles. Am J Control de Infecciones. (2009) 37:569–73. doi: 10.1016/j.ajic.2008.12.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Benson, L, LeBlanc, D, Bush, L, y White, J. Los efectos de los sistemas tensioactivos y los productos hidratantes sobre la actividad residual de un gluconato de clorhexidina Lavar a mano con un sustrato de piel de cerdo. Infect Control Hosp Epidemiol. (1990) 11:67–70. doi: 10.2307/30144264
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Walsh, B, Drabu, PHBYJ, y Drabu, YJ. El efecto de la crema de manos sobre la actividad antibacteriana del gluconato de clorhexidina. J Hosp Infectar. (1985) 9:30–3. doi: 10.1016/0195-6701(87)90091-0
20. Evans, LKM, Knowles, TG, Werrett, G, y Holt, PE. La eficacia del gluconato de clorhexidina en la preparación de la piel canina: encuesta práctica y ensayos clínicos. J Pequeña Anim Pract. (2009) 50:458–65. doi: 10.1111/j.1748-5827.2009.00773.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Aly, R . Actividad antimicrobiana del gluconato de clorhexidina contra la contaminación natural y artificial durante la simulación de condiciones de uso. J Pharm Sci. (1981) 70:964–4. doi: 10.1002/jps.2600700839
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Oie, S, y Kamiya, A. Contaminación microbiana de antisépticos y desinfectantes. Am J Control de Infecciones. (1996) 24:389–95. doi: 10.1016/s0196-6553(96)90027-9
23. Davids, BI, Davidson, MJ, TenBroeck, SH, Colahan, PT, y Oli, MW. Eficacia de la preparación cutánea preoperatoria estéril mecánica versus no mecánica con solución de gluconato de clorhexidina al 4%. Cirugía veterinaria. (2015) 44:648–52. doi: 10.1111/vsu.12335
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Swales, N, y Cogan, T. El fracaso en lograr la asepsia después de la preparación quirúrgica de la piel está influenciado por la resistencia bacteriana a la clorhexidina, pero no por la técnica de preparación de la piel. Enfermeras veterinarias J. (2017) 32:224–7. doi: 10.1080/17415349.2017.1328994
25. Osuna, DJ, DeYoung, DJ, y Walker, RL. Comparación de tres técnicas de preparación cutánea parte 2: ensayo clínico en 100 perros. Cirugía veterinaria. (1990) 19:20–3. doi: 10.1111/j.1532-950x.1990.tb01137.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Berríos-Torres, SI, Umscheid, CA, Bratzler, DW, Leas, B, Stone, EC, Kelz, RR, et al. Guía de los Centros para el Control y la Prevención de Enfermedades para la prevención de infecciones del sitio quirúrgico, 2017. JAMA Surg. (2017) 152:784–91. doi: 10.1001/jamasurg.2017.0904
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Webster, J y Osborne, S. Baño o ducha preoperatoria con antisépticos para la piel para prevenir la infección del sitio quirúrgico. Sistema de la Base de Datos Cochrane Rev. (2015) 2015:CD004985. doi: 10.1002/14651858.cd004985.pub5
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. De C, FLM, Cota, GF, Pinto, TS y Ercole, FF. Baño preoperatorio del sitio quirúrgico con clorhexidina para la prevención de infecciones: revisión sistemática con metaanálisis. Am J Control de Infecciones. (2017) 45:343–9. doi: 10.1016/j.ajic.2016.12.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Kapadia, BH, Zhou, PL, Jauregui, JJ, y Mont, MA. ¿La preparación cutánea de clorhexidina antes de la admisión reduce las infecciones del sitio quirúrgico después de la artroplastia total de rodilla? Clin Orthop Relat Res. (2016) 474:1592–8. doi: 10.1007/s11999-016-4767-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Kapadia, BH, Elmallah, RK, y Mont, MA. Un ensayo clínico aleatorizado de preparación cutánea de clorhexidina previa al ingreso para la artroplastia total de las articulaciones de las extremidades inferiores. J Arthroplast. (2016) 31:2856–61. doi: 10.1016/j.arth.2016.05.043
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Edmiston, CE, Lee, CJ, Krepel, CJ, Spencer, M, Leaper, D, Brown, KR, et al. Evidencia de un régimen estandarizado de ducha previa al ingreso para lograr concentraciones máximas antisépticas de gluconato de clorhexidina en la superficie de la piel, 4%, en pacientes quirúrgicos. JAMA Surg. (2015) 150:1027–33. doi: 10.1001/jamasurg.2015.2210
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Coskun, Ö y Viskjer, S. Lavado con clorhexidina en perros la noche anterior a la cirugía electiva: ¿son aplicables las recomendaciones humanas a la medicina veterinaria? Can J Vet Res. (2022) 86:306–10.
33. Sánchez, IR, Nusbaum, KE, Swaim, SF, Hale, AS, HendersonN, RA, y McGuire, JA. Diacetato de clorhexidina y citotoxicidad de povidona yodada para fibroblastos embrionarios caninos y Staphylococcus aureus. Cirugía veterinaria. (1988) 17:182–5. doi: 10.1111/j.1532-950x.1988.tb00995.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Lozier, S, Pope, E y Berg, J. Efectos de cuatro preparaciones de cicatrización de heridas con diacetato de clorhexidina al 0,05% en perros. Cirugía veterinaria. (1992) 21:107–12. doi: 10.1111/j.1532-950X.1992.tb00025.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Sánchez, IR, Swaim, SF, Nsubaum, KE, Hale, AS, Henderson, RA, y McGuire, JA. Efectos del diacetato de clorhexidina y la povidona-lodina en la cicatrización de heridas en perros. Cirugía veterinaria. (1988) 17:291–5. doi: 10.1111/j.1532-950x.1988.tb01019.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Hennessey, TD . Algunas propiedades antibacterianas de la clorhexidina. J Res. Periodontal. (1973) 8:61–7. doi: 10.1111/j.1600-0765.1973.tb02166.x
37. Gélinas, P, y Goulet, J. Neutralización de la actividad de ocho desinfectantes por materia orgánica. J Appl Microbiol. (1983) 54:243–7. doi: 10.1111/j.1365-2672.1983.tb02613.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Pérez, R, Freeman, S, Sohmer, H, y Sichel, JY. Ototoxicidad vestibular y coclear de antisépticos tópicos evaluada por potenciales evocados. Laringoscopio. (2000) 110:1522–7. doi: 10.1097/00005537-200009000-00021
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Bicknell, PG . Sordera neurosensorial después de operaciones de miringoplastia. J Laringol Otol. (1971) 85:957–62. doi: 10.1017/s0022215100074272
40. Merchant, SR, Neer, TM, Tedford, BL, Twedt, AC, Cheramie, PM y Strain, GM. Evaluación de la ototoxicidad de una preparación ótica de clorhexidina en perros. Prog Vet Neurol. (2015) 4:72–5.
41. Harvey, R . Uso de limpiadores tópicos de oídos en animales pequeños. En Pract. (2006) 28:131–5. doi: 10.1136/inpract.28.3.131
42. Igarashi, Y, y Oka, Y. Lesiones de la mucosa después de aplicaciones intratimpánicas de gluconato de clorhexidina en el gato. Arco Otorrinolaringología. (1988) 245:273–8. doi: 10.1007/bf00464629
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Anderson, GM . Tejidos blandos de la cavidad oral En: K Tobias y S Johnston, editores. Cirugía veterinaria: Animales menores, 2. 2ª Edn. (2018). 1641.
44. Steinsapir, KD, y Woodward, JA. Queratitis por clorhexidina. Cirugía dermatológica. (2017) 43:1–6. doi: 10.1097/dss.000000000000000822
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Rae, SMM, Brown, B, y Edelhauser, HF. La toxicidad corneal de los antisépticos cutáneos prequirúrgicos. Am J Ophthalmol. (1984) 97:221–32. doi: 10.1016/s0002-9394(14)76094-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Morgan, JP, Haug, RH, y Kosman, JW. Preparaciones antimicrobianas para la piel de la región maxilofacial. J Cirugía Oral Maxil. (1996) 54:89–94. doi: 10.1016/s0278-2391(96)90312-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Fowler, JD, y Schuh, JCL. Preparación química preoperatoria del ojo: comparación del diacetato de clorhexidina, el gluconato de clorhexidina y la povidona-lodina. J Am Vet Med Assoc. (1992) 28:451–7.
48. Gili, NJ, Noren, T, Törnquist, E, Crafoord, S y Bäckman, A. La preparación preoperatoria del ojo con solución de clorhexidina reduce significativamente la carga bacteriana antes de la vitrectomía de calibre 23 en la atención médica sueca. BMC Ophthalmol. (2018) 18:167. doi: 10.1186/s12886-018-0844-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Greener, Y, McCartney, M, Jordan, L, Schmitt, D, y Youkilis, EJ. Evaluación de los efectos sistémicos, irritación dérmica primaria e irritación ocular de soluciones de acetato de clorhexidina. Int J Toxicol. (1985) 4:309–19. doi: 10.3109/10915818509078694
50. Harper, WES, y Matz, LR. El efecto de la irrigación con clorhexidina de la vejiga en la rata. Brit J Urol. (1975) 47:539–43. doi: 10.1111/j.1464-410x.1975.tb06257.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Wilson, DG, Cooley, AJ, Macwilliams, PS, y Markel, MD. Efectos del lavado con clorhexidina al 0,05% en las articulaciones Tarsocos rurales de caballos. Cirugía veterinaria. (1994) 23:442–7. doi: 10.1111/j.1532-950X.1994.tb00505.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Caso, DE, McAinsh, J, Rushton, A, y Winrow, MJ. (1976) «Clorhexidina: intentos de detectar la absorción percutánea en el hombre» en Problemas especiales de quimioterapia. eds. JD. Williams y AM. Geddes Quimioterapia, vol 3. (Boston, MA: Springer).
53. Silvestri, DL, y McEnery-Stonelake, M. Clorhexidina. Dermatitis. (2013) 24:112–8. doi: 10.1097/der.0b013e3182905561
54. Heinemann, C, Sinaiko, R, y Maibach, HI. Urticaria de contacto inmunológico y anafilaxia a clorhexidina: visión general. Curr Probl Dermatol. (2002) 1:186–94. doi: 10.1159/000066145
55. Zamora, JL . Características químicas, microbiológicas y toxicidad de las soluciones de povidona yodada. Am J Surg. (1986) 151:400–6. doi: 10.1016/0002-9610(86)90477-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Durani, P, y Leaper, D. Povidona yodada: uso en la desinfección de manos, preparación de la piel e irrigación antiséptica. Herida int J. (2008) 5:376–87. doi: 10.1111/j.1742-481x.2007.00405.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Bigliardi, PL, Alsagoff, SAL, El-Kafrawi, HY, Pyon, JK, Wa, CTC y Villa, MA. Povidona yodada en la cicatrización de heridas: una revisión de los conceptos y prácticas actuales. Int J Surg. (2017) 44:260–8. doi: 10.1016/j.ijsu.2017.06.073
Resumen de PubMed | Texto completo de Crossref | Google Académico
58. Rutala, WA . Guía APIC para la selección y uso de desinfectantes. Am J Control de Infecciones. (1996) 24:313–42. doi: 10.1016/s0196-6553(96)90066-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
59. Larson, ELCommittee 1992, 1993 y 1994 APIC Guidelines . Directrices de APIC para el lavado de manos y la antisepsia de manos en entornos de atención médica. Am J Control de Infecciones. (1995) 23:251–69. doi: 10.1016/0196-6553(95)90070-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
60. Atemnkeng, MA, Plaizier-Vercammen, J y Schuermans, A. Comparación de especies de yodo y yoduro libres y unidas en función de la dilución de tres formulaciones comerciales de povidona y yodo y su actividad microbicida. Int J Pharm. (2006) 317:161–6. doi: 10.1016/j.ijpharm.2006.03.013
Resumen de PubMed | Texto completo de Crossref | Google Académico
61. Berkelman, RL, Holland, BW, y Anderson, RL. Aumento de la actividad bactericida de preparaciones diluidas de soluciones de povidona yodada. J Clin Microbiol. (1982) 15:635–9. doi: 10.1128/jcm.15.4.635-639.1982
Resumen de PubMed | Texto completo de Crossref | Google Académico
62. Zamora, JL, Price, MF, Chuang, P, y Gentry, LO. Inhibición de la actividad bactericida de la povidona yodada por sustancias orgánicas comunes: un estudio experimental. Cirugía. (1985) 98:25–9.
63. Ghogawala, Z, y Furtado, D. Actividades bactericidas in vitro e in vivo de una solución de povidona yodada al 10, 2,5 y 1%. Am J Hosp Pharm. (1990) 47:1562–6.
64. Hemani, ML y Lepor, H. Preparación de la piel para la prevención de la infección del sitio quirúrgico: ¿qué agente es mejor? Rev. Urol. (2009) 11:190–5. doi: 10.3909/riu0467
65. Schmidt, AL, Oliver, SP, y Fydenkevez, ME. Persistencia germicida de los fondos de pezón por tetina extirpada modificada Procedimiento1. J Dairy Sci. (1985) 68:158–62. doi: 10.3168/jds.s0022-0302(85)80810-9
66. Berkelman, RL, Anderson, RL, Davis, BJ, Highsmith, AK, Petersen, NJ, Bond, WW, et al. Contaminación bacteriana intrínseca de una solución comercial de lodóforo: investigación de la planta de fabricación implicada. App Environ Microbiol. (1984) 47:752–6. doi: 10.1128/aem.47.4.752-756.1984
Resumen de PubMed | Texto completo de Crossref | Google Académico
67. O’Rourke, E, Runyan, D, O’Leary, J y Stern, J. Yodóforo contaminado en el quirófano. Am J Control de Infecciones. (2003) 31:255–6. doi: 10.1067/mic.2003.13
Resumen de PubMed | Texto completo de Crossref | Google Académico
68. Goswami, K, y Austin, MS. Irrigación intraoperatoria con povidona yodada para la prevención de infecciones. Arthroplast en la actualidad. (2019) 5:306–8. doi: 10.1016/j.artd.2019.04.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
69. Israel, SK, Jaramillo, E, y Liska, WD. Lavado de povidona yodada antes del cierre en la cirugía de reemplazo total de cadera: resultados de la infección y análisis de costo-beneficio. Cirugía veterinaria. (2023) 52:33–41. doi: 10.1111/vsu.13910
Resumen de PubMed | Texto completo de Crossref | Google Académico
70. Roberts, SM, Severin, GA, y Lavach, JD. Actividad antibacteriana de las soluciones diluidas de povidona yodada utilizadas para la desinfección de la superficie ocular en perros. Am J Vet Res. (1986) 47:1207–10.
71. Ferguson, AW, Scott, JA, McGavigan, J, Elton, RA, McLean, J, Schmidt, U, et al. Comparación de la solución de povidona yodada al 5% frente a la solución de povidona yodada al 1% en la antisepsia preoperatoria de la cirugía de cataratas: un estudio prospectivo aleatorizado doble ciego. Brit J Ophthalmol. (2003) 87:163–7. doi: 10.1136/bjo.87.2.163
Resumen de PubMed | Texto completo de Crossref | Google Académico
72. Birnbach, DJ, Meadows, W, Stein, DJ, Murray, O, Thys, DM, y Sordillo, EM. Comparación de povidona yodada y DuraPrep, una solución de yodoforo en alcohol isopropílico, para la desinfección de la piel antes de la inserción del catéter epidural en parturientes. Anestesiología. (2003) 98:164–9. doi: 10.1097/00000542-200301000-00026
Resumen de PubMed | Texto completo de Crossref | Google Académico
73. Osuna, DJ, DeYoung, DJ, y Walker, RL. Comparación de un paño adhesivo antimicrobiano y una preparación cutánea preoperatoria de povidona y lodina en perros. Cirugía veterinaria. (1992) 21:458–62. doi: 10.1111/j.1532-950x.1992.tb00081.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
74. Owen, LJ, Gines, JA, Knowles, TG y Holt, PE. Eficacia de los paños de incisión adhesivos en la prevención de la contaminación bacteriana de heridas quirúrgicas caninas limpias. Cirugía veterinaria. (2009) 38:732–7. doi: 10.1111/j.1532-950x.2009.00537.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
75. Webster, J y Alghamdi, A. Uso de paños adhesivos de plástico durante la cirugía para prevenir la infección del sitio quirúrgico. Sistema de la Base de Datos Cochrane Rev. (2015) 2019:CD006353. doi: 10.1002/14651858.cd006353.pub4
Resumen de PubMed | Texto completo de Crossref | Google Académico
76. Osuna, DJ, DeYoung, DJ, y Walker, RL. Comparación de tres técnicas de preparación de la piel en el perro parte 1: ensayo experimental. Cirugía veterinaria. (1990) 19:14–9. doi: 10.1111/j.1532-950x.1990.tb01136.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
77. Neihaus, SA, Hathcock, TL, Boothe, DM, y Goring, RL. Eficacia antiséptica prequirúrgica del diacetato de clorhexidina y povidona yodada en la cavidad prepucial canina. J Am Anim Hosp Assoc. (2011) 47:406–12. doi: 10.5326/jaaha-ms-5681
Resumen de PubMed | Texto completo de Crossref | Google Académico
78. Cruz, FD, Brown, DH, Leikin, JB, Franklin, C y Hryhorczuk, DO. Absorción de yodo después de la administración tópica. West J Med. (1987) 146:43–5.
79. Adams, D, Quayum, M, Worthington, T, Lambert, P y Elliott, T. Evaluación de un gluconato de clorhexidina al 2% en desinfectante cutáneo con alcohol isopropílico al 70%. J Hosp Infectar. (2005) 61:287–90. doi: 10.1016/j.jhin.2005.05.015
80. Lowbury, EJL, Lilly, HA, y Ayliffe, GAJ. Desinfección preoperatoria de las manos de los cirujanos: uso de soluciones alcohólicas y efectos de los guantes sobre la piel Flora. Hno. Med J. (2016) 4:369–72. doi: 10.1136/bmj.4.5941.369
81. Larson, E, y Bobo, L. Desgerminación efectiva de las manos en presencia de sangre. J Emerg Med. (1992) 10:7–11. doi: 10.1016/0736-4679(92)90003-C
Resumen de PubMed | Texto completo de Crossref | Google Académico
82. Isaza, D, DiGangi, BA, Isaza, N e Isaza, R. Impacto de los enjuagues quirúrgicos preparatorios con alcohol isopropílico o agua en la temperatura corporal perioperatoria en perras y gatas pediátricas. Veterinario Anaesth Analg. (2021) 48:198–204. doi: 10.1016/j.vaa.2020.11.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
83. Martínez, TT, Jaeger, RW, deCastro, FJ, Thompson, MW, y Hamilton, MF. Comparación de la absorción y el metabolismo del alcohol isopropílico por vía oral, dérmica e inhalación. Veterinario Hum Toxicol. (1986) 28:233–6.
84. Guarnición, RF . Intoxicación aguda por el uso de alcohol isopropílico en esponjas tibias. J Am Vet Med Assoc. (1953) 152:317–8. doi: 10.1001/jama.1953.63690040001007
Resumen de PubMed | Texto completo de Crossref | Google Académico
85. Grant, DH . Las propiedades antisépticas y bactericidas del alcohol isopropílico. Am J Med Sci. (1923) 166:261–4. doi: 10.1097/00000441-192308000-00014
86. Lee, I, Agarwal, RK, Lee, BY, Fishman, NO y Umscheid, CA. Revisión sistemática y análisis de costos que comparan el uso de clorhexidina con el uso de yodo para la antisepsia cutánea preoperatoria para prevenir la infección del sitio quirúrgico. Infect Control Hosp Epidemiol. (2010) 31:1219–29. doi: 10.1086/657134
Resumen de PubMed | Texto completo de Crossref | Google Académico
87. Noorani, A, Rabey, N, Walsh, SR, y Davies, RJ. Revisión sistemática y metaanálisis de la antisepsia preoperatoria con clorhexidina versus povidona yodada en cirugía limpia contaminada. Hno. J Surg. (2010) 97:1614–20. doi: 10.1002/bjs.7214
Resumen de PubMed | Texto completo de Crossref | Google Académico
88. Chen, S, Chen, JW, Guo, B y Xu, CC. Antisepsia preoperatoria con clorhexidina versus povidona yodada para la prevención de la infección del sitio quirúrgico: una revisión sistemática y metaanálisis. Mundo J Surg. (2020) 44:1412–24. doi: 10.1007/s00268-020-05384-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
89. Privitera, GP, Costa, AL, Brusaferro, S, Chirletti, P, Crosasso, P, Massimetti, G, et al. Antisepsia cutánea con clorhexidina versus yodo para la prevención de la infección del sitio quirúrgico: una revisión sistemática y metanálisis. Am J Control de Infecciones. (2017) 45:180–9. doi: 10.1016/j.ajic.2016.09.017
Resumen de PubMed | Texto completo de Crossref | Google Académico
90. Kamel, C, McGahan, L, Polisena, J, Mierzwinski-Urban, M, y Embil, JM. Preparaciones antisépticas cutáneas preoperatorias para prevenir infecciones del sitio quirúrgico: una revisión sistemática. Infect Control Hosp Epidemiol. (2012) 33:608–17. doi: 10.1086/665723
91. Dumville, JC, McFarlane, E, Edwards, P, Lipp, A, Holmes, A y Liu, Z. Antisépticos cutáneos preoperatorios para prevenir infecciones de heridas quirúrgicas después de una cirugía limpia. Sistema de la Base de Datos Cochrane Rev. (2013) 3:CD003949. doi: 10.1002/14651858.cd003949.pub3
Resumen de PubMed | Texto completo de Crossref | Google Académico
92. Marchionatti, E, Constant, C y Steiner, A. Protocolos preoperatorios de asepsia cutánea con clorhexidina frente a povidona yodada en cirugía veterinaria: una revisión sistemática y metaanálisis. Cirugía veterinaria. (2022) 51:744–52. doi: 10.1111/vsu.13810
Resumen de PubMed | Texto completo de Crossref | Google Académico
93. Amber, EI, Henderson, RA, Swaim, SF, y Gray, BW. Comparación de la eficacia antimicrobiana y la reacción tisular de cuatro antisépticos en heridas caninas. Cirugía veterinaria. (1983) 12:63–8. doi: 10.1111/j.1532-950x.1983.tb00708.x
94. Nye, AK, Rogovskyy, A, Lazarus, MA, Amore, R, y Mankin, KMT. Efectividad del diacetato de clorhexidina y la povidona yodada en la preparación antiséptica del conducto auditivo externo canino antes de la ablación total del conducto auditivo con el procedimiento de osteotomía bulla: un estudio preliminar. Vet Med Sci. (2023) 9:1998–2005. doi: 10.1002/vms3.1200
Resumen de PubMed | Texto completo de Crossref | Google Académico
95. Phillips, MF, Vasseur, PB y Gregory, CR. Yodo de clorhexidina para la preparación preoperatoria de la piel: una comparación prospectiva aleatorizada en perros y gatos. J Am Anim Hosp Assoc. (1991) 27:105–8.
96. Belo, L, Serrano, I, Cunha, E, Carneiro, C, Tavares, L, Carreira, LM, et al. Protocolos de asepsia cutánea como medida preventiva de infecciones del sitio quirúrgico en perros: clorhexidina-alcohol versus povidona-yodo. BMC Vet Res. (2018) 14:95. doi: 10.1186/s12917-018-1368-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
97. Gibson, KL, Donald, AW, Hariharan, H, y McCarville, C. Comparación de dos técnicas prequirúrgicas de preparación de la piel. Can J Vet res Revue Can de recherche vétérinaire. (1997) 61:154–6.
98. Swaim, SF, Riddell, KP, Geiger, DL, Hathcock, TL, y McGuire, JA. Evaluación de exfoliantes quirúrgicos y soluciones antisépticas para la preparación quirúrgica de patas caninas. J Am Vet Med Assoc. (1991) 198:1941–5. doi: 10.2460/javma.1991.198.11.1941
Resumen de PubMed | Texto completo de Crossref | Google Académico
99. Maiwald, M, y Chan, ESY. El papel olvidado del alcohol: una revisión sistemática y un metaanálisis de la eficacia clínica y el papel percibido de la clorhexidina en la antisepsia cutánea. PLoS Uno. (2012) 7:E44277. doi: 10.1371/journal.pone.0044277
Resumen de PubMed | Texto completo de Crossref | Google Académico
100. Kaoutzanis, C, Kavanagh, CM, Leichtle, SW, Welch, KB, Talsma, A, Vandewarker, JF, et al. Clorhexidina con alcohol isopropílico versus yodo Povacrylex con alcohol isopropílico y preparaciones cutáneas a base de alcohol versus no alcohol. Dis colon recto. (2015) 58:588–96. doi: 10.1097/dcr.000000000000000379
Resumen de PubMed | Texto completo de Crossref | Google Académico
101. Asimus, E, Palierne, S, Blondel, M, Pollet, V, Ferran, A, Bousquet-Melou, A, et al. Comparación del frotamiento hidroalcohólico y el lavado convencional con clorhexidina para la preparación aséptica de la piel en perros. Cirugía veterinaria. (2019) 48:1466–72. doi: 10.1111/vsu.13222
Resumen de PubMed | Texto completo de Crossref | Google Académico
102. Peel, TN, Watson, E y Lee, SJ. Ensayos controlados aleatorios de preparación cutánea del sitio quirúrgico a base de alcohol para la prevención de infecciones del sitio quirúrgico: revisión sistemática y metanálisis. J Clin Med. (2021) 10:663. doi: 10.3390/jcm10040663
Resumen de PubMed | Texto completo de Crossref | Google Académico
103. CCRSERI (Comité Científico de los Riesgos Sanitarios Emergentes y Recientemente Identificados) , Evaluación de los efectos de resistencia a los antibióticos de los biocidas. (2009). Disponible en: https://ec.europa.eu/health/ph_risk/committees/04_scenihr/docs/scenihr_o_021.pdf
104. Boothe, DM, y Boothe, HW. Consideraciones antimicrobianas en el paciente perioperatorio. Vet Clin North Am Small Anim Pract. (2015) 45:585–608. doi: 10.1016/j.cvsm.2015.01.006
105. Russell, AD . ¿Los biocidas seleccionan la resistencia a los antibióticos?*. J Pharm Pharmacol. (2000) 52:227–33. doi: 10.1211/0022357001773742
106. Kampf, G . La resistencia a los antibióticos puede mejorarse en las especies grampositivas mediante algunos agentes biocidas utilizados para la desinfección. Antibióticos. (2019) 8:13. doi: 10.3390/antibióticos8010013
Resumen de PubMed | Texto completo de Crossref | Google Académico
107. Kampf, G . Los agentes biocidas utilizados para la desinfección pueden aumentar la resistencia a los antibióticos en especies gramnegativas. Antibióticos. (2018) 7:110. doi: 10.3390/antibióticos7040110
Resumen de PubMed | Texto completo de Crossref | Google Académico
108. Kampf, G . Resistencia adquirida a la clorhexidina: ¿ha llegado el momento de establecer una iniciativa de «optimización antiséptica»? J Hosp Infectar. (2016) 94:213–27. doi: 10.1016/j.jhin.2016.08.018
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: antiséptico, acción antiséptica, cirugía, agentes de preparación de la piel, técnicas de preparación de la piel
Cita: Nye AK y Thieman Mankin KM (2024) Preparación preoperatoria de pacientes con animales pequeños: una revisión de antisépticos comunes, estudios comparativos y resistencia. Frente. Vet. Sci. 11:1374826. doi: 10.3389/fvets.2024.1374826
Recibido: 22 de enero de 2024; Aceptado: 19 de marzo de 2024;
Publicado: 28 Marzo 2024.
Editado por:
Michael Jaffe, Universidad Estatal de Mississippi, Estados Unidos
Revisado por:
Gregg Mitchell Griffenhagen, Universidad Estatal de Colorado, Estados
Unidos Cristin Coman, «Cantacuzino», Instituto Nacional de Investigación y Desarrollo Médico-Militar, Rumania
Derechos de autor © 2024 Nye y Thieman Mankin. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Kelley M. Thieman Mankin, KThieman@tamu.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía