Progresión de los niveles sanguíneos de ciclosporina A en gatos experimentales
 Sarah Rösch1*†
Sarah Rösch1*† Anna Frommeyer1
Anna Frommeyer1 Jenny Schulte Bocholt1
Jenny Schulte Bocholt1 Denis Grote-Koska2
Denis Grote-Koska2 Marca Korbinian2
Marca Korbinian2 Reinhard Mischke1*
Reinhard Mischke1*- 1Clínica de Pequeños Animales, Universidad de Medicina Veterinaria de Hannover, Fundación, Hannover, Alemania
- número arábigoInstituto de Química Clínica, Facultad de Medicina de Hannover (MHH), Hannover, Alemania
Fondo: La ciclosporina A (CsA) se utiliza como agente inmunosupresor alternativo o ahorrador de esteroides en gatos con diversas enfermedades inmunomediadas, como la anemia hemolítica inmunomediada. Se han descrito dosis diarias de tratamiento de 5-20 mg/kg. Se sabe que ocurren variaciones interindividuales en los niveles sanguíneos de CsA. Para determinar cuándo se alcanzan las condiciones de estado estacionario y, por lo tanto, el momento más temprano aconsejable para controlar los niveles de CsA en sangre durante el curso del tratamiento, se llevó a cabo un estudio experimental prospectivo en seis gatos domésticos de pelo corto adultos sanos.
Materiales y métodos: Los gatos fueron tratados con una dosis oral de 7 mg/kg de CsA cada 12 h durante 10 días. En los días 1, 2, 3, 5, 7 y 10 después del inicio de la administración de CsA (es decir, después de 1, 3, 5, 9, 13 y 19 administraciones de CsA), se recolectó sangre con EDTA para medir el nivel de CsA 12 h después de la administración de CsA (valores mínimos) utilizando cromatografía líquida de alta resolución acoplada a espectrometría de masas (HPLC-MS/MS).
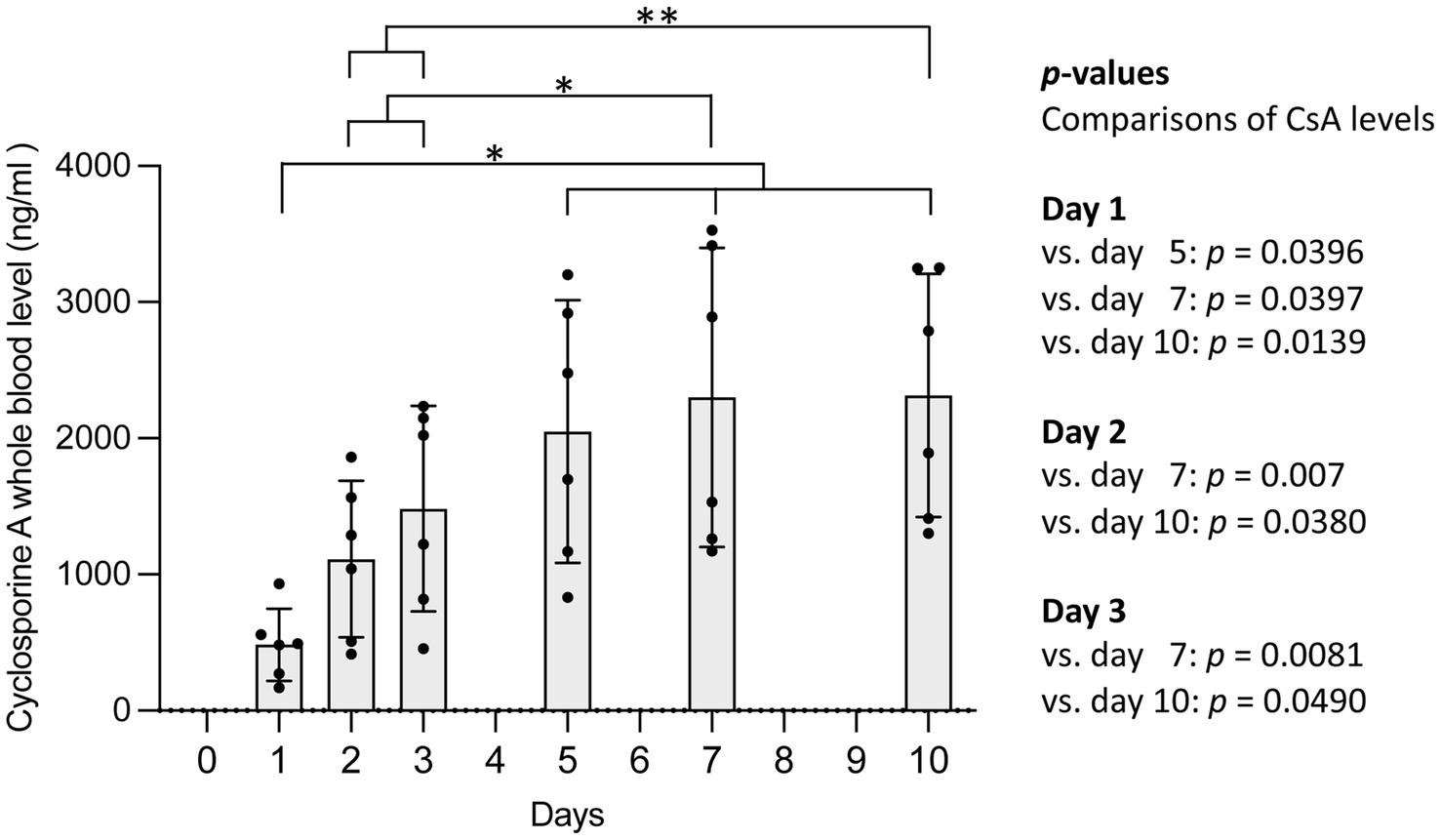
Resultados: El análisis estadístico reveló un aumento significativo en los niveles medios de CsA en sangre hasta el día 5 (2.050 ± 964,2 ng/mL [media ± DE], 832-3.203 ng/mL [mínimo-máximo]; ANOVA de medidas repetidas: p = 0,0021), mientras que los valores de los días 5 y 7 no difirieron significativamente de las concentraciones de CsA en el día 10. Las concentraciones de CsA mostraron una marcada variabilidad interindividual.
Conclusión: Los niveles de ciclosporina A en sangre alcanzaron un estado estable en el día 5 de dosis altas de CsA a las 12 h (es decir, después de nueve administraciones de CsA), lo que indica que este punto de tiempo es adecuado para monitorizar los niveles sanguíneos en pacientes clínicos. Los resultados confirmaron la notable variabilidad interindividual de la CsA, lo que indica la necesidad de un seguimiento del tratamiento. El régimen de tratamiento evaluado dio como resultado niveles medios de CsA mínimos significativamente más altos que el rango objetivo para la terapia inmunosupresora (200-600 ng/mL).
Introducción
La ciclosporina A (CsA) es un agente inmunomodulador e inmunosupresor sistémico (1-3). En general, actúa sobre las subpoblaciones de linfocitos T auxiliares e inductores al inhibir la calcineurina en las células T, suprimiendo así la producción de interleucina (IL)-2 y otras, como IL-4, IL-5, IL-6, IL-8 e IL-13 (1, 2). La inmunidad humoral se ve menos afectada. Otros efectos antiinflamatorios de la CsA incluyen la reducción de la degranulación de los mastocitos, eosinófilos y basófilos, la reducción de la expresión de moléculas de adhesión epitelial y la reducción de la actividad de las células presentadoras de antígenos (1, 2). A la CsA se le atribuyen efectos antiproliferativos. A diferencia de otros inmunosupresores, no se observan efectos secundarios tóxicos sobre la médula ósea (4).
Debido a sus propiedades inmunosupresoras, la CsA se utiliza eficazmente con recomendaciones de dosis variables en gatos con diversas enfermedades inmunomediadas, incluidas las enfermedades de la piel (3) y enfermedades hematológicas como la anemia hemolítica inmunomediada (5). En general, se recomienda una dosis de 7 mg/kg por OS cada 24 h en gatos hasta que los signos clínicos remitan, seguida de una reducción de la dosis a una administración cada 48 h (1, 6). Sin embargo, en casos de anemia hemolítica inmunomediada o aplasia pura de glóbulos rojos, se describen dosis más altas de CsA de hasta 20 mg/kg por par cada 24 h (1, 7). Por lo tanto, en la clínica de pequeños animales de los autores, los gatos con anemia hemolítica inmunomediada o aplasia pura de glóbulos rojos se tratan inicialmente con 7 mg/kg por par cada 12 h.
Pocos estudios han abordado la farmacocinética y los niveles mínimos de CsA en gatos en particular, especialmente en lo que respecta a dosis más altas (1, 8, 9). Sin embargo, se han descrito grandes variaciones interindividuales de los niveles de CsA después de la administración (1). Para evitar que los niveles altos y tóxicos de CsA provoquen efectos adversos o niveles por debajo del rango terapéutico, se recomienda el control de los niveles de CsA después de alcanzar condiciones de estado estacionario. Sin embargo, no se conoce con exactitud el tiempo necesario para alcanzar un estado estable en gatos con la administración de dosis altas dos veces al día. En la literatura existen estimaciones variables para el control de los niveles de CsA de 1 semana (7) o de 2 a 4 semanas (1) después del inicio del tratamiento, pero se refieren a dosis más bajas y/o a la aplicación una vez al día.
En cuanto a la interpretación de los niveles de CsA, hay que tener en cuenta el método de detección (10). En la literatura se describen varios métodos para determinar los niveles de CsA. El radioinmunoensayo mide la CsA y varios de sus metabolitos circulantes, lo que posiblemente conduzca a niveles más altos de CsA medidos (2, 10). Por el contrario, la cromatografía líquida de alta resolución junto con la espectrometría de masas en tándem (HPLC-MS/MS) detecta solo el fármaco adecuado y no tiene reactividad cruzada con sus metabolitos (11). Además, el momento de la recogida de muestras es importante. A diferencia de los niveles máximos determinados 2 h después de la administración de CsA según la literatura en gatos (5) similares a los humanos (10), los niveles mínimos que representan los niveles más bajos de CsA se determinan dentro de 1 h antes de la administración del fármaco (1, 9).
El objetivo principal de este estudio fue determinar los días de tratamiento en los que se alcanzaron las condiciones de estado estacionario de los niveles mínimos en gatos sanos después de la administración oral de 7 mg/kg de PCc CsA cada 12 h utilizando HPLC-MS/MS para la medición de CsA y determinar el momento más temprano aconsejable para monitorizar los niveles sanguíneos de CsA en gatos que recibieron este protocolo de dosis altas. Además, se deben evaluar los posibles efectos adversos.
Métodos
Diseño del estudio
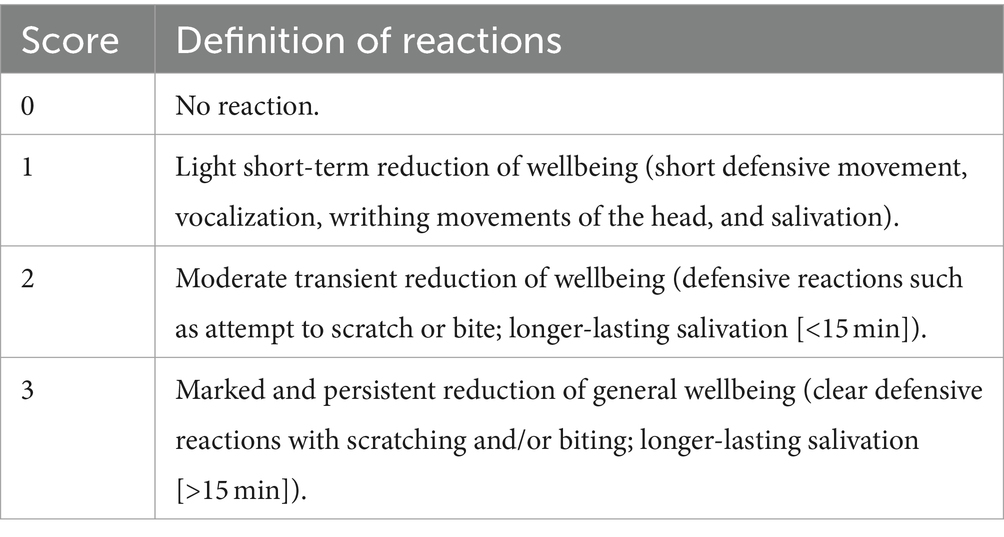
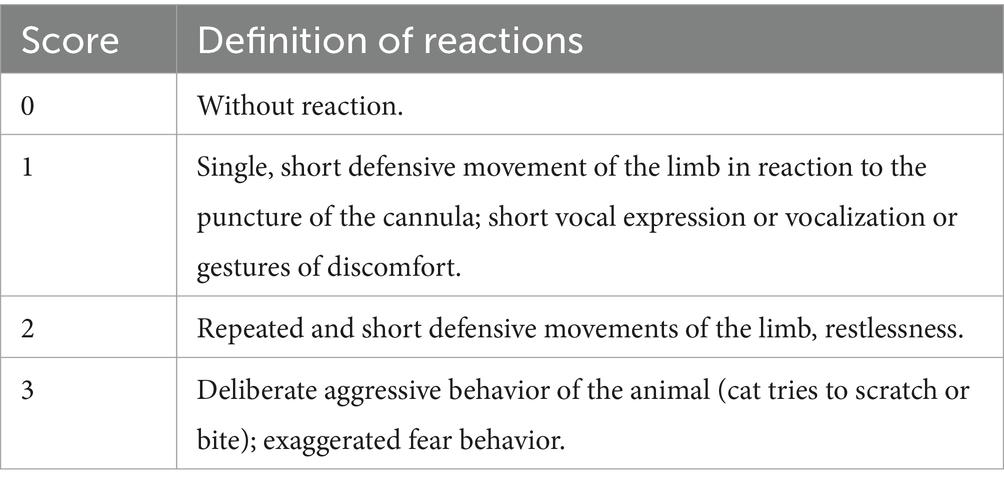
Seis gatos domésticos sanos y experimentales de pelo corto fueron tratados con una dosis oral de 7 mg/kg de CsA cada 12 h durante 10 días. A los 6 días: días 1, 2, 3, 5, 7 y 10 de tratamiento con CsA (es decir, después de 1, 3, 5, 9, 13 y 19 administraciones de CsA), se recolectó sangre de EDTA por la noche para medir el nivel de CsA 12 h después de la administración de CsA e inmediatamente antes de la administración de la siguiente dosis (nivel mínimo) utilizando HPLC-MS/MS. Posibles reacciones directas a la administración de CsA, Las reacciones a las venopunciones venosas y las posibles reacciones adversas se registraron mediante sistemas de puntuación (Tablas 1-3). Por lo tanto, se realizaron controles de salud diarios, incluido el control de la ingesta de alimentos y agua, así como la producción de orina y heces. Además, antes y al final del experimento (en los días 0 y 10), se evaluó el score de condición corporal (BCS) según las guías de evaluación nutricional de la WSAVA (12), y se realizaron análisis de sangre hematológicos y bioquímicos.

Gatos
Se incluyeron seis gatos domésticos de pelo corto experimentales del Instituto de Parasitología de la Universidad de Medicina Veterinaria de Hannover, Alemania (cinco machos castrados, una hembra esterilizada). Estaban poco acostumbrados a la manipulación y al tratamiento por parte de los veterinarios. La edad fue de 2,5 años (n = 4) y 3,5 años (n = 2); El peso corporal medio fue de 4,4 kg ± 0,7 kg (3,4-5,1 kg; mínimo-máximo). Para ser incluidos en el estudio, los gatos tenían que ser poco notables en el comportamiento clínico, el examen clínico, el recuento sanguíneo y la química sanguínea (incluida la actividad de la lipasa). Otros criterios de inclusión fueron un examen parasitológico fecal negativo (procedimiento de flotación, sedimentación y emigración según Baermann, Instituto de Parasitología, Universidad de Medicina Veterinaria de Hannover) y resultados negativos de las pruebas de antígeno del virus de la leucemia felina y anticuerpos contra el virus de la inmunodeficiencia felina (pruebas SNAP FIV/FeLV, IDEXX, Ludwigsburg, Alemania).
Alojamiento de los gatos
Los gatos fueron alojados en condiciones experimentales bien definidas y estandarizadas en una habitación separada en la Clínica para Pequeños Animales de la Universidad de Medicina Veterinaria de Hannover, Alemania. Se tomaron precauciones higiénicas especiales con desinfección de manos y pies antes de ingresar a la habitación. Todos los tratamientos se llevaron a cabo de acuerdo con las guías de Prácticas Amigables® con los Gatos (12). Para la evaluación de los vómitos, la defecación y la ingesta de alimentos, fue necesaria una sola vivienda. Por lo tanto, los gatos se alojaron durante un mínimo de hasta 2 h después del tratamiento con CsA oral, así como por la tarde y durante la noche en jaulas individuales con lugares de descanso, cajas de arena y agua ad libitum. Durante el día, después de que los gatos hubieran defecado y evaluado la consistencia fecal, grupos de hasta tres gatos tenían libre acceso a la habitación con juguetes. Durante el acceso gratuito, las cajas de arena compartidas y el agua estaban disponibles libremente. Antes de que los gatos fueran devueltos a sus jaulas individuales y antes de cada administración de CsA, se comprobó su identidad correcta utilizando los microchips de los gatos.
Dos horas antes (por la mañana) y después (por la noche) del tratamiento oral con CsA, los gatos fueron alimentados con su dieta habitual y estandarizada de acuerdo con su peso corporal. El agua estuvo disponible ad libitum durante todo el tiempo que duró el experimento.
Administración de CsA
La cantidad requerida de CsA (microemulsión, Atopica®, 100 mg/mL CsA, Elanco, Bad Homburg vor der Höhe, Alemania) se ajustó y calculó de acuerdo con el peso determinado en los puntos temporales específicos de la aplicación de CsA (por la mañana y por la noche). Por lo tanto, la dosis precisa del fármaco se llenó en cápsulas vacías utilizando una pipeta monocanal (pipeta de transferencia S, 100-1.000 μL, Brand, Wertheim, Alemania). La administración en cápsulas (cápsula de gelatina dura, transparente, tamaño 1, Wepa Apothekenbedarf, Hillscheid, Alemania, fuente de la cápsula cumple con la monografía de Ph.Eur. 10.0/0016; primera administración por la mañana del día 1) se optó para evitar la salivación observada después de la administración oral de CsA líquida (2). En una prueba preliminar, se demostró que, a diferencia del agua que resulta en el ablandamiento de la cápsula dentro de los 10 minutos posteriores al llenado, no se pudo observar ninguna alteración palpable dentro de las 2 semanas posteriores al llenado de la formulación del medicamento utilizada (Atopica®) en la cápsula.
Para la administración oral, la cápsula preparada se sumergió en una golosina cremosa comercial (Schleckerli®, Winston, Rossmann, Burgwedel, Alemania, sabor a salmón e inulina o pollo y biotina). Como resultado, los gatos ingirieron las cápsulas por su cuenta, escondidos en las golosinas. El éxito de la administración fue supervisado por una segunda persona (JSB o AF; Video Complementario S1). Se introdujeron y documentaron puntuaciones de viabilidad y comportamiento felino para la alimentación de las cápsulas (Tabla 1).
Seguimiento clínico
Durante el ensayo, se registraron diariamente los resultados del examen clínico, las mediciones de peso (dos veces al día) y la evaluación del comportamiento general. Para evaluar la tolerancia gastrointestinal y los posibles efectos secundarios de la administración de CsA (Tabla 2), se registraron y evaluaron diariamente la ingesta de alimentos (apetito), los vómitos, la defecación (cantidad, color) y la consistencia fecal (según la puntuación® fecal de Purina) (Tabla 2). Según la aprobación del estudio experimental, los gatos también podrían ser tratados con varios medicamentos de apoyo en caso de malestar gastrointestinal. También se registró la micción.
Extracción de sangre
Para la extracción de sangre, los gatos fueron movidos cuidadosamente en una posición semilateral y acurrucados y masajeados por dos asistentes (uno en el hombro y el otro en la cadera), y se distrajeron con un bocadillo muy pequeño para lamer mientras se tomaba la muestra de sangre de la pata trasera (vena saphena medialis). Inmediatamente antes de la venopunción, se realizó la desinfección con dos desinfectantes cutáneos (Softasept N y Braunol 7,5% solución, Braun, Melsungen, Alemania). Para la punción se utilizó una cánula desechable Easy-Lance (22Gx 1 1/4″, WDT, Garbsen, Alemania). Se registraron las puntuaciones de reacción a la venopunción (Tabla 3). Para la medición de las concentraciones sanguíneas de CsA (a partir del día 1), así como para el hemograma del día 0 (antes de la administración de CsA) y el día 10 de la administración de CsA (después de 19 administraciones de CsA), se recolectó sangre en tubos de muestra de EDTA de potasio y para la química sanguínea en el día 0 y el día 10 en tubos de muestra de heparina de litio (Sarstedt, Nümbrecht, Alemania). Después de la venopunción, se aplicó un vendaje y, posteriormente, si los gatos lo toleraban, una cantidad de gel de heparina del tamaño de un guisante (Hepathrombin-Gel 30000 I.E., Teofarma Deutschland, Friburgo de Brisgovia, Alemania) en los sitios de punción para prevenir la flebitis.
Mediciones de CsA
Las muestras de sangre de EDTA para las mediciones de CsA se congelaron a -80° después de la extracción de sangre. Se enviaron congelados en hielo seco para su examen externo después de la finalización del experimento. Las mediciones de CsA se realizaron en el Instituto de Química Clínica de la Facultad de Medicina de Hannover (MHH), Alemania. El personal del laboratorio quedó ciego. Como se ha descrito anteriormente (5), para los análisis, la sangre se preparó con el sistema de automatización MassStar (Hamilton Robotics, Hamilton Alemania, Graefelfing, Alemania) de acuerdo con el kit certificado por IVD-CE ONEMINUTE MassTox® Immunosuppressants (Chromsystems Instruments & Chemicals, Graefelfing, Alemania). Las muestras se analizaron mediante HPLC (sistema de HPLC 1260 Infinity) acoplado a un espectrómetro de masas en tándem (6460 Triple Quad LC/MS, Agilent Technologies, Palo Alto, Estados Unidos). Como se describió anteriormente (5), se realizó una calibración multipunto 6 + 1 utilizando CsA marcado con isótopos como patrón interno. Se midieron cuatro controles de calidad comerciales varias veces al día. Las muestras con concentraciones de CsA que superaban el rango de medición lineal (15-1.880 ng/mL) se diluyeron de acuerdo con la hoja de instrucciones. La precisión de las mediciones intraensayo e interensayo es (coeficiente de variación, n = 10 mediciones) de 1,8 y 2,6%, respectivamente. La precisión fue confirmada por 4 materiales de control y el calibrador más bajo, revelando resultados entre el 91 y el 104% de los valores asignados.
Resto de métodos de laboratorio
El hemograma completo se midió automáticamente e incluyó recuentos de hematocrito, leucocitos, neutrófilos y linfocitos (Advia 2120 Hematology System, Siemens Healthineers, Alemania). El perfil bioquímico sanguíneo basal incluyó lo siguiente: proteínas totales, albúmina, creatinina, urea, glucosa, concentraciones de colesterol, así como las actividades de las enzimas alanina aminotransferasa y lipasa (basadas en el sustrato 1,2-Di-O-lauril-rac-glicero-3-ácido glutárico 6′-metilresorufina-éster). Las mediciones se realizaron automáticamente con el autoanalizador Cobas C311 utilizando reactivos, calibrador y material de control de calidad del fabricante (Roche Diagnostics, Mannheim, Alemania).
Estadística
El análisis estadístico se realizó con el uso de GraphPad Prism (v 9.5.1., La Jolla, Estados Unidos). Los datos se probaron para la distribución normal mediante las pruebas de Shapiro-Wilk y Kolmogorov-Smirnov. Los datos de los niveles de CsA se distribuyeron normalmente y, en consecuencia, se informaron como media ± desviación estándar (DE). Para la comparación estadística de los niveles de CsA en los días 1, 2, 3, 5, 7 y 10 (es decir, después de 1, 3, 5, 9, 13 y 19 administraciones de CsA), se utilizó ANOVA de medidas repetidas con corrección de Geisser-Greenhouse con la prueba de comparaciones múltiples de Tukey.
Los valores sanguíneos registrados en los días 0 y 10 no se distribuyeron normalmente y se informaron como mediana y rango intercuartílico (RIC). Para estos valores sanguíneos no distribuidos normalmente, se utilizó la prueba de rangos con signo de Wilcoxon emparejado de dos colas como diseño experimental para los datos pareados. Los valores de p de <0,05 se consideraron significativos.
Resultados
Nivel de CsA
La concentración media de CsA difirió significativamente entre los seis puntos temporales (días de muestreo de sangre) con un aumento significativo después de nueve administraciones de CsA en el día 5 (ANOVA de medidas repetidas, F = 22,21, p = 0,0021, Figura 1). Los valores de los días 5, 7 y 10 (es decir, después de 9, 13 y 19 administraciones de CsA) no fueron estadísticamente significativamente diferentes. Las concentraciones de CsA mostraron una marcada variabilidad interindividual (Figura 1; Cuadro complementario).
Examen de sangre: hematología y bioquímica
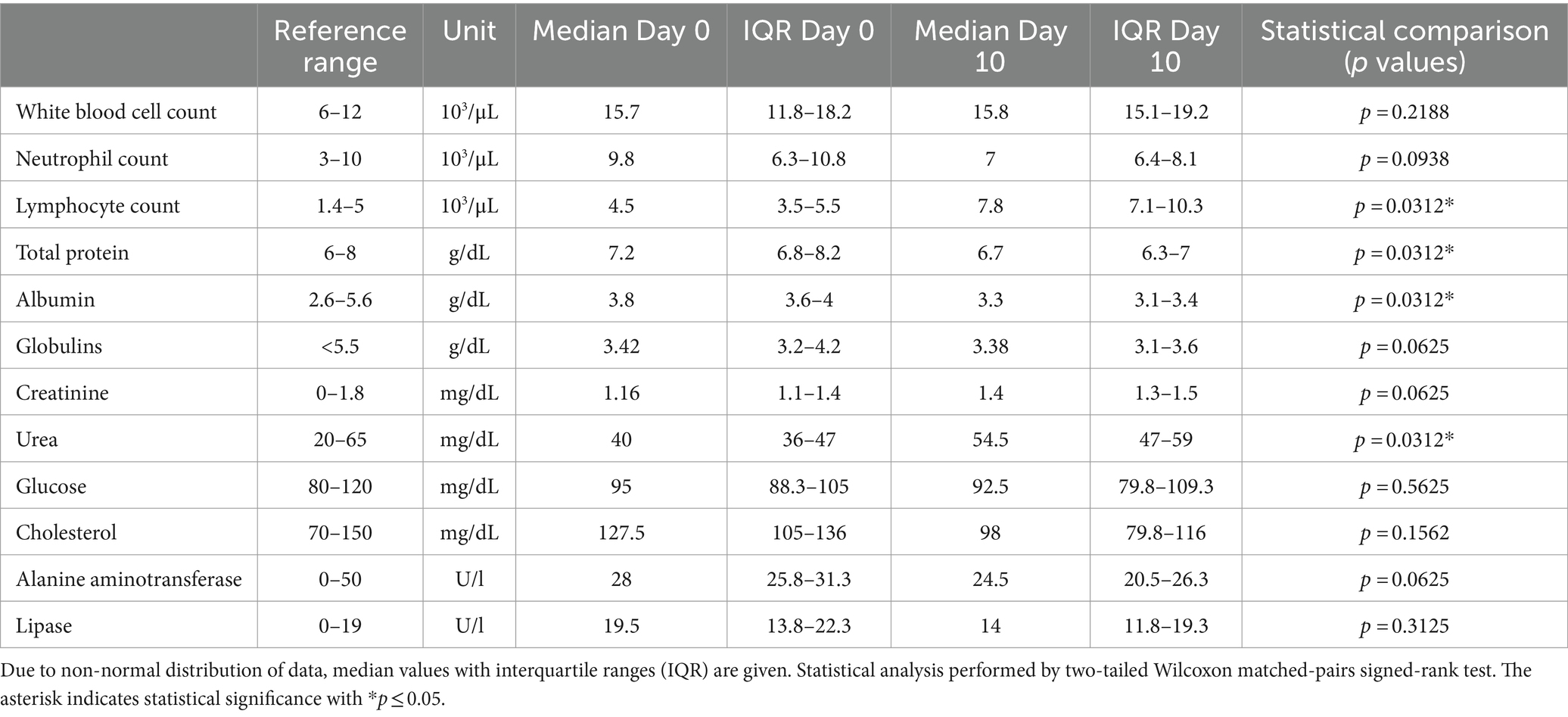
La mediana de los recuentos de glóbulos blancos estuvo ligeramente por encima del rango de referencia al principio y al final del estudio (Tabla 4). El recuento absoluto de linfocitos aumentó significativamente y estuvo por encima del rango de referencia en todos los gatos el día 10 (Tabla 4). En el día 10 de tratamiento, se observaron disminuciones significativas en las concentraciones totales de proteína y albúmina en los seis gatos en comparación con los valores basales, a pesar de que los valores (excepto para un gato) estaban dentro del rango de referencia antes y después del tratamiento (Tabla 4). Además, hubo un aumento en la concentración media de urea en sangre (Tabla 4).
Administración de CsA, extracción de sangre, tolerancia y efectos adversos
Los gatos toleraron bien la administración de CsA en cápsulas y las comieron sin ninguna fijación (puntuado con 0 todos los días; puntuación: ver Tabla 1, Video Suplementario S1). Ningún gato mostró vómitos o salivación después de comer la cápsula. Durante todo el período de prueba, todos los gatos mostraron una buena condición física con parámetros vitales en el rango de referencia y sin anomalías clínicamente detectables. Todas las punciones venosas se puntuaron con 0-1 (puntuación: véase la Tabla 3). El BCS fue de 4/9 en todos los gatos al inicio y al final del estudio. Todos los gatos mostraron un buen apetito e ingesta de alimentos durante el ensayo. Sin embargo, un gato vomitó una vez (sin tiempo en relación con la administración de CsA). Otro gato (gato 6) vomitó en dos ocasiones, que no estaban relacionadas con el tiempo de administración de CsA, y recibió una única inyección subcutánea de 1 mg/kg de maropitant el día 6 y de omeprazol 1 mg/kg por par cada 24 h los 4 días siguientes. No se observaron más vómitos en ese gato. Se observaron heces más blandas en cinco de los seis gatos en el segundo día de administración de CsA. Si bien la consistencia de las heces mejoró en dos de los cinco gatos en los días siguientes, las heces permanecieron más blandas en la mayoría de los días del período experimental en los tres de los cinco gatos restantes. En uno de estos tres gatos (gato 1), un complemento alimenticio de origen vegetal (Diatab®; con orujo de frutas, bentonita y electrolitos; Alfavet, Neumünster, Alemania). Por lo tanto, los efectos adversos de CsA (puntuación Tabla 2) se calificaron como de 1 (3/6 gatos) a grado medio 2 (3/6 gatos) considerando la calidad fecal y los vómitos. En los siguientes 6 meses después del ensayo experimental, los gatos parecían sanos en términos de condición general, comportamiento, comida e ingesta de agua, así como heces y excreción de orina.
Discusión
Las concentraciones sanguíneas de ciclosporina A aumentaron después del inicio del tratamiento con 7 mg/kg de CsA cada 12 h y alcanzaron con esta dosis alta de administración dos veces al día condiciones de estado estacionario después de 5 días (es decir, después de 9 administraciones de CsA como parte de un esquema de aplicación cada 12 h). Por lo tanto, el control de los niveles sanguíneos terapéuticamente relevante del tratamiento con dosis altas de CsA se puede realizar después de este período de tiempo. En gatos con enfermedades hematológicas inmunomediadas y hospitalización prolongada, este hecho es importante porque los controles de los niveles de CsA ya se pueden realizar durante la hospitalización y antes del alta. La información previa en la literatura que se refiere a dosis más bajas y/o aplicación una vez al día sugirió 1 semana (7) o 2-4 semanas (1) hasta que se alcancen las condiciones de estado estacionario.
Sorprendentemente, los niveles mínimos de CsA en el presente estudio fueron marcadamente más altos que los niveles del rango objetivo para la terapia inmunosupresora, que son de 200 a 600 ng/mL en «nuestra» clínica o de 400 a 600 ng/mL en otros estudios sobre CsA oral en gatos (7, 13). El primer rango citado se alcanza en muchos de nuestros pacientes felinos que sufren de anemia hemolítica inmunomediada o aplasia pura de glóbulos rojos y tratados con 7 mg/kg cada 12 h de CsA (datos no publicados). Los primeros controles de los niveles sanguíneos de CsA se realizan actualmente aproximadamente 10 días después de iniciar el tratamiento. El rango objetivo de 200-600 ng/mL para los niveles de CsA en sangre, originalmente derivado de la medicina humana, parece ser clínicamente eficaz en gatos que padecen las enfermedades citadas anteriormente en «nuestra» clínica durante muchos años, pero aún está pendiente una evaluación retrospectiva de estos datos. Los niveles marcadamente más altos de CsA en este estudio en comparación con los pacientes felinos podrían deberse al hecho de que los gatos del presente estudio estaban sanos y no estaban recibiendo ningún fármaco adicional que pudiera influir en el metabolismo de CsA, según lo informado por Colombo et al. (1). Otros posibles factores que influyen incluyen la administración incompleta en comparación con las condiciones experimentales optimizadas y la reducción de las concentraciones de glóbulos rojos en gatos anémicos, lo que influye en los niveles sanguíneos de CsA como se especifica a continuación. Por lo tanto, los resultados de este estudio deben verificarse en gatos enfermos, que reciben adicionalmente otros fármacos. Además, las investigaciones adicionales parecen valiosas para aclarar la relevancia de diferentes factores posiblemente responsables de los niveles más bajos de CsA en pacientes felinos en comparación con las condiciones experimentales optimizadas para optimizar los programas de tratamiento de CsA en gatos.
Los niveles mínimos de ciclosporina A en el presente estudio también fueron más altos que en otro estudio con gatos sanos (2). En el estudio citado de Latimer et al., se midieron valores mínimos de CsA entre 134 y 902 ng/mL en gatos sanos tratados con una dosis aún mayor de 10 mg/kg de CsA cada 12 h, aunque los niveles de CsA se determinaron mediante radioinmunoensayo (2). Como ya se ha mencionado en la introducción, la detección de niveles de CsA mediante inmunoensayos puede conducir a valores más altos de CsA al detectar adicionalmente varios de los metabolitos circulantes de CsA (5).
Una posible razón para las concentraciones más altas de CsA en nuestro estudio podría ser el hecho de que los gatos en el estudio citado y en otros mostraron salivación (2, 5) o sacudidas de cabeza (2) después de la administración de la solución oral de CsA. Las soluciones de CsA se utilizan a menudo para el tratamiento en gatos porque permiten una dosificación exacta según el peso corporal. Por el contrario, esto no es posible con las cápsulas de CsA disponibles en el mercado (25 mg de CsA por cápsula) (3). Para administrar de forma fiable toda la dosis calculada y evitar sacudidas de cabeza o vómitos después de administrar la solución de CsA, en el presente estudio, la CsA se administró en cápsulas vacías (cápsulas de gelatina dura). A diferencia de otros estudios, no se observaron ni salivación ni vómitos. Sumergir las cápsulas en una golosina cremosa comercial resultó en una administración fácil de CsA para los gatos. Como resultado, los gatos ingirieron las cápsulas por su cuenta, escondidos en las golosinas. En general, se aconseja administrar CsA con el estómago vacío, ya que su biodisponibilidad depende de los alimentos (14). La ventaja de una aplicación del fármaco apta para gatos supera claramente la reducción teóricamente mínima de la biodisponibilidad en una pequeña cantidad de la golosina.
Otra razón para los valores más altos de CsA en el presente estudio es la naturaleza de las muestras. En el estudio de Latimer et al. (2), las mediciones de CsA se tomaron mediante la realización de radioinmunoensayo en muestras de suero. Según Wood et al., después de la administración de CsA y la absorción, el 50% de la CsA permanece en los glóbulos rojos, el 10-20% en los leucocitos y el resto en el plasma, donde se une principalmente a lipoproteínas de alta y baja densidad (2). En el presente estudio, al igual que en otros estudios (10, 11), se realizó un análisis de la sangre con EDTA, comprendiendo así también el contenido de CsA de las células sanguíneas (8).
Otra posible razón para los niveles más altos de CsA en el presente estudio podría ser la formulación de CsA en sí misma. Latimer et al. (2) utilizaron CsA en aceite de oliva que se diluyó aún más con aceite de cocina de cacahuete, en contraste con la microemulsión Atopica® utilizada en el presente estudio, que a menudo se denomina formulación de referencia (8).
El presente estudio experimental confirmó la alta variabilidad interindividual en cuanto a los valores mínimos de CsA en gatos, que se ha descrito previamente en gatos (1, 2, 9) como en otras especies como perros (15) y humanos (16). Los factores que se sabe que influyen en la farmacocinética de la CsA son la absorción de CsA en el tracto gastrointestinal (4), ya que solo se absorbe mal después de la administración oral, su distribución y el metabolismo hepático (5, 17). Se cree que la metabolización del fármaco por enzimas como el citocromo-P450 en el hígado es el factor más importante responsable de la variabilidad interindividual (1, 18). Por lo tanto, en pacientes enfermos, con posibles alteraciones gastrointestinales y hepáticas y medicaciones adicionales, la farmacocinética de CsA puede verse afectada (1, 17). Esto puede afectar no solo a los valores mínimos, sino también a la vida media de absorción y eliminación. Por lo tanto, como ya se indicó anteriormente, el intervalo de tiempo más temprano para lograr las condiciones de estado estacionario evaluado en el presente estudio debe ser reevaluado en pacientes clínicos.
Una limitación del presente estudio y de los niveles de CsA obtenidos es el pequeño tamaño de la muestra de seis gatos sanos. Este bajo número de animales de experimentación se eligió por razones éticas y teniendo en cuenta el principio de las 3R para reducir, refinar y reemplazar los experimentos con animales (19). A pesar del bajo número de gatos, los hallazgos del presente estudio tienen una potencia superior al 50%, que puede extrapolarse a partir de los valores de p observados (en nuestro estudio menos de 0,05) con un valor alfa de 0,05 (20). Una limitación más es, como se mencionó anteriormente, que el estudio se realizó en gatos adultos sanos y los resultados pueden diferir en animales enfermos, por lo que recomendamos realizar más estudios en gatos enfermos.
En el presente experimento se determinaron los niveles mínimos, ya que es de uso común en la clientela de pacientes de nuestra clínica. A diferencia de la toma de muestras de sangre por la noche para determinar los niveles mínimos en este experimento, las citas temprano en la mañana antes de que el propietario administre CsA son fácilmente practicables en lo que respecta a la comunicación con el propietario y la elección de la cita.
Los puntos de tiempo especificados (días) para los análisis de sangre se eligieron en función de los principios farmacológicos generales, lo que sugiere que el estado estacionario se alcanza después de 4-6 aplicaciones, lo que corresponde a los días 2-3 en nuestro experimento con dos administraciones de CsA por día (con el inicio de la aplicación de CsA el día 1). La condición para esta suposición es que las aplicaciones posteriores estén por debajo de las cinco vidas medias, como fue el caso en este experimento, considerando el resultado de estudios realizados previamente sobre la vida media de CsA [según Schuh et al. (5); 4.6 h]. Por lo tanto, los controles de nivel de CsA eran más estrictos al comienzo del experimento. Debido a consideraciones éticas que evaluaban el volumen de sangre a extraer, las posibles reacciones cutáneas y venosas con la toma diaria de muestras de sangre y el bienestar de los animales, la toma de muestras diarias de sangre no fue factible y se redujo a los días especificados. Al final, sin embargo, se alcanzó el estado estacionario después de nueve aplicaciones de CsA (el día 5), que es más largo de lo habitual para muchos otros fármacos. Las razones de esto son especulativas. El almacenamiento en el tejido graso y los fenómenos de saturación y redistribución podrían desempeñar un papel. La duración del ensayo fue de 10 días, ya que históricamente se han determinado los niveles de CsA en gatos enfermos tratados con CsA en este día en nuestra clínica.
En los gatos del presente estudio, solo se observaron cambios menores en las pruebas de sangre después del estudio. En confirmación con Latimer et al. (2), se observaron recuentos de linfocitos significativamente más altos (por encima del rango de referencia) en todos los gatos en este estudio, lo que resultó en recuentos de leucocitos más altos. Latimer et al. (2) discutieron una respuesta fisiológica inducida por la epinefrina a la fijación (por ejemplo, para la toma de muestras de sangre o la administración de medicamentos CsA) como la causa de esto, porque los gatos pueden exhibir linfocitosis durante la excitación. Sin embargo, los autores del presente estudio no consideran que este sea el caso en los animales examinados aquí, ya que, en primer lugar, no se detectó un aumento sincrónico de los granulocitos neutrófilos y, en segundo lugar, los gatos fueron tratados de acuerdo con Cat Friendly Practice® sin una fijación pesada y con una adaptación cada vez mayor al procedimiento de toma de muestras de sangre.
A diferencia de otros estudios de mayor duración en gatos enfermos con dermatitis por hipersensibilidad no inducida por pulgas tratados con CsA, en los que se observó un ligero aumento de la bilirrubina total, una ligera disminución de la actividad de la alanina aminotransferasa, de la albúmina y de la fosfatasa alcalina, y un aumento de los valores renales (nitrógeno ureico en sangre y creatinina) (1, 6, 21), todos los gatos de este estudio no mostraron cambios notables en todos estos parámetros después de este estudio de 10 días. De acuerdo con otros estudios que utilizaron dosis más altas de CsA en gatos sanos en los que se observó hipoproteinemia (1, 9), los gatos de este estudio mostraron una disminución significativa de la albúmina y de las proteínas totales. Posiblemente, la toma repetida de muestras de sangre o la malabsorción gastrointestinal de los alimentos o la pérdida por las heces son las causas, especialmente porque algunos gatos mostraron efectos secundarios gastrointestinales con menor consistencia fecal.
Los efectos adversos reportados de CsA incluyen malestar gastrointestinal (vómitos, diarrea y anorexia), en el tratamiento a largo plazo de la hiperplasia gingival, así como nefrotoxicidad y hepatotoxicidad en ratas (1) o nefrotoxicidad en humanos (17). Como consecuencia del corto periodo experimental en el presente estudio, no se observó hipertrofia gingival tras 28 días de tratamiento en un gato en otro estudio con CsA (2). Se detectaron heces blandas en la mayoría de los gatos durante el período experimental, pero el apetito se mantuvo bueno como se describió anteriormente (2). Por lo tanto, en conclusión, los efectos secundarios fueron comparables a otros estudios en los que se reportaron molestias gastrointestinales transitorias y autorresolutivas (9).
Conclusión
Aunque los resultados de nuestro estudio son, en sentido estricto, válidos únicamente para el protocolo descrito (únicamente aplicación de CsA, formulación galénica especial en cápsulas vacías, etc.) en gatos sanos, los resultados indican que los niveles de CsA en sangre alcanzan un estado estacionario 5 días después de la administración de altas dosis de CsA a las 12 h. Por lo tanto, los resultados sugieren que este punto de tiempo es adecuado para monitorear los niveles en sangre. Sin embargo, esto tiene que ser confirmado en pacientes clínicos. El modo de aplicación utilizado, es decir, una solución oral de CsA envasada en cápsulas vacías y administrada con algunas golosinas, es bien tolerada por los gatos. Los resultados confirman la conocida y notable variabilidad interindividual de la CsA. La pauta de tratamiento estudiada dio como resultado niveles medios de CsA mínimos marcadamente más altos que el rango objetivo utilizado actualmente en nuestra clínica para la terapia inmunosupresora (200-600 ng/mL) que, sin embargo, debe validarse en estudios posteriores. Otros estudios también pueden aclarar los principales factores que conducen a los niveles generalmente más bajos de CsA en pacientes clínicos que reciben el mismo programa de tratamiento con CsA con el fin de posiblemente optimizar aún más los protocolos de tratamiento de CsA a las 12 h en gatos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse a los autores correspondientes.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética de la Oficina de Protección del Consumidor y Seguridad Alimentaria de Baja Sajonia (Departamento 33, Oldenburg, Alemania, número de experimento: 19/3260). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
SR: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Administración de proyectos, Recursos, Software, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. AF: Curación de datos, Investigación, Metodología, Administración de proyectos, Redacción, revisión y edición. JS: Curación de datos, Investigación, Metodología, Administración de proyectos, Redacción, revisión y edición. DG-K: Conceptualización, Curación de datos, Investigación, Metodología, Administración de proyectos, Validación, Redacción, revisión y edición. KB: Conceptualización, Investigación, Metodología, Redacción – revisión y edición, Administración de proyectos. RM: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Administración de proyectos, Recursos, Software, Supervisión, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) que se recibió apoyo financiero para la publicación de este artículo. Agradecemos el apoyo financiero del Fondo de Publicaciones de Acceso Abierto de la Fundación de la Universidad de Medicina Veterinaria de Hannover. Este estudio no fue apoyado ni financiado por ninguna otra subvención.
Reconocimientos
Parte de los datos se han presentado para su presentación en el 33º Congreso Anual del Colegio Europeo de Medicina Interna Veterinaria-Animales de Compañía (ECVIM-CA), Barcelona, España (21-24 de septiembre de 2023), así como para su presentación en la 32ª reunión anual del InnLab de la DVG en Hannover, Alemania (02-03 de febrero de 2024).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1444586/full#supplementary-material
VÍDEO COMPLEMENTARIO S1 | Administración de cápsula de CsA en un gato. Los gatos toleraron bien la administración de CsA en cápsulas. Después de sumergir las cápsulas en una golosina cremosa, las ingirieron por sí solas sin necesidad de fijación. Ninguno de los gatos del presente estudio mostró vómitos o salivación después de comer la cápsula. Como se escucha en el video, se tocó música clásica durante todos los tratamientos.
Abreviaturas
BCS: Puntuación de la condición corporal; Peso corporal; CsA: ciclosporina A; EDTA: ácido etilendiaminotetraacético; HPLC-MS/MS, Cromatografía líquida de alta resolución acoplada a espectrometría de masas en tándem; IQR: Rango intercuartílico; DE: Desviación estándar; WSAVA, Asociación Mundial de Veterinarios de Pequeños Animales.
Referencias
1. Colombo, S, y Sartori, R. La ciclosporina y el gato: comprensión actual y revisión del uso clínico. J Feline Med Surg. (2018) 20:244–55. doi: 10.1177/1098612X17748718
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Latimer, KS, Rakich, PM, Purswell, BJ, y Kircher, IM. Efectos de la administración de ciclosporina A en gatos. Veterinario Immunol Immunopathol. (1986) 11:161–73. doi: 10.1016/0165-2427(86)90095-4
3. Miller, R, Schick, AE, Boothe, DM y Lewis, TP. Absorción de ciclosporina transdérmica y oral en seis gatos sanos. J am anim hosp assoc. (2014) 50:36–41. doi: 10.5326/JAAHA-MS-5970
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Gridelli, B, Scanlon, L, Pellicci, R, LaPointe, R, DeWolf, A, Seltman, H, et al. Metabolismo y farmacocinética de la ciclosporina tras la administración intravenosa y oral en el perro. Trasplante. (1986) 41:388–91. doi: 10.1097/00007890-198603000-00021
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Schuh, L, Kietzmann, M, Grote-Koska, D, Brand, K y Mischke, R. Farmacocinética de una dosis terapéutica única administrada por vía oral de ciclosporina a en gatos sanos. Res Vet Sci. (2023) 161:77–9. doi: 10.1016/j.rvsc.2023.05.015
6. King, S, Favrot, C, Messinger, L, Nuttall, T, Steffan, J, Forster, S, et al. Estudio aleatorizado, doble ciego y controlado con placebo para evaluar una dosis efectiva de ciclosporina para el tratamiento de la dermatitis por hipersensibilidad felina. Veterinario Dermatol. (2012) 23:440. doi: 10.1111/j.1365-3164.2012.01086.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Winzelberg Olson, S, y Hohenhaus, AE. Anemia felina no regenerativa: recomendaciones diagnósticas y terapéuticas. J Feline Med Surg. (2019) 21:615–31. doi: 10.1177/1098612X19856178
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Yang, Y, Kong, J, Liu, Y, Wu, Q, Cao, Y, Qiu, J, et al. Farmacocinética y bioequivalencia de dos formulaciones de solución oral de ciclosporina en gatos. Frente Vet Sci. (2022) 9:940472. doi: 10.3389/fvets.2022.940472
9. Roberts, ES, Vanlare, KA, Strehlau, G, Peyrou, M, Roycroft, LM y King, S. Seguridad, tolerabilidad y farmacocinética de la dosificación diaria de 6 meses de una formulación oral de ciclosporina (ATOPICA for cats(R)) en gatos. J Vet Pharmacol ther. (2014) 37:161–8. doi: 10.1111/jvp.12081
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Burckart, GJ, Ptachcinski, RJ, Venkataramanan, R, Iwatsuki, S, Esquivel, C, Van Thiel, DH, et al. Monitorización de la concentración mínima de ciclosporina en pacientes trasplantados hepáticos. Trasplante Proc. (1986) 18:188–93.
11. Mehl, ML, Kyles, AE, Craigmill, AL, Epstein, S y Gregory, CR. Disposición de ciclosporina después de la administración oral intravenosa y multidosis en gatos. J Vet Pharmacol ther. (2003) 26:349–54. doi: 10.1046/j.1365-2885.2003.00496.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Rodan, I, Dowgray, N, Carney, HC, Carozza, E, Ellis, SL, Heath, S, et al. 2022 Pautas de interacción veterinaria amigable con los gatos de la AAFP/ISFM: técnicas de enfoque y manejo. J Feline Med Surg. (2022) 24:1093–132. doi: 10.1177/1098612X221128760
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Katayama, M, Katayama, R y Kamishina, H. Efectos de la dosificación oral múltiple de itraconazol en la farmacocinética de la ciclosporina en gatos. J Feline Med Surg. (2010) 12:512–4. doi: 10.1016/j.jfms.2010.02.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Fahr, A . Farmacocinética clínica de la ciclosporina. Clin Farmacokinet. (1993) 24:472–95. doi: 10.2165/00003088-199324060-00004
15. Steffan, J, Strehlau, G, Maurer, M y Rohlfs, A. Ciclosporina, una farmacocinética y eficacia en el tratamiento de la dermatitis atópica en perros. J Vet Pharmacol ther. (2004) 27:231–8. doi: 10.1111/j.1365-2885.2004.00587.x
16. Savoldi, S, Maiorca, R, Chiappini, R, Scolari, F y Sandrini, S. Variabilidad de la concentración de ciclosporina. Trasplante Proc. (1998) 30:1642–4. doi: 10.1016/S0041-1345(98)00374-1
17. Einecke, G, Mai, I, Diekmann, F, Fritsche, L, Neumayer, HH y Budde, K. Perfil de absorción de ciclosporina y monitorización terapéutica de fármacos utilizando niveles sanguíneos de C(2) en receptores de aloinjertos renales estables. Trasplante Proc. (2002) 34:1738–9. doi: 10.1016/S0041-1345(02)03003-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Lindholm, A . Factores que influyen en la farmacocinética de la ciclosporina en el hombre. (1991) 13:465–77. doi: 10.1097/00007691-199111000-00001
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Kirschner, KM . Reducir, reemplazar, refinar los experimentos con animales. Acta Physiol (Oxford). (2021) 233:E13726. doi: 10.1111/apha.13726
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Hoenig, JM, y Heisey, DM. El abuso de poder: la falacia generalizada de los cálculos de poder para el análisis de datos. Am Stat. (2001) 55:19–24. doi: 10.1198/000313001300339897
21. Steffan, J, Roberts, E, Cannon, A, Prelaud, P, Forsythe, P, Fontaine, J, et al. Reducción gradual de la dosis de ciclosporina en gatos con dermatitis por hipersensibilidad no inducida por pulgas. Veterinario Dermatol. (2013) 24:315–322.e70. doi: 10.1111/vde.12018
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: ciclosporina, monitorización de fármacos, LC-MS/MS, inhibidor de la calcineurina, inmunosupresor sistémico, oral, fármaco, nivel sanguíneo terapéutico
Cita: Rösch S, Frommeyer A, Schulte Bocholt J, Grote-Koska D, Brand K y Mischke R (2024) Progresión de los niveles sanguíneos de ciclosporina A en gatos experimentales que reciben un protocolo de tratamiento de dosis altas. Frente. Vet. Sci. 11:1444586. doi: 10.3389/fvets.2024.1444586
Recibido: 05 de junio de 2024; Aceptado: 13 de septiembre de 2024;
Publicado: 16 de octubre de 2024.
Editado por:
Getu Abraham, Universidad de Leipzig, Alemania
Revisado por:
Jianzhong Wang, Universidad Agrícola de Shanxi, China
Ralf Regenthal, Universidad de Leipzig, Alemania
Derechos de autor © 2024 Rösch, Frommeyer, Schulte Bocholt, Grote-Koska, Brand y Mischke. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución (CC BY).
*Correspondencia: Sarah Rösch, de sarah.rosch@ugent.be años; Reinhard Mischke, Reinhard.Mischke@tiho-hannover.de
†Dirección actual: Sarah Rösch, Departamento de Pequeños Animales, Facultad de Medicina Veterinaria, Universidad de Gante, Gante, Bélgica
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

