Propiedades farmacocinéticas y farmacodinámicas del pantoprazol en terneros
Propiedades farmacocinéticas y farmacodinámicas del pantoprazol en terneros
 Jeff D. Olivarez1*
Jeff D. Olivarez1*  Pierre-Yves Mulon2
Pierre-Yves Mulon2  Lisa S. Ebner3
Lisa S. Ebner3  Haley Cremerius2
Haley Cremerius2  Channing Cantrell2
Channing Cantrell2  Rebecca Rahn2
Rebecca Rahn2  Ventoso Soto-González2
Ventoso Soto-González2  Joan Bergman4
Joan Bergman4  Jerez Cox4
Jerez Cox4  Jonathan P. Mochel5
Jonathan P. Mochel5  Amanda J. Kreuder6
Amanda J. Kreuder6  Joe S. Smith1,2*
Joe S. Smith1,2*- 1Ciencias Biomédicas, Facultad de Medicina Veterinaria, Universidad Estatal de Iowa, Ames, IA, Estados Unidos
- 2Large Animal Clinical Sciences, Facultad de Medicina Veterinaria, Universidad de Tennessee, Knoxville, Knoxville, TN, Estados Unidos
- 3Facultad de Medicina Veterinaria, Lincoln Memorial University, Harrogate, TN, Estados Unidos
- 4Ciencias Biomédicas y Diagnósticas, Universidad de Tennessee, Knoxville, Knoxville, TN, Estados Unidos
- 5Veterinary Diagnostic and Production Animal Medicine, College of Veterinary Medicine, Iowa State University, Ames, IA, Estados Unidos
- 6Microbiología Veterinaria y Medicina Preventiva, Facultad de Medicina Veterinaria, Universidad Estatal de Iowa, Ames, IA, Estados Unidos
Introducción: El desarrollo de ulceración abomasal es una gran preocupación, especialmente dentro de los terneros; Sin embargo, hay una escasez de investigación sobre el uso de gastroprotectores en especies de rumiantes. Los inhibidores de la bomba de protones, como el pantoprazol, son ampliamente utilizados en humanos y animales de compañía. Su eficacia en especies de rumiantes es indeterminada. Los objetivos de este estudio fueron 1) estimar los parámetros farmacocinéticos plasmáticos para pantoprazol en terneros neonatos después de tres días de administración intravenosa (IV) o subcutánea (SC), y 2) medir el efecto que pantoprazol tuvo sobre el pH abomasal durante el período de tratamiento.
Métodos: Pantoprazol se administró a 6 terneros cruzados Holstein-Angus a una dosis de 1 mg/kg (IV) o 2 mg/kg (SC), una vez al día (cada 24 h) durante tres días. Las muestras de plasma se recogieron durante un período de 72 h y se analizaron mediante HPLC-UV para determinar las concentraciones de pantoprazol. Los parámetros farmacocinéticos se derivaron mediante análisis no compartimental. Las muestras de abomasal (n = 8) se recolectaron a través de cánulas abomasales durante un período de 12 h, por ternero por día. El pH abomasal se determinó a través de un analizador de pH de sobremesa.
Resultados: Después del día 1 de la administración IV, el aclaramiento plasmático, la vida media de eliminación y el volumen de distribución de pantoprazol se estimaron en 199,9 ml/kg/h, 1,44 h y 0,51 l/kg, respectivamente. En el día 3 de la administración IV, los valores reportados fueron 192,9 mL/kg/h, 2,52 h y 1,80 L/kg mL, respectivamente. La vida media de eliminación y el volumen de distribución (V/F) de pantoprazol después de la administración SC se estimaron en 1,81 h y 0,55 L/kg, respectivamente, el día 1; y 2,99 h y 2,82 L/kg, respectivamente, el día 3.
Discusión: Los valores reportados para la administración IV fueron similares a los reportados previamente en terneros. La administración de SC parece ser bien absorbida y tolerada. El metabolito sulfona fue detectable durante 36 h después de la última administración para ambas vías. El pH abomasal fue significativamente mayor que el pH pre-pantoprazol 4, 6 y 8 h después de la administración en los grupos IV y SC. Se justifican estudios adicionales del pantoprazol como tratamiento/preventivo para las úlceras abomasales.
1. Introducción
La ulceración del sistema gastrointestinal es una enfermedad compleja que se ha documentado en muchas especies domesticadas (1-5). Específicamente, en el ganado vacuno, la ulceración abomasal es una causa común de morbilidad y mortalidad en todas las industrias de carne y lácteos (1, 6). Los factores identificados que contribuyen a la ulceración incluyen el estrés (por ejemplo, manipulación, viajes), el clima, la vivienda, las deficiencias minerales, el crecimiento excesivo de bacterias y el uso de medicamentos antiinflamatorios no esteroideos (AINE) (7). La edad del animal también puede contribuir al trastorno, con la mayor prevalencia reportada en terneros; Sin embargo, las úlceras se pueden encontrar en todas las edades del ganado (1, 8). Se ha demostrado que la producción de ácido clorhídrico (HCl) por las células parietales gástricas exacerba la ulceración y se cree que contribuye al establecimiento de úlceras (9). Muchas terapias farmacéuticas para la ulceración gástrica en especies no rumiantes están dirigidas hacia la reducción de HCl gástrico debido a su papel en la formación de úlceras (4, 5, 10). Se propone que la reducción del HCl es terapéutica para los rumiantes, aunque se desconoce la etiología completa de las ulceraciones abomasales.
El pantoprazol es un inhibidor de la bomba de protones que se une irreversiblemente a las bombas de hidrógeno potasio ATPasa en la superficie luminal de las células parietales en la mucosa gástrica para evitar la secreción de ácido (11). El pantoprazol está etiquetado para el tratamiento de úlceras pépticas en humanos al reducir la secreción de ácido y aumentar el pH gástrico (12). El aumento del pH gástrico a >4 durante >66% de un período de 24 h ha sido la ventana terapéutica sugerida para promover la curación de las úlceras gástricas en humanos y caballos (13). Los estudios tanto en potros como en alpacas han demostrado que el pantoprazol intravenoso aumenta efectivamente el pH gástrico, pero faltan estudios en especies de rumiantes (14, 15). Varias investigaciones retrospectivas demuestran el uso de pantoprazol en pacientes clínicos bovinos, pero no existe información farmacodinámica (16-18). Un estudio reciente que investigó las propiedades farmacocinéticas del pantoprazol IV en terneros neonatos demostró una vida media de eliminación más larga de pantoprazol en terneros y un aclaramiento similar en comparación con las alpacas y los potros, lo que sugiere que el pantoprazol IV puede ser una opción terapéutica efectiva en rumiantes si posee propiedades farmacodinámicas similares (19). El estudio de pantoprazol en alpacas también indicó que la administración subcutánea de pantoprazol redujo efectivamente la secreción de ácido gástrico del tercer compartimento (C3) (14). Actualmente no hay estudios que investiguen el uso de pantoprazol subcutáneo en rumiantes; Sin embargo, el acceso intravenoso no siempre es manejable en el ganado vacuno, y existe la necesidad de rutas parenterales alternativas.
Los objetivos primarios de este estudio fueron determinar las propiedades farmacocinéticas y farmacodinámicas de pantoprazol después de la administración intravenosa (IV) y subcutánea (SC) de pantoprazol en terneros neonatos, así como informar la farmacocinética del metabolito sulfona en estos terneros.
2. Materiales y métodos
2.1. Animales
Este estudio se completó en el Centro de Investigación y Educación Veterinaria de la Universidad de Tennessee. Seis terneros Holstein-Angus adquiridos de una granja de una sola fuente se inscribieron en el estudio. La edad de estos terneros en el momento de la inscripción fue de 17 a 18 días, con un peso promedio de 55,8 ± 4,6 kg. El estudio fue aprobado por el Comité de Cuidado y Uso de Animales de la Institución (IACUC # 2825-05221) de la Universidad de Tennessee. Los terneros fueron alojados individualmente en conejeras bajo un pabellón sombreado. Los criterios de inscripción para este estudio incluyeron la ausencia de antecedentes médicos previos de enfermedad, la administración previa de medicamentos, así como un examen físico realizado por un veterinario que arrojó parámetros vitales normales para un ternero bovino. El estado de vacunación era desconocido para todos los terneros. Todos los terneros recibieron una dieta de sustituto comercial de leche no medicada que cumplía o excedía los requisitos del Consejo Nacional de Investigación (NRC) para el mantenimiento y crecimiento de los terneros bovinos. Todos los terneros tenían acceso ad libitum al agua.
Dos semanas antes de la inscripción en el estudio, los terneros se sometieron a un procedimiento para colocar cánulas abomasales (Bard Gastrostomy Buttons; BB) como se describió anteriormente (20). Brevemente, los terneros fueron anestesiados usando un protocolo de anestesia intravenosa total (TIVA) de xilazina (0.1 mg / kg), butorfanol (0.1 mg / kg) y ketamina (bolos de 1 mg / kg, según sea necesario). Inmediatamente antes de la cirugía, a los terneros se les administró una dosis única de flunixina meglumina (1,1 mg/kg, IV) y una dosis única de penicilina procaína (22.000 UI/kg, IM). Una vez anestesiados, los terneros fueron colocados en decúbito lateral izquierdo. El área paracostal derecha se recortó y se preparó asépticamente con exfoliante quirúrgico de povidina y alcohol al 70%. Luego, la piel se infundió con 10-15 mLs de lidocaína al 2% en un patrón de «L invertida», craneodorsal a la incisión. Luego se realizó una incisión longitudinal de 5 cm a través de la piel y las capas musculares subyacentes, comenzando 3 cm caudales hasta la caja torácica y ~ 10 cm laterales hasta la línea media ventral. Luego se identificó el cuerpo del abomaso y se colocó en la pared del cuerpo utilizando dos suturas horizontales de colchón en las porciones craneal y caudal de la incisión de la pared corporal. Las cánulas se insertaron a través de una incisión de puñalada a través de la pared del cuerpo y en el abomaso y se aseguraron con una sutura de cuerda de bolso. Luego se recuperaron los terneros y se permitió que los sitios quirúrgicos sanaran durante 14 días antes del inicio del estudio.
2.2. Diseño experimental
Los seis terneros fueron asignados aleatoriamente (por lanzamiento de moneda) en uno de dos grupos: intravenoso (IVG) o subcutáneo (SCG).
La implantación quirúrgica de los seis terneros se completó durante un período de 2 días, y a todos los animales se les dio al menos 14 días para recuperarse antes del inicio del experimento. El contenido de Abomasal se recolectó durante un período de 12 h antes de la administración de pantoprazol (día 0), en los puntos de tiempo 0, 1, 2, 3, 4, 6, 8 y 12 h.
El día 1, 1 h antes del inicio del estudio, los terneros fueron sujetados con un halter de cuerda, y un catéter yugular IV se colocó asépticamente en todos los terneros. Antes de la colocación del catéter, la piel se preparó asépticamente utilizando cuatro toallitas alternas de exfoliante quirúrgico de povidina y alcohol isopropílico al 70%. La piel se infiltró con 1-2 mLs de lidocaína al 2%, y se utilizó una cuchilla # 15 para crear una incisión cortada. Se colocó un catéter de calibre 14 a través del corte hasta la yugular, y el catéter se aseguró a la piel con 2 suturas Ethilon. Luego se colocó un segundo catéter IV en la vena yugular contralateral en las pantorrillas IVG utilizando el mismo proceso descrito anteriormente.
Pantoprazol sódico (West-Ward, Eatontown, NJ, Estados Unidos) se reconstituyó a una concentración de 4 mg/ml utilizando 10 ml de una bolsa salina de 0L IV al 9,1% según las recomendaciones del fabricante. Los terneros fueron alimentados ~ 2 h antes de T0 y a las 2 h antes de T12. En T0, los terneros IVG recibieron una dosis de 1 mg/kg en la vena yugular izquierda durante 1 min, mientras que a los terneros SCG se les administró una dosis de 2 mg/kg por vía subcutánea en el cuello. Las dosis SC >10 ml se administraron en más de un lugar, según las pautas de garantía de calidad de la carne (BQA). La administración de pantoprazol para los terneros IVG y SCG se repitió a intervalos de 24 h los días 2 y 3.
En los días 1 y 3 del estudio, se recolectaron muestras de sangre a las 0, 15, 30, 45 y 60 min, así como a las 2, 3, 4, 8, 12, 18 y 24 h después de la administración del medicamento. Las muestras se obtuvieron de todos los terneros a través de un catéter IV en la vena yugular derecha utilizando una técnica push-pull previamente descrita (21). Las muestras de sangre se colocaron inmediatamente en tubos de heparina de sodio, luego se colocaron en hielo hasta centrifugarse a 1.500 × g durante 10 minutos. Todas las muestras de sangre se procesaron dentro de las 6 h posteriores a la recolección. Después de la centrifugación, el plasma se transfirió a crioviales que luego se almacenaron a -80 ° C hasta el análisis. El contenido de Abomasal se recogió cada día del estudio a las 0, 1, 2, 3, 4, 6, 8 y 12 h después de la administración de pantoprazol y se procesó como se describe a continuación.
Después de un período de lavado de 10 días, los terneros originalmente en la IVG se cambiaron a la SCG y viceversa. El estudio se repitió como se describió anteriormente.
2.3. Recogida del contenido abomasal y medición del pH
Los contenidos abomasales se recogieron a través del tubo BB colocado quirúrgicamente. Brevemente, se introdujo una cánula de tetina de dos ojos de acero inoxidable de 3 × 70 mm unida a una jeringa de 12 ml en el tubo BB ~ 30 mm para evitar la válvula unidireccional dentro del tubo. La presión negativa se aplicó suavemente con la jeringa de 12 ml hasta que se adquirieron 4-5 ml de contenido abomasal. El pH de cada muestra se registró dentro de los 15 minutos posteriores a la recolección en un proceso que se describe a continuación.
Las alícuotas de contenido abomasal se colocaron en un tubo de halcón de 30 mL. Luego se utilizó un analizador de pH de sobremesa (medidor de pH / mV UB-10, Denver Instruments, EE. UU.) para medir el pH. El analizador se calibró antes de cada conjunto de muestras de acuerdo con el procedimiento del fabricante. Una vez calibrada, la sonda se introdujo en la muestra de contenido abomasal y se dejó equilibrar durante 30 s, momento en el que se registró el pH.
2.4. Método analítico
El análisis de pantoprazol plasmático se realizó utilizando un método de cromatografía líquida de alta resolución (HPLC) de fase inversa como se describió anteriormente para pantoprazol y el metabolito de sulfona de pantoprazol en plasma de cabra (22). El sistema consistía en un módulo de 2.695 separaciones y un detector de absorbancia UV de 2.487 (Waters). Los compuestos se separaron en una columna de simetría C18 (4,6 × 150 mm, 5 μm) con una columna de protección de simetría C5 de 18 μm. La fase móvil fue una mezcla de 0,1 M de fosfato de sodio dibásico y acetonitrilo (68:32). El caudal fue de 1 mL/min, y la absorbancia se midió a 290 nm.
Pantoprazol y su metabolito se extrajeron de muestras de plasma utilizando un método de extracción líquido-líquido. Las muestras previamente congeladas se descongelaron, se mezclaron con vórtices y se transfirieron 100 μl de plasma a un tubo superior de rosca de 13 × 100 mm, seguido de 10 μl de tinidazol (patrón interno, 100 μg / ml) y 2 ml de cloroformo. Los tubos se agitaron durante 15 minutos y luego se centrifugaron durante 20 minutos a 1.000 × g. La capa orgánica se transfirió a un tubo de vidrio y se evaporó a sequedad con gas nitrógeno. Las muestras se reconstituyeron en 250 μL de fase móvil y se analizaron 100 μL.
Las curvas estándar para el análisis plasmático se prepararon fortificando el plasma combinado no tratado con pantoprazol y el metabolito, lo que produjo un rango de concentración lineal de 0,01-100 μg / ml. La recuperación promedio para pantoprazol y su metabolito fue de 100 y 90%. La recuperación promedio para el estándar interno fue del 99%. Las muestras de control de calidad (QC) utilizadas para la validación fueron 0,03, 0,3, 3 y 30 μg/ml, y la variabilidad intra e interensayo varió de 2 a 11% para pantoprazol y 3% a 9% para el metabolito. El límite inferior de cuantificación para ambos fue de 0,1 μg/ml.
2.5. Análisis farmacocinético
Los parámetros farmacocinéticos se calcularon a partir de datos de concentración plasmática de tiempo como se describió anteriormente (19). El modelado farmacocinético se realizó a través del software de modelado estándar de la industria (PKanalix, Monolix Suite 2021R2, Lixoft, Francia) como se describe para pantoprazol en cabras y terneros (19, 23). Los datos estándar que representan la información de tiempo vs. concentración para pantoprazol se determinaron mediante HPLC a partir de las muestras recolectadas en 8 puntos de tiempo que van de 0 a 12 h después del día 1 y 3 de administración. Se generaron parámetros farmacocinéticos estándar para terneros individuales, de la siguiente manera: concentración máxima de pantoprazol extrapolada al tiempo cero, C0; Tiempo de concentración máxima de pantoprazol, Tmax; Área bajo curva de concentración-tiempo de pantoprazol, AUClast y AUCinf; Área bajo la curva de momento, AUMCinf; Pantoprazol tiempo medio de residencia, MRT = AUMCinf/AUCinf; Vida media terminal de pantoprazol, T1/2 (λz) = ln (2)/λz; Aclaramiento sistémico de pantoprazol, CL = dosis/AUCinf; Volumen de distribución de pantoprazol (área), Vz.
Se utilizó una regla trapezoidal lineal/logarítmica para el análisis de datos para estimar el área bajo la curva de tiempo del pantoprazol. Posteriormente, se realizaron estadísticas resumidas sobre los parámetros farmacocinéticos individuales para derivar la media geométrica, la mediana, el mínimo y el máximo.
2.6. Análisis estadístico
Se evaluaron los datos de las pruebas de pH para determinar la normalidad. Luego se realizó un ANOVA unidireccional seguido de múltiples comparaciones (basadas en la distribución) utilizando GraphPad Prism (versión 8.0.0, GraphPad Software, San Diego, CA). El día cero fue el basal que se comparó con los días de tratamiento individuales. La significancia se fijó en un valor de P < 0,05.
3. Resultados
3.1. Animales
En el momento de la inscripción, todos los terneros tenían parámetros vitales normales y se consideraban sanos. La implantación quirúrgica de la BB fue bien tolerada por la mayoría de los terneros, con cuatro de las seis cánulas permaneciendo en su lugar durante todo el período de estudio y solo se observó una hinchazón leve en el sitio de inserción. Un BB se desalojó después del día 1 del primer juicio y otro se desalojó inmediatamente antes del comienzo del primer juicio. Estos terneros se mantuvieron en el estudio para datos farmacocinéticos y se incluyeron en los datos de pH abomasal de los días 0 y 1. Uno de los terneros desarrolló una infección en el sitio del catéter y tromboflebitis en los sitios del catéter IV. El cateterismo intravenoso fue bien tolerado por todos los demás terneros. No se observaron manifestaciones clínicas de reacciones adversas debidas a la administración intravenosa o subcutánea de pantoprazol.
3.2. Farmacocinética
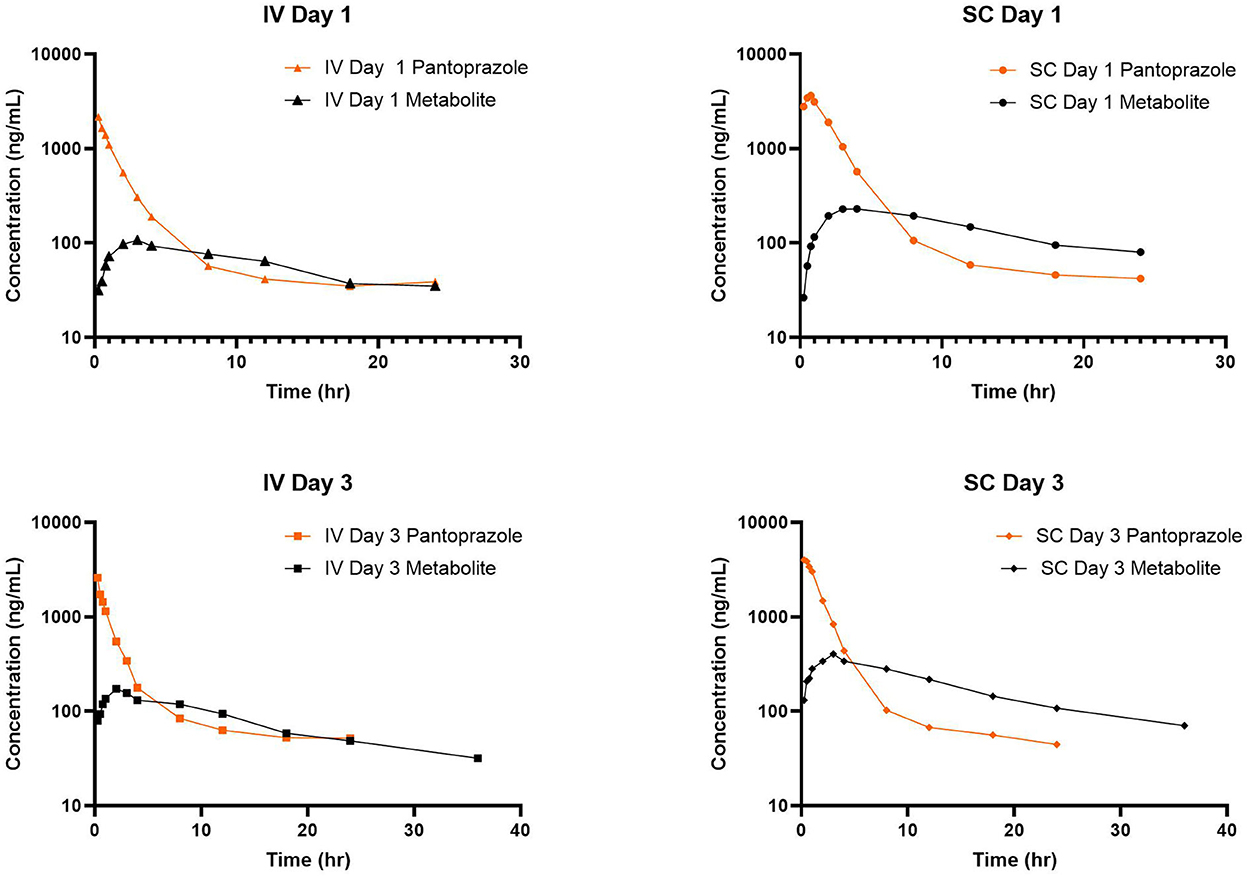
No se detectaron concentraciones de pantoprazol en ninguno de los terneros antes de la administración el día 1. La Tabla 1 muestra la media geométrica, la mediana, el mínimo y el máximo de los parámetros farmacocinéticos de pantoprazol en terneros después de la administración IV y SC. La administración IV y SC tuvieron una eliminación bastante rápida con vidas medias de 1,44 y 1,81 h, respectivamente. La Tabla 2 muestra la media geométrica, la mediana, el mínimo y el máximo de los parámetros farmacocinéticos de pantoprazol en terneros después de tres días consecutivos de administración IV y SC. Las vidas medias de eliminación de la administración intravenosa y subcutánea habían aumentado a 2,52 y 2,99 h, respectivamente. La Figura 1 muestra las curvas de tiempo vs. concentración para pantoprazol en los días 1 y 3.
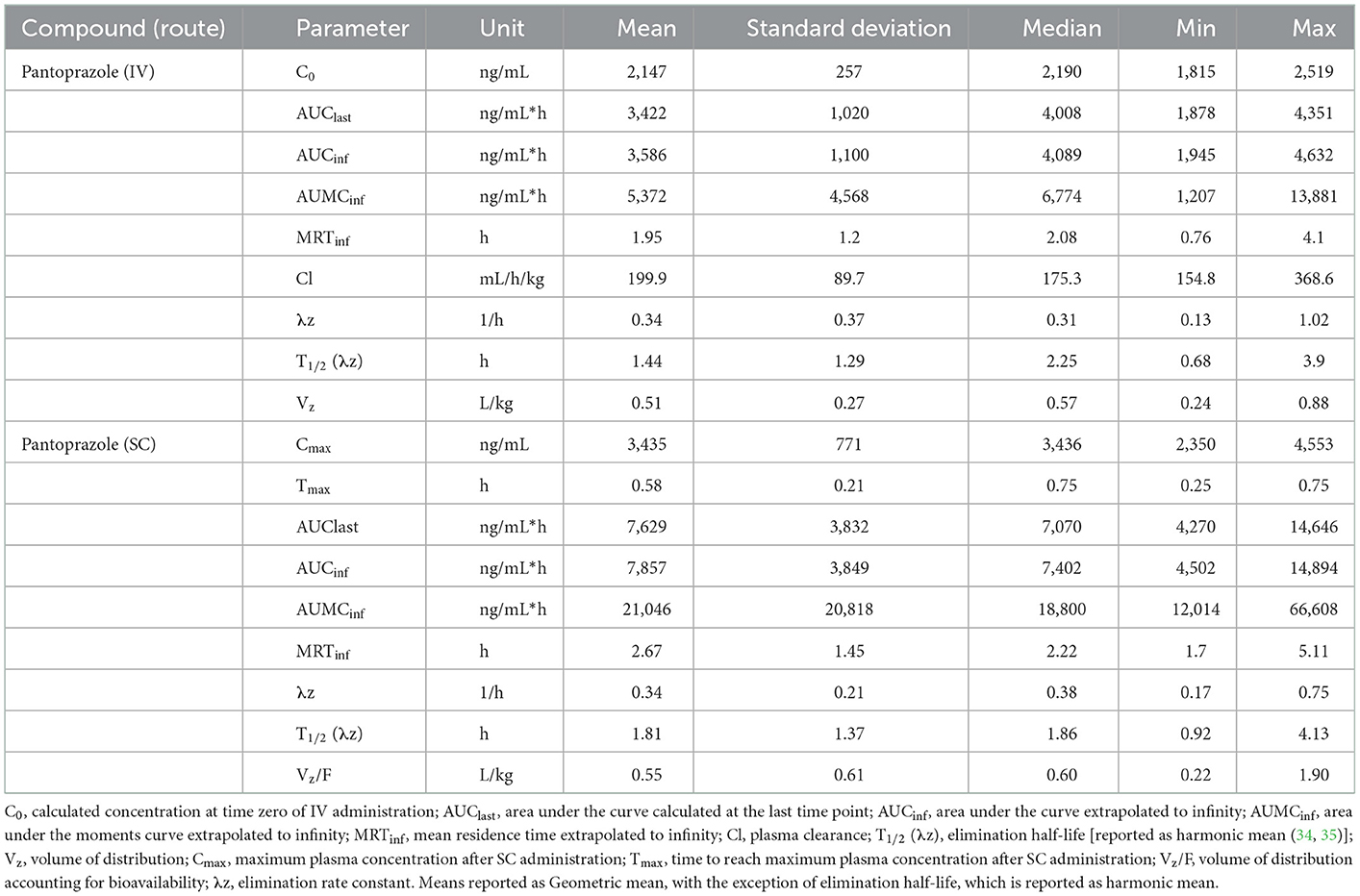 Tabla 1. Día 1 parámetros farmacocinéticos de pantoprazol después de la administración intravenosa (IV) y subcutánea (SC) en terneros.
Tabla 1. Día 1 parámetros farmacocinéticos de pantoprazol después de la administración intravenosa (IV) y subcutánea (SC) en terneros.
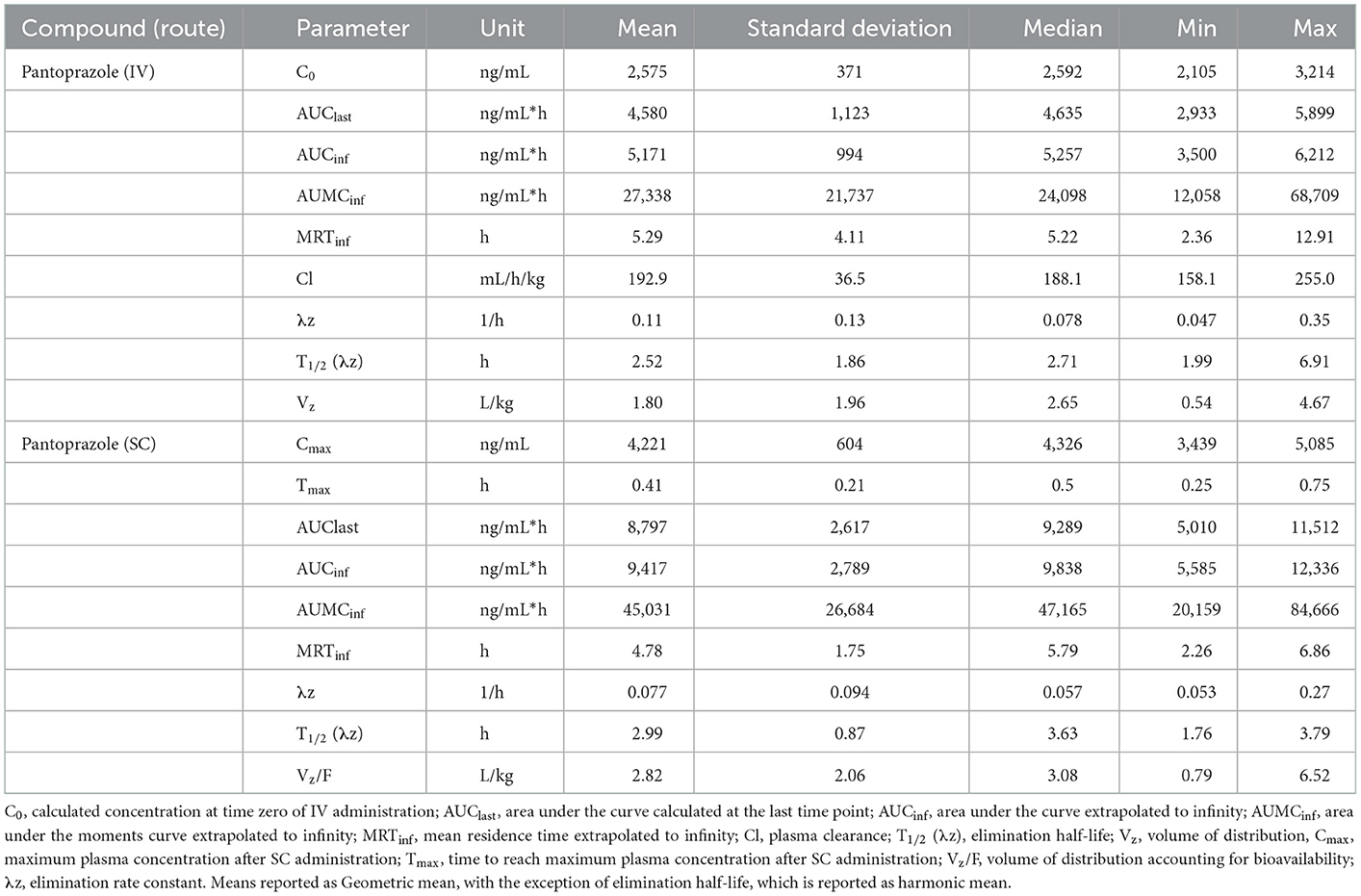 Tabla 2. Día 3 parámetros farmacocinéticos de pantoprazol después de la administración intravenosa (IV) y subcutánea (SC) en terneros.
Tabla 2. Día 3 parámetros farmacocinéticos de pantoprazol después de la administración intravenosa (IV) y subcutánea (SC) en terneros.
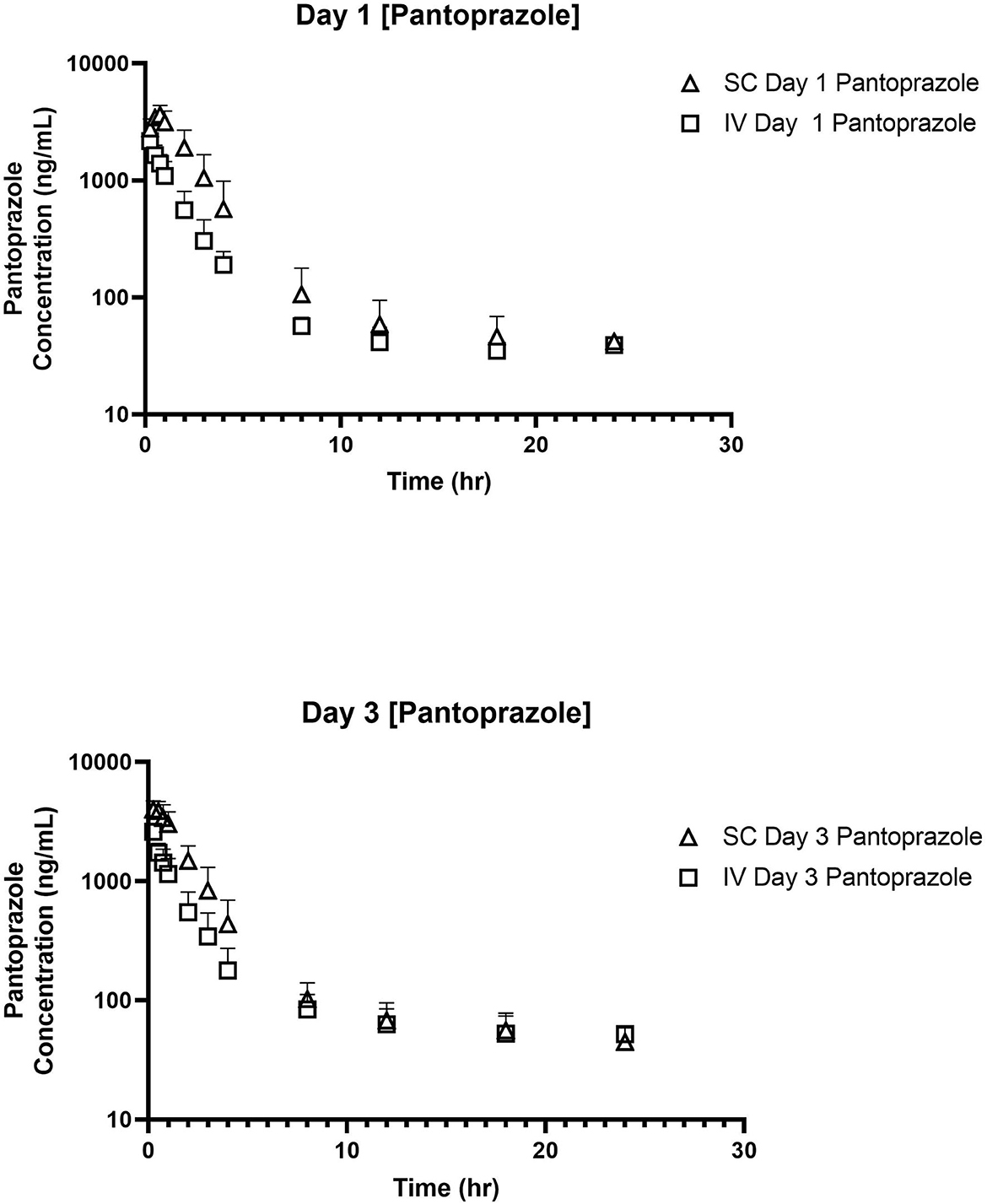 Figura 1. Curvas de tiempo vs. concentración para la administración intravenosa (IV; cuadrada) y subcutánea (SC; triángulo) de pantoprazol en los días 1 (arriba) y 3 (abajo).
Figura 1. Curvas de tiempo vs. concentración para la administración intravenosa (IV; cuadrada) y subcutánea (SC; triángulo) de pantoprazol en los días 1 (arriba) y 3 (abajo).
Las tablas 3, 4 muestran la media geométrica, la mediana, el mínimo y el máximo de los parámetros farmacocinéticos del metabolito sulfona en los días 1 y 3, respectivamente. La Figura 2 muestra las curvas de tiempo vs. concentración para el metabolito sulfona en los días 1 y 3.
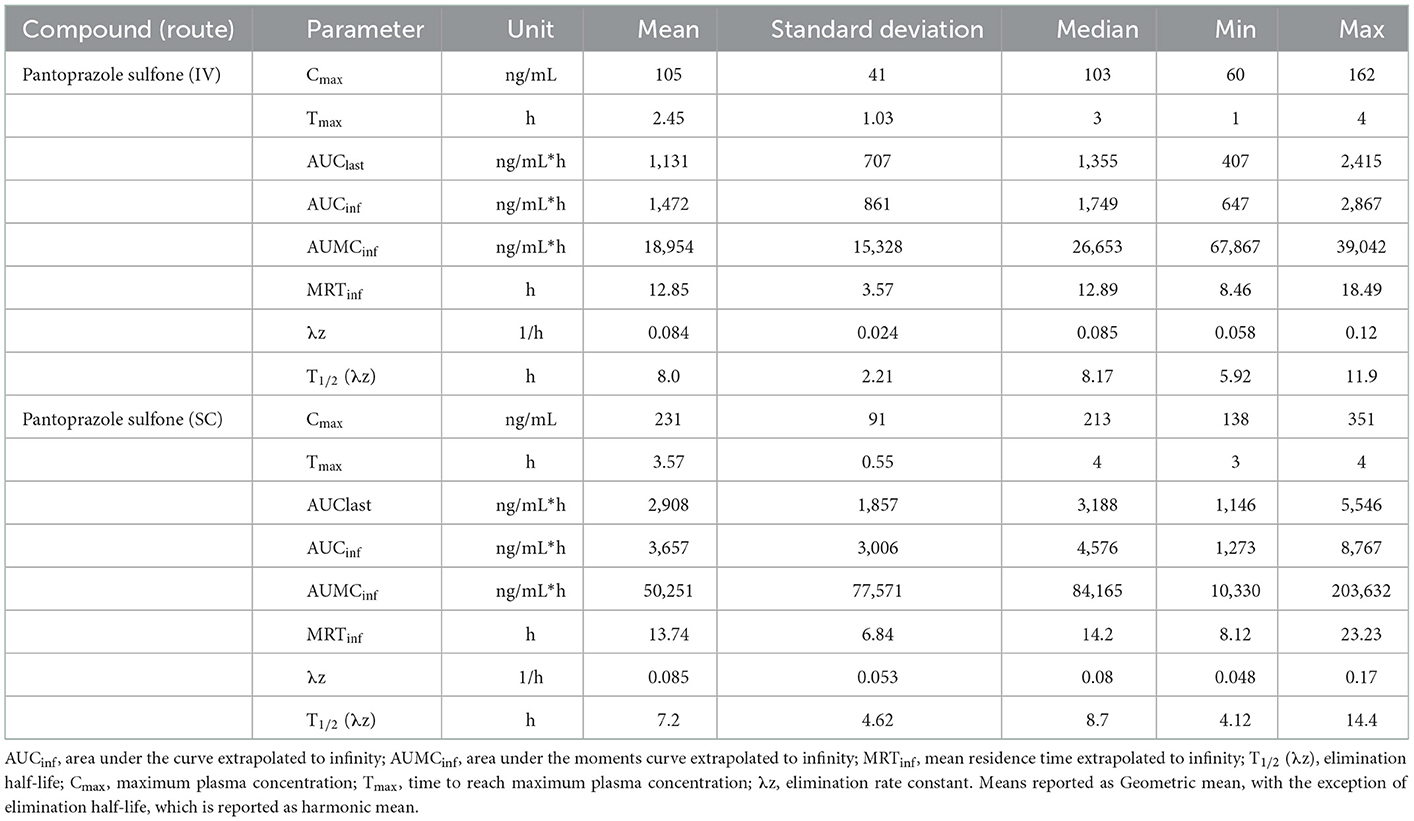 Tabla 3. Día 1 parámetros farmacocinéticos de pantoprazol sulfona después de la administración intravenosa (IV) y subcutánea (SC) de pantoprazol sódico en terneros.
Tabla 3. Día 1 parámetros farmacocinéticos de pantoprazol sulfona después de la administración intravenosa (IV) y subcutánea (SC) de pantoprazol sódico en terneros.
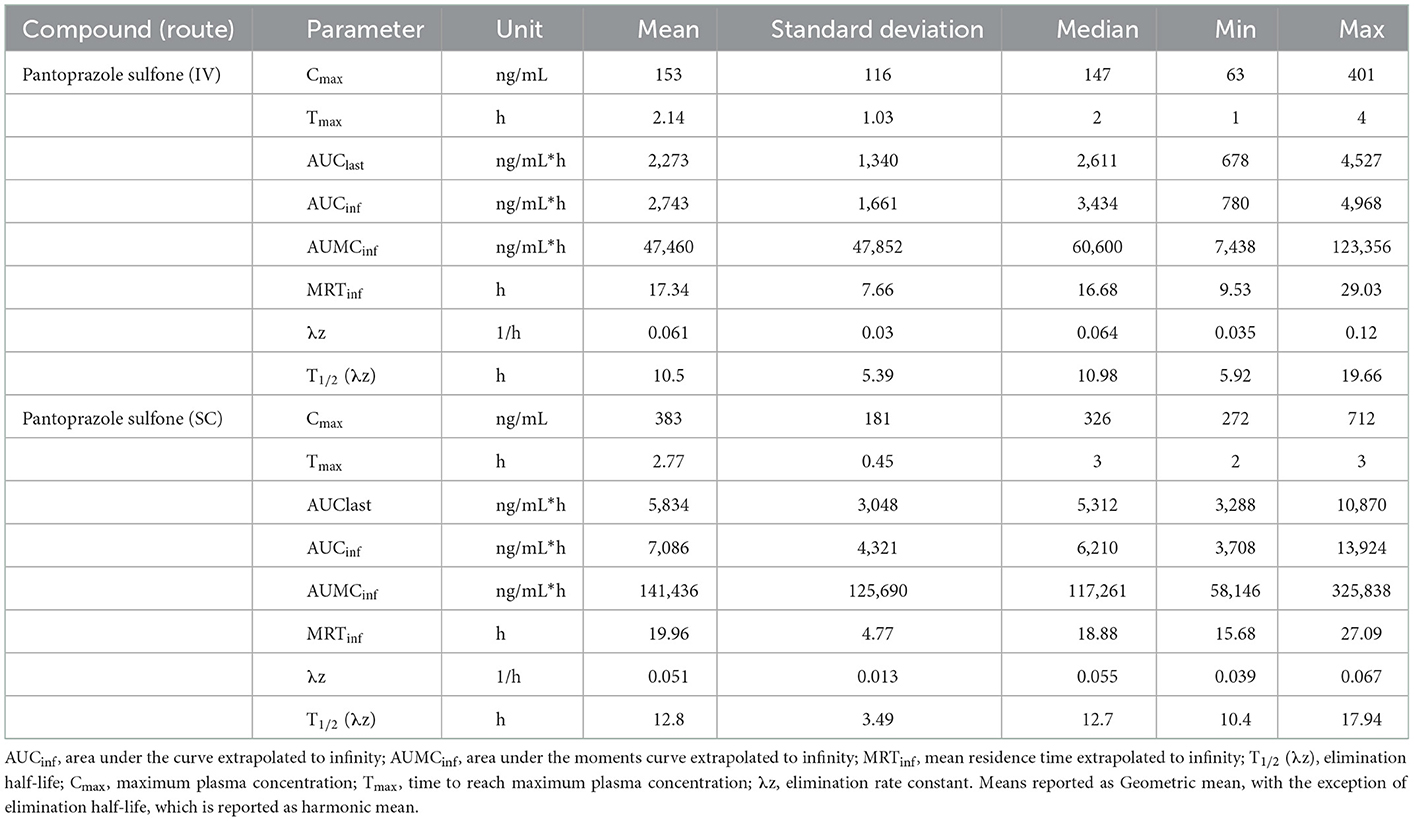 Tabla 4. Día 3 parámetros farmacocinéticos de pantoprazol sulfona después de la administración intravenosa (IV) y subcutánea (SC) de pantoprazol sódico en terneros.
Tabla 4. Día 3 parámetros farmacocinéticos de pantoprazol sulfona después de la administración intravenosa (IV) y subcutánea (SC) de pantoprazol sódico en terneros.
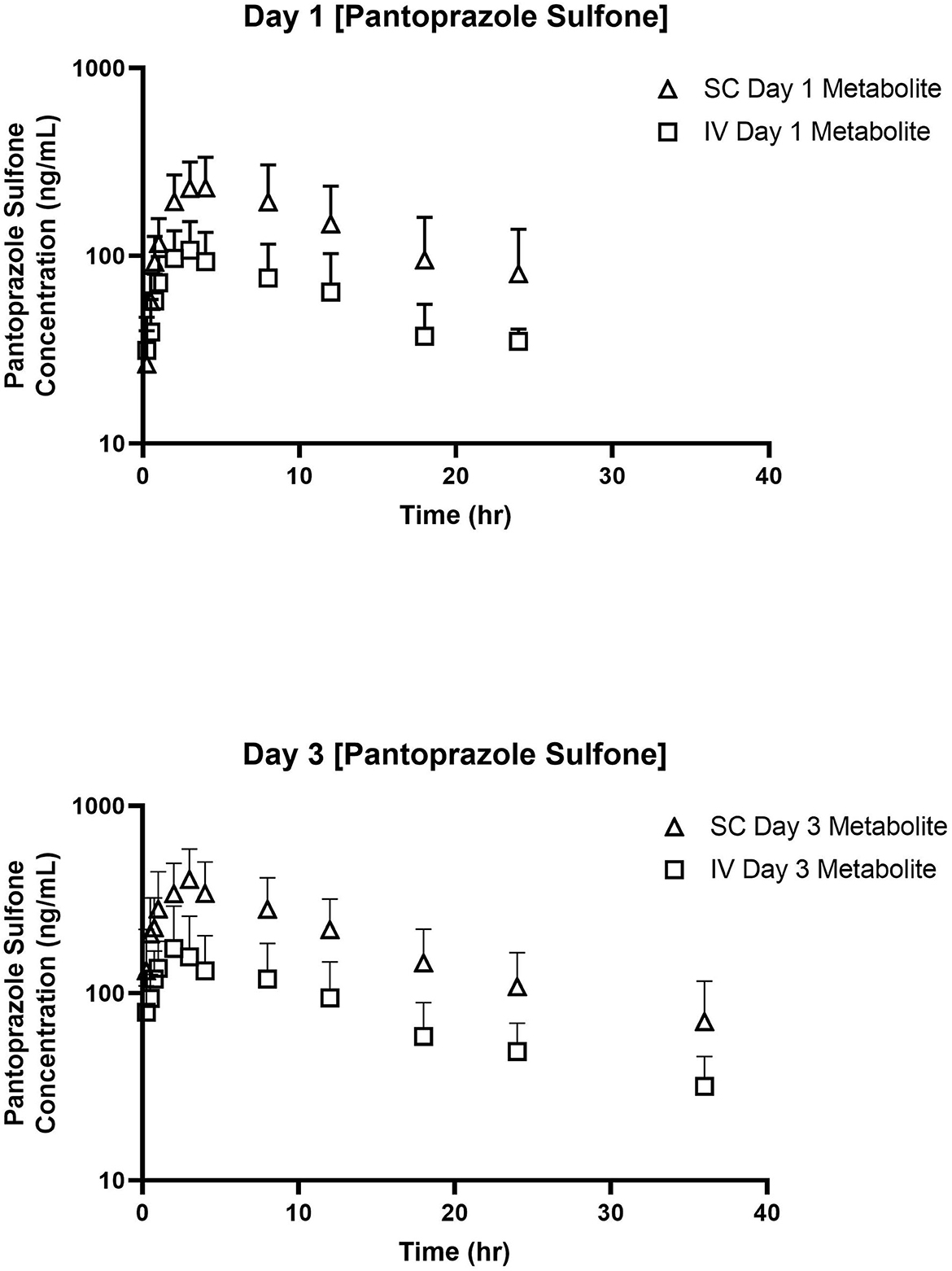 Figura 2. Curvas de tiempo vs. concentración para pantoprazol sulfona después de la administración intravenosa (IV; cuadrada) y subcutánea (SC; triángulo) de pantoprazol en los días 1 (arriba) y 3 (abajo).
Figura 2. Curvas de tiempo vs. concentración para pantoprazol sulfona después de la administración intravenosa (IV; cuadrada) y subcutánea (SC; triángulo) de pantoprazol en los días 1 (arriba) y 3 (abajo).
La biodisponibilidad de la primera administración SC fue de 115,2 ± 56,0 %.
3.3. Investigación del pH
Las figuras 3-5 comparan el pH abomasal entre los grupos control y tratamiento en los días 1-3, respectivamente. Cabe destacar que ambos grupos de tratamiento tuvieron un pH significativamente más alto en los puntos de tiempo de 4, 6 y 8 h en comparación con el pH de control previo al tratamiento en los 3 días. Las tablas 5, 6 muestran el pH promedio en cada punto de tiempo para pantoprazol IV y SC, respectivamente.
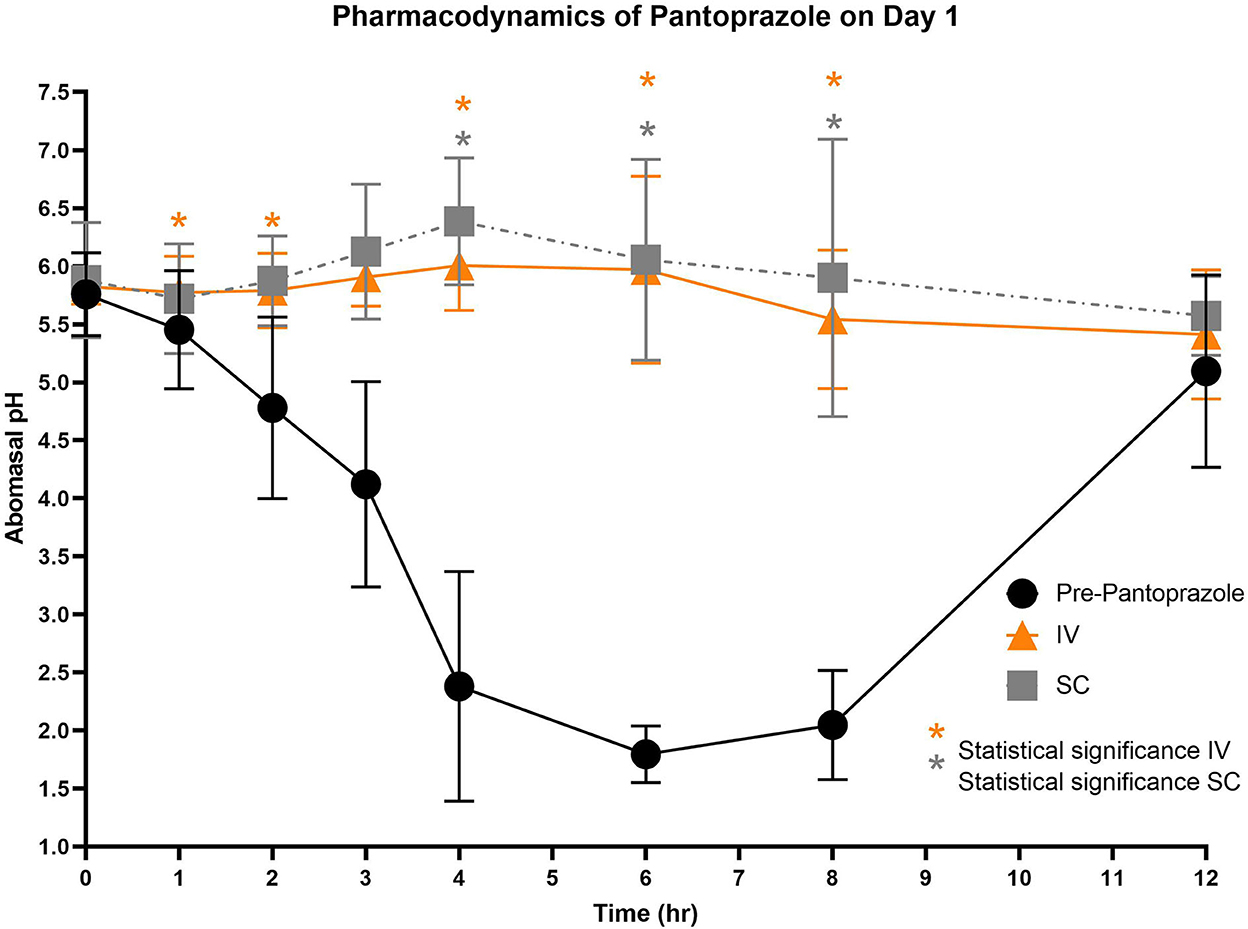 Figura 3. Comparación del pH abomasal a lo largo del tiempo entre los grupos de tratamiento control, IV y SC en el día 1. Círculos negros, pH pre-pantoprazol administración; Triángulos naranjas, pH después de la administración IV de pantoprazol; Grais cuadrado, pH después de la administración SC. Significación estadística (P < 0,05) anotada con asterisco.
Figura 3. Comparación del pH abomasal a lo largo del tiempo entre los grupos de tratamiento control, IV y SC en el día 1. Círculos negros, pH pre-pantoprazol administración; Triángulos naranjas, pH después de la administración IV de pantoprazol; Grais cuadrado, pH después de la administración SC. Significación estadística (P < 0,05) anotada con asterisco.
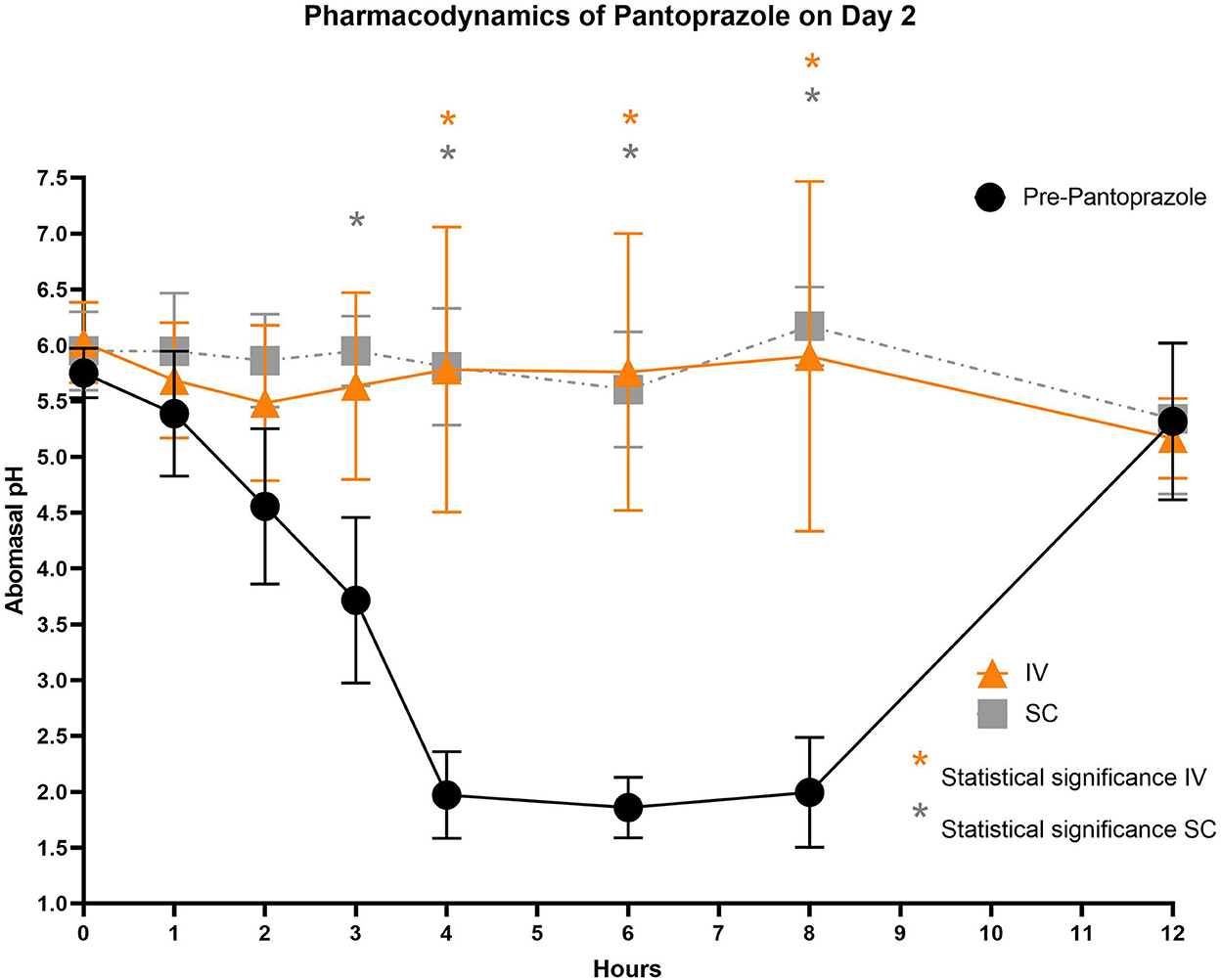 Figura 4. Comparación del pH abomasal a lo largo del tiempo entre los grupos de tratamiento control, IV y SC en el día 2. Círculos negros, pH pre-pantoprazol administración; Triángulos naranjas, pH después de la administración IV de pantoprazol; Grais cuadrado, pH después de la administración SC. Significación estadística (P < 0,05) anotada con asterisco.
Figura 4. Comparación del pH abomasal a lo largo del tiempo entre los grupos de tratamiento control, IV y SC en el día 2. Círculos negros, pH pre-pantoprazol administración; Triángulos naranjas, pH después de la administración IV de pantoprazol; Grais cuadrado, pH después de la administración SC. Significación estadística (P < 0,05) anotada con asterisco.
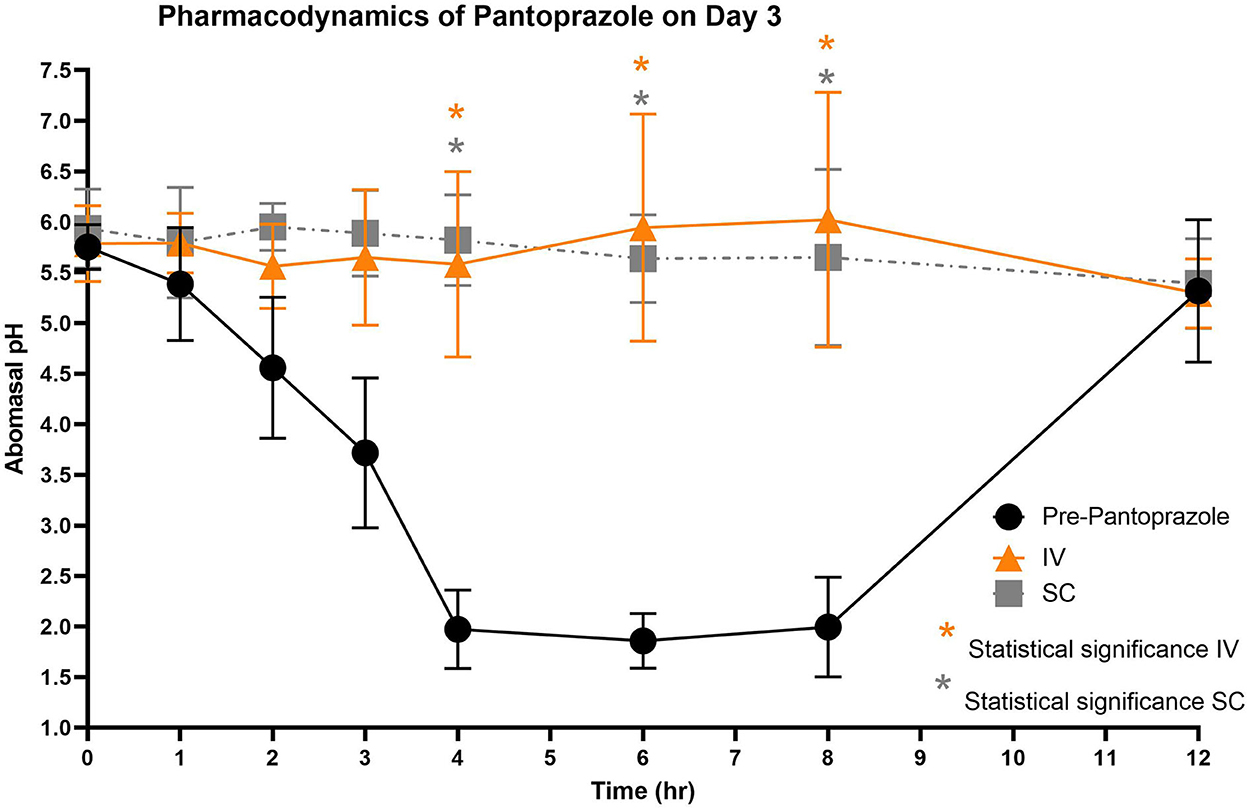 Figura 5. Comparación del pH abomasal a lo largo del tiempo entre los grupos de tratamiento control, IV y SC en el día 3. Círculos negros, pH pre-pantoprazol administración; Triángulos naranjas, pH después de la administración IV de pantoprazol; Grais cuadrado, pH después de la administración SC. Significación estadística (P < 0,05) anotada con asterisco.
Figura 5. Comparación del pH abomasal a lo largo del tiempo entre los grupos de tratamiento control, IV y SC en el día 3. Círculos negros, pH pre-pantoprazol administración; Triángulos naranjas, pH después de la administración IV de pantoprazol; Grais cuadrado, pH después de la administración SC. Significación estadística (P < 0,05) anotada con asterisco.
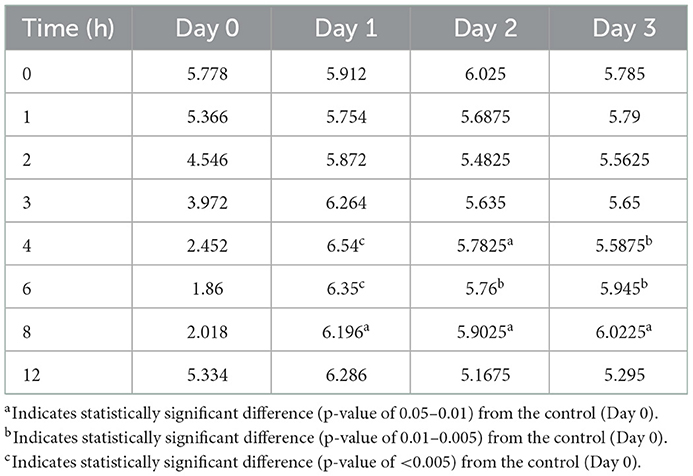 Tabla 5. Comparación del pH abomasal promedio por hora después de la administración intravenosa de pantoprazol.
Tabla 5. Comparación del pH abomasal promedio por hora después de la administración intravenosa de pantoprazol.
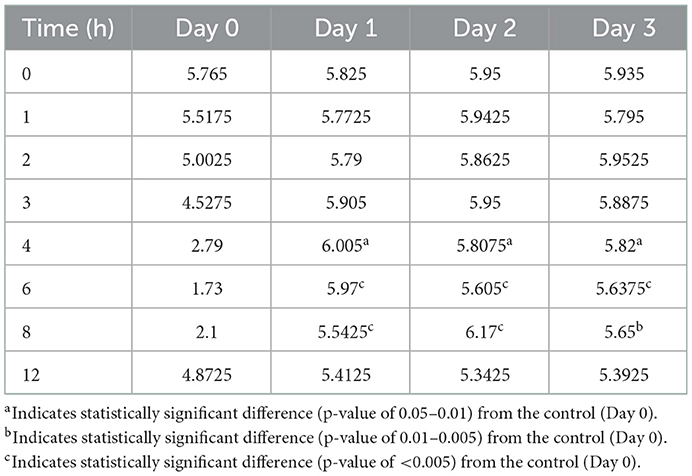 Tabla 6. Comparación del pH abomasal medio por hora después de la administración subcutánea de pantoprazol.
Tabla 6. Comparación del pH abomasal medio por hora después de la administración subcutánea de pantoprazol.
4. Discusión
Hasta donde sabemos, este es el primer informe que investiga las propiedades farmacocinéticas y farmacodinámicas de la administración intravenosa y subcutánea de pantoprazol en terneros durante varios días. En este estudio, la administración IV y SC de pantoprazol mantuvo un pH abomasal de > 4 en terneros durante un período de 12 h.
Las propiedades farmacocinéticas de pantoprazol después de 1 día de administración IV fueron menores que las reportadas previamente (19). La vida media de pantoprazol reportada en ese estudio fue de 2,81 h, mientras que nuestro estudio actual encontró una vida media de 1,44 h. Las diferencias entre estos valores podrían deberse a variaciones entre las técnicas de medición, así como a diferencias en los límites inferiores de cuantificación (LLOQ). Se informó que el LLOQ para el estudio farmacocinético original era mucho más bajo que el de nuestro estudio actual (0.002 y 0.1μg / ml, respectivamente). La capacidad de detectar cantidades más pequeñas de pantoprazol en el plasma podría explicar la vida media más larga (24). Para la administración subcutánea, la Cmax (3,434.77 ng / ml) se logró con bastante rapidez (dentro de las 0.58 h), lo que indica que el pantoprazol se absorbió rápidamente, lo que también se informa en estudios en humanos (25).
Curiosamente, los datos farmacocinéticos para el día 3 demostraron la acumulación potencial del fármaco con la administración de varios días, como Cmax, AUC, MRT y T.1/2 todos habían aumentado tanto para los grupos IV como SC. Sin embargo, debido a las cortas vidas medias de eliminación, esto podría ser cinética no lineal en disposición, posiblemente debido a la inhibición enzimática. El pantoprazol es metabolizado rápidamente por el sistema citocromo P450 (CYP) del hígado (26). Estudios previos han indicado que algunos IBP [como el omeprazol (27)] pueden inhibir el CYP, reduciendo su eficacia para descomponer el fármaco en sus metabolitos, lo que significa que el fármaco original puede detectarse en concentraciones más altas después de administraciones repetidas; sin embargo, no se ha demostrado que el pantoprazol inhiba el CYP en humanos (28). Si esto es cierto en rumiantes, entonces los aumentos en los valores farmacocinéticos en el día 3 pueden deberse a la saturación del mecanismo CYP en lugar de a la inhibición. A pesar del aumento de las concentraciones plasmáticas de pantoprazol, no hubo diferencias significativas en el pH abomasal entre el día 1 y el día 3 de tratamiento.
En los 3 días de prueba, el pH abomasal fue significativamente más alto que el pH pre-pantoprazol 4, 6 y 8 h después de la administración tanto en la IVG como en la SCG. Como se ve en las Figuras 3-5, el pH previo al tratamiento disminuye constantemente durante las primeras 4 h del estudio, luego mantiene un pH de alrededor de 2.0 desde el período de 4-8 h. Los terneros fueron alimentados con un sustituto de leche comercial ~ 2 h antes de los puntos de tiempo 0 h y 12 h. El pH del sustituto de leche fue ~ 6.61 ± 0.046, lo que puede explicar el contenido abomasal relativamente alto pH a 0 h y el aumento drástico en el pH de los terneros control entre los puntos de tiempo de 8 y 12 h. En medicina humana y equina, alcanzar un pH gástrico de >4 durante >66% de un período de 24 h es ideal para la curación de úlceras gástricas (13). Los datos de nuestro estudio sugieren que la administración IV y SC de pantoprazol puede lograr esta ventana terapéutica, aunque se necesitarían más puntos de tiempo para confirmar este período de tiempo. Si bien estos resultados son prometedores en terneros, la eficacia de su uso en rumiantes adultos no está clara debido a la fisiología gastrointestinal muy diferente. Como los terneros se consideran prerumiantes, funcionan de manera similar a las especies monogástricas porque el surco esofágico permite que la leche evite el rumen rudimentario y entre directamente en el abomaso (29, 30). Los rumiantes adultos tienen un rumen funcional, que es una fuente constante de ingesta que entra en el abomaso. Como los alimentos que ingresan al abomaso son un estimulante para la secreción de ácido, el movimiento casi constante de la ingesta del reticulo-rumen al abomaso sugiere un período más prolongado de producción de ácido en comparación con los terneros (31). La secreción ácida prolongada puede presentar un desafío para la terapia con IBP, y es posible que sea necesario realizar modificaciones en los regímenes de dosificación.
El metabolito sulfona se detectó en todos los terneros después de todas las administraciones, con concentraciones detectables a las 24 y 36 h después de la dosis del día 1 y 3, respectivamente. Esto es similar a las concentraciones tisulares de sulfona de pantoprazol detectadas en terneros a los 1-3 días después de la administración intravenosa (19), pero diferente de las cabras que no tenían niveles detectables de pantoprazol sulfona después de 4 h después de la administración intravenosa a 1 mg / kg (23). Si bien se cree que el metabolito sulfona está inactivo, es detectable durante más tiempo en los tejidos que el compuesto original en los terneros (19), por lo que los estudios futuros que investiguen la disposición de residuos tisulares podrían determinar aún más la relación entre los niveles plasmáticos y tisulares de pantoprazol sulfona.
La media aritmética ± los valores de DE de las constantes de la tasa de eliminación (λz) para el metabolito original y sulfona fueron 0,47 ± 0,36 y 0,087 ± 0,024 1/h después de la administración intravenosa el día 1; 0,38 y 0,08 1/h después de la administración subcutánea el día 1; 0,15 ± 0,13 y 0,066 ± 0,03 1/h después de la administración intravenosa el día 3; y 0,099 ± 0,094 y 0,54 ± 0,01 1/h después de la administración subcutánea el día 3. La Figura 6 muestra los datos simultáneos de tiempo vs. concentración para el padre y el metabolito para cada día y método de administración. A partir de estos valores parece que la formación del metabolito sulfona es el paso limitante de la velocidad en la farmacocinética de pantoprazol sulfona en terneros. Al evaluar la media aritmética ± DE λz para IV y SC padre, los valores son comparables en general a 0,47 ± 0,36 y 0,36 ± 0,22 1/h, respectivamente, mientras que en el día 3 estos valores son 0,15 ± 0,13 y 0,099 ± 0,094 1/h. Las comparaciones de λz para el metabolito después de la administración IV y SC son 0,087 ± 0,024 y 0,097 ± 0,053 1/h el día 1, y 0,066 ± 0,03 y 0,054 ± 0,01 1/h el día 3. Si bien existen diferencias sutiles entre las pendientes de pantoprazol después de la administración IV y SC, las similitudes en la eliminación no apoyan la farmacocinética flip flop para la administración SC.
Figura 6. Comparación de tiempo vs. concentración para el padre y el metabolito para cada día y vía de administración.
Después de la primera administración SC, se observó que la biodisponibilidad (F) era del 115%. Aunque es poco común, una biodisponibilidad del >100% puede ocurrir por varias razones, como la distribución entre compartimentos o como resultado del programa de muestreo. Se ha observado una biodisponibilidad del >100% para pantoprazol en alpacas (115%) (14), así como un inhibidor de la bomba de protones similar esomeprazol en cabras (F = 116%) (32). Esto podría indicar farmacocinética no lineal a dosis más altas o farmacocinética potencialmente flip flop, aunque la farmacocinética flip flop parece menos probable comparando las pendientes de cada ruta.
Todos los terneros toleraron bien ambas vías de administración, y no se observó dolor ni hinchazón en los lugares de inyección. Los eventos adversos en humanos incluyen diarrea, dolor de cabeza y dolor abdominal (33). Todos los terneros en el estudio mantuvieron un apetito saludable y consistencia fecal. Las investigaciones de seguridad anteriores sobre el uso de pantoprazol en rumiantes hospitalizados también informan hallazgos similares (16).
La principal limitación de este estudio es el pequeño tamaño de la muestra que se utilizó. Si bien los estudios farmacocinéticos se potencian adecuadamente con 4-6 animales, aumentar el número de animales puede disminuir el impacto de los datos atípicos, así como resaltar posibles variables poblacionales que pueden describir la variación en algunos parámetros, como los polimorfismos genéticos. Los animales en este estudio también eran todos de una sola granja y todos sanos, lo que no refleja la población de animales que generalmente se presentan en un hospital para recibir atención.
Los estudios de investigación futuros deben investigar la eficacia y la seguridad del pantoprazol en poblaciones enfermas, así como su uso en rumiantes adultos. Como este estudio ha demostrado que el pH abomasal se puede aumentar con pantoprazol, sería imperativo determinar el efecto sobre el microbioma del tracto gastrointestinal. También sería importante realizar investigaciones adicionales sobre la dosis y la frecuencia ideales, ya que el tratamiento con pantoprazol puede representar una inversión económica sustancial. Como los rumiantes son parte del suministro de alimentos y el uso de pantoprazol se considera fuera de etiqueta, es vital establecer tiempos de retiro adecuados. Además, aunque los puntos de tiempo de pH se recolectaron a las 18 horas, estos no se presentaron, ya que parece que se debe considerar un muestreo adicional de pH después de la segunda alimentación con leche para futuros estudios en terneros para tener en cuenta realmente los cambios de pH del pantoprazol, frente a la segunda alimentación con leche. Este modelo de canulación para el muestreo de líquido abomasal podría utilizarse para otras terapias gastroprotectoras en rumiantes, como el esomeprazol, el S-enantiómero del omeprazol (32). Los estudios futuros también podrían evaluar la variación dentro de los individuos de una población para ver si factores como el estado de la enfermedad o el polimorfismo genético influyen en el metabolismo del pantoprazol.
En conclusión, el pantoprazol aumentó efectivamente el pH abomasal en terneros después de la administración IV o SC, y la administración de varios días pareció ser bien tolerada. Si bien se necesita más investigación para determinar el papel de la secreción ácida en la formación de úlceras abomasales, esta información es un paso adelante en el tratamiento de la úlcera de los rumiantes.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Tennessee
Contribuciones del autor
JO, P-YM, LE, AK, JM y JS idearon el diseño experimental. SC y JB desarrollaron el método analítico. JO, P-YM, LE, JS, HC, CC, RR y WS-G contribuyeron a la configuración, cría y recopilación de datos de los animales. JO, SC, JB y HC contribuyeron al análisis de la muestra. JO, AK, JM, SC y JS contribuyeron a la interpretación de los datos. Todos los autores contribuyeron al desarrollo del manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Reconocimientos
Los autores desean agradecer a Lainey Harvill, Sarah Bullock y Carla Hill por su ayuda en la recopilación de datos y el cuidado de los animales.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Hund A, Wittek T. Abomasal y úlceras del tercer compartimento en rumiantes y camélidos sudamericanos. Veterinario Clin North Am Food Anim Pract. (2018) 34:35–54. doi: 10.1016/j.cvfa.2017.10.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Graham DY. Historia de Helicobacter pylori, úlcera duodenal, úlcera gástrica y cáncer gástrico. Mundo J Gastroenterol. (2014) 20:5191–204. doi: 10.3748/wjg.v20.i18.5191
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Kuhl A, Odunayo A, Price J, Hecht S, Marshall K, Steiner J, et al. Análisis comparativo del efecto de los supresores de ácido administrados por vía intravenosa sobre el pH gástrico en perros. J Vet Pasante Med. (2020) 34:678–83. DOI: 10.1111/JVIM.15718
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Sykes BW, Hewetson M, Hepburn RJ, Luthersson N, Tamzali Y. European College of Equine Internal Medicine Consensus Statement—Equine gastric ulcer syndrome in adult horses. J Vet Pasante Med. (2015) 29:1288–99. DOI: 10.1111/JVIM.13578
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Marks SL, Kook PH, Papich MG, Tolbert MK, Willard MD. Declaración de consenso de ACVIM: apoyo a la administración racional de protectores gastrointestinales a perros y gatos. J Vet Pasante Med. (2018) 32:1823–40. DOI: 10.1111/JVIM.15337
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Smith BP, Van Metre D, Pusterla N. Medicina interna de animales grandes. En: Smith PB, Van Metre D, Pusterla N, editores. 6ª edición. St. Louis, MO: Elsevier (2020).
7. Marshall T. Ulceración abomasal y timpany de terneros. Veterinario Clin N Am-Food Anim Pract. (2009) 25:209. doi: 10.1016/j.cvfa.2008.10.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Mosichuk A, Smith J, Tatarniuk D, Kreuder A. Ulceration gastrointestinal in terners presented to a central Iowa veterinary referral facility: An underappreciate morbidity? bioRxiv. (2021) 2021:423269. doi: 10.1101/2020.12.17.423269
9. Laine L, Takeuchi K, Tarnawski A. Defensa de la mucosa gástrica y citoprotección: de banco a cabecera. Gastroenterología. (2008) 135:41–60. doi: 10.1053/j.gastro.2008.05.030
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Miner P Jr, Katz PO, Chen Y, Sostek M. Control del ácido gástrico con esomeprazol, lansoprazol, omeprazol, pantoprazol y rabeprazol: un estudio cruzado de cinco vías. Am J Gastroenterol. (2003) 98:2616–20. doi: 10.1111/j.1572-0241.2003.08783.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Cheer SM, Prakash A, Faulds D, Lamb HM. Pantoprazol: una actualización de sus propiedades farmacológicas y uso terapéutico en el tratamiento de trastornos relacionados con el ácido. Drogas. (2003) 63:101–32. DOI: 10.2165/00003495-200363010-00006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Brunner G, Athmann C, Boldt JH. Edema feripheral reversible en pacientes femeninas que toman inhibidores de la bomba de protones para enfermedades del ácido péptico. Dig Dis Sci. (2001) 46:993–6. doi: 10.1023/A:1010745624971
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Wise JC, Raidal SL, Wilkes EJA, Hughes KJ. pH intragástrico de los potros ingresados en la unidad de cuidados intensivos. J Vet Pasante Med. (2020) 34:2719–26. DOI: 10.1111/JVIM.15888
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Smith GW, Davis JL, Smith SM, Gerard MP, Campbell NB, Foster DM. Eficacia y farmacocinética de pantoprazol en alpacas. J Vet Pasante Med. (2010) 24:949–55. doi: 10.1111/j.1939-1676.2010.0508.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Ryan CA, Sanchez LC, Giguere S, Vickroy T. Pharmacokinetics and pharmacodynamics of pantoprazol in clinically normal neonatal foals. Veterinario equino J. (2005) 37:336–41. DOI: 10.2746/0425164054529427
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Smith JS, Kosusnik AR, Mochel JP. Investigación clínica retrospectiva de la seguridad y los efectos adversos del pantoprazol en rumiantes hospitalizados. Front Vet Sci. (2020) 7:97. DOI: 10.3389/FVETS.2020.00097
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Smith JS, Zhou X, Merkatoris PT, Klostermann CA, Breuer RM. Manejo médico del síndrome del intestino hemorrágico en un toro de carne. Case Rep Vet Med. (2019) 2019:9209705. doi: 10.1155/2019/9209705
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Smith JS, Sheley M, Chigerwe M. Neumonía por aspiración en dos toros tibetanos Yak (Bos grunniens) como complicación de la anestesia con ketamina-xilazina-butorfanol para la castración reclinada. J Zoo Wildl Med. (2018) 49:242–6. doi: 10.1638/2016-0205R1.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Olivarez JD, Kreuder AJ, Tatarniuk DM, Wulf LW, Dembek KA, Mochel JP, et al. Farmacocinética y niveles tisulares de pantoprazol en terneros neonatos después de la administración intravenosa. Front Vet Sci. (2020) 7:580735. doi: 10.3389/fvets.2020.580735
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Smith JC, Cantrell H, Olivarez C, Tatarniuk J, Kreuder D, Mulon, AJ. Implementación de canulación abomasal quirúrgica para la medición de pH abomasal en terneros de carne con teléfonos inteligentes. En: Conference of Research Workers of Animal Disease. Chicago, IL (2021).
21. Barr CA, Gianotti G, Graffeo CE, Drobatz KJ, Silverstein DC. Efecto de la recolección de sangre mediante la técnica push-pull de un catéter permanente versus venopunción directa sobre los valores de gases en sangre venosa antes y después de la administración de alfaxalona o propofol en perros. J Am Vet Med Assoc. (2017) 251:1166–74. doi: 10.2460/javma.251.10.1166
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Cox S, Harvill L, Bullock S, Smith J, Bergman J. Validación de un método para pantoprazol y su metabolito de sulfona en plasma de cabra utilizando cromatografía líquida de alta resolución. J Chromatogr Abierto. (2022) 2:100038. doi: 10.1016/j.jcoa.2022.100038
23. Smith JS, Mochel JP, Soto-Gonzalez WM, Rahn RR, Fayne BN, Escher OG, et al. Farmacocinética de pantoprazol y pantoprazol sulfona en cabras después de la administración intravenosa: un informe preliminar. Front Vet Sci. (2021) 8:744813. DOI: 10.3389/FVETS.2021.744813
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Smith JS, Coetzee JF, Fisher IWG, Borts DJ, Mochel JP. Farmacocinética de citrato de fentanilo y norfentanilo en terneros Holstein y efecto de las prestaciones analíticas en la estimación de parámetros de fentanilo. J Vet Pharmacol Ther. (2018) 41:555–61. DOI: 10.1111/JVP.12501
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Robinson M, Horn J. Farmacología clínica de los inhibidores de la bomba de protones: lo que el médico en ejercicio necesita saber. Drogas. (2003) 63:2739–54. doi: 10.2165/00003495-200363240-00004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Badwan A, Nabulsi L, Al Omari M, Daraghmeh N, Ashour M, Abdoh A, et al. Pantoprazol sódico. Anal Prof Drug Subst Excip. (2022) 29:213–59. doi: 10.1016/S1075-6280(02)29008-4
27. Furuta T, Ohashi K, Kosuge K, Zhao XJ, Takashima M, Kimura M, et al. CYP2C19 genotype status and effect of omeprazole on intragastric pH in humans. Clin Pharmacol Ther. (1999) 65:552–61. doi: 10.1016/S0009-9236(99)70075-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Fock KM, Ang TL, Bee LC, Lee EJD. Inhibidores de la bomba de protones: ¿las diferencias en la farmacocinética se traducen en diferencias en los resultados clínicos? Clin Pharmacokinet. (2008) 47:1–6. DOI: 10.2165/00003088-200847010-00001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Constable PD, Wittek T, Ahmed AF, Marshall TS, Sen I, Nouri M. Abomasal ph and emptying rate in the ternero and dairy cow and the effect of common administration therapeutic agents. En: Proceedings of the 24th Annual World Buiatrics Congress. Niza (2006). págs. 54–68.
30. Ahmed AF, Constable PD, Misk NA. Efecto de la frecuencia de alimentación y vía de administración sobre el ph luminal abomasal en terneros lecheros alimentados con sustituto de leche1. J Dairy Sci. (2002) 85:1502–8. DOI: 10.3168/JDS. S0022-0302(02)74219-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Colina KJ. Secreción gástrica continua en el rumiante. Q J Exp Physiol Cogn Med Sci. (1955) 40:32–9. doi: 10.1113/expphysiol.1955.sp001095
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Fladung R, Smith JS, Hines MT, Soto-Gonzalez WM, Fayne B, Rahn RR, et al. Farmacocinética de esomeprazol en cabras (Capra aegagrus hircus) después de la administración intravenosa y subcutánea. Front Vet Sci. (2022) 9:968973. DOI: 10.3389/fvets.2022.968973
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Poole P. Pantoprazol. Am J Health Syst Pharm. (2001) 58:999–1008. DOI: 10.1093/AJHP/58.11.999
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Lam FC, Hung CT, Perrier DG. Estimación de la varianza para las vidas medias armónicas. J Pharm Sci. (1985) 74:229–31. DOI: 10.1002/jps.2600740229
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Martínez MN, Bartolomé MJ. ¿Qué «significa»? Una revisión de la interpretación y el cálculo de diferentes tipos de medias y desviaciones estándar. Farmacia. (2017) 9:14. DOI: 10.3390/Pharmaceutics9020014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: bovino, úlcera, abomaso, ganado, inhibidor de la bomba de protones
Cita: Olivarez JD, Mulon P-Y, Ebner LS, Cremerius H, Cantrell C, Rahn R, Soto-Gonzalez W, Bergman J, Cox S, Mochel JP, Kreuder AJ y Smith JS (2023) Propiedades farmacocinéticas y farmacodinámicas de pantoprazol en terneros. Frente. Vet. Sci. 9:1101461. doi: 10.3389/fvets.2022.1101461
Recibido: 17 de noviembre de 2022; Aprobado: 29 de diciembre de 2022;
Publicado: 30 de enero de 2023.
Editado por:
Nora Mestorino, Universidad Nacional de La Plata, Argentina
Revisado por:
Pierre-Louis Toutain, Ecole Nationale Vétérinaire de Toulouse (ENVT), Francia
Matilde Sierra Vega, Universidad de León, España
Derechos de autor © 2023 Olivarez, Mulon, Ebner, Cremerius, Cantrell, Rahn, Soto-Gonzalez, Bergman, Cox, Mochel, Kreuder y Smith. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Jeff D. Olivarez,  olivarez@iastate.edu; Joe S. Smith,
olivarez@iastate.edu; Joe S. Smith,  jss303@iastate.edu; jsmit604@utk.edu
jss303@iastate.edu; jsmit604@utk.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía