Pruebas moleculares emergentes para diferenciar los linfocitos inflamatorios y neoplásicos en el tracto intestinal

Pruebas moleculares emergentes para diferenciar los linfocitos inflamatorios y neoplásicos en el tracto intestinal
- Timothy M. Fan, DVM, PhD, DACVIM (Oncología, Medicina Interna), Universidad de Illinois en Urbana-Champaign
El tracto intestinal es un órgano altamente especializado responsable de la digestión y absorción de nutrientes. En el tejido intestinal, varios tipos de células (es decir, epiteliales, mesenquimales, hematopoyéticas) contribuyen a preservar las funciones peristálticas normales y a mantener barreras físicas competentes a los microorganismos luminales. Los linfocitos residen en la capa submucosa de los intestinos y normalmente participan en la vigilancia inmunitaria, proporcionando una línea de defensa contra los patógenos luminales. Sin embargo, esta misma población de células linfoides puede dar lugar a diversas patologías inflamatorias o neoplásicas.
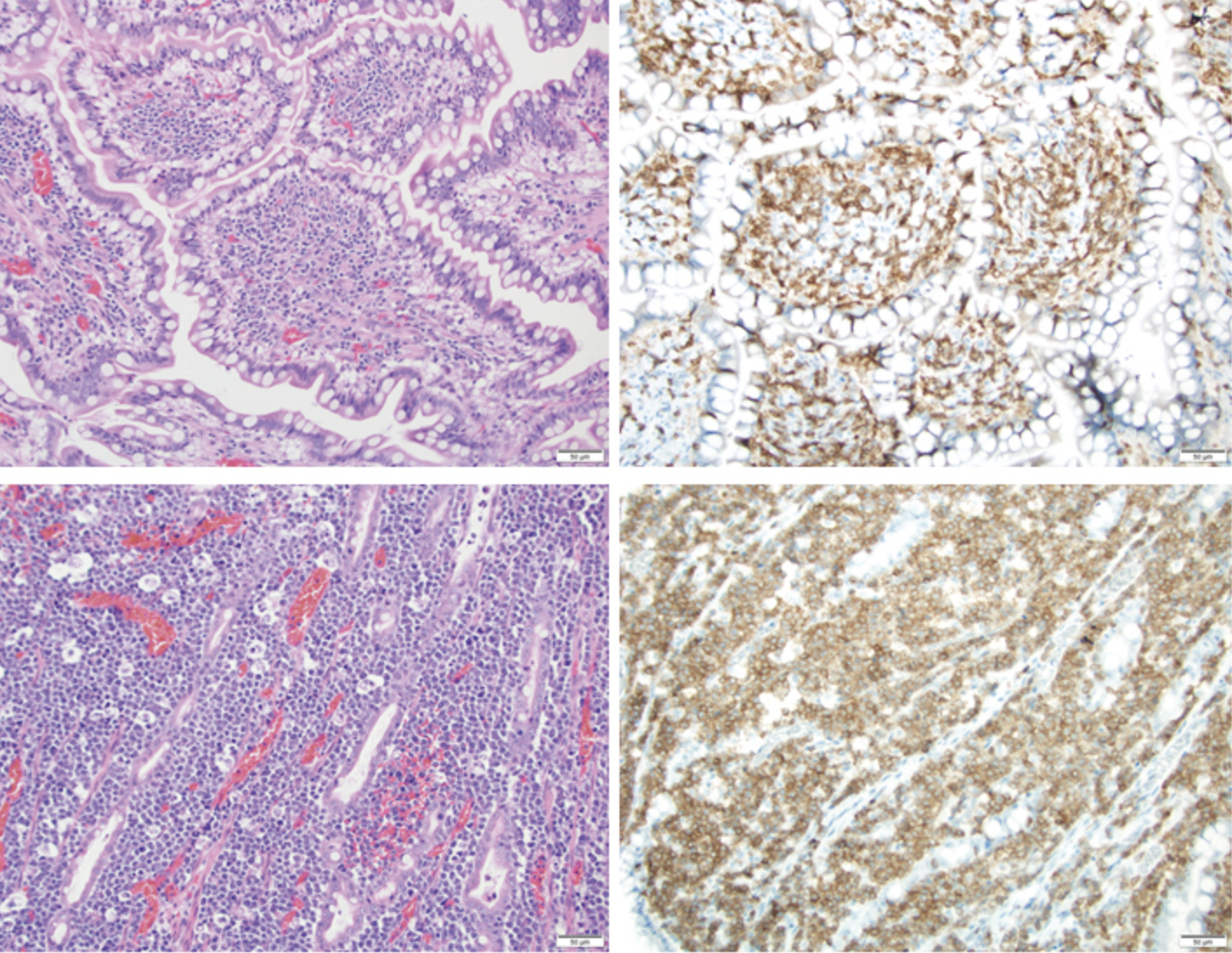
En perros, 2 enfermedades intestinales notables incluyen la enfermedad inflamatoria intestinal (EII) linfocítica rica en células T y el linfoma intestinal de células T (LSA).1-3 Debido a que ambas patologías tienen una población de linfocitos T predominantemente CD3+, diferenciar entre estas entidades clínicas puede ser difícil, y el diagnóstico definitivo puede requerir un panel de pruebas, incluyendo histología, inmunohistoquímica y perfiles moleculares a través de PCR para reordenamientos de receptores de antígenos4. La identificación de biomarcadores sustitutos complementarios, que son confiables y ayudan a distinguir las patologías linfoides inflamatorias de las neoplásicas, podría hacer avanzar la medicina veterinaria.
Los microARN son secuencias de ARN no codificantes que se encuentran en el genoma y que regulan la traducción de proteínas después de la transcripción génica. En función de su mecanismo de acción, los microARN pueden controlar los fenotipos de la población celular regulando la expresión de diferentes vías de señalización que influyen en los comportamientos biológicos5. Las patologías que pueden ser fenotípicamente similares o superpuestas (por ejemplo, EII linfoplasmacítica, ACL de células T intestinales) podrían
Este estudio examinó los patrones de expresión de microARN derivados de las biopsias intestinales de espesor completo recogidas de perros normales y de perros que tenían un diagnóstico confirmado de EII linfoplasmacítica rica en células T o ACL de células T. De los 183 candidatos a microARN maduros, se seleccionaron 12 microARN específicos en función de sus expresiones robustas y altamente diferenciales entre grupos (normal, EII, LSA), así como de su papel funcional previsto en la biología linfoide patológica.
Cuando se evaluaron a través de 8 muestras intestinales de LSA normales, 8 EII y 8 de células T, los 12 paneles de microARN produjeron patrones diferenciales que podrían diferenciar la mayoría (7 de 8) casos de ACL de células T intestinales del intestino normal o de la EII linfoplasmacítica rica en células T. En general, los microARN asociados al LSA de células T intestinales incluían la regulación al alza de los microARN oncogénicos y la regulación a la baja de los microARN supresores de tumores. Estos hallazgos preliminares derivados de un pequeño número de muestras intestinales sugieren que los patrones de expresión de microARN podrían servir como prueba molecular adyuvante para ayudar en la discriminación del ACL de células T intestinales de otras patologías de células T intestinales no neoplásicas.
Perlas clave para poner en práctica:
1.- Las patologías intestinales que involucran a las células T pueden ser difíciles de distinguir clínica y fenotípicamente entre sí sin diagnósticos moleculares más avanzados.
2.- Los microARN pueden regular el comportamiento biológico celular alterando las expresiones de las proteínas involucradas en diversas cascadas de señalización (supresores de tumores y vías oncogénicas).
Clinician’s Brief
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

